- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 13415-3:2021 BS EN 455-3:2015 Găng tay y tế sử dụng một lần - Phần 3: Yêu cầu và thử nghiệm đánh giá sinh học
| Số hiệu: | TCVN 13415-3:2021 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Y tế-Sức khỏe |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
22/11/2021 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 13415-3:2021
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 13415-3:2021
TIÊU CHUẨN QUỐC GIA
TCVN 13415 - 3 : 2021
BS EN 455 - 3 : 2015
GĂNG TAY Y TẾ SỬ DỤNG MỘT LẦN - PHẦN 3: YÊU CẦU VÀ THỬ NGHIỆM ĐÁNH GIÁ SINH HỌC
Medical gloves for single use - Part 3: Requirements and testing for biological evaluation
Lời nói đầu
TCVN 13415-3:2021 hoàn toàn tương đương với BS EN 455-3:2015;
TCVN 13415-3:2021 do Viện Trang thiết bị và Công trình y tế biên soạn, Bộ Y tế đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Bộ tiêu chuẩn TCVN 13415 (BS EN 455) Găng tay y tế sử dụng một lần, gồm các tiêu chuẩn sau:
- TCVN 13415-1:2021 (BS EN 455-1:2020), Phần 1: Yêu cầu và thử nghiệm không có lỗ thủng;
- TCVN 13415-2:2021 (BS EN 455-2:2015), Phần 2: Yêu cầu và thử nghiệm tính chất vật lý;
- TCVN 13415-3:2021 (BS EN 455-3:2015), Phần 3: Yêu cầu và thử nghiệm đánh giá sinh học;
- TCVN 13415-4:2021 (BS EN 455-4:2009), Phần 4: Yêu cầu và thử nghiệm xác định hạn sử dụng.
Lời giới thiệu
Các phản ứng có hại với protein trong các sản phẩm cao su đã được báo cáo trong nhiều năm qua với tỷ lệ lưu hành khác nhau. Ngoài ra, các phản ứng có hại do hóa chất, chất bôi trơn, dư lượng chất tiệt trùng, chất gây sốt hay các dư lượng khác đã được mô tả trong tài liệu khoa học. Phản ứng có hại được báo cáo phổ biến nhất do găng tay làm từ mủ cao su tự nhiên, nhưng cũng gặp một số phản ứng do găng tay làm từ polyme tổng hợp.
EN ISO 10993 quy định các yêu cầu và phương pháp thử nghiệm để đánh giá sinh học các thiết bị y tế. Tuy nhiên, nó không đề cập cụ thể đến các phản ứng có hại xảy ra do sử dụng găng tay y tế (ví dụ: các dị ứng loại tức thì). Những phản ứng bất lợi này xảy ra với các dị nguyên đặc hiệu có thể hiện diện trong găng tay. Một số yếu tố góp phần vào rủi ro phản ứng:
a) độ dài thời gian và tần suất tiếp xúc của da với găng tay;
b) phơi nhiễm với các dị nguyên thông qua tiếp xúc trực tiếp với niêm mạc và da (đặc biệt là khi đã tổn thương) và do hít phải các hạt nhỏ;
c) bản chất kín của tương tác găng tay / da trong quá trình sử dụng găng tay.
Tiêu chuẩn này đưa ra các yêu cầu và phương pháp thử nghiệm để đánh giá tính an toàn sinh học của găng tay y tế như một phần của quy trình quản lý nguy cơ, phù hợp với EN ISO 10993.
GĂNG TAY Y TẾ SỬ DỤNG MỘT LẦN - PHẦN 3: YÊU CẦU VÀ THỬ NGHIỆM ĐÁNH GIÁ SINH HỌC
Medical gloves for single use - Part 3: Requirements and testing for biological evaluation
1 Phạm vi áp dụng
Tiêu chuẩn này quy định những yêu cầu đánh giá an toàn sinh học đối với găng tay y tế sử dụng một lần. Tiêu chuẩn này cũng cung cấp các yêu cầu về ghi nhãn và công bố thông tin liên quan đến các phương pháp thử nghiệm đã sử dụng.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau đây là cần thiết để áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
EN 1041:2008+A1:2013, Information supplied by the manufacturer of medical devices (Thông tin cung cấp bởi nhà sản xuất thiết bị y tế)
EN ISO 10993-1, Biological evaluation of medical devices - Part 1: Evaluation and testing within a risk management process (ISO 10993-1:2009) (Đánh giá sinh học thiết bị y tế - Phần 1: Đánh giá và thử nghiệm bên trong một quá trình quản lý nguy cơ)
EN ISO 10993-5, Biological evaluation of medical devices - Part 5: Tests for in vitro cytotoxicity (ISO 10993-5) (Đánh giá sinh học thiết bị y tế - Phần 5: Thử nghiệm đánh giá độc tính in vitro)
EN ISO 10993-10, Biological evaluation of medical devices -Part 10: Tests for irritation and skin sensitization (ISO 10993-10) (Đánh giá sinh học thiết bị y tế- Phần 10: Thử nghiệm gây mẫn cảm và kích ứng da)
EN ISO 14971, Medical devices - Application of risk management to medical devices (ISO 14971, Corrected version 2007-10-01) (Thiết bị y tế-Áp dụng quản lý rủi ro vào thiết bị y tế)
EN ISO 15223-1, Medical devices - Symbols to be used with medical device labels, labelling and information to be supplied - Part 1: General requirements (ISO 15223-1) (Thiết bị y tế - Ký hiệu sử dụng với nhãn thiết bị y tế, ghi nhãn và thông tin cần cung cấp - Phần 1: Những yêu cầu chung)
EN ISO 21171, Medical gloves - Determination of removable surface powder (ISO 21171 (Găng tay y tế - Xác định bột có thể loại bỏ được trên bề mặt găng tay)
European Pharmacopeia, General chapter 2.6.14 Bacterial Endotoxins: publisher EDQM -Council of Europe; 7 allée Kastner, CS 30026, F-67081 Strasbourg; France http://www.edqm.eu/
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này, áp dụng các thuật ngữ và định nghĩa sau:
3.1
Chất hóa học (Chemicals)
Chất thêm vào hoặc tạo ra trong mọi bước của quá trình sản xuất hoặc trong bảo quản và có thể có trong sản phẩm cuối
CHÚ THÍCH 1: Những chất này có thể bao gồm các chất bôi trơn, các hóa chất phủ và các chất tiệt khuẩn. Một số thành phần hóa học thường được sử dụng trong quá trình xử lý găng tay, một số trong đó được biết có thể gây ra các phản ứng dị ứng tip IV. Loại và lượng chất hóa học tồn dư thêm vào và cuối cùng hiện diện có thể rất khác nhau.
3.2
Nội độc tố (endotoxins)
Các lipo-polysaccharide có nguồn gốc từ màng ngoài tế bào của vi khuẩn gram âm
CHÚ THÍCH: Nội độc tố là một loại chất gây sốt. Nguồn của nội độc tố có thể bao gồm ô nhiễm vi khuẩn ở các vật liệu thô, đặc biệt nước xử lý dùng trong quá trình sản xuất và xử lý thủ công găng tay.
3.3
Bột (powder)
Toàn bộ vật liệu không tan trong nước hiện diện trên bề mặt găng tay và được loại bỏ bằng rửa trong các điều kiện thử nghiệm
CHÚ THÍCH: Loại này bao gồm cả bột thêm vào có chủ đích và các chất hỗ trợ xử lý hoặc các vật liệu vô tình hiện diện và có thể loại bỏ một cách dễ dàng khỏi bề mặt găng tay. Đối với tiêu chuẩn này, mọi găng tay chứa ≤ 2 mg bột được coi là găng tay không dính bột và hơn 2 mg được coi là găng tay dính bột (xem yêu cầu trong 4.4).
3.4
Giới hạn xử lý (process limit)
Giá trị cao nhất có thể gặp phải đối với một quá trình sản xuất đã được xác thực
3.5
Protein dị nguyên (proteins, allergenic)
Protein có khả năng gây một phần ứng dị ứng tip I
3.6
Protein có thể ngâm chiết (proteins, leachable)
Protein và peptid tan trong nước có thể chiết được từ sản phẩm cuối
3.7
Chất gây sốt (pyrogens)
Các chất tạo sốt ở thỏ và có thể liên quan đến sốt sốt và các phản ứng có hại khác ở người.
4 Yêu cầu
4.1 Yêu cầu chung
EN ISO 10993-1:2009 mô tả các nguyên tắc chung chỉ dẫn việc đánh giá sinh học các thiết bị y tế và sẽ được sử dụng để lựa chọn các thử nghiệm thích hợp đã mô tả trong các phần khác của loạt tiêu chuẩn này. Dựa trên EN ISO 10993-1:2009, găng tay y tế được phân loại là thiết bị tiếp xúc bề mặt thời gian giới hạn và cần tuân thủ EN ISO 10993-5:2009 và EN ISO 10993-10:2013.
Không nên nhầm lẫn việc phân loại găng tay y tế theo EN ISO 10993-1:2009 với các định nghĩa được cung cấp trong các hướng dẫn về thiết bị y tế cho các sản phẩm này.
Cần thiết lập một quy trình quản lý rủi ro phù hợp với EN ISO 14971:2012
4.2 Chất hóa học
Găng tay không được đeo vào cùng với bột talc (ma-giê silicat).
Theo yêu cầu, nhà sản xuất phải đưa ra danh sách các thành phần hóa học được thêm vào trong quá trình sản xuất hoặc đã biết có hiện diện trong sản phẩm như chất gia tốc, chất chống oxy hóa và chất diệt khuẩn có thể gây ra các ảnh hưởng xấu đến sức khỏe dựa trên dữ liệu hiện tại.
Theo yêu cầu, nhà sản xuất phải cung cấp bằng chứng về các bước được thực hiện để giảm nguy cơ cho người dùng cuối do tiếp xúc với các hóa chất đã sử dụng trong quá trình sản xuất và dựa trên dữ liệu hiện tại được biết là gây ra các ảnh hưởng xấu đến sức khỏe.
Các nhà sản xuất chỉ có thể công bố không có một chất hóa học nếu chất đó không được sử dụng trong bất kỳ phần nào của quá trình sản xuất. Không được sử dụng các hợp chất trong quá trình sản xuất nếu biết rằng chúng sẽ tạo ra một chất thuộc đối tượng phải công bố như vậy.
4.3 Nội độc tố
Nhà sản xuất phải theo dõi sự nhiễm nội độc tố của găng tay vô khuẩn bằng cách sử dụng phương pháp thử nghiệm đã mô tả ở 5.1 nếu như găng tay được ghi nhãn "lượng nội độc tố thấp”. Đối với những găng tay được ghi nhãn như vậy, lượng nội độc tố phải không được vượt quá giới hạn 20 đơn vị nội độc tố trong một đôi găng tay.
4.4 Găng tay không bột
Đối với găng tay không bột, tổng dư lượng bột xác định được theo phương pháp thử nghiệm đã mô tả ở 5.2 phải không vượt quá 2 mg trên một găng tay. Mọi găng tay chứa hơn 2 mg bột được coi là găng tay có bột.
4.5 Protein có thể ngâm chiết
Nhà sản xuất phải cố gắng giảm thiểu mức protein có thể ngâm chiết.
Nhà sản xuất phải theo dõi giới hạn protein có thể ngâm chiết trong găng tay thành phẩm có chứa mủ cao su tự nhiên bằng phương pháp đã nêu trong 5.3 và được mô tả trong Phụ lục A. Phải lưu giữ tài liệu về các kết quả này. Kết quả thử nghiệm và phương pháp thử nghiệm áp dụng phải được cung cấp theo yêu cầu.
CHÚ THÍCH: Protein dị nguyên: tiêu chuẩn này quy định phương pháp đo một giá trị gần đúng cho hàm lượng dị nguyên, ví dụ: protein có thể ngâm chiết. Không có mối tương quan trực tiếp giữa các protein có thể ngâm chiết và hàm lượng chất gây dị ứng. Các phương pháp định lượng để đo các protein gây dị ứng được mô tả trong Phụ lục B.
4.6 Ghi nhãn
Ngoài việc ghi nhãn được quy định trong EN 1041:2008 + A1:2013 và các ký hiệu liên quan được nêu trong EN ISO 15223-1:2012, còn áp dụng các yêu cầu sau:
a) găng tay y tế có chứa mủ cao su tự nhiên phải được dán nhãn ít nhất trên bao bì đơn vị đóng gói nhỏ nhất với ký hiệu EN ISO 15223-1:2012 cho cao su (số tham chiếu 5.4.5).
Việc ghi nhãn phải bao gồm công bố cảnh báo hoặc tương đương như sau cùng với biểu tượng (Sản phẩm) có chứa mủ cao su tự nhiên có thể gây ra phản ứng dị ứng, bao gồm cả phản ứng phản vệ.
b) việc ghi nhãn phải bao gồm một dấu hiệu nổi bật về việc găng tay có bột hay không có bột;
c) găng tay có bột vô khuẩn phải được ghi nhãn như sau hoặc tương đương:
'THẬN TRỌNG: Bột bề mặt phải được loại bỏ một cách vô trùng trước khi tiến hành các quy trình phẫu thuật để giảm thiểu rủi ro phản ứng có hại cho mô’
CHÚ THÍCH 1: Có thể đưa ra tuyên bố thận trọng này trên bao bì bên trong.
d) đối với bất kỳ loại găng tay y tế nào có chứa mủ cao su tự nhiên, ghi nhãn sản phẩm sẽ không bao gồm:
- mọi thuật ngữ gợi ý tính an toàn tương đối, chẳng hạn như tính dị nguyên thấp, ít gây dị ứng hoặc ít protein;
- mọi chỉ dấu không chính đáng về sự hiện diện của các chất gây dị ứng;
e) nếu nhà sản xuất ghi nhãn hàm lượng protein trên găng tay thì phải đưa ra giới hạn quá trình, được đo như quy định trong 5.3.
CHÚ THÍCH 2: Không cho phép công bố ghi nhãn protein dưới 50 μg /g. Các công bố thấp hơn không được coi là đáng tin cậy do có sự khác biệt quy trình dự kiến trong sản xuất và thử nghiệm giữa các phòng thí nghiệm.
5 Phương pháp thử nghiệm
5.1 Nội độc tố
Ngoại trừ trường hợp có những sự can nhiễu không thể loại bỏ trong các quy trình thử nghiệm Limulus Amoebocyte Lysate (LAL), việc lựa chọn, xác thực và sử dụng kỹ thuật phải được như mô tả trong Dược điển Châu Âu, Chuyên mục 2.6.14, "Nội độc tố vi khuẩn". Kết quả phải được biểu thị bằng đơn vị nội độc tố (E.U.) trên mỗi đôi găng tay.
CHÚ THÍCH 1: Trong trường hợp có các can nhiễu không thể loại bỏ trong quy trình LAL, không thể đo chính xác lượng nội độc tố của vi khuẩn.
Số lượng tối thiểu các đôi găng tay được khuyến nghị thử nghiệm liên quan đến số lượng sản phẩm trong lô là hai đôi găng tay cho cỡ lô dưới ba mươi, ba đôi cho cỡ lô từ ba mươi đến một trăm và 3 % của lô trên một trăm chiếc, cho tới tối đa mười đôi găng tay cho mỗi lô.
Bề mặt bên ngoài của đôi găng tay được chiết bằng 40 ml nước không có nội độc tố (Nước LAL, Dược điển Châu Âu) trong thời gian không dưới 40 min và không quá 60 min ở nhiệt độ từ 37 °C đến 40 °C để đảm bảo rằng tất cả các bề mặt găng tay đều tiếp xúc với môi trường chiết. Dịch chiết được ly tâm, nếu cần thiết, trong 15 min ở 2.000 g để loại bỏ các hạt, sau đó đem gạn lọc thành phần lỏng và kiểm tra nội độc tố ngay sau đó.
CHÚ THÍCH 2: Tồn tại các phương pháp khác để phân tích nội độc tố và có thể sử dụng các phương pháp đó cho mục đích kiểm soát thường quy chất lượng miễn là chúng đã được xác thực và đã chứng tỏ sự tương quan với phương pháp chuẩn quy định trong tiêu chuẩn này.
5.2 Bột
Cần sử dụng phương pháp thử nghiệm để xác định tồn dư bột đã mô tả trong EN ISO 21171:2006, Điều 7 và 9.
5.3 Protein có thể ngâm chiết
Phương pháp thử nghiệm để xác định phân tích protein có thể ngâm chiết phải là phương pháp Lowry cải tiến nêu trong Phụ lục A hoặc một phương pháp đã xác thực một cách thích hợp khác đã được chứng tỏ tương quan với phương pháp Lowry cải tiến.
CHÚ THÍCH 1: Ví dụ về phương pháp phân tích đã xác thực được nêu trong Phụ lục C.
CHÚ THÍCH 2: Các phương pháp miễn dịch học trong Phụ lục B hiện vẫn chưa được xác thực theo phương pháp Lowry cải tiến nhưng có thể tương quan với dữ liệu đáp ứng lâm sàng.
6 Báo cáo thử nghiệm
Mọi báo cáo thử nghiệm phải bao gồm ít nhất các thông tin sau:
- viện dẫn tiêu chuẩn này;
- loại găng tay và mã lô sản xuất;
- tên và địa chỉ của nhà sản xuất hoặc nhà phân phối và phòng thử nghiệm, nếu khác;
- ngày thử nghiệm được thực hiện;
- mô tả của phương pháp thử nghiệm đã áp dụng
- kết quả thử nghiệm.
Phụ lục A
(quy định)
Phương pháp xác định protein có thể ngâm chiết trong nước ở găng tay cao su tự nhiên bằng phương pháp Lowry cải tiến
A.1 Phạm vi áp dụng
Phương pháp này dùng để xác định lượng protein có thể ngâm chiết xuất được trong nước ở găng y tế làm từ cao su tự nhiên (NR). Nó đã được xác thực trong các thử nghiệm liên phòng thí nghiệm. Giới hạn định lượng dưới là khoảng 10 μg protein trên mỗi g găng tay (tức là 2 μg protein trên mỗi ml dịch chiết) tùy thuộc vào trọng lượng găng tay.
Các hóa chất như chất hoạt tính bề mặt, chất gia tốc và chất chống oxy hóa được thêm vào mủ cao su tự nhiên trong quá trình sản xuất găng tay có thể cản trở sự phát triển màu trong quá trình xác định, một số vật liệu có thể làm giảm sự phát triển màu trong khi những vật liệu khác có thể làm tăng màu sắc. Nếu phương pháp thử nghiệm mang lại kết quả có vẻ sai do các chất cản trở, khi đó có thể sử dụng bất kỳ phương pháp phân tích axit amin nào đã được xác thực (ví dụ xem phương pháp nêu trong Phụ lục C).
Người sử dụng phương pháp này phải quen thuộc với thực hành thông thường trong phòng thí nghiệm.
CHÚ THÍCH: Phương pháp này không có mục đích giải quyết tất cả các vấn đề an toàn, nếu có, liên quan đến việc sử dụng nó. Người sử dụng có trách nhiệm thiết lập các thực hành an toàn và sức khỏe thích hợp và đảm bảo tuân thủ mọi điều kiện quy định của quốc gia.
A.2 Nguyên tắc
Protein hòa tan trong nước được chiết xuất vào một dung dịch đệm và sau đó được kết tủa bởi các axit với sự có mặt natri deoxycholate để cô đặc chúng và tách chúng khỏi các chất hòa tan trong nước có thể gây trở ngại cho việc xác định. Các protein kết tủa được hòa tan lại trong kiềm và được định lượng bằng đo màu trong phương pháp Lowry cải tiến. Thử nghiệm này dựa trên phản ứng của protein với đồng và thuốc thử Folin trong môi trường kiềm để tạo ra màu xanh đặc trưng. Các phép đo quang phổ được thực hiện ở một bước sóng cố định trong khoảng 600 nm đến 750 nm.
A.3 Thuốc thử
A.3.1 Yêu cầu chung
Bất cứ khi nào cần nước, nên sử dụng nước cất hai lần hoặc nước có chất lượng tương đương. Tất các các chất thử khác đều nên được phân tích chất lượng.
A.3.2 Dịch dùng để chiết
A.3.2.1 N-tris-[Hydroxymethyl]-methyl-2-aminoethanesulfonic acid (TES).
Muối hemisodium
A.3.2.2 Dịch đệm 0,1 M, được chuẩn bị bằng cách pha loãng 24 g TES (A.3.2.1) trong một lít nước. Có thể sử dụng bất kỳ hệ thống đệm tương đương nào miễn là dung dịch đó có khả năng tạo đệm đủ để duy trì pH 7,4 ± 0,2 trong dịch chiết được từ găng tay.
Chuẩn bị một lượng đủ để chiết găng tay (A.6.2), chuẩn bị các dung dịch protein chuẩn (A.6.3.2) và mẫu trắng.
A.3.2.3 Dung dịch nhuộm, bromophenol blue, dung dịch NaCI, chuẩn bị bằng cách pha loãng 100 g xanh bromophenol trong một lít nước. Chuẩn bị một dung dịch mới mỗi 4 tuần.
A.3.3 Thuốc thử xét nghiệm protein
CHÚ THÍCH: Các thuốc thử có thể được chuẩn bị từ các hóa chất off-shelf hoặc được mua dưới dạng bộ thuốc thử thương mại. Phương pháp thử nghiệm dùng cho tiêu chuẩn này đã được xác thực với một bộ thuốc thử thương mại.
A.3.3.1 Thuốc thử A Thuốc thử đồng (tartate đồng có tính kiềm hoặc dung dịch citrate đồng).
A.3.3.2 Thuốc thử B Thuốc thử Folin pha loãng.
A.3.4 NaOH, dung dịch 0,1 M.
A.3.5 Natri deoxycholate (DOC), 3,47 nM, chuẩn bị bằng cách pha 0,15 g natri deoxycholate trong nước và pha loãng với nước tới 100 ml. Không sử dụng dung dịch này quá 4 tuần sau khi chuẩn bị.
A.3.6 Axit trichloroacetic (TCA), 4,4 mM trong nước, được chuẩn bị bằng cách pha 72 g TCA trong nước và pha loãng với nước tới 100 ml.
A.3.7 Axit phosphotungstic (PTA), được chuẩn bị bằng cách pha 72 g PTA trong nước và pha loãng với nước tới 100 ml.Không sử dụng dung dịch này quá 4 tuần sau khi chuẩn bị.
A.3.8 Ovalbumin, từ trứng gà, được đông lạnh, không chứa muối.
A.4 Thiết bị/dụng cụ
A.4.1 Găng tay tổng hợp, không có bột.
A.4.2 Máy ly tâm, có khả năng đạt được ít nhất 6000 g.
A.4.3 Ống ly tâm, ống polypropylen dung tích 30 ml hoặc 50 ml với khả năng gắn kết protein thấp 10 μg trong một ống hoặc ít hơn. Không sử dụng dụng cụ thủy tinh do tính chất hấp thụ protein trên bề mặt.
CHÚ THÍCH: Một phương pháp xác định khả năng gắn kết protein được mô tả ở A.5.
A.4.4 Đơn vị lọc, sử dụng một lần, với kích thước lỗ xốp 0,22 μm và khả năng gắn kết protein thấp 10 μg cho một đơn vị lọc hoặc thấp hơn.
CHÚ THÍCH: Một phương pháp xác định khả năng gắn kết protein được mô tả ở A.5.
A.4.5 Bơm tiêm, dùng xong rồi bỏ, 20 ml, làm từ polyethylene hoặc polypropylene.
A.4.6 Vi ống, 2 ml, làm từ polypropylene.
A.4.7 Ống cuvette thạch anh, chiều dài path length 10 mm.
A.4.8 Khay vi thể chuẩn, với 96 giếng, đáy bằng, làm từ polystyrene hay các ống cuvette dùng xong rồi bỏ (A.4.9).
A.4.9 Cuvette dùng một lần, bán vi lượng 1,5 ml, độ dài path length 10 mm, làm từ polystyrene.
A.4.10 Đầu đọc khay vi thể, hoạt động ở bước sóng trong phạm vi 600 nm đến 750 nm.
A.4.11 Máy đo quang phổ, hoạt động ở phạm vi bước sóng 230 nm đến 750 nm.
A.4.12 Máy trộn, Vortex.
A.4.13 Ống hút vi thể, với đầu polypropylene sử dụng một lần.
A.4.14 Kẹp, để bịt kín nước găng tay trong khi chiết, là các thanh kẹp nhôm lót xốp cao su có thể bắt vít chặt với nhau (xem Hình A.1) hoặc có thể gợi ý các thanh kẹp nhựa dài 170 mm dùng trong lọc máu.
A.4.15 Máy lắc
A.5 Đo khả năng gắn kết Protein
A.5.1 Yêu cầu chung
Khuyến khích sử dụng xuyên suốt các thiết bị polypropylene sử dụng một lần (biết rõ có khả năng gắn kết protein thấp). Khả năng gắn kết protein phải được kiểm tra bằng các phương pháp sau đây trước khi sử dụng các ống ly tâm hay đơn vị lọc từ mẻ mới. Thử nghiệm sẽ được thực hiện trong một ngày.
A.5.2 Khả năng gắn kết protein của các ống ly tâm
A.5.2.1 Chuẩn bị một ống ly tâm (A.4.3) dung tích 30 ml đựng dung dịch chuẩn chứa ovalbumin 10 μg/ml bằng cách pha dung dịch protein gốc (A.6.3.1) với dung dịch đệm (A.3.2.2)
A.5.2.2 Chuyển các phần thử nghiệm 10 ml của dung dịch chuẩn ovalbumin sang 2 ống ly tâm mới và lắc trên máy lắc (A.4.15) và đảm bảo rằng toàn bộ bề mặt ống đều thấm ướt dịch chuẩn. Sau 30 min lại chuyển các dung dịch sang hai ống khác và lắc. Lặp lại quy trình cho đến khi từng phần 10 ml đã tiếp xúc đủ với 5 ống. Lưu giữ dung dịch thử nghiệm còn lại.
A.5.2.3 Xác định nồng độ protein trong dung dịch chuẩn và hai dung dịch thử ba lần bằng cách sử dụng phương pháp nêu trong A.6.4 đến A .6.6
A.5.2.4 Tính lượng ovalbumin hấp thu trung bình từ công thức:

Trong đó:
O là lượng ovalbumin hấp thu theo μg/ống;
R là giá trị trung bình từ 3 lần xác định lượng ovalbumin dung dịch chuẩn, μg/ml;
T là lượng ovalbumin trung bình của dung dịch thử sau khi cho qua các ống (nghĩa là trung bình của 6 giá trị) theo μg/ống.
Giá trị ovalbumin hấp thu (O) phải dưới 10 μg/ống, nếu không ống được coi là không thích hợp cho việc xác định protein.
A.5.3 Khả năng gắn kết protein của đơn vị lọc
A.5.3.1 Chuẩn bị một ống ly tâm (A.4.3) 30 ml đựng dung dịch chuẩn chứa ovalbumin 10 μg/ml bằng cách pha loãng dung dịch protein gốc (A.6.3) với dung dịch đệm (A.3.2.2).
A.5.3.2 Chuẩn bị hai chồng 5 đơn vị lọc (A.4.4). Lọc 10 ml dung dịch chuẩn qua mỗi chồng đơn vị lọc vào một ống ly tâm (A.4.3).
A.5.3.3 Xác định lượng protein của dung dịch chuẩn và 2 dung dịch thử 3 lần bằng cách sử dụng phương pháp nêu trong A.6.4 đến A.6.6.
A.5.3.4 Tính lượng trung bình ovalbumin hấp thu từ phương trình
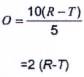
Trong đó:
O là lượng ovalbumin hấp thu theo μg/ống;
R là giá trị trung bình của 3 lần xác định lượng ovalbumin dung dịch chuẩn, theo μg/ml;
T là lượng ovalbumin trung bình của dung dịch thử nghiệm sau khi cho qua các đơn vị lọc (nghĩa là trung bình của 6 giá trị) theo μg /ống.
Giá trị ovalbumin hấp thu (O) phải dưới 10 μg/ống, nếu không ống được coi là không thích hợp cho việc xác định protein.
A.6 Quy trình thử
A.6.1 Quy định chung
Quy trình này bao gồm chiết găng tay, sau đó là lọc sạch và cô đặc dịch chiết được theo hệ số 5. Việc xác định trên dịch chiết được thực hiện bằng cách tham chiếu đến đường chuẩn được chuẩn bị bằng cách sử dụng các dung dịch protein chuẩn đã được cô đặc theo cùng một cách.
Quy trình chiết sử dụng là quy trình trong có thể chiết đồng thời mặt trong của một găng tay và mặt ngoài của găng tay thứ hai. Nó cho phép giảm thiểu thể tích chiết ở mức 25 ml và tránh làm mất protein vào các bề mặt vật chứa vì dịch đệm chỉ tiếp xúc với găng tay.
CHÚ THÍCH: Có thể sử dụng các quy trình chiết thay thế nếu chúng đã được xác thực theo phương pháp này. Một thử nghiệm round robin test bởi các phòng thí nghiệm được chọn ở Châu Âu và Hoa Kỳ cho thấy kết quả tương đương với Tiêu chuẩn ASTM D5712:1995 khi chiết các mảnh cắt găng tay trong 2 h ở 25 °C trong dung dịch đệm TES pH 7,4.
A.6.2 Quy trình chiết
A.6.2.1 Sử dụng găng tay tổng hợp (A.4.1) để chuẩn bị các mẫu găng tay đem chiết.
Lấy tám mẫu găng tay có cùng kích thước và cùng một lô rồi tách chúng thành bốn cặp. Trong trường hợp găng tay đặc thù bàn tay, hãy chọn bốn mẫu găng tay bên phải và bốn mẫu găng tay bên trái rồi tách chúng thành hai cặp găng tay bên phải và hai cặp găng tay bên trái. Đánh dấu vòng bít của một găng tay của mỗi cặp tại một điểm (200 ± 10) mm tính từ đầu ngón tay giữa và cân găng tay (m1) chính xác đến 0,1 g. Đối với mỗi cặp, đút găng tay thứ hai vào bên trong găng tay đã đánh dấu sao cho chúng vừa khít với nhau như trong Hình A.1 a).
CHÚ THÍCH: Phương pháp đưa một găng tay này vào găng tay kia không quan trọng miễn là các găng được thao tác càng ít càng tốt. Một cách có thể đạt được là trượt một que ở ngón cái và ngón út của găng tay bên trong để giúp đưa chúng vào các ngón tay tương ứng của găng tay thứ hai. Sử dụng các que để đút ba ngón tay khác.
A.6.2.2 Đổ vào trong găng tay bên trong một lượng dung dịch thuốc nhuộm (A.3.2.3) vừa đủ để lấp đầy cả năm ngón tay. Cho 25 ml dung dịch đệm (A.3.2.2) ở (25 ± 5) °C vào giữa găng tay trong và găng tay ngoài. Đối với gàng tay lớn hơn, thể tích này có thể tăng lên tới mức tối đa 50 ml. Loại bỏ hầu hết các bọt khí và bịt kín găng tay bằng kẹp (A.4.14) ở chỗ đánh dấu 20 cm để tạo ra sự bịt kín nước như trong Hình A.1 b).
A.6.2.3 Cố định găng tay vào máy lắc (A.4.15) và lắc trong (120 ± 5) min ở (25 ± 5) °C.
A.6.2.4 Tháo kẹp và tách các găng tay một cách cẩn thận. Chú ý không để dịch chiết bị nhiễm vào dung dịch thuốc nhuộm. Nếu dịch chiết có màu xanh lam, nó phải được loại bỏ và quá trình chiết lặp lại với găng tay tươi.
A.6.2.5 Cẩn thận chuyển dịch chiết vào một ống ly tâm (A.4.3) và làm rõ trong chiết hoặc bằng cách ly tâm không dưới 2000 g trong 15 min hoặc lọc qua bộ lọc sử dụng một lần (A.4.4), hoặc kết hợp cả hai nếu thích hợp. Bảo quản dung dịch trong suốt thu được trong tủ lạnh ở 2 °C đến 8 °C và thực hiện phép xác định trong vòng 48 h hoặc làm đông lạnh các phần dung dịch ở -18 °C hoặc thấp hơn trong thời gian không quá 2 tháng trước khi phân tích.
A.6.2.6 Cắt đoạn vòng bít bên trên mốc 20 cm từ găng tay bên ngoài đã chiết, dùng khăn giấy lau sạch chất lỏng trên bề mặt, để khô ở nhiệt độ phòng và cân chính xác đến 0,1 g (m2). Tính khối lượng (m) của phần đã chiết ra từ chiếc găng tay như sau:
m = m1 - m2
A.6.3 Dung dịch chuẩn protein
A.6.3.1 Dung dịch protein gốc
Chuẩn bị dung dịch ovalbumin (A.3.8) có nồng độ danh nghĩa là 1 mg/ml bằng cách hòa tan 25 mg ovalbumin trong 25 ml dung dịch đệm chiết (A.3.2.2). Lọc dung dịch qua màng lọc 0,22 μm (A.4.4) và xác định nồng độ thực ovalbumin bằng cách sử dụng máy đo quang phổ uv để đo độ hấp thụ ở bước sóng 280 nm, sử dụng một cuvette thạch anh (A.4.7). Nếu độ hấp thụ được chia cho 0,715 a thì nó sẽ cho nồng độ chính xác tính bằng mg/ml. Để dung dịch này ổn định trong vòng 2 ngày trong tủ lạnh hoặc trong 2 tháng đông lạnh ở -18 °C. Quá trình rã đông cần làm ấm đến 45 °C trong 15 min.
CHÚ THÍCH: a giả sử trọng lượng phân tử 43000 D và sự hấp thu phân tử (molar extinction) là 30745 tại bước sóng 280 nm và pH 7,4, khi đó sự hấp thu của ovalbumin 1 mg/ml trong dịch đệm 0,1 M TES pH 7,4 là 0,715, sử dụng đường ánh sáng 1 cm.
A.6.3.2 Dung dịch chuẩn protein
Chuẩn bị các dãy dung dịch pha loãng nối tiếp của dung dịch gốc protein (A.6.3.1) bằng cách sử dụng dung dịch đệm chiết (A.3.2.2), để tạo ra các dung dịch có nồng độ danh định khoảng 100 μg /ml, 50 μg/ml, 20 μg/ml, 10 μg/ml, 5 μg/ml và 2 μg/ml. Sử dụng dung dịch đệm chiết làm mẫu trắng. Các dung dịch này để ổn định trong 2 ngày đề trong tủ lạnh hoặc trong 2 tháng đông lạnh ở -18 °C. Quá trình rã đông cần làm ấm đến 45 °C trong 15 min.
A.6.4 Kết tủa và cô đặc protein
A.6.4.1 Tiến hành lặp lại quy trình ở (25 ± 5) °C.
A.6.4.2 Chuyên chính xác 1 ml màu trắng và dung dịch protein chuẩn (A.6.3.2) và bốn dịch chiết găng tay (A.6.2.5) vào các ống nhỏ (A.4.6). Thêm 0,1 ml DOC (A.3.5), trộn trên máy Vortex và để yên trong 10 min. Thêm 0,1 ml TCA (A.3.6) và 0,1 ml PTA (A.3.7), trộn bằng máy trộn Vortex và để yên thêm 30 min.
A.6.4.3 Ly tâm ở 6000 g trong 15 min. Gạn phần chất lỏng nổi bên trên và để ráo trong 5 min bằng cách lật ngược từng ống ly tâm trên giấy thấm.
A.6.4.4 Thêm 0,2 ml dung dịch NaOH 0,1M (A.3.4) vào mỗi ống kể cả mẫu trắng. Trộn trên máy Vortex để hòa tan lại các protein kết tủa. Đảm bảo rằng các protein được hòa tan lại hoàn toàn thành một dung dịch trong suốt. Tùy thuộc vào loại găng tay, đôi khi dung dịch này cần để trong tủ lạnh qua đêm ở nhiệt độ (5 ± 3) °C. Nếu vẫn còn bất kỳ kết tủa nào, thêm một lượng dung dịch natri hydroxit (NaOH) với mức gia tăng 0,2 ml mỗi lần cho đến tổng cộng 1 ml. Có thể hữu ích khi pha loãng dịch chiết của các mẫu như vậy trước khi kết tủa.
CHÚ THÍCH: Quá trình cô đặc protein bằng cách kết tủa và hòa tan lại nhằm mục đích tinh lọc protein và loại protein ra khỏi các chất cản trở. Trong quá trình này không thể tránh khỏi làm mất một lượng protein nhất định. Với mục đích thử nghiệm, người ta cho rằng tỷ lệ phần trăm protein bị mất từ các dung dịch protein chuẩn cũng tương tự như tỷ lệ mất từ các dịch chiết mẫu thử. Tuy nhiên, lượng bị mất có thể giữ ở mức tối thiểu vì tổng hao hụt có thể không tái lập.
A.6.5 Phát triển màu
A.6.5.1 Phương pháp được mô tả ở đây đã được điều chỉnh cho phù hợp với bộ kít thương mại sử dụng để xác nhận. Các bộ thử hay thuốc thử khác được chuẩn bị từ các hóa chất off-shelf có thể đòi hỏi các thể tích và thời gian ủ khác.
A.6.5.2 Thêm 0,125 ml Thuốc thử A (A.3.3.1) vào mỗi ống nhỏ chứa các dung dịch protein đã hòa tan lại kể cả mẫu trắng. Trộn đều. Thêm 1 ml thuốc thử B (A.3.3.2), đậy nắp ống, trộn trên máy Vortex và để màu phát triển hoàn toàn trong 30 min. Nếu kết tủa xảy ra ở giai đoạn này, hãy ly tâm hoặc lọc để loại bỏ kết tủa trước khi đo độ hấp thụ.
A.6.6 Đo lường
A.6.6.1 Đầu đọc khay vi thể
Dùng pipet lấy một thể tích đồng nhất dung dịch (A.6.5.2) vào giếng của đĩa vi chuẩn độ (A.4.8) sao cho gần đầy giếng, ví dụ: 490 μl trong giếng 500 μl. Đo độ hấp thụ so với mẫu trắng ở một bước sóng cụ thể trong phạm vi 600 nm đến 750 nm.
CHÚ THÍCH: Điều quan trọng để có kết quả đồng nhất là các dung dịch chuẩn cùng với dịch chiết găng tay được phân tích cùng nhau trong vòng 1 h sau khi đã phát triển màu ổn định.
A.6.6.2 Máy đo quang phổ
Chuyển dung dịch (A.6.5.2) vào một ống cuvette (A.4.9) và đo độ hấp thụ so với mẫu trắng ở một bước sóng xác định trong phạm vi từ 600 nm đến 760 nm.
CHÚ THÍCH: Điều quan trọng để có kết quả đồng nhất là các dung dịch chuẩn cùng với dịch chiết găng tay phải được phân tích cùng nhau trong vòng 1 h sau khi đã phát triển màu ổn định.
A.7 Biểu thị kết quả
A.7.1 Tính toán
A.7.1.1 Đường hiệu chuẩn/ Đường cong hiệu chuẩn
Tính độ hấp thụ trung bình từ các phép xác định lặp lại. Nếu các giá trị riêng khác nhau quá 20 %, lặp lại phép xác định. Lặp đường hiệu chuẩn bằng cách vẽ đồ thị các số đo độ hấp thụ trung bình theo nồng độ thực của các dung dịch protein chuẩn ban đầu như trong Hình A.2. Đường hiệu chuẩn nên là đường tuyến tính trong khoảng từ 0 μg đến 100 μg protein /ml trong các dung dịch protein chuẩn ban đầu.
CHÚ THÍCH: Một số protein bị mất trong quá trình cô đặc. Giả định rằng tỷ lệ protein bị mất từ các tiêu chuẩn cũng giống như từ các mẫu thử nghiệm trong quá trình cô đặc.
Kích thước tính bằng milimét
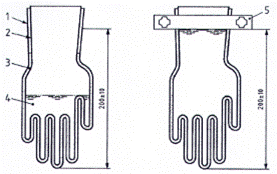
CHÚ DẪN:
| 1 Găng tay bên ngoài (găng tay 1) | 4 Dung dịch thuốc nhuộm |
| 2 Găng tay bên trong (găng tay 2) | 5 Kẹp găng tay |
| 3 Dịch đệm chiết |
|
Hình A.1 - Chiết găng tay (mặt cắt ngang)
A.7.1.2 Nồng độ dịch chiết
Tính độ hấp thụ trung bình từ các phép xác định lặp lại cho mỗi dịch chiết trong số bốn dịch chiết (xem A.6.4.1). Nếu các giá trị riêng khác nhau quá 20 %, lặp lại phép xác định. Xác định nồng độ của các mẫu chiết (C) theo μg /ml dịch chiết bằng cách đọc chúng trực tiếp từ phần tuyến tính của đường đồ thị.
CHÚ THÍCH: Trong trường hợp đường hiệu chuẩn phi tuyến tính, giá trị có thể được tính bằng hồi quy bậc hai. Người ta cho rằng phần mềm máy tính thương mại để điều chỉnh đường cong và tính toán các nồng độ chưa biết là thực tế hơn.
A.7.2 Kết quả
Lượng protein của mỗi dịch chiết được tính theo công thức
![]()
Trong đó:
P là protein có thể chiết được theo μg/g găng tay;
V là thể tích môi trường chiết đã sử dụng tính theo ml;
C là nồng độ protein của dịch chiết tính theo μg/ml;
F là hệ số pha loãng.
CHÚ THÍCH: F là thể tích thật của dung dịch NaOH theo ml sử dụng để tái pha loãng protein chia cho 0,2
m là khối lượng của găng tay đã chiết tính theo g (A.6.2.6)
Báo cáo lượng protein trung bình của bốn xác định dịch chiết găng tay
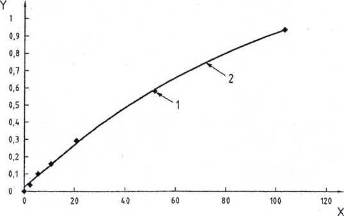
CHÚ DẪN:
Trục Y là độ hấp thụ tại bước sóng 750 nm
Trục X là nồng độ ovalbumin (μg/ml)
1 Độ hấp thụ
2 Đa thức phù hợp nhất tạo ra trên máy tính
![]()
| Nồng độ (μg/ml) | Độ hấp thụ |
| 2,1 | 0,036 |
| 5,2 | 0,099 |
| 10,4 | 0,159 |
| 20,8 | 0,291 |
| 52,0 | 0,583 |
| 104,0 | 0,945 |
Hình A.2 - Đường chuẩn điển hình đo được ở máy đo quang phổ tại bước sóng 750 nm với độ dài đường dẫn 1 cm
A.7.3 Thông tin thống kê
Chín phòng thí nghiệm đã tham gia vào một nhiệm vụ liên phòng thí nghiệm như một phần của nghiên cứu khoa học do EU hỗ trợ từ năm 1996 đến 1998 và được công bố trong báo cáo cuối cùng MAT 1 - CT 940060 European Commision Directorate General XII. Trong thí nghiệm này, đều tiến hành kiểm tra độ chuẩn xác của phương pháp Lowry và độ chuẩn xác của toàn bộ quy trình bao gồm cả quá trình chiết. Toàn bộ phương pháp bao gồm bổ sung độ biến thiên lượng protein giữa các găng tay và trong một số trường hợp độ biến thiên này còn cao hơn nhiều độ biến thiên của phương pháp. Kết quả được tóm tắt trong Bảng A.1.
Bảng A.1 - Thông tin thống kê
|
| Số phép đo | Số dịch chiết | Số ngày | Trung bình μg/ml | Hệ số lặp lại trong các labo, tính bằng % | Hệ số tái lập giữa các labo, tính bằng % |
| Dịch chiết găng tay | 8 lần lặp 3 | 1 sử dụng bởi tất cả labo tham gia | 1 | 63,9 | 4,9 | 9,6 |
| Dịch chiết găng tay | 15 lần lặp 3 | 5 | 61,7 | 6,8 | 6,3 | |
| Găng tay A | 5 lần lặp 3 | 5 | 1 | 88,8 | 7,9 | 22,5 |
| Găng tay A | 5 lần lặp 3 | 5 | 5 | 84,5 | 6,1 | 20,3 |
| Găng tay B | 3 lần lặp 3 | 3 | 1 | 109 | 20,2 | 23,3 |
| Găng tay C | 3 lần lặp 3 | 3 | 1 | 727 | 8,3 | 23,0 |
| Găng tay D | 3 lần lặp 3 | 3 | 1 | 46,5 | 10,1 | 31,8 |
| Chiết xuất trung bình mà không cần quy trình chiết | 5,0 | 8,0 | ||||
| Quy trình trung bình toàn bộ (găng tay A đến găng tay D) | 10,5 | 24,2 | ||||
Giới hạn định lượng được thiết lập tới 10 μg/g do nó phụ thuộc vào độ dày (trọng lượng) của các găng tay. Giá trị này đã được phát hiện trong khoảng 1 μg/g đến 5 μg/g.
A.8 Tham khảo
[1] Lowry OH, Rosebrough, NJ, Farr AL, Randall RJ, Protein measurement with Folin Phenol reagent. J Biol Chem 1951 : 193 : 265-275 (Phép đo protein bằng thuốc thử folin phenol)
[2] ASTM D 5712:1995, standard test method for analysis of protein in natural rubber and its products (Phương pháp thử nghiệm tiêu chuẩn để phân tích protein trong cao su tự nhiên và các sản phẩm cao su)
[3] Kidwai SA, Ansari AA, Salahuddin, Effect of succinylation (3-carboxypropionylation) on the conformation and immunological activity of ovalbumin. Biochem J 1976:155:171-180 [Ảnh hưởng của succinyl hóa (3-carboxypropionyl hóa) lên hình thái học và hoạt tính miễn dịch của ovalbumin]
Phụ lục B
(tham khảo)
Các phương pháp miễn dịch học đo dị nguyên mủ cao su tự nhiên
B.1 Giới thiệu
Các phản ứng dị ứng tức thì với các protein của mủ cao su tự nhiên (NRL) được công nhận là một vấn đề sức khỏe nghề nghiệp và y tế quan trọng. Các protein và peptit thôi ra từ các găng tay bảo hộ NRL đã được coi là một nguồn chính gây mẫn cảm chính.
Mặc dù lượng protein toàn phần có thể ngâm chiết thường tương quan khá tốt với lượng dị nguyên của găng tay NRL đo bằng thử nghiệm lẩy da (SPT) hoặc xét nghiệm dựa trên IgE ở người [2], [3], [4], [5], nhưng các phương pháp đo lường protein toàn phần cũng đo các protein không phải dị nguyên có thể không liên quan đến dị ứng NLR. Do đó, ngày càng có nhu cầu phát triển các phương pháp có khả năng đo lường một cách chính xác và đặc hiệu lượng dị nguyên trong các sản phẩm NRL. Người ta nhất trí rằng các xét nghiệm đặc hiệu dị nguyên có thể cung cấp nhiều thông tin chính xác và đáng tin cậy hơn cho cả các mục đích quy định và giám sát các quá trình sản xuất. Tuy nhiên, hiện vẫn còn thiếu các xét nghiệm đặc hiệu. Hơn nữa, sự hiểu biết chưa đầy đủ về toàn bộ vai trò của một phổ rộng các dị nguyên NRL đã gây khó khăn cho việc quyết định nên thực hiện đo lường dị nguyên nào trong số nhiều dị nguyên có trong nguyên liệu nguồn NRL.
Các phương pháp bán định lượng, chẳng hạn như ức chế RAST và ức chế IgE ELISA, dựa trên việc sử dụng các kháng thể IgE của người, đã xuất hiện vài năm trong các phòng thí nghiệm nghiên cứu. Hạn chế của các phương pháp này là chúng khó tiêu chuẩn hóa và sự hạn chế lượng huyết thanh người chứa kháng thể IgE đặc hiệu cao su liên quan lâm sàng. Ngoài ra, cần lưu ý rằng các tiêu chuẩn được sử dụng không tương đương với protein găng tay. Nguyên tắc cho rằng một tét lý tưởng cho việc đánh giá khả năng gây dị ứng của các sản phẩm NRL phải dựa trên việc định lượng dị nguyên cụ thể đã được thông qua gần đây và chấp nhận trong việc tiêu chuẩn hóa đang diễn ra ở cả Châu Âu [6], [7] và Mỹ [8], [31 ].
Gần đây đã có những tiến bộ đáng kể trong việc phát triển các xét nghiệm định lượng và đặc hiệu để định lượng các dị nguyên NRL riêng lẻ [9], [10], [30], Các xét nghiệm mới này, dựa trên nguyên tắc xét nghiệm miễn dịch bắt enzym (EIA) và sử dụng các kháng thể đơn dòng cũng như các dị nguyên tinh khiết hay tái tổ hợp, đều là xét nghiệm đặc hiệu; chúng có thể được chuẩn hóa thích hợp và có đủ độ nhạy cảm và độ tái lập. Trong phụ lục này, các phương pháp hiện hành để đo lường dị nguyên NRL được xem xét.
B.2 Dị nguyên cao su tự nhiên trong các sản phẩm cao su
Trong số khoảng 250 protein hoặc polypeptit khác nhau đã được chứng minh trong nguyên liệu nguồn NRL là mủ lỏng của cây cao su, Hevea brasiliensis, khoảng 1/4 đến 1/5 đã được chứng minh là liên kết với IgE và thể hiện tính dị nguyên [11], [12]. Hỗn hợp các protein thực vật trong nguyên liệu nguồn phản ánh đáp ứng stress của cây cao su đối với việc tạo vết thương (quy trình cạo mủ). Một số loại protein này là protein bảo vệ đã được bảo tồn tốt ở thực vật trong quá trình tiến hóa. Sự tương đồng cấu trúc giữa các protein này tạo ra cơ sở phân tử cho các phản ứng chéo phổ biến của IgE đặc hiệu latex của bệnh nhân với các protein thực vật khác. Có vẻ là tất cả các dị nguyên đáng kể đều có trong NRL lỏng nhưng, như đã đề cập ở trên, phần lớn các protein và polypeptit có trong nguyên liệu nguồn NRL có vẻ không liên quan trong việc đánh giá các đặc tính gây dị ứng của các sản phẩm NRL đã sản xuất, Ủy ban Danh pháp Dị nguyên WHO /IUIS liệt kê (tháng 2 năm 2013) 14 di nguyên NRL đã được mô tả cấp độ phân tử ( http://www.allergen.org ), Hầu hết trong số đó đã được nhân bản và sản xuất bằng kỹ thuật DNA tái tổ hợp.
Cần thiết kế một thử nghiệm tối ưu để đo lường chính xác tất cả các dị nguyên có thể hiện diện trong các sản phẩm cao su được sản xuất. Điều này có thể bao gồm các epitop (biểu vị) có trên protein tự nhiên, cũng như các epitop mới trên các sản phẩm phân hủy tạo ra từ các quá trình sản xuất cao su phức tạp. Cho đến nay, mới có một số lượng hạn chế các dị nguyên đã được chứng minh trong các sản phẩm NRL. Các tài liệu hiện tại ủng hộ luận điểm rằng ít nhất Hev b 1, Hev b 3, Hev b 5 và Hev b 6,02, và /hoặc các mảnh hay polyme của chúng mang epitop liên kết IgE, đều có thể hiện diện trong các sản phẩm được sản xuất [13], [ 14], [15], [16], [17], [18]. Không rõ các dị nguyên bổ sung, chẳng hạn như Hev b2, Hev b7 Hev b13 [19] hoặc Hev b14 [32], có phải là dị nguyên quan trọng đặc hiệu sản phẩm cao su hay không, vẫn còn chờ sự xác nhận.
B.3 Các phương pháp đo dị nguyên cao su tự nhiên
B.3.1 Các phương pháp định tính
Các phương pháp điện di miễn dịch và kỹ thuật thấm miễn dịch sử dụng rộng rãi đầu những năm 1990 đã chứng minh và mô tả sơ bộ một số protein NRL có thể gắn kết với IgE từ huyết thanh của bệnh nhân dị ứng NRL. Tuy nhiên, ngày nay người ta đồng ý rằng không thể sử dụng một cách đơn lẻ những phương pháp để xác định một cách đáng tin cậy các dị nguyên [11], [12], [20], [21].
B.3.2 Các phương pháp bán định lượng
B.3.2.1 Tét lẩy da ở những đối tượng dị ứng latex tự nguyện
Khả năng gây dị ứng của các chiết xuất NRL có thể được đánh giá bán định lượng bằng thử nghiệm lẩy da (skin prick test - SPT) ở một số lượng đáng kể về mặt thống kê bệnh nhân dị ứng NRL. Kích thước phản ứng phụ thuộc và tỷ lệ với lượng chất dị nguyên mà bệnh nhân có kháng thể IgE đặc hiệu [2]. Từ quan điểm sinh học, SPT có thể là một thử nghiệm lý tưởng để đánh giá khả năng gây dị ứng liên quan lâm sàng, tuy nhiên do những ràng buộc về đạo đức, nên phương pháp này không thể được sử dụng thường xuyên như một thử nghiệm để theo dõi hàm lượng dị nguyên trong găng tay NRL.
B.3.2.2 Ức chế IgE-ELISA (còn được gọi là ức chế RAST)
Ức chế ELISA (ELISA = xét nghiệm hấp thụ miễn dịch liên kết enzym) có thể được sử dụng trên cơ sở các xét nghiệm tự làm hoặc có bán sẵn trên thị trường để xác định kháng thể IgE cụ thể. RAST thông thường sử dụng các kháng thể đánh dấu phóng xạ thay vì các kháng thể đánh dấu bằng enzym cho mục đích phát hiện.
Sự ức chế ELISA đã được sử dụng để đánh giá chất gây dị ứng NRL trong các sản phẩm y tế và tiêu dùng khác nhau [3], [4], [22], [23].
Trong quy trình này, cho lượng dị nguyên NRL tối ưu liên kết với pha rắn (ví dụ: giấy hoặc polystyrene). Đem ủ các mẫu thử chưa biết và mẫu tiêu chuẩn với huyết thanh chứa IgE lấy từ những người đã khẳng định bị dị ứng với NRL. Khi kháng thể IgE gắn kết với dị nguyên hòa tan, nó sẽ bị ngăn cần không liên kết được với dị nguyên ở pha rắn. Sau khi ủ, hỗn hợp được chuyển sang chế phẩm dị nguyên cố định nơi các kháng thể IgE tự do gắn kết với các dị nguyên trên pha rắn. Sau đó, đo sự gắn kết đặc hiệu bằng cách sử dụng kháng thể ant-lgE đánh dấu enzym. Mức độ ức chế tỷ lệ thuận với số lượng dị nguyên hòa tan trong dịch chiết.
Các chất phản ứng quan trọng là dị nguyên cố định, pun huyết thanh người và dị nguyên tiêu chuẩn.
Trong thử nghiệm tự làm sử dụng trong tài liệu tham khảo 4, NRL nguyên bản không amoni hóa được sử dụng để tạo lớp phủ và làm dị nguyên tiêu chuẩn. Thiết lập nồng độ 10 mg protein mỗi ml trong mẫu chuẩn thành 100 000 đơn vị tùy ý. Đem ủ các dung dịch pha loãng nối tiếp của dịch chiết găng tay và dung dịch pha loãng NRL tiêu chuẩn với pun huyết thanh IgE pha loãng tối ưu có nguồn gốc huyết thanh chuẩn độ hóa cao đã được mô tả cẩn thận từ bệnh nhân dị ứng NRL [4]
B.3.3 Các phương pháp định lượng đặc hiệu
B.3.3.1 Xét nghiệm miễn dịch gắn kết enzym (EIA) để định lượng dị nguyên NRL
B.3.3.2 Cơ sở
Một nguyên tắc đã được thừa nhận rằng một xét nghiệm tối ưu nên được thiết kế để chỉ phát hiện những dị nguyên NRL đã được chứng minh có hiện diện trong các sản phẩm được sản xuất. Bốn dị nguyên NRL, như Hev b1, Hev b3, Hev b5 và Hev b6,02, cho đến nay đã được xác định một cách rõ ràng là có trong các chiết xuất găng tay NRL [13], [15], [16], [17], [ 24], Hai dị nguyên quan trọng nhất đối với đối tượng người lớn là Hev b5 và Hev b6,02 (hevein) [15], [17], [25]. Hev b1 và Hev b3 là những dị nguyên quan trọng đối với trẻ em bị nứt đốt sống [26], [27], Các xét nghiệm miễn dịch gắn kết enzym đặc hiệu dị nguyên (EIA) để định lượng bốn dị nguyên NRL này đã được phát triển gần đây và các bộ kít đo các dị nguyên này đã được bán trên thị trường từ tháng 12 năm 2001. Cũng có thể mua riêng lẻ thuốc thử và thiết bị đo.
B.3.3.3 Mô tả các phương pháp EIA*
Các xét nghiệm EIA đã làm cho việc sử dụng kháng thể đơn dòng đặc hiệu và các dị nguyên hay protein tinh khiết tạo ra bằng công nghệ DNA tái tổ hợp trở thành phương pháp tiêu chuẩn. Trong mỗi thử nghiệm, các giếng vi chuẩn độ được phủ bởi một kháng thể đơn dòng đặc hiệu để gắn kết dị nguyên mong muốn từ mẫu. Sau khi ủ, vật liệu không gắn kết được loại bỏ bằng cách rửa. Trong lần ủ thứ hai, kháng thể đơn dòng đặc hiệu dị nguyên đánh dấu enzym (thường là peroxidase củ cải ngựa - HRP) gắn kết với các phân tử dị nguyên bám trên đĩa vi chuẩn độ trong lần ủ đầu tiên. Sau khi rửa, thêm cơ chất cho enzyme, Sau khi dừng phản ứng, đo độ hấp thụ ở bước sóng thích hợp. Cường độ màu tạo ra tỷ lệ thuận với nồng độ dị nguyên của mẫu.
* Theo thông tin cung cấp bởi nhà sản xuất các bộ kít thương mại (FITkit® Insert, http://www.quattromed.com), giới hạn phát hiện 4 dị nguyên trong phạm vi từ 0,1 μg/l (Hiv b6.02) đến 2,3 μg/l (Hev b3). Hệ số lặp lại đã chứng tỏ nằm trong phạm vi từ 2,8% đến 5,8% và hệ số tái lập từ 2,6% đến 7,6%. Thông tin này cung cấp sự thuận tiện cho người dùng Tiêu chuẩn Châu Âu này và không phải là sự quảng cáo bởi CEN cho sản phẩm đã nêu tên
B.3.3.4 Tính năng của xét nghiệm EIA so với xét nghiệm dị nguyên dựa trên IgE
Xét nghiệm dị nguyên đặc hiệu hiện đã được sử dụng trong một loạt nghiên cứu để đánh giá khả năng gây dị ứng của găng tay y tế. Sự xác minh tốt nhất về khả năng gây dị ứng của một chiết xuất nhất định có lẽ được thể hiện ở khả năng phản ứng của nó trên da của những bệnh nhân dị ứng NRL. Trong một nghiên cứu 22 găng tay NRL, xuất hiện sự tương quan cao đáng kể khi tìm sự liên quan của tổng 4 dị nguyên này (đo bằng bộ kít EIA thương mại) với kết quả từ các xét nghiệm ức chế dựa trên IgE ở người [10]. Sự tương quan cao nhất được thấy giữa tổng 4 dị nguyên trong găng tay và SPT ở 20 người tình nguyện dị ứng NRL (r = 0,95), sau đó là tổng 4 dị nguyên và kết quả ức chế ELISA IgE (r = 0,90). Sự tương quan với tổng protein được đo bằng phương pháp Lowry cải tiến là rất thấp (r = -0,11). Trong một loạt 58 găng tay NRL khác được báo cáo trong cùng một giao tiếp [10], sự tương quan giữa tổng bốn dị nguyên và hoạt tính dị nguyên toàn phần đo bằng ức chế ELISA IgE là 0,84. Kết quả của một nghiên cứu quốc tế gần đây [28] do FDA sắp xếp và thực hiện tại bảy phòng thí nghiệm để đo dị nguyên NRL ở 30 găng tay đã cho thấy một cách tương tự rằng tổng bốn dị nguyên đo bằng EIA đơn dòng thể hiện sự tương quan cao nhất (r2 = 0,91 - 0,95) với các thử nghiệm sử dụng ức chế RAST /ELISA dựa trên IgE của người. Hiện tại, vẫn cần thiết các nghiên cứu mở rộng với số lượng lớn găng tay để đảm bảo hơn nữa khả năng áp dụng xét nghiệm EIA đặc hiệu dị nguyên nhưng có vẻ là tổng bốn dị nguyên này phản ánh lượng dị nguyên toàn phần của các chiết xuất găng tay theo cách có ý nghĩa sinh học. Các nghiên cứu đang tiến hành hiện nay dự kiến sẽ làm sáng tỏ liệu có cần thêm các dị nguyên hay không và liệu chúng có ảnh hưởng đến kết quả của các đánh giá hay không.
Một nghiên cứu khác ở 208 găng tay [30] sử dụng xét nghiệm miễn dịch thương mại (FitKit, lcosagen AS, Tartu, Estonia) đáp ứng các tiêu chí của Tiêu chuẩn ASTM D7427-08 đã cung cấp sự tương quan mạnh mẽ giữa tổng bốn dị nguyên liên quan lâm sàng và xét nghiệm miễn dịch dựa trên IgE người đã được xác nhận bằng tét lẩy da. Hiện tại, vẫn cần thiết các nghiên cứu mở rộng với số lượng lớn găng tay để đảm bảo hơn nữa khả năng áp dụng xét nghiệm EIA đặc hiệu dị nguyên nhưng có vẻ là tổng bốn dị nguyên này phản ánh lượng dị nguyên toàn phần của các chiết xuất găng tay theo cách có ý nghĩa sinh học.
Hiện tại, các nghiên cứu mở rộng với số lượng găng tay lớn hơn vẫn cần thiết để đảm bảo hơn nữa khả năng áp dụng của các EIA dành riêng cho chất gây dị ứng nhưng dường như tổng của bốn chất gây dị ứng phản ánh tổng hàm lượng chất gây dị ứng của các chất chiết xuất từ găng tay trong một cách thức có ý nghĩa sinh học mặc dù không có tuyên bố nào về độ an toàn được đưa ra. Các nghiên cứu đang tiến hành hiện nay cần làm sáng tỏ liệu có cần thêm các dị nguyên và liệu chúng có ảnh hưởng đến kết quả của các đánh giá hay không.
B.4 Kết luận
Đo tổng lượng protein có thể chiết không được coi là phương pháp lý tưởng để kiểm soát lượng dị nguyên NRL của găng tay y tế. Tuy nhiên, tại thời điểm công bố tiêu chuẩn này, các phương pháp dựa trên IgE đặc hiệu của người để đo dị nguyên vẫn chưa được xác thực, thiếu tiêu chuẩn hóa và thiếu thuốc thử cần thiết. Do đó, nó vẫn là phương pháp được quy định trong phần quy phạm của tiêu chuẩn này. Các phương pháp EIA để định lượng dị nguyên NRL đã khắc phục được một số hạn chế của các phương pháp trước đây bằng cách sử dụng các dị nguyên đã mô tả với độ tinh khiết cao và các kháng thể đơn dòng đặc hiệu chống lại dị nguyên NRL được biết có trong các sản phẩm NRL. Các xét nghiệm này có tính đặc hiệu cao, không bị ảnh hưởng bởi sự hiện diện của các protein hay hóa chất khác bắt nguồn từ quá trình sản xuất sản phẩm NRL và có độ nhạy cao. Các xét nghiệm này khá dễ thực hiện về mặt kỹ thuật và có thể thu được kết quả trong thời gian xét nghiệm ngắn (<2 h). Nhược điểm bao gồm chi phí hiện đang cao và vẫn chưa thể xác định một cách chắc chắn rằng dị nguyên nào trong số các dị nguyên NRL đã biết cần thiết cho việc thiết lập các khuyến nghị và giới hạn an toàn. Ngoài ra, có thể cần một số lượng lớn các kháng thể đơn dòng để đảm bảo phát hiện tất cả các dị nguyên liên quan. Hiện tại, các xét nghiệm và /hoặc thuốc thử để đo bốn dị nguyên NRL riêng bằng các phương pháp dựa trên EIA đã được bán trên thị trường. Nếu xuất hiện thêm các dị nguyên ở lượng đáng kể trong các sản phẩm cao su, các bộ kít và thuốc thử mới dựa trên các khuôn khổ hiện có sẽ được phát triển.
Một thử nghiệm liên phòng thí nghiệm liên quan đến việc đánh giá ba phương pháp thử nghiệm định lượng protein và dị nguyên NRL trong găng tay y tế đã được CEN / TC205 / WG3 thực hiện vào năm 2002. Ba phương pháp thử nghiệm được đánh giá là:
- Đo lường các dị nguyên đặc hiệu (xem * từ B.3.3.3)
- ASTM D 6499 (protein kháng nguyên) [29]
- Phân tích axit amin (protein toàn phần)
Không kết luận nào rút ra từ thí nghiệm này có thể cho phép khuyến nghị đưa các phương pháp thử nghiệm đã nêu ở trên vào tiêu chuẩn.
Cần có các nghiên cứu mở rộng với một bộ sưu tập các găng tay hiện bán trên thị trường Châu Âu và các mẫu tham chiếu với nồng độ dị nguyên quan tâm đã định lượng chính xác để xác thực thêm tính năng và tính hữu dụng của các xét nghiệm đặc hiệu dị nguyên mới.
B.5 Tài liệu tham khảo
[1] Turjanmaa, K. et al., Natural rubber latex allergy (review), Allergy, 51, 593, 1966. (Dị ứng mủ cao su tự nhiên)
[2] Turjanmaa, K., et al, Rubber contact urticaria. Allergnic properties of 19 brands of latex gloves, Contact Dermatitis, 19, 362, 1988 (Mày đay do tiếp xúc cao su. Các tính chất dị nguyên của 19 thương hiệu găng tay cao su, Viêm da tiếp xúc)
[3] Yunginger, J.W., et al., Extractable latex allergens and proteins in disposable medical gloves and other rubber products, J. Allergy Clin. Immunol., 93, 836,1994 (Dị nguyên và protein cao su có thể chiết xuất trong găng tay y tế sử dụng một lần và các sản phẩm cao su khác)
[4] Palosuo, T. et al.,. Measurement of natural rubber latex allergen levels in medical gloves by allergenspecific IgE-ELISA inhibition, RAST inhibition, and skin prick test. Allergy, 53, 59, 1998 (Phép đo mức độ dị nguyên cao su tự nhiên trong găng tay y tế bằng ức chế IgE-ELISA đặc hiệu dị nguyên, ức chế RAST, và tét lẩy da)
[5] Yip, E., et al., Allergic responses and levels of extractable proteins in NR latex gloves and dry rubber products. J. Nat. Rubber Res., 9, 79, 1994 (Đáp ứng dị ứng và các mức độ protein có thể chiết trong găng tay cao su tự nhiên và các sản phẩm cao su khô)
[6] CEN/STAR Document N 409 - Endorsement by star of research proposal on immunological test to measure allergens in natural rubber latex (document CEN/TC 205 N 1187), European Committee for Standardisation, Brussels, 2002 (Chứng thực dấu sao đề xuất nghiên cứu trên thử nghiệm miễn dịch học để đo các dị nguyên trong mủ cao su tự nhiên)
[7] Scientific committee on medicinal products and medical devices. Opinion on Natural rubber latex allergy. European Commission, http://europa.eu.int/comm/foods/fs/sc/scmp/out31_en.pdf, 2000 (Ý kiến về dị ứng mủ cao su tự nhiên)
[8] Hamilton, R.G., Palosuo, T., Minutes of the ASTM meeting on Immunoenzymetric assay (IEMA) task group (D11.40.08), Denver, CO, June, 2003.
[9] Turjanmaa, K., et al., Recent develoμments in latex allergy, Curr. Opin. Allergy Clin. Immunol., 2, 407, 2002 (Những phát triển gần đây trong dị ứng mủ cao su)
[10] Palosuo, T., Alenius, H. and Turjanmaa, K., Quantitation of latex allergens, Methods, 27, 52, 2002 (Định lượng các dị nguyên mủ cao su, các phương pháp)
[11] Alenius, H., et al., Latex allergy: frequent occurrence of IgE antibodies to a cluster of 11 latex proteins in patients with spina bifida and histones of anaphylaxis. J. Lab. Clin. Med., 123, 712, 1994 (Dị ứng mủ cao su: sự xuắt hiện thường xuyên kháng thể IgE với một nhóm 11 protein cao su ở những bệnh nhân nứt đốt sống và có lịch sử phản vệ)
[12] Posch, A. et al., Characterization and identification of latex allergens by two-dimensional electrophoresis and protein micro sequencing, J. Allergy Clin. Immunol., 99, 385, 1997 (Mô tả đặc tính và nhận dạng các dị nguyên mủ cao su bằng điện di hai chiều và phân tích vi cấu trúc chuỗi protein)
[13] Czuppon, A.B. et al., The rubber elongation factor of rubber trees (Hevea brasiliensis) is the major allergen in latex. J. Allergy Clin. Immunol., 92:690,. 1993 (Yếu tố kéo dài cao su của cây cao su là dị nguyên chính trong mủ cao su)
[14] Lu, L-J. et al., Characterization of a major latex allergen associated with hypersensitivity in spina bifida patients, J. Immunol., 155, 2721, 1995 (Mô tả đặc tính dị nguyên mủ cao su chính liên quan với quá mẫn cảm ở những bệnh nhân nứt đốt sống)
[15] Alenius, H., et al., The main IgE-binding epitope of a major latex allergen, prohevein, is present in its N-terminal 43-amino acid fragment, hevein. J. Immunol., 156, 1618, 1996. (Epitop gắn kết IgE chính của một dị nguyên cao su chính, prohevein, hiện diện ở đầu cuối N của mảnh 43 axit amin, hevein)
[16] Akasawa, A., et al., A novel acidic allergen, Hev b5, in latex: purification, cloning and characterization, J. Biol. Chem., 271, 25389, 1996 (Một dị nguyên axit mới, H ev b5, trong mủ cao su; tinh lọc, nhân bản và mô tả đặc tính)
[17] Sutherland, M.F., et al., Specific monoclonal antibodies and human immunoglobulin E show that Hev b5 is an abundant allergen in high protein powdered latex gloves. Clin. Exp. Allergy. 32, 583, 2002 (Các kháng thể đơn dòng đặc hiệu và globulin miễn dịch IgE của người chứng tỏ rằng Hev b5 là dị nguyên phổ biến ở găng tay cao su chứa bột có hàm lượng protein cao)
[18] Palosuo, T., et al., The Major Latex Allergens Hev fa 6.02 (hevein) and Hev b5 are regularly detected in medical gloves with moderate or high allergen content. J. Allergy Clin. Immunol., 107, S321 (abstract), 2001 (Các dị nguyên cao su chính Hev b6.02 (hevein) và Hev b5 được phát hiện đều đặn trong găng tay y tế có hàm lượng dị nguyên trung bình hoặc cao)
[19] Yeang HY, Arif SA, Raulf-Heimsoth M, Loke YH, Sander I, Sulong SH, Lau CH, Hamilton RG. Hev b5 and Hev b13 as allergen markers to estimate the allergenic potency of latex gloves. J. Allergy Clin Immunol 2004; 114:593-8 (Hev b5 và Hev b13 là các dị nguyên đánh dấu để ước tính hiệu lực dị nguyên của găng tay cao su)
[20] Laemmli, U.K., Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 77, 680, 685, 1970 (Phân tách các protein cấu trúc trong quá trình lắp ghép phần đầu thực khuẩn T4)
[21] O’Farrell, P.H., High-resolution two-dimensional electrophoresis of proteins. J. Biol. Chem. 250: 4007- 4021, 1975 (Điện di hai chiều độ phân giải cao các protein)
[22] Yman, L., Ponterius, G. and Brandt, R., RAST-based allergen assay methods. Dev. Biol, stand., 29, 151, 1975 (Các phương pháp xét nghiệm dị nguyên dựa trên RAST)
[23] Crippa, M., et al., Prevention of latex allergy among health care workers: evaluation of the extractable latex protein content in different types of medical gloves. Am. J. Ind. Med., 44, 24, 2003 (Phòng ngừa dị ứng cao su ở những người lao động trong ngành chăm sóc sức khỏe: đánh giá hàm lượng protein cao su có thể chiết xuất được trong các loại găng tay y tế khác nhau)
[24] Baur, X., et al., Protein and allergen content of various natural latex articles. Allergy, 52, 661, 1997 (Hàm lượng protein và dị nguyên của các sản phẩm cao su tự nhiên khác nhau)
[25] Ylitalo, L, et al., IgE antibodies to prohevein, hevein, and rubber elongation factor in children with latex allergy. J. Allergy Clin. Immunol. 102, 659, 1998 (Các kháng thể IgE đặc hiệu prohevein, hevein và yếu tố kéo dài cao su ở trẻ em dị ứng mủ cao su)
[26] Alenius, H., Palosuo, T., Kelly, K., Kurup, V., Reunala, T„ Mäkinen-Kiljunen, S., Turjanmaa, K., Fink, J. IgE reactivity to 14-kD and 27-kD natural rubber proteins in latex-allergic children with spina bifida and other congenital anomalities. Int. Arch. Allergy Immunol. 1993; 102:61-66 (Tính phản ứng IgE với các protein cao su tự nhiên 14-kD và 27 kD ở trẻ em dị ứng cao su bị hở đốt sống và các dị dạng bẩm sinh khác)
[27] Yeang, H.Y., et al., The 14.6 kD rubber elongation factor (Hev b 1) and 24 kD (Hev b 3) rubber particle proteins are recognized by IgE from patients with spina bifida and latex allergy. J. Allergy Clin.Immunol.; 98, 628, 1996 (Nhận biết yếu tố kéo dài cao su 14,6 kD (Hev b1) và protein 24 kD (Hev b3) bằng IgE từ các bệnh nhân hở đốt sống và dị ứng cao su)
[28] Tomazic-Jezic V.J., et al., Performance of methods for the measurement of natural rubbe latex (NRL) proteins, antigens and allergens. J. Allergy Clin. Immunol.; 113, S78 (abstract), 2004 (Tính năng của các phương pháp đo protein, kháng nguyên và dị nguyên cao su tự nhiên)
[29] ASTM D 6499, Standard Test Method for the Immunological Measurement of Antigenic Protein in Natural Rubber and its Products (Phương pháp thử nghiệm tiêu chuẩn để đo miễn dịch protein kháng nguyên trong cao su tự nhiên và các sản phẩm của nó)
[30] Palosuo, T., Reinikka-Railo, H., Kautiainen, H., Alenius, H., Kalkkinen, N., Kulomaa, M., Reunala, T. and Turjanmaa, K. Latex allergy: the sum quantity of four major allergens shows the allergenic potential of medical gloves. Allergy, 62: 781-786, 2007 (Dị ứng cao su: tổng lượng bốn dị nguyên chính thể hiện khả năng gây dị ứng của găng tay y tế)
[31] ASTM D7427-08. Standard Test Method for Immunological Measurement of Four Principal Allergenic Proteins (Hev b 1, 3, 5 and 6.02) in Natural Rubber and Its Products Derived from Latex [Phương pháp thử nghiệm tiêu chuẩn để đo miễn dịch 4 protein dị nguyên chính (Hev b1,3,5 và 6.02) trong cao su tự nhiên và các sản phẩm nguồn gốc cao su)
[32] Lee, M.F., Wang, N.M., Han, J.L., Lin, S.J., Tsai, ,JJ. and Chen, Y.H Estimating Allergenicity of Latex Gloves Using Hev b1 and Hevamine. J Investigat Allergol Clin Immunol. 20: 499-505, 2010 (Dự tính tính dị nguyên của găng tay cao su bằng cách sử dụng Hev b1 và hevamine)
Phụ lục C
(tham khảo)
Phân tích amino axit (AAA) bằng phép đo sắc ký dịch áp lực cao (HPLC)
C.1 Cơ sở
Việc xác định protein thường dựa trên phần ứng màu với các yếu tố cấu trúc đặc biệt, thường không phân bố trong các protein khác nhau [1], [2], [3], [4], [5]. Do đó đáp ứng khác nhau đáng kể giữa các protein [2], [4]. Ngoài ra, có một số chất can thiệp vào các xét nghiệm đo màu do phản ứng không đặc hiệu của chúng với thuốc thử màu hoặc ức chế sự phát triển màu.
Việc phân tích axit amin tránh được những vấn đề này. Điều này đã được xác nhận bởi kết quả của nghiên cứu 'Xác định các hợp chất liên quan dị ứng học trong găng tay dùng một lần - Sự tương quan của các dữ liệu hóa học, dị ứng học và miễn dịch học’ trong chương trình ‘Đo lường và Thử nghiệm' của Ủy ban Châu Âu (MATI-CT 940060) [8], Trong nghiên cứu này, đã phát hiện mối tương quan tốt nhất giữa dữ liệu lâm sàng (tét lẩy da) và phân tích hóa học, nếu nồng độ protein được đo bằng phân tích axit amin [6].
Dù vậy, nên sử dụng phương pháp Lowry cải tiến làm phương pháp tiêu chuẩn để xác định protein trong găng tay cao su tự nhiên, vì phân tích axit amin dường như rất không phổ biến và phức tạp đối với một quy trình chuẩn. Có thể sử dụng phân tích axit amin để làm rõ các kết quả đáng ngờ thu được từ phương pháp Lowry cải tiến. Không nên sử dụng nó cho việc công bố protein nhưng có thể giúp nhà sản xuất tránh được các chất dẫn đến việc xác định protein không chính xác bằng phương pháp chuẩn này.
C.2 Các nguyên lý xác định Protein bằng HPLC
Ở bước đầu tiên, các protein được thủy phân bằng axit HCl 6M. Sau đó tách các axit amin tự do tạo thành và phát hiện bằng phép đo HPLC [7]. Việc định lượng thông qua chất chuẩn nội bộ (internal standard) như norvalin, và cộng tổng các axit amin riêng lẻ cho ra lượng protein toàn phần. Do quy trình này, nên phương pháp độc lập với bất kỳ đặc điểm cấu trúc nào của phân tử polyme ban đầu. Hiện tại chưa thể phát hiện các chất cản trở, nhưng sự có mặt của các muối TES dường như tránh được sự mất mát axit amin (ví dụ do tác dụng của thành ống nghiệm).
C.3 Vật liệu
C.3.1 DL-Norvalin.
C.3.2 HCl 30 % Suprapur.
C.3.3 Chất chuẩn axit amin (chứa L-alanine, amoni clorua, L-arginine, axit L-aspartic, axit L- glutamic, glycine, L-histidine, L-isoleucine, L-leucine, L-lysine, L-methionine , L-phenylalanine, L- proline, L-serine, L-threonine, L-tryptophan, L-tyrosine, L-valine 0,5 mM chất và L-cystine 0,25 mM).
C.3.4 Methanol, cấp độ phân tích chuỗi protein (phù hợp cho phân tích chuỗi protein pha rắn)
C.3.5 o-phtalicandehit (OPA).
C.3.6 Axit boric.
C.3.7 Axit etylendiaminetetratacetic, muối dinatri (EDTA).
C.3.8 Kali photphat đơn bazơ (KH2PO4).
C.3.9 Natri photphat đi bazơ (Na2HPO4).
C.3.10 Natri photphat đơn bazơ (NaH2PO4).
C.3.11 Axit 3-mercaptopropionic.
C.3.12 Cột tách: Hypersil ODS 3 μm, 150 x 4,6 mm, đã thử nghiệm trước cho ứng dụng OPA.
C.3.13 Cột trước: Hypersil ODS, 3 μm, 5 x 4,6 mm.
C.3.14 Nước, ít nhất là Milli-Q hoặc chất lượng tương đương.
C.3.15 Bộ lọc có kích thước lỗ 0,2 μm.
C.3.16 Tetrahydrofuran (THF), cấp độ gradient dùng cho phép đo sắc ký lỏng.
C.3.17 Acetonitril, cấp độ gradient dùng cho phép đo sắc ký lỏng.
C.3.18 Các bình polypropylen 2 ml có nắp vặn.
C.3.19 Natri cacbonat (NaHCO3).
C.3.20 Viên natri hydroxit (NaOH) hoặc kali hydroxit (KOH).
C.4 Chất đệm và dung dịch
CHÚ THÍCH: Dung môi 1 và dung môi 2 được tạo ra cho cột OPA-1 của Grom, Herrenberg, Germany. Nếu sử dụng bất kỳ cột nào khác, có thể cần có những thay đổi.
C.4.1 Norvalin-100
11,7 mg norvalin (C.3.1) trong 1 ml nước (C.3.14) = norvalin 100 mM.
C.4.2 Norvalin-1
100 pl norvalin-100 (C.4.1) trong 10 ml nước (C.3.14) = norvalin 1 mM, bảo quản ở nhiệt độ dưới 8 °C không quá 4 tuần.
C.4.3 o-Phthaldialdehyde (OPA)
50 mg o-phtalicandehit (C.3.5), 4,5 ml metanol (C.3.4), 50 pl axit mercaptopropionic (C.3.11).
C.4.4 Bộ đệm boratebuffer
Natri borat 400 mM, EDTA 5 mM, pH 10,4.
1,24 g axit boric và 85 mg EDTA trong 30 ml nước (C.3.14), điều chỉnh đến pH 10,4 bằng NaOH 2M và thêm nước (C.3.14) thêm 50 ml. Lọc qua bộ lọc 0,2 μm (C.3.15), bảo quản ở nhiệt độ phòng không quá hai tuần. Tránh để trong tủ lạnh vì có thể tạo kết tủa không tan.
C.4.5 Dung dịch dừng
1,36 g KH2PO4 (C.3.8) trong nước (C.3.14), lọc qua bộ lọc 0,2 μm (C.3.15) và bảo quản ở nhiệt độ phòng không quá 4 tuần.
C.4.6 Dung dịch đệm photphat
7,15 g Na2HPO4 (C.3.8) và 3,45 g NaH2PO4-H2O (C.3.9) trong 1,5 I nước (C.3.14).
C.4.7 Dung môi 1
20 ml tetrahydrofuran (C.3.16) cộng với 1 I đệm phosphat (C.4.6).
C.4.8 Dung môi 2
250 ml acetonitril (C.3.17), 100 ml tertrahydrofuran (C.3.16), thêm 1 I đệm phosphat (C.4.6).
C.4.9 Dung dịch natri cacbonat (0,1 M)
2,12 g natri cacbonat (C.3.19) trong 10 ml nước (C.3.14).
C.5 Thủy phân
C.5.1 Các mẫu thử nghiệm
400 μl dịch chiết (trong đệm TES) + 10 μl norvalin-1 (C.4.2) + 700 μl HCl (C.3.3).
C.5.2 Các dịch chuẩn
380 μl nước (C.3.14) + 20 pl axit amin chuẩn (C.3.3) + 10 μl norvalin-1 (C.4.2) + 700 pl HCl (C.3.2).
C.5.3 Ủ (thủy phân)
Ủ mẫu thử nghiệm và mẫu chuẩn đồng thời trong vòng 48 h ở nhiệt độ 100 °C trong các bình PP có nắp vặn kín (C.3.18). Các bình phải được kẹp vào giá có vít để tránh làm nứt nắp. Điều rất quan trọng là phải thủy phân đồng thời các mẫu chuẩn và mẫu thử nghiệm để có điều kiện nhiệt độ và thời gian bằng nhau.
Làm nguội mẫu thử và mẫu chuẩn, làm khô trong máy ly tâm cô đặc chân không hoặc trong bình hút ẩm trên NaOH hoặc KOH trong chân không.
Cần loại bỏ hoàn toàn HCl; nếu không dung tích của đệm borat để tạo dẫn xuất có thể không đủ.
C.5.4 Axit amin tự do
Chuẩn bị từ mỗi dịch chiết và từ mẫu chuẩn chưa thủy phân.
- 400 μl dịch chiết + 10 μl norvalin 1 (C.4.2);
- 380 μl nước (C.3.14) + 20 μl axit amin chuẩn (C.3.3) + 10 μl norvalin 1 (C.4.2).
C.6 Phân tích (HPLC)
C.6.1 Chuẩn bị mẫu
- thêm 20 μl dung dịch natri cacbonat vào các mẫu thử nghiệm đã làm khô (C.4.9);
- trộn đều hoặc rung siêu âm;
- ủ 15 min ở nhiệt độ phòng, trộn lại để loại bỏ CO2;
- thêm 180 μl đệm borat (C.4.4).
C.6.2 Tạo dẫn xuất (dẫn xuất hóa)
Bước tạo dẫn xuất phụ thuộc vào thời gian và nhiệt độ; nó cần được thực hiện bằng bộ lấy mẫu tự động ở nhiệt độ không đổi từ 20 °C đến 25 °C.
Trộn 25 μl đệm borat (C.4.4), 12 μl OPA (C.4.3) và 8 μl mẫu thử.
Sau 2,5 min kết thúc phản ứng bằng cách thêm 25 μl dung dịch dừng (C.4.5).
C.6.3 HPLC
Có thể thực hiện phân tích HPLC trong bất kỳ thiết bị HPLC nào bằng cách sử dụng hệ thống gradient và máy dò huỳnh quang.
Một ví dụ thành công được liệt kê ở đây, nhưng các điều kiện này phải được điều chỉnh phù hợp với hệ thống và cột đã sử dụng.
VÍ DỤ:
| 0 min - 2,5 min | 0 % dung môi 2 | 100 % dung môi 1 |
| 2,5 min - 3,0 min | 0 % -12,5 % dung môi 2 | 87,5 %-100 % dung môi 1 |
| 3,0 min - 9,0 min | 12,5 % dung môi 2 | 87,5 % dung môi 1 |
| 9,0 min -13,0 min | 12,5 % - 42 % dung môi 2 | 58 %- 87,5 % dung môi 1 |
| 13,0 min - 24,0 min | 42 % dung môi 2 | 58 % dung môi 1 |
| 24,0 min - 26,0 min | 42 % - 80 % dung môi 2 | 20 % - 58 % dung môi 1 |
| 26,0 min - 30,0 min | 80 % dung môi 2 | 20 % dung môi 1 |
| 30,0 min - 31,0 min | 0 % - 80 % dung môi 2 | 20 % -100 % dung môi 1 |
C.6.4 Tính toán
Nồng độ của các axit amin riêng lẻ phải được thực hiện bằng phương pháp chuẩn nội bộ và trừ đi các axit amin tự do. Tổng các axit amin bằng lượng protein toàn phần.
C.7 Các ví dụ
C.7.1 Dịch chuẩn
Sắc ký đồ điển hình của dung dịch chuẩn thủy phân với 19 axit amin ở các nồng độ đẳng môn được thể hiện trong Hình C.1 a). Các axit amin dự kiến được liệt kê trong Bảng C.1. Asparagine và glutamine chuyển hoàn toàn thành axit aspartic và axit glutamic không được đưa vào trong dung dịch tiêu chuẩn. Norvaline vốn không xuất hiện tự nhiên được sử dụng làm chất chuẩn nội bộ. Tryptophan và cystine có trong dung dịch chuẩn không thủy phân nhưng bị phân hủy bởi sự thủy phân HCl. Proline không phản ứng với OPA /MPA do thiếu nhóm amin chính và do đó không thể phát hiện được trong các điều kiện dẫn xuất hóa này. Lysine thường tạo ra hai đỉnh do một hoặc hai nhóm amin của nó có thể phản ứng với OPA /MPA. Tỷ lệ của hai đỉnh này phụ thuộc vào các điều kiện phản ứng (nhiệt độ, tuổi của dung dịch OPA) và do đó thay đổi tùy từng lần thử nghiệm nhưng không ảnh hưởng đến kết quả nếu tính đến hai diện tích cả hai đỉnh.
C.7.2 Dịch chiết găng tay
Sắc ký đồ của dịch chiết găng tay đã thủy phân (được chuẩn bị như mô tả trong Phụ lục A) được thể hiện trên Hình C.1 b). Quá trình thủy phân protein cao su này cho thấy bảng đầy đủ các axit amin dự kiến (Bảng C.1). Phát hiện thêm các đỉnh ở 14,23 min và 24,08 min và đã được xác định là các sản phẩm nguồn gốc TES. Đỉnh này đã hoàn toàn biến mất khôi sắc ký đồ của tất cả axit amin và không ảnh hưởng đến phân tích.
C.8 Ưu và nhược điểm của phương pháp HPLC
C.8.1 Ưu điểm
- không phụ thuộc vào cấu trúc polime của protein;
- nó tiết lộ sự tương quan tốt nhất với dữ liệu lâm sàng (thử nghiệm lẩy da);
- không biết các chất gây nhiễu;
- nhạy hơn các phép xác định đo màu;
- có tính đặc hiệu cao với protein.
C.8.2 Nhược điểm
- là phương pháp không phổ biến, chỉ được cài đặt ở một số phòng thí nghiệm;
- tốn nhiều thời gian;
- việc đánh giá dữ liệu rất phức tạp, đòi hỏi nhiều kinh nghiệm.
Bảng C.1 - Danh sách axit amin phát hiện trong phân tích HPLC dung dịch chuẩn
(Hình C.1a) và trong thủy phân dịch chiết găng tay (Hình C.1b)
| Axit amin | Thời gian lưu giữ | Nhận xét | |
| Tiêu chuẩn | Phân tích |
| |
| Axit aspartic (ASP) | 2,52 | 2,52 |
|
| Asparagine (ASN) |
|
| Chuyển thành ASP |
| Axit glutamic (Glu) | 3,23 | 3,24 |
|
| Glutamine (GLN) |
|
| Chuyển thành GLU |
| Serine (SER) | 6,83 | 6,85 |
|
| Histidine (HIS) | 8,60 |
|
|
| Glycine (GLY) | 9,25 | 9,25 |
|
| Threonine (THR) | 9,84 | 9,82 |
|
| Arginine (ARG) | 11,24 | 11,21 |
|
| Alanine (ALA) | 12,30 | 12,29 |
|
|
|
| 14,23 | TES (đệm chiết xuất) |
| Tyrosine (TYR) | 17,7 |
|
|
| Valine (VAL) | 20,95 | 21,07 |
|
| Methionine (MET) | 21,75 | 21,90 |
|
| Norvaline (NORVAL) | 22,42 | 22,55 | Tiêu chuẩn nôi bộ |
|
|
| 24,08 | TES (đệm chiết xuất) |
| iso-Leucine (ILE) | 25,15 | 25,32 |
|
| Phenylalanine (PHE) | 25,48 | 25,64 |
|
| Leucine (LEU) | 26,61 | 26,74 |
|
| Lysine (LYS) | 28,41 | 28,44 | Phân hủy bởi thủy |
|
| 30,65 | 30,60 | phân |
| Cystine, cysteine (CYS) |
|
| Phân hủy bởi thủy phân |
| Proline (PRO) |
|
| Không thể phát hiện |
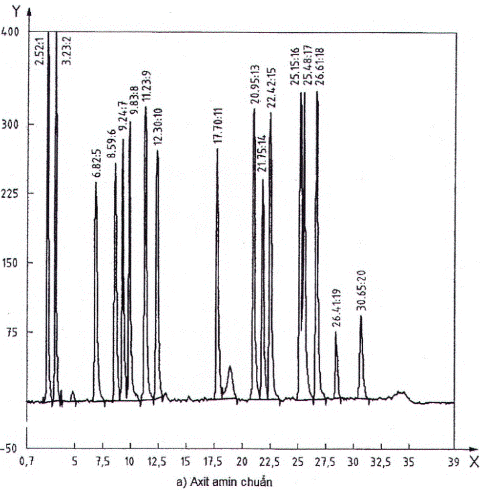
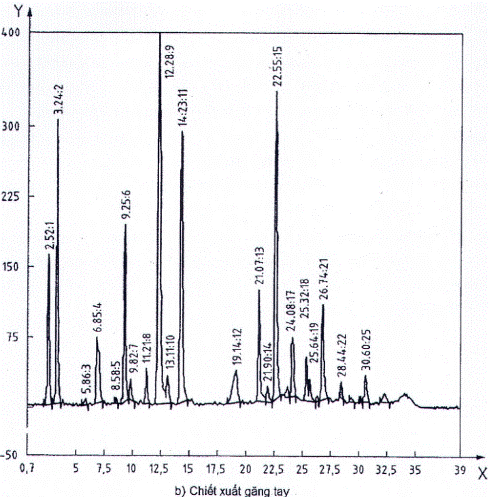
Hình C.1 - Sắc ký điển hình của axit amin tiêu chuẩn (A) và phân tích dịch chiết xuất găng tay ( 35 μg protein)
C.9 Tài liệu tham khảo
[1] Bradford M, A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem 1976 : 72: 248-255 (Một phương pháp nhanh và nhạy để định lượng các lượng microgram protein bằng cách sử dụng nguyên tắc liên kết protein-thuốc nhuộm)
[2] Langheinrich U, Bestimmung von Proteinkonzentrationen in Losungen Teil 1: Chemie in Labor und Biotechnik 1995 : 46 : 82-85
[3] Langheinrich U, Bestimmung von Proteinkonzentrationen in Losungen Teil 2: Chemie in Labor und Biotechnik 1995 : 46 : 135-136
[4] Lowry OH, Rosebrough, NJ, Farr AL, Randall RJ, Protein measurement with Folin Phenol reagent. J Biol Chem 1951 : 193 : 265-275 (Phép đo protein bằng thuốc thử Folin Phenol)
[5] Petersen GL, Determination of total protein. In Methods of Ezymology, Academic Press, Inc., New York 91, 95-118 (Xác định protein toàn phần. Trong phương pháp enzym học)
[6] Koch HU, Regulatory aspects of latex allergy (CEN; extractable protein and allergen assay for latex gloves). Rev Fr Allergol 1997: 37 : 1201-1210 [Các khía cạnh quy định của dị ứng cao su (CEN; Xét nghiệm protein và dị nguyên có thể chiết xuất đối với găng tay cao su]
[7] Graser TA,. Godel HG, Albers S, Foldi P, Furst P, An ultra-rapid and sensitive high- performance liquid chromatographic method for determination of tissue and plasma free amino acids. Anal Biochem 1985 : 151:142-152 (Phương pháp ghi sắc ký lỏng tính năng cao, nhạy cảm và siêu nhanh dùng để xác định axit amin tự do trong mô và huyết tương)
[8] MATI_CT 940064 European Commission Study - Determination of allergological relevant compounds in disposable gloves - Correlation of chemical, allergological and immunological data (Xác định các hợp chất liên quan dị ứng học trong găng tay dùng một lần - Sự tương quan của dữ liệu hóa học, dị ứng học và miễn dịch học)
Phụ lục ZA
(tham khảo)
Sự liên quan giữa tiêu chuẩn này và các yêu cầu cơ bản của Chỉ thị EU 93/42/EEC về trang thiết bị y tế
Tiêu chuẩn này đã được chuẩn bị theo sự ủy nhiệm cho CEN bởi Liên minh Châu Âu và Hiệp hội Thương mại tự do Châu Âu để cung cấp phương tiện tuân thủ các yêu cầu cơ bản của chỉ thị tiếp cận Mới 93/42 /EEC về trang thiết bị y tế.
Một khi tiêu chuẩn này được trích dẫn trong tạp chí chính thức của Liên minh Châu Âu theo Chỉ thị đó và đã được thực hiện như một tiêu chuẩn quốc gia ở ít nhất một quốc gia thành viên, thì việc tuân thủ các điều khoản của tiêu chuẩn này nêu trong Bảng ZA.1, trong giới hạn của phạm vi của tiêu chuẩn này, được coi là phù hợp với các yêu cầu cơ bản tương ứng của Chỉ thị đó và các quy định EFTA liên quan.
Bảng ZA.1- Sự tương quan giữa Tiêu chuẩn Châu Âu này và Chỉ thị 93/42/EEC
| Điều của Tiêu chuẩn EN | Yêu cầu Cơ bản của Chỉ thị EU | Nhận xét ghi chú |
| 4 | 6, 7.1, 7.2, 7.5 |
|
| 4.6 | 2, 13.1, 13.3 |
|
Đối với các thiết bị được nhà sản xuất dự định sử dụng kép theo Điều 1 (6) của Chỉ thị 93/42 EEC, Bảng ZA.2 sau đây nêu chi tiết các yêu cầu cơ bản liên quan của chỉ thị 89/686 /EEC về thiết bị bảo vệ cá nhân và các điều khoản tương ứng của chúng trong tiêu chuẩn này. Tuy nhiên, Bảng ZA.2 không ngụ ý bất kỳ trích dẫn nào trong OJEU theo chỉ thị PPE và do đó không đưa ra giả định về sự phù hợp đối với chỉ thị PPE.
Bảng ZA.2 - Những yêu cầu cơ bản liên quan từ Chỉ thị 89/686/EEC về thiết bị bảo vệ cá nhân được đề cập đến bởi tiêu chuẩn này
| Điều của tiêu chuẩn EN | Yêu cầu cơ bản của Chỉ thị EU về thiết bị bảo vệ cá nhân | Nhận xét/ghi chú |
| 4.2 | 1.2.1.1 |
|
CẢNH BÁO - Có thể áp dụng các yêu cầu và Chỉ thị EU khác vào (các) sản phẩm không nằm trong phạm vi áp dụng của tiêu chuẩn này.
MỤC LỤC
1 Phạm vi áp dụng
2 Tài liệu viện dẫn
3 Thuật ngữ và định nghĩa
4 Yêu cầu
5 Phương pháp thử nghiệm
5.1 Nội độc tố
6 Báo cáo thử nghiệm
Phụ lục A
Phương pháp xác định protein có thể ngâm chiết trong nước ở găng tay cao su tự nhiên bằng phương pháp Lowry cải tiến
Phụ lục B
Các phương pháp miễn dịch học đo dị nguyên mủ cao su tự nhiên
Phụ lục C
Phân tích amino axit (AAA) bằng phép đo sắc ký dịch áp lực cao (HPLC)
Phụ lục ZA
Sự liên quan giữa tiêu chuẩn này và các yêu cầu cơ bản của Chỉ thị EU 93/42/EEC về thiết bị y tế
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 13415-3:2021 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 13415-3:2021 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 13415-3:2021 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 13415-3:2021 DOC (Bản Word)