- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn TCVN 8424-2:2010 Xác định thuốc BVTV bằng cách chiết trong thực phẩm thực vật
| Số hiệu: | TCVN 8424-2:2010 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Y tế-Sức khỏe , Thực phẩm-Dược phẩm |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
2010 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 8424-2:2010
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 8424-2:2010
TIÊU CHUẨN QUỐC GIA
TCVN 8424-2:2010
EN 12393-2:2008
THỰC PHẨM CÓ NGUỒN GỐC TỪ THỰC VẬT PHƯƠNG PHÁP SẮC KÝ KHÍ XÁC ĐỊNH ĐA DƯ LƯỢNG THUỐC BẢO VỆ THỰC VẬT – PHẦN 2 – PHƯƠNG PHÁP CHIẾT VÀ LÀM SẠCH
Foods of plant origin - Multiresidue methods for the gas chromatographic determination of pesticide residues - Part 2: Methods for extraction and cleanup
Lời nói đầu
TCVN 8424-2:2010 hoàn toàn tương đương với EN 12393-2:2008;
TCVN 8424-2:2010 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC/F13 Phương pháp phân tích và lấy mẫu biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
Bộ TCVN 8424 (EN 12393), Thực phẩm có nguồn gốc từ thực vật - Phương pháp sắc ký khí xác định đa dư lượng thuốc bảo vệ thực vật bao gồm các phần sau:
TCVN 8424-1:2010 (EN 12393-1:2008), Phần 1: Xem xét chung;
TCVN 8424-2:2010 (EN 12393-2:2008), Phần 2: Phương pháp chiết và làm sạch;
TCVN 8424-3:2010 (EN 12393-3:2008), Phần 3: Phương pháp xác định và phép thử khẳng định.
Lời giới thiệu
Tiêu chuẩn này đưa ra một loạt các phương pháp xác định đa dư lượng có giá trị ngang nhau: không có phương pháp nào được coi là phương pháp chính, bởi vì hiện nay các phương pháp này đang tiếp tục được xây dựng. Các phương pháp được chọn trong tiêu chuẩn này đã được xác nhận hiệu lực và/hoặc được sử dụng rộng rãi trên toàn châu Âu.
Vì những phương pháp này có thể áp dụng được cho phạm vi rất rộng các hàng hoá thực phẩm/các hỗn hợp thuốc bảo vệ thực vật, có sử dụng các hệ thống khác nhau để xác định, có các thay đổi về thiết bị, cách chiết, phương pháp làm sạch và các điều kiện sắc ký phù hợp để tăng hiệu năng của phương pháp, xem Điều 3.
THỰC PHẨM CÓ NGUỒN GỐC TỪ THỰC VẬT PHƯƠNG PHÁP SẮC KÝ KHÍ XÁC ĐỊNH ĐA DƯ LƯỢNG THUỐC BẢO VỆ THỰC VẬT – PHẦN 2 – PHƯƠNG PHÁP CHIẾT VÀ LÀM SẠCH
Foods of plant origin - Multiresidue methods for the gas chromatographic determination of pesticide residues - Part 2: Methods for extraction and cleanup
1. Phạm vi áp dụng
Tiêu chuẩn này qui định các phương pháp chiết và làm sạch các mẫu thực phẩm có nguồn gốc từ thực vật để xác định các dư lượng thuốc bảo vệ thực vật.
Đối với mục đích này có thể sử dụng các dung môi khác nhau. Các dư lượng thuốc bảo vệ thực vật này thường lẫn với các hợp chất được chiết cùng mà có thể gây nhiễu đến phép phân tích. Để tinh sạch các chất chiết thô cần phân tích, có thể sử dụng một vài phương pháp.
Tiêu chuẩn này bao gồm các phương pháp chiết và làm sạch sau đây đã qua các nghiên cứu liên phòng thử nghiệm và/hoặc được chấp nhận trong toàn Châu Âu:
- Phương pháp L: Chiết bằng axeton, chiết phân đoạn lỏng-lỏng bằng diclorometan và làm sạch trên cột silica-gel/than [1];
- Phương pháp M: Chiết bằng axeton và chiết phân đoạn lỏng-lỏng bằng diclometan/dầu nhẹ, nếu cần thì làm sạch trên cột Florisil ®1) [2], [3], [4];
- Phương pháp N: Chiết bằng axeton, chiết phân đoạn lỏng-lỏng bằng diclorometan hoặc xyclohexan/etyl axetat và làm sạch bằng thẩm thấu gel và sắc ký silica gel [5], [6];
- Phương pháp P: Chiết bằng etyl axetat, có làm sạch bằng sắc ký thẩm thấu gel, nếu cần [7].
Tiêu chuẩn này qui định chi tiết các phương pháp từ L đến P để chiết và làm sạch các mẫu thực phẩm có nguồn gốc từ thực vật. Một số dung môi có các thể tích khác nhau được dùng để chiết. Các kỹ thuật làm sạch đã được liệt kê như chiết phân đoạn lỏng-lỏng, sắc ký lỏng trên các chất hấp phụ khác nhau và sắc ký thẩm thấu gel.
Bảng cung cấp các cặp chất nền/thuốc bảo vệ thực vật đã được nghiên cứu liên phòng thử nghiệm và danh mục khả năng áp dụng của phương pháp đối với các loại thuốc bảo vệ thực vật khác nhau được đưa ra cho từng phương pháp, khi có thể.
2. Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 8424-1:2010 (EN 12393-2:2008), Thực phẩm có nguồn gốc từ thực vật - Phương pháp sắc ký khí xác định đa dư lượng thuốc bảo vệ thực vật - Phần 1: Xem xét chung.
TCVN 8424-3:2010 (EN 12393-3:2008), Thực phẩm có nguồn gốc từ thực vật - Phương pháp sắc ký khí xác định đa dư lượng thuốc bảo vệ thực vật - Phần 3: Phương pháp xác định và phép thử khẳng định.
3. Nguyên tắc
Như đã nêu trong phần giới thiệu, tùy từng trường hợp cụ thể, có thể thay đổi thiết bị sử dụng, điều kiện chiết, làm sạch và sắc ký để nâng cao hiệu quả của phương pháp. Những điều chỉnh đó phải được lập thành văn bản rõ ràng và được chứng minh cho kết quả hợp lệ.
Các dư lượng thuốc bảo vệ thực vật được chiết ra khỏi mẫu bằng cách sử dụng các dung môi thích hợp, sao cho thu được hiệu quả chiết tối đa các dư lượng thuốc bảo vệ thực vật và giảm thiểu các chất bị chiết cùng mà có thể làm tăng sự gây nhiễu đến phép xác định. Loại bỏ hết mọi chất gây nhiễu ra khỏi dịch chiết mẫu để thu được dung dịch chứa dư lượng thuốc bảo vệ thực vật trong dung môi thích hợp cho việc định lượng bằng phương pháp xác định đã chọn.
4. Yêu cầu chung: Tóm tắt các qui trình
4.1. Chiết
Qui trình chiết được nêu trong Bảng 1.
Bảng 1 - Qui trình chiết
| Phương pháp | Khối lượng mẫu (MS) g | Thể tích dung môi (VS) ml | Tỷ lệ MS/VS g/ml |
| L | 100 | Axeton: 200 | 1/2 |
| M | 100 | Axeton: 200 | 1/2 |
| N | 100 a | Axeton: 200 | 1/2 |
| P | 50 | Etyl axetat: 100 | 1/2 |
| a) Chỉ liên quan nếu hàm lượng nước của chất nền lớn hơn 70 %. | |||
4.2. Làm sạch
4.2.1. Chiết phân đoạn lỏng-lỏng
Các qui trình chiết phân đoạn lỏng-lỏng được nêu trong Bảng 2.
Bảng 2 – Chiết phân đoạn lỏng-lỏng
| Phương pháp | Phần dịch chiết (AE) ml | Thể tích nước được thêm vào (VW) ml | Thể tích dung môi (VS) ml | Tỷ lệ AE/VW |
| L | 50 (= 20 %) | 250 | 50 | 1/5 |
| M | 80 | 0 | 200 | -a |
| N | 200 | xa | 100 | -a |
| a Phụ thuộc vào hàm lượng nước của chất nền. | ||||
Hai kỹ thuật chiết phân đoạn lỏng-lỏng được khuyến nghị:
- có bổ sung nước (các phương pháp L, N);
- không bổ sung nước (phương pháp M).
4.2.2. Cột sắc ký hấp phụ
Các phương pháp: L, M, N với các chất hấp phụ khác nhau: silica gel, than, Florisil®, được sử dụng ở dạng tinh khiết hoặc hỗn hợp.
4.2.3. Sắc ký thẩm thấu gel với BioBeads® S-X 32)
Phương pháp N có kết hợp với phương pháp P, nếu cần.
5. Phương pháp L: Chiết bằng axeton, chiết phân đoạn lỏng-lỏng bằng diclometan và làm sạch trên cột silica gel/than hoạt tính
5.1. Nguyên tắc
Phần mẫu thử được cắt nhỏ rồi đồng hóa trong axeton, sau đó dịch đồng hóa được lọc. Phần dịch lọc được pha loãng với nước rồi được chiết bằng diclometan. Pha hữu cơ được cô đặc, trên cột silica gel và than hoạt tính. Các dư lượng thuốc bảo vệ thực vật được rửa giải bằng hỗn hợp của diclometan, toluen và axeton. Dịch rửa giải được cô đặc để xác định bằng sắc ký khí (GC).
5.2. Thuốc thử
5.2.1. Yêu cầu chung
Sử dụng tất cả các thuốc thử có độ tinh khiết thích hợp để phân tích dư lượng thuốc bảo vệ thực vật và phù hợp với Điều 4 của TCVN 8424-1:2010 (EN 12393-1:2008).
5.2.2. Axeton
5.2.3. Diclometan
5.2.4. n-Hexan
5.2.5. Toluen
5.2.6. Hỗn hợp rửa giải: diclometan/toluen/axeton, với tỷ lệ 5 : 1 : 1 (tính theo thể tích)
5.2.7. Dung dịch natri clorua, bão hòa
5.2.8. Natri sulfat
Được nung ở 500 oC trong ít nhất 4 h, để nguội và bảo quản trong chai có nắp đậy kín.
5.2.9. Than hoạt tính
5.2.10. Silica gel 60 dùng cho cột sắc ký, cỡ hạt từ 63 µm đến 200 µm (70 mesh đến 230 mesh)
5.2.11. Celite ® 5453) (tùy chọn)
5.3. Thiết bị, dụng cụ
Sử dụng các thiết bị, dụng cụ của phòng thử nghiệm trong TCVN 8424-1:2010 (EN 12393-1:2008) và cụ thể các thiết bị, dụng cụ sau:
5.3.1. Máy trộn tốc độ cao hoặc máy đồng hóa, có cốc trộn thích hợp
5.3.2. Bộ làm bay hơi dung môi, có nồi cách thủy, khả năng duy trì được nhiệt độ ở 40 oC
5.3.3. Cột sắc ký, có đĩa thủy tinh xốp và van khóa bằng polytetrafluoroethylene (PTFE), đường kính trong 25 mm, dài 400 mm.
5.4. Cách tiến hành
5.4.1. Chuẩn bị mẫu
Cắt mẫu thành các miếng nhỏ và trộn kỹ.
5.4.2. Chiết
Cân 100 g mẫu đã nghiền thô vào cốc có mỏ 1 lít, thêm 200 ml axeton và đồng hóa trong khoảng 30 s. Có thể sử dụng Celite ® 545 để hỗ trợ cho việc lọc, nếu cần. Tráng bộ đồng hóa bằng 50 ml axeton và dùng để tráng luôn cốc có mỏ và sau đó tráng phễu Buchner. Lọc dịch đã đồng hóa bằng cách hút qua giấy lọc đã làm ẩm đựng trong phễu Buchner. Rửa sạch miếng giấy lọc bằng 50 ml axeton mà trước đó đã dùng để rửa.
Lắc kỹ dịch lọc và đo thể tích phần dịch lọc này. Lấy chính xác một phần năm phần dịch lọc này và lắc mạnh ít nhất trong 2 min với 250 ml nước, 25 ml dung dịch natri clorua (5.2.7) và 50 ml diclometan trong phễu chiết 1 lít. Nếu phần dịch lọc không được lắc kỹ, thì độ thu hồi có thể bị giảm đáng kể. Lặp lại việc chiết này dùng 50 ml diclometan. Gộp các pha chiết diclometan và làm khô bằng 30 g natri sulfat (5.2.8) trong 30 min. Lọc chất chiết đã làm khô qua giấy lọc. Tráng bình và giấy lọc ba lần mỗi lần dùng 30 ml diclometan. Làm bay hơi dịch lọc đến khoảng 2 ml và xoay bình bằng tay để loại bỏ hết dung môi. Hòa tan phần còn lại trong 10 ml diclometan.
5.4.3. Chuẩn bị cột
Cho diclometan vào cột sắc ký (5.3.3) đến một lớp dày 1 cm. Làm nhão 5 g silica gel (5.2.10) trong 15 ml hỗn hợp rửa giải (5.2.6) và rót hỗn hợp nhão này lên cột. Gạn lớp nổi phía trên. Tiếp theo, trộn kỹ 15 g silica gel và 1 g than hoạt tính trong cốc có mỏ 50 ml và thêm từ từ 35 ml hỗn hợp rửa giải (Cẩn thận: Có phát nhiệt). Không thêm quá 35 ml hỗn hợp rửa giải, nếu không thì huyền phù sẽ bị tách pha và các thành phần chính sẽ khó đi qua cột.
Cho hỗn hợp gel silica-than đã hoạt hóa vào silica gel trong cột sắc ký, bằng cách rót qua phễu, lần đầu tiên rót từ từ, sau đó rót mạnh, đồng thời khuấy liên tục và mở khóa van. Sử dụng hết dịch rửa giải đã đi qua cột để tráng bình. Rút hỗn hợp rửa giải đến mức còn 2 cm cách phía trên vật liệu nhồi và cho lên đỉnh cột từng lượng nhỏ natri sulfat cho đến tổng số 5 g. Tiếp theo tráng cột sơ bộ bằng 50 ml hỗn hợp rửa giải.
5.4.4. Làm sạch
Chuyển lượng dung dịch diclometan thu được từ 5.4 2 sang cột đã chuẩn bị, cuối cùng chuyển tổng số là 5 ml diclometan. Thu lấy chất lỏng đã chảy qua cột và sau đó rửa giải trong bình cầu đáy tròn 250 ml. Rửa giải cột với 140 ml hỗn hợp rửa giải (5.2.6). Làm bay hơi các dịch rửa giải thu được đến khoảng 30 ml. Chuyển vào bình cầu đáy tròn 50 ml và cho bay hơi lại đến khoảng 2 ml. Trước đó làm rỗng bộ phận thu nhận của bộ cô quay. Không làm bay hơi dung dịch đến khô trên bộ cô quay. Chuyển dung dịch sang ống nghiệm chia độ và pha loãng bằng n-hexan đến 5,0 ml.
5.5. Sắc ký khí
Sử dụng hệ thống sắc ký khi thích hợp để xác định các dư lượng thuốc bảo vệ thực vật nhóm halogen hữu cơ, phospho hữu cơ và nitơ hữu cơ.
5.6. Các nghiên cứu cộng tác
Các cặp chất nền và dư lượng thuốc bảo vệ thực vật đã qua nghiên cứu cộng tác 4) như trong Bảng 3.
Bảng 3 - Chất nền và thuốc bảo vệ thực vật
|
| cà rốt | khoai tây | bắp cải savoa | rau chân vịt | cà chua | đậu vàng |
| bromophos | + | + |
|
| + |
|
| bromopropylate |
|
|
| + | + |
|
| captan |
|
|
|
| + |
|
| chlorpropham |
| + |
|
|
|
|
| chlorpyrifos |
|
|
| + | + |
|
| cypermethrin |
|
|
| + |
|
|
| 0. p’-DDE | + |
|
|
|
|
|
| p, p'-DDE | + |
|
| + |
|
|
| 0. p'-DDT | + |
|
|
|
|
|
| p, p'-DDT | + |
|
|
| + |
|
| diazinon | + |
| + |
|
| + |
| dichlofluanid | + |
|
|
|
|
|
| dicofol |
|
|
| + | + |
|
| dieldrin | + | + | + | + | + | + |
| a-endosulfan |
|
|
|
| + |
|
| b-endosulfan |
|
|
| + | + |
|
| sulfate endosulfan |
|
|
| + | + |
|
| endrin |
|
|
|
| + |
|
| ethion |
|
|
|
| + |
|
| fenarimol |
|
|
| + |
|
|
| fenitrothion | + |
| + |
|
|
|
| fenpropathrin |
|
|
| + |
|
|
| folpet |
|
|
| + |
|
|
| a-HCH |
|
|
|
| + |
|
| heptachlor epoxit | + |
| + |
|
|
|
| iprodione |
|
|
| + |
|
|
| Lindane (y-HCH) | + | + | + | + | + | + |
| malathion |
|
|
| + |
| + |
| mecarbam |
|
|
| + |
|
|
| parathion | + |
| + | + | + |
|
| permethrin |
|
|
| + |
|
|
| phosalone | + |
|
| + |
| + |
| pirimiphos-metyl |
| + |
| + | + | + |
| procymidone |
|
|
|
| + |
|
| propham |
| + |
|
|
|
|
| quintozene |
|
|
| + |
| + |
| tetradifon |
|
|
|
| + |
|
| tolclofos-metyl |
|
|
| + |
|
|
| vinclozoline | + | + |
| + | + |
|
5.7. Khả năng áp dụng
Các loại thuốc bảo vệ thực vật sau đây có thể phân tích được bằng phương pháp này:
| Aldrin | Dieldrin | Metribuzin |
| Ametryn | Dimethachlor | Mevinphos |
| Atrazine | Dimethoate | Naled |
| Azinphos-etyl | Dioxathion | Nitrofen |
| Azinphos-metyl | Disulfoton | Paraoxon |
| Aziprotryne | Ditalimfos | Parathion |
| Bifenthrin |
| Metyl parathion |
| Bromacil |
| Pendimethalin |
| Bromophos | Endosulfan sulfate | Permethrin |
| Bromophos-etyl | Ethion | Perthane |
| Bromopropylate | Ethoprophos | Phenkapton |
| Bupirimate | Etrimfos | Phorate |
| Captafol | Fenamiphos | Phosalone |
| Captan | Fenarimol | Pirimiphos-metyl |
| Carbophenothion | Fenchlorphos | Procymidone |
| Chlorbenside | Fenitrothion | Profenofos |
| Chlorfenson | Fenpropathrin | Profluralin |
| Chlorfenvinphos | Fenson | Prometryn |
| Chlorflurenol | Fensulfothion | Propazine |
| Chlorpropham | Fenthion | Propham |
| Chlorobenzilate | Fenvalerate | Propyzamide |
| Chloropropylate | Fluchloralin | Prothiofos |
| Chlorpyrifos | Flucythrinate | Pyrazophos |
| Chlorpyrifos-metyl | Fluorodifen | Pyrethrins |
| Chlorthal | Fluvalinate | Quinalphos |
| Chlorthiophos | Folpet | Quintozene |
| Cyanazine | Fonofos | Simazine |
| Cyanofenphos | Formothion | Sulfotep |
| Cyanophos | a-HCH | Tecnazene |
| Cyfluthrin | b-HCH | Terbacil |
| l-Cyhalothrin | Heptachlor | Terbufos |
| Cypermethrin | Heptachlor epoxit | Terbutryn |
| p,p'-DDD | Heptenophos | Tetrachlorvinphos |
| o,p'-DDE | lodofenphos | Tetradifon |
| p,p'-DDE | Iprodione | Tetramethrin |
| o,p'-DDT | Isofenphos | Tetrasul |
| p,p'-DDT | Lindane | Thionazin |
| Deltamethrin | Malaoxon | Tolclofos-metyl |
| Desmetryn | Malathion | Tolylfluanid |
| Dialifos | Mecarbam | Triadimefon |
| Diazinon | Metalaxyl | Tri-allate |
| Dichlobenil | Metazachlor | Triazophos |
| Oichlofenthion | Methidathion | Trichloronat |
| Dichlofluanid | Methoprotryne | Trifluralin |
| Dichlorvos | Methoxychlor | Vinclozolin |
| Dicofol | Metolachlor |
|
Phương pháp này đã được thử nghiệm trên các loại cây trồng và các loại thực phẩm sau:
| Táo | Nho | Dứa |
| Mơ | Bắp cải | Mận |
| Cà tím | Mật ong | Khoai tây |
| Đậu | Cải củ | Củ cải (lớn và loại nhỏ) |
| Cà rốt | Tỏi tây | Bắp cải đỏ |
| Cần củ | Rau diếp | Bắp cải Xavoa |
| Anh đào | Quýt | Rau chân vịt |
| Ớt | Nấm | Dâu |
| Cải bắp Trung quốc | Cam | Ớt ngọt |
| Salad ngô | Mùi tây | Cà chua |
| Dưa chuột | Đào | Rau xà lách |
| Cây bồ công anh | Lê |
|
| Rau diếp quăn | Đậu Hà lan |
|
6. Phương pháp M: Chiết bằng axeton và chiết phân đoạn lỏng-lỏng bằng diclometan/dầu nhẹ, làm sạch trên Florisil®, nếu cần
6.1. Nguyên tắc
Phần mẫu thử được cắt nhỏ rồi đồng hóa trong axeton và phần mẫu đồng nhất được lọc. Lấy một phần dịch lọc chiết với hỗn hợp dầu nhẹ, diclometan và sau đó chiết bằng diclometan. Pha hữu cơ có thể được bơm trực tiếp vào máy sắc ký khí có detector thích hợp mà không cần phải làm sạch hoặc tinh sạch trên một cột Florisil ®. Dịch rửa giải được cô đặc để kiểm tra bằng sắc ký khí.
6.2. Thuốc thử
6.2.1. Yêu cầu chung
Sử dụng tất cả các thuốc thử có độ tinh khiết thích hợp để phân tích dư lượng thuốc bảo vệ thực vật và phù hợp với Điều 4 của TCVN 8424-1:2010 (EN 12393-1:2008).
6.2.2. Axeton
6.2.3. Dầu nhẹ, có nhiệt độ sôi trong khoảng từ 40 oC đến 60 oC
6.2.4. Natri clorua
Được nung ở 500 oC trong ít nhất 4 h, để nguội rồi bảo quản trong chai có nắp đậy kín.
6.2.5. Diclometan
6.2.6. Acetonitril
6.2.7. Natri sulfat
Được nung ở 500 oC trong ít nhất 4 h, để nguội rồi bảo quản trong chai có nắp đậy kín.
6.2.8. Florisil ® (Floridin hoặc tương đương), cỡ hạt từ 150 µm đến 250 µm (60 mesh đến 100 mesh)
Được hoạt hóa bằng cách gia nhiệt ở 130 oC đến 135 oC ít nhất 5 h, để nguội trong bình hút ẩm và chuyển sang bình có nắp đậy kín khí. Chất hấp phụ được xử lý này giữ được hoạt tính của nó chỉ trong 4 ngày. Có thể phải được tái hoạt hóa bằng cách xử lý tương tự. Hoạt độ của chất hấp phụ cần được kiểm tra thường xuyên bằng cách rửa giải các chất chuẩn thuốc bảo vệ thực vật như mô tả trong phương pháp này.
6.2.9. Dietyl ete, không chứa peroxit, có chứa 2 % etanol (phần thể tích)
6.2.10. Dung dịch rửa giải A: ete dietyl/dầu nhẹ với tỷ lệ 6 : 94 (tính theo thể tích)
6.2.11. Dung dịch rửa giải B: ete dietyl/dầu nhẹ với tỷ lệ 15 : 85 (tính theo thể tích)
6.2.12. Dung dịch rửa giải C: ete dietyl/dầu nhẹ với tỷ lệ 50 : 50 (tính theo thể tích)
6.2.13. Dung dịch rửa giải D: diclometan/dầu nhẹ với tỷ lệ 20 : 80 (tính theo thể tích)
6.2.14. Dung dịch rửa giải E: diclometan/dầu nhẹ/acetonitril với tỷ lệ 50 : 49,65 : 0,35 (tính theo thể tích)
6.2.15. Dung dịch rửa giải F: diclometan/dầu nhẹ/acetonitril với tỷ lệ 50 : 48,5 : 1,5 (tính theo thể tích)
6.3 Thiết bị, dụng cụ
Sử dụng thiết bị, dụng cụ của phòng thử nghiệm như trong TCVN 8424-1:2010 (EN 12393-1:2008) và cụ thể như sau:
6.3.1. Máy trộn tốc độ cao hoặc máy đồng hóa, có cốc trộn phù hợp.
6.3.2. Cột sắc ký, có van khóa bằng PTFE, đường kính trong 22 mm, dài 300 mm.
6.3.3. Bộ làm bay hơi dung môi, Kuderna Danish hoặc loại tương đương.
6.4. Cách tiến hành
6.4.1. Chuẩn bị mẫu
Phần mẫu thử được cắt nhỏ và trộn kỹ để thu được phần mẫu thử đồng nhất.
Nếu hàm lượng nước của mẫu nhỏ hơn 30 %, thì chỉnh đến khoảng 80 % bằng cách thêm nước
6.4.2. Chiết và chiết phân đoạn
Cân 100 g (m) mẫu đã được chuẩn bị vào cốc trộn (6.3.1) và thêm 200 ml axeton. Trộn ở tốc độ cao trong 3 min. Chuyển hỗn hợp vào phễu Buchner có chứa giấy lọc đã được làm ẩm bằng axeton lọc vào bình Buchner và đo thể tích dịch lọc.
Rót 80 ml dịch lọc vào phễu chiết 1 lít với 100 ml diclometan và 100 ml dầu nhẹ (6.2.3). Lắc 3 min và để cho tách lớp. Chuyển pha nước phía dưới sang phễu chiết 1 lít thứ hai. Làm khô lớp hữu cơ phía trên trong phễu chiết thứ nhất bằng cách cho đi qua lớp natri sulfat (6.2.7) dày 3 cm để trên bông thủy tinh đã được rửa dày 10 cm trong phễu thu nhận trong bình cầu đáy tròn.
Cho 7 g natri clorua vào pha nước và lắc 30 s cho đến khi natri clorua (6.2.4) hòa tan. Thêm 100 ml diclometan và lắc trong 3 min. Để cho tách lớp. Chuyển pha nước sang phễu chiết thứ ba và làm khô lại pha hữu cơ trên cùng loại natri sulfat. Cho vào phễu chiết thứ ba này 100 ml diclometan và lắc 3 min, để cho tách pha rồi loại bỏ pha nước và làm khô pha diclometan trên cùng lớp natri sulfat. Rửa natri sulfat bằng 50 ml diclometan và cô đặc tất cả các pha hữu cơ đến 2 ml. Thêm 100 ml dầu nhẹ, cô đặc lại đến 2 ml và lặp lại cho đến khi hết hẳn diclometan. Thêm 20 ml axeton và cô đặc lại đến 2 ml (Vfinal). Phần cô đặc này có thể được bơm trực tiếp vào máy sắc ký khí được trang bị HECD (Hall detector), NPD hoặc FPD (phương pháp M).
Trong một số trường hợp, nên có bước làm sạch khi xác định bằng ECD: phương pháp M1 hoặc M2. Để tinh sạch, cần cô đặc dịch chiết mẫu đến 1 ml bằng axeton (thay vì 2 ml) và được pha loãng bằng dầu nhẹ đến 10 ml.
6.4.3. Làm sạch
6.4.3.1. Phương pháp M1
Đặt một nút sợi bông vào đáy cột sắc ký (6.3.2) và rót dầu nhẹ (6.2.3) đến 20 cm. Đổ 20 g Florisil® (6.2 8) và gõ thành cột để nén chất hấp phụ. Phủ lên lớp trên cùng của chất hấp phụ một lớp natri sulfat (6.2.7) dày khoảng từ 1 cm đến 2 cm. Rửa chất hấp phụ bằng khoảng 30 ml dầu nhẹ. Đặt bình làm bay hơi dưới cột đề thu lấy dịch rửa giải. Chuyển dịch chiết để tinh sạch như mô tả trong 6.4.2, sang cột, với tốc độ không quá 5 ml/min. Tráng rửa vật chứa hai lần, mỗi lần dùng 5 ml dầu nhẹ, cho nước rửa vào cột, rửa sạch thành cột sắc ký với các lượng nhỏ của dầu nhẹ vá rửa giải với tốc độ 5 ml/min bằng 200 ml dung môi rửa giải A (6.2.10).
Rửa giải tiếp với 200 ml dung môi rửa giải B (6.2.11) vào một bình nhận riêng rẽ và với 200 ml dung môi rửa giải C (6.2.12). Cô đặc từng dịch rửa giải thu được đến một thể tích thích hợp (Vfinal) để kiểm tra bằng GC.
6.4.3.2. Phương pháp M2
Đặt một nút sợi bông vào đáy cột sắc ký (6.3.2) và rót dầu nhẹ (6.2.3) đến 20 cm. Đổ 20 g của Florisil® (6.2.8) và gõ thành cột để nén chất hấp phụ. Phủ lên lớp trên cùng của chất hấp phụ một lớp natri sulfat (6.2.7) dày khoảng từ 1 cm đến 2 cm.
Rửa chất hấp phụ bằng khoảng 30 ml dầu nhẹ. Đặt bình làm bay hơi dưới cột để thu lấy dịch rửa giải. Chuyển dịch chiết sang cột để tinh sạch như mô tả trong 6.4.2 , với tốc độ không quá 5 ml/min. Tráng vật chứa hai lần, mỗi lần dùng 5 ml dầu nhẹ, cho nước tráng vào cột, tráng sạch thành cột sắc ký với các lượng nhỏ của dầu nhẹ và rửa giải với tốc độ 5 ml/min bằng 200 ml dung môi rửa giải D (6.2.13)
Rửa giải tiếp bằng 200 ml dung môi rửa giải E (6.2.14) vào một bình nhận riêng rẽ và cuối cùng với 200 ml dung môi rửa giải F (6.2.15). Cô đặc từng dịch rửa giải để thu được thể tích thích hợp (Vfinal) để dùng cho GC.
6.5. Sắc ký khí và tính toán
Sử dụng hệ thống sắc ký khí thích hợp để xác định dư lượng thuốc bảo vệ thực vật nhóm halogen hữu cơ, phospho hữu cơ và nitơ hữu cơ.
Khối lượng tương đương của mẫu tính bằng milligam trên microlit dịch chiết cuối cùng được tính theo công thức (1):
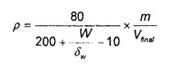
Trong đó:
p là đương lượng mẫu tính bằng milligam trên microlit (mg/µm);
m là khối lượng phần mẫu thử, tính bằng gam (g) (trong trường hợp này: 100 g);
w là lượng nước có trong mẫu, tính bằng gam (g);
là tỷ trọng của nước, milligam trên microlit (mg/µl);
Vfinal là thể tích dung dịch chiết cuối cùng, tính bằng mililit (ml);
10 ml là thể tích cô đặc.
Thể tích cô đặc được lấy là 10 ml đối với các mẫu có chứa 80 g/100 g đến 95 g/100 g nước khi dùng 200 ml axeton để chiết. Tham khảo các tài liệu tham khảo về hàm lượng nước trung bình của thành phần thực phẩm. Ví dụ về hàm lượng nước trung bình đối với một số cây trồng và rau được nêu trong Bảng A.1. Hàm lượng nước của phần lớn các loại rau quả tươi được giả định khoảng 85 g/100 g
CHÚ THÍCH : Lượng mẫu trong dịch chiết cuối cùng đối với việc làm sạch bằng Florisil® hoặc sắc ký có tính chính xác được bằng cách đo tổng thể tích của dịch chiết bằng axeton ban đầu.
7. Phương pháp N: Chiết bằng axeton, chiết phân đoạn lỏng-lỏng bằng diclometan hoặc xyclohexan/etyl axetat, làm sạch bằng thẩm thấu gel và sắc ký gel silica
7.1. Nguyên tắc
Phần mẫu thử được cắt nhỏ rồi đồng hóa trong axeton sau khi bổ sung nước, tùy thuộc vào hàm lượng nước tự nhiên của mẫu để đảm bảo tỷ lệ của axeton và nước là 2 : 1 (tính theo thể tích). Dịch đã đồng hóa được lọc. Phần dịch đã lọc được bão hòa với natri clorua rồi được pha loãng bằng diclometan, làm tách phần nước dư. Cách khác, bổ sung natri clorua và hỗn hợp của etyl axetat xyclohexan vào dịch đã đồng hóa và lắc trộn mạnh hỗn hợp.
Pha hữu cơ được cô đặc và làm sạch bằng sắc ký thẩm thấu gel (GPC) trên BioBeads S-X3® (gel polystyren) sử dụng hỗn hợp của etyl axetat và xyclohexan làm chất rửa giải. Các phần có chứa dư lượng cô đặc và được phân tích trực tiếp bằng sắc ký khi sử dụng detector chọn lọc nitơ hoặc phospho. Đối với các phép phân tích sử dụng detector bắt giữ electron và trong một số trường hợp của detector chọn lọc nitơ có thể cần phải làm sạch thêm trên cột silica gel nhỏ. Trong bước làm sạch này, các loại thuốc bảo vệ thực vật được chiết trong vài phân đoạn, do đó cung cấp thêm thông tin cho việc nhận dạng.
7.2. Thuốc thử
7.2.1. Yêu cầu chung
Sử dụng tất cả các thuốc thử có độ tinh khiết thích hợp để phân tích dư lượng thuốc bảo vệ thực vật và phù hợp với Điều 4 của TCVN 8424-1:2010 (EN 12393-1:2008).
7.2.2. Axeton
7.2.3. Diclometan
7.2.4. Etyl axetat
7.2.5. Xyclohexan
7.2.6. Hỗn hợp rửa giải GPC: xyclohexan/etyl axetat với tỷ lệ 1 : 1 (tính theo thể tích)
7.2.7. n-Hexan
7.2.8. Isooctan
7.2.9. Toluen
7.2.10. Nước, được chưng cất bằng dụng cụ thủy tinh
7.2.11. Chất rửa giải 1: n-hexan/toluen với tỷ lệ 65 : 35 (tính theo thể tích)
7.2.12. Chất rửa giải 2: toluen
7.2.13. Chất rửa giải 3: toluen/axeton với tỷ lệ 95 : 5 (tính theo thể tích)
7.2.14. Chất rửa giải 4: toluen/axeton với tỷ lệ 80 : 20 (tính theo thể tích)
7.2.15. Chất rửa giải 5: axeton
7.2.16. Natri clorua
Nung ở nhiệt độ 500 oC ít nhất 4 h, để nguội và bảo quản trong chai có nắp đậy kín.
7.2.17. Natri sulfat, dạng bột
Nung ở nhiệt độ 500 oC ít nhất 4 h, để nguội và bảo quản trong chai có nắp đậy kín.
7.2.18.Hỗn hợp muối: natri sulfat/natri clorua: với tỷ lệ 1 : 1 (tính theo khối lượng)
7.2.19. Celite® 545
7.2.20. Silica gel 60 đối với cột sắc ký, cỡ hạt từ 63 µm đến 200 µm (70 mesh đến 230 mesh), đã khử hoạt tính bằng 1,5 % nước.
Làm nóng silica gel ít nhất 5 h ở 130 oC, để nguội trong bình hút ẩm và bảo quản trong vật chứa có nắp đậy kín để trong bình hút ẩm. Cho 1,5 ml nước chảy từng giọt từ buret vào 98,5 g silica gel khô đựng trong bình nón 300 ml (có khớp nối mài), trong khi xoay bình liên tục. Đậy ngay nắp bình bằng nút mài rồi lắc mạnh trong 5 min cho đến khi hết các mảng vón cục, sau đó cho lắc tiếp 2 h trên máy lắc cơ và bảo quản trong vật chứa có nắp đậy kín.
7.2.21. Bông thủy tinh, đã được chiết kỹ bằng axeton
7.2.22. Bông vải sợi, đã được chiết kỹ với axeton
7.2.23. BioBeads S-X3 ®, 38 µm đến 75 µm (200 mesh đến 400 mesh)
7.2.24. Giấy lọc, đường kính 6 cm và 13,5 cm, tốc độ lọc nhanh, đã được chiết kỹ bằng axeton
7.3 Thiết bị, dụng cụ
Sử dụng thiết bị, dụng cụ của phòng thử nghiệm như trong TCVN 8424-1:2010 (EN 12393-1:2008) và cụ thể như sau:
7.3.1. Máy trộn tốc độ cao hoặc máy đồng hóa, có cốc trộn thích hợp.
7.3.2. Bộ làm bay hơi dung môi, có nồi cách thủy
7.3.3. Dụng cụ dùng cho GPC, ví dụ GPC Autoprep 1001 hoặc 1002 ®5), được trang bị cột sắc ký, đường kính trong 25 mm, 50 cm, và hai mươi ba vòng mẫu 5 ml; cột được nhồi 50 g resin BioBeads S-X3 ®, đã được làm trương nở qua đêm trong hỗn hợp rửa giải GPC, cột cao khoảng 32 cm, đã được nhồi như trong 7.4.3 2.
7.3.4. Cột sắc ký, có đầu thoát được mở rộng, đường kính trong 7 mm, dài 230 mm
7.4. Cách tiến hành
7.4.1. Chiết
7.4.1.1. Yêu cầu chung
Hàm lượng nước trung bình của một số cây trồng và các loại thực phẩm được nêu trong Phụ lục A.
7.4.1.2. Nguyên liệu thực vật và các thực phẩm khác có hàm lượng nước trên 70 g/100 g
Dùng máy trộn (7.3.1) đồng hóa 100 g (m) phần mẫu đã xay có hàm lượng nước là x g/100 g với (100 - x) g nước và 200 ml axeton trong 3 min.
7.4.1.3. Nguyên liệu thực vật có hàm lượng nước thấp
Cân từ 10 g đến 50 g (m) chất nền khô hoặc sấy khô có hàm lượng nước là x g/100 g (ví dụ từ 25 g đến 50 g đối với rau quả khô; từ 10 g đến 20 g đối với gia vị và chè; 50 g đối với hạt ngũ cốc). Sau đó cho thêm đủ nước để điều chỉnh tổng lượng nước có mặt đến 100 g. Lượng nước (W) được thêm vào được tính từ công thức w = 100 - (m x x)/100. Trộn rồi để yên khoảng từ 10 min đến 20 min. Sau đó tiếp thêm 200 ml axeton và đồng hóa trong 3 min.
7.4.2. Chiết phân đoạn
7.4.2.1. Chiết phân đoạn bằng diclometan
Thêm 10 g Celite ® 545 và đồng hóa lại trong 10 s
Lọc dịch đã đồng hóa thu được trong 7.4.1.2 hoăc 7.4.1.3 qua giấy lọc nhanh (7.2 24) trong phễu Buchner, có hút chân không nhẹ, cho đến khi thu được nhiều hơn 200 ml dịch lọc.
Để tránh thất thoát dung môi do chân không mạnh, thì nên sử dụng chân không thấp. Không để bánh lọc hút khô.
Đong lấy 200 ml dịch lọc (VR1) trong ống đong và chuyển sang phễu chiết 500 ml. Thêm 20 g natri clorua (7.2.16) và lắc mạnh trong 3 min. Tiếp theo thêm 100 ml diclometan, lắc trong 2 min, sau đó để yên trong khoảng 10 min để cho tách pha. Loại bỏ pha nước phía dưới. Thu lấy pha hữu cơ cho vào bình cầu và thêm khoảng 25 g natri sulfat (7.2.17), để yên trong khoảng 30 min, thường xuyên xoay bình, rồi sau đó lọc qua một nút bông vải (7.2.22) có lớp natri sulfat dày 3 cm để trong phễu. Thu lấy phần dịch lọc cho vào bình cầu 500 ml đáy tròn và tráng phễu chiết cùng với bộ lọc hai lần mỗi lần dùng 20 ml etyl axetat. Cô đặc dung dịch đến 2 ml trên bộ có quay (7.3.2). Loại hết các vết dung môi cuối cùng bằng dòng nitơ nhẹ.
7.4.2.2. Chiết phân đoạn bằng xyclohexan/etyl axetat
Thêm 35 g natri clorua (7.2.16) và chính xác 100 ml hỗn hợp rửa giải GPC (7.2.6) vào dịch đã đồng hóa thu được trong 7.4.1.2 hoặc 7.4.1.3 và đồng hóa lại trong 1 min. Khi có tách pha rõ, thu lấy pha hữu cơ phía trên. Trường hợp tách pha chưa đầy đủ hoặc bị trì hoãn (hơn 30 min) thì cho ly tâm hỗn hợp. Đong chính xác 200 ml (VR1) pha hữu cơ vào ổng đóng chia độ và lọc lượng nảy qua nút bông vải (7.2.22) cùng với khoảng 100 g sulfat natri (7.2.17) trong phễu. Thu lấy phần dịch lọc vào bình cầu đáy tròn 500 ml, tráng ống đong chia độ và phễu chiết bốn lần mỗi lần khoảng 20 ml hỗn hợp rửa giải GPC. Cô đặc hỗn hợp dịch lọc (không để khô) sử dụng bộ cô quay (7.3.2).
7.4.3. Làm sạch bằng sắc ký thẩm thấu gel
7.4.3.1. Yêu cầu chung
Trong trường hợp chiết không dùng GPC cũng đủ sạch để có được sắc phổ không bị nhiễu đáng kể đến chất nền thi có thể bỏ qua bước làm sạch bằng GPC. Tuy nhiên, các dữ liệu xác nhận theo 7.7 và 7.8. đã thu được với GPC. Các kiểu loại và kích thước khác của cột GPC được mô tả trong 7.3.3 có thể được sử dụng nếu các điều kiện tương ứng phù hợp và nếu cho kết quả tương đương.
7.4.3.2. Cột nhồi thẩm thấu gel
Để BioBeads® (khoảng 50 g) trương nở qua đêm trong hỗn hợp rửa giải GPC (7.2 6). Sau đó rót tất cả huyền phù cùng một lúc vào cột (dung tích khoảng 180 ml). Ngay sau khi lớp nền gel đã ổn định (không có bọt khí) đến mức xấp xỉ 32 cm, thì chèn pittông, hạ thấp xuống đến mức nền và xoay vào vị trí. Nếu lớp nền gel bị lún xuống mức thấp hơn sau khi thao tác kéo dài, thì phải chỉnh pittông cho phù hợp (theo hướng dẫn của nhà sản xuất).
7.4.3.3. Kiểm tra thể tích rửa giải
Đối với mỗi cột thẩm thấu gel trước khi sử dụng lần đầu, cần phải kiểm tra các điều kiện rửa giải trên vài hợp chất có khoảng thể tích rửa giải thấp hơn và cao hơn (xem Bảng 4) và trên các dịch chiết thô thích hợp. Để thực hiện điều này, nạp đầy các vòng mẫu bằng dịch chiết thô hoặc hỗn hợp các dung dịch chuẩn, rửa giải theo mô tả trong 7.4.3.4 và xác định bằng phương pháp phân tích thích hợp cho dù các hợp chất được thêm vào đã được thu hồi hoàn toàn hoặc các chất gây nhiễu sinh ra do các tạp chất chưa được tách. Tương tự, phải kiểm tra các cột sau khi đã qua thời gian sử dụng dài.
CHÚ THÍCH: Thực tế cho thấy rằng, một số các chất nền có thể cho thấy hiệu quả hấp phụ ngẫu nhiên của một số chất phân tích nhất định trên resin BioBeads® và có thể cho các kết quả âm tính giả hoặc dương tính giả.
7.4.3.4. Làm sạch dịch chiết thô
Thêm chính xác 7,5 ml etyl axetat vào phần dịch chiết thô cô đặc thu được trong 7.4.2.1 hoặc 7 4.2.2 và hòa tan bằng cách xoay nhẹ. Thêm khoảng 5 g hỗn hợp muối (7.2.18) để hút hết phần nước còn lại, xoay bình lần nữa và thêm chính xác 7,5 ml xyclohexan để có tổng thể tích là 15,0 ml (VR2). Lắc khoảng 20 s, để cho hỗn hợp muối lắng xuống, lọc qua giấy lọc nhanh và bơm dịch lọc này vào một vòng mẫu của sắc ký thẩm thấu gel (VR3).
Rửa giải cột thẩm thấu gel bằng hỗn hợp rửa giải GPC với tốc độ dòng 5,0 ml/min. Bộ phận chuyển mạch của máy sắc ký thẩm thấu gel được điều chỉnh để kiểm tra thể tích dịch rửa giải. Việc cài đặt này phụ thuộc vào các thuốc bảo vệ thực vật mục tiêu. Việc cài đặt điển hình như sau (xem thêm Bảng 4):
- chế độ thải (dump) chuyển sang 18 min để loại bỏ 90 ml,
- chế độ thu nhận chuyển sang 15 min để thu được 75 ml;
- chế độ rửa chuyển sang 2 min để tráng cột dùng 10 ml.
Cô đặc thể tích thu được đến khoảng 1 ml trên bộ cô quay (quay chậm, chỉ ngâm nhẹ bình cầu), dùng pipet cho lượng này vào ống nghiệm chia độ được đậy bằng nút mài, tráng bộ cô quay bằng etyl axetat và pha loãng bằng etyl axetat đến 5,0 ml (VR4). Việc bổ sung etyl axetat này không được bỏ qua để đảm bảo hòa tan hoàn toàn dư lượng.
Để xác định các dư lượng thuốc bảo vệ thực vật riêng rẽ, thì có thể cài đặt dụng cụ để thu được một lượng nhỏ hơn, phù hợp với hợp chất tương ứng theo các giá trị nêu trong Bảng 4
7.4.4. Sắc ký trên cột nhỏ silica gel
7.4.4.1. Chuẩn bị cột
Nhồi cột sắc ký (7.3.4) theo thứ tự sau: nút bông thủy tinh (7.2 21), 1,0 g của silica gel đã khử hoạt tính (7.2.20), lớp natri sulfat (7.2.17) dày từ 5 mm đến 10 mm, nút bông thủy tinh. Trước khi sử dụng, tráng cột bằng 5 ml n-hexan và loại bỏ dịch rửa giải. Ngay sau khi n-hexan đã rút khỏi đỉnh lớp silica gel, cho dung dịch mẫu lên đỉnh cột, phù hợp với 7.4.4.3.
7.4.4.2. Kiểm tra hiệu quả chiết của silica gel
Cho lên cột đã được rửa sơ bộ trong 7.4.4.1 như sau: 1,0 ml dung dịch chứa 0,05 μg/ml HCB, 0,10 μg /ml lindan, 0,20 μg /ml heptaclo epoxit, 0,25 μg/ml α-endosulfan, 0,25 μg /ml dieldrin và 1,25 μg/ml endosulfan sulfat trong n-hexan. Với điều kiện là hoạt tính của silica gel được điều chỉnh đúng, các hợp chất được bổ sung có mặt sau khi rửa giải như trong 7.4.4.3 và phép phân tích sắc ký khí bắt giữ electron trong các phân đoạn sau đây:
- dịch rửa giải 1: HCB (100 %), lindan (100 %), heptaclo epoxit (một phần), α -endosulfan (một phần);
- dịch rửa giải 2: Heptaclo epoxit (lượng còn lại), α -endosulfan (lượng còn lại), endosulfan sulfat (từ 95 % đến 100 %), dieldrin (100 %).
7.4.4.3. Phân đoạn của chất chiết mẫu
Dùng pipet lấy 2,5 ml (VR5)) dung dịch thu được trong 7.4.3.4 cho vào bình cầu đáy tròn cổ dài và 5 ml isooctan. Cho bay hơi cẩn thận đến 1 ml (không để đến khô) trên bộ cô quay (quay chậm, chỉ nhúng nhẹ bình cầu). Nếu dung dịch này vẫn còn mùi của etyl axetat, thì lại thêm isooctan và làm bay hơi.
Dùng pipet lấy dung dịch còn lại sau khi bay hơi cho lên cột silica gel đã được rửa sơ bộ trong 7.4.4.1 và tráng rửa bằng 1 ml n-hexan. Sau đó tráng sạch bình bằng 2 ml chất rửa giải 1 (7.2.11), ngay khi hexan đã rút khỏi đỉnh cột nhồi, cho nước tráng lên cột. Lúc này thu lấy dịch rửa giải vào ống nghiệm chia độ. Sau đó tiếp tục rửa giải với 6 ml chất rửa giải 1 và đổ đầy chất rửa giải 1 vào ống thu nhận đến 10 ml (Vend). Dung dịch thu được này là dịch rửa giải 1.
Tráng rửa bình cầu đã được sử dụng để làm bay hơi dịch rửa giải GPC với 2 ml toluen (chất rửa giải 2). Sau đó cho nước rửa này sang cột. Thu lấy dung dịch vào ống nghiệm chia độ thứ hai và rửa giải với 6 ml toluen. Cho toluen vào ống nghiệm thứ hai đến 10 ml (Vend) để thu được dịch rửa giải 2. Tiếp tục chạy sắc ký theo cùng qui trình được thực hiện liên tục với chất rửa giải 3 (7.2.13), chất rửa giải 4 (7 2.14) và axeton (chất rửa giải 5) (7.2.15). Mỗi lần, tráng rửa bình bằng 2 ml, rửa giải tiếp với 6 ml và pha loãng dịch rửa giải đến 10 ml (Vend) để thu được dịch rửa giải 3, 4 và 5. Một ví dụ về phân bố các hợp chất trong các dịch rửa giải khác nhau được nêu trong Bảng 4.
Bảng 4 - Khoảng thể tích rửa giải trong sắc ký thẩm thấu gel và phân bố các hợp chất trong các dịch rửa giải từ cột sắc ký silica gel
| Các hợp chất | Khoảng thể tích rửa giải GPC | Dịch rửa giải silica gel *) | ||||
|
| ml | 1 | 2 | 3 | 4 | 5 |
| Acephate | từ 115 đến 145 | 0 | 0 | 0 | 0 | 5 |
| Aclonifen | từ 115 đến 145 | 0 | 5 | 0 | 0 | 0 |
| Alachlor | từ 125 đến 150 | 0 | 0 | 5 | 0 | 0 |
| Aldrin | từ 120 đến 150 | 5 | 0 | 0 | 0 | 0 |
| Ametryn | từ 115 đến 190 | 0 | 0 | 1 | 3 | 0 |
| Amidithion | từ 115 đến 145 | 0 | 0 | 0 | 4 | 3 |
| Anilazinea | từ 105 đến 135 | 0 | 0 | 5 | 0 | 0 |
| Anthraquinon | từ 145 đến 185 | 0 | 2 | 4 | 0 | 0 |
| Atrazine | từ 110 đến 135 | 0 | 0 | 4 | 3 | 0 |
| Azinphos-etyl | từ 130 đến 160 | 0 | 0 | 5 | 0 | 0 |
| Azinphos-metyl | từ 145 đến 180 | 0 | 0 | 4 | 0 | 0 |
| Azoxystrobin | từ 120 đến 155 | 0 | 0 | 0 | 5 | 0 |
| Benfluralin | từ 100 đến 130 | 5 | 0 | 0 | 0 | 0 |
| Benzoylprop-etyl | từ 125 đến 150 | 0 | 3 | 3 | 0 | 0 |
| Bifenox | từ 115 đến 150 | 0 | 3 | 3 | 0 | ũ |
| Bifenthrin | từ 090 đến 120 | 0 | 5 | 0 | 0 | 0 |
| Binapacryl | từ 100 đến 130 | 0 | 5 | 0 | 0 | 0 |
| Bitertanol | từ 100 đến 130 | 0 | 0 | 0 | 4 | 2 |
| Boscalid | từ 105 đến 130 | 0 | 0 | 5 | 0 | 0 |
| Bromacilb | từ 105 đến 140 | 0 | 0 | 0 | 5 | 0 |
| Bromophos | từ 120 đến 150 | 4 | 2 | 0 | 0 | 0 |
| Bromophos-etyl | từ 110 đến 140 | 5 | 1 | 0 | 0 | 0 |
| Bromopropylate | từ 095 đến 135 | 0 | 0 | 3 | 3 | 1 |
| Bromoxynil | từ 120 đến 150 | 0 | 5 | 1 | 0 | 0 |
| Camphechlor (Toxaphene) | từ 110 đến 150 | 5 | 1 | 0 | 0 | 0 |
| Captafolc | từ 120 đến 150 | 0 | 0 | 5 | 0 | 0 |
| Captanc | từ 120 đến 150 | 0 | 0 | 5 | 0 | 0 |
| Carbophenothion | từ 120 đến 140 | 0 | 3 | 0 | 0 | 0 |
| Carbophenothion-metyI | từ 120 đến 160 | 0 | 4 | 0 | 0 | 0 |
| Chinomethionat | từ 170 đến 200 | 0 | 1 | 4 | 0 | 0 |
| (Quinomethionate) | từ 170 đến 200 | 0 | 1 | 4 | 0 | 0 |
| Chlorbensided | từ 120 đến 155 | 0 | 0 | 1 | 0 | 0 |
| Chlorbenside sulfone | từ 130 đến 160 | 0 | 0 | 5 | 0 | 0 |
| α-chlordane | từ 110 đến 140 | 5 | 0 | 0 | 0 | 0 |
| γ-chlordane | từ 100 đến 130 | 5 | 0 | 0 | 0 | 0 |
| Chlorfenapyr | từ 085 đến 105 | 0 | 5 | 0 | 0 | 0 |
| Chlorfenprop-metyl | từ 125 đến 150 | 0 | 5 | 0 | 0 | 0 |
| Chlorfenson | từ 120 đến 150 | 1 | 5 | 0 | 0 | 0 |
| Chlorfenvinphos | từ 110 đến 140 | 0 | 0 | 4 | 3 | 0 |
| Chloridazon | từ 130 đến 155 | 0 | 0 | 0 | 4 | 1 |
| Chlormephos | từ 115 đến 145 | 3 | 3 | 0 | 0 | 0 |
| Chlorobenzilate | từ 100 đến 135 | 0 | 0 | 4 | 2 | 1 |
| Chloroneb | từ 145 đến 170 | 0 | 5 | 0 | 0 | 0 |
| Chloropropylate | từ 100 đến 135 | 0 | 0 | 4 | 2 | 0 |
| Chlorothalonil | từ 125 đến 165 | 0 | 5 | 0 | 0 | 0 |
| Chlorotoluron | từ 115 đến 150 | 0 | 0 | 0 | 5 | 2 |
| Chloroxuron | từ 130 đến 155 | 0 | 0 | 1 | 5 | 0 |
| Chlorpropham | từ 110 đến 135 | 0 | 2 | 4 | 0 | 0 |
| Chlorpyrifos | từ 110 đến 140 | 2 | 4 | 0 | 0 | 0 |
| Chlorpyrifos-metyl | từ 120 đến 150 | 1 | 4 | 0 | 0 | 0 |
| Chlorthal-dimetyl | từ 135 đến 160 | 0 | 5 | 1 | 0 | 0 |
| Chlorthiophos | từ 115 đến 155 | 0 | 4 | 0 | 0 | 0 |
| Clodinafop-propargyl | từ 100 đến 125 | 0 | 0 | 5 | 0 | 0 |
| Clomazone | từ 115 đến 145 | 0 | 0 | 5 | 0 | 0 |
| Cloquintocet-1-mexyl | từ 105 đến 130 | 0 | 0 | 2 | 4 | 0 |
| Coumaphos | từ 135 đến 165 | 0 | 0 | 5 | 0 | 0 |
| Crotoxyphos | từ 105 đến 145 | 0 | 0 | 0 | 4 | 0 |
| Crufomate | từ 100 đến 140 | 0 | 0 | 0 | 3 | 4 |
| Cyanazine | từ 110 đến 135 | 0 | 0 | 0 | 4 | 0 |
| Cyanofenphos | từ 115 đến 145 | 0 | 2 | 4 | 0 | 0 |
| Cyanophos | từ 115 đến 150 | 0 | 0 | 4 | 0 | 0 |
| Cyfluthrin | từ 090 đến 120 | 0 | 5 | 0 | 0 | 0 |
| λ-Cyhalothrin | từ 090 đến 110 | 0 | 5 | 0 | 0 | 0 |
| Cymoxanile | từ 110 đến 130 | 0 | 0 | 0 | 5 | 0 |
| Cypermethrin | từ 100 đến 135 | 0 | 5 | 0 | 0 | 0 |
| Cyprodinil | từ 105 đến 135 | 0 | 0 | 5 | 0 | 0 |
| o, p', DDD | từ 110 đến 140 | 5 | 0 | 0 | 0 | 0 |
| p.p '-DDD | từ 100 đến 140 | 5 | 0 | 0 | 0 | 0 |
| o.p '-DDE | từ 120 đến 150 | 5 | 0 | 0 | 0 | 0 |
| p, p'-DDE | từ 120 đến 150 | 5 | 0 | 0 | 0 | 0 |
| o, p'-DDT | từ 120 đến 150 | 5 | 0 | 0 | 0 | 0 |
| p.p '-DDT | từ 110 đến 140 | 5 | 0 | 0 | 0 | 0 |
| DEFf | từ 115 đến 135 | 0 | 0 | 5 | 1 | 0 |
| Deltamethrin | từ 100 đến 135 | 0 | 5 | 0 | 0 | 0 |
| Demeton-S-metyl | từ 125 đến 155 | 0 | 0 | 0 | 0 | 0 |
| Demeton-S-metyl sulfone | từ 120 đến 160 | 0 | 0 | 0 | 2 | 3 |
| Demeton-S sulfoneg | từ 115 đến 140 | 0 | 0 | 0 | 3 | 3 |
| Demeton-S sulfoxid h | từ 140 đến 170 | 0 | 0 | 0 | 0 | 3 |
| N-Desetyl-pirim iphos-metyl | từ 120 đến 155 | 0 | 0 | 1 | 5 | 0 |
| Dialifos | từ 110 đến 140 | 0 | 3 | 3 | 0 | 0 |
| Di-allate | từ 120 đến 150 | 0 | 4 | 1 | 0 | 0 |
| Diazinon | từ 105 đến 135 | 0 | 0 | 5 | 0 | 0 |
| Dichlobenil | từ 125 đến 155 | 1 | 5 | 0 | 0 | 0 |
| Dichlofenthion | từ 110 đến 140 | 3 | 3 | 0 | 0 | 0 |
| Dichlofluanid i | từ 100 đến 140 | 0 | 3 | 3 | 0 | 0 |
| p.p'-Dichlorobenzophenonej | từ 125 đến 155 | 0 | 5 | 0 | 0 | 0 |
| Dichlorvos | từ 115 đến 140 | 0 | 0 | 1 | 3 | 0 |
| Diclofop-methyl | từ 135 đến 165 | 0 | 0 | 5 | 0 | 0 |
| Dicloran | từ 105 đến 145 | 0 | 5 | 0 | 0 | 0 |
| Dicofolk | từ 100 đến 150 | 2 | 4 | 0 | 0 | 0 |
| Dicrotophos | từ 130 đến 160 | 0 | 0 | 0 | 0 | 5 |
| Dieldrin | từ 120 đến 150 | 0 | 5 | 0 | 0 | 0 |
| Diethofencarb | từ 105 đến 130 | 0 | 0 | 5 | 0 | 0 |
| Difenoconazol | từ 110 đến 140 | 0 | 0 | 0 | 3 | 3 |
| Diflufenican | từ 105 đến 125 | 0 | 0 | 5 | 0 | 0 |
| Dimefox | từ 120 đến 155 | 0 | 0 | 0 | 0 | 5 |
| Dimethachlor | từ 135 đến 165 | 0 | 0 | 4 | 2 | 0 |
| Dimethoate | từ 120 đến 150 | 0 | 0 | 0 | 3 | 3 |
| Dinitraminel | từ 105 đến 130 | 4 | 1 | 0 | 0 | 0 |
| Dinobuton | từ 110 đến 140 | 0 | 4 | 2 | 0 | 0 |
| Dinocap | từ 100 đến 120 | 0 | 5 | 0 | 0 | 0 |
| Dioxathion | từ 110 đến 140 | 0 | 3 | 3 | 1 | 0 |
| Diphenylamin | từ 130 đến 160 | 0 | 5 | 0 | 0 | 0 |
| Disulfoton m | từ 115 đến 150 | 0 | 2 | 0 | 0 | 3 |
| Disulfoton sulfone | từ 110 đến 140 | 0 | 0 | 5 | 0 | 0 |
| Disulfoton sulfoxide | từ 120 đến 150 | 0 | 0 | 0 | 0 | 5 |
| Ditalimfos | từ 120 đến 150 | 0 | 0 | 4 | 1 | 0 |
| Edifenphos | từ 130 đến 160 | 0 | 0 | 4 | 0 | 0 |
| α-Endosulfan | từ 110 đến 150 | 2 | 4 | 0 | 0 | 0 |
| β-Endosulfan | từ 110 đến 150 | 0 | 5 | 0 | 0 | 0 |
| Endosulfan sulfate | từ 100 đến 140 | 0 | 5 | 0 | 0 | 0 |
| Endrin | từ 130 đến 160 | 0 | 5 | 0 | 0 | 0 |
| EPN | từ 135 đến 160 | 0 | 5 | 0 | 0 | 0 |
| Ethion | từ 100 đến 140 | 0 | 5 | 0 | 0 | 0 |
| Ethofumesate | từ 110 đến 135 | 0 | 0 | 3 | 0 | 0 |
| Ethoprophos | từ 120 đến 155 | 0 | 0 | 4 | 1 | 0 |
| Etrimfos | từ 105 đến 140 | 0 | 0 | 5 | 0 | 0 |
| Famophos | tứ 125 đến 155 | 0 | 0 | 5 | 0 | 0 |
| Fenamidone | từ 105 đến 140 | 0 | 0 | 4 | 1 | 0 |
| Fenamiphos | từ 105 đến 140 | 0 | 0 | 0 | 4 | 2 |
| Fenarimol | từ 125 đến 150 | 0 | 0 | 0 | 4 | 0 |
| Fenazaquin | từ 105 đến 145 | 0 | 0 | 3 | 2 | 0 |
| Fenchlorphos | từ 120 đến 150 | 4 | 2 | 0 | 0 | 0 |
| Fenitrothion | từ 120 đến 150 | 0 | 4 | 0 | 0 | 0 |
| Fenoxycarb | từ 120 đến 145 | 0 | 0 | 4 | 0 | 0 |
| Fenpiclonil | từ 100 đến 130 | 0 | 0 | 3 | 3 | 0 |
| Fenpropathrin | từ 100 đến 120 | 0 | 5 | 1 | 0 | 0 |
| Fenson | từ 130 đến 160 | 0 | 5 | 0 | 0 | 0 |
| Fensulfothion | từ 120 đến 150 | 0 | 0 | 0 | 3 | 3 |
| Fenthion | từ 130 đến 160 | 0 | 3 | 0 | 0 | 0 |
| Fenvalerate | từ 105 đến 135 | 0 | 4 | 1 | 0 | 0 |
| Flubenziminei | từ 085 đến 120 | 0 | 5 | 0 | 0 | 0 |
| Fluchloralin | từ 100 đến 120 | 5 | 1 | 0 | 0 | 0 |
| Flucythrinat | từ 090 đến 120 | 0 | 5 | 0 | 0 | 0 |
| Fludioxonil | từ 090 đến 120 | 0 | 0 | 5 | 0 | 0 |
| Fluoroglycofen-etyl | từ 090 đến 115 | 0 | 0 | 5 | 0 | 0 |
| Fluotrimazole | từ 100 đến 140 | 0 | 0 | 4 | 2 | 0 |
| Fluquinconazol | từ 095 đến 125 | 0 | 0 | 3 | 3 | 0 |
| Flurtamone | từ 085 đến 105 | 0 | 0 | 0 | 5 | 0 |
| Flutriafol | từ 115 đến 135 | 0 | 0 | 0 | 3 | 3 |
| Fluvalinate | từ 095 đến 120 | 0 | 5 | 0 | 0 | 0 |
| Folpet | từ 140 đến 180 | 0 | 3 | 4 | 0 | 0 |
| Fonofos | từ 120 đến 150 | 0 | 4 | 1 | 0 | 0 |
| Formothion | từ 120 đến 150 | 0 | 0 | 4 | 1 | 0 |
| Fuberidazolel | từ 120 đến 160 | 0 | 0 | 0 | 5 | 1 |
| Genite | từ 135 đến 165 | 0 | 5 | 0 | 0 | 0 |
| αHCH- | từ 120 đến 150 | 5 | 0 | 0 | 0 | 0 |
| β- HCH | từ 100 đến 130 | 5 | 0 | 0 | 0 | 0 |
| δ-HCH | từ 100 đến 130 | 5 | 0 | 0 | 0 | 0 |
| ε-HCH | từ 105 đến 135 | 5 | 0 | 0 | 0 | 0 |
| Heptachlor | từ 110 đến 140 | 5 | 0 | 0 | 0 | 0 |
| cis-Heptachlor epoxit | từ 125 đến 155 | 3 | 3 | 0 | 0 | 0 |
| trans-Heptachlor epoxit | từ 125 đến 155 | 3 | 3 | 0 | 0 | 0 |
| Heptenophos | từ 120 đến 150 | 0 | 0 | 1 | 4 | 0 |
| Hexachlorobenzene | từ 140 đến 165 | 5 | 0 | 0 | 0 | 0 |
| Imazalil hl | từ 120 đến 150 | 0 | 0 | 0 | 0 | 5 |
| Indoxacarb | từ 095 đến 120 | 0 | 0 | 5 | 0 | 0 |
| lodofenphos | từ 120 đến 150 | 4 | 2 | 0 | 0 | 0 |
| loxynil | từ 125 đến 155 | 0 | 5 | 1 | 0 | 0 |
| Iprodione | từ 115 đến 145 | 0 | 0 | 5 | 1 | 0 |
| Iprovalicarb | từ 085 đến 110 | 0 | 0 | 0 | 5 | 0 |
| lsobenzan | từ 105 đến 140 | 5 | 0 | 0 | 0 | 0 |
| Isocarbamid | tử 130 đến 165 | 0 | 0 | 0 | 1 | 5 |
| Isodrin | từ 120 đến 150 | 5 | 0 | 0 | 0 | 0 |
| Isopropalin | từ 110 đến 135 | 5 | 0 | 0 | 0 | 0 |
| δ-Keto-endrin | từ 135 đến 165 | 3 | 4 | 0 | 0 | 0 |
| Kresoxim-metyl | từ 120 đến 155 | 0 | 0 | 5 | 0 | 0 |
| Lenacil | từ 130 đến 160 | 0 | 0 | 0 | 5 | 0 |
| Leptophos | từ 120 đến 150 | 5 | 1 | 0 | 0 | 0 |
| Lindane (γ-HCH) | từ 110 đến 140 | 5 | 0 | 0 | 0 | 0 |
| Linuron | từ 120 đến 140 | 0 | 0 | 4 | 1 | 0 |
| Malaoxon | từ 110 đến 140 | 0 | 0 | 0 | 4 | 0 |
| Malathion | từ 110 đến 140 | 0 | 0 | 4 | 0 | 0 |
| MCPA-(2-butoxyetyl) estere | từ 115 đến 145 | 0 | 0 | 5 | 0 | 0 |
| Mecarbam | từ 105 đến 145 | 0 | 0 | 4 | 0 | 0 |
| Mefenpyr-dietyl | từ 100 đến 130 | 0 | 0 | 5 | 0 | 0 |
| Mephosfolan | từ 140 đến 170 | 0 | 0 | 0 | 2 | 4 |
| Merphosn | từ 125 đến 145 | 5 | 0 | 0 | 0 | 0 |
| Metalaxyl | từ 115 đến 150 | 0 | 0 | 0 | 5 | 1 |
| Metconazol | từ 085 đến 115 | 0 | 0 | 0 | 4 | 1 |
| Methabenzthiazuron | từ 150 đến 180 | 0 | 0 | 0 | 5 | 0 |
| Methamidophos | từ 120 đến 150 | 0 | 0 | 0 | 0 | 4 |
| Methidathion | từ 130 đến 165 | 0 | 0 | 4 | 0 | 0 |
| Methoprotryne | từ 115 đến 140 | 0 | 0 | 0 | 4 | 1 |
| Methoxychlor | từ 125 đến 155 | 0 | 5 | 0 | 0 | 0 |
| Metolachlor | từ 130 đến 160 | 0 | 0 | 5 | 1 | 0 |
| Metribuzin | từ 125 đến 150 | 0 | 0 | 3 | 1 | 0 |
| Mevinphos | từ 120 đến 150 | 0 | 0 | 0 | 5 | 0 |
| Mirex | từ 130 đến 160 | 5 | 0 | 0 | 0 | 0 |
| Monocrotophos | từ 115 đến 140 | 0 | 0 | 0 | 0 | 5 |
| Monolinuron | từ 125 đến 150 | 0 | 0 | 4 | 2 | 0 |
| Morphothion | từ 130 đến 170 | 0 | 0 | 0 | 5 | 0 |
| Naled 0 | từ 115 đến 155 | 0 | 0 | 4 | 1 | 0 |
| Napropamid | từ 135 đến 165 | 0 | 0 | 2 | 4 | 0 |
| Nitralin | từ 115 đến 145 | 0 | 1 | 5 | 0 | 0 |
| Nitrofen | từ 135 đến 165 | 2 | 5 | 0 | 0 | 0 |
| Nitrothal-isopropyl | từ 105 đến 135 | 0 | 1 | 4 | 1 | 0 |
| Nuarimol | từ 130 đến 155 | 0 | 0 | 0 | 5 | 0 |
| Octachlorodipropyl ete (S 421) | từ 110 đến 130 | 5 | 0 | 0 | 0 | 0 |
| Omethoate | từ 140 đến 160 | 0 | 0 | 0 | 0 | 5 |
| Oxadiazon | từ 115 đến 145 | 0 | 0 | 5 | 0 | 0 |
| Oxychlordane (Octachlor epoxit) | từ 100 đến 160 | 5 | 0 | 0 | 0 | 0 |
| Oxydemeton-metylh | từ 135 đến 165 | 0 |
| 0 | 0 | 0 |
| Paraoxon | từ 110 đến 140 | 0 | 0 | 1 | 4 | 0 |
| Paraoxon-metyl | từ 140 đến 170 | 0 | 0 | 1 | 4 | 1 |
| Parathion | từ 110 đến 140 | 0 | 4 | 1 | 0 | 0 |
| Metyl parathion | từ 120 đến 150 | 0 | 4 | 1 | 0 | 0 |
| Pendimethalin | từ 125 đến 155 | 1 | 5 | 0 | 0 | 0 |
| Pentachloroaniline | từ 110 đến 140 | 5 | 0 | 0 | 0 | 0 |
| Pentach loroa nisole | từ 125 đến 160 | 5 | 0 | 0 | 0 | 0 |
| Pentachlorobenzene | từ 125 đến 165 | 5 | 0 | 0 | 0 | 0 |
| Permethrin | từ 115 đến 145 | 0 | 5 | 1 | 0 | 0 |
| Perthane | từ 110 đến 140 | 5 | 1 | 0 | 0 | 0 |
| Phenkapton | từ 115 đến 145 | 3 | 3 | 0 | 0 | 0 |
| Phenmedipham | từ 105 đến 130 | 0 | 0 | 3 | 3 | 1 |
| Phenthoate | từ 115 đến 150 | 0 | 1 | 4 | 0 | 0 |
| Phorate p | từ 115 đến 145 | 0 | 2 | 0 | 0 | 0 |
| Phosalone | từ 110 đến 140 | 0 | 0 | 4 | 0 | 0 |
| Phosphamidon | từ 110 đến 145 | 0 | 0 | 0 | 1 | 5 |
| Phoxim | từ 120 đến 150 | 0 | 5 | 0 | 0 | 0 |
| Picoxystrobin | từ 100 đến 130 | 0 | 0 | 5 | 0 | 0 |
| Piperonyl butoxide e | từ 100 đến 130 | 0 | 0 | 4 | 1 | 0 |
| Pirimicarb | từ 130 đến 170 | 0 | 0 | 0 | 5 | 0 |
| Pirimiphos-etyl | từ 100 đến 135 | 0 | 0 | 4 | 0 | 0 |
| Pirimiphos-metyl | từ 105 đến 145 | 0 | 0 | 4 | 0 | 0 |
| Procymidone | từ 120 đến 150 | 0 | 0 | 5 | 0 | 0 |
| Profenofos | từ 130 đến 155 | 0 | 0 | 4 | 1 | 0 |
| Profluralin | từ 100 đến 125 | 5 | 0 | 0 | 0 | 0 |
| Propachlor | từ 125 đến 150 | 0 | 0 | 5 | 0 | 0 |
| Propanil | từ 105 đến 130 | 0 | 0 | 4 | 2 | 0 |
| Propham | từ 100 đến 180 | 0 | 0 | 5 | 0 | 0 |
| Propiconazole | từ 120 đến 150 | 0 | 0 | 0 | 4 | 2 |
| Propoxur | từ 110 đến 130 | 0 | 0 | 4 | 2 | 0 |
| Propyzamide | từ 095 đến 125 | 0 | 0 | 4 | 0 | 0 |
| Prosulfocarb | từ 120 đến 145 | 0 | 2 | 3 | 0 | 0 |
| Prothiofos | từ 105 đến 145 | 5 | 0 | 0 | 0 | 0 |
| Pyrazophos | từ 110 đến 140 | 0 | 0 | 5 | 0 | 0 |
| Pyrethrin1 | từ 100 đến 130 | 0 | 0 | 5 | 1 | 0 |
| Pyridaben | từ 095 đến 125 | 0 | 0 | 4 | 0 | 0 |
| Pyrifenox | từ 125 đến 165 | 0 | 0 | 2 | 4 | 0 |
| Pyriproxyfen | từ 105 đến 135 | 0 | 2 | 3 | 0 | 0 |
| Quinaiphos | từ 115 đến 155 | 0 | 0 | 4 | 0 | 0 |
| Quintozene | từ 135 đến 165 | 0 | 0 | 4 | 0 | 0 |
| Rabenzazolel | từ 120 đến 160 | 0 | 0 | 5 | 0 | 0 |
| Resmethrinee | từ 100 đến 130 | 0 | 5 | 0 | 0 | 0 |
| Salithion | từ 125 đến 165 | 0 | 5 | 0 | 0 | 0 |
| Silthiofam | từ 090 đến 120 | 0 | 0 | 5 | 0 | 0 |
| Simazine | từ 095 đến 135 | 0 | 0 | 2 | 4 | 0 |
| Spiroxamin q | từ 085 đến 105 | 0 | 0 | 0 | 0 | 4 |
| Strobane T | từ 125 đến 160 | 5 | 0 | 0 | 0 | 0 |
| Sulfotep | từ 100 đến 130 | 0 | 4 | 1 | 0 | 0 |
| Sulprofos | từ 115 đến 155 | 0 | 3 | 0 | 0 | 0 |
| Tebufenpyrad | từ 105 đến 145 | 0 | 0 | 5 | 0 | 0 |
| Tecnazene | từ 130 đến 160 | 5 | 0 | 0 | 0 | 0 |
| Terbacil | từ 120 đến 145 | 0 | 0 | 0 | 5 | 0 |
| Terbufos | từ 125 đến 155 | 0 | 3 | 0 | 0 | 0 |
| Terbutryn | từ 115 đến 175 | 0 | 0 | 1 | 2 | 0 |
| 2,3,4, 5-Tetrachloronitrobenzene | từ 130 đến 160 | 5 | 0 | 0 | 0 |
|
| Tetrachlorvinphos | từ 120 đến 140 | 0 | 0 | 4 | 1 | 0 |
| Tetradifon | từ 120 đến 150 | 0 | 5 | 0 | 0 | 0 |
| Tetramethrin | từ 120 đến 150 | 0 | 0 | 5 | 0 | 0 |
| Tetrasul | từ 125 đến 155 | 5 | 0 | 0 | 0 | 0 |
| Thionazin | từ 120 đến 150 | 0 | 1 | 4 | 0 | 0 |
| Tolclofos-metyl | từ 130 đến 165 | 0 | 5 | 0 | 0 | 0 |
| Tolylfluanidi | từ 105 đến 135 | 0 | 3 | 3 | 0 | 0 |
| Triadimefon | từ 100 đến 130 | 0 | 0 | 3 | 3 | 0 |
| Triadimenol | từ 100 đến 130 | 0 | 0 | 0 | 4 | 2 |
| Tri-allate | từ 120 đến 150 | 0 | 5 | 0 | 0 | 0 |
| Triamiphos | từ 125 đến 160 | 0 | 0 | 0 | 0 | 4 |
| Triazophos | từ 120 đến 140 | 0 | 0 | 4 | 1 | 0 |
| Triazoxide | từ 165 đến 195 | 0 | 0 | 0 | 5 | 0 |
| Trichlorfon h | từ 100 đến 140 | 0 | 0 | 0 | 0 | 4 |
| Trichloronat | từ 110 đến 140 | 5 | 1 | 0 | 0 | 0 |
| Trifloxystrobin | từ 090 đến 110 | 0 | 0 | 5 | 0 | 0 |
| Triflumizol | từ 085 đến 105 | 0 | 0 | 0 | 5 | 0 |
| Trifluralin | từ 100 đến 130 | 5 | 0 | 0 | 0 | 0 |
| Triticonazol | từ 100 đến 125 | 0 | 0 | 0 | 4 | 1 |
| Vinclozolin | từ 100 đến 130 | 0 | 4 | 1 | 0 | 0 |
| Zoxamid | từ 085 đến 125 | 0 | 0 | 5 | 0 | 0 |
| *) Silica gel dịch rửa giải; 1 n-Hexan-toluen với tỷ lệ 65 : 35 (tính theo thể tích) 2 toluen. 3 toluen, axeton với tỷ lệ 95 : 5 (tính theo thể tích). 4 toluen, axeton với tỷ lệ 80 : 20 (tính theo thể tích) 5 axeton CHÚ THÍCH Các con số trong bảng cho thấy mức thu hồi: 5 = trên 90%; 4 = khoảng từ 60 % đến 905 , 3 = khoảng từ 30% đến 60%; 2 = khoảng từ 10% đến 30%; 1 = nhỏ hơn 10 %; 0 = không thu hồi được. a Chiết mẫu phân tích có bổ sung kali axetat; đối với GC, bơm một lượng dung dịch mẫu có bổ sung axit axetic. b Chiều cao pic thuộc vào dung môi. c Cột sắc ký khí đã được ổn định tốt. d Khi chạy sắc ký trên silica gel, quan sát thấy có thêm một pic có thời gian lưu lâu hơn e Được phân tích bằng GC/MS. f Cũng từ Merphos. g Bơm dung dịch chuẩn trong vòng 2 min sau khi bơm dung dịch mẫu. h Độ thu hồi được cải thiện khi được rửa giải thêm với 8 ml axeton. i Chiết phần mẫu thử có bổ sung axit xitric và axit oxalic. j Sự phân huỷ của dicofol. k Sự phân huỷ về p,p’-dichlorobenzophenone. l Đối với việc chuẩn bị mẫu, tiến hành tránh hoàn toàn ánh sáng. m Sau sắc ký trên silica gel, quan sát được sulfoxid trong dịch rửa giải 5. n Một phần bị oxi hoá đến DEF. o Khi chạy sắc ký trên silica gel, quan sát được các độ thu hồi khác nhau. p Một phần bị phân huỷ trong quá trình sắc ký trên silica gel. q Dịch rửa giải 5 cần 12 ml axeton để rửa giải hoàn toàn hợp chất này. | ||||||
7.5. Sắc ký khí
Sử dụng hệ thống sắc ký khí thích hợp để xác định dư lượng thuốc bảo vệ thực vật nhóm halogen hữu cơ, phospho hữu cơ và nitơ hữu cơ như trong TCVN 8424-3:2010 (EN 12393-3:2008).
Bơm một lượng (Vi) các dịch rửa giải thu được trong 7.4.4.3 vào sắc ký khí. Đối với phép phân tích có detector ion hóa nhiệt và detector quang phổ ngọn lửa, thì cũng có thể bơm một lượng (Vi) dung dịch thu được trong 7.4.3 4 (VR4) vào máy sắc ký khí
7.6. Tính dư lượng
Dư lượng, R được biểu thị bằng miligam trên kilogam, của một hợp chất đã được nhận biết, tính theo công thức (2):
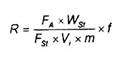 (2)
(2)
Trong đó:
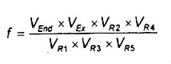 (3)
(3)
Trong đó:
m là khối lượng của phần mẫu thử, tính bằng gam (g);;
VEX là thể tích của axeton và nước được thêm vào trong bước chiết 7.4.1.2 hoặc 7.4.1.3, cộng với nước có trong mẫu, ít hơn lượng thực tế trong 7.4.2.1 là 5 ml hoặc trong 7.4.2.2 là 15 ml, tính bằng mililit (ml);
VR1 là phần thể tích VEx được sử dụng để chiết phân đoạn trong 7.4.2, tính bằng mililit (ml);
VR2 là thể tích dung dịch còn lại sau khi cho bay hơi được chuẩn bị cho sắc ký thẩm thấu gel bằng phương pháp mô tả trong 7.4.3.4, tính bằng mililit (ml);
VR3 là phần thể tích của VR2 được bơm cho sắc ký thẩm thấu gel (thể tích của vòng mẫu), tính bằng mililit (ml);
VR4 là thể tích của dung dịch thu được sau sắc ký thẩm thấu gel bằng qui trình mô tả trong 7.4.3.4, tính bằng mililit (ml);
VR5 là phần thể tích VR4 được sử dụng cho sắc ký trong 7.4.4.3, tính bằng mililit (ml);
VEND là thể tích cuối cùng của dịch rửa giải thu được trong 7.4.4.3, tính bằng mililit (ml);
Vi là phần thể tích của VEnd hoặc thể tích của VR4 được bơm vào máy sắc ký khí, tính bằng microlit (μl);
Wst là lượng hợp chất được bơm cùng với dung dịch chuẩn, tính bằng nanogam (ng);
FA là diện tích pic thu được từ Vb
FSt là chiều cao pic thu được từ WSt.
7.7.Nghiên cứu cộng tác
Các cặp chất nền và thuốc bảo vệ thực vật đã được nghiên cứu cộng tác được nêu trong Bảng 5.
Bảng 5 - Chất nền và thuốc bảo vệ thực vật
|
| cà rốt | khoai tây | cải bắp Savoy | rau chân vịt | cà chua | dưa chuột | giống cam chanh | ngũ cốc | các loại hạt, bơ | đậu vàng |
| acephate |
|
|
| + |
|
|
|
|
|
|
| aclonifen |
|
|
|
| + |
| + | + | + |
|
| azoxystrobin |
|
|
|
| + |
| + | + | + |
|
| boscalid |
|
|
|
|
| + | + | + | + |
|
| bromophos | + | + |
|
| + |
|
|
|
|
|
| bromopropylate |
|
|
| + | + |
|
|
|
|
|
| captan |
|
|
|
| + |
|
|
|
|
|
| chlorfenapyr |
|
|
|
|
| + | + | + | + |
|
| chlorfenprop-metyl |
|
|
|
|
| + | + | + | + |
|
| chlorothalonil |
|
|
| + |
|
|
|
|
|
|
| chlorpropham |
| + |
|
|
|
|
|
|
|
|
| chlorpyrifos |
|
|
| + | + |
|
|
|
|
|
| clodinafop-propargyl |
|
|
|
| + |
| + | + | + |
|
| clomazone |
|
|
|
| + |
| + | + | + |
|
| cloquintocet-1 -mexyI |
|
|
|
| + |
| + | + | + |
|
| cyprodinil |
|
|
|
| + |
| + | + | + |
|
| o,p’-DDE | + |
|
|
|
|
|
|
|
|
|
| p,p'-DDE | + |
|
| + |
|
|
|
|
|
|
| o,p'-DDT | + |
|
|
|
|
|
|
|
|
|
| p,p'-DDT | + |
|
|
| + |
|
|
|
|
|
| diazinon | + |
| + |
|
|
|
|
|
| + |
| dichlofiuartid | + |
|
|
|
|
|
|
|
|
|
| dicloran | + |
|
|
|
|
|
|
|
|
|
| idicofol |
|
|
| + | + |
|
|
|
|
|
| dieldrin | + | + | + | + | + |
|
|
|
| + |
| diethofencarb |
|
|
|
| + |
| + | + | + |
|
| difenoconazole |
|
|
|
| + |
| + | + | + |
|
| diflufenican |
|
|
|
| + |
| + | + | + |
|
| diphenylamin |
|
|
|
| + |
| + | + | + |
|
|
|
|
|
|
| + |
|
|
|
|
|
|
|
|
|
| + | + |
|
|
|
|
|
| endosultan sulfate |
|
|
| + | + |
|
|
|
|
|
| endrin |
|
|
|
| + |
|
|
|
|
|
| ethion |
|
|
|
| + |
|
|
|
|
|
| ethofumesate |
|
|
|
| + |
| + | + | + |
|
| fenamidone |
|
|
|
|
| + | + | + | + |
|
| fenarimol |
|
|
| + |
|
|
|
|
|
|
| fenazaquin |
|
|
|
| + |
| + | + | + |
|
| fenitrothion | + |
| + |
|
|
|
|
|
|
|
| fenoxycarb |
|
|
|
| + |
| + | + | + |
|
| fenpicloriii |
|
|
|
| + |
| + | + | + |
|
| fenpropathrin |
|
|
| + |
|
|
|
|
|
|
| fludioxonil |
|
|
|
| + |
| + | + | + |
|
| fluoroglycofen-etyl |
|
|
|
| + |
| + | + | + |
|
| fluquinconazole |
|
|
|
| + |
| + | + | * + |
|
| flurtamone |
|
|
|
|
| + | + | + | + |
|
| flutriafol |
|
|
|
| + |
| + | + | + |
|
| folpet |
|
|
| + |
|
|
|
|
|
|
| HCB | + | + |
| + | + |
|
|
|
| + |
| a-HCH |
|
|
|
| + |
|
|
|
|
|
| Lindane (y-HCH) | + | + | + | + | + |
|
|
|
| + |
| heptachlor epoxit | + |
| + |
|
|
|
|
|
|
|
| indoxacarb |
|
|
|
|
| + | + | + | + |
|
| iprodione |
|
|
| + |
|
|
|
|
|
|
| iprovalicarb |
|
|
|
|
| + | + | + | + |
|
| kresoxim-metyl |
|
|
|
| + |
| + | + | + |
|
| malathion |
|
|
| + |
|
|
|
|
| + |
| mecarbam |
|
|
| + |
|
|
|
|
|
|
| mefenpyr-dietyl |
|
|
|
| + |
| + | + | + |
|
| metconazole |
|
|
|
| + |
| + | + | + |
|
| napropamide |
|
|
|
| + |
| + | + | + |
|
| nuarimol |
|
|
|
| + |
| + | + | + |
|
| parathion | + |
| + | + | + |
|
|
|
|
|
| permethrin |
|
|
| + |
|
|
|
|
|
|
| phosalone | + |
|
| + |
|
|
|
|
| + |
| picoxystrobin |
|
|
|
|
| + | + | + | + |
|
| pirimiphos-metyl |
| + |
| + | + |
|
|
|
| + |
| procymidone |
|
|
|
| + |
|
|
|
|
|
| propham |
| + |
|
|
|
|
|
|
|
|
| prosulfocarfo |
|
|
|
| + |
| + | + | + |
|
| pyridaben |
|
|
|
|
| + | + | + | + |
|
| pyrifenox |
|
|
|
| + |
| + | + | + |
|
| pyriproxyfen |
|
|
|
|
| + | + | + | + |
|
| quintozene |
|
|
| + |
|
|
|
|
| + |
| silthiofam |
|
|
|
|
| + | + | + | + |
|
| spiroxamine |
|
|
|
|
| + | + | + | + |
|
| tebufenpyrad |
|
|
|
| + |
| + | + | + |
|
| tetradifon |
|
|
|
| + |
|
|
|
|
|
| tolclofos-metyl |
|
|
| + |
|
|
|
|
|
|
| trifloxystrobin |
|
|
|
|
| + | + | + | + |
|
| triticonazole |
|
|
|
| + |
| + | + | + |
|
| vinclozolin | + | + |
| + | + |
|
|
|
|
|
| zoxamide |
|
|
|
|
| + | + | + | + |
|
7.8. Khả năng ứng dụng
Các loại thuốc bảo vệ thực vật có thể phân tích bằng phương pháp này được nêu trong Bảng 4 Các loại cây trồng và thực phẩm đã thử nghiệm bằng phương pháp này là:
| Táo | Nho đỏ Hy lạp | Đậu Hà lan |
| Bơ | Nho | Dứa |
| Chuối | Bắp cải | Mận |
| Đậu | Cây hublong | Khoai tây |
| Bia | Cải củ | Bắp cải Savoy |
| Cà rốt | Rau diếp | Gia vị |
| Bông cải | Dưa vàng | Rau chân vịt |
| Ngũ cốc | Nước quả nho | Dâu |
| Anh đào | Các loại hạt | Củ cải đường |
| Quả cam quýt | Hành tây | Ớt ngọt |
| Các sản phẩm ca cao | Đào | Chè và sản phẩm tương tư |
| Cà phê, dạng thô | Hạt lạc | Thuốc lá |
| Dưa chuột | Lê | Cà chua |
| Cải xoăn |
| Rượu vang |
8. Phương pháp P: Chiết bằng etyl axetat và làm sạch bằng sắc ký thẩm thấu gel, nếu cần
8.1. Nguyên tắc
Phần mẫu thử được cắt nhỏ rồi đồng hóa với natri sulfat trong etyl axetat và phần dịch đồng hóa được Iọc. Phần dịch lọc được cô đặc và có thể được bơm trực tiếp vào máy sắc ký khí có detector chọn lọc phospho mà không cần phải làm sạch, hoặc được tinh sạch bằng sắc ký thẩm thấu gel trên BioBeads®S-X3 dùng hỗn hợp etyl axetat và xyclohexan làm chất rửa giải, nếu cần. Dịch rửa giải được cô đặc để xác định bằng sắc ký khí.
8.2. Thuốc thử
8.2.1. Yêu cầu chung
Sử dụng tất cả các thuốc thử có độ tinh khiết thích hợp để phân tích dư lượng thuốc bảo vệ thực vật và phù hợp với Điều 4 của TCVN 8424-1:2010 (EN 12393-1:2008).
8.2.2. Etyl axetat
8.2.3. Natri sulfat
Nung ở nhiệt độ 500 oC ít nhất 4 h, để nguội rồi bảo quản trong chai có nắp đậy kín.
8.2.4. Xyclohexan
8.2.5. Hỗn hợp rửa giải GPC: xyclohexan/etyl axetat với tỷ lệ 1 : 1 (tính theo thể tích)
8.2.6. Bio Beads ® S-X3, cỡ hạt từ 38 µm đến 75 µm (200 mesh đến 400 mesh)
8.3. Thiết bị, dụng cụ
Sử dụng các thiết bị, dụng cụ của phòng thử nghiệm thông thường và cụ thể như sau:
8.3.1. Máy trộn tốc độ cao hoặc máy đồng hóa, có cốc trộn thích hợp
8.3.2. Bộ làm bay hơi dung môi, có nồi cách thủy
8.3.3. Dụng cụ dùng cho GPC, ví dụ GPC Autoprep® 1001 hoặc 1002 ®, được trang bị cột sắc ký, đường kính trong 25 mm, 50 cm và hai mươi ba vòng mẫu 5 ml; cột được nhồi 50 g resin BioBeads S-X3 ®, đã được làm trương nở qua đêm trong hỗn hợp rửa giải GPC, cột cao khoảng 32 cm đã được nhồi như mô tả trong 8.4.3.1.
8.4. Cách tiến hành
8.4.1. Chuẩn bị mẫu
Phần mẫu thử được cắt nhỏ và trộn kỹ để thu được phần mẫu thử đồng nhất.
8.4.2. Chiết
Cân 50 g mẫu đã chuẩn bị cho vào cốc trộn (8.3.1), thêm một lượng thích hợp ít nhất 50 g natri sulfat (8.2.3) để hấp thụ phần nước có trong mẫu (xem Bảng A.1 về hàm lượng nước ) và 100 ml etyl axetat. Trộn từ 2 min đến 3 min. Lọc chất lỏng qua phễu Buchner có đường kính trong 90 mm, rửa cẩn thận bộ máy trộn và bánh lọc hai lần, mỗi lần dùng 25 ml etyl axetat. Đo thể tích dịch lọc, chuyển một phần tư dung dịch (tương đương 12,5 g mẫu) vào bình và cô đặc đến khoảng 2,5 ml bằng bộ cô quay (8.3.2). Chuyển sang ống đong và chỉnh bằng axetat etyl đến chính xác 5 ml. Dịch cô đặc này có thể được bơm trực tiếp vào sắc ký khi được trang bị detector FPD hoặc NPD.
Trong một số trường hợp, khi có chất gây nhiễu, thì nên làm sạch bằng GPC.
8.4.3. Làm sạch bằng sắc ký thẩm thấu gel (nếu cần)
8.4.3.1. Nhồi cột thẩm thấu gel
Để BioBeads® (8.2.6) (khoảng 50 g) trương nở qua đêm trong hỗn hợp rửa giải GPC (8.2.5). Sau đó rót tất cả huyền phù cùng một lúc vào cột (dung tích khoảng 180 ml). Ngay sau khi lớp nền gel đã ổn định (không có bọt khí) đến mức xấp xỉ 32 cm, thì chèn pittông, hạ thấp xuống đến mức nền và xoay vào vị trí. Nếu lớp nền gel bị lún xuống mức thấp hơn sau khi thao tác kéo dài, thì phải chỉnh pittông cho phù hợp (theo hướng dẫn của nhà sản xuất).
8.4.3.2. Kiểm tra thể tích rửa giải
Đối với mỗi cột thẩm thấu gel trước khi sử dụng lần đầu, cần phải kiểm tra các điều kiện rửa giải trên vài hợp chất có khoảng thể tích rửa giải thấp hơn và cao hơn và trên các dịch chiết thô thích hợp. Để thực hiện điều này, nạp đầy các vòng mẫu bằng dịch chiết thô hoặc hỗn hợp các dung dịch chuẩn, rửa giải theo mô tả trong 8.4.3.3 và xác định bằng phương pháp phân tích thích hợp cho dù các hợp chất được thêm vào đã được thu hồi hoàn toàn hoặc các chất gây nhiễu sinh ra do các tạp chất chưa được tách. Tương tự, phải kiểm tra các cột sau khi đã qua một khoảng thời gian sử dụng dài.
8.4.3.3. Làm sạch dịch chiết thô
Thêm 5 ml xyclohexan và 5 ml dịch chiết etyl axetat (8.4 2). Lắc khoảng 20 s rồi lọc qua giấy lọc nhanh và bơm dịch lọc vào một vòng mẫu của máy sắc ký thẩm thấu gel.
Rửa giải cột thẩm thấu gel bằng hỗn hợp rửa giải với tốc độ 5,0 ml/min. Bộ phận chuyển mạch của máy sắc ký thẩm thấu gel được điều chỉnh để kiểm tra thể tích dịch rửa giải Thông thường được cài đặt như sau:
- chế độ thải (dump) chuyển sang 18 min để loại bỏ 90 ml;
- chế độ thu nhận chuyển sang 15 min để thu được 75 ml;
- chế độ rửa chuyển sang 2 min để rửa cột dùng 10 ml.
Cô đặc thể tích thu được đến khoảng 1 ml trên bộ cô quay (quay chậm, ngâm nhẹ bình cầu), dùng pipet cho lượng này vào ống nghiệm chia độ được đậy bằng nút mài, tráng rửa bộ cô quay bằng etyl axetat và pha loãng bằng etyl axetat đến 5,0 ml. Việc bổ sung etyl axetat không được bỏ qua để đảm bảo hòa tan hoàn toàn dư lượng.
Để xác định các dư lượng thuốc bảo vệ thực vật riêng rẽ, thì có thể cài đặt dụng cụ để thu được một lượng nhỏ hơn, phù hợp với hợp chất tương ứng, theo các giá trị nêu trong Bảng 4.
8.5. Sắc ký khí
Sử dụng hệ thống sắc ký khí thích hợp để xác định dư lượng thuốc bảo vệ thực vật nhóm phospho hữu cơ.
8.6. Nghiên cứu cộng tác
Các cặp chất nền và thuốc bảo vệ thực vật đã được nghiên cứu cộng tác mà không có bước làm sạch:
- Chất nền: táo; tỏi; bắp cải.
- Thuốc bảo vệ thực vật: bromophos-etyl, chlorfenvinphos; diazinon; mevinphos; parathion.
8.7. Khả năng áp dụng
Các thuốc bảo vệ thực vật sau đây có thể phân tích được trong rau quả bằng phương pháp này:
| acephate | dichlofenthion | heptenophos | phosmet |
| azinphos-etyl | dichlorvos | isofenphos | phoxim |
| azinphos-metyl | dimethoate | malathion | pirimiphos-etyl |
| bromophos | dioxathion | methamidophos | pirimiphos-metyl |
| bromophos-etyl | disulfoton | methidathion | prothoate |
| carbophenothion | ditalimfos | menazon | pyrazophos |
| chlorfenvinfos | ethion | mevinphos | sulfotep |
| chlorpyrifos | ethoprophos | monocrotophos | temephos |
| chlorpyrifos-metyl | etrimfos | naled | TEPP |
| chlorthiophos | fenamiphos | omethoate | tetrachlorvinphos |
| coumaphos | fenchlorphos | oxydemeton-mEtyl | thiometon |
| cyanofenphos | fenitrothion | parathion | tolclofos-metyl |
| demeton-S-metyl | fensulfothion | -metyl parathion | triamiphos |
| demeton-S-metyl sulfone | fenthion | phorate | triazophos |
| dialifos | fonofos | phosalone | trichlorfon |
| diazinon | formothion | phosphamidon | trichloronate vamidothion |
Phụ lục A
(Tham khảo)
Hàm lượng nước trung bình có trong các loại cây trồng và các loại thực phẩm
Bảng A.1 – Hàm lượng nước trung bình có trong các loại cây trồng và các loại thực phẩm
| Cây trồng và thực phẩm | Hàm lượng nước trung bình (g/100 g) |
| Bột cacao | 5 |
| Ngũ cốc, gia vị (rau thơm), càphê (nguyên liệu), chè và sản phảm tương tư | 10 |
| Chuối, cây cải ngựa | 75 |
| Đậu Hà Lan, nho Hy lạp (đen), khoai tây, mùi tây, nho | 80 |
| Dứa, táo, lê, nho Hy lạp (đỏ), anh đào, cam, mận, rau thơm | 85 |
| Súp lơ, đậu (hạt non), bông cải xanh, dâu tây, bưởi, cải xoăn, su hào, dưa hấu, cà rót, nước quả nho, hạt tiêu, đào, nấm, củ cải đỏ, bắp cải đỏ, rau chân vịt, ngọn cải, chanh, củ cải đường (ăn được gốc), hành tây | 90 |
| Rau diếp xoăn, rau xà lách, dưa chuột, củ cải, đại hoàng, rau diếp, cần tây, măng tây, cà chua | 95 |
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] Becker, G.: Organohalogen, organophosphorus and triazine compounds. In DFG Manual of Pesticide Residue Analysis, VCH Weinheim, Method S 8, in Vol. 1 (1987), pp. 283. and Vol. 2 (1992), pp 313
[2] Luke, Milton A.; Froberg, Jerry E ; Masumoto, Herbert T, Extraction and clean-up of organochlorine, organophosphate, organonitrogen and hydrocarbon pesticides in produce for determination by gas-liquid chromatography. J. Assoc. Off. Anal. Chem. 58,1020 -1026,1975
[3] Luke, Milton A.; Froberg, Jerry E.; Doose, Gregory M.; Masumoto, Herbert T. Improved multiresidue gas chromatographic determination of organophosphorus, organonitrogen and organohalogen pesticides in produce, using flame photometric and electrolytic conductivity detectors. J. Assoc. Off. Anal. Chem. 64.1187-1195(1981)
[4] Pesticide Analytical Manual-Vol. 1, Multiresidue methods, Section 302,3rd Edition, 1994
[5] Specht, W.: Organochlorine, organophosphorus, nitrogen-containing and other pesticides. In DFG, Manual of Pesticide Residue Analysis, VCH Weinheim, Method S 19, in Vol.1 (1987), pp. 383, and VoI.2 (1992). pp. 317
[6] Specht W., Pelz, S., Gilsbach, W.: Gas-chromatographic determination of pesticide residues after clean-up by gel-permeation chromatography and mini-silica gel-column chromatography. Replacement of dichloromethane by ethyl acetate/cydohexane in liquid- liquid partition and simplified conditions for extraction and liquid- liquid partition, Fresenius J. Anal. Chem. 353,183-190 (1995)
[7] Analytical Methods for Residues of Pesticides in Foodstuffs, Sixth edition, The Hague (1996)
1) là ví dụ về sản phẩm thích hợp có bán sẵn. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn này, còn không ấn định phải sử dụng chúng.
2) Biobeads® là ví dụ về sản phẩm thích hợp có bán sẵn. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn này, không ấn định phải sử dụng chúng.
3)Celite® là ví dụ về sản phẩm thích hợp có bán sẵn. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn này, không ấn định phải sử dụng chúng.
4)Đối với các nghiên cứu cộng tác, sử dụng thanh hoạt tính, silicagel 60 , 63 đến 200 (70 mesh đến 230 mesh) của công ty Merck. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn, không ấn định phải sử dụng chúng.
5)GPC Autoprep 1001 hoặc 1002 Ò là những ví dụ về sản phẩm thích hợp có bán sẵn. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn này, không ấn định phải sử dụng chúng.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 8424-2:2010 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 8424-2:2010 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 8424-2:2010 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 8424-2:2010 DOC (Bản Word)