- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 13389:2021 ISO 15675:2016 with AMD 1:2020 Vật cấy ghép tim mạch và các cơ quan nhân tạo - Hệ thống tuần hoàn ngoài cơ thể - Bộ lọc máu đường động mạch
| Số hiệu: | TCVN 13389:2021 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Y tế-Sức khỏe |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
28/12/2021 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 13389:2021
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 13389:2021
TIÊU CHUẨN QUỐC GIA
TCVN 13389:2021
ISO 15675:2016 WITH AMD 1:2020
VẬT CẤY GHÉP TIM MẠCH VÀ CÁC CƠ QUAN NHÂN TẠO - HỆ THỐNG TUẦN HOÀN NGOÀI CƠ THỂ - BỘ LỌC MÁU ĐƯỜNG ĐỘNG MẠCH
Cardiovascular implants and artificial organs - Cardiopulmonary bypass systems - Arterial blood line filters
Lời nói đầu
TCVN 13389:2021 hoàn toàn tương đương với ISO 15675:2016 và sửa đổi 1:2020;
TCVN 13389:2021 do Viện Trang thiết bị và Công trình y tế biên soạn, Bộ Y tế đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
VẬT CẤY GHÉP TIM MẠCH VÀ CÁC CƠ QUAN NHÂN TẠO - HỆ THỐNG TUẦN HOÀN NGOÀI CƠ THỂ - BỘ LỌC MÁU ĐƯỜNG ĐỘNG MẠCH
Cardiovascular implants and artificial organs - Cardiopulmonary bypass systems - Arterial blood line filters
1 Phạm vi áp dụng
Tiêu chuẩn này quy định những yêu cầu đối với các bộ lọc máu đường động mạch vô khuẩn, sử dụng một lần dùng để lọc và loại khỏi máu người các cục nghẽn, mảnh vụn, cục máu đống và các chất rắn và khí khác có khả năng gây hại trong quá trình phẫu thuật sử dụng hệ thống tuần hoàn ngoài cơ thể.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau đây là cần thiết để áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 7391-1 (ISO 10993-1), Đánh giá sinh học trang thiết bị y tế - Phần 1: Đánh giá và thử nghiệm.
TCVN 7391-4 (ISO 10993-4), Đánh giá sinh học trang thiết bị y tế- Phần 4 Chọn phép thử tương tác với máu.
TCVN 7391-7 (ISO 10993-7), Đánh giá sinh học trang thiết bị y tế - Phần 7: Các chất tồn dư tiệt khuẩn ethylen oxit.
TCVN 7391-11 (ISO 10993-11), Đánh giá sinh học các thiết bị y tế - Phần 11: Các thử nghiệm độc tính hệ thống.
TCVN 7392 (ISO 11135), Trang thiết bị y tế - Đánh giá xác nhận và kiểm soát thường quy tiệt khuẩn ethylen oxit.
TCVN 7393-1 (ISO 11137-1), Tiệt khuẩn các sản phẩm chăm sóc sức khỏe - Bức xạ - Phần 1: Yêu cầu triển khai, đánh giá xác nhận và kiểm soát thường quy quá trình tiệt khuẩn đối với thiết bị y tế.
TCVN 8582 (ISO 14937), Tiệt khuẩn sản phẩm chăm sóc sức khỏe - Yêu cầu chung về đặc tính của tác nhân tiệt khuẩn, triển khai, đánh giá xác nhận và kiểm soát thường quy quá trình tiệt khuẩn thiết bị y tế.
TCVN 7394-1 (ISO 11607-1), Bao gói trang thiết bị y tế đã tiệt khuẩn - Phần 1: Yêu cầu đối với vật liệu, hệ thống bảo vệ vô khuẩn và hệ thống bao gói.
TCVN 7394-2 (ISO 11607-2) Bao gói trang thiết bị y tế đã tiệt khuẩn - Phần 2: Yêu cầu đánh giá xác nhận đối với quá trình tạo hình, niêm kín và lắp ráp.
ISO 594-2, Conical fittings with 6 % (Luer) taper for syringes, needles and certain other medical equipment - Part 2: Lock fittings (Các đầu nối côn với độ côn 6 % (Luer) dùng cho bơm tiêm, kim và một số thiết bị y tế khác - Phần 2: Các đầu nối khóa).
ISO 17665-1, Sterilizaton of health care products - Moist heat - Part 1: Requirements for the development, validation and routine control of a sterilization process for medical devices (Tiệt khuẩn các sản phẩm chăm sóc sức khỏe - Nhiệt ẩm - Phần 1: Những yêu cầu về phát triển, xác thực và kiểm soát thường quy quá trình tiệt khuẩn thiết bị y tế).
ISO 80369-7, Small-bore connectors for liquids and gases in healthcare applications - Part 7: Connectors for intravascular or hypodermic applications (Đầu nối nòng nhỏ cho chất lỏng và khí trong các ứng dụng chăm sóc sức khỏe - Phần 7: Đầu nối cho các ứng dụng nội mạch hoặc dưới da)
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này, áp dụng các thuật ngữ và định nghĩa sau:
3.1
Bộ lọc máu đường động mạch (arterial blood line filter)
Thiết bị phụ trợ sử dụng như một phần của hệ thống tuần hoàn ngoài cơ thể ở đường trở về của máu động mạch để lọc khỏi máu các thể hạt như cục máu đông, các mảnh vụn và cục nghẽn khí.
3.2
Đường dẫn máu (blood pathway)
Các đường dẫn chứa máu của bộ lọc máu động mạch (3.1) khi sử dụng trong lâm sàng
3.3
Tổn hại tế bào máu (blood cell damage)
Mất hay phá hủy các thành phần tế bào máu
3.4
Giảm tiểu cầu (platelet reduction)
Giảm phần trăm lượng tiểu cầu chứa trong một mạch dẫn, phụ thuộc vào thời gian
3.5
Mức haemoglobin tự do trong huyết tương (plasma-free haematoglobin level)
Hiệu giữa nồng độ haemaglobin tự do trong huyết tương ở một hệ tuần hoàn, phụ thuộc vào thời gian
3.5.1
Chỉ số bình thường hóa của tán huyết (normalized index of hemolysis)
NIH
Haematoglobin tự do trong huyết tương được giải phóng sau khi bơm 100 L máu
![]()
Trong đó:
∆fHb tăng nồng độ hemoglobin tự do trong huyết tương (g/L) trong khoảng thời gian lấy mẫu;
V thể tích mạch dẫn (L);
Q lưu lượng dòng chảy (L/min);
Hct hemactocrit (%);
T khoảng thời gian lấy mẫu (min)
3.6
Giảm bạch cầu (white blood cell reduction)
Giảm phần trăm tế bào bạch cầu chứa trong một mạch dẫn, phụ thuộc vào thời gian
3.7
Hiệu suất lọc (filtration efficiency)
Khả năng của bộ lọc loại bỏ các thể hạt từ dịch thử nghiệm mô phỏng dịch máu, thể hiện theo tỷ lệ phần trăm
3.8
Dịch tương tự máu (blood analogue)
Dịch thử nghiệm mô phỏng độ nhớt của máu giữa 2,0 x 10-3 Pa.s (2,0 cP) đến 3,5 x 10-3 Pa.s (3,5 cP)
3.9
Thiết bị khử bọt khí (bubble eliminator)
Thiết bị có thể khử bọt khí
3.10
Bộ lọc động mạch tương đương (predicate arterial filter)
Bộ lọc động mạch tương tự với bộ lọc động mạch thử nghiệm đã được chấp nhận trước đó và được sử dụng cho cùng một mục đích sử dụng lâm sàng.
4 Các yêu cầu
4.1 Đặc tính sinh học
4.1.1 Tính vô khuẩn và không gây sốt
Đường dẫn máu phải vô khuẩn và không chứa chất gây sốt.
Kiểm tra sự phù hợp theo Điều 5.2.1.
4.1.2 Tính tương thích sinh học
Tất cả các phần của đường dẫn máu phải tương thích sinh học với sử dụng dự định của chúng.
Kiểm tra sự phù hợp theo Điều 5.2.2.
4.2 Đặc tính vật lý
4.2.1 Sự toàn vẹn của đường dẫn máu
Khi thử nghiệm theo 5.3.1, đường dẫn máu phải không bị rò rỉ.
4.2.2 Thể tích máu
Thể tích của đường dẫn máu phải nằm bên trong độ dung sai quy định bởi nhà sản xuất (xem 6.3).
4.2.3 Đầu nối
Đầu nối để kết nối vào đường dẫn máu phải đảm bảo sự kết nối chắc chắn khi thử nghiệm theo 5.3.3, cho phép kết nối an toàn (xem Hình A.1 đến A.11 để biết ví dụ về đầu nối).
CHÚ THÍCH 1: Các đầu nối loại cho phép kết nối với các ống có đường kính trong 4,8 mm, 6,3 mm, 9,5 mm hay 12,7 mm hoặc của loại phù hợp với ISO 8637-1: 2017, Hình 1, hay của loại phù hợp với ISO 80369-7 được cho là đạt yêu cầu.
CHÚ THÍCH 2: Các đầu nối có kích thước như cho trong Phụ lục A và phù hợp với máy đo chức năng và đầu nối thép chuẩn là một cách để tuân thủ yêu cầu này.
Thử nghiệm tính năng của các đầu nối phải được thực hiện theo Điều 6 của ISO 80369-7:2016, sử dụng các đầu nối chuẩn được nêu trong Phụ lục A.
4.3 Đặc tính tính năng
4.3.1 Tổn hại tế bào máu
Khi xác định theo 5.4.1, sự thay đổi phần trăm (dương hay âm) haematoglobin tự do trong huyết tương, tiểu cầu, và tế bào bạch cầu, cần nằm trong phạm vi các giá trị quy định bởi nhà sản xuất.
Kết quả tán huyết phải được báo cáo theo mg/dL và NIH.
4.3.2 Hiệu suất lọc
Khi thử nghiệm theo 5.4.2, hiệu suất lọc của bất kỳ bộ lọc cần phải đạt ít nhất 80 % khi thử nghiệm với các thể hạt lớn hơn 20 % kích cỡ lỗ danh nghĩa của bộ lọc.
4.3.3 Lưu lượng
Khi thử nghiệm theo 5.4.3, kết quả thử nghiệm sẽ chứng tỏ lưu lượng và (các) hạn chế áp suất để đảm bảo hiệu năng an toàn và hiệu quả, giống như quy định bởi nhà sản xuất.
4.3.4 Thời hạn sử dụng
Khi thử nghiệm theo 5.4.4, kết quả thử nghiệm cần chứng tỏ thời hạn sử dụng định mức như quy định bởi nhà sản xuất.
4.3.5 Khả năng xử lý khí
Khi thử nghiệm theo 5.4.5, kết quả thử nghiệm cần chứng tỏ khả năng xử lý khí như quy định bởi nhà sản xuất
5 Các thử nghiệm và phép đo để xác định sự phù hợp tiêu chuẩn này
5.1 Yêu cầu chung
5.1.1 Cần thực hiện các thử nghiệm và phép đo với thiết bị cần thử nghiệm ở dạng đã tiệt khuẩn lần cuối và đã được chuẩn bị theo hướng dẫn của nhà sản xuất cho sử dụng lâm sàng dự định.
5.1.2 Các biến số vận hành phải là những biến số quy định bởi nhà sản xuất cho sử dụng lâm sàng dự định, trừ khi có quy định khác.
5.1.3 Trừ khi có công bố khác, nhiệt độ của các dịch thử nghiệm cần là (37 ± 1) °C.
5.1.4 Nếu sự quan hệ giữa các biến số không phải tuyến tính, cần thực hiện đủ các phép đo để cho phép nội suy hợp lệ giữa các điểm dữ liệu.
5.1.5 Những quy trình thử nghiệm và đo này được coi là quy trình tham khảo. Có thể chấp nhận các quy trình khác miễn là các quy trình thay thế này đã được chứng tỏ có độ chuẩn xác tương đương.
5.2 Đặc tính sinh học
5.2.1 Tính vô khuẩn và không gây sốt
Kiểm tra sự phù hợp bằng xác nhận tài liệu của nhà sản xuất về tiệt khuẩn và thử nghiệm tác nhân gây sốt theo ISO 17665-1, TCVN 7392 (ISO 11135), TCVN 7393-1 (ISO 11137-1), TCVN 8582 (ISO 14937), hoặc TCVN 7391-11 (ISO 10993-11), nếu thích hợp.
5.2.2 Tính tương thích sinh học
Kiểm tra sự phù hợp bằng xác nhận tài liệu của nhà sản xuất về tính tương thích sinh học đối với thiết bị hoàn thiện theo các TCVN 7391-1 (ISO 10993-1) và TCVN 7391-7-(ISO 10993-7).
5.3 Đặc tính vật lý
5.3.1 Xác định sự toàn vẹn đường dẫn máu (thành phẩm lắp ráp vô khuẩn)
Cho đường dẫn máu của thiết bị chứa đầy nước chịu tác động bởi áp suất dương lớn gấp 1,5 lần áp suất định mức của nhà sản xuất, hoặc nếu không cung cấp áp suất định mức, cho tác động bởi áp suất 152 kPa (22 psi) và duy trì áp suất này trong vòng 6 h hoặc trong khoảng thời gian sử dụng dự định theo quy định của nhà sản xuất. Kiểm tra thiết bị bằng mắt để tìm bằng chứng rò rỉ nước.
5.3.2 Thể tích máu
Dịch thử nghiệm phải là máu kháng đông bằng heparin hoặc nước.
Thể tích của đường dẫn máu cần được xác định theo quy định của nhà sản xuất.
5.3.3 Các đầu nối
Cần tạo thành các kết nối phù hợp với các hướng dẫn sử dụng của nhà sản xuất.
Kết nối cần chịu được lực kéo 15 N trong vòng 15 s mà không bị tách rời.
5.4 Đặc tính tính năng
5.4.1 Tổn hại tế bào máu
5.4.1.1 Môi trường thử nghiệm
Dịch thử nghiệm cho đường dẫn máu là máu kháng đông heparin.
5.4.1.2 Quy trình
Cần lắp ráp hai bộ linh kiện mạch giống hệt nhau, bao gồm máy bơm, ống nối, bình chứa (theo quy định của nhà sản xuất và có kích thước phù hợp với thiết bị được thử) và bộ trao đổi nhiệt. Thiết bị được thử phải được đặt trong một trong các mạch. Một thiết bị thêm phải được đặt trong mạch thử nghiệm thứ hai. Việc mồi và gỡ rối các mạch bằng cách tuần hoàn với một dung dịch thích hợp được khuyến nghị trước khi thêm máu. Các thể tích chất lỏng xét nghiệm con đường máu, khi bắt đầu xét nghiệm phải trong phạm vi 1 % của nhau. Thực hiện thử nghiệm in vitro bằng các điều kiện được đưa ra trong Bảng 1. Cần thực hiện đủ số lượng thử nghiệm ghép nối để hỗ trợ phân tích thống kê. Bình chứa thêm nên được kiểm tra trong cùng điều kiện. Sự phù hợp cần được xác minh bằng thử nghiệm hoặc kiểm tra tài liệu của nhà sản xuất về tổn thương tế bào máu đối với thiết bị đã hoàn thành, theo TCVN 7391-4 (ISO 10993-4), nếu có.
Bảng 1 - Các điều kiện thử nghiệm in vitro sự tổn hại tế bào máu
| Chi tiết | Mức độ | Biến thiên tối đa |
| Lưu lượng máu | Tối đa quy định bởi nhà sản xuất cho sử dụng dự định (xem 6.3) | ±5% |
| Glucose máu | 10 mmol/dl | ± 5 mmol/l |
| Haemoglobin | 12 g/dl | ± 1 g/dl |
Lịch trình lấy mẫu cần phù hợp với Bảng 2. Thời gian lấy mẫu thường xuyên hơn là tùy chọn.
Bảng 2 - Lịch trình lấy mẫu
| Thông số | Trước khi thử nghiệm | Thời gian sau khi bắt đầu thử nghiệm (min) | ||
| 30 | 180 | 360 | ||
| Haemoglobin tự do huyết tương | x | x | x | x |
| Bạch cầu | x | x | x | x |
| Tiểu cầu | x | x | x | x |
| Haemoglobin | x | x | x | x |
| Glucose | x |
|
|
|
| Thời gian đông máu hoạt hóa | x | x | x | x |
| Nhiệt độ | x | x | x | x |
| Lưu lượng | x | x | x | x |
5.4.2 Hiệu suất lọc
5.4.2.1 Dịch thử nghiệm
Dịch thử nghiệm là dung dịch glycerin hoặc nước. Dịch thử nghiệm phải chứa 350 đến 5000 thể hạt trong một mililít với kích thước lớn hơn 15 % đến 25 % so với kích cỡ lỗ danh nghĩa của bộ lọc.
5.4.2.2 Quy trình
Cho 500 ml dịch thử nghiệm ở nhiệt độ trong phòng (20 đến 22) °C đi qua bộ lọc máu đường động mạch với lưu lượng không ít hơn 100 ml/min và ở áp suất không quá 152 kPa (22 psi). Xác định số lượng hạt trung bình trước và sau khi lọc. Thử nghiệm cần được thực hiện ở các lưu lượng khuyến nghị bởi nhà sản xuất. Tính toán hiệu suất lọc, sử dụng kết quả thu được từ phạm vi kích cỡ của hạt thử nghiệm sử dụng cho mỗi mẫu, bằng cách lấy số lượng hạt trung bình trước khi lọc trừ đi số lượng hạt trung bình sau khi lọc, chia cho tổng số hạt trước lọc và nhân với 100 để thu được phần trăm.
5.4.3 Lưu lượng máu qua bộ lọc
5.4.3.1 Dịch thử nghiệm
Dịch thử nghiệm phải là dịch mô phỏng máu.
5.4.3.2 Quy trình
Đặt thiết bị cần thử nghiệm vào một hệ tuần hoàn thử nghiệm thích hợp. Đặt lưu lượng ở định mức tối đa và theo dõi áp suất đầu vào và đầu ra qua bộ lọc trong vòng 6 h. Đo lưu lượng bằng lưu lượng kế đã hiệu chuẩn. Ghi chú mọi thay đổi áp suất trong khi thử nghiệm.
Thử nghiệm này không tính đến ảnh hưởng của các tế bào máu hay các kết tụ protein.
5.4.4 Thời hạn sử dụng
Bằng cách sử dụng phương pháp dẫn chứng trong tài liệu, làm lão hóa nhân tạo các thiết bị hoàn thiện đã đóng gói để xác định thời hạn sử dụng danh nghĩa.
5.4.5 Khả năng xử lý khí
5.4.5.1 Dịch thử nghiệm
Dịch thử nghiệm phải là máu kháng đông heparin với lượng protein là (12 ± 1) g/dl.
5.4.5.2 Quy trình
Sử dụng ống thông khí của bộ lọc theo quy định tại IFU. Chiều dài và đường kính trong của ống thông khí phải được quy định. Áp suất hút ở lưu lượng thử nghiệm tối đa phải là 26,6 kPa (3,9 psi) ± 5 %. Sử dụng thiết bị khử bọt khí để đo mọi dòng khí đi xuống từ bộ lọc đã tích tụ trong khoảng thời gian 5 min kể từ khi bơm khí.
Ở các lưu lượng bằng 33 %, 67 % và 100 % lưu lượng tối đa quy định của nhà sản xuất, cần tiêm 30 ml (đối với bộ lọc động mạch cho trẻ em hoặc trẻ sơ sinh có tốc độ dòng chảy tối đa dưới 500ml/min, bolus phải là 2,5 ml và đối với tốc độ dòng chảy tối đa cao hơn 500ml/min, bolus phải được tăng thêm 2,5 ml cho mỗi 500ml/min tốc độ dòng chảy tối đa, bolus tối đa phải là 10 ml) phải được tiêm dưới dạng một bolus duy nhất, cần cung cấp chỉ dẫn về điểm tiêm bolus trong mạch thử nghiệm, tốc độ tiêm và loại bơm sử dụng để lưu thông chất lỏng thử trong quy trình thử nghiệm.
5.4.5.3 Kết quả thử nghiệm
Cần báo cáo kết quả là hiệu suất (phần trăm) loại bỏ khí toàn phần.
6 Thông tin cung cấp bởi nhà sản xuất
6.1 Thông tin cung cấp trên bộ lọc máu đường động mạch
Thông tin sau đây cần được cung cấp trên bộ lọc máu đường động mạch:
a) nhận dạng nhà sản xuất;
b) ký hiệu mẫu mã;
c) hướng dòng máu.
6.2 Thông tin cung cấp trên bao bì
6.2.1 Thông tin cung cấp trên bao bì đơn vị
Thông tin sau đây cần được cung cấp trên hộp chứa đơn vị:
a) tên và địa chỉ của nhà sản xuất;
b) mô tả các nội dung (đơn vị) bên trong;
c) ký hiệu mẫu mã;
d) công bố về tính vô khuẩn và tính không gây sốt;
e) hạn sử dụng;
f) ký hiệu số sêri hoặc số lô/mẻ;
g) một công bố “Đọc các hướng dẫn trước khi sử dụng” hoặc ký hiệu tương đương;
h) các điều kiện vận chuyển và bảo quản đặc biệt;
i) công bố sử dụng một lần.
6.2.2 Thông tin cần cung cấp trên hộp vận chuyển
Thông tin sau đây cần được cung cấp trên hộp vận chuyển:
a) tên và địa chỉ của nhà sản xuất;
b) mô tả các nội dung bên trong, kể cả số lượng đơn vị;
c) ký hiệu mẫu mã;
d) hạn sử dụng;
e) các điều kiện vận chuyển và bảo quản đặc biệt hoặc các hướng dẫn mở bao bì.
6.3 Thông tin cần cung cấp trong các tài liệu kèm theo
Mỗi hộp vận chuyển cần chứa một tờ “các hướng dẫn sử dụng” với thông tin sau:
a) địa chỉ và số điện thoại, số fax của nhà sản xuất;
b) ký hiệu mẫu mã;
c) thiết bị bổ sung cần thiết;
d) các hướng dẫn về những quy trình cần thiết, đặc biệt hay đặc trưng riêng có thể áp dụng;
e) hướng đặt bộ lọc trong thiết bị hỗ trợ hoặc vận hành;
f) sự xếp đặt, loại và sự mức độ đảm bảo của các kết nối ống;
g) vị trí và mục đích của các cửa ra, vào bổ sung;
h) quy trình mồi;
i) hướng của dòng máu;
j) các quy trình vận hành chung cho sử dụng bình thường;
k) khả năng xử lý khí;
l) lưu lượng máu tối thiểu và tối đa khuyến nghị;
m) thể tích mồi;
n) một công bố thông tin sau đây có sẵn nếu yêu cầu:
1) danh sách các vật liệu tạo thành đường dẫn máu;
2) áp lực đường máu giảm trên phạm vi lưu lượng máu theo quy định của nhà sản xuất;
3) dữ liệu liên quan đến tổn thương tế bào máu;
4) các độ dung sai liên quan với dữ liệu trình bày;
o) một công bố về tính tiệt khuẩn, phương pháp tiệt khuẩn và tính không gây sốt.
6.4 Thông tin cung cấp trong các tài liệu kèm theo ở dạng nổi bật
Thông tin sau đây cần được cung cấp ở dạng nổi bật trong các tài liệu kèm theo:
a) các hạn chế lưu lượng;
b) các hạn chế khác của thiết bị, chẳng hạn, tính không tương thích vật liệu với các chất gây mê dễ bay hơi, các dung môi hay các chất sát trùng.
7 Bao gói
Đóng bao bì cần phù hợp với các yêu cầu thích hợp của TCVN 7394-1 (ISO 11607-1) và TCVN 7394-2 (ISO 11607-2).
Phụ lục A
(tham khảo)
Ví dụ về các đầu nối và khớp nối tham chiếu
A.1 Đầu nối trượt tham chiếu
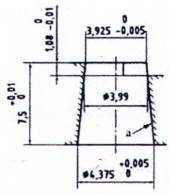
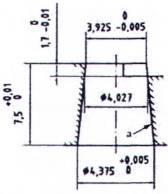
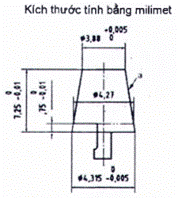
A.1.1 Hình A.1 và A.2 mô tả các đầu nối trượt Luer. Đối với các kích thước tương ứng, xem Bảng A.1.
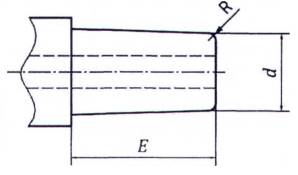
a) Đầu nối hình nón đực 6% (Luer) ( "đầu nối đực")
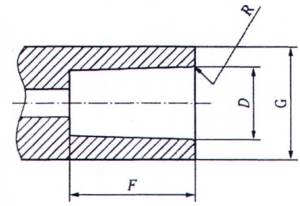
b) Đầu nối hình nón cái 6% (Luer) ( "đầu nối cái")
CHÚ THÍCH: Xem chú dẫn và kích cỡ trong-Bảng B.1
Hình B.1 - Đầu nối hình nón điển hình 6% (Luer)
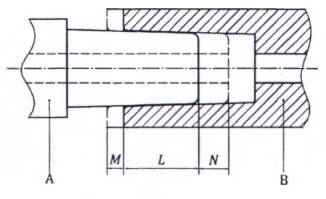
CHÚ THÍCH: Xem chú dẫn và kích cỡ trong Bảng A.1
Hình A.2 - Cụm đầu nối hình nón điển hình 6% (Luer)
Bảng A.1 - Kích thước của đầu nối hình nón 6% (Luer)
| Tham chiếu | Quy định | Kích thước | |||
| Vật liệu cứng | Vật liệu bán cứng | ||||
| A | Đầu nối đực | N/A | N/A | ||
| B | Đầu nối cái | N/A | N/A | ||
| Kích thước cơ bản | d | min. | Đường kính tối thiểu của phần cuối của đầu nối hình nón đực (đường kính chuẩn) | 3,925 | 3,925 |
| max. | Đường kính tối đa của phần cuối của đầu nối hình nón đực | 3,990 | 4,027 | ||
| D | min. | Đường kính tối thiểu ở phần mở đầu nối hình nón cái | 4,270 | 4,270 | |
| max. | Đường kính tối đa ở phần mở đầu nối hình nón cái | 4,315 | 4,315 | ||
| E | Độ dài tối thiểu của đầu nối hình nón đực | 7,500 | 7,500 | ||
| F | Độ sâu tối thiểu của đầu nối hình nón cái | 7,500 | 7,500 | ||
| G | Đường kính bên ngoài tối đa của đầu nối hình nón cái | 6,730 | 6,730 | ||
| Các kích thước khác | La | Độ dài khớp nối tối thiểu | 4,665 | 4,050 | |
| Ma | Dung sai đối với độ dài khớp nối của đầu nối hình nón cái | 0,750 | 0,750 | ||
| Na | Dung sai đối với độ dài khớp nối của đầu nối hình nón đực | 1,083 | 1,700 | ||
| Rb | Bán kính cong (tối đa) | 0,5 | 0,5 | ||
| a Các kích thước L, M và N được suy ra từ các kích thước cơ bản b Hoặc vát cạnh tương đương mà không có bất kỳ góc sắc nhọn nào. | |||||
A.1.2 Thử nghiệm đo
A.1.2.1 Khi được thử theo A. 1.2.4, đầu nối hình nón phải thỏa mãn các yêu cầu quy định trong A. 1.2.2 và A.1.2.3.
A.1.2.2 Đầu nhỏ của đầu nối hình nón đực phải nằm giữa hai mặt phẳng giới hạn của máy đo và đầu lớn hơn của phần hình côn phải kéo dài ra ngoài mặt phẳng mốc của máy đo. Không được thấy hiện tượng rung lắc giữa máy đo và đầu nối làm bằng vật liệu cứng đang được thử nghiệm.
A.1.2.3 Mặt phẳng có đường kính lớn nhất tại lỗ mở của đầu nối hình côn cái phải nằm giữa hai mặt phẳng giới hạn của máy đo. Không được thấy hiện tượng rung lắc giữa máy đo và đầu nối làm bằng vật liệu cứng đang được thử nghiệm.
A.1.2.4 Quy trình phải được thực hiện như quy định trong A.1.2.4.1 đến A.1.2.4.4.
A.1.2.4.1 Tiến hành thử nghiệm bằng máy đo bằng thép như minh họa trong Hình A.3.
A.1.2.4.2 Tiến hành thử nghiệm ở nhiệt độ (20 ± 5) °C.
A.1.2.4.3 Trước khi thử nghiệm, điều kiện sản phẩm làm từ vật liệu hút ẩm ở (20 ± 5) °C và (50 ± 10)% độ ẩm tương đối trong thời gian không ít hơn 24 h. Không cần điều hòa đối với các sản phẩm làm từ vật liệu không hút ẩm.
A.1.2.4.4 Tác dụng máy đo lên đầu nối hình nón với tổng lực dọc trục là 5 N, không sử dụng mômen xoắn. Bỏ tải dọc trục.
|
|
|
|
| a) Máy đo thử nghiệm đầu nối hình nón đực cứng | b) Máy đo thử nghiệm các đầu nối hình nón bán cứng | c) Máy đo thử nghiệm các đầu nối hình nón cái của tất cả các vật liệu |
CHÚ THÍCH: Độ côn hình nón (0,06: 1)
Hình A.3 - Máy đo thử nghiệm đầu nối hình nón 6% (Luer)
A.1.3 Đầu nối thép tham chiếu
A.1.3.1 Hình A.4 và A.5 mô tả các đầu nối thép tham chiếu đực và cái.
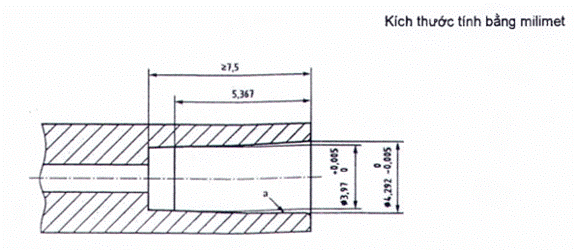
CHÚ THÍCH: Độ côn hình nón (0,06: 1)
Hình A.4 - Đầu nối hình nón cái thép tham chiếu
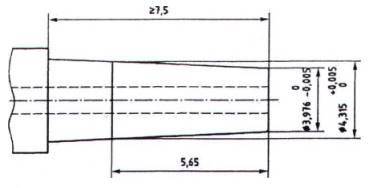
CHÚ THÍCH: Độ côn hình nón (0,06: 1)
Hình A.5 - Đầu nối hình nón đực thép tham chiếu
A.2 Đầu nối khóa Luer
A.2.1 Hình A.6 đến A.9 mô tả đầu nối khóa Luer trong khi Hình A.10 và A.11 mô tả đầu nối thép tham chiếu để thử nghiệm đầu nối khóa đực 6 % (Luer). Đối với các kích thước tương ứng, xem Bảng A.2.
Nếu đầu nối khóa hình nón cái 6 % (Luer) như trong Hình A.8 có các vấu nằm trên mặt phẳng nghiêng với trục của khớp nối, các vấu phải tạo thành một phần của dạng ren như trong Hình A.9. Trong trường hợp này, 'V' không áp dụng.
Tất cả các cạnh bên ngoài của vấu hoặc dạng ren như trong Hình A.10 và A.11 phải có bán kính giữa 0,15 mm và 0,2 mm (trừ khi có quy định khác).
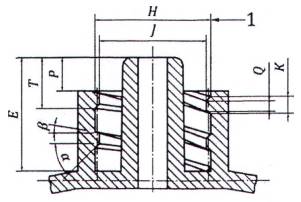
CHÚ DẪN:
1 khởi động kép, ren bên phải có bước sóng 2,5 mm
CHÚ THÍCH: Xem chú dẫn và các kích thước trong Bảng A.2
Hình A.6 - Đầu nối khóa hình nón đực 6% (Luer) với vòng ren bên trong được kết nối cố định
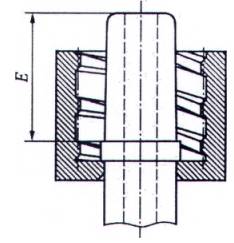
CHÚ THÍCH 1: Đối với các kích thước khác, xem Hình A.6.
CHÚ THÍCH 2: Xem chú dẫn và các kích thước trong Bảng A.2
Hình A.7 - Đầu nối khóa hình nón đực 6% (Luer) với vòng ren trong có thể xoay được
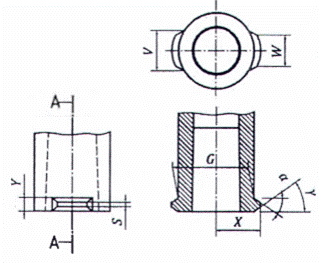
a) Biến thể A19
b) Biến thể B
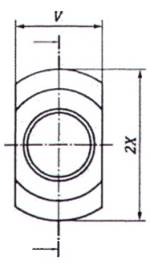
c) Biến thể C
CHÚ THÍCH 1: Các biến thể B và C chỉ được sử dụng để thiết kế các đầu nối cứng.
CHÚ THÍCH 2: Để đảm bảo tính tương thích với các đầu nối cứng hiện có, ưu tiên K = 0,8 mm tối đa.
CHÚ THÍCH 3: Xem chú dẫn và kích thước trong Bảng A.2.
Hình A.8 - Đầu nối khóa hình nón cái 6 % (Luer) với các vấu trong mặt phẳng vuông góc với trục của khớp nối
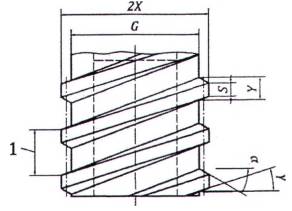
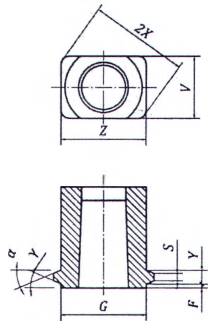
CHÚ DẪN:
1 Bước răng
CHÚ THÍCH 1: Đối với các kích thước khác, xem Hình A.8.
CHÚ THÍCH 2: Xem Chú dẫn và kích thước cho trong Bảng A.2.
Hình A.9 - Đầu nối hình nón khóa cái 6 % (Luer) với ren ngoài
Bảng A.2 - Kích thước của đầu nối khóa hình nón cứng 6% (Luer)
Kích thước tính bằng milimét
| Ký hiệu | Quy định | Kích thước | |
| Hình A.6, A.7, A.8 và A.9 | Hình A.8 b) và A.8 c) | ||
| α | Góc của ren hoặc bề mặt mang vấu chống lại sự phân tách với mặt phẳng vuông góc với trục của đầu nối khoá |
|
|
| β | Góc nhỏ nhất của bề mặt không chịu lực ren trong chống lại sự phân tách với mặt phẳng vuông góc với trục của đầu nối khoá | 25° | — |
| γ | Góc nhỏ nhất của ren ngoài hoặc bề mặt không chịu lực vầu chống lại sự phân tách với mặt phẳng vuông góc với trục của đầu nối khoá | 0° | 0° |
| E | Độ dài tối thiểu của đầu nối khoá đực | 7,5 | — |
| F | Khoảng cách danh nghĩa từ mặt của khớp nối đến đế của vấu | — | 0,20 |
| G | Đường kính ngoài tối đa của đầu nối khoá cái lắp ở đế vấu hoặc đường kính trong tối đa của ren ngoài; Đường kính này không được tăng lên trong khoảng cách từ mặt trục là 5,5 mm | 6,73 | 5,7 |
| H | Đường kính gốc của ren của đầu nối khoá đực | 8,0 ± 0,1 | — |
| J | Đường kính đỉnh của ren của đầu nối khoá đực | 7,0 ± 0,2 | — |
| K | Độ rộng ren tối đa của đầu nối khoá đực ở gốc | 1 | — |
| P | Hình chiếu tối thiểu của vòi phun từ vành | 2,1 | — |
| Q | Độ rộng đỉnh ren tối thiểu của đầu nối khoá đực | 0,3 | — |
| S | Độ rộng đỉnh vấu hoặc độ rộng đỉnh ren của đầu nối khoá cái với vấu hoặc ren ngoài | tối thiểu 0,3 | tối đa 0,27 |
| T | Khoảng cách tối đa từ đầu của đầu nối khoá đực đến đáy của dạng ren hoàn chỉnh đầu tiên của ren trong | 3,2 | — |
| V | Độ dài dây tối đa tại đáy của vấu trong mặt phẳng chỉ vuông góc với trục của đầu nối, được đo trên dây của một đường tròn có đường kính tối thiểu là J . (7,0 mm) | 3,5 | 5,0 |
| W | Độ dài dây tối thiểu tại cực điểm của vấu trong một mặt phẳng chỉ vuông góc với trục của đầu nối (W không được lớn hơn V) | 2,71 | — |
| X | Khoảng cách từ trục của đầu nối khóa cái đến cực điểm của vấu | — | — |
| 2X | Đường kính ngoài qua vấu hoặc ren ngoài |
|
|
| Y | Độ rộng tối đa của đế vấu (trục) hoặc ren ở đế, của đầu nối khóa cái được đo tại điểm tương ứng với đường kính ngoài bằng G (tối đa 6,73) | 1,2 | 1,30 |
| Z | Chiều rộng trên các vấu ở ren ngoài | — |
|
| Bước răng | Bước danh nghĩa của ren khởi động kép, bên phải của đầu nối khóa cái - dây dẫn 5 mm | 2,5 | — |
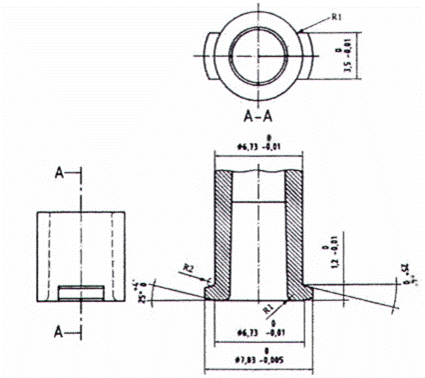
CHÚ DẪN:
R1 Bán kính tối đa 0,5 mm
R2 Bán kính tối đa 0,2 mm
Hình A.10 - Đầu nối hình nón cái tham chiếu để thử nghiệm các đầu nối khóa đực 6 % (Luer) về khả năng rò rỉ, dễ lắp ráp, mô-men xoắn tháo xoắn và nứt ứng suất
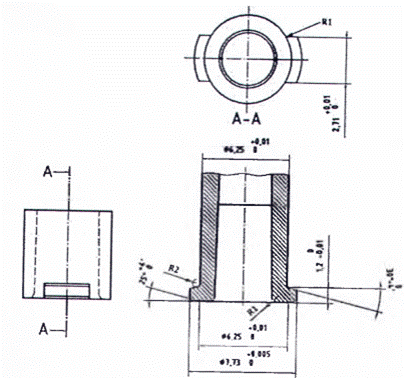
CHÚ DẪN:
R1 Bán kính tối đa 0,5 mm
R2 bán kính tối đa 0,2 mm
Hình A.11 - Đầu nối hình nón cái tham chiếu để thử nghiệm các đầu nối đực khóa 6 % (Luer) cho lực tách và khả năng chống đè
Thư mục tài liệu tham khảo
[1] ISO 7199, Cardiovascular implants and artificial organs - Blood-gas exchangers (oxiganators). (Vật cấy ghép tim mạch và các cơ quan nhân tạo - Thiết bị trao đổi khí-máu (thiết bị cấp oxy máu).
[2] ISO 8637-1:2017, Extracorporeal systems for blood purification - Part 1: Haemodialysers, haemodiafilters, haemofilters and haemoconcentrators (Hệ thống ngoài cơ thể cho lọc máu - Phần 1: Thiết bị thẩm tách máu, thẩm lọc máu, lọc máu và thiết bị cô máu)
[3] TCVN 7391-10 (ISO 10993-10) Đánh giá sinh học đối với Trang thiết bị y tế - Phần 10: Phép thử kích thích và quá mẫn muộn.
[4] TCVN ISO 13485, Trang thiết bị y tế - Hệ thống quản lý chất lượng - Yêu cầu đối với mục đích chế định.
[5] TCVN ISO 14971, Trang thiết bị y tế - Áp dụng quản lý rủi ro đối với trang thiết bị y tế.
[6] TCVN 6916-1 (ISO 15223-1) Trang thiết bị y tế - Ký hiệu sử dụng với nhãn trang thiết bị y tế, ghi nhãn và cung cấp thông tin - Phần 1 - Yêu cầu chung.
[7] TCVN 6916-2 (ISO 15223-2) Trang thiết bị y tế - Ký hiệu sử dụng với nhãn trang thiết bị y tế, ghi nhãn và cung cấp thông tin - Phần 2 - Phát triển, chọn lựa và đánh giá ký hiệu.
[8] ISO/TS 23810, Cardiovascular implants and artificial organs - Checklist for preoperative extracorporeal circulation equipment setup (Vật cấy ghép tim mạch và các cơ quan nhân tạo - Danh mục kiểm tra đối với việc thiết lập thiết bị tuần hoàn máu ngoài cơ thể trước khi phẫu thuật).
[9] ANSI/AAMI AT6, Autologous transfusion devices (Thiết bị truyền máu tự động).
MỤC LỤC
1 Phạm vi áp dụng
2 Tài liệu viện dẫn
3 Thuật ngữ và định nghĩa
4 Yêu cầu
5 Các thử nghiệm và phép đo để xác định sự phù hợp tiêu chuẩn này
6 Thông tin cung cấp bởi nhà sản xuất
7 Bao gói
Phụ lục A (tham khảo) - Ví dụ về các đầu nối và khớp nối tham chiếu
Thư mục tài liệu tham khảo
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 13389:2021 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 13389:2021 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 13389:2021 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 13389:2021 DOC (Bản Word)