- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn TCVN 11924:2017 Phát hiện Yersinia enterocolitica, Yersinia pseudotuberculosis trong thực phẩm
| Số hiệu: | TCVN 11924:2017 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Y tế-Sức khỏe , Thực phẩm-Dược phẩm |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
2017 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 11924:2017
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 11924:2017
TIÊU CHUẨN QUỐC GIA
TCVN 11924:2017
ISO/TS 18867:2015
VI SINH VẬT TRONG CHUỖI THỰC PHẨM - PHẢN ỨNG CHUỖI POLYMERASE (PCR) ĐỂ PHÁT HIỆN VI SINH VẬT GÂY BỆNH TỪ THỰC PHẨM - PHÁT HIỆN YERSINIA ENTEROCOLITICA GÂY BỆNH VÀ YERSINIA PSEUDOTUBERCULOSIS
Microbiology of the food chain - Polymerase chain reaction (PCR) for the detection of food- borne pathogens - Detection of pathogenic Yersinia enterocolitica and Yersinia pseudotuberculosis
Lời nói đầu
TCVN 11924:2017 hoàn toàn tương đương với ISO/TS 18867:2015;
TCVN 11924:2017 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC/F13 Phương pháp phân tích và lấy mẫu biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Lời giới thiệu
Yersinia enterocolitica và Yersinia pseudotuberculosis là các vi khuẩn gây bệnh ở động vật gây ngộ độc thực phẩm cho người (yersiniosis). Vật chủ chính của Y. enterocolitica gây bệnh là lợn nuôi[3] và của Y. pseudotuberculosis là hàng loạt các vật nuôi và động vật hoang dã như các loài gặm nhấm, hươu, chim và động vật ở các trang trại khác nhau là các nguồn gây bệnh tiềm tàng [4]. Một số biotyp của Y. enterocolitica liên quan đến nhiễm trùng ở người. Ngược lại tất cả các Y. pseudotuberculosis được coi là có khả năng gây bệnh cho người. [9]
Gen ail cố định trên nhiễm sắc thể (gắn vào locus xâm lấn) có mặt trong tất cả các bio (sero) typ của Y. enterocolitica liên quan đến bệnh và biến thể của nó cũng có mặt trong Y. pseudotuberculosis[8]. Trong tiêu chuẩn này sử dụng gen ail là gen đích để phát hiện và bộ mồi/đầu dò bố trí các vị trí đích khác nhau của gen ail đối với hai loại vi khuẩn gây bệnh này [7] [8] [13], [14].
VI SINH VẬT TRONG CHUỖI THỰC PHẨM - PHẢN ỨNG CHUỖI POLYMERASE (PCR) ĐỂ PHÁT HIỆN VI SINH VẬT GÂY BỆNH TỪ THỰC PHẨM - PHÁT HIỆN YERSINIA ENTEROCOLITICA GÂY BỆNH VÀ YERSINIA PSEUDOTUBERCULOSIS
Microbiology of the food chain - Polymerase chain reaction (PCR) for the detection of food- borne pathogens - Detection of pathogenic Yersinia enterocolitica and Yersinia pseudotuberculosis
1 Phạm vi áp dụng
Tiêu chuẩn này quy định hai phương pháp phát hiện các bioserotyp gây bệnh của Yersinia enterocolitica và một phương pháp phát hiện Yersinia pseudotuberculosis dựa trên phương pháp real-time PCR (phản ứng chuỗi polymerase thời gian thực). Các phương pháp này cho phép phát hiện hai vi khuẩn gây bệnh trong môi trường tăng sinh và cho phép phân lập các khuẩn lạc Yersinia pestis, tác nhân gây bệnh dịch hạch và viêm phổi mang các biến thể gen ail được phát hiện bằng bộ mồi/đầu dò dùng cho Y. pseudotuberculosis. Tuy nhiên, Y. pestis thường không liên quan đến thực phẩm. Tiêu chuẩn này có thể áp dụng cho các sản phẩm thực phẩm cho người, thức ăn chăn nuôi và các mẫu môi trường.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 6507-1 (ISO 6887-1) Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử; huyền phù ban đầu và các dung dịch pha loãng thập phân để kiểm tra vi sinh vật - Phần 1: Các nguyên tắc chung để chuẩn bị huyền phù ban đầu và các dung dịch pha loãng thập phân
TCVN 7682 (ISO 20838) Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phản ứng chuỗi polymerase (PCR) để phát hiện sinh vật gây bệnh từ thực phẩm - Yêu cầu về khuếch đại và phát hiện đối với các phương pháp định tính
TCVN 8127 (ISO 10273) Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phát hiện Yersinia enterocolitica gây bệnh giả định
TCVN 11133 (ISO 22119) Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phản ứng chuỗi polymerase real-time (PCR real-time) để phát hiện vi sinh vật gây bệnh từ thực phẩm - Định nghĩa và yêu cầu chung
TCVN 11134 (ISO 22174) Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phản ứng chuỗi polymerase (PCR) để phát hiện vi sinh vật gây bệnh từ thực phẩm - Định nghĩa và yêu cầu chung
TCVN 11925 (ISO 20837) Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phản ứng chuỗi polymerase (PCR) để phát hiện vi sinh vật gây bệnh từ thực phẩm - Yêu cầu về chuẩn bị mẫu để phát hiện định tính
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này áp dụng các thuật ngữ và định nghĩa nêu trong TCVN 11134 (ISO 22174) và TCVN 11133 (ISO 22119).
4 Nguyên tắc
4.1 Yêu cầu chung
Phương pháp này bao gồm các bước liên tiếp sau đây:
a) Tăng sinh vi khuẩn (4.2);
b) Tách chiết axit nucleic (4.3);
c) Khuếch đại và phát hiện (4.4);
d) Phân lập (4.5).
4.2 Tăng sinh vi khuẩn
Số lượng tế bào vi khuẩn Y. enterocolitica gây bệnh và Y. pseudotuberculosis được tăng lên bằng cách cho phát triển trong môi trường dinh dưỡng lỏng không chọn lọc hoặc bán chọn lọc.
4.3 Tách chiết axit nucleic
Tế bào vi khuẩn được tách ra khỏi canh thang dinh dưỡng, được dung giải và tách chiết axit nucleic để dùng trong phản ứng PCR.
4.4 Khuếch đại và phát hiện
Các axit nucleic đã tách chiết được khuếch đại sử dụng đầu dò real-time PCR. Phát hiện các trình tự đích bằng cách theo dõi sự gia tăng rõ ràng tín hiệu huỳnh quang trên ngưỡng chu trình, Ct.
CHÚ THÍCH: Đầu dò real-time PCR kết hợp khuếch đại, phát hiện và khẳng định ADN đích.
4.5 Phân lập
Sau khi thu được kết quả PCR dương tính, vi sinh vật đích có thể được phân lập bằng cách sử dụng các phương pháp nuôi cấy mô tả trong tiêu chuẩn này.
5 Thuốc thử
5.1 Quy định chung
Đối với các bước trong 4.1 b) -c), phải sử dụng các thuốc thử dùng cho sinh học phân tử và vật tư tiêu hao thích hợp cho sinh học phân tử như trong TCVN 11925 (ISO 20837) và TCVN 7682 (ISO 20838).
Các yêu cầu được quy định trong TCVN 7682 (ISO 20838).
Cần sử dụng môi trường nuôi cấy và các thuốc thử sau đây.
5.2 Môi trường nuôi cấy
5.2.1 Yêu cầu chung
Xem TCVN 6404 (ISO 7218) và TCVN 8128 (ISO 11133) để chuẩn bị, sản xuất và thử nghiệm hiệu năng của môi trường nuôi cấy.
5.2.2 Chất pha loãng
Xem TCVN 6507-1 (ISO 6887-1) và các phần liên quan của TCVN 6507 (ISO 6887) phù hợp với sản phẩm cần thử nghiệm.
5.2.3 Môi trường tăng sinh
5.2.3.1 Canh thang trypton đậu tương có bổ sung nấm men, TSBY
5.2.3.1.1 Thành phần
Sản phẩm thủy phân casein bằng enzym tuyến tụy 17,0 g
Sản phẩm thủy phân đậu tương bằng enzym papain 3,0 g
Natri clorua (NaCl) 5,0 g
Dikali hydro Phosphat (K2HPO4) 2,0 g
Glucose 2,5 g
Chất chiết nấm men 6,0 g
Nước 1 000 ml
5.2.3.1.2 Chuẩn bị
Hòa tan các thành phần trên trong 1 000 ml nước cất. Chỉnh pH, nếu cần, sao cho sau khi khử trùng, pH là 7,3 ± 0,2. Phân phối môi trường này vào các bình hoặc ống có dung tích thích hợp để chứa được các phần mẫu thử thích hợp. Khử trùng 15 min ở 121 °C ± 1 °C.
Bảo quản ở nhiệt độ phòng ở nơi tối không quá 4 tuần.
Ngoài ra, có thể sử dụng canh thang trypton đậu tương (TSB) khô 30 g/l có bổ sung 0,6 % chất chiết nấm men, có pH 7,3 ± 0,2.
5.2.3.2 Canh thang pepton-sorbitol-mật-muối, PSB[15]
5.2.3.2.1 Thành phần
Pepton 5,0 g
Sorbitol 10,0 g
Natri clorua (NaCl) 5,0 g
Dinatri hydro phosphat (Na2HPO4) 8,23 g
Natri dihydro phosphat ngậm một phân tử nước (NaH2PO4.H2O) 1,2 g
Muối mật 1,5 g
Nước 1 000ml
5.2.3.2.2 Chuẩn bị
Hòa tan các thành phần trên hoặc môi trường hoàn chỉnh khô trong nước, đun nóng nếu cần.
Chỉnh pH, nếu cần, sao cho sau khi khử trùng, pH là 7,6 ± 0,2.
Phân phối môi trường này vào các bình hoặc ống có dung tích thích hợp để chứa được các phần mẫu thử thích hợp. Khử trùng 15 min ở 121 °C ± 1 °C.
5.2.3.3 Canh thang tăng sinh lạnh, PMB [5]
5.2.3.3.1 Thành phần
Dinatri hydro Phosphat (Na2HPO4) 7,6 g
Kali dihydro phosphat (KH2PO4) 1,0 g
Natri clorua (NaCl) 8,5 g
Manitol 10,0 g
Muối mật Số 3 1,5 g
Nước 1 000 ml
5.2.3.3.2 Chuẩn bị
Hòa tan các thành phần trên hoặc môi trường hoàn chỉnh khô trong nước, đun nóng nếu cần.
Chỉnh pH, nếu cần, sao cho sau khi khử trùng, pH là 7,6 ± 0,2.
Phân phối môi trường này vào các bình hoặc ống có dung tích thích hợp để chứa được các phần mẫu thử thích hợp. Khử trùng 15 min ở 121 °C ± 1 °C.
5.2.4 Môi trường đặc chọn lọc
5.2.4.1 Thạch cefsulodin irgasan novobioxin, CIN[10]
5.2.4.1.1 Môi trường cơ bản, thành phần
Sản phẩm thủy phân gelatin bằng enzym 17,0 g
Sản phẩm thủy phân casein và mô động vật bằng enzym 3,0 g
Chất chiết nấm men 2,0 g
Manitol 20,0 g
Natri pyruvat 2,0 g
Natri clorua (NaCl) 1,0 g
Magie sulfat (MgSO4.7H2O) 0,01 g
Natri desoxycholat 0,5 g
Đỏ trung tính 0,03 g
Tím tinh thể 0,001 g
Thạch 12,5 g
Nước 1 000 ml
5.2.4.1.2 Chuẩn bị
Hòa tan các thành phần trên hoặc môi trường hoàn chỉnh khô trong nước, đun nóng nếu cần.
Chỉnh pH, nếu cần, sao cho sau khi khử trùng, pH là 7,4 ± 0,2 ở 25 °C. Phân phối môi trường này vào các bình hoặc ống có dung tích thích hợp. Khử trùng 15 min ở 121 °C ± 1 °C.
5.2.4.2 Các chất bổ sung
5.2.4.2.1 Dung dịch cefsulodin (15 mg/ml)
Hòa tan 1,5 g cefsulodin trong 100 ml nước. Khử trùng bằng cách lọc.
5.2.4.2.2 IrgasanTM [5-clo-2- [2,4-diclophenoxy) phenol], trong dung dịch etanol (4 mg/ml).
Hòa tan Irgasan trong etanol, bảo quản dung dịch này ở khoảng -20 °C không quá 4 tuần.
5.2.4.2.3 Dung dịch novobioxin (2,5 mg/ml)
Hòa tan novobioxin trong nước. Khử trùng bằng cách lọc.
5.2.4.3 Thành phần của môi trường hoàn chỉnh
Môi trường cơ bản (5.2.4.1.1) 997 ml
Dung dịch cefsulodin (5.2.4.2.1) 1 ml
Dung dịch irgasan (5.2.4.2.2) 1 ml
Dung dịch novobioxin (5.2.4.2.3) 1 ml
5.2.4.4 Chuẩn bị
Bằng kỹ thuật vô trùng, cho từng dung dịch kháng sinh vào môi trường cơ bản, làm nguội đến khoảng 45 °C, trộn đều. Rót khoảng 15 ml môi trường hoàn chỉnh này vào mỗi đĩa petri vô trùng.
5.2.5 Dung dịch nước muối kali hydroxit (KOH)
5.2.5.1 Thành phần
Kali hydroxit (KOH) 0,25 g/0,50 g
Dung dịch muối 100 ml
CHÚ THÍCH: Nên sử dụng dung dịch KOH 0,5 % mới chuẩn bị cho Y. enterocolitica gây bệnh và dung dịch 0,25 % cho Y. pseudotuberculosis.
5.2.5.2 Chuẩn bị
Hòa tan kali hydroxit trong dung dịch nước muối. Phân phối dung dịch vào các bình có dung tích thích hợp. Khử trùng 15 min ở 121 °C ± 1 °C. Chuẩn bị dung dịch trong ngày trước khi sử dụng.
5.3 Tách chiết axit nucleic
Sử dụng quy trình tách chiết axit nucleic và thuốc thử thích hợp cho vi khuẩn Gram âm.
CHÚ THÍCH: Có thể sử dụng bộ kit thử thương mại.
5.4 Thuốc thử dùng cho PCR
Xem TCVN 11133 (ISO 22119) và TCVN 7682 (ISO 20838).
5.5 Mồi và đầu dò
Các mồi và đầu dò để phát hiện Y. enterocolitica gây bệnh và Y. pseudotuberculosis được liệt kê trong Phụ lục B và Phụ lục C.
6 Thiết bị, dụng cụ
6.1 Yêu cầu chung
Sử dụng các thiết bị, dụng cụ thông thường của phòng thử nghiệm vi sinh [xem TCVN 6404 (ISO 7218), TCVN 11925 (ISO 20837) và TCVN 11133 (ISO 22119)) và cụ thể như sau:
6.2 Dụng cụ để chuẩn bị mẫu trước khi tăng sinh
Bộ trộn nhu động và các túi vô trùng có bộ lọc.
CHÚ THÍCH: Nên sử dụng bộ lọc có cỡ lỗ nhỏ thích hợp cho PCR.
6.3 Thiết bị tăng sinh vi khuẩn
Tủ ấm, có khả năng hoạt động ở 25 °C ± 1 °C và 30 °C ± 1 °C.
6.4 Dụng cụ, thiết bị tách chiết axit nucleic
6.4.1 Ống ly tâm micro, có dung tích 1,5 ml và 2,0 ml.
6.4.2 Máy ly tâm, dùng cho các ống phản ứng có dung tích 1,5 ml và 2,0 ml và có khả năng đạt được gia tốc khoảng 14 000 x g.
6.4.3 Khối nhiệt, có thể làm nóng lên đến 100 °C.
6 4.4 Pipet chia vạch và đầu lọc pipet, có thể tích từ 1 μl đến 1000 μl.
6.4.5 Bộ trộn.
6.5 Thiết bị, dụng cụ dùng cho real-time PCR
6.5.1 Máy chu trình nhiệt real-time PCR.
6.5.2 Đĩa 96 giếng và/hoặc các dải 8 giếng.
7 Lấy mẫu
Việc lấy mẫu không quy định trong tiêu chuẩn này. Nếu không có tiêu chuẩn cụ thể liên quan đến việc lấy mẫu sản phẩm thì các bên có liên quan cần thống nhất về việc lấy mẫu.
8 Cách tiến hành
Xem sơ đồ trong Phụ lục A.
8.1 Chuẩn bị mẫu trước khi tăng sinh
8.1.1 Yêu cầu chung
Nên phân tích ít nhất 25 g hoặc 25 ml mẫu. Tuy nhiên, nếu lượng mẫu bị hạn chế thì có thể sử dụng cỡ mẫu nhỏ hơn.
8.1.2 Chuẩn bị mẫu
Chuẩn bị và đồng hóa mẫu theo TCVN 6507-1 (ISO 6887-1) và các phần có liên quan trong TCVN 6507 (ISO 6887) phù hợp với mẫu cần phân tích [xem TCVN 6507-1 (ISO 6887-1) đến TCVN 6507-5 (ISO 6887-5)].
Phần mẫu thử được bổ sung vào môi trường tăng sinh để thu được tỷ lệ của phần mẫu thử với môi trường là 1/10.
8.2 Tăng sinh vi khuẩn
Tùy thuộc vào vi sinh vật đích, cần sử dụng môi trường tăng sinh phù hợp nhất.
8.2.1 Y. enterocolitica gây bệnh
Cần sử dụng môi trường tăng sinh PSB trước khi phát hiện bằng PCR.
Tăng sinh PSB ở 25 °C ± 1 °C trong 24 h ± 3 h.
Nếu cần phân lập khuẩn lạc thì thời gian tăng sinh cần được tăng đến 48 h. Nên tham khảo TCVN 8127 (ISO 10273).
Nếu sử dụng dung giải bằng nhiệt để tách chiết ADN (phương pháp trong Phụ lục B) thì có thể cần kéo dài thời gian tăng sinh PSB đến 48 h.
8.2.2 Y. pseudotuberculosis
Cần sử dụng môi trường tăng sinh TSBY trước khi phát hiện bằng PCR.
Tăng sinh TSBY ở 25 °C ± 1 °C trong 24 h ± 3 h.
CHÚ THÍCH: Quy trình này không cho phép phân lập các vi khuẩn. Quá trình phân lập gồm bước tăng sinh sơ bộ chủng cấy chọn lọc của mẫu như quy định trong 8.3.2 và C.2.
Nếu lượng mẫu hoặc mẫu tăm bông bị hạn chế không thể đủ cho việc sàng lọc PCR (TSBY) và phân lập các khuẩn lạc thì có thể sử dụng môi trường PMB thay cho môi trường TSBY, xem C.2, 5.2.3.3 và 8.3.2.
8.2.3 Y. enterocolitica gây bệnh và Y. pseudotuberculosis
Để phát hiện đồng thời Y. enterocolitica gây bệnh và Y. pseudotuberculosis bằng PCR, có thể sử dụng môi trường TSBY.
Nguy cơ thu được kết quả âm tính giả đối với Y. enterocolitica có thể tăng lên khi sử dụng môi trường TSBY.
8.3 Phân lập khuẩn lạc, tùy chọn
8.3.1 Y. enterocolitica gây bệnh
Sau khi tăng sinh trong 24 h ± 3 h, chuyển 0,5 ml dịch tăng sinh PSB vào 4,5 ml dung dịch kali hydroxit (KOH) 0,5 % (5.2.5) và trộn nhẹ trong 25 s ± 5 s. Cấy 1 μl, 10 μl và 100 μl hỗn hợp theo vạch trên bề mặt ba đĩa thạch CIN. Tiếp tục ủ môi trường tăng sinh thêm 24 h. Ủ các đĩa thạch CIN ở 30 °C ± 1 °C trong 24 h ± 3 h. Kiểm tra các đĩa thạch (tốt nhất bằng kính lúp) và các khuẩn lạc điển hình có màu hồng nhạt có tâm đỏ sẫm được chọn để khẳng định, cấy lên đĩa thạch CIN lần thứ hai được thực hiện sau 48 h ± 4 h tăng sinh, thực hiện theo cùng cách như cấy đĩa sau tăng sinh 24 h.
Các khuẩn lạc Y. enterocolitica gây bệnh giả định cần được khẳng định theo TCVN 8127 (ISO 10273).
CHÚ THÍCH: Chỉ đối với các mẫu dự kiến có mức nhiễm Y. enterocolitica cao, mới tăng sinh trong PSB để phân lập các khuẩn lạc như quy định trong tiêu chuẩn này. Đối với các mẫu nghi ngờ có mức nhiễm Y. enterocolitica thấp, nên theo TCVN 8127 (ISO 10273) để phân lập các khuẩn lạc.
8.3.2 Y. pseudotuberculosis
Mẫu thử được nuôi cấy (độ pha loãng 1/10) vào môi trường tăng sinh PMB (5.2.3.3) lạnh, đồng hóa và ủ ở nhiệt độ 4 °C ± 1 °C trong 7 ngày và 14 ngày. Nếu việc phát hiện PCR của Y. pseudotuberculosis được thực hiện sau khi tăng sinh trong PMB (xem 8.2.2) thì việc tách chiết axit nucleic và khuếch đại PCR cần được thực hiện sau khi ủ 72 h ± 8 h (xem 8.4 và 8.5).
Chuyển 0,5 ml dịch tăng sinh (PMB) dã ủ vào 4,5 ml dung dịch kali hydroxit 0,25 % (5.2.5) và trộn nhẹ trong 25 s ± 5 s. Sử dụng vòng cấy 10 μl chuyển hỗn hợp lên bề mặt đĩa thạch CIN (thực hiện lặp lại hai lần), ủ đĩa thạch CIN ở 30 °C ± 1 °C trong tổng thời gian 48 h ± 4 h nhưng kiểm tra các đĩa về sự phát triển điển hình sau 24 h. Các đĩa được kiểm tra bằng kính lúp và các khuẩn lạc điển hình được chọn để khẳng định. Khuẩn lạc điển hình nhỏ (sau khi ủ 24 h thường có đường kính < 0,5 mm) và mép không đều. Các khuẩn lạc thường có tâm đỏ sẫm không có ranh giới rõ ràng. Xung quanh khuẩn lạc có quầng trong suốt hoặc rất mỏng và gần như không thể nhìn thấy sau 24 h. Để khẳng định, có thể cần thực hiện phép thử sinh hóa hoặc PCR.
8.3.3 Kiểm soát quá trình
Phải sử dụng các kiểm soát quá trình dương tính và âm tính theo TCVN 11134 (ISO 22174).
8.4 Tách chiết axit nucleic
Axit nucleic được tách chiết ra khỏi dịch cấy tăng sinh, thường là 1 ml. Có thể sử dụng bất kỳ quy trình tách chiết axit nucleic thích hợp nào đối với vi khuẩn Gram âm được thử nghiệm phù hợp cho mục đích này, ví dụ: phương pháp tách chiết CTAB[2]. Ngoài ra, có thể sử dụng bộ kit thử thương mại.
CHÚ THÍCH: Như đã biết, đối với nền mẫu nhất định, phương pháp tách chiết axit nucleic tạo ra được lượng ADN cao và có độ tinh khiết cao (xem các Phụ lục B, C và D đối với nền mẫu thử nghiệm).
8.5 Khuếch đại PCR
8.5.1 Yêu cầu chung
Có thể sử dụng các nguyên tắc khác nhau đối với việc khuếch đại real-time PCR đầu dò.
Các ví dụ về phân tích real-time PCR để phát hiện Y. enterocolitca gây bệnh được nêu trong Phụ lục B.
Ví dụ về phân tích real-time PCR để phát hiện Y. pseudotuberculosis được nêu trong Phụ lục C.
Ví dụ về phân tích real-time PCR để phát hiện đồng thời Y. enterocolitica gây bệnh và Y. pseudotuberculosis được nêu trong Phụ lục D.
8.5.2 Kiểm chứng PCR
Thực hiện các phép kiểm chứng PCR theo TCVN 11134 (ISO 22174).
8.6 Khẳng định sản phẩm PCR
8.6.1 Yêu cầu chung
Theo TCVN 7682 (ISO 20838) kết quả real-time PCR đầu dò dương tính không yêu cầu khẳng định thêm sản phẩm PCR.
8.6.2 Diễn giải kết quả PCR
Kết quả thu được, bao gồm các phép kiểm chứng trong TCVN 11134 (ISO 22174) cần phải rõ ràng, nếu không phải lặp lại việc chạy PCR.
Kết quả PCR là một trong hai trường hợp sau:
a) dương tính nếu sản phẩm PCR cụ thể được phát hiện và tất cả các phép kiểm chứng cho kết quả dự kiến hoặc
b) âm tính trong giới hạn phát hiện, nếu sản phẩm PCR cụ thể không phát hiện được và tất cả các phép kiểm chứng cho kết quả dự kiến.
9 Báo cáo thử nghiệm
Báo cáo thử nghiệm phải phù hợp với các yêu cầu trong TCVN 11134 (ISO 22174).
Ngoài ra, báo cáo thử nghiệm phải nêu rõ phương pháp đã sử dụng trong tiêu chuẩn này, đặc biệt là khi phát hiện đồng thời Y. enterolitica gây bệnh và Y. pseudotuberculosis.
Phụ lục A
(Quy định)
Phát hiện và phân lập Y. enterolitica gây bệnh bằng PCR
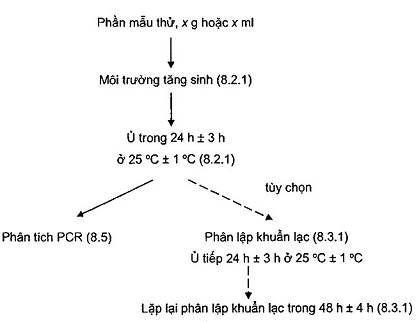
Hình A.1 - Sơ đồ phát hiện và phân lập Y. enterolitica gây bệnh bằng PCR
Phụ lục B
(Tham khảo)
Phát hiện Y. enterolitica bằng real-time PCR
B.1 Phát hiện Y. enterolitica bằng real-time PCR - Phương pháp 1
B.1.1 Yêu cầu chung
Đây là phương pháp phát hiện Yersinia enterocolitica gây bệnh bằng cách khuếch đại một trình tự cụ thể đối với đoạn gen ail của Y. enterocolitica. Gen này là một phần cơ chế gây bệnh của Y. enterocolitica.
Hệ thống phát hiện đã được xây dựng là real-time PCR mồi kép kết hợp với kiểm soát khuếch đại bên trong khác loại dựa trên plasmid pUC 19. Bằng real-time PCR, một đoạn kéo dài của operon lac từ M13mp18 đến các trình tự pBR322 được khuếch đại. Trình tự này không xảy ra tự nhiên.
B.1.2 Đặc tính hiệu năng
B.1.2.1 Yêu cầu chung
Phương pháp đã được công bố này[7] được áp dụng để phát hiện các chủng Y. enterocolitica thuộc các bioserotyp liên quan đến khả năng gây bệnh ở người.
B.1.2.2 Độ chọn lọc
Độ chọn lọc được thực hiện bằng cách sử dụng các mồi ye-ail-F2 và ye-ail-R2, với đầu dò thủy phân ye-ail-tmp kết hợp với kiểm soát khuếch đại bên trong sử dụng hệ thống mồi-đầu dò puc 18-F, pUC 18-R và Tm-pUC 18.
B.1.2.2.1 Phép thử độ chọn lọc mục tiêu
Độ chọn lọc mục tiêu của phép phân tích PCR được thử nghiệm trên 50 chủng, cho kết quả độ chọn lọc mục tiêu là 100 % (xem Bảng B.1).
Các chủng thử nghiệm được phân lập từ người, động vật và thực phẩm.
Bảng B.1 - Phép thử độ chọn lọc mục tiêu sử dụng 50 chủng đích
| Các loài và bio/serotyp | Số lượng chủng thu được trong khuếch đại đoạn gen đích | |
| Y. enterocolitica 4/O:3 | (33) | 33 |
| Y. enterocolitica 2/O:9 | (3) | 3 |
| Y. enterocolitica 2/O:9 | (11) | 11 |
| Y. enterocolitica IB/O:8 | (1) | 1 |
| Y. enterocolitica 2/O:5,27 | (2) | 2 |
| Tổng số | (50) | 50 |
B.1.2.2.2 Phép thử độ chọn lọc ngoại trừ
Độ chọn lọc ngoại trừ của phép phân tích PCR được thử nghiệm trên 51 chủng không phải đích, cho kết quả độ chọn lọc ngoại trừ là 100 % (xem bảng B.2). Các chủng thử nghiệm được phân lập từ người, động vật và nguồn gốc thực phẩm.
Bảng B.2 - Phép thử độ chọn lọc ngoại trừ sử dụng 51 chủng không phải đích
| Các loài bio/serotyp | Số lượng chủng thu được trong khuếch đại đoạn gen đích | |
| Y. enterocolitica 1A/O:5 | (2) | 0 |
| Y. enterocolitica 1A/O:6, 30 | (1) | 0 |
| Y. enterocolitica 1A/O:10 | (1) | 0 |
| Y. frederiksenii | (2) | 0 |
| Y. kristensenii | (2) | 0 |
| Y. intermedia | (2) | 0 |
| Y. aldovae | (1) | 0 |
| Y. mollaretii | (1) | 0 |
| Y. pseudotuberculosis | (3) | 0 |
| Các loài vi khuẩn gây bệnh liên quan đến thực phẩm | (34) | 0 |
| Saccharomyces cerevisiae | (1) | 0 |
| Aspergillus niger | (1) | 0 |
| Tổng số | (51) | 0 |
B.1.2.2.3 Độ chọn lọc phân tử
Theo nghiên cứu BLAST (16/05/2011) mồi và đầu dò đã được đánh giá xác nhận in silico.
B.1.2.3 Độ nhạy
B.1.2.3.1 Độ nhạy phản ứng
Giới hạn phát hiện là 5 gen tương đồng (genome equivalent) [25 femtogam (fg)] trên một phản ứng. Tất cả các phép phân tích được thực hiện với sự có mặt của khoảng 25 bản sao kiểm soát khuếch đại bên trong (IAC).
B.1.2.3.2 Độ nhạy của phương pháp
Mức phát hiện LOD95[17] của phương pháp PCR là 10,7 cfu trên 25 g thực phẩm. Giới hạn phát hiện của phương pháp này đã được đánh giá bằng cách đo bốn nền mẫu thực phẩm khác nhau, ở đây là xúc xích Mortadella, bắp cải, sữa thanh trùng và cá sống, được nuôi cấy ở mức nhiễm 5 cfu và 50 cfu trong 25 g với sáu lần lặp lại cho mỗi mức nhiễm. Sau 48 h tăng sinh trong PSB, giới hạn phát hiện trong xúc xích Mortadella, cá sống và sữa thanh trùng là 5 cfu trong 25 g và trong bắp cải là 50 cfu trong 25 g.
B.1.2.3.3 Các thông số hiệu năng liên quan đến độ chính xác tương đối, độ nhạy tương đối và độ đặc hiệu tương đối
| Độ chính xác tương đối | AC | 89,5 % |
| Độ nhạy tương đối | SE | 100 % |
| Độ đặc hiệu tương đối | SP | 76,7 % |
Các thông số hiệu năng đã được đánh giá bằng cách so sánh với phương pháp nuôi cấy theo Điều 5 của TCVN 8127:2009 (ISO 10273:2003).
CHÚ THÍCH: Các dữ liệu này thu được bằng cách phân tích các mẫu nhiễm nhân tạo.
B.1.2.4 Độ chắc chắn
Độ chắc chắn của PCR đã được thử nghiệm bằng cách áp dụng các thay đổi sau đây trong việc thiết lập phản ứng,
- Tăng và giảm nồng độ mồi và đầu dò khoảng ± 20 % với sự có mặt của 25 bản sao kiểm soát khuếch đại bên trong.
- Sử dụng hai công thức khác nhau của mastermix Taq-polymerase từ hai nhà cung cấp.
Các thay đổi không ảnh hưởng đến hiệu năng phản ứng.
B.1.2.5 Thiết bị
Việc đánh giá đã được thực hiện bằng cách sử dụng thiết bị Roche LightCycler® 4801) và real-time PCR ABI 7900HT1).
Các thiết bị real-time PCR khác nhau ít ảnh hưởng đến hiệu năng của phương pháp.
B.1.3 Cách tiến hành
B.1.3.1 Nguyên tắc
Một đoạn ADN đặc hiệu của locus ail Yersinia enterocolitica được khuếch đại và phát hiện bằng real-time PCR. Hệ thống real-time PCR dựa trên đầu dò thủy giải đặc hiệu được đánh dấu bằng Carboxyfluorescein (FAM) làm phân tử phát huỳnh quang và Dabcyl làm phân tử dập tắt huỳnh quang.
B.1.3.2 Thuốc thử
B.1.3.2.1 Yêu cầu chung
Đối với chất lượng của thuốc thử được sử dụng, xem TCVN 11134 (ISO 22174).
B.1.3.2.2 Thuốc thử dùng cho PCR
Xem TCVN 11133 (ISO 22119) và TCVN 7682 (ISO 20838).
B.1.3.2.3 Oligonucleotid
B.1.3.2.3.1 Oligonucleotid, Y. enterocolitica gây bệnh
Bảng B.3 - Trình tự của các oligonucleotid
| Mồi và đầu dò | Trình tự ADN của oligonucleotid (5' - 3') | Kích thước sản phẩm PCR |
| ye-ail-F2 | 5'-GGT TAT GCA CAA AGC CAT GTA AA -3' | 93 bp |
| ye-ail-R2 | 5-AAA CGA ACC TAT TAC TCC CCA GTT-3' | |
| Đầu dò ye-ail-tmp | 5'-FAM-AAC CTG AAG TAC CGT TAT GAA CTC GAT GA-DB-3'a |
|
| a FAM: 6 Carboxytluorescein, DB: Dabcyl. | ||
B.1.3.2.3.2 Oligonucleotid, kiểm soát khuếch đại bên trong, IAC
Bảng B.4 - Trình tự các oligonucleotid
| Tên | Trình tự DNA của oligonucleotide (5' - 3') | Kích thước sản phẩm PCR |
| pUC 18-F pUC 18-R Đầu dò Tm-pUC18 | 5'-TGT CGT GCC AGC TGC ATT A-3' 5'-GAG CGA GGA AGC GGA AGA G-3' 5'-TexasRed - AAT CGG CCA ACG CGC GG -BHQ2-3'a | 83 bp |
| a TexasRed: Sulforhodamin-101-Sulfonylchlorid, BHQ2:N-Nitrophenylazo-dimethoxy-phenylazo-phenyl-N-dimethoxytrityloxy-etyl-2-aminoethyl-l-oxyglycolat (Black-Hole Quencher 2TM). | ||
CHÚ THÍCH: Có thể sử dụng phân tử phát và/hoặc phân tử tắt tương đương.
B.1.4 Quy trình chạy phân tử
B.1.4.1 Tách chiết ADN
Chuyển 1 ml từng dung dịch mẫu được liệt kê ở trên vào ống phản ứng 1,5 ml và ly tâm 10 min ở 13 000 x g. Cặn vi khuẩn được rửa hai lần trong 1 ml NaCl 0,9 % và cuối cùng hòa vào 200 μl nước dùng cho sinh học phân tử. Sau khi ủ 10 min ở 95 °C, dùng 2,5 μl làm khuôn mẫu cho real-time PCR.
B.1.4.2 Cài đặt PCR
Tổng thể tích thuốc thử dùng cho mỗi phản ứng PCR là 25 μl. Các loại thuốc thử được liệt kê trong Bảng B.5.
Bảng B.5 - Bổ sung các thuốc thử
| Thuốc thử (nồng độ gốc) | Nồng độ cuối cùng | Thể tích/phản ứng (μl) |
| LightCycler® 480 Probes Mastera (chứa Fast Start Taq ADN polymerase, đệm phản ứng, dNTP-mix với dUTP thay cho dTTP và 6,4 mmol/1 MgCl2) | 1 x | 12,5 |
| ye-ail-F2 (10 μmol/l) | 300 nmol/l | 0,75 |
| ye-ail-R2 (10 μmol/l) | 300 nmol/l | 0,75 |
| ye-ail-tmp (10 μmol/l) | 125 nmol/l | 0,312 |
| puc 18-F (10 μmol/l) | 250 nmol/l | 0,625 |
| pUC 18-R (10 μmol/l) | 250 nmol/l | 0,625 |
| Tm-pUC18 (10 μmol/l) | 100 nmol/l | 0,25 |
| IAC plasmid pUC19 | ~ 25 bản sao (0,1 pg) | 1 |
| Mẫu thử |
| 2,5 |
| Nước cất vô trùng | Chỉnh đến 25 μl | 5,687 |
| a Roche LC 480 Probes Master là ví dụ về sản phẩm phù hợp có bán sẵn của Roche Diagnostics. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng sản phẩm. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương. | ||
B.1.4.3 Kiểm chứng PCR
Thực hiện các phép kiểm chứng PCR theo TCVN 11134 (ISO 22174).
B.1.4.3.1 Kiểm chứng PCR âm tính
Sử dụng nước không có ADN làm kiểm chứng âm.
B.1.4.3.2 Kiểm chứng PCR dương tính
Sử dụng dung dịch có chứa một lượng xác định và/hoặc số lượng bản sao ADN đích làm kiểm chứng dương.
B.1.4.3.3 Kiểm soát khuếch đại
Một ví dụ của IAC được nêu trong Bảng B.4. IAC này được dựa trên ADN E. coli plasmid pUC19 làm phân tử đích. Ngoài ra, có thể sử dụng các công cụ kiểm soát khuếch đại bán sẵn.
CHÚ THÍCH: Các vectơ plasmid pUC18 và pUC19 (số L08752; 2686 Bp) giống hệt nhau ngoại trừ việc chúng có chứa các vị trí đa tách dòng (polycloning site) được sắp xếp theo hướng ngược lại.
B.1.4.4 Chương trình nhiệt độ - thời gian
Chương trình nhiệt độ - thời gian quy định trong Bảng B.6 đã được chứng minh phù hợp.
Bảng B.6 - Chương trình nhiệt độ/thời gian
| Hoạt hóa/biến tính ban đầu | 95 °C trong 10 min |
| Biến tính | 95 °C trong 10 s |
| Khuếch đại | 60 °C trong 30 s |
| Số lượng chu trình | 45 |
B.1.4.5 Hạn chế của phép phân tích
Một mối tương quan cao đã được xác định giữa sự có mặt của gen ail và gen độc lực của yersiniae[8], tuy nhiên, trong rất ít trường hợp các chủng Yersinia enterocolitica biotyp 1A, thường được coi là không gây bệnh, có thể mang một biến thể của gen ail [6],[11]. Tuy nhiên, có những dấu hiệu cho thấy một tỷ lệ nhỏ các chủng 1A có thể gây bệnh cho người[12].
B.2 Phát hiện Y. enterocolitica gây bệnh bằng real-time PCR - Phương pháp 2
B.2.1 Yêu cầu chung
Đây là phương pháp phát hiện Yersinia enterocolitica gây bệnh bằng cách khuếch đại một trình tự đặc hiệu đối với đoạn gen ail của Yersinia enterocolitica. Gen này là một phần cơ chế gây bệnh của Yersinia enterocolitica.
Hệ thống phát hiện được xây dựng là real-time PCR lặp lại kết hợp với kiểm soát khuếch đại bên trong khác loại dựa trên plasmid PUC 19.
B.2.2 Đặc tính hiệu năng
B.2.2.1 Yêu cầu chung
Phương pháp đã được công bố này[13] [14] có thể áp dụng để phát hiện các chủng Y. enterocolitica thuộc bioserotyp liên quan đến khả năng gây bệnh ở người.
Phương pháp này
B.2.2.2 Độ chọn lọc
Độ chọn lọc được thực hiện bằng cách sử dụng các mồi R-real 9A và F-real 10A kết hợp với mồi MGBTM2) hoặc đầu dò TAMRA-quencher [đầu dò ail) kết hợp với kiểm soát khuếch đại bên trong sử dụng hệ thống mồi/đầu dò IAC-fw, lAC-re và đầu dò pUC 19.
B.2.2.2.1 Phép thử độ chọn lọc mục tiêu
Độ chọn lọc mục tiêu của phép phân tích PCR được thử nghiệm trên 102 chủng, cho kết quả độ chọn lọc mục tiêu là 100 %, xem Bảng B.7.
Các chủng thử nghiệm đã phân lập được từ người (n = 70), động vật (n = 15), thực phẩm (n = 8) và nguồn chưa xác định (n = 9).
Bảng 7 - Phép thử độ chọn lọc mục tiêu sử dụng 102 chủng
| Các loài và bio/serotyp | Số lượng các chủng thu được trong khuếch đại đoạn gen đích | |
| Y. enterocolitica 4/O:3 | (81) | 81 |
| Y. enterocolitica NT/O:9 | (3) | 3 |
| Y. enterocolitica NT/O:8 | (8) | 8 |
| Y. enterocolitica NT/O:5,27 | (4) | 4 |
| Y. enterocolitica 1B/O:18 | (1) | 1 |
| Y. enterocolitica NT/O:20 | (2) | 2 |
| Y. enterocolitica 1B/O:21 | (1) | 1 |
| Y. enterocolitica 3/O:1,2,3 | (1) | 1 |
| Y. enterocolitica 5/O:2,3 | (1) | 1 |
| Tổng số | 102 | 102 |
| NT là không phân typ. | ||
B.2.2.2.2 Phép thử độ chọn lọc ngoại trừ
Độ chọn lọc ngoại trừ của phân tích PCR được thử nghiệm trên 71 chủng không phải đích, cho kết quả độ chọn lọc ngoại trừ là 100 % (xem Bảng B.8). Các chủng thử nghiệm đã phân lập được từ người (n = 20), động vật (n = 1), thực phẩm (n = 21) và nguồn chưa xác định (n = 29).
Bảng B.8 - Phép thử độ chọn lọc ngoại trừ sử dụng 71 chủng không phải đích
| Các loài và bio/serotyp | Số lượng các chủng thu được trong khuếch đại đoạn gen đích | |
| Y. enterocolitica 1A | (5) | 0 |
| Y. enterocolitica NT | (9) | 0 |
| Y. frederiksenii | (7) | 0 |
| Y. kristensenii | (2) | 0 |
| Y. intermedia | (2) | 0 |
| Y. pseudotuberculosis | (25) | 0 |
| Các loài khác nhau liên quan đến thực phẩm | (21) | 0 |
| Tổng số | (71) | 0 |
| NT là không phân typ. | ||
B.2.2.3 Độ nhạy phản ứng
Các giới hạn phát hiện là 15 gen đến 20 gen tương đồng (genome equivalent) (85 fg) cho một phản ứng. Tất cả các phép phân tích được thực hiện với sự có mặt 100 bản sao của kiểm soát khuếch đại bên trong (IAC).
B.2.2.4 Độ nhạy của phương pháp
Mức phát hiện LOD95 của phương pháp PCR là 23 cfu/10 g thực phẩm. Giới hạn phát hiện của phương pháp được đánh giá bằng cách đo năm nền mẫu thực phẩm khác nhau, ở đây là sữa, xúc xích hun khói lạnh, cá, cà rốt, thịt xay được cấy ở mức nhiễm 1 cfu đến 55 cfu trong 10 g với sáu lần lặp lại cho mỗi mức nhiễm. Sau 18 h đến 20 h tăng sinh thì giới hạn phát hiện trong sữa là 1 cfu trong 10 g, trong xúc xích hun khói lạnh là 5,5 cfu và trong cà rốt, cá và thịt xay là 55 cfu trong 10 g.
B.2.2.5 Các thông số hiệu năng liên quan đến độ chính xác tương đối, độ nhạy tương đối, độ đặc hiệu tương đối
Độ chính xác tương đối của phương pháp real-time PCR (kết quả đạt được/dự kiến) là 99 %, độ nhạy tương đối là 98 % và độ đặc hiệu tương đối là 100 % trong một nghiên cứu của 90 mẫu thịt giăm bông, cà rốt và xay thịt khi sử dụng các mức từ 10 cfu đến 300 cfu Y. enterocolitica trong 25 g mẫu thực phẩm. Trong phạm vi của nghiên cứu này, ADN tách chiết ra được pha loãng 1/10 trước khi chạy phản ứng. Nghiên cứu này cũng cho thấy độ chính xác tương đối là 60 % đối với phương pháp nuôi cấy trong TCVN 8127:2009 (EN/ISO 10273:2003) và độ nhạy tương đối là 40 % và độ đặc hiệu tương đối là 100 %.
CHÚ THÍCH: Các dữ liệu thu được bằng cách phân tích các mẫu nhiễm nhân tạo. Một so sánh giữa kết quả dự kiến và kết quả thu được đã được tính theo quy trình NMKL n° 20, 2007[1].
B.2.2.6 Độ chắc chắn
Độ chắc chắn của phương pháp PCR đã được thử nghiệm bằng cách thay đổi nhiệt độ ủ ± 2 °C và nồng độ thuốc thử PCR ± 20 % sử dụng 50 bản sao ADN của Y. enterocolitica (SLV-408) với sự có mặt của 100 bản sao kiểm soát khuếch đại bên trong (IAC). Độ lệch Ct là ± 1 Ct từ các điều kiện của phương pháp đã nêu.
B.2.2.7 Thiết bị
Tiến hành đánh giá các thiết bị ABI 7300, 75003) và real-time PCR BioRad CFX96TM3). Các thiết bị real-time PCR khác nhau cho thấy không ảnh hưởng đáng kể đến hiệu năng của các phương pháp.
B.2.3 Cách tiến hành
B.2.3.1 Nguyên tắc
Một đoạn ADN đặc hiệu của đoạn gen (ail) xâm lấn gắn với gen liên quan đến độc lực cố định trên nhiễm sắc thể được khuếch đại và được phát hiện bằng real-time PCR[13]. Hệ thống real-time PCR dựa trên đầu dò thủy phân được dán nhãn 6-carboxyfluorescein (FAM) là phân tử phát huỳnh quang và tại đầu 3' là hợp chất hóa học đặc biệt gọi là chất liên kết (binder) rãnh phụ, MGB (đầu dò ail) hoặc tetrametyl-6-carboxyrhodamin, TAMRA (đầu dò Ye).
B.2.3.2 Thuốc thử
B.2.3.2.1 Yêu cầu chung
Đối với chất lượng của thuốc thử được sử dụng, xem TCVN 11134 (ISO 22174).
B.2.3.2.2 Thuốc thử dùng cho PCR
Xem TCVN 11133 (ISO 22119) và TCVN 7682 (ISO 20838).
B.2.3.2.2.1 Oligonucleotid, Y. enterocolitica gây bệnh
Bảng B.9 - Trình tự oligonucleotid
| Mồi và đầu dò | Trình tự ADN của oligonucleotide (5' - 3') | Kích thước sản phẩm PCR |
| R-real 9Aa | CCCAGTAATCCATAAAGGCTAACATAT | 163 bp |
| F-real 10Aa | ATGATAACTGGGGAGTAATAGGTTCG | |
| Đầu dò Yeb | FAM-TCTATG G C AGTA ATAAGTTTGGTC ACGGTGATCT-TAMRA |
|
| Đầu dò ailb | FAM-TGACCAAACTTATTACTGCCATA-MGB TMc |
|
| a Ngược; xuôi b Đầu dò Ye và đầu dò ail được sử dụng để thay thế. c Chất liên kết (binder) rãnh phụ (MGBTM) là một ví dụ về sản phẩm thích hợp có bán sẵn của Applied Biosystems. Forster City, CA, USA. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng sản phẩm này. Có thể sử dụng sản phẩm tương tự nếu cho kết quả tương đương. | ||
B.2.3.2.2.2 Oligonucleotid, kiểm soát khuếch đại bên trong (IAC)
Bảng B.10 - Trình tự các oligonucleotid
| Tên | Trình tự DNA của oligonucleotid | Kích thước sản phẩm PCR |
| IAC-fw | TGTGAAATACCGCACAGATG | 119 |
| IAC-re | AGCTGGCGTAATAGCGAAG | |
| Đầu dò-pUC19 | Z1-TAAGGAGAAAATACCGCATCAGGCGCC-Z2. |
|
| Z1 là thuốc nhuộm phát huỳnh quang khác với thuốc nhuộm được sử dụng cho đầu dò phát hiện đích; Z2 là thuốc nhuộm dập tắt huỳnh quang thích hợp bất kỳ. Ví dụ: thuốc nhuộm màu Cyanua CY5 là phân tử phát huỳnh quang và tại đầu kết thúc 3' là thuốc nhuộm dập tắt huỳnh quang Blackberry, BBQ. | ||
CHÚ THÍCH: Có thể sử dụng các thuốc nhuộm phân tử phát huỳnh quang và/hoặc thuốc nhuộm phân tử dập tắt huỳnh quang tương đương.
B.2.3.3 Tách chiết ADN
ADN được tách chiết ra khỏi các chất đồng nhất đã tăng sinh, canh thang nuôi cấy hoặc các huyền phù tế bào sử dụng bộ kit thử tế bào và huyết DNeasy hoặc bộ kit thử tinh sạch ADN hoàn chỉnh MasterPure4). Thực hiện quy trình theo hướng dẫn của nhà sản xuất. Ngoài ra, có thể sử dụng các bộ kit thử tinh sạch khác có bán sẵn.
B.2.3.4 Cài đặt PCR
Tổng thể tích thuốc thử dùng cho mỗi phản ứng PCR là 25 μl. Các thuốc thử được liệt kê trong Bảng B.11. Nồng độ cuối cùng của các thuốc thử nêu trong bảng đã được chứng minh là phù hợp.
Bảng B.11 - Các thuốc thử bổ sung
| Thuốc thử (nồng độ gốc) | Nồng độ cuối cùng | Thể tích/phản ứng |
| Dung dịch đệm 10xTaqMan® Aa,b | 1x | 2,5 |
| MgCl2 (25 mmol/l)a | 3,5 mmol/l | 3,5 |
| dNTP (50 mmol/l) a | 200 μmol/l | 0,1 |
| AmpliTaqGold® (5 U/μl)a | 0,02 U/μl | 0,25 |
| R-real 9A (10 μmol/l) | 300 nmol/l | 0,75 |
| F-real 10A (10 μmol/l) | 300 nmol/l | 0,75 |
| Đầu dò Ye (20 μmol/l) | 200 nmol/l | 0,25 |
| IAC pUC19 DNA | ~100 bản sao (0,3 pg) | 1,0 |
| IAC-fw (20 μmol/l) | 500 nmol/l | 0,625 |
| lAC-re (20 μmol/l) | 500 nmol/l | 0,625 |
| Đầu dò pUC19 (20 μmol/l) | 200 nmol/l | 0,25 |
| Mẫu thử |
| 5,0 |
| Dùng nước cắt vô trùng chỉnh đến 25 μl |
| |
| a Các thành phần này có thể được thay thế bằng các dung dịch đệm tương tự hoặc mastermix có sẵn để dùng ngay từ các nhà cung cấp khác. Các dung dịch đệm này bao gồm tất cả các thuốc thử trong cùng một dung dịch. Các TaqMan® 2x Universal PCR MasterMix có bán sẵn đã được sử dụng trong phép thử hiệu năng. b Dung dịch đệm 10xTaqMan A, AmpliTaqGold® là một ví dụ về sản phẩm thích hợp của Applied Biosystems. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn còn không ấn định phải sử dụng sản phẩm này. Có thể sử dụng sản phẩm tương tự nếu cho kết quả tương đương. | ||
B.2.3.5 Kiểm chứng PCR
Thực hiện các phép kiểm chứng PCR theo TCVN 11134 (ISO 22174).
B.2.3.6 Kiểm soát khuếch đại
Một ví dụ của IAC được đưa ra trong Bảng B.10. IAC này được dựa trên ADN pUC19 E. coli plasmid làm phân tử đích. Có thể sử dụng các kiểm soát khuếch đại thương mại có sẵn.
B.2.3.7 Chương trình nhiệt độ-thời gian
Chương trình nhiệt độ-thời gian nêu trong Bảng B.12 đã được sử dụng trong nghiên cứu đánh giá.
CHÚ THÍCH: Việc sử dụng máy chu trình nhiệt real-time PCR khác ở trên (B.2.2.7) có thể yêu cầu điều chỉnh thêm. Thời gian kích hoạt/biến tính ban đầu phụ thuộc vào polymerase được sử dụng.
Bảng B.12 - Chương trình nhiệt độ-thời gian
| Kích hoạt/biến tính ban đầu | 95 °C 10 min |
| Biến tính | 95°C 15s |
| Khuếch đại | 60 °C 1 min |
| Số chu trình | 45 |
B.2.3.8 Hạn chế của phép phân tích real-time PCR
Một mối tương quan cao đã được xác định giữa sự có mặt của gen ail và gen độc lực của vi khuẩn Yersinia spp[8]. Trong rất ít trường hợp Yersinia enterocolitica biotyp 1A, thường được coi là không gây bệnh, có thể mang một biến thể của gen ail[6],[11]. Tuy nhiên, có những dấu hiệu cho thấy một tỷ lệ nhỏ các chủng 1A có thể gây bệnh cho người [12].
Phụ lục C
(tham khảo)
Phát hiện và phân lập Y. pseudotuberculosis
C.1 Phát hiện Y. pseudotuberculosis bằng real-time PCR
C.1.1 Yêu cầu chung
Phụ lục này mô tả phương pháp real-time PCR đầu dò để phát hiện Y. pseudotuberculosis.
C.1.2 Đặc tính hiệu năng
C.1.2.1 Yêu cầu chung
Phương pháp đã được công bố này[14] có thể áp dụng để phát hiện các chủng Y. pseudotuberculosis được coi là có khả năng gây bệnh cho người.
C.1.2.2 Độ chọn lọc
Thực hiện phép thử độ chọn lọc bằng cách sử dụng các mồi F-Yps 1 và R-Yps 2, kết hợp với đầu dò MGB™ hoặc đầu dò Tamra-quenched kết hợp với kiểm soát khuếch đại bên trong sử dụng hệ thống mồi-đầu dò IAC-fw, IAC-re và đầu dò PUC 19.
C.1.2.2.1 Phép thử độ chọn lọc mục tiêu
Độ chọn lọc mục tiêu của phép phân tích PCR được thử nghiệm trên 44 chủng đích, cho kết quả độ chọn lọc mục tiêu là 95 %. Các cặp mồi/đầu dò đã không phát hiện được các serotyp O:11 và O:12.
Bảng C.1 - Phép thử độ chọn lọc mục tiêu sử dụng 44 chủng đích
| Các loài và bio/serotyp | Số lượng chủng thu được trong khuếch đại đoạn gen đích | |
| Y. pseudotuberculosis O:1-O:15 | (33) | 31 |
| Y. pseudotuberculosis NT | (11) | 11 |
| Tổng số | (44) | 42 |
| NT là không phân typ. | ||
C.1.2.2.2 Phép thử độ chọn lọc ngoại trừ
Độ chọn lọc ngoại trừ của phép phân tích PCR được thử nghiệm trên 23 chủng không phải đích, cho kết quả độ chọn lọc ngoại trừ là 100 %. Các chủng thử nghiệm đã phân lập được từ người (n = 24), động vật (n = 2), thực phẩm (n = 10), môi trường (n = 4) và nguồn chưa xác định (n = 27).
Bảng C.2 - Phép thử độ chọn lọc ngoại trừ sử dụng 23 chủng không phải đích
| Các loài và bio/serotyp | Số lượng chủng thu được trong khuếch đại đoạn gen đích | |
| Y. enterocolitica gây bệnh | (9) | 0 |
| Y. enterocolitica không gây bệnh | (2) | 0 |
| Các loài khác liên quan đến thực phẩm | (12) | 0 |
| Tổng số | (23) | 0 |
| NT là không phân typ. | ||
C.1.2.3 Độ nhạy
C.1.2.3.1 Độ nhạy phản ứng
Giới hạn phát hiện LOD95[17] là 15 gen tương đồng (75 fg) cho một phản ứng.
C.1.2.3.2 Độ nhạy của phương pháp
Mức phát hiện của phương pháp được đánh giá bằng cách đo ba nền mẫu thực phẩm khác nhau được cấy ở hai mức nhiễm (13 cfu và 200 cfu) trong 25 g, ở đây là sữa không tiệt trùng, thịt bò xay nhỏ và salad rau trộn (cà rốt nghiền và xà lách cuộn). Mỗi loại thực phẩm sử dụng 10 mẫu. Sau 24 h tăng sinh, mức phát hiện, LOD95[17] cho cả ba nền mẫu thực phẩm là 13 cfu trong 25 g. Xem B.1.2 về giới hạn của dữ liệu phát hiện trên nhiều nền mẫu.
C.1.2.4 Các thông số hiệu năng liên quan đến độ chính xác tương đối, độ nhạy tương đối, độ đặc hiệu tương đối
Độ chính xác tương đối, độ nhạy tương đối và độ đặc hiệu tương đối của phương pháp real-time PCR (dự kiến/kết quả đạt được) là 100 % trong một nghiên cứu 90 mẫu thực phẩm (sữa không tiệt trùng, thịt bò xay nhỏ và salad rau trộn) khi có mức nhiễm Y. pseudotuberculosis thấp, tức là 10 cfu đến 200 cfu trong mỗi 25 g mẫu thực phẩm được sử dụng. Trong nghiên cứu này, ADN tách chiết ra được pha loãng 1/10 trước khi chạy phản ứng.
CHÚ THÍCH: Các dữ liệu này thu được bằng cách phân tích các mẫu nhiễm nhân tạo. Sự so sánh giữa các kết quả dự kiến và kết quả thu được đã được tính theo quy trình NMKL n° 20, 2007[1].
C.1.2.5 Thiết bị
Việc đánh giá đã được thực hiện bằng cách sử dụng thiết bị ABI 7300, 75005) và real-time PCR BioRad CFX96™5).
C.1.3 Cách tiến hành
C.1.3.1 Nguyên tắc
Một đoạn ADN đặc hiệu của locus (ail) xâm lấn gắn với gen liên quan đến độc lực cố định trên nhiễm sắc thể được khuếch đại và được phát hiện bằng real-time PCR đầu dò để phát hiện Y. pseudotuberculosis[14].
C.1.3.2 Thuốc thử
C.1.3.2.1 Yêu cầu chung
Đối với chất lượng của thuốc thử được sử dụng, xem TCVN 11134 (ISO 22174).
C.1.3.2.2 Thuốc thử dùng cho PCR
C.1.3.2.2.1 Yêu cầu chung
Xem TCVN 11133 (ISO 22119) và TCVN 7682(ISO 20838).
C.1.3.2.2.2 Oligonucleotid, Y. pseudotuberculosis
Bảng C.3 - Trình tự các oligonucleotid
| Mồi và đầu dò | Trình tự DNA của các oligonucleotid (5' - 3') | Kích thước của sản phẩm PCR |
| F-Yps 1a | CGTCTGTTAATGTGTATGCCGAAG | 157 bp |
| R-Yps 2a | GAACCTATCACTCCCCAGTCATTATT | |
| Đầu dò Ypsb,c | VIC-CGTGTCAAGGACGATGGGTACAAGTTGG-TAMRA |
|
| Đầu dò Yps_2b,c | NED-ATGCTCAAAGTCGTGTCAA-MGB™d |
|
| a Xuôi; ngược. b TAMRA™; VIC® MGB™, chất liên kết rãnh phụ; NED™. c Đầu dò Yps và đầu dò Yps_2 được dùng thay thế. d MGB™, chất liên kết rãnh phụ; NED™ là ví dụ về các sản phẩm thích hợp của Applied Biosystems. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng các sản phẩm này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương. | ||
C.1.3.3 Tách chiết ADN
Xem B.2.3.3.
C.1.3.4 Cài đặt PCR
Tổng thể tích thuốc thử dùng cho mỗi phản ứng PCR là 25 μl. Các thuốc thử được nêu trong Bảng C.4. Nồng độ cuối cùng của các thuốc thử nêu trong bảng này đã được chứng minh là phù hợp.
Bảng C.4 - Thuốc thử dùng cho phản ứng PCR
| Thuốc thử (nồng độ gốc) | Nồng độ cuối cùng | Thể tích/mẫu (μl) |
| TaqMan®2x Universal PCRa | 1x | 12,5 |
| F-Yps 1 (10 μmol/l) | 300 nmol/l | 0,75 |
| R-Yps 2 (10 μmol/l) | 300 nmol/l | 0,75 |
| Đầu dò Yps (20 μmol/l] | 200 nmol/l | 0,25 |
| IAC PUC19 DNA | xấp xỉ 100 bản sao (0,3 pg) | 1,0 |
| IAC-fw (20 μmol/l) | 500 nmol/l | 0,625 |
| lAC-re (20 μmol/l) | 500 nmol/l | 0,625 |
| Probe-pUC19 (20 μmol/l) | 200 nmol/l | 0,25 |
| Mẫu thử |
| 5,0 |
| Dùng nước cất vô trùng chỉnh đến 25 μl |
| |
| a TaqMan®2x Universal PCR là ví dụ về các sản phẩm thích hợp có bán sẵn của Applied Biosystems. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng sản phẩm này. Có thể sử dụng sản phẩm tương tự nếu cho kết quả tương đương. | ||
C.1.3.5 Kiểm chứng PCR
Thực hiện kiểm chứng PCR theo TCVN 11134 (ISO 22174).
C.1.3.6 Kiểm soát khuếch đại
Một ví dụ của IAC được đưa ra trong Bảng B.10. IAC này dựa trên ADN pUC19 plasmid E. coli làm phân tử đích. Ngoài ra, có thể sử dụng các kiểm soát khuếch đại thương mại sẵn có.
C.1.3.7 Chương trình nhiệt độ-thời gian
Xem B.2.3.7.
C.1.4 Hạn chế của phép phân tích real-time PCR
Tất cả các chủng Y. pseudotuberculosis được coi là có khả năng gây bệnh cho người[9]. Phép thử real- time PCR nêu trong tiêu chuẩn này không làm khuếch đại các gen đích của các serotyp O:11 và O:12, chưa rõ khả năng gây bệnh. Bộ mồi/đầu dò này sẽ phát hiện được Y. pestis, nhưng thường không liên quan đến thực phẩm.
C.2 Phân lập Y. pseudotuberculosis
C.2.1 Sơ đồ phân lập (và phát hiện bằng PCR) Y. pseudotuberculosis
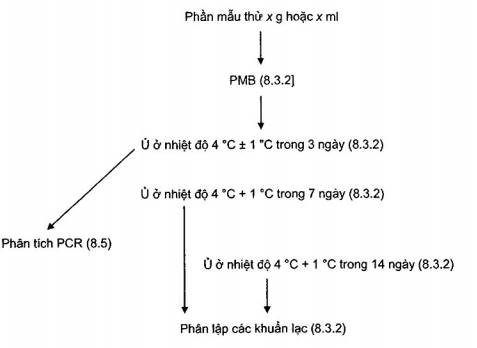
Hình C.1 - Sơ đồ phân lập (và phát hiện bằng PCR) Y. pseudotuberculosis
C.2.2 Đặc tính hiệu năng của việc phân lập các khuẩn lạc Y. pseudotuberculosis bằng canh thang PMB
Độ chính xác tương đối, độ nhạy tương đối và độ đặc hiệu tương đối của phương pháp nuôi cấy này (kết quả dự kiến/kết quả đạt được) là 100 % trong một nghiên cứu 42 nền mẫu thực phẩm (sữa không tiệt trùng, thịt đã nấu chín và salad) ở ba mức nhiễm (30 cfu/25 g, 170 cfu/25 g và 850 cfu/25 g) Y. pseudotuberculosis và mỗi loại thực phẩm nghiên cứu 4 mẫu.
Mức độ phát hiện (LOD50)[17] chung đối với các nền mẫu này là 7 cfu/25 g mẫu. Trong một nghiên cứu riêng 30 mẫu cả rốt nghiền, LOD95[17] là 53 cfu/25 g mẫu.
CHÚ THÍCH: Các dữ liệu thu được khi phân tích các mẫu gây nhiễm nhân tạo. Việc so sánh giữa kết quả dự kiến và kết quả thu được tính theo quy trình của Ủy ban Bắc Âu về phân tích thực phẩm [Nordic Committee on food Analysis (NMKL)] n° 20, 2007.[1]
Phụ lục D
(tham khảo)
Phát hiện đồng thời Y. enterocolitica gây bệnh và Y. pseudotuberculosis bằng multiplex real-time PCR
D.1 Yêu cầu chung
Phụ lục này mô tả phương pháp real-time PCR đầu dò để phát hiện đồng thời Y. enterocolitica gây bệnh và Y. pseudotuberculosis.
D.2 Đặc tính hiệu năng
D.2.1 Yêu cầu chung
Xem B.2.2.1 và C.1.2.1.
Phương pháp này đã được công bố[14].
D.2.2 Độ chọn lọc
D.2.2.1 Yêu cầu chung
Xem B.2.2.2 và C.1.2.2
D.2.2.2 Phép thử độ chọn lọc mục tiêu và độ chọn lọc ngoại trừ
Xem B.2.2.2.1 đến B.2.2.2.2 và C.1.2.2.1 đến C.1.2.2.1.2.
D.2.3 Độ nhạy
D.2.3.1 Độ nhạy phản ứng
Chưa được đánh giá.
D.2.3.2 Độ nhạy của phương pháp
Mức phát hiện, LOD95[17] đối với Y. pseudotuberculosis sau khi nuôi cấy kết hợp với Y. enterocolitica đã tính được là 525 cfu/10 g. Mức phát hiện được tính sau khi tăng sinh đồng thời hai loại vi khuẩn trong 24 h, mỗi loại với 2,8 cfu, 28 cfu và 2,8 x 102 cfu trong 10 g của hai nền mẫu thực phẩm khác nhau, đó là cà rốt và thịt bò xay nhỏ.
D.2.4 Thiết bị
Việc đánh giá đã được thực hiện bằng cách sử dụng thiết bị ABI 75006) và real-time PCR BioRad CFX96™6).
D.3 Cách tiến hành
D.3.1 Nguyên tắc
Các đoạn ADN khác nhau của đoạn gen (ail) xâm lấn gắn với gen liên quan đến độc lực cố định trên nhiễm sắc thể có trong các chủng Y. enterocolitica gây bệnh và Y. pseudotuberculosis được khuếch đại và được phát hiện bằng real-time PCR đầu dò multiplex.
D.3.2 Thuốc thử
D.3.2.1 Yêu cầu chung
Đối với chất lượng của thuốc thử được sử dụng, xem TCVN 11134 (ISO 22174).
D.3.2.2 Thuốc thử dùng cho PCR
Xem TCVN 11133 (ISO 22119) và TCVN 7682 (ISO 20838).
D.3.2.3 Oligonucleotid
Trình tự của các oligonucleotid để phát hiện Y. enterocolitica và Y. pseudotuberculosis gây bệnh được liệt kê trong Bảng B.9 và Bảng C.3 tương ứng.
D.3.3 Tách chiết ADN
ADN được tách chiết ra khỏi các các chất đồng nhất đã tăng sinh, canh thang nuôi cấy hoặc các huyền phù tế bào sử dụng bộ kit thử tế bào và huyết Dneasy (Qiagen Gmbh, Hilden, Đức). Thực hiện quy trình theo hướng dẫn của nhà sản xuất. Ngoài ra, có thể sử dụng các bộ kit thử tinh sạch khác có bán sẵn.
D.3.4 Cài đặt PCR
Tổng thể tích thuốc thử dùng cho mỗi phản ứng PCR là 25 μl. Các thuốc thử được liệt kê trong Bảng D.1. Các nồng độ cuối cùng của thuốc thử nêu trong bảng này đã được chứng minh là phù hợp.
Bảng D.1 - Thuốc thử, nồng độ cuối cùng và thể tích mẫu
| Thuốc thử (nồng độ gốc) | Nồng độ cuối cùng | Thể tích/mẫu (μl) |
| TaqMan®2x Universal PCRa | 1x | 12,5 |
| R-real 9A (10 μmol/l) | 300 nmol/l | 0,75 |
| F-real 10A(10 μmol/l) | 300 nmol/l | 0,75 |
| Mồi Ye (20 μmol/l) | 200 nmol/l | 0,25 |
| F-Yps 1 (10 μmol/l) | 300 nmol/l | 0,75 |
| R-Yps 2 (10 μmol/l) | 300 nmol/l | 0,75 |
| Mồi Yps (20 μmol/l) | 200 nmol/l | 0,25 |
| ADN IAC pUC19 | Khoảng 100 bản sao (0,3 pg) | 1,0 |
| IAC-fw (20 μmol/l) | 500 nmol/l | 0,625 |
| lAC-re (20 μmol/l) | 500 nmol/l | 0,625 |
| Mồi pUC19 (20 μmol/l) | 200 nmol/l | 0,25 |
| Mẫu thử |
| 5,0 |
| Dùng nước cất vô trùng chỉnh đến 25 μl |
| |
| a TaqMan®2x Universal PCR là ví dụ về sản phẩm thích hợp có bán sẵn của Applied Biosystems. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng sản phẩm này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương. | ||
D.3.5 Kiểm chứng PCR
Thực hiện kiểm chứng PCR phù hợp với TCVN 11134 (ISO 22174).
D.3.6 Kiểm soát khuếch đại
Một ví dụ của IAC được nêu trong Bảng B.10. IAC này dựa trên ADN pUC19 plasmid E. coli làm phân tử đích. Ngoài ra, có thể sử dụng kiểm soát khuếch đại thương mại có sẵn.
D.3.7 Chương trình nhiệt độ-thời gian
Xem B.2.3.7.
D.4 Hạn chế của phép phân tích real-time PCR
Xem B.2.4 và C.1.4 tương ứng.
Thư mục tài liệu tham khảo
[1] NMKL procedure N° 20, 2007. Evaluation of results from qualitative methods (www.nmkl.org)
[2] AUSUBEL F.M., BRENT R., KINGSTON R.E., MOORE D.D., SEIDMAN J.G., SMITH J.A. Current Protocols in Molecular Biology. John Wiley & Sons, New York, 1987
[3] BOTTONE E.J. Yersinia enterocolitica: overview and epidemiologic correlates. Microbes Infect. 1999, 1 pp. 323-333
[4] FUKUSHIMA H., MATSUDA Y., SEKI R., TSUBOKURA M., TAKEDA N., SHUBIN F.N. Geographical heterogeneity between Far Eastern and Western countries in prevalence of the virulence plasmid, the superantigen Y. pseudotubercuhsis-derived mitogen, and the high-pathogenicity island among Y. pseudotuberculosis strains. J. Clin. Microbiol. 2001, 39 pp. 3541-3547
[5] FUKUSHIMA H., SAITO K,, TSUBOKURA M., OTSUKI K. YERSINIA SPP. IN SURFACE WATER IN MATSUE, JAPAN. ZENTRALBI. BAKTERIOL. ABT 1 ORIG. B. HYG. KRANHENHAUSHYG. BETREIBSHYG. PRAEV. MED. 1984, 179 PP. 235-247
[6] KRAUSHAAR B., DIECKMANN R., WITTWER M., KNABNER D., KONIETZNY A., MADE D. CHARACTERIZATION OF A YERSINIA ENTEROCOLITICA BIOTYPE 1A STRAIN HARBORING AN AIL GENE. J. APPL. MICROBIOL. 2011, 111 pp. 997-1005
[7] MADE D., REITING R., STRAUCH E., KETTERITZSCH K., WICKE A. A REAL-TIME PCR FOR DETECTION OF PATHOGENIC YERSINIA ENTEROCOLITICA IN FOOD COMBINED WITH AN UNIVERSAL INTERNAL AMPLIFICATION CONTROL SYSTEM. J. VERBR. LEBENSM. 2008, 3 PP. 141-151
[8] MILLER V.L., FARMER J.J., HILL W.E., FALKOW S. THE AIL LOCUS IS FOUND UNIQUELY IN YERSINIA ENTEROCOLITICA SEROTYPES COMMONLY ASSOCIATED WITH DISEASE. INFECT, IMMUN. 1989, 57 PP. 121-131
[9] NAGANO T., KIYOHARA T., SUZUKI K., TSUBOKURA M., OTSUKI K. IDENTIFICATION OF PATHOGENIC STRAINS WITHIN SEROGROUPS OF YERSINIA PSEUDOTUBERCULOSIS AND THE PRESENCE OF NON- PATHOGENIC STRAINS ISOLATED FROM ANIMALS AND THE ENVIRONMENT. J. VET. MED. SCI. 1997, 59 PP. 153-158
[10] SCHIEMANN D.A. Yersinia enterocolitica: Observations on some growth characteristics and response to selective agents. Can. J. Microbiol. 1980, 26 pp. 1232-1240
[11] SIHVONEN L.M., HALLANVUO S.,HAUKKA K., SKURNIK M., SIITONEN A. The ail gene is present in some YERSINIA enterocolitica Biotype 1A strains. Foodborne Pathog. Dis. 2011, 8 [3] pp. 455-457
[12] TENNANT S.H., GRANT T.H., ROBINS-BROWNE R.M. PATHOGENICITY OF YERSINIA ENTEROCOLITICA BIOTYPE 1A. FEMS IMMUNOL. MED. MICROBIOL. 2003, 38 PP. 127-137
[13] THISTED LAMBERTZ S., NILSSON C, HALLANVUO S., LINDBLAD M. REAL-TIME PCR METHOD FOR DETECTION OF PATHOGENIC YERSINIA ENTEROCOLTICA IN FOOD. APPL. ENVIRON. MICROBIOL. 2008, 74 PP. 6060-6067
[14] THISTED LAMBERTZ S., NILSSON C, HALLANVUO S. A TAQMAN-BASED REAL-TIME PCR METHOD FOR DETECTION OF YERSINIA PSEUDOTUBERCULOSIS IN FOOD. APPL. ENVIRON. MICROBIOL. 2008, 74 PP. 6465-6469
[15] WEAGANT S.D. Medium for the presumptive identification of Yersinia enterocolitica. FDA Laboratory. Appl Environ Microbiol. 1983 45 (2) pp:472-473
[16] US FOOD AND DRUG ADMINISTRATION EBAM, CHAPTER 8. HTTP://WWW.FDA.GOV/FNNH/ FQ0DSCIENCERESEARCH/LABORATORYMETHODS/NRM072633.HTM
[17] WILRICH C.,&WILRICH P.-TH. 2009. EXCEL PROGRAM FOR THE ESTIMATION OF THE POD FUNCTION AND THE LOD OF A QUALITATIVE MICROBIOLOGICAL MEASUREMENT METHOD. J.AOAC INT. 2009, 92 PP. 1763 - 1772. FHTTN://WWW.WIWISS.FU-HERLIN.DE/FARHHEREICH/VWL/IJ;N/PHEMALIGE/WILRICH/INRIPX.HTRT1N
[18] TCVN 8128 (ISO 11133), Vi sinh vật trong thực phẩm, thức ăn chăn nuôi và nước - Chuẩn bị, sản xuất, bảo quản và thử hiệu năng môi trường nuôi cấy
[19] TCVN 6404 (ISO 7218), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Yêu cầu chung và hướng dẫn kiểm tra vi sinh vật.
1) Thiết bị Roche LightCycler® 480 và real-time PCR ABI 7900HT là các ví dụ về sản phẩm phù hợp có bán sẵn tương ứng của Roche Diagnostics và Lite Technologies. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng các sản phẩm này. Các sản phẩm tương tự có thể được sử dụng nếu cho các kết quả tương đương.
2) Minor groove binder (MGBTM) là ví dụ về sản phẩm phù hợp có bán sẵn của Applied Biosystems. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng sản phẩm này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
3) Các thiết bị ABI 7300, 7500 và real-time PCR BioRad CFX96TM ví dụ về các sản phẩm phù hợp có bán sẵn tương ứng của Applied Biosystems và BioRad. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng các sản phẩm này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
4) Bộ kit thử tế bào và huyết DNeasy hoặc bộ kit thử tinh sạch AND hoàn chỉnh MasterPure là ví dụ về các sản phẩm phù hợp có bán sẵn tương ứng của Qiagen (Gmbh), (Hilden, Đức) và Trung tâm Công nghệ sinh học (Madision, Wl, Mỹ). Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng các sản phẩm này. Có thể sử dụng sản phẩm tương tự nếu cho kết quả tương đương.
5) ABI 7300, 7500 và real-time PCR BioRad CFX96™ là ví dụ về các sản phẩm phù hợp có bán sẵn tương ứng của Life Technologies và Bio-Rad. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng sản phẩm này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
6) ABI 7500 và real-time PCR BioRad CFX96™ là ví dụ về các sản phẩm phù hợp có bán sẵn tương ứng của Applied Biosystems và Bio-Rad. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng các sản phẩm này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 11924:2017 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 11924:2017 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 11924:2017 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 11924:2017 DOC (Bản Word)