- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 10780-2:2015 ISO/TS 6579-2:2012 Vi sinh vật trong thực phẩm và thức ăn chăn nuôi-Phương pháp phát hiện, định lượng và xác định kiểu huyết thanh của Salmonella-Phần 2: Định lượng bằng kỹ thuật số đếm có xác suất lớn nhất được thu nhỏ
| Số hiệu: | TCVN 10780-2:2015 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Thực phẩm-Dược phẩm , Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
09/07/2015 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 10780-2:2015
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 10780-2:2015
TIÊU CHUẨN QUỐC GIA
TCVN 10780-2:2015
ISO/TS 6579-2:2012
VI SINH VẬT TRONG THỰC PHẨM VÀ THỨC ĂN CHĂN NUÔI - PHƯƠNG PHÁP PHÁT HIỆN, ĐỊNH LƯỢNG VÀ XÁC ĐỊNH KIỂU HUYẾT THANH CỦA SALMONELLA - PHẦN 2: ĐỊNH LƯỢNG BẰNG KỸ THUẬT SỐ ĐẾM CÓ XÁC SUẤT LỚN NHẤT ĐƯỢC THU NHỎ
Microbiology of food and animal feed - Horizontal method for the detection, enumeration and serotyping of Salmonella - Part 2: Enumeration by a miniaturizied most probable number technique
Lời nói đầu
TCVN 10780-2:2015 hoàn toàn tương đương với ISO/TS 6579-2:2012;
TCVN 10780-2:2015 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC/F13 Phương pháp phân tích và lấy mẫu biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Lời giới thiệu
Quy trình này dựa trên phương pháp nêu trong Tài liệu tham khảo [1].
Quy trình định lượng này liên quan đến kỹ thuật số đếm có xác suất lớn nhất (MPN). Đối với kỹ thuật MPN mini-MSRV (môi trường Rappaport-Vaasiliadis nửa đặc cải biến) này thì thể tích dịch pha loãng ban đầu được thử nghiệm ít hơn thể tích dịch pha loãng ban đầu trong phương pháp phát hiện nêu trong TCVN 4829:2005 sửa đổi 1:2008 (ISO 6579:2002, Cor 1:2004, Amd 1:2007 [5]). Vì lý do này, nên độ nhạy của kỹ thuật mini-MSRV thấp hơn độ nhạy trong các phương pháp phát hiện này (Tài liệu tham khảo [1]). Giới hạn phát hiện của phương pháp mini-MSRV là khoảng 1 cfu/g nhưng có thể thay đổi tùy theo kiểu kháng nguyên của Salmonella và từng nền mẫu. Đối với các phương pháp phát hiện đã đề cập trước đây thì giới hạn phát hiện này thường là 1 cfu/25 g (0,04 cfu/g). Đối với các mẫu có số lượng Salmonella spp. (rất) thấp (<1 cfu/g) thì quy trình mini-MRSV có thể không đủ nhạy. Nếu yêu cầu kết quả định lượng đối với các mẫu chứa số lượng Salmonella spp. thấp như vậy (ví dụ, phép thử âm tính đối với kỹ thuật mini-MRSV này) thì nên định lượng bằng kỹ thuật MNP "thông thường" (không thu nhỏ). Đối với mẫu khác, phương pháp mini-MSRV có thể có lợi thế hơn kỹ thuật MNP thông thường do hiệu quả của kỹ thuật MNP thu nhỏ có thể mất ít thời gian hơn và cần ít nguồn vật liệu hơn (do số lượng nhỏ).
VI SINH VẬT TRONG THỰC PHẨM VÀ THỨC ĂN CHĂN NUÔI - PHƯƠNG PHÁP PHÁT HIỆN, ĐỊNH LƯỢNG VÀ XÁC ĐỊNH KIỂU HUYẾT THANH CỦA SALMONELLA - PHẦN 2: ĐỊNH LƯỢNG BẰNG KỸ THUẬT SỐ ĐẾM CÓ XÁC SUẤT LỚN NHẤT ĐƯỢC THU NHỎ
Microbiology of food and animal feed - Horizontal method for the detection, enumeration and serotyping of Salmonella - Part 2: Enumeration by a miniaturizied most probable number technique
CẢNH BÁO - Để bảo vệ sức khỏe của nhân viên phòng thí nghiệm, chỉ thử nghiệm để phát hiện Salmonella trong phòng thử nghiệm được trang bị, dưới sự kiểm soát của người phân tích vi sinh vật có kinh nghiệm và rất cẩn thận trong quá trình xử lý tất cả các vật liệu đã ủ.
Người sử dụng tiêu chuẩn này phải thành thạo với các thao tác phòng thử nghiệm thông thường. Tiêu chuẩn này không đề cập đến tất cả các vấn đề an toàn, liên quan đến việc sử dụng tiêu chuẩn. Người sử dụng tiêu chuẩn phải tự thiết lập các thao tác an toàn sức khỏe thích hợp và đảm bảo tuân thủ các quy định hiện hành.
1. Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp định lượng Salmonella spp. có trong:
- các thực phẩm dùng cho người và thức ăn chăn nuôi;
- các mẫu môi trường trong khu vực sản xuất và chế biến thực phẩm;
- phân động vật;
- các mẫu môi trường trong giai đoạn sản xuất ban đầu;
bằng cách tính số có xác suất lớn nhất (MPN).
Phương pháp này dựa trên sự thu nhỏ các bước pha loãng, tăng sinh sơ bộ và tăng sinh chọn lọc. Môi trường tăng sinh chọn lọc, môi trường Rappaport-Vassiliadis nửa đặc cải biến (MSRV) được dùng để phát hiện các Salmonella di động và không thích hợp để phát hiện Salmonella không di động.
Phương pháp này ít thích hợp để định lượng Salmonella ser. Typhi và Salmonella ser. Paratyphi.
Phương pháp này không thích hợp cho việc định lượng Salmonella spp. trong các mẫu bị nhiễm bẩn thấp (< 1 cfu/g).
CHÚ THÍCH: Salmonella không di động thường ít có trong các nền mẫu liên quan đến phương pháp này. Chú thích này đưa ra các ví dụ về các mẫu thu được từ giai đoạn sản xuất ban đầu. Các Salmonella biovar không di động thuộc Salmonella Gallinarum (Salmonella Gallinarum biovar gallinarum và Salmonella Gallinarum biovar pullorum) không tồn tại lâu dài trong các mẫu môi trường và do đó rất khó phát hiện trong mẫu phân hoặc mẫu môi trường (như bụi) (không là đối tượng của phương pháp). Số lượng các Salmonella serovar không di động khác có trong mẫu phân thường rất thấp. Ví dụ: trong Tài liệu tham khảo [4], trong khoảng 1 000 mẫu phân gà đẻ trứng và khoảng 900 mẫu phân gà giò được phân tích thì có ít hơn 1 % tổng số mẫu là dương tính trong canh thang chọn lọc và đồng thời âm tính trên môi trường MSRV (và dường không di động). Kết quả tương tự cũng được tìm thấy trong một nghiên cứu của Hà Lan với khoảng 3 200 mẫu phân lợn (số liệu chưa công bố). Mặt khác, trong trường hợp nghiên cứu được báo cáo trong Tài liệu tham khảo [4], thì các mẫu dương tính lên đến gần 40 % không phát hiện được (tức là âm tính giả) nếu chỉ sử dụng canh thang chọn lọc (trong trường hợp này là môi trường Rappaport-Vassiliadis) thay vì sử dụng môi trường nửa đặc.
2. Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 6404 (ISO 7218), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Yêu cầu chung và hướng dẫn kiểm tra vi sinh vật.
TCVN 6507 (ISO 6887) (tất cả các phần), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử, huyền phù ban đầu và các dung dịch pha loãng thập phân để kiểm tra vi sinh vật.
TCVN 8128-1 (ISO/TS 11133-1), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Hướng dẫn chuẩn bị và sản xuất môi trường nuôi cấy - Phần 1: Hướng dẫn chung về đảm bảo chất lượng đối với việc chuẩn bị môi trường nuôi cấy trong phòng thử nghiệm.
TCVN 8128-2 (ISO/TS 11133-2), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Hướng dẫn chuẩn bị và sản xuất môi trường nuôi cấy - Phần 2: Các hướng dẫn thực hành về thử hiệu năng của môi trường nuôi cấy.
3. Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng các thuật ngữ và định nghĩa sau:
3.1. Salmonella (Salmonella)
Các vi sinh vật hình thành các khuẩn lạc điển hình hoặc ít điển hình trên môi trường đặc chọn lọc và có các đặc điểm sinh hóa và huyết thanh đặc trưng.
CHÚ THÍCH: Các phép thử thích hợp về các đặc tính sinh hóa và huyết thanh đặc trưng được quy định trong tiêu chuẩn này.
3.2. Số đếm Salmonella (count of Salmonella)
Số lượng Salmonella spp. tìm thấy có trong một mililit hoặc một gam mẫu thử hoặc một diện tích bề mặt hoặc trên một vật thể (ví dụ bao gạc bọc ủng).
4. Nguyên tắc
4.1. Yêu cầu chung
Định lượng Salmonella spp. bằng kỹ thuật MPN cần qua bốn giai đoạn kế tiếp nhau (từ 4.2 đến 4.5).
4.2. Tăng sinh sơ bộ trong môi trường lỏng không chọn lọc
Chuẩn bị dung dịch pha loãng ở độ pha loãng 10-1 của các mẫu trong nước đệm pepton (BPW) (huyền phù ban đầu).
Cho huyền phù ban đầu vào hàng ba giếng (rỗng) thứ nhất của đĩa 12 giếng.
Cấy một lượng xác định thu được từ hàng thứ nhất trong đĩa 12 giếng vào hàng thứ hai gồm ba giếng chứa canh thang tăng sinh sơ bộ không chọn lọc (BPW).
Cấy vào ba giếng của hàng thứ ba, thứ tư và nếu cần cấy vào nhiều hơn hàng ba giếng chứa BPW.
Ủ đĩa 12 giếng đã cấy ở 37 oC trong 18 h.
4.3. Tăng sinh trên môi trường nửa đặc chọn lọc
Cấy truyền từng giếng thu được trong 4.2 vào giếng chứa thạch nửa đặc (MSRV).
Ủ ở 41,5 oC (MSRV) trong 24 h. Nếu MSRV là âm tính sau 24 h thì ủ đĩa tiếp 24 h.
4.4. Cấy đĩa chọn lọc và nhận biết
Từ các dịch cấy (nghi ngờ) (các dung dịch pha loãng nhất) thu được trong 4.3, cấy vào thạch deoxycholat lysin xylose (XLD) môi trường đặc chọn lọc và ủ ở 37 oC trong 24 h.
4.5. Khẳng định
Khẳng định các khuẩn lạc Salmonella giả định thu được trong 4.4 bằng các thử nghiệm sinh hóa và huyết thanh thích hợp.
4.6. Tính số đếm có xác suất lớn nhất
Từ số lượng các giếng đã khẳng định dương tính, tính số MPN của Salmonella spp. có trong một mililit hoặc một gam mẫu thử.
5. Huyết thanh và môi trường nuôi cấy
5.1. Yêu cầu chung
Đối với thực hành phòng thử nghiệm, xem TCVN 6404 (ISO 7218).
Để kiểm tra hiệu quả của môi trường nuôi cấy, nên tiến hành theo TCVN 8128-1 (ISO/TS 11133-1), TCVN 8128-2 (ISO/TS 11133-2) và các thông tin nêu trong A.8.
Tất cả các thuốc thử và môi trường cần thiết được quy định trong Phụ lục A. Ngoài ra, có thể sử dụng các chất pha loãng hoặc môi trường hoàn chỉnh khô, khi đó, sử dụng theo hướng dẫn của nhà sản xuất.
5.2. Môi trường nuôi cấy
5.2.1. Môi trường tăng sinh sơ bộ không chọn lọc: Nước đệm pepton (BPW). Xem A.1.
5.2.2. Thạch tăng sinh chọn lọc nửa đặc: Môi trường Rappaport-Vassiliadis nửa đặc cải biến (MSRV). Xem A.2.
5.2.3. Thạch deoxycholat-lysin-xylose (XLD). Xem A.3.
5.2.4. Thạch dinh dưỡng. Xem A.4.
5.2.5. Thạch sắt-ba đường (thạch TSI ). Xem A.5.
Có thể sử dụng thạch sắt-hai đường (Kligler-Hajna) để thay thế cho thạch sắt-ba đường.
5.2.6. Thạch urê (Christensen). Xem A.6.
5.2.7. Môi trường L-Lysin khử cacboxyl (LDC). Xem A.7.
5.2.8. Kháng huyết thanh
Một số kiểu huyết thanh ngưng kết có chứa các kháng thể đối với một hoặc vài kháng nguyên O và đối với một hoặc vài kháng nguyên H có bán sẵn.
Trong mọi thử nghiệm phải đảm bảo rằng các kháng huyết thanh được sử dụng là đủ để phát hiện tất cả các kiểu huyết thanh Salmonella.
6. Thiết bị và dụng cụ thủy tinh
Có thể sử dụng dụng cụ thủy tinh dùng một lần thay cho các dụng cụ thủy tinh sử dụng nhiều lần nếu chúng có các đặc tính tương đương.
Sử dụng thiết bị phòng thử nghiệm vi sinh thông thường và cụ thể như sau:
6.1. Thiết bị khử trùng khô (lò sấy) hoặc khử trùng ướt (nồi hấp áp lực). Xem TCVN 6404 (ISO 7218).
6.2. Tủ sấy hoặc lò sấy thông gió, có thể duy trì nhiệt độ từ 25 oC đến 50 oC hoặc tủ thông khí phân tầng.
6.3. Tủ ấm, có thể vận hành ở 37 oC ± 1oC và 41,5 oC ± 1 oC.
6.4. Nồi cách thủy, có thể vận hành ở 47 oC đến 50 oC.
6.5. Tủ lạnh (dùng để bảo quản các môi trường đã chuẩn bị), có thể vận hành ở 5 oC ± 3 oC.
6.6. Dụng cụ đo pH, có độ phân giải 0,01 pH và độ chính xác ± 0,1 đơn vị pH ở 25 oC. Xem TCVN 6404 (ISO 7218).
6.7. Ống nghiệm hoặc bình cầu vô trùng, có dung tích thích hợp. Có thể sử dụng bình hoặc chai và ống nghiệm có nắp đậy bằng kim loại hoặc bằng chất dẻo không độc.
6.8. Que cấy vòng vô trùng, 1 μl.
6.9. Pipet chia vạch hoặc pipet tự động vô trùng, có dung tích danh định 10 ml (được chia vạch 0,5 ml), 2 ml (được chia vạch 0,1 ml), 0,1 ml (được chia vạch 0,01 ml). Pipet đa kênh dung tích danh định 0,5 ml và 0,02 ml để bơm cùng một lúc vào ba giếng.
6.10. Đĩa Petri vô trùng, có đường kính khoảng 90 mm.
6.11. Đĩa 12 giếng vô trùng, có đường kính khoảng 25 mm và sâu 20 mm (dung tích 5 ml), đáy phẳng có nắp.
6.12. Máy đồng hóa, xem TCVN 6404 (ISO 7218).
7. Lấy mẫu
Việc lấy mẫu không quy định trong tiêu chuẩn này. Xem tiêu chuẩn cụ thể đối với các sản phẩm liên quan.
Mẫu gửi đến phòng thử nghiệm phải là mẫu đại diện. Mẫu không bị hư hỏng trong suốt quá trình bảo quản hoặc vận chuyển.
Nếu không có tiêu chuẩn cụ thể đối với việc lấy mẫu của các sản phẩm tương ứng thì các bên có liên quan có thể tự thỏa thuận về vấn đề này.
8. Chuẩn bị mẫu thử
Chuẩn bị mẫu thử theo tiêu chuẩn cụ thể phù hợp với các sản phẩm tương ứng.
Nếu không có tiêu chuẩn cụ thể thì các bên có liên quan có thể tự thỏa thuận về vấn đề này.
9. Cách tiến hành
9.1. Phần mẫu thử và huyền phù ban đầu
Xem TCVN 6507 (ISO 6887) và tiêu chuẩn cụ thể phù hợp với các sản phẩm tương ứng. Chuẩn bị huyền phù ban đầu bằng cách pha loãng mẫu thử 10 lần trong BPW (5.2.1). Ví dụ, cho 25 g mẫu vào 225 ml BPW và đồng hóa, ví dụ: trong một máy đồng hóa (6.12), trong 1 min.
9.2. Pha loãng và tăng sinh sơ bộ trong môi trường lỏng không chọn lọc
Lấy một đĩa 12 giếng (6.11) có các giếng rỗng trong hàng ba giếng thứ nhất và các giếng khác (hàng ba giếng thứ hai, thứ ba và thứ tư, xem Phụ lục B) có chứa 2 ml BPW (5.2.1).
CHÚ THÍCH 1: Trong trường hợp chung, quy trình này quy định các dung dịch pha loãng cho một đĩa 12 giếng. Khi nghi ngờ số đếm Salmonella cao hơn 500 cfu/g thì cần tiến hành với một đĩa 12 giếng thứ hai có chứa 2 ml BPW (5.2.1) trong mỗi giếng. Chuẩn bị đủ số lượng đĩa (hoặc dung dịch pha loãng) để đảm bảo rằng giếng cuối cùng trong đĩa 12 giếng cho kết quả âm tính.
Dùng pipet (6.9) chuyển 2,5 ml huyền phù ban đầu (9.1) vào từng giếng trong hàng ba giếng (rỗng) thứ nhất.
Chuyển 0,5 ml huyền phù (ví dụ: dùng pipet đa kênh, 6.9) trong mỗi giếng hàng thứ nhất vào các giếng hàng thứ hai có chứa 2 ml BPW (độ pha loãng 5-1 thứ nhất).
Chuyển 0,5 ml huyền phù (ví dụ: dùng pipet đa kênh, 6.9, với đầu pipet mới) trong mỗi giếng hàng thứ hai vào các giếng trong hàng thứ ba có chứa 2 ml BPW (độ pha loãng 5-1 thứ hai).
Trước khi chuyển 0,5 ml huyền phù trong hàng giếng thứ hai vào hàng giếng thứ ba thì trộn huyền phù trong các giếng này bằng cách lặp lại thao tác hút và nhả (cẩn thận) huyền phù trong pipet vào các giếng.
Tiến hành tương tự đối với các hàng giếng khác.
Ủ đĩa 12 giếng đã cấy trong tủ ấm (6.3) ở 37 oC trong 18 h ± 2 h.
CHÚ THÍCH 2: Do mức nhiễm bẩn của các mẫu thử nghiệm thường không biết rõ và thường thấp, nên có thể đánh giá chứng minh để kiểm tra sự có mặt của Salmonella spp. trong mẫu bằng cách cũng nuôi cấy huyền phù ban đầu. Đối với mục đích này, ủ huyền phù ban đầu (9.1) trong tủ ấm (6.3) ở 37 oC trong 18 h ± 2 h. Đối với các bước nuôi cấy tiếp theo, tiến hành theo quy trình nêu trong 9.3 đến 9.5. Trong 9.3: cấy các chấm đều nhau 1 đến 3 lên đĩa Petri có chứa MSRV với tổng thể tích dịch cấy BPW của huyền phù ban đầu (9.1) đã ủ là 0,1 ml.
9.3. Tăng sinh chọn lọc trên môi trường nửa đặc
Để các đĩa 12 giếng chứa MSRV (5.2.2) ổn định đến nhiệt độ phòng nếu các đĩa này được bảo quản ở nhiệt độ thấp hơn.
Cấy 20 μl dịch cấy BPW (9.2) vào mỗi giếng chứa 2 ml MSRV, ví dụ: sử dụng pipet đa kênh (6.9). Sử dụng các đầu tip mới cho từng hàng ba giếng.
Cho 20 μl dịch cấy BPW ở thành giếng và trên bề mặt môi trường (xem Phụ lục B).
Khi lấy dịch cấy truyền từ BPW, cố gắng không làm xáo trộn các mẫu hạt. Sau đó, chuyển các đĩa cẩn thận. Tránh làm rớt các mẫu hạt từ pipet lên các đĩa MSRV.
Ủ các đĩa MSRV đã cấy trong tủ ấm (6.3) ở 41,5 oC trong 24 h ± 3 h
Không lật úp các đĩa.
Các giếng nghi ngờ cho thấy có vùng trắng xám, đục lan rộng ra ngoài giọt được cấy. Vùng đục được đặc trưng bởi một quầng sáng trắng có một viền xác định rõ.
Nếu các giếng đều âm tính sau 24 h thì ủ tiếp 24 h ± 3 h.
9.4. Cấy đĩa chọn lọc
Để các đĩa thạch XLD (5.2.3) cân bằng đến nhiệt độ phòng, nếu các đĩa này được bảo quản ở nhiệt độ thấp hơn. Nếu cần, làm khô bề mặt các đĩa trước khi sử dụng.
Cấy truyền các giếng MSRV nghi ngờ (9.3) bằng cách nhúng que cấy vòng 1 μl (6.8) ngay bên trong mép của vùng phát triển đục và bằng cách cấy chất cấy này lên bề mặt của một đĩa XLD kích thước chuẩn sao cho thu được các khuẩn lạc phân lập tốt.
Cấy truyền các dung dịch pha loãng nhất: các dung dịch pha loãng vẫn cho thấy có ba giếng MSRV
nghi ngờ cũng như các dung dịch pha loãng tiếp theo cho thấy một hoặc hai giếng MSRV nghi ngờ.
Ủ các đĩa XLD đã lật úp trong tủ ấm (6.3) ở 37 oC trong 24 h ± 3 h.
Đặt lại các đĩa MSRV âm tính vào tủ ấm (6.3) ở 41,5 oC và ủ tiếp 24 h ± 3 h. Thực hiện quy trình đổ đĩa chọn lọc nếu sau 48 h ủ các giếng cho thấy nghi ngờ.
Các khuẩn lạc Salmonella spp. điển hình phát triển trên thạch XLD có tâm màu đen và có quầng màu đỏ nhạt trong suốt do sự đổi màu của chất chỉ thị.
CHÚ THÍCH: Các biến thể Salmonella spp. âm tính với hydro sulfua phát triển trên thạch XLD có màu hồng với tâm màu hồng sẫm. Các biến thể Salmonella spp. dương tính với lactose phát triển trên thạch XLD có màu vàng với tâm màu đen hoặc không.
9.5. Khẳng định sinh hóa và huyết thanh
9.5.1. Yêu cầu chung
Tiến hành khẳng định ít nhất một khuẩn lạc nghi ngờ được phân lập tốt từ mỗi đĩa XLD (9.4). Nếu không thể thu được khuẩn lạc phân lập tốt thì tiến hành thêm bước nuôi cấy phụ trên thạch XLD hoặc trên thạch không chọn lọc, ví dụ: thạch dinh dưỡng (5.2.4), để thu được khuẩn lạc phân lập tốt.
Nếu tất cả các giếng được chọn được khẳng định là không có Salmonella spp. thì cần kiểm tra lại các giếng MSRV giả định chưa được cấy truyền (trong dung dịch pha loãng thấp hơn).
Có thể sử dụng các kit nhận biết có bán sẵn trong phép thử sinh hóa Salmonella spp., nếu được chứng minh là đáng tin cậy. Sử dụng các kit nhận biết để khẳng định sinh hóa các khuẩn lạc. Các kit này cần được sử dụng theo hướng dẫn của nhà sản xuất.
CHÚ THÍCH: Cần có nhiều kinh nghiệm khi nhận biết các khuẩn lạc Salmonella spp. vì hình dạng bên ngoài của chúng có thể thay đổi ít nhiều không chỉ từ serovar này đến serovar khác mà còn từ mẻ này đến mẻ khác của môi trường nuôi cấy chọn lọc được sử dụng.
9.5.2. Chọn các khuẩn lạc để khẳng định
Để khẳng định, lấy từ mỗi đĩa XLD (9.4) ít nhất một khuẩn lạc được coi là điển hình hoặc nghi ngờ.
Nếu các khuẩn lạc phân lập tốt (của dịch cấy thuần khiết) có sẵn trên môi trường đổ đĩa chọn lọc (9.4) thì phép thử khẳng định sinh hóa có thể được thực hiện trực tiếp trên một khuẩn lạc nghi ngờ được phân lập tốt từ môi trường đổ đĩa chọn lọc đó. Bước nuôi cấy trên môi trường thạch không chọn lọc giống như trên thạch dinh dưỡng (5.2.4) có thể thực hiện song song với các phép thử sinh hóa để kiểm tra độ thuần khiết của khuẩn lạc được lấy từ môi trường thạch chọn lọc. Ủ các đĩa thạch dinh dưỡng đã được cấy trong tủ ấm (6.3) ở 37 oC trong 24 h ± 3 h.
Sử dụng các chủng cấy thuần khiết để khẳng định phép thử sinh hóa và huyết thanh.
9.5.3. Khẳng định sinh hóa
9.5.3.1. Yêu cầu chung
Sử dụng que cấy, cấy từng dịch nuôi cấy thu được từ các khuẩn lạc đã chọn trong 9.5.2 vào các môi trường quy định trong 9.5.3.2, 9.5.3.3 và 9.5.3.4.
9.5.3.2. Thạch TSI (5.2.5)
Cấy vạch trên bề mặt nghiêng của thạch và cấy đâm sâu xuống đáy. Ủ trong tủ ấm (6.3) ở 37 oC trong 24 h ± 3 h.
Diễn giải các thay đổi trong môi trường như sau:
| Cấy đâm sâu | màu vàng | glucose dương tính (sử dụng glucose) |
| màu đỏ hoặc không đổi màu | glucose âm tính (không sử dụng glucose) | |
| màu đen | sinh khí hydro sulfua | |
| bọt khí hoặc vết nứt | sinh khí từ glucose | |
| Cấy nghiêng trên bề mặt thạch | màu vàng | lactose và/hoặc sucrose dương tính (sử dụng lactose và/hoặc sucrose) |
| màu đỏ hoặc không đổi màu | lactose và sucrose âm tính (không sử dụng lactose và không sử dụng sucrose) |
Các chủng cấy Salmonella spp. điển hình cho thấy tính kiềm (màu đỏ) trên bề mặt nghiêng và tính axit (màu vàng) có sinh khí (bọt khí) và sinh khí hydro sulfua (thạch bị đen) (trong khoảng 90 % trường hợp) khi cấy đâm sâu, xem Bảng 1.
Biến thể Salmonella spp. dương tính với lactose có màu vàng trên bề mặt nghiêng của thạch TSI. Do đó, việc khẳng định sơ bộ các chủng cấy Salmonella không chỉ dựa trên kết quả của phép thử trên thạch TSI.
9.5.3.3. Thạch urê (5.2.6)
Cấy vạch trên bề mặt nghiêng của thạch. Ủ trong tủ ấm (6.3) ở 37 oC trong 24 h ± 3 h và kiểm tra thường xuyên.
Nếu phản ứng dương tính, thì có sự phân hủy urê thành amoniac, làm đổi màu phenol đỏ thành màu hồng và sau đó chuyển thành màu đỏ hồng. Phản ứng này thường xuất hiện sau 2 h đến 4 h.
Các chủng cấy Salmonella điển hình không thủy phân urê, do đó màu sắc của urê vẫn không thay đổi (màu vàng, xem Bảng 1).
9.5.3.4. Môi trường L-Lysin đã khử nhóm carboxyl (5.2.7)
Cấy truyền ngay dưới bề mặt của môi trường lỏng. Ủ trong tủ ấm (6.3) ở 37 oC trong 24 h ± 3 h.
Màu đục và màu đỏ tía sau khi ủ cho thấy phản ứng dương tính. Màu vàng cho thấy phản ứng âm tính. Hầu hết các chủng cấy Salmonella điển hình cho phản ứng dương tính (xem Bảng 1).
9.5.3.5. Giải thích các phép thử sinh hóa
Nhìn chung, Salmonella cho thấy các phản ứng như trong Bảng 1. Nếu có các phản ứng này, có thể coi rằng mẫu có chứa Salmonella spp.
Bảng 1 - Giải thích các phép thử sinh hóa; các phản ứng điển hình của hầu hết các serovar của Salmonella (phần trăm nêu trong ngoặc)
| Thạch TSI | ||
| Cấy đâm sâu | màu vàng | glucose dương tính (100 %) |
| màu đen | sinh khí hydro sulfua, H2S (91,6 %) | |
| bọt khí hoặc vết nứt | sinh khí từ glucose (91,9 %) | |
| Cấy nghiêng trên bề mặt thạch | màu đỏ hoặc không đổi màu | lactose và/hoặc sucrose âm tính (tương ứng với 99,2 % và 99,5 %) |
| Thạch urê | ||
| - | màu vàng, không đổi màu môi trường | âm tính (100 %) |
| LDC | ||
| - | đục và màu đỏ tía | dương tính (94,6 %) |
9.5.4. Khẳng định huyết thanh và kiểu huyết thanh
Các kết quả của phép thử sinh hóa có thể chỉ ra rằng khuẩn lạc phân lập được thuộc chi Salmonella. Đối với kiểu đầy đủ của các chủng Salmonella, thì có thể tiến hành khẳng định kiểu huyết thanh. Việc khẳng định huyết thanh cung cấp thêm thông tin về nhóm huyết thanh thuộc chủng phân lập. Đối với kiểu huyết thanh có thể tiếp tục phân lập đến mức serovar. Để biết thêm chi tiết, xem TCVN 4829 (ISO 6579) [5] và Tài liệu tham khảo [3].
10. Biểu thị kết quả
Đếm số lượng các giếng cho phản ứng khẳng định dương tính trên mỗi độ pha loãng. Tính số MPN từ số lượng các giếng khẳng định dương tính ở mỗi độ pha loãng.
Nếu tất cả các giếng âm tính, nhưng huyền phù ban đầu (ở độ pha loãng 10-1) được tìm thấy là dương tính với Salmonella spp. (sau khi khẳng định) thì kết quả có thể được báo cáo là: Salmonella spp. có mặt trong lượng mẫu thử nghiệm (ví dụ: 25 g), nhưng thấp hơn giới hạn phát hiện dưới của phương pháp mini-MPN (<1 cfu/g).
Để tính số MPN, có thể sử dụng các công thức được nêu trong TCVN 6404 (ISO 7218), vì không có sẵn các bảng số MPN "chuẩn" cho tất cả các độ pha loãng được sử dụng. Chương trình phần mềm sử dụng trong Excel1) có thể xử lý các mức 10 của các dãy pha loãng. Nên sử dụng chương trình này, vì tất cả các kết quả kết hợp cụ thể thu được từ ba độ pha loãng sẽ giống như các kết quả nêu trong các bảng của TCVN 6404 (ISO 7218). Các thông tin chi tiết về việc tính toán được nêu trong Tài liệu tham khảo [2] và các phần mềm là miễn phí có sẵn trên: http://standards.iso.org/iso/ts/6579/-2/
11. Báo cáo thử nghiệm
Báo cáo thử nghiệm phải chỉ rõ:
a) mọi thông tin cần thiết để nhận biết đầy đủ về mẫu thử;
b) phương pháp lấy mẫu đã sử dụng, nếu biết;
c) phương pháp thử đã dùng, viện dẫn đến tiêu chuẩn này;
d) mọi chi tiết thao tác không quy định trong tiêu chuẩn này hoặc được coi là tùy chọn cùng với các tình huống bất thường có thể ảnh hưởng đến kết quả;
e) kết quả thử nghiệm thu được;
f) nêu các kết quả cuối cùng, nếu kiểm tra độ lặp lại.
PHỤ LỤC A
(Tham khảo)
Thành phần và chuẩn bị thuốc thử và môi trường nuôi cấy
CHÚ Ý - Nếu các thuốc thử hoặc môi trường được chuẩn bị từ các thuốc thử hoặc môi trường hoàn chỉnh khô, hoặc nếu sử dụng các thuốc thử và môi trường có sẵn để sử dụng ngay thì phải tuân thủ hướng dẫn của nhà sản xuất liên quan đến việc chuẩn bị, điều kiện bảo quản, thời hạn sử dụng và cách sử dụng.
Thời hạn sử dụng của các môi trường nêu trong Phụ lục này đã được chỉ rõ trong một số nghiên cứu. Người sử dụng cần kiểm tra lại điều này với các điều kiện bảo quản cụ thể [xem TCVN 8128-1 (ISO/TS 11133-1) và TCVN 8128-2 (ISO/TS 11133-2)].
Phép thử hiệu năng về đảm bảo chất lượng môi trường nuôi cấy được nêu trong A.8.
A.1 Nước đệm pepton (BPW)
A.1.1 Thành phần
Peptona 10,0 g
Natri clorua 5,0 g
Dinatri hydro phosphat ngậm mười hai phân tử nước (Na2HPO4.12H2O) 9,0 g
Kali dihydro phosphat (KH2PO4) 1,5 g
Nước 1 000 ml
a Ví dụ sản phẩm phân hủy từ casein bằng enzym.
A.1.2. Chuẩn bị
Hòa tan các thành phần trên trong nước, đun nóng (không đun sôi) nếu cần.
Chỉnh pH sao cho sau khi khử trùng là 7,0 ± 0,2 ở 25 oC, nếu cần.
Phân phối môi trường vào các bình (6.7) có dung tích thích hợp để thu được các lượng cần thiết cho một phép thử.
Khử trùng 15 min ở 121 oC trong nồi hấp áp lực (6.1).
Bảo quản ở 5 oC trong bình kín khí (6.5), đặt ở nơi tối đến 6 tháng.
Sử dụng pipet đa kênh (6.9), bằng kỹ thuật vô trùng chuyển 2 ml môi trường đã chuẩn bị vào từng giếng của đĩa 12 giếng (6.11). Chuẩn bị một đĩa 12 giếng có một hàng ba giếng thứ nhất rỗng.
A.2. Môi trường Rappaport-Vassiliadis nửa đặc cải biến (MSRV)
A.2.1. Môi trường cơ bản
A.2.1.1. Thành phần
Sản phẩm phân hủy từ mô động vật và thực vật bằng enzym 4,6 g
Sản phẩm thủy phân casein bằng axit 4,6 g
Natri clorua (NaCl) 7,3 g
Kali dihydro phosphat (KH2PO4) 1,5 g
Magie clorua khan (MgCl2) 10,9 g
Xanh malachit oxalat 0,04 g
Thạch 2,7 g
Nước 1 000 ml
A.2.1.2. Chuẩn bị
Hòa tan các thành phần trên trong nước.
Đun đến sôi đồng thời khuấy trộn.
CHÚ Ý - Không sử dụng nồi hấp áp lực.
Không để môi trường ở nhiệt độ cao lâu hơn cần thiết.
Để nguội môi trường đến nhiệt độ từ 47 oC đến 50 oC.
A.2.2 Dung dịch novobiocin
A.2.2.1 Thành phần
Muối natri novobiocin 0,05 g
Nước 10 ml
A.2.2.2. Chuẩn bị
Hòa tan muối natri novobiocin trong nước.
Khử trùng bằng cách lọc qua màng lọc cỡ lỗ 0,22 µm.
Dung dịch cần được bảo quản ở 5 oC trong tủ lạnh (6.5) đến 4 tuần hoặc chia thành các lượng nhỏ (ví dụ 2 ml) và được bảo quản ở −20 oC đến 1 năm.
A.2.3. Môi trường hoàn chỉnh
A.2.3.1. Thành phần
Môi trường cơ bản (A.2.1) 1 000 ml
Dung dịch novobiocin (A.2.2) 2 ml
A.2.3.2. Chuẩn bị
Bằng kỹ thuật vô trùng, cho 2 ml dung dịch novobiocin (A.2.2) vào 1 000 ml môi trường cơ bản (A.2.1) ở nhiệt độ từ 47 oC đến 50 oC. Trộn kỹ.
Nồng độ cuối của novobiocin là 10 mg/l môi trường MSRV.
pH cuối phải là 5,2 (từ 5,1 đến 5,4) ở nhiệt độ từ 20 oC đến 25 oC.
Chuyển 2 ml (ví dụ: sử dụng pipet đa kênh 6.9) vào từng giếng trong đĩa 12 giếng (6.11).
Nếu cần, cũng rót vào các đĩa Petri có đường kính 90 mm (6.10) đến thể tích cuối từ 15 ml đến 20 ml. Để môi trường đặc lại trước khi di chuyển và xử lý cẩn thận.
Bảo quản các đĩa, với bề mặt hướng lên trên ở 5 oC trong tủ lạnh (6.5), đặt ở nơi tối, đến 2 tuần.
Không lật úp các đĩa do thạch nửa đặc quá lỏng.
Không sử dụng các đĩa thạch nửa đặc đã hóa lỏng hoặc bị phân mảng.
Ngay trước khi sử dụng, nếu có hơi ẩm đọng thì làm khô cẩn thận bề mặt đĩa thạch, ví dụ: mở nắp và để bề mặt thạch hướng lên rồi đặt vào tủ sấy thông khí. Tiến hành cẩn thận để không làm quá khô môi trường.
A.3. Thạch deoxycolat lyzin xylose (thạch XLD)
A.3.1. Thành phần
Chất chiết nấm men 3,0 g
Natri clorua (NaCl) 5,0 g
D(+)-Xylose 3,75 g
Lactose 7,5 g
Sucrose (sacarose) 7,5 g
L(+)-lysin hydroclorua 5,0 g
Natri thiosulfat (Na2S2O3) 6,8 g
Sắt(III) amino xitrat 0,8 g
Đỏ phenol 0,08 g
Natri deoxycholat 1,0 g
Thạch từ 9 g đến 18 ga
Nước 1 000 ml
a Tùy thuộc vào sức đông của thạch.
A.3.2. Chuẩn bị
Hòa tan các thành phần trên trong nước.
Đun nóng đồng thời khuấy liên tục cho đến khi môi trường bắt đầu sôi. Tránh quá nhiệt.
CHÚ Ý - Không sử dụng nồi hấp áp lực.
Điều quan trọng là tránh chuẩn bị các thể tích quá lớn vì quá trình đun nóng bị kéo dài.
Chỉnh pH đến 7,4 ± 0,2 ở 25 oC, nếu cần.
Chuyển môi trường vào nồi cách thủy (6.4) ở nhiệt độ từ 47 oC đến 50 oC.
Ngay khi môi trường đã nguội, rót vào các đĩa Petri (6.10). Để cho đông đặc.
Bảo quản các đĩa đã rót (lật úp mặt thạch xuống) ở 5 oC trong tủ lạnh (6.5), đặt ở nơi tối đến 4 tuần. Giữ cho các đĩa không bị khô.
Ngay trước khi sử dụng, cần làm khô cẩn thận bề mặt đĩa thạch. Tiến hành cẩn thận để không làm quá khô môi trường.
A.4. Thạch dinh dưỡng
A.4.1. Thành phần
Chất chiết từ thịt 3,0 g
Peptona 5,0 g
Natri clorua (NaCl) (tùy chọn) 5,0 g
Thạch từ 9 g đến 18 gb
Nước 1 000 ml
a Ví dụ, sản phẩm phân hủy từ casein bằng enzym.
b Tùy thuộc vào sức đông của thạch.
A.4.2 Chuẩn bị
Hòa tan các thành phần trên trong nước bằng cách đun nóng.
Chỉnh pH sao cho sau khi khử trùng bằng 7,0 ± 0,2 ở 25 oC, nếu cần.
Chuyển môi trường nuôi cấy vào bình (6.7) có dung tích thích hợp.
Khử trùng 15 min ở 121 oC trong nồi hấp áp lực (6.1).
Chuyển khoảng 15 ml môi trường đã tan chảy vào các đĩa Petri vô trùng (6.10). Để cho đông đặc.
Bảo quản các đĩa đã rót (lật úp mặt thạch xuống) ở 5 oC trong tủ lạnh (6.5), đặt ở nơi tối đến 4 tuần. Giữ cho các đĩa không bị khô.
Ngoài ra, có thể sử dụng các môi trường thạch không chọn lọc thích hợp khác.
A.5. Thạch sắt-ba đường (thạch TSI)
A.5.1. Thành phần
Chất chiết từ thịt 3,0 g
Chất chiết nấm men 3,0 g
Pepton 20,0 g Natri clorua (NaCl) 5,0 g
Lactose 10,0 g
Sucrose 10,0 g
Glucose (dextrose) 1,0 g
Sắt(III) xitrat 0,3 g
Natri thiosulfat (Na2S2O3) 0,3 g
Đỏ phenol 0,024 g
Thạch từ 9 g đến 18 ga
Nước 1 000 ml
a Tùy thuộc vào sức đông của thạch.
A.5.2. Chuẩn bị
Hòa tan các thành phần trên trong nước, đun nóng, nếu cần.
Chỉnh pH sao cho sau khi khử trùng bằng 7,4 ± 0,2 ở 25 oC, nếu cần.
Phân phối các lượng 10 ml môi trường này vào các ống nghiệm, tốt nhất là ống có các nắp vặn.
Khử trùng 15 min ở 121 oC trong nồi hấp áp lực (6.1).
Đặt nghiêng các ống để có độ sâu từ 2,5 cm đến khoảng 5 cm.
Các ống đã được đậy chặt bằng nắp vặn có thể bảo quản ở 5 oC trong tủ lạnh (6.5), đặt ở nơi tối đến 3 tháng.
A.6. Thạch urê (UA) Christensen
A.6.1. Môi trường cơ bản
A.6.1.1. Thành phần
Peptona 1,0 g
Glucose (dextrose) 1,0
Natri clorua (NaCl) 5,0 g
Kali dihydro phosphat (KH2PO4) 2,0 g
Đỏ phenol 0,012 g
Thạch từ 9 g đến 18 ga
Nước 1 000 ml
a Ví dụ, sản phẩm phân hủy từ casein bằng enzym.
b Tùy thuộc vào sức đông của thạch.
A.6.1.2. Chuẩn bị
Hòa tan các thành phần trên trong nước, đun nóng, nếu cần.
Chỉnh pH sao cho sau khi khử trùng bằng 6,8 ± 0,2 ở 25 oC, nếu cần.
Khử trùng 15 min ở 121 oC trong nồi hấp áp lực (6.1).
Bảo quản các bình đã đậy kín khí ở 5 oC trong tủ lạnh (6.5), đặt ở nơi tối đến 3 tháng.
A.6.2. Dung dịch urê
A.6.2.1. Thành phần
Urê 400 g
Nước, thể tích cuối cùng 1 000 ml
A.6.2.2. Chuẩn bị
Hòa tan urê trong nước và khử trùng bằng cách lọc.
Bảo quản các bình đã đậy kín khí ở 5 oC trong tủ lạnh (6.5), đặt ở nơi tối đến 3 tháng.
A.6.3. Môi trường hoàn chỉnh
A.6.3.1. Thành phần
Môi trường cơ bản (A.6.1) 950 ml
Dung dịch urê (A.6.2) 50 ml
A.6.3.2 Chuẩn bị
Ở điều kiện vô trùng, cho dung dịch urê vào môi trường cơ bản đã làm tan chảy và để nguội đến nhiệt độ từ 47 oC đến 50 oC.
Phân phối các lượng 10 ml môi trường hoàn chỉnh vào các ống nghiệm vô trùng. Đặt nghiêng ống nghiệm.
Các ống đã được đậy chặt bằng nắp vặn có thể bảo quản ở 5 oC trong tủ lạnh (6.5), đặt ở nơi tối đến 3 tháng.
A.7. Môi trường L-Lysin đã khử nhóm cacboxyl (LDC)
A.7.1. Thành phần
L-Lysin monohydroclorua 5,0 g
Chất chiết nấm men 3,0 g
Glucose 1,0 g
Đỏ tía bromocresol 0,015 g
Nước 1 000 ml
A.7.2. Chuẩn bị
Hòa tan các thành phần trên trong nước, đun nóng, nếu cần.
Chỉnh pH sao cho sau khi khử trùng là 6,8 ± 0,2 ở 25 oC, nếu cần.
Phân phối các lượng từ 2 ml đến 5 ml môi trường này vào các ống nghiệm (6.7), tốt nhất là ống có nắp vặn.
Khử trùng 15 min ở 121 oC trong nồi hấp áp lực (6.1).
Các ống đã được đậy chặt bằng nắp vặn có thể bảo quản ở 5 oC trong tủ lạnh (6.5), đặt ở nơi tối đến 3 tháng.
A.8. Phép thử hiệu năng về đảm bảo chất lượng của môi trường nuôi cấy
Thông tin về phép thử hiệu năng của môi trường nuôi cấy được nêu trong Bảng A.1 của TCVN 10780-2 (ISO 5579-2). Đối với các định nghĩa về tính chọn lọc và hiệu suất, xem TCVN 8128-1 (ISO/TS 11133-1) và TCVN 8128-2 (ISO/TS 11133-2).
Bảng A.1 - Phép thử hiệu năng của môi trường nuôi cấy
| Môi trường | Tham số | Ủ | Chủng kiểm chứnga | Tiêu chíc |
| BPW | Hiệu suất | 18 h ở 37 oC | Salmonella Typhimurium WDCM 00031b Salmonella Enterididis WDCM 00030 | Độ đục (từ 1 đến 2) |
| MSRV | Hiệu suất | (2x) 24 h ở 41,5 oC | Salmonella Typhimurium WDCM 00031b Salmonella Enterididis WDCM 00030 | Vùng màu trắng xám, màu đục lan ra ngoài giọt cấy. Sau 24 h đến 48 h, vùng màu đục sẽ (hầu hết) bị dịch chuyển khắp đĩa |
| Tính chọn lọc | (2x) 24 h ở 41,5 oC | Escherichia coli WDCM 00012b Escherichia coli WDCM 00012b | Phát triển dương tính tại giọt cấy không có quầng đục | |
| Enterococcus faecalis WDCM 00009b Enterococcus faecalis WDCM 00087 | Không phát triển | |||
| XLD | Hiệu suất | 24 h ở 37 oC | Salmonella Typhimurium WDCM 00031b Salmonella Enterididis WDCM 00030 | Các khuẩn lạc phát triển tốt (2) có tâm màu đen và vùng màu hơi đỏ nhạt do sự đổi màu của môi trường |
| Tính chọn lọc | 24 h ở 37 oC | Escherichia coli WDCM 00012b Escherichia coli WDCM 00013 | Các khuẩn lạc màu vàng phát triển hoặc bị ức chế một phần (từ 0 đến 1) | |
| Enterococcus faecalis WDCM 00009b Enterococcus faecalis WDCM 00087 | Bị ức chế toàn bộ (0) | |||
| Thạch dinh dưỡng | Hiệu suất | 24 h ở 37 oC | Salmonella Typhimurium WDCM 00031 | Phát triển tốt (2) |
| a Đối với thông tin về số lượng chủng cấy và các chi tiết liên hệ, nên tham khảo danh mục chủng có sẵn trên http://refs.wdcm.org/home.htm (WDCM: Trung tâm Dữ liệu về Vi sinh vật Thế giới). b Chủng sử dụng được lựa chọn bởi phòng thử nghiệm cuối cùng (tối thiểu). c Sự phát triển được phân hạng như sau: 0 - không phát triển; 1 - phát triển yếu; 2 - phát triển tốt [xem TCVN 8128-1 (ISO/TS 11133-1) và TCVN 8128-2 (ISO/TS 11133-2)]. | ||||
PHỤ LỤC B
(Tham khảo)
Sơ đồ quy trình
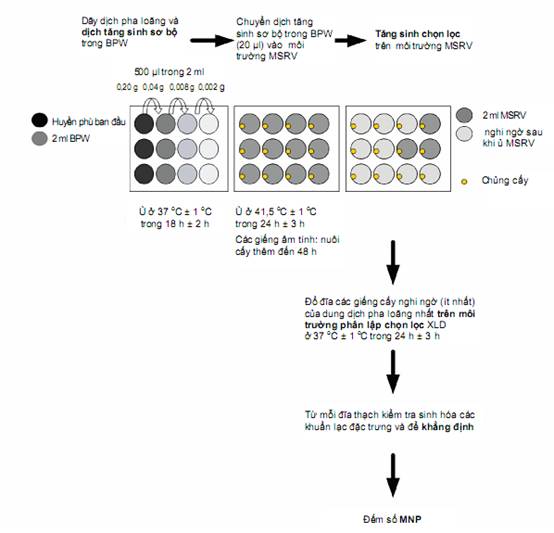
Hình B.1 - Sơ đồ biểu diễn quy trình mini-MSRV
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] FRAVALO, P., HASCOET, Y., LE FELLIC, M., QUEGUINER, S., PETTON, J., SALVAT, G. Convenient method for rapid and quantitative assessment of Salmonella enterica contamination: The mini-MSRV MPN technique. J. Rapid Meth. Automat. Micribiol. 2003, 11, pp. 81-88.
[2] JARVIS, B., WILRICH, C., WILRICH, P.-T. Reconsideration of the derivation of most proble numbers, their standard deviations, confidence bounds and rarity values. J. Appl. Microbiol. 2010, 109, pp, 1660-1667.
[3] GRIMONT,P.A.D., WEILL, F.-X.Antigenic formulae of the Salmonella serovars, 9 thedition, WHO Collaborating Centre for Reference and Research on Salmonella. Paris: Institut Pasteur, 2007. 166 p. Available (viewed 2012-10-15) at: http://www.pastuer.fr/ip/portal/action/Webdrive ActionEvent/oid/01s-000036-089.
[4] VOOGT, N., RAES, M., WANNET, WJB., HENKEN, A.M., VAN DE GIESSEN, A.W. Comparison of selective enrichment media for the detection of Salmonella in poultry faeces. Lett. Appl. Mocrobiol. 2001, 32, pp, pp.89 - 92.
[5] TCVN 4829:2005 sửa đổi 1:2008 (ISO 6579: 2002, Cor 1: 2004, Amd 1: 2007), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp phát hiện Salmonella spp. trên đĩa thạch.
1) Excel là tên thương mại của sản phẩm do Microsoft cung cấp. Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 10780-2:2015 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 10780-2:2015 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 10780-2:2015 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 10780-2:2015 DOC (Bản Word)