- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn TCVN 14444:2025 Thực phẩm - Xác định độc tố saxitoxin trong nhuyễn thể có vỏ - Phương pháp HPLC
| Số hiệu: | TCVN 14444:2025 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Thực phẩm-Dược phẩm |
| Trích yếu: | BS EN 14526:2017 Thực phẩm - Xác định độc tố nhóm saxitoxin trong nhuyễn thể có vỏ - Phương pháp sắc ký lỏng hiệu năng cao (HPLC) có tạo dẫn xuất trước cột và oxy hóa bằng peroxide hoặc periodat | ||
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
24/06/2025 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 14444:2025
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 14444:2025
TIÊU CHUẨN QUỐC GIA
TCVN 14444:2025
BS EN 14526:2017
THỰC PHẨM - XÁC ĐỊNH ĐỘC TỐ NHÓM SAXITOXIN TRONG NHUYỄN THỂ CÓ VỎ - PHƯƠNG PHÁP SẮC KÝ LỎNG HIỆU NĂNG CAO (HPLC) CÓ TẠO DẪN XUẤT TRƯỚC CỘT VÀ OXY HÓA BẰNG PEROXIDE HOẶC PERIODAT
Foodstuffs - Determination of saxitoxin-group toxins in shellfish - HPLC method using pre-column derivatization with peroxide or periodate oxidation
Lời nói đầu
TCVN 14444:2025 hoàn toàn tương đương với BS EN 14526:2017;
TCVN 14444:2025 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC/F11 Thủy sản và sản phẩm thủy sản biên soạn, Viện Tiêu chuẩn Chất lượng Việt Nam đề nghị, Ủy ban Tiêu chuẩn Đo lường Chất lượng Quốc gia thẩm định, Bộ Khoa học và Công nghệ công bố.
Lời giới thiệu
Độc tố gây liệt cơ trong nhuyễn thể có vỏ (PSP) là dẫn xuất của saxitoxin. Các độc tố này được phát hiện trong nhuyễn thể hai mảnh vỏ ăn lọc ở nhiều nơi trên thế giới. Ngộ độc độc tố gây liệt cơ trong nhuyễn thể có vỏ đặc trưng bởi các triệu chứng khác nhau, từ cảm giác ngứa ran nhẹ hoặc tê quanh môi đến tê liệt hô hấp dẫn đến tử vong. Tiêu chuẩn này mô tả phương pháp phân tích định lượng các độc tố PSP này bằng cách chiết từ thịt nhuyễn thể có vỏ, sau đó làm sạch và tách bằng sắc ký lỏng hiệu năng cao (HPLC) sử dụng detector huỳnh quang (FLD).
THỰC PHẨM - XÁC ĐỊNH ĐỘC TỐ NHÓM SAXITOXIN TRONG NHUYỄN THỂ CÓ VỎ - PHƯƠNG PHÁP SẮC KÝ LỎNG HIỆU NĂNG CAO (HPLC) CÓ TẠO DẪN XUẤT TRƯỚC CỘT VÀ OXY HÓA BẰNG PEROXIDE HOẶC PERIODAT
Foodstuffs - Determination of saxitoxin-group toxins in shellfish - HPLC method using pre-column derivatization with peroxide or periodate oxidation
CẢNH BÁO - Khi áp dụng tiêu chuẩn này có thể liên quan đến các vật liệu, thiết bị và các thao tác nguy hiểm. Tiêu chuẩn này không đề cập đến tất cả các vấn đề về an toàn liên quan trong việc sử dụng chúng. Người sử dụng tiêu chuẩn này phải tự thiết lập các thao tác an toàn thích hợp và xác định khả năng áp dụng hoặc các giới hạn quy định trước khi sử dụng tiêu chuẩn.
1 Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp [1] để định lượng saxitoxin (STX), decarbamoyl saxitoxin (dcSTX), neosaxitoxin (NEO), decarbamoyl neosaxitoxin (dcNEO), gonyautoxin 1 và 4 (GTX1,4; tổng các đồng phân), gonyautoxin 2 và 3 (GTX2,3; tổng các đồng phân), gonyautoxin 5 (GTX5 còn được gọi là B1), gonyautoxin 6 (GTX6 còn được gọi là B2), decarbamoyl gonyautoxin 2 và 3 (dcGTX2,3; tổng số đồng phân), N-sulfocarbamoyl-gonyautoxin 1 và 2 (C1,2; tổng các đồng phân) và N-sulfocarbamoyl- gonyautoxin 3 và 4 (C3,4; tổng các đồng phân) [tùy thuộc vào sự sẵn có của các chất chuẩn được chứng nhận (CRM)] trong vẹm, hàu, sò và nghêu (tươi sống). Thực tế phòng thử nghiệm cho thấy tiêu chuẩn cũng có thể áp dụng cho các sản phẩm nhuyễn thể có vỏ [2], [3] và nhuyễn thể có vỏ đã nấu chín khác. Phương pháp này đã được xác nhận giá trị sử dụng trong nghiên cứu liên phòng thử nghiệm [4], [5] và cũng đã được kiểm tra xác nhận trong phép thử hiệu năng EURL nhằm thử nghiệm tổng độc tính của các mẫu thử [6], Các độc tố không có sẵn trong nghiên cứu liên phòng thử nghiệm đầu tiên [4], [5] như dcGTX2,3 và dcNEO được xác nhận giá trị sử dụng trong hai nghiên cứu liên phòng thử nghiệm bổ sung [7], [8]. Các mức xác nhận giá trị sử dụng thấp nhất [4], [5], [8], được tính bằng μg độc tố (dạng base tự do)/kg thịt nhuyễn thể có vỏ và cũng được biểu thị bằng μmol/kg thịt nhuyễn thể có vỏ, được liệt kê trong Bảng 1.
Bảng 1 - Mức xác nhận giá trị sử dụng thấp nhất
| Độc tố | μg/kg | μmol/kg | |
| Saxitoxin (STX) [5] | 22 c | 0,07 c | |
| Gonyautoxin 2,3 (GTX2,3) [5] | 114 b | 0,29 b | |
| Gonyautoxin 5 (GTX5, B1) [5] | 27 c | 0,07 c | |
| dc-Saxitoxin (dcSTX) [5] | 8 c | 0,03 c | |
| Neosaxitoxin (NEO) [5] | 33 c | 0,10 c | |
| Gonyautoxin 1,4 (GTX1.4) [5] | 61,4 c | 0,15 c | |
| N-Sulfocarbamoyl-gonyautoxin 1,2 (C1,2) [5] | 93 c | 0,20 c | |
| N-Sulfocarbamoyl-gonyautoxin 3,4 (C3,4) [5] | 725 b | 1,48 b | |
| Gonyautoxin 6 (GTX6, B2) | Xác định trực tiếp [4] | 30 | 0,08 |
|
| Xác định gián tiếp [9] | 834 b | 2,11 b |
| dc-Gonyautoxin 2,3 (dcGTX2,3) [8] | 271 a | 0,77 a | |
| dc-Neosaxitoxin (dcNEO) [8] | 594 b | 2,18 b | |
| a Mức thêm chuẩn thấp nhất, độ thu hồi trung bình: 58 % [8]. b Nồng độ thấp nhất được thử nghiệm. c Nồng độ thấp nhất được thử nghiệm với giá trị HorRat < 2 [4], [5]. | |||
Phép định lượng GTX6 (B2) không được nêu trong nghiên cứu liên phòng thử nghiệm đầu tiên nhưng một số phòng thử nghiệm đã phát hiện trực tiếp độc tố này sau khi chiết pha rắn có làm sạch bằng cột trao đổi ion (SPE-COOH) và báo cáo nồng độ khối lượng bằng hoặc cao hơn 30 μg/kg trong các mẫu nhất định. Vì lý do đó, phương pháp hiện tại có thể áp dụng để định lượng trực tiếp GTX6 (B2), tùy thuộc vào sự sẵn có của chất chuẩn. Hiện tại, có thể xác định GTX6 sau khi thủy phân dịch chiết phân đoạn 2 của quá trình làm sạch bằng cột SPE-COOH, được mô tả trong 6.4 theo NEO. Định lượng gián tiếp GTX6 đã được xác nhận giá trị sử dụng trong hai nghiên cứu liên phòng thử nghiệm bổ sung [7], [8].
Phép xác định định lượng C3,4 đã được nêu trong nghiên cứu liên phòng thử nghiệm đầu tiên. Phương pháp hiện tại có thể áp dụng để định lượng trực tiếp C3,4, tùy thuộc vào sự sẵn có của chất chuẩn.
Nếu không có sẵn chất chuẩn, chỉ có thể định lượng C3,4 theo GTX1,4, nếu sử dụng cùng một quy trình thủy phân đối với GTX6 (6.4) thì áp dụng dịch chiết phân đoạn 1 của quá trình làm sạch bằng cột SPE-COOH, xem [10].
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau là rất cần thiết cho việc áp dụng tiêu chuẩn. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 4851 (ISO 3696), Nước dùng để phân tích trong phòng thí nghiệm - Yêu cầu kỹ thuật và phương pháp thử.
3 Nguyên tắc
CẢNH BÁO - Độc tố PSP là độc tố thần kinh có thể hấp thụ qua đường hô hấp hoặc đường miệng. Do đó, cần áp dụng các biện pháp bảo vệ thích hợp.
Độc tố gây liệt cơ trong nhuyễn thể có vỏ (PSP) được chiết ra sau khi đồng nhất thịt của nhuyễn thể có vỏ bằng cách gia nhiệt với acid acetic. Sau khi ly tâm, phần nổi phía trên được tinh sạch bằng chiết pha rắn (SPE) sử dụng cột làm sạch C18. Dịch chiết được phân tích bằng HPLC cùng với detector huỳnh quang sau khi oxy hóa bằng periodat hoặc peroxide. Phần lớn các độc tố (STX, C1,2, GTX5 (B1), dcSTX, GTX2,3 và dcGTX2,3) có thể được định lượng sau khi làm sạch bằng cột SPE-C18 [1] .
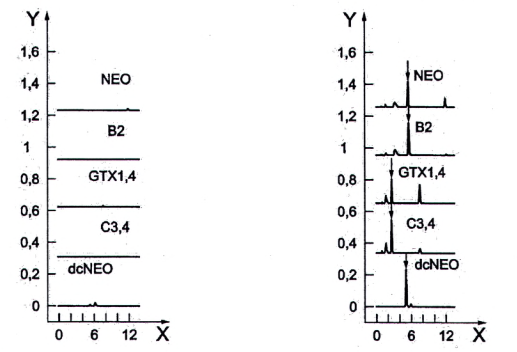
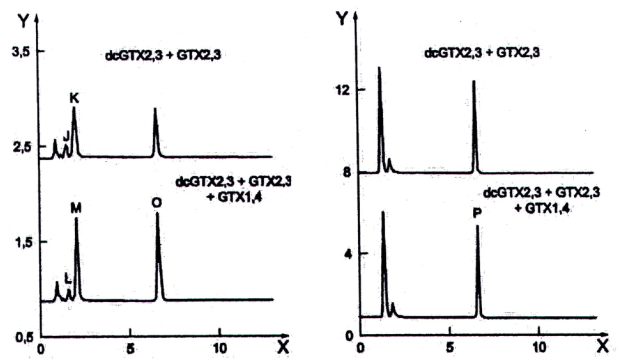
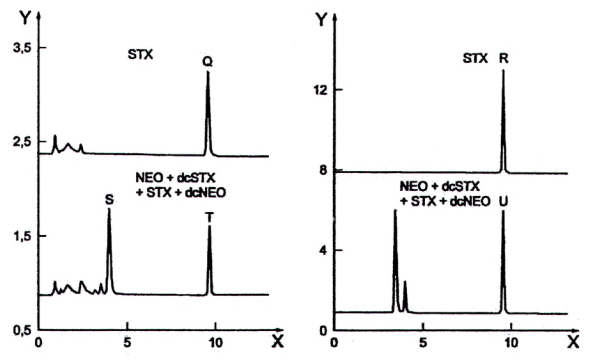
Quá trình oxy hóa các độc tố PSP tạo ra một số sản phẩm phản ứng, các sản phẩm này được tách bằng HPLC pha đảo và phát hiện bằng detector huỳnh quang. Các sản phẩm phản ứng đối với độc tố PSP thu được sau khi oxy hóa bằng peroxide và periodat được nêu trong Bảng 2. Ngoài ra, các sắc ký đồ tương ứng được nêu trong Hình 1.
Các gonyautoxin GTX2 và GTX3 cũng như GTX1 và GTX4, các decarbamoyl gonyautoxin dcGTX2 và dcGTX3, các N-sulfocarbamoyl-gonyautoxin C1 và C2 cũng như C3 và C4 là các đồng phân cấu trúc và dẫn đến cả hai phương pháp oxy hóa các đồng phân cấu trúc sẽ cho các sản phẩm phản ứng tương tự. Lượng các đồng phân cấu trúc được xác định bằng tổng của cả hai độc tố.
STX phản ứng với một sản phẩm oxy hóa cụ thể duy nhất không kể đến loại phản ứng oxy hóa (dù là peroxide hoặc periodat). Điều tương tự cũng đúng với GTX2,3 cũng như GTX5 (B1) và C1,2. Ngược lại, trong cả hai phản ứng oxy hóa, dcSTX và dcGTX2,3 tạo thành hai sản phẩm oxy hóa khác nhau, xem Bảng 2. Độc tố dcNEO bị oxy hóa tạo thành hai sản phẩm oxy hóa chỉ với quá trình oxy hóa bằng periodat. Mỗi độc tố NEO, GTX6 (B2), GTX1,4 và C3,4 tạo ra ba pic sau khi oxy hóa bằng periodat nhưng chỉ sử dụng pic rửa giải thứ hai để định lượng (không oxy hóa bằng peroxide để định lượng).
Sự xuất hiện đồng thời của các độc tố PSP khác nhau trong nhuyễn thể có vỏ có thể ảnh hưởng đến các kết quả phân tích, do một số độc tố PSP có thể (một phần) cho các sản phẩm phản ứng tương tự (xem Bảng 2). Do đó, sắc ký đồ phải được diễn giải cẩn thận sau khi làm sạch trên cột SPE C18.
Bảng 2 - Sản phẩm phản ứng sau khi oxy hóa bằng periodat và peroxide
| Độc tố | Các sản phẩm oxy hóa và trình tự rửa giải HPLC | Cường độ | Sản phẩm oxy hóa ở cùng thời gian lưu | |||
|
| peroxide | periodat | peroxide | periodat | peroxide | periodat |
| STX | một lần | một lần | ++ | + | NEO a {3} b | NEO {3}: GTX6 (B2) {3} |
| dc-STX | lần một {1} | lần một {1} | ++ | - |
| dcNEO {1} |
|
| lần hai {2} | lần hai {2} | + | + | NEO a {2} | NEO {2}; GTX6 (B2) {2}; dcNEO {2} |
| NEO | không | lần một {1} | — | + |
| GTX6 (B2) {1} |
|
| lần hai {2} | lần hai {2} | - | ++ | dcSTX {2} | GTX6 (B2) {2}; dcSTX {2}; dcNEO {2} |
|
| lần ba {3} | lần ba {3} | - | + | STX | STX; GTX6 (B2) {3} |
| C1,2 | một lần | một lần | ++ | + |
|
|
| C3,4 | không | lần một{1} | — | + |
| GTX1,4 {1} |
|
| không | lần hai {2} | — | ++ |
| GTX1,4 {2}; dcGTX2,3{2} |
|
| không | lần ba {3} | — | + |
| GTX1,4 {3}; GTX2.3 |
| GTX1,4 | Không | lần một {1} | — | + |
| C3,4{1} |
|
| không | lần hai {2} | — | ++ |
| C3,4 {2}: dcGTX2,3 {2} |
|
| lần ba {3} | lần ba {3} | — | ++ | GTX2.3 | C3,4 {3}; GTX2.3 |
| GTX2.3 | một lần | một lần | ++ | ++ | GTX1.4 a {3} | C3,4{3}; GTX1.4 {3} |
| GTX5 (B1) | một lần | một lần | ++ | - |
|
|
| GTX6 (B2) | không | lần một{1} | — | + |
| NEO {1} |
|
| không | lần hai {2} | — | ++ |
| NEO {2}; dcSTX {2}; dcNEO {2} |
|
| không | lần ba {3} | — | - |
| NEO {3}; STX |
| dcGTX2,3 | lần một {1} | lần một{1} | ++ | + |
|
|
|
| lần hai {2} | lần hai {2} | + | ++ |
| C3,4{2}; GTX1,4 {2} |
| dcNEO | lần một {1} | lần một{1} | - | ++ |
| dcSTX {1} |
|
| lần hai {2} | lần hai {2} | - | + | dcSTX {2} | dcSTX {2}: NEO {2}: GTX6 (B2) {2} |
| Cường độ: — không phát hiện | ||||||
| - rất thấp | ||||||
| + thấp | ||||||
| ++ cao | ||||||
| a Nồng độ cao của độc tố được chỉ định có thể ảnh hưởng đến việc định lượng bằng cách mô phòng hàm lượng tăng. | ||||||
| b Các số trong ngoặc nhọn là thứ tự rửa giải. | ||||||

| a) Các độc tố không hydroxyl hóa: peroxide | b) Các độc tố không hydroxyl hóa: periodat |
| c) Các độc tố N-hyroxyl hóa: peroxide | d) Các độc tố N-hyroxyl hóa: periodat |
CHÚ DẪN:
Y: tín hiệu của detector (V)
X: thời gian (phút)
Hình 1 - Sản phẩm phản ứng sau khi tạo dẫn xuất với peroxide và periodat (các pic để định lượng được đánh dấu bằng mũi tên)
Để định lượng các độc tố N-hydroxyl hóa, cần chiết phân đoạn với làm sạch bằng cột SPE-COOH (nêu trong Bảng 3) vì các sản phẩm oxy hóa của một số độc tố PSP [NEO và GTX6 (B2), GTX1,4 và C3,4] là giống hệt nhau. Bước này tách các độc tố PSP thành ba nhóm riêng biệt, cụ thể là các độc tố C, các độc tố GTX và nhóm saxitoxin bằng cách rửa giải với các pha động có cường độ ion khác nhau. Các độc tố C rửa giải không bị giữ lại cùng với nước, các độc tố GTX (từ GTX1 đến GTX6 cũng như dcGTX2 và dcGTX3) rửa giải bằng NaCl 0,05 mol/L trong khi nhóm saxitoxin (STX, NEO, dcNEO và dc-STX) cần rửa giải bằng NaCl 0,3 mol/L. Các dịch chiết phân đoạn này có thể được phân tích bằng HPLC sau khi oxy hóa bằng periodat hoặc peroxide
Bảng 3 - Thứ tự rửa giải độc tố sau khi làm sạch bằng cột SPE-COOH
| Chiết phân đoạn | Dịch rửa giải | Rửa giải độc tố |
| 1 | Nước | C1,2; C3,4 |
| 2 | NaCl 0,05 mol/L | dcGTX2,3; GTX2,3; GTX1.4; GTX5; GTX6 (B2) |
| 3 | NaCl 0,3 mol/L | dcSTX; STX; NEO; dcNEO |
4 Thuốc thử
Chỉ sử dụng các thuốc thử loại tinh khiết phân tích và dung môi phù hợp dùng cho HPLC-FLD, nếu không có quy định khác.
Nước phải được chưng cất trong bình thủy tinh hoặc khử khoáng trước khi sử dụng hoặc phải có độ tinh khiết tương đương theo TCVN 4851 (ISO 3696).
Độ bền của dung dịch phải được xác định bởi phòng thử nghiệm, nếu chưa được quy định.
4.1 Methanol, loại dùng cho HPLC.
4.2 Acetonitril, loại dùng cho HPLC.
4.3 Dung dịch amoni format, nồng độ chất c = 0,3 mol/L
Hòa tan 1,892 g amoni format (tinh thể dạng bột) trong 100 ml nước.
4.4 Acid acetic băng.
4.4.1 Dung dịch acid acetic 1, p ≈ 1 % phần khối lượng
Pha loãng 1 ml acid acetic băng (4.4) bằng nước đến 100 ml.
4.4.2 Dung dịch acid acetic 2, c ≈ 0,1 mol/L
Pha loãng 572 μl acid acetic băng (4.4) bằng nước đến 100 ml.
4.4.3 Dung dịch acid acetic 3, c ≈ 0,1 mmol/L
Pha loãng 100 μl dung dịch acid acetic 2 (4.4.2) bằng nước đến 100 ml.
4.5 Amoni acetat
4.5.1 Dung dịch amoni acetat 1, c = 0,1 mol/L
Hòa tan 0,77 g amoni acetat (4.5) bằng nước đến 100 ml.
4.5.2 Dung dịch amoni acetat 2, c = 0,01 mol/L
Pha loãng 10 ml dung dịch amoni acetat 1 (4.5.1) bằng nước đến 100 ml.
4.6 Natri chloride
4.6.1 Dung dịch natri chloride 1, c = 0,05 mol/L
Hòa tan 0,29 g natri chloride (4.6) bằng nước đến 100 ml.
4.6.2 Dung dịch natri chloride 2, c = 0,3 mol/L
Hòa tan 1,75 g natri chloride (4.6) bằng nước đến 100 ml.
4.7 Acid chlorhydric, c = 1 mol/L.
4.8 Dung dịch dinatri hydrophosphat, c = 0,3 mol/L.
Hòa tan 4,26 g dinatri hydrophosphat trong 100 ml nước hoặc hòa tan 8,04 g dinatri hydrophosphat ngậm 7 phân tử nước trong 100 ml nước.
4.9 Natri hydroxide
4.9.1 Dung dịch natri hydroxide 1, c = 1 mol/L
Hòa tan 4 g natri hydroxide (4.9) bằng nước đến 100 ml.
4.9.2 Dung dịch natri hydroxide 2, c = 0,2 mol/L
Pha loãng 10 ml dung dịch natri hydroxide 1 (4.9.1) bằng nước đến 50 ml.
4.10 Dung dịch hydro peroxide, w ≈ 10 %
Pha loãng 3 ml dung dịch hydro peroxide có bán sẵn trên thị trường, w = 30 % phần khối lượng bằng 6 ml nước. Chuẩn bị dung dịch mới mỗi ngày. Bảo quản cả hai dung dịch nơi tối ở nhiệt độ khoảng +4 °C.
4.11 Acid periodic
4.11.1 Dung dịch acid periodic 1, c = 0,1 mol/L
Hòa tan 0,227 9 g acid periodic (4.11) trong 10 ml nước.
4.11.2 Dung dịch acid periodic 2, c = 0,034 mol/L
Pha loãng 3,4 ml dung dịch acid periodic 1 (4.11.1) bằng 6,6 ml nước. Bảo quản dung dịch này trong tủ lạnh nơi tối ở nhiệt độ khoảng +4 °C. Chuẩn bị dung dịch mới mỗi ngày.
4.12 Thuốc thử quá trình oxy hóa bằng periodat
Trộn một phần thể tích dung dịch acid periodic 2 (4.11.2) với một phần thể tích dung dịch dinatri hydrophosphat (4.8) và một phần thể tích dung dịch amoni format (4.3). Đưa hỗn hợp về pH 8,2 bằng cách thêm từng giọt dung dịch natri hydroxide 2 (4.9.2) và kiểm tra pH bằng máy đo pH. Chuẩn bị dung dịch mới trong ngày phân tích.
4.13 Chất chuẩn độc tố PSP
4.13.1 Dung dịch gốc độc tố PSP
Để thuận tiện, các chất chuẩn có thể được gộp thành ba hỗn hợp bằng cách pha loãng dung dịch chuẩn thích hợp trong nước. Chỉnh các dung dịch đó về khoảng pH 4 bằng dung dịch acid acetic 2 nồng độ 0,1 mol/L (4.4.2). Đối với phép phân tích C1,2, chỉnh dung dịch đến pH 5 để không quan sát thấy sự phân hủy. Bảng 4 đưa ra nồng độ thích hợp đối với mỗi độc tố PSP trong ba hỗn hợp dung dịch gốc. Bảo quản các dung dịch nơi tối ở nhiệt độ khoảng +4 °C và kiểm tra nồng độ khối lượng định kỳ sau 2 tuần hoặc bảo quản nơi tối ở nhiệt độ bằng hoặc thấp hơn -18 °C và kiểm tra nồng độ khối lượng định kỳ sau 6 tháng.
Bảng 4 - Ví dụ về nồng độ thích hợp đối với từng độc tố PSP trong ba hỗn hợp dung dịch gốc
| Hỗn hợp dung dịch gốc | Nồng độ độc tố | ||
| μg/ml a | nmol/ml | ||
| Hỗn hợp 1 | GTX1.4 | 0,192 | 0,467 |
| NEO | 0,189 | 0,600 | |
| Hỗn hợp 2 | GTX2.3 | 0,265 | 0,670 |
| GTX5 (B1) | 0,202 | 0,532 | |
| STX | 0,201 | 0,672 | |
| dc-STX | 0,054 | 0,211 | |
| dcGTX2,3 | 0,080 | 0,227 | |
| Hỗn hợp 3 | C1,2 | 0,203 | 0,427 |
| C3,4 | 0,188 | 0,383 | |
| dcNEO | 0,137 | 0,503 | |
| a Liên quan đến dạng base tự do của độc tố. | |||
CHÚ THÍCH: Các ống chứa các chất chuẩn STX, NEO, GTX1.4, GTX2.3, C1,2, GTX5, dcGTX2,3, dcNEO, dcSTX trong acid chlorhydric hoặc dung dịch acid acetic với nồng độ nằm trong dài từ 100 μg/ml đến 2 000 μg/ml là có bán sẵn trên thị trường [2] .
Một số chất chuẩn có thể bị nhiễm độc tố PSP khác; do đó đối với mục đích hiệu chuẩn phải tính đến tạp chất (bằng cách định lượng tạp chất, chạy các đường chuẩn khác nhau hoặc đưa vào phép đo độ không đảm bảo đo).
4.13.2 Dung dịch hiệu chuẩn độc tố PSP
Chuẩn bị dung dịch hiệu chuẩn với ít nhất năm điểm để xác định độc tố PSP, ví dụ: không pha loãng, pha loãng 2,5 lần, 5 lần, 7,5 lần và 10 lần dung dịch gốc PSP (4.13.1) bằng dung dịch acid acetic 3, 0,1 mmol/L (4.4.3). Dung dịch hiệu chuẩn độc tố PSP cũng có thể được chuẩn bị bằng cách pha loãng hỗn hợp dung dịch gốc bằng nước (miễn là pH có tính acid). Bảo quản nơi tối ở -18 °C và kiểm tra nồng độ khối lượng định kỳ sau 6 tháng.
CHÚ THÍCH 1: Điều quan trọng là bảo quản các dung dịch chuẩn đã pha loãng trong lọ bằng chất dẻo hoặc trong vật chứa bằng thủy tinh đã khử hoạt tính, ví dụ: bằng cách ngâm lọ qua đêm trong natri hydroxide, rửa sạch bằng nước sau đó bằng methanol và làm khô.
Trong nghiên cứu liên phòng thử nghiệm nêu trong A.1 [4], [5] đã sử dụng ba điểm hiệu chuẩn. Tuy nhiên để tăng độ vững của phương pháp, cần sử dụng ít nhất năm điểm hiệu chuẩn.
CHÚ THÍCH 2: Phương pháp khác để chuẩn bị dung dịch hiệu chuẩn là thực hiện hiệu chuẩn trong bước oxy hóa (6.5.2 và 6.5.3). Sử dụng các phần khác nhau của dung dịch gốc độc tố PSP và pha loãng đến thể tích cuối cùng 100 μl bằng dung dịch acid acetic 3, nồng độ 0,1 mmol/L (4.4.3).
4.13.3 Dung dịch PSP để kiểm tra độ thu hồi
Chuẩn bị các dung dịch độc tố có nồng độ khối lượng thích hợp (ví dụ: trong acid acetic 0,6 %) để kiểm tra độ thu hồi độc tố trên cột SPE.
4.14 Chất bổ chính nền dùng cho quá trình oxy hóa bằng periodat
Sử dụng dịch chiết trắng (không chứa PSP) từ hàu nêu trong 6.1 và 6.2. Dịch chiết hàu thô không chứa PSP ban đầu này ổn định và có thể dùng được trong vòng ít nhất hai tháng, nếu được bảo quản đông lạnh ở -20 °C. Để sử dụng làm chất bổ chính nền, làm sạch theo 6.3.1 và chỉnh dịch chiết đến pH 6,5 bằng dung dịch natri hydroxide 1 (4.9.1). Có thể bảo quản dung dịch trong tủ lạnh từ 2 ngày đến 3 ngày để kết tủa vật liệu chiết cùng. Gạn phần nổi phía trên hoặc lọc bằng bộ lọc cỡ lỗ 0,45 μm (5.20) và bảo quản chất bổ chính nền thu được trong tủ lạnh. Phân tích chất bổ chính nền đối với độc tố PSP bằng quá trình oxy hóa peroxidat và peroxide để đảm bảo không có độc tố trước khi sử dụng. Dung dịch được chuẩn bị hai tuần một lần (tức là làm sạch lại từ dịch chiết thô).
4.15 Dung môi rửa giải HPLC
4.15.1 Dung môi rửa giải A: Amoni format, c = 0,1 mol/L
Hòa tan 6,31 g amoni format trong 1 L nước và chỉnh đến pH 6,0 bằng cách thêm khoảng 6 ml dung dịch acid acetic 2 (4.4.2). Lọc hút chân không qua bộ lọc màng (5.18).
4.15.2 Dung môi rửa giải B: Amoni format, c = 0,1 mol/L trong acetonitril 5 %.
Hòa tan 6,31 g amoni format trong 950 ml nước và thêm 50 ml acetonitril (4.2). Chỉnh đến pH 6,0 bằng cách thêm khoảng 6 ml dung dịch acid acetic 2 (4.4.2). Lọc hút chân không qua bộ lọc màng (5.18).
5 Thiết bị, dụng cụ
Sử dụng các thiết bị, dụng cụ thông thường phòng thử nghiệm và cụ thể như sau:
5.1 Máy xay.
5.2 Cân, có thể cân chính xác đến 0,01 g.
5.3 Cân phân tích, có thể cân chính xác đến 0,1 mg.
5.4 Ống ly tâm bằng chất dẻo, polypropylen, dung tích 50 ml, có nắp đậy.
5.5 Máy ly tâm, có thể đạt đến gia tốc 3 600g [3] ở điểm ngoài cùng của ống ly tâm.
5.6 Pipet, pipet tự động có đầu tip bằng chất dẻo dùng một lần.
5.7 Máy trộn Vortex.
5.8 Nồi cách thủy hoặc bếp điện.
5.9 Ống nghiệm hình nón chia vạch, dung tích 2 ml, 5 ml, 10 ml, 15 ml.
5.10 Cột SPE-C18, ví dụ: 500 mg trên dung tích 3 ml
Kiểm tra từng mẻ cột SPE-C18 mới (ví dụ: Supelcoclean LC18) bằng các dung dịch chuẩn (4.13.3) để đảm bảo độ thu hồi tối thiểu thu được bằng cột C18 là 80 %. Theo kinh nghiệm, việc kiểm tra này là cần thiết trong quá trình xây dựng phương pháp khi quan sát thấy các thay đổi có thể xảy ra. Không thể thực hiện việc kiểm tra này đối với GTX6 và C3,4 vì chất chuẩn chưa bán sẵn trên thị trường.
Nếu theo thời gian, phòng thử nghiệm cho thấy không có sự khác nhau về hiệu năng giữa các mẻ cột SPE, thì có thể sử dụng phương pháp tiếp cận sau: Kiểm tra mỗi mẻ cột SPE-C18 mới bằng các dung dịch mẫu thử có nồng độ đã biết, để đảm bảo độ thu hồi tối thiểu của toàn bộ quá trình ở mức tối thiểu của dữ liệu xác nhận giá trị sử dụng.
5.11 Cột trao đổi ion SPE-COOH, ví dụ: 500 mg trên dung tích 3 ml
Kiểm tra từng mẻ cột SPE-COOH mới (ví dụ: Bakerbond Carboxylic Acidsilane hoặc, tùy chọn, chất trao đổi cation yếu, ví dụ Strata-X® từ Phenomenex) bằng các dung dịch chuẩn (4.13.3) để đảm bảo thu được độ thu hồi tối thiểu với cột COOH là 80 % và thu được các mẫu rửa giải chính xác theo 6.3.2. Theo kinh nghiệm, việc kiểm tra này là cần thiết trong quá trình xây dựng phương pháp khi quan sát thấy các thay đổi có thể xảy ra. Không thể thực hiện việc kiểm tra này đối với GTX6 và C3,4 vì chất chuẩn chưa bán sẵn trên thị trường.
Nếu theo thời gian, phòng thử nghiệm chứng minh không có sự thay đổi về hiệu năng giữa các mẻ cột COOH, thì có thể sử dụng phương pháp tiếp cận sau: Mỗi mẻ cột COOH mới phải được kiểm tra bằng các dung dịch mẫu thử có nồng độ đã biết để đảm bảo độ thu hồi tối thiểu của toàn bộ quá trình ở mức tối thiểu của dữ liệu xác nhận giá trị sử dụng.
5.12 Thiết bị chiết pha rắn hoặc hệ thống chiết pha rắn tự động (dùng để làm sạch bằng cột SPE).
5.13 Khối gia nhiệt (hoặc tương tự), dùng cho bước thủy phân.
5.14 Ống phản ứng, ví dụ: ống thủy tinh có nắp vặn hoặc lọ nhỏ, dung tích 1,5 ml.
5.15 Giấy chỉ thị pH, có thể xác định chính xác pH 6,5 ± 0,3.
5.16 Máy đo pH.
5.17 Bộ cô quay, tùy chọn dùng cho các mẫu có nồng độ thấp.
5.18 Màng lọc, dùng cho dung dịch dạng lỏng, cỡ lỗ 0,45 μm, ví dụ: bằng celulose tái sinh.
5.19 Lọ HPLC, ví dụ: bằng thủy tinh màu nâu đỏ.
5.20 Hệ thống HPLC, bao gồm các bộ phận sau:
5.20.1 Bộ bơm, tốt nhất là bộ bơm được làm lạnh, có thể bơm đến 100 μl.
5.20.2 Bơm, có khả năng rửa giải gradient.
5.20.3 Lò cột, có thể gia nhiệt đến (40 ± 2) °C.
5.20.4 Cột phân tích, ví dụ: cột RP C18, cỡ hạt 5 μm, kích thước 150 mm (dài) × 4,6 mm (đường kính)
Có thể tiến hành phép đo với các cột tách khác nhau (kích thước, nhà sản xuất). Tuy nhiên, các sản phẩm oxy hóa độc tố PSP phải được tách khỏi đường nền bằng sắc ký.
5.20.5 Detector huỳnh quang, bước sóng kích thích λ = 340 nm và bước sóng phát xạ λ = 395 nm, có thể phát hiện 400 pg chất chuẩn STX đã xử lý bằng peroxide (6.5.3) dưới dạng base tự do trên cột với tỷ lệ tín hiệu-nhiễu thấp nhất là 10:1.
6 Cách tiến hành
6.1 Chuẩn bị mẫu thử
Rửa sạch kỹ vỏ bên ngoài của nhuyễn thể có vỏ bằng nước sạch để loại bỏ cát và tạp chất. Mở vỏ bằng cách cắt cơ khép. Lấy thịt của nhuyễn thể có vỏ ra khỏi vỏ bằng cách tách các cơ khép và mô liên kết tại khớp nối. Sau khi lấy thịt ra khỏi vỏ, để ráo thịt trong 5 min trên sàng. Đồng nhất thịt của nhuyễn thể có vỏ trong máy xay (5.1). Nên lấy ít nhất từ 100 g đến 150 g thịt nhuyễn thể đã đồng nhất gộp lại. Nếu không tiến hành phân tích ngay, cấp đông lạnh thịt nhuyễn thể có vỏ đồng nhất.
6.2 Quy trình chiết
Rã đông mẫu thử đã đồng nhất trong tủ lạnh hoặc ở nhiệt độ phòng hoặc sử dụng trực tiếp sau khi xay (6.1).
Không gia nhiệt mẫu.
Bảo quản tất cả các dịch chiết và dung dịch trong tủ lạnh khi không sử dụng.
Cân 5 g ± 0,1 g phần mẫu thử nhuyễn thể có vỏ đã đồng nhất cho vào ống ly tâm dung tích 50 ml (5.4) và trộn với 3 ml dung dịch acid acetic 1 nồng độ 1 % (4.4.1) trên máy trộn Vortex. Nới lỏng nắp ống để tránh tạo áp suất trong quá trình gia nhiệt và đặt vào nồi cách thủy đun sôi (100 °C) sao cho lượng chứa trong ống thấp hơn mức nước trong nồi. Gia nhiệt mẫu trong 5 min.
Đảm bảo rằng nồi cách thủy đã đạt đến điểm sôi trước khi cho mẫu vào và bắt đầu tính thời gian đun. Không đặt quá nhiều ống trong nồi cách thủy cùng một lúc để tránh nồi ngừng sôi trong hơn 30 s.
Lấy mẫu ra khỏi nồi cách thủy, trộn lại trên máy trộn Vortex và làm nguội mẫu bằng cách đặt trong tủ lạnh hoặc cốc nước lạnh trong 5 min và ly tâm trong 10 min ở 3 600g. Gạn phần dịch nổi phía trên cho vào ống nghiệm hình nón chia vạch dung tích 15 ml (5.9).
Thêm 3 ml dung dịch acid acetic 1 nồng độ 1 % (4.5.1) vào ống ly tâm chứa mẫu đã chiết một lần (cặn ở thể rắn), trộn đều trên máy trộn Vortex và ly tâm lại trong 10 min ở 3 600g. Gạn và thu lấy phần dịch nổi phía trên cho vào cùng một ống nghiệm hình nón chia vạch (5.9) có chứa dịch chiết thô ban đầu và thêm nước chính xác đến 10 ml.
Có thể dừng quy trình tại thời điểm này và dịch chiết phải được bảo quản trong tủ lạnh.
6.3 Tinh sạch mẫu
6.3.1 Làm sạch bằng cột SPE-C18
Ổn định cột theo hướng dẫn của nhà sản xuất, ví dụ: ổn định cột SPE-C18 dung tích 3 ml (5.10) bằng 6 ml methanol sau đó bằng 6 ml nước. Loại bỏ các dung dịch đi qua cột. Đặt ống nghiệm hình nón chia vạch dung tích 5 ml (5.9) dưới cột. Thêm 1 ml dịch chiết thô (6.2) (tương đương 0,5 g thịt nhuyễn thể có vỏ) vào cột. Giữ tốc độ dòng rửa giải trong khoảng từ 2 ml/min đến 3 ml/min đối với tất cả các lần rửa giải. Thu dịch rửa giải vào ống nghiệm hình nón chia vạch. Rửa cột bằng 2 ml nước và gộp nước rửa vào dịch rửa giải để thu được dịch chiết đã tinh sạch.
Trong quá trình làm sạch, không để cột bị khô.
Chỉnh dịch chiết đã tinh sạch này đến pH 6,5 bằng NaOH 1 mol/L (4.9.1), sử dụng giấy chỉ thị pH (5.15) hoặc máy đo pH (5.16) và sau đó pha loãng bằng nước chính xác đến 4 ml.
Đối với mục đích sàng lọc, có thể dừng quá trình làm sạch mẫu tại thời điểm này. Dịch chiết thu được từ quá trình làm sạch bằng cột SPE-C18 thường bền hơn một năm khi được bảo quản trong tủ đông, tuy nhiên, điều này phải được kiểm tra xác nhận.
Sử dụng các phần dịch chiết này cho quá trình oxy hóa bằng periodat và peroxide nêu trong 6.5.2 và 6.5.3.
Ngoài ra, phân tích một phần dịch chiết không bị oxy hóa dùng làm mẫu kiểm soát cho quá trình oxy hóa bằng peroxide để kiểm tra xác nhận các pic trên sắc ký đồ của mẫu bị oxy hóa gây ra bởi các độc tố PSP không phải bởi các hợp chất phát huỳnh quang tự nhiên. Đồng thời, phân tích một phần dịch chiết mẫu từ quá trình làm sạch bằng cột SPE-C18 được trộn với chất bổ chính nền và nước (thay vì chất oxy hóa periodat) làm mẫu kiểm soát quá trình oxy hóa bằng periodat. Sắc ký đồ thu được cho phép nhận dạng các pic phát sinh từ các dịch chiết phát huỳnh quang tự nhiên bị chiết đồng thời cùng mẫu. Các độc tố PSP không tạo ra các pic trong các điều kiện này.
Nếu phát hiện các độc tố PSP N-hydroxyl hóa trong dịch chiết này, thì tiếp tục quá trình làm sạch bằng cột trao đổi ion SPE-COOH nêu dưới đây.
CHÚ THÍCH: Đối với nghiên cứu về sò điệp Pecten maximus nguyên con và sò điệp Aequipecten opercularis nguyên con bị nhiễm NEO và GTX1,4, sử dụng 1,5 ml dịch chiết thô để làm sạch cột SPE-C18 làm tăng độ thu hồi của GTX1,4 và NEO [3].
6.3.2 Làm sạch bằng cột SPE-COOH (chiết phân đoạn)
Chỉ chiết phân đoạn các dịch chiết từ quá trình làm sạch bằng cột SPE-C18 có chứa độc tố PSP N-hydroxyl hóa (ví dụ: NEO, dcNEO, C3,4; GTX6 (B2) và GTX1,4) sau khi làm sạch bằng cột SPE-C18.
Ổn định cột theo hướng dẫn của nhà sản xuất, ví dụ: ổn định cột SPE-COOH dung tích 3 ml (5.11) bằng cách cho 10 ml dung dịch amoni acetat 2 nồng độ 0,01 mol/L (4.6.2) đi qua cột. Giữ tốc độ dòng trong khoảng từ 2 ml/min đến 3 ml/min đối với tất cả các dịch rửa giải. Loại bỏ dịch rửa giải.
Dịch chiết phân đoạn 1: Cho 2 ml phần dịch chiết mẫu của nhuyễn thể có vỏ (tương đương 0,25 g thịt nhuyễn thể có vỏ) thu được từ quá trình làm sạch bằng cột SPE-C18 (6.3.1) đi qua cột và thu dịch rửa giải vào ống nghiệm hình nón chia vạch dung tích 10 ml được ghi nhãn dịch chiết phân đoạn 1. Sau đó, cho 4 ml nước đi qua cột và thu vào cùng một ống nghiệm. Chỉnh tổng thể tích cuối cùng đến 6 ml. Dịch chiết này chứa độc tố C. Tiếp tục tiến hành theo 6.5.2 và/hoặc 6.5.3 đối với các bước oxy hóa. Nếu có mặt C3,4, tiến hành theo 6.4.
Dịch chiết phân đoạn 2: Cho 4 ml dung dịch NaCl 1 nồng độ 0,05 mol/L (4.6.1) đi qua cùng một cột và thu dịch rửa giải (được ghi nhãn dịch chiết phân đoạn 2) vào ống nghiệm hình nón chia vạch dung tích 5 ml. Chỉnh thể tích cuối cùng đến 4 ml. Dịch chiết này chứa các độc tố GTX1.4, GTX2,3, GTX5 (B1), GTX6 (B2) và dcGTX2,3. Tiếp tục tiến hành theo 6.5.2 và/hoặc 6.5.3 đối với các bước oxy hóa. Nếu có mặt GTX6 (B2), tiến hành theo 6.4.
Dịch chiết phân đoạn 3: Cho 5 ml dung dịch NaCl 2 nồng độ 0,3 mol/L (4.6.2) đi qua cột và thu dịch rửa giải vào ống nghiệm hình nón chia vạch 5 ml được ghi nhãn dịch chiết phân đoạn 3. Chỉnh thể tích cuối cùng đến 5 ml. Dịch chiết này chứa các độc tố STX, NEO, dcNEO và dcSTX. Tiếp tục tiến hành theo 6.5.2 và/hoặc 6.5.3 đối với các bước oxy hóa.
Trong quá trình làm sạch, không để cột bị khô.
Nếu gặp vấn đề về độ nhạy của detector, thì cô đặc từng dịch chiết thu được. Cho từng dịch chiết thu được từ quá trình làm sạch bằng cột SPE-COOH vào các bình cầu đáy tròn dung tích 50 ml thay cho việc dùng các ống nghiệm hình nón chia vạch và cho bay hơi đến khoảng 1 ml trên thiết bị cô quay, ví dụ: bộ cô quay hoặc bộ bay hơi thích hợp khác có nồi cách thủy cài đặt ở nhiệt độ 45 °C. Dùng pipet Pasteur chuyển dung dịch này vào ống nghiệm hình nón chia vạch dung tích 5 ml. Tráng rửa bình cầu đáy tròn dung tích 50 ml 3 lần, mỗi lằn bằng khoảng 0,2 ml đến 0,3 ml nước, chuyển phần nước rửa vào ống nghiệm chia vạch sao cho thể tích cuối cùng của dịch chiết phân đoạn đã làm sạch bằng cột SPE-COOH là 2 ml. Phân tích các dịch chiết phân đoạn 1, 2 và 3 bằng HPLC sau khi oxy hóa bằng peroxidat và peroxide theo 6.5.2 và/hoặc 6.5.3.
CHÚ THÍCH: Để cải thiện độ nhạy của phương pháp, quy trình làm sạch bằng cột SPE trao đổi ion thay thế đã được xây dựng trong quá trình xác nhận giá trị sử dụng phòng thử nghiệm đơn lẻ [2], [11], (quy trình xem 6.3.3).
Việc tinh sạch mẫu có thể được dừng lại tại thời điểm này. Tiếp tục tiến hành ngay quá trình oxy hóa và phân tích HPLC-FDL hoặc bảo quản dịch chiết phân đoạn đã làm sạch bằng cột SPE-COOH không quá một tuần trong tủ lạnh hoặc không quá một năm trong tủ đông.
6.3.3 Làm sạch bằng cột SPE trao đổi cation yếu thay thế [2], [11]
Để cải thiện độ nhạy và giảm nhiễm chéo trong các dịch chiết phân đoạn kế tiếp của các lượng độc tố PSP thấp, có thể sử dụng quy trình làm sạch cải biến dưới đây sau khi làm sạch bằng cột SPE-C18, tuy nhiên, quy trình này chỉ được xác nhận giá trị sử dụng nội bộ.
Quy trình chiết phân đoạn tương tự như trong 6.3.2. Ngược với [1], chỉ khác nhau về nồng độ của dung dịch natri chloride và thể tích rửa giải (xem Bảng 5).
Bảng 5 - So sánh các điều kiện chiết phân đoạn [2], [11]
|
|
| Cột COOH-SPE (ví dụ: Bakerbond Carboxylic Acidsilane) | Cột trao đổi cation yếu (ví dụ: Strata-X-CW, Phenomenex) | ||
| Chiết phân đoạn | Độc tố | Dung môi rửa giải | Thể tích | Dung môi rửa giải | Thể tích |
| F1 | C1,2; C3,4 | Nước | 6,0 ml | Nước | 5,0 ml |
| F2 | GTX1,4; GTX2.3; dcGTX2,3; GTX5 GTX6 | NaCl 0,05 mol/L | 4,0 ml | NaCl 0,3 mol/L | 3,0 ml |
| F3 | STX; NEO; dcNEO; dcSTX | NaCl 0,3 mol/L | 5,0 ml | NaCl 2,0 mol/L | 3,0 ml |
6.4 Chuyển đổi GTX6 (B2) thành NEO và/hoặc C3,4 thành GTX1,4
6.4.1 Yêu cầu chung
Hiện nay chất chuẩn GTX6 (B2) không bán sẵn. Do đó, để phân tích GTX6 (B2), thủy phân độc tố này thành NEO để có thể định lượng được [7], [8], Xác định gián tiếp hàm lượng GTX6 (B2) bằng cách thủy phân dịch chiết phân đoạn 2 của quá trình làm sạch bằng cột SPE-COOH khi không có mặt NEO.
Hiện nay chất chuẩn C3,4 không bán sẵn trên thị trường. Độc tố này, có mặt trong dịch chiết phân đoạn 1 của quá trình làm sạch bằng cột SPE-COOH, có thể xác định gián tiếp bằng cách thủy phân thành GTX1,4 [10].
6.4.2 Thủy phân dịch chiết phân đoạn 1 hoặc 2 của quá trình làm sạch bằng cột SPE-COOH
Cho 75 μl HCl nồng độ 1 mol/L vào 300 μl dịch chiết phân đoạn 2 của quá trình làm sạch bằng cột SPE-COOH (6.3.2) đựng trong lọ HPLC hoặc trong ống bằng thủy tinh có nắp vặn. Đậy kín lọ/ống và cân. Đun nóng hỗn hợp trong 20 min ở 90 °C trong nồi cách thủy hoặc khối gia nhiệt. Làm nguội hỗn hợp đến nhiệt độ phòng và cân lại lọ để kiểm tra khả năng bay hơi (nếu có bay hơi, thêm nước vào khối lượng ban đầu). Ví dụ: cho năm lần các thể tích nhỏ 15 μl của dung dịch NaOH 1 mol/L (4.9.1) và trộn đều mỗi lần cho đến khi tổng thể tích sau khi thêm là 75 μl. Các bước này là cần thiết để trung hòa acid đồng thời tránh kiềm hóa quá mức dịch chiết phân đoạn 2 đã thủy phân. Chỉnh về pH trung tính.
Trong quá trình oxy hóa bằng periodat (gộp dịch chiết phân đoạn 2 đã thủy phân, chất bổ chính nền và thuốc thử tạo dẫn xuất periodat), hỗn hợp thay đổi đến pH 8,2. Tuy nhiên, nếu dịch chiết phân đoạn đã thủy phân bị oxy hóa không đạt đến pH 8,2 thì cần chỉnh dịch chiết phân đoạn 2 đã thủy phân này bằng cách thêm một ít dung dịch NaOH và ghi lại lượng bổ sung để tính kết quả [12].
Phân tích mẫu bằng HPLC sau quá trình oxy hóa bằng periodat theo 6.5.2.
Quy trình này cũng có thể được áp dụng cho dịch chiết phân đoạn 1 của quá trình làm sạch bằng cột SPE-COOH.
CHÚ THÍCH: Tùy thuộc vào thể tích đo tối thiểu của máy đo pH đã sử dụng, mà có thể tăng tỷ lệ tất cả các thuốc thử (nghĩa là 900 μl dịch chiết phân đoạn 2 của quá trình làm sạch bằng cột SPE-COOH (đã lọc) + 225 μl HCl nồng độ 1 mol/L và sau phản ứng là 225 μl dung dịch NaOH 1 nồng độ 1 mol/L).
6.5 Quy trình oxy hóa
6.5.1 Yêu cầu chung
Trong các phản ứng oxy hóa, quan trọng là thời gian phản ứng đối với tất cả các mẫu thử và hỗn hợp chất chuẩn là như nhau, do các thay đổi về thời gian có thể ảnh hưởng đến hiệu quả của quá trình oxy hóa và hiệu suất thu sản phẩm oxy hóa, làm ảnh hưởng đến độ lặp lại của kết quả. Cần có một mẫu kiểm soát để chứng minh sự không có mặt của các hợp chất có huỳnh quang tự nhiên như được chỉ ra trong đoạn 6 của 6.3.1.
Đối với nghiên cứu sò điệp Pecten maximus nguyên con và sò điệp Aequipecten opercularis nguyên con bị nhiễm NEO và GTX1,4, phương pháp tiếp cận này có thể làm giảm độ nhạy. Để tăng độ nhạy, có thể sử dụng các thay đổi trong bước oxy hóa bằng periodat nêu trong Chú thích 3 của 6.5.2.
6.5.2 Oxy hóa bằng periodat
Sử dụng pipet tự động có đầu tip bằng chất dẻo dùng một lần để phân phối tất cả các thuốc thử và các dung dịch được sử dụng trong các phản ứng oxy hóa.
Chỉnh các dung dịch đến pH 6,5 trước quá trình oxy hóa bằng periodat [12].
Cho 100 μl dung dịch chuẩn hoặc dịch chiết mẫu sau khi làm sạch bằng cột SPE C18 (6.3.1) hoặc phần dịch chiết phân đoạn của quá trình làm sạch bằng cột SPE-COOH (6.3.2) vào 100 μl dung dịch chất bổ chính nền đựng trong lọ 1,5 ml. Sau đó thêm 500 μl chất oxy hóa periodat (4.13) và trộn đều trên máy trộn Vortex. Để dung dịch phản ứng ở nhiệt độ phòng trong 1 min, sau đó thêm 5 pi acid acetic băng (4.4) và trộn đều. Để yên hỗn hợp ít nhất 10 min ở nhiệt độ phòng trước khi bơm 50 μl đến 100 μl vào hệ thống HPLC.
Dung dịch ổn định trong ít nhất một ngày đối với các độc tố không hydroxyl hóa. Tuy nhiên, đối với NEO GTX6(B2), GTX1.4 xảy ra hiện tượng phân hủy chậm sản phẩm oxy hóa. Mặc dù xảy ra sự phân hủy này nhưng có thể định lượng các độc tố nếu dung dịch chuẩn và dung dịch thử được bảo quản và phân tích trong cùng điều kiện, xem [5].
CHÚ THÍCH: Đối với nghiên cứu sò điệp Pecten maximus nguyên con và sò điệp Aequipecten opercularis nguyên con bị nhiễm NEO và GTX1.4, sử dụng chất bổ chính nền của sò điệp hoàng đế thay cho chất bổ chính nền của hàu (4.14) để oxy hóa các chất chuẩn hiệu chuẩn đã cho thấy đạt độ thu hồi tốt. Thuốc thử periodat cải biến chứa gấp 5 lần lượng acid periodic thông thường cho thấy độ nhạy tốt. sử dụng periodat để oxy hóa tất cả các dung dịch chuẩn và các mẫu thử đã được chuẩn bị bằng acid periodic nồng độ 0,03 mol/L (4.11.2), amoni format nồng độ 0,3 mol/L (4.3) và natri hydro phosphat nồng độ 0,3 mol/L (4.8) với các tỷ lệ tương ứng là 5:1:1, chỉnh đến pH 8,2 trước khi sử dụng. Ngoài ra, có thể làm tăng độ nhạy bằng cách tăng thể tích bơm (100 μl) [3].
6.5.3 Oxy hóa bằng peroxide
Cho 25 μl dung dịch H 2 O 2 nồng độ 10 % (khối lượng/thể tích) (4.10) vào 250 μl dung dịch NaOH 1 mol/L (4.9.1) đựng trong lọ 1,5 ml và trộn đều. Sau đó thêm 100 μl dung dịch chuẩn hoặc dịch chiết mẫu sau khi làm sạch bằng cột SPE C18 (6.3.1) hoặc cột SPE-COOH (6.3.2). Trộn và để phản ứng trong 2 min ở nhiệt độ phòng. Thêm 20 μl acid acetic băng (4.4) và trộn dung dịch. Bơm từ 25 μl đến 50 μl dung dịch này vào hệ thống HPLC. Dung dịch này bền ít nhất 8 h ở nhiệt độ phòng, xem [5].
CHÚ THÍCH: Bơm nhiều hơn 50 μl dung dịch có thể làm pic bị doãng rộng.
7 Xác định bằng HPLC
Kiểm tra độ ổn định của hệ thống (% biến thiên diện tích pic và % biến thiên thời gian lưu) so với yêu cầu của HPLC. Bơm các sản phẩm oxy hóa của độc tố PSP và tách bằng sắc ký để cho phép nhận biết và định lượng các độc tố riêng lẻ.
Lưu ý dcGTX2,3 và dcSTX mỗi loại tạo ra hai pic sau khi oxy hóa bằng peroxide cho hai sản phẩm oxy hóa khác nhau, các sản phẩm này phải được tách bằng sắc ký với độ phân giải lớn hơn 1,5. FLD có thể phát hiện 400 μg chất chuẩn STX được xử lý bằng peroxide (6.5.3) dưới dạng base tự do trên cột với tỷ lệ tín hiệu-nhiễu thấp nhất là 10:1.
Các điều kiện HPLC sau đây cho các kết quả thỏa mãn:
| Cột: | C18 pha đảo, cỡ hạt 5 μm, kích thước 150 mm × 4,6 mm |
| Nhiệt độ: | 40 °C |
| Tốc độ dòng: | 2 ml/min |
| Thể tích bơm: | Từ 25 μl đến 50 μl (đối với quá trình oxy hóa bằng peroxide) hoặc từ 50 μl đến 100 μl (đối với quá trình oxy hóa bằng periodat) |
| Detector huỳnh quang: | Bước sóng kích thích: 340 nm |
|
| Bước sóng phát xạ: 395 nm |
Gradient HPLC thích hợp với tốc độ dòng 2 ml/min được liệt kê trong Bảng 6
Bảng 6 - Gradient pha động được khuyến cáo ở tốc độ dòng 2 ml/min
| Thời gian | Dung môi rửa giải A | Dung môi rửa giải B |
| min | % | % |
| 0 | 100 | 0 |
| 5 | 95 | 5 |
| 9 | 30 | 70 |
| 11 | 100 | 0 |
| 15 | 100 | 0 |
CHÚ THÍCH 1: Có thể tiến hành phép đo với các cột tách khác nhau (kích thước, nhà sản xuất).
pH của dung môi rửa giải A và dung môi rửa giải B không ổn định theo thời gian. Do đó, chuẩn bị dung môi rửa giải A và dung môi rửa giải B mới trước mỗi dãy phân tích [12].
Sơ đồ bơm sau đây đã được chứng minh là thành công: bơm một dãy mẫu thử trước, sau đó bơm một dãy dung dịch hiệu chuẩn. Trong quá trình phân tích mẫu thử, bơm các dung dịch hiệu chuẩn và/hoặc dung dịch có nồng độ xác định theo các khoảng thời gian đều nhau để kiểm tra tính ổn định của hệ thống (ví dụ: cứ sau bốn lần bơm một dung dịch có nồng độ cố định). Sau khi kết thúc bơm dãy mẫu thử, bơm tiếp dãy dung dịch hiệu chuẩn.
CHÚ THÍCH 2: Một số sản phẩm oxy hóa của độc tố chưa ổn định khi sử dụng bộ lấy mẫu tự động ở nhiệt độ phòng, do đó tín hiệu của các độc tố này (ví dụ: dcNEO và NEO) có thể giảm trong một trình tự. Điều này có thể được cải thiện bằng cách sử dụng bộ lấy mẫu tự động được làm mát (ví dụ: +6 °C) [12].
Phân tích dịch chiết sau khi làm sạch bằng cột SPE C18 (6.3.1) hoặc các dịch chiết phân đoạn của quá trình làm sạch bằng cột SPE-COOH được oxy hóa bằng periodat và peroxide, cần phân tích các dịch chiết sau khi làm sạch bằng cột SPE C18 không bị oxy hóa liên tiếp bằng periodat và peroxide để kiểm tra xác nhận rằng các pic độc tố PSP được tìm thấy trong sắc ký đồ là do các độc tố PSP không phải do các dịch chiết phát huỳnh quang tự nhiên bị chiết đồng thời cùng với mẫu (6.3.1). Pha loãng các dịch chiết có hàm lượng độc tố PSP vượt quá chất chuẩn hiệu chuẩn cao nhất bằng nước. Ghi lại các hệ số pha loãng.
Để áp dụng hiệu quả phương pháp này cho các điều kiện phân tích thông thường khi cần phân tích số lượng lớn mẫu thử, thì nên sử dụng quy trình trong Hình 2.
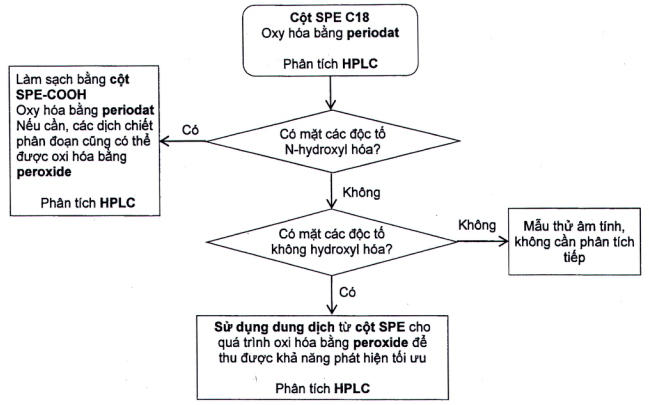
Hình 2 - Sơ đồ quy trình [4]
Phân tích dịch chiết sau khi làm sạch bằng cột SPE C18 và oxy hóa bằng periodat. Nếu không có pic tương ứng với pic bất kỳ của chất chuẩn PSP, thì mẫu thử là âm tính và không cần phân tích tiếp.
Nếu có mặt độc tố không hydroxyl hóa [STX, dcSTX, GTX2,3, dcGTX2,3, GTX5 (B1) hoặc C1,2] bất kỳ và không có mặt độc tố N-hydroxyl hóa [NEO, dcNEO, GTX1,4 , GTX6 (B2) và 03,4], thì có thể định lượng các độc tố không hydroxyl hóa bằng cách so sánh trực tiếp với các dung dịch chuẩn đã biết được tạo dẫn xuất bởi quá trình oxy hóa bằng peroxide. Tuy nhiên, phản ứng oxy hóa bằng peroxide nhạy hơn nhiều đối với GTX5 (B1), C1,2 và dcSTX và được ưu tiên nếu yêu cầu độ nhạy tối ưu.
Nếu có mặt cả hai độc tố N-hydroxyl hóa và không hydroxyl hóa, thì các độc tố không hydroxyl hóa được định lượng sau khi một phần dịch chiết khác được làm sạch bằng cột SPE C18 bị oxy hóa bằng peroxide và so sánh các pic với pic của các dung dịch chuẩn đã oxy hóa tương đương. Nguyên nhân là do quá trình oxy hóa bằng periodat một số độc tố N-hydroxyl hóa phản ứng với các sản phẩm tương tự như các chất chuyển hóa không hydroxyl hóa. Ngoài ra, đối với một số độc tố [đặc biệt là GTX5 (B1), C1,2 và dcSTX] quá trình oxy hóa bằng peroxide cho độ nhạy tốt hơn.
Để định lượng độc tố N-hydroxyl hóa bất kỳ, một phần dịch chiết tiếp theo sau khi làm sạch bằng cột SPE C18 được chiết phân đoạn (6.3.2) và oxy hóa bằng periodat. Bước này tách C3,4 khỏi GTX1,4 và GTX6 (B2) khỏi NEO, cho phép định lượng tất cả các độc tố bằng cách so sánh trực tiếp với các chất chuẩn và được thực hiện cùng quy trình oxy hóa bằng periodat, xem [5].
8 Đường chuẩn
Dựng đường chuẩn khi bắt đầu phân tích và bất cứ khi nào điều kiện sắc ký thay đổi. Dựng đồ thị tín hiệu pic theo nồng độ khối lượng của dung dịch hiệu chuẩn của độc tố PSP được bơm. Hệ số xác định ít nhất phải bằng 0,98 đối với tất cả các độc tố. Xác định nồng độ của các độc tố PSP trực tiếp bằng đường chuẩn (xem 10.2.2) hoặc bằng cách so sánh trực tiếp với các chất chuẩn phân tích ở các nồng độ tương tự được dự kiến có trong mẫu thử [5] (xem 10.2.3).
9 Định danh
Định danh độc tố PSP bằng cách so sánh các thời gian lưu và số sản phẩm oxy hóa của mẫu thử với các chất chuẩn.
10 Tính kết quả
10.1 Yêu cầu chung
Xác định định lượng từng độc tố trong thịt nhuyễn thể có vỏ sử dụng đường chuẩn (10.2.2). Ngoài ra, diện tích pic của dung dịch mẫu thử được so sánh với diện tích pic của dung dịch chuẩn ở nồng độ khối lượng tương tự như được dự kiến có trong mẫu thử (10.2.3). Để thuận tiện, có thể sử dụng ba hỗn hợp chất chuẩn để định lượng các độc tố nêu trong Bảng 4. Tính kết quả theo 10.2 trừ các trường hợp được liệt kê trong Bảng 7.
Bảng 7 - Tính kết quả đối với các thành phần độc tố khác nhau
| Độc tố | Neo | C3,4 | GTX1,4 | GTX6 | dcNeo | |
| Có mặt | dcSTX | STX, dcSTX, dcNeo |
| GTX2,3, dcGTX2,3 |
| dcSTX |
| Tính kết quả | 10.3 | 10.8 | 10.5 | 10.7 | 10.4 | 10.6 |
Áp dụng công thức nêu trong 10.9 để tính các nồng độ độc tố theo tương đương STX 2HCl.
STX phản ứng với một sản phẩm oxy hóa cụ thể bất kể loại phản ứng oxy hóa. Điều tương tự cũng đúng với GTX2,3 cũng như GTX5 (B1) và C1,2. Ngược lại, dcSTX và dcGTX2,3 tạo ra hai sản phẩm oxy hóa khác nhau trong cả hai phản ứng oxy hóa, xem thêm Điều 3 và Bảng 2.
Độc tố dcNEO bị oxy hóa tạo ra hai sản phẩm oxy hóa chỉ với quá trình oxy hóa bằng periodat. Mỗi độc tố NEO, GTX6 (B2), GTX1,4 và C3,4 tạo ra ba pic sau khi oxy hóa bằng periodat nhưng chỉ pic rửa giải thứ hai được sử dụng để định lượng (không sử dụng quá trình oxy hóa bằng peroxide để định lượng) (Bảng 2). Do một số các độc tố PSP [NEO và GTX6 (B2), GTX1,4 và C3,4] cho các sản phẩm oxy hóa giống nhau, nên chỉ có thể thực hiện việc xác định định lượng các độc tố này sau khi tách bằng cột SPE-COOH như mô tả trong 6.3.2 hoặc 6.3.3. Nếu dcSTX có mặt với nồng độ cao, thì sẽ gây nhiễu đến việc định lượng NEO sau khi oxy hóa bằng periodat. NEO có thể được định lượng theo các tỷ lệ pic sau khi oxy hóa bằng periodat và peroxide (10.3). Do thiếu các chất chuẩn nên GTX6 có thể được định lượng sau khi thủy phân thành NEO (6.4.2), (10.4). C3,4 có thể định lượng được sau khi thủy phân thành GTX1,4 (6.4.2), (10.5). Do dcNEO và dcSTX có hai pic chung khi bị oxy hóa bằng periodat, nên định lượng theo 10.6.
CHÚ THÍCH 1: Cần lưu ý sau khi làm sạch bằng cột SPE-COOH, không thể tách hoàn toàn một số độc tố trong một lần của ba lần chiết phân đoạn và đôi khi một lượng nhỏ độc tố có thể xuất hiện trong lần chiết phân đoạn kế tiếp.
CHÚ THÍCH 2: Cần biểu thị các chất hiệu chuẩn bằng μmol/ml, do điều này có thể làm giảm nguy cơ tính sai kết quả sau khi phân tích và làm cho việc tính kết quả trở nên đơn giản hơn.
10.2 Tính độc tố
10.2.1 Yêu cầu chung
Có hai phương pháp tính để định lượng nồng độ độc tố:
10.2.2 Phương pháp tính bằng đường chuẩn
Nồng độ chất, c, tính bằng micromol trên kilogam (μmol/kg) hoặc nồng độ khối lượng, w, tính bằng microgam (dạng base tự do) trên kilogam [μg (dạng base tự do)/kg] độc tố, sử dụng đường chuẩn và Công thức (1):
|
| (1) |
Trong đó:
| A x | là diện tích pic của độc tố trong dịch chiết hoặc dịch chiết phân đoạn được phân tích; |
| a | là độ dốc đường chuẩn của độc tố; |
| b | là giao điểm của đường chuẩn với trục tung; |
| V x | là thể tích cuối cùng của dịch chiết được phân tích, tính bằng mililit (ml); |
| F d | là hệ số pha loãng (đối với các dịch chiết hoặc dịch chiết phân đoạn được phân tích có nồng độ độc tố PSP cao hơn nồng độ độc tố PSP cao nhất trong hỗn hợp chất chuẩn thì cần pha loãng bằng nước); |
| m | là khối lượng của phần mẫu thử đã dùng trong quá trình làm sạch, thường là 0,5 g đối với quá trình làm sạch bằng cột SPE-C18 và 0,25 g đối với quá trình làm sạch bằng cột SPE-COOH, tính bằng gam (g); |
| 1 000 | là hệ số chuyển đổi kết quả từ μmol/g sang μmol/kg hoặc μg/g sang μg/kg. |
Do có nhiều nhóm chức tích điện nên độc tố có thể tồn tại ở các dạng khác nhau. Do đó, quan trọng là phải quy định dạng muối chính xác (khối lượng phân tử) nếu các kết quả được biểu thị bằng μg/kg.
10.2.3 Phương pháp thay thế tính kết quả sử dụng hiệu chuẩn một điểm [4], [5]
Tính nồng độ từng độc tố trong mẫu thử bằng cách so sánh diện tích pic tương ứng với diện tích pic của chất chuẩn được đưa ra trong các phép đo. Bơm dung dịch chuẩn gần thời điểm bơm mẫu thử chưa biết (trước hoặc sau) và ngoài ra nồng độ của cả hai phải tương tự nhau.
Nồng độ chất, c, tính bằng micromol trên kilogam (μmol/kg) hoặc phần khối lượng, w, tính bằng microgam (dạng base tự do) trên kilogam độc tố theo Công thức (2), xem thêm [4], [5].
|
| (2) |
Trong đó:
| A x | là diện tích pic của độc tố trong dịch chiết hoặc phần dịch chiết phân đoạn được phân tích; |
| A s | là diện tích píc của dung dịch chuẩn gần giống nhất (thời gian và nồng độ) với chất phân tích; |
| C s | là nồng độ chất hoặc nồng độ khối lượng của dung dịch chuẩn, tính bằng micromol trên mililit (μmol/ml) hoặc microgam trên mililit (μg/ml); |
| V x | là thể tích cuối cùng của dịch chiết hoặc phần dịch chiết phân đoạn được phân tích, tính bằng mililit (ml); |
| F d | là hệ số pha loãng (đối với các dịch chiết có nồng độ độc tố PSP cao hơn nồng độ độc tố PSP cao nhất trong hỗn hợp chất chuẩn thì cần pha loãng bằng nước); |
| m | là khối lượng của phần mẫu thử đã dùng trong quá trình làm sạch (0,5 g đối với quá trình làm sạch bằng cột SPE C18, 0,25 g đối với quá trình làm sạch bằng cột SPE-COOH), tính bằng gam (g); |
| 1 000 | là hệ số chuyển đổi kết quả từ μmol/g sang μmol/kg hoặc μg/g sang μg/kg. |
10.3 Tính NEO khi có mặt dcSTX [4], [5]
10.3.1 Yêu cầu chung
Vì thực tế một trong các sản phẩm phản ứng của NEO và dcSTX giống hệt nhau nên cần có phương pháp định lượng NEO khi có mặt dcSTX. Sản phẩm oxy hóa thứ hai của NEO có cùng thời gian lưu với sản phẩm oxy hóa thứ hai của dcSTX. Có thể tính diện tích pic của NEO trong mẫu thử chứa cả NEO và dcSTX theo hai cách. Hình 3 cho thấy sắc ký đồ sau khi oxy hóa bằng peropdat và peroxide của dung dịch chuẩn dcSTX và một mẫu thử chưa biết có chứa hỗn hợp NEO và dcSTX.
Phương pháp 1 và phương pháp 2 không áp dụng để tính NEO khi có mặt dcSTX và dcNEO. Cách duy nhất để định lượng là sử dụng pic periodat thứ ba của NEO khi không có mặt STX. Nếu cũng có mặt STX, thì tính hàm lượng STX sau khi oxy hóa bằng peroxide. Không tính đến phần NEO trong pic peroxide. Hàm lượng thu được của STX được chuyển đổi thành diện tích tương ứng của quá trình oxy hóa bằng periodat và được trừ đi trong diện tích pic thứ ba của NEO sau khi oxy hóa bằng periodat. Diện tích còn lại tương ứng với hàm lượng của NEO, xem 10.8.
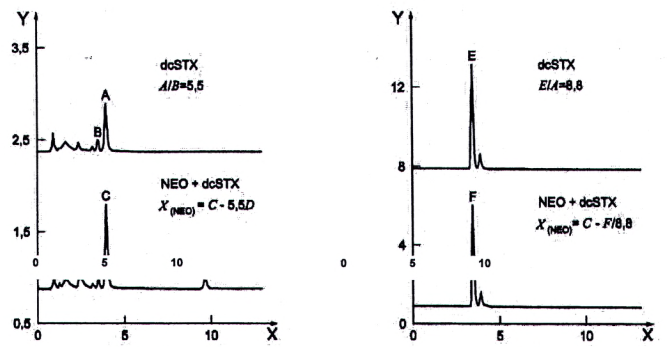
| a) Oxy hóa bằng periodat | b) Oxy hóa bằng peroxide |
CHÚ DẪN:
| Sắc ký đồ trên | Dung dịch chuẩn dcSTX |
| Sắc ký đồ dưới | Mẫu thử chưa biết |
| Dung dịch chuẩn dcSTX | A = pic thứ hai (lớn hơn), oxy hóa bằng periodat B = pic thứ nhất (nhỏ hơn), oxy hóa bằng periodat E = pic thứ nhất (lớn hơn), oxy hóa bằng peroxide |
| Mẫu chưa biết | C = pic thứ hai (lớn hơn), oxy hóa bằng periodat D = pic thứ nhất (nhỏ hơn), oxy hóa bằng periodat F = pic thứ nhất (lớn hơn), oxy hóa bằng peroxide |
| Y | Tín hiệu của detector (Phát quang, Lu) |
| X | Thời gian (phút) |
Hình 3 - Sắc ký đồ giải thích phép tính NEO khi có mặt dcSTX (các tỷ lệ pic được đưa ra chỉ là ví dụ)
10.3.2 Phương pháp 1
Nếu nồng độ của dcSTX trong mẫu thử chứa hỗn hợp NEO và dcSTX đủ để tạo ra pic thứ nhất tích phân tốt (pic D, Hình 3) với quá trình oxy hóa bằng periodat, thì tính diện tích pic tương ứng với NEO (X (NEO) ) từ tỷ số của hai diện tích pic dcSTX được tạo ra với quá trình oxy hóa bằng periodat của chất chuẩn.
Đối với dung dịch chuẩn dcSTX được phân tích sau khi oxy hóa bằng periodat, tính tỷ số của hai diện tích pic theo Công thức (3).
|
| (3) |
Trong đó:
| A | là diện tích pic của pic dcSTX thứ hai (lớn hơn) từ quá trình oxy hóa bằng periodat; |
| B | là diện tích pic của pic dcSTX thứ nhất (nhỏ hơn) từ quá trình oxy hóa bằng periodat; |
| D | là diện tích pic của pic dcSTX thứ nhất (nhỏ hơn) trong mẫu thử chưa biết từ quả trình oxy hóa bằng periodat; |
| X (dc S TX) | là diện tích pic của dcSTX trong pic C. |
Tính diện tích pic của NEO theo Công thức (4):
|
| (4) |
Trong đó:
C là diện tích pic của pic dcSTX+ NEO thứ hai (lớn hơn) trong mẫu thử chưa biết từ quá trình oxy hóa bằng periodat.
Để tính khối lượng và/hoặc nồng độ chất của NEO, sử dụng Công thức (1) và/hoặc Công thức (2).
10.3.3 Phương pháp 2
Nếu nồng độ của dcSTX trong mẫu thử có chứa NEO và dcSTX không đủ để tạo ra pic thứ nhất có thể tích phân tốt trong quá trình oxy hóa bằng periodat (pic D, Hình 3), thì tính diện tích pic tương ứng với NEO (X(NEO)) từ tỷ số diện tích pic dcSTX được tạo ra với quá trình oxy hóa bằng periodat (pic A) và diện tích pic dcSTX tạo ra trong quá trình oxy hóa bằng peroxide (pic E) trong dung dịch chuẩn.
Đối với dung dịch chuẩn dcSTX được phân tích sau khi oxy hóa bằng periodat và peroxide, tính tỷ số hai diện tích pic theo Công thức (5):
|
| (5) |
Trong đó:
| E | là diện tích pic của pic dcSTX thứ nhất (lớn hơn) từ quá trình oxy hóa bằng peroxide; |
| F | là diện tích pic của pic dcSTX thứ nhất (lớn hơn) trong mẫu thử chưa biết từ quá trình oxy hóa bằng peroxide; |
| X ( dcSTX) | là diện tích pic của dcSTX trong pic C. |
Tính diện tích pic của NEO theo Công thức (6):
|
| (6) |
Để tính khối lượng và/hoặc nồng độ chất của NEO, sử dụng Công thức (1) và/hoặc Công thức (2).
CHÚ THÍCH: Kết quả của hai phương pháp khác nhau. Phương pháp 2 có thể chính xác hơn vì diện tích pic (pic E và pic F) được sử dụng trong các phép tính lớn hơn nhiều so với pic B và pic D được sử dụng trong phương pháp 1.
10.4 Tính GTX6 (B2)
Nếu phát hiện thấy GTX6 (B2), thì sử dụng quá trình oxy hóa bằng periodat phần dịch chiết phân đoạn 2 đã thủy phân để định lượng. Quá trình thủy phân chuyển đổi GTX6 (B2) thành NEO. Để định lượng, sử dụng phép hiệu chuẩn pic rửa giải thứ hai của NEO, tính bằng micromol trên kilogam (μmol/kg). Nồng độ mol của độc tố GTX6 (B2) bằng với nồng độ mol của độc tố NEO có trong dịch chiết phân đoạn 2 sau khi thủy phân.
10.5 Tính C3,4
Nếu phát hiện thấy C3,4, thì sử dụng quá trình oxy hóa bằng periodat phần dịch chiết phân đoạn 1 đã thủy phân để định lượng. Quá trình thủy phân chuyển đổi C3,4 thành GTX1,4. Để định lượng, sử dụng phép hiệu chuẩn pic rửa giải thứ hai của GTX1,4, tính bằng micromol trên kilogam (μmol/kg). Nồng độ mol của độc tố C3,4 bằng nồng độ mol của độc tố GTX1,4 có trong phần dịch chiết phân đoạn 1 sau khi thủy phân.
10.6 Tính dcNEO khi có mặt dcSTX
10.6.1 Yêu cầu chung
Do thực tế cả hai sản phẩm phản ứng của quá trình oxy hóa bằng periodat của dcNEO và dcSTX (Pic G và pic H trong Hình 4) là giống hệt nhau, do đó cần có phương pháp định lượng dcNEO khi có mặt dcSTX. Có hai phương pháp (phương pháp 3 và phương pháp 4) để định lượng nồng độ độc tố.
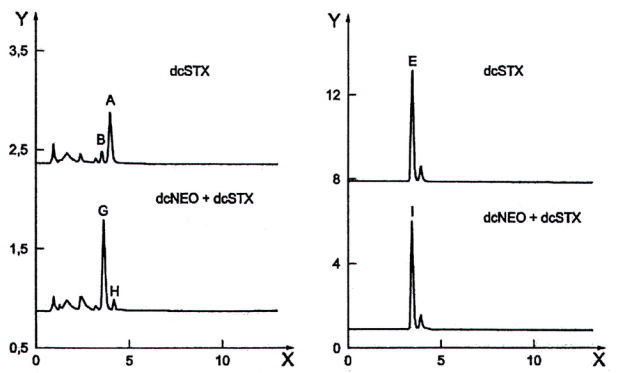
| a) Oxy hóa bằng peridoat | b) Oxy hóa bằng peroxide |
CHÚ DẪN:
| Sắc ký đồ trên | Dung dịch chuẩn dcSTX |
| Sắc ký đồ dưới | Mẫu chưa biết |
| Dung dịch chuẩn dcSTX | B = pic thứ nhất (nhỏ hơn), oxy hóa bằng periodat A = pic thứ hai (lớn hơn), oxy hóa bằng periodat E = pic thứ nhất (lớn hơn), oxy hóa bằng peroxide |
| Mẫu thử chưa biết | G = pic thứ nhất (lớn hơn), oxy hóa bằng periodat H = pic thứ hai (nhỏ hơn), oxy hóa bằng periodat I = pic thứ nhất (lớn hơn), oxy hóa bằng peroxide |
| Y | Tín hiệu của detector (Phát quang, Lu) |
| X | Thời gian (phút) |
Hình 4 - Sắc ký đồ giải thích phép tính dcNEO khi có mặt dcSTX
10.6.2 Phương pháp 3
Nếu nồng độ của dcSTX trong mẫu thử có chứa hỗn hợp dcNEO và dcSTX đủ lớn để tạo ra pic thứ nhất tích phân tốt (pic G, Hình 4) với quá trình oxy hóa bằng periodat và dcNEO góp phần không đáng kể trong quá trình oxy hóa bằng peroxide, thì diện tích pic tương ứng với dcNEO (X(dcNEO)) có thể được tính từ tỷ số của hai diện tích pic dcSTX được tạo ra do quá trình oxy hóa bằng peroxide và periodat dung dịch chuẩn (pic B và pic E) và mẫu thử chưa biết (pic I).
Đối với dung dịch chuẩn dcSTX được phân tích sau quá trình oxy hóa bằng periodat và peroxide, tính tỷ số hai diện tích pic theo Công thức (7):
|
| (7) |
Trong đó:
| B | là diện tích pic của pic dcSTX thứ nhất (nhỏ hơn) từ quá trình oxy hóa bằng periodat; |
| E | là diện tích pic của pic dcSTX thứ nhất (lớn hơn) từ quá trình oxy hóa bằng peroxide; |
| I | là diện tích pic của pic dcSTX thứ nhất (lớn hơn) trong mẫu thử chưa biết từ quá trình oxy hóa bằng peroxide; |
| X (dc STX-Period) | là diện tích pic của dcSTX trong pic G. |
Tính diện tích pic của dcNEO trong pic G theo Công thức (8)
|
| (8) |
Trong đó:
G là diện tích pic của pic dcSTX+ dcNEO thứ nhất (lớn hơn) của mẫu thử chưa biết từ quá trình oxy hóa bằng periodat.
Để tính khối lượng và/hoặc nồng độ chát của dcNEO, sử dụng Công thức (1) và/hoặc Công thức (2).
10.6.3 Phương pháp 4
Độ nhạy của phương pháp sử dụng peroxide đối với dcNEO là rất thấp, do đó có thể bỏ qua hàm lượng dcNEO khi tính dcSTX sau khi oxy hóa bằng peroxide. Phần dcSTX trong diện tích pic G được tính bằng đường chuẩn theo Công thức (10) hoặc Công thức (11), tương ứng:
|
| (9) |
|
| (10) |
|
| (11) |
Trong đó:
| ρ (dcSTX-H2 O 2) | là nồng độ khối lượng của dcSTX trong pic I; |
| I | là diện tích pic I; |
| P (dcSTX-Period) | là nồng độ khối lượng của dcSTX trong pic G; |
| X (dcSTX-Period) | là diện tích pic của dcSTX trong pic G; |
| a dcSTX-H2O2 | là độ dốc đường chuẩn của dcSTX bị oxy hóa bằng peroxide; |
| a dcSTX-per i od | là độ dốc đường chuẩn của dcSTX bị oxy hóa bằng periodat; |
| b dcSTX-H2O2 | là giao điểm với trục tung của đường chuẩn của dcSTX bị oxy hóa bằng peroxide; |
| b dcSTX-period | là giao điểm với trục tung của đường chuẩn của dcSTX bị oxy hóa bằng periodat. |
Tính diện tích pic của dcNEO trong pic G theo Công thức (12).
|
| (12) |
Để tính khối lượng và/hoặc nồng độ chất của dcNEO, sử dụng Công thức (1) và/hoặc Công thức (2).
10.7 Tính GTX1,4 khi có mặt GTX2.3 và dcGTX2,3
10.7.1 Yêu cầu chung
Do thực tế một số sản phẩm phản ứng của GTX1,4 và GTX2,3 cũng như GTX1,4 và dcGTX2,3 là giống hệt nhau, do đó cần có phương pháp để định lượng GTX1,4 khi có mặt GTX2,3 và dcGTX2,3, mặc dù trường hợp này không chắc sẽ xảy ra. Sản phẩm oxy hóa thứ hai của GTX1,4 (pic M, Hình 5) có cùng thời gian lưu với sản phẩm oxy hóa thứ hai của dcGTX2,3. Sản phẩm oxy hóa thứ ba của GTX1,4 (pic O) có cùng thời gian lưu với sản phẩm oxy hóa thứ nhất của GTX2,3.
Nếu chỉ có mặt GTX2,3 thì có thể tính hàm lượng của GTX1,4 sử dụng diện tích pic oxy hóa thứ hai của GTX1.4.
Nếu chỉ có mặt dcGTX2,3 thì có thể tính hàm lượng của GTX1,4 sử dụng diện tích pic oxy hóa thứ ba của GTX1,4.
Có thể tính lượng GTX1,4 trong mẫu thử có chứa GTX1,4, dcGTX2,3 và GTX2,3 bằng phương pháp 5 và phương pháp 6.
| a) Oxy hóa bằng periodat | b) Oxy hóa bằng peroxide |
CHÚ DẪN:
| Sắc ký đồ trên | dung dịch chuẩn có chứa GTX2,3 và dcGTX2,3 |
| Sắc ký đồ dưới | mẫu thử chưa biết |
| Dung dịch chuẩn dcGTX2,3 | J = pic thứ nhất (nhỏ hơn), oxy hóa bằng periodat K = pic thứ hai (lớn hơn), oxy hóa bằng periodat |
| Mẫu chưa biết | L = pic thứ nhất (nhỏ hơn), oxy hóa bằng periodat M = pic thứ hai (lớn hơn), oxy hóa bằng periodat O = pic thứ ba (lớn hơn), oxy hóa bằng periodat P = pic thứ ba (lớn hơn), oxy hóa bằng peroxide |
| Y | tín hiệu của detector (Lu) |
| X | thời gian (phút) |
Hình 5 - Sắc ký đồ giải thích phép tính GTX1,4 khi có mặt GTX2,3 và dcGTX2,3
10.7.2 Phương pháp 5
Nếu nồng độ dcGTX2,3 trong mẫu thử có chứa hỗn hợp GTX1.4 và dcGTX2,3 đủ lớn để tạo ra pic thứ nhất tích phân tốt (pic L, Hình 5) với quá trình oxy hóa bằng periodat, thì có thể tính diện tích pic tương ứng với GTX1,4 (X (GTX 1 , 4 ) ) từ tỷ số của hai diện tích pic dcGTX2,3 được tạo ra do quá trình oxy hóa bằng periodat của chất chuẩn (sử dụng Công thức (13)).
|
| (13) |
Trong đó:
| J | là diện tích pic của pic dcGTX2,3 thứ nhất (nhỏ hơn) từ quá trình oxy hóa bằng periodat; |
| K | là diện tích pic của pic dcGTX2,3 thứ hai (lớn hơn) từ quá trình oxy hóa bằng periodat; |
| L | là diện tích pic của pic dcGTX2,3 thứ hai (nhỏ hơn) trong mẫu thử chưa biết từ quá trình oxy hóa bằng periodat; |
| X (dcGTX2,3) | là diện tích pic của dcGTX2,3 trong pic M. |
Tính diện tích pic của GTX1,4 theo Công thức (14).
|
| (14) |
Trong đó:
M là diện tích pic của pic dcGTX2,3 và GTX1,4 thứ hai (lớn hơn) trong mẫu thử chưa biết từ quá trình oxy hóa bằng periodat.
Để tính khối lượng và/hoặc nồng độ chất của GTX1,4, sử dụng Công thức (1) và/hoặc Công thức (2).
10.7.3 Phương pháp 6
Độ nhạy của phương pháp sử dụng peroxide đối với GTX1.4 là rất thấp, do đó có thể bỏ qua hàm lượng GTX1,4 khi tính GTX2,3 sau khi oxy hóa bằng peroxide. Phần GTX2.3 trong diện tích pic O được tính bằng đường chuẩn theo Công thức (16) hoặc Công thức (17), tương ứng.
|
| (15) |
|
| (16) |
|
| (17) |
Trong đó:
| ρ (GTX2,3-H2O2) | là nồng độ khối lượng của GTX2,3 trong pic P; |
| ρ (GTX2,3-Period) | là nồng độ khối lượng của GTX2,3 trong pic O; |
| P | là diện tích pic P; |
| X (GTX2,3-Period) | là diện tích pic của GTX2,3 trong pic O; |
| a SGTX2,3-H2O2 | là độ dốc đường chuẩn của GTX2,3 bị oxy hóa bằng peroxide; |
| a GTX2 , 3- Period | là độ dốc đường chuẩn của GTX2,3 bị oxy hóa bằng periodat; |
| b GTX2 , 3-H2O2 | là giao điểm với trục tung của đường chuẩn của GTX2.3 bị oxy hóa bằng peroxide; |
| b GTX2 , 3- Period | là giao điểm với trục tung của đường chuẩn của GTX2,3 bị oxy hóa bằng periodat. |
Tính diện tích pic của GTX1,4 trong pic o theo Công thức (18).
|
| (18) |
Trong đó:
O là diện tích pic của pic GTX2.3 và GTX1,4 thứ ba (lớn hơn) trong mẫu thử chưa biết từ quá trình oxy hóa bằng periodat.
Để tính khối lượng và/hoặc nồng độ chất của GTX1,4, sử dụng Công thức (1) và/hoặc Công thức (2).
10.8 Tính NEO khi có mặt dcSTX, dcNEO và STX (tùy chọn)
10.8.1 Yêu cầu chung
Do thực tế một số sản phẩm phản ứng của NEO, dcNEO, STX và dcSTX là giống hệt nhau, do đó cần phương pháp định lượng NEO khi có mặt dcNEO, dcSTX và STX, mặc dù trường hợp này khó có thể xảy ra. Sản phẩm oxy hóa thứ hai của NEO có cùng thời gian lưu với thời gian lưu của sản phẩm oxy hóa thứ hai của dcSTX và dcNEO (Pic s. Hình 6). Sản phẩm oxy hóa thứ ba của NEO có cùng thời gian lưu với thời gian lưu của sản phẩm oxy hóa của STX (Pic T). Diện tích pic của NEO trong mẫu thử chứa NEO, dcNEO, dcSTX và STX có thể được tính bằng hai phương pháp sau (phương pháp 7 và phương pháp 8). Hình 6 đưa ra sắc ký đồ sau khi oxy hóa bằng periodat và peroxide của dung dịch chuẩn STX và mẫu thử chưa biết chứa hỗn hợp NEO và dcNEO, dcSTX và STX.
| a) Oxy hóa bằng periodat | b) Oxy hóa bằng peroxide |
CHÚ DẪN:
| Sắc ký đồ trên | dung dịch chuẩn STX |
| Sắc ký đồ dưới | mẫu thử chưa biết |
| Dung dịch chuẩn STX | Q = pic, oxy hóa bằng periodat R = pic, oxy hóa bằng peroxide |
| Mẫu thử chưa biết | S = pic thứ hai (lớn hơn), oxy hóa bằng periodat T = pic thứ ba (lớn hơn), oxy hóa bằng periodat U = pic thứ ba (lớn hơn), oxy hóa bằng peroxide |
| Y | tín hiệu detector (Lu) |
| X | thời gian (phút) |
Hình 6 - Sắc ký đồ giải thích phép tính NEO khi có mặt dcSTX, dcNEO và STX
10.8.2 Phương pháp 7
Nếu mẫu thử chứa NEO và dcSTX, dcNEO và STX (pic T: NEO và STX là đồng thời, pic S: NEO, dcNEO và dcSTX là đồng thời, Hình 6) và có thể bỏ qua sự đóng góp của NEO trong pic U trong quá trình oxy hóa bằng peroxide, thì sau đó tính diện tích pic tương ứng với NEO (X (NE O )) từ tỷ số giữa các pic STX được tạo ra trong quá trình oxy hóa bằng periodat (pic Q) và quá trình oxy hóa bằng peroxide (pic R) trong dung dịch chuẩn.
Đối với dung dịch chuẩn STX được phân tích sau khi oxy hóa bằng periodat và peroxide, tính tỷ số hai diện tích pic theo Công thức (19).
|
| (19) |
Trong đó:
| Q | là diện tích pic của pic STX từ quá trình oxy hóa bằng periodat; |
| R | là diện tích pic của pic STX từ quá trình oxy hóa bằng peroxide; |
| U | là diện tích pic của pic STX trong mẫu thử chưa biết từ quá trình oxy hóa bằng peroxide; |
| X (STX) | là diện tích pic của STX trong pic T. |
Tính diện tích pic của NEO theo Công thức (20)
|
| (20) |
Trong đó:
T là diện tích pic của pic STX và NEO thứ ba (lớn hơn) trong mẫu thử chưa biết từ quá trình oxy hóa bằng periodat.
Để tính khối lượng và/hoặc nồng độ chất của NEO, sử dụng Công thức (1) và/hoặc Công thức (2).
10.8.3 Phương pháp 8
Độ nhạy của phương pháp sử dụng peroxide đối với NEO là rất thấp; do đó có thể bỏ qua hàm lượng của NEO, khi tính STX sau khi oxy hóa bằng peroxide. Phần STX trong diện tích pic T được tính bằng đường chuẩn theo Công thức (22) hoặc Công thức (23), tương ứng.
|
| (21) |
|
| (22) |
|
| (23) |
Trong đó:
| ρ (STX-H2O2) | là nồng, độ khối lượng của STX trong pic U; |
| ρ (STX-Period) | là nồng độ khối lượng của STX trong pic T; |
| U | là diện tích pic U; |
| X (STX-Period) | là diện tích pic của STX trong pic T; |
| a STX-H2O2 | là độ dốc đường chuẩn của STX bị oxy hóa bằng peroxide; |
| a STX-period | là độ dốc đường chuẩn của STX bị oxy hóa bằng periodat; |
| b STX-H2O2 | là giao điểm với trục tung của đường chuẩn của STX bị oxy hóa bằng peroxide; |
| b STX-Period | là giao điểm với trục tung của đường chuẩn của STX bị oxy hóa bằng periodat. |
Tính diện tích pic của NEO trong pic T theo Công thức (24)
|
| (24) |
Để tính khối lượng và/hoặc nồng độ chất của NEO, sử dụng Công thức (1) và/hoặc Công thức (2).
10.9 Chuyển đổi sang các đương lượng STX 2HCl
Để kiểm soát giới hạn quy định đối với độc tố PSP trong thịt nhuyễn thể có vỏ, cần tính tổng độc tính theo các STX 2HCl tương đương. Do đó, phải chuyển đổi mỗi phần khối lượng độc tố PSP thành nồng độ chất, tính bằng micromol trên kilogam (μmol/kg) theo công thức (25), nếu chưa thực hiện theo 10.2.
|
| (25) |
Trong đó:
| w | là phần khối lượng của độc tố, tính bằng microgam trên kilogam (μg/kg) (tính theo 10.2); |
| M | là khối lượng phân tử của độc tố, tính bằng microgam trên micromol (μg/μmol); |
Tổng độc tính trong thịt được tính theo Công thức (26):
|
| (26) |
Trong đó:
| C i | là nồng độ của từng độc tố được phát hiện, tính bằng micromol trên kilogam (μmol/kg); |
| T i | là hệ số độ độc tương đương của các độc tố PSP theo Bảng 8, xem [13]; [14]; |
| 372,2 | là khối lượng phân tử của STX 2HCl (g/mol). |
Đối với các độc tố được xác định đồng thời, vì đồng rửa giải (dcGTX2 và dcGTX3; GTX1 và GTX4; GTX2 và GTX3; C1 và C2; C3 và C4) nên chọn hệ số độ độc cao nhất của hai đồng phân để tính phần độc tính của từng độc tố.
CHÚ THÍCH: Nhóm công tác châu Âu về xác định các độc tố PSP bằng phương pháp nêu trong AOAC 2005.06 do Phòng thử nghiệm chuẩn châu Âu về độc tố sinh học biển (EURLMB) tiến hành đã thống nhất tại cuộc họp lần thứ 3 năm 2009 về việc sử dụng hệ số độ độc tương đương (TEF) được nêu trong Bảng 8 do cơ quan an toàn thực phẩm châu Âu (EFSA) đưa ra.
Có thể sử dụng các hệ số độ độc tương đương (TEF) khác ngoài các loại được liệt kê trong Bảng 8 với điều kiện việc sử dụng các hệ số được quốc tế chấp nhận.
Bảng 8 - Hệ số độ độc tương đương (TEF) của độc tố PSP
| Tên độc tố | TEF theo quan điểm của EFSA [14] | TEF theo quan điểm của Oshima [13] |
| GTX5(B1) | 0,1 | 0,064 4 |
| GTX6(B2) | 0,1 | 0,064 4 |
| C1 | 0,0 | 0,006 0 |
| C2 | 0,1 | 0,096 3 |
| C3 | 0,0 | 0,013 3 |
| C4 | 0,1 | 0,057 6 |
| dcGTX2 | 0,2 | 0,153 8 |
| dcGTX3 | 0,4 | 0,376 6 |
| dcNeo | 0,4 | Không bán sẵn |
| dcSTX | 1 | 0,513 1 |
| GTX1 | 1 | 0,9940 |
| GTX2 | 0,4 | 0,359 2 |
| GTX3 | 0,6 | 0,637 9 |
| GTX4 | 0,7 | 0,726 1 |
| 11-hydroxy-STX | 0,3 | 0,318 6 |
| NEO | 1 | 0,924 3 |
| STX | 1 | 1,000 0 |
11 Độ chụm
Chi tiết về các nghiên cứu liên phòng thử nghiệm và hiệu năng của phương pháp được nêu trong Phụ lục A.
Các giá trị thu được từ các nghiên cứu liên phòng thử nghiệm này có thể không áp dụng được cho các dải nồng độ và nền mẫu khác với các dải nồng độ và nền mẫu nêu trong Phụ lục A.
12 Báo cáo thử nghiệm
Báo cáo thử nghiệm phải bao gồm các dữ liệu cần thiết theo TCVN ISO/IEC 17025 (ISO/IEC 17025) và các thông tin sau:
a) mọi thông tin cần thiết để nhận biết về mẫu thử (loại mẫu thử [ví dụ: đã nấu chín, đã chế biến hoặc tươi sống], nguồn gốc mẫu thử, tên gọi);
b) viện dẫn tiêu chuẩn này;
c) ngày và kiểu loại quy trình lấy mẫu (nếu biết);
d) ngày nhận mẫu;
e) ngày thử nghiệm;
f) các kết quả thử nghiệm và đơn vị biểu thị kết quả;
g) mọi điểm đặc biệt quan sát được trong quá trình thử nghiệm;
h) mọi thao tác không quy định trong phương pháp hoặc được xem là tùy chọn, có thể ảnh hưởng đến kết quả thử nghiệm.
Phụ lục A
(tham khảo)
Dữ liệu về độ chụm
A.1 Nghiên cứu liên phòng thử nghiệm do Bộ Y tế Canada tổ chức (2001)
Dữ liệu sau đây thu được trong nghiên cứu liên phòng thử nghiệm do Bộ phận Nghiên cứu Thực phẩm, Bộ Y tế Canada, Ottawa, Canada tổ chức theo Chương trình xác nhận giá trị sử dụng của phương pháp AOAC® [15] vào năm 2001. Đối với nghiên cứu liên phòng thử nghiệm này, sử dụng ba điểm hiệu chuẩn (4.13.2). Các mẫu vẹm, cả mẫu trắng và mẫu bị nhiễm tự nhiên, đều được trộn và đồng nhất để tạo ra nhiều loại hỗn hợp độc tố PSP và các mức nồng độ khác nhau. Thực hiện quy Trình tương tự đối với các mẫu nghêu, hàu và sò. Tổng cộng 21 mẫu đã được gửi đến 21 phòng thử nghiệm cộng tác nhưng 3 phòng thử nghiệm không tham gia sau khi nhận được vật liệu thử. Kết quả thu được từ 18 phòng thử nghiệm đại diện cho 14 quốc gia khác nhau. Dữ liệu từ hai phòng thử nghiệm không được đưa vào báo cáo vì không cung cấp đủ thông tin để kiểm tra xác nhận kết quả. Dữ liệu (không hiệu chính về độ thu hồi) của 16 phòng thử nghiệm còn lại được phân tích thống kê và tóm tắt trong Bảng A.5 đến Bảng A.19. Bảng A.20 và Bảng A.21 đưa ra các kết quả thu được từ các mẫu mù lặp lại đối với tất cả các độc tố được nghiên cứu. Tất cả các kết quả đều được chấp nhận với giá trị HorRat dưới 2, xem [4] và [5],
Nghiên cứu liên phòng thử nghiệm đã áp dụng phép thử Dixon cho từng mẫu thử riêng lẻ có đủ số điểm dữ liệu để thu được dữ liệu thống kê liên phòng thử nghiệm đối với các mẫu thử. Giá trị HorRat (giá trị được chấp nhận là < 2) cho thấy độ biến thiên của các kết quả đối với hầu hết các độc tố ở các nồng độ khác nhau nằm trong dải chấp nhận được.
Vật liệu của nghiên cứu liên phòng thử nghiệm này bao gồm thịt nhuyễn thể có vỏ từ Tây Ban Nha, New Zealand, bờ biển phía đông và phía tây của Canada, có chứa nhiều mẫu độc tố PSP khác nhau để thử nghiệm phương pháp với các nền mẫu và hỗn hợp độc tố PSP khác nhau về mặt địa lý, xem Bảng A.1.
GTX6 (B2) không được đưa vào nghiên cứu liên phòng thử nghiệm này để định lượng do lượng chất chuẩn có sẵn không đủ. Tuy nhiên, sau khi làm sạch bằng cột SPE-COOH, phần lớn các phòng thử nghiệm đã phát hiện và báo cáo kết quả GTX6 (B2) trong các mẫu thử nhất định ở nồng độ bằng hoặc cao hơn 30 μg/kg. Điều này cho thấy khi chất chuẩn phân tích có bán sẵn thì có thể áp dụng phương pháp này để phát hiện định lượng độc tố này.
Các chữ viết tắt sau đây được sử dụng cho tất cả các bảng trong Phụ lục A:
| nd | Không xác định được; |
| Năm | Năm nghiên cứu liên phòng thử nghiệm |
| Các phòng thử nghiệm không có ngoại lệ | Số phòng thử nghiệm còn lại sau khi trừ ngoại lệ |
| Các kết quả được chấp nhận | Số các kết quả được chấp nhận |
|
| Giá trị trung bình |
| s r | Độ lệch chuẩn lặp lại |
| RSD r | Độ lệch chuẩn lặp lại tương đối |
| r | Giới hạn lặp lại |
| s R | Độ lệch chuẩn tái lập |
| RSD R | Độ lệch chuẩn tái lập tương đối |
| R | Giới hạn tái lập |
| σ | Độ lệch chuẩn mục tiêu để đánh giá độ thành thạo |
Dữ liệu mẫu thử dưới đây là hợp lệ đối với tất cả các bảng dữ liệu về độ chụm
Bảng A.1 - Đặc tính của các mẫu thử
| Số mẫu thử | Nền mẫu | Đặc tính |
| Mẫu thực nghiệm | Vẹm, bị nhiễm tự nhiên |
|
| 1 | Sò, bị nhiễm tự nhiên |
|
| 2 | Nghêu, bị nhiễm tự nhiên |
|
| 3 | Hàu, mẫu trắng |
|
| 4 | Vẹm, mẫu trắng |
|
| 5 | Nghêu, bị nhiễm tự nhiên | Mẫu mù lặp lại của mẫu 5D |
| 5D | Nghêu, bị nhiễm tự nhiên | Mẫu mù lặp lại của mẫu 5 |
| 6 | Nghêu, mẫu trắng |
|
| 7 | Vẹm, bị nhiễm tự nhiên |
|
| 8 | Vẹm, bị nhiễm tự nhiên | Mẫu mù lặp lại của mẫu 8D |
| 8D | Vẹm, bị nhiễm tự nhiên | Mẫu mù lặp lại của mẫu 8 |
| 9 | Vẹm, bị nhiễm tự nhiên |
|
| 10 | Hàu, bị nhiễm tự nhiên | Mẫu mù lặp lại của mẫu 10D |
| 10D | Hàu, bị nhiễm tự nhiên | Mẫu mù lặp lại của mẫu 10 |
| 11 | Hàu, bị nhiễm tự nhiên |
|
| 12 | Vẹm, bị nhiễm tự nhiên |
|
| Thêm chuẩn 1 | Vẹm, bị nhiễm nhân tạo (thêm chuẩn) | Thêm chuẩn bằng NEO; STX; GTX1,4; GTX2.3 |
| Thêm chuẩn 2 | Vẹm, bị nhiễm nhân tạo (thêm chuẩn) | Thêm chuẩn bằng NEO; STX; GTX1.4; GTX2,3; C1,2; C3,4 |
| Thêm chuẩn 3 | Vẹm, bị nhiễm nhân tạo (thêm chuẩn) | Thêm chuẩn bằng dcSTX; STX; GTX5 |
| Thêm chuẩn 4 | Vẹm, bị nhiễm nhân tạo (thêm chuẩn) | Thêm chuẩn bằng dcSTX; STX; GTX5 |
| Thêm chuẩn 5 | Vẹm, bị nhiễm nhân tạo (thêm chuẩn) | Thêm chuẩn bằng dcSTX; GTX2.3; GTX5; C1,2; C3,4 |
A.2 Phép thử hiệu năng về tổng độc tính do Phòng thử nghiệm chuẩn Quan hệ cộng đồng về độc tố sinh học biển (CRLMB) [4] tổ chức năm 2006
Dữ liệu sau đây thu được trong phép thử hiệu năng [6] do Phòng thử nghiệm chuẩn Quan hệ cộng đồng về độc tố sinh học biển (CRLMB) tổ chức, theo Chương trình xác nhận giá trị sử dụng các phương pháp AOAC [15] năm 2006 trên các mẫu thử (tươi sống và đông lạnh). Đây là một nghiên cứu nhằm đánh giá “sự phù hợp với mục đích” của phương pháp Lawrence HPLC-FLD để kiểm soát độc tố PSP trong các phòng thử nghiệm ở châu Âu. Hiệu năng của các phòng thử nghiệm EU tham gia áp dụng phương pháp này được so sánh với kết quả thu được trong Nghiên cứu liên phòng thử nghiệm do Lawrence tổ chức [5], Phương pháp Lawrence [1] nêu cách tính nồng độ của từng độc tố PSP (tính bằng μg độc tố dạng base tự do/kg thịt nhuyễn thể có vỏ), nhưng không nêu cách tiến hành báo cáo kết quả về tổng độc tính. Phép thử hiệu năng biểu thị kết quả bằng μg các STX 2HCl tương đương/100 g thịt nhuyễn thể có vỏ. Trong tiêu chuẩn này, các giá trị được chuyển đổi theo μg các STX 2HCl tương đương/kg thịt nhuyễn thể có vỏ. Sử dụng các độc tính đặc hiệu của độc tố PSP (Oshima, 1995, [13] cũng xuất hiện trong “Thông tin bổ sung về các chất chuẩn được chứng nhận của độc tố PSP”) để tính kết quả.
Đồng nhất các mẫu vẹm, sò, nghêu và Acanthocardia tuberculata (sò khổng lồ) bị nhiễm tự nhiên (xem Bảng A.2). Có thể định lượng các mẫu thử chứa C1,2 (chất chuẩn không bán sẵn ở thời điểm thử nghiệm), dc-STX, GTX2,3, GTX5, STX và dcGTX2,3 sau khi làm sạch bằng cột SPE-C18. Các dịch chiết cũng chứa GTX1,4, C3,4 (chất chuẩn không bán sẵn), NEO và GTX6 (chất chuẩn không bán sẵn)
Tổng cộng có 6 mẫu được gửi đến 21 phòng thử nghiệm cộng tác nhưng có 3 phòng thử nghiệm không trả kết quả đúng thời điểm. Kết quả thu được từ 18 phòng thử nghiệm. Đối với các phòng thử nghiệm nhầm lẫn một loại độc tố PSP với một loại độc tố khác (ví dụ: GTX6 thành NEO), kết quả của các phòng thử nghiệm này được coi là dữ liệu không hợp lệ và bị loại bỏ trước khi đánh giá thống kê. Tiến hành phép thử Cochran và Grubbs để xác định các ngoại lệ đối với các mẫu thử CRL/06/P/01 và CRL/06/P/05 (các mẫu mù lặp lại). Đối với các mẫu thử còn lại, sử dụng phép thử Dixon (α = 0,05) thay thế.
Dữ liệu về độ chụm được nêu trong Bảng A.22 và Bảng A.23
Bảng A.2 - Đặc tính của mẫu thử từ phép thử hiệu năng
| Số mẫu thử | Nền mẫu | Đặc tính |
| CRL/06/P/01 | Vẹm, bị nhiễm tự nhiên | Mẫu mù lặp lại của mẫu CRL/06/P/05 |
| CRL/06/P/02 | Acanthocardia tuberculata, sò khổng lồ bị nhiễm tự nhiên |
|
| CRL/06/P/03 | Nghêu, bị nhiễm tự nhiên |
|
| CRL/06/P/04 | Sò, bị nhiễm tự nhiên |
|
| CRL/06/P/05 | Vẹm, bị nhiễm tự nhiên | Mẫu mù lặp lại của mẫu CRL/06/P/01 |
| CRL/06/P/06 | Vẹm, bị nhiễm tự nhiên |
|
A.3 Xác định độc tố PSP trong nhuyễn thể có vỏ bao gồm GTX6 sau khi thủy phân do Phòng thử nghiệm chuẩn Quan hệ cộng đồng về độc tố sinh học biển (CRLMB) 4) tổ chức năm 2007
Nghiên cứu liên phòng thử nghiệm [7] do Phòng thử nghiệm chuẩn Quan hệ cộng đồng về độc tố sinh học biển (CRLMB), Agenda Espanola de Seguridad Alimentaria y Nutricion (AESAN) tổ chức trên các mẫu tươi sống. So với nghiên cứu trước đó có cải tiến cần thiết là có sẵn chất chuẩn độc tố C1,2 và xác định GTX6 (B2) thông qua quá trình thủy phân bằng acid, cần thiết lập ở quy mô nhỏ xem quy trình thủy phân có khả thi để xác định gián tiếp GTX6 (B2) hay không. Do đó, hai mẫu (vẹm đông lạnh và đồng nhất: xem Bảng A.3) được phân tích bởi bảy phòng thử nghiệm của EU. Sử dụng phương pháp Lawrence HPLC và ngoài ra, tiến hành thủy phân acid dịch chiết phân đoạn 2 làm sạch bằng cột COOH-SPE đã tinh sạch để xác định gián tiếp độc tố GTX6 (B2) (xem 6.4).
Bảng A.3 - Đặc tính của mẫu thử
| Số mẫu thử | Nền mẫu | Loài | Nguồn gốc | Chú thích |
| CRL/07/HYDR/01 | Vẹm | Mytilus galloprovincialis | Tây Ban Nha (E) | Bị nhiễm tự nhiên |
| CRL/07/HYDR/02 | Vẹm | Mytilus galloprovincialis | Tây Ban Nha (E) | Bị nhiễm tự nhiên |
Đánh giá phép xác định GTX6 (B2), GTX5 (B1), dcGTX2,3, C1,2, dcSTX và tổng độc tính. Sử dụng độc tính đặc hiệu của độc tố PSP (Oshima, 1995, [13] cũng xuất hiện trong “Thông tin bổ sung về các chất chuẩn được chứng nhận của độc tố PSP”) để tính tổng độc tính. Tất cả các dữ liệu phòng thử nghiệm được đưa vào để đánh giá thống kê. Kết quả ngoại lệ được xác định bằng phép thử Dixon (α = 0,05) và được loại khỏi giá trị trung bình tính được của các phòng thử nghiệm tham gia. Dữ liệu thu được được nêu trong Bảng A.24 đến Bảng A.27, Bảng A.29 và Bảng A.30.
A.4 Mở rộng xác nhận giá trị sử dụng bao gồm dcGTX2,3 và dcNEO do Phòng thử nghiệm chuẩn Quan hệ cộng đồng về độc tố sinh học biển (CRLMB) 4) đưa ra năm 2008
Phòng thử nghiệm chuẩn Quan hệ cộng đồng về độc tố sinh học biển (CRLMB), Agenda Espanola de Scguridad Alimentaria y Nutrition (AESAN) tiến hành nghiên cứu liên phòng thử nghiệm để xác định độc tố PSP trong nhuyễn thể có vỏ tươi sống và đông lạnh [8], Do đó, cần mở rộng phương pháp nêu trong AOAC 2005.06 bằng dcGTX2,3 và dcNEO. Ngoài ra, cần có cả quy trình thủy phân acid để chuyển đổi GTX6 (B2) thành NEO, quy trình này đã được chứng minh là có lợi cho việc định lượng GTX6 [17].
Đồng nhất các mẫu thử của nghêu và vẹm được thêm chuẩn hoặc bị nhiễm tự nhiên khác nhau và sử dụng các mẫu này làm vật liệu thử cho nghiên cứu liên phòng thử nghiệm (xem Bảng A.4). Tổng cộng 11 mẫu thử đã được gửi đến 11 phòng thử nghiệm cộng tác. Đánh giá thống kê dữ liệu thu được từ 10 phòng thử nghiệm khác nhau để xác định các ngoại lệ bị loại trừ trong các phép tính kết quả tiếp theo.
Tiến hành các phép thử Cochran và Grubbs để xác định các ngoại lệ đối với các mẫu thử (các mẫu mù lặp lại). Đối với các mẫu thử còn lại, sử dụng phép thử Dixon (a = 0,05) thay thế.
Cuối cùng, xác định dữ liệu xác nhận giá trị sử dụng đối với dcGTX2,3 trong nghiên cứu liên phòng thử nghiệm này. Các phép xác định GTX6 (B2), GTX5 (B1), dcGTX2,3, C1,2, dcSTX, dcNEO và tổng độc tính được đánh giá. Sử dụng các độc tính đặc hiệu của độc tố PSP [13] để tính tổng độc tính. Dữ liệu thu được được nêu trong Bảng A.24 đến Bảng A.31.
Việc tính kết quả để định lượng dcNEO và GTX6 (B2) có thể là nguyên nhân dẫn đến hiệu năng thấp của một số phòng thử nghiệm trong nghiên cứu liên phòng thử nghiệm này.
Bảng A.4 - Đặc tính của mẫu thử
| Số mẫu thử | Nền mẫu | Loài | Nguồn gốc | Chú thích |
| CRL/08/P01 và CRL/08/P/07 | Nghêu | Venuerupis pullarstra | Obidos Lagoon, Bồ Đào Nha (P), Tây Ban Nha (E) | Mẫu nghêu trắng mù lặp lại (Tây Ban Nha) được trộn với mẫu nghêu bị nhiễm tự nhiên (P) |
| CRL/08/P/02 | Vẹm | Mytilus galloprovincialis | Tây Ban Nha (E) | Mẫu trắng, mua tại chợ bán lẻ |
| CRL/08/P03 và CRL/08/P/08 | Vẹm | Mytilus galloprovincialis | Tây Ban Nha (E) | Mẫu mù lặp lại, mẫu trắng nguyên liệu được trộn với một mẫu bị nhiễm tự nhiên |
| CRL/08/P/04 | Nghêu | Spisula solida | Sines, Bồ Đào Nha (P) | Mẫu bị nhiễm tự nhiên |
| CRL/08/P/05 | Vẹm | Mytilus galloprovincialis | Tây Ban Nha (E) | Mẫu CRL/08/P/02 được thêm chuẩn bằng NRC-dcGTX2,3-b ở nồng độ 0,807 μmol/kg mẫu |
| CRL/08/P/06 | Nghêu | Meretryx lyrata (Nghêu Bến Tre) | Việt Nam | Mẫu CRL/08/P/10 được thêm chuẩn bằng NRC-dcGTX2,3-b ở nồng độ 0,773 μmol/kg mẫu |
| CRL/08/P/09 | Vẹm | Mytilus galloprovincialis | Tây Ban Nha (E) | Mẫu CRL/08/P/02 được thêm chuẩn bằng NRC-dcGTX2,3-b ở nồng độ 1,84 μmol/kg mẫu |
| CRL/08/P/10 | Nghêu | Meretryx lyrata | Việt Nam | Mẫu trắng |
| CRL/08/P/11 | Nghêu | Meretryx lyrata | Việt Nam | Mẫu CRL/08/P/10 được thêm chuẩn bằng NRC-dcGTX2,3-b ở nồng độ 1,80 μmol/kg mẫu |
Bảng A.5 - Dữ liệu về độ chụm đối với STX sau khi làm sạch bằng cột SPE C18 thu được bằng nghiên cứu liên phòng thử nghiệm trong A.1
| Mẫu | Thực nghiệm | 1 | 2 | 3 | 4 | 5 | 5D | 6 | 7 | 8 | 8D | 9 | 10 | 10D | 11 | 12 | Thêm chuẩn 1 | Thêm chuẩn 2 | Thêm chuẩn 3 | Thêm chuẩn 4 | Thêm chuẩn 5 a |
| Năm | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 |
| Số phòng thử nghiệm | 12 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 14 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 11 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 11 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 14 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 11 |
| Số phòng thử nghiệm ngoại lệ | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Các kết quả được chấp nhận | 11 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 14 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 15 | 11 |
|
| 471 | 1 048 | 338 | nd | nd | 522 | 518 | nd | 23,4 | 310 | 316 | 132 | 136 | 144 | 258 | 784 | 223 | 447 | 51,3 | 169 | 13,2 |
| s R , μg/kg | 41,2 | 229 | 90,9 |
|
| 69,4 | 73,9 |
| 8,48 | 78,1 | 70,3 | 33,4 | 46,1 | 41,6 | 59,5 | 215 | 52,5 | 112 | 17,0 | 43,0 | 8,65 |
| RSD R , % | 8,74 | 21,9 | 26,9 |
|
| 13,3 | 14,3 |
| 36,3 | 25,2 | 22,3 | 25,2 | 33,9 | 28,8 | 23,1 | 27,5 | 23,5 | 25,2 | 33,1 | 25,4 | 65,6 |
| R[R = 2,8 x s R ], μg/kg | 115 | 642 | 254 |
|
| 194 | 207 |
| 23,7 | 219 | 197 | 93,5 | 129 | 117 | 167 | 603 | 147 | 315 | 47,5 | 120 | 24,2 |
| Giá trị HorRat | 0,49 | 1,38 | 1,43 |
|
| 0,75 | 0,81 |
| 1,29 | 1,32 | 1,17 | 1,16 | 1,57 | 1,35 | 1,18 | 1,65 | 1,17 | 1,39 | 1,32 | 1,22 | 2,14 |
| Độ thu hồi, % |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 74,4 | 74,5 | 93,2 | 76,8 |
|
| a Đối với mẫu thử này, giá trị Horat vượt quá 2. | |||||||||||||||||||||
Bảng A.6 - Dữ liệu về độ chụm đối với STX sau khi làm sạch bằng cột SPE-COOH thu được bằng nghiên cứu liên phòng thử nghiệm trong A.1
| Mẫu | Thực nghiệm | 1 | 2 | 3 | 4 | 5 | 5D | 6 | 7 | 8 | 8D | 9 | 10 | 10D | 11 | 12 | Thêm chuẩn 1 | Thêm chuẩn 2 | Thêm chuẩn 3 | Thêm chuẩn 4 | Thêm chuẩn 5 |
| Năm | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 |
| Số phòng thử nghiệm | 15 | 15 | 14 | 14 | 14 | 15 | 15 | 14 | 12 | 15 | 13 | 14 | 14 | 15 | 15 | 14 | 13 | 15 | 11 | 15 | 9 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 15 | 15 | 14 | 14 | 14 | 15 | 15 | 14 | 12 | 15 | 13 | 14 | 14 | 15 | 15 | 14 | 13 | 15 | 11 | 15 | 9 |
| Số phòng thử nghiệm ngoại lệ | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Các kết quả được chấp nhận | 15 | 15 | 14 | 14 | 14 | 15 | 15 | 14 | 12 | 15 | 13 | 14 | 14 | 15 | 15 | 14 | 13 | 15 | 11 | 15 | 9 |
|
| 452 | 956 | 295 | nd | nd | 510 | 474 | nd | 21,3 | 270 | 269 | 120 | 140 | 124 | 233 | 644 | 191 | 409 | 43,6 | 148 | 10,4 |
| s R , μg/kg | 122 | 188 | 82,8 |
|
| 85,8 | 82,6 |
| 6,80 | 68,8 | 49,8 | 38,2 | 45,2 | 26,9 | 37,9 | 78,9 | 39,2 | 123 | 11,4 | 31,4 | 4,48 |
| RSD R , % | 26,9 | 19,6 | 28,1 |
|
| 16,8 | 17,4 |
| 31,9 | 25,5 | 18,5 | 31,9 | 32,3 | 21,8 | 16,3 | 12,3 | 20,5 | 30,0 | 26,1 | 21,2 | 42,9 |
| R[R = 2,8 × s R ], μg/kg | 341 | 526 | 232 |
|
| 240 | 231 |
| 19,0 | 193 | 139 | 107 | 127 | 75,4 | 106 | 221 | 110 | 343 | 31,8 | 88,0 | 12,5 |
| Giá trị HorRat | 1,49 | 1,22 | 1,46 |
|
| 0,95 | 0,97 |
| 1,12 | 1,31 | 0,95 | 1,45 | 1,50 | 0,99 | 0,82 | 0,72 | 1,00 | 1,64 | 1,02 | 150 | 1,35 |
| Độ thu hồi, % |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 63,7 | 68,2 | 79,2 | 67,2 |
|
Bảng A.7 - Dữ liệu về độ chụm đối với NEO sau khi làm sạch bằng cột SPE C18 thu được bằng nghiên cứu liên phòng thử nghiệm trong A.1
| Mẫu | Thực nghiệm | 3 | 4 | 5 | 5D | 6 | 8 | 8D | 9 | 12 | Thêm chuẩn 1 | Thêm chuẩn 2 | Thêm chuẩn 3 a | Thêm chuẩn 4 b | Thêm chuẩn 5 bc |
| Năm | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 |
| Số phòng thử nghiệm | 12 | 15 | 15 | 8 | 10 | 15 | 14 | 14 | 13 | 15 | 14 | 15 | 14 | 12 | 12 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 10 | 15 | 15 | 7 | 9 | 15 | 14 | 14 | 13 | 15 | 14 | 15 | 14 | 12 | 12 |
| Số phòng thử nghiệm ngoại lệ | 2 | 0 | 0 | 1 | 1 I | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Các kết quả được chấp nhận | 10 | 15 | 15 | 7 | 9 | 15 | 14 | 14 | 13 | 15 | 14 | 15 | 14 | 12 | 12 |
|
| 566 | nd | nd | 33,1 | 40,0 | nd | 284 | 278 | 140 | 871 | 223 | 455 | 158 | 213 | 344 |
| s R , μg/kg | 113 |
|
| 12,8 | 17,4 |
| 91,8 | 70,6 | 45,9 | 228 | 88,0 | 117 | 39,4 | 85,8 | 164 |
| RSD R , % | 20,0 |
|
| 38,5 | 43,5 |
| 32,3 | 25,4 | 32,8 | 26,1 | 39,5 | 25,7 | 24,9 | 40,2 | 47,6 |
| R[R = 2,8 × s R ], μg/kg | 317 |
|
| 35,7 | 48,8 |
| 257 | 198 | 128 | 637 | 246 | 327 | 110 | 240 | 458 |
| Giá trị HorRat | 1,15 |
|
| 1,44 | 1,68 |
| 1,67 | 1,31 | 1,52 | 1,60 | 1,97 | 1,43 | 1,18 | 1,99 | 2,53 |
| Độ thu hồi, % |
|
|
|
|
|
|
|
|
|
| 55,7 | 56,9 |
|
|
|
| a NEO có mặt đồng thời với dcSTX nhưng được tính theo NEO. b Không có mặt NEO trong các mẫu thử. Pic tùy thuộc vào dcSTX nhưng được tính theo NEO. c Đối với mẫu thử này, giá trị HorRat vượt quá 2. | |||||||||||||||
Bảng A.8 - Dữ liệu về độ chụm đối với NEO sau khi làm sạch bằng cột SPE-COOH thu được bằng nghiên cứu liên phòng thử nghiệm trong A.1
| Mẫu | Thực nghiệm | 3 | 4 | 5 | 5D | 6 | 8 | 8D | 9 a | 12 | Thêm chuẩn 1 | Thêm chuẩn 2 |
| Năm | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 |
| Số phòng thử nghiệm | 15 | 14 | 14 | 10 | 10 | 14 | 14 | 15 | 14 | 15 | 14 | 15 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 15 | 14 | 14 | 10 | 10 | 14 | 13 | 15 | 14 | 14 | 14 | 15 |
| Số phòng thử nghiệm ngoại lệ | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 |
| Các kết quả được chấp nhận | 15 | 14 | 14 | 10 | 10 | 14 | 13 | 15 | 14 | 14 | 14 | 15 |
|
| 643 | nd | nd | 38,8 | 42,2 | nd | 255 | 266 | 97,6 | 843 | 212 | 492 |
| s R , μg/kg | 148 |
|
| 13,0 | 18,3 |
| 89,9 | 92,9 | 46,4 | 199 | 68,1 | 159,6 |
| RSD R , % | 23,0 |
|
| 33,6 | 43,3 |
| 35,3 | 34,9 | 47,5 | 23,7 | 32,1 | 32,4 |
| R[R = 2,8 × s R ], μg/kg | 414 |
|
| 36,5 | 51,2 |
| 252 | 260 | 130 | 558 | 191 | 447 |
| Giá trị HorRat | 1,35 |
|
| 1,29 | 1,68 |
| 1,80 | 1,79 | 2,09 | 1,44 | 1,59 | 1,82 |
| Độ thu hồi, % |
|
|
|
|
|
|
|
|
|
| 53,1 | 61,6 |
Bảng A.9 - Dữ liệu về độ chụm đối với dcSTX sau khi làm sạch bằng cột SPE C18 thu được bằng nghiên cứu liên phòng thử nghiệm trong A.1
| Mẫu | Thực nghiệm > HR | 1 | 3 | 4 | 5 | 5D | 6 | 7 | 11 | 12 a | Thêm chuẩn 3 b | Thêm chuẩn 4 | Thêm chuẩn 5 |
| Năm | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 |
| Số phòng thử nghiệm | 9 | 13 | 15 | 15 | 14 | 13 | 15 | 12 | 11 | 7 | 15 | 15 | 15 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 9 | 13 | 15 | 15 | 14 | 12 | 15 | 11 | 11 | - | 15 | 15 | 14 |
| Số phòng thử nghiệm ngoại lệ | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 |
| 0 | 0 | 1 |
| Các kết quả được chấp nhận |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 18,8 | 12,3 | nd | nd | 8,14 | 7,42 | nd | 10,6 | 3,45 |
| 83,7 | 294 | 386 |
| s R , μg/kg | 21,6 | 4,33 |
|
| 2,71 | 1,83 |
| 2,02 | 1,63 |
| 41,2 | 63,4 | 40,6 |
| RSD R , % | 115 | 35,2 |
|
| 33,3 | 24,7 |
| 19,2 | 47,3 |
| 49,2 | 21,6 | 10,5 |
| R[R = 2,8 x s R ], μg/kg | 60,5 | 12,1 |
|
| 7,59 | 5,12 |
| 5,66 | 4,56 I |
| 115 | 177 | 114 |
| Giá trị HorRat | 3,95 | 1,13 |
|
| 1,01 | 0,74 |
| 0,60 | 1,26 I |
| 2,12 | 1,12 | 0,57 |
| Độ thu hồi, % |
|
|
|
|
|
|
|
|
|
| 83,7 | 73,5 | 64,3 |
| a Không tính được. Chỉ có 7 phòng thử nghiệm báo cáo dữ liệu số, các phòng thử nghiệm còn lại được báo cáo là không phát hiện được. b Đối với mẫu thử này, giá trị HorRat vượt quá 2. | |||||||||||||
Bảng A.10 - Dữ liệu về độ chụm đối với dcSTX sau khi làm sạch bằng cột SPE-COOH thu được bằng nghiên cứu liên phòng thử nghiệm trong A.1
| Mẫu | Thực nghiệm b | 1 | 3 | 4 | 5 | 5D | 6 | 7 | 11 a | 12 | Thêm chuẩn 3 | Thêm chuẩn 4 | Thêm chuẩn 5 |
| Năm | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 |
| Số phòng thử nghiệm | 10 | 13 | 14 | 14 | 11 | 10 | 14 | 13 | 6 | 10 | 13 | 15 | 15 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 10 | 12 | 14 | 14 | 11 | 10 | 14 | 13 | - | 10 | 13 | 15 | 15 |
| Số phòng thử nghiệm ngoại lệ | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 |
| 0 | 0 | 0 | 0 |
| Các kết quả được chấp nhận | 10 | 12 | 14 | 14 | 11 | 10 | 14 | 13 |
| 10 | 13 | 15 | 15 |
|
| 12,6 | 9,88 | nd | nd | 8,36 | 6,80 | nd | 11,6 |
| 7,80 | 69,1 | 276 | 396 |
| s R , μg/kg | 12,4 | 3,89 |
|
| 4,86 | 3,33 |
| 3,04 |
| 3,22 | 17,1 | 52,8 | 93,7 |
| RSD R , % | 98,3 | 39,4 |
|
| 58,1 | 49,0 |
| 26,2 |
| 41,3 | 24,7 | 19,1 | 23,7 |
| R[R = 2,8 × s R ], μg/kg | 34,7 | 10,9 |
|
| 13,6 | 9,32 |
| 8,51 |
| 9,02 | 47,9 | 148 | 262 |
| Giá trị HorRat | 3,18 | 1,23 |
|
| 1,77 | 1,44 |
|
|
|
| 1,03 | 0,99 | 1,29 |
| Độ thu hồi, % |
|
|
|
|
|
|
|
|
|
| 69,1 | 69,0 | 66,0 |
| a Không tính được. Chỉ có 6 phòng thử nghiệm báo cáo dữ liệu số, các phòng thử nghiệm còn lại báo cáo là không phát hiện được. b Đối với mẫu thử này, giá trị HorRat vượt quá 2. | |||||||||||||
Bảng A.11 - Dữ liệu về độ chụm đối với GTX1,4 (đồng thời) sau khi làm sạch bằng cột SPE C18 thu được bằng nghiên cứu liên phòng thử nghiệm trong A.1
| Mẫu | Thực nghiệm | 1 | 2 | 3 | 4 | 5 | 5D | 6 | 7a | 8 | 8D | 9 | 11 | 12a | Thêm chuẩn 1 | Thêm chuẩn 2 a | Thêm chuẩn 3 a |
| Năm | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 |
| Số phòng thử nghiệm | 11 | 10 | 12 | 16 | 16 | 11 | 11 | 16 | 15 | 12 | 13 | 13 | 12 | 10 | 10 | 11 | 13 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 11 | 10 | 11 | 16 | 16 | 11 | 11 | 16 | 15 | 12 | 13 | 13 | 12 | 10 | 10 | 11 | 12 |
| Số phòng thử nghiệm ngoại lệ | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Các kết quả được chấp nhận | 11 | 10 | 11 | 16 | 16 | 11 | 11 | 16 | 15 | 12 | 13 | 13 | 12 | 10 | 10 | 11 | 12 |
|
| 1 438 | 199 | 285 | nd | nd | 61,4 | 62,1 | nd | 1 489 | 573 | 672 | 254 | 81,0 | 1 816 | 240 | 1 440 | 2 236 |
| s R , μg/kg | 650 | 170 | 60,1 |
|
| 28,5 | 17,7 |
| 417 | 157 | 164 | 69,6 | 54,9 | 428 | 116 | 275 | 572 |
| RSD R , % | 45,2 | 85,4 | 21,1 |
|
| 46,4 | 28,6 |
| 28,0 | 27,4 | 24,4 | 27,3 | 67,7 | 23,6 | 48,3 | 19,1 | 25,6 |
| R[R = 2,8 × s R ], μg/kg | 1 819 | 476 | 168 |
|
| 79,7 | 49,6 |
| 1 168 | 439 | 459 | 195 | 154 | 1 198 | 324 | 770 | 1 602 |
| Giá trị HorRat | 2,98 | 4,19 | 1,09 |
|
| 1,91 | 1,17 |
| 1,86 | 1,57 | 1,44 | 1,39 | 2,90 | 1,61 | 2,43 | 1,26 | 1,80 |
| Độ thu hồi, % |
|
|
|
|
|
|
|
|
|
|
|
|
|
| 60,0 |
|
|
| a GTX1.4 đồng thời với C3,4 nhưng tính theo GTX1,4. | |||||||||||||||||
Bảng A.12 - Dữ liệu về độ chụm đối với GTX1,4 (đồng thời) sau khi làm sạch bằng cột SPE-COOH thu được bằng nghiên cứu liên phòng thử nghiệm trong A.1
| Mẫu | Thực nghiệm | 1 a | 2 | 3 | 4 | 5 | 5D | 6 | 7 | 8 | 8D | 9 | 11 | 12 | Thêm chuẩn 1 | Thêm chuẩn 2 | Thêm chuẩn 5 b |
| Năm | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 |
| Số phòng thử nghiệm | 16 |
| 14 | 15 | 15 | 13 | 13 | 16 | 15 | 16 | 16 | 14 | 9 | 16 | 14 | 15 | 14 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 16 |
| 13 | 15 | 15 | 13 | 13 | 16 | 14 | 15 | 15 | 14 | 8 | 16 | 14 | 15 | 14 |
| Số phòng thử nghiệm ngoại lệ | 0 | - | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 0 | 0 |
| Các kết quả được chấp nhận | 16 |
| 13 | 15 | 15 | 13 | 13 | 16 | 14 | 15 | 15 | 14 | 8 | 16 | 14 | 15 | 14 |
|
| 1 279 |
| 364 | nd | nd | 73,5 | 71,5 | nd | 240 | 645 | 675 | 236 | 48,9 | 2 079 | 268 | 628 | 265 |
| s R , μg/kg | 317 |
| 141 |
|
| 17,2 | 22,6 |
| 64,5 | 148 | 121 | 44,9 | 13,0 | 395 | 86,8 | 167 | 68,8 |
| RSD R , % | 24,8 |
| 38,8 |
|
| 23,4 | 31,6 |
| 26,9 | 22,9 | 17,9 | 19,1 | 26,7 | 19,0 | 32,5 | 26,6 | 25,9 |
| R[R = 2,8 × s R ] μg/kg | 887 |
| 395 |
|
| 48,1 | 63,3 |
| 181 | 414 | 339 | 126 | 36,5 | 1 106 | 243 | 468 | 193 |
| Giá trị HorRat | 1,61 |
| 2,08 |
|
| 0,99 | 1,33 |
| 1,35 | 1,34 | 1,06 | 0,96 | 1,06 | 1,33 | 1,66 | 1,55 | 1,33 |
| Độ thu hồi, % |
|
|
|
|
|
|
|
|
|
|
|
|
|
| 66,9 | 78,5 |
|
| a Không tính được. Một nửa số phòng thử nghiệm báo cáo là không phát hiện được. b GTX1,4 không có mặt trong mẫu thử này. Pic tùy thuộc vào GTX2.3 (được khẳng định bằng quá trình oxy hóa bằng peroxide) nhưng được tính theo GTX1,4. | |||||||||||||||||
Bảng A.13 - Dữ liệu về độ chụm đối với GTX2,3 (đồng thời) sau khi làm sạch bằng cột SPE C18 thu được bằng nghiên cứu liên phòng thử nghiệm trong A.1
| Mẫu | Thực nghiệm | 1 | 2 | 3 | 4 | 5 | 5D | 6 | 7 | 8 | 8D | 9 | 10 | 10D | 11 | 12 | Thêm chuẩn 1 | Thêm chuẩn 2 | Thêm chuẩn 5 |
| Năm | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 |
| Số phòng thử nghiệm | 13 | 16 | 16 | 16 | 16 | 16 | 16 | 16 | 14 | 16 | 16 | 16 | 16 | 16 | 16 | 16 | 15 | 16 | 16 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 12 | 16 | 15 | 16 | 16 | 16 | 16 | 16 | 14 | 16 | 16 | 16 | 16 | 15 | 15 | 15 | 14 | 16 | 16 |
| Số phòng thử nghiệm ngoại lệ | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 0 | 0 |
| Các kết quả được chấp nhận | 12 | 16 | 15 | 16 | 16 | 16 | 16 | 16 | 14 | 16 | 16 | 16 | 16 | 15 | 15 | 15 | 14 | 16 | 16 |
|
| 3 291 | 2 526 | 2 538 | nd | nd | 120 | 114 | nd | 349 | 813 | 757 | 316 | 367 | 336 | 673 | 1 856 | 227 | 529 | 954 |
| s R , μg/kg | 524 | 652 | 479 |
|
| 21,8 | 24,4 |
| 93,0 | 253 | 181 | 66,0 | 89,0 | 78,6 | 182 | 505 | 42,7 | 167 | 293 |
| RSD R , % | 15,9 | 25,8 | 18,9 |
|
| 18,2 | 21,5 |
| 26,7 | 31,1 | 23,8 | 20,8 | 24,2 | 23,4 | 27,1 | 27,2 | 18,8 | 31,6 | 30,8 |
| R[R = 2,8 × s R ] μg/kg | 1 467 | 1 826 | 1 342 |
|
| 61,0 | 68,4 |
| 260 | 708 | 506 | 185 | 249 | 220 | 510 | 1 415 | 120 | 469 | 822 |
| Giá trị HorRat | 1,19 | 1,86 | 1,36 |
|
| 0,83 | 0,97 |
| 1,42 | 1,89 | 1,43 | 1,10 | 1,30 | 1,24 | 1,59 | 1,87 | 0,94 | 1,80 | 1,91 |
| Độ thu hồi, % |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 75,8 | 88,2 | 79,5 |
Bảng A.14 - Dữ liệu về độ chụm đối với GTX2,3 (đồng thời) sau khi làm sạch bằng cột SPE-COOH thu được bằng nghiên cứu liên phòng thử nghiệm trong A.1
| Mẫu | Thực nghiệm | 1 | 2 | 3 | 4 | 5 | 5D | 6 | 7 | 8 | 8D | 9 | 10 | 10D | 11 | 12 | Thêm chuẩn 1 | Thêm chuẩn 2 | Thèm chuẩn 5 |
| Năm | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 |
| Số phòng thử nghiệm | 16 | 16 | 16 | 15 | 14 | 16 | 16 | 15 | 15 | 16 | 16 | 16 | 16 | 15 | 16 | 16 | 15 | 16 | 16 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 15 | 16 | 16 | 15 | 14 | 15 | 16 | 15 | 15 | 16 | 16 | 16 | 15 | 15 | 16 | 16 | 15 | 16 | 16 |
| Số phòng thử nghiệm ngoại lệ | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 |
| Các kết quả được chấp nhận | 15 | 16 | 16 | 15 | 14 | 15 | 16 | 15 | 15 | 16 | 16 | 16 | 15 | 15 | 16 | 16 | 15 | 16 | 16 |
|
| 3 314 | 2 348 | 2 698 | nd | nd | 132 | 116 | nd | 343 | 805 | 746 | 321 | 369 | 342 | 701 | 1 874 | 261 | 564 | 1 025 |
| s R , μg/kg | 594 | 522 | 506 |
|
| 25,3 | 28,4 |
| 80,2 | 164 | 165 | 58,2 | 71,4 | 86,1 | 204 | 345 | 42,7 | 117 | 175 |
| RSD R , % | 17,9 | 22,2 | 18,8 |
|
| 19,2 | 24,5 |
| 23,4 | 20,4 | 22,1 | 18,1 | 19,3 | 25,2 | 29,1 | 18,4 | 16,4 | 20,7 | 17,1 |
| R[R = 2,8 × s R ], μg/kg | 1 665 | 1 462 | 1 417 |
|
| 70,9 | 79,6 |
| 225 | 460 | 461 | 163 | 200 | 241 | 571 | 966 | 120 | 327 | 489 |
| Giá trị HorRat | 1,34 | 1,58 | 1,36 |
|
| 0,88 | 1,11 |
| 1,25 | 1,24 | 1,32 | 0,96 | 1,04 | 1,34 | 1,72 | 1,27 | 0,84 | 1,19 | 1,07 |
| Độ thu hồi, % |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 87,1 | 93,9 | 85,4 |
Bảng A.15 - Dữ liệu về độ chụm đối VỚI GTX5 (B1) sau khi làm sạch bằng cột SPE C18 thu được bằng nghiên cứu liên phòng thử nghiệm trong A.1
| Mẫu | Thực nghiệm | 1 | 2 | 3 | 4 | 5 | 5D | 6 | 7 | 8 | 8D | 9 | 10 | 10D | 11 | 12 | Thêm chuẩn 2 | Thêm chuẩn 3 | Thêm chuẩn 4 | Thêm chuẩn 5 |
| Năm | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 |
| Số phòng thử nghiệm | 11 | 13 | 11 | 16 | 16 | 14 | 14 | 16 | 15 | 15 | 15 | 15 | 12 | 14 | 14 | 15 | 14 | 15 | 15 | 15 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 11 | 13 | 11 | 16 | 16 | 13 | 13 | 16 | 15 | 15 | 15 | 15 | 12 | 14 | 14 | 15 | 14 | 15 | 15 | 14 |
| Số phòng thử nghiệm ngoại lệ | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Các kết quả được chấp nhận | 11 | 13 | 11 | 16 | 16 | 13 | 13 | 16 | 15 | 15 | 15 | 15 | 12 | 14 | 14 | 15 | 14 | 15 | 15 | 14 |
|
| 435 | 91,1 | 31,0 | nd | nd | 42,8 | 40,5 | nd | 145 | 328 | 334 | 120 | 37,7 | 39,6 | 73,1 | 947 | 53,4 | 311 | 1 213 | 691 |
| s R , μg/kg | 47,8 | 25,1 | 7,36 |
|
| 8,36 | 7,22 |
| 27,1 | 47,1 | 51,5 | 25,3 | 9,26 | 13,0 | 16,5 | 264 | 16,0 | 70,0 | 240 | 223 |
| RSD R , % | 11,0 | 27,6 | 23,7 |
|
| 19,6 | 17,8 |
| 18,7 | 14,4 | 15,4 | 21,2 | 24,6 | 32,8 | 22,5 | 27,9 | 30,0 | 22,5 | 19,8 | 32,3 |
| R[R = 2,8 × s R ], μg/kg | 134 | 70,3 | 20,6 |
|
| 23,4 | 20,2 |
| 75,9 | 132 | 144 | 71,0 | 25,9 | 36,3 | 46,1 | 739 | 44,8 | 196 | 671 | 626 |
| Giá trị HorRat | 0,61 | 1,20 | 0,88 |
|
| 0,76 | 0,69 |
| 0,87 | 0,76 | 0,82 | 0,96 | 0,94 | 1,26 | 0,95 | 1,73 | 1,21 | 1,18 | 1,27 | 1,91 |
| Độ thu hồi, % |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 77,8 | 75,8 | 86,4 |
Bảng A.16 - Dữ liệu về độ chụm đối với GTX5 (B1) sau khi làm sạch bằng cột SPE-COOH thu được bằng nghiên cứu liên phòng thử nghiệm trong A.1
| Mẫu | Thực nghiệm | 1 | 2 | 3 | 4 | 5 | 5D | 6 | 7 | 8 | 8D | 9 | 10 | 10D | 11 | 12 | Thêm chuẩn 2 | Thêm chuẩn 3 | Thêm chuẩn 4 | Thêm chuẩn 5 |
| Năm | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 |
| Số phòng thử nghiệm | 14 | 13 | 9 | 14 | 14 | 12 | 12 | 14 | 13 | 14 | 14 | 14 | 10 | 12 | 12 | 14 | 13 | 13 | 14 | 15 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 14 | 12 | 9 | 14 | 14 | 12 | 12 | 14 | 13 | 14 | 14 | 14 | 10 | 12 | 12 | 14 | 13 | 13 | 14 | 15 |
| Số phòng thử nghiệm ngoại lệ | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Các kết quả được chấp nhận | 14 | 12 | 9 | 14 | 14 | 12 | 12 | 14 | 13 | 14 | 14 | 14 | 10 | 12 | 12 | 14 | 13 | 13 | 14 | 15 |
|
| 350 | 71,8 | 27,1 | nd | nd | 42,0 | 40,8 | nd | 121 | 286 | 274 | 124 | 30,6 | 37,6 | 63,0 | 785 | 46,0 | 293 | 1 065 | 620 |
| s R , μg/kg | 58,8 | 13,0 | 4,43 |
|
| 11,1 | 9,73 |
| 17,7 | 43,7 | 52,5 | 29,1 | 5,99 | 10,9 | 11,1 | 73,4 | 8,78 | 43,0 | 147 | 85,4 |
| RSD R , % | 16,8 | 18,2 | 16,3 |
|
| 26,4 | 23,9 |
| 14,7 | 15,3 | 19,1 | 23,5 | 19,6 | 29,1 | 17,6 | 9,35 | 19,1 | 14,7 | 13,8 | 13,8 |
| R[R = 2,8 × s R ], μg/kg | 165 | 36,5 | 12,4 |
|
| 31,0 | 27,2 |
| 49,6 | 122 | 147 | 81,5 | 16,8 | 30,6 | 31,1 | 206 | 24,6 | 120 | 413 | 239 |
| Giá trị HorRat | 0,90 | 0,76 | 0,59 |
|
| 1,02 | 0,92 |
| 0,67 | 0,79 | 0,98 | 1,07 | 0,72 | 1,11 | 0,73 | 0,56 | 0,75 | 0,76 | 0,87 | 0,80 |
| Độ thu hồi, % |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 73,1 | 66,5 | 77,5 |
Bảng A.17 - Dữ liệu về độ chụm đối với C1,2 (đồng thời) sau khi làm sạch bằng cột SPE C18 thu được bằng nghiên cứu liên phòng thử nghiệm trong A.1
| Mẫu | Thực nghiệm | 2 | 3 | 4 | 5 | 5D | 6 | 7 | 8 | 8D | 9 | 10 | 10D | 11 | 12 | Thêm chuẩn 2 | Thêm chuẩn 5 |
| Năm | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 |
| Số phòng thử nghiệm | 12 | 14 | 16 | 15 | 16 | 16 | 16 | 15 | 12 | 11 | 9 | 11 | 15 | 16 | 16 | 14 | 15 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 12 | 13 | 16 | 15 | 16 | 15 | 16 | 15 | 12 | 10 | 9 | 11 | 15 | 16 | 16 | 13 | 14 |
| Số phòng thử nghiệm ngoại lệ | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 1 |
| Các kết quả được chấp nhận | 12 | 13 | 16 | 15 | 16 | 15 | 16 | 15 | 12 | 10 | 9 | 11 | 15 | 16 | 16 | 13 | 14 |
|
| 299 | 254 | nd | nd | 257 | 239 | nd | 912 | 118 | 96,3 | 76,6 | 162 | 190 | 358 | 257 | 735 | 1 567 |
| s R , μg/kg | 50,8 | 56,8 |
|
| 74,7 | 50,8 |
| 302 | 63,8 | 24,1 | 80,3 | 43,7 | 58,5 | 58,2 | 67,4 | 109 | 228 |
| RSD R , % | 17,0 | 22,4 |
|
| 29,1 | 21,3 |
| 33,1 | 54,0 | 25,0 | 105 | 27,0 | 30,8 | 16,3 | 26,3 | 14,8 | 14,5 |
| R[R = 2,8 × s R ], μg/kg | 142 | 159 |
|
| 209 | 142 |
| 845 | 179 | 67,5 | 225 | 122 | 164 | 163 | 189 | 305 | 638 |
| Giá trị HorRat | 0,89 | 1,14 |
|
| 1,48 | 1,07 |
| 2,04 | 2,45 | 1,10 | 4,46 | 1,28 | 1,50 | 0,87 | 1,34 | 0,88 | 0,97 |
| Độ thu hồi, % |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 73,5 | 78,3 |
Bảng A.18 - Dữ liệu về độ chụm đối với C1,2 (đồng thời) sau khi làm sạch bằng cột SPE-COOH thu được bằng nghiên cứu liên phòng thử nghiệm trong A.1
| Mẫu | Thực nghiệm | 2 | 3 | 4 | 5 | 5D | 6 | 7 | 8 | 8D | 9 a | 10 | 10D | 11 | 12 | Thêm chuẩn 2 | Thêm chuẩn 5 |
| Năm | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 |
| Số phòng thử nghiệm | 14 | 15 | 14 | 14 | 15 | 15 | 15 | 15 | 9 | 10 |
| 14 | 14 | 15 | 13 | 14 | 15 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 14 | 14 | 14 | 14 | 14 | 15 | 15 | 15 | 9 | 10 |
| 14 | 14 | 15 | 12 | 14 | 15 |
| Số phòng thử nghiệm ngoại lệ | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | - | 0 | 0 | 0 | 1 | 0 | 0 |
| Các kết quả được chấp nhận | 14 | 14 | 14 | 14 | 14 | 15 | 15 | 15 | 9 | 10 |
| 14 | 14 | 15 | 12 | 14 | 15 |
|
| 301 | 261 | nd | nd | 237 | 238 | nd | 983 | 109 | 93,4 |
| 204 | 201 | 349 | 258 | 860 | 1 687 |
| s R , μg/kg | 77,8 | 66,2 |
|
| 64,3 | 80,3 |
| 255 | 40,3 | 35,8 |
| 57,4 | 48,5 | 81,3 | 39,2 | 205 | 342 |
| RSD R , % | 25,8 | 25,4 |
|
| 27,1 | 33,8 |
| 25,9 | 37,1 | 38,3 |
| 28,1 | 24,2 | 23,3 | 15,2 | 23,8 | 20,3 |
| R[R = 2,8 × s R ], μg/kg | 218 | 185 |
|
| 180 | 225 |
| 714 | 113 | 100 |
| 161 | 136 | 228 | 110 | 573 | 959 |
| Giá trị HorRat | 1,35 | 1,30 |
|
| 1,37 | 1,70 |
| 1,62 | 1,66 | 1,67 |
| 1,38 | 1,19 | 1,24 | 0,78 | 1,45 | 1,37 |
| Độ thu hồi, % |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 86,0 | 84,4 |
| a Không tính được. Chỉ có 3 phòng thử nghiệm báo cáo số liệu, số còn lại báo cáo là không phát hiện được. | |||||||||||||||||
Bảng A.19 - Dữ liệu về độ chụm đối với C3,4 (đồng thời) sau khi làm sạch bằng cột SPE-COOH thu được bằng nghiên cứu liên phòng thử nghiệm trong A.1
| Mẫu | 3 | 4 | 6 | 7 | 12 | Thêm chuẩn 2 | Thêm chuẩn 5 |
| Năm | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 |
| Số phòng thử nghiệm | 15 | 15 | 15 | 13 | 11 | 9 | 15 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 15 | Ị5 | 15 | 13 | 10 | 9 | 15 |
| Số phòng thử nghiệm ngoại lệ | 0 | 0 | 0 | 0 | 1 | 0 | 0 |
| Các kết quả được chấp nhận | 15 | 15 | 15 | 13 | 10 | 9 | 15 |
|
| nd | nd | nd | 837 | 238 | 725 | 1 425 |
| s R , μg/kg |
|
|
| 227 | 106 | 181 | 302 |
| RSD R , % |
|
|
| 27,1 | 44,8 | 25,0 | 21,2 |
| R[R = 2,8 × s R ], μg/kg |
|
|
| 636 | 298 | 506 | 846 |
| Giá trị HorRat |
|
|
| 1,65 | 2,25 | 1,49 | 1,40 |
| Độ thu hồi, % |
|
|
|
|
| 80,5 | 79,2 |
Bảng A.20 - Dữ liệu về độ chụm đối với các mẫu mù lặp lại sau khi làm sạch bằng cột SPE C18 thu được bằng nghiên cứu liên phòng thử nghiệm trong A.1
| Độc tố PSP | STX | NEO | drSTX | GTX1.4 | GTX2.3 | GTX5(B1) | C1,2 | |||||||||
| Mẫu a | 5/5 D | 8/8D | 10/10D | 8/8D | 5/5D | 5/5 D | 8/8 D | 5/5 D | 8/8 D | 10/10D | 5/5 D | 8/8 D | 10/10D | 5/5 D | 8/8 D | 10/10D |
| Năm | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 |
| Số phòng thử nghiệm | 15 | 15 | 15 | 13 | 12 | 9 | 11 | 16 | 16 | 15 | 13 | 15 | 12 | 15 | 8 | 11 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 15 | 15 | 15 | 13 | 12 | 9 | 11 | 16 | 16 | 15 | 13 | 15 | 12 | 15 | 8 | 11 |
| Số phòng thử nghiệm ngoại lệ | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Các kết quả được chấp nhận | 15 | 15 | 15 | 13 | 12 | 9 | 11 | 16 | 16 | 15 | 13 | 15 | 12 | 15 | 8 | 11 |
|
| 520 | 313 | 140 | 280 | 7,46 | 64,6 | 601 | 117 | 785 | 347 | 41,7 | 331 | 38,6 | 241 | 101 | 169 |
| s R , μg/kg | 31,4 | 67,8 | 25,0 | 43,1 | 0,68 | 12,9 | 120 | 15,8 | 136 | 66,6 | 5,26 | 27,9 | 8,35 | 37,5 | 28,6 | 53,5 |
| RSD R , % | 6,03 | 21,7 | 17,8 | 15,4 | 9,08 | 19,9 | 20,0 | 13,5 | 17,3 | 19,2 | 12,6 | 8,42 | 21,6 | 15,5 | 28,3 | 31,7 |
| r [r = 2,8 x s r ], μg/kg | 87,9 | 190 | 69,9 | 121 | 1,90 | 36,0 | 336 | 44,2 | 381 | 187 | 14,7 | 78,0 | 23,4 | 105 | 80,1 | 150 |
| s R , μg/kg | 71,5 | 73,2 | 43,9 | 83,8 | 2,02 | 24,1 | 156 | 23,2 | 220 | 81,1 | 7,82 | 49,2 | 11,7 | 53,4 | 38,4 | 53,5 |
| RSD R , % | 13,7 | 23,4 | 31,3 | 29,9 | 27,0 | 37,4 | 25,9 | 19,8 | 28,1 | 23,4 | 18,8 | 14,9 | 30,3 | 22,1 | 38,0 | 31,7 |
| R[R = 2,8 × s R ], μg/kg | 200 | 205 | 123 | 235 | 5,65 | 67,6 | 435 | 64,8 | 617 | 227 | 21,9 | 138 | 32,7 | 149 | 107 | 150 |
| Giá trị HorRat | 0,78 | 1,23 | 1,46 | 1,55 | 0,81 | 1,55 | 1,50 | 0,90 | 1,69 | 1,25 | 0,73 | 0,79 | 1,16 | 1,12 | 1,68 | 1,52 |
| Độ thu hồi, % |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| a Cặp Youden | ||||||||||||||||
Bảng A.21 - Dữ liệu về độ chụm đối với các mẫu mù lặp lại sau khi làm sạch bằng cột SPE-COOH thu được bằng nghiên cứu liên phòng thử nghiệm trong A.1
| Độc tố PSP | STX | NEO | dcSTX | GTX1,4 | GTX2,3 | CTX5(B1) | C1,2 | ||||||||||
| Mẫu* | 5/5D | 8/8 D | 10/10D | 8/8D | 5/5 D | 5/5 D | 5/5 D | 8/8 D | 5/5 D | 8/8D | 10/10D | 5/5 D | 8/8D | 10/10D | 5/5 D | 8/8 D | 10/10D |
| Năm | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 | 2002 |
| Số phòng thử nghiệm | 15 | 13 | 14 | 13 | 10 | 9 | 12 | 15 | 15 | 16 | 14 | 11 | 14 | 10 | 14 | 8 | 14 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 15 | 13 | 14 | 13 | 10 | 9 | 12 | 15 | 15 | 16 | 14 | 11 | 14 | 10 | 14 | 8 | 14 |
| Số phòng thử nghiệm ngoại lệ | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Các kết quả được chấp nhận | 15 | 13 | 14 | 13 | 10 | 9 | 12 | 15 | 15 | 16 | 14 | 11 | 14 | 10 | 14 | 8 | 14 |
|
| 492 | 273 | 132 | 263 | 40,5 | 6,89 | 73,9 | 660 | 124 | 775 | 357 | 40,7 | 280 | 35,3 | 230 | 101 | 203 |
| s R , μg/kg | 44,0 | 36,2 | 32,9 | 67,7 | 7,82 | 0,88 | 11,1 | 85,8 | 19,9 | 91,1 | 84,3 | 5,04 | 40,6 | 8,49 | 46,1 | 20,0 | 37,1 |
| RSD R , % | 8,94 | 13,2 | 24,9 | 25,8 | 19,3 | 12,8 | 15,0 | 13,0 | 16,0 | 11,8 | 23,6 | 12,4 | 14,5 | 24,1 | 20,0 | 19,8 | 18,3 |
| r [r = 2,8 x s r ], μg/kg | 123 | 101 | 92,1 | 190 | 21,9 | 2,47 | 31,1 | 240 | 55,7 | 381 | 236 | 14,1 | 114 | 23,8 | 129 | 56,0 | 104 |
| s R , μg/kg | 85,7 | 60,1 | 37,9 | 90,0 | 15,9 | 3,15 | 19,4 | 135 | 28,1 | 167 | 84,3 | 10,4 | 48,0 | 9,56 | 62,1 | 40,5 | 52,7 |
| RSD R , % | 17,4 | 22,0 | 28,7 | 34,2 | 39,2 | 45,8 | 26,2 | 20,5 | 22,6 | 21,5 | 23,6 | 25,5 | 17,2 | 27,1 | 27,0 | 40,1 | 26,0 |
| R[R = 2,8 × s R ], μg/kg | 240 | 168 | 106 | 252 | 44,4 | 8,83 | 54,2 | 378 | 78,8 | 617 | 236 | 29,0 | 134 | 26,8 | 174 | 113 | 147 |
| Giá trị HorRat | 0,98 | 1,13 | 1,32 | 1,75 | 1,51 | 1,35 | 1,11 | 1,20 | 1,03 | 1,69 | 1,26 | 0,98 | 0,89 | 1,02 | 1,35 | 1,78 | 1,28 |
| Độ thu hồi, % |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| a Cặp Youden. | |||||||||||||||||
Bảng A.22 - Dữ liệu về độ chụm đối với tổng độc tính thu được bằng phép thử hiệu năng trong A.2
| Mẫu | CRL/06/ P/01 a | CRL/06/ P/02 | CRL/06/ P/03 | CRL/06/ P/04 | CRL/06/ p/05 a | CRL/06/ P/06 |
| Năm | 2006 | 2006 | 2006 | 2006 | 2006 | 2006 |
| Số phòng thử nghiệm | 18 | 18 | 16 | 17 | 18 | 13 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 16 | 17 | 15 | 15 | 16 | 11 |
| Số phòng thử nghiệm ngoại lệ | 2 | 1 | 1 | 2 | 2 | 2 |
| Các kết quả được chấp nhận | 16 | 17 | 15 | 15 | 16 | 11 |
|
| 1 708,3 | 1 033,9 | 2 829,4 | 319,8 | 1 524,9 | 105,4 b |
| σ, μg STX 2 HCl eq,/kg | 469,1 | 277,8 | 610,0 | 82,6 | 418,7 | 34,1 |
| s R c , μg STX 2HCl eq,/kg | 476,4 | 249,2 | 551,2 | 57,3 | 340,8 | 26,1 |
| RSD R , % | 27,39 | 24,10 | 19,48 | 17,92 | 22,35 | 24,80 |
| R c [R = 2,8 × s R ], μg đương lượng STX 2 HCl/kg | 1 334,0 | 697,7 | 1 543,3 | 160,5 | 954,3 | 73,2 |
| Giá trị HorRat | 1,88 | 1,51 | 1,42 | 0,95 | 1,49 | 1,10 |
| Độ thu hồi, % |
|
|
|
|
|
|
| a Mẫu mù lặp lại. b Không thể đánh giá tổng độc tính của mẫu này do thiếu các chất chất chuẩn, ví dụ: GTX6 (B2), C3,4 và dcNEO. c Tính kết quả dựa trên độ lệch chuẩn tái lập tương đối RSD R , tính bằng %. | ||||||
Bảng A.23 - Dữ liệu về độ chụm đối với tổng độc tính của các mẫu mù lặp lại thu được bằng phép thử hiệu năng trong A.2
| Mẫu | CRL/06/P/01 và CRL/06/P/05 |
| Năm | 2006 |
| Số phòng thử nghiệm | 18 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 16 |
| Số phòng thử nghiệm ngoại lệ | 2 |
| Các kết quả được chấp nhận | 16 |
|
| 1 616 |
| s r , μg đương lượng STX 2 HCl/kg | 210,6 |
| RSD r , % | 13,03 |
| r [r = 2,8 × s r ], μg đương lượng STX 2 HCl/kg | 589,6 |
| s R , μg đương lượng STX 2 HCl/kg | 423,3 |
| RSD R , % | 26,19 |
| R [R = 2,8 × s R ], μg đương lượng STX 2 HCl/kg | 1 185 |
| Giá trị HorRat | 1,31 |
| Độ thu hồi, % |
|
Bảng A.24 - Dữ liệu về độ chụm đối với dcGTX2,3 thu được bằng nghiên cứu liên phòng thử nghiệm trong A.3 và A.4
| Mẫu | CRL/7/ HYDR/02 | CRL/08/ P/01 | CRL/08/ P/03 | CRL/08/ P/04 | CRL/08/ P/05 | CRL/08/ P/06 | CRL/08/ P/07 | CRL/08/ P/08 | CRL/08/ P/09 | CRL/08/ P/11 |
| Năm | 2007 | 2008 | 2008 | 2008 | 2008 | 2008 | 2008 | 2008 | 2008 | 2008 |
| Số phòng thử nghiệm | 6 | 10 | 10 | 10 | 9 | 10 | 10 | 10 | 10 | 10 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 6 | 10 | 9 | 10 | 9 | 10 | 10 | 9 | 10 | 10 |
| Số phòng thử nghiệm ngoại lệ | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 |
| Các kết quả được chấp nhận | 6 | 10 | 9 | 10 | 9 | 10 | 10 | 9 | 10 | 10 |
|
| 1,19 | 2,07 | 2,48 | 3,84 | 0,43 | 0,45 | 2,45 | 2,62 | 0,99 | 0,96 |
| σ, μmol/kg | 0,42 | 0,62 | 0,75 | 1,15 |
|
| 0,74 | 0,79 |
|
|
| s R , a μmol/kg | 0,55 | 0,73 | 0,86 | 1,08 | 0,13 | 0,13 | 0,99 | 1,20 | 0,29 | 0,38 |
| RSD R , % | 46,1 | 35,5 | 34,7 | 28,2 | 30,3 | 29,9 | 40,4 | 45,7 | 29,1 | 39,6 |
| R a [R = 2,8 × s R ], μmol/kg | 1,54 | 2,06 | 2.41 | 3,03 | 0,36 | 0,38 | 2,77 | 3,35 | 0,81 | 1,06 |
| Giá trị HorRat | 2,53 | 2,12 | 2,13 | 1,85 | 1,57 | 1,54 | 2,48 | 2,82 | 1,71 | 2,31 |
| Độ thu hồi, % |
|
|
|
| 53,6 | 58,6 |
|
| 53,9 | 53,1 |
| a Tính kết quả dựa trên độ lệch chuẩn tái lập tương đối RSD R , tính bằng %. | ||||||||||
Bảng A.25 - Dữ liệu về độ chụm đối với C1,2 thu được bằng nghiên cứu liên phòng thử nghiệm trong A.3 và A.4
| Mẫu | CRL/07/ HYDR/01 | CRL/07/ HYDR/02 | CRL/08/ P/01 | CRL/08/ P/03 | CRL/08/ P/07 | CRL/08/ P/08 |
| Năm | 2007 | 2007 | 2008 | 2008 | 2008 | 2008 |
| Số phòng thử nghiệm | 6 | 6 | 10 | 10 | 10 | 10 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 6 | 6 | 9 | 10 | 9 | 10 |
| Số phòng thử nghiệm ngoại lệ | 0 | 0 | 1 | 0 | 1 | 0 |
| Các kết quả được chấp nhận | 6 | 6 | 9 | 10 | 9 | 10 |
|
| 1,96 | 7,93 | 15,3 | 19,1 | 15,9 | 20,8 |
| σ, μmol/kg | 0,65 | 1,15 | 2,23 | 2,78 | 2,32 | 2,72 |
| s R , a μmol/kg | 0,87 | 3,36 | 2,97 | 3,57 | 3,13 | 5,55 |
| RSD R , % | 44,4 | 42,4 | 19,4 | 18,7 | 19,7 | 26,7 |
| R a [R = 2,8 × s R ], μmol/kg | 2,44 | 9,41 | 8,31 | 10,0 | 8,77 | 15,5 |
| Giá trị HorRat | 2,74 | 3,24 | 1,63 | 1,63 | 1,67 | 2,36 |
| Độ thu hồi, % |
|
|
|
|
|
|
| a Tính kết quả dựa trên độ lệch chuẩn tái lập tương đối RSD R , tính bằng %. | ||||||
Bảng A.26 - Dữ liệu về độ chụm đối với dcSTX thu được bằng nghiên cứu liên phòng thử nghiệm trong A.3 và A.4
| Mẫu | CRL/07/ HYDR/01 | CRL/07/ HYDR/02 | CRL/08/ P/01 | CRL/08/ P/03 | CRL/08/ P/04 | CRL/08/ P/07 | CRL/08/ P/08 |
| Năm | 2007 | 2007 | 2008 | 2008 | 2008 | 2008 | 2008 |
| Số phòng thử nghiệm | 8 | 7 | 10 | 10 | 10 | 10 | 10 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 7 | 7 | 10 | 9 | 10 | 10 | 9 |
| Số phòng thử nghiệm ngoại lệ | 1 | 0 | 0 | 1 | 0 | 0 | 1 |
| Các kết quả được chấp nhận | 7 | 7 | 10 | 9 | 10 | 10 | 9 |
|
| 0,327 | 2,18 | 4,23 | 3,97 | 3,44 | 4,31 | 3,88 |
| σ, μmol/kg | 0,11 | 0,47 | 0,45 | 0,42 | 0,36 | 0,45 | 0,41 |
| s R , a μmol/kg | 0,085 | 0,78 | 0,65 | 0,67 | 0,56 | 1,38 | 0,66 |
| RSD R , % | 26,1 | 35,6 | 15,6 | 16,8 | 16,4 | 32,1 | 16,9 |
| R a [R = 2,8 × s R ], μmol/kg | 0,24 | 2,17 | 1,85 | 1,87 | 1,58 | 3,57 | 1,84 |
| Giá trị HorRat | 1,12 | 2,04 | 0,99 | 1,05 | 1,01 | 2,03 | 1,06 |
| Độ thu hồi, % |
|
|
|
|
|
|
|
| a Tính kết quả dựa trên độ lệch chuẩn tái lập tương đối RSD R , tính bằng %. | |||||||
Bảng A.27 - Dữ liệu về độ chụm đối với GTX5 (B1) thu được bằng nghiên cứu liên phòng thử nghiệm trong A.3 và A.4
| Mẫu | CRL/07/ HYDR/01 | CRL/07/ HYDR/02 | CRL/08/ P/01 | CRL/08/ P/03 | CRL/08/ P/07 | CRL/08/ P/08 |
| Năm | 2007 | 2007 | 2008 | 2008 | 2008 | 2008 |
| Số phòng thử nghiệm | 8 | 8 | 10 | 10 | 10 | 10 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 7 | 7 | 10 | 10 | 10 | 10 |
| Số phòng thử nghiệm ngoại lệ | 1 | 1 | 0 | 0 | 0 | 0 |
| Các kết quả được chấp nhận | 7 | 7 | 10 | 10 | 10 | 10 |
|
| 1,26 | 5,42 | 13,7 | 9,50 | 14,3 | 9,50 |
| σ, μmol/kg | 0,20 | 1,07 | 2,71 | 1,88 | 2,82 | 1,88 |
| s R , a μmol/kg | 0,15 | 0,39 | 2,30 | 2,18 | 2,50 | 1,85 |
| RSD R , % | 11,6 | 7,27 | 16,8 | 22,9 | 17,5 | 19,5 |
| R a [R = 2,8 × s R ], μmol/kg | 0,41 | 1,10 | 6,44 | 6,09 | 7,01 | 5,19 |
| Giá trị HorRat | 0,65 | 0,51 | 1,25 | 1,74 | 1,41 | 1,48 |
| Độ thu hồi, % |
|
|
|
|
|
|
| a Tính kết quả dựa trên độ lệch chuẩn tái lập tương đối RSD R , tính bằng %. | ||||||
Bảng A.28 - Dữ liệu về độ chụm đối với NEO thu được bằng nghiên cứu liên phòng thử nghiệm trong A.4
| Mẫu | CRL/08/ P/01 | CRL/08/ P/03 | CRL/08/ P/04 | CRL/08/ P/07 | CRL/08/ P/08 |
| Năm | 2008 | 2008 | 2008 | 2008 | 2008 |
| Số phòng thử nghiệm | 9 | 8 | 8 | 9 | 8 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 9 | 8 | 8 | 9 | 8 |
| Số phòng thử nghiệm ngoại lệ | 0 | 0 | 0 | 0 | 0 |
| Các kết quả được chấp nhận | 9 | 8 | 8 | 9 | 8 |
|
| 4,61 | 4,67 | 2,18 | 4,78 | 5,22 |
| σ, μmol/kg | 1,38 | 1,40 | 0,65 | 1,43 | 1,57 |
| s R , a μmol/kg | 3,34 | 3,29 | 1,23 | 2,58 | 2,54 |
| RSD R , % | 72,4 | 70,4 | 56,4 | 53,9 | 48,7 |
| R a [R = 2,8 × s R ], μmol/kg | 9,35 | 9,21 | 3,44 | 7,21 | 7,12 |
| Giá trị HorRat | 4,68 | 4,57 | 3,26 | 3,51 | 3,21 |
| Độ thu hồi, % |
|
|
|
|
|
| a Tính kết quả dựa trên độ lệch chuẩn tái lập tương đối RSD R , tính bằng %. | |||||
Bảng A.29 - Dữ liệu về độ chụm đối với GTX6 (B2) thu được bằng nghiên cứu liên phòng thử nghiệm trong A.3 và A.4
| Mẫu | CRL/07/ HYDR/01 | CRL/07/ HYDR/02 | CRL/08/ P/01 | CRL/08/ P/03 | CRL/08/ P/07 | CRL/08/ P/08 |
| Năm | 2007 | 2007 | 2008 | 2008 | 2008 | 2008 |
| Số phòng thử nghiệm | 6 | 6 | 9 | 9 | 9 | 9 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 6 | 6 | 8 | 8 | 8 | 8 |
| Số phòng thử nghiệm ngoại lệ | 0 | 0 | 1 | 1 | 1 | 1 |
| Các kết quả được chấp nhận | 6 | 6 | 8 | 8 | 8 | 8 |
|
| 2,64 | 11,7 | 12,8 | 18,8 | 13,3 | 17,4 |
| σ, μmol/kg | 0,92 | 4,08 | 3,85 | 5,65 | 3,98 | 5,22 |
| s R , a μmol/kg | 0,55 | 5,34 | 4,83 | 7,37 | 4,11 | 5,95 |
| RSD R , % | 20,9 | 45,6 | 37,7 | 39,2 | 30,9 | 34,2 |
| R a [R = 2,8 × s R ], μmol/kg | 1,54 | 15,0 | 13,5 | 20,6 | 11,5 | 16,7 |
| Giá trị HorRat | 1,31 | 3,59 | 3,01 | 3,31 | 2,48 | 2,86 |
| Độ thu hồi, % |
|
|
|
|
|
|
| a Tính kết quả dựa trên độ lệch chuẩn tái lập tương đối RSD R , tính bằng %. | ||||||
Bảng A.30 - Dữ liệu về độ chụm đối với tổng độc tính thu được bằng nghiên cứu liên phòng thử nghiệm trong A.3 và A.4
| Mẫu | CRL/07/ HYDR/01 | CRL/07/ HYDR/02 | CRL/08/ P/01 | CRL/08/ P/03 | CRL/08/ P/04 | CRL/08/ P/07 | CRL/08/ P/08 |
| Năm | 2007 | 2007 | 2008 | 2008 | 2008 | 2008 | 2008 |
| Số phòng thử nghiệm | 8 | 7 | 10 | 10 | 10 | 10 | 10 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 7 | 7 | 9 | 8 | 9 | 9 | 8 |
| Số phòng thử nghiệm ngoại lệ | 1 | 0 | 1 | 2 | 1 | 1 | 2 |
| Các kết quả được chấp nhận | 7 | 7 | 9 | 8 | 9 | 9 | 8 |
|
| 260 | 1 261 | 3 277 | 3 030 | 1 436 | 3 322 | 3 078 |
| σ, μg đương lượng STX 2 HCl/kg | 90,9 | 441,3 | 983 | 908 | 430 | 996 | 923 |
| s R a , μg đương lượng STX 2 HCl/kg | 43,4 | 421,1 | 1 294 | 642 | 304 | 897 | 871 |
| RSD R , % | 16,7 | 33,4 | 39,5 | 21,2 | 21,2 | 27,0 | 28,3 |
| R a [R = 2,8 x s R ], μg đương lượng STX 2 HCl/kg | 122 | 1 179 | 3 624 | 1 798 | 852 | 2 511 | 2 439 |
| Giá trị HorRat | 0,85 | 2,16 | 2,95 | 1,57 | 1,39 | 2,02 | 2,09 |
| Độ thu hồi, % |
|
|
|
|
|
|
|
| a Tính kết quả dựa trên độ lệch chuẩn tái lập tương đối RSD R , tính bằng %. | |||||||
Bảng A.31 - Dữ liệu về độ chụm đối với tổng độc tính thu được bằng nghiên cứu liên phòng thử nghiệm trong A.3 và A.4
| Độc tố PSP | dcGTX2,3 | C1,2 | dcSTX | GTX5 (B1) | dcNEO | GTX6 | Tổng độc tính b | |||||||
| Mẫu | CRL/08/ P/1 và 7 | CRL/08/ P/3 và 8 | CRL/08/ P/1 và 7 | CRL/08/ P/3 và 8 | CRL/08/ P/1 và 7 | CRL/08/ P/3 và 8 | CRL/08/ P/1 và 7 | CRL/08/ P/3 và 8 | CRL/08/ P/1 và 7 | CRL/08/ P/3 và 8 | CRL/08/ P/1 và 7 | CRL/08/ P/3 và 8 | CRL/08/ P/1 và 7 | CRL/08/ P/3 và 8 |
| Năm | 2008 | 2008 | 2008 | 2008 | 2008 | 2008 | 2008 | 2008 | 2008 | 2008 | 2008 | 2008 | 2008 | 2008 |
| Số phòng thử nghiệm | 11 | 11 | 11 | 11 | 11 | 11 | 11 | 11 | 11 | 11 | 11 | 11 | 11 | 11 |
| Số phòng thử nghiệm sau khi trừ ngoại lệ | 10 | 8 | 9 | 10 | 9 | 9 | 10 | 10 | 8 | 7 | 8 | 8 | 10 | 10 |
| Số phòng thử nghiệm ngoại lệ | 1 | 3 | 2 | 1 | 2 | 2 | 1 | 1 | 3 | 4 | 3 | 3 | 1 | 1 |
| Các kết quả được chấp nhận | 10 | 8 | 9 | 10 | 9 | 9 | 10 | 10 | 8 | 7 | 8 | 8 | 10 | 10 |
|
| 2,3 | 2,3 | 15,2 | 20,2 | 4,1 | 3,9 | 14,0 | 9,5 | 4,0 | 4,1 | 13,0 | 18,1 | 2 976,8 | 3120,6 |
| σ, μmol/kg | 0,70 | 0,36 | 3,25 | 2,98 | 0,61 | 0,31 | 1,46 | 0,65 | 0,93 | 1,36 | 1,36 | 2,74 | 395,4 | 631,2 |
| s R , a μmol/kg | 30,9 | 15,7 | 21,4 | 14,9 | 15,0 | 7,99 | 10,5 | 6,82 | 23,5 | 32,9 | 10,4 | 15,1 | 13,3 | 20,2 |
| RSD R , % | 1,96 | 1,02 | 9,11 | 8,35 | 1,71 | 0,88 | 4,10. | 1,81 | 2,60 | 3,81 | 3,81 | 7,67 | 1107,1 | 1767,2 |
| R a [R = 2,8 × s R ], μmol/kg | 0,86 | 0,75 | 2,91 | 4,65 | 0,70 | 0,65 | 2,37 | 2,01 | 2,04 | 1,79 | 1,46 | 6,66 | 1456,6 | 1736,3 |
| Giá trị HorRat | 38,2 | 32,4 | 19,1 | 23,3 | 17,1 | 16,7 | 16,9 | 21,1 | 51,4 | 43,4 | 34,2 | 36,8 | 48,9 | 55,6 |
| Độ thu hồi, % | 2,42 | 2,10 | 8,14 | 13,02 | 1,95 | 1,83 | 6,63 | 5,62 | 5,70 | 5,02 | 12,49 | 18,65 | 4078,6 | 4861,6 |
| a Nguồn: [8], b Đơn vị tổng độc tính được tính bằng đương lượng STX 2 HCl/kg. | ||||||||||||||
Thư mục tài liệu tham khảo
[1] AOAC Official Method 2005.06. Paralytic Shellfish Poisoning Toxins in Shellfish PrechromatographK Oxidation and Liquid Chromatography with Fluorescence. First Action 2005 (2005) Official Methods of Analysis of AOAC International. 19
[2] TURNER A.D., HATFIELD R.G., RAPKOVA-DHANJI M., NORTON D.M., ALGOET M. and LEES D.N. (2010) “Singlelaboratory validation of a refined AOAC HPLC method 2005.06 for oysters, cockles, and clams in U.K. shellfish”. J AOAC Int 93.1482-1493
[3] TURNER A.D., HATFIELD R.G (2012). "Refinement of AOAC Official MethodSM 2005.06 Liquid Chromatography-Fluorescence Detection Method to Improve Performance Characteristics for the Determination of Paralytic Shellfish Toxins in King and Queen Scallops J AOAC Int. 95(1): 129-142
[4] LAWRENCE J.F, NIEDZWIADEK B., MENARD C. (2004) “Quantitative determination of paralytic shellfish poisoning toxins in shellfish using prechromatographic oxidation and liquid chromatography with fluorescence detection: interlaboratory study”. J AOAC Int 87. No 1.83-100
[5] LAWRENCE J.F., NIEDZWIADEK B., MENARD C. (2005) “Quantitative determination of paralytic shellfish poisoning toxins in shellfish using prechromatographic oxidation and liquid chromatography with fluorescence detection: collaborative study”. J AOAC Int 88. No 6.1714-1732
[6] BEN-GIGIREY B. RODRiGUEZ-VELASCO M.L., VILLAR-GONZALES A., BOTANA L.M. (2007) “Influence of the samμle toxic profile on the suitability of a high performance liquid chromatography method for official paralytic shellfish toxins control”. I Chromatgr. A. 1140. 78-87
[7] COMMUNITY REFERENCE LABORATORY FOR MARINE BIOTOXINS (CRLMB). (2007) “Report on the Study on the Determination of PSP Toxins in Shellfish including GTX6 after Hydrolysis (AOAC Official Method 2005.06)”. http://aesan.msssi.gob.es/CRLMB/docs/docs/ayuda cientifica/PSP-Hydrolysis study-2007-Report.pdf
[8] BEH-GIGIREY B., RODRiGUEZ-VELASCOM.L., GAGO-MARTINEZ A. (2012) “Extension of the validation of AOAC Official Method 2005.06 for dcGTX2.3: interiaboratory study”. J AOAC Int 95. 111-121
[9] COMMUNITY REFERENCE LABORATORY FOR MARINE BIOTOXINS (CRLMB). (2009) “Report on the CRLMB 2009 proficiency testing on saxitoxin group (PSP) toxin determination, available at http://aesan.msssi.gob.es/CRLMB/docs/docs/laboratorio_nacional_referencia/actividades/intercom parativo/intercomparative CRLMB-ProficiencyTestinq-2009-PSP-RESQRT LNR.pdf
[10] BEN GIGIREY B., TURNER A. GAGO- MARTINEZ A. Instrumental Methods for Paralytic Shellfish Toxins. In: Toxinology. Marine and Freshwater Toxins, edited by P. Gopalakrishnakone, Editorial- Springer (ISBN 978-94-007-6419-4)
[11] TURMER A.D., NORTON D.M., HATFIELD R.G, MORRIS., REESE A.R., ALGOET M. and LEES D.N. (2009) “Refinement and extension of AOAC Method 2005.06 to include additional toxins in mussels: single-laboratory validation”. J AOAC Int 92.190-207
[12] COMMUNITY REFERENCE LABORATORY FOR MARINE BIOTOXINTS (CRLMB). (2009) "Practical aspects of the imμlementation of 2005.06 AOAC Official Method for the Official Control of PSP toxins technical issues and pitfalls”, http://aesan.msssi.gob.es/CRLMB/docs/docs/ayudacientifica/CRLMB-WG_PSP-HPLC_Working_Document_Technical_issues_and_pitfalls_AOAC_2005_06.pdf
[13] OSHIWA Y. (1995). “Post column derivatization liquid chromatographic method for paralytic shellfish toxins”. Journal of AOAC International. 78. No 2. 528-532; some errors in the original data values have been corrected (Y. Oshima. personal communication)
[14] EFSA - SCIENTIFIC OPINION OF THE PANEL ON CONTAMINANTS IN THE FOOD CHAIN Marine biotoxins in shellfish - Saxitoxin group. The EFSA Journal. 2009,1019 pp. 1-76
[15] AOAC Guidelines for collaborative study procedures to validate characteristics of a method analysis (appendix D). 2002. AOAC International
Mục lục
Lời nói đầu
Lời giới thiệu
1 Phạm vi áp dụng
2 Tài liệu viện dẫn
3 Nguyên tắc
4 Thuốc thử
5 Thiết bị, dụng cụ
6 Cách tiến hành
7 Xác định bằng HPLC
8 Đường chuẩn
9 Định danh
10 Tính kết quả
11 Độ chụm
12 Báo cáo thử nghiệm
Phụ lục A (tham khảo) Dữ liệu về độ chụm
Thư mục tài liệu tham khảo
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 14444:2025 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 14444:2025 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 14444:2025 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 14444:2025 DOC (Bản Word)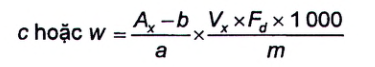
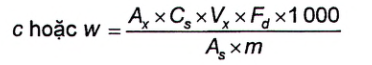
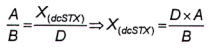
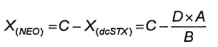
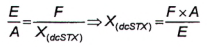
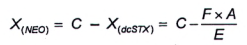
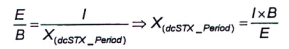
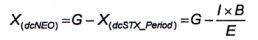
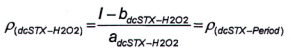
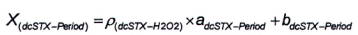
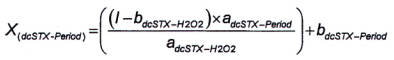
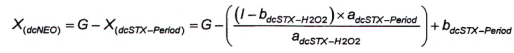
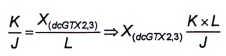
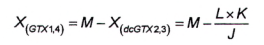
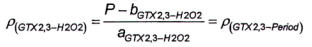
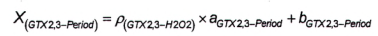
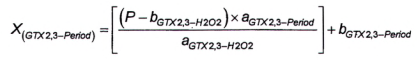
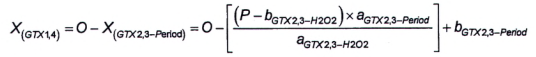
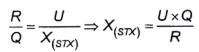
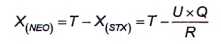
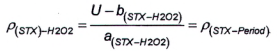
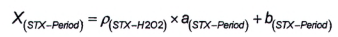
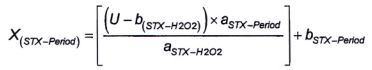
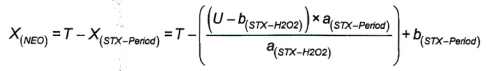
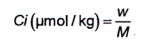

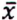 , μg/kg
, μg/kg 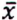 , μg/kg
, μg/kg 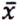 , μg/kg
, μg/kg 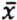 , μg/kg
, μg/kg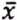 , μg/kg
, μg/kg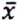 , μg/kg
, μg/kg 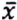 , μg/kg
, μg/kg 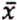 . μg/kg
. μg/kg 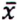 , μg/kg
, μg/kg 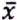 , μg/kg
, μg/kg 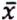 , μg/kg
, μg/kg 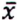 , μg/kg
, μg/kg 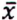 , μg/kg
, μg/kg 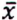 , μg/kg
, μg/kg 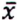 , μg/kg
, μg/kg 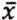 , μg/kg
, μg/kg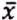 , μg/kg
, μg/kg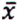 , μg đương lượng STX 2 HCl/kg
, μg đương lượng STX 2 HCl/kg 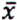 , μg đương lượng STX 2 HCl/kg
, μg đương lượng STX 2 HCl/kg 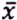 , μmol/kg
, μmol/kg 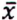 , μmol/kg
, μmol/kg 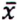 , μmol/kg
, μmol/kg 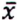 , μmol/kg
, μmol/kg 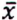 , μmol/kg
, μmol/kg 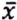 , μmol/kg
, μmol/kg 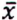 , μg đương lượng STX 2 HCl/kg
, μg đương lượng STX 2 HCl/kg 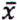 , μmol/kg
, μmol/kg 