- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 13402:2021 ISO 17511:2020 Thiết bị y tế chẩn đoán in vitro - Yêu cầu đối với việc thiết lập liên kết đo lường của các giá trị được chỉ định cho các chất hiệu chuẩn, vật liệu kiểm tra độ đúng và mẫu bệnh phẩm người
| Số hiệu: | TCVN 13402:2021 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Y tế-Sức khỏe |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
31/12/2021 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 13402:2021
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 13402:2021
TIÊU CHUẨN QUỐC GIA
TCVN 13402:2021
ISO 17511:2020
THIẾT BỊ Y TẾ CHẨN ĐOÁN IN VITRO - YÊU CẦU ĐỐI VỚI VIỆC THIẾT LẬP LIÊN KẾT ĐO LƯỜNG CỦA CÁC GIÁ TRỊ ĐƯỢC CHỈ ĐỊNH CHO CÁC CHẤT HIỆU CHUẨN, VẬT LIỆU KIỂM TRA ĐỘ ĐÚNG VÀ MẪU BỆNH PHẨM NGƯỜI
In vitro diagnostic medical devices - Requirements for establishing metrological traceability of values assigned to calibrators, trueness control materials and human samples
Lời nói đầu
TCVN 13402:2021 hoàn toàn tương đương với ISO 17511:2020;
TCVN 13402:2021 do Viện Trang thiết bị và Công trình y tế biên soạn, Bộ Y tế đề nghị, Tổng cục Tiêu chuẩn đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Lời giới thiệu
Trong phòng thí nghiệm y học, mục tiêu của việc kiểm tra đại lượng đo trong mẫu bệnh phẩm người là để tạo ra kết quả phòng thí nghiệm cho phép bác sĩ lâm sàng đánh giá nguy cơ mắc bệnh hoặc chẩn đoán và đưa ra quyết định điều trị cho một tình trạng bệnh. Để hữu ích về mặt lâm sàng, các kết quả thu được từ một mẫu bệnh phẩm người nhất định do các phòng thí nghiệm khác nhau kiểm tra hoặc giữa các thiết bị y tế chẩn đoán in vitro khác nhau (In Vitro Diagnostic Medical Device - IVD MD) trong một phòng thí nghiệm phải tương đương nhau, bất kể quy trình đo được sử dụng. Các kết quả tương đương cho phép áp dụng thống nhất các giới hạn quyết định y tế và khoảng tham chiếu, có thể làm giảm nguy cơ tổn hại do các quyết định y tế gây ra dựa trên các kết quả kiểm tra không tương đương. Sự tương đương về kết quả giữa các IVD MD khác nhau cho cùng một đại lượng đo cũng rất quan trọng đối với việc phân tích kết quả trong hồ sơ bệnh án nhằm mục đích hỗ trợ các quyết định lâm sàng và tiến hành điều tra dịch tễ học.
Có thể đạt được các kết quả tương đương đối với mẫu bệnh phẩm người đối với đại lượng đo bằng cách thiết lập liên kết đo lường của các giá trị được gán cho các chất hiệu chuẩn đối với thủ tục đo (MP) đến thành phần hệ thống chuẩn cao nhất có sẵn cho đại lượng đo. Liên kết đo lường mô tả sơ đồ hiệu chuẩn và trình tự ấn định giá trị, thể hiện mối liên kết không đứt đoạn giữa kết quả đo đối với mẫu bệnh phẩm người cho đến thành phần hệ thống chuẩn cao nhất hiện có trong sơ đồ hiệu chuẩn. Thời điểm bắt đầu liên kết đo lường (tức là mức liên kết đo lường cao nhất trong sơ đồ hiệu chuẩn) phụ thuộc vào sự sẵn có của các thủ tục đo quy chiếu (RMP) bậc cao hơn, mẫu chuẩn (RM) hoặc các giao thức hài hòa cho đại lượng đo đã nêu.
Các hạn chế trong việc thực hiện các hiệu chuẩn có thể theo dõi đo lường xảy ra khi các IVD MD khác nhau dành cho cùng một đại lượng đo không đo được các đại lượng có thể đo được giống nhau hoặc có liên quan rất chặt chẽ. Một số đại lượng y tế quan tâm có thể là các nguyên tố hoặc phân tử được xác định rõ. Ngày càng có nhiều quyết định y tế phụ thuộc vào các đại lượng đo bao gồm các hỗn hợp phức tạp và biến đổi của cấu trúc hóa học, các loài phân tử và phức hợp phân tử với tỷ lệ khác nhau, ví dụ: glycoprotein với nhiều đồng dạng, trình tự axit amin biến thể, trình tự axit nucleic và các dạng phân tử phức tạp khác. Khi tính chọn lọc của IVD MD không phù hợp với mục đích, số lượng lưu lượng mẫu cụ thể trong mẫu bệnh phẩm người do các yếu tố bao gồm bệnh tật, thuốc hoặc các tình trạng bệnh lý khác có thể dẫn đến giá trị sai đối với đại lượng đo dự kiến. Ngay cả với liên kết đo lường đối với các thành phần của hệ thống tham chiếu bậc cao hơn, tính chọn lọc của MP ở tất cả các cấp trong sơ đồ hiệu chuẩn đối với IVD MD nhất định có thể tạo ra khả năng đạt được kết quả cho mẫu bệnh phẩm người tương đương với kết quả thu được với IVD MD khác cho cùng một đại lượng đo.
Tiêu chuẩn này quy định các yêu cầu đối với nhà sản xuất IVD MD trong việc ghi lại sơ đồ hiệu chuẩn cho một đại lượng đo được trong mẫu bệnh phẩm người sử dụng IVD MD được chỉ định. Tài liệu bao gồm các sơ đồ hiệu chuẩn mô hình khác nhau cung cấp các giải pháp kỹ thuật tiềm năng cho các loại đại lượng đo khác nhau trong việc thiết lập liên kết đo lường của các giá trị được chỉ định cho mẫu bệnh phẩm người, chất hiệu chuẩn và vật liệu kiểm soát độ đúng. Việc sử dụng tiêu chuẩn này như một phần của chương trình quản lý rủi ro trên diện rộng dành cho các nhà sản xuất IVD MD là phù hợp với các yêu cầu của TCVN 8023 (ISO 14971) và dự kiến sẽ hỗ trợ giảm nguy cơ gây hại cho bệnh nhân do kết quả không tương đương giữa các IVD MD khác nhau.
THIẾT BỊ Y TẾ CHẨN ĐOÁN INVITRO - YÊU CẦU ĐỐI VỚI VIỆC THIẾT LẬP LIÊN KẾT ĐO LƯỜNG CỦA CÁC GIÁ TRỊ ĐƯỢC CHỈ ĐỊNH CHO CÁC CHẤT HIỆU CHUẨN, VẬT LIỆU KIỂM TRA ĐỘ ĐÚNG VÀ MẪU BỆNH PHẨM NGƯỜI
In vitro diagnostic medical devices - Requirements for establishing metrological traceability of values assigned to calibrators, trueness control materials and human samples
1 Phạm vi áp dụng
Tiêu chuẩn này quy định yêu cầu kỹ thuật và tài liệu cần thiết để thiết lập liên kết đo lường của các giá trị được chỉ định cho các chất hiệu chuẩn, vật liệu kiểm tra độ đúng và mẫu bệnh phẩm người đối với các đại lượng được đo bằng IVD MDs. Các mẫu bệnh phẩm người là những mẫu được thiết kế để đo, như được chỉ định cho từng IVD MD. Liên kết đo lường của các giá trị đối với các lượng trong mẫu bệnh phẩm người mở rộng đến thành phần hệ thống tham chiếu có sẵn cao nhất, lý tưởng là RMP và các mẫu chuẩn được chứng nhận (CRM).
Tất cả các bên có vai trò trong bất kỳ bước nào được mô tả trong sơ đồ hiệu chuẩn cho IVD MD đều phải tuần theo các yêu cầu được mô tả. Các bên này bao gồm nhưng không giới hạn đối với nhà sản xuất (của IVD MD), nhà phát triển RMP (xem TCVN 13416 (ISO 15193)), nhà sản xuất RM (xem ISO 15194) và các phòng thí nghiệm tham chiếu/hiệu chuẩn (xem ISO 15195) hỗ trợ phân cấp hiệu chuẩn cho IVD MD.
CHÚ THÍCH 1: Các nhà sản xuất RM nhằm mục đích sử dụng trong việc tiêu chuẩn hóa hoặc hiệu chuẩn IVD MD bao gồm các tổ chức thương mại và phi thương mại sản xuất RM đề sử dụng cho nhiều người dùng cuối IVD MD và/hoặc phòng thí nghiệm hiệu chuẩn hoặc cho một phòng thí nghiệm y tế của người dùng cuối, như trong trường hợp chuẩn đo lường (chất hiệu chuẩn) được sử dụng riêng để hiệu chuẩn MP do phòng thí nghiệm phát triển.
Tiêu chuẩn này áp dụng cho:
a) Tất cả IVD MD cung cấp kết quả đo dưới dạng giá trị số, tức là thang đo hợp lý (tỷ lệ) và/hoặc vi phân (khoảng) và thang đếm.
b) IVD MDs trong đó kết quả đo được báo cáo dưới dạng giá trị định tính được thiết lập với tỷ lệ của hai phép đo (nghĩa là tín hiệu từ mẫu đang được thử nghiệm và tín hiệu từ RM với nồng độ hoặc hoạt tính xác định tại điểm cắt), hoặc thang đếm, với (các) ngưỡng quyết định tương ứng. Điều này cũng bao gồm các IVD MD trong đó kết quả được phân loại theo các danh mục thứ tự dựa trên các khoảng đại lượng được thiết lập trước cho một số lượng.
c) RM được sử dụng làm vật liệu kiểm soát độ đúng để kiểm định hoặc đánh giá hiệu chuẩn IVD MD, tức là một số CRM có thể chuyển đổi và một số vật liệu đánh giá chất lượng bên ngoài (EQA) (nếu được nêu trong tuyên bố sử dụng dự kiến của RM).
d) Các chất hiệu chuẩn dành riêng cho IVD MD và vật liệu kiểm soát độ đúng với các giá trị được ấn định, nhằm mục đích sử dụng cùng với IVD MD được chỉ định.
e) IVD MD như được mô tả trong a) và b), trong đó không yêu cầu người dùng cuối thực hiện hiệu chuẩn (tức là khi nhà sản xuất thực hiện hiệu chuẩn tại nhà máy của IVD MD).
Tiêu chuẩn này không áp dụng cho:
a) Chất hiệu chuẩn và vật liệu kiểm soát độ đúng cho IVD MDs, do công thức của chúng, được biết là không có lượng đại lượng đo;
b) Vật liệu kiểm soát chỉ được sử dụng cho mục đích kiểm soát chất lượng nội bộ trong các phòng thí nghiệm y tế để đánh giá tính không chính xác của IVD MD, hoặc độ lặp lại hoặc độ tái lập của nó, và/hoặc để đánh giá những thay đổi trong kết quả IVD MD so với điều kiện hiệu chuẩn đã thiết lập trước đó;
c) Vật liệu kiểm soát chỉ được sử dụng cho mục đích kiểm soát chất lượng nội bộ trong các phòng thí nghiệm y tế và được cung cấp với các khoảng giá trị được đề xuất chấp nhận được mà không thể liên kết đo lường đối với các thành phần của hệ thống quy chiếu bậc cao;
d) Các đặc tính được báo cáo dưới dạng thang đo danh nghĩa và thang đo thứ tự, không liên quan đến độ lớn.
CHÚ THÍCH 2: Các thang đo danh nghĩa thường được sử dụng để báo cáo, ví dụ: nhận dạng các loại tế bào máu, các loại vi sinh vật, nhận dạng trình tự axit nucleic, nhận dạng các hạt nước tiểu.
CHÚ THÍCH 3: Thang đo thứ tự thường được áp dụng cho các kết quả được phân biệt thành các nhóm lưỡng phân (ví dụ: "ốm" so với "khỏe mạnh"), và đôi khi cho các kết quả được phân biệt thành các danh mục không phân đôi trong đó các loại kết quả được sắp xếp theo thứ tự nhưng các danh mục có thứ tự không thể được phân biệt về mức độ khác biệt tương đối, ví dụ âm tính, +1, +2, +3 để phân loại sự hiện diện của hemoglobin trong mẫu nước tiểu bằng quan sát bằng mắt.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau đây là cần thiết để áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 13416 (ISO 15193), Thiết bị y tế chẩn đoán in vitro - Đo lường trong mẫu thử có nguồn gốc sinh học - Yêu cầu về nội dung và thể hiện các thủ tục đo quy chiếu.
ISO 18113-2, In vitro diagnostic medical devices - Information supplied by the manufacturer (labelling) - Part 2: In vitro diagnostic reagents for professional use (Thiết bị y tế chẩn đoán in vitro - Thông tin do nhà sản xuất cung cấp (ghi nhãn) - Phần 2: Thuốc thử chẩn đoán in vitro dùng trong chuyên môn).
ISO 15194, In vitro diagnostic medical devices - Measurement of quantities in samples of biological origin - Requirements for certified reference materials and the content of supporting documentation (Thiết bị y tế chẩn đoán trong ống nghiệm - Đo lượng trong các mẫu có nguồn gốc sinh học - Yêu cầu đối với mẫu chuẩn được chứng nhận và nội dung của tài liệu hỗ trợ).
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này, áp dụng các thuật ngữ và định nghĩa sau:
3.1
Chất phân tích (analyte)
Thành phần thể hiện bằng tên của một đại lượng có thể đo lường
VÍ DỤ: Trong loại đại lượng (3.38) “khối lượng protein trong nước tiểu 24 h”, “protein” là chất phân tích. Trong đại lượng “lượng chất glucose trong huyết thanh”, “glucose” là chất phân tích. Trong cả hai trường hợp, cụm từ dài thể hiện đại lượng đo (3.26).
3.2
Độ chọn lọc phân tích (analytical selectivity)
Độ chọn lọc của hệ thống đo (selectivity of a measuring system)
Độ chọn lọc (selectivity)
Tính chất của hệ thống đo (3.29), được sử dụng với một MP cụ thể (3.27), theo đó cung cấp giá trị đại lượng đo được (3.38) cho một hoặc nhiều đại lượng đo (3.26) sao cho giá trị của mỗi đại lượng đo (3.26) độc lập với các đại lượng đo khác (3.26) hoặc các đại lượng khác (3.38) trong hiện tượng, cơ thể hoặc chất đang được khảo sát.
VÍ DỤ: Khả năng của hệ thống đo (3.29) để đo nồng độ lượng chất của creatinin trong huyết tương không bị ảnh hưởng bởi các thành phần khác có trong mẫu.
CHÚ THÍCH 1: Trong hóa học, độ chọn lọc của hệ thống đo (3.29) thường thu được đối với các đại lượng (3.38) với các thành phần được chọn ở nồng độ trong khoảng thời gian đã nêu.
CHÚ THÍCH 2: Tính chọn lọc được sử dụng trong vật lý là một khái niệm gần với tính đặc hiệu vì nó đôi khi được sử dụng trong hóa học.
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 4.13, được sửa đổi - "Độ chọn lọc phân tích" được thêm vào làm thuật ngữ ưu tiên. Chỉ bao gồm Ví dụ 5 với văn bản viết tắt và CHÚ THÍCH 3 và 4].
3.3
Độ chệch (measurement bias)
Chệch (bias)
Ước lượng của sai số đo hệ thống.
CHÚ THÍCH 1: Xem TCVN 6165:2009 (ISO/IEC Guide 99:2007) 2.17, sai số đo hệ thống.
CHÚ THÍCH 2: Định nghĩa này chỉ áp dụng cho các phép đo đại lượng.
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 2.18, được sửa đổi - Chú thích 1 và 2 được bổ sung].
3.4
Hiệu chuẩn (calibration)
Hoạt động trong bước đầu tiên thiết lập mối quan hệ giữa các giá trị của đại lượng (3.38) với độ không đảm bảo đo (3.48) được cung cấp bởi các chuẩn đo lường (3.28) và các chỉ báo tương ứng với độ không đảm bảo đo liên quan (3.48) và trong một giây bước, sử dụng thông tin này để thiết lập mối quan hệ để thu được kết quả đo từ một chỉ báo.
CHÚ THÍCH 1: Hiệu chuẩn có thể được thể hiện bằng một tuyên bố, chức năng hiệu chuẩn, sơ đồ hiệu chuẩn, đường chuẩn hoặc bảng hiệu chuẩn. Trong một số trường hợp, nó có thể bao gồm hiệu chính cộng hoặc nhân của chỉ báo với độ không đảm bảo đo liên quan (3.48).
CHÚ THÍCH 2: Không nên nhầm lẫn hiệu chuẩn với điều chỉnh hệ thống đo (3.29), thường bị gọi nhầm là "tự hiệu chuẩn", hoặc với kiểm định (3.50) hiệu chuẩn.
CHÚ THÍCH 3: Thông thường, chỉ bước đầu tiên trong định nghĩa trên được coi là hiệu chuẩn.
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 2.39].
3.5
Sơ đồ hiệu chuẩn (calibration hierarchy)
Chuỗi hiệu chuẩn (3.4) từ mốc quy chiếu đến hệ thống đo cuối cùng (3.29), trong đó đầu ra của từng phép hiệu chuẩn (3.4) phụ thuộc vào đầu ra của phép hiệu chuẩn trước đó (3.4).
CHÚ THÍCH 1: Độ không đảm bảo đo (3.48) nhất thiết tăng lên dọc theo chuỗi hiệu chuẩn (3.4).
CHÚ THÍCH 2: Các thành phần của sơ đồ hiệu chuẩn là một hay một số chuẩn đo lường (3.28) và hệ thống đo vận hành (3.29) theo các thủ tục đo (3.27).
CHÚ THÍCH 3: Việc so sánh giữa hai chuẩn đo lường (3.28) có thể xem như là hiệu chuẩn (3.4) nếu việc so sánh được dùng để kiểm tra và, nếu cần thiết, hiệu chính giá trị đại lượng (3.38) và độ không đảm bảo đo (3.48) được quy cho một trong các chuẩn đo lường (3.28).
CHÚ THÍCH 4: Trong tiêu chuẩn này, sơ đồ hiệu chuẩn được định nghĩa là mô tả chi tiết về quá trình ấn định giá trị của đại lượng đo (3.26) cho một mẫu bằng cách sử dụng một chuỗi cụ thể gồm các MP (3.27) và RM (3.39) (đã hiệu chuẩn theo thứ tự cao hơn RM (3.39) và/hoặc MP (3.27) cho cùng một loại đại lượng (3.38), nếu có).
CHÚ THÍCH 5: Đối với mục đích của định nghĩa này, một mẫu bao gồm mẫu bệnh phẩm người cũng như vật liệu hiệu chuẩn (3.6), vật liệu EQA hoặc RM khác (3.39).
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 2.40, được sửa đổi - loại trừ Chú thích gốc 3. Chú thích 3 là Chú thích 4 và Chú thích 5 được thêm vào].
3.6
Chất hiệu chuẩn (calibrator)
Vật liệu hiệu chuẩn (calibration material)
Chuẩn đo lường (3.28) được sử dụng trong hiệu chuẩn (3.4) của hệ thống đo (3.29) theo một MP xác định (3.27).
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 5.12, được sửa đổi - "vật liệu hiệu chuẩn" đã được thêm vào như một thuật ngữ được thừa nhận, "của hệ thống đo theo một MP xác định" đã được thêm vào cuối định nghĩa, CHÚ THÍCH đã xóa].
3.7
Hoạt tính xúc tác (catalytic activity)
Thuộc tính của một thành phần tương ứng với tốc độ chuyển hóa chất được xúc tác của một phản ứng hóa học xác định, trong một hệ thống đo cụ thể (3.29).
CHÚ THÍCH 1: Trong tiêu chuẩn này, "thành phần" là một enzym.
CHÚ THÍCH 2: Đại lượng (3.38) "hoạt tính xúc tác" liên quan đến một lượng enzym hoạt động, không phải nồng độ của nó; xem 3.8.
CHÚ THÍCH 3: Đơn vị SI dẫn xuất nhất quán là "katal" (kat), bằng "mol trên giây" (mol s - 1).
CHÚ THÍCH 4: MP (3.27) là yếu tố thiết yếu của định nghĩa đại lượng đo (3.26).
CHÚ THÍCH 5: Trong nhiều trường hợp, thay vì tốc độ chuyển đổi của cơ chất được mô tả trong tên viết tắt của chất phân tích enzym (3.1), ví dụ: "creatine" trong "creatine kinase", tỷ lệ chuyển đổi của chất chỉ thị làm chất nền của phản ứng kết hợp được đo. Sau đó, đại lượng đo (3.26) phải được định nghĩa là "hoạt tính xúc tác của enzym được đo bằng tốc độ chuyển đổi của chất chỉ thị trong một hệ thống xác định theo một MP (3.27) nhất định", ví dụ "hoạt tính xúc tác của creatine kinase được đo bằng tốc độ chuyển đổi NADP + trong quy trình chuẩn IFCC trong huyết thanh người".
[NGUỒN: ISO 18153: 2003, 3.2],
3.8
Nồng độ hoạt tính xúc tác (catalytic-activity concentration)
Nồng độ xúc tác (catalytic concentration)
Hoạt tính xúc tác (3.7) của một thành phần chia cho thể tích của hệ ban đầu.
CHÚ THÍCH 1: Đơn vị SI dẫn xuất nhất quán là "katal trên mét khối" hoặc "mol trên mét khối giây" (kat m-3 = mol s-1 m-3). Trong y học phòng thí nghiệm, đơn vị thể tích có thể được chọn là "lít" (L).
CHÚ THÍCH 2: Trong tiêu chuẩn này, "thành phần" là một enzym và "hệ ban đầu" có thể ví dụ là huyết tương của mẫu máu.
[NGUỒN: ISO 18153: 2003, 3.3].
3.9
Mẫu chuẩn được chứng nhận (certified reference material - CRM)
Mẫu chuẩn (3.39) cùng với tài liệu được công bố bởi cơ quan có thẩm quyền và cung cấp một hay một số giá trị tính chất xác định với độ không đảm bảo kèm theo (3.48) và liên kết đo lường (3.31), sử dụng các thủ tục có hiệu lực
VÍ DỤ: Huyết thanh người với giá trị được ấn định (3.38) cho nồng độ cholesterol và độ không đảm bảo đo kèm theo (3.48) được công bố trong giấy chứng nhận đi kèm, được sử dụng như là một chất hiệu chuẩn (3.6) hoặc vật liệu kiểm soát độ đúng đo (3.46).
CHÚ THÍCH 1: "Tài liệu" được cung cấp dưới dạng "giấy chứng nhận" (xem ISO Guide 31).
CHÚ THÍCH 2: Thủ tục để sản xuất và mẫu chuẩn được chứng nhận nêu trong TCVN ISO 17034:2016 và ISO Guide 35: 2017.
CHÚ THÍCH 3: Trong định nghĩa này, "độ không đảm bảo" bao gồm cả "độ không đảm bảo đo" (3.48) và "độ không đảm bảo gắn với giá trị của tính chất danh nghĩa", như nhận biết và trình tự. "Liên kết" bao gồm cả hai.
"Liên kết đo lường (3.31) của một giá trị số lượng" và "liên kết của một giá trị tài sản danh nghĩa".
CHÚ THÍCH 4: Giá trị đại lượng cụ thể (3.38) của CRM yêu cầu liên kết đo lường (3.31) với độ không đảm bảo đo kèm theo (3.48) [25].
CHÚ THÍCH 5: ISO/REMCO có một định nghĩa tương tự [25] nhưng dùng từ bổ nghĩa "metrological’" và "metrologicaly" để chỉ cả hai tính chất đại lượng (3.38) và tính chất danh nghĩa.
CHÚ THÍCH 6: Các yêu cầu cụ thể đối với CRM và nội dung của tài liệu hỗ trợ (trong lĩnh vực thiết bị y tế chẩn đoán in vitro) được nêu trong ISO 15194.
CHÚ THÍCH 7: Đối với một loại vật liệu cụ thể, chứng chỉ hiệu chuẩn (3.4) do phòng thí nghiệm hiệu chuẩn được công nhận (3.4) cung cấp không cấp trạng thái CRM cho các loại vật liệu này.
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 5.14, đã được sửa đổi - Chú thích 6 và 7 được bổ sung].
3.10
Tính chuyển đổi của mẫu chuẩn (commutability of a reference material)
Tính chuyển đổi (commutability)
Tính chất của mẫu chuẩn (3.39), thể hiện bằng sự gần nhau của mối quan hệ giữa các kết quả đo đối với đại lượng (3.38) đã ấn định trong vật liệu này, nhận được theo hai thủ tục đo đã cho (3.27), và mối quan hệ nhận được giữa các kết quả đo đối với các vật liệu quy định khác
CHÚ THÍCH 1: RM (3.39) được đề cập thường là chất hiệu chuẩn (3.6) và các vật liệu được chỉ định khác thường là mẫu thông thường.
CHÚ THÍCH 2: Trong đánh giá khả năng đi lại của RM (3,39), cần có sự so sánh giữa tất cả các MP áp dụng (3.27).
CHÚ THÍCH 3: Mức độ chặt chẽ của thỏa thuận kết quả đo được xác định về mặt phù hợp với mục đích phù hợp với mục đích sử dụng của RM (3.39).
CHÚ THÍCH 4: Tuyên bố về khả năng giao hoán bị hạn chế đối với các MP (3.27) như được chỉ định trong một phép so sánh cụ thể.
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 5.15 được sửa đổi - Chú thích 2 và Chú thích 3 đã bị xóa. Chú thích 2 đến chú thích 4 được thêm vào]
3.11
Vật liệu kiểm soát (control material)
Chất, vật liệu hoặc vật phẩm được nhà sản xuất (3.22) dự định sử dụng để kiểm định các đặc tính hoạt động của IVD MD (3.21)
[NGUỒN: ISO 18113-1:2009, 3.13].
3.12
Chất hiệu chuẩn IVD MD cho người dùng cuối (end-user IVD MD calibrator)
Chất hiệu chuẩn cho người dùng cuối (end-user calibrator)
Mẫu chuẩn (3.39) được sử dụng làm chuẩn đo lường (3.28) được sử dụng với một hoặc nhiều IVD MD (3.21) MP (3.27) nhằm kiểm tra một đại lượng đo cụ thể (3.26) trong mẫu bệnh phẩm người.
CHÚ THÍCH 1: Chất hiệu chuẩn của người dùng cuối bao gồm RM (3.39) hoặc chất hiệu chuẩn (3.6) được nhà sản xuất áp dụng nội bộ (3.22) để thực hiện hiệu chuẩn cuối cùng (3.4) của IVD MD (3.21), trước IVD MD (3.21) phát hành và giao hàng cho người dùng cuối, trong đó người dùng cuối không cần phải hiệu chuẩn (tức là "hiệu chuẩn nhà máy").
CHÚ THÍCH 2: Các chức năng hiệu chuẩn (3.4) hoặc hiệu chuẩn (3.4) do nhà máy tạo ra bao gồm thông tin hiệu chuẩn (3.4) (phương trình, công thức, chức năng, tham số, dữ liệu) được lưu trữ, ví dụ: ở định dạng điện tử, để sử dụng với bộ vi xử lý như một phần của hệ thống đo IVD MD (3.21) (3.29) để biến đổi "tín hiệu" được tạo ra trong quá trình đo các mẫu bệnh phẩm người chưa biết thành một lượng chất hoặc giá trị đo cuối cùng khác.
3.13
Sự tương đương của các giá trị đo được (equivalence of measured values)
Kết quả tương đương (equivalent results)
Quy ước của các giá trị đo được giữa các IVD MD khác nhau (3.21) nhằm đo lường cùng một đại lượng đo (3.26), trong đó sự khác biệt về giá trị đo được trên cùng một mẫu bệnh phẩm người không ảnh hưởng đến diễn giải lâm sàng.
CHÚ THÍCH 1: Kết luận về sự tương đương của các giá trị đo được đối với cùng một mẫu bệnh phẩm người giữa hai hoặc nhiều MP (3.27) dựa trên sự khác biệt về giá trị đo nằm trong một biên độ hoặc giới hạn xác định trước.
[NGUỒN: Harmonization.net, đã sửa đổi - từ ngữ được sửa lại cho rõ ràng]
3.14
Mẫu chuẩn yêu cầu cao hơn (higher order reference material)
RM yêu cầu cao hơn (higher order RM)
CRM (3.9) đáp ứng yêu cầu chất lượng được quốc tế chấp nhận và cung cấp tham chiếu đo lường chung trong Sơ đồ hiệu chuẩn (3.5) mà các nhà sản xuất (3.22) có thể thiết lập liên kết đo lường (3.31)
CHÚ THÍCH 1: Yêu cầu chất lượng đối với RM bậc cao hơn được quy định trong ISO 15194.
CHÚ THÍCH 2: Các RM bậc cao hơn bao gồm các RM chính phù hợp cho mục đích (3.35), các chất hiệu chuẩn đầu (3.37), các chất hiệu chuẩn thứ (3.42) và các chất hiệu chuẩn quốc tế thông thường (3.17).
CHÚ THÍCH 3: Các chất tinh khiết tạo thành chuẩn đo lường đầu (3.37) và là nguồn cuối cùng của khả năng liên kết đo lường bậc cao hơn (3.31) đối với hầu hết các chuỗi liên kết trong hóa học, đo nhiệt và đo nhiệt lượng nối chung và để chứng nhận dung dịch và chất nền (3.24) Đặc biệt là RM (3.39) (xem ISO Guide 35:2017).
CHÚ THÍCH 4: Theo câu hỏi thường gặp của Ủy ban Liên hợp về liên kết trong Y học phòng thí nghiệm (JCTLM) [27], RM bậc cao hơn là CRM (3.9), đáp ứng các yêu cầu chất lượng được quốc tế chấp nhận, mà các kết quả đo khác có thể được tham khảo và độ không đảm bảo đo (3.48) hoàn toàn được thiết lập. Về mặt đo lường, RM bậc cao hơn là RM (3,39) được triển khai ở mức cao hơn trong sơ đồ hiệu chuẩn (3,5). Các RM có thứ tự cao nhất, được chứng nhận, nếu có, được sử dụng bởi các nhà sản xuất IVD MD (3.21) (3.22) để gán giá trị cho các chất hiệu chuẩn đang hoạt động (3.51). Các chất hiệu chuẩn đang hoạt động này (3.51) sau đó được nhà sản xuất (3.22) sử dụng để gán giá trị cho các đại lượng đo (3.26) trong các chất hiệu chuẩn IVD MD cho người dùng cuối (3.12) và vật liệu kiểm soát (3.11) để sử dụng với IVD MD (3.21) trong các phòng thí nghiệm y tế và các môi trường thử nghiệm IVD khác. Các RM bậc cao được các viện đo lường quốc gia (NMI) sản xuất và phân phối phổ biến nhất, ví dụ: Viện Tiêu chuẩn và Công nghệ Quốc gia Hoa Kỳ (NIST), Trung tâm Nghiên cứu hỗn hợp của Ủy ban Châu Âu (EU-JRC), Tiêu chuẩn LGC (Anh), Tổ chức Y tế Thế giới (WHO), Viện Kiểm soát và Tiêu chuẩn Sinh học Quốc gia (Anh), Viện Đo lường Quốc gia (CN), Viện Đo lường Quốc gia Nhật Bản (JP), Viện Mẫu chuẩn cho Tiêu chuẩn Hóa học Lâm sàng (JP), Ủy ban Tiêu chuẩn Công nghiệp Nhật Bản (JISC), Centro Nacional de Metrología (MX), v.v. Một số nguồn thương mại cũng cung cấp RM được liệt kê bởi JCTLM [28].
3.15
Thủ tục đo quy chiếu bậc cao hơn (higher order reference measurement procedure)
RMP yêu cầu cao hơn (higher order RMP)
Thủ tục đo quy chiếu (RMP) (3.40) đáp ứng các yêu cầu chất lượng được quốc tế chấp nhận và cung cấp tham chiếu đo lường chung trong sơ đồ hiệu chuẩn (3.5) mà nhà sản xuất "(3.22) có thể thiết lập khả năng liên kết đo lường (3.31) và được chấp nhận là cung cấp kết quả đo phù hợp với mục đích sử dụng để đánh giá độ đúng của phép đo (3.47).
CHÚ THÍCH 1: Yêu cầu chất lượng đối với RMP bậc cao hơn (3.15) được định nghĩa trong ISO 15193.
CHÚ THÍCH 2: Ví lý do chi phí cao hơn, độ phức tạp của thiết bị và yêu cầu đào tạo người vận hành, các RMP bậc cao thường được thực hiện trong các viện đo lường quốc gia (3.32) và/hoặc các phòng thí nghiệm hiệu chuẩn được công nhận (3.4).
CHÚ THÍCH 3: Trong phòng thí nghiệm y học, RMP (3.40) đáp ứng các yêu cầu của TCVN 13416 (ISO 15193) được coi là RMP bậc cao hơn.
CHÚ THÍCH 4: Theo Câu hỏi thường gặp của JCTLM [27], các RMP bậc cao được ghi chép đầy đủ, độ chính xác cao (MP) (3.27) được sử dụng để gán giá trị cho vật liệu hiệu chuẩn (3.6). Ở mức cao nhất (các MP này) (3.27) thường tốn kém để phát triển, quá phức tạp để sử dụng thường xuyên và không thích hợp để phân tích thông lượng cao.
3.16
Đại lượng ảnh hưởng (influence quantity)
Đại lượng (3.38) mà trong phép đo trực tiếp không ảnh hưởng đến đại lượng (3.38) được đo thực tế, nhưng ảnh hưởng đến mối quan hệ giữa số chỉ và kết quả đo.
VÍ DỤ: Nồng độ lượng chất của bilirubin trong phép đo trực tiếp nồng độ lượng chất hemoglobin trong huyết tương người.
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 2.52, được sửa đổi - loại trừ 3 ví dụ và 2 chú thích]
3.17
Hiệu chuẩn thông thường quốc tế (international conventional calibrator)
Vật liệu hiệu chuẩn thông thường quốc tế (international conventional calibration material)
Chuẩn đo lường quốc tế (international measurement standard)
Chất hiệu chuẩn (3.6) có giá trị đại lượng (3.38) không thể liên kết đo lường (3.31) đối với SI nhưng được chỉ định theo thỏa thuận quốc tế.
CHÚ THÍCH 1: Đại lượng (3.38) được xác định đối với ứng dụng lâm sàng dự kiến.
3.18
Thủ tục đo quy chiếu thông thường quốc tế (international conventional reference measurement procedure)
RMP thông thường quốc tế (international conventional RMP)
MP (3.27) mang lại các giá trị không thể theo dõi đo lường đối với SI nhưng theo thỏa thuận quốc tế được sử dụng làm giá trị tham chiếu cho một đại lượng xác định (3.38).
CHÚ THÍCH 1: Đại lượng (3.38) được xác định đối với ứng dụng lâm sàng dự kiến.
3.19
Giao thức hài hòa quốc tế (international harmonisation protocol)
Mô tả quy trình do một tổ chức quốc tế thực hiện để đạt được sự tương đương của các giá trị đo được (3.13) trong giới hạn có thể chấp nhận được về mặt y tế giữa hai hoặc nhiều IVD MD (3.21) nhằm kiểm tra cùng một đại lượng đo (3.26) đối với các trường hợp không có RMP bậc cao hơn (3.15) và không phù hợp với mục đích CRM (3.9) hoặc các chất hiệu chuẩn thông thường quốc tế (3.17).
CHÚ THÍCH 1: Một giao thức hài hòa có thể được sử dụng để đạt được tiêu chuẩn hóa các giá trị đo cho đại lượng đo đã nêu (3.26) khi không có thành phần hệ quy chiếu bậc cao nào khác phù hợp để sử dụng.
3.20
Chuẩn đo lường quốc tế (international measurement standard)
Chuẩn đo lường (3.28) được các bên ký kết hiệp định quốc tế công nhận và nhằm mục đích phục vụ trên toàn thế giới làm cơ sở để ấn định giá trị cho các tiêu chuẩn khác cho cùng một đại lượng (3.38).
VÍ DỤ 1: Nguyên mẫu quốc tế của kg.
VÍ DỤ 2: ERM®-DA470k/IFCC để hiệu chuẩn (3.4) các thiết bị chẩn đoán trong ống nghiệm dựa trên xét nghiệm miễn dịch hoặc các sản phẩm kiểm soát cho các protein được chứng nhận, Ủy ban Châu Âu - Trung tâm Nghiên cứu Chung (JRC), Geel, Bỉ.
VÍ DỤ 3: Điểm ba của nước - sự kết hợp duy nhất của áp suất và nhiệt độ tại đó nước lỏng, nước đá rắn và hơi nước cùng tồn tại ở trạng thái cân bằng ổn định, xảy ra ở chính xác 273,16 K (0,01°C; 32.02°F) ở áp suất hơi riêng phần là 611,657 pascal (6,11657 mbar; 0,00603659 atm).
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 5.2, được sửa đổi - Ví dụ 2 và Ví dụ 3 đã bị xóa. Ví dụ 2 và Ví dụ 3 mới đã được thêm vào]
3.21
Thiết bị y tế chẩn đoán trong ống nghiệm (in vitro diagnostic medical device)
Thiết bị y tế IVD (IVD medical device - IVD MD)
Thiết bị, cho dù được sử dụng đơn lẻ hay kết hợp, được nhà sản xuất (3.22) dự định để kiểm tra trong ống nghiệm các mẫu lấy từ cơ thể người chỉ hoặc chủ yếu để cung cấp thông tin cho mục đích chẩn đoán, giám sát hoặc tương thích và bao gồm thuốc thử, chất hiệu chuẩn (3.6), vật liệu kiểm soát (3.11), hộp đựng mẫu, phần mềm, và các dụng cụ hoặc thiết bị liên quan hoặc các sản phẩm khác.
[NGUỒN: ISO 18113-1:2009, 3.27]
3.22
Nhà sản xuất (manufacturer)
Pháp nhân chịu trách nhiệm thiết kế, sản xuất, chế tạo, lắp ráp, đóng gói hoặc dán nhãn IVD MD (3.21), để lắp ráp hệ thống đo (3.29), hoặc điều chỉnh IVD MD (3.21) trước khi nó được đưa ra thị trường và/hoặc được đưa vào sử dụng, bất kể các hoạt động này được thực hiện bởi tổ chức đó hay do một bên thứ ba thay mặt họ thực hiện.
CHÚ THÍCH 1: Một pháp nhân bao gồm nhưng không giới hạn ở một cá nhân, một công ty (hoặc doanh nghiệp được thành lập hợp pháp khác), một hiệp hội, một tổ chức hoặc một phòng thí nghiệm y tế. Một thực thể cần được xác định bằng sự tồn tại riêng biệt và khác biệt và thực tế khách quan.
CHÚ THÍCH 2: Nhà sản xuất có trách nhiệm pháp lý cuối cùng trong việc đảm bảo tuân thủ tất cả các yêu cầu quy định hiện hành đối với IVD MD (3.21) ở các quốc gia hoặc khu vực pháp lý nơi nó được dự định cung cấp hoặc bán, trừ khi trách nhiệm này được áp đặt cụ thể cho người khác thực thể của Cơ quan quản lý (RA) trong phạm vi quyền hạn đó.
CHÚ THÍCH 3: Trách nhiệm của nhà sản xuất được mô tả trong các tài liệu hướng dẫn GHTF khác. Những trách nhiệm này bao gồm việc đáp ứng cả các yêu cầu trước khi đưa ra thị trường và các yêu cầu sau khi đưa ra thị trường, chẳng hạn như báo cáo sự kiện bất lợi và thông báo về các hành động khắc phục.
CHÚ THÍCH 4: "Thiết kế và/hoặc sản xuất", như được đề cập trong định nghĩa trên, có thể bao gồm phát triển đặc điểm kỹ thuật, sản xuất, chế tạo, lắp ráp, chế biến, đóng gói, đóng gói lại, dán nhãn, dán nhãn lại, khử trùng, lắp đặt hoặc tái sản xuất một IVD MD (3,21); hoặc tập hợp các IVD MD (3.21), và có thể là các sản phẩm khác, cùng với mục đích y tế.
CHÚ THÍCH 5: Bất kỳ thực thể nào lắp ráp hoặc điều chỉnh IVD MD (3.21) đã được nhà sản xuất cung cấp cho mục đích kiểm tra được thực hiện trên mẫu bệnh phẩm người theo hướng dẫn sử dụng, không phải là nhà sản xuất, miễn là việc lắp ráp hoặc điều chỉnh không làm thay đổi mục đích sử dụng của IVD MD (3.21).
CHÚ THÍCH 6: Bất kỳ pháp nhân nào thay đổi mục đích sử dụng hoặc sửa đổi IVD MD (3.21) mà không thay mặt cho nhà sản xuất ban đầu và người cung cấp nó để sử dụng dưới tên riêng của họ, sẽ được coi là nhà sản xuất của thiết bị đã sửa đổi.
CHÚ THÍCH 7: Người đại diện, nhà phân phối hoặc nhà nhập khẩu được ủy quyền chỉ thêm địa chỉ và chi tiết liên hệ của mình vào IVD MD (3.21) hoặc bao bì, mà không che khuất hoặc thay đổi nhãn hiện có, không được coi là nhà sản xuất.
CHÚ THÍCH 8: Trong phạm vi phụ kiện tuân theo các yêu cầu quy định của (IVD MD (3.21)), pháp nhân chịu trách nhiệm thiết kế và/hoặc sản xuất phụ kiện đó được coi là nhà sản xuất.
[NGUỒN: ISO 18113-1:2009, 3.36, được sửa đổi - Đã thay thế "thể nhân hoặc pháp nhân" và "cá nhân" bằng "thực thể"; nguồn Chú thích bị loại trừ; Chú thích 1 mới được giới thiệu; Chú thích 2-8 được bổ sung và lấy nguồn (với những sửa đổi nhỏ để đảm bảo tính nhất quán trong thuật ngữ như được đưa ra trong định nghĩa này) từ GHTF / SG1N055: 2009, 5.1].
3.23
Hiệu ứng nền (matrix effect)
Thể hiện đặc tính của mẫu, không phụ thuộc vào sự có mặt của chất phân tích (3.1), trên phép đo và do đó dựa trên giá trị đại lượng đo (3.38).
CHÚ THÍCH 1: Nguyên nhân cụ thể của hiệu ứng nền là đại lượng ảnh hưởng (3.16).
CHÚ THÍCH 2: Thuật ngữ "hiệu ứng nền" đôi khi được sử dụng sai trong các trường hợp vật liệu không thể chuyển đổi do các nguyên nhân như, ví dụ: chất phân tích biến tính (3.1) hoặc thành phần không chính hãng được bổ sung (chất phân tích thay thế (3.1)) nhằm mục đích mô phỏng đại lượng đo (3.26).
[NGUỒN: ISO 15194:2009, 3.7, được sửa đổi - CHÚ THÍCH 2 và Ví dụ được loại trừ; đã thêm Chú thích 2].
3.24
Chất nền (matrix)
Hệ thống chất nền (system matrix)
Các thành phần <vật liệu> của hệ thống vật liệu, ngoại trừ chất phân tích (3.1).
CHÚ THÍCH 1: Hệ thống sinh học không bao gồm chất phân tích (3.1) là chất nền của vật liệu.
[NGUỒN: ISO 15194:2009, 3.6, được sửa đổi - thêm vào <vật liệu> dưới dạng miền; thêm từ đồng nghĩa "chất nền hệ thống"; đã thêm Chú thích 1].
3.25
Độ không đảm bảo đo tối đa cho phép (maximum allowable measurement uncertainty)
Umax(y)
Độ không đảm bảo đo phù hợp tối đa cho mục đích (3.48) đối với kết quả đo được tạo ra bởi một MP nhất định (3.27) và được chỉ định như một giới hạn trên dựa trên việc đánh giá các yêu cầu y tế.
CHÚ THÍCH 1: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 4.26, xác định sai số đo tối đa cho phép. Trong cách sử dụng tiếng Anh hiện đại, sự khác biệt giữa các thuật ngữ được phép và được phép tương tự như sự khác biệt giữa khái niệm khoan dung (được phép) và sự cho phép (được phép), ủy quyền ngụ ý một yêu cầu theo luật định, được ủy quyền hoặc pháp lý. Đối với hầu hết các đại lượng đo (3.26) trong y học phòng thí nghiệm, không có giới hạn pháp lý nào về hiệu suất, do đó cho phép là tính từ được ưu tiên trong ngữ cảnh của định nghĩa này.
CHÚ THÍCH 2: Trong tiêu chuẩn này, thông số kỹ thuật về độ không đảm bảo đo tối đa cho phép (3.25) đối với IVD MD (3.21) được viết tắt là Umax (y).
3.26
Đại lượng đo (measurand)
Đại lượng (3.38) dự định đo.
CHÚ THÍCH 1: Đặc điểm kỹ thuật của đại lượng đo yêu cầu kiến thức về loại đại lượng (3.38), mô tả trạng thái của hiện tượng, cơ thể hoặc chất mang đại lượng (3.38), bao gồm bất kỳ thành phần liên quan nào và các thực thể hóa học có liên quan.
CHÚ THÍCH 2: Trong phiên bản thứ hai của VIM và trong IEC 60050-300:2001, đại lượng đo được định nghĩa là "đại lượng (3.38) cần đo".
CHÚ THÍCH 3: Phép đo, bao gồm hệ thống đo (3.29) và các điều kiện thực hiện phép đo, có thể thay đổi hiện tượng, cơ thể hoặc chất sao cho đại lượng (3.38) được đo có thể khác với đại lượng đo như được xác định. Trong trường hợp này, cần hiệu chính đầy đủ.
VÍ DỤ Chiều dài của một thanh thép ở trạng thái cân bằng ở nhiệt độ C của môi trường xung quanh là 23 °C sẽ khác với chiều dài ở nhiệt độ xác định là 20 °C, là đại lượng đo. Trong trường hợp này, cần phải sửa lại.
CHÚ THÍCH 4: Trong hóa học, "chất phân tích" (3.1), hoặc tên của một chất hoặc hợp chất, là những thuật ngữ đôi khi được sử dụng cho "đại lượng đo". Cách sử dụng này là sai vi các thuật ngữ này không đề cập đến đại lượng (3.38).
CHÚ THÍCH 5: Trong phòng thí nghiệm y học, mô tả đại lượng đo bao gồm tên của đại lượng (3.38) (ví dụ nồng độ chất), thành phần/chất phân tích (3.1) (ví dụ β-D-glucose), và sinh học, hệ thống mà nó được tìm thấy (ví dụ như huyết tương).
[NGUỒN: ISO 18113-1:2009, 3.39, được sửa đổi - Chú thích 3 và 5 được thêm vào, ví dụ được thêm vào].
3.27
Thủ tục đo (measurement procedure - MP)
Mô tả chi tiết phép đo theo một hoặc nhiều nguyên tắc đo và theo phương pháp đo đã cho (3.30), dựa trên mô hình đo và bao gồm bất kỳ phép tính nào để thu được kết quả đo.
CHÚ THÍCH 1: Một MP thường được ghi đầy đủ chi tiết để cho phép người vận hành thực hiện phép đo.
CHÚ THÍCH 2: MP có thể bao gồm tuyên bố liên quan đến độ không đảm bảo đo mục tiêu (3.48).
CHÚ THÍCH 3: MP đôi khi được gọi là quy trình vận hành tiêu chuẩn, viết tắt là SOP.
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 2.6].
3.28
Chuẩn đo lường (measurement standard)
Chuẩn (standard)
Thực hiện định nghĩa của một đại lượng nhất định (3.38), với giá trị đại lượng đã nêu (3.38) và độ không đảm bảo đo liên quan (3.48), được sử dụng làm tham chiếu.
VÍ DỤ 1: Chuẩn đo lường khối lượng 1 kg với độ không đảm bảo đo chuẩn liên quan (3.48) là 3 µg.
VÍ DỤ 2: Bộ dung dịch đối chiếu của cortisol trong huyết thanh người có giá trị đại lượng được chứng nhận với độ không đảm bảo đo (3.48) cho mỗi dung dịch.
VÍ DỤ 3: RM (3.39) cung cấp các giá trị đại lượng (3.38) với độ không đảm bảo đo (3.48) cho nồng độ khối lượng của từng loại trong số mười protein khác nhau.
CHÚ THÍCH 1: "Việc thực hiện định nghĩa của một đại lượng nhất định (3.38)" có thể được cung cấp bởi hệ thống đo (3.29), phép đo vật liệu hoặc RM (3.39).
CHÚ THÍCH 2: Chuẩn đo lường thường được sử dụng làm tham chiếu để thiết lập giá trị đại lượng đo (3.38) và độ không đảm bảo đo liên quan (3.48) đối với các đại lượng khác (3.38) cùng loại, do đó thiết lập khả năng liên kết đo lường (3.31) thông qua hiệu chuẩn (3.4) các chuẩn đo lường, dụng cụ đo lường hoặc hệ thống đo khác (3.29).
CHÚ THÍCH 3: Thuật ngữ "hiện thực hóa" được sử dụng ở đây với nghĩa chung nhất. Nó biểu thị ba thủ tục "hiện thực hóa". Phương pháp đầu tiên bao gồm nhận thức vật lý của đơn vị đo lường từ định nghĩa của nó và là nhận thức cảm nhận nghiêm ngặt. Thứ hai, được gọi là "tái tạo", không bao gồm việc nhận ra đơn vị đo lường từ định nghĩa của nó mà là thiết lập một chuẩn đo lường có thể tái lập cao dựa trên một hiện tượng vật lý, khi nó xảy ra, ví dụ: trong trường hợp sử dụng laser ổn định tần số đề thiết lập chuẩn đo lường cho đồng hồ, của hiệu ứng Josephson đối với vôn hoặc của hiệu ứng Hall lượng tử đối với ohm. Thủ tục thứ ba bao gồm việc sử dụng một phép đo vật chất làm chuẩn đo lường. Nó xảy ra trong trường hợp chuẩn đo lường (3,28) là 1 kg.
CHÚ THÍCH 4: Độ không đảm bảo đo chuẩn (3.48) đi kèm với chuẩn đo lường luôn là một thành phần của độ không đảm bảo đo chuẩn tổng hợp (3.33) trong kết quả đo thu được bằng cách sử dụng chuẩn đo lường (xem TCVN 9595-3:2013 (ISO/IEC Guide 98-3:2008) - GUM, 2.3.4). Thông thường, thành phần này nhỏ so với các thành phần khác của độ không đảm bảo đo chuẩn tổng hợp (3.33).
CHÚ THÍCH 5: Giá trị đại lượng (3.38) và độ không đảm bảo đo (3.48) phải được xác định tại thời điểm sử dụng chuẩn đo lường.
CHÚ THÍCH 6: Một số đại lượng (3.38) cùng loại hoặc các loại khác nhau có thể được thực hiện trong một thiết bị thường được gọi là chuẩn đo lường.
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 5.1, được sửa đổi - Ví dụ 2 đến Ví dụ 4 và Chú thích 7 đến Chú thích 9 đã bị xóa]
3.29
Hệ thống đo (measuring system/measurement system)
Bộ một hoặc nhiều dụng cụ đo và thường là các thiết bị khác, bao gồm bất kỳ thuốc thử và nguồn cung cấp nào, được lắp ráp và điều chỉnh để cung cấp thông tin được sử dụng để tạo ra các giá trị đại lượng đo (3.38) trong khoảng thời gian xác định cho các đại lượng (3.38) thuộc loại xác định;
CHÚ THÍCH 1: Hệ thống đo chỉ có thể bao gồm một dụng cụ đo.
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 3.2].
3.30
Phương pháp đo (measurement method/method of measurement)
Mô tả chung về một tổ chức hợp lý của các hoạt động được sử dụng trong một phép đo.
CHÚ THÍCH 1: Các phương pháp đo có thể được đáp ứng theo nhiều cách khác nhau như:
- Phương pháp đo thay thế;
- Phương pháp đo vi sai;
- Phương pháp đo vô hiệu;
- Phương pháp đo trực tiếp;
- Phương pháp đo gián tiếp.
Xem IEC 60050-300:2001.
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007), 2.5].
3.31
Liên kết đo lường (metrological traceability)
Tính chất của kết quả đo nhờ đó kết quả có thể liên hệ tới mốc quy chiếu thông qua một chuỗi không đứt đoạn các phép hiệu chuẩn (3.4) được lập thành tài liệu, mỗi phép hiệu chuẩn đóng góp vào độ không đảm bảo đo (3.48).
CHÚ THÍCH 1: Với định nghĩa này, "mốc quy chiếu" có thể là định nghĩa của đơn vị đo thông qua việc thể hiện thực tế nó, hoặc một thủ tục đo (3.27) bao gồm đơn vị đo cho đại lượng không phải là đại lượng thứ tự (3.38) hoặc một chuẩn đo lường (3.28).
CHÚ THÍCH 2: Liên kết đo lường yêu cầu thiết lập một sơ đồ hiệu chuẩn (3.5).
CHÚ THÍCH 3: Thông số kỹ thuật của mốc quy chiếu phải bao gồm thời gian mà mốc quy chiếu này đã được sử dụng trong việc thiết lập sơ đồ hiệu chuẩn (3.5), cùng với mọi thông tin đo lường liên quan khác về mốc quy chiếu, ví dụ khi việc hiệu chuẩn đầu tiên (3.4) trong sơ đồ hiệu chuẩn (3.5) đã được thực hiện
CHÚ THÍCH 4: Đối với phép đo có nhiều đại lượng đầu vào (3.38) trong mô hình đo, từng giá trị đại lượng đầu vào (3.38) cần phải tự liên kết đo lường và sơ đồ hiệu chuẩn (3.5) liên quan có thể tạo nên một cấu trúc nhánh hoặc mạng. Sự nỗ lực cần thiết trong việc thiết lập liên kết đo lường cho từng giá trị đại lượng vào (3.38) cần tương xứng với sự đóng góp tương đối của nó vào kết quả đo.
CHÚ THÍCH 5: Liên kết đo lường của kết quả đo không đảm bảo rằng độ không đảm bảo đo (3.48) là thích hợp với một mục đích đã định, cũng không đảm bảo là không có sai lỗi.
CHÚ THÍCH 6: Việc so sánh giữa hai chuẩn đo lường (3.28) có thể xem là hiệu chuẩn nếu việc so sánh được dùng để kiểm tra và, nếu cần thiết, hiệu chính giá trị đại lượng (3.38) và độ không đảm bảo đo (3.48) được quy cho một trong số các chuẩn đo lường (3.28).
CHÚ THÍCH 7: ILAC coi các yếu tố để xác nhận liên kết đo lường là một chuỗi liên kết đo lường không đứt đoạn tới chuẩn đo lường quốc tế (3.20) hoặc chuẩn đo lường quốc gia (3.28), độ không đảm bảo đo được làm thành tài liệu (3.48), thủ tục đo được lập thành văn bản (3.27), năng lực kỹ thuật được công nhận, liên kết đo lường tới SI, và các khoảng thời gian hiệu chuẩn (3.4) (xem ILAC P-10-2002).
CHÚ THÍCH 8: Thuật ngữ rút gọn "liên kết" đôi khi được sử dụng để chỉ ‘liên kết đo lường’ cũng như các khái niệm khác, ví dụ như ‘liên kết mẫu' hoặc ‘liên kết tài liệu’ hoặc ‘liên kết phương tiện' hoặc ‘liên kết vật liệu’, trong đó lịch sử (“dấu vết”) của đối tượng được đưa ra. Vì vậy, thuật ngữ đầy đủ "liên kết đo lường" được ưu tiên nếu có bất cứ nguy cơ nhầm lẫn nào.
CHÚ THÍCH 9: Đối với Chú giải 4 của mục ở trên, VIM, 2.50, xác định đại lượng đầu vào (3.38) trong mô hình đo lường là đại lượng (3.38) phải được đo, hoặc đại lượng (3.38) giá trị của nó có thể khác thu được, để tính giá trị đại lượng đo được của đại lượng đo (3.26).
VÍ DỤ Chiều dài của thanh thép ở nhiệt độ xác định là đại lượng đo (3.26), trong khi nhiệt độ môi trường, chiều dài quan sát đuvc của thanh thép và hệ số giãn nở nhiệt của thanh thép là đại lượng đầu vào (3.38) trong phép đo mô hình.
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 2.41, được sửa đổi - Chú thích 9 và VÍ DỤ được thêm vào].
3.32
Đo lường (metrology)
Khoa học đo và ứng dụng của nó.
CHÚ THÍCH 1: Đo lường bao gồm tất cả các khía cạnh lý thuyết và thực tiễn của phép đo, bất kể độ không đảm bảo đo (3.48) và lĩnh vực áp dụng.
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 2.2].
3.33
Độ không đảm bảo đo chuẩn tổng hợp (combined standard measurement uncertainty)
Độ không đảm bảo chuẩn tổng hợp (combined standard uncertainty)
u(y)
Độ không đảm bảo đo chuẩn (3.48) nhận được bằng cách sử dụng các độ không đảm bảo đo chuẩn riêng biệt gắn với các đại lượng đầu vào (3.38) trong một mô hình đo (xem 4.7).
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 2.31, được sửa đổi - Chú thích bị xóa].
3.34
Độ chụm đo (precision of measurement)
Mức độ gần nhau giữa các số chỉ hoặc các giá trị đại lượng đo (3.38) nhận được bởi phép đo lặp trên các đối tượng như nhau hoặc tương tự nhau trong điều kiện quy định.
CHÚ THÍCH 1: Độ chụm đo thường được thể hiện về mặt số lượng bằng thước đo sự phân tán, như độ lệch chuẩn, phương sai, hoặc hệ số biến thiên trong điều kiện đo quy định.
CHÚ THÍCH 2: 'Điều kiện quy định' có thể là, ví dụ, điều kiện lặp lại của phép đo, điều kiện chụm trung gian của phép đo, hoặc điều kiện tái lập của phép đo (xem TCVN 6910-1 (ISO 5725-1)).
CHÚ THÍCH 3: Độ chụm đo được dùng để định nghĩa độ lặp lại đo, độ chụm đo trung gian và độ tái lặp đo.
CHÚ THÍCH 4: Đôi khi "độ chụm đo" được dùng không đúng theo nghĩa độ chính xác đo.
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 2.15]
3.35
Mẫu chuẩn đầu (primary reference material)
RM đầu (primary RM)
Vật liệu có độ tinh khiết cao của chất phân tích (3.1), được chứng nhận về khối lượng / phần mol của chất phân tích (3.1) trong vật liệu, và là vật liệu cấu thành việc thực hiện Hệ đơn vị quốc tế (SI) cho chất phân tích (3.1) quan tâm.
CHÚ THÍCH 1: Mẫu chuẩn đầu có giá trị của nó được ấn định trực tiếp bởi RMP đầu (3.36) hoặc gián tiếp bằng cách xác định các tạp chất của vật liệu bằng các phương pháp phân tích thích hợp (ví dụ: phương pháp cân bằng khối lượng).
3.36
Thủ tục đo quy chiếu đầu (primary reference measurement procedure)
RMP đầu (primary RMP)
Thủ tục đo quy chiếu (RMP) (3.40) được sử dụng để thu được kết quả đo không liên quan đến chuẩn đo lường (3.28) của một đại lượng (3.38) cùng loại.
VÍ DỤ Thể tích nước được phân phối bằng pipet 50 mL ở 20° C được đo bằng cách cần lượng nước do pipet đưa vào cốc, lấy khối lượng của cốc cộng với nước trừ đi khối lượng của cốc rỗng ban đầu và hiệu chính khối lượng chênh lệch đối với nhiệt độ nước thực tế bằng cách sử dụng khối lượng thể tích (khối lượng riêng).
CHÚ THÍCH 1: Thuật ngữ "RMP đầu" (3.36) như được sử dụng ở đây đề cập đến một bộ hướng dẫn đo lường chi tiết đầy đủ trong khi thuật ngữ "phương pháp đo chính" (3.30) được định nghĩa bởi Ủy ban Tư vấn về Lượng chất (CCQM) là mô tả chung về nguyên tắc đo hoặc phương pháp đo (3.30) bao gồm các quy trình khác nhau.
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 2.8, được sửa đổi - Chú thích 1 và Chú thích 2 đã bị xóa và Chú thích 1 cho mục nhập đã được thêm vào].
3.37
Chuẩn đo lường đầu (primary measurement standard)
Chuẩn đầu (primary standard)
Chất hiệu chuẩn đầu (primary calibrator)
Chuẩn đo lường (3.28) được thiết lập bằng cách sử dụng RMP chính (3.36), hoặc được tạo ra dưới dạng đồ tạo tác, được chọn theo quy ước.
VÍ DỤ 1 Chuẩn đo lường cơ bản của nồng độ lượng chất được điều chế bằng cách hòa tan một lượng chất đã biết của thành phần hóa học vào một thể tích dung dịch đã biết.
VÍ DỤ 2 Chuẩn đo lường đầu cho áp suất dựa trên các phép đo riêng biệt về lực và diện tích.
VÍ DỤ 3 Chuẩn đo lường đầu để đo tỷ lệ lượng chất đồng vị, được chuẩn bị bằng cách trộn lượng chất đã biết của các đồng vị cụ thể.
VÍ DỤ 4 Tế bào ba điểm nước làm chuẩn đo lường đầu của nhiệt độ nhiệt động lực học.
VÍ DỤ 5 Nguyên mẫu quốc tế của kilogam làm đồ tạo tác, được chọn theo quy ước.
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 5.4]
3.38
Đại lượng (quantity)
Thuộc tính của một hiện tượng, cơ thể hoặc chất, trong đó thuộc tính có độ lớn có thể được biểu thị dưới dạng một số và một tham chiếu.
VÍ DỤ 1: "Huyết tương (Máu) - Ion natri; nồng độ lượng chất bằng 143 mmol/L ở một người tại một thời điểm nhất định".
VÍ DỤ 2: Nồng độ số lượng hồng cầu trong mẫu máu (Máu toàn phần - hồng cầu; nồng độ số lượng bằng 5 x 106/uL ở một người nhất định tại một thời điểm nhất định).
CHÚ THÍCH 1: Định dạng IUPAC-IFCC ưa thích để chỉ định số lượng trong y học phòng thí nghiệm là "Hệ thống - Thành phần; loại - số lượng".
CHÚ THÍCH 2: Không được nhầm lẫn "lượng" với "chất phân tích" (3.1).
CHÚ THÍCH 3: Các MP (3.27) mà phép đo được thể hiện theo cách định tính (ví dụ; "có" hoặc "không có") so với tỷ lệ hoặc thang đếm với ngưỡng quyết định được xác định trước, phù hợp với định nghĩa này về số lượng kỳ hạn.
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 1.1, được sửa đổi - Chú thích 1 của Chú giải 6 đã bị xóa và Ví dụ 2, Chú thích 2 cho mục nhập và Chú thích 3 cho mục nhập đã được thêm vào].
3.39
Mẫu chuẩn (reference material - RM)
Vật liệu, đủ đồng nhất và ổn định với mốc quy chiếu về các tính chất xác định, được thiết lập phù hợp với việc sử dụng đã định trong phép đo hoặc trong việc kiểm tra các tính chất danh nghĩa.
VÍ DỤ 1: Ví dụ về mẫu chuẩn thể hiện các đại lượng (3.38):
a) nước có độ tinh khiết quy định, độ nhớt động của nó được dùng để hiệu chuẩn nhớt kế;
b) huyết thanh người không có giá trị đại lượng (3.38) được ấn định cho nồng độ lượng chất của cholesterol vốn có, chỉ dùng làm vật liệu kiểm soát chụm đo (3.11).
VÍ DỤ 2: Ví dụ về mẫu chuẩn thể hiện các tính chất danh nghĩa:
a) bảng màu cho một hoặc một số màu xác định;
b) Hợp chất DNA chứa một dãy nucleotide xác định;
c) urine chứa 19 - androstenedione.
VÍ DỤ 3: Chất đã biết điểm ba trong bình điểm ba.
VÍ DỤ 4: Thấu kính có mật độ quang học đã biết trong bộ kính lọc.
VÍ DỤ 5: Quả cầu có kích thước đồng đều lắp trên bàn trượt kính hiển vi.
VÍ DỤ 6: Huyết thanh người với giá trị đại lượng được ấn định cho nồng độ cholesterol (lượng chất) và độ không đảm bảo đo liên quan (3.48), được sử dụng làm chất chuẩn (3.6) hoặc vật liệu kiểm soát độ đúng của phép đo (3.46).
CHÚ THÍCH 1: Việc kiểm tra đặc tính danh nghĩa cung cấp giá trị đặc tính danh nghĩa và độ không đảm bảo đo liên quan. Độ không đảm bảo đo này không phải là độ không đảm bảo đo (3.48).
CHÚ THÍCH 2: Các RM có hoặc không có giá trị đại lượng được ấn định (3.38) có thể được sử dụng để kiểm soát độ chính xác phép đo trong khi chỉ những RM có giá tri đại lượng được ấn định (3.38) mới có thể được sử dụng để hiệu chuẩn (3.4) hoặc kiểm soát độ đúng của phép đo (3.46).
CHÚ THÍCH 3: “RM" bao gồm các vật liệu thể hiện các đại lượng (3.38) cũng như các thuộc tính danh nghĩa.
CHÚ THÍCH 4: RM đôi khi được kết hợp vào một hệ thống đo (3.29).
CHÚ THÍCH 5: Một số mẫu chuẩn có giá trị đại lượng (3.38) được ấn định có thể liên kết đo lường (3.31) tới đơn vị đo ngoài hệ đơn vị. Vật liệu như thế bao gồm các vắc-xin có Đơn vị Quốc tế (IU) đã được Tổ chức Y tế Thế giới (WHO) ấn định [29].
CHÚ THÍCH 6: Trong phép đo đã cho, một mẫu chuẩn xác định chỉ có thể sử dụng cho việc hiệu chuẩn (3.4) hoặc đảm bảo chất lượng.
CHÚ THÍCH 7: Quy định kỹ thuật của mẫu chuẩn cần bao gồm liên kết vật liệu, chỉ ra nguồn gốc và quá trình xử lý [25].
CHÚ THÍCH 8: ISO/REMCO có một định nghĩa tương tự [25] nhưng dùng thuật ngữ “quá trình đo” để chỉ ‘kiểm tra’ (xem TCVN ISO 15189 (ISO 15189)), bao hàm cả phép đo đại lượng (3.38) và kiểm tra tính chất danh nghĩa.
CHÚ THÍCH 9: Mẫu chuẩn, kèm theo tài liệu do cơ quan có thẩm quyền cấp và đề cập đến các quy trình hợp lệ được sử dụng để thu được giá trị đặc tính cụ thể với độ không đảm bảo đo liên quan (3.48) và liên kết đo lường (3.31), được gọi là CRM (3.9).
CHÚ THÍCH 10: Các yêu cầu đối với thông số kỹ thuật của RM dùng để hiệu chuẩn (3.4) của RMP (3.40) được mô tả trong ISO 15194.
CHÚ THÍCH 11: Việc sử dụng RM bao gồm hiệu chuẩn (3.4) hệ thống đo (3.29), đánh giá MP (3.27), ấn định giá trị cho các vật liệu khác và kiểm soát chất lượng. Xem thêm chuẩn đo lường (3.28).
CHÚ THÍCH 12: Ví dụ về RM bao hàm một đại lượng (3.38): Huyết tương máu chứa một phần khối lượng đã nêu của glucoza, được dùng làm chất chuẩn (3.6).
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 5.13, được sửa đổi - CHÚ THÍCH 3, loại trừ VÍ DỤ 1.c; CHÚ THÍCH 4: Đã thay thế "... thiết bị được chế tạo đặc biệt" bằng "... hệ thống đo"].
3.40
Thủ tục đo quy chiếu (reference measurement procedure)
RMP
Thủ tục đo (3.27) được chấp nhận để cung cấp kết quả đo phù hợp với việc sử dụng dự kiến trong việc đánh giá độ đúng đo (3.47) của giá trị đại lượng đo (3.38) được nhận từ những thủ tục đo khác (3.27) cho đại lượng (3.38) cùng loại, trong việc hiệu chuẩn (3.4), hoặc trong việc xác định đặc trưng mẫu chuẩn (3.39).
CHÚ THÍCH 1: Yêu cầu đối với RMP để sử dụng trong phân cấp hiệu chuẩn (3.5) hỗ trợ IVD MDs (3.21) được mô tả trong TCVN 13416 (ISO 15193).
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 2.7, đã được sửa đổi - Chú thích 1 cho mục nhập đã được bổ sung].
3.41
Hệ thống đo quy chiếu (reference measurement system)
Hệ thống đo (3.29) được chấp nhận là phù hợp với mục đích dự kiến của nó trong việc đánh giá hoặc thiết lập độ đúng của phép đo (3.47) đối với các giá trị đại lượng thu được từ các MP khác (3.27) đối với đại lượng đo (3.26); bao gồm (1) đơn vị đo, (2) định nghĩa về đại lượng đo (3.26), (3) RMP (s) (3.40), (4) RM (s) (3.39) và (5) một hoặc nhiều các phòng thí nghiệm cung cấp dịch vụ đo tham chiếu.
CHÚ THÍCH 1: Định nghĩa được lấy từ Tài liệu tham khảo [30].
3.42
Chuẩn đo lường thứ (secondary measurement standard)
Chuẩn thứ (secondary standard)
Chất hiệu chuẩn thứ (secondary calibrator)
Chuẩn đo lường (3.28) được thiết lập thông qua hiệu chuẩn (3.4) đối với chuẩn đo lường đầu (3.37) cho một đại lượng (3.38) cùng loại.
CHÚ THÍCH 1: Hiệu chuẩn (3.4) có thể được thực hiện trực tiếp giữa chuẩn đo lường đầu (3.37) và chuẩn đo lường thứ hoặc liên quan đến hệ thống đo trung gian (3.29) được hiệu chuẩn bởi chuẩn đo lường đầu (3.37) và gán kết quả đo cho chuẩn đo lường thứ.
CHÚ THÍCH 2: Chuẩn đo lường (3.28) có giá trị đại lượng được ấn định bởi tỷ lệ RMP đầu (3.36) là chuẩn đo lường thứ.
CHÚ THÍCH 3: Thuật ngữ áp dụng thay thế cho chất chuẩn thứ hoặc chất hiệu chuẩn (3.6), không có trong VIM 5.5, là "mẫu chuẩn thứ".
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 5.5, được sửa đổi - Chú thích 3 cho mục nhập đã được bổ sung]
3.43
Quy trình đo đã chọn của nhà sản xuất (manufacturer's selected measurement procedure)
MP đã chọn của nhà sản xuất (manufacturer's selected MP)
MP (3.27) được hiệu chuẩn bởi một hoặc nhiều mẫu chuẩn đầu (3.37) hoặc chuẩn thứ (3.42) khi có sẵn.
CHÚ THÍCH 1: Thông lượng và các tính năng "năng suất" mong muốn khác có thể khiến MP đã chọn (3.27) ít được mong muốn hơn để sử dụng trong cài đặt yêu cầu âm lượng cao hơn và thời gian quay vòng nhanh hơn. MP được chọn (3.27) cũng có thể là MP có giá trị lâm sàng đã được thiết lập, ngoài việc có các thuộc tính hiệu suất phân tích đã biết (và có thể chấp nhận được). Các MP được chọn (3.27) đôi khi được các nhà sản xuất (3.22) sử dụng làm điểm chuẩn nội bộ để hỗ trợ nghiên cứu và phát triển các MP mới (3.27) (nhằm mục đích thương mại hóa bởi nhà sản xuất (3.22)) và thường được sử dụng để hỗ trợ việc ấn định các giá trị đến các chất hiệu chuẩn "đang hoạt động" hoặc "chính" (3.51) để hỗ trợ việc ấn định giá trị thường xuyên của các chất hiệu chuẩn IVD-MD cho người dùng cuối "sản phẩm" (3.12) để sử dụng bởi một hoặc nhiều IVD-MD (3:21).
CHÚ THÍCH 2: MP đã chọn của nhà sản xuất có thể dựa trên nguyên tắc và phương pháp đo tương tự (3.30) như IVD MD (3.21) của người dùng cuối, nhưng hoạt động trong các điều kiện được kiểm soát chính xác hơn (ví dụ, số lượng lặp lại lớn hơn và/hoặc hệ thống kiểm soát chặt chẽ hơn) để giảm độ không đảm bảo đo (3.48) trong giá trị của đại lượng (3.38) được đo.
CHÚ THÍCH 3: MP được chọn của nhà sản xuất có thể dựa trên nguyên tắc và phương pháp đo tương tự (3.30) như của RMP bậc cao hơn (3.15) cho đại lượng đo (3.26).
3.44
Quy trình đo đã chọn của nhà sản xuất (manufacturer's selected measurement procedure)
MP đã chọn của nhà sản xuất (manufacturer's selected MP)
MP (3.27), được hiệu chuẩn bằng RM (3.39) hoặc bằng chất hiệu chuẩn đang hoạt động của nhà sản xuất (3.51), được sử dụng để đánh giá hoặc gán giá trị cho chất hiệu chuẩn của người dùng cuối (3.12).
CHÚ THÍCH 1: MP đã chọn của nhà sản xuất có thể dựa trên nguyên tắc và phương pháp đo tương tự (3.30) như IVD MD (3.21) của người dùng cuối, nhưng hoạt động trong các điều kiện được kiểm soát chính xác hơn (ví dụ: số lượng lặp lại lớn hơn và/hoặc hệ thống kiểm soát chặt chẽ hơn) để giảm độ không đảm bảo đo (3.48) trong giá trị của đại lượng (3.38) được đo.
3.45
Giá trị thực của đại lượng (true value of a quantity)
Giá trị thực (true value)
Giá trị đại lượng phù hợp với định nghĩa về đại lượng (3.38).
CHÚ THÍCH 1: Trong phương pháp tiếp cận sai số (tổng số) đề mô tả phép đo, một giá trị thực của đại lượng được coi là duy nhất và trong thực tế, không thể biết được. Phương pháp tiếp cận không chắc chắn là thừa nhận rằng, do định nghĩa về đại lượng không đầy đủ chi tiết (3.38), không có một giá trị thực của đại lượng nào mà là một tập hợp các giá trị thực của đại lượng phù hợp với định nghĩa. Tuy nhiên, về nguyên tắc và thực tế, bộ giá trị này là không thể biết được. Các cách tiếp cận khác phân biệt hoàn toàn với khái niệm giá trị thực của đại lượng và dựa vào khái niệm về tính tương thích đo lường của các kết quả đo để đánh giá tính hợp lệ của chúng.
CHÚ THÍCH 2: Trong trường hợp đặc biệt của một hằng số cơ bản, đại lượng (3.38) được coi là có một giá trị thực của đại lượng duy nhất.
CHÚ THÍCH 3: Khi độ không đảm bảo xác định liên quan đến đại lượng đo (3.26) được coi là không đáng kể so với các thành phần khác của độ không đảm bảo đo (3:48), đại lượng đo (3.26) có thể được coi là có giá trị đúng "về cơ bản là duy nhất" giá trị số lượng. Đây là cách tiếp cận được thực hiện bởi GUM và các tài liệu liên quan, trong đó từ "đúng" được coi là thừa.
CHÚ THÍCH 4: Khái niệm giá trị thực thừa nhận rằng do độ không đảm bảo đo cố hữu (3.48), giá trị thực không bao giờ có thể biết được.
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 2.11, đã được sửa đổi - Lưu ý 4 cho mục nhập đã được thêm vào]
3.46
Vật liệu kiểm soát độ đúng (trueness control material)
Kiểm soát độ đúng (trueness control)
RM (3.39) được sử dụng để đánh giá độ chệch đo lường (3.3) của một đại lượng xác định (3.38) trong một hệ thống đo cụ thể (3.29).
CHÚ THÍCH 1: Vật liệu kiểm soát độ đúng thường được chuẩn bị trong chất nền (3.24) được thiết kế để mô phỏng chất nền (3.24) của các mẫu bệnh phẩm người dự kiến.
CHÚ THÍCH 2: Các vật liệu kiểm soát độ đúng phải được đánh giá để thiết lập khả năng giao hoán của chúng (3.10) với mẫu bệnh phẩm người.
CHÚ THÍCH 3: Các nhà sản xuất (3.22) có thể cung cấp các vật liệu kiểm soát độ đúng dưới dạng CRM (3.9).
3.47
Độ đúng của phép đo (trueness of measurement)
Độ đúng đo (measurement trueness)
Độ đúng (trueness)
Mức độ gần nhau giữa trung bình của một số vô hạn các giá trị đại lượng đo được lặp lại và giá trị đại lượng quy chiếu
CHÚ THÍCH 1: Độ đúng của phép đo không phải là đại lượng và do đó không thể hiện bằng số, nhưng thước đo mức độ gần nhau được nêu trong TCVN 6910-1 (ISO 5725-1).
CHÚ THÍCH 2: Độ đúng của phép đo tỷ lệ nghịch với sai số đo hệ thống, nhưng không liên quan đến sai số đo ngẫu nhiên.
CHÚ THÍCH 3: Không được sử dụng "độ chính xác đo" cho "độ đúng đo" và ngược lại.
CHÚ THÍCH 4: Đối với các phép thử định tính, độ đúng của phép đo (mức độ gần đúng của thỏa thuận) có thể được biểu thị theo sự phù hợp (tức là phần trăm đồng ý với phép kiểm tra đối chứng).
CHÚ THÍCH 5: Độ đúng là một thuộc tính của MP (3.27) tham chiếu đánh giá độ chệch (3.3) của các phép đo so với giá trị kỳ vọng hoặc giá trị mục tiêu. Nó được mô tả định tính là tốt hoặc xấu. MP (3.27) có độ đúng tốt nếu độ chệch (3.3) của các phép đo thấp.
CHÚ THÍCH 6: Phép đo độ đúng thường được biểu thị dưới dạng độ chệch (3.3). Độ đúng đôi khi được gọi là "độ chính xác của giá trị trung bình".
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 2.14, đã được sửa đổi - Chú thích 3 và Chú thích 6 cho mục nhập đã được thêm vào. Lưu ý 6 được lấy từ ISO 16577:2016, 3.105]
3.48
Độ không đảm bảo của phép đo (uncertainty of measurement)
Độ không đảm bảo đo (measurement uncertainty)
Thông số không âm đặc trưng cho sự phân tán của các giá trị đại lượng được quy cho đại lượng đo (3.26), trên cơ sở thông tin đã sử dụng.
CHÚ THÍCH 1: Độ không đảm bảo đo bao gồm các thành phần xuất hiện từ những ảnh hưởng hệ thống, như thành phần gắn với sự hiệu chính và giá trị đại lượng được ấn định của chuẩn đo lường (3.28), cũng như độ không đảm bảo định nghĩa. Đôi khi các ảnh hưởng hệ thống đã ước lượng không được hiệu chính, nhưng thay thế là các thành phần độ không đảm bảo đo kèm theo được đưa vào.
CHÚ THÍCH 2: Thông số có thể là, ví dụ, độ lệch chuẩn được gọi là độ không đảm bảo chuẩn (hoặc một bội xác định của nó), hoặc nửa của khoảng, với xác suất phủ quy định.
CHÚ THÍCH 3: Nói chung, độ không đảm bảo đo bao gồm nhiều thành phần. Một số thành phần có thể đánh giá theo cách đánh giá loại A của độ không đảm bảo đo bằng phân bố thống kê của các giá trị đại lượng từ dãy các phép đo và có thể được đặc trưng bằng độ lệch chuẩn. Các thành phần khác có thể được đánh giá theo cách đánh giá loại B của độ không đảm bảo đo, cũng có thể đặc trưng bằng độ lệch chuẩn, được đánh giá từ hàm mật độ xác suất dựa trên kinh nghiệm hoặc thông tin khác.
CHÚ THÍCH 4: Nói chung, đối với một tập hợp thông tin đã cho, độ không đảm bảo đo được gắn với một giá trị đại lượng đã ấn định quy cho đại lượng đo (3.26). Sự thay đổi của giá trị này dẫn đến sự thay đổi của độ không đảm bảo kèm theo.
CHÚ THÍCH 5: Đánh giá độ không đảm bảo đo loại A được định nghĩa là đánh giá thành phần của độ không đảm bảo đo bằng phân tích thống kê các giá trị đại lượng đo thu được trong các điều kiện đo xác định [điều chỉnh theo VIM, 2.28].
CHÚ THÍCH 6: Đánh giá loại B về độ không đảm bảo đo được định nghĩa là đánh giá thành phần của độ không đảm bảo đo được xác định bằng các phương tiện khác với đánh giá loại A. Điều này có thể bao gồm độ lệch chuẩn (a) thu được từ thông tin liên quan đến giá trị đại lượng được công bố có thẩm quyền, (b) liên quan đến giá trị số lượng của CRM (3.9), (c) thu được từ chứng chỉ hiệu chuẩn (3.4), (d) thu được từ kinh nghiệm hoặc các phương tiện khác [phỏng theo VIM, 2.29].
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 2.26].
3.49
Đánh giá xác nhận (validation)
Kiểm định (3.50), trong đó các yêu cầu quy định là thỏa đáng với mục đích sử dụng.
VÍ DỤ 1: Một MP (3.27), thường được sử dụng để đo nồng độ khối lượng của nitơ trong nước, cũng có thể được xác nhận để đo nồng độ khối lượng của nitơ trong huyết thanh người.
VÍ DỤ 2: Một MP (3.27) cho nồng độ creatinin (khối lượng) trong huyết thanh người cũng có thể được xác nhận để đo nồng độ creatinin (khối lượng) trong nước tiểu người.
VÍ DỤ 3: Một MP (3.27) để đo nồng độ PSA (khối lượng) trong huyết thanh để hỗ trợ chẩn đoán ung thư tuyến tiền liệt ở nam giới trên 40 tuổi.
CHÚ THÍCH 1: ISO 9000 định nghĩa xác nhận là xác nhận, thông qua việc cung cấp bằng chứng khách quan rằng các yêu cầu đối với mục đích sử dụng hoặc ứng dụng cụ thể đã được đáp ứng.
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 2.45, được sửa đổi - Ví dụ 2, Ví dụ 3 và Chú thích 1 cho mục nhập đã được thêm vào. Ví dụ 2 và Chú giải 1 của mục nhập lấy từ ISO 18113- 1:2009, 3.72].
3.50
Kiểm định (verification)
Việc cung cấp bằng chứng khách quan rằng đối tượng đã cho đáp ứng các yêu cầu quy định.
VÍ DỤ 1: Xác nhận rằng RM (3.39) đã cho như công bố là đồng nhất đối với giá trị đại lượng và MP (3.27) liên quan, đối với phần đo có khối lượng 10 mg.
VÍ DỤ 2: Xác nhận rằng đạt được các đặc tính hiệu suất hoặc các yêu cầu pháp lý của hệ thống đo (3.29).
VÍ DỤ 3: Xác nhận rằng có thể đáp ứng độ không đảm bảo đo mục tiêu (3.48).
CHÚ THÍCH 1: Khi áp dụng, cần xem xét độ không đảm bảo đo (3.48).
CHÚ THÍCH 2: Mặt hàng có thể là, ví dụ: một quy trình, MP (3.27), vật liệu, hợp chất hoặc hệ thống đo (3.29).
CHÚ THÍCH 3: Các yêu cầu cụ thể có thể là, ví dụ: đáp ứng các thông số kỹ thuật (3.22) của nhà sản xuất.
CHÚ THÍCH 4: Kiểm định trong đo lường hợp pháp (3.32), như được định nghĩa trong OIML V1:2013, và trong đánh giá sự phù hợp nói chung, liên quan đến việc kiểm tra và đánh dấu và/hoặc cấp chứng chỉ kiểm định cho một hệ thống đo (3.29).
CHÚ THÍCH 5: Không nên nhầm lẫn kiểm định với hiệu chuẩn (3.4). Không bao giờ y verifyf ication là xác nhận (3.49).
CHÚ THÍCH 6: Trong hóa học, việc kiểm định danh tính của thực thể liên quan hoặc hoạt động, yêu cầu mô tả cấu trúc hoặc đặc tính của thực thể hoặc hoạt động đó.
CHÚ THÍCH 7: Kiểm định là quá trình phòng thí nghiệm xác nhận rằng các tuyên bố về hiệu suất đã thiết lập của IVD (ví dụ: độ chính xác, độ chụm, phạm vi có thể báo cáo) có thể được lặp lại trong phòng thí nghiệm trước khi thực hiện thử nghiệm mẫu bệnh phẩm người.
CHÚ THÍCH 8: Việc kiểm định có thể đủ để thực hiện IVD mới trong các trường hợp mà phép thử được thực hiện và sử dụng theo cách như được chỉ dẫn trong tờ hướng dẫn sử dụng.
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 2.44, được sửa đổi - Chú thích 7 cho mục nhập và Chú thích 8 cho mục nhập đã được thêm vào].
3.51
Chuẩn đo lường công tác (working measurement standard)
Chuẩn công tác (working standard)
Chất hiệu chuẩn công tác của nhà sản xuất (manufacturer's working calibrator)
Chất hiệu chuẩn chính của nhà sản xuất (manufacturer's master calibrator)
Chuẩn đo lường (3.28) được sử dụng để hiệu chuẩn hoặc kiểm định dụng cụ đo lường hoặc hệ thống đo (3.29).
CHÚ THÍCH 1: Chuẩn đo lường đang hoạt động thường được hiệu chuẩn (giá trị được ấn định) với tham chiếu đến chuẩn đo lường tham chiếu (3.28).
CHÚ THÍCH 2: Liên quan đến kiểm định (3.50), các thuật ngữ "tiêu chuẩn kiểm tra" hoặc "tiêu chuẩn kiểm soát" đôi khi cũng được sử dụng.
CHÚ THÍCH 3: Nhà sản xuất (3.22) có thể chọn chuẩn bị chất hiệu chuẩn đang hoạt động của nhà sản xuất, nhằm mục đích chuyển độ đúng (3.47) bằng cách hiệu chuẩn (3.4) sang chất hiệu chuẩn IVD-MD của người dùng cuối (3.12).
CHÚ THÍCH 4: Chuẩn đo lường đang hoạt động đôi khi được thực hiện dưới dạng RM thay thế (3.39) thay cho RM bậc cao hơn đắt tiền hơn (3.14).
[NGUỒN: TCVN 6165:2009 (ISO/IEC Guide 99:2007) 5.7, được sửa đổi - Chú thích 3 và Chú thích 4 được thêm vào]
4 Yêu cầu chung nhà sản xuất phải đáp ứng để thiết lập, xác nhận và lập hồ sơ liên kết đo lường của các giá trị mẫu bệnh phẩm người được xác định với IVD MD quy định
4.1 Yêu cầu đối với việc lập hồ sơ liên kết đo lường của các giá trị đại lượng đo
Nhà sản xuất phải ghi lại sơ đồ hiệu chuẩn hoàn chỉnh và xác định tham chiếu đo lường cao nhất mà các giá trị đại lượng đo được kết quả có thể theo dõi được, phù hợp với các yêu cầu nêu trong tiêu chuẩn này.
Tài liệu của nhà sản xuất liên quan đến liên kết đo lường của các giá trị đại lượng đo được trong mẫu bệnh phẩm người với IVD MD cụ thể phải bao gồm:
a) Mô tả hệ thống đo chuẩn, bao gồm các yếu tố sau:
I. Hệ thống đơn vị áp dụng (ví dụ SI, IU, tùy ý hoặc khác) và định nghĩa của đại lượng đo;
II. MP bậc cao nhất, nếu có, hoặc các giao thức để thiết lập hiệu chuẩn có thể theo dõi đo lường cho IVD MD;
CHÚ THÍCH 1: "Các giao thức" trong phần "ii." Bao gồm các giao thức được xác định bởi một cơ quan được ủy quyền hoặc bởi cơ quan có thẩm quyền khác (ví dụ: một cơ quan chuyên môn quốc tế).
III. RM để hiệu chuẩn bất kỳ MP nào trong "ii" (nếu có);
IV. Các phòng thí nghiệm tham chiếu và/hoặc mạng lưới phòng thí nghiệm, được chỉ định bởi các viện đo lường quốc gia, cơ quan chuyên môn, cơ quan công nhận hoặc cơ quan có thẩm quyền khác để có khả năng cung cấp phù hợp cho mục đích kiểm tra đại lượng đo trong các mẫu bệnh phẩm người dự kiến.
CHÚ THÍCH 2: Các phòng thử nghiệm trong phạm vi của "iv." Bao gồm các phòng thử nghiệm hiệu chuẩn hoặc tham chiếu được điều hành bởi (hoặc thay mặt) một nhà sản xuất.
b) Mô tả sơ đồ hiệu chuẩn, thường bao gồm các cặp MP và RM xen kẽ, thiết lập một chuỗi chuyển giá trị không bị gián đoạn, bắt đầu với phần từ hệ quy chiếu bậc cao nhất hiện có (xem 4.1.a) và đạt đến đỉnh điểm là các giá trị đại lượng đo được đối với con người mẫu bằng IVD MD.
c) Thông số kỹ thuật cho Umax(y) đối với IVD MD (nghĩa là giới hạn đặc điểm kỹ thuật trên của độ không đảm bảo đo, xem 3.25). Độ không đảm bảo đo mở rộng kết hợp ước tính, U(y) (xem 4.3.2), phải được lập thành văn bản để không vượt quá Umax(y). Đánh giá này phải bao gồm ước tính về độ không đảm bảo đo chuẩn tổng hợp, u(y) (3.33), của các giá trị đo cuối cùng trên mẫu bệnh phẩm người đối với IVD MD được chỉ định. Việc ước lượng u(y) (3.33) sẽ tính đến (và ghi lại) ucal của (các) giá trị được chỉ định cho bát kỳ chất hiệu chuẩn nào được sử dụng để hiệu chuẩn IVD MD, bất kể việc hiệu chuẩn cuối cùng của IVD MD có được thực hiện hay không - người sử dụng IVD MD hoặc của nhà sản xuất IVD MD (đôi khi được gọi là "hiệu chuẩn nhà máy")
d) Mô tả tóm tắt về (các) nghiên cứu xác nhận hỗ trợ tuyên bố về liên kết đo lường của các giá trị đại lượng đo cuối cùng được chỉ định cho mẫu bệnh phẩm người, sử dụng IVD MD được chỉ định.
4.2 Định nghĩa đại lượng đo
Đại lượng đo phải được xác định và mô tả theo các đặc điểm sau và được bao gồm trong tài liệu của nhà sản xuất:
a) tên của chất phân tích (ví dụ β-D-glucose).
b) hệ thống sinh học (ví dụ huyết tương người). Việc sử dụng y tế dự kiến liên quan đến một quyết định y tế cụ thể phải được tính đến.
VÍ DỤ Human chorionic gonadotropin (total β-hCG) trong huyết tương người, dùng để phát hiện mang thai hoặc để phát hiện và theo dõi khối u.
c) loại số lượng (ví dụ: lượng chất).
d) đơn vị đo lường (ví dụ: mmol/L).
e) trong trường hợp đại lượng đo được xác định bởi một MP cụ thể, giao thức đo lường hoặc một nhóm MP (tức là đại lượng đo được xác định trong hoạt động), MP hoặc các giao thức phải được nêu rõ. MP, mẫu hiệu chuẩn hoặc giao thức cần thiết cho định nghĩa của đại lượng đo cụ thể phải có sẵn để nhân viên phòng thí nghiệm có trình độ thích hợp tiếp cận và sử dụng chung.
4.3 Các thông số kỹ thuật đối với độ không đảm bảo đo mở rộng tối đa cho phép, Umax(y)
4.3.1 Yêu cầu chung
Umax(y) cho IVD MD phải được nhà sản xuất thiết lập cho các phép đo sử dụng IVD MD trong cài đặt dự kiến của nó với các mẫu bệnh phẩm người dự kiến và tối thiểu trong khoảng thời gian đo khi đưa ra các quyết định y tế. Thông số kỹ thuật cho Umax (y) phải được bao gồm trong tài liệu của nhà sản xuất về phân cấp hiệu chuẩn cho IVD MD.
4.3.2 Phạm vi của đặc điểm kỹ thuật
Thông số kỹ thuật Umax(y) do nhà sản xuất IVD MD thiết lập phải tính đến độ không đảm bảo đo kết hợp liên quan đến tất cả các bước trong Sơ đồ hiệu chuẩn cho IVD MD, cho đến và bao gồm cả việc ấn định giá trị của các máy hiệu chuẩn IVD MD của người dùng cuối đến mức đóng góp của độ không đảm bảo dự kiến do việc sử dụng IVD MD thường xuyên, tối thiểu trong các điều kiện lặp lại.
CHÚ THÍCH 1: Thông số kỹ thuật Umax (y) cho IVD MD là thông số kỹ thuật cho độ không đảm bảo đo tối đa cho phép mở rộng (k = 2) kết hợp bao gồm tất cả các bước trong Sơ đồ hiệu chuẩn, bao gồm cả phép đo cuối cùng trên mẫu bệnh phẩm người. Các chiến lược thiết lập Umax (y) cho IVD MD đã là chủ đề trọng tâm của nhiều hội nghị quốc tế khác nhau [31] - [34].
4.4 Xác định sơ đồ hiệu chuẩn
4.4.1 Yêu cầu chung
Sơ đồ hiệu chuẩn phải được định nghĩa là một chuỗi các hiệu chuẩn liên tiếp và ấn định giá trị, xen kẽ giữa các MP và RM phù hợp với mục đích (chuẩn đo lường hoặc hiệu chuẩn), bắt đầu bằng chuẩn đo lường và/hoặc MP và kết thúc bằng các giá trị cho đại lượng đo trong mẫu bệnh phẩm người dự kiến được xác định với IVD MD cho người dùng cuối. Tài liệu kỹ thuật của sơ đồ hiệu chuẩn phải bao gồm một biểu diễn đồ họa (tức là một hình hoặc hình minh họa khác) mô tả mối liên hệ từ các kết quả cuối cùng trên các mẫu bệnh phẩm người được kiểm tra với IVD MD được chỉ định cho đến tham chiếu đo lường cao nhất hiện có.
CHÚ THÍCH 1: Tùy thuộc vào sự sẵn có của các tham chiếu bậc cao hơn (vật liệu và MP) cho một đại lượng đo nhất định, các phân cấp hiệu chuẩn khác nhau và các mô hình truyền giá trị có sẵn (xem Điều 5).
CHÚ THÍCH 2: Kết quả (kết quả) của mỗi lần hiệu chuẩn liên tiếp trong hệ thống phân cấp phụ thuộc vào kết quả (kết quả) của lần hiệu chuẩn trước đó (xem Điều 5).
CHÚ THÍCH 3: Đối với các đại lượng đo nhất định, đại lượng được đo thay đổi ở các bước khác nhau trong toàn bộ phân cấp hiệu chuẩn.
VÍ DỤ 1 Đối với một số protein nhất định trong huyết thanh, số lượng được đo có thể là lượng chất của một peptit xác định có nguồn gốc từ protein quan tâm hoặc lượng chất của một biểu mô chức năng.
VÍ DỤ 2 Đối với β-D-glucose trong huyết thanh, đại lượng được đo có thể là một đoạn khối lượng của dẫn xuất β-D-glucose được xác định bằng phương pháp khối phổ, hoặc sản phẩm của sự phân hủy enzym (β-D- glucose (ví dụ: H2O2 khi sử dụng quy trình glucose oxidase).
4.4.2 Số lượng đo được
Đối với mỗi bước trong sơ đồ hiệu chuẩn được xác định nếu thực tế, đại lượng được đo trong RM áp dụng (hoặc mẫu bệnh phẩm người, trong trường hợp các phép đo cuối cùng với IVD MD) sẽ được xác định và mối quan hệ giữa đại lượng đo (hoặc các đại lượng) và đại lượng đo sẽ được thiết lập.
4.4.3 Liên kết đo lường cao nhất
Đối với một đại lượng đo nhất định, MP, giao thức đo hoặc vật liệu hiệu chuẩn được đặt cao nhất về mặt đo lường trong sơ đồ hiệu chuẩn phải được xác định và phải xác định mức độ liên kết đo lường cao nhất cho hệ thống đo đã nêu.
4.4.4 Liên kết đối với SI
Đối với IVD MD yêu cầu liên kết đo lường của các giá trị được báo cáo đối với mẫu bệnh phẩm người cho SI, sơ đồ hiệu chuẩn xác định phải được hỗ trợ bởi các tham chiếu bậc cao hơn có sẵn, bao gồm một hoặc cả hai RM (áp dụng các yêu cầu của ISO 15194) và RMP (các yêu cầu của TCVN 13416 (ISO 15193) phải áp dụng) cho phép thực hiện đơn vị đo SI thích hợp cho đại lượng đo tương ứng.
4.4.5 MD IVD có thể theo dõi không phải SI
Để yêu cầu khả năng liên kết đo lường đối với hiệu chuẩn và các giá trị được báo cáo (ví dụ: đơn vị tùy ý hoặc đơn vị quy ước Quốc tế) sử dụng IVD MD có thể theo dõi không phải SI, Sơ đồ hiệu chuẩn cho IVD MD phải được xác định theo cách cho phép thực hiện nhất quán giá trị tương ứng (không SI) đơn vị đo.
4.4.6 Số cấp trong hệ thống phân cấp được chỉ định
Các bên thực hiện phân cấp hiệu chuẩn có thể sửa đổi số lượng các mức (tức là số cặp MP và chất hiệu chuẩn liên tiếp) trong Sơ đồ hiệu chuẩn, với điều kiện là các thay đổi được xác nhận và giữ lại các phần tử cao nhất về mặt đo lường của phân cấp (xem Điều 5).
4.5 Lựa chọn và yêu cầu đối với RM và chất hiệu chuẩn
4.5.1 Yêu cầu chung
Các chất hiệu chuẩn (chuẩn đo lường) được sử dụng ở mỗi bước trong sơ đồ hiệu chuẩn phải được bên chịu trách nhiệm về một bước hiệu chuẩn nhất định lập thành văn bản để phù hợp với mục đích. Cơ sở lý luận cho việc lựa chọn từng chất hiệu chuẩn trong sơ đồ hiệu chuẩn phải được bao gồm trong tài liệu của nhà sản xuất IVD MD.
4.5.2 Các đặc điểm cần được lập thành tài liệu
Đối với mỗi chất hiệu chuẩn hoặc RM được áp dụng trong sơ đồ hiệu chuẩn xác định cho IVD MD cụ thể (không bao gồm các chất hiệu chuẩn IVD MD dành cho người dùng cuối), các đặc điểm sau phải được xác định và ghi lại, và tính nhất quán của chúng được đảm bảo trong các lô thay thế:
a) Mục đích sử dụng của vật liệu;
b) Nhận dạng của chất phân tích (xác định là dạng nguyên tử hoặc dạng phân tử có thể áp dụng và/hoặc dạng thay thế hóa học của chất phân tích);
c) Nguồn gốc của vật liệu (ví dụ tổng hợp, tái tổ hợp, vi sinh vật, người hoặc động vật);
d) (Các) pha (khí, lỏng, rắn);
e) (Các) trạng thái tập hợp (dung dịch, dịch treo, đông khô);
f) Chất nền của vật liệu (ví dụ nước, dung môi khác, dung dịch đệm, dung dịch protein, mẫu bệnh phẩm người);
g) Các giá trị được ấn định và liên kết đo lường của chúng;
h) Độ không đảm bảo đo mở rộng, U (y), của các giá trị được ấn định RM;
CHÚ THÍCH 1: Độ không đảm bảo đo mở rộng, U(y), chia cho hệ số phù (báo cáo trên chứng chỉ RM), là độ không đảm bảo đo chuẩn, u(y), được sử dụng để tính toán thêm độ không đảm bảo đo kết hợp.
CHÚ THÍCH 2: Đối với mẫu chuẩn không được chứng nhận (3.39) hoặc chất hiệu chuẩn, độ không đảm bảo đo chuẩn của giá trị ấn định và hệ số phủ tương ứng đôi khi được biểu thị dưới dạng phân bố mật độ xác suất của giá trị ấn định.
e) Tính ổn định;
f) Tính đồng nhất trong lô;
g) Đặc tính giao hoán;
h) Sự công nhận nếu có (ví dụ quốc tế, khu vực, quốc gia);
i) Cơ quan cấp nếu có (ví dụ: WHO, JISC, EU-JRC, NIST);
j) Tình trạng chứng chỉ (chứng nhận, không chứng nhận).
4.5.3 RM thứ tự cao hơn phù hợp với ISO 15194
Khi các RM bậc cao hơn được yêu cầu cho các bước cụ thể trong Sơ đồ hiệu chuẩn, các vật liệu đó phù hợp với các yêu cầu của ISO 15194 sẽ được sử dụng khi phù hợp và sẵn có. Tài liệu về trạng thái tuân thủ ISO 15194 của bất kỳ RM áp dụng nào bao gồm các giai đoạn khác nhau trong sơ đồ hiệu chuẩn cho IVD MD sẽ được bao gồm (hoặc tham chiếu) trong hồ sơ kỹ thuật của nhà sản xuất IVD MD.
CHÚ THÍCH: Ban kỹ thuật về liên kết trong y học phòng thí nghiệm (JCTLM) liệt kê [28] RM phù hợp với các yêu cầu của ISO 15194.
4.5.4 RM không phù hợp với ISO 15194
Trong trường hợp các RM tuân thủ ISO 15194 không có sẵn hoặc nếu các CRM có sẵn không phù hợp vì các lý do khác (ví dụ, tính khả chuyển không được thiết lập hoặc không đạt yêu cầu) các RM khác không đáp ứng tất cả các yêu cầu của ISO 15194 có thể được áp dụng ở các cấp cao hơn (cao nhất) trong một Sơ đồ hiệu chuẩn cụ thể cho IVD MD, miễn là các bên chịu trách nhiệm thiết lập sơ đồ hiệu chuẩn đã chứng minh (với bằng chứng tài liệu) về sự phù hợp với mục đích và đặc điểm hoạt động của các RM đó. Tài liệu về các RM đó như được định nghĩa trong điều này sẽ đề cập đến các đặc tính của vật liệu như quy định trong 4.5.2.
4.5.5 Tính khả chuyển của RM
Nếu có thể, khả năng chuyển đổi của RM so với mẫu bệnh phẩm người phải được lập thành văn bản để phù hợp với mục đích sử dụng tại vị trí của nó trong phân cấp hiệu chuẩn của IVD MD.
CHÚ THÍCH: Các MP bao gồm các MP được sử dụng để đặc trưng và/hoặc chuẩn bị RM chính (ví dụ như chất tinh khiết) và các chất hiệu chuẩn đầu (xem Điều 5, Hình 1 và 3, m.1 và m.2) thường không thể được áp dụng cho các mẫu bệnh phẩm người theo yêu cầu khi thực hiện các đánh giá khả năng giao hoán, do đó không cần đánh giá tính khả chuyển đối với các RM như vậy ở các mức này (Điều 5, Hình 1 và 3, m.1 và m.2) trong sơ đồ hiệu chuẩn.
4.5.6 Ngoại lệ đối với các yêu cầu đánh giá khả năng đi lại
Khi có sẵn RMP cho đại lượng đo (xem Điều 5, Hình 1, 2 và 3, p.3), mức đầu tiên mà khả năng giao hoán của RM có thể được đánh giá là ở mức mà RM thứ (chất nền) hoặc thứ khác máy hiệu chuẩn (Điều 5, Hình 1, 2 và 3, m.3), ví dụ CRM, được sử dụng trong phân cấp hiệu chuẩn, như trong trường hợp của chất hiệu chuẩn cho MP đã chọn của nhà sản xuất (Điều 5, Hình 1, 2 và 3, p.4). Đối với các bước tiếp theo xuống sâu hơn trong phân cấp hiệu chuẩn, chẳng hạn như ở bước chuyển giao giá trị, sử dụng mẫu hiệu chuẩn đang hoạt động (Điều 5, Hình 1, 2 và 3, m.4) để hiệu chuẩn MP đã chọn của nhà sản xuất (Điều 5, Hình 1, 2 và 3, p.5), tính khả chuyển của RM/chất hiệu chuẩn công tác (Điều 5, Hình 1, 2 và 3, m.4) phải được đánh giá để đảm bảo chuyển giá trị thích hợp và tránh sai lệch.
4.5.7 Ứng dụng của một CRM không thể chuyển đổi
Nếu CRM (Điều 5, Hình 1, 2 và 3, m.3) hoặc chất hiệu chuẩn thông thường quốc tế nhằm hiệu chuẩn MP đã chọn của nhà sản xuất (Điều 5, Hình 1, 2 và 3, p.4) chứng tỏ khả năng giao hoán với con người, các mẫu khi được đo bởi một số chứ không phải tất cả IVD MD của người dùng cuối nhằm mục đích kiểm tra đại lượng đo đã nêu, CRM vẫn có thể được sử dụng như một chất hiệu chuẩn trong phân cấp hiệu chuẩn cho một IVD MD cụ thể mà RM không chứng minh được khả năng chuyển đổi so với dự kiến, mẫu bệnh phẩm người, bằng cách áp dụng hệ số hoặc chức năng hiệu chính đối với giá trị được ấn định của CRM. Nếu có thể áp dụng, các chi tiết về việc sử dụng và xác nhận hiệu chính đó đối với các giá trị được ấn định của CRM hoặc các RM khác như các chất hiệu chuẩn thông thường quốc tế phải được tiết lộ trong tài liệu của sơ đồ hiệu chuẩn cho IVD MD được chỉ định và ucal của các giá trị được chỉ định cho (các) hiệu chuẩn IVD MD cho người dùng cuối phải bao gồm bất kỳ độ không đảm bảo đo gia tăng nào liên quan đến hệ số hoặc chức năng hiệu chính.
4.5.8 RM thay thế
Trong trường hợp không có CRM có thể chuyển đổi hoặc các chất hiệu chuẩn thông thường quốc tế, cơ sở lý luận phải được lập thành văn bản để lựa chọn bất kỳ RM thay thế nào (được sử dụng làm chất hiệu chuẩn) ở mỗi giai đoạn áp dụng trong sơ đồ hiệu chuẩn. Các RM thay thế phải được lập thành văn bản để phù hợp với mục đích đã định của chúng, mỗi RM phải có giá trị ấn định với độ không đảm bảo đo chuẩn và phải được chứng minh là có thể thay thế được với các mẫu bệnh phẩm người dự kiến trong mỗi bước chuyển hiệu chuẩn mà chúng được triển khai. Tài liệu kỹ thuật cho các RM thay thế như vậy phải bao gồm các đặc tính thích hợp như được nêu trong 4.5.2.
CHÚ THÍCH 1: RM thay thế bao gồm các tấm và/hoặc bể chứa các mẫu bệnh phẩm người riêng lẻ, các mẫu bổ sung hoặc mẫu "có gai" được chuẩn bị bằng chất nền tự nhiên hoặc nhân tạo, hoặc các vật liệu thích hợp khác.
CHÚ THÍCH 2: Để biết hướng dẫn về việc lựa chọn thích hợp các thành viên bảng mẫu bệnh phẩm người để sử dụng trong Sơ đồ hiệu chuẩn, hãy xem CLSI EP09-A3, EP14-A3 và EP30-A.
CHÚ THÍCH 3: Mẫu bệnh phẩm người được giả định là có thể chuyển đổi được khi được bảo quản trong các điều kiện đã được xác nhận là không làm thay đổi độ ổn định của đại lượng đo hoặc chất nền.
CHÚ THÍCH 4: Việc xác nhận các điều kiện bảo quản đối với mẫu bệnh phẩm người, đối với một đại lượng đo cụ thể, có thể được thực hiện với bảng đại diện gồm các mẫu bệnh phẩm người riêng lẻ. Việc xác nhận các điều kiện bảo quản như vậy đối với các bảng mẫu của con người có thể được sử dụng để hỗ trợ việc sử dụng các bảng mẫu tiếp theo, được lấy từ những người có hồ sơ sức khỏe/bệnh tật tương tự, để duy trì sơ đồ hiệu chuẩn cho IVD MD được chỉ định, không yêu cầu xác nhận tính khả chuyển của tấm mẫu.
4.5.9 Tăng cường các RM thay thế
Trong trường hợp các tấm mẫu của người được triển khai làm RM thay thế trong sơ đồ hiệu chuẩn cho IVD MD cụ thể, nếu chất phân tích trong mẫu bệnh phẩm người (tấm hoặc bể) được sử dụng làm RM cần được sửa đổi bằng cách tăng thêm hoặc làm cạn kiệt để đạt được các giá trị số lượng thích hợp, khả năng giao hoán của các mẫu sửa đổi phải được xác nhận. Khi xác định được các nhiễu cụ thể của mẫu hoặc các giới hạn không chọn lọc của MP, các mẫu bệnh phẩm người riêng lẻ có các hạn chế này sẽ bị loại ra khỏi bảng mẫu bệnh phẩm người được thiết kế để sử dụng làm mẫu hiệu chuẩn trong sơ đồ hiệu chuẩn.
4.5.10 Bộ hiệu chuẩn IVD MD dành cho người dùng cuối không thể chuyển đổi
Khi các vật liệu không thể chuyển đổi được sử dụng làm hiệu chuẩn cho người dùng cuối (xem Hình 1 đến Hình 6, m.5) cho IVD MD, các vật liệu có thể giao hoán (ví dụ bảng mẫu bệnh phẩm người) sẽ được sử dụng trong Sơ đồ hiệu chuẩn để xác định hiệu chính hệ số hoặc chức năng hiệu chính để gán các giá trị tùy ý cho bộ hiệu chuẩn IVD MD của người dùng cuối không thể giao hoán để bù đắp cho bất kỳ sai lệch nào do tính không thể giao hoán. Nếu có thể áp dụng, chi tiết về việc sử dụng và xác nhận hiệu chính đó đối với các giá trị được chỉ định của chất hiệu chuẩn IVD MD dành cho người dùng cuối không thể chuyển đổi phải được tiết lộ trong tài liệu của Sơ đồ hiệu chuẩn cho IVD MD được chỉ định và ucal của các giá trị được chỉ định cho (các) hiệu chuẩn IVD MD cho người dùng cuối phải bao gồm bất kỳ độ không đảm bảo đo gia tăng nào liên quan đến hệ số hoặc chức năng hiệu chính.
4.6 Lựa chọn và yêu cầu đối với các MP
4.6.1 Cơ sở lý luận cho việc lựa chọn các MP và trách nhiệm lập hồ sơ
Mỗi bước chuyển giá trị tuần tự trong sơ đồ hiệu chuẩn phải bao gồm một MP xác định phù hợp với mục đích. Cơ sở lý luận để lựa chọn các MP ở mỗi cấp của sơ đồ hiệu chuẩn đã thiết lập phải được bao gồm trong tài liệu của nhà sản xuất IVD MD và phải kèm theo dữ liệu hỗ trợ chứng minh rằng các đặc tính hiệu suất phân tích của mỗi MP đáp ứng các yêu cầu về hiệu suất (tức là phù hợp với mục đích). Các phần tử của tài liệu cho một MP nhất định trong sơ đồ hiệu chuẩn có thể được lấy từ bên thứ ba, ví dụ như từ nhà phát triển MP hiện hành.
4.6.2 Tình trạng đo lường của các MP
Các MP ở mỗi cấp của sơ đồ hiệu chuẩn xác định phải được xác định về trạng thái đo lường của chúng. Các RMP bao gồm các phần tử của sơ đồ hiệu chuẩn theo các mô hình được mô tả trong Điều 5 và đáp ứng các yêu cầu của TCVN 13416 (ISO 15193) sẽ được coi là các MP của thứ tự đo lường cao hơn. Các RMP bậc cao khác nhau có thể được triển khai ở các bước khác nhau trong hệ thống phân cấp. Trong trường hợp không có các RMP phù hợp với TCVN 13416 (ISO 15193), các MP không đáp ứng các yêu cầu của TCVN 13416 (ISO 15193) vẫn có thể được áp dụng trong hệ thống phân cấp (ví dụ: MP được chọn của nhà sản xuất hoặc MP thường trực của nhà sản xuất), miễn là các bên chịu trách nhiệm về Sơ đồ hiệu chuẩn đã chứng minh (với bằng chứng tài liệu) sự phù hợp với mục đích và đặc điểm hoạt động của các MP liên quan.
VÍ DỤ: Trong phân cấp hiệu chuẩn cho một đại lượng đo cụ thể, RMP bậc cao hơn có thể theo dõi SI, được hiệu chuẩn bằng CRM, được triển khai ở cấp cao nhất trong phân cấp hiệu chuẩn, ở các mức tiếp theo (thấp hơn) trong sơ đồ hiệu chuẩn, các bước chuyển giá trị để gán giá trị cho các chất hiệu chuẩn thương mại được giới thiệu để triển khai các MP cấp thấp hơn về mặt đo lường (ví dụ: RMP thông thường quốc tế, MP được lựa chọn của nhà sản xuất và/hoặc MP thường trực của nhả sản xuất), được hiệu chuẩn bằng các chất hiệu chuẩn thứ (có hoặc không có chứng nhận).
CHÚ THÍCH 1: Một số MP là một phần của sơ đồ hiệu chuẩn, đặc biệt là ở các cấp thấp hơn của sơ đồ hiệu chuẩn, dựa trên nguyên tắc tương tự như IVD MD của người dùng cuối (ví dụ: MP thường trực của nhà sản xuất).
CHÚ THÍCH 2: Các mô tả đầy đủ về RMP bậc cao thiết lập liên kết đối với các đơn vị đo lường SI và phù hợp với TCVN 13416 (ISO 15193) thường được xuất bản trong các tài liệu khoa học.
4.6.3 Các phòng thí nghiệm đo lường tham chiếu
Các phòng thí nghiệm đo tham chiếu phù hợp với ISO 15195 có thể được nhà sản xuất hoặc bên chịu trách nhiệm khác lựa chọn để cung cấp dịch vụ đo tham chiếu nhằm hỗ trợ việc triển khai sơ đồ hiệu chuẩn có thể liên kết đo lường. Các phòng thí nghiệm đo lường tham chiếu được lựa chọn, ngay cả khi không phù hợp với ISO 15195, phải chứng tỏ năng lực cung cấp các phép đo khả dụng tốt nhất cho đại lượng đo đã chọn về liên kết đo lường của các giá trị đo được trong mẫu bệnh phẩm người thuộc loại dự kiến và trong phạm vi xác định.
CHÚ THÍCH: Sự phù hợp với ISO 15195 được chứng minh một cách độc lập bằng cách đạt được danh sách các dịch vụ đo tham chiếu của phòng thí nghiệm đo lường tham chiếu trong cơ sở dữ liệu JCTLM [28].
4.6.4 Tác động của các đại lượng ảnh hưởng
Mô tả về sơ đồ hiệu chuẩn có thể theo dõi về mặt đo lường cho IVD MD phải bao gồm các kết quả từ việc điều tra tác động của các đại lượng dẫn truyền lên các MP có liên quan ở mỗi cấp của sơ đồ hiệu chuẩn.
4.6.5 Những thay đổi về đại lượng đo được trong Sơ đồ hiệu chuẩn
Để đảm bảo một chuỗi các mối quan hệ không bị gián đoạn và cho phép báo cáo các giá trị đo được có thể liên kết theo RMP bậc cao nhất hiện có (trong giới hạn có thể chấp nhận được về mặt y tế), các bước phải được thực hiện ở tất cả các cấp của sơ đồ hiệu chuẩn để giải quyết và/hoặc ngăn ngừa các vấn đề liên quan đến sự khác biệt hoặc những thay đổi về đại lượng đo được giữa các MP khác nhau ở các mức khác nhau trong sơ đồ hiệu chuẩn. Trong bối cảnh này, điều quan trọng là phải nhận ra và giảm thiểu sự khác biệt khi cần thiết giữa đại lượng đo (hoặc đại lượng được đo) và đại lượng đo (đại lượng dự định đo).
CHÚ THÍCH 1: Nhiều IVD MD nhằm mục đích đo cùng một lượng nhưng dựa trên các nguyên tắc hóa học khác nhau đôi khi cho các giá trị khác nhau cho cùng một mẫu bệnh phẩm người hoặc RM.
CHÚ THÍCH 2: Các MD IVD cụ thể đôi khi được chứng minh bởi các đặc tính chọn lọc phép đo như cấu trúc phân tử bậc ba, tính không đồng nhất vi mô hoặc cấu hình hóa học của chất phân tích đích.
VÍ DỤ 1: Các trường hợp có sự không đồng nhất vi mô khác nhau của chất phân tích (đồng dạng, dẫn xuất) trong một hoặc cả chất hiệu chuẩn và/hoặc mẫu bệnh phẩm người dự kiến (ví dụ: các lớp chất phân tích như enzym, kháng thể, glycoprotein, dấu ấn sinh học từ vi sinh vật và các mẫu tự do khác hoặc các dạng liên kết của chất phân tích).
CHÚ THÍCH 3: Các vấn đề về liên kết đo lường thường xảy ra khi nguyên tắc của IVD MD dựa trên việc phát hiện chất thay thế cho chất cần phân tích (ví dụ: đoạn peptit của một protein lớn thay vì toàn bộ phân tử protein) hoặc khi chất hiệu chuẩn IVD MD có chứa một chất phân tích là chất thay thế cho chất phân tích được tìm thấy trong mẫu bệnh phẩm người.
VÍ DỤ 2 Hai hoặc nhiều MP xét nghiệm miễn dịch IVD MD, tất cả đều nhằm mục đích đo lượng nồng độ chất của một hormone protein đơn lẻ (ví dụ: hormone kích thích tuyến giáp [TSH]). Nếu các MP miễn dịch IVD MD khác nhau nhận ra và phản ứng với các mức độ khác nhau với các biểu mô khác nhau của TSH, các giá trị cho các đại lượng liên quan khác nhau được tạo ra bởi mỗi IVD MD, có thể dẫn đến sự thiếu tương đương trong các giá trị đo cuối cùng trong một số mẫu bệnh phẩm người nhất định.
VÍ DỤ 3: Có thể quan sát thấy sự không tương đương của các giá trị giữa các IVD MD khác nhau trong số các nguyên tắc đo rất chọn lọc (nhưng khác nhau) (ví dụ: MP khối phổ so với quy trình xét nghiệm miễn dịch đối với hormone protein trong huyết thanh người). Mỗi IVD MD được nhắm mục tiêu để phát hiện các đồng dạng khác nhau hoặc các đoạn của cùng một protein, nhưng các giá trị khác nhau có thể được xác định vì các số lượng khác nhau đang được đo với mỗi IVD MD.
VÍ DỤ 4: Chất chuẩn dành cho người dùng cuối cho IVD MD dùng để đo bilirubin huyết thanh có thể chứa ditaurobilirubin (chất phân tích thay thế tổng hợp không được tìm thấy như một chất tự nhiên trong mẫu bệnh phẩm người) thay cho (hoặc ngoài) bilirubin và bilirubin không liên hợp tự nhiên, liên hợp glucuronid. Độ chọn lọc tương đối của IVD MD đối với chất phân tích thay thế so với chất phân tích tự nhiên được tìm thấy trong mẫu bệnh phẩm người có thể thay đổi trong vòng đời của IVD MD do các yếu tố như sự già đi của một hoặc nhiều thuốc thử, làm mất hiệu lực các giá trị được chỉ định cho IVD MD của người dùng cuối máy hiệu chuẩn.
VÍ DỤ 5 Đối với phép đo miễn dịch hóa lượng ferritin nồng độ chất trong huyết thanh với sự không đồng nhất vi mô của chất phân tích, trong đó các dạng đồng dạng khác nhau của ferritin được nhận biết ở các mức độ khác nhau bởi các kháng thể đơn dòng khác nhau được tích hợp vào các IVD MD khác nhau, dẫn đến các giá trị được báo cáo khác nhau cho các IVD MD khác nhau với một số mẫu bệnh phẩm người nhất định.
4.7 Ước tính độ không đảm bảo của các giá trị được ấn định cho các máy hiệu chuẩn IVD MD của người dùng cuối
4.7.1 Yêu cầu chung
Độ không đảm bảo đo chuẩn tổng hợp của giá trị được ấn định cho chất hiệu chuẩn IVD MD (được chỉ định ucal trong tài liệu này) phải được nhà sản xuất ước tính và cung cấp cho người dùng cuối, ucal không được vượt quá một phần nhỏ có thể chấp nhận được của thông số kỹ thuật Umax(y) đối với IVD MD có tính đến hệ số phủ k.
CHÚ THÍCH: Việc phát triển phân bổ ngân sách sai số cho ucal được thảo luận ở nơi khác [33] [34].
4.7.2 Tài liệu về phương pháp ước tính ucal
Tốt nhất là ước tính ucal theo các nguyên tắc của GUM. Bất kể phương pháp GUM hay một phương pháp khác để ước lượng ucal được tuân theo, phương pháp tính toán thống kê của ucal phải được ghi lại và duy trì trong hồ sơ kỹ thuật của chất hiệu chuẩn IVD MD ít nhất trong suốt thời gian sử dụng của sản phẩm.
4.7.3 Xem xét thống kê và phạm vi ước tính ucal
Đối với mỗi chát hiệu chuẩn IVD MD được nhà sản xuất xác định để sử dụng trong việc hiệu chuẩn một IVD MD cụ thể, ucal do nhà sản xuất chất hiệu chuẩn IVD MD ước tính và cung cấp phải được xác định bằng cách kết hợp thống kê các độ không đảm bảo liên quan với mỗi phép gán giá trị tuần tự các bước dưới sự kiểm soát của nhà sản xuất. Khi xác định ucal, nhà sản xuất cũng phải tính đến độ không đảm bảo đo đã biết và có thể dự đoán được do tất cả các bước ấn định giá trị bậc cao hơn trong sơ đồ hiệu chuẩn đã xác định, bao gồm các bước không nằm trong tầm kiểm soát của nhà sản xuất, chẳng hạn như (nếu có) độ không đảm bảo đo chuẩn của giá trị được ấn định cho RM thứ tự cao nhất. Các yêu cầu bổ sung khi ước tính ucal bao gồm:
- Việc ước lượng ucal phải dựa trên ít nhất một lô (đơn) đại diện hoặc một lô thuốc thử;
- Các biến thể đã biết và có thể dự đoán trước và độ không đảm bảo đo chuẩn tương ứng trong thuốc thử và hiệu chuẩn IVD MD được chỉ định cũng như trong bất kỳ RM trung gian và hệ thống đo hoặc MP nào trong toàn bộ Sơ đồ hiệu chuẩn (ví dụ do các yếu tố như nhưng không giới hạn ở tính không đồng nhất và không ổn định của vật liệu) sẽ được tính đến.
CHÚ THÍCH: Ucal ước tính thường khác nhau giữa các lô chất hiệu chuẩn IVD MD cho người dùng cuối khác nhau, đặc biệt trong trường hợp các lô hiệu chuẩn khác nhau cho cùng một IVD MD có giá trị ấn định khác nhau về cơ bản.
4.7.4 Biểu thức của ucal
Ucal phải được biểu thị bằng độ lệch chuẩn (SD). Khi kết hợp nhiều độ không đảm bảo đo thành phần để ước tính độ không đảm bảo đo chuẩn tổng hợp, thì mỗi độ không đảm bảo đo thành phần (tức là u (y) ở mỗi mức trong sơ đồ hiệu chuẩn) trước tiên phải được biểu thị dưới dạng phương sai, SD2. Các thành phần phương sai đóng góp sau đó được tính tổng, và căn bậc hai của tổng phương sai là độ không đảm bảo đo chuẩn tổng hợp, u(y); xem VÍ DỤ 1. Ngoài ra, ucal có thể được tính toán và biểu thị theo độ không đảm bảo đo kết hợp tương đối, hoặc phần trăm độ không đảm bảo đo kết hợp tương đối, % ru(y), tức là độ không đảm bảo đo tương đối liên quan đến giá trị trung bình hoặc mục tiêu của đại lượng đo trong chất hiệu chuẩn; xem VÍ DỤ 2.
CHÚ THÍCH 1: Thông tin tối thiểu cần thiết để ước tính đóng góp của độ không đảm bảo đo của bất kỳ MP nào trong Sơ đồ hiệu chuẩn là độ lệch chuẩn của MP trong các điều kiện lặp lại (uRw-p.x) cũng như độ không đảm bảo của giá trị được gán cho bất kỳ chất hiệu chuẩn nào được sử dụng cho MP đó.
CHÚ THÍCH 2: Các tính toán nêu trong ví DỤ 1 và 2 chỉ có thể áp dụng trong các trường hợp mà các đại lượng đầu vào là độc lập. Nếu các đại lượng đầu vào không độc lập thì đồng phương sai là phù hợp.
VÍ DỤ 1 Việc tính toán độ không đảm bảo đo chuẩn tổng hợp được thực hiện theo Công thức (1):
![]()
Trong đó:
u(y) là độ không đảm bảo đo tiêu chuẩn kết hợp của giá trị đo cuối cùng;
u(y)1, u(y)2, u(y)3, ... u(y)n là độ không đảm bảo đo tiêu chuẩn của các phương sai góp phần từ mỗi bước trong Sơ đồ hiệu chuẩn đã xác định.
Độ không đảm bảo đo kết hợp mở rộng, U, được tính theo công thức (2) như sau:
U = u(y) x k (2)
Trong đó:
u(y) là độ không đảm bảo đo chuẩn tổng hợp được xác định theo công thức (1):
U là độ không đảm bảo đo kết hợp mở rộng;
k là hệ số bao phủ (thường là 2, cho mức độ tin cậy xấp xỉ 95 %.
VÍ DỤ 2: Tính toán độ không đảm bảo đo tương đối theo phần trăm tổng hợp của hệ thống đo được thực hiện theo Công thức tổng quát (3):
![]()
Trong đó %ru(y) là độ không đảm bảo đo chuẩn tương đối phần trăm kết hợp và trong đó độ không đảm bảo đo tương đối của từng thành phần được tính theo Công thức (4):
![]()
Trong đó:
%ru(y)n là độ không đảm bảo đo chuẩn tương đối phần trăm của độ không đảm bảo đo thành phần thứ n;
u(y)n là độ không đảm bảo đo tiêu chuẩn của độ không đảm bảo đo thành phần thứ n;
m(y)n là giá trị trung bình được đo (hoặc mục tiêu) của đại lượng đo đối với quy trình đo thành phần n.
Bình phương của mỗi thành phần phần trăm độ không đảm bảo tương đối, %ru(y)2, tức là phần trăm phương sai tương đối, được tính theo công thức (5):
![]()
Trong đó ![]() là phương sai tương đối phần trăm của độ không đảm bảo đo thành phần thứ n.
là phương sai tương đối phần trăm của độ không đảm bảo đo thành phần thứ n.
Sau đó, các phương sai tương đối phần trăm thành phần được tính tổng, và căn bậc hai của tổng phương sai tương đối phần trăm thành phần được tính theo công thức (3) để tính ra %ru(y), độ không đảm bảo đo chuẩn tương đối phần trăm kết hợp cho hệ thống đo.
4.7.5 Sửa đổi sản phẩm
Khi nhà sản xuất sửa đổi IVD MD hoặc chất hiệu chuẩn dành cho người dùng cuối được chỉ định cho IVD MD (nhà sản xuất ban đầu hoặc tổ chức khác), thì ucal của các giá trị được ấn định cho từng chất hiệu chuẩn IVD MD liên quan phải được xác nhận hoặc ước tính lại bởi nhà sản xuất, trừ khi được cung cấp giải thích lý do tại sao thay đổi không ảnh hưởng đến ucal.
CHÚ THÍCH: Trong điều này, nhà sản xuất là bất kỳ tổ chức nào, bao gồm cả phòng thí nghiệm y tế, người điều chỉnh IVD MD.
4.7.6 Thông tin được cung cấp cho người dùng cuối
Đối với các giá trị được ấn định của chất hiệu chuẩn IVD MD, thông tin tối thiểu liên quan đến ucal sẽ được nhà sản xuất chất hiệu chuẩn cung cấp cho người dùng cuối theo yêu cầu là: giá trị số của y, ucal(y), trong đó y là giá trị được gán cho chất hiệu chuẩn.
CHÚ THÍCH 1: Các ước lượng về ucal của chất hiệu chuẩn IVD MD đôi khi được trình bày dưới dạng độ không đảm bảo đo mở rộng (Ucal), trong đó Ucal = ucal(y) x k, thường với hệ số phủ k = 2, cho mức độ tin cậy xấp xỉ 95 %. Vì thông tin được nhà sản xuất ưu tiên cung cấp là ucal chỉ là độ không đảm bảo đo chuẩn tổng hợp, nên không khuyến khích báo cáo về độ không đảm bảo đo mở rộng (Ucal) của các giá trị được ấn định của mẫu hiệu chuẩn.
CHÚ THÍCH 2: Tùy thuộc vào các yêu cầu của địa phương và khu vực, người sử dụng cuối cùng của phòng thí nghiệm y tế của IVD MD thường sử dụng giá trị ucal do nhà sản xuất chất hiệu chuẩn IVD MD cung cấp để ước tính độ không đảm bảo đo kết hợp của giá trị đo được đối với mẫu bệnh phẩm người như được xác định với quy định người dùng cuối IVD MD.
4.8 Thẩm định liên kết đo lường của các giá trị được chỉ định cho chất hiệu chuẩn IVD MD
4.8.1 Yêu cầu xác nhận chung
Nhà sản xuất chất hiệu chuẩn IVD MD phải xác nhận công bố về liên kết đo lường của giá trị được chỉ định cho chất hiệu chuẩn IVD MD.
CHÚ THÍCH 1: Trong 3.49, ISO 9000 định nghĩa xác nhận là xác nhận (được hỗ trợ bởi bằng chứng khách quan) rằng các yêu cầu đối với mục đích sử dụng hoặc ứng dụng cụ thể đã được đáp ứng. ISO 9000 xác định rõ hơn "bằng chứng khách quan" là dữ liệu hỗ trợ sự tồn tại của một cái gì đó. Bằng chứng khách quan thu được bằng quan sát, đo lường, thử nghiệm hoặc các phương tiện khác.
CHÚ THÍCH 2: Có thể đạt được hiệu lực liên kết đo lường của hiệu chuẩn bằng cách sử dụng liên tục các công cụ và chiến lược. Các chiến lược đơn giản nhất để phát triển bằng chứng khách quan về tính hợp lệ của liên kết hiệu chuẩn là dành cho các đại lượng đo với hệ quy chiếu được phát triển hoàn chỉnh nhất. Các chiến lược xác nhận phức tạp hơn (và tăng gánh nặng trách nhiệm đối với tài liệu) là cần thiết cho các phân cấp hiệu chuẩn hỗ trợ các đại lượng đo mà không có tham chiếu bậc cao hơn hoặc giao thức hài hòa hiện có.
4.8.2 Các chiến lược xác nhận
Thiết kế các nghiên cứu để xác nhận công bố về khả năng liên kết các giá trị được ấn định cho Chất hiệu chuẩn IVD MD cho người dùng cuối phải được nhà sản xuất ghi lại trong hồ sơ kỹ thuật IVD MD. Việc lựa chọn một chiến lược xác nhận cụ thể cho một sơ đồ hiệu chuẩn nhất định phải phụ thuộc vào độ chín và đặc tính hoạt động của hệ quy chiếu đối với đại lượng đo cũng như sự sẵn có của vật liệu (RM) và MP khi cần thiết để thực hiện các loại nghiên cứu được liệt kê dưới đây. Đối với sơ đồ hiệu chuẩn nhất định, một số chiến lược xác nhận có thể được áp dụng, tùy theo lựa chọn của bên chịu trách nhiệm (thường là nhà sản xuất) để xác định phân cấp hiệu chuẩn của IVD MD cụ thể. Các chiến lược nghiên cứu áp dụng để xác nhận công bố liên kết hiệu chuẩn cho IVD MD bao gồm nhưng không giới hạn ở:
a) Kiểm tra các RM có thể chuyển đổi (tốt nhất là CRM và/hoặc các vật liệu kiểm soát độ đúng; xem 3.46).
b) Tham gia vào EQA, thử nghiệm thành thạo (PT) hoặc các chương trình so sánh liên phòng thí nghiệm khác sử dụng các mẫu thử nghiệm có thể chuyển đổi, với các giá trị mục tiêu được RMP chỉ định (nếu có) hoặc một giao thức hài hòa.
c) Kiểm tra các mẫu bệnh phẩm người có ngân với các giá trị đã được RMP ấn định trước đó.
d) Nghiên cứu so sánh phương pháp trên một nhóm mẫu bệnh phẩm người, so sánh với RMP bậc cao hơn.
e) Nghiên cứu so sánh phương pháp trên một tập hợp các mẫu bệnh phẩm người với một MP độc lập khác (không phải là RMP).
f) Các biện pháp kiểm soát phân tích bậc cao hơn được nhúng vào sơ đồ hiệu chuẩn và chỉ định giá trị MP, tập trung vào việc sử dụng các công cụ và kiểm soát đo lường có thể theo dõi SI đã được hiệu chuẩn cẩn thận (ví dụ: cân, dụng cụ thủy tinh thể tích, máy quang phổ, nhiệt kế, kiểm soát môi trường xung quanh, thuốc thử có sẵn cao nhất độ tinh khiết).
CHÚ THÍCH 1: Trong số các khả năng xác nhận được mô tả ở trên, tính sẵn có của RMP là yếu tố quan trọng nhất.
CHÚ THÍCH 2: Trong số các chiến lược xác nhận chung được mô tả ở trên, các mục từ a) đến e) tập trung vào kết quả đầu ra (tức là độ đúng của các giá trị đo được) của Sơ đồ hiệu chuẩn được chỉ định, trong khi các chiến lược trong gạch đầu dòng f) tập trung vào độ đúng và khả năng tái lập của giá trị chuyển quy trình và thủ tục trong Sơ đồ hiệu chuẩn (nghĩa là các bước quan trọng như đo thể tích và trọng lượng).
CHÚ THÍCH 3: Để có hướng dẫn về việc lựa chọn thích hợp các thành viên ban mẫu bệnh phẩm người cho các nghiên cứu so sánh phương pháp (gạch đầu dòng c), d) và e) ở trên), hãy tham khảo CLSI EP09-A3, EP14-A3 và EP30-A.
4.8.3 Cân nhắc thiết kế và tiêu chí chấp nhận
Đối với công việc liên quan nhận dạng nghiên cứu để so sánh phương pháp với người mẫu bảng để hỗ trợ bố trí về các nguồn đo lường liên kết của một giá trị được định nghĩa chỉ cho IVD MD tiêu chuẩn chất lượng [xem 4.8.2, c), d) và e)], các biến thể đã biết ảnh hưởng đến người mẫu và/hoặc các chuẩn đo lường hiệu quả cho cả IVD MD thử nghiệm được đánh giá và RMP (hoặc MP khác) dựa trên kết quả thử nghiệm IVD MD sẽ được tính đến. Các tiêu chí chấp nhận được xác định trước để xác nhận phải được lấy từ và không được vượt qua các kỹ thuật thông tin Umax(y) cho IVD MD như được xác định trong hệ thống tiêu chuẩn cấp hiệu ứng tương ứng với đại lượng (xem 4.3). Số lần lặp lại của mỗi mẫu được đo bằng IVD MD thử nghiệm phải được thiết lập sao cho khả năng phát hiện sai lệch lớn như tiêu chí xác nhận là cao hợp lý (ví dụ > 80 %), trong khi khả năng không đạt sai tiêu chí xác nhận là thấp (ví dụ <5 %).
CHÚ THÍCH: Các phương pháp xác định thông tin kỹ thuật số Umax(y) cho IVD MD được thảo luận chuyên sâu ở các phần khác [31] - [34].
4.8.4 Phân cấp hiệu chuẩn với RMP có sẵn
Đối với phân cấp hiệu chuẩn như mô tả trong 5.2, 5.3 và 5.4 (Hình 1, 2 và 3), với RMP có sẵn để đo lường, khả năng liên kết các giá trị được gán cho các mẫu hiệu chuẩn của người dùng cuối và mẫu bệnh phẩm người phải được xác nhận bằng cách so sánh các giá trị đo được với các bộ mẫu bệnh phẩm người thuộc (các) loại được thiết kế để sử dụng với IVD MD. Những so sánh này sẽ được thực hiện giữa các giá trị được đo bằng RMP (xem Hình 1-3, [p.3]) và các giá trị được đo bằng IVD MD của người dùng cuối đã hiệu chuẩn. Trong trường hợp các giới hạn vật lý và chi phí làm cho việc so sánh như vậy không thực tế, thay vì so sánh IVD MD thử nghiệm với RMP cao nhất hiện có, so sánh với RMP thứ (hoặc RMP bậc thấp khác) là một phần của Sơ đồ hiệu chuẩn được xác định cho đại lượng đo (xem Hình 1-3, [p.4]) sẽ là một phương án thay thế có thể chấp nhận được, với sự giải thích bằng văn bản.
4.8.5 Phân cấp hiệu chuẩn không có RMP
Trong trường hợp phân cấp hiệu chuẩn cho đại lượng đo không có RMP sẵn có cho đại lượng đo, bao gồm phân cấp hiệu chuẩn được hỗ trợ bởi máy hiệu chuẩn thông thường quốc tế hoặc giao thức hài hòa quốc tế như được mô tả trong 5.5 và 5.6, tương ứng (Hình 4 và 5), xác nhận liên kết đo lường của Các giá trị được ấn định cho hiệu chuẩn đối với IVD MD được chỉ định cho các đại lượng đo này phải được thực hiện, sử dụng các tiêu chí chấp nhận được xác định trước, bằng cách thực hiện các nghiên cứu so sánh phương pháp sử dụng bảng mẫu bệnh phẩm người thuộc (các) loại IVD MD được dự định. Đối với IVD MD cho các đại lượng đo được chuẩn hóa bằng cách sử dụng chất hiệu chuẩn thông thường quốc tế hoặc CRM với giá trị của nó được ấn định bởi sự đồng thuận của một số MP đủ điều kiện (nhưng không phải là MP chuẩn) như mô tả trong 5.5 và Hình 4, ít nhất một nghiên cứu so sánh phương pháp phải được thực hiện để so sánh sang một IVD MD khác và độc lập dành cho cùng một đại lượng đo đã được tiêu chuẩn hóa với cùng một chất hiệu chuẩn thông thường quốc tế hoặc CRM và tuyên bố là có thể liên kết đo lường đối với chất hiệu chuẩn thông thường quốc tế hoặc CRM đã chỉ định. Với IVD MD cho các đại lượng đo lường được chuẩn hóa theo giao thức hài hòa quốc tế (xem 5.6 và Hình 5), ít nhất một nghiên cứu so sánh phương pháp sẽ được thực hiện so với IVD MD khác và độc lập đã được hài hòa theo giao thức hài hòa quốc tế.
4.8.6 Phân cấp hiệu chuẩn không có RMP và không có CRM
Trong trường hợp các đại lượng đo không có sẵn RMP hoặc CRM, và không có các chuẩn hiệu chuẩn thông thường quốc tế hoặc các giao thức hài hòa cho đại lượng đo (xem 5.7 và Hình 6), Sơ đồ hiệu chuẩn được phát triển và duy trì nội bộ được xác định bởi các nhà sản xuất IVD MD dành cho các loại đại lượng đo này phải được xác nhận về liên kết đo lường của các giá trị được chỉ định cho các chất hiệu chuẩn, theo các tiêu chí chấp nhận đã xác định trước, bằng cách thực hiện các nghiên cứu kiểm định xác nhận rằng tất cả các đại lượng đầu vào đã biết và đại lượng lưu lượng trong công thức đo đều được kiểm soát cẩn thận và có thể lặp lại. Các biến đo lường chính và đại lượng dẫn truyền góp phần vào hiệu suất của IVD MD phải được xác định và đặc trưng.
Sự biến thiên bình thường của các biến MP đã biết và các đại lượng lưu lượng phải được đánh giá và đại lượng theo những đóng góp của chúng đối với độ không đảm bảo đo chuẩn của IVD MD, và các ảnh hưởng kết hợp của chúng (khi được tổng hợp theo thống kê) không được vượt quá một phần thích hợp của Umax (y) cho IVD MD.
4.8.7 Xác nhận các thay đổi thiết kế đối với bộ hiệu chuẩn IVD MD dành cho người dùng cuối
Trong trường hợp thay đổi thiết kế đối với chất hiệu chuẩn IVD MD và theo yêu cầu của kết quả đánh giá rủi ro thích hợp, nhà sản xuất phải thực hiện xác nhận lại liên kết đo lường của các giá trị được chỉ định cho chất hiệu chuẩn IVD MD hoặc phải chứng minh trong tài liệu kỹ thuật của nhà sản xuất (ví dụ: tệp lịch sử thiết kế) lý do tại sao không yêu cầu xác nhận lại liên kết đo lường. Trong quá trình thực hiện bất kỳ thay đổi thiết kế nào, người dùng cuối phải được thông báo nếu có bất kỳ thông tin mới nào liên quan đến các kỳ vọng về hiệu suất đối với chất hiệu chuẩn và IVD MD dự kiến của nó.
CHÚ THÍCH: Những thay đổi về thiết kế bao gồm (nhưng không giới hạn ở) những thay đổi về thông số kỹ thuật của nguyên liệu thô, những thay đổi về nguồn nguyên liệu (ví dụ như thay đổi từ nguồn mô này sang nguồn mô khác cho enzyme), quy trình sản xuất hoặc thay đổi về nhà cung cấp, số lượng thông số kỹ thuật đo lường thay đổi, thay đổi giao thức gán giá trị.
4.9 Các trách nhiệm bổ sung về tài liệu phân cấp hiệu chuẩn
4.9.1 Nghĩa vụ đối với người dùng cuối
Nhà sản xuất (các) chất hiệu chuẩn IVD MD cho người dùng cuối phải cung cấp cho người dùng cuối theo yêu cầu giá trị mục tiêu được chỉ định, liên kết đo lường liên quan và ucal cho từng cấp của chất hiệu chuẩn được cung cấp để sử dụng với IVD MD được chỉ định.
4.9.2 Lưu giữ tài liệu
Tài liệu về các thủ tục và dữ liệu hỗ trợ sơ đồ hiệu chuẩn của IVD MD để đo (các) đại lượng đo cụ thể trong mẫu bệnh phẩm người, bao gồm các thông số kỹ thuật sản xuất, độ không đảm bảo đo chuẩn ước tính, vật liệu, nghiên cứu kiểm định và xác nhận và quy trình vận hành, phải được duy trì trong hồ sơ kỹ thuật của nhà sản xuất ít nhất đối với tuổi thọ của IVD MD.
4.9.3 Các nhà sản xuất bên thứ ba của chất hiệu chuẩn IVD MD
Trong một số trường hợp, nhà sản xuất IVD MD chỉ định máy hiệu chuẩn IVD MD cho người dùng cuối được sản xuất bởi một nhà sản xuất khác (thứ hai hoặc độc lập). Các nhà sản xuất chất hiệu chuẩn IVD MD độc lập (bên thứ ba) đó phải duy trì hồ sơ kỹ thuật hỗ trợ các tuyên bố về liên kết đo lường của các giá trị được ấn định cho mỗi đại lượng đo được nêu trong tuyên bố sử dụng dự kiến cho (các) chất hiệu chuẩn IVD MD áp dụng đó. Tương tự, bất kỳ nhà sản xuất chất hiệu chuẩn IVD MD nào bán chất hiệu chuẩn được thiết kế để sử dụng với các IVD MD "khác" (bên thứ ba) (có hoặc không hợp tác với nhà sản xuất hệ thống đo IVD MD) có trách nhiệm đáp ứng tất cả các yêu cầu tài liệu đã xác định trong tài liệu này.
4.9.4 Các sửa đổi do các đơn vị độc lập đưa ra
Nếu các sửa đổi đối với IVD MD được xác định và thực hiện bởi phòng thí nghiệm y tế hoặc tổ chức độc lập khác, bên thứ ba hoặc người không phải là nhà sản xuất ban đầu của IVD MD, mô tả đầy đủ và xác nhận lại sơ đồ hiệu chuẩn dựa trên các giá trị được báo cáo cho con người các mẫu khi được kiểm tra bằng IVD MD đã được sửa đổi sẽ do (các) đơn vị đã chỉ định và thực hiện các sửa đổi đó chịu trách nhiệm.
4.9.5 Phân cấp hiệu chuẩn hỗ trợ IVD MD do một đơn vị phát triển để sử dụng riêng
Trong trường hợp IVD MD được phát triển bởi một đơn vị để sử dụng riêng, đơn vị đang phát triển và/hoặc thực hiện phải chịu trách nhiệm xác nhận và mô tả sơ đồ hiệu chuẩn đầy đủ cho đến và bao gồm các kết quả đối với mẫu bệnh phẩm người.
4.9.6 RM không phải là máy hiệu chuẩn IVD MD cho người dùng cuối
Đối với các RM không phải là chất hiệu chuẩn IVD MD của người dùng cuối (ví dụ: vật liệu kiểm soát độ đúng IVD MD, 3.46), nhà sản xuất RM phải chịu trách nhiệm xác nhận và mô tả sơ đồ hiệu chuẩn làm cơ sở cho bất kỳ giá trị đại lượng nào được gán cho các RM đó và để lập hồ sơ trạng thái về khả năng giao tiếp của vật liệu với mẫu bệnh phẩm người (nếu có) khi được sử dụng với bất kỳ MP dự kiến nào, bao gồm bất kỳ IVD MD nào. Độ không đảm bảo đo chuẩn tổng hợp của các giá trị được ấn định cho các loại RM này cho IVD MD (không phải là hiệu chuẩn IVD MD) sẽ được nhà sản xuất ước tính và cung cấp cho người dùng cuối theo yêu cầu.
4.9.7 Vật liệu EQA và PT với công bố về giá trị mục tiêu có thể theo dõi đo lường
Nhà sản xuất vật liệu dựa trên độ chân thực có thể giao hoán (xem 3.46) EQA và/hoặc PT với (các) giá trị được ấn định được tuyên bố là có thể theo dõi đo lường đối với các tham chiếu bậc cao hơn (đối với một hoặc nhiều đại lượng đo), phải xác định, mô tả và xác nhận sơ đồ hiệu chuẩn hỗ trợ các giá trị được ấn định cho mỗi đại lượng đo đã nêu. Khi được nhà sản xuất công bố, khả năng chuyển đổi của các vật liệu EQA hoặc PT đó phải được chứng minh theo các khuyến nghị đã công bố (xem CLSI EP30-A và [35] - [37]) cho các IVD MD đại diện được sử dụng rộng rãi bởi các phòng thí nghiệm y tế người dùng cuối. Các giá trị được ấn định cho mỗi đại lượng đo và giá trị ucal ước tính sẽ được xác định và cung cấp cho người dùng cuối khi có yêu cầu.
5 Phân cấp hiệu chuẩn mô hình để liên kết đo lường
5.1 Các yếu tố của mô tả sơ đồ hiệu chuẩn
Phân cấp hiệu chuẩn cho IVD MDs phải được mô tả trong tài liệu kỹ thuật của nhà sản xuất. Mô tả sơ đồ hiệu chuẩn phải bao gồm các yếu tố sau:
a) Định nghĩa về đại lượng đo;
b) Mô tả trình tự của các bước hiệu chuẩn và đo lường, mỗi bước bao gồm một MP và một mẫu hiệu chuẩn, trong đó (các) mẫu "chưa biết" được đo ở mỗi bước trong hệ thống phân cấp (trừ bước cuối cùng) hoạt động trong trở thành (các) chất hiệu chuẩn cho bước tiếp theo/tiếp theo (một MP);
c) Ước tính độ không đảm bảo của các giá trị được ấn định của đại lượng đo trong RM (bộ hiệu chuẩn IVD MD) được triển khai ở mức thấp nhất trong Sơ đồ hiệu chuẩn (thường với IVD MD), để cho phép người dùng cuối ước tính độ không đảm bảo đo chuẩn tổng hợp của các giá trị được báo cáo trong các mẫu dự kiến (ví dụ, mẫu bệnh phẩm người, vật liệu EQA hoặc các chất hiệu chuẩn khác).
CHÚ THÍCH 1: Sáu phân cấp hiệu chuẩn mô hình chung được mô tả (5.2 đến 5.7) là các phân cấp có thể được thực hiện bởi các nhà sản xuất IVD để hỗ trợ các hiệu chuẩn có thể theo dõi đo lường cho các đại lượng đo khác nhau. Trong các mô hình này, "độ đúng" từ vật liệu hiệu chuẩn đầu tiên (bậc cao nhất) và/hoặc MP được chuyển đến vật liệu cuối cùng được đo (mẫu bệnh phẩm người) ổ bước đo cuối cùng của trình tự (thường là IVD MD).
CHÚ THÍCH 2: Sơ đồ hiệu chuẩn mô hình được mô tả là đại diện cho tình trạng kỹ thuật hiện tại và các công nghệ có sẵn rộng rãi, và có thể áp dụng cho các loại đại lượng đo cụ thể, tùy thuộc vào sự sẵn có của các tham chiếu bậc cao hơn. Các mô hình được trình bày không nhằm mục đích bao hàm tất cả các khả năng và không loại trừ các khả năng khác; các mô hình bổ sung có thể được mô tả để hỗ trợ các đại lượng đo cụ thể và/hoặc các công nghệ mới.
CHÚ THÍCH 3: Số lượng các mức (tức là các cặp MP và mẫu hiệu chuẩn) được áp dụng trong sơ đồ hiệu chuẩn cho một đại lượng đo nhất định là trách nhiệm của các bên thực hiện phân cấp hiệu chuẩn, với điều kiện là các phần tử có thứ tự cao nhất (ví dụ, RM và/hoặc RMP) vẫn được nhúng trong hệ thống phân cấp cuối cùng. Sự lựa chọn cuối cùng của các mức đo lường cụ thể được đưa vào sơ đồ hiệu chuẩn nhất định phụ thuộc vào đặc tính hóa học của đại lượng đo, độ không đảm bảo đo mục tiêu đối với kết quả cuối cùng, và tính sẵn có của MP, chất hiệu chuẩn và công nghệ liên quan khác (ví dụ: công nghệ thông tin).
5.2 Các trường hợp có RMP và RM chính
5.2.1 Những cân nhắc chung
Sơ đồ hiệu chuẩn mô hình cho các đại lượng đo được hỗ trợ với các RMP và RM đầu có sẵn, với liên kết đo lường đầy đủ đến SI được mô tả trong Hình 1. Các đặc điểm cần giải quyết trong mô tả của các loại phân cấp hiệu chuẩn này được trình bày trong 5.2.2 đến 5.2.13.
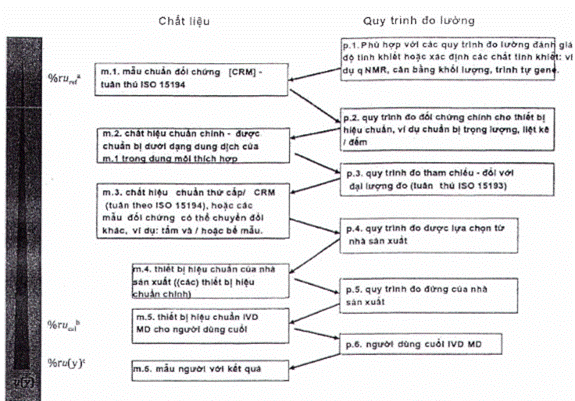
Hình 1 - Sơ đồ hiệu chuẩn - Liên kết đo lường đầy đủ đối với SI
a Độ không đảm bảo đo chuẩn phần trăm tương đối của giá trị được gán cho RM đầu [m.1].
b Hiệu chuẩn IVD MD [m.5] ấn định giá trị phần trăm độ không đảm bảo đo kết hợp tương đối, theo công thức sau:
![]()
Trong đó %ruRw-p.2, %ruRw-p.3, v.v..., đại diện cho phần trăm độ không đảm bảo đo chuẩn tương đối cho mỗi MP áp dụng trong Sơ đồ hiệu chuẩn.
c Phần trăm tương đối kết hợp độ không đảm bảo đo tiêu chuẩn cho các giá trị được báo cáo của đại lượng đo với IVD MD của người dùng cuối, được tính theo công thức sau:
![]()
Trong đó ![]() là độ không đảm bảo đo chuẩn phần trăm tương đối của IVD MD dựa trên dài hạn độ chính xác (điều kiện lặp lại của phép đo).
là độ không đảm bảo đo chuẩn phần trăm tương đối của IVD MD dựa trên dài hạn độ chính xác (điều kiện lặp lại của phép đo).
5.2.2 Định nghĩa đại lượng đo
Định nghĩa đại lượng đo phải bao gồm đơn vị đo SI, là đại lượng cơ bản hay đại lượng dẫn xuất, dùng để liên kết đo lường.
VÍ DỤ 1
1) các đại lượng cơ bản: mol, kilogam;
2) các đại lượng dẫn xuất: mol trên mét khối (= milimole trên lít), gam trên kilogam.
CHÚ THÍCH 1: Đại lượng đo được ở các bước khác nhau trong phân cấp hiệu chuẩn có thể thay đổi khi vật liệu được đo thay đổi. Những thay đổi đối với đại lượng đo thường dẫn đến các đơn vị báo cáo SI khác nhau.
VÍ DỤ 2: Trong phép đo cân bằng khối lượng để đánh giá độ tinh khiết của RM đầu được chứng nhận đối với cortisol, phần khối lượng của tạp chất (đại lượng đo được trong trường hợp này) được xác định chứ không phải phần khối lượng của cortisol và độ tinh khiết của vật liệu được xác định, dưới dạng phần khối lượng, sử dụng đơn vị g / kg. Đối với các RM khác được sử dụng ở các mức thấp hơn trong Sơ đồ hiệu chuẩn của IVD MD cho cortisol, chẳng hạn như RM thứ (ví dụ như CRM) hoặc các chất hiệu chuẩn công tác của nhà sản xuất, nồng độ lượng chất của cortisol (trong huyết thanh hoặc cơ thể khác) là đo và kết quả đo được biểu thị bằng các đơn vị SI thích hợp (μmol/L).
VÍ DỤ 3: Đối với các đại lượng đo phức tạp như protein cụ thể trong huyết thanh máu người (ví dụ: albumin), đại lượng đo được trong Sơ đồ hiệu chuẩn ở mức cao nhất thường là độ tinh khiết của protein nguyên vẹn (ví dụ: phần khối lượng, mg/g). ở các mức thấp hơn khác trong sơ đồ hiệu chuẩn, đại lượng đo thường là nồng độ lượng chất của các epitop hoặc peptit cụ thể có nguồn gốc từ protein quan tâm. Trong những trường hợp như vậy, đại lượng đo được là khác nhau ở các mức khác nhau trong hệ thống phân cấp và các giá trị được ấn định cho các RM khác nhau trong hệ thống phân cấp sẽ được biểu thị bằng các đơn vị SI khác nhau.
CHÚ THÍCH 2: Một số đại lượng đo được không thể được biểu thị dưới dạng bảy đại lượng cơ bản của SI, nhưng có bản chất là một số đếm [38]. Ví dụ là số lượng (tức là số lượng) các phân tử cụ thể, một số thực thể tế bào hoặc phần tử sinh học cụ thể (ví dụ: số lượng bản sao của một trình tự axit nucleic cụ thể hoặc số lượng các hạt lipoprotein cụ thể). Mô tả đầy đủ về số lượng được đếm là điều cần thiết.
VÍ DỤ 4: Số lượng tế bào CD4 trên một đơn vị thể tích [40].
VÍ DỤ 5: Số bản sao của trình tự axit nucleic KR AS xác định trên một đơn vị thể tích [41].
CHÚ THÍCH 3: Việc liên kết chính thức đối với SI đối với số đếm được thiết lập thông qua các MP đếm thích hợp, được xác nhận (xem ISO 20391, ISO 20395 và [38], [42]).
5.2.3 Lựa chọn RMP
Các RMP đầu và các MP phù hợp khác cho mục đích (xem Hình 1, p.1, p.2) phải dựa trên các nguyên tắc đo lường được chứng minh là phù hợp với mục đích thực hiện, cung cấp liên kết đo lường đối với một đơn vị đo SI với phép đo nhỏ nhất có thể đạt được, tính không chắc chắn. Có thể tồn tại nhiều hơn một RMP chính tại một thời điểm nhất định để ấn định giá trị cho các đại lượng của một loại nhất định cho các chất hiệu chuẩn đầu. Các giá trị thu được bởi hai hoặc nhiều RMP đầu đối với một đại lượng đo nhất định không được khác biệt đáng kể trong phạm vi độ không đảm bảo đo đã nêu ở một mức độ tin cậy nhất định.
CHÚ THÍCH: Việc đếm (dựa trên số liệu) MP có thể tạo thành cơ sở của RMP chính dựa trên mô tả chi tiết về đại lượng đo, thiết lập độ chọn lọc và tính đầy đủ của phép đếm và tuyên bố về độ không đảm bảo đo.
VÍ DỤ 1: Hai MP đếm cho nồng độ số bản sao DNA không yêu cầu tiêu chuẩn hiệu chuẩn là đếm tế bào f thấp (FCM) và phản ứng chuỗi polymerase kỹ thuật số (dPCR) [41] [43].
VÍ DỤ 2: Hai MP đếm cho nồng độ số tế bào không yêu cầu tiêu chuẩn hiệu chuẩn là kính hiển vi và FCM [40] [42].
5.2.4 RMP chính
RM đầu được chọn (xem Hình 1, m.1) phải là đơn vị đo lường có sẵn tốt nhất (phương án) với độ không đảm bảo đo chuẩn tương đối nhỏ nhất có thể đạt được (ký hiệu bằng chữ viết tắt %ruref trong Hình 1) RM đầu, phải có giá trị của nó được ấn định trực tiếp bởi RMP chính hoặc bởi MP phù hợp với mục đích để đánh giá nhận dạng và/hoặc độ tinh khiết của các chất tinh khiết, ví dụ qNMR, cân bằng khối lượng, xác định trình tự gen [38] [39]. Việc ấn định giá trị và tài liệu cho RM chính phải phù hợp với ISO 15194.
CHÚ THÍCH: RM đầu (xem Hình 1, m.1) thường được tinh chế cao, chứa chất phân tích được xác định rõ về mặt hóa lý, được đánh giá về độ ổn định, tính toàn vẹn của thành phần và kèm theo chứng chỉ (tức là CRM).
VÍ DỤ 1 β-D-Glucose as SRM 917b1) từ NIST; Phần khối lượng của β-D-Glucose trong vật liệu là 997,0 mg/g, với độ không đảm bảo đo mở rộng là 0,2 mg/g. (Đại lượng đo là phần khối lượng của β-D-glucose trong vật liệu glucose kết tinh được biểu thị bằng mg/g).
VÍ DỤ 2 Cholesterol as SRM 911b1) từ NIST; phần khối lượng 0,998 ± 0,001 trong đó độ tinh khiết và độ không đảm bảo ước tính dựa trên đánh giá khoa học và đánh giá của nhiều phép thử phân tích áp dụng cho CRM này trong quá trình chứng nhận. Độ không đảm bảo đo đưa ra xấp xỉ hai độ lệch chuẩn về giá trị được chứng nhận. (Độ không đảm bảo đo mở rộng là 0,001 với hệ số phủ k = 2, cho mức độ tin cậy xấp xỉ 0,95).
5.2.5 Chất hiệu chuẩn chính
Mẫu chuẩn đầu (xem Hình 1, m.2) phải được chuẩn bị từ mẫu chuẩn đầu [m.1] và được ấn định giá trị bằng cách sử dụng RMP chính (xem Hình 1, p.2).
CHÚ THlCH: Thông thường, RMP đầu là phép đo trọng lượng, với sự hòa tan khối lượng đo được của RM đầu trong khối lượng đo được của dung môi thích hợp.
VÍ DỤ Chất hiệu chuẩn chính cho axit uric có thể được chuẩn bị bằng cách hòa tan trọng lượng vào dung môi CRM của axit uric tinh khiết, ví dụ SRM 913b2), giá trị do NIST ấn định, với giá trị được chứng nhận về phần khối lượng của axit uric trong vật liệu nguyên chất là 0,998 kg/kg, với độ không đảm bảo đo mở rộng (mức độ tin cậy 95 %, k = 2) là 0,002 kg/kg .
5.2.6 Gán giá trị cho RM thứ hoặc chất hiệu chuẩn
Một RMP thích hợp (xem Hình 1, p.3) cho đại lượng đo phải được sử dụng để gán giá trị cho chất hiệu chuẩn thứ hoặc RM thứ (xem Hình 1, m.3) với chất nền phức tạp. Đối với tài liệu của RMP (xem Hình 1, p.3) cho đại lượng đo, phải áp dụng các yêu cầu của ISO 15193.
CHÚ THÍCH 2: Trong trường hợp có nhiều hơn một RMP hoặc nhiều phòng thí nghiệm tham chiếu có khả năng thực hiện cùng một MP cho phép đo, các chương trình EQA như Chương trình đánh giá chất lượng bên ngoài IFCC để tham khảo (hiệu chuẩn) Các Phòng thí nghiệm trong Y học Phòng thí nghiệm [44] có thể hữu ích thông tin về sự tương đương giữa các RMP khác nhau và các phòng thí nghiệm tham chiếu khác nhau.
5.2.7 Tính khả chuyển của các RM thứ
Các chất hiệu chuẩn thứ hoặc RM thứ (xem Hình 1, m.3) phải có thể hoán đổi với các mẫu bệnh phẩm người như được xác định trong các nghiên cứu đánh giá khả năng giao hoán.
LƯU Ý: Xem CLSI EP30-A và các khuyến nghị đã xuất bản khác [36] - [38] để thực hiện các nghiên cứu về tính giao hoán. VÍ DỤ NIST SRM 967a1) creatinine trong huyết thanh người đông lạnh, hai lọ riêng biệt với các giá trị được chứng nhận là 0,074 9 mmol/L và 0,3427 mmol/L, là một ví dụ về mẫu chuẩn có thể hoán đổi thích hợp để sử dụng làm chất hiệu chuẩn thứ (xem Hình 1, m.3). Đại lượng đo là lượng nồng độ chất của creatinine trong huyết thanh người đông lạnh được biểu thị bằng mmol/L. Các giá trị nồng độ được chứng nhận cho mỗi mức của vật liệu này dựa trên sắc ký lòng / khối phổ pha loãng đồng vị.
5.2.8 MP do nhà sản xuất lựa chọn
MP đã chọn của nhà sản xuất (xem Hình 1, p.4) phải bao gồm một hệ thống đo được hiệu chuẩn bởi một hoặc nhiều chất hiệu chuẩn (có thể giao hoán) hoặc RM (xem Hình 1, m.3), nếu có.
VÍ DỤ: Đối với nồng độ cortisol trong huyết tương, phương pháp sắc ký khí - khối phổ pha loãng đồng vị (ID- GC/MS) có thể là một MP được chọn.
5.2.9 Chất hiệu chuẩn công tác
Chất hiệu chuẩn công tác của nhà sản xuất (xem Hình 1, m.4) phải có giá trị của nó được ấn định theo MP đã chọn của nhà sản xuất (xem Hình 1, p.4), hoặc (tùy thuộc vào đặc tính giao hoán của chất hiệu chuẩn đang hoạt động), theo RMP (xem Hình 1, p.3). Các chất hiệu chuẩn thứ (làm việc) (xem Hình 1, m.4) phải được chuyển đổi với các mẫu bệnh phẩm người như được xác định trong các nghiên cứu đánh giá khả năng giao hoán (xem 4.5.5) so sánh MP đã chọn của nhà sản xuất (xem Hình 1, p.4) và MP đã chọn của nhà sản xuất (xem Hình 1, p.5), hoặc so sánh RMP (xem Hình 1, p.3) và MP đã chọn của nhà sản xuất (xem Hình 1, p.5) nếu các bước (xem Hình 1, m.3) và (xem Hình 1, p. 4) được bỏ qua khỏi Sơ đồ hiệu chuẩn. (RM này là một ví dụ về sản phẩm phù hợp có bán trên thị trường. Thông tin này được cung cấp chỉ để tạo sự thuận tiện cho người sử dụng tài liệu này và không cấu thành sự chứng thực của ISO đối với sản phẩm này).
CHÚ THÍCH 1: Chất hiệu chuẩn đang hoạt động của nhà sản xuất (xem Hình 1, m.4) đôi khi được gọi là "mẫu chuẩn đầu của nhà sản xuất", "chất hiệu chuẩn nội bộ" hoặc "lô mẫu chuẩn đầu".
CHÚ THÍCH 2: Chất hiệu chuẩn công tác của nhà sản xuất thường là vật liệu có chất nền giống với chất nền của mẫu bệnh phẩm người dự định đo bằng IVD MD của người dùng cuối.
CHÚ THÍCH 3: Các nhà sản xuất thường sử dụng các tấm mẫu lâm sàng hoặc một loạt các nhóm mẫu lâm sàng của con người để làm việc hiệu chuẩn.
5.2.10 MP thường trực của nhà sản xuất
MP đã chọn của nhà sản xuất (xem Hình 1, p.5) phải xác định MP được hiệu chuẩn bởi một hoặc nhiều chất hiệu chuẩn công tác của nhà sản xuất hoặc các chất hiệu chuẩn chất nền có thể chuyển đổi khác và được xác nhận về độ chọn lọc phân tích.
5.2.11 Máy hiệu chuẩn cho người dùng cuối của nhà sản xuất
Chất hiệu chuẩn cho người dùng cuối của nhà sản xuất (xem Hình 1, m.5) Phải có giá trị được ấn định theo MP đã chọn của nhà sản xuất (xem Hình 1, p.5) hoặc MP đã chọn của nhà sản xuất (xem Hình 1, p.4) và được thiết kế để hiệu chuẩn IVD MD của người dùng cuối (xem Hình 1, p.6).
5.2.12 Ucal của giá trị được chỉ định của chất hiệu chuẩn của người dùng cuối
Nhà sản xuất phải ước tính ucal của giá trị ấn định của chất hiệu chuẩn cho người dùng cuối (xem Hình 1, m.5) (xem 4.7), kết hợp tất cả các độ không đảm bảo đo bậc cao thích hợp như độ không đảm bảo đo (uRef) của giá trị ấn định của RM đầu (xem Hình 1, m.1) cùng với độ không đảm bảo của từng MP tiếp theo trong sơ đồ hiệu chuẩn xuống và bao gồm cả MP đã chọn của nhà sản xuất (xem Hình 1, p.5).
5.2.13 IVD MD của người dùng cuối
IVD MD cho người dùng cuối (xem Hình 1, p.6) phải mô tả hệ thống đo được hiệu chuẩn bởi một hoặc nhiều chất hiệu chuẩn của người dùng cuối. MP này, MP cuối cùng trong sơ đồ hiệu chuẩn cho đại lượng đo xác định, được sử dụng để kiểm tra mẫu bệnh phẩm người và tạo ra các giá trị đo cuối cùng cho đại lượng đo, với độ không đảm bảo đo chuẩn tổng hợp của các giá trị được báo cáo để người dùng cuối ước tính, tính vào tính tất cả các độ không đảm bảo đo đã biết được tích lũy ở mỗi bước cao hơn trong sơ đồ hiệu chuẩn đã xác định.
5.3 Các trường hợp có RMP chính xác định đại lượng đo
5.3.1 Cân nhắc chung
Sơ đồ hiệu chuẩn mô hình cho các đại lượng đo với RMP chính xác định đại lượng đo, (với liên kết đo lường tới SI) được mô tả trong Hình 2. Đối với các loại đại lượng đo này, không có sẵn các RM chính được chứng nhận. Trong những trường hợp như vậy, như được minh họa bằng sơ đồ hiệu chuẩn đối với một số đại lượng có thể đo được đối với nồng độ hoạt tính xúc tác của các enzym được đo trong huyết thanh người (hoặc các chất lỏng khác của cơ thể), liên kết đo lường đối với SI dựa trên các RMP được quốc tế xác định rõ và thống nhất. Các đặc điểm được đề cập trong phần mô tả của các phân cấp hiệu chuẩn này được trình bày chi tiết trong 5.3.2 đến 5.3.11.
CHÚ THÍCH: Các yếu tố đông máu nhất định cũng được kiểm tra bằng cách đo nồng độ hoạt tính xúc tác của chúng trong máu hoặc huyết tương, ví dụ yếu tố VIII [45].
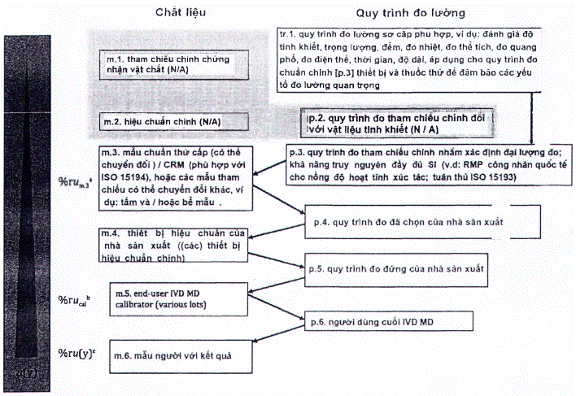
Hình 2 - Sơ đồ hiệu chuẩn - Đại lượng đo được xác định bởi RMP, nhưng không có RM chính cho số lượng; có thể liên kết đến SI. Vật liệu [m.1] và [m.2] và MP [p.2] không được áp dụng (N/A)
a Độ không đảm bảo đo ấn định giá tri kết hợp phần trăm tương đối của chất chuẩn [m.3], được tính theo công thức sau:
![]()
Trong đó:
![]() là độ không đảm bảo đo chuẩn tổng hợp phần trăm tương đối đối với các MP bậc cao hơn [p.1 ] có quan hệ với v.d. phép đo nhiệt, phép đo thể tích, phép đo quang phổ, pH, thời gian, độ dài, v.v.;
là độ không đảm bảo đo chuẩn tổng hợp phần trăm tương đối đối với các MP bậc cao hơn [p.1 ] có quan hệ với v.d. phép đo nhiệt, phép đo thể tích, phép đo quang phổ, pH, thời gian, độ dài, v.v.;
![]() là độ lệch chuẩn phần trăm tương đối (CV %) đối với MP [p.3] trong các điều kiện lặp lại.
là độ lệch chuẩn phần trăm tương đối (CV %) đối với MP [p.3] trong các điều kiện lặp lại.
b Độ không đảm bảo đo ấn định giá trị kết hợp phần trăm tương đối của chất hiệu chuẩn IVD MD [m.5] được tính theo công thức sau:
![]()
Trong đó ![]() đại diện cho phần trăm độ không đảm bảo đo chuẩn tương đối cho mỗi MP áp dụng trong sơ đồ hiệu chuẩn.
đại diện cho phần trăm độ không đảm bảo đo chuẩn tương đối cho mỗi MP áp dụng trong sơ đồ hiệu chuẩn.
c Phần trăm tương đối kết hợp độ không đảm bảo đo tiêu chuẩn cho các giá trị được báo cáo của đại lượng đo với IVD MD của người dùng cuối, được tính theo công thức sau:
![]()
Trong đó ![]() là độ không đảm bảo đo chuẩn phần trăm tương đối của IVD MD dựa trên độ chính xác dài hạn (điều kiện đo lặp lại).
là độ không đảm bảo đo chuẩn phần trăm tương đối của IVD MD dựa trên độ chính xác dài hạn (điều kiện đo lặp lại).
5.3.2 Định nghĩa đại lượng đo
Định nghĩa đại lượng đo phải bao gồm đơn vị đo SI, cho dù là đơn vị cơ sở hay đơn vị dẫn xuất, mà khả năng liên kết đo lường sẽ tham chiếu.
VÍ DỤ: Đối với nồng độ xúc tác của enzym, các đại lượng dẫn xuất có liên quan bao gồm: mol trên giây trên mét khối (= mol s-1 m-3), katal trên lít (= kat L-1).
CHÚ THÍCH 1: "Nồng độ chất xúc tác" thuộc loại đại lượng là hoạt tính xúc tác của thành phần tính bằng katal (hoặc mol trên giây) chia cho thể tích của hệ thống (ban đầu) được lấy mẫu tính bằng mét khối.
CHÚ THÍCH 2: Trong y học phòng thí nghiệm, mẫu số có thể được chọn là "lít", cho đơn vị dẫn xuất không nhất quán là "katal trên lít", được ký hiệu = kat L-1 = kat/L = mol s-1 L-1 = (mol/s)/L.
CHÚ THÍCH 3: Một đơn vị khác, không liên kết được sử dụng dựa trên đơn vị cho hoạt tính xúc tác "đơn vị enzym" (hoặc "đơn vị quốc tế"), ký hiệu là U, với công thức chuyển đổi, 1 U = 1 pmol min-1 = 16,667 x 10-9 kat. Do đó, 1 U/L = 16,667 x 10-9 kat/L. Đơn vị đo lường không phụ thuộc vào MP.
5.3.3 RMP bậc cao hơn xác định đại lượng đo
RMP bậc cao hơn (đầu) xác định đại lượng đo (xem Hình 2, p.3) phải được thực hiện với (các) hệ thống đo được hiệu chuẩn theo nhiều sự phù hợp khác nhau cho mục đích RMP đầu (xem Hình 2, p.1), như vậy như phép đo trọng lực, phép đo nhiệt, phép đo thể tích, phép đo quang phổ, phép đo điện thế, thời gian, độ dài, nếu có.
CHÚ THÍCH: Theo định nghĩa của Ủy ban tư vấn về lượng chất (CCQM), các trường hợp không có mẫu chuẩn đầu yêu cầu một bộ phương pháp đo chính (xem Hình 2, p.1) được áp dụng trực tiếp cho hệ thống đo, để cho phép SI - tiêu chuẩn hóa có thể theo dõi của RMP chính (Hình 2, p.3).
5.3.4 RMP chính và định nghĩa của đại lượng đo
Đối với đại lượng đo là nồng độ xúc tác của enzym, RMP chính (xem Hình 2, p.3) là một phần không thể thiếu trong định nghĩa về đại lượng đo. Theo đó, RMP chính (xem Hình 2, p.3) phải được quy định đầy đủ chi tiết về thiết bị, thuốc thử, điều kiện phản ứng và tính toán từ tín hiệu đo để RMP có thể được tái tạo trong bất kỳ phòng thí nghiệm đủ điều kiện nào có ý định thực hiện phép đo.
CHÚ THÍCH: Các kết quả đo nồng độ chất xúc tác chỉ có thể so sánh giữa các phòng thí nghiệm khác nhau nếu các hoạt động của enzym được đo trong cùng điều kiện. Do đó, đại lượng đo enzyme không thể chỉ được mô tả bằng loại đại lượng (ví dụ nồng độ chất xúc tác), tên của enzyme và hệ thống, mà còn yêu cầu MP xác định, đặc biệt là thành phần chỉ thị của phản ứng được đo. Ở đầu Sơ đồ hiệu chuẩn, RMP chính được quốc tế đồng ý.
VÍ DỤ Creatine kinase được đo bằng tỷ lệ chuyển đổi NADP + theo IFCC RMP [46].
5.3.5 Tài liệu về RMP chính
Tài liệu cho RMP chính được triển khai trong sơ đồ hiệu chuẩn như được mô tả trong Hình 2, p.3 (ví dụ, đối với nồng độ xúc tác của một enzym trong cơ thể f luid) phải đáp ứng các yêu cầu của TCVN 13416 (ISO 15193). Ngoài ra, mô tả của RMP chính cho đại lượng đo (xem Hình 2, p.3) phải bao gồm các thông tin sau (nếu có):
a) Loại cơ chất và nồng độ của nó;
b) Chất hoạt hóa hoặc chất ức chế và nồng độ của chúng;
c) Hướng của phản ứng có xúc tác;
d) Phản ứng chỉ thị;
e) Hệ đệm và pH;
f) Phần thể tích của mẫu;
g) Phần thể tích của dung dịch thuốc thử ban đầu;
h) Nhiệt độ đo;
i) Thời gian ủ;
j) Mẫu trắng;
k) Vật liệu được sử dụng để bắt đầu phản ứng;
l) Thời gian trì hoãn;
m) Khoảng thời gian đo;
n) Bước sóng đo;
o) Băng thông quang học;
p) Chiều dài đường quang học;
q) Loại đường hồi quy để phân tích các điểm dữ liệu.
5.3.6 Gán giá trị cho các RM thứ
RMP đầu cho đại lượng đo (xem Hình 2, p.3) phải được sử dụng để gán giá trị cho chất hiệu chuẩn thứ hoặc RM thứ (xem Hình 2, m.3) với chất nền phức tạp.
CHÚ THÍCH: Các RM thứ hoặc chất hiệu chuẩn như vậy (xem Hình 2, m.3) thường có chất nền giống như mẫu bệnh phẩm người dự định đo bởi các MP thông thường của người dùng cuối, để cải thiện khả năng các vật liệu này có thể thay thế được với mẫu bệnh phẩm người khi được sử dụng trong các MP bậc thấp hơn trong sơ đồ hiệu chuẩn. Các tấm hoặc vũng mẫu bệnh phẩm người là loại RM thứ có thể áp dụng trong bối cảnh này (xem Hình 2, m.3), tùy thuộc vào các đặc điểm sinh hóa (ví dụ độ ổn định) của đại lượng đo enzyme cụ thể.
VÍ DỤ ERM-AD457 / IFCC2, từ Ban Giám đốc Trung tâm nghiên cứu hỗn hợp của Ủy ban Châu Âu F - Sức khỏe, người tiêu dùng và RMs, được chứng nhận về nồng độ hoạt tính xúc tác của aspartate aminotransferase và được liệt kê với JCTLM [28], Các nghiên cứu về khả năng giao hoán [47] đã chứng minh rằng vật liệu này có hiệu suất tương đương với các mẫu huyết thanh người ở 5 trên 11 so sánh với RMP sử dụng IVD MDs có sẵn.
5.3.7 MP do nhà sản xuất lựa chọn
MP được chọn của nhà sản xuất (xem Hình 2, p.4) phải xác định MP được hiệu chuẩn bởi một hoặc nhiều RM thứ hoặc chất hiệu chuẩn thứ (xem Hình 2, m.3) và được sử dụng để gán các giá trị cho chất hiệu chuẩn đang hoạt động của nhà sản xuất (xem Hình 2, m.4).
CHÚ THÍCH: Các RM thứ (xem Hình 2, m.3) có các giá trị được chứng nhận với độ không đảm bảo đo liên quan và được phòng thử nghiệm hiệu chuẩn ấn định giá trị bằng cách sử dụng RMP đầu phù hợp với mục đích.
5.3.8 Máy hiệu chuẩn hoạt động của nhà sản xuất
Bộ hiệu chuẩn công tác của nhà sản xuất (xem Hình 2, m.4) phải có các giá trị được ấn định theo MP đã chọn của nhà sản xuất (xem Hình 2, p.4) hoặc (tùy thuộc vào các đặc tính giao hoán của bộ hiệu chuẩn đang hoạt động) theo RMP chính (xem Hình 2, p.3) để biết đại lượng đo. Các chất hiệu chuẩn thứ (làm việc) (xem Hình 2, m.4) phải có thể hoán đối với các mẫu bệnh phẩm người như được xác định trong các nghiên cứu đánh giá khả năng giao hoán (xem 4.5.5) so sánh MP đã chọn của nhà sản xuất (xem Hình 2, p.4) và của nhà sản xuất. MP đứng (xem Hình 2, p.5), hoặc so sánh RMP (xem Hình 2, p.3) và MP đã chọn của nhà sản xuất [xem Hình 2, p.5) nếu các bước (xem Hình 2, m.3) và (xem Hình 2, p.4) được bỏ qua khỏi sơ đồ hiệu chuẩn.
5.3.9 MP thường trực của nhà sản xuất
MP đã chọn của nhà sản xuất (xem Hình 2, p.5) phải xác định MP được hiệu chuẩn bởi một hoặc nhiều chất hiệu chuẩn đang hoạt động của nhà sản xuất (xem Hình 2, m.4) hoặc các loại hiệu chuẩn cao hơn và được xác nhận về độ chọn lọc phân tích.
5.3.10 Bộ hiệu chuẩn cho người dùng cuối của nhà sản xuất
Chất hiệu chuẩn dành cho người dùng cuối của nhà sản xuất (xem Hình 2, m.5) phải có giá trị được ấn định theo MP đã chọn của nhà sản xuất (xem Hình 2, p.5) và được thiết kế để hiệu chuẩn IVD MD của người dùng cuối. Nhà sản xuất phải ước tính ucal của giá trị ấn định của chất hiệu chuẩn dành cho người dùng cuối (xem Hình 2, m.5) (xem 4.7), kết hợp tất cả các độ không đảm bảo đo bậc cao thích hợp cùng với độ không đảm bảo đo của từng MP tiếp theo trong phân cấp hiệu chuẩn xuống và bao gồm cả MP đã chọn của nhà sản xuất (xem Hình 2, p.5).
5.3.11 MD IVD của người dùng cuối
IVD MD cho người dùng cuối (xem Hình 2, p.6) phải mô tả hệ thống đo được hiệu chuẩn bởi một hoặc nhiều chất hiệu chuẩn của người dùng cuối. MP này, MP cuối cùng trong sơ đồ hiệu chuẩn cho đại lượng đo xác định, được sử dụng để kiểm tra mẫu bệnh phẩm người và tạo ra các giá trị đo cuối cùng cho đại lượng đo, với độ không đảm bảo đo chuẩn tổng hợp của các giá trị được báo cáo để người dùng cuối ước tính, tính vào tính tất cả các độ không đảm bảo đo đã biết được tích lũy ở mỗi bước cao hơn trong sơ đồ hiệu chuẩn đã xác định.
5.4 Các trường hợp đối với các đại lượng đo được xác định bởi RMP dược hiệu chuẩn bằng một mẫu hiệu chuẩn chính cụ thể
5.4.1 Những lưu ý chung
Phân cấp hiệu chuẩn cho các đại lượng đo được xác định bởi RMP được hiệu chuẩn bằng chất hiệu chuẩn chính cụ thể (có liên kết tới SI) được mô tả trong Hình 3. Trong những trường hợp như vậy, RMP phát hiện một đại lượng là thành phần của đại lượng đo (ví dụ: peptit mảnh hoặc một đoạn nhỏ), chứ không phải là toàn bộ cấu trúc phân tử của đại lượng dự định đo. Các đặc điểm được đề cập trong mô tả của các phân cấp hiệu chuẩn này được trình bày chi tiết trong 5.4.2 đến 5.4.10.
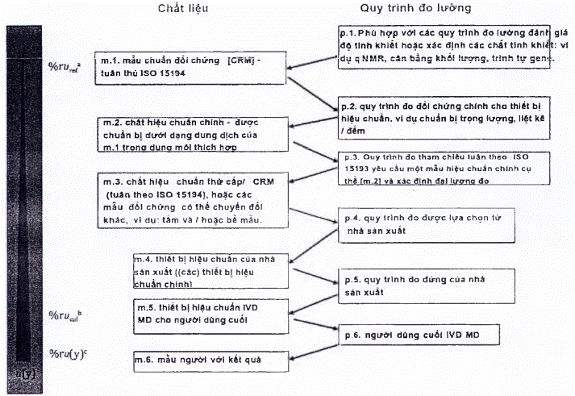
Hình 3 - Sơ đồ hiệu chuẩn - Giá trị đo được xác định bởi RMP được hiệu chuẩn với một mẫu hiệu chuẩn chính cụ thể; có thể theo dõi SI
a Độ không đảm bảo đo chuẩn phần trăm tương đối của giá trị được gán cho RM đầu [m.1].
b Hiệu chuẩn IVD MD [m.5] ấn định giá trị phần trăm độ không đảm bảo đo kết hợp tương đối, theo công thức sau:
![]()
Trong đó ![]() v.v..., đại diện cho phần trăm độ không đảm bảo đo chuẩn tương đối cho mỗi MP áp dụng trong Sơ đồ hiệu chuẩn.
v.v..., đại diện cho phần trăm độ không đảm bảo đo chuẩn tương đối cho mỗi MP áp dụng trong Sơ đồ hiệu chuẩn.
c Phần trăm tương đối kết hợp độ không đảm bảo đo tiêu chuẩn cho các giá trị được báo cáo của đại lượng đo với IVD MD của người dùng cuối, được tính theo công thức sau:
![]()
Trong đó ![]() là độ không đảm bảo đo chuẩn phần trăm tương đối của IVD MD dựa trên độ chính xác dài hạn (điều kiện đo lặp lại).
là độ không đảm bảo đo chuẩn phần trăm tương đối của IVD MD dựa trên độ chính xác dài hạn (điều kiện đo lặp lại).
5.4.2 Định nghĩa đại lượng đo
Do tính chọn lọc của nó đối với một cấu trúc phân tử hoặc biểu mô cụ thể là một phần của đại lượng đo, RMP bậc cao hơn (xem Hình 3, p.3) được hiệu chuẩn bằng một chất hiệu chuẩn chính cụ thể (xem Hình 3, m.2) sẽ xác định đại lượng đo.
VÍ DỤ: Trong hệ thống đo quy chiếu IFCC cho hemoglobin A1c (HbA1c), đại lượng đo được xác định là phần mol của chuỗi beta của hemoglobin A1 với glycation ở valine đầu N hoặc gốc epsilon-axit amin (HbA1c) so với không - phần xấu xí của hemoglobin chuỗi beta A (HbA0), trong máu toàn phần. Chất phân tích được định nghĩa là hemoglobin (Hb) được glycated không thể đảo ngược ở một hoặc cả hai valin đầu N và axit epsilon- amino của chuỗi beta.
5.4.3 Gán giá trị của RM chính
RM chính (xem Hình 3, m.1) phải được ấn định bởi một hoặc nhiều MP (để xác nhận danh tính và xác định độ tinh khiết của các chất tinh khiết) (xem Hình 3, p.1). Các MP được chọn phải là các MP có đặc tính hiệu suất để giúp đảm bảo độ không đảm bảo đo tiêu chuẩn tương đối nhỏ nhất có thể đạt được (được biểu thị bằng chữ viết tắt % ruref trong Hình 3) cho giá trị ấn định của RM đầu.
5.4.4 Chỉ định giá trị của mẫu chuẩn đầu
Mẫu chuẩn đầu (xem Hình 3, m.2) phải được ấn định giá trị bởi một hoặc nhiều RMP chính (ví dụ: trọng lượng) (xem Hình 3, p.2). Việc lựa chọn RM chính (xem Hình 3, m.1), ngoài việc chuẩn bị và ấn định giá trị của mẫu chuẩn đầu (xem Hình 3, m.2) là rất quan trọng đối với định nghĩa của đại lượng đo, cùng với RMP (xem Hình 3, p.3).
VÍ DỤ 1 Trong hệ thống đo quy chiếu IFCC cho hemoglobin A1c (HbA1c), để gán giá trị của chất hiệu chuẩn chính (xem Hình 3, m.2) để sử dụng trong hiệu chuẩn RMP (xem Hình 3, p.3), hỗn hợp được làm bằng HbA1c tinh khiết và HbA0 tinh khiết, đã được phân lập bằng cách sử dụng sắc ký ái lực và trao đổi cation, và được đặc trưng bằng cách sử dụng khối phổ ion hóa hội tụ đẳng điện mao quản và tia điện tử [48].
VÍ DỤ 2 Việc đo đại lượng protein phản ứng C (CRP) bằng xét nghiệm miễn dịch đồng nhất phụ thuộc vào trạng thái oligomeric của chất phân tích [51]. Một phương pháp tham chiếu thông thường dựa trên việc phát hiện monopeptit có nguồn gốc từ CRP sẽ không liên quan đến trạng thái oligomeric của CRP. Để loại trừ sai lệch như là một hàm của sự khác biệt về trạng thái oligomeric của protein trong RM so với mẫu bệnh phẩm người dự kiến, phần monome trong RM chính và chất hiệu chuẩn được xác định một cách độc lập.
5.4.5 Lựa chọn và mục đích sử dụng RMP trong Sơ đồ hiệu chuẩn
RMP (xem Hình 3, p.3) (khi được hiệu chuẩn với mẫu chuẩn đầu [xem Hình 3, m.2] xác định đại lượng đo) sẽ được sử dụng để gán giá trị cho mẫu hiệu chuẩn thứ hoặc RM thứ có phức chất nền (xem Hình 3, m.3). Bộ hiệu chuẩn thứ hoặc RM thứ (xem Hình 3, m.3) phải có thể hoán đổi với các mẫu bệnh phẩm người ở cả MP ban đầu (xem Hình 3, p.3) được sử dụng để ấn định giá trị của nó cũng như trong MP tiếp theo (xem Hình 3, p.4), trong đó nó được sử dụng làm chất hiệu chuẩn cho mục đích ấn định giá trị cho (các) chất hiệu chuẩn đang hoạt động của nhà sản xuất (xem Hình 3, m.4).
VÍ DỤ: Trong thủ tục đo quy chiếu IFCC cho hemoglobin A1c (HbA1c), có sẵn hai RMP (xem Hình 3, p.3) để đo chọn lọc dư lượng đầu cuối được glycated của chuỗi beta hemoglobin (Hb). Hb sau đó được phân cắt thành các peptit nhờ một enzym phân giải protein. Các peptit đầu N được glycated và không glycated cụ thể của chuỗi beta Hb được đo bằng cách tách HPLC, sau đó là phép đo khối phổ hoặc điện di mao quản [49] [50].
5.4.6 MP đã chọn của nhà sản xuất
MP đã chọn của nhà sản xuất (xem Hình 3, p.4) phải xác định hệ thống đo được hiệu chuẩn bằng một hoặc nhiều mẫu hiệu chuẩn thứ hoặc RM thứ (xem Hình 3, m.3). Mục đích chính của nó là chuyển tính đúng đắn cho chất hiệu chuẩn đang hoạt động của nhà sản xuất (xem Hình 3, m.4). Như vậy, MP này phải được chọn một phần vì các chất hiệu chuẩn (xem Hình 3, m.3 và/hoặc m.4) có thể hoán đổi được với mẫu bệnh phẩm người.
CHÚ THÍCH: Các RM thứ hoặc chất hiệu chuẩn thứ như vậy thường sẽ có chất nền giống với mẫu bệnh phẩm người dự định đo bằng IVD MD của người dùng cuối, để cải thiện khả năng (các) RM này có thể hoán đối với mẫu bệnh phẩm người, giúp đảm bảo tính phù hợp của chúng để sử dụng với các MP mà chúng được thiết kế để hiệu chuẩn (tức là [Hình 3, p.4 và/hoặc p.5])
5.4.7 Máy hiệu chuẩn hoạt động của nhà sản xuất
Bộ hiệu chuẩn công tác của nhà sản xuất (xem Hình 3, m.4) phải được ấn định giá trị của nó theo MP đã chọn của nhà sản xuất (xem Hình 3, p.4). Vật liệu hiệu chuẩn (xem Hình 3, m.4) phải chứng minh được tính khả chuyển với các mẫu bệnh phẩm người dự kiến, để giúp đảm bảo tính phù hợp để sử dụng với MP đã chọn của nhà sản xuất (xem Hình 3, p.4) và quy trình được hiệu chuẩn, tức là MP đã chọn của nhà sản xuất (xem Hình 3, p.5).
CHÚ THÍCH: Chất hiệu chuẩn đang làm việc của nhà sản xuất thường là vật liệu có chất nền giống với mẫu bệnh phẩm người dự kiến được sử dụng với IVD MD cho người dùng cuối, chẳng hạn như bảng điều khiển hoặc một loạt các nhóm mẫu bệnh phẩm người.
5.4.8 MP thường trực của nhà sản xuất
MP đã chọn của nhà sản xuất (xem Hình 3, p.5) phải xác định MP được hiệu chuẩn bởi một hoặc nhiều chất hiệu chuẩn công tác của nhà sản xuất (xem Hình 3, m.4) hoặc các loại chất hiệu chuẩn cao hơn và được xác nhận về độ chọn lọc phân tích.
5.4.9 Bộ hiệu chuẩn IVD MD cho người dùng cuối
Chất hiệu chuẩn IVD MD cho người dùng cuối của nhà sản xuất (xem Hình 3, m.5) phải có giá trị được ấn định theo MP đã chọn của nhà sản xuất (xem Hình 3, p.5) và được thiết kế để hiệu chuẩn IVD MD cho người dùng cuối. Giá trị được ấn định của chất hiệu chuẩn IVD MD dành cho người dùng cuối (xem Hình 3, m.5) phải được ước tính bởi nhà sản xuất (xem 4.7), bao gồm tất cả các độ không đảm bảo đo bậc cao thích hợp cùng với độ không đảm bảo đo của từng giá trị tiếp theo. Các MP trong sơ đồ hiệu chuẩn xuống và bao gồm cả MP đã chọn của nhà sản xuất (Hình 3, p.5).
5.4.10 IVD MD của người dùng cuối
Người dùng cuối IVD MD [Hình 3, p.6] phải mô tả hệ thống đo được hiệu chuẩn bởi một hoặc nhiều hiệu chuẩn của người dùng cuối. MP này, MP cuối cùng trong sơ đồ hiệu chuẩn cho đại lượng đo xác định, được sử dụng để kiểm tra mẫu bệnh phẩm người và tạo ra các giá trị đo cuối cùng cho đại lượng đo, với độ không đảm bảo đo chuẩn tổng hợp của các giá trị được báo cáo để người dùng cuối ước tính, tính vào tính tất cả các độ không đảm bảo đo đã biết được tích lũy ở mỗi bước cao hơn trong sơ đồ hiệu chuẩn đã xác định.
5.5 Các trường hợp có máy hiệu chuẩn thông thường quốc tế xác định đại lượng đo
5.5.1 Những cân nhắc chung
Sơ đồ hiệu chuẩn được mô tả trong Hình 4 sẽ áp dụng cho các trường hợp có một hiệu chuẩn thông thường quốc tế xác định đại lượng đo (xem Hình 4, m.3) và phù hợp với các yêu cầu của ISO 15194. Đối với các loại đại lượng có thể đo này, không có RMP (xem Hình 4, p.2), không có RM chính (xem Hình 4, m.1) hoặc không có chất hiệu chuẩn chính (xem Hình 4, m.2) và không có liên kết tới SI. Giá trị được ấn định cho chất hiệu chuẩn thông thường quốc tế (xem Hình 4, m.3) có giá trị tùy ý cho đại lượng đo được ấn định bởi một giao thức ấn định giá trị đã được thống nhất quốc tế (xem Hình 4, p.3), bao gồm mức cao nhất của liên kết đo lường đối với đại lượng đo được chỉ định. Các đặc điểm cần giải quyết trong mô tả của các loại phân cấp hiệu chuẩn này được trình bày chi tiết trong 5.5.2 đến 5.5.9.
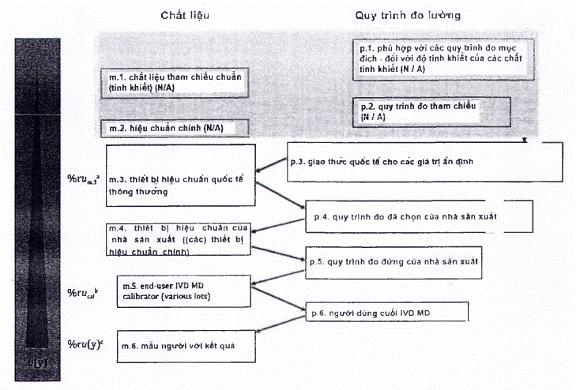
Hình 4 - Sơ đồ hiệu chuẩn - Giá trị đo được xác định bằng giao thức ấn định giá trị cho chất hiệu chuẩn thông thường quốc tế (phù hợp với ISO 15194; không có liên kết SI). Vật liệu [m.1], [m.2] và MP [p.1] và [p.2] không được áp dụng (N / A)
a Độ không đảm bảo đo ấn định giá trị kết hợp phần trăm tương đối của chất chuẩn [m.3], được tính theo công thức sau:
![]()
Trong đó ![]() là độ lệch chuẩn phần trăm tương đối (CV %) đối với MP [p.3] trong các điều kiện lặp lại, tức là độ không đảm bảo của giao thức quốc tế để ấn định giá trị của mẫu hiệu chuẩn thông thường quốc tế [m.3].
là độ lệch chuẩn phần trăm tương đối (CV %) đối với MP [p.3] trong các điều kiện lặp lại, tức là độ không đảm bảo của giao thức quốc tế để ấn định giá trị của mẫu hiệu chuẩn thông thường quốc tế [m.3].
b Độ không đảm bảo đo ấn định giá trị kết hợp phần trăm tương đối của chất hiệu chuẩn IVD MD [m.5], được tính theo công thức sau:
![]()
Trong đó ![]() và
và ![]() đại diện cho phần trăm độ không đảm bảo do chuẩn tương đối cho mỗi MP áp dụng trong sơ đồ hiệu chuẩn.
đại diện cho phần trăm độ không đảm bảo do chuẩn tương đối cho mỗi MP áp dụng trong sơ đồ hiệu chuẩn.
c Phần trăm tương đối kết hợp độ không đảm bảo đo tiêu chuẩn cho các giá trị được báo cáo của đại lượng đo với IVD MD của người dùng cuối, được tính theo công thức sau:
![]()
Trong đó ![]() là độ không đảm bảo đo chuẩn phần trăm tương đối của IVD MD dành cho người dùng cuối dựa trên độ chính xác dài hạn (điều kiện đo lặp lại).
là độ không đảm bảo đo chuẩn phần trăm tương đối của IVD MD dành cho người dùng cuối dựa trên độ chính xác dài hạn (điều kiện đo lặp lại).
5.5.2 Máy hiệu chuẩn thông thường quốc tế - Mô tả vật liệu
Chất hiệu chuẩn thông thường quốc tế (xem Hình 4, m.3) phải là chế phẩm có chứa đại lượng đo (xem 3.17). Khi thích hợp, chất hiệu chuẩn được chuẩn bị từ vật liệu được cung cấp phải có các chất nền giống với chất nền của mẫu bệnh phẩm người dự định đo bằng IVD MDs, để có nhiều khả năng (các) RM (xem Hình 4, m.3) có thể hoán đổi được, với các mẫu bệnh phẩm người trong MP (ví dụ [Hình 4, p.3, p.4 và/hoặc p.5]) mà chúng được dùng để hiệu chuẩn trong sơ đồ hiệu chuẩn đã xác định.
CHÚ THÍCH 1: Đại lượng đo thường có ở dạng đặc trưng tốt và thường được chứa trong chất nền giống như chất nền của các mẫu có nguồn gốc con người để đo bởi IVD MD cho người dùng cuối.
VÍ DỤ: Một chất hiệu chuẩn thông thường quốc tế được cung cấp trong một chất nền gần giống với các mẫu có nguồn gốc từ con người như dự định để đo bằng IVD MD được chỉ định (ví dụ: huyết thanh tổng hợp, nước tiểu tổng hợp).
CHÚ THÍCH 2: Chất hiệu chuẩn thông thường quốc tế đôi khi không có sẵn ở dạng phù hợp để sử dụng trực tiếp làm chất hiệu chuẩn trong MP. Một số chất chuẩn thông thường quốc tế được cung cấp dưới dạng bột hoặc chất đông khô, yêu cầu pha loãng với chất pha loãng thích hợp trước khi sử dụng. Trong một số trường hợp, nhà cung cấp chất hiệu chuẩn bao gồm hướng dẫn cụ thể về chuẩn bị và pha loãng trong hướng dẫn sử dụng.
CHÚ THÍCH 3: Chất hiệu chuẩn thông thường quốc tế có thể là một vật liệu đơn lẻ hoặc nhiều vật liệu, ví dụ một bảng các mẫu hoặc một loạt các nhóm mẫu, mỗi nhóm có các lượng khác nhau của đại lượng đo.
5.5.3 Chỉ định giá trị của chất hiệu chuẩn quốc tế thông thường
Một giao thức đã được thống nhất quốc tế (xem Hình 4, p.3) sẽ được sử dụng để ấn định (các) giá trị đại lượng cho (các) mẫu hiệu chuẩn thông thường quốc tế (xem Hình 4, m.3).
CHÚ THÍCH 1: Ví dụ về giao thức là một sơ đồ trong đó giá trị trung bình (sau khi loại bỏ giá trị ngoại lai) của đại lượng đo trong hiệu chuẩn thông thường quốc tế được xác định giữa một nhóm MP đã đủ điều kiện để có các đặc tính hoạt động phù hợp. Việc xác định tính phù hợp của các đặc tính tính năng thường dựa trên kết quả đo được đối với nhóm mẫu bệnh phẩm người và đặc biệt bao gồm việc xem xét: tính không chính xác, độ chọn lọc, sự tương quan, giảm sự khác biệt giữa các quy trình khi sử dụng chất hiệu chuẩn thông thường quốc tế ứng cử viên để hiệu chuẩn lại các quy trình, cùng với các đại lượng dẫn truyền chính khác.
CHÚ THÍCH 2: Ủy ban chuyên gia của WHO về tiêu chuẩn hóa sinh học (ECBS) thiết lập các RM sinh học quốc tế được gọi là "Tiêu chuẩn quốc tế (IS)" (và trước đây là "Chế phẩm tham chiếu quốc tế (IRP)") để sử dụng với quy trình sinh học và quy trình miễn dịch. Đối với lô nguyên liệu đầu tiên, "đơn vị quốc tế" được định nghĩa là một lượng nguyên liệu được chỉ định tùy ý và được đặc trưng bởi hoạt tính sinh học cụ thể của nó. Các lô tiếp theo được hiệu chuẩn bằng các phép đo cộng tác liên phòng so với vật liệu trước đó. Các lô trong một loạt được chỉ định bởi "IS thứ nhất", "IS thứ hai", v.v. (Các) giá trị được chỉ định của RM như vậy, ngay cả khi nó được tinh chế cao, có liên quan đến một MP sinh học chuyên dụng (hoặc quốc tế khác đã được thỏa thuận giao thức) không có liên kết đo lường đối với các đơn vị SI. Do đó, những vật liệu như vậy không thể được gọi là RM chính. Các RM quy ước quốc tế này chỉ có thể được sử dụng làm (các) chất chuẩn cho IVD MD nếu vật liệu được phát triển trên cơ sở định nghĩa rõ ràng về đại lượng liên quan đến ứng dụng y tế dự kiến và nếu (các) giá trị ấn định của vật liệu có độ không đảm bảo, được chấp nhận để hiệu chuẩn IVD MDs.
5.5.4 Khả năng chuyển đổi của chất hiệu chuẩn thông thường quốc tế
Khả năng chuyển đổi của chất hiệu chuẩn quốc tế thông thường với mẫu bệnh phẩm người phải được xác nhận đối với một số IVD MD đại diện khác nhau, phù hợp với mục đích sử dụng của chất hiệu chuẩn. Nhà cung cấp chất hiệu chuẩn thông thường quốc tế, trước khi xuất bản lần đầu tiên vật liệu cho mục đích sử dụng của nó, phải tiến hành đánh giá khả năng chuyển đổi. Nhà sản xuất chịu trách nhiệm xác định sơ đồ hiệu chuẩn cho IVD MD cụ thể chịu trách nhiệm đánh giá khả năng chuyển đổi bổ sung khi cần thiết để đảm bảo rằng chất hiệu chuẩn thông thường quốc tế đã chọn phù hợp để sử dụng với IVD MD được chỉ định, nếu có.
CHÚ THÍCH 1: Việc sử dụng chất nền giống mẫu bệnh phẩm người trong chất hiệu chuẩn thông thường quốc tế (hoặc bất kỳ mẫu hiệu chuẩn nào khác) không đảm bảo rằng chất hiệu chuẩn thu được thực sự là vật liệu có thể chuyển đổi được.
CHÚ THÍCH 2: Các giao thức để thực hiện đánh giá khả năng giao hoán có sẵn trong CLSI EP30-A và các khuyến nghị đã xuất bản khác [35] - [37].
CHÚ THÍCH 3: Việc lựa chọn các MP để tham gia vào một nghiên cứu về khả năng đi lại có tính đến các yếu tố như thị phần cũng như sự khác biệt về công nghệ giữa các IVD MD có sẵn để làm đại lượng quan tâm.
5.5.5 Hiệu chuẩn và lựa chọn MP đã chọn của nhà sản xuất
Một chất hiệu chuẩn thông thường quốc tế (xem Hình 4, m.3) phải được sử dụng để hiệu chuẩn MP đã chọn của nhà sản xuất (xem Hình 4, p.4). MP được chọn của nhà sản xuất (xem Hình 4, p.4) phải xác định một hệ thống đo được hiệu chuẩn bởi một hoặc nhiều chất hiệu chuẩn thông thường quốc tế. MP đã chọn, khi được hiệu chuẩn thích hợp, sẽ được sử dụng để xác định các giá trị được ấn định cho chất hiệu chuẩn đang hoạt động của nhà sản xuất (xem Hình 4, m.4).
5.5.6 Đặc điểm và ấn định giá trị của chất hiệu chuẩn đang hoạt động của nhà sản xuất
Bộ hiệu chuẩn công tác của nhà sản xuất (xem Hình 4, m.4) phải được ấn định giá trị của nó theo MP đã chọn của nhà sản xuất (xem Hình 4, p.4). Chất hiệu chuẩn công tác của nhà sản xuất (xem Hình 4, m.4) phải chứng minh được khả năng giao hoán với các mẫu bệnh phẩm người dự kiến liên quan đến MP đã chọn của nhà sản xuất (xem Hình 4, p.4) và MP đã chọn của nhà sản xuất (xem Hình 4, p.5).
CHÚ THÍCH: Các chất hiệu chuẩn công tác của nhà sản xuất thường là vật liệu có chất nền giống như mẫu bệnh phẩm người dự định đo bằng IVD MD của người dùng cuối. Trong một số trường hợp, các nhà sản xuất làm việc với các máy hiệu chuẩn bao gồm một bảng điều khiển hoặc một loạt các nhóm mẫu bệnh phẩm người.
5.5.7 MP thường trực của nhà sản xuất
MP đã chọn của nhà sản xuất (xem Hình 4, p.5) phải xác định MP được hiệu chuẩn bởi một hoặc nhiều chất hiệu chuẩn đang hoạt động của nhà sản xuất (xem Hình 4, m.4) hoặc các loại chất hiệu chuẩn cao hơn như chất hiệu chuẩn quốc tế thông thường (xem Hình 4, m.3) và được xác nhận về độ chọn lọc trong phân tích.
5.5.8 Bộ hiệu chuẩn IVD MD cho người dùng cuối
Chất hiệu chuẩn IVD MD cho người dùng cuối (xem Hình 4, m.5) phải có giá trị được ấn định theo MP đã chọn của nhà sản xuất và được thiết kế để hiệu chuẩn IVD MD cho người dùng cuối (xem Hình 4, p.6). Giá trị được ấn định của chất hiệu chuẩn IVD MD dành cho người dùng cuối (xem Hình 4, m.5) phải được ước tính bởi nhà sản xuất (xem 4.7), bao gồm tất cả các độ không đảm bảo đo bậc cao thích hợp cùng với độ không đảm bảo đo của từng giá trị tiếp theo. Các MP trong sơ đồ hiệu chuẩn xuống và bao gồm cả MP tiêu chuẩn của nhà sản xuất (xem Hình 4, p.5).
5.5.9 MD IVD của người dùng cuối
IVD MD dành cho người dùng cuối (xem Hình 4, p.6) phải mô tả hệ thống đo được hiệu chuẩn bởi một hoặc nhiều chất hiệu chuẩn của người dùng cuối. MP này, MP cuối cùng trong sơ đồ hiệu chuẩn cho đại lượng đo xác định, được sử dụng để kiểm tra mẫu bệnh phẩm người và tạo ra các giá trị đo cuối cùng cho đại lượng đo, với độ không đảm bảo đo chuẩn tổng hợp của các giá trị được báo cáo để người dùng cuối ước tính, tính vào tính tất cả các độ không đảm bảo đo đã biết được tích lũy ở mỗi bước cao hơn trong Sơ đồ hiệu chuẩn đã xác định.
5.6 Các trường hợp có liên kết đo lường được hỗ trợ bởi một giao thức hài hòa quốc tế
5.6.1 Cân nhắc chung
Sơ đồ hiệu chuẩn được mô tả trong Hình 5 sẽ áp dụng cho các trường hợp trong đó đại lượng đo trong mẫu bệnh phẩm người được xác định bởi một giao thức hài hòa quốc tế; nhưng không có RMP được quốc tế đồng ý, không có RM chính, không có RMP hoặc RM thông thường, và không có liên kết đo lường đối với SI. Các đặc điểm cần giải quyết trong mô tả của các loại phân cấp hiệu chuẩn này được trình bày chi tiết trong 5.6.2 đến 5.6.5.
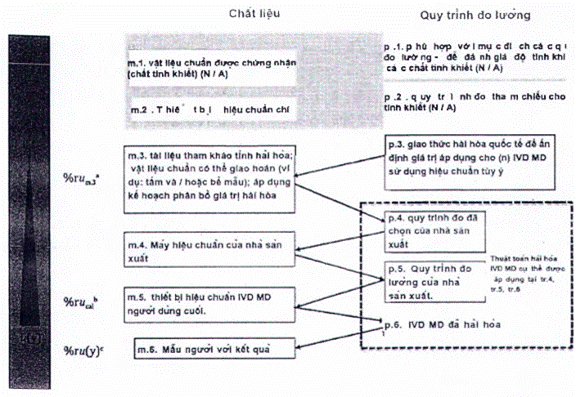
Hình 5 - Sơ đồ hiệu chuẩn - Đại lượng đo lường được xác định bởi giao thức hài hòa quốc tế (Không có CRM; không thể liên kết từ SI). Vật liệu [m.1], [m.2] và MP [p.1] và [p.2] không được áp dụng (N / A)
a Độ không đảm bảo đo ấn định giá trị kết hợp phần trăm tương đối của chất chuẩn [m.3], được tính theo công thức sau:
%rum.3 = %ruRw-p.3
Trong đó %ruRw-p.3 là độ lệch chuẩn phần trăm tương đối (CV%) đối với MP [p.3] trong các điều kiện lặp lại, tức là độ không đảm bảo của giao thức đối với việc ấn định giá trị của (các) chất hiệu chuẩn hài hòa [m.3].
b Độ không đảm bảo đo ấn định giá trị kết hợp phần trăm tương đối của chất hiệu chuẩn IVD MD [m.5], được tính theo công thức sau:
![]()
Trong đó %ruRw-p.4 và %ruRw-p.5 đại diện cho phần trăm độ không đảm bảo đo chuẩn tương đối cho mỗi IMP áp dụng trong Sơ đồ hiệu chuẩn.
c Phần trăm tương đối kết hợp độ không đảm bảo đo tiêu chuẩn cho các giá trị được báo cáo của đại lượng đo với IVD MD của người dùng cuối, được tính theo công thức sau:
![]()
Trong đó ![]() là độ không đảm bảo đo chuẩn phần trăm tương đối của IVD MD dành cho người dùng cuối dựa trên độ chính xác lâu dài (điều kiện đo lặp lại).
là độ không đảm bảo đo chuẩn phần trăm tương đối của IVD MD dành cho người dùng cuối dựa trên độ chính xác lâu dài (điều kiện đo lặp lại).
5.6.2 Nghị định hài hòa quốc tế
Giao thức hài hòa quốc tế được quy định cho đại lượng đo (xem Hình 5, p.3) phải xác định mức đo lường cao nhất trong sơ đồ hiệu chuẩn và nhằm đạt được sự tương đương của các kết quả được báo cáo đối với các mẫu bệnh phẩm người dự kiến (xem Hình 5, m.6) trong số các IVD MD cho người dùng cuối được hài hòa sẵn có (xem Hình 5, p.6) cho đại lượng đo.
CHÚ THÍCH: Có thể tìm thấy chi tiết bổ sung liên quan đến việc sử dụng và áp dụng giao thức hài hòa trong sơ đồ hiệu chuẩn có thể theo dõi đo lường trong ISO 21151.
5.6.3 Việc ấn định các giá trị cho các RM hài hòa
Giao thức hài hòa quốc tế (xem Hình 5, p.3) phải quy định quy trình được sử dụng để ấn định các giá trị hài hòa (đơn vị tùy ý, không thể theo dõi SI) cho các RM hài hòa (xem Hình 5, m.3). Giao thức hài hòa quốc tế (xem Hình 5, p.3) phải chỉ rõ cách sử dụng các RM hài hòa để ước tính mối quan hệ giữa các kết quả đối với RM hài hòa (xem Hình 5, m.3) giữa các MD của IVD (xem Hình 5, p .6) tham gia vào giao thức hài hòa. Độ không đảm bảo đo, um.3, được liên kết với các giá trị đại lượng được ấn định cho các RM hài hòa phải được ước lượng và tính vào ước tính ucal cho các chất hiệu chuẩn dành cho người dùng cuối IVD MD được chỉ định.
5.6.4 Áp dụng RM hài hòa
Mỗi nhà sản xuất IVD MD phải xác định và ghi lại thuật toán dành riêng cho IVD MD mà khi áp dụng cho (a) MP đã chọn của họ (xem Hình 5, p.4) để gán các giá trị cho chất hiệu chuẩn hoặc chất hiệu chuẩn đang hoạt động của họ (xem Hình 5, m. 4), hoặc (b) tới MP đứng của họ (xem Hình 5, p.5) để gán các giá trị cho chất hiệu chuẩn IVD MD người dùng cuối hoặc các chất hiệu chuẩn (xem Hình 5, m.5), hoặc (c) cho IVD MD hài hòa (xem Hình 5, p.6) để gán các giá trị cho mẫu bệnh phẩm người (xem Hình 5, m.6), sẽ cho phép đạt được kết quả tương đương cho các mẫu bệnh phẩm người với IVD MD được chỉ định của chúng, khi so sánh với các IVD MD khác tham gia vào giao thức hài hòa. Độ không đảm bảo đo được đưa ra bởi thuật toán hài hòa IVD MD cụ thể do từng nhà sản xuất IVD MD xác định cũng phải được tính đến và đưa vào ước lượng của thành phần độ không đảm bảo đo gia tăng tại vị trí áp dụng trong sơ đồ hiệu chuẩn, cũng như trong kết hợp cuối cùng độ không đảm bảo đo của (các) hiệu chuẩn của người dùng cuối, ucal, đối với mỗi IVD MD hài hòa.
5.6.5 MD IVD của người dùng cuối
IVD MD cho người dùng cuối (xem Hình 5, p.6) phải mô tả hệ thống đo được hiệu chuẩn bởi một hoặc nhiều chất hiệu chuẩn IVD MD cho người dùng cuối được chỉ định (xem Hình 5, m.5). MP này, MP cuối cùng trong sơ đồ hiệu chuẩn cho đại lượng đo xác định, được sử dụng để kiểm tra mẫu bệnh phẩm người và tạo ra các giá trị đo cuối cùng cho đại lượng đo, với độ không đảm bảo đo chuẩn tổng hợp của các giá trị được báo cáo để người dùng cuối ước tính, tính vào tính tất cả các độ không đảm bảo đo đã biết được tích lũy ở mỗi bước cao hơn trong sơ đồ hiệu chuẩn đã xác định.
5.7 Các trường hợp đối với đại lượng đo có liên kết đo lường chỉ đối với (các) RM được xác định tùy ý bên trong của nhà sản xuất
5.7.1 Quy định chung
Sơ đồ hiệu chuẩn được mô tả trong Hình 6 phải áp dụng cho các đại lượng đo có liên kết đo lường chỉ đối với các RM nội bộ, được xác định tùy ý của nhà sản xuất (xem Hình 6, m.3), đối với các đại lượng đo nhất định không có RM tinh khiết được chứng nhận (xem Hình 6, m.1), không có chất hiệu chuẩn đầu (xem Hình 6, m.2), không có RMP (xem Hình 6, p.3), không có giao thức hài hòa và không có liên kết đối với SI. Các đặc điểm cần giải quyết trong phần mô tả của các loại phân cấp hiệu chuẩn này được trình bày chi tiết trong 5.7.2 đến 5.7.7.
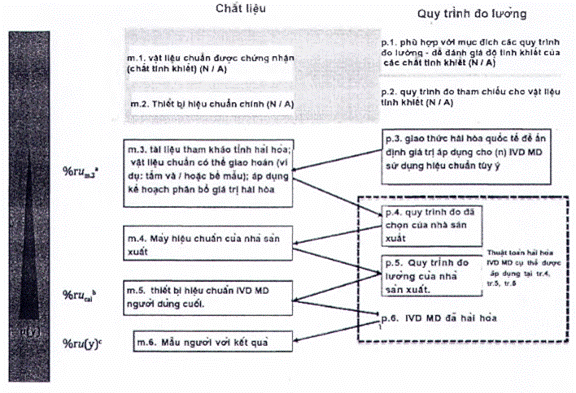
Hình 6 - Sơ đồ hiệu chuẩn - Đại lượng đo được xác định bởi các RM được xác định tùy ý nội bộ của nhà sản xuất (không có RM hoặc CRM chính; không có RMP; không có giao thức hài hòa; không thể theo dõi SI). Vật liệu [m.1] và [m.2] và MP [p.1], [p.2] và [p.3] không áp dụng được (N/A)
a Độ không đảm bảo xác định giá trị kết hợp phần trăm tương đối của chất hiệu chuẩn tùy ý [m.3].
b Độ không đảm bảo đo ấn định giá trị kết hợp phần trăm rửa giải của chất hiệu chuẩn IVD MD [m.5], được tính theo công thức sau:
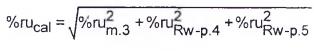
Trong đó %ruRw-p.4 và %%ruRw-p.5 đại diện cho phần trăm độ không đảm bảo đo chuẩn tương đối cho mỗi MP áp dụng trong Sơ đồ hiệu chuẩn.
c Phần trăm tương đối kết hợp độ không đảm bảo đo tiêu chuẩn cho các giá trị được báo cáo của đại lượng đo với IVD MD của người dùng cuối, được tính theo công thức sau:
![]()
Trong đó ![]() là độ không đảm bảo đo chuẩn phần trăm tương đối của IVD MD dành cho người dùng cuối dựa trên độ chính xác lâu dài (điều kiện đo lặp lại).
là độ không đảm bảo đo chuẩn phần trăm tương đối của IVD MD dành cho người dùng cuối dựa trên độ chính xác lâu dài (điều kiện đo lặp lại).
5.7.2 Lựa chọn RM
Vì các RM và MP bậc cao hơn (xem Hình 6, m.1, m.2, p.1, p.2, p.3) không tồn tại cho các loại đại lượng đo này, các RM tùy ý (xem Hình 6, m.3) phải được thiết lập, nếu có, là mức cao nhất về mặt đo lường trong Sơ đồ hiệu chuẩn xác định cho đại lượng đo.
CHÚ THÍCH 1: Để giúp đảm bảo tính nhất quán trong việc hiệu chuẩn loại IVD MD của người dùng cuối được chỉ định, các nhà sản xuất đôi khi thiết lập các MP tùy ý (xem Hình 6, p.4) và/hoặc RM tùy ý (xem Hình 6, m.3) như cấp cao nhất của các phân cấp hiệu chuẩn này.
CHÚ THÍCH 2: Các RM tùy ý (xem Hình 6, m.3) đôi khi được chuẩn bị từ, ví dụ, các dấu ấn sinh học tinh khiết, sau đó được đo bằng một MP đã chọn (xem Hình 6, p.4), cho phép hiệu chuẩn thêm và gán giá trị cho chất hiệu chuẩn đang hoạt động (xem Hình 6, m.4). Các chất hiệu chuẩn công tác như vậy thường được chuẩn bị trong chất nền mẫu bệnh phẩm người hoặc chất nền thích hợp khác, hoặc cách khác được bao gồm, ví dụ, các tấm (hoặc nhóm) mẫu bệnh phẩm người hoặc mẫu bệnh phẩm người "có gai".
5.7.3 MP do nhà sản xuất lựa chọn
Trong trường hợp nhà sản xuất thiết lập sơ đồ hiệu chuẩn độc lập bằng cách sử dụng MP đã chọn (xem Hình 6, p.4) khi không có sẵn RM cho đại lượng đo (ví dụ: MP phụ thuộc vào các đặc tính khác như khả năng hấp thụ UV; quy trình dựa trên việc đếm; v.v), MP được chọn phải là mức cao nhất về mặt đo lường trong sơ đồ hiệu chuẩn được chỉ định cho đại lượng đo xác định.
5.7.4 MP thường trực của nhà sản xuất
MP đã chọn của nhà sản xuất (xem Hình 6, p.5) phải xác định một hệ thống đo được hiệu chuẩn với chất hiệu chuẩn công tác của nhà sản xuất (xem Hình 6, m.4), hệ thống này có thể bao gồm các RM tùy ý bao gồm các tấm mẫu của người hoặc mẫu thử, hồ bơi. MP đứng (xem Hình 6, p.5) phải được sử dụng để xác định các giá trị được ấn định cho (các) chất hiệu chuẩn IVD MD dành cho người dùng cuối của nhà sản xuất (xem Hình 6, m.5).
5.7.5 Bộ hiệu chuẩn IVD MD cho người dùng cuối
Máy hiệu chuẩn IVD MD dành cho người dùng cuối của nhà sản xuất (xem Hình 6, m.5) phải có các giá trị được ấn định theo MP đã chọn của nhà sản xuất (xem Hình 6, p.5) và được thiết kế để sử dụng trong việc hiệu chuẩn của người dùng cuối IVD MD (xem Hình 6, p.6). Giá trị được ấn định của chất hiệu chuẩn IVD MD dành cho người dùng cuối (xem Hình 6, m.5) phải được ước tính bởi nhà sản xuất (xem 4.7), bao gồm tất cả các độ không đảm bảo đo bậc cao thích hợp cùng với độ không đảm bảo đo của từng giá trị tiếp theo Các MP trong sơ đồ hiệu chuẩn xuống và bao gồm cả MP đã chọn của nhà sản xuất (xem Hình 6, p.5).
5.7.6 MD IVD của người dùng cuối
IVD MD cho người dùng cuối (xem Hình 6, p.6) phải mô tả hệ thống đo được hiệu chuẩn bởi một hoặc nhiều chất hiệu chuẩn IVD MD của người dùng cuối. MP này (xem Hình 6, p.6), MP cuối cùng trong Sơ đồ hiệu chuẩn cho đại lượng đo xác định, được sử dụng để kiểm tra mẫu bệnh phẩm người và tạo ra các giá trị đo cuối cùng cho đại lượng đo (xem Hình 6, m.6), với kết hợp độ không đảm bảo đo chuẩn trong các giá trị được báo cáo để người dùng cuối ước tính, có tính đến tất cả độ không đảm bảo đo đã biết được tích lũy ở mỗi bước cao hơn trong phân cấp hiệu chuẩn đã xác định.
5.7.7 Tài liệu về sơ đồ hiệu chuẩn
Tài liệu về phân cấp hiệu chuẩn được đưa vào hồ sơ kỹ thuật của nhà sản xuất đối với IVD MD được chỉ định cho đại lượng đo có liên kết đo lường theo sơ đồ trong Hình 6 phải bao gồm các thông số kỹ thuật (do đánh giá rủi ro) và tài liệu xác nhận cho các yếu tố quan trọng hiệu suất và khả năng tái lập của sơ đồ hiệu chuẩn, bao gồm nhưng không giới hạn ở:
a) Đặc điểm kỹ thuật của nguyên liệu thô được chuẩn bị, mua, chế biến hoặc mua theo cách khác để chuẩn bị bất kỳ RM tùy ý nào (xem Hình 6, m.3, m.4) hoặc thuốc thử và các thành phần khác của MP (xem Hình 6, p.4, p.5) bao gồm các thông số kỹ thuật cho bất kỳ mẫu bệnh phẩm người nào (hoặc các bể) hoặc các loại mẫu khác được sử dụng để làm RM ở các mức khác nhau (xem Hình 6, m.3, m.4) trong Sơ đồ hiệu chuẩn.
b) Đặc điểm kỹ thuật của đại lượng đo quan tâm và bất kỳ đại lượng đo được liên quan và/hoặc đại lượng lưu thông thích hợp cho từng mục đích sử dụng lâm sàng của IVD MD được chỉ định một cách chi tiết đầy đủ để cho phép lựa chọn mẫu bệnh phẩm người có thể tái tạo và/hoặc chuẩn bị chung cho các lô RM tiếp theo (xem Hình 6, m.3, m.4) nếu có.
CHÚ THÍCH 1: Đại lượng đo có trong mỗi mẫu bệnh phẩm người được chọn làm thành viên ban hiệu chuẩn (xem Hình 6, m.3 và/hoặc m.4) được giả định để đại diện cho đại lượng đo quan tâm đối với mỗi mục đích sử dụng IVD MD đã nêu.
c) Hoặc các bước trong sơ đồ hiệu chuẩn dưới sự kiểm soát của nhà sản xuất, các thủ tục và hướng dẫn công việc để ấn định các giá trị đại lượng cho mẫu bệnh phẩm người (hoặc nhóm) hoặc các vật liệu tùy ý khác dùng để làm RM (xem Hình 6, m.3, m. 4), bao gồm mô tả các biện pháp cần thực hiện để đảm bảo tính nhất quán của quá trình ấn định giá trị cho các lô thay thế bảng hiệu chuẩn hoặc các RM tùy ý khác.
CHÚ THÍCH 2: Các RM bên trong (xem Hình 6, m.3, m.4) được nhà sản xuất ấn định giá trị bằng cách sử dụng các giao thức bao gồm, ví dụ (a) các đơn vị đo tùy ý, (b) tiêu chuẩn bổ sung các thể tích đã cân hoặc phân phối theo thể tích của a cô đặc, (c) các phép đo trực tiếp bằng cách sử dụng MP đã chọn của nhà sản xuất (xem Hình 6, p.4) (ví dụ: MP thương mại có sẵn), hoặc (d) các phương pháp có giá trị khoa học khác phù hợp với công nghệ đo và loại chất phân tích.
VÍ DỤ: Một bảng phụ gồm các mẫu bệnh phẩm người từ bảng hiệu chuẩn đầu tiên (xem Hình 6, m.3) thường được sử dụng để chuyển các giá trị được ấn định sang bảng hiệu chuẩn tiếp theo.
6 Thông tin ghi nhãn được nhà sản xuất cung cấp cho người dùng cuối
Áp dụng các yêu cầu nêu trong ISO 18113-2, 7.5.
Thư mục tài liệu tham khảo
[1] IEC 60050-300:2001, International Electrotechnical Vocabulary - Electrical and electronic measurements and measuring instruments - Part 311: General terms relating to measurements (Từ vựng kỹ thuật điện quốc tế - Phép đo điện và điện tử và dụng cụ đo lường - Phần 311: Thuật ngữ chung liên quan đến phép đo)
[2] ISO Guide 31:2015, Reference materials - Contents of certificates, labels and accompanying documentation (Mẫu chuẩn - Nội dung của chứng chỉ, nhãn và tài liệu kèm theo)
[3] ISO Guide 35:2017, Reference materials - Guidance for characterization and assessment of homogeneity and stability (Mẫu chuẩn - Hướng dẫn mô tả và đánh giá tính đồng nhất và ổn định)
[4] TCVN 9595-3:013 (ISO/IEC Guide 98-3:2008), Độ không đảm bảo đo - Phần 3: Hướng dẫn trình bày độ không đảm bảo đo (GUM: 1995)
[5] TCVN 6165:2009 (ISO/IEC Guide 99:2007), Từ vựng quốc tế về đo lường học - Khái niệm, thuật ngữ chung và cơ bản (VIM)
[6] ISO 5725-1:1994, Accuracy (trueness and precision) of measurement methods and results - Part 1: General principles and definitions (Độ chính xác (độ đúng và độ chụm) của các phương pháp đo và kết quả - Phần 1: Nguyên tắc chung và định nghĩa)
[7] TCVN ISO 9000:2015, Hệ thống quản lý chất lượng - Cơ sở và từ vựng
[8] ISO 15189:2012, Medical laboratories - Requirements for quality and competence (Phòng thí nghiệm y tế - Yêu cầu về phẩm chất và năng lực)
[9] ISO 15195, Laboratory medicine - Requirements for the competence of calibration laboratories using reference measurement procedures (Phòng thí nghiệm y học - Yêu cầu đối với năng lực của các phòng thử nghiệm hiệu chuẩn sử dụng các quy trình đo tham chiếu)
[10] ISO/TR 16476:2016, Reference materials - Establishing and expressing metrological traceability of quantity values assigned to reference materials (Mẫu chuẩn - Thiết lập và thể hiện khả năng liên kết đo lường của các giá trị đại lượng được gán cho mẫu chuẩn)
[11] TCVN ISO/IEC 17025:2017, Yêu cầu chung về năng lực của các phòng thử nghiệm và hiệu chuẩn
[12] TCVN ISO 17034:2017 (ISO 17034:2016), Yêu cầu chung về năng lực của nhà sản xuất mẫu chuẩn
[13] ISO 18113-1:2009, In vitro diagnostic medical devices - Information supplied by the manufacturer (labelling) - Part 1: Terms, definitions and general requirements (Trang thiết bị y tế chẩn đoán in vitro - Thông tin do nhà sản xuất cung cấp (dán nhãn) - Phần 1: Thuật ngữ, định nghĩa và yêu cầu chung)
[14] TCVN 13406:2021 (ISO 18153:2003), Thiết bị y tế chẩn đoán in vitro - Phép đo đại lượng trong các mẫu sinh học - Liên kết đo lường của các giá trị đối với nồng độ xúc tác của các enzym ấn định cho các bộ hiệu chuẩn và các mẫu đối chứng)
[15] ISO 20391-1:2018, Biotechnology - Cell counting - Part 1: General guidance on cell counting methods (Công nghệ sinh học - Đếm tế bào - Phần 1: Hướng dẫn chung về phương pháp đếm tế bào)
[16] ISO 20395:2019, Biotechnology - Requirements for evaluating the performance of quantification methods for nucleic acid target sequences - qPCR and dPCR (Công nghệ sinh học - Yêu cầu để đánh giá tính năng của các phương pháp đại lượng đối với trình tự mục tiêu axit nucleic - qPCR và dPCR)
[17] ISO 21151, (in development), In vitro diagnostic medical devices - Measurement of quantities in samples of biological origin - Requirements for international harmonisation protocols establishing metrological traceability of values assigned to calibrators and human samples (Thiết bị y tế chẩn đoán in vitro - Phép đo đại lượng trong các mẫu có nguồn gốc sinh học - Yêu cầu đối với các giao thức hài hòa quốc tế thiết lập khả năng liên kết đo lường của các giá trị ấn định cho các bộ hiệu chuẩn và mẫu người)
[18] CLSI Measurement Procedure Comparison and Bias Estimation Using Patient Samples - Approved Guideline. EP09-A3. Clinical and Laboratory Standards Institute, Wayne, PA, 2013 (Quy trình so sánh và ước tính độ chệch của CLSI bằng cách sử dụng mẫu bệnh nhân - Hướng dẫn đã được phê duyệt. EP09-A3. Viện Tiêu chuẩn Phòng thí nghiệm và Lâm sàng, Wayne, PA, 2013)
[19] CLSI Evaluation of Commutability of Processed Samples - Approved Guideline. EP14-A3. Clinical and Laboratory Standards Institute, Wayne, PA, 2014 (Đánh giá CLSI về khả năng giao hoán của các mẫu đã xử lý - Hướng dẫn đã được phê duyệt. EP14-A3. Viện Tiêu chuẩn Phòng thí nghiệm và Lâm sàng, Wayne, PA, 2014)
[20] CLSI Characterization and qualification of commutable reference materials for laboratory medicine - Approved Guideline. EP30-A. Clinical and Laboratory Standards Institute, Wayne, PA, 2010 (Đặc tính CLSI và năng lực của các mẫu chuẩn có thể thay thế cho y học trong phòng thí nghiệm - Hướng dẫn đã được phê duyệt. EP30-A. Viện Tiêu chuẩn Phòng thí nghiệm và Lâm sàng, Wayne, PA, 2010)
[21] Global Harmonization Task Force (GHTF), Principles of IVD Medical Devices Classification, GHTF/SG1/N045:2008 (Nhóm công tác hài hòa toàn cầu (GHTF), Nguyên tắc phân loại thiết bị y tế IVD, GHTF / SG1 / N045: 2008)
[22] Global Harmonization Task Force (GHTF), Definitions of the Terms Manufacturer, Authorised Representative, Distributor and Importer, Document GHTF/SG1/N055:2009 (Nhóm công tác hài hòa toàn cầu (GHTF), Định nghĩa của điều khoản Nhà sản xuất, Đại diện được ủy quyền, Nhà phân phối và Nhà nhập khẩu, Tài liệu GHTF / SG1 / N055: 2009)
[23] ILAC P10, 01/2013 ILAC Policy on Traceability of Measurement Results. International Laboratory Accreditation Cooperation (ILAC), PO Box 7507, Silverwater NSW 2128, Australia (Chính sách về Liên kết đo lường. Hợp tác Công nhận Phòng thí nghiệm Quốc tế (ILAC))
[24] OIML V1 2013, Vocabulaire international des termes de métrologie légale (VIML), International Organization for Legal Metrology (Tổ chức Đo lường Pháp lý Quốc tế)
[25] Emons H et al., New definitions on reference materials. Accred Qual Assur. 2006; 10(10):576- 578 (Các định nghĩa mới về mẫu chuẩn)
[26] Harmonization.net. https://www.harmonization.net/media/1004/tool_box_2013.pdf (accessed 19/03/2018)
[27] Joint Committee for Traceability in Laboratory Medicine (JCTLM) FAQs. http://www.bipm.org/en/committees/jc/jctlm/jctlm-faq.html, accessed 14 April 2016 (Ủy ban Hỗn hợp về Liên kết trong Y học Phòng thí nghiệm)
[28] Joint Committee for Traceability in Laboratory Medicine (JCTLM). https://www.bipm.org/jctlm/ (Ủy ban Hỗn hợp về Liên kết trong Y học Phòng thí nghiệm)
[29] WHO, Guidelines for the preparation, characterization and establishment of international and other standards and reference reagents for biological substances. Techn Rep Ser 1990; No.800 (Annex 4):181-214 (Hướng dẫn chuẩn bị, mô tả đặc tính và thiết lập các tiêu chuẩn quốc tế và các tiêu chuẩn khác và thuốc thử tham chiếu cho các chất sinh học)
[30] Panteghini M., Traceability, Reference Systems and Result Comparability. Clin Biochem Rev. 2007; 28(3):97-104 (Liên kết, Hệ thống Tham chiếu và Khả năng So sánh Kết quả)
[31] Sandberg S et al., Defining analytical performance specifications: Consensus Statement from the 1st Strategic Conference of the European Federation of Clinical Chemistry and Laboratory Medicine. Clin Chem Lab Med. 2015; 53(6):833-5 (Xác định các thông số kỹ thuật phân tích: Tuyên bố Đồng thuận từ Hội nghị Chiến lược lần thứ nhất của Liên đoàn Châu Âu về Hóa học Lâm sàng và Y học Phòng thí nghiệm)
[32] Braga F et al., Verification of in vitro medical diagnostics (IVD) metrological traceability: responsibilities and strategies. Clin Chim Acta. 2014; 432:55-61 (Xác minh khả năng liên kết đo lường chẩn đoán y tế in vitro(IVD): trách nhiệm và chiến lược)
[33] Braga F et al., Performance criteria for combined uncertainty budget in the implementation of metrological traceability. Clin Chem Lab Med. 2015; 53(6):905-12 (Tiêu chí thực hiện cho ngân sách không đảm bảo kết hợp trong việc thực hiện liên kết đo lường)
[34] Braga F et al., Defining permissible limits for the combined uncertainty budget in the implementation of metrological traceability. Clin Biochem. 2018 Mar 8. pii: S0009-9120(18)30053-5. doi: 10.1016/j.clinbiochem.2018.03.007. [Epub ahead of print] (Xác định các giới hạn cho phép đối với ngân sách độ không đảm bảo kết hợp trong việc thực hiện liên kết đo lường)
[35] Miller WG, Schimmel H, Rej R et al., IFCC Working Group Recommendations for Assessing Commutability Part 1: General Experimental Design. Clin Chem. 2018; 64(3):447-454 (Khuyến nghị để đánh giá khả năng giao hoán Phần 1: Thiết kế thử nghiệm chung)
[36] Nilsson G et al., IFCC Working Group Recommendations for Assessing Commutability Part 2: Using the Difference in Bias between a Reference Material and Clinical Samples. Clin Chem. 2018; 64(3):455-464 (Khuyến nghị để đánh giá khả năng giao hoán Phần 2: Sử dụng sự khác biệt về độ chệch giữa mẫu chuẩn và mẫu lâm sàng)
[37] Budd JR et al., IFCC Working Group Recommendations for Assessing Commutability Part 3: Using the Calibration Effectiveness of a Reference Material. Clin Chem. 2018; 64(3):465-474 (Khuyến nghị để đánh giá khả năng giao hoán Phần 3: Sử dụng hiệu quả hiệu chuẩn của mẫu chuẩn)
[38] Draft of the ninth SI Brochure, 11 December 2015, https:// w w w.bipm.org/utils/common/pdf/si-brochure-draft-2016.pdf, accessed 11/10/2017 (Bản thảo Sách giới thiệu SI thứ chín)
[39] Westwood SW et al., Mass Balance Method for the SI Value Assignment of the Purity of Organic Compounds. Anal Chem. 2013; 85(6):3118-3126 (Phương pháp cân bằng khối lượng để chỉ định giá trị SI của độ tinh khiết của các hợp chất hữu cơ)
[40] Stebbings R et al., Quantification of cells with specific phenotypes I: Determination of CD4+cell count per microliter in reconstituted lyophilized human PBMC prelabeled with anti-CD4 FITC antibody. Cytometry A. 2015; 87(3):244-253 (Đại lượng tế bào có kiểu hình cụ thể I: Xác định số lượng tế bào CD4 + trên mỗi microlit trong PBMC người đông khô hoàn nguyên được dán nhãn với kháng thể FITC kháng CD4)
[41] Whale AS, Jones GM, Pavšič J, Dreo T, Redshaw N et al., Assessment of Digital PCR as a Primary Reference Measurement Procedure to Support Advances in Precision Medicine. Clin Chem. 2018; 64 (9), Published June 14, 2018 as doi:10.1373/clinchem.2017.285478 (Đánh giá PCR kỹ thuật số như một quy trình đo tham chiếu chính để hỗ trợ những tiến bộ trong y học chính xác)
[42] Kammel M et at., Flow cytometer for reference measurements of blood cell concentrations with low uncertainties. Medical Measurements and Applications (MeMeA) (IEEE 2015) 517-520. DOI: 10.1109/MeMeA.2015.7145258 (Máy đo lưu lượng tế bào để đo tham chiếu nồng độ tế bào máu với độ không đảm bảo thấp. Đo lường và Ứng dụng Y tế)
[43] Yoo HB et al., An International Comparison of Enumeration-based Quantification of DNA Copy-concentration Using Flow Cytometric Counting and Digital Polymerase Chain Reaction. Anal Chem. 2016; 88(24): 12169-12176 (So sánh quốc tế về Đại lượng dựa trên phương pháp liệt kê nồng độ bản sao DNA bằng cách sử dụng phương pháp đếm tế bào dòng chảy và phản ứng chuỗi polymerase kỹ thuật số)
[44] International Federation of Clinical Chemistry and Laboratory Medicine (IFCC). IFCC External Quality Assessment Scheme for Reference (calibration) Laboratories in Laboratory Medicine (RELA), Rev. 1.3 (2008), http:// w w w.dgkl-rf b.de:81/IFCC _EQAS_ProcManual.pdf (Chương trình Đánh giá Chất lượng Bên ngoài của IFCC cho các Phòng thí nghiệm tham chiếu (hiệu chuẩn) trong Y học Phòng thí nghiệm (RELA))
[45] Moser K A et al., Chromogenic factor VIII activity assay, Am J Hematol.2014; 89(7):781 (Thử nghiệm hoạt tính của yếu tố nhiễm sắc thể VIII)
[46] Schumann G et al., IFCC Primary Reference Procedures for the Measurement of Catalytic Activity Concentrations of Enzymes at 37 °C. Part 2. Reference Procedure for the Measurement of Catalytic Concentration of Creatine Kinase. Clin Chem Lab Med. 2002; 40(6):635-642 (Quy trình tham chiếu chính của IFCC để đo nồng độ hoạt động xúc tác của enzym ở 37 ° C. Phần 2. Quy trình tham chiếu để đo nồng độ xúc tác của Creatine Kinase)
[47] Toussaint B. et al., Traceability of values for catalytic activity concentration of enzymes: a Certified Reference Material for aspartate transaminase. Clin Chem Lab Med. 2010; 48(6):795- 803 (Liên kết các giá trị cho nồng độ hoạt tính xúc tác của các enzym: Mẫu chuẩn được chứng nhận cho aspartate transaminase)
[48] Finke A et al., Preparation of a candidate primary reference material for the international standardisation of HbA1c determinations. Clin Chem Lab Med. 1998; 36(5):299-308 (Chuẩn bị mẫu chuẩn chính ứng cử đề tiêu chuẩn hóa quốc tế các phép xác định HbA1c)
[49] Jeppsson J-O et al., Approved IFCC reference method for the measurement of HbA1c in human blood. Clin Chem Lab Med. 2002; 40(1):78-89 (Phương pháp tham chiếu IFCC đã chấp nhận để đo FlbA1c trong máu người)
[50] Kobold u et al., Candidate reference methods for HbA1c based on peptide mapping. Clin Chem.1997; 43(10): 1944-51 (Các phương pháp tham chiếu ứng cử cho HbA1c dựa trên ánh xạ peptit)
[51] Rzychon M et al., Analysis of the Physicochemical state of C-Reactive Protein in Different Preparations Including 2 Certified Reference Materials. Clin Chem. 2010; 56(9): 1475-1482 (Phân tích trạng thái hóa lý của protein phản ứng C trong các chế phẩm khác nhau bao gồm 2 mẫu chuẩn được chứng nhận)
MỤC LỤC
1 Phạm vi áp dụng
2 Tài liệu viện dẫn
3 Thuật ngữ và định nghĩa
4 Yêu cầu chung nhà sản xuất phải đáp ứng để thiết lập, xác nhận và lập hồ sơ liên kết đo lường của các giá trị mẫu bệnh phẩm người được xác định với IVD MD quy định
5 Phân cấp hiệu chuẩn mô hình để liên kết đo lường
6 Thông tin ghi nhãn được nhà sản xuất cung cấp cho người dùng cuối
Thư mục tài liệu tham khảo
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 13402:2021 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 13402:2021 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 13402:2021 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 13402:2021 DOC (Bản Word)