- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 8127:2018 ISO 10273:2017 Vi sinh vật trong chuỗi thực phẩm - Phương pháp phát hiện Yersinia enterrocolitica gây bệnh
| Số hiệu: | TCVN 8127:2018 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Thực phẩm-Dược phẩm |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
28/12/2018 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 8127:2018
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 8127:2018
TIÊU CHUẨN QUỐC GIA
TCVN 8127:2018
ISO 10273:2017
VI SINH VẬT TRONG CHUỖI THỰC PHẨM - PHƯƠNG PHÁP PHÁT HIỆN YERSINIA ENTERROCOLITICA GÂY BỆNH
Microbiology of the food chain - Horizontal method for the detection of pathogenic Yersinia enterocolitica
Lời nói đầu
TCVN 8127:2018 thay thế TCVN 8127:2009;
TCVN 8127:2018 hoàn toàn tương đương với ISO 10273:2017;
TCVN 8127:2018 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC/F13 Phương pháp phân tích và lấy mẫu biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Lời giới thiệu
Tiêu chuẩn này quy định phương pháp phát hiện Yersinia enterocolitica gây bệnh cho con người. Do tính đa dạng của thực phẩm và thức ăn chăn nuôi nên phương pháp này có thể không thích hợp đến từng chi tiết cho từng sản phẩm cụ thể và đối với một số sản phẩm khác cần sử dụng các phương pháp khác nhau. Trong trường hợp này, có thể sử dụng các phương pháp khác đặc trưng cho từng sản phẩm, nếu hoàn toàn chỉ vì lý do kỹ thuật. Tuy nhiên, cần cố gắng áp dụng phương pháp này khi có thể.
Việc hài hòa các phương pháp thử có thể không thực hiện được ngay và đối với một vài nhóm sản phẩm có thể tồn tại các tiêu chuẩn quốc tế và/hoặc tiêu chuẩn quốc gia mà không phù hợp với tiêu chuẩn này. Thông thường khi các tiêu chuẩn như thế được soát xét thì chúng phải được sửa đổi để phù hợp với tiêu chuẩn này, sao cho chỉ giữ lại các phần của phương pháp này cần cho các lý do kỹ thuật được thừa nhận.
VI SINH VẬT CHUỖI THỰC PHẨM - PHƯƠNG PHÁP PHÁT HIỆN YERSINIA ENTEROCOLITICA GÂY BỆNH
Microbiology of food chain - Horizontal method for the detection of pathogenic Yersinia enterocolitica
CẢNH BÁO - Để bảo vệ sức khỏe của nhân viên phòng thử nghiệm, điều cần thiết là các phép thử phát hiện Yersinia enterocolitica gây bệnh chỉ được thực hiện trong các phòng thử nghiệm được trang bị đầy đủ, dưới sự kiểm soát của nhà vi sinh vật học có kỹ năng và cẩn thận khi thải bỏ tất cả các vật liệu đã ủ. Người sử dụng tiêu chuẩn này phải có kinh nghiệm với thực hành phòng thử nghiệm thông thường. Tiêu chuẩn này không đề cập đến tất cả các khía cạnh an toàn, nếu có, chỉ liên quan đến việc sử dụng tiêu chuẩn. Người sử dụng có trách nhiệm thiết lập các vấn đề an toàn và sức khỏe phù hợp và đảm bảo tuân thủ các quy định hiện hành.
1 Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp phát hiện Y. enterocolitica gây bệnh cho con người. Tiêu chuẩn này có thể áp dụng cho:
- các sản phẩm thực phẩm và thức ăn chăn nuôi; và
- các mẫu môi trường trong khu vực sản xuất và chế biến thực phẩm.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 6404 (ISO 7218), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Yêu cầu chung và hướng dẫn kiểm tra vi sinh vật
TCVN 6507 (ISO 6887) (tất cả các phần), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử, dung dịch huyền phù ban đầu và các dung dịch pha loãng thập phân để kiểm tra vi sinh vật
TCVN 8128:2015 (ISO 11133:2014), Vi sinh vật trong thực phẩm, thức ăn chăn nuôi và nước - Chuẩn bị, sản xuất, bảo quản và thử hiệu năng của môi trường nuôi cấy
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng các thuật ngữ và định nghĩa sau đây:
3.1
Yersinia enterocolitica gây bệnh (pathogenic Yersinia enterocolitica)
Vi khuẩn ưa lạnh tạo thành các khuẩn lạc đặc trưng trên môi trường đặc chọn lọc và có các đặc tính sinh hóa và phân tử đáp ứng các tiêu chí về tính gây bệnh như mô tả, khi tiến hành phép thử khẳng định theo tiêu chuẩn này.
3.2
Phát hiện Yersinia enterocolitica gây bệnh (detection of pathogenic Yersinia enterocolitica)
Xác định sự có mặt hay không có mặt vi khuẩn Yersinia enterocolitica (3.1) trong một lượng hoặc một thể tích xác định của sản phẩm hoặc bề mặt quy định, khi tiến hành thử theo tiêu chuẩn này.
4 Từ viết tắt
Trong tiêu chuẩn này sử dụng các từ viết tắt sau đây:
| CEB | Canh thang tăng sinh lạnh (cold enrichment broth) |
| CIN | Cefsulodin, Irgasan™ và Novobiocin (cefsulodin, Irgasan™ and Novobiocin) |
| CR-MOX | Đỏ congo magie-oxalat (congo red magnesium-oxalate) |
| ITC | Irgasan™, Ticarcillin và kali clorat (Irgasan™, Ticarcillin and potassium chlorate) |
| KOH | kali hydroxit (potassium hydroxide) |
| MRB | canh thang rappaport cải biến (modified rappaport broth) |
| PCR | phản ứng chuỗi polymerase (polymerase chain reaction) |
| PSB | pepton, sorbitol và muối mật (peptone, sorbitol and bile salts) |
| TSB | canh thang tryptic đậu tương (tryptic soy broth) |
| WDCM | Trung tâm dữ liệu thế giới về vi sinh vật (World data centre for microorganisms) |
5 Nguyên tắc
5.1 Yêu cầu chung
Việc phát hiện Y. enterocolitica gây bệnh bao gồm bốn giai đoạn liên tiếp (xem Phụ lục A về sơ đồ quy trình và khẳng định). Ngoài các quy trình chung, ví dụ trong điều tra dịch bệnh, có thể sử dụng quy trình tăng sinh lạnh tùy chọn như trong Phụ lục D.
5.2 Nuôi cấy trực tiếp từ môi trường tăng sinh lỏng
Mẫu đã được đồng nhất, cho vào môi trường tăng sinh lỏng (canh thang PSB), sau đó cấy một lượng quy định vào hai đến bốn thạch đĩa CIN[15]. Ủ các đĩa đã nuôi cấy ở 30 °C trong 24 h.
CHÚ THÍCH: Cũng có thể sử dụng thêm các đĩa môi trường thạch sinh màu để phát hiện Y. enterocolitica gây bệnh [9,13,18].
5.3 Tăng sinh trong môi trường tăng sinh lỏng chọn lọc và môi trường tăng sinh lỏng
Chuyển một lượng quy định của mẫu thử được nuôi cấy trong môi trường tăng sinh PSB (5.2) vào canh thang tăng sinh chọn lọc ITC [17]. Canh thang ITC và huyền phù PSB ban đầu được ủ ở 25 °C trong 44 h.
5.4 Cấy đĩa sau khi tăng sinh và nhận dạng
Từ dịch cấy tăng sinh thu được trong 5.3, cấy lên bề mặt thạch đĩa CIN bằng cách đầu tiên chuyển một lượng quy định dịch cấy tăng sinh (5.3, xem Điều 10 về cách tiến hành) vào dung dịch KOH 0,5 % và sau khi trộn đều trong một khoảng thời gian xác định (xử lý bằng KOH hoặc kiềm), cấy lên đĩa CIN. Các đĩa ria cấy được ủ ở 30 °C trong 24 h. Nhận biết các khuẩn lạc điển hình của Y. enterocolitica gây bệnh (xem 10.5) và xác nhận hình thái khuẩn lạc như là Y. enterocolitica giả định trên đĩa thạch chọn lọc (xem 10.5).
CHÚ THÍCH: Cũng có thể sử dụng thêm các đĩa như môi trường thạch sinh màu để phát hiện Y. enterocolitica gây bệnh [9,13,18].
5.5 Khẳng định
Từ các khuẩn lạc Yersinia enterocolitica gây bệnh giả định (5.2 và 5.4), khẳng định Y. enterocolitica gây bệnh bằng các phép thử khẳng định phân tử hoặc/và các phép thử sinh hóa thích hợp (xem 10.6 và Hình A.2).
6 Thuốc thử và môi trường nuôi cấy
Về thực hành trong phòng thử nghiệm hiện hành, xem TCVN 6404 (ISO 7218).
Về các yêu cầu cụ thể về đảm bảo chất lượng và hiệu năng của môi trường, xem Phụ lục B của TCVN 8128 (ISO 11133).
Thành phần của môi trường nuôi cấy, thuốc thử và quy trình chuẩn bị được nêu trong Phụ lục B. Ngoài ra, cũng có thể sử dụng các môi trường hoàn chỉnh khô, các dịch pha loãng hoặc môi trường chuẩn bị có sẵn tuân thủ theo hướng dẫn của nhà sản xuất.
7 Thiết bị, dụng cụ và vật tư
Có thể dùng dụng cụ sử dụng một lần thay thế cho dụng cụ thủy tinh sử dụng nhiều lần, nếu có các quy định thích hợp. Sử dụng các thiết bị, dụng cụ của phòng thử nghiệm vi sinh thông thường [TCVN 6404 (ISO 7218)] và cụ thể như sau:
7.1 Thiết bị khử trùng khô (tủ sấy) hoặc thiết bị khử trùng ướt (nồi hấp áp lực)
Theo quy định trong TCVN 6404 (ISO 7218).
7.2 Tủ ấm, theo quy định trong TCVN 6404 (ISO 7218), có thể duy trì nhiệt độ ở 4 °C ± 2 °C, 25 °C ± 1 °C, 30 °C ± 1 °C và 37 °C ± 1 °C.
7.3 Túi trộn, ống nghiệm, chai và/hoặc bình cầu vô trùng, có dung tích thích hợp.
7.4 Đĩa Petri, bằng thủy tinh hoặc bằng chất dẻo, có đường kính 90 mm và kích thước lớn (đường kính khoảng 140 mm (tùy chọn).
7.5 Pipet chia vạch hoặc tự động, có miệng rộng, dung tích danh định 1 ml và 10 ml và được chia vạch tương ứng 0,1 ml và 0,5 ml và pipet Pasteur.
7.6 Que cấy vòng và bộ dàn mẫu. Vòng cấy vô trùng đường kính khoảng 6 mm (thể tích 10 µl), que cấy thẳng hoặc dây kim loại. Bộ dàn mẫu chữ T hoặc chữ L dùng một lần. Tăm bông (xem Phụ lục D).
7.7 Kính hiển vi soi nổi, được trang bị đèn chiếu sáng truyền qua trường tối hoặc chếch một góc (góc 45°).
7.8 Máy trộn nhu động.
8 Lấy mẫu
Việc lấy mẫu không quy định trong tiêu chuẩn này, xem tiêu chuẩn cụ thể phù hợp cho sản phẩm có liên quan. Nếu không có tiêu chuẩn cụ thể thì các bên liên quan cần thỏa thuận về vấn đề này.
Nên sử dụng các kỹ thuật lấy mẫu quy định trong các tiêu chuẩn sau:
- TCVN 11923 (ISO/TS 17728) đối với thực phẩm và thức ăn chăn nuôi;
- TCVN 10782 (ISO 13307) đối với giai đoạn sản xuất ban đầu;
- TCVN 7925 (ISO 17604) đối với thân thịt;
- TCVN 8129 (ISO 18593) đối với các mẫu môi trường.
Điều quan trọng là phòng thử nghiệm nhận được đúng mẫu đại diện và không bị hư hỏng hoặc biến đổi trong quá trình vận chuyển và bảo quản.
9 Chuẩn bị mẫu thử
Chuẩn bị mẫu thử từ mẫu phòng thử nghiệm theo tiêu chuẩn cụ thể có liên quan đến sản phẩm. Nếu không có tiêu chuẩn cụ thể thì các bên có liên quan cần thỏa thuận về vấn đề này.
10 Cách tiến hành (xem Phụ lục A)
10.1 Phần mẫu thử và huyền phù ban đầu
10.1.1 Xem phần có liên quan của bộ TCVN 6507 (ISO 6887) (tất cả các phần) hoặc tiêu chuẩn thích hợp đối với sản phẩm có liên quan.
10.1.2 Trong trường hợp chung, để chuẩn bị huyền phù ban đầu, sử dụng môi trường tiền tăng sinh làm dịch pha loãng như quy định trong B.2 (canh thang PSB). Làm ấm trước canh thang PSB đến nhiệt độ phòng trước khi sử dụng.
Thông thường, một lượng mẫu thử (khối lượng hoặc thể tích) được cho vào một lượng PSB (khối lượng hoặc thể tích) để tạo ra dung dịch pha loãng mười lần. Thường là 25 g mẫu thử được trộn với 225 ml PSB.
Đồng hóa huyền phù này bằng cách sử dụng máy trộn nhu động (7.8) trong 1 min.
Tiêu chuẩn này đã được xác nhận giá trị sử dụng cho các phần mẫu thử 25 g hoặc 25 ml. Có thể sử dụng một phần thử nhỏ hơn, mà không cần xác nhận giá trị sử dụng/kiểm tra bổ sung, với điều kiện là duy trì được cùng tỷ lệ giữa canh thang tăng sinh với phần mẫu thử. Có thể sử dụng phần mẫu thử lớn hơn so với lượng được xác nhận ban đầu, nếu nghiên cứu xác nhận giá trị sử dụng/kiểm tra cho thấy không ảnh hưởng đến việc phát hiện Y. enterocolitica gây bệnh.
CHÚ THÍCH: Việc xác nhận giá trị sử dụng phải được thực hiện theo các phần thích hợp của TCVN (ISO 16140) (tất cả các phần). Việc kiểm tra xác nhận các mẫu tổng hợp có thể được thực hiện theo quy trình nêu trong TCVN 6707-1 (ISO 6887-1), Phụ lục D (quy trình kiểm tra xác nhận đối với mẫu tổng hợp về thử nghiệm định tính).
10.1.3 Chuẩn bị dung dịch huyền phù ITC tăng sinh chọn lọc bằng cách chuyển 10 ml huyền phù PSB (10.1.2) vào 90 ml canh thang ITC (B.3) và trộn.
10.2 Cấy trực tiếp lên đĩa thạch chọn lọc
Lấy 1 ml huyền phù PSB ban đầu chưa tăng sinh thu được (10.1.2) vào hai đến bốn thạch đĩa CIN (B.6) và dàn đều trên các đĩa, sử dụng bộ dàn mẫu (7.6).
Lật ngược các đĩa CIN và đặt chúng vào tủ ấm ở 30 °C (7.2) trong 24 h ± 2 h.
CHÚ THÍCH 1: Trước khi ủ, có thể cần làm khô các thạch đĩa CIN (ví dụ: trong tủ cấy thoáng khí) trong nửa giờ để hấp thụ hoàn toàn dịch cấy vào thạch.
CHÚ THÍCH 2: Số lượng thạch đĩa CIN cần sử dụng phụ thuộc vào mức dự kiến về hệ vi khuẩn nền trong mẫu.
10.3 Tăng sinh
Ủ huyền phù ban đầu trong PSB (10.1.2) và canh thang tăng sinh chọn lọc ITC (10.1.3) ở 25 °C (7.2) trong 44 h ± 4 h (không khuấy trộn).
10.4 Cấy đĩa và ủ ấm
10.4.1 Cấy lên thạch đĩa CIN môi trường tăng sinh PSB và ITC đã xử lý bằng KOH
Dùng pipet vô trùng (7.5) chuyển 0,5 ml môi trường tăng sinh PSB (10.3) vào 4,5 ml dung dịch kali hydroxit (B.5) (được chuẩn bị trong ngày sử dụng) trộn đều[7]. Sau 20 s ± 5 s bổ sung môi trường tăng sinh PSB vào dung dịch KOH, dùng vòng cấy (7.6) ria cấy lên bề mặt thạch đĩa CIN (B.6) sao cho thu được các khuẩn lạc riêng rẽ. Lặp lại quy trình với môi trường tăng sinh ITC (10.3).
CHÚ THÍCH 1: Điều quan trọng đối với hiệu năng của phương pháp là chuẩn bị KOH trong ngày, trước khi sử dụng, xem Phụ lục B và Phụ lục C.
Lật úp các đĩa CIN và đặt vào tủ ấm ở 30 °C (7.2) trong 24 h ± 2 h.
CHÚ THÍCH 2: Ngoài ra, có thể ria cấy [dùng vòng cấy (7.6)] các thạch đĩa CIN với PSB và ITC chưa xử lý (không xử lý với KOH).
CHÚ THÍCH 3: Trong quá trình xử lý KOH, môi trường tăng sinh được pha loãng 10 lần. Ngoài ra, việc xử lý có thể làm giảm số lượng vi khuẩn gây bệnh Y. enterocolitica trong dung dịch. Do đó, trong một số trường hợp, có thể ria cấy đĩa thạch CIN bổ sung 0,1 ml dịch cấy.
10.4.2 Cấy lên thạch sinh màu môi trường tăng sinh PSB và ITC xử lý bằng KOH (tùy chọn)
Lặp lại quy trình trong 10.4.1 và nuôi cấy, sau khi xử lý KOH, sử dụng vòng cấy (7.6), ria cấy lên bề mặt của đĩa thạch sinh màu [9,13,18] sao cho thu được các khuẩn lạc riêng rẽ.
Ủ các đĩa thạch sinh màu theo hướng dẫn của nhà sản xuất.
10.5 Nhận biết các khuẩn lạc điển hình
Sau khi ủ 24 h ± 2 h, kiểm tra các đĩa CIN để phát hiện sự có mặt các khuẩn lạc điển hình của Y. enterocolitica. Nên sử dụng kính hiển vi soi nổi (7.7) được trang bị đèn chiếu sáng truyền qua trường tối hoặc chếch một góc 45°.
Trên thạch CIN, Y. enterocolitica gây bệnh có khuẩn lạc nhỏ (khoảng 1 mm hoặc nhỏ hơn), hình tròn, bờ đều trơn nhẵn. Các khuẩn lạc có viền nhỏ màu đỏ đậm, sắc nét (“mắt bò”) bao quanh. Viền bao quanh mờ hoặc đục và khi kiểm tra với ánh sáng truyền chéo, các hạt nhỏ mịn và không óng ánh.
CHÚ THÍCH 1: Ánh sáng truyền qua trường tối hoặc xiên góc giúp phân biệt các khuẩn lạc Yersinia enterocolitica điển hình so với các khuẩn lạc tương tự của các loài Yersinia khác [12] và một số loài không phải Yersinia.
CHÚ THÍCH 2: Trong trường hợp hệ vi khuẩn nền mọc dày đặc trên đĩa CIN, kích thước khuẩn lạc Y. enterocolitica gây bệnh có thể nhỏ hơn và tâm đỏ điển hình có thể không rõ ràng hoặc không có.
10.6 Khẳng định
10.6.1 Yêu cầu chung
Cần sử dụng các chủng kiểm chứng của các loài Yersinia đặc biệt là để phân biệt giữa Yersinia enterocolitica gây bệnh và các loài Yersinia khác trên thạch CIN. Cần sử dụng các chủng kiểm chứng âm và kiểm chứng dương thích hợp cho mỗi phép thử khẳng định. Các ví dụ thích hợp về các chủng kiểm chứng được nêu trong các phần liên quan với các phép kiểm chứng này. Sơ đồ khẳng định được nêu trong Hình A.2.
10.6.2 Chọn các khuẩn lạc để khẳng định
Để khẳng định, lấy từ mỗi đĩa các môi trường chọn lọc (xem 10.3), năm khuẩn lạc được coi là điển hình của Y. enterocolitica gây bệnh nếu có sẵn (xem 10.5).
Ria cấy các khuẩn lạc đã chọn lên bề mặt thạch đĩa CIN (B.6) sao cho có các khuẩn lạc riêng rẽ. Đồng thời ria cấy các chủng Y. enterocolitica kiểm chứng typ huyết thanh sinh học (typ huyết thanh sinh học) 4/0:3; 2/0:9, typ sinh học 1A và các loài Yersinia khác để so sánh hình thái khuẩn lạc.
Ngoài ra, nên ria cấy các khuẩn lạc điển hình để khẳng định và các chủng kiểm chứng thích hợp trên thạch sinh màu song song với ria cấy trên thạch CIN. Để nhận dạng các khuẩn lạc điển hình trên thạch sinh màu, tiến hành theo hướng dẫn của nhà sản xuất về đánh giá hình thái điển hình của khuẩn lạc.
VÍ DỤ: Các chủng Y. enterocolitica kiểm chứng phù hợp là WDCM 00216 (typ huyết thanh sinh học 4/0:3), WDCM 00215 (typ huyết thanh sinh học 2/0:9) và WDCM 00160 (typ huyết thanh sinh học 1B/0:8).
Lật úp các đĩa và đặt vào tủ ấm cài đặt ở nhiệt độ 30 °C (7.2) trong 24 h ± 2 h.
Kiểm tra các đĩa đã ủ các khuẩn lạc đặc trưng (xem 10.5) và độ thuần khiết của chủng cấy. Điều này được thực hiện với sự trợ giúp của kính hiển soi vi nổi (7.7). So sánh hình thái của các khuẩn lạc nghi ngờ với các khuẩn lạc của các chủng kiểm chứng để phân biệt rõ hơn giữa các khuẩn lạc điển hình và không điển hình. Loại bỏ các đĩa có các khuẩn lạc không điển hình. Nếu trên đĩa có khuẩn lạc điển hình và không điển hình thì cấy truyền các khuẩn lạc điển hình lên các thạch đĩa CIN (B.6) và ủ như trên.
Tiến hành với một đĩa cấy thuần đại diện cho các khuẩn lạc điển hình ban đầu trên đĩa gốc. Giữ lại đĩa cấy các khuẩn lạc thuần điển hình khác (đến năm đĩa khuẩn lạc, nếu có) để khẳng định trong trường hợp đĩa cấy đầu tiên không khẳng định được. Ria cấy các khuẩn lạc đã chọn lên bề mặt thạch không chọn lọc (ví dụ: thạch dinh dưỡng (B.7), thạch máu hoặc thạch trypton đậu tương) sao cho thu được các khuẩn lạc riêng rẽ.
Lật úp các đĩa đã cấy và đặt vào tủ ấm ở 30 °C (7.2) trong 18 h đến 24 h hoặc cho đến khi khuẩn lạc phát triển tốt.
Sử dụng các chủng cấy thuần để khẳng định sinh hóa và để thử nghiệm tính gây bệnh.
CHÚ THÍCH 1: Không bắt buộc phải khẳng định từ tất cả các bước tăng sinh tiếp theo nếu Y. enterocolitica gây bệnh đã được khẳng định ngay từ bước đầu.
CHÚ THÍCH 2: Đối với các mục đích dịch tễ học hoặc trong quá trình điều tra dịch bệnh thì việc khẳng định các khuẩn lạc bổ sung, ví dụ: năm khuẩn lạc điển hình hoặc nghi ngờ từ mỗi môi trường tăng sinh chọn lọc/kết hợp môi trường phân lập, có thể có ích.
10.6.3 Xác định các loài Yersinia gây bệnh
10.6.3.1 Phát hiện urease
Ria cấy các khuẩn lạc lên bề mặt nghiêng của thạch (B.10). Nới lỏng nắp ống nghiệm sao cho không khí có thể đi vào và tạo điều kiện phát triển hiếu khí.
Ủ ở 30 °C (7.2) trong 24 h ± 2 h.
Màu hồng tím hoặc đỏ hồng là phản ứng urease dương tính.
Ví dụ: Chủng kiểm chứng dương tính phù hợp là WDCM 00216 (Y. enterocolitica, typ huyết thanh sinh học 4/0:3) hoặc WDCM 00160 (Y. enterocolitica, typ huyết thanh sinh học 1B/0:8).
Màu vàng-cam là phản ứng urease âm tính.
Giữ lại tất cả các khuẩn lạc urease dương tính và có hình thái khuẩn lạc điển hình để khẳng định thêm.
CHÚ THÍCH 1: Các chủng Y. enterocolitica gây bệnh được cấy trên một số loại thạch urê có bán sẵn có thể cần thêm thời gian (lên đến 7 ngày) để cho phản dương tính.
CHÚ THÍCH 2: Cũng có các chủng Y. enterocolitica gây bệnh cho phản ứng urease âm tính, nhưng rất hiếm (0,01 %).
10.6.3.2 Thủy phân esculin
Ria cấy vi khuẩn trên bề mặt thạch nghiêng (B.12).
Ủ ấm ở 30 °C (7.2) trong 24 h ± 2 h.
Sau khi ủ thấy có quầng đen quanh các khuẩn lạc chứng tỏ phản ứng dương tính.
VÍ DỤ: Chủng kiểm chứng âm thích hợp là WDCM 00216 (Y. enterocolitica, typ huyết thanh sinh học 4/0:3) hoặc WDCM 000160 (Y. enterocolitica, typ huyết thanh sinh học 1B/0:8) và chủng kiểm chứng dương là bất kỳ chủng Y. enterocolitica nào có typ sinh học 1A điển hình hoặc Y. intermedia WDCM 00217.
CHÚ THÍCH: Phép thử thủy phân esculin này tương đương với phép thử lên men salicin trong việc xác định khả năng gây bệnh.
10.6.3.3 Phát hiện plasmid độc lực (pYV) bằng phép thử trên thạch CR-MOX
Y.enterocolitica gây bệnh liên kết với đỏ Congo để hình thành các khuẩn lạc nhỏ như đầu đinh ghim (pin-point) điển hình ở 37 °C. Plasmid độc lực (pYV) xác định các đặc điểm liên quan đến khả năng gây bệnh của Yersinia và nhiều trong số đó, kể cả sự phát triển phụ thuộc vào canxi chỉ ở 37 °C.
Plasmid độc lực (pYV) có thể tự mát đi trong quá trình bảo quản tại phòng thử nghiệm, khi nuôi cấy lâu dài và các bước lặp lại. Do đó, phép thử kiểm tra plasmid độc (thử nghiệm CR-MOX) phải được thực hiện ở giai đoạn khẳng định sớm.
Sử dụng vòng cấy (7.6) lấy vài khuẩn lạc của chủng cấy thuần đã chọn để khẳng định tiếp (urease dương tính, hình thái của khuẩn lạc điển hình). Cấy vào bề mặt thạch CR-MOX (B.11) sao cho thu được các khuẩn lạc riêng rẽ.
Ủ ấm ở 37 °C (7.2) trong khoảng từ 24 h đến 48 h.
Nếu cần, kiểm tra các đĩa dương tính có chứa khuẩn lạc pYV sau 24 h và ủ tiếp 24 h nữa, nếu chưa thấy có khuẩn lạc dương tính.
Đĩa cho phản ứng dương tính có chứa các khuẩn lạc nhỏ như đầu đinh ghim (liên kết đỏ congo) sắc tố cam đỏ rõ nét (phát triển phụ thuộc vào canxi ở 37 °C) và có thể là các khuẩn lạc lớn hơn không màu. Đĩa cho phản ứng âm tính chỉ chứa các khuẩn lạc không màu.
CHÚ THÍCH 1: Trong dịch cấy thuần, thông thường một số khuẩn lạc có chứa các tế bào mang plasmid độc lực pYV, trong khi các khuẩn lạc khác trong cùng mẻ cấy lại chứa các tế bào không mang plasmid. Khi chuẩn bị dịch cấy cho thử nghiệm này, dùng que cấy lấy vài khuẩn lạc để tránh chỉ chọn phải các tế bào vi khuẩn không mang plasmid.
CHÚ THÍCH 2: Để phân biệt rõ hơn giữa các phản ứng dương tính và âm tính, tốt nhất là cấy song song hai đĩa CR-MOX từ cùng một chủng cấy thử nghiệm và ủ một đĩa ở 37 °C (7.2) và một đĩa ở 25 °C (7.2 ). Đĩa ủ ở 25 °C (7.2) luôn cho phản ứng âm tính (ngay cả khi chùng đó có chứa pYV). Do đó, có thể quan sát rõ sự khác nhau giữa kết quả dương tính được chứng nhận ở 37 °C (7.2) và phản ứng âm tính ở 25 °C (7.2).
Kiểm chứng dương thích hợp là bất kỳ chủng Y. enterocolitica gây bệnh nào đã được kiểm tra xác nhận mang plasmid độc, trước khi sử dụng.
VÍ DỤ: Chủng kiểm chứng dương thích hợp là WDCM 00216 (Y. enterocolitica, typ huyết thanh sinh học 4/0:3) và chủng kiểm chứng âm là WDCM 00160 (Y. enterocolitica, typ huyết thanh sinh học 1B/0:8, plasmid tự do) hoặc WDCM 00217 (Y. intermedia).
Vì plasmid độc lực (pYV) có thể bị mất đi trong quá trình nuôi cấy truyền trong phòng thử nghiệm, nên cần tiếp tục khẳng định với các chủng cho phản ứng âm tính trong phép thử.
Ngoài ra, cần bảo quản các chủng dương bằng cách đông lạnh chủng cấy gốc ở giai đoạn đầu của quá trình khẳng định [tốt nhất là sau khi có phản ứng urease dương tính (10.6.3.1) và phép thử CR-MOX (10.6.3.3)].
Ví dụ về bảo quản các chủng được nêu dưới đây (có thể dùng các phương pháp bảo quản dịch cấy thích hợp khác):
- cấy truyền ngay từng dịch cấy thuần vào TSB (B.8):
- ủ ở 30 °C (7.2) trong 24 h ± 2 h;
- thêm một thể tích tương đương của glycerol 40 % vô trùng (B.9) để có được nồng độ glycerol cuối cùng là 20 %;
- trộn đều và cấp đông, tốt nhất ở -70 °C.
10.6.3.4 Phát hiện pyrazinamidase
Cấy một vòng cấy (7.6) đầy các khuẩn lạc lên hết mặt thạch nghiêng (B.13) của môi trường. Ủ ở 30 °C (7.2) trong 48 h ± 4 h.
Thêm 1 ml dung dịch sắt(II) amoni sulfat 1 % (B.14) mới chuẩn bị (trong ngày sử dụng).
Nếu phản ứng dương tính, xuất hiện màu nâu hồng trong vòng 15 min cho thấy sự có mặt axit pyrazinoic được hình thành do enzym pyrazinamidase.
VÍ DỤ: Chủng kiểm chứng âm thích hợp là WDCM 00216 (Y. enterocolitica, typ huyết thanh sinh học 4/0:3) hoặc WDCM 000160 (Y. enterocolitica, typ huyết thanh sinh học 1B/0:8) và chủng kiểm chứng dương là bất kỳ chủng Y. enterocolitica có typ sinh học 1A điển hình nào hoặc Y. intermedia WDCM 00217.
CHÚ THÍCH: Khả năng các phản ứng dương tính giả tăng nếu sử dụng dung dịch sắt(II) amoni sulfat 1 % đã chuẩn bị lâu ngày.
10.6.3.5 Phát hiện pyrazinamidase
Chủng cấy Yersinia gây bệnh nếu cho phản ứng urease dương tính, esculin và pyrazinamidase âm tính. Ngoài ra, sự có mặt của plasmid độc lực pYV (10.6.3.3) là một dấu hiệu chắc chắn về khả năng gây bệnh [10,14]. Để khẳng định Y. enterocolitica gây bệnh, tiến hành theo 10.6.4.
10.6.4 Khẳng định Y. enterocolitica gây bệnh
10.6.4.1 Yêu cầu chung
Sau khi xác định Yersinia gây bệnh tiến hành khẳng định Y. enterocolitica. Điều này chỉ cần nếu phép thử trong 10.6.3 cho thấy sự có mặt của loài Yersinia gây bệnh.
10.6.4.2 Lysin decarboxylase và arginin dihydrolase
Dùng que cấy (7.6) cấy vi khuẩn vào từng môi trường lỏng ở ngay dưới bề mặt (B.15). Nếu ống không đầy môi trường và không kín khí thì phủ bề mặt bằng dầu Vaselin®2) nóng chảy (được gia nhiệt sau đó làm nguội ngay sao cho vẫn giữ ở dạng lỏng) hoặc paraffin dạng lỏng vô trùng.
Ủ ở 30 °C (7.2) trong 24 h ± 2 h.
Môi trường có màu tím sau khi ủ là phản ứng dương tính.
Môi trường có màu vàng là phản ứng âm tính.
10.6.4.3 Phenylalanin (tryptophan) deaminase
Cấy vi khuẩn lên một khoảng rộng của bề mặt thạch nghiêng (B.16) của môi trường.
Ủ ở 30 °C (7.2) trong 24 h ± 2 h.
Nhỏ 2 giọt đến 3 giọt dung dịch sắt (III) clorua 10 % (B.17) lên khuẩn lạc mọc trên bề mặt thạch nghiêng.
Nếu thấy có màu xanh là phản ứng dương tính.
10.6.4.4 Lên men sucrose, sorbitol, rhamnose và melibiose
Cấy vi khuẩn vào từng môi trường (B.18) ngay dưới bề mặt chất lỏng.
Ủ ở 30 °C (7.2) trong 24 h ± 2 h.
Môi trường có màu vàng sau khi ủ là phản ứng dương tính.
Môi trường có màu đỏ là phản ứng âm tính.
10.6.4.5 Sử dụng citrat (Simmon's citrate) (tùy chọn)
Dùng que cấy (7.6) lấy một khuẩn lạc riêng rẽ của một chủng được thử nghiệm và trộn kỹ với một giọt dung dịch muối (B.4).
CHÚ THÍCH 1: Bước rửa bằng muối loại bỏ chất dinh dưỡng dư thừa từ môi trường cấy và hỗ trợ để tránh cho kết quả dương tính giả và giải quyết sự cố. Việc ủ quá lâu có thể cũng gây ra phản ứng dương tính giả.
CHÚ THÍCH 2: Phép thử có thể cho phản ứng dương tính giả trong một số kít thử nhận biết sinh hóa có bán sẵn.
Cấy huyền phù lên thạch (B.19) và ủ ở 30 °C (7.2) trong 24 ± 2 h.
Phản ứng dương tính nếu có vi khuẩn mọc và môi trường chuyển màu xanh. Phản ứng có màu xanh mờ cũng được coi là dương tính.
VÍ DỤ: Chủng kiểm chứng dương phù hợp là Y. intermedia WDCM 00217 (kiểm chứng dương) và Y. enterocolitica WDCM 00216 (typ huyết thanh sinh học 4/0:3, kiểm chứng âm) hoặc WDCM 000160 (Y. enterocolitica, typ huyết thanh sinh học 1B/0:8, kiểm chứng âm).
CHÚ THÍCH 3: Phép thử này có ích trong việc phân biệt giữa Y. enterocolitica (phản ứng âm tính) và nhiều loài có liên quan như Y. intermedia, Y. frederiksenii, Y. rohdei và Y. aldovae (phản ứng dương tính và phản ứng thay đổi).
10.6.4.6 Các phép thử khẳng định thay thế
Trong phép thử khẳng định khả năng gây bệnh của Y. enterocolitica, có thể thay các phép thử sinh hóa 10.6.3 và 10.6.4 bằng phép thử PCR real-time nhằm vào gen-ail theo TCVN 11924 (ISO/TS 18867) (xem Hình A.2 và Tài liệu tham khảo [6]). Tuy nhiên, trong trường hợp phản ứng PCR real-time dương tính thì bắt buộc phải tiến hành phát hiện pyrazinamidase (10.6.3.4) để thu được kết quả thử nghiệm theo tiêu chuẩn này.
Nếu được chứng minh là đáng tin cậy, có thể sử dụng các bộ sưu tập thu nhỏ để nhận dạng sinh hóa của Y. enterocolitica [xem TCVN 6404 (ISO 7218)]. Các bộ sưu tập này tối thiểu phải bao gồm các phép thử sinh hóa được quy định trong tiêu chuẩn này.
CHÚ THÍCH 1: Có thể dùng các quy trình thay thế để khẳng định chủng phân lập là Y. enterocolitica, cung cấp tính phù hợp của các quy trình thay thế đã được kiểm tra xác nhận [xem TCVN 6404 (ISO 7218)].
CHÚ THÍCH 2: Một số quy trình nhận biết thay thế có thể xác định không chính xác loài gần nhất của các loài Yersinia là Y. enterocolitica.
10.6.5 Diễn giải kết quả của các phép thử khẳng định Y. enterocolitica
Y. enterocolitica cho các kết quả theo Bảng 1.
Bảng 1 - Diễn giải kết quả các phép thử khẳng định đối với Yersinia enterocolitica
| Phép thử | Phản ứng |
| Ure (10.6.3.1) | + |
| Lysin decarboxylase (10.6.4.2) | - |
| Arginin dihydrolase (10.6.4.2) |
|
| Phenylalanin/Tryptophan deaminase (10.6.4.3) | - |
| Sucrose (10.6.4.4) | +a |
| Sorbitol (10.6.4.4) | +a |
| Rhamnose (10.6.4.4) | - |
| Melibiose (10.6.4.4) | - |
| Xitrat (10.6.4.5) | - |
| a Có thể gặp các chủng âm tính thuộc typ sinh học gây bệnh. | |
10.6.6 Diễn giải các kết quả thử khẳng định đối với Y. enterocolitica gây bệnh
Y. enterocolitica gây bệnh được phát hiện nếu có ít nhất một khuẩn lạc urease dương tính và esculin và pyrazinamidase âm tính (10.6.3.5) và thể hiện các đặc tính của Y. enterocolitica nêu trong Bảng 1 (10.6.5).
Đối với việc diễn giải kết quả của PCR real-time (khẳng định lựa chọn thay thế), xem Phụ lục A, Hình A.2 và TCVN 11924 (ISO/TS 18867).
10.7 Đánh glá typ sinh học của Y. enterocolitica (tùy chọn)
10.7.1 Yêu cầu chung
Ngoài các phép thử esculin (10.6.3.2) và pyrazinamidase (10.6.3.4), quá trình đánh giá typ sinh học hoàn chỉnh bao gồm các phép thử xylose, tween-esterase/lipase, salicin (tùy chọn), trehalose và indole.
Sử dụng các chủng kiểm chứng thích hợp cho mỗi lần thử trong đánh giá typ sinh học.
VÍ DỤ: Chủng kiểm chứng dương tính thích hợp cho tất cả các phép thử là bất kỳ chủng Y. enterocolitica nào có typ sinh học 1A điển hình. Y. enterocolitica WDCM 000160 (typ sinh học 1B/0:8) phù hợp cho kiểm chứng dương đối với tất cả các phép thử khác (10.7.1 đến 10.7.4) trừ phép thử salicin (10.7.3). Y. intermedia WDCM 00217 thích hợp làm kiểm chứng dương tính cho tất cả các phép thử khác (10.7.1 đến 10.7.4) trừ phép thử tween-esterase (10.7.2). Một ví dụ khác về chủng kiểm chứng âm thích hợp cho các phép thử xylose (10.7.1), tween-esterase (10.7.2), salicin (10.7.3) và indole (10.7.4) là WDCM 00216 (Y. enterocolitica, typ huyết thanh sinh học 4/0:3).
10.7.2 Lên men xylose
Cấy vi khuẩn vào môi trường (B.18) ngay dưới bề mặt của chất lỏng.
Ủ ở 30 °C (7.2) trong 24 h ± 2 h.
Môi trường có màu vàng sau khi ủ là phản ứng dương tính.
Môi trường có màu đỏ là phản ứng âm tính.
10.7.3 Phép thử tween-esterase
Ria cấy vi khuẩn lên bề mặt của đĩa thạch (B.20).
Ủ ở 25 °C (7.2) trong 44 h ± 4 h.
Phản ứng là dương tính nếu xuất hiện quầng mờ đục kết tủa (do các tinh thể canxi oleate).
CHÚ THÍCH: Một số chủng Y. enterocolitica có khả năng gây bệnh điển hình typ sinh học 1B có thể cho phản ứng dương tính chậm hoặc yếu trong thử nghiệm tween-esterase. Phản ứng dương tính của chúng có thể quan sát tốt hơn trong môi trường thạch lòng đỏ trứng (phép thử lipase) [11].
10.7.4 Lên men salicin (tùy chọn) và trehalose
Cấy vi khuẩn vào từng môi trường (B.18) ngay dưới bề mặt của chất lỏng.
Ủ ở 30 °C (7.2) trong 24 h ± 2 h.
Môi trường có màu vàng sau khi ủ là phản ứng dương tính.
Môi trường có màu đỏ là phản ứng âm tính.
10.7.5 Hình thành indole
Cấy vi khuẩn vào ống môi trường trypton/tryptophan (B.21). Sử dụng ít nhất năm khuẩn lạc để nuôi cấy.
Ủ ở 30 °C (7.2) trong 48 h ± 4 h.
Nhỏ 1 ml thuốc thử Kovac (B.22) và để ở nhiệt độ phòng từ 10 min đến 15 min.
Môi trường có màu đỏ là phản ứng dương tính.
Môi trường có màu vàng/nâu là phản ứng âm tính.
10.7.6 Diễn giải thử nghiệm typ sinh học
Dựa vào phép thử esculin (10.6.3.2), pyrazinamidase (10.6.3.4) và các phép thử xylose, tween-esterase (lipase), trehalose và indole (10.7.2 đến 10.7.5). Các chủng Y. enterocolitica có thể được chia thành các typ sinh học (Bảng 2). Theo các phản ứng của phép thử, các chủng Y. enterocolitica được coi là gây bệnh nếu chúng thuộc các typ sinh học 1B, 2, 3, 4 hoặc 5. Có thể thực hiện các phép thử sinh hóa bổ sung.
Đối với mục đích dịch tễ học, cần xác định các kháng nguyên somatic của Y. enterocolitica. Các chủng gây bệnh có typ huyết thanh thường gặp là các typ huyết thanh 0:3, 0:8, 0:9 hoặc 0:5,27 khi sử dụng kháng huyết thanh thích hợp.
Nếu các phép thử esculin, xylose và pyrazinamidase cho phản ứng âm tính thì kết quả cho thấy typ sinh học 4. Điều này có thể được khẳng định bằng cách xác định typ huyết thanh vì typ huyết thanh sinh học 4/0:3 chiếm tỷ lệ cao nhất ở nhiều quốc gia [8].
Bảng 2 - Các typ huyết thanh của Yersinia enterocolitica
| Phản ứng | Typ huyết thanha | |||||
| 1Ab | 1B | 2 | 3 | 4 | 5 | |
| Esculin/Salicin | + | - | - | - | - | - |
| Xylose | + | + | + | + | - | Dd |
| Pyrazinamidase | + | - | - | - | - | - |
| Tween-esterase/Lipase | + | +c | - | - | - | - |
| Trehalose | + | + | + | + | + | - |
| Indole | + | + | + | - | - | - |
| a Các chủng thuộc typ sinh học 1B, 2, 3, 4 và 5 chứa các plasmid độc lực pYV (10.6.3.3) mà có thể mất đi trong quá trình cấy truyền trong phòng thử nghiệm. b Thường được coi là không gây bệnh. Tuy nhiên, có các chỉ thị cho thấy một tỷ lệ nhỏ của các chủng 1A có thể gây bệnh [16]. c Phản ứng tween-esterase có thể yếu hoặc chậm (xem 10.7.3). d D: thường yếu hoặc chậm. | ||||||
11 Biểu thị kết quả
Theo diễn giải kết quả cho thấy Yersinia enterocolitica gây bệnh được phát hiện hoặc không phát hiện có trong phần mẫu thử x g hoặc x ml sản phẩm [xem TCVN 6404 (ISO 7218)], hoặc trên một diện tích bề mặt hoặc trong tăm bông.
12 Đặc tính hiệu năng của phương pháp
12.1 Nghiên cứu liên phòng
Các đặc tính hiệu năng của phương pháp được xác định trong một nghiên cứu liên phòng (hoặc các nghiên cứu) để xác định độ đặc hiệu, độ đáp ứng và LOD50 của phương pháp. Dữ liệu được thống kê trong Phụ lục C. Các giá trị thu được từ nghiên cứu liên phòng này có thể không áp dụng được cho các loại thực phẩm khác với các loại thực phẩm nêu trong Phụ lục C.
12.2 Độ đáp ứng
Độ đáp ứng được xác định là số mẫu dương tính tìm thấy được chia cho số mẫu dương tính thực được thử nghiệm ở mức nhiễm đã nêu. Do đó, các kết quả phụ thuộc vào mức nhiễm của mẫu.
12.3 Độ đặc hiệu
Độ đặc hiệu được xác định là số mẫu âm tính tìm thấy được chia cho số lượng mẫu âm tính thực (hoặc mẫu trắng) được thử nghiệm.
12.4 LOD50
LOD50 là nồng độ (cfu/mẫu) mà xác suất phát hiện là 50 %.
13 Báo cáo kết quả thử nghiệm
Báo cáo thử nghiệm phải ghi rõ:
- phương pháp thử đã sử dụng, viện dẫn tiêu chuẩn này;
- phương pháp lấy mẫu đã sử dụng, nếu biết;
- cỡ phần mẫu thử và/hoặc bản chất của mẫu được kiểm tra;
- mọi chi tiết thao tác không quy định trong tiêu chuẩn này, hoặc tùy chọn cùng với các chi tiết bất thường khác có thể ảnh hưởng tới kết quả;
- mọi thay đổi về môi trường hoặc điều kiện ủ được sử dụng;
- mọi thông tin cần thiết để nhận biết đầy đủ về mẫu thử;
- các kết quả thử nghiệm thu được;
- ngày thử nghiệm.
Báo cáo kết quả cũng phải nêu rõ nếu các phép thử tiếp theo phải được hoặc đã được thực hiện trong phòng thử nghiệm chuẩn, nếu sẵn có thì nêu các kết quả thu được.
14 Bảo đảm chất lượng
Phòng thử nghiệm phải có một hệ thống kiểm soát chất lượng được xác định rõ ràng để đảm bảo rằng thiết bị, thuốc thử và kỹ thuật thích hợp cho các phép thử. Việc sử dụng các kiểm chứng dương tính, kiểm chứng âm tính và mẫu trắng là một phần của phép thử. Việc kiểm tra hiệu năng của môi trường nuôi cấy được quy định trong B.23 và trong TCVN 8128 (ISO 11133)].
Phụ lục A
(Quy định)
Sơ đồ quy trình
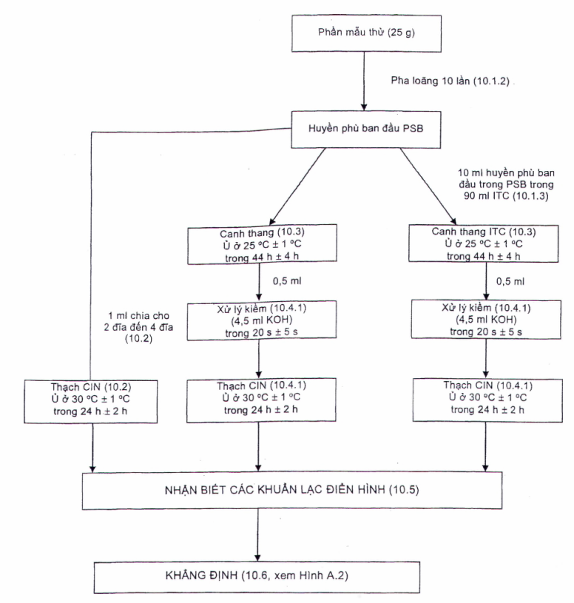
Hình A.1 - Sơ đồ quy trình phát hiện Y. enterocolitica gây bệnh trong các mẫu thực phẩm, thức ăn chăn nuôi và môi trường
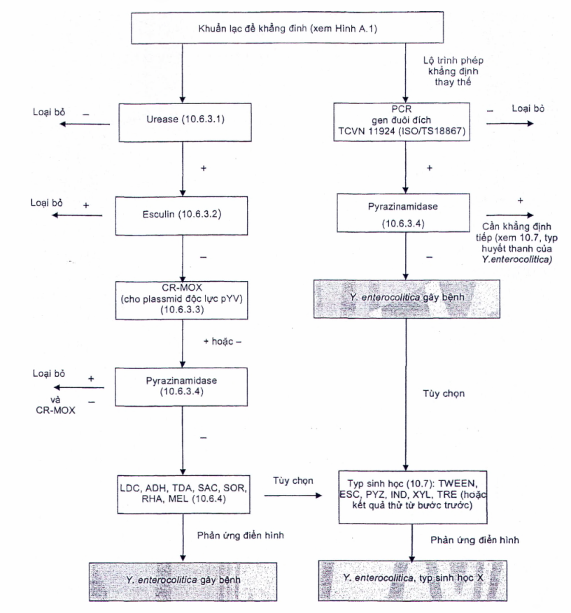
CHÚ THÍCH: PCR real-time gen đuôi đích có thể được sử dụng để sàng lọc mẫu dương trong canh thang PSB sau khi ủ 24 h ± 2h ở 25 °C (7.2). Xem TCVN 11924 (ISO/TS 18867) về quy trình chi tiết.
Hình A.2 - Sơ đồ khẳng định Y. enterocolitica gây bệnh
Phụ lục B
(Quy định)
Thành phần và cách chuẩn bị môi trường nuôi cấy và thuốc thử
B.1 Yêu cầu chung
Các quy định chung của TCVN 8128 (ISO 11133) có thể áp dụng để chuẩn bị và kiểm tra hiệu năng của môi trường nuôi cấy nêu trong phụ lục này. Nếu môi trường nuôi cấy hoặc thuốc thử được chuẩn bị từ các môi trường/thuốc thử hoàn chỉnh khô hoặc sử dụng các môi trường/thuốc thử bán sẵn để sử dụng, thì thực hiện theo hướng dẫn của nhà sản xuất về việc chuẩn bị, điều kiện bảo quản, hạn sử dụng và cách sử dụng.
Thời hạn sử dụng của các môi trường được nêu trong phụ lục này đã được nêu trong một số nghiên cứu. Người sử dụng phải xác nhận lại hạn sử dụng trong điều kiện bảo quản của mình [xem TCVN 8128 (ISO 11133)].
Thử nghiệm hiệu năng về đảm bảo chất lượng của môi trường nuôi cấy được nêu trong B.23.
B.2 Canh thang pepton, sorbitol và muối mật (PSB)
B.2.1 Thành phần
| Sản phẩm thủy phân casein bằng enzym | 5,0 g |
| Sorbitol | 10,0 g |
| Natri clorua | 5,0 g |
| Dinatri hydro phosphat (Na2HPO4) | 8,23 g |
| Natri dihydro phosphat ngậm một phân tử nước (NaH2PO4.H2O) | 1,2 g |
| Muối mật | 1,5 g |
| Nước | 1 000 ml |
B.2.2 Chuẩn bị
Hòa tan các thành phần hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun nóng nếu cần. Chỉnh pH để sau khi khử trùng, pH là 7,6 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường vào các ống nghiệm hoặc bình (7.3) có dung tích thích hợp cho các mẫu thử (xem 10.1.2).
Khử trùng 15 min trong nồi hấp áp lực (7.1) ở nhiệt độ 121 °C.
B.3 Canh thang Irgasan™, ticarcillin và kali clorat (ITC); canh thang triclosan, ticarcillin clorat (TTC)
B.3.1 Môi trường cơ bản
B.3.1.1 Thành phần
| Sản phẩm thủy phân casein bằng enzym | 10,0 g |
| Chất chiết nấm men | 1,0 g |
| Magie clorua ngậm sáu phân tử nước (MgCl2.6H2O) | 60,0 g |
| Natri clorua (NaCl) | 5,0 g |
| Xanh lục malachit, dung dịch 0,2 % | 5,0 ml |
| Nước | 1 000 ml |
B.3.1.2 Chuẩn bị
Hòa tan các thành phần hoặc môi trường cơ bản khô trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH, sao cho sau khi khử trùng pH là 6,9 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường cơ bản vào các bình cầu (7.3) có dung tích thích hợp để thu được các lượng cần thiết (ví dụ: 988 ml đối với 1 l môi trường hoàn chỉnh).
Khử trùng 15 min trong nồi hấp áp lực (7.1) ở nhiệt độ 121 °C.
B.3.2 Dung dịch Ticarcillin (1 mg/ml)
B.2.2.1 Thành phần
| Ticarcillin | 10,0 mg |
| Nước | 10 ml |
B.3.2.2 Chuẩn bị
Hòa tan ticarcillin trong nước. Lọc để khử trùng.
B.3.3 Dung dịch triclosan (Irasan™) [5-clo-2-(2,4-diclorophenoxy)phenol] trong etanol (1 mg/ml)
B.3.3.1 Thành phần
| Triclosan | 10,0 mg |
| Etanol, 95 % (thể tích) | 10,0 ml |
B.3.3.2 Chuẩn bị
Hòa tan triclosan trong etanol khi cần dùng hoặc dung dịch này được bảo quản ở khoảng -20 °C trong không quá 4 tuần.
B.3.4 Dung dịch kali clorat (100 mg/ml)
B.3.4.1 Thành phần
| Kali clorat (KClO3) | 10,0 g |
| Nước | 100 ml |
B.3.4.2 Chuẩn bị
Hòa tan kali clorat trong nước. Lọc để khử trùng.
B.3.5 Môi trường hoàn chỉnh
B.3.5.1 Thành phần
| Môi trường cơ bản (B.3.1) | 988 ml |
| Dung dịch ticarcillin (B.3.2) | 1 ml |
| Dung dịch triclosan (B.3.3) | 1 ml |
| Dung dịch kali clorat (B.3.4) | 10 ml |
B.3.5.2 Chuẩn bị
Cho ticarcillin, triclosan và dung dịch kali clorat một cách vô trùng vào môi trường cơ bản đã được làm nguội đến 47 °C và trộn đều.
Phân phối 90 ml môi trường này một cách vô trùng vào các bình cầu có dung tích thích hợp (xem 10.1.3), sao cho thu được tỷ lệ diện tích/thể tích là tối thiểu (kỵ khí tương đối).
B.4 Dung dịch muối
B.4.1 Thành phần
| Natri clorua (NaCl) | 9,0 g |
| Nước | 1 000 ml |
B.4.2 Chuẩn bị
Hòa tan natri clorua trong nước.
Phân phối dung dịch vào các bình cầu (7.3) có dung tích thích hợp.
Khử trùng 15 min trong nồi hấp áp lực (7.1) ở nhiệt độ 121 °C.
B.5 Kali hydroxit (KOH) trong dung dịch muối
B.5.1 Thành phần
| Kali hydroxit (KOH) | 0,5 g |
| Dung dịch muối vô trùng (0,9 % NaCl, xem B.2) | 100 ml |
B.5.2 Chuẩn bị
Hòa tan kali hydroxit trong dung dịch muối vô trùng.
Phân phối dung dịch vào các bình cầu (7.3) có dung tích thích hợp.
Chuẩn bị dung dịch KOH trong ngày sử dụng.
B.6 Thạch cefsulodin, Irgasan™ (triclosan) và novobioxin (CIN)
B.6.1 Môi trường cơ bản
B.6.1.1 Thành phần
| Sản phẩm thủy phân gelatin bằng enzym | 17,0 g |
| Sản phẩm thủy phân casein và mô động vật bằng enzym | 3,0 g |
| Chất chiết nấm men | 2,0 g |
| Manitol | 20,0 g |
| Natri pyruvat | 2,0 g |
| Natri clorua | 1,0 g |
| Magie sulfat ngậm bảy phân tử nước (MgSO4.7H2O) | 0,01 g |
| Natri desoxycholat | 0,5 g |
| Đỏ trung tính | 0,03 g |
| Tím tinh thể | 0,001 g |
| Thạch | 12,0 g |
| Nước | 1 000 ml |
B.6.1.2 Chuẩn bị
Hòa tan các thành phần hoặc môi trường cơ bản khô trong nước bằng cách đun nóng.
Chỉnh pH, sao cho sau khi khử trùng pH là 7,4 ± 0,2 ở 25 °C nếu cần.
Phân phối môi trường vào các bình cầu (7.3) có dung tích thích hợp để thu được các phần cần thiết (ví dụ: 997 ml cho 1 lít môi trường hoàn chỉnh).
Khử trùng 15 min trong nồi hấp áp lực (7.1) ở nhiệt độ 121 °C.
B.6.2 Dung dịch cefsulodin (15 mg/ml)
B.6.2.1 Thành phần
| Cefsulodin | 1,5 g |
| Nước | 100 ml |
B.6.2.2 Chuẩn bị
Hòa tan cefsulodin trong nước. Lọc để khử trùng.
B.6.3 Dung dịch Triclosan (Igrasan™) [5-cloro-2-(2,4-diclorophenoxy)phenol] trong etanol (4 mg/ml)
B.6.3.1 Thành phần
| Triclosan | 0,4 g |
| Etanol, 95 % (thể tích) | 100 ml |
B.6.3.2 Chuẩn bị
Hòa tan triclosan trong etanol khi cần dùng hoặc dung dịch này được bảo quản ở khoảng - 20 °C trong không quá 4 tuần.
B.6.4 Dung dịch novobiocin (2,5 mg/ml)
B.6.4.1 Thành phần
| Novobiocin | 0,25 g |
| Nước | 100 ml |
B.6.4.2 Chuẩn bị
Hòa tan novobiocin trong nước. Lọc để khử trùng.
B.6.5 Môi trường hoàn chỉnh
B.6.5.1 Thành phần
| Môi trường cơ bản (B.6.1) | 997 ml |
| Dung dịch cefsulodin (B.6.2) | 1 ml |
| Dung dịch Triclosan (B.6.3) | 1 ml |
| Dung dịch novobiocin (B.6.4) | 1 ml |
B.6.5.2 Chuẩn bị
Cho từng dung dịch kháng sinh này một cách vô trùng vào môi trường cơ bản đã được làm nguội đến khoảng 45 °C và trộn đều.
B.6.5.3 Chuẩn bị các thạch đĩa CIN
Rót khoảng 15 ml môi trường hoàn chỉnh vào các đĩa Petri vô trùng (7.4). Để yên các đĩa.
B.7 Thạch dinh dưỡng (ví dụ về môi trường không chọn lọc)
B.7.1 Thành phần
| Chất chiết thịt | 3,0 g |
| Pepton | 5,0 g |
| Natri clorua (NaCl) (tùy chọn) | 5,0 g |
| Thạch | 9 g đến 18 g a |
| Nước | 1 000 ml |
a Tùy thuộc vào sức đông của thạch.
B.7.2 Chuẩn bị
Hòa tan các thành phần hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun sôi.
Chỉnh pH, sao cho sau khi khử trùng pH là 7,0 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường vào các bình cầu (7.3) có dung tích thích hợp.
Khử trùng 15 min trong nồi hấp áp lực (7.1) ở nhiệt độ 121 °C.
B.7.3 Chuẩn bị các đĩa thạch dinh dưỡng
Rót khoảng 15 ml môi trường đã làm nguội đến khoảng 45 °C vào các đĩa Petri vô trùng (7.3). Để yên các dĩa.
B.8 Canh thang đậu tương tryptic (TSB) (canh thang đậu tương trypton, môi trường thủy phân casein đậu tương)
B.8.1 Thành phần
| Sản phẩm thủy phân casein bằng enzym | 17,0 g |
| Sản phẩm thủy phân đậu tương bằng enzym | 3,0 g |
| Natri clorua | 5,0 g |
| Dikali hydro phosphat | 2,5 g |
| Glucose (= Dextrose) | 2,5 g |
| Nước | 1 000 ml |
B.8.2 Chuẩn bị
Hòa tan các thành phần hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun sôi, nếu cần.
Chỉnh pH, sao cho sau khi khử trùng pH là 7,3 + 0,2 ở 25 °C, nếu cần.
Phân phối môi trường với các lượng 10 ml vào các ống nghiệm (7.3).
Khử trùng 15 min trong nồi hấp áp lực ở nhiệt độ 121 ° C.
B.9 Glycerol vô trùng
Phân phối 100 ml glycerol vào các ống nghiệm hoặc bình cầu (7.3) và khử trùng 15 min trong nồi hấp áp lực (7.1) ở nhiệt độ 121 °C.
B.10 Thạch ure (Christensen)
B.10.1 Môi trường cơ bản
B.10.1.1 Thành phần
| Pepton | 1,0 g |
| Glucose | 1,0 g |
| Natri clorua | 5,0 g |
| Kali dihydro phosphat (KH2PO4) | 2,0 g |
| Đỏ phenol |
|
| Thạch | 12,0 g |
| Nước | 1 000 ml |
B.10.1.2 Chuẩn bị
Hòa tan các thành phần hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH, sao cho sau khi khử trùng pH là 6,8 ± 0,2 ở 25 °C, nếu cần.
Khử trùng 15 min trong nồi hấp áp lực (7.1) ở nhiệt độ 121 °C.
B.10.2 Dung dịch ure
B.10.2.1 Thành phần
| Ure | 400,0 g |
| Nước, đến thể tích cuối cùng là | 1 000 ml |
B.10.2.2 Chuẩn bị
Hòa tan ure trong nước. Lọc để khử trùng.
B.10.3 Môi trường hoàn chỉnh
B.10.3.1 Thành phần
| Môi trường cơ bản (B.10.1) | 950 ml |
| Dung dịch ure (B.10.2) | 50 ml |
B.10.3.2 Chuẩn bị
Cho dung dịch ure một cách vô trùng vào môi trường cơ bản đã được làm nguội đến khoảng 44 °C đến 47 °C.
Phân phối các lượng 10 ml môi trường hoàn chỉnh vào các ống nghiệm (7.3) vô trùng.
Để các ống ở tư thế nghiêng.
B.11 Thạch đỏ congo magie oxalat (CR-MOX)
B.11.1 Môi trường cơ bản
B.11.1.1 Thành phần
| Thạch đậu tương trypton | 40,0 g |
| Magie clorua ngậm 6 phân tử nước (MgCl2. 6H2O) | 4,1 g |
| Natri oxalat (C2Na2O4) | 2,7 g |
| Galactose | 2,0 g |
| Nước | 1 000 ml |
B.11.1.2 Chuẩn bị
Hòa tan các thành phần hoặc môi trường cơ bản khô trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH, sao cho sau khi khử trùng pH của môi trường hoàn chỉnh là 7,3 ± 0,2 ở 25 °C, nếu cần.
B.11.2 Dung dịch đỏ congo (25 mg/ml)
B.11.2.1 Thành phần
| Đỏ congo | 2,5 g |
| Nước | 100 ml |
B.11.2.2 Chuẩn bị
Hòa tan đỏ congo trong nước.
CHÚ THÍCH: Dung dịch đỏ congo có thể được bảo quản trong chai thủy tinh tối màu đến 1 năm.
B.11.3 Môi trường hoàn chỉnh
B.11.3.1 Thành phần
| Môi trường cơ bản (B.11.1) | 1 000ml |
| Dung dịch đỏ congo (B.11.2) | 2 ml |
B.11.3.2 Chuẩn bị
Cho dung dịch đỏ congo vào môi trường cơ bản và trộn.
Khử trùng 15 min trong nồi hấp áp lực (7.1) ở nhiệt độ 121 °C.
B.11.3.3 Chuẩn bị các đĩa thạch CR-MOX
Rót khoảng 25 ml môi trường hoàn chỉnh đã làm nguội đến khoảng 47 °C vào các đĩa Petri (7.4) vô trùng. Để yên các đĩa.
B.12 Thạch mật bò và esculin
B.12.1 Thành phần
| Chất chiết thịt | 3,0 g |
| Sản phẩm thủy phân mô động vật bằng enzym | 5,0 g |
| Esculin | 1,0 g |
| Muối mật | 40,0 g |
| Sắt(III) xitrat | 0,5 g |
| Thạch | 12,0 g |
| Nước | 1 000 ml |
B.12.2 Chuẩn bị
Hòa tan các thành phần hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun sôi nhẹ.
Chỉnh pH, sao cho sau khi khử trùng là 6,6 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường với các lượng 10 ml vào các ống nghiệm (7.3) có dung tích thích hợp.
Khử trùng 15 min trong nồi hấp áp lực (7.1) ở nhiệt độ 121 °C.
Để nghiêng ống nghiệm sao cho thu được phần mặt thạch nghiêng dài 2,5 cm.
B.13 Thạch casein-đậu tương để phát hiện pyrazinamidase
B.13.1 Thành phần
| Sản phẩm thủy phân casein bằng enzym | 15,0 g |
| Sản phẩm thủy phân đậu tương bằng enzym | 5,0 g |
| Pyrazinecarboxamid (C5H5N3O) | 1,0 g |
| Natri clorua | 5,0 g |
| Thạch | 12,0 g |
| Đệm tris-maleat (0,2 mol/l, pH 6) | 1 000 ml |
B.13.2 Chuẩn bị
Hòa tan các thành phần hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun sôi.
Chỉnh pH, sao cho sau khi khử trùng là 7,3 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường với các lượng 10 ml vào các bình (7.3) có dung tích thích hợp.
Khử trùng 15 min trong nồi hấp áp lực (7.1) cài đặt ở nhiệt độ 121 °C.
Sau khi khử trùng, để nghiêng ống nghiệm sao cho thu được phần mặt thạch nghiêng dài nhất.
B.14 Dung dịch amoni sắt(II) sulfat để phát hiện pyrazinamidase
B.14.1 Thành phần
| Amoni sắt (II) sulfat | 1,0 g |
| Nước | 100 ml |
B.14.2 Chuẩn bị
Ngay trước khi sử dụng, hòa tan amoni sắt (II) sulfat trong nước.
B.15 Môi trường decarboxylase (lyzin hoặc arginin)
B.15.1 Thành phần
| L-lysin hoặc L-arginin | 5,0 g |
| Pepton | 5,0 g |
| Chất chiết nấm men | 3,0 g |
| Glucose | 1,0 g |
| Tía bromocresol | 0,02 g |
| Nước | 1 000 ml |
B.15.2 Chuẩn bị
Hòa tan các thành phần trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH sao cho sau khi khử trùng pH là 6,8 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường này với các lượng từ 2 ml đến 5 ml vào các ống nghiệm (7.3) có dung tích thích hợp.
Khử trùng 15 min trong nồi hấp áp lực (7.1) ở nhiệt độ 121 °C.
B.16 Thạch phenylalanin (tryptophan) deaminase
B.16.1 Thành phần
| Chất chiết nấm men | 3,0 g |
| L-phenylalanin hoặc | 1,0 g |
| DL-phenylalanin | 2,0 g |
| Dinatri hydro phosphat (Na2HPO4) | 1,0 g |
| Natri clorua | 5,0 g |
| Thạch | 12,0 g |
| Nước | 1 000 ml |
B.16.2 Chuẩn bị
Hòa tan các thành phần trên trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH sao cho sau khi khử trùng pH là 7,3 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường này với các lượng 5 ml vào các ống nghiệm (7.3) có dung tích thích hợp.
Khử trùng 15 min trong nồi hấp áp lực (7.1) ở nhiệt độ 121 °C.
Để yên ở vị trí nghiêng.
B.17 Sắt (III) clorua, 10 %
B.17.1 Thành phần
| Sắt(III) clorua (FeCl3) | 10,0 g |
| Nước | 90 ml |
B.17.2 Chuẩn bị
Hòa tan sắt(III) clorua trong nước.
B.18 Môi trường lên men cacbohydrat (nước pepton với đỏ phenol và cacbohydrat)
B.18.1 Môi trường cơ bản
B.18.1.1 Thành phần
| Pepton | 10,0 g |
| Natri clorua | 5,0 g |
| Đỏ phenol | 0,02 g |
| Nước | 1 000 ml |
B.18.1.2 Chuẩn bị
Hòa tan các thành phần hoặc môi trường cơ bản khô trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH, sao cho sau khi khử trùng là 6,8 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường cơ bản này vào các bình cầu (7.3) có dung tích thích hợp.
Khử trùng 10 min trong nồi hấp áp lực (7.1) ở nhiệt độ 121 °C.
B.18.2 Dung dịch cacbohydrat (melibiose, rhamnose, salicin, sorbitol, sucrose, trehalose hoặc xylose, 100 mg/ml)
B.18.2.1 Thành phần
| Cacbohydrat (melibiose, rhamnose, salicin, sorbitol, sucrose, trehalose hoặc xylose) | 10,0 g |
| Nước | 100 ml |
B.18.2.2 Chuẩn bị
Chuẩn bị riêng rẽ từng dung dịch cacbohydrat bằng cách cho từng chất vào nước cất.
Lọc để khử trùng.
B.18.3 Môi trường hoàn chỉnh
B.18.3.1 Thành phần
| Môi trường cơ bản (B.18.1) | 900 ml |
| Dung dịch cacbohydrat (B.18.2) | 100 ml |
B.18.3.2 Chuẩn bị
Đối với từng cacbon hydrat, thêm một cách vô trùng dung dịch cacbohydrat vào môi trường cơ bản đã làm nguội đến khoảng 45 °C và trộn đều.
Phân phối môi trường hoàn chỉnh một cách vô trùng với các lượng 10 ml vào các ống nghiệm hoặc chai (7.3) có dung tích thích hợp.
B.19 Môi trường Simmon xitrat
B.19.1 Thành phần
| Natri xitrat | 2,0 g |
| Natri clorua | 5,0 g |
| Dikali hydro phosphat (K2HPO4) | 1,0 g |
| Xanh bromothymol | 0,08 g |
| Amoni dihydro phosphat (NH4H2PO4) | 1,0 g |
| Magie sulfat | 0,2 g |
| Thạch | 12,0 g |
| Nước | 1 000 ml |
B.19.2 Chuẩn bị
Hòa tan các thành phần hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun sôi.
Chỉnh pH, sao cho sau khi khử trùng pH là 6,8 ± 0,2 ở 25 °C, nếu cần.
Khử trùng 15 min trong nồi hấp áp lực (7.1) ở nhiệt độ 121 °C.
B.19.3 Chuẩn bị các đĩa Simmon xitrat
Rót khoảng 15 ml môi trường đã để nguội đến khoảng 45 °C vào các đĩa Petri vô trùng (7.4). Để yên các đĩa.
B.20 Môi trường thử Tween-esterase
B.20.1 Môi trường cơ bản
B.20.1.1 Thành phần
| Sản phẩm dịch thủy phân peptic của thịt | 10,0 g |
| Natri clorua (NaCl) | 5,0 g |
| Canxi clorua (CaCl2) | 0,1 g |
| Thạch | 12,0 g |
| Nước | 1 000 ml |
B.20.1.2 Chuẩn bị
Hòa tan các thành phần trên trong nước bằng cách đun sôi, nếu cần.
Chỉnh pH, sao cho sau khi khử trùng pH là 7,4 ± 0,2 ở 25 °C, nếu cần.
Khử trùng 30 min trong nồi hấp áp lực ở nhiệt độ 121 °C.
B.20.2 Môi trường hoàn chỉnh
B.20.2.1 Thành phần
| Môi trường cơ bản (D.22.1) | 990 ml |
| Sorbitol mono-oleata | 10 ml |
a Tween 80™ là một ví dụ về sản phẩm thích hợp bán sẵn. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng chúng.
B.20.2.2 Chuẩn bị
Cho sorbitol mono-oleat vào môi trường lỏng cơ bản và trộn đều.
Khử trùng 30 min trong nồi hấp áp lực cài đặt ở nhiệt độ 110 °C.
B.20.3 Chuẩn bị các đĩa tween-esterase
Phân phối 15 ml môi trường hoàn chỉnh đã làm nguội đến 45 °C vào các đĩa Petri (7.4) vô trùng. Để yên đĩa.
B.21 Môi trường trypton/tryptophan
B.21.1 Thành phần
| Sản phẩm thủy phân casein (trypton) bằng enzym | 10,0 g |
| Natri clorua | 5,0 g |
| DL-tryptophan | 3,0 g |
| Nước | 1 000 ml |
B.21.2 Chuẩn bị
Hòa tan các thành phần trong nước bằng cách đun sôi, nếu cần
Chỉnh pH, sao cho sau khi khử trùng pH là 7,5 ± 0,2 ở 25 °C.
Phân phối môi trường với các lượng 5 ml vào các ống nghiệm hoặc chai (7.3) có dung tích thích hợp.
Khử trùng 15 min trong nồi hấp áp lực (7.1) ở nhiệt độ 121 °C.
B.22 Thuốc thử Kovac
B.22.1 Thành phần
| 4-Dimetylaminobenzaldehyt | 5,0 g |
| Axit clohydric, P = 1,18 g/ml đến 1,19 g/ml | 25 ml |
| 2-Metylbutan-2-ol | 75 ml |
B.22.2 Chuẩn bị
Hòa tan 4-dimetylaminobenzaldehyt trong 2-metylbutan-2-ol để trong nồi cách thủy ở 60 °C.
Làm nguội đến nhiệt độ phòng rồi đặt bình cầu vào bể nước đá. Sau đó thêm cẩn thận axit clohyric, trộn từ từ.
Bảo quản ở 3 °C ± 2 °C, trong chai màu nâu. Không sử dụng chai có nút đậy bằng cao su vì sẽ làm hỏng thuốc thử.
B.23 Thử nghiệm hiệu năng về đảm bảo chất lượng của môi trường nuôi cấy
Xem Bảng B.1. về định nghĩa tính chọn lọc và năng suất, xem TCVN 8128 (ISO 11133). Thể tích chất cấy phải giống lượng được sử dụng trong phương pháp đối với môi trường đó và cần chứa một lượng sinh vật đích hoặc không phải sinh vật đích như quy định trong 5.4 của TCVN 8128 (ISO 11133).
Bảng B.1 - Phép thử hiệu năng để đảm bảo chất lượng của môi trường nuôi cấy
| Môi trường | Chức năng | Ủ | Chủng kiểm chứng | Số lượng WDCMa | Tiêu chíd |
| ITC | Năng suất | 44 h ± 4 h/ 25 °C ± 1 °C | Yersinia enterocolitica + Escherichia colic + Pseudomonas aeruginosa | 00216b + 00012 hoặc 00013 + 00025 | > 10 khuẩn lạc điển hình trên CIN (xem 10.5) |
| Yersinia enterocolitica + Escherichia colic + Pseudomonas aeruginosa | 00160 + 00012 hoặc 00013 + 00025 | ||||
| Chọn lọc | Proteus mirabilis | 00023 | Ức chế hoàn toàn (0) hoặc một phần (< 10 khuẩn lạc) trên TSA | ||
| PSB | Năng suất | 44 h ± 4 h/ 25 °C ± 1 °C | Yersinia enterocolitica + Pseudomonas aeruginosa | 00216b + 00025 | > 10 khuẩn lạc điển hình trên CIN (xem 10.5) |
| Yersinia enterocolitica + Pseudomonas aeruginosa | 00160 + 00025 | ||||
| CIN | Năng suất | 24 h ± 2 h/ 30 °C + 1 °C | Yersinia enterocolitica | 00216b 00160 | Các khuẩn lạc điển hình (2) phát triển tốt (xem 10.5). |
| Chọn lọc | Escherichia colic | 00012 hoặc 00013 | Ức chế hoàn toàn hoặc một phần (0 -1), không có khuẩn lạc điển hình | ||
| Staphylococcus aureus | 00034 | Ức chế hoàn toàn (0) | |||
| Thạch dinh dưỡng | Năng suất | 24 h ± 2 h/ 30 °C + 1 °C | Yersinia enterocolitica | 00216b 00160 | Phát triển tốt (2) |
| a Xem catalog chủng chuẩn trên trang www.wfcc.info về thông tin bộ sưu tập số lượng chủng cấy và chi tiết liên hệ; WDCM: Trung tâm dữ liệu quốc tế về vi sinh vật. b Chủng tối thiểu được sử dụng. c Chủng được tự do lựa chọn; một trong các chủng là chủng tối thiểu phải được sử dụng. d Xếp loại phát triển: 0 không phát triển; 1 phát triển yếu (ức chế một phần); 2 phát triển tốt [xem TCVN 8128 (ISO 11133)]. CHÚ THÍCH: Hình thái khuẩn lạc của chủng WDCM 00160 (typ huyết thanh sinh học 1B/0:8) không điển hình cho typ huyết thanh sinh học gây bệnh chủ yếu của Y. enterocolitica (typ huyết thanh sinh học 4/0:3 và 2/0:9) trên thạch CIN. Xem 10.6.2 về ví dụ của chủng kiểm chứng đối với các typ huyết thanh sinh học này (được sử dụng là hình thái khuẩn lạc chuẩn trong quá trình phân tích mẫu). | |||||
Phụ lục C
(Tham khảo)
Các nghiên cứu xác nhận giá trị sử dụng và đặc tính hiệu năng của phương pháp
Một nghiên cứu liên phòng gồm 13 đến 14 phòng thử nghiệm ở 5 quốc gia thực hiện. Các loại thực phẩm sau đây đã bao gồm trong các nghiên cứu: sữa tươi, thịt xay và rau diếp. Các mẫu thực phẩm này được thử nghiệm ở hai mức nhiễm khác nhau, cùng với mẫu kiểm soát âm tính. Nghiên cứu này được tổ chức vào năm 2013 đến năm 2014 do Cơ quan An toàn Thực phẩm Phần Lan Evira được Ủy ban châu Âu tài trợ.
Các mẫu đã bị làm nhiễm trong các vòng nghiên cứu khác nhau với chủng Y. enterocolitica typ huyết thanh sinh học 4/0:3 (các mẫu sữa tươi nguyên liệu) và hai chủng khác nhau của Y. enterocolitica typ huyết thanh sinh học 2/0:9 (thịt băm và rau diếp).
Thực hiện theo quy trình (xem Phụ lục A) và tất cả các chi tiết thực hiện theo tiêu chuẩn này. Các giá trị của các đặc tính hiệu năng đối với từng loại mẫu, bắt nguồn từ nghiên cứu liên phòng thử nghiệm này được thể hiện trong các Bảng C.1 đến C.3. Dữ liệu thu được bởi một số cộng tác viên đã bị loại ra khỏi các phép tính toán chỉ vì các lý do kỹ thuật đã được xác định rõ (sai lệch so với quy trình).
Trong nghiên cứu liên phòng, việc khẳng định bằng cách sử dụng cả hai cách thay thế (xem hình A.2) đã được xác nhận giá trị sử dụng bằng cách so sánh. Đối với điều này, các cộng tác viên đã sử dụng TCVN 11924:2017 (ISO/TS 18867:2015), Phụ lục B, Phương pháp 1 hoặc Phương pháp 2 và thử nghiệm pyrazinamidase (10.6.3.4) song song với cách khẳng định bằng sinh hóa (10.6). Kết quả được thống kê trong Bảng C.4. Kết quả phù hợp thu được từ 410 phép thử khẳng định song song.
Bảng C.1 - Kết quả phân tích số liệu thu được với sữa tươi nguyên liệu
| Đặc tính hiệu năng | Mẫu trắng 0 cfu/25 g | Mức nhiễm thấp 9 cfu/25 g | Mức nhiễm cao 59 cfu/25 g |
| Số lượng cộng tác viên tham gia | 14 | 14 | 14 |
| Số lượng cộng tác viên giữ lại sau khi đánh giá dữ liệu | 12a | 12a | 12a |
| Số lượng mẫu | 112 | 112 | 112 |
| Số lượng mẫu giữ lại sau khi đánh giá dữ liệu | 96 | 96 | 96 |
| Độ đáp ứng, % | - | 68 | 96 |
| Độ đặc hiệu, % | 100 | - | - |
| LOD50, (95 % khoảng tin cậy), cfu/mẫu | - | 9,4 (7,4 đến 12,0) | |
| a Hai phòng thử nghiệm đã bị loại ra; một phòng do sai lệch về quy trình và một phòng khác do không thống nhất trong báo cáo kết quả. | |||
Bảng C.2 - Kết quả phân tích dữ liệu thu được với mẫu thịt băm
| Đặc tính hiệu năng | Mẫu trắng 0 cfu/25 g | Mức nhiễm thấp 16 cfu/25 g | Mức nhiễm cao 85 cfu/25 g |
| Số lượng cộng tác viên tham gia | 13 | 13 | 13 |
| Số lượng cộng tác viên giữ lại sau khi đánh giá dữ liệu | 13 | 13 | 13 |
| Số lượng mẫu | 104 | 104 | 104 |
| Số lượng mẫu giữ lại sau khi đánh giá dữ liệu | 104 | 104 | 104 |
| Độ đáp ứng, % | - | 77 | 97 |
| Độ đặc hiệu, % | 96a | - | - |
| LOD50, (95 % khoảng tin cậy), cfu/mẫu |
| 9,9 (7,8 đến 12,5) | |
| a Các kết quả dương tính giả thu được tại ba phòng thử nghiệm khác nhau (một phòng thử nghiệm có 2 trong 8 mẫu, hai phòng thử nghiệm có 1 trong 8 mẫu). Các chủng phân lập từ các mẫu này không thể phân biệt được với chủng sử dụng để gây nhiễm các mẫu. Điều này cho thấy đã có sự nhiễm chéo của các mẫu, từ phòng thử nghiệm tổ chức hoặc từ các phòng thử nghiệm tham gia. | |||
Bảng C.3 - Kết quả phân tích dữ liệu thu được với mẫu rau diếp
| Đặc tính hiệu năng | Mẫu trắng 0 cfu/25 g | Mức nhiễm thấp 110 cfu/25 g | Mức nhiễm cao 1100 cfu/25 g |
| Số lượng cộng tác viên tham gia | 13 | 13 | 13 |
| Số lượng cộng tác viên giữ lại sau khi đánh giá dữ liệu | 13 | 13 | 13 |
| Số lượng mẫu | 104 | 104 | 104 |
| Số lượng mẫu giữ lại sau khi đánh giá dữ liệu | 103a | 103a | 104 |
| Độ đáp ứng, % | - | 81 | 98 |
| Độ đặc hiệu, % | 98b | - | - |
| LOD50, (95 % khoảng tin cậy), cfu/mẫu | - | 63 (49 đến 81) | |
| a Một mẫu trắng và một mẫu ở mức thấp đối với một phòng thử nghiệm đã bị loại ra khỏi phân tích do thiếu các phép thử khẳng định. b Các kết quả dương tính giả thu được tại hai phòng thử nghiệm khác nhau (1 trong 8 mẫu). Các chủng phân lập từ các mẫu này không thể phân biệt được với chủng sử dụng để gây nhiễm các mẫu. Điều này cho thấy đã có sự nhiễm chéo của các mẫu, từ phòng thử nghiệm tổ chức hoặc từ các phòng thử nghiệm tham gia. | |||
Bảng C.4 - Kết quả khẳng định Y. enterocolitica gây bệnh sử dụng các phương pháp thay thếa
| Đặc tính hiệu năng | Số lượng phòng thử nghiệm | Số lượng mẫu với phép khẳng định song song3 | Số lượng phản ứng khẳng định song song | Số lượng kết quả không thống nhất |
| Kết quả khẳng định/sữa tươi nguyên liệu | 7 | 91 | 119 | 0 |
| Kết quả khẳng định/thịt băm | 8 | 122 | 130 | 0 |
| Kết quả khẳng định/rau diếp | 8 | 106 | 161 | 0 |
| Kết quả khẳng định/tất cả nền mẫu |
| 319 | 410 | 0 |
| a Xem Hình A.2 về diễn giải các phương pháp khẳng định thay thế. Để khẳng định các khuẩn lạc, các cộng tác viên đã sử dụng TCVN 11924:2017 (ISO/TS 18867:2015), Phụ lục B. Phương pháp 1 hoặc phương pháp 2 và thử nghiệm pyrazinamidase (10.6.3.4) song song với khẳng định sinh hóa (10.6). | ||||
Phụ lục D
(Tham khảo)
Quy trình tăng sinh lạnh
D.1 Giới thiệu
Quy trình tăng sinh lạnh nêu trong Phụ lục này có thể được sử dụng để bổ sung cho quy trình chung trong các điều tra, chẳng hạn như trong các vụ ngộ độc thực phẩm. Có thể sử dụng canh thang CEB (D.3.1) hoặc PSB (B.2).
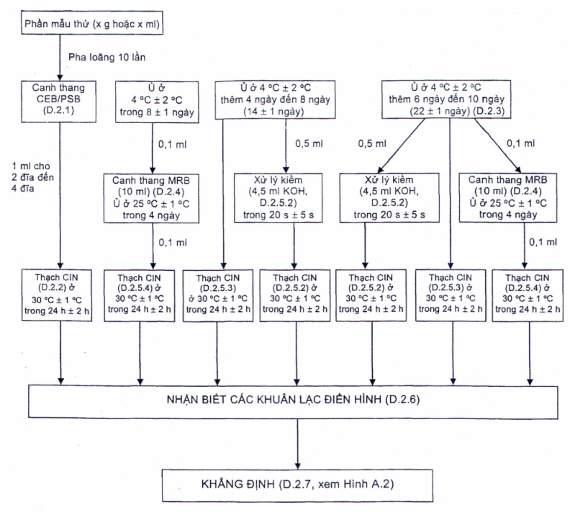
Hình D.1 - Sơ đồ quy trình tăng sinh lạnh
CHÚ THÍCH: Có thể được sử dụng PCR Real-time nhắm vào gen ail đích để sàng lọc các mẫu dương tính trong canh thang PSB sau khi ủ 24 h ở 25 ⁰C. Xem TCVN 11924 (ISO/TS 18867) để biết chi tiết về quy trình.
D.2 Phát hiện Y. enterocolitica gây bệnh bằng tăng sinh lạnh
D.2.1 Phần mẫu thử và huyền phù ban đầu
Xem phần liên quan của TCVN 6507 (ISO 6887) (tất cả các phần) hoặc bất kỳ tiêu chuẩn cụ thể khác phù hợp với sản phẩm có liên quan.
Để chuẩn bị huyền phù ban đầu, trong trường hợp chung, sử dụng như dịch pha loãng môi trường tiền tăng sinh trong D.3.1 (CEB) hoặc B.2 (PSB).
Nhìn chung, một lượng phần mẫu thử (khối lượng hoặc thể tích) được thêm vào một lượng CEB hoặc PSB (khối lượng hoặc thể tích) để thu được độ pha loãng mười lần. Đối với điều này, một phần mẫu thử 25 g được trộn với 225 ml CEB hoặc PSB.
Đồng hóa huyền phù, tốt nhất là sử dụng máy trộn nhu động (7.8) trong 1 min.
D.2.2 Nuôi cấy trực tiếp trên thạch chọn lọc
Xem 10.2.
D.2.3 Tăng sinh
Ủ huyền phù ban đầu của CEB hoặc PSB (D.2.1) ở 4 °C trong 22 ngày ± 1 ngày.
D.2.4 Tăng sinh lần thứ hai
Sau 8 ngày ± 1 ngày và 22 ngày ± 1 ngày ủ CEB hoặc PSB (D.2.1), chuyển 0,1 ml dịch tăng sinh sang 10 ml canh thang MRB (D.3.2) và ủ ở 25 °C trong 4 ngày.
D.2.5 Nuôi cấy trên đĩa thạch và ủ đĩa
D.2.5.1 Yêu cầu chung
Sau khi ủ môi trường tăng sinh (D.2.3 và D.2.4), tiến hành như sau:
CHÚ THÍCH: Có thể sử dụng các đĩa bổ sung như môi trường thạch sinh màu để phát hiện Y. enterocolitica gây bệnh [9,13,18].
D.2.5.2 Nuôi cấy từ CEB hoặc PSB có xử lý KOH trên thạch CIN
Sau 14 ngày ± 1 ngày và 22 ngày ± 1 ngày ủ ở 4 °C, sử dụng pipet vô trùng (7.5) chuyển 0,5 ml dịch tăng sinh CEB hoặc PSB (D.2.3) vào 4,5 ml dung dịch KOH (B.5) (chuẩn bị ngay trước khi sử dụng) và trộn đều [7]. Sau khi để 20 s ± 5 s dịch tăng sinh CEB hoặc PSB vào dung dịch KOH, ria cấy sử dụng vòng cấy (7.6) lên mặt thạch đĩa CIN (B.6) sao cho thu được các khuẩn lạc riêng rẽ.
CHÚ THÍCH 1: Các kết quả tốt nhất thu được bằng cách sử dụng dung dịch KOH đã chuẩn bị một ngày trước đó.
CHÚ THÍCH 2: Trong quá trình xử lý kiềm, dịch tăng sinh được làm loãng 10 lần. Ngoài ra, việc xử lý này có thể làm giảm số lượng Y. enterocolitica gây bệnh trong dịch cấy. Do đó, trong một số trường hợp cấy thêm một đĩa CIN với 0,1 ml dịch cấy.
D.2.5.3 Nuôi cấy từ CEB hoặc PSB không xử lý KOH
Sau 14 ngày ± 1 ngày và 22 ngày ± 1 ngày ủ ở 4 °C, dùng vòng cấy vô trùng (7.6) cấy một ăng dịch tăng sinh CEB hoặc PSB (D.2.3) lên mặt thạch đĩa CIN (B.6) sao cho thu được các khuẩn lạc riêng rẽ.
D.2.5.4 Nuôi cấy đĩa từ lần tăng sinh thứ hai (MRB)
Sau khi ủ 4 ngày trong lần tăng sinh thứ hai MRB (D.2.4), sử dụng pipet (7.5) vô trùng lấy 0,1 ml dịch cấy MRB nhỏ lên bề mặt đĩa thạch (CIN) (B.6) và dùng tăm bông hoặc bộ dàn mẫu (7.6) dàn đều dịch cấy sao cho thu được các khuẩn lạc riêng rẽ.
D.2.5.5 Ủ các đĩa
Lật úp các đĩa (D.2.5.2 đến D.2.5.4) và đặt vào tủ ấm (7.2) ở 30 °C (7.2) trong 24 h ± 2 h.
D.2.6 Nhận dạng các khuẩn lạc điển hình
Xem 10.5.
D.2.7 Khẳng định Y. enterocolitica gây bệnh
Xem 10.6 và Hình A.2.
D.2.8 Xác định typ sinh học của Y. enterocolitica
Xem 10.7.
D.3 Môi trường nuôi cấy
D.3.1 Canh thang tăng sinh lạnh (CEB)
D.3.1.1 Thành phần
| Dinatri hydro phosphat (Na2HPO4) | 7,6 g |
| Kali dihydro phosphat (KH2PO4) | 1,0 g |
| Natri clorua | 8,5 g |
| Sorbitol | 20,0 g |
| Muối mật (số 3) | 1,5 g |
| Nước | 1 000 ml |
D.3.1.2 Chuẩn bị
Hòa tan các thành phần hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH, sao cho sau khi khử trùng pH là 7,6 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường này vào các vật chứa có dung tích thích hợp để thu được các phần mẫu thử thích hợp (xem D.3.1).
Khử trùng 15 min trong nồi hấp áp lực (7.1) ở nhiệt độ 121 °C.
D.3.2 Môi trường canh thang rappaport cải biến (MRB) bằng magie clorua
D.3.2.1 Môi trường cơ bản
D.3.2.1.1 Thành phần
| Sản phẩm thủy phân casein bằng enzym | 10,0 g |
| Chất chiết nấm men | 1,0 g |
| Dinatri hydro phosphat (Na2HPO4) | 2,0 g |
| Xanh malachit | 0,013 g |
| Nước | 800 ml |
D.3.2.1.2 Chuẩn bị
Hòa tan các thành phần hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH, sao cho sau khi khử trùng pH của môi trường hoàn chỉnh là 5,8 ± 0,1 ở 25 °C, nếu cần.
Khử trùng 15 min trong nồi hấp áp lực (7.1) ở nhiệt độ 121 °C.
D.3.2.2 Dung dịch magie clorua (0,4 g/ml)
D.3.2.2.1 Thành phần
| Magie clorua ngậm sáu phân tử nước (MgCl2.6 H2O) | 80,0 g |
| Nước | 200 ml |
D.3.2.2.2 Chuẩn bị
Hòa tan magie clorua trong nước.
Khử trùng 15 min trong nồi hấp áp lực (7.1) ở nhiệt độ 121 °C.
D.3.2.3 Môi trường hoàn chỉnh
D.3.2.3.1 Thành phần
| Môi trường cơ bản (D.3.2.1) | 800 ml |
| Dung dịch magie clorua (D.3.2.2) | 200 ml |
D.3.2.3.2 Chuẩn bị
Cho dung dịch magie clorua một cách vô trùng vào môi trường cơ bản và trộn đều.
Phân phối 10 ml môi trường này một cách vô trùng vào các ống nghiệm (7.3).
Các dung dịch phải được làm nguội đến nhiệt độ phòng trước khi trộn để tránh tạo thành kết tủa.
D.3.3 Thử nghiệm hiệu năng đảm bảo chất lượng của môi trường tăng sinh lạnh
Về định nghĩa tinh chọn lọc và năng suất, xem TCVN 8128 (ISO 11133). Thể tích dịch cấy phải giống lượng được sử dụng trong phương pháp đối với môi trường đó và cần chứa một lượng sinh vật đích và không phải đích như quy định trong 5.4 của TCVN 8128 (ISO 11133).
Bảng D.1 - Thử nghiệm hiệu năng đảm bảo chất lượng của môi trường tăng sinh lạnh
| Môi trường | Chức năng | Ủ | Chủng kiểm chứng | Số lượng WDCMa | Tiêu chíd |
| MRB | Năng suất | 44 h ± 4 h / 25 °C ± 1 °C | Yersinia enterocolitica + Escherichia coli c + Pseudomonas aeruginosa | 00160b + 00012 hoặc 00013 + 00025 | > 10 khuẩn lạc đặc trưng trên CIN (xem 10.5) |
| Chọn lọc | Pseudomonas aeruginosa Proteus mirabilis | 00025 00023 | Ức chế hoàn toàn (0) hoặc một phần (< 10 khuẩn lạc) trên TSA | ||
| CEB | Năng suất | 44 h ± 4 h/ 25 °C ± 1 °C | Yersinia enterocolitica + Pseudomonas aeruginosa | 00160b + 00025 | > 10 khuẩn lạc điển hình trên CIN (xem 10.5) |
| a Xem catalog về chủng chuẩn trên trang www.wfcc.info về thông tin bộ sưu tập chủng cấy và chi tiết liên hệ: WDCM: Trung tâm dữ liệu quốc tế về vi sinh vật. b Chủng tối thiểu được sử dụng. c Chủng được tự do lựa chọn; một trong các chủng là chủng tối thiểu phải được sử dụng. d Xếp loại phát triển: 0 không phát triển; 1 phát triển yếu (ức chế một phần); 2 phát triển tốt [xem TCVN 8128 (ISO 11133)]. CHÚ THÍCH: Hình thái khuẩn lạc của chủng WDCM 00160 (typ huyết thanh sinh học 1B/0:8) không điển hình cho typ huyết thanh sinh học gây bệnh chủ yếu của Y. enterocolitica (typ huyết thanh sinh học 4/0:3 và 2/0:9) trên thạch CIN. Xem 10.6.2 về ví dụ của chủng kiểm chứng đối với các typ huyết thanh sinh học này (được sử dụng là hình thái khuẩn lạc chuẩn trong quá trình phân tích mẫu). | |||||
Thư mục tài liệu tham khảo
[1] TCVN 10782 (ISO 13307) Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Giai đoạn sản xuất ban đầu - Kỹ thuật lấy mẫu
[2] TCVN 11922 (ISO 17468) Vi sinh vật trong chuỗi thực phẩm - Yêu cầu và hướng dẫn kỹ thuật để xây dựng hoặc soát xét phương pháp chuẩn
[3] TCVN 7925 (ISO 17604) Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp lấy mẫu thân thịt tươi để phân tích vi sinh vật
[4] TCVN 11923 (ISO/TS 17728) Vi sinh vật trong chuỗi thực phẩm - Kỹ thuật lấy mẫu để phân tích vi sinh vật trong thực phẩm và thức ăn chăn nuôi
[5] TCVN 8129 (ISO 18593) Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp lấy mẫu bề mặt sử dụng đĩa tiếp xúc và lau bề mặt
[6] TCVN 11924 (ISO/TS 18867) Vi sinh vật trong chuỗi thực phẩm - Phản ứng chuỗi polymerase (PCR) để phát hiện vi sinh vật gây bệnh từ thực phẩm - Phát hiện Yersinia enterocolitica và Yersinia pseudotuberculosis gây bệnh
[7] AULISIO C.C.G., MEHLMAN I.J. and SANDERS A.C. Alkali method for rapid recovery of Yersinia enterocolitica and Yersinia pseudotuberculosis from foods. Appl. Environ. Microbiol. 1980, 39 pp. 135-140
[8] BOTTONE E.J. Yersinia enterocolitica: Overview and epidemiologic correlates. Microbes Infect. 1999, 1 (4) pp. 323-333
[9] DENIS M., HOUARD E., LABBÉ A., FONDREVEZ M. and SALVAT G.A. A Selective Chromogenic Plate, YECA, for the Detection of Pathogenic Yersinia enterocolitica: Specificity, Sensitivity, and Capacity to Detect Pathogenic Y. enterocolitica from Pig Tonsils. Journal of Pathogens, vol. 2011, Article ID 296275, 8 pages, 2011. doi: 10.4061/2011/296275
[10] FARMER J.J. Ill, CARTER G.P., MILLER V.L., FALKOW S. and WACHSMUTH I.K. Pyrazinamidase, CR-MOX Agar, Salicin Fermentation - Esculin Hydrolysis, and D-Xylose fermentation for identifying pathogenic serotypes of Yersinia enterocolitica. J. Clin. Microbiol. 1992, 30 pp. 2589-2594
[11] FOOD AND DRUG ADMINISTRATION. Protocol in FDA. Yersinia enterocolitica and Yersinia pseudotuberculosis. Chapter 8 In: Bacteriological Analytical Manual, 8th edn., Washington, DC, 1998, online version updated in 2007: www.fda.gov/Food/FoodScienceResearch/LaboratoryMethods/ucm072633.htm
[12] HALLANVUO S., PELTOLA J., HEISKANEN T. and SIITONEN A. Simplified phenotypic scheme evaluated by 16S rRNA sequencing for differentiation between Yersinia enterocolitica and Y. enterocolitica -like species. J. Clin. Microbiol. 2006, 44 pp. 1077-1080
[13] RENAUD N., LECCI L, COURCOL R.J., SIMONET M. and GAILLOT O. CHROMagar Yersinia, a new chromogenic agar for screening of potentially pathogenic Yersinia enterocolitica isolates in stools. J. Clin. Microbiol. 2013, 51 pp. 1184-1187
[14] RILEY G. and TOMA S. Detection of pathogenic Yersinia enterocolitica by using Congo red-magnesium oxalate agar medium. J. Clin. Microbiol. 1989, 27 pp. 213-214
[15] SCHIEMANN D A. Synthesis of selective agar medium for Yersinia enterocolitica. Can. J. Microbiol. 1979, 25 pp. 1298-1304
[16] TENNANT S.H., GRANT T.H. and ROBINS-BROWNE R.M. Pathogenicity of Yersinia enterocolitica typ huyết thanh 1A. FEMS Immun. Medical Microbiol. 2003, 38 pp. 127-137
[17] WAUTERS G., GOOSSENS V., JANSSENS M. and VANDEPITTE J. New enrichment method for isolation of pathogenic Yersinia enterocolitica serogroup O:3 from pork. Appl. Environ. Microbiol. 1988, 54 pp. 851-854
[18] WEAGANT S.D. A new chromogenic agar medium for detection of potentially virulent Yersinia enterocolitica. J. Microbiol. Methods. 2008, 72 pp. 185-190
2) Vaselin® là ví dụ về sản phẩm thích hợp có bán sẵn. Thông tin đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn này và không ấn định phải sử dụng sản phẩm này.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 8127:2018 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 8127:2018 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 8127:2018 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 8127:2018 DOC (Bản Word)