- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn quốc gia TCVN 8127:2009 Vi sinh vật trong thực phẩm và thức ăn chăn nuôi
| Số hiệu: | TCVN 8127:2009 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
21/12/2009 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 8127:2009
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 8127:2009
TIÊU CHUẨN QUỐC GIA
TCVN 8127 : 2009
ISO 10273 : 2003
VI SINH VẬT TRONG THỰC PHẨM VÀ THỨC ĂN CHĂN NUÔI - PHƯƠNG PHÁP PHÁT HIỆN YERSINIA ENTEROCOLITICA GÂY BỆNH GIẢ ĐỊNH
Microbiology of food and animal feeding stuffs - Horizontal method for the detection of presumptive pathogenic Yersinia enterocolitica
Lời nói đầu
TCVN 8127 : 2009 hoàn toàn tương đương với ISO 10723 : 2003;
TCVN 8127 : 2009 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC/P13 Phương pháp phân tích và lấy mẫu biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
VI SINH VẬT TRONG THỰC PHẨM VÀ THỨC ĂN CHĂN NUÔI - PHƯƠNG PHÁP PHÁT HIỆN YERSINIA ENTEROCOLITICA GÂY BỆNH GIẢ ĐỊNH
Microbiology of food and animal feeding stuffs - Horizontal method for the detection of presumptive pathogenic Yersinia enterocolitica
CẢNH BÁO - Khi áp dụng tiêu chuẩn này có thể cần phải sử dụng các vật liệu, thiết bị và các thao tác nguy hiểm. Người sử dụng tiêu chuẩn này phải tự thiết lập các thao tác an toàn thích hợp và xác định khả năng áp dụng các giới hạn quy định trước khi sử dụng tiêu chuẩn.
1. Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp phát hiện Yersinia enterocolitica được giả định là gây bệnh cho con người. Tiêu chuẩn này có thể áp dụng cho:
- các sản phẩm thực phẩm và thức ăn chăn nuôi, và;
- các mẫu môi trường trong khu vực sản xuất và chế biến thực phẩm.
2. Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 6263 (ISO 8261), Sữa và sản phẩm sữa - Hướng dẫn chung về chuẩn bị mẫu thử, huyền phù ban đầu và dung dịch pha loãng thập phân để kiểm tra vi sinh vật.
TCVN 6404 (ISO 7218), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Nguyên tắc chung về kiểm tra vi sinh vật.
TCVN 6507 (ISO 6887) (tất cả các phần), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử, dung dịch huyền phù ban đầu và các dung dịch pha loãng thập phân để kiểm tra vi sinh vật.
TCVN 8128-1 : 2009 (ISO 11133-1 : 2009), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Hướng dẫn chuẩn bị và sản xuất môi trường nuôi cấy - Phần 1: Hướng dẫn chung về đảm bảo chất lượng đối với việc chuẩn bị môi trường nuôi cấy trong phòng thử nghiệm.
3. Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng các thuật ngữ và định nghĩa sau đây:
3.1. Yersinia enterocolitica gây bệnh giả định (Presumptive pathogenic Yersinia enterocolitica)
Vi khuẩn ưa lạnh tạo thành các khuẩn lạc đặc trưng trên môi trường đặc chọn lọc và có các đặc tính hóa sinh thỏa mãn các tiêu chí về tính gây bệnh như đã mô tả, khi tiến hành thử theo tiêu chuẩn này.
3.2. Phát hiện Yersinia enterocolitica gây bệnh giả định (Detection of presumptive pathogenic Yersinia enterocolitica)
Xác định sự có mặt hay không có mặt các vi khuẩn trong một lượng xác định của sản phẩm, khi tiến hành thử theo tiêu chuẩn này.
4. Nguyên tắc
4.1. Yêu cầu chung
Yersinia enterocolitica gây bệnh giả định được phát hiện bằng ba giai đoạn liên tiếp sau.
4.2. Tăng sinh trong môi trường lỏng chọn lọc
Phần mẫu thử được cấy vào hai môi trường tăng sinh:
- canh thang pepton, sorbitol và muối mật (PSB), và;
- canh thang irgasan™, ticarcilin và kali clorat (ITC).
Canh thang ITC được ủ ở 25 °C trong 48 h và canh thang PSB được ủ ở nhiệt độ này từ 3 ngày đến 5 ngày.
CHÚ THÍCH 1 Việc tăng sinh trong canh thang ITC được khuyến nghị (xem [1]) để phân lập Yersinia enterocolitica biovar 4/serovar O:3 nhưng không dùng cho biovar 1B serovar O:8, biovar 2/serovar O:9 (xem [2]). hoặc biovar 2/serovar O:5,27. Việc phân lập Yersinia enterocolitica biovar 2/serovar O:9 cần sử dụng môi trường ITC không có clorat và có chứa 80 % nồng độ gốc của magie clorua và xanh malachit (xem [3]).
4.3. Cấy đĩa và nhận dạng
Từ dịch cấy thu được trong 4.2, cấy lên bề mặt đĩa của hai môi trường đặc chọn lọc:
- thạch có cefsulodin, irgasan™ và novobioxin (CIN) (xem [7]);
- thạch Salmonella/Shigella, có natri desoxycolat và canxi clorua (SSDC).
Môi trường này được ủ ở 30 °C rồi kiểm tra sau 24 h và nếu cần thì kiểm tra sau 48 h, tùy thuộc vào môi trường, để kiểm tra sự có mặt hay không có mặt khuẩn lạc đặc trưng của Yersinia enterocolitica
4.4. Khẳng định
Kiểm tra Yersinia enterocolitica giả định trên các khuẩn lạc trên đĩa và tiếp theo bằng các phép thử khẳng định, các phép thử biotyp, các phép thử để thiết lập các tiêu chí gây bệnh và các phép thử huyết thanh học có thể.
5. Thuốc thử và môi trường nuôi cấy
Về thực hành trong phòng thử nghiệm hiện hành, xem TCVN 6404 (ISO 7218).
Xem TCVN 8128-1 : 2009 (ISO/TS 11133-1 : 2009) về các yêu cầu cụ thể về đảm bảo chất lượng và hiệu năng của môi trường.
CHÚ THÍCH TCVN 8128-2 : 2009 (ISO 11133-2 : 2003) đưa ra các hướng dẫn thực hành về thử nghiệm hiệu năng của môi trường nuôi cấy.
Do trong tiêu chuẩn sử dụng một lượng lớn môi trường nuôi cấy và thuốc thử, để cho nội dung tiêu chuẩn được gọn nên các thành phần của thuốc thử được đưa riêng vào trong Phụ lục B, trong đó bao gồm các chi tiết về cách phân phối, bảo quản v.v...
5.1. Môi trường tăng sinh
5.1.1. Canh thang pepton, sorbitol và muối mật (PSB)
Xem B.1.
5.1.2. Canh thang irgasan™, ticarcilin và kali clorat (ITC)
Xem B 2.
5.2. Môi trường đổ đĩa
5.2.1. Thạch cefsulodin, irgasan™ và novobioxin (CIN) (xem [7])
Xem B.3.
5.2.2. Thạch Salmonella/Shigella, có natri desoxycolat và canxi clorua (SSDC)
Xem B.4.
5.2.3. Thạch dinh dưỡng
Xem B.5.
5.3. Môi trường nhận dạng và thuốc thử
5.3.1. Môi trường ure indol
Xem B.6.
5.3.2. Thuốc thử phát hiện indol
Xem B.7.
5.3.3. Thạch Kligler
Xem B.8.
5.3.4. Thuốc thử phát hiện oxidaza
Xem B.9.
5.3.5. Môi trường đã khử nhóm carboxyl
5.3.5.1. Môi trường lyzin đã khử nhóm carboxyl
Xem B.10.
5.3.5.2. Môi trường ornithin đã khử nhóm carboxyl
Xem B.11.
5.3.6. Môi trường lên men cacbohydrat (sacaroza, rhamoza, trehaloza và xyloza)
Xem B.12.
5.3.7. Môi trường simmon xitrat
Xem B.13.
5.3.8. Môi trường tween™-esteraza
Xem B.14.
5.3.9. Thạch mật và aesculin
Xem B.15.
5.3.10. Thạch casein đậu tương
Xem B.16.
5.3.11. Thạch casein đậu tương, để phát hiện pyrazinamidaza
Xem B.17.
5.3.12. Dung dịch amoni sắt (II) sulfat, để phát hiện pyrazinamidaza
Xem B.18.
5.3.13. Thạch casein đậu tương, có magie và oxalat
Xem B.19.
5.4. Dung dịch muối
Xem B.20.
5.5. Kali hydroxit trong dung dịch muối
Xem B.21.
5.6. Canh thang thịt bê
Xem B.22.
5.7. Glyxerol vô trùng
Xem B.23.
6. Thiết bị và dụng cụ thủy tinh
Có thể dùng dụng cụ sử dụng một lần thay thế cho dụng cụ thủy tinh sử dụng nhiều lần, nếu có các quy định thích hợp.
Sử dụng các thiết bị, dụng cụ của phòng thử nghiệm vi sinh thông thường và cụ thể như sau:
6.1. Thiết bị để khử trùng khô (tủ sấy) hoặc thiết bị để khử trùng ướt (nồi hấp áp lực)
Xem TCVN 6404 (ISO 7218).
6.2. Tủ ấm, có thể duy trì nhiệt độ từ 22 °C ± 1 °C, 25 °C ± 1 °C, 30 °C ± 1 °C và 37 °C ± 1 °C.
6.3. Tủ sấy hoặc lò sấy, có đối lưu không khí, duy trì được nhiệt độ từ 37 °C ± 1 °C đến 50 °C ± 1 °C.
6.4. Nồi cách thủy hoặc tủ ấm, có thể duy trì nhiệt độ ở 22 °C ± 1 °C, 24 °C ± 2 °C và 25 °C ± 1 °C, tốt nhất là có bộ phận khuấy trộn thích hợp.
6.5. Nồi cách thủy, có thể duy trì nhiệt độ ở 44 °C đến 47 °C.
6.6. Ống nghiệm, có kích thước 18 mm x 180 mm, 9 mm x 180 mm và 12 mm x 50 mm.
6.7. Chai và/hoặc bình cầu, có dung tích thích hợp.
6.8. Đĩa Petri, bằng thủy tinh hoặc bằng chất dẻo, có đường kính từ 90 mm đến 100 mm.
6.9. Pipet xả hết, có dung tích danh định 1 ml và 10 ml, miệng rộng và được chia vạch tương ứng 0,1 ml.
6.10. Núm cao su, hoặc các hệ thống hút an toàn khác dùng cho vi sinh vật.
6.11. Que cấy vòng, có đường kính khoảng 3 mm, que cấy thẳng bằng hợp chất platin/iridi và/hoặc niken/crom, đũa thủy tinh và pipet Pasteur.
Có thể sử dụng que cấy vòng bằng chất dẻo vô trùng hoặc que cấy thẳng. Niken crom không thích hợp cho phép thử phát hiện oxidaza (xem 9.4.3.5).
6.12. Máy đo pH, có thể đo chính xác đến ± 0,1 đơn vị pH ở 25 °C.
6.13. Đèn chiếu, thích hợp cho việc rọi xiên.
6.14. Kính hiển vi lập thể hoặc kính lúp.
6.15. Bộ trộn nhu động.
7. Lấy mẫu
Điều quan trọng là phòng thử nghiệm nhận được đúng mẫu đại diện và không bị hư hỏng hoặc biến đổi trong suốt quá trình vận chuyển và bảo quản.
Khuyến cáo không nên làm đông lạnh mẫu trước khi phân tích, cho dù Yersinia spp có thể phục hồi được từ các sản phẩm đông lạnh.
Việc lấy mẫu không quy định trong tiêu chuẩn này. Nếu không có tiêu chuẩn riêng về lấy mẫu sản phẩm có liên quan thì các bên tự thỏa thuận về vấn đề này.
8. Chuẩn bị mẫu thử
Chuẩn bị mẫu thử theo tiêu chuẩn cụ thể đối với sản phẩm có liên quan. Nếu không có tiêu chuẩn cụ thể đó thì các bên tự thỏa thuận về vấn đề này.
9. Cách tiến hành (xem Phụ lục A)
9.1. Phần mẫu thử và huyền phù ban đầu
9.1.1. Xem phần có liên quan của TCVN 6507 (ISO 6887) hoặc TCVN 6263 (ISO 8261), hoặc tiêu chuẩn thích hợp đối với sản phẩm có liên quan.
9.1.2. Nhìn chung, để chuẩn bị huyền phù ban đầu, cho một lượng (x) phần mẫu thử (có khối lượng hoặc thể tích đã biết) vào một lượng xác định của canh thang PSB (B.1) để thu được dung dịch pha loãng 1/10 (khối lượng/thể tích hoặc thể tích/thể tích). Đồng hóa huyền phù này bằng cách sử dụng bộ trộn kiểu nhu động (6.15) trong 2 min.
9.1.3. Chuẩn bị dung dịch huyền phù ban đầu thứ hai theo cách tương tự với canh thang ITC (B.2) sao cho thu được dung dịch pha loãng 1/100 (khối lượng/thể tích hoặc thể tích/thể tích) của phần mẫu thử/môi trường tăng sinh.
9.2. Tăng sinh
Ủ hai dung dịch huyền phù ban đầu (9.1.2 và 9.1.3) như sau:
a) môi trường PSB ở 22 °C đến 25 °C trong 48 h đến 72 h có khuấy trộn, hoặc để yên không khuấy/ trộn trong 5 ngày;
b) môi trường ITC ở 25 °C trong 48 h.
9.3. Cấy ra đĩa và nhận dạng
9.3.1. Sau khi ủ môi trường tăng sinh (9.2), tiến hành như sau:
9.3.2. Từ dịch cấy trong môi trường PSB (9.2), dùng que cấy vòng (6.11) cấy lên bề mặt đĩa thạch C.N (B.3) để thu được các khuẩn lạc tách biệt tốt.
9.3.3. Dùng pipet vô trùng (6.9) chuyển 0,5 ml dịch cấy trong môi trường PSB (9.2) vào 4,5 ml dung dịch kali hydroxit (B.21) và trộn (xem [5]). Sau 20 s ± 5 s dùng que cấy vòng (6.11) cấy ngay lên bề mặt đĩa thạch CIN (B.3) để thu được các khuẩn lạc tách biệt tốt.
9.3.4. Từ dịch cấy trong môi trường ITC (9.2), dùng que cấy vòng (6.11) cấy lên bề mặt đĩa thạch SSDC (B.4) để thu được các khuẩn lạc tách biệt tốt.
9.3.5. Lật úp các đĩa (9.3.2 đến 9.3.4) và đặt chúng vào tủ ấm (6.2) để ở 30 °C.
9.3.6. Sau khi ủ 24 h, kiểm tra các đĩa bằng kính lúp (6.14) tốt nhất là được trang bị đèn chiếu rọi xiên (6.13) để phát hiện sự có mặt của các khuẩn lạc đặc trưng Yersinia enterocolitica như sau:
a) trên thạch CIN, các khuẩn lạc đặc trưng của Yersinia enterocolitica là nhỏ (£ 1 mm) và nhẵn trơn có tâm đỏ và có mép biên mờ và khi được kiểm tra bằng ánh sáng rọi xiên (6.13) cho thấy những hạt nhỏ không óng ánh.
b) trên thạch SSDC, các khuẩn lạc đặc trưng của Yersinia enterocolitica là nhỏ (£ 1 mm) và có mép biên màu xám không rõ ràng, không óng ánh và khi được kiểm tra bằng ánh sáng rọi xiên cho thấy những hạt nhỏ li ti.
CHÚ THÍCH Ánh sáng rọi xiên giúp cho việc phân biệt các khuẩn lạc đặc trưng của Yersinia enterocolitica với các khuẩn lạc tương tự Pseudomonas.
9.3.7. Nếu các khuẩn lạc mọc chậm, nếu màu sắc mờ nhạt hoặc nếu không có các khuẩn lạc đặc trưng thì tiếp tục ủ các đĩa đến 48 h rồi kiểm tra lại.
9.4. Khẳng định
9.4.1. Yêu cầu chung
Có thể sử dụng các bộ kit thử nhận dạng hóa sinh thu nhỏ có bán sẵn và cho phép nhận dạng Yersinia enterocolitica. Một số bộ kit thử nhận dạng hóa sinh thu nhỏ không nhận dạng được chính xác các loài Yersinia như Yersinia mollaretii và Yersinia bercovieri (tiền biovar Yersinia enterocolitica 3A và 3B) và Yersinia intermedia mà đã được nhận biết như Yersinia enterocolitica. Trong trường hợp sau, thì phải thực hiện phép thử Mucate để phân biệt giữa các loài này. Việc cải tiến khả năng phân biệt của các bộ kit thử nhận dạng hóa sinh thu nhỏ này đã được đưa ra (xem [6] và [7]).
9.4.2. Chọn các khuẩn lạc để khẳng định
9.4.2.1. Để khẳng định, từ mỗi đĩa đựng mỗi môi trường chọn lọc (xem 9.3.2 đến 9.3.4), lấy năm khuẩn lạc được coi là đặc trưng hoặc nghi ngờ.
Nếu trên một đĩa có chứa ít hơn năm khuẩn lạc đặc trưng hoặc nghi ngờ thì lấy tất cả để khẳng định.
Ria cấy các khuẩn lạc đã chọn lên bề mặt đĩa thạch dinh dưỡng (B.5) sao cho các khuẩn lạc đã phát triển tách biệt rõ.
Ủ các đĩa này ở 30 °C trong 24 h.
Kiểm tra các đĩa đã ủ về độ thuần khiết của dịch cấy. Nếu có mặt các dịch cấy hỗn hợp, thì cấy truyền từng loại khuẩn lạc riêng biệt vào các đĩa thạch dinh dưỡng tiếp theo và ủ như trên.
Sử dụng dịch cấy thuần khiết cho các phép thử khẳng định hóa sinh và phép thử khả năng gây bệnh.
9.4.2.2. Plasmit để xác định các đặc trưng liên quan đến tính gây bệnh của Yersinia có thể tự nhiên mất đi trong giai đoạn cấy ở nhiệt độ cao hơn 30 °C hoặc có dịch cấy dài hơn và trôi qua ở nhiệt độ thấp hơn 30 °C trong phòng thử nghiệm.
Do đó, bảo quản chúng như dịch cấy đông lạnh bằng cách cấy truyền ngay từng dịch cấy thuần khiết vào canh thang thịt bê (B.22).
Ủ các đĩa này ở 22 °C đến 25 °C trong 24 h đến 48 h.
Bổ sung glyxerol vô trùng 10 % (B.2.3), trộn kỹ và làm đông lạnh, tốt nhất là ở âm 70 °C.
9.4.3. Phép thử giả định
9.4.3.1. Yêu cầu chung
Dùng que cấy vòng (6.11) cấy các khuẩn lạc được chọn trong 9.4.2 vào các môi trường quy định trong 9.4.3.2 đến 9.4.3 4 và tiến hành phát hiện phản ứng oxidaza theo 9.4.3 5.
9.4.3.2. Phát hiện ureaza
Sử dụng chất cấy để cấy vào ngay dưới bề mặt môi trường canh thang ureaza/indol (B.6).
Ủ các ống này ở 30 °C trong 24 h, tốt nhất là để trong nồi cách thủy
Màu hồng-tím hoặc hồng-đỏ chứng tỏ phản ứng ureaza dương tính. Yersinia enterocolitica phần lớn cho phản ứng ureaza dương tính trong khoảng từ 1 min đến 5 min. Việc ghi lại tốc độ phản ứng dương tính có thể cho giá trị chẩn đoán.
Màu vàng-cam chứng tỏ phản ứng ureaza âm tính. Có thể xuất hiện các phản ứng âm tính giả nếu môi trường không được cấy đủ lượng vi sinh vật.
9.4.3.3. Phát hiện indol
Thêm 0,1 ml đến 0,2 ml thuốc thử (B.7) vào các ống nghiệm (9.4.3.2) để phát hiện indol.
Vòng màu đỏ trên bề mặt của dịch cấy trong 15 min chứng tỏ phản ứng dương tính.
9.4.3.4. Thạch Kligler
Cấy đâm sâu trên đáy thạch và cấy vạch lên bề mặt nghiêng của thạch (B.7.2).
Ủ ở 30 °C trong 24 h đến 48 h.
Diễn giải các thay đổi trong môi trường như sau:
a) Quan sát ở đáy cột thạch
- màu vàng: dương tính glucoza (lên men glucoza);
- màu đỏ hoặc không đổi màu: âm tính glucoza (không lên men glucoza);
- màu đen: sinh khí hydro sulfua;
- có bọt hoặc rạn nứt: sinh khí từ glucoza.
b) Quan sát trên mặt nghiêng của thạch
- màu vàng: dương tính lactoza (sử dụng lactoza);
- màu đỏ hoặc không đổi màu: âm tính lactoza (không sử dụng lactoza).
9.4.3.5. Phát hiện oxidaza
Dùng que cấy vòng bằng platin/iridi hoặc đũa thủy tinh (6.11), lấy một phần của từng khuẩn lạc đặc trưng đã chọn (9.4.2) và cấy vạch lên giấy lọc đã làm ẩm bằng thuốc thử oxidaza (B.9) (một giọt), hoặc trên đĩa có bán sẵn. Không sử dụng que cấy vòng hoặc que cấy thẳng bằng niken/crom (6.11).
Phép thử được coi là âm tính nếu màu của giấy lọc không đổi sang màu tím hoa cà, màu tím hoặc xanh sẫm trong 10 s đầu.
9.4.4. Phép thử khẳng định hóa sinh
9.4.4.1. Chọn khuẩn lạc và cách tiến hành
9.4.4.1.1. Tiếp tục nhận dạng các khuẩn lạc có các đặc trưng sau đây:
- phát hiện ureaza: dương tính;
- phát hiện indol: dương tính hoặc âm tính;
- lên men glucoza: dương tính;
- sinh khí từ glucoza: âm tính;
- lên men lactoza: âm tính;
- sinh khí H2S: âm tính;
- phát hiện oxidaza: âm tính.
CHÚ THÍCH 1 Các chủng âm tính ureaza được ghi lại nhưng trong đó không có loại gây bệnh.
CHÚ THÍCH 2 Đối với việc sinh khí từ glucoza, có thể tạo ra một ít bọt khí. Cho dù Yersinia thường được coi là lên men cacbohydrat mà không sinh khí, thì một số chủng của Yersinia enterocolitica (như Yersinia enterocolitica biovar 3) có thể sinh một hoặc hai bọt khí (sinh khí yếu).
CHÚ THÍCH 3 Một số chủng của Yersinia enterocolitica dương tính lactoza đã được phân lập, đặc biệt từ các sản phẩm sữa. Thực tế hiện nay, nhìn chung các chủng này được coi là không gây bệnh.
9.4.4.1.2. Dùng que cấy vòng hoặc que cấy thẳng (6.11) cấy các khuẩn lạc đã được phân lập (9.4.2; trên thạch dinh dưỡng và được chọn trong 9.4.4.1.1 vào các môi trường quy định trong 9.4.4.2 đến 9.4.4.5.
9.4.4.2. Môi trường lyzin đã khử nhóm carboxyl
Cấy từng môi trường (B.10) ngay dưới bề mặt của môi trường lỏng. Nếu các ống nghiệm chứa không đầy môi trường và kín khí, thì phủ lên bề mặt bằng một lớp dầu Vaselin® (được làm nóng rồi làm nguội nhanh sao cho vẫn ở dạng lỏng) hoặc lớp parafin lỏng vô trùng.
Ủ ở 30 °C trong 24 h.
Sau khi ủ thấy có màu tím chứng tỏ phản ứng dương tính.
Màu vàng chứng tỏ phản ứng âm tính.
9.4.4.3. Môi trường ornithin đã khử nhóm cacboxyl
Cấy từng môi trường (B.11) ngay dưới bề mặt của môi trường lỏng. Nếu các ống nghiệm chứa không đầy môi trường và kín khí, thì phủ lên bề mặt bằng một lớp dầu Vaselin® (được làm nóng rồi làm nguội nhanh sao cho vẫn ở dạng lỏng) hoặc lớp parafin lỏng vô trùng.
Ủ ở 30 °C trong 24 h.
Sau khi ủ thấy có màu tím chứng tỏ phản ứng dương tính.
Màu vàng chứng tỏ phản ứng âm tính.
9.4.4.4. Môi trường lên men sacaroza, rhamnoza, trehaloza và xyloza
Cấy từng môi trường (B.12) ngay dưới bề mặt của môi trường lỏng.
Ủ ở 30 °C trong 24 h.
Sau khi ủ thấy có màu vàng chứng tỏ phản ứng dương tính.
Màu đỏ chứng tỏ phản ứng âm tính.
9.4.4.5. Môi trường Simmon
Cấy vạch trên bề mặt thạch nghiêng (B.13). Không đậy nắp các ống nghiệm quá chặt sao cho không khí có thể đi vào và tạo ra các điều kiện phát triển hiếu khí.
Ủ ở 30 °C trong 24 h.
Sau khi ủ thấy có màu xanh chứng tỏ phản ứng dương tính.
9.4.4.6. Phép thử tween-esteraza
Cấy vạch trên bề mặt thạch nghiêng (B.14).
Ủ ở 25 °C trong 5 ngày và định kỳ kiểm tra.
Sau khi ủ thấy có quầng mờ đục của kết tủa do xuất hiện các tinh thể nhỏ canxi oleat chứng tỏ phản ứng dương tính.
9.4.5. Phép thử tính gây bệnh giả định (xem [8])
9.4.5.1. Chọn khuẩn lạc và cách tiến hành
9.4.5.1.1. Chỉ sử dụng các khuẩn lạc có các đặc trưng sau đây:
- phát hiện lyzin decarboxylaza: âm tính;
- phát hiện ornithin decarboxylaza: dương tính;
- lên men rhamnoza: âm tính;
- lên men sacaroza: dương tính;
- thủy phân xitrat: âm tính;
CHÚ THÍCH 1 Hiếm khi các chủng Yersinia enterocolitica gây bệnh giả định là âm tính sacaroza được phân lập từ thịt lợn.
CHÚ THÍCH 2 Yersinia enterocolitica biovar 4 và 5 đã được ghi lại là âm tính ornithin decarboxylaza
9.4.5.1.2. Dùng que cấy vòng hoặc que cấy thẳng (6.11) cấy từng dịch cấy thuần khiết trên thạch dinh dưỡng từ các khuẩn lạc được chọn (9.4.5.1) vào các môi trường quy định trong 9.4.5.2 đến 9.4.5.4
9.4.5.2. Môi trường lên men aesculin
Cấy vạch trên bề mặt thạch nghiêng (B.15).
Ủ ở 30 °C trong 24 h.
Sau khi ủ thấy có quầng đen quanh các khuẩn lạc chứng tỏ phản ứng dương tính.
CHÚ THÍCH Phép thử lên men aesculin này tương đương với phép thử lên men salixin.
9.4.5.3. Môi trường phát hiện pyrazinamidaza
Cấy vạch trên một vùng rộng của bề mặt thạch nghiêng (B.17).
Ủ ở 30 °C trong 48 h.
Thêm 1 ml dung dịch sắt (II) amoni sunfat 1 % (B.18).
Sau 15 min thấy có màu hồng-nâu chứng tỏ phản ứng dương tính.
9.4.5.4. Phép thử các yêu cầu canxi ở 37 °C
9.4.5.4.1. Phép thử về các yêu cầu đối với canxi ở 37 °C có thể được thay thế bằng cách sử dụng natri axetat
CHÚ THÍCH 1 Các phép thử ủ ở 37 °C có thể làm cho đặc trưng này bị mất đi vì các gen đã mã hóa cho đặc trưng này được thực hiện trên plasmit.
9.4.5.4.2. Đối với từng dịch cấy thuần khiết được phân lập trên thạch dinh dưỡng (9.4.5.1), hòa một phần nhỏ khuẩn lạc vào dung dịch natri clorua (B.20) để thu được huyền phù chứa khoảng 1 000 tế bào vi khuẩn trên mililit.
Cấy 0,1 ml từng huyền phù bằng cách dàn lên trên:
- hai đĩa thạch casein đậu tương (B 16) (các đĩa kiểm chứng) và
- hai đĩa thạch casein đậu tương có magie và oxalat (B.19).
Ủ một đĩa của mỗi loại môi trường ở 25 °C trong 48 h và một đĩa còn lại ở 37 °C trong 48 h.
9.4.5.4.3. Phản ứng được coi là dương tính nếu ở 25 °C cho thấy các khuẩn lạc có các kích thước đồng đều và nếu ở 37 °C khi có mặt magie và oxalat, sự ức chế khuẩn lạc thấy rõ khi có > 20 % các khuẩn lạc nhỏ hơn, có đường kính 0,1 mm và số còn lại có đường kính từ 0,5 mm đến 1 mm.
Các khuẩn lạc bị ức chế phụ thuộc vào canxi và được cho là loại gây bệnh.
9.4.6. Diễn giải kết quả các phép thử hóa sinh và thử tính gây bệnh
9.4.6.1. Các chủng Yersinia enterocolitica gây bệnh giả định nhìn chung cho thấy các phản ứng như trong Bảng 1; có thể phải thực hiện các phép thử bổ sung (xem Bảng C.1).
Bảng 1 – Diễn giải kết quả các phép thử hóa sinh và tính gây bệnh đối với Yersinia enterocolitica
| Phép thử | Phản ứng |
| Xác định các loài | |
| Ure (9.4.3.2) | + |
| Indol (9.4.3.3) | - / +a |
| Glucoza (9.4.3.4) | + |
| Sinh khí từ glucoza (9.4.3.4) | - |
| Lactoza (9.4.3.4) | - |
| Hydro sulfua (9.4.3.4) | - |
| Oxidaza (9.4.3.5) | - |
| Lyzin decarboxylaza (9.4.4.2) | - |
| Ornithin decarboxylaza (9.4.4.3) | + |
| Sacaroza (9.4.4.4) | + |
| Trehaloza (9.4.4.4) | +/-b |
| Rhamnoza (9.4.4.4) | +/-b |
| Xyloza (9.4.4.4) | +/-b |
| Xitrat (9.4.4.5) | - |
| Tween-esteraza (9.4.4.6) | +/-b |
| Xác định tính gây bệnh | |
| Aesculin (9.4.5.2) | - |
| Pyrazinamidaza (9.4.5.3) | - |
| Phụ thuộc vào canxi ở 37 °C (9.4.5.4)c | + |
| a Biovar 1 và một số serovar của biovar 2 dương tính với indol. Biovar 3, 4 và 5 và một số serovar của biovar 2 âm tính với indol. b Phụ thuộc vào biovar của Yersinia enterocolitica (Phụ lục C). c Đặc trưng gây bệnh được mã hóa bằng plasmit độc lực. | |
9.4.6.2. Việc xác định biovar của Yersinia enterocolitica theo các phép thử trong Bảng D.1 (Phụ lục D) cần được thực hiện để khẳng định tính gây bệnh giả định (Tween-esteraza, aesculin, pyrazinamidaza, indol, xyloza, trehaloza), các Yersinia enterocolitica biovar 1B, 2, 3, 4 và 5 được biết là gây bệnh.
9.4.6.3. Các phép thử aesculin, pyrazinamidaza phải được xây dựng để xác định tính gây bệnh giả định. Chủng dương tính với aesculin và/hoặc pyrazinamidaza và âm tính phụ thuộc canxi ở 37 °C là loại không gây bệnh. Chủng âm tính với aesculin và pyrazinamidaza và dương tính phụ thuộc canxi ở 37 °C là gây bệnh. Các phép thử tính gây bệnh cần được thực hiện thường xuyên (xem [9]).
9.4.6.4. Đối với các mục đích về dịch tễ học, thì việc xác định các kháng nguyên thân của Yersinia enterocolitica cần được nghiên cứu. Các chủng gây bệnh giả định được kiểm tra kiểu huyết thanh bằng cách dùng kháng huyết thanh thích hợp thường là loại serovar O:3, O:8, O:9 và O:5,27.
10. Báo cáo thử nghiệm
Báo cáo thử nghiệm phải ghi rõ:
a) mọi thông tin cần thiết để nhận biết đầy đủ về mẫu thử;
b) phương pháp lấy mẫu đã sử dụng, nếu biết;
c) phương pháp đã sử dụng, viện dẫn tiêu chuẩn này;
d) nhiệt độ ủ đã sử dụng;
e) mọi chi tiết thao tác không quy định trong tiêu chuẩn này, hoặc tùy ý lựa chọn, cùng với các chi tiết bất thường khác có thể ảnh hưởng tới kết quả;
f) các kết quả thử nghiệm thu được hoặc nếu đáp ứng các yêu cầu về độ lặp lại thì nêu kết quả thu được;
Báo cáo thử nghiệm cũng phải nêu rõ nếu thực hiện các phép thử tiếp tại phòng thử nghiệm chuẩn và nếu có thì nêu kết quả thu được.
PHỤ LỤC A
(Quy định)
SƠ ĐỒ QUI TRÌNH
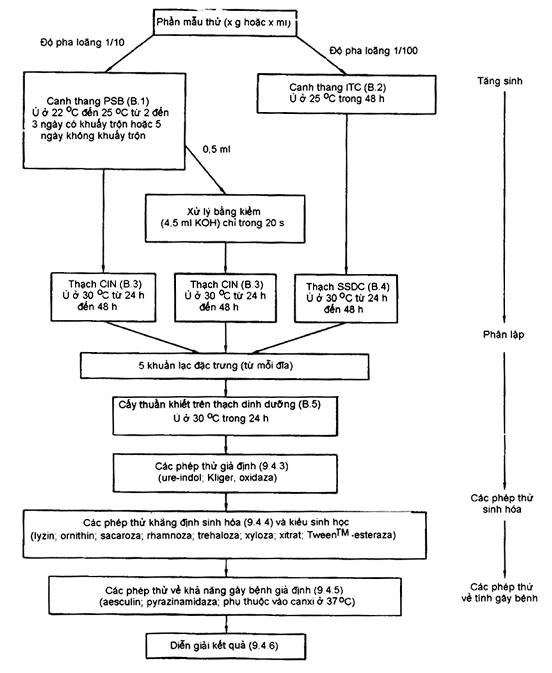
PHỤ LỤC B
(Quy định)
THÀNH PHẨN VÀ CÁCH CHUẨN BỊ MÔI TRƯỜNG NUÔI CẤY VÀ THUỐC THỬ
B.1. Canh thang pepton, sorbitol và muối mật (PSB)
B.1.1. Thành phần
| Sản phẩm thủy phân casein bằng enzym | 5,0 g |
| Sorbitol | 10,0 g |
| Natri clorua | 5,0 g |
| Dinatri hydro phosphat (Na2HPO4) | 8,23 g |
| Natri dihydro phosphat ngậm một phân tử nước (Na2HPO4.H2O) | 1,2 g |
| Muối mật | 1.5 g |
| Nước | 1 000 ml |
B.1.2. Chuẩn bị
Hòa tan các thành phần cơ bản hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH, sao cho sau khi khử trùng là 7,6 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường vào các ống nghiệm hoặc bình cầu có dung tích thích hợp để thu được các lượng cần thiết cho phép thử (xem 9.1.2).
Khử trùng 15 min trong nồi hấp áp lực (6.1) ở nhiệt độ 121 °C.
B.2. Canh thang Irgasan™, ticarcillin và kali clorat (ITC)
B.2.1. Môi trường cơ bản
B.2.1.1. Thành phần
| Sản phẩm thủy phân casein bằng enzym | 10,0 g |
| Chất chiết nấm men | 1,0 g |
| Magie clorua ngậm sáu phân tử nước (MgCl2.6H2O) | 60,0 g |
| Natri clorua (NaCI) | 5,0 g |
| Xanh lục malachit, dung dịch 0,2 % | 5,0 ml |
| Nước | 1 000 ml |
B.2.1.2. Chuẩn bị
Hòa tan các thành phần cơ bản hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH, sao cho sau khi khử trùng là 6,9 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường cơ bản vào các bình cầu (6.7) có dung tích thích hợp để thu được các lượng cần thiết (ví dụ: 988 ml đối với 1 I môi trường hoàn chỉnh).
Khử trùng 15 min trong nồi hấp áp lực (6.1) ở nhiệt độ 121 °C.
B.2.2. Dung dịch Ticarcillin (1 mg/ml)
B.2.2.1. Thành phần
| Ticarcillin | 10,0 mg |
| Nước | 10 ml |
B.2.2.2. Chuẩn bị
Hòa tan ticarcillin trong nước. Lọc để khử trùng.
B.2.3. Dung dịch Irasan™ [5-clo-2-(2,4-diclorophenoxy)phenol] trong etanol (1 mg/ml)
B.2.3.1. Thành phần
| Irgasan™ | 10,0 mg |
| Etanol, 95 % (thể tích) | 10,0 ml |
B.2.3.2. Chuẩn bị
Hòa tan Irgasan™ trong etanol khi cần dùng hoặc dung dịch này được bảo quản ở khoảng âm 20 °C trong không quá 4 tuần.
B.2.4. Dung dịch kali clorat (100 mg/ml)
B.2.4.1. Thành phần
| Kali clorat (KClO3) | 10,0 g |
| Nước | 100 ml |
B.2.4.2. Chuẩn bị
Hòa tan kali clorat trong nước. Lọc để khử trùng.
B.2.5. Môi trường hoàn chỉnh
B.2.5.1. Thành phần
| Môi trường cơ bản (B.2.1) | 988 ml |
| Dung dịch tircacillin (B.2.2) | 1 ml |
| Dung dịch Irgasan (B.2.3) | 1 ml |
| Dung dịch kali clorat (B.2.4) | 10 ml |
B.2.5.2. Chuẩn bị
Khi cần, cho tircacillin, Irgasan™ và dung dịch kali clorat một cách vô trùng vào môi trường cơ bản đã được làm nguội đến 47 °C và trộn.
Phân phối môi trường này một cách vô trùng vào các ống nghiệm với các lượng 10 ml hoặc 100 ml vào các bình cầu có dung tích thích hợp (xem 9.1.3), sao cho thu được tỷ lệ diện tích/thể tích là tối thiểu (kỵ khí tương đối).
B.3. Thạch cefsulodin, lrgasan™và novobioxin (CIN)
B.3.1. Môi trường cơ bản
B.3.1.1. Thành phần
| Sản phẩm thủy phân gelatin bằng enzym | 17,0 g |
| Sản phẩm thủy phân casein và mô động vật | 3,0 g |
| Chất chiết nấm men | 2,0 g |
| Manitol | 20,0 g |
| Natri pyruvat | 2,0 g |
| Natri clorua | 1,0 g |
| Magie sultat ngậm bảy phân tử nước (MgSO4.7H2O) | 0,01 g |
| Natri desoxycolat | 0,5 g |
| Đỏ trung tính | 0,03 g |
| Tím tinh thể | 0,001 g |
| Thạch | 9 đến18 g1) |
| Nước | 1 000 ml |
B.3.1.2. Chuẩn bị
Hòa tan các thành phần cơ bản hoặc môi trường cơ bản khô trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH, sao cho sau khi khử trùng là 7,4 ± 0,2 ở 25 oC, nếu cần.
Phân phối môi trường vào các bình cầu (6.7) có dung tích thích hợp.
Khử trùng 15 min trong nồi hấp áp lực (6.1) ở nhiệt độ 121 °C.
B.3.2. Dung dịch cefsulodin (15 mg/ml)
B.3.2.1. Thành phần
| Cefsulodin | 1,5g |
| Nước | 100 ml |
B.3.2.2. Chuẩn bị
Hòa tan cefsulodin trong nước. Lọc để khử trùng.
B.3.3 Dung dịch Irasan™ [5-clo-2-(2,4-diclorophenoxy)phenol] trong etanol (4 mg/ml)
B.3.3.1. Thành phần
| Irgasan™ | 0,4 g |
| Etanol, 95 % (thể tích) | 100 ml |
B.3.3.2. Chuẩn bị
Hòa tan Irgasan™ trong etanol khi cần dùng hoặc dung dịch này được bảo quản ở khoảng âm 20 °C trong không quá 4 tuần.
B.3.4. Dung dịch novobiocin (2,5 mg/ml)
B.3.4.1. Thành phần
| Novobiocin | 0,25 g |
| Nước | 100 ml |
B.3.4.2. Chuẩn bị
Hòa tan novobiocin trong nước. Lọc để khử trùng.
B.3.5. Môi trường hoàn chỉnh
B.3.5.1. Thành phần
| Môi trường cơ bản (B.3.1) | 997 ml |
| Dung dịch cefsulodin (B.3.2) | 1 ml |
| Dung dịch Irgasan (B.3.3) | 1 ml |
| Dung dịch novobiocin (B.3.4) | 1 ml |
B.3.5.2. Chuẩn bị
Cho từng dung dịch kháng sinh này một cách vô trùng vào môi trường cơ bản đã được làm nguội đến 45°C và trộn đều.
B.3.5.3. Chuẩn bị các đĩa thạch CIN
Rót khoảng 15 ml môi trường hoàn chỉnh vào các đĩa Petri vô trùng (6.8). Để yên các đĩa.
B.4. Thạch Salmonella/Shigella có natri desoxycolat và canxi clorua (SSDC)
B.4.1 Thành phần
| Chất chiết nấm men | 5,0 g |
| Chất chiết thịt | 5,0 g |
| Sản phẩm thủy phân mô động vật bằng enzym | 5,0 g |
| Lactoza | 10,0 g |
| Muối mật | 8,5 g |
| Natri desoxycolat | 10,0 g |
| Canxi clorua | 1,0 g |
| Natri xitrat | 10,0 g |
| Natri thiosulfat ngậm năm phân tử nước | 8,5 g |
| Sắt (III) xitrat | 1,0 g |
| Xanh brilliant | 0,0003 g |
| Đỏ trung tính | 0,025 g |
| Thạch | 9 g đến 18 g a |
| Nước | 1 000 ml |
| a Tùy thuộc vào sức đông của thạch | |
B.4.2. Chuẩn bị
Hòa tan các thành phần khô hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun sôi.
Chỉnh pH, sao cho sau khi khử trùng là 7,4 ± 0,2 ở 25 °C, nếu cần.
Không khử trùng
B.4.3. Chuẩn bị các đĩa thạch SSDC
Rót khoảng 20ml môi trường đã làm nguội đến khoảng 45 °C vào các đĩa Petri vô trùng (6.8). Để yên các đĩa.
Nếu môi trường đã được chuẩn bị trước thì các đĩa thạch chưa khô phải được để trong túi bằng chất dẻo ở nơi tối khoảng 1 tuần ở 8 °C ± 2°C vì sẽ hình thành kết tủa trong môi trường và sẽ giảm hiệu năng của môi trường.
B.5. Thạch dinh dưỡng
B.5.1. Thành phần
| Chất chiết thịt | 3,0 g |
| Pepton | 5,0 g |
| Thạch | 9 g đến 18 g a |
| Nước | 1 000 ml |
| a Tùy thuộc vào sức đông của thạch | |
B.5.2. Chuẩn bị
Hòa tan các thành phần cơ bản hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH, sao cho sau khi khử trùng là 7,0 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường vào các bình cầu (6.7) có dung tích thích hợp.
Khử trùng 15 min trong nồi hấp áp lực (6.1) ở nhiệt độ 121 °C.
B.5.3. Chuẩn bị các đĩa thạch dinh dưỡng
Rót khoảng 15 ml môi trường đã làm nguội đến khoảng 45 °C vào các đĩa Petri vô trùng (6.8). Để yên các đĩa.
B.6. Môi trường ure indol
B.6.1. Thành phần
| L-Tryptophan, không chứa indol | 3,0 g |
| Kali dihydro phosphat (KH2PO4) | 1,0 g |
| Dikali hydro phosphat (K2HPO4) | 1,0 g |
| Natri clorua | 5,0 g |
| Ure | 20,0 g |
| Etanol 95o (thể tích) | 10 ml |
| Đỏ phenol | 0,025 g |
| Nước | 1 000 ml |
B.6.2. Chuẩn bị
Hòa tan L-Tryptophan trong nước ở 60 °C. Làm nguội rồi hòa tan các thành phần còn lại trong nước, bằng cách khuấy.
Cách khác, hòa tan môi trường hoàn chỉnh khô trong nước bằng cách khuấy.
Chỉnh pH, sao cho sau khi khử trùng là 6,9 ± 0,2 ở 25 °C, nếu cần.
Lọc để khử trùng.
Phân phối môi trường này một cách vô trùng, với các lượng 0,5 ml vào các ống nghiệm vô trùng có kích thước 12 mm x 50 mm (6.6). Bảo quản môi trường này ở 3 °C ± 2 °C, nơi tối.
B.7. Thuốc thử Kovac
B.7.1 Thành phần
| 4-Dimetylaminobenzaldehyt | 5,0 g |
| Axit clohydric, r = 1,18 g/ml đến 1,19 g/ml | 25 ml |
| 2-Metylbutan-2-ol | 75 ml |
B.7.2. Chuẩn bị
Hòa tan 4-Dimetylaminobenzaldehyt trong 2-Metylbutan-2-ol để trong nồi cách thủy ở 60 °C.
Làm nguội đến nhiệt độ phòng rồi đặt bình cầu trên bể nước đá. Sau đó thêm cẩn thận axit clohyric, trộn từ từ.
Bảo quản ở 3 °C ± 2 °C, trong chai màu nâu. Không sử dụng chai có nút đậy bằng cao su vì sẽ làm hỏng thuốc thử.
B.8. Thạch Kligler
B.8.1. Thành phần
| Chất chiết thịt | 3,0 g |
| Chất chiết nấm men | 3,0 g |
| Pepton pancreatic casein | 20,0 g |
| Natri clorua | 5,0 g |
| Lactoza | 10,0 g |
| Glucoza | 1.0 g |
| Sắt (II) sulfat | 0,2 g |
| Natri thiosultat ngậm năm phân tử nước (Na2S2O3.5H2O) | 0,3 g |
| Đỏ phenol | 0,025 g |
| Thạch | 9 g đến 18 g a |
| Nước | 1 000 ml |
| * Tùy thuộc vào sức đông của thạch. | |
B.8.2 Chuẩn bị
Hòa tan các thành phần trên hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun sôi.
Chỉnh pH, sao cho sau khi khử trùng là 7,4 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường với các lượng 10 ml vào các ống nghiệm (6.6) có dung tích thích hợp.
Khử trùng 15 min trong nồi hấp áp lực (6.1) ở nhiệt độ 121 °C.
Để các ống thạch ở tư thế nghiêng, sao cho thu được cột thạch có chiều sâu 3 cm và đoạn nghiêng dài 5 cm.
B.9. Thuốc thử phát hiện oxidaza
B.9.1. Thành phần
| N,N,N'N' -Tetrametyl-r-phenylendiamin dihydroclorua | 1,0 ga |
| Nước | 100 ml |
| a Có thể dùng oxalat để thay thế cho dihydroclorua nhưng hạn sử dụng của dung dịch sẽ ngắn hơn. | |
B.9.2. Chuẩn bị
Hòa tan thành phần trên trong nước ngay trước khi sử dụng.
Khi được bảo quản ở 3 °C ± 2 °C và nơi tối, dung dịch bền không quá một tuần.
B.10. Môi trường lyzin decarboxylaza (LDC)
B.10.1. Thành phần
| L-lyzin monohydroclorua | 5,0 g |
| Chất chiết nấm men | 3,0 g |
| Glucoza | 1,0 g |
| Bromocresol tía | 0,015 g |
| Nước | 1 000 ml |
B.10.2. Chuẩn bị
Hòa tan các thành phần trên trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH sao cho sau khi khử trùng pH là 6,8 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường này với các lượng 5 ml vào các ống nghiệm có kích thước 9 mm x 180 mm (6.6).
Khử trùng 15 min trong nồi hấp áp lực (6.1) ở nhiệt độ 121 °C.
B.11. Môi trường Ornithin decarboxylaza
B.11.1. Thành phần
| L-Ornithin monohydroclorua | 5,0 g |
| Chất chiết nấm men | 3,0 g |
| Glucoza | 1,0 g |
| Bromocresol tía | 0,015 g |
| Nước | 1 000 ml |
B.11.2. Chuẩn bị
Hòa tan các thành phần trên trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH sao cho sau khi khử trùng pH là 6,8 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường này với các lượng 5 ml vào các ống có kích thước 9 mm x 180 mm (6.6).
Khử trùng 15 min trong nồi hấp áp lực (6.1) ở nhiệt độ 121 °C.
B.12. Môi trường lên men cacbohydrat (nước pepton với đỏ phenol, rhamnoza hoặc sacaroza hoặc trehaloza hoặc xyloza)
B.12.1. Môi trường cơ bản
B.12.1.1. Thành phần
| Pepton | 10,0 g |
| Natri clorua | 5,0 g |
| Đỏ phenol | 0,02 g |
| Nước | 1 000 ml |
B.12.1.2. Chuẩn bị
Hòa tan các thành phần trên hoặc môi trường cơ bản khô trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH, sao cho sau khi khử trùng là 6,8 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường cơ bản này vào các bình cầu (6.7) có dung tích thích hợp.
Khử trùng 10 min trong nồi hấp áp lực (6.1) ở nhiệt độ 121 °C.
B.12.2 Dung dịch cacbohydrat (rhamnoza, sacaroza, trehaloza hoặc xyloza 100 mg/ml)
B.12.2.1 Thành phần
| Cacbohydrat (rhamnoza, sacaroza, trehaloza hoặc xyloza) | 10,0 g |
| Nước | 100 ml |
B.12.2.2. Chuẩn bị
Chuẩn bị riêng rẽ từng dung dịch cacbohydrat bằng cách cho vào nước cất.
Lọc để khử trùng.
B.12.3. Môi trường hoàn chỉnh
B.12.3.1. Thành phần
| Môi trường cơ bản (B.12.1) | 900 ml |
| Dung dịch cacbohydrat (B.12.2) | 100 ml |
B.12.3.2. Chuẩn bị
Đối với từng cacbon hydrat, thêm một cách vô trùng dung dịch cacbohydrat vào môi trường cơ bản đã làm nguội đến khoảng 45 °C và trộn.
Phân phối môi trường hoàn chỉnh một cách vô trùng với các lượng 10 ml vào các ống nghiệm (6.6) hoặc các chai (6.7) có dung tích thích hợp.
B.13. Môi trường Simmon xitrat
B.13.1. Thành phần
| Natri xitrat | 2,0 g |
| Natri clorua | 5,0 g |
| Dikali hydro phosphat (K2HPO4) | 1,0 g |
| Xanh bromothymol | 0,08 g |
| Amoni dihydro phosphat (NH4H2PO4) | 1,0 g |
| Magie sulfat | 0,2 g |
| Thạch | 9 g đến 18 g a |
| Nước | 1 000 ml |
| a Tùy thuộc vào sức đông của thạch. | |
B.13.2. Chuẩn bị
Hòa tan các thành phần trên hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun sôi.
Chỉnh pH, sao cho sau khi khử trùng là 6,8 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường với các lượng 10 ml vào các ống nghiệm mới (6.6) có dung tích thích hợp. Nếu không có sẵn các ống nghiệm mới thì trước khi sử dụng phải làm sạch các ống nghiệm để các ống nghiệm này không chứa các chất gây nhiễu đến phép thử.
Khử trùng 15 min trong nồi hấp áp lực (6.1) ở nhiệt độ 121 °C.
Để ống nghiệm ở tư thế nghiêng sao cho thu được mặt nghiêng có chiều sâu 2,5 cm.
B.14. Mổi trường thử Tween-esteaza
B.14.1. Môi trường cơ bản
B.14.1.1. Thành phần
| Dịch thủy phân peptic của thịt | 10,0 g |
| Natri clorua (NaCl) | 5,0 g |
| Canxi clorua (CaCl2) | 0,1 g |
| Thạch | 9 g đến 18 g a |
| Nước | 1 000 ml |
| a Tùy thuộc vào sức đông của thạch. | |
B.14.1.2. Chuẩn bị
Hòa tan các thành phần trên trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH, sao cho sau khi khử trùng là 7,4 ± 0,2 ở 25 °C, nếu cần.
Khử trùng 30 min trong nồi hấp áp lực (6.1) ở nhiệt độ 121 °C.
B.14.2 Môi trường hoàn chỉnh
B.14.2.1. Thành phần
| Môi trường cơ bản (B.14.1) | 990 ml |
| Tween 80™ (sorbitol mono-oleat) | 10 ml |
B.14.2.2. Chuẩn bị
Cho dung dịch Tween 80™ vào môi trường lỏng cơ bản và đồng hóa.
Khử trùng 30 min ở nhiệt độ 110 °C.
Phân phối môi trường hoàn chỉnh này với các lượng 2,5 ml vào các ống nghiệm (6.6) có dung tích thích hợp.
Để các ống nghiệm ở tư thế gần như nằm ngang sao cho mặt nghiêng dài nhất có đáy nhỏ nhất.
B.15. Thạch mật và aesculin
B.15.1. Thành phần
| Chất chiết thịt | 3,0 g |
| Pepton thịt | 5,0 g |
| Aesculin | 1,0 g |
| Muối mật | 40,0 g |
| Sắt (III) xitrat | 0,5 g |
| Thạch | 9 g đến 18 g a |
| Nước | 1 000 ml |
| a Tùy thuộc vào sức đông của thạch. | |
B.15.2. Chuẩn bị
Hòa tan các thành phần trên hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun sôi nhẹ.
Chỉnh pH, sao cho sau khi khử trùng là 6,6 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường với các lượng 10 ml vào các ống nghiệm (6.6) có dung tích thích hợp.
Khử trùng 15 min trong nồi hấp áp lực (6.1) ở nhiệt độ 121 °C.
Để ống nghiệm ở tư thế nghiêng sao cho thu được mặt nghiêng có chiều sâu 2,5 cm.
B.16. Thạch casein đậu tương
B.16.1. Thành phần
| Sản phẩm thủy phân casein bằng enzym | 15,0 g |
| Pepton đậu tương | 5,0 g |
| Natri clorua | 5,0 g |
| Thạch | 9 g đến 18 g a |
| Nước | 1 000 ml |
| a Tùy thuộc vào sức đông của thạch. | |
B.16.2. Chuẩn bị
Hòa tan các thành phần trên hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun sôi.
Chỉnh pH, sao cho sau khi khử trùng là 7,3 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường vào các bình cầu (6.7) có dung tích thích hợp và với các lượng 830 ml (xem B.19.5.1). Môi trường này cần để sử dụng trong B. 19.5.1.
Khử trùng 15 min trong nồi hấp áp lực (6.1) ở nhiệt độ 121 °C.
B.17. Thạch casein đậu tương để phát hiện pyrazinamidaza
B.17.1. Thành phần
| Sản phẩm thủy phân casein bằng enzym | 15,0 g |
| Pepton đậu tương | 5,0 g |
| Pyrazincarboxamid (C5H5N3O) | 1,0 g |
| Natri clorua | 5,0 g |
| Thạch | 9 g đến 18 g a |
| Dung dịch đệm tris-maleat (0,2 mol/l, pH 6) | 1 000 ml |
| a Tùy thuộc vào sức đông của thạch. | |
B.17.2. Chuẩn bị
Hòa tan các thành phần cơ bản hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun sôi.
Chỉnh pH, sao cho sau khi khử trùng là 7,3 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường với các lượng 10 ml vào các bình cầu (6.7) có dung tích thích hợp.
Khử trùng 15 min trong nồi hấp áp lực (6.1) ở nhiệt độ 121 °C.
Sau khi khử trùng, để ở tư thế nghiêng sao cho thu được mặt nghiêng dài.
B.18. Dung dịch amoni sắt (III) sulfat để phát hiện pyrazinamidaza
B.18.1. Thành phần
| Amoni sắt (II) sulfat | 1,0 g |
| Nước | 100 ml |
B.18.2. Chuẩn bị
Ngay trước khi sử dụng, hòa tan amoni sắt (II) sulfat trong nước.
B.19. Thạch casein đậu tương có magie và oxalat
B.19.1. Môi trường cơ bản (xem B.16)
B.19.2. Dung dịch magie clorua
B.19.2.1. Thành phần
| Magie clorua ngậm sáu phân tử nước (MgCI2.6H2O) (0,25 mol/l) | 5,09 g |
| Nước | 100 ml |
B.19.2.2. Chuẩn bị
Hòa tan magie clorua trong nước. Lọc để khử trùng.
B.19.3. Dung dịch natri oxalat
B.19.3.1. Thành phần
| Natri oxalat | 3,35 g |
| Nước | 100 ml |
B.19.3.2. Chuẩn bị
Hòa tan natri oxalat trong nước. Lọc để khử trùng.
B.19.4. Dung dịch glucoza
B.19.4.1. Thành phần
| Glucoza | 18,0 g |
| Nước | 100 ml |
B.19.4.2. Chuẩn bị
Hòa tan glucoza trong nước. Lọc để khử trùng.
B.19.5. Môi trường hoàn chỉnh
B.19.5.1. Thành phần
| Môi trường cơ bản (B.16) | 830 ml |
| Dung dịch magie clorua (B.19.2) | 80 ml |
| Dung dịch natri oxalat (B.19.3) | 80 ml |
| Dung dịch glucoza (B.19.4) | 10 ml |
B.19.5.2. Chuẩn bị
Bổ sung một cách vô trùng các dung dịch magie clorua, natri oxalat và glucoza vào môi trường cơ bản đã được làm nguội đến 47 °C và trộn.
B.19.5.3. Chuẩn bị các đĩa thạch
Rót các lượng khoảng 15 ml môi trường hoàn chỉnh vào các đĩa Petri vô trùng (6.8). Để yên các đĩa này cho môi trường lắng xuống.
B.20. Dung dịch muối
B.20.1. Thành phần
| Natri clorua | 5,0 g |
| Nước | 1 000 ml |
B.20.2. Chuẩn bị
Hòa tan natri clorua trong nước.
Phân phối dung dịch vào các bình cầu (6.7) có dung tích thích hợp.
Khử trùng 15 min trong nồi hấp áp lực (6.1) ở nhiệt độ 121 °C.
B.21. Kali hydroxit trong dung dịch muối
B.21.1. Thành phần
| Kali hydroxit (KOH) | 0,5 g |
| Dung dịch muối (B.20) | 100 ml |
B.21.2. Chuẩn bị
Hòa tan kali hydroxit trong dung dịch muối.
Phân phối dung dịch vào các bình cầu (6.7) có dung tích thích hợp.
Khử trùng 15 min trong nồi hấp áp lực (6.1) ở nhiệt độ 121 °C.
CHÚ THÍCH Dung dịch gốc kali hydroxit 40 % có thể được chuẩn bị và bảo quản ở 3 °C ± 2 °C. Pha loãng dung dịch này bằng dung dịch NaCl 0,5 % với tỷ lệ 1 : 80 để có được dung dịch KOH 0,5 %.
B.22. Canh thang thịt bê pha loãng
B.22.1. Thành phần
| Chất chiết từ thịt bê (dạng khô) | 5,0 g |
| Sản phẩm thủy phân casein bằng enzym | 10 g |
| Natri clorua | 5g |
| Nước cất | 1 000 ml |
B.22.2. Chuẩn bị
Hòa tan các thành phần trên hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun sôi.
Chỉnh pH, sao cho sau khi khử trùng là 7,4 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường với các lượng 10 ml vào các ống nghiệm (6.6) và đậy nắp.
Khử trùng 15 min trong nồi hấp áp lực (6.1) ở nhiệt độ 121 °C.
B.23. Glyxerol vô trùng
Phân phối glyxerol với các lượng 100 ml vào các bình cầu hoặc chai và khử trùng 15 min trong nồi hấp áp lực (6.1) ở nhiệt độ 121 °C.
PHỤ LỤC C
(Tham khảo)
CÁC ĐẶC TRƯNG HÓA SINH CỦA YERSINIA PSEUDOTUBERCULOSIS, YERSINIA ENTEROCOLITICA VÀ CÁC LOÀI CÓ HÓA SINH LIÊN QUAN
Bảng C.1 - Các đặc trưng hóa sinh của Yersinia
| Phép thử | Yersinia pseudotuberculosis | Yersinia enterocolitica | Các loài có liên quan |
| Glucoza | + a | + | + |
| Sinh khí từ glucoza | - | - (hoặc một số bọt khí) | - (hoặc một số bọt khí) |
| Lactoza | - | - | - |
| ONPG | + | +/- | +/- |
| Adonitol | - | - | - |
| Cellobioza | - | + | D |
| Dulcitol | - | - | - |
| Mannitol | + | + | + |
| Melibioza | +/- | - | D |
| Rhamnoza | + | - | D |
| Sacaroza | - | + | D |
| Sorbitol | - | +/- | D |
| Trehaloza | + | +/- | + |
| Xyloza | + | D | + |
| Aesculin | + | D | D |
| Salicin | + | D | D |
| Ure | + | + | + |
| Indol | - | D | D |
| Voges Proskauer | - | +*/- | D |
| Hydro sulfua | - | - | - |
| Deaminaza (APP) | - | - | - |
| Lysin | - | - | - |
| Ornithin | - | +/- | + |
| Xitrat (Simmons) | - | - | D |
| Lipaza (Tween 80) | - | D | D |
| Mucat | - |
| D |
| a + dương tính; - âm tính; +/- phần lớn các chủng dương tính; D các kiểu hóa sinh khác nhau. * Các chủng thường âm tính ở 37 oC. | |||
PHỤ LỤC D
(Tham khảo)
BIOVAR (BIOTYPE) CỦA YERSINIA ENTEROCOLITICA
| Biovar | Tween-esteraza | Aesculin | Pyrazinamidasa | Indol | Xyloza | Trehaloza |
| 1Aa | + | + | + | + | + | + |
| 1B | + | - | - | + | + | + |
| 2 | - | - | - | (+)b | + | + |
| 3 | - | - | - | - | + | + |
| 4 | - | - | - | - | - | + |
| 5 | - | - | - | - | Db | - |
| a Không gây bệnh b Thường yếu và phát triển chậm. | ||||||
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] Wauters. G., Goossens. V., Janssens. M. and Vanoepitte, J. New enrichment method for isolation of pathogenic Yersinia enlerocolitica serogroup O:3 from pork. Appl. Environ. Microbiol., 54. 1988. pp. 851-854
[2] DE Boer. E. Isolation of Yersinia enlerocolitica from foods, Int. J. Food Microbiol., 17, 1992, pp. 75-84
[3] De Zutter. L. Le Mort. L, Janssens. M. and Wauters. G. Short-comings of irgasan ticarcillin chlorate broth for the enrichment of Yersinia enlerocolitica biovar 2, serovar 9 from meat. Int. J. Food. Microbiol., 23, 1994. pp. 231-237
[4] Schiemann, D.A. Synthesis of selective agar medium for Yersinia enterocolitica. Can. J Microbiol., 25. 1979, pp. 1298-1304
[5] Aulisio. C.C.G., Mehlman, I.J. and Sanders. A.C. Alkali method for rapid recovery of Yersinia enlerocolitica and Yersinia pseudotuberculosis from foods. Appl. Environ. Microbiol., 39. 1980. pp. 135-140
[6] Archer, J.R., Schell, R.F., Pennell, D.R. and Wick, P.D. Identification of Yersinia spp. with the API 20E system. J. Clin. Microbiol., 25,1987. pp. 2398-2399
[7] Sharma. N.K.. Doyle, P.W., GERBasi, S.A. and Jessop. J.H. Identification of Yersinia species by the API 20E. J. Clin. Microbiol., 28.1990, pp. 1443-1444
[8] Farmer III, J.J.. Carter, G.P., Miller, V.L., Falkow, S. and Wachsmuth, I.K. Pyrazinamidase, CR-MOX Agar. Salicin Fermentation - Esculin Hydrolysis, and D-Xylose fermentation for identifying pathogenic serotypes of Yersinia enterocolitica. J. Clin. Microbiol., 30. 1992. pp. 2589-2594
[9] Food and Drug Administration. Protocol in FDA. Yersinia enlerocolitica and Yersinia pseudotuberculosis. In: Bacteriological Analytical Manual, 8th edn., Washington, DC, 1998.
1) Tùy thuộc vào sức đông của thạch.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 8127:2009 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 8127:2009 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 8127:2009 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 8127:2009 DOC (Bản Word)