- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN III:2014 Bộ tiêu chuẩn Quốc gia về thuốc
| Số hiệu: | TCVN III:2014 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Y tế-Sức khỏe |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
21/04/2014 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN III:2014
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN III:2014
TIÊU CHUẨN QUỐC GIA
TCVN III : 2014
BỘ TIÊU CHUẨN QUỐC GIA VỀ THUỐC
Set of national standards for medicines
Lời nói đầu
Bộ tiêu chuẩn quốc gia về thuốc TCVN III: 2014 được xây dựng trên nguyên tắc nối tiếp Bộ TCVN I: 2009 và Bộ TCVN II: 2012
Bộ tiêu chuẩn quốc gia về thuốc TCVN III: 2014 do Hội đồng Dược điển Việt Nam biên soạn, Bộ Y tế đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Lời giới thiệu
Tiêu chuẩn quốc gia về thuốc là văn bản kỹ thuật về tiêu chuẩn hoá và kiểm nghiệm chất lượng thuốc. Bộ tiêu chuẩn quốc gia về thuốc này có 51 tiêu chuẩn, chia thành 5 phần như sau:
Phần 1: Phương pháp kiểm nghiệm thuốc và chuyên mục gồm 3 tiêu chuẩn;
Phần 2: Nguyên liệu hóa dược gồm 13 tiêu chuẩn;
Phần 3: Thành phẩm hóa dược gồm 12 tiêu chuẩn;
Phần 4: Dược liệu gồm 16 tiêu chuẩn;
Phần 5: vắc xin gồm 7 tiêu chuẩn.
Danh pháp, thuật ngữ trong Bộ tiêu chuẩn quốc gia về thuốc được viết theo quy định của Hội đồng Dược điển Việt Nam, Bộ Y tế. Các thuật ngữ dược phẩm được viết dựa trên nguyên tắc việt hoá tên chung quốc tế Latin (DCI Latin) một cách hợp lý nhằm tránh làm biến dạng mặt chữ quá khác so với thuật ngữ quốc tế. Tên hợp chất hữu cơ được viết theo danh pháp do Hiệp hội quốc tế hoá học thuần tuý và ứng dụng (I.U.P.A.C) quy định. Trong một số trường hợp cá biệt, các thuật ngữ tiếng Việt đã quen dùng đối với một số nguyên tố, hoá chất hay tên dược liệu vẫn tiếp tục sử dụng.
BỘ TIÊU CHUẨN QUỐC GIA VỀ THUỐC
Set of national standards for medicines
1 Phạm vi áp dụng
Bộ tiêu chuẩn này quy định:
- Các phương pháp kiểm nghiệm thuốc áp dụng để kiểm tra, đánh giá chất lượng thuốc thành phẩm, nguyên liệu làm thuốc, vắc xin và sinh phẩm y tế, dược liệu và thuốc từ dược liệu đăng ký lưu hành trong nước.
- Các chỉ tiêu, yêu cầu kỹ thuật, phương pháp kiểm nghiệm, bảo quản và các yêu cầu có liên quan đến chất lượng đối với các nguyên liệu hoá dược; áp dụng để kiểm tra đánh giá chất lượng các nguyên liệu hoá dược đăng ký lưu hành trong nước.
- Các chỉ tiêu, yêu cầu kỹ thuật, phương pháp kiểm nghiệm, bảo quản và các yêu cầu có liên quan đến chất lượng thành phẩm hoá dược; áp dụng để kiểm tra, đánh giá chất lượng các thành phẩm hoá dược đăng ký lưu hành trong nước.
- Các chỉ tiêu, yêu cầu kỹ thuật, phương pháp kiểm nghiệm, bảo quản và các yêu cầu có liên quan đến chất lượng dược liệu; áp dụng để kiểm tra, đánh giá chất lượng dược liệu đăng ký lưu hành trong nước.
- Các chỉ tiêu, yêu cầu kỹ thuật, phương pháp kiểm nghiệm, bảo quản và các yêu cầu có liên quan đến chất lượng vắc xin; áp dụng để kiểm tra, đánh giá chất lượng vắc xin đăng ký lưu hành trong nước.
Đối với các các nguyên liệu hoá dược, các thành phẩm hoá dược, các vắc xin, các dược liệu, các phương pháp kiểm nghiệm thuốc không nêu trong bộ tiêu chuẩn này hoặc Bộ tiêu chuẩn quốc gia về thuốc TCVN 1:2009 và Bộ tiêu chuẩn quốc gia về thuốc TCVN 11:2012 thì các nhà sản xuất và/hoặc các tổ chức, cá nhân có liên quan có thể áp dụng tiêu chuẩn cơ sở hoặc tiêu chuẩn nước ngoài theo quy định hiện hành.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn có ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả sửa đổi bổ sung (nếu có).
TCVN I-1:2009, Bộ tiêu chuẩn quốc gia về thuốc - Phần 1: Phương pháp kiểm nghiệm thuốc;
TCVN I-2:2009, Bộ tiêu chuẩn quốc gia về thuốc - Phần 2: Nguyên liệu hoá dược;
TCVN II:2012, Bộ tiêu chuẩn quốc gia về thuốc.
3 Các tiêu chuẩn
Các Phụ lục nêu trong các tiêu chuẩn dưới đây được tham chiếu theo TCVN I-1:2009, Bộ tiêu chuẩn quốc gia về thuốc - Phần 1: Phương pháp kiểm nghiệm thuốc và Phần 1 của Bộ tiêu chuẩn này.
PHẦN 1
PHƯƠNG PHÁP KIỂM NGHIỆM THUỐC VÀ CHUYÊN MỤC
PHỤ LỤC 15
(Qui định)
15.42 XÁC ĐỊNH HÀM LƯỢNG SACHARID TỔNG SỐ BẰNG PHƯƠNG PHÁP ORCINOL
Nguyên tắc
Phương pháp cho phép định lượng polyribosylribitol Phosphat (PRP), polysacharid này được xem là thành phần hoạt động chính của vắc xin Haemophilus Influenza type b. Phương pháp dựa trên sự hình thành phức hợp màu xanh và hòa tan trong nước.
Chuẩn bị dung dịch
Các dung dịch sau đây được pha ngay trước khi thử nghiệm.
Dung dịch chuẩn ribose: Hoà tan 5,0 mg ribose chuẩn trong bình định mức 10 ml bằng nước cất, thêm nước cất đến vạch. Lắc đều.
Dung dịch sắt (III) clorid trong acid hydrocloric: Cân 1 g sắt (III) clorid (TT) và hòa tan trong 10 ml nước cất. Pha 0,25 ml dung dịch sắt (III) clorid thu được với 50 ml acid hydrocloric (TT).
Dung dịch orcinol: Cân 230 mg orcinol (TT) và hòa tan trong 5 ml ethanol (TT), chuẩn bị xong phải chứa dung dịch trong chai thủy tinh màu.
Dung dịch natri azid 0,02 %: Cân 0,02 g natri azid (TT) và pha loãng với 100 ml nước cất.
Chuẩn bị dung dịch để lập đường chuẩn: Từ dung dịch chuẩn ribose pha về các nồng độ 1 µg/ml, 4 µg/mi, 12 pg/ml và 20 µg/ml.
Chuẩn bị mẫu kiểm tra:
Đối với mẫu cộng hợp (ARM): 50 µl mẫu pha loãng với 450 µl nước cất.
Nếu mẫu là sản phẩm cuối cùng thì không cần pha loãng.
Tiến hành
Xác định hàm lượng sacharid tổng số
Lấy vào mỗi ống 500 µl dung dịch chuẩn ribose đã pha (nồng độ 1,4, 12, 20 µg/ml).
Lấy 500 µl mẫu vắc xin cần kiểm tra vào một ống khác.
Thêm nước vào tất cả các ống để được 2000 µl.
Thêm 1000 µl dung dịch sắt (III) clorid trong acid hydrocloric vào các ống.
Thêm 80 µl dung dịch orcinol vào các ống.
Giữ 80 °C trong 15 min.
Để nguội, đo mật độ quang của các dung dịch ở 670 nm (OD 670 nm) và ở 580 nm (OD 580 nm) và tính kết quả.
Xác định hàm lượng sacharid tự do
Chú ý: Trước khi sử dụng ống ly tâm Centricon với màng lọc Ultracel YM -30, phải rửa ống ly tâm lại với nước và sau đó thêm 500 µl nước cất và ly tâm trong 5 min.
Thêm 500 µl mẫu vào phần trên của ống ly tâm Centricon.
Ly tâm ở 3500 r/min trong 20 min.
Sử dụng phần dịch được lọc ra (phần dịch nằm bên dưới) và tiến hành các bước theo phần xác định hàm lượng sacharid tổng số.
Rửa hệ thống ống ly tâm Centricon với màng lọc Ultracel YM-30 bằng nước và thêm dung dịch natri azid 0,02 %. Bảo quản ở 4 °C cho đến khi dùng trở lại.
Tính hàm lượng sacharid cuối cùng của mẫu thử (Cf) theo công thức sau:
Cf = Cm x 10-3 x 2,45
Trong đó:
Cm là giá trị trung bình của hàm lượng ribose trong mẫu thử;
2,45 là hệ số biểu hiện mối tương quan về khối lượng phân tử của polymer (sacharid) và D-ribose;
10-3 là hệ số chuyển đổi từ đơn vị µg/ml thành mg/ml.
Kết quả được tính theo đơn vị mg/ml (mg carbohydrat/ml mẫu cần kiểm tra).
15.43 QUI TRÌNH THỬ NGHIỆM CÔNG HIỆU (IN VIVO) CỦA VACXIN VIÊM GAN B TÁI TỔ HỢP
Sinh vật phẩm
Chuột nhắt cái giống BALB/c thuần chủng từ cùng một đàn tùy loại 2D hoặc 2K từ 5 đến 6 tuần tuổi, khối lượng tối thiểu 16 g được lựa chọn, vận chuyển và chăm sóc trong điều kiện cách ly.
Vắc xin viêm gan B mẫu chuẩn quốc tế từ WHO.
Chuẩn thứ cấp (địa phương) vắc xin viêm gan B tái tổ hợp.
Chuẩn bị dung dịch
Dung dịch để pha loãng mẫu: Hoà tan nhôm hydroxyd (TT) trong dung dịch natri clorid 0,9 % (TT) để được dung dịch có nồng độ 1,5 g/l.
Gel phải có nồng độ AI3+ như trong mẫu vắc xin (0,5 mg AI3+/ml); 0,5 mg AI3+ tương đương với 1,44 mg AI(OH)3.
Hấp tiệt trùng dung dịch đã pha ở 121 °C trong 30 min. Bảo quản ở 4 °C.
Tiến hành
Chuẩn bị các độ pha của vắc xin: Tiến hành trong Laminar.
Các độ pha của mẫu vắc xin hấp phụ được pha loãng bằng dung dịch pha loãng mẫu, mỗi độ pha tương ứng với một nồng độ của vắc xin. Chỉ chuẩn bị 1 lọ cho mỗi độ pha mẫu hoặc chuẩn.
Trước khi lấy đủ lượng vắc xin cần thiết (1 ml) phải lắc đều lọ để đồng nhất mẫu.
Để chuẩn bị các độ pha vắc xin từ nồng độ kháng nguyên 20 pg/ml cần tiến hành theo hướng dẫn trong Bảng 1.
Bảng 1: Chuẩn bị các độ pha loãng của vắc xin
| Mẫu vắc xin (ml) | Dung dịch pha loãng (ml) | Độ pha loãng | HbsAg (µg/ml) |
| 1 (vắc xin không pha loãng) | 15 | 1/16 | 1,25 |
| 4 (vắc xin 1/16) | 12 | 1/64 | 0,312 |
| 4 (vắc xin 1/64) | 12 | 1/256 | 0,078 |
| 4 (vắc xin 1/64) | 28 | 1/512 | 0,039 |
| 4 (vắc xin 1/256) | 12 | 1/1024 | 0,019 |
| Giả dược (Placebo) | 12 |
|
|
Song song làm tương tự với mẫu chuẩn quốc tế của WHO hoặc chuẩn thứ cấp của phòng thí nghiệm (chuẩn quốc tế được dùng để chuẩn hóa chuẩn thứ cấp).
Sau khi chuẩn bị xong các độ pha, đậy nút cao su và nắp đã tiệt trùng. Chuyển các lọ mẫu pha loãng đến nhà chăn nuôi súc vật thí nghiệm để gây nhiễm trên động vật.
Gây nhiễm trên động vật:
Với mỗi độ pha của vắc xin gây nhiễm trên 10 chuột nhắt (1 ml/con) bằng đường tiêm màng bụng. Sau khi tiêm theo dõi trong vòng 28 ngày ở vùng cách ly bảo vệ.
Lấy máu: Tiến hành lấy máu sau 28 ngày gây nhiễm trên chuột. Lấy máu riêng từng con vào ống nhựa, dán nhãn ghi số lô và độ pha. Có thể ly tâm ngay khi lấy máu tại nhà chuột hoặc giữ ở nhiệt độ phòng không quá 24 giờ để ly tâm sau đó.
Ly tâm, tách huyết thanh cẩn thận bằng pipet (không được làm lẫn huyết thanh giữa các ống khác nhau) sang một ống nhựa khác. Nếu chưa tiến hành định lượng kháng thể anti-HBs ngay, bảo quản các mẫu huyết thanh ở âm 20 °C để kiểm tra sau.
Định lượng kháng thể kháng HBsAg bằng phương pháp ELISA với bộ kit của BIO-RAD.
Tính kết quả: Sau khi xác định được các mẫu huyết thanh dương tính (có chứa kháng thể), tính phần trăm số chuột có đáp ứng miễn dịch trên mỗi độ pha tức là trên tổng số chuột gây nhiễm có bao nhiêu chuột có đáp ứng miễn dịch của độ pha đó. Làm tương tự với mẫu vắc xin chuẩn.
Chú ý: Chuột có đáp ứng miễn dịch là trong huyết thanh có chứa kháng thể kháng HbsAg.
Tính phần trăm số chuột có đáp ứng miễn dịch với mỗi độ pha như sau:
![]()
Trong đó:
Ni là số chuột có đáp ứng miễn dịch của một độ pha;
N là số chuột gây nhiễm trên độ pha đó.
Sau khi tính phần trăm số chuột có đáp ứng miễn dịch, tính ED50 (Liều vắc xin gây nhiễm 50 % chuột có đáp ứng miễn dịch) và công hiệu bằng chương trình Potency.
BẢNG LIÊN HỆ GIỮA PHẦN TRĂM ETHANOL THEO THỂ TÍCH, PHẦN TRĂM ETHANOL THEO KHỐI LƯỢNG, KHỐI LƯỢNG RIÊNG CỦA HỖN HỢP ETHANOL VÀ NƯỚC
(Quy định)
| % tt/tt | % kl/kl | ρ20 (kg/m3) | %tt/tt | %kl/kl | ρ20 (kg/m3) |
| 0,0 | 0,0 | 998,20 | 4,0 | 3,18 | 992,41 |
| 0,1 | 0,08 | 998,05 | 4,1 | 3,26 | 992,28 |
| 0,2 | 0,16 | 997,90 | 4,2 | 3,34 | 992,14 |
| 0,3 | 0,24 | 997,75 | 4,3 | 3,42 | 992,00 |
| 0,4 | 0.32 | 997,59 | 4,4 | 3,50 | 991,87 |
| 0,5 | 0,40 | 997,44 | 4,5 | 3,58 | 991,73 |
| 0,6 | 0,47 | 997,29 | 4,6 | 3,66 | 991,59 |
| 0,7 | 0,55 | 997,14 | 4,7 | 3,74 | 991,46 |
| 0,8 | 0,63 | 996,99 | 4,8 | 3,82 | 991,32 |
| 0,9 | 0,71 | 996,85 | 4,9 | 3,90 | 991,19 |
|
|
|
|
|
|
|
| 1,0 | 0,79 | 996,70 | 5,0 | 3,98 | 991,06 |
| 1,1 | 0,87 | 996,55 | 5,1 | 4,06 | 990,92 |
| 1,2 | 0,95 | 996,40 | 5,2 | 4,14 | 990,79 |
| 1,3 | 1,03 | 996,25 | 5,3 | 4,22 | 990,65 |
| 1,4 | 1,11 | 996,11 | 5,4 | 4,30 | 990,52 |
| 1,5 | 1,19 | 995,96 | 5,5 | 4,38 | 990,39 |
| 1,6 | 1,27 | 995,81 | 5,6 | 4,46 | 990,26 |
| 1,7 | 1,35 | 995,67 | 5,7 | 4,54 | 990,12 |
| 1,8 | 1,43 | 995,52 | 5,8 | 4,62 | 989,99 |
| 1,9 | 1,51 | 995,38 | 5,9 | 4,70 | 989,86 |
|
|
|
|
|
|
|
| 2,0 | 1,59 | 995,23 | 6,0 | 4,78 | 989,73 |
| 2,1 | 1,67 | 995,09 | 6,1 | 4,86 | 989,60 |
| 2,2 | 1,75 | 994,94 | 6,2 | 4,95 | 989,47 |
| 2,3 | 1,82 | 994,80 | 6,3 | 5,03 | 989,34 |
| 2,4 | 1,90 | 994,66 | 6,4 | 5,11 | 989,21 |
| 2,5 | 1,98 | 994,51 | 6,5 | 5,19 | 989,08 |
| 2,6 | 2,06 | 994,37 | 6,6 | 5,27 | 988,95 |
| 2,7 | 2,14 | 994,23 | 6,7 | 5,35 | 988,82 |
| 2,8 | 2,22 | 994,09 | 6,8 | 5,43 | 988,69 |
| 2,9 | 2,30 | 993,95 | 6,9 | 5,51 | 988,56 |
|
|
|
|
|
|
|
| 3,0 | 2,38 | 993,81 | 7,0 | 5,59 | 988,43 |
| 3,1 | 2,46 | 993,66 | 7,1 | 5,67 | 988,30 |
| 3,2 | 2,54 | 993,52 | 7,2 | 5,75 | 988,18 |
| 3,3 | 2,62 | 993,38 | 7,3 | 5,83 | 988,05 |
| 3,4 | 2,70 | 993,24 | 7,4 | 5,91 | 987,92 |
| 3,5 | 2,78 | 993,11 | 7,5 | 5,99 | 987,79 |
| 3,6 | 2,86 | 992,97 | 7,6 | 6,07 | 987,67 |
| 3,7 | 2,94 | 992,83 | 7,7 | 6,15 | 987,54 |
| 3,8 | 3,02 | 992,69 | 7,8 | 6,23 | 987,42 |
| 3.9 | 3,10 | 992,55 | 7,9 | 6,32 | 987,29 |
|
|
|
|
|
|
|
|
|
|
| 8,0 | 6,40 | 987,16 |
|
|
|
|
|
|
|
| 8,1 | 6,48 | 987,04 | 12,4 | 9,97 | 981,89 |
| 8,2 | 6,56 | 986,91 | 12,5 | 10,05 | 981,78 |
| 8,3 | 6,64 | 986,79 | 12,6 | 10,13 | 981,67 |
| 8,4 | 6,72 | 986,66 | 12,7 | 10,21 | 981,55 |
| 8,5 | 6,80 | 986,54 | 12,8 | 10,29 | 981,44 |
| 8,6 | 6,88 | 986,42 | 12,9 | 10,37 | 981,32 |
| 8,7 | 6,96 | 986,29 |
|
|
|
| 8,8 | 7,04 | 986,17 | 13,0 | 10,46 | 981,21 |
| 8,9 | 7,12 | 986,05 | 13,1 | 10,54 | 981,10 |
|
|
|
| 13,2 | 10,62 | 980,98 |
| 9,0 | 7,20 | 985,92 | 13,3 | 10,70 | 980,87 |
| 9,1 | 7,29 | 985,80 | 13,4 | 10,78 | 980,76 |
| 9,2 | 7,37 | 985,68 | 13,5 | 10,87 | 980,64 |
| 9,3 | 7,45 | 985,56 | 13,6 | 10,95 | 980,53 |
| 9,4 | 7,53 | 985,44 | 13,7 | 11,03 | 980,42 |
| 9,5 | 7,61 | 985,31 | 13,8 | 11,11 | 980,31 |
| 9,6 | 7,69 | 985,19 | 13,9 | 11,19 | 980,19 |
| 9,7 | 7,77 | 985,07 |
|
|
|
| 9,8 | 7,85 | 984,95 | 14,0 | 11,27 | 980,08 |
| 9,9 | 7,93 | 984,83 | 14,1 | 11,36 | 979,97 |
|
|
|
| 14,2 | 11,44 | 979,86 |
| 10,0 | 8,01 | 984,71 | 14,3 | 11,52 | 979,75 |
| 10,1 | 8,10 | 984,59 | 14,4 | 11,60 | 979,64 |
| 10,2 | 8,18 | 984,47 | 14,5 | 11,68 | 979,52 |
| 10,3 | 8,26 | 984,35 | 14,6 | 11,77 | 979,41 |
| 10,4 | 8,34 | 984,23 | 14,7 | 11,85 | 979,30 |
| 10,5 | 8,42 | 984,11 | 14,8 | 11,93 | 979,19 |
| 10,6 | 8,50 | 983,99 | 14,9 | 12,01 | 979,08 |
| 10,7 | 8,58 | 983,88 |
|
|
|
| 10,8 | 8,66 | 983,76 | 15,0 | 12,09 | 978,97 |
| 10,9 | 8,75 | 983,64 | 15,1 | 12,17 | 978,86 |
|
|
|
| 15,2 | 12,26 | 978,75 |
| 11,0 | 8,83 | 983,52 | 15,3 | 12,34 | 978,64 |
| 11,1 | 8,91 | 983,40 | 15,4 | 12,42 | 978,53 |
| 11,2 | 8,99 | 983,29 | 15,5 | 12,50 | 978,42 |
| 11,3 | 9,07 | 983,17 | 15,6 | 12,59 | 978,31 |
| 11,4 | 9,15 | 983,05 | 15,7 | 12,67 | 978,20 |
| 11.5 | 9,23 | 982,94 | 15,8 | 12,75 | 978,09 |
| 11,6 | 9,32 | 982,82 | 15,9 | 12,83 | 977,98 |
| 11,7 | 9,40 | 982,70 |
|
|
|
| 11,8 | 9,48 | 982,59 | 16,0 | 12,91 | 977,87 |
| 11,9 | 9,56 | 982,47 | 16,1 | 13,00 | 977,76 |
|
|
|
| 16,2 | 13,08 | 977,65 |
| 12,0 | 9,64 | 982,35 | 16,3 | 13,16 | 977,55 |
| 12,1 | 9,72 | 982,24 | 16,4 | 13,24 | 977,44 |
| 12,2 | 9,80 | 982,12 | 16,5 | 13,32 | 977,33 |
| 12,3 | 9,89 | 982,01 | 16,6 | 13,41 | 977,22 |
| 16,7 | 13,49 | 977,11 |
|
|
|
| 16,8 | 13,57 | 977,00 | 21,0 | 17,04 | 972,48 |
| 16,9 | 13,65 | 976,89 | 21,1 | 17,13 | 972,37 |
|
|
|
| 21,2 | 17,21 | 972,27 |
| 17,0 | 13,74 | 976,79 | 21,3 | 1729 | 972,16 |
| 17,1 | 13,82 | 976,68 | 21,4 | 17,38 | 972,05 |
| 17,2 | 13,90 | 976,57 | 21,5 | 17,46 | 971,94 |
| 17,3 | 13,98 | 976,46 | 21,6 | 17,54 | 971,83 |
| 17,4 | 14,07 | 976,35 | 21,7 | 17,62 | 971,73 |
| 17,5 | 14,15 | 976,25 | 21,8 | 17,71 | 971,62 |
| 17,6 | 14,23 | 976,14 | 21,9 | 17,79 | 971,51 |
| 17,7 | 14,31 | 976,03 |
|
|
|
| 17,8 | 14,40 | 975,92 | 22,0 | 17,87 | 971,40 |
| 17,9 | 14,48 | 975,81 | 22,1 | 17,96 | 971,29 |
|
|
|
| 22,2 | 18,04 | 971,18 |
| 18,0 | 14,56 | 975,71 | 22,3 | 18,12 | 971,08 |
| 18,1 | 14,64 | 975,60 | 22,4 | 18,21 | 970,97 |
| 18,2 | 14,73 | 975,49 | 22,5 | 18,29 | 970,86 |
| 18,3 | 14,81 | 975,38 | 22,6 | 18,37 | 970,75 |
| 18,4 | 14,89 | 975,28 | 22,7 | 18,46 | 970,64 |
| 18,5 | 14,97 | 975,17 | 22,8 | 18,54 | 970,53 |
| 18,6 | 15,06 | 975,06 | 22,9 | 18,62 | 970,42 |
| 18,7 | 15,14 | 974,95 |
|
|
|
| 18,8 | 15,22 | 974,85 | 23,0 | 18,71 | 970,31 |
| 18,9 | 15,30 | 974,74 | 23,1 | 18,79 | 970,20 |
|
|
|
| 23,2 | 18,87 | 970,09 |
| 19,0 | 15,39 | 974,63 | 23,3 | 18,96 | 969,98 |
| 19,1 | 15,47 | 974,52 | 23,4 | 19,04 | 969,87 |
| 19,2 | 15,55 | 974,42 | 23,5 | 19,13 | 969,76 |
| 19,3 | 15,63 | 974,31 | 23,6 | 19,21 | 969,65 |
| 19,4 | 15,72 | 974,20 | 23,7 | 19,29 | 969,54 |
| 19,5 | 15,80 | 974,09 | 23,8 | 19,38 | 969,43 |
| 19,6 | 15,88 | 973,99 | 23,9 | 19,46 | 969,32 |
| 19,7 | 15,97 | 973,88 |
|
|
|
| 19,8 | 16,05 | 973,77 | 24,0 | 19,54 | 969,21 |
| 19,9 | 16,13 | 973,66 | 24,1 | 19,63 | 969,10 |
|
|
|
| 24,2 | 19,71 | 968,99 |
| 20,0 | 16,21 | 973,56 | 24,3 | 19,79 | 968,88 |
| 20,1 | 16,30 | 973,45 | 24,4 | 19,88 | 968,77 |
| 20,2 | 16,38 | 973,34 | 24,5 | 19,96 | 968,66 |
| 20,3 | 16,46 | 973,24 | 24,6 | 20,05 | 968,55 |
| 20,4 | 16,55 | 973,13 | 24,7 | 20,13 | 968,43 |
| 20,5 | 16,63 | 973,02 | 24,8 | 20,21 | 968,32 |
| 20,6 | 16,71 | 972,91 | 24,9 | 20,30 | 968,21 |
| 20,7 | 16,79 | 972,80 |
|
|
|
| 20,8 | 16,88 | 972,70 | 25,0 | 20,38 | 968,10 |
| 20,9 | 16,96 | 972,59 | 25,1 | 20,47 | 967,99 |
| 25,2 | 20,55 | 967,87 | 29,5 | 24,18 | 962,83 |
| 25,3 | 20,63 | 967,76 | 29,6 | 24,27 | 962,71 |
| 25,4 | 20,72 | 967,65 | 29,7 | 24,35 | 962,58 |
| 25,5 | 20,80 | 967,53 | 29,8 | 24,44 | 962,46 |
| 25,6 | 20,88 | 967,42 | 29,9 | 24,52 | 962,33 |
| 25,7 | 20,97 | 967,31 |
|
|
|
| 25,8 | 21,05 | 967,19 | 30,0 | 24,61 | 962,21 |
| 25,9 | 21,14 | 967,08 | 30,1 | 24,69 | 962,09 |
|
|
|
| 30,2 | 24,78 | 961,96 |
| 26,0 | 21,22 | 966,97 | 30,3 | 24,86 | 961,84 |
| 26,1 | 21,31 | 966,85 | 30,4 | 24,95 | 961,71 |
| 26,2 | 21,39 | 966,74 | 30,5 | 25,03 | 961,59 |
| 26,3 | 21,47 | 966,62 | 30,6 | 25,12 | 961,46 |
| 26,4 | 21,56 | 965,51 | 30,7 | 25,20 | 961,33 |
| 26,5 | 21,64 | 966,39 | 30,8 | 25,29 | 961,21 |
| 26,6 | 21,73 | 966,28 | 30,9 | 25,38 | 961,08 |
| 26,7 | 21,81 | 966,16 |
|
|
|
| 26,8 | 21,90 | 966,05 | 31,0 | 25,46 | 960,95 |
| 26,9 | 21,98 | 965,93 | 31,1 | 25,55 | 960,82 |
|
|
|
| 31,2 | 25,63 | 960,70 |
| 27,0 | 22,06 | 965,81 | 31,3 | 25,72 | 960,57 |
| 27,1 | 22,15 | 965,70 | 31,4 | 25,80 | 960,44 |
| 27,2 | 22,23 | 965,58 | 31,5 | 25,89 | 960,31 |
| 27,3 | 22,32 | 965,46 | 31,6 | 25,97 | 960,18 |
| 27,4 | 22,40 | 965,35 | 31,7 | 26,06 | 960,05 |
| 27,5 | 22,49 | 965,23 | 31,8 | 26,15 | 959,92 |
| 27,6 | 22,57 | 965,11 | 31,9 | 26,23 | 959,79 |
| 27,7 | 22,65 | 964,99 |
|
|
|
| 27,8 | 22,74 | 964,88 | 32,0 | 26,32 | 959,66 |
| 27,9 | 22,82 | 964,76 | 32,1 | 26,40 | 959,53 |
|
|
|
| 32,2 | 26,49 | 959,40 |
| 28,0 | 22,91 | 964,64 | 32,3 | 26,57 | 959,27 |
| 28,1 | 22,99 | 964,52 | 32,4 | 26,66 | 959,14 |
| 28,2 | 23,08 | 964,40 | 32,5 | 26,75 | 959,01 |
| 28,3 | 23,16 | 964,28 | 32,6 | 26,83 | 958,87 |
| 28,4 | 23,25 | 964,16 | 32,7 | 26,92 | 958,74 |
| 28,5 | 23,33 | 964,04 | 32,8 | 27,00 | 958,61 |
| 28,6 | 23,42 | 963,92 | 32,9 | 27,09 | 958,47 |
| 28,7 | 23,50 | 963,80 |
|
|
|
| 28,8 | 23.59 | 963,68 | 33,0 | 27,18 | 958,34 |
| 28,9 | 23,67 | 963,56 | 33,1 | 27,26 | 958,20 |
|
|
|
| 33,2 | 27,35 | 958,07 |
| 29,0 | 23,76 | 963,44 | 33,3 | 27,44 | 957,94 |
| 29,1 | 23,84 | 963,32 | 33,4 | 27,52 | 957,80 |
| 29,2 | 23,93 | 963,20 | 33,5 | 27,61 | 957,66 |
| 29,3 | 24,01 | 963,07 | 33,6 | 27,69 | 957,53 |
| 29,4 | 24,10 | 962,95 | 33,7 | 27,78 | 957,39 |
| 33,8 | 27,87 | 957,26 | 38,0 | 31,53 | 951,18 |
| 33,9 | 27,95 | 957,12 | 38,1 | 31,62 | 951,02 |
|
|
|
| 38,2 | 31,71 | 950,87 |
| 34,0 | 28,04 | 956,98 | 38,3 | 31,79 | 950,72 |
| 34,1 | 28,13 | 956,84 | 38,4 | 31,88 | 950,56 |
| 34,2 | 28,21 | 956,70 | 38,5 | 31,97 | 950,41 |
| 34,3 | 28,30 | 956,57 | 38,6 | 32,06 | 950,25 |
| 34,4 | 28,39 | 956,43 | 38,7 | 32,15 | 950,10 |
| 34,5 | 28,47 | 956,29 | 38,8 | 32,24 | 949,94 |
| 34,6 | 28,56 | 956,15 | 38,9 | 32,32 | 949,79 |
| 34,7 | 28,65 | 956,01 |
|
|
|
| 34,8 | 28,73 | 955,87 | 39,0 | 32,41 | 949,63 |
| 34,9 | 28,82 | 955,73 | 39,1 | 32,50 | 949,47 |
|
|
|
| 39,2 | 32,59 | 949,32 |
| 35,0 | 28,91 | 955,59 | 39,3 | 32,68 | 949,16 |
| 35,1 | 28,99 | 955,45 | 39,4 | 32,77 | 949,00 |
| 35,2 | 29,08 | 955,30 | 39,5 | 32,86 | 948,84 |
| 35,3 | 29,17 | 955,16 | 39,6 | 32,94 | 948,68 |
| 35,4 | 29,26 | 955,02 | 39,7 | 33,03 | 948,52 |
| 35,5 | 29,34 | 954,88 | 39,8 | 33,12 | 948,37 |
| 35,6 | 29,43 | 954,73 | 39,9 | 3321 | 948,21 |
| 35,7 | 29,52 | 954,59 |
|
|
|
| 35,8 | 29,60 | 954,44 | 40,0 | 33,30 | 948,05 |
| 35,9 | 29,69 | 954,30 | 40,1 | 33,39 | 947,88 |
|
|
|
| 40,2 | 33,48 | 947,72 |
| 36,0 | 29,78 | 954,15 | 40,3 | 33,57 | 947,56 |
| 36,1 | 29,87 | 954,01 | 40,4 | 33,66 | 947,40 |
| 36,2 | 29,95 | 953,86 | 40,5 | 33,74 | 947,24 |
| 36,3 | 30,04 | 953,72 | 40,6 | 33,83 | 947,08 |
| 36,4 | 30,13 | 953,57 | 40,7 | 33,92 | 946,91 |
| 36,5 | 30,21 | 953,42 | 40,8 | 34,01 | 946,75 |
| 36,6 | 30,30 | 953,28 | 40,9 | 34,10 | 946,58 |
| 36,7 | 30,39 | 953,13 |
|
|
|
| 36,8 | 30,48 | 952,98 | 41,0 | 34,19 | 946,42 |
| 36,9 | 30,56 | 952,83 | 41,1 | 34,28 | 946,26 |
|
|
|
| 41,2 | 34,37 | 946,09 |
| 37,0 | 30,65 | 952,69 | 41,3 | 34,46 | 945,93 |
| 37,1 | 30,74 | 952,54 | 41,4 | 34,55 | 945,76 |
| 37,2 | 30,83 | 952,39 | 41,5 | 34,64 | 945,59 |
| 37,3 | 30,92 | 952,24 | 41,6 | 34,73 | 945,43 |
| 37,4 | 31,00 | 952,09 | 41,7 | 34,82 | 945,26 |
| 37,5 | 31,09 | 951,94 | 41,8 | 34,91 | 945,09 |
| 37,6 | 31,18 | 951,79 | 41,9 | 35,00 | 944,93 |
| 37,7 | 31,27 | 951,63 |
|
|
|
| 37,8 | 31,35 | 951,48 | 42,0 | 35,09 | 944,76 |
| 37,9 | 31,44 | 951,33 | 42,1 | 35,18 | 944,59 |
|
|
|
| 42,2 | 35,27 | 944,42 |
| 42,3 | 35,36 | 944,25 | 46,6 | 39,27 | 936,63 |
| 42,4 | 35,45 | 944,08 | 46,7 | 39,36 | 936,44 |
| 42,5 | 35,54 | 943,91 | 46,8 | 39,45 | 936,26 |
| 42,6 | 35,63 | 943,74 | 46,9 | 39,54 | 936,07 |
| 42,7 | 35,72 | 943,57 |
|
|
|
| 42,8 | 35,81 | 943,40 | 47,0 | 39,64 | 935,88 |
| 42,9 | 35,90 | 943,23 | 47,1 | 39,73 | 935,70 |
|
|
|
| 47,2 | 39,82 | 935,51 |
| 43,0 | 35,99 | 943,06 | 47,3 | 39,91 | 935,32 |
| 43,1 | 36,08 | 942,88 | 47,4 | 40,00 | 935,14 |
| 43,2 | 36,17 | 942,71 | 47,5 | 40,10 | 934,95 |
| 43,3 | 36,26' | 942,54 | 47,6 | 40,19 | 934,76 |
| 43,4 | 36,35 | 942,37 | 47,7 | 40,28 | 934,57 |
| 43,5 | 36,44 | 942,19 | 47,8 | 40,37 | 934,38 |
| 43,6 | 36,53 | 942,02 | 47,9 | 40,47 | 934,19 |
| 43,7 | 36,62 | 941,84 |
|
|
|
| 43,8 | 36,71 | 941,67 | 48,0 | 40,56 | 934,00 |
| 43,9 | 36,80 | 941,49 | 48,1 | 40,65 | 933,81 |
|
|
|
| 48,2 | 40,75 | 933,62 |
| 44,0 | 36,89 | 941,32 | 48,3 | 40,84 | 933,43 |
| 44,1 | 36,98 | 941,14 | 48,4 | 40,93 | 933,24 |
| 44,2 | 37,07 | 940,97 | 48,5 | 41,02 | 933,05 |
| 44,3 | 37,16 | 940,79 | 48,6 | 41,12 | 932,86 |
| 44,4 | 37,25 | 940,61 | 48,7 | 41,21 | 932,67 |
| 44,5 | 37,35 | 940,43 | 48,8 | 41,30 | 932,47 |
| 44,6 | 37,44 | 940,26 | 48,9 | 41,40 | 932,28 |
| 44,7 | 37,53 | 940,08 |
|
|
|
| 44,8 | 37,62 | 939,90 | 49,0 | 41,49 | 932,09 |
| 44,9 | 37,71 | 939,72 | 49,1 | 41,58 | 931,90 |
|
|
|
| 49,2 | 41,68 | 931,70 |
| 45,0 | 37,80 | 939,54 | 49,3 | 41,77 | 931,51 |
| 45,1 | 37,89 | 939,36 | 49,4 | 41,86 | 931,31 |
| 45,2 | 37,98 | 939,18 | 49,5 | 41,96 | 931,12 |
| 45,3 | 38,08 | 939,00 | 49,6 | 42,05 | 930,92 |
| 45,4 | 38,17 | 938,82 | 49,7 | 42,14 | 930,73 |
| 45,5 | 38,26 | 938,64 | 49,8 | 42,24 | 930,53 |
| 45,6 | 38,35 | 938,46 | 49.9 | 42,33 | 930,34 |
| 45,7 | 38,44 | 938,28 |
|
|
|
| 45,8 | 38,53 | 938,10 | 50,0 | 42,43 | 930,14 |
| 45,9 | 38,62 | 937,91 | 50,1 | 42,52 | 929,95 |
|
|
|
| 50,2 | 42,61 | 929,75 |
| 46,0 | 38,72 | 937,73 | 50,3 | 42,71 | 929,55 |
| 46,1 | 38,81 | 937,55 | 50,4 | 42,80 | 929,35 |
| 46,2 | 38,90 | 937,36 | 50,5 | 42,90 | 929,16 |
| 46,3 | 38,99 | 937,18 | 50,6 | 42,99 | 928,96 |
| 46,4 | 39,08 | 937,00 | 50,7 | 43,08 | 928,76 |
| 46,5 | 39,18 | 936,81 | 50,8 | 43,18 | 928,56 |
| 50,9 | 43,27 | 928,36 | 55,1 | 47,28 | 919,75 |
|
|
|
| 55,2 | 47,38 | 919,54 |
| 51,0 | 43,37 | 928,16 | 55,3 | 47,47 | 919,33 |
| 51,1 | 43,46 | 927,96 | 55,4 | 47,57 | 919,12 |
| 51,2 | 43,56 | 927,77 | 55,5 | 47,67 | 918,91 |
| 51,3 | 43,65 | 927,57 | 55,6 | 47,77 | 918,69 |
| 51,4 | 43,74 | 927,36 | 55,7 | 47,86 | 918,48 |
| 51,5 | 43,84 | 927,16 | 55,8 | 47,96 | 918,27 |
| 51,6 | 43,93 | 926,96 | 55,9 | 48,06 | 918,06 |
| 51,7 | 44,03 | 926,76 |
|
|
|
| 51,8 | 44,12 | 926,56 | 56,0 | 48,15 | 917,84 |
| 51,9 | 44,22 | 926,36 | 56,1 | 48,25 | 917,63 |
|
|
|
| 56,2 | 48,35 | 917,42 |
| 52,0 | 44,31 | 926,16 | 56,3 | 48,45 | 917,20 |
| 52,1 | 44,41 | 925,95 | 56,4 | 48,54 | 916,99 |
| 52,2 | 44,50 | 925,75 | 56,5 | 48,64 | 916,77 |
| 52,3 | 44,60 | 925,55 | 56,6 | 48,74 | 916,56 |
| 52,4 | 44,69 | 925,35 | 56,7 | 48,84 | 916,35 |
| 52,5 | 44,79 | 925,14 | 56,8 | 48,93 | 916,13 |
| 52,6 | 44,88 | 924,94 | 56,9 | 49,03 | 915,91 |
| 52,7 | 44,98 | 924,73 |
|
|
|
| 52,8 | 45,07 | 924,53 | 57,0 | 49,13 | 915,70 |
| 52,9 | 45,17 | 924,32 | 57,1 | 49,23 | 915,48 |
|
|
|
| 57,2 | 49,32 | 915,27 |
| 53,0 | 45,26 | 924,12 | 57,3 | 49,42 | 915,05 |
| 53,1 | 45,36 | 923,91 | 57,4 | 49,52 | 914,83 |
| 53,2 | 45,46 | 923,71 | 57,5 | 49,62 | 914,62 |
| 53,3 | 45,55 | 923,50 | 57,6 | 49,72 | 914,40 |
| 53,4 | 45,65 | 923,30 | 57,7 | 49,81 | 914,18 |
| 53,5 | 45,74 | 923,09 | 57,8 | 49,91 | 913,97 |
| 53,6 | 45,84 | 922,88 | 57,9 | 50,01 | 913,75 |
| 53,7 | 45,93 | 922,68 |
|
|
|
| 53,8 | 46,03 | 922,47 | 58,0 | 50,11 | 913,53 |
| 53,9 | 46,13 | 922,26 | 58,1 | 50,21 | 913,31 |
|
|
|
| 58,2 | 50,31 | 913,09 |
| 54,0 | 46,22 | 922,06 | 58,3 | 50,40 | 912,87 |
| 54,1 | 46,32 | 921,85 | 58,4 | 50,50 | 912,65 |
| 54,2 | 46,41 | 921,64 | 58,5 | 50,60 | 912,43 |
| 54,3 | 46,51 | 921,43 | 58,6 | 50,70 | 912,22 |
| 54,4 | 46,61 | 921,22 | 58,7 | 50,80 | 912,00 |
| 54,5 | 46,70 | 921,01 | 58,8 | 50,90 | 911,78 |
| 54,6 | 46,80 | 920,80 | 58,9 | 51,00 | 911,55 |
| 54,7 | 46,90 | 920,59 |
|
|
|
| 54,8 | 46,99 | 920,38 | 59,0 | 51,10 | 911,33 |
| 54,9 | 47,09 | 920,17 | 59,1 | 51,19 | 911,11 |
|
|
|
| 59,2 | 51,29 | 910,89 |
| 55,0 | 47,18 | 919,96 | 59,3 | 51,39 | 910,67 |
| 59,4 | 51,49 | 910,45 | 63,7 | 55,82 | 900,69 |
| 59,5 | 51,59 | 910,23 | 63,8 | 55,92 | 900,46 |
| 59,6 | 51,69 | 910,01 | 63,9 | 56,02 | 900,23 |
| 59,7 | 51,79 | 909,78 |
|
|
|
| 59,8 | 51,89 | 909,56 | 64,0 | 56,12 | 899,99 |
| 59,9 | 51,99 | 909,34 | 64,1 | 56,23 | 899,76 |
|
|
|
| 64,2 | 56,33 | 899,53 |
| 60,0 | 52,09 | 909,11 | 64,3 | 56,43 | 899,29 |
| 60,1 | 52,19 | 908,89 | 64,4 | 56,53 | 899,06 |
| 60,2 | 52,29 | 908,67 | 64,5 | 56,64 | 898,83 |
| 60,3 | 52,39 | 908,44 | 64,6 | 56,74 | 898,59 |
| 60,4 | 52,49 | 908,22 | 64,7 | 56,84 | 898,36 |
| 60,5 | 52,59 | 908,00 | 64,8 | 56,94 | 898,12 |
| 60,6 | 52,69 | 907,77 | 64,9 | 57,05 | 897,89 |
| 60,7 | 52,79 | 907,55 |
|
|
|
| 60,8 | 52,89 | 907,32 | 65,0 | 57,15 | 897,65 |
| 60,9 | 52,99 | 907,10 | 65,1 | 57,25 | 897,42 |
|
|
|
| 65,2 | 57,36 | 897,18 |
| 61,0 | 53,09 | 906,87 | 65,3 | 57,46 | 896,94 |
| 61,1 | 53,19 | 906,64 | 65,4 | 57,56 | 896,71 |
| 61,2 | 53,29 | 906,42 | 65,5 | 57,67 | 896,47 |
| 61,3 | 53,39 | 906,19 | 65,6 | 57,77 | 896,23 |
| 61,4 | 53,49 | 905,97 | 65,7 | 57,87 | 896,00 |
| 61,5 | 53,59 | 905,74 | 65,8 | 57,98 | 895,76 |
| 61,6 | 53,69 | 905,51 | 65,9 | 58,08 | 895,52 |
| 61,7 | 53,79 | 905,29 |
|
|
|
| 61,8 | 53,89 | 905,06 | 66,0 | 58,18 | 895,28 |
| 61,9 | 53,99 | 904,83 | 66,1 | 58,29 | 895,05 |
|
|
|
| 66,2 | 58,39 | 894,81 |
| 62,0 | 54,09 | 904,60 | 66,3 | 58,49 | 894,57 |
| 62,1 | 54,19 | 904,37 | 66,4 | 58,60 | 894,33 |
| 62,2 | 54,30 | 904,15 | 66,5 | 58,70 | 894,09 |
| 62,3 | 54,40 | 903,92 | 66,6 | 58,81 | 893,85 |
| 62,4 | 54,50 | 903,69 | 66,7 | 58,91 | 893,61 |
| 62,5 | 54,60 | 903,46 | 66,8 | 59,01 | 893,37 |
| 62,6 | 54,70 | 903,23 | 66,9 | 59,12 | 893,13 |
| 62,7 | 54,80 | 903,00 |
|
|
|
| 62,8 | 54,90 | 902,77 | 67,0 | 59,22 | 892,89 |
| 62,9 | 55,00 | 902,54 | 67,1 | 59,33 | 892,65 |
|
|
|
| 67,2 | 59,43 | 892,41 |
| 63,0 | 55,11 | 902,31 | 67,3 | 59,54 | 892,17 |
| 63,1 | 55,21 | 902,08 | 67,4 | 59,64 | 891,93 |
| 63,2 | 55,31 | 901,85 | 67,5 | 59,74 | 891,69 |
| 63,3 | 55,41 | 901,62 | 67,6 | 59,85 | 891,45 |
| 63,4 | 55,51 | 901,39 | 67,7 | 59,95 | 891,20 |
| 63,5 | 55,61 | 901,15 | 67,8 | 60,06 | 890,96 |
| 63,6 | 55,72 | 900,92 | 67,9 | 60,16 | 890,72 |
|
|
|
| 72,2 | 64,75 | 880,03 |
| 68,0 | 60,27 | 890,48 | 72,3 | 64,86 | 879,78 |
| 68,1 | 60,37 | 890,23 | 72,4 | 64,97 | 879,52 |
| 68,2 | 60,48 | 889,99 | 72,5 | 65,08 | 879,27 |
| 68,3 | 60,58 | 889,75 | 72,6 | 65,19 | 879,01 |
| 68,4 | 60,69 | 889,50 | 72,7 | 65,29 | 878,75 |
| 68,5 | 60,80 | 889,26 | 72,8 | 65,40 | 878,50 |
| 68,6 | 60,90 | 889,01 | 72,9 | 65,51 | 878,24 |
| 68,7 | 61,01 | 888,77 |
|
|
|
| 68,8 | 61,11 | 888,52 | 73,0 | 65,62 | 877,99 |
| 68,9 | 61,22 | 888,28 | 73,1 | 65,73 | 877,73 |
|
|
|
| 73,2 | 65,84 | 877,47 |
| 69,0 | 61,32 | 888,03 | 73,3 | 65,95 | 877,21 |
| 69,1 | 61,43 | 887,79 | 73,4 | 66,06 | 876,96 |
| 69,2 | 61,54 | 887,54 | 73,5 | 66,17 | 876,70 |
| 69,3 | 61,64 | 887,29 | 73,6 | 66,28 | 876,44 |
| 69,4 | 61,75 | 887,05 | 73,7 | 66,39 | 876,18 |
| 69,5 | 61,85 | 886,80 | 73,8 | 66,50 | 875,92 |
| 69,6 | 61,96 | 886,55 | 73,9 | 66,61 | 875,66 |
| 69,7 | 62,07 | 886,31 |
|
|
|
| 69,8 | 62,17 | 886,06 | 74,0 | 66,72 | 875,40 |
| 69,9 | 62,28 | 885,81 | 74,1 | 66,83 | 875,14 |
|
|
|
| 74,2 | 66,94 | 874,88 |
| 70,0 | 62,39 | 885,56 | 74,3 | 67,05 | 874,62 |
| 70,1 | 62,49 | 885,31 | 74,4 | 67,16 | 874,36 |
| 70,2 | 62,60 | 885,06 | 74,5 | 67,27 | 874,10 |
| 70,3 | 62,71 | 884,82 | 74,6 | 67,38 | 873,84 |
| 70,4 | 62,81 | 884,57 | 74,7 | 67,49 | 873,58 |
| 70,5 | 62,92 | 884,32 | 74,8 | 67,60 | 873,32 |
| 70,6 | 63,03 | 884,07 | 74,9 | 67,71 | 873,06 |
| 70,7 | 63,13 | 883,82 |
|
|
|
| 70,8 | 63,24 | 883,57 | 75,0 | 67,82 | 872,79 |
| 70,9 | 63,35 | 883,32 | 75,1 | 67,93 | 872,53 |
|
|
|
| 75,2 | 68,04 | 872,27 |
| 71,0 | 63,46 | 883,06 | 75,3 | 68,15 | 872,00 |
| 71,1 | 63,56 | 882,81 | 75,4 | 68,26 | 871,74 |
| 71,2 | 63,67 | 882,56 | 75,5 | 68,38 | 871,48 |
| 71,3 | 63,78 | 882,31 | 75,6 | 68,49 | 871,21 |
| 71,4 | 63,89 | 882,06 | 75,7 | 68,60 | 870,95 |
| 71,5 | 63,99 | 881,81 | 75,8 | 68,71 | 870,68 |
| 71,6 | 64,10 | 881,55 | 75,9 | 68,82 | 870,42 |
| 71,7 | 64,21 | 881,30 |
|
|
|
| 71,8 | 64,32 | 881,05 | 76,0 | 68,93 | 870,15 |
| 71,9 | 64,43 | 880,79 | 76,1 | 69,04 | 869,89 |
|
|
|
| 76,2 | 69,16 | 869,62 |
| 72,0 | 64,53 | 880,54 | 76,3 | 69,27 | 869,35 |
| 72,1 | 64,64 | 880,29 | 76,4 | 69,38 | 869,09 |
| 76,5 | 69,49 | 868,82 | 80,8 | 74,41 | 857,03 |
| 76,6 | 69,61 | 868,55 | 80,9 | 74,53 | 856,75 |
| 76,7 | 69,72 | 868,28 |
|
|
|
| 76,8 | 69,83 | 868,02 | 81,0 | 74,64 | 856,46 |
| 76,9 | 69,94 | 867,75 | 81,1 | 74,76 | 856,18 |
|
|
|
| 81,2 | 74,88 | 855,90 |
| 77,0 | 70,06 | 867,48 | 81,3 | 74,99 | 855,62 |
| 77,1 | 70,17 | 867,21 | 81,4 | 75,11 | 855,33 |
| 77,2 | 70,28 | 866,94 | 81,5 | 75,23 | 855,05 |
| 77,3 | 70,39 | 866,67 | 81,6 | 75,34 | 854,76 |
| 77,4 | 70,51 | 866,40 | 81,7 | 75,46 | 854,48 |
| 77,5 | 70,62 | 866,13 | 81,8 | 75,58 | 854,19 |
| 77,6 | 70,73 | 865,86 | 81,9 | 75,70 | 853,91 |
| 77,7 | 70,85 | 865,59 |
|
|
|
| 77,8 | 70,96 | 865,32 | 82,0 | 75,82 | 853,62 |
| 77,9 | 71,07 | 865,05 | 82,1 | 75,93 | 853,34 |
|
|
|
| 82,2 | 76,05 | 853,05 |
| 78,0 | 71,19 | 864,78 | 82,3 | 76,17 | 852,76 |
| 78,1 | 71,30 | 864,50 | 82,4 | 76,29 | 852,48 |
| 78,2 | 71,41 | 864,23 | 82,5 | 76,41 | 852,19 |
| 78,3 | 71,53 | 863,96 | 82,6 | 76,52 | 851,90 |
| 78,4 | 71,64 | 863,69 | 82,7 | 76,64 | 851,61 |
| 78,5 | 71,76 | 863,41 | 82,8 | 76,76 | 851,32 |
| 78,6 | 71,87 | 863,14 | 82,9 | 76,88 | 851,03 |
| 78,7 | 71,98 | 862,86 |
|
|
|
| 78,8 | 72,10 | 862,59 | 83,0 | 77,00 | 850,74 |
| 78,9 | 72,21 | 862,31 | 83,1 | 77,12 | 850,45 |
|
|
|
| 83,2 | 77,24 | 850,16 |
| 79,0 | 72,33 | 862,04 | 83,3 | 77,36 | 849,87 |
| 79,1 | 72,44 | 861,76 | 83,4 | 77,48 | 849,58 |
| 79,2 | 72,56 | 861,49 | 83,5 | 77,60 | 849,29 |
| 79,3 | 72,67 | 861,21 | 83,6 | 77,72 | 848,99 |
| 79,4 | 72,79 | 860,94 | 83,7 | 77,84 | 848,70 |
| 79,5 | 72,90 | 860,66 | 83,8 | 77,96 | 848,41 |
| 79,6 | 73,02 | 860,38 | 83,9 | 78,08 | 848,11 |
| 79,7 | 73,13 | 860,10 |
|
|
|
| 79,8 | 73,25 | 859,83 | 84,0 | 78,20 | 847,82 |
| 79,9 | 73,36 | 859,55 | 84,1 | 78,32 | 847,53 |
|
|
|
| 84,2 | 78,44 | 847,23 |
| 80,0 | 73,48 | 859,27 | 84,3 | 78,56 | 846,93 |
| 80,1 | 73,60 | 858,99 | 84,4 | 78,68 | 846,64 |
| 80,2 | 73,71 | 858,71 | 84,5 | 78,80 | 846,34 |
| 80,3 | 73,83 | 858,43 | 84,6 | 78,92 | 846,05 |
| 80,4 | 73,94 | 858,15 | 84,7 | 79,04 | 845,75 |
| 80,5 | 74,06 | 857,87 | 84,8 | 79,16 | 845,45 |
| 80,6 | 74,18 | 857,59 | 84,9 | 79,28 | 845,15 |
| 80,7 | 74,29 | 857,31 |
|
|
|
| 85,0 | 79,40 | 844,85 | 89,3 | 84,76 | 831,48 |
| 85,1 | 79,53 | 844,55 | 89,4 | 84,89 | 831,15 |
| 85,2 | 79,65 | 844,25 | 89,5 | 85,02 | 830,82 |
| 85,3 | 79,77 | 843,95 | 89,6 | 85,15 | 830,50 |
| 85,4 | 79,89 | 843,65 | 89,7 | 85,28 | 830,17 |
| 85,5 | 80,01 | 843,35 | 89,8 | 85,41 | 829,84 |
| 85,6 | 80,14 | 843,05 | 89,9 | 85,54 | 829,51 |
| 85,7 | 80,26 | 842,75 |
|
|
|
| 85,8 | 80,38 | 842,44 | 90,0 | 85,66 | 829,18 |
| 85,9 | 80,50 | 842,14 | 90,1 | 85,79 | 828,85 |
|
|
|
| 90,2 | 85,92 | 828,52 |
| 86,0 | 80,63 | 841,84 | 90,3 | 86,05 | 828,19 |
| 86,1 | 80,75 | 841,53 | 90,4 | 86,18 | 827,85 |
| 86,2 | 80,87 | 841,23 | 90,5 | 86,31 | 827,52 |
| 86,3 | 81,00 | 840,92 | 90,6 | 86,44 | 827,18 |
| 86,4 | 81,12 | 840,62 | 90,7 | 86,57 | 826,85 |
| 86,5 | 81,24 | 840,31 | 90,8 | 86,71 | 826,51 |
| 86,6 | 81,37 | 840,00 | 90,9 | 86,84 | 826,17 |
| 86,7 | 81,49 | 839,70 |
|
|
|
| 86,8 | 81,61 | 839,39 | 91,0 | 86,97 | 825,83 |
| 86,9 | 81,74 | 839,08 | 91,1 | 87,10 | 825,49 |
|
|
|
| 91,2 | 87,23 | 825,15 |
| 87,0 | 81,86 | 838,77 | 91,3 | 87,36 | 824,81 |
| 87,1 | 81,99 | 838,46 | 91,4 | 87,49 | 824,47 |
| 87,2 | 82,11 | 838,15 | 91,5 | 87,63 | 824,13 |
| 87,3 | 82,24 | 837,84 | 91,6 | 87,76 | 823,78 |
| 87,4 | 82,36 | 837,52 | 91,7 | 87,89 | 823,44 |
| 87,5 | 82,49 | 837,21 | 91,8 | 88,02 | 823,09 |
| 87,6 | 82,61 | 836,90 | 91,9 | 88,16 | 822,74 |
| 87,7 | 82,74 | 836,59 |
|
|
|
| 87,8 | 82,86 | 836,27 | 92,0 | 88,29 | 822,39 |
| 87,9 | 82,99 | 835,96 | 92,1 | 88,42 | 822,04 |
|
|
|
| 92,2 | 88,56 | 821,69 |
| 88,0 | 83,11 | 835,64 | 92,3 | 88,69 | 821,34 |
| 88,1 | 83,24 | 835,32 | 92,4 | 88,83 | 820,99 |
| 88,2 | 83,37 | 835,01 | 92,5 | 88,96 | 820,63 |
| 88,3 | 83,49 | 834,69 | 92,6 | 89,10 | 820,28 |
| 88,4 | 83,62 | 834,37 | 92,7 | 89,23 | 819,92 |
| 88,5 | 83,74 | 834,05 | 92,8 | 89,37 | 819,57 |
| 88,6 | 83,87 | 833,73 | 92,9 | 89,50 | 819,21 |
| 88,7 | 84,00 | 833,41 |
|
|
|
| 88,8 | 84,13 | 833,09 | 93,0 | 89,64 | 818,85 |
| 88,9 | 84,25 | 832,77 | 93,1 | 89,77 | 818,49 |
|
|
|
| 93,2 | 89,91 | 818,12 |
| 89,0 | 84,38 | 832,45 | 93,3 | 90,05 | 817,76 |
| 89,1 | 84,51 | 832,12 | 93,4 | 90,18 | 817,40 |
| 89,2 | 84,64 | 831,80 | 93,5 | 90,32 | 817,03 |
| 93,6 | 90,46 | 816,66 | 96,9 | 95,16 | 803,70 |
| 93,7 | 90,59 | 816,30 |
|
|
|
| 93,8 | 90,73 | 815,93 | 97,0 | 95,31 | 803,27 |
| 93,9 | 90,87 | 815,55 | 97,1 | 95,45 | 802,85 |
|
|
|
| 97,2 | 95,60 | 802,42 |
| 94,0 | 91,01 | 815,18 | 97,3 | 95,75 | 801,99 |
| 94,1 | 91,15 | 814,81 | 97,4 | 95,90 | 801,55 |
| 94,2 | 9129 | 814,43 | 97,5 | 96,05 | 801,12 |
| 94,3 | 91,43 | 814,06 | 97,6 | 96,21 | 800,68 |
| 94,4 | 91,56 | 813,68 | 97,7 | 96,36 | 800,24 |
| 94,5 | 91,70 | 813,30 | 97,8 | 96,51 | 799,80 |
| 94,6 | 91,84 | 812,92 | 97,9 | 96,66 | 799,35 |
| 94,7 | 91,98 | 812,54 |
|
|
|
| 94,8 | 92,13 | 812,15 | 98,0 | 96,81 | 798,90 |
| 94,9 | 92,27 | 811,77 | 98,1 | 96,97 | 798,45 |
|
|
|
| 98,2 | 97,12 | 798,00 |
| 95,0 | 92,41 | 811,38 | 98,3 | 97,28 | 797,54 |
| 95,1 | 92,55 | 810,99 | 98,4 | 97,43 | 797,08 |
| 95,2 | 92,69 | 810,60 | 98,5 | 97,59 | 796,62 |
| 95,3 | 92,83 | 810,21 | 98,6 | 97,74 | 796,15 |
| 95,4 | 92,98 | 809,82 | 98,7 | 97,90 | 795,68 |
| 95,5 | 93,12 | 809,42 | 98,8 | 98,06 | 795,21 |
| 95,6 | 93,26 | 809,02 | 98,9 | 98,22 | 794,73 |
| 95,7 | 93,41 | 808,63 |
|
|
|
| 95,8 | 93,55 | 808,23 | 99,0 | 98,38 | 794,25 |
| 95,9 | 93,69 | 807,82 | 99,1 | 98,53 | 793,77 |
|
|
|
| 99,2 | 98,69 | 793,28 |
| 96,0 | 93,84 | 807,42 | 99,3 | 98,86 | 792,79 |
| 96,1 | 93,98 | 807,01 | 99,4 | 99,02 | 792,30 |
| 96,2 | 94,13 | 806,61 | 99,5 | 99,18 | 791,80 |
| 96,3 | 94,27 | 806,20 | 99,6 | 99,34 | 791,29 |
| 96,4 | 94,42 | 805,78 | 99,7 | 99,50 | 790,79 |
| 96,5 | 94,57 | 805,37 | 99,8 | 99,67 | 790,28 |
| 96,6 | 94,71 | 804,96 | 99,9 | 99,83 | 789,76 |
| 96,7 | 94,86 | 804,54 |
|
|
|
| 96,8 | 95,01 | 804,12 | 100,0 | 100,0 | 789,24 |
PHẦN 2
NGUYÊN LIỆU HÓA DƯỢC
AMIODARON HYDROCLORID
Amiodaroni hydrochloridum
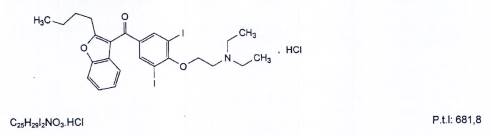
Amiodaron hydroclorid là (2-butylbenzofuran-3-yl)[4-[2-(diethylamino)ethoxy]-3,5-diiodophenyl] methanon hydroclorid, phải chứa từ 98,5 % đến 101,0 % C25H29I2NO3.HCl, tính theo chế phẩm đã làm khô.
Tính chất
Bột tinh thể mịn, trắng hoặc gần như trắng. Dễ tan trong methylen clorid, tan trong methanol, hơi tan trong ethanol 96 %, rất khó tan trong nước.
Định tính
A. Phổ hồng ngoại (Phụ lục 4.2) của chế phẩm phải phù hợp với phổ hồng ngoại của amiodaron hydroclorid chuẩn.
B. Chế phẩm phải cho phản ứng (B) của clorid (Phụ lục 8.1).
Độ trong và màu sắc của dung dịch
Hòa tan 1,0 g chế phẩm trong methanol (TT) và pha loãng thành 20 ml với cùng dung môi. Dung dịch thu được phải trong (Phụ lục 9.2) và không được có màu đậm hơn màu mẫu VL5 hay VN5 (Phụ lục 9.3, phương pháp 2).
pH
Từ 3,2 đến 3,8 (Phụ lục 6.2).
Hòa tan 1,0 g chế phẩm trong nước không có carbon dioxyd (TT) bằng cách đun ở 80 °C, để nguội và pha loãng thành 20 ml với cùng dung môi.
Tạp chất H
Phương pháp sắc ký lớp mỏng (Phụ lục 5.4).
Bản mỏng: Silica gel F254.
Dung môi khai triển: Add formic khan - methanol - methylen clorid (5 : 10: 85).
Pha các dung dịch ngay trước khi sử dụng và tránh ánh sáng.
Dung dịch thử: Hòa tan 0,500 g chế phẩm vào methylen clorid (TT) và pha loãng thành 5,0 ml với cùng dung môi.
Dung dịch đối chiếu (1): Hòa tan 10,0 mg (2-cloroethyl)diethylamin hydroclorid (Tạp chất H) trong methylen clorid (TT) và pha loãng thành 50,0 ml với cùng dung môi. Pha loãng 2,0 ml dung dịch thu được thành 20,0 ml với methylen clorid (TT).
Dung dịch đối chiếu (2): Trộn đều 2,0 ml dung dịch thử với 2,0 ml dung dịch đối chiếu (1).
Cách tiến hành: Chấm riêng biệt lên bản mỏng 50 µl mỗi dung dịch thử và dung dịch đối chiếu (1), 100 µl dung dịch đối chiếu (2). Triển khai sắc ký tới khi dung môi đi được 15 cm, để khô bản mỏng ngoài không khí. Phun lên bản mỏng lần lượt thuốc thử kali iodobismuthat (TT1) và dung dịch hydrogen peroxyd loãng (TT). Quan sát ngay dưới ánh sáng ban ngày. Phép thử chỉ có giá trị khi sắc ký đồ của dung dịch đối chiếu (2) cho thấy rõ vết tạp chất H.
Trên sắc ký đồ của dung dịch thử, màu của vết có Rf tương ứng với tạp chất H không đậm hơn màu của vết chính trên sắc ký đồ dung dịch đối chiếu (1) (0,02 %).
Tạp chất liên quan
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động: Dung dịch đệm pH 4,9- methanol - acetonitril (30 : 30 : 40).
Dung dịch đệm pH 4,9: Thêm 3,0 ml acid acetic băng (TT) vào 800 ml nước, điều chỉnh đến pH 4,9 bằng dung dịch ammoniac loãng (TT) và pha loãng thành 1000 ml với nước.
Dung dịch thử: Hòa tan 0,125 g chế phẩm vào hỗn hợp đồng thể tích acetonitril (TT) và nước, pha loãng thành 25 ml với cùng dung môi.
Dung dịch đối chiếu: Hòa tan 5 mg tạp amiodaron D chuẩn, 5 mg tạp amiodaron E chuẩn và 5,0 mg amiodaron hydroclorid chuẩn vào methanol (TT) và pha loãng thành 25,0 ml với cùng dung môi. Pha loãng 1,0 ml dung dịch thu được thành 20,0 ml với hỗn hợp đồng thể tích acetonitril (TT) và nước.
Điều kiện sắc ký:
Cột thép không gỉ (15 cm x 4,6 mm) được nhồi pha tĩnh C (5 µm).
Nhiệt độ cột: 30 °C.
Detector quang phổ hấp thụ tử ngoại đặt ở bước sóng 240 nm.
Tốc độ dòng: 1 ml/min.
Thể tích tiêm: 10 µl.
Triển khai sắc ký với thời gian gấp 2 lần thời gian lưu của amiodaron.
Thời gian lưu tương đối so với amiodaron (thời gian lưu khoảng 24 min): tạp chất A khoảng 0,26; tạp chất D khoảng 0,29; tạp chất E khoảng 0,37; tạp chất B khoảng 0,49; tạp chất C khoảng 0,55; tạp chất G khoảng 0,62; tạp chất F khoảng 0,69.
Phép thử chỉ có giá trị khi trên sắc ký đồ của dung dịch đối chiếu, hệ số phân giải giữa các pic tương ứng với tạp chất D và tạp chất E ít nhất là 3,5.
Giới hạn:
Trên sắc ký đồ của dung dịch thử, diện tích của từng pic tạp chất A, B, C, D, E, F, G không được lớn hơn diện tích của pic amiodaron trên sắc ký đồ của dung dịch đối chiếu (0,2 %).
Diện tích của các pic tạp chất chưa định danh không được lớn hơn 0,5 lần diện tích pic amiodaron trên sắc ký đồ của dung dịch đối chiếu (0,1 %).
Tổng diện tích của tất cả các pic tạp chất không được lớn hơn 2,5 lần diện tích của pic amiodaron trên sắc ký đồ của dung dịch đối chiếu (0,5 %).
Bỏ qua những pic có diện tích nhỏ hơn 0,1 lần diện tích pic amlodaron trên sắc ký đồ của dung dịch đối chiếu (0,02 %).
Ghi chú:
Tạp chất A: (2-butylbenzofuran-3-yl)[4-[2-(diethylamino)ethoxy]phenyl] methanon,
Tạp chất B: (2-butylbenzofuran-3-yl)[4-[2-(ethylamino)ethoxy]-3,5-diiodophenyl]methanon,
Tạp chất C: (2-butylbenzofuran-3-yl)[4-[2-(diethylamino)ethoxy]-3-iodophenyl]methanon,
Tạp chất D: (2-butylbenzofuran-3-yl)(4-hydroxy-3,5-diiodophenyl)methanon,
Tạp chất E: (2-butylbenzofuran-3-yl)(4-hydroxyphenyl)methanon,
Tạp chất F: (2-butylbenzofuran-3-yl)(4-hydroxy-3-iodophenyl)methanon,
Tạp chất G: [2-[(1 RS)-1-methoxybutyl]benzofuran-3-yl][4-[2-(diethylamino)ethoxy]-3,5- diiodophenyl]methanon,
Tạp chất H: 2-cloro-N,N-diethylethanamin (2-clorotriethylamin,(2-cloroethyl)diethylamin).
lodid
Không được quá 0,015 %.
Pha đồng thời dung dịch thử và dung dịch đối chiếu.
Dung dịch A: Hòa tan 1,50 g chế phẩm trong 40 ml nước ở 80 °C và lắc cho đến khi tan hoàn toàn. Để nguội và pha loãng thành 50,0 ml với nước.
Dung dịch thử: Thêm 1,0 ml dung dịch acid hydrocloric 0,1 M (TT) và 1,0 ml dung dịch kali iodat 0,05 M vào 15,0 ml dung dịch A. Pha loãng thành 20,0 ml với nước. Để yên trong chỗ tối khoảng 4 h.
Dung dịch đối chiếu: Thêm 1,0 ml dung dịch acid hydrocloric 0,1 M (TT) 1,0 ml dung dịch kali iodid 88,2 mg/l và 1,0 ml dung dịch kali iodat 0,05 M (TT) vào 15,0 ml dung dịch A. Pha loãng thành 20,0 ml với nước (TT). Để yên trong chỗ tối khoảng 4 h.
Cách tiến hành: Đo độ hấp thụ (Phụ lục 4.1) của các dung dịch ở bước sóng 420 nm, dùng mẫu trắng là hỗn hợp 15,0 ml dung dịch A và 1,0 ml dung dịch acid hydrocloric 0,1 M (TT), pha loãng thành 20,0 ml với nước. Độ hấp thụ của dung dịch thử không được lớn hơn 0,5 lần độ hấp thụ của dung dịch đối chiếu.
Kim loại nặng
Không được quá 20 phần triệu (Phụ lục 9.4.8).
Lấy 1,0 g chế phẩm tiến hành thử theo Phương pháp 3. Dùng 2,0 ml dung dịch chì mẫu 10 phần triệu Pb (TT) để chuẩn bị mẫu đối chiếu.
Mất khối lượng do làm khô
Không được quá 0,5 % (Phụ lục 9.6).
(1,000 g; 50 °C; áp suất không quá 0,3 kPa; 4 h).
Tro sulfat
Không được quá 0,1 % (Phụ lục 9.9, phương pháp 2).
Dùng 1,0 g chế phẩm.
Định lượng
Hòa tan khoảng 0,600 g chế phẩm trong hỗn hợp gồm 5,0 ml dung dịch acid hydrocloric 0,01 N (CĐ) và 75 ml ethanol 96 % (TT). Chuẩn độ bằng dung dịch natri hydroxyd 0,1 N (CĐ).
Xác định điểm tương đương bằng phương pháp chuẩn độ đo điện thế (Phụ lục 10.2).
Đọc thể tích dung dịch natri hydroxyd 0,1 N (CĐ) tiêu thụ giữa 2 điểm uốn.
1 ml dung dịch natri hydroxyd 0,1 N (CĐ) tương đương với 68,18 mg C25H29l2NO3.HCl
Bảo quản
Đựng trong lọ nút kín, tránh ánh sáng, nhiệt độ không quá 30 °C.
Loại thuốc
Thuốc chống loạn nhịp.
Chế phẩm
Viên nén.
CARBIDOPA
Carbidopum

Carbidopa là acid (2S)-3-(3,4-dihydroxyphenyl)-2-hydrazino-2-methylpropanoic monohydrat, phải chứa từ 98,5 % đến 101,0 % C10H14N2O4, tính theo chế phẩm đã làm khô.
Tính chất
Bột trắng hoặc trắng ngà. Hơi tan trong methanol, khó tan trong nước, rất khó tan trong ethanol 96 %, thực tế không tan trong dicloromethan và diethyl ether, tan trong các dung dịch acid vô cơ loãng.
Định tính
Có thể chọn một trong hai nhóm định tính sau:
Nhóm I: A, C.
Nhóm II: B, C, D, E.
A. Phổ hồng ngoại (Phụ lục 4.2) của chế phẩm phải phù hợp với phổ hồng ngoại của carbidopa chuẩn.
B. Phổ tử ngoại (Phụ lục 4.1)
Hòa tan 50,0 mg chế phẩm trong dung dịch acid hydrocloric 8,5 g/l trong methanol (TT) và pha loãng thành 100,0 ml với cùng dung môi. Pha loãng 10,0 ml dung dịch này thành 100,0 ml với dung dịch acid hydrocloric 8,5 g/l trong methanol (TT). Phổ tử ngoại của dung dịch thử trong khoảng từ 230 nm đến 350 nm có cực đại hấp thụ ở 283 nm và A (1%, 1 cm) ở cực đại 283 nm từ 135 đến 150, tính theo chế phẩm đã làm khô.
C. Chế phẩm phải đáp ứng phép thử Góc quay cực riêng.
D. Lắc mạnh khoảng 5 mg chế phẩm với 10 ml nước trong 1 min và thêm 0,3 ml dung dịch sắt (III) clorid 1,3% (TT). Màu xanh lục đậm xuất hiện và nhanh chóng chuyển sang màu nâu đỏ.
E. Phân tán khoảng 20 mg chế phẩm trong 5 ml nước và thêm 5 ml thuốc thử Fehling (TT). Đun nóng, màu của dung dịch biến thành màu nâu sẫm và xuất hiện tủa màu đỏ.
Độ trong và màu sắc của dung dịch
Hòa tan 0,25 g chế phẩm trong 25 ml dung dịch acid hydrocloric 1 M (TT).
Dung dịch phải trong (Phụ lục 9.2) và không được có màu đậm hơn màu mẫu VN6 hoặc N6 (Phụ lục 9.3, phương pháp 2).
Góc quay cực riêng
Từ -22,5° đến -26,5°, tính theo chế phẩm đã làm khô (Phụ lục 6.4).
Hòa tan 0,250 g chế phẩm trong dung dịch nhôm clorid (TT) bằng cách lắc siêu âm cho đến khi tan hoàn toàn, pha loãng thành 25,0 ml với cùng dung môi.
Methyldopa và methylcarbidopa
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động: Dung dịch kali dihydrophosphat 1,4%- methanol (2 : 98).
Dung dịch thử: Hòa tan 0,100 g chế phẩm trong dung dịch acid hydrocloric 0,1 M (TT) và pha loãng thành 10,0 ml với cùng dung môi.
Dung dịch đối chiếu: Hòa tan 1 mg methyldopa chuẩn và 1 mg methylcarbidopa chuẩn trong dung dịch acid hydrocloric 0,1 M (TT), pha loãng thành 20,0 ml với cùng dung môi.
Dung dịch phân giải: Hòa tan 5 mg carbidopa chuẩn và 5 mg methyldopa chuẩn trong dung dịch acid hydrocloric 0,1 M (TT) và pha loãng thành 10,0 ml với cùng dung môi.
Điều kiện sắc ký:
Cột thép không gỉ (25 cm x 4,6 mm) nhồi pha tĩnh B (5 µm).
Tốc độ dòng: 1 ml/min.
Detector quang phổ hấp thụ tử ngoại ở bước sóng 282 nm.
Thể tích tiêm: 20 µl.
Cách tiến hành: Tiêm dung dịch phân giải. Phép thử chỉ có giá trị khi độ phân giải giữa hai pic methyldopa và carbidopa ít nhất là 4,0.
Giới hạn methyldopa và methylcarbidopa: diện tích pic của mỗi tạp chất thu được trên sắc ký đồ của dung dịch thử không được lớn hơn diện tích pic tương ứng của dung dịch đối chiếu (0,5%).
Kim loại nặng
Không được quá 20 phần triệu (Phụ lục 9.4.8).
Lấy 1,0 g chế phẩm tiến hành theo phương pháp 3. Dùng 2 ml dung dịch chì mẫu 10 phần triệu Pb (TT) để chuẩn bị mẫu đối chiếu.
Mất khối lượng do làm khô
Từ 6,9 % đến 7,9 % (Phụ lục 9.6).
(1,000 g; 105 °C).
Tro sulfat
Không được quá 0,1 % (Phụ lục 9.9, phương pháp 2).
Dùng 1,0 g chế phẩm.
Định lượng
Hòa tan 0,15 g chế phẩm trong 75 ml acid acetic khan (TT), bằng cách đun nóng nhẹ. Chuẩn độ bằng dung dịch acid percloric 0,1 M (CĐ). Xác định điểm kết thúc bằng phương pháp chuẩn độ đo điện thế (Phụ lục 10.2)
1 ml dung dịch acid percloric 0,1 M (CĐ) tương đương với 22,62 mg C10H14N2O4.
Bảo quản
Tránh ánh sáng.
Loại thuốc
Thuốc chống bệnh Parkinson, thuốc chống loạn vận động.
Chế phẩm
Viên nén (phối hợp với levodopa).
CEFTAZIDIM PENTAHYDRAT
Ceftazidimum pentahydricum

Ceftazidim pentahydrat là (6f?,7R)-7-[[(Z)-2-(2-aminothiazol-4-yl)-2-[(1 -carboxy-1 -methylethoxy)imino] acetyl]amino]-8-oxo-3-[(1-pyridino)methyl]-5-thia-1-azabicyclo[4.2.0]oct-2-en-2-carboxylat pentahydrat, phải chứa từ 95,0 % đến 102,0 % C22H22N6O7S2, tính theo chế phẩm khan.
Tính chất
Bột kết tinh màu trắng hay gần như trắng. Khó tan trong nước và methanol, thực tế không tan trong aceton và ethanol 96 %. Tan trong dung dịch acid và kiềm.
Định tính
Phổ hồng ngoại của chế phẩm (Phụ lục 4.2) phải phù hợp với phổ hồng ngoại của ceftazidim chuẩn.
Độ trong và màu sắc của dung dịch
Dung dịch S: hòa tan 0,25 g chế phẩm trong nước không có carbon dioxyd (TT) và pha loãng thành 50,0 ml với cùng dung môi.
Dung dịch S phải trong (Phụ lục 9.2) và không màu (Phụ lục 9.3, phương pháp 2).
pH
Dung dịch S có pH từ 3,0 đến 4,0 (Phụ lục 6.1).
Tạp chất liên quan
A. Phương pháp sắc ký lớp mỏng (Phụ lục 5.4).
Bản mỏng: Silica gel F254.
Dung môi khai triển: Butanol - dung dịch đệm natri acetat pH 4,5 - butyl acetat - acid acetic băng (6 : 26 : 32: 32)
Dung dịch thử: Hòa tan 0,100 g chế phẩm trong dung dịch dinatri hydrophosphat 3,6 % và pha loãng thành 2 ml với cùng dung môi.
Dung dịch đối chiếu: Pha loãng 1 ml dung dịch thử thành 200 ml với dung dịch dinatri hydrophosphat 3,6%.
Cách tiến hành: Chấm riêng rẽ lên bản mỏng 2 µl mỗi dung dịch trên. Triển khai sắc ký đến khi dung môi đi được 15 cm. Làm khô bản mỏng bằng không khí nóng và phát hiện vết bằng đèn tử ngoại 254 nm. Bất kỳ vết nào có Rf lớn hơn vết chính trên sắc ký đồ của dung dịch thử không được đậm màu hơn vết thu được trên sắc ký đồ của dung dịch đối chiếu (0,5 %).
B. Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động: Hỗn hợp acetonitril - dung dịch amoni dihydrophosphat 2,26 % (7 : 93), điều chỉnh pH đến 3,9 bằng dung dịch acid phosphoric 10 % (TT).
Dung dịch thử: Hòa tan 0,100 g chế phẩm trong pha động và pha loãng thành 20,0 ml với cùng dung môi. Pha loãng 5,0 ml dung dịch thu được thành 20,0 ml với cùng dung môi.
Dung dịch đối chiếu: Hòa tan 5,0 mg tạp chất A chuẩn của ceftazidim trong pha động và pha loãng thành 20 ml với cùng dung môi. Pha loãng 1,0 ml dung dịch thu được thành 20,0 ml với cùng dung môi.
Dung dịch phân giải: Hòa tan 5 mg tạp chất A chuẩn của ceftazidim và 5 mg ceftazidlm chuẩn trong pha động và pha loãng thành 20,0 ml với cùng dung môi. Pha loãng 1,0 ml dung dịch thu được thành 20,0 ml với cùng dung môi.
Điều kiện sắc ký
Cột thép không gỉ (25 cm x 4,6 mm) được nhồi pha tĩnh C (5 µm).
Nhiệt độ cột: 35 °C.
Detector quang phổ từ ngoại đặt ở bước sóng 255 nm.
Tốc độ dòng: 1,3 ml/min.
Thể tích tiêm: 20 µl.
Cách tiến hành:
Tiêm dung dịch phân giải, điều chỉnh độ nhạy của hệ thống sao cho chiều cao của 2 pic trên sắc ký đồ ít nhất bằng 50 % của thang đo. Phép thử chỉ có giá trị khi độ phân giải giữa pic ceftazidim và tạp chất A tối thiểu là 5,9.
Tiêm dung dịch thử và dung dịch đối chiếu. Thời gian sắc ký của dung dịch thử gấp 3 lần thời gian lưu của ceftazidim. Diện tích của bất kỳ pic phụ nào trên sắc ký đồ của dung dịch thử không được lớn hơn 0,5 lần diện tích của pic chính thu được từ sắc ký đồ của dung dịch đối chiếu (0,5 %). Tổng diện tích của tất cả các pic phụ trên sắc ký đồ của dung dịch thử không được lớn hơn 2 lần diện tích của pic chính từ sắc ký đồ của dung dịch đối chiếu (2,0 %). Bỏ qua các pic có diện tích nhỏ hơn 10 % diện tích của pic chính trên sắc ký đồ của dung dịch đối chiếu.
Ghi chú: Tạp chất A: (2RS,6R,7R)-7-[[(Z)-2-(2-aminothiazol-4-yl)-2-[(1-carboxy-1- methylethoxy)imlno]acetyl] amino]-8-oxo-3-[(1-pyridlno)methyl]-5-thia-1-azabicyclo[4.2.0]oct-3-en-2- carboxylat (Δ-2-ceftazldim).
Pyridin
Không được quá 0,05 %.
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động: Dung dịch amoni dihydrophosphat 2,88 % được điều chỉnh pH đến 7,0 bằng amoniac - acetonitril - nước (8 : 24 : 68).
Các dung dịch sau pha ngay trước khi sử dụng.
Dung dịch thử: Hòa tan 0,500 g chế phẩm trong hỗn hợp gồm 10 thể tích dung dịch đệm phosphat pH 7.0 (TT4) và 90 thể tích nước (hỗn hợp A). Pha loãng thành 100,0 ml với cùng dung môi.
Dung dịch đối chiếu: Hòa tan 1,0 g pyridin (TT) trong nước và pha loãng thành 100,0 ml với cùng dung môi. Pha loãng 5,0 ml dung dịch này thành 200,0 ml với nước. Lấy 1,0 ml dung dịch thu được thêm 10.0 ml dung dịch đệm phosphat pH 7,0 (TT) và pha loãng thành 100,0 ml với nước.
Dung dịch phân giải: Pha loãng 1,0 ml dung dịch thử thành 200,0 ml với hỗn hợp A. Lấy 1,0 ml dung dịch thu được, thêm 20,0 ml dung dịch đối chiếu và pha loãng thành 200,0 ml với hỗn hợp A.
Điều kiện sắc ký:
Cột thép không gỉ (25 cm x 4,6 mm) được nhồi pha tĩnh C (5 µm).
Detector quang phổ tử ngoại đặt ở bước sóng 255 nm.
Tốc độ dòng: 1,0 ml/mln.
Thể tích tiêm: 20 µl.
Cách tiến hành:
Tiêm dung dịch phân giải, phép thử chỉ có giá trị khi độ phân giải giữa các pic tương ứng với ceftazidim và pyridin tối thiểu là 7,0.
Tiêm dung dịch đối chiếu, điều chỉnh độ nhạy của hệ thống sao cho chiều cao của pic chính trên sắc ký đồ phải ít nhất bằng 50 % của thang đo. Tiêm lần lượt dung dịch thử và dung dịch đối chiếu, diện tích của pic tương ứng với pyridin trên sắc ký đồ của dung dịch thử không được lớn hơn diện tích của pic chính thu được trên sắc ký đồ của dung dịch đối chiếu.
Nước
Từ 13,0 % đến 15,0 %.
Dùng 0,200 g chế phẩm (Phụ lục 10.3).
Nội độc tố vi khuẩn
Không được quá 0,10 EU/mg. Nếu chế phẩm dự định để sản xuất thuốc tiêm mà không có phương pháp hữu hiệu nào để loại bỏ nội độc tố vi khuẩn thì phải đáp ứng phép thử nội độc tố vi khuẩn (Phụ lục 13.2).
Định lượng
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động: Hòa tan 4,26 g dinatri hydrophosphat (TT) và 2,73 g kali dihydrophosphat (TT) trong 980 ml nước, thêm 20 ml acetonitril (TT).
Dung dịch thử: Hòa tan 25,0 mg chế phẩm trong pha động và pha loãng thành 25,0 ml với cùng dung môi.
Dung dịch chuẩn: Hòa tan 25,0 mg ceftazidim chuẩn trong pha động và pha loãng thành 25,0 ml với cùng dung môi.
Dung dịch phân giải: Hòa tan 5,0 mg tạp chất A chuẩn của ceftazidim trong 5,0 ml dung dịch chuẩn. Điều kiện sắc ký:
Cột thép không gỉ (15 cm x 4,6 mm) được nhồi hexylsilyl silica gel dùng cho sắc ký (5 µm).
Detector quang phổ từ ngoại đặt ở bước sóng 245 nm.
Tốc độ dòng: 2,0 ml/min.
Thể tích tiêm: 20 µl.
Cách tiến hành: Tiêm dung dịch phân giải, điều chỉnh độ nhạy của hệ thống sao cho chiều cao của pic chính trên sắc ký đồ phải ít nhất bằng 50 % của thang đo. Phép thử chỉ có giá trị khi độ phân giải giữa pic tương ứng với ceftazidim và tạp chất A tối thiểu là 1,5. Tiêm lần lượt dung dịch thử và dung dịch chuẩn. Tính hàm lượng ceftazidim, C22H22N8O7S2, trong chế phẩm dựa vào diện tích pic thu được trên sắc ký đồ của dung dịch thử, dung dịch chuẩn và hàm lượng C22H22N6O7S2 trong ceftazidim chuẩn.
Bảo quản
Bảo quản trong đồ đựng kín, tránh ánh sáng. Nếu là chế phẩm vô khuẩn phải đựng trong đồ đựng vô khuẩn, kín, chống nhiễm khuẩn.
Loại thuốc
Kháng sinh.
Chế phẩm
Thuốc tiêm.
FEXOFENADIN HYDROCLORID
Fexofenadini hydrochloridum
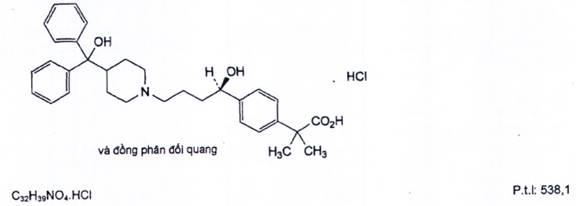
Fexofenadin hydroclorid là acid 2-[4-[(1 RS)-1-hydroxyl-4[4-(hydroxydiphenylmethyl)piperidin-1-yl] butyl]phenyl]-2-metylpropanoic hydroclorid, phải chứa từ 98,0 % đến 102,0 % C32H39N04.HCl, tính theo chế phẩm khan.
Tính chất
Bột màu trắng hay gần như trắng, có tính chất đa hình.
Khó tan trong nước, dễ tan trong methanol, rất khó tan trong aceton.
Định tính
A. Phổ hồng ngoại của chế phẩm phải phù hợp với phổ hồng ngoại của fexofenadin chuẩn (Phụ lục 4.2). Nếu so sánh phổ có sự khác nhau thì hòa tan mẫu thử và mẫu đối chiếu riêng biệt trong methanol (TT), bốc hơi đến cắn và đo phổ phần cắn.
B. Hòa tan 30 mg mẫu thử trong hỗn hợp đồng thể tích methanol - nước, siêu âm nếu cần và pha loãng thành 2 ml với cùng hỗn hợp dung môi. Dung dịch phải cho phản ứng (A) của clorid.
Tạp chất B
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động: Acetonitril - dung dịch đệm (20 : 80).
Dung dịch đệm: Pha loãng 1,15 ml acid acetic băng (TT) bằng 900 ml nước, điều chỉnh pH đến 4,0 ± 0,1 bằng dung dịch amoniac loãng (TT), thêm nước vừa đủ 1000 ml.
Dung dịch thử: Hòa tan 50,0 mg chế phẩm trong pha động và pha loãng thành 100,0 ml với cùng dung môi.
Dung dịch đối chiếu: Pha loãng 1,0 ml dung dịch thử thành 100,0 ml bằng pha động. Pha loãng 10 lần dịch này với pha động.
Dung dịch phân giải: Hòa tan toàn bộ lượng tạp chất B chuẩn của fexotenadin có trong 1 lọ chuẩn bằng dung dịch thử, pha loãng thành 2,0 ml với cùng dung môi.
Điều kiện sắc ký:
Cột có kích thước 25 cm x 4,6 mm được nhồi silica gel BC dùng cho sắc ký tách đồng phân đối quang. Detector quang phổ hấp thụ từ ngoại đặt ở bước sóng 220 nm.
Tốc độ dòng: 0,5 ml/min.
Thể tích tiêm: 20 µl.
Thời gian chạy sắc ký: bằng 1,2 lần thời gian lưu của fexofenadin.
Cách tiến hành:
Tiêm dung dịch phân giải, thời gian lưu tương đối của tạp chất B so với fexofenadin (thời gian lưu khoảng 20 min) là 0,7. Phép thử chỉ có giá trị khi độ phân giải giữa pic fexofenadin và tạp chất B ít nhất bằng 3,0.
Tiêm lần lượt dung dịch thử và dung dịch đối chiếu, trên sắc ký đồ của dung dịch thử, diện tích của pic tương ứng với tạp chất B nhân với 1,3 không được lớn hơn diện tích pic chính trên sắc ký đồ của dung dịch đối chiếu (0,1 %).
Tạp chất liên quan
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động: Acetonitril - dung dịch đệm - triethylamin (350 : 650 : 3)
Dung dịch đệm: Hòa tan 6,64 g natri dihydrophosphat monohydrat (TT) và 0,84 g natriperclorat (TT) vào nước, điều chỉnh pH đến 2,0 ± 0,1 bằng acid phosphoric (TT) và pha loãng thành 1000 ml bằng nước.
Hỗn hợp dung môi: Hỗn hợp đồng thể tích acetonitril (TT) và dung dịch đệm.
Dung dịch thử (1): Hòa tan 25,0 mg chế phẩm trong 25,0 ml hỗn hợp dung môi.
Dung dịch thử (2): Pha loãng 3,0 ml dung dịch thử (1) thành 50,0 ml bằng pha động.
Dung dịch đối chiếu (1): Hòa tan 25,0 mg chất đối chiếu fexofenadin hydroclorid bằng hỗn hợp dung môi và pha loãng tới 25,0 ml bằng hỗn hợp dung môi. Pha loãng 3,0 ml dung dịch này thành 50,0 ml bằng pha động.
Dung dịch đối chiếu (2): Pha loãng 1,0 ml dung dịch thử (1) thành 100,0 ml bằng pha động. Pha loãng 1,0 ml dung dịch này thành 10,0 ml bằng pha động.
Dung dịch đối chiếu (3): Hòa tan 1,0 mg tạp chất A của fexofenadin và 1,0 mg tạp chất C của fexofenadin trong 20,0 ml dung dịch đối chiếu (1) và pha loãng thành 200,0 ml bằng pha động.
Điều kiện sắc ký:
Cột kích thước 25 cm x 4,6 mm được nhồi pha tĩnh phenylsilyl silica gel dùng cho sắc ký (5 µm). Detector quang phổ hấp thụ tử ngoại đặt ở bước sóng 220 nm.
Tốc độ dòng: 1,5 ml/min.
Thể tích tiêm: 20 µl.
Cách tiến hành:
Thời gian chạy sắc ký: Với dung dịch thử (1) và dung dịch đối chiếu (3), thời gian chạy sắc ký bằng 6 lần thời gian lưu của fexofenadin; với dung dịch đối chiếu (2) thời gian chạy sắc ký bằng 2 lần thời gian lưu của fexofenadin.
Kiểm tra tính phù hợp của hệ thống: Tiến hành chạy sắc ký với dung dịch đối chiếu (3), độ phân giải giữa pic fexofenadin và tạp chất A ít nhất bằng 10.
Thời gian lưu tương đối so với fexofenadin (thời gian lưu khoảng 9 min): tạp chất A khoảng 1,7; tạp chất D khoảng 2,3 và tạp chất C khoảng 3,2.
Hệ số hiệu chỉnh: khi tính toán, nhân diện tích pic tạp chất A với 1,4.
Giới hạn:
Tạp chất A, C, D: Diện tích của từng pic tương ứng với tạp chất A, C, D không được lớn hơn diện tích của pic chính trên sắc ký đồ của dung dịch đối chiếu (2) (0,1 %).
Tạp chất chưa định danh: Đối với mỗi tạp chất, không được lớn hơn diện tích của pic chính trên sắc ký đồ của dung dịch đối chiếu (2) (0,1 %).
Tổng diện tích của các pic tạp chất không không được lớn hơn 3 lần diện tích pic chính trên sắc ký đồ của dung dịch đối chiếu (2) (0,3 %).
Bỏ qua các pic có diện tích nhỏ hơn 0,5 lần diện tích của pic chính trên sắc ký đồ của dung dịch đối chiếu 2 (0,05 %).
Ghi chú:
Tạp chất A: Acid 2-[4-[4-[4-(hydroxydiphenylmethyl)piperidin-1-yl]butanoyl]phenyl]-2-methylpropanoic, Tạp chất B: Acid 2-[3-[(1RS)-1-hydroxy-4-[4-(hydroxydiphenylmethyl)piperidin-1-yl]butyl]phenyl]-2- methylpropanoic,
Tạp chất C: (1RS)-4-[4-(hydroxydiphenylmethyl)piperidin-1-yl]-1-[4-(1-methylethyl) phenyl]butan-1-ol, Tạp chất D: methyl 2-[4-[(1RS)-1-hydroxy-4-[4-(hydroxydiphenylmethyl)piperidin-1-yl]butyl]phenyl]-2- methylpropanoat,
Kim loại nặng
Không được quá 10 phần triệu (Phụ lục 9.4.8).
Hòa tan 1,0 g chế phẩm trong hỗn hợp của nước và methanol (15 : 85) và pha loãng thành 20,0 ml với cùng hỗn hợp dung môi. Lấy 12,0 ml dung dịch thử theo phương pháp 2. Dùng 5,0 ml dung dịch chì mẫu 1 phần triệu Pb (TT) để chuẩn bị mẫu đối chiếu.
Nước
Không được quá 0,5 % (Phụ lục 10.3).
Hòa tan 1,000 g trong methanol khan (TT) và pha loãng thành 5,0 ml. Dùng 1,0 ml của dung dịch này để thử.
Tro sulfat
Không được quá 0,1 % (Phụ lục 9.9, phương pháp 2).
Dùng 1,0 g.
Định lượng
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động, dung dịch đệm, hỗn hợp dung môi, điều kiện sắc ký và chuẩn bị các dung dịch như mô tả trong mục Tạp chất liên quan.
Cách tiến hành:
Tiến hành sắc ký với dung dịch thử (2) dung dịch đối chiếu (1), thời gian chạy sắc ký bằng 2 lần thời gian lưu của fexofenadin. Tính hàm lượng fexofenadin hydroclorid, C32H39NO4.HCL, trong chế phẩm dựa vào diện tích pic thu được trên sắc ký đồ của dung dịch thử (2), dung dịch đối chiếu (1) và hàm lượng C32H39NO4.HCL trong fexofenadin hydroclorid chuẩn.
Bảo quản
Đựng trong lọ nút kín, tránh ánh sáng, nhiệt độ không quá 30 °C.
Loại thuốc
Kháng histamin.
Chế phẩm
Viên nén.
LORATADIN
Loratadinum

Loratadin là ethyl 4-(8-cloro-5,6-dihydro-11H-benzo [5,6] cyclohepta [1,2-b] pyridin-11-yliden) piperidin- 1-carboxylat, phải chứa từ 98,5 % đến 101,5 % C22H23ClN2O2, tính theo chế phẩm đã làm khô.
Tính chất
Bột kết tinh màu trắng hoặc gần như trắng, có tính chất đa hình.
Thực tế không tan trong nước, dễ tan trong aceton và methanol.
Định tính
Phổ hồng ngoại của chế phẩm (Phụ lục 4.2) phải phù hợp với phổ hồng ngoại của loratadin chuẩn. Nếu so sánh phổ có sự khác nhau thì hòa tan mẫu thử và mẫu đối chiếu riêng biệt trong aceton (TT), bay hơi đến khô và dùng cắn để đo phổ mới.
Độ trong và màu sắc của dung dịch
Hòa tan 1,0 g chế phẩm trong methanol (TT) và pha loãng thành 20,0 ml với cùng dung môi. Dung dịch thu được phải trong (Phụ lục 9.2) và không có màu đậm hơn dung dịch màu đối chiếu VN5 (Phụ lục 9.3, phương pháp 2).
Tạp chất H
Phương pháp sắc ký khí (Phụ lục 5.2).
Dung dịch chuẩn nội: Hòa tan 25,0 mg isoamyl benzoat (TT) trong methylen clorid (TT) và pha loãng thành 100,0 ml với cùng dung môi. Pha loãng 5,0 ml dung dịch này thành 50,0 ml với methylen clorid (TT).
Dung dịch đối chiếu (1): Hòa tan 25,0 mg tạp chất H chuẩn của loratadin trong methylen clorid (TT) và pha loãng thành 100,0 ml với cùng dung môi. Pha loãng 5,0 ml dung dịch này thành 50,0 ml với methylen clorid (TT).
Dung dịch đối chiếu (2): Lấy 1,0 ml dung dịch đối chiếu (1) thêm 1,0 ml của dung dịch chuẩn nội và pha loãng thành 5,0 ml với methylen clorid (TT).
Dung dịch thử: Hòa tan 25,0 mg chế phẩm trong methylen clorid (TT), thêm 1,0 ml dung dịch đối chiếu (1) và 1,0 ml dung dịch chuẩn nội và pha loãng thành 5,0 ml với methylen clorid (TT).
Điều kiện sắc ký:
Cột silica nung chảy, chiều dài 25 m, đường kính trong 0,32 mm, pha tĩnh poly(dimethyl) siloxan (phim có độ dày 0,52 µm).
Khí mang: Khí heli dùng cho sắc ký.
Tốc độ dòng: 1,0 ml/min.
Tỷ lệ chia dòng: 1 : 30.
Nhiệt độ:
|
| Thời gian (min) | Nhiệt độ (°C) |
| Cột | 0 - 1 | 80 |
|
| 1 - 23 | 80 → 300 |
|
| 23 - 33 | 300 |
| Buồng tiêm |
| 260 |
| Detector |
| 300 |
Detector: Ion hóa ngọn lửa.
Thể tích tiêm: 1,0 µl.
Cách tiến hành:
Tiến hành sắc ký với dung dịch thử và dung dịch đối chiếu (2).
Thời gian lưu tương đối so với loratadin (thời gian lưu khoảng 32 min) của tạp chất H khoảng 0,33; của isoamyl benzoat khoảng 0,37.
Kiểm tra tính phù hợp của hệ thống: Trên sắc ký đồ của dung dịch đối chiếu (2) độ phân giải giữa pilc của tạp chất H và isoamyl benzoat tối thiểu là 2,0; tỷ số tín hiệu trên nhiễu không được nhỏ hơn 10 đối với pic tạp chất H.
Giới hạn: Tính tỷ lệ (R) của diện tích pic của tạp chất H so với diện tích pic của isoamyl benzoat từ sắc đồ thu được của dung dịch đối chiếu (2); từ sắc đồ thu được với dung dịch thử, tính tỷ lệ diện tích pic của tạp chất H so với diện tích pic của isoamyl benzoat, tỷ lệ này không được lớn hơn hai lần giá trị R (0,1 %)
Tạp chất liên quan
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động: Methanol - dung dịch kali dihydrophosphat 0,68 % được chỉnh pH đến 2,80 ± 0,05 bằng acid phosphoric - acetonitril (30 : 35 : 40).
Dung dịch thử: Hòa tan 25,0 mg chế phẩm trong pha động và pha loãng thành 25,0 ml với pha động. Dung dịch đối chiếu (1): Hòa tan 5,0 mg tạp chất F chuẩn của loratadin trong pha động và pha loãng thành 25,0 ml với pha động. Pha loãng 1,0 ml dung dịch này thành 10,0 ml với pha động.
Dung dịch đối chiếu (2): Hòa tan 5,0 mg loratadin chuẩn dùng để đánh giá tính phù hợp của hệ thống (có chứa tạp chất A và E) trong pha động, thêm 0,5 ml dung dịch đối chiếu (1) và pha loãng thành 5,0 ml với pha động.
Dung dịch đối chiếu (3): Pha loãng 1,0 ml dung dịch thử thành 100,0 ml với pha động. Pha loãng 1,0 ml dung dịch này thành 10,0 ml với pha động.
Điều kiện sắc ký:
Cột kích thước 25 cm x 4,6 mm được nhồi end-capped octadecylsilyl silicagel hình cầu (5 µm) với hoạt độ silanol rất thấp.
Nhiệt độ cột: 40 °C.
Tốc độ dòng: 1,5 ml/min.
Detector quang phổ tử ngoại ở bước sóng 220 nm.
Thể tích tiêm: 20 µl.
Cách tiến hành:
Tiến hành sắc ký với dung dịch thử, dung dịch đối chiếu (2) và dung dịch đối chiếu (3), thời gian chạy sắc ký bằng 5 lần thời gian lưu của loratadin.
Định tính các tạp chất: Sử dụng sắc đồ đối chiếu đi kèm với loratadin chuẩn dùng để đánh giá tính phù hợp của hệ thống và sắc đồ thu được từ dung dịch đối chiếu (2) để xác định các pic tạp chất A và E.
Thời gian lưu tương đối so với loratadin (thời gian lưu khoảng 12 min): của tạp chất D khoảng 0,2; tạp chất B khoảng 0,4; tạp chất F khoảng 0,9; tạp chất E khoảng 1,1; tạp chất A khoảng 2,4; tạp chất C khoảng 2,7.
Tính phù hợp của hệ thống: Trên sắc ký đồ của dung dịch đối chiếu (2), tỷ số đỉnh-hõm tối thiểu là 2,5 trong đó Hp là chiều cao so với đường nền của pic tạp chất E và Hv là chiều cao so với đường nền của đáy hõm tách pic tạp chất E và pic loratadin.
Giới hạn:
- Hệ số hiệu chỉnh: Để tính hàm lượng, nhân diện tích pic của các tạp chất sau với các hệ số hiệu chỉnh tương ứng: tạp chất A là 1,7; tạp chất E là 1,9; tạp chất F là 1,6;
- Tạp chất F: không quá hai lần diện tích pic chính trên sắc đồ của dung dịch đối chiếu (3) (0,2 %);
- Tạp chất A, B, C, D, E: Đối với mỗi tạp chất, không lớn hơn diện tích pic chính trên sắc đồ của dung dịch đối chiếu (3) (0,1 %);
- Tạp chất chưa định danh: Đối với mỗi tạp chất, không lớn hơn diện tích pic chính trên sắc đồ của dung dịch đối chiếu (3) (0,1 %);
- Tổng lượng tạp chất: Không được quá 5 lần diện tích pic chính trên sắc đồ của dung dịch đối chiếu (3) (0,5 %);
- Bỏ qua các pic có diện tích nhỏ hơn 0,5 lần diện tích pic chính trên sắc đồ của dung dịch đối chiếu (3) (0,05%).
Ghi chú:
Tạp chất A: Ethyl 4-[(11RS)-8-cloro-11-hydroxy-6,11-dihydro-5H-benzo[5,6]cyclohepta [1,2-b] pyridin- 11-yl]piperidin-1-carboxylat,
Tạp chất F: Ethyl 4-[(11RS)-8-cloro-11-fluoro-6,11-dihydro-5H-benzo[5,6]cyclohepta[1,2-b]pyridin-11-yl] piperidln-1 -carboxylat,
Tạp chất B: 8-cloro-5,6-dihydro-11H-benzo[5,6]cyclohepta[1,2-b]pyridin-11-on,
Tạp chất C: Ethyl 4-(4,8-dicloro-5,6-dihydro-11H-benzo[5,6]cyclohepta [1,2-b] pyridin-11-yliden) piperidin-1-carboxylat,
Tạp chất D: 8-chloro-11-(piperidin-4-yliden)-6,11-dihydro-5H-benzo[5,6]cyclohepta [1,2-b] pyrldin,
Tạp chất G: 8-cloro-11-(1-methylpiperidin-4-yliden)-6,11-dihydro-5H-benzo [5,6]cyclohepta[1,2-b]pyridin,
Tạp chất E: Ethyl 4-[(11RS)-8-cloro-6,11-dihydro-5H-benzo[5l6]cyclohepta[1,2-b]pyridin-11-yl]-3,6- dihydropyridin-1(2H)-carboxylat,
Tạp chất H: Ethyl 4-oxoplperidin-1-carboxylat.
Sulfat
Không được quá 150 phần triệu (Phụ lục 9.4.14).
Nung 1,33 g chế phẩm ở 800 ± 25 °C và hòa cắn với 20 ml nước cất. Lọc nếu cần bằng giấy lọc không chứa sulfat. Lọc lại qua giấy lọc mới cho đến khi dịch lọc không còn đục, được dung dịch thử.
Mất khối lượng do làm khô
Không được quá 0,5 % (Phụ lục 9.6).
(1,000 g, 105 °C).
Tro Sulfat
Không được quá 0,1 % (Phụ lục 9.9, phương pháp 2).
Dùng 1,0 g chế phẩm.
Định lượng
Hòa tan 0,300 g chế phẩm trong 50 ml acid acetic băng (TT). Chuẩn độ bằng dung dịch acid percloric 0,1 N (CĐ). Xác định điểm kết thúc bằng phương pháp chuẩn độ đo điện thế (Phụ lục 10.2).
1 ml dung dịch acid percloric 0,1 N (CĐ) tương đương với 38,29 mg C22H23ClN2O2.
Bảo quản
Đựng trong lọ nút kín, tránh ánh sáng, nhiệt độ không quá 30 °C.
Loại thuốc
Kháng histamin,
Chế phẩm
Viên nén.
MAGNESI LACTAT DlHYDRAT
Magnesii lactas dihydricus

Magnesi lactat dihydrat là magnesi bis(2-hydroxypropanoat) hay hỗn hợp magnesi (2R)-, (2S)- và (2RS)-2-hydroxypropanoat dihydrat, phải chứa từ 98,0 % đến 102,0 % C6H10MgO6, tính theo chế phẩm đã làm khô.
Tính chất
Bột kết tinh hoặc dạng hạt, màu trắng hay gần như trắng.
Khó tan trong nước, tan trong nước sôi, thực tế không tan trong ethanol 96 %.
Định tính
A. Chế phẩm phải cho phản ứng của lactat (Phụ lục 8.1).
B. Chế phẩm phải cho phản ứng của ion magnesi (Phụ lục 8.1).
Độ trong và màu sắc của dung dịch
Dung dịch S: Hoà tan 5,0 g chế phẩm trong nước không có carbon dioxyd (TT) bằng cách đun nóng, làm nguội và pha loãng thành 100,0 ml với cùng dung môi.
Dung dịch S phải không được đục hơn hỗn dịch đối chiếu II (Phụ lục 9.2) và không được có màu đậm hơn dung dịch màu đối chiếu VN5 (Phụ lục 9.3, phương pháp 2).
pH
Dung dịch s có pH từ 6,5 đến 8,5 (Phụ lục 6.2).
Clorid
Không được quá 200 phần triệu (Phụ lục 9.4.5).
Lấy 5 ml dung dịch s pha loãng với nước thành 15 ml để thử.
Sulfat
Không được quá 400 phần triệu (Phụ lục 9.4.14).
Lấy 7,5 ml dung dịch S pha loãng với nước cất (TT) thành 15 ml để thử.
Sắt
Không được quá 50 phần triệu (Phụ lục 9.4.13).
Lấy 4 ml dung dịch S pha loãng với nước thành 10 ml để thử.
Kim loại nặng
Không được quá 20 phần triệu (Phụ lục 9.4.8).
Lấy 12 ml dung dịch S và tiến hành thử theo phương pháp 1. Dùng dung dịch chì mẫu 1 phần triệu Pb (TT) để chuẩn bị mẫu đối chiếu.
Mất khối lượng do làm khô
Từ 14,0 % đến 17,0 % (Phụ lục 9.6).
(0,500 g; 125 °C).
Định lượng
Hoà tan 0,180 g chế phẩm trong nước và pha loãng thành 300 ml với cùng dung môi. Tiến hành chuẩn độ bằng dung dịch natri edetat 0,1 M (CĐ) theo phương pháp chuẩn độ complexon cho magnesi (Phụ lục 10.5).
1 ml dung dịch natri edetat 0,1 M (CĐ) tương đương với 20,25 mg C6H10MgO6.
Bảo quản
Trong chai lọ nút kín.
METOCLOPRAMID HYDROCLORID
Metoclopramidi hydrochloridum
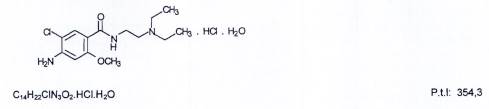
Metoclopramid hydroclorid là 4-amino-5-cloro-N-[2-(diethylamino)ethyl]-2-methoxybenzamid hydroclorid monohydrat, phải chứa từ 99,0 % đến 101,0 % C14H22CIN3O2.HCl, tính theo chế phẩm khan.
Tính chất
Bột kết tinh hoặc tinh thể trắng hoặc gần như trắng. Rất tan trong nước, dễ tan trong ethanol 96 %, hơi tan trong dicloromethan.
Nhiệt độ nóng chảy khoảng 183 °C, kèm theo phân hủy.
Định tính
Có thể chọn một trong hai nhóm định tính sau:
Nhóm I: A, B, D.
Nhóm II: B, C, D, E.
A. Phổ hồng ngoại của chế phẩm (Phụ lục 4.2) phải phù hợp với phổ hồng ngoại của metoclopramid hydroclorid chuẩn. Chuẩn bị mẫu đo dạng viên nén (đĩa halid), dùng kali clorid (TT).
B. pH của dung dịch S (xem mục Độ trong và màu sắc của dung dịch) từ 4,5 đến 6,0 (Phụ lục 6.2).
C. Ở phần Tạp chất liên quan, quan sát sắc ký đồ dưới ánh sáng tử ngoại trước khi phun dung dịch dimethylaminobenzaldehyd (TT1): Vết chính trên sắc ký đồ của dung dịch thử (2) phải giống về vị trí và kích thước với vết chính trên sắc ký đồ của dung dịch đối chiếu (1).
D. Pha loãng 1 ml-dung dịch S thành 2 ml với nước. Dung dịch phải cho phản ứng định tính (A) của clorid (Phụ lục 8.1).
E. Hòa tan khoảng 2 mg chế phẩm trong 2 ml nước. Dung dịch phải cho phản ứng định tính của amin thơm bậc nhất (Phụ lục 8.1).
Độ trong và màu sắc của dung dịch
Dung dịch S: Hòa tan 2,5 g chế phẩm trong nước không có carbon dioxyd (TT) và pha loãng thành 25 ml với cùng dung môi.
Dung dịch S phải trong (Phụ lục 9.2) và không màu (Phụ lục 9.3, phương pháp 2).
Tạp chất liên quan
Phương pháp sắc ký lớp mỏng (Phụ lục 5.4).
Bản mỏng: Silica gel HF254.
Dung môi khai triển: Amoniac đậm đặc - dioxan - methanol - dicloromethan (2 : 10 : 14 : 90).
Dung dịch thử (1): Hòa tan 0,40 g chế phẩm trong methanol (TT) và pha loãng thành 10 ml với cùng dung môi.
Dung dịch thử (2): Pha loãng 1 ml dung dịch thử (1) thành 10 ml với methanol (TT).
Dung dịch đối chiếu (1): Hoà tan 20 mg metoclopramid hydroclorid chuẩn trong methanol (TT) và pha loãng thành 5 ml với cùng dung môi.
Dung dịch đối chiếu (2): Pha loãng 5 ml dung dịch thử (1) thành 100 ml với methanol (TT). Pha loãng 1 ml dung dịch này thành 10 ml với methanol (TT).
Dung dịch đối chiếu (3): Hòa tan 10 mg N,N-diethylethylendiamin (TT) trong methanol (TT) và pha loãng thành 50 ml với cùng dung môi.
Cách tiến hành: Chấm riêng biệt lên bản mỏng 5 µl mỗi dung dịch trên. Triển khai sắc ký đến khi dung môi đi được 12 cm. Lấy bản mỏng ra để khô ngoài không khí. Quan sát dưới ánh sáng tử ngoại ở bước sóng 254 nm. Bất kỳ vết phụ nào trên sắc ký đồ của dung dịch thử (1) không được đậm màu hơn vết trên sắc ký đồ của dung dịch đối chiếu (2) (0,5 %). Phun dung dịch p-dimethylaminobenzaldehyd (TT1). Để khô bản mỏng ngoài không khí. Bất kỳ vết phụ nào trên sắc ký đồ của dung dịch thử (1) mà không quan sát thấy dưới ánh sáng từ ngoại ở bước sóng 254 nm không được đậm màu hơn vết trên sắc ký đồ của dung dịch đối chiếu (3) (0,5 %).
Kim loại nặng
Không được quá 20 phần triệu (Phụ lục 9.4.8)
Lấy 12 ml dung dịch S, tiến hành theo phương pháp 1.
Dùng dung dịch chì mẫu 2 phần triệu Pb (TT) để chuẩn bị mẫu đối chiếu.
Nước
Từ 4,5 % đến 5,5 % (Phụ lục 10.3).
Dùng 0,500 g chế phẩm.
Tro sulfat
Không được quá 0,1 % (Phụ lục 9.9, phương pháp 2).
Dùng 1,0 g chế phẩm.
Định lượng
Hòa tan 0,250 g chế phẩm trong hỗn hợp 5,0 ml dung dịch acid hydrocloric 0,01 M (TT) và 50 ml ethanol 96 % (TT). Chuẩn độ bằng dung dịch natri hydroxyd 0,1 N (CĐ). Tiến hành phương pháp chuẩn độ đo điện thế (Phụ lục 10.2). Đọc thể tích dung dịch natri hydroxyd 0,1 N (CĐ) tiêu thụ giữa hai điểm uốn của đường chuẩn độ.
1 ml dung dịch natri hydroxyd 0,1 N (CĐ) tương đương với 33,63 mg C14H22ClN3O2.HCl.
Bảo quản
Tránh ánh sáng.
Loại thuốc
Phòng và chống nôn.
Chế phẩm
Viên nén, thuốc tiêm.
NICLOSAMID KHAN
Niclosamidum anhydricum
Niclosamid khan là 5-cloro-N-(2-cloro-4-nitrophenyl)-2-hydroxybenzamid, phải chứa từ 98,0 % đến 101,0 % C13HaCI2N2O4, tính theo chế phẩm đã làm khô.
Tính chất
Tinh thể mịn màu trắng ánh vàng hoặc màu hơi vàng.
Thực tế không tan trong nước, hơi tan trong aceton, khó tan trong ethanol.
Định tính
Có thể chọn một trong hai nhóm định tính sau:
Nhóm I: A, E.
Nhóm II: B, C, D, E.
A. Phổ hồng ngoại (Phụ lục 4.2) của chế phẩm phải phù hợp với phổ hồng ngoại của niclosamid khan chuẩn. Chuẩn bị mẫu thử bằng cách trộn 0,5 mg chế phẩm với 0,3 g kali bromid (TT) và nén thành viên nén.
B. Điểm chảy: Từ 227 °C đến 232 °C (Phụ lục 6.7).
C. Hòa tan 50 mg chế phẩm trong 5 ml dung dịch acid hydrocloric 1 M (TT), thêm 0,1 g kẽm bột (TT), đun nóng trong cách thủy 10 min, để nguội và lọc. Thêm vào dịch lọc 1 ml dung dịch natri nitrit 0,5 % và để yên 3 min. Thêm 2 ml dung dịch amoni sulfamat 2 %, lắc, để yên 3 min và thêm 2 ml dung dịch naphthylethylendiamin dihydroclorid 0,5% (TT). Màu tím xuất hiện.
D. Đốt chế phẩm trên dây đồng bằng ngọn lửa không màu. Ngọn lửa chuyền màu xanh lục.
E. Chế phẩm phải đáp ứng yêu cầu của phép thử Mất khối lượng do làm khô.
Tạp chất liên quan
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động: Hỗn hợp đồng thể tích của acetonitril (TT) và dung dịch chứa 0,2 % kali dihydrophosphat, 0,1 % dinatri hydrophosphat, 0,2% tetrabutylamoni hydrosulfat.
Dung dịch thử: Hòa tan 50 mg chế phẩm trong methanol (TT) bằng cách đun nóng nhẹ, để nguội và thêm methanol (TT) vừa đủ 50,0 ml.
Dung dịch đối chiếu: Pha loãng 1,0 ml dung dịch thử thành 100,0 ml bằng acetonitril (TT). Pha loãng tiếp 1,0 ml dung dịch thu được thành 20,0 ml bằng acetonitril (TT).
Điều kiện sắc ký:
Cột thép không gỉ (12,5 cm x 4 mm) được nhồi pha tĩnh C (5 µm).
Detector quang phổ hấp thụ tử ngoại đặt ở bước sóng 230 nm.
Tốc độ dòng: 1,0 ml/min.
Thể tích tiêm: 20 µl.
Cách tiến hành: Tiêm dung dịch đối chiếu. Điều chỉnh độ nhạy sao cho chiều cao của pic niclosamid không thấp hơn 20 % của thang đo. Tiêm dung dịch thử và tiến hành sắc ký trong khoảng thời gian gấp hai lần thời gian lưu của pic niclosamid. Trên sắc đồ của dung dịch thử: Tổng diện tích của các pic phụ, trừ pic niclosamid và pic dung môi, không được lớn hơn bốn lần diện tích của pic chính trên sắc đồ của dung dịch đối chiếu (0,2 %). Bỏ qua các pic có diện tích nhỏ hơn 10 % diện tích của pic niclosamid trên sắc đồ của dung dịch đối chiếu (0,005 %).
Acid 5-clorosalicylic
Không được quá 60 phần triệu.
Dung dịch thử: Thêm 15 ml nước vào 1,-0 g chế phẩm, đun sôi 2 min, để nguội, lọc qua màng lọc 0,45 |im, rửa màng lọc. Gộp dịch lọc và dịch rửa, pha loãng dịch thu được thành 20,0 ml bằng nước.
Dung dịch đối chiếu: Hòa tan 30 mg acid 5-clorosalicylic (TT) trong 20 ml methanol (TT) và pha loãng thành 100,0 ml bằng nước. Pha loãng 1,0 ml dung dịch thu được thành 100,0 ml bằng nước.
Cách tiến hành: Thêm lần lượt 0,1 ml dung dịch sắt (III) clorid 1,3 % (TT) vào 10,0 ml dung dịch thử và 10.0 ml dung dịch đối chiếu. Màu tím tạo thành trong dung dịch thử không được đậm hơn màu tím tạo thành trong dung dịch đối chiếu.
2-Cloro-4-nitroanilin
Không được quá 0,01 %.
Dung dịch thử: Thêm 5 ml methanol (TT) vào 0,250 g chế phẩm, đun sôi, để nguội. Thêm 45 ml dung dịch acid hydrocloric 1 M (TT), đun sôi, để nguội, lọc rồi pha loãng dịch lọc thành 50,0 ml bằng dung dịch acid hydrocloric 1 M (TT).
Dung dịch đối chiếu: Hòa tan 50 mg 2-cloro-4-nitroanilin (TT) trong methanol (TT) và pha loãng thành 100,0 ml với cùng dung môi. Pha loãng 1,0 ml dung dịch thu được thành 100,0 ml bằng methanol (TT). Pha loãng 2,0 ml dung dịch này thành 20,0 ml bằng dung dịch acid hydrocloric 1 M (TT).
Cách tiến hành: Thêm lần lượt 0,5 ml dung dịch natri nitrit 0,5 % vào 10,0 ml dung dịch thử và 10,0 ml dung dịch đối chiếu. Để yên 3 min. Thêm 1 ml dung dịch amoni sulfamat 2 %, lắc, để yên trong 3 min rồi thêm 1 ml dung dịch naphthylethylendiamin dihydroclorid 0,5 % (TT). Màu tím hồng tạo thành trong dung dịch thử không được đậm hơn màu tím hồng tạo thành trong dung dịch đối chiếu.
Clorid
Không được quá 0,05 % (Phụ lục 9.4.5).
Thêm hỗn hợp gồm 1,2 ml acid acetic (TT) và 40 ml nước vào 2,0 g chế phẩm, đun sôi trong 2 min, để nguội và lọc. Lấy 2 ml dịch lọc pha loãng với nước thành 15 ml để thử.
Mất khối lượng do làm khô
Không được quá 0,5 % (Phụ lục 9.6).
(1,000 g; 105 °C; 4 h).
Tro sulfat
Không được quá 0,1 % (Phụ lục 9.9, phương pháp 2).
Dùng 1,0 g chế phẩm.
Định lượng
Cân chính xác khoảng 0,300 g chế phẩm hòa tan trong 80 ml hỗn hợp đồng thể tích aceton (TT) và methanol (TT). Định lượng bằng dung dịch tetrabutylamoni hydroxyd 0,1 M (CĐ). Xác định điểm kết thúc bằng phương pháp chuẩn độ đo điện thế (Phụ lục 10.2).
1 ml dung dịch tetrabutylamoni hydroxyd 0,1 M (CĐ) tương đương với 32,71 mg C13H8CI2N2O4.
Bảo quản
Trong bao bì kín, tránh ánh sáng.
Loại thuốc
Trị giun sán.
Chế phẩm
Viên nén.
OXYTETRACYCLIN HYDROCLORID
Oxytetracydinum hydrochloridum
Oxytetracyclin hydroclorid là (4S,4aR,5S,5aR,6S,12aS)-4-(dimethylamino)-3,5,6,10,12)12a- hexahydroxy-e-methyl-1,11-dioxo-1,4,4a,5,5a,6,11,12a-octahydrotetracen-carboxamid hydroclorid, phải chứa từ 95,0 % đến 102,0 % C22H24N2O9.HCl tính theo chế phẩm khan.
Chế phẩm thu được từ quá trình nuôi cấy một số chủng Streptamyces rimosus hoặc từ các phương pháp khác.
Tính chất
Bột kết tinh vàng, dễ hút ẩm. Dễ tan trong nước, hơi tan trong ethanol (96 %). Dung dịch trong nước vẩn đục khi để yên do oxytetracyclin kết tủa.
Định tính
A. Phương pháp sắc ký lớp mỏng (Phụ lục 5.4)
Bản mỏng: Octadecylsilyl silica gel F254.
Dung môi khai triển: Acetonitril - methanol - dung dịch acid oxalic 6,3 % đã được điều chỉnh pH đến 2,0 bằng amoniac đặc (20 : 20 : 60).
Dung dịch thử: Hòa tan 5 mg chế phẩm trong methanol (TT), pha loãng thành 10 ml với cùng dung môi. Dung dịch đối chiếu (1): Hòa tan 5 mg oxytetracyclin hydroclorid chuẩn trong methanol (TT) và pha loãng thành 10 ml với cùng dung môi.
Dung dịch đối chiếu (2): Hòa tan 5 mg oxytetracyclin hydroclorid chuẩn, 5 mg tetracyclin hydrodorid chuẩn và 5 mg minocyclin hydroclorid chuẩn trong methanol (TT), pha loãng thành 10 ml với cùng dung môi.
Cách tiến hành: Chấm riêng biệt lên bản mỏng 1 µl mỗi dung dịch thử, dung dịch đối chiếu (1) và dung dịch đối chiếu (2). Triển khai sắc ký đến khi dung môi đi được khoảng 3/4 bản mỏng. Làm khô bản mỏng ngoài không khí, kiểm tra dưới ánh sáng đèn từ ngoại ở bước sóng 254 nm. Vết chính trên sắc ký đồ của dung dịch thử phải tương ứng về vị trí và kích thước với vết chính trên sắc ký đồ của dung dịch đối chiếu (1). Phép thử chỉ có giá trị khi trên sắc ký đồ của dung dịch đối chiếu (2) cho ba vết tách ra rõ ràng.
B. Thêm 5 ml acid sulfuric (TT) vào 2 mg chế phẩm, màu đỏ đậm tạo thành. Thêm dung dịch thu được vào 2,5 ml nước, màu chuyển sang vàng.
C. Chế phẩm cho phản ứng (A) của clorid (Phụ lục 8.1).
pH
Từ 2,3 đến 2,9 (Phụ lục 6.2).
Hòa tan 0,1 g chế phẩm trong 10 ml nước không có carbon dioxyd (TT).
Góc quay cực riêng
Từ -188° đến -200°, tính theo chế phẩm khan (Phụ lục 6.4).
Hòa tan 0,250 g chế phẩm trong dung dịch acid hydrocloric 0,1 M (TT) và pha loãng thành 25,0 ml với cùng dung môi.
Độ hấp thụ riêng
Từ 270 đến 290 tại bước sóng 353 nm, tính theo chế phẩm khan (Phụ lục 4.1).
Hòa tan 20,0 mg chế phẩm trong dung dịch đệm pH 2,0 (TT) và pha loãng thành 100,0 ml với cùng dung môi. Pha loãng 10,0 ml dung dịch thu được thành 100,0 ml bằng dung dịch đệm pH 2,0 (TT) và đo độ hấp thụ tại 353 nm.
Tạp chất hấp thụ ánh sáng
Đo độ hấp thụ của dung dịch trong vòng 1 h kể từ khi bắt đầu chuẩn bị các dung dịch (Phụ lục 4.1).
Hòa tan 20,0 mg chế phẩm trong hỗn hợp dung môi gồm dung dịch acid hydrocloric 1 M - methanol (1 : 99) và pha loãng thành 10,0 ml với cùng hỗn hợp dung môi. Độ hấp thụ của dung dịch tại bước sóng 430 nm không được quá 0,50 (tính theo chế phẩm khan).
Hòa tan 0,100 g chế phẩm trong hỗn hợp dung dịch acid hydrocloric 1 M - methanol (1 : 99) và pha loãng thành 10,0 ml với cùng hỗn hợp dung môi. Độ hấp thụ của dung dịch tại bước sóng 490 nm không được quá 0,20 (tính theo chế phẩm khan).
Tạp chất liên quan
Phương pháp sắc ký lỏng (Phụ lục 5.3). Chuẩn bị các dung dịch trước khi dùng.
Pha động A: Cân 30,0 g 2-methyl-2-propanol (TT) chuyển vào bình định mức dung tích 1000 ml bằng 200 ml nước. Thêm 60 ml dung dịch đệm phosphat 0,33 M pH 7,5 (TT), 50 ml dung dịch tetrabutylamoni hydrosulfat 1,0 % đã được chỉnh pH đến 7,5 bằng dung dịch natri hydroxyd loãng (TT). Thêm 10 ml dung dịch natri edetat 0,04 % đã được chỉnh pH đến 7,5 bằng dung dịch natri hydroxyd loãng (TT), pha loãng thành 1000 ml bằng nước. Lọc và đuổi khí trước khi dùng.
Pha động B: Pha tương tự pha động A, thay 30,0 g 2-methyl-2-propanol (TT) bằng 100,0 g 2-methyl-2- propanol (TT).
Pha động được sử dụng theo chương trình dung môi như sau:
| Thời gian (min) | Pha động A (% tt/tt) | Pha động B (% tt/tt) |
| 0 - 15 | 70 | 30 |
| 15 - 30 | 30 | 70 |
| 30 - 45 | 70 | 30 |
Dung dịch thử: Hòa tan 20,0 mg chế phẩm trong dung dịch acid hydroclonc 0,01 M (TT) và pha loãng thành 25,0 ml với cùng dung môi.
Dung dịch đối chiếu (1): Hòa tan 20,0 mg oxytetracyclin chuẩn trong dung dịch acid hydroclonc 0,01 M (TT) và pha loãng thành 25,0 ml với cùng dung môi.
Dung dịch đối chiếu (2): Hòa tan 20,0 mg 4-epioxytetracyclin chuẩn trong dung dịch acid hydrocloric 0,01 M (TT) và pha loãng thành 25,0 ml với cùng dung môi.
Dung dịch đối chiếu (3): Hòa tan 20,0 mg tetracyclin hydroclorid chuẩn trong dung dịch acid hydrocloric 0,01 M (TT) và pha loãng thành 25,0 ml với cùng dung môi.
Dung dịch đối chiếu (4): Hòa tan 8,0 mg α-apo-oxytetracydin chuẩn trong 5 ml dung dịch natri hydroxyd 0,01 M và pha loãng thành 100,0 ml bằng dung dịch acid hydrocloric 0,01 M (TT).
Dung dịch đối chiếu (5): Hòa tan 8,0 mg β-apo-oxytetracyclin chuẩn trong 5 ml dung dịch natri hydroxyd 0,01 M và pha loãng thành 100,0 ml bằng dung dịch acid hydrocloric 0,01 M (TT).
Dung dịch đối chiếu (6): Trộn 1,5 ml dung dịch đối chiếu (1), 1,0 ml dung dịch đổi chiếu (2), 3,0 ml dung dịch đối chiếu (3), 3,0 ml dung dịch đối chiếu (4), 3,0 ml dung dịch đối chiếu (5) và pha loãng thành 25,0 ml bằng dung dịch acid hydrocloric 0,01 M (TT).
Dung dịch đối chiếu (7): Trộn 1,0 ml dung dịch đối chiếu (2), 4,0 ml dung dịch đối chiếu (3), 40,0 ml dung dịch đối chiếu (5) và pha loãng thành 200,0 ml bằng dung dịch acid hydrocloric 0,01 M (TT).
Điều kiện sắc ký:
Cột thép không gỉ (25 cm x 4,6 mm) được nhồi pha tĩnh là styren-divinylbenzen copolymer (8 µm).
Nhiệt độ cột: 60 °C.
Detector quang phổ tử ngoại tại bước sóng 254 nm.
Tốc độ dòng: 1,0 ml/min.
Thể tích tiêm: 20 µl.
Cách tiến hành:
Kiểm tra tính phù hợp của hệ thống: Tiêm dung dịch đối chiếu (6). Độ phân giải giữa pic tạp chất A (pic đầu tiên) và pic oxytetracyclin (pic thứ hai) phải ít nhất bằng 4,0. Độ phân giải giữa oxytetracyclin và pic tạp chất B (pic thứ ba) phải ít nhất bằng 5,0. Độ phân giải giữa pic tạp chất D (pic thứ tư) và pic tạp chất E (pic thứ 5) phải ít nhất bằng 3,5. Nếu cần, điều chỉnh tỷ lệ pha động A và pha động B và/hoặc điều chỉnh chương trình thời gian để đạt được rửa giải một bước. Hệ số đối xứng của pic oxytetracyclin không được lớn hơn 1,25.
Tiêm dung dịch thử và dung dịch đối chiếu (7).
Giới hạn:
Tạp chất A: Trên sắc ký đồ của dung dịch thử, diện tích của pic tạp chất A không được lớn hơn diện tích của pic tương ứng thu được trên sắc ký đồ của dung dịch đối chiếu (7) (0,5 %).
Tạp chất B: Trên sắc ký đồ của dung dịch thử, diện tích của pic tạp chất B không được lớn hơn diện tích của pic tương ứng thu được trên sắc ký đồ của dung dịch đối chiếu (7) (2,0 %).
Tạp chất C: Trên sắc ký đồ của dung dịch thử, tạp chất C rửa giải trên đuôi pic chính và có diện tích không được lớn hơn 4 lần diện tích của pic tạp chất A thu được trên sắc ký đồ của dung dịch đối chiếu (7) (2,0 %). Tổng các tạp chất D, E và F (rửa giải giữa D và E); tổng diện tích các pic tạp chất D, E và F không lớn hơn diện tích của pic tạp chất E thu được trên sắc ký đồ của dung dịch đối chiếu (7) (2,0 %).
Bỏ qua các pic có diện tích pic nhỏ hơn hoặc bằng 0,02 lần diện tích pic oxytetracyclin trên sắc ký đồ của dung dịch đối chiếu (6) (0,1 %).
Ghi chú:
Tạp chất A: 4-epioxytetracyclin(4R,4aR,5S,5aR,6S,12aS)-4-(dimethylamino)-3,5,6,10,12,12a- hexahydroxy-6-methyl-1,11-dioxo-1,4,4a,5,5a,6,11,12a-octahydrotetracen-2-carboxamid),
Tạp chất B: Tetracyclin,
Tạp chất C: 2-acetyl-2-decarbamoyloxytetracyclin (4S,4aR5S,5aR6S,12aS)-2-acetyl-4-(dimethylamino)- 3,5,6,10,12,12a-hexahydroxy-6-methyl-4a, 5a,6,12a-tetrahydrotetracen-1,11 (4H,5H-y)-dion),
Tạp chất D: α-apo-oxytetracyclin (3S,4S,5S)-4-[(1R)-4,5-dihydroxy-9-methyl-3-oxo-1,3-dihydronaphtho [2,3-c]furan-1-yl]-3-(dimethylamino)-2,5-dihydroxy-6-oxocyclohex-1-enecarboxamid),
Tạp chất E: β-apo-oxytetracyclin (3S,4S,5R)-4-[(1R)-4.5-dihydroxy-9-methyl-3-oxo-1,3-dihydronaphtho [2,3-c]furan-1-yl]-3-(dimethylamino)-2,5-dihydroxy-6-oxocyclohex-1-enecarboxamid,
Tạp chất F: anhydro-oxytetracyclin (4S,4aR,5R,12aS)-4-(dimethylamino)-3,5,10,11,12a-pentahydroxy- 6-methyl-1,12-dioxo-1,4,4a,5,12,12a-hexahydrotetracen-2-carboxamid).
Kim loại nặng
Không được quá 50 phần triệu (Phụ lục 9.4.8).
Lấy 0,5 g chế phẩm tiến hành theo phương pháp 6. Dùng 2,5 ml dung dịch chì mẫu 10 phần triệu Pb (TT) để chuẩn bị mẫu đối chiếu.
Nước
Không được quá 2,0 % (Phụ lục 10.3).
Dùng 0,500 g chế phẩm.
Tro sulfat
Không được quá 0,5 % (Phụ lục 9.9, phương pháp 2).
Dùng 1,0 g chế phẩm.
Nội độc tố vi khuẩn
Không được quá 0,4 EU/mg, nếu chế phẩm được dùng để pha chế thuốc tiêm mà không có qui trình loại bỏ nội độc tố thích hợp.
Định lượng
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Điều kiện sắc ký như phần thử tạp chất liên quan.
Tiến hành với dung dịch thử và dung dịch đối chiếu (1). Tính hàm lượng của C22H25ClN2O9 dựa vào diện tích pic chính của dung dịch thử và dung dịch đối chiếu (1).
1 mg Oxytetracyclin tương đương với 1,079 mg Oxytetracyclin hydroclorid.
Bảo quản
Đựng trong đồ bao gói kín, tránh ánh sáng. Nếu chế phẩm vô khuẩn, bảo quản trong bao bì kín, vô khuẩn.
Loại thuốc
Kháng sinh.
Chế phẩm
Viên nén.
SULBACTAM NATRI
Sulbactamum Natricum

Sulbactam natri là natri (2S,5R)-3,3-dimethyl-7-oxo-4-thia-1-azabicyclo[3.2.0]heptan-2-carboxylat 4,4- dioxyd, được bán tổng hợp từ một sản phẩm lên men, phải chứa từ 97,0 % đến 102,0 % C8H10NNaO5S, tính theo chế phẩm khan.
Tính chất
Bột kết tinh trắng hoặc gần như trắng, hút ẩm.
Dễ tan trong nước, hơi tan trong ethyl acetat, rất khó tan trong ethanol 96 %. Dễ tan trong acid loãng.
Định tính
A. Phổ hồng ngoại (Phụ lục 4.2) của chế phẩm phải phù hợp với phổ hồng ngoại đối chiếu của sulbactam natri hoặc phổ hồng ngoại của sulbactam natri chuẩn.
B. Chế phẩm phải cho phản ứng định tính của muối natri (Phụ lục 8.1).
Độ trong của dung dịch
Hòa tan 2,0 g chế phẩm trong nước và pha loãng thành 20 ml với cùng dung môi. Dung dịch thu được phải trong (Phụ lục 9.2).
Độ hấp thụ ánh sáng
Hòa tan 1,0 g chế phẩm trong nước và pha loãng thành 100,0 ml với cùng dung môi. Đo độ hấp thụ (Phụ lục 4.1) của dung dịch thu được ở bước sóng 430 nm. Độ hấp thụ đo được không được lớn hơn 0,10.
pH
Hòa tan 1,0 g chế phẩm trong nước không có carbon dioxyd (TT) dung dịch thu được phải có pH (Phụ lục 6.2) từ 4,5 đến 7,2. Với chế phẩm vô khuẩn, pH của dung dịch thu được phải từ 5,2 đến 7,2.
Góc quay cực riêng
Từ +219° đến + 233°, tính theo chế phẩm khan (Phụ lục 6.4).
Hòa tan 0,50 g chế phẩm trong nước, pha loãng thành 50,0 ml với cùng dung môi.
Tạp chất liên quan
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động: Sử dụng hỗn hợp pha động A và pha động B theo chương trình mô tả trong Bảng 1.
Pha động A: Điều chỉnh pH dung dịch kali dihydrophosphat 5,44 g/l tới 4,0 bằng acidphosphoric loãng (TT).
Pha động B: Acetonitril (TT).
Bảng 1 - Chương trình pha động
| Thời gian | Pha động A | Pha động B |
| (min) | (% tt/tt) | (% tt/tt) |
| 0 - 7,5 | 9 8 → 5 0 | 2 → 50 |
| 7,5-8,5 | 50 | 50 |
| 8,5-90 | 50 → 98 | 50 → 2 |
| 9,0-12,5 | 98 | 2 |
Dung dịch A: Điều chỉnh pH dung dịch kali dihydrophosphat 2,72 g/l tới pH 4,0 bằng acid phosphoric loãng (TT).
Dung dịch B: Pha loãng 2 ml acetonitril dùng cho sắc ký lỏng (TT) thành 100,0 ml bằng dung dịch A. Dung dịch thử: Phân tán 77,0 mg chế phẩm trong 2 ml acetonitril dùng cho sắc ký lỏng (TT) và lắc siêu âm trong khoảng 5 min. Pha loãng thành 100,0 ml với dung dịch A.
Dung dịch đối chiếu (1): Phân tán 70,0 mg sulbactam chuẩn trong 2 ml acetonitril dùng cho sắc ký lỏng (TT) và lắc siêu âm trong khoảng 5 min. Pha loãng thành 100,0 ml với dung dịch A.
Dung dịch đối chiếu (2): Pha loãng 1,0 ml dung dịch đối chiếu (1) thành 100,0 ml với dung dịch B. Pha loãng 1,0 ml dung dịch này thành 10,0 ml với dung dịch B.
Dung dịch đối chiếu (3): Hòa tan 15,0 mg acid 6-aminopenicilanic chuẩn trong dung dịch A và pha loãng thành 50,0 ml với dung dịch A.
Dung dịch phân giải: Trộn 1 ml dung dịch đối chiếu (1) với 1 ml dung dịch đổi chiếu (3) rồi pha loãng thành 25,0 ml với dung dịch B.
Dung dịch đối chiếu (4): Hòa tan 8 mg sulbactam chuẩn dùng cho định tính pic (bao gồm các tạp chất A, C, D, E và F) trong 1 ml acetonltril dùng cho sắc ký lỏng (TT), lắc siêu âm trong khoảng 5 min và pha loãng thành 10,0 ml với dung dịch B.
Điều kiện sắc ký:
Cột thép không gỉ (10 cm x 4 mm), được nhồi pha tĩnh C (5 đến 10 pm).
Nhiệt độ cột: 40 °C.
Detector quang phổ tử ngoại đặt tại bước sóng 215 nm.
Tốc độ dòng: 1,0 ml/min.
Thể tích tiêm: 20 µl.
Cách tiến hành:
Tiêm các dung dịch thử, dung dịch B, dung dịch đối chiếu (2), dung dịch phân giải và dung dịch đối chiếu (4).
Thời gian lưu tương đối của các pic tạp so với sulbactam (thời gian lưu khoảng 2,5 min) như sau: tạp chất A khoảng 0,4; tạp chất B khoảng 0,6; tạp chất C khoảng 1,6; tạp chất D khoảng 2,0; tạp chất E khoảng 2,1; tạp chất F khoảng 2,5.
Định tính các tạp chất: sử dụng sắc đồ đối chiếu đi kèm với sulactam chuẩn dùng cho định tính pic và sắc đồ thu được từ dung dịch đổi chiếu (4) để xác định các pic tạp chất A, C, D, E và F.
Kiểm tra tính phù hợp của hệ thống: Trên sắc ký đồ của dung dịch phân giải, độ phân giải giữa pic tạp chất B (acid 6-aminopenicilanic) và sulbactam tối thiểu là 7,0.
Giới hạn:
- Hệ số hiệu chỉnh: Để tính hàm lượng, nhân diện tích pic của các tạp chất sau với các hệ số hiệu chỉnh tương ứng: tạp chất A bằng 0,6; tạp chất B bằng 0,5; tạp chất D bằng 0,5; tạp chất F bằng 0,6;
- Tạp chất A: Không được lớn hơn 5 lần diện tích pic chính trên sắc ký đồ thu được từ dung dịch đối chiếu (2) (0,5%).
- Tạp chất B, D, F: Với mỗi tạp chất, diện tích pic không được lớn hơn diện tích pic chính trên sắc ký đồ thu được từ dung dịch đối chiếu (2) (0,1%).
- Tạp chất C, E: Với mỗi tạp chất, diện tích pic không lớn hơn hai lần diện tích pic chính trên sắc ký đồ thu được từ dung dịch đối chiếu (2) (0,2%).
- Tạp chất chưa định danh: Với mỗi tạp chất, diện tích pic không được lớn hơn diện tích pic chính trên sắc ký đồ thu được từ dung dịch đối chiếu (2) (0,1%).
- Tổng lượng tạp chất: Không được lớn hơn 10 lần diện tích pic chính trên sắc ký đồ thu được từ dung dịch đối chiếu (2) (1,0%).
- Bỏ qua các pic có diện tích bằng và nhỏ hơn 0,5 lần diện tích pic chính trên sắc ký đồ thu được từ dung dịch đối chiếu (2) (0,05%).
Ghi chú:
Tạp chất A: Acid (2S)-2-amino-3-methyl-3-sulphinobutanoic,
Tạp chất B: Acid (2S,5R,6R)-6-amino-3,3-dimethyl-7-oxo-4-thia-1-azabicyclo[3.2.0]heptan-2-carboxylic (acid 6-aminopenicilanic),
Tạp chất C: Acid (2S,5R,6R)-6-bromo-3,3-dimethyl-7-oxo-4-thia-1-azabicyclo[3.2.0]heptan-2-carboxylic 4.4- dioxyd (acid 6-bromopenlcllanic sulphon),
Tạp chất D: Acid (2S,5R,6R)-6-bromo-3,3-dimethyl-7-oxo-4-thia-1-azabicyclo[3.2.0]heptan-2-carboxylic (acid 6-bromopenicilanic),
Tạp chất E: Acid (2S,5R)-6,6-dibromo-3,3-dimethyl-7-oxo-4-thia-1-azabicyclo[3.2.0]heptan-2-carboxylic 4.4- dioxyd (acid 6,6-dibromopenicilanic sulphon),
Tạp chất F: Acid (2S,5R)-6,6-dibromo-3,3-dimethyl-7-oxo-4-thia-1-azabicyclo[3.2.0]heptan-2-carboxylic (acid 6,6-dibromopenicilanic).
Acid 2-ethylhexanoic
Không được quá 0,5 % (Phụ lục 10.17).
Kim loại nặng
Không được quá 20 phần triệu (Phụ lục 9.4.8).
Hòa tan 1,0 g chế phẩm trong nước và pha loãng thành 20 ml với cùng dung môi. Lấy 12 ml dung dịch này tiến hành thử theo phương pháp 1. Dùng 10,0 ml dung dịch chì mẫu 2 phần triệu Pb (TT) để chuẩn bị mẫu đối chiếu.
Nước
Không được quá 1,0 % (Phụ lục 10.3).
Dùng 1,00 g chế phẩm.
Nội độc tố vi khuẩn
Không được quá 0,17 EU/mg (Phụ lục 13.2, phương pháp tạo gel).
Nếu chế phẩm được dùng để sản xuất thuốc tiêm mà không có qui trình thích hợp để loại bỏ nội độc tố thì phải đáp ứng phép thử này.
Định lượng
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động, điều kiện sắc ký, chuẩn bị các dung dịch như mô tả trong mục thử Tạp chất liên quan.
Cách tiến hành: Tiêm dung dịch thử và dung dịch đối chiếu (1).
Dựa vào diện tích pic thu được từ dung dịch thử và dung dịch đối chiếu (1) và hàm lượng C8H11NO5S của sulbactam chuẩn, tính hàm lượng sulbactam có trong chế phẩm.
Tính hàm lượng phần trăm sulbactam natri bằng hàm lượng sulbactam nhân với 1,094.
Bảo quản
Trong bao bì kín. Nếu chế phẩm vô khuẩn, bảo quản trong bao bì tiệt trùng, kín, tránh nhiễm khuẩn.
Loại thuốc
Kháng sinh.
Chế phẩm
Bột pha tiêm
TRIAMCINOLON ACETONID
Triamcinoloni acetonidum
Triamcinolon acetonid là 9-fluoro-11β,21-dihydroxy-16α,17-(1-methylethylidendioxy) pregna-1,4-dien-3,20-dion, phải chứa từ 97,0 % đến 103,0 % C24H31FO6, tính theo chế phẩm khan.
Tính chất
Bột kết tinh trắng hay gần như trắng, đa hình.
Thực tế không tan trong nước, hơi tan trong ethanol 96 %.
Định tính
Có thể chọn một trong 2 nhóm định tính sau:
Nhóm I: A, B
Nhóm II: C, D
A. Phổ hồng ngoại (Phụ lục 4.2) của chế phẩm phải phù hợp với phổ hồng ngoại của triamcinolon acetonid chuẩn. Nếu phổ hồng ngoại của mẫu thử và mẫu chuẩn ở trạng thái rắn khác nhau thì hoà tan riêng biệt chế phẩm và triamcinolon acetonid chuẩn trong một lượng tối thiểu methanol (TT), bốc hơi đến khô. Ghi phổ mới các cắn thu được bằng cách tạo đĩa với muối halogen hoặc tạo bột nhão với paratin lỏng (TT).
B. Phương pháp sắc ký lớp mỏng (Phụ lục 5.4).
Chuẩn bị các dung dịch ngay trước khi dùng và tránh ánh sáng.
Bản mỏng: Silica gel F254.
Dung môi khai triển: Trộn hỗn hợp gồm 1,2 thể tích nước và 8 thể tích methanol (TT) với hỗn hợp gồm 15 thể tích ether (TT) và 77 thể tích methylen clorid (TT).
Dung dịch thử: Hoà tan 10 mg chế phẩm trong methanol (TT) và pha loãng thành 10 ml với cùng dung môi.
Dung dịch đối chiếu (1): Hoà tan 20 mg triamcinolon acetonid chuẩn trong methanol (TT) và pha loãng thành 20 ml với cùng dung môi.
Dung dịch đối chiếu (2): Hoà tan 10 mg triamcinolon hexacetonid chuẩn trong dung dịch đối chiếu (1) và pha loãng thành 10 ml với dung dịch đối chiếu (1).
Cách tiến hành:
Chấm riêng biệt lên bản mỏng 5 µl mỗi dung dịch trên. Triển khai sắc ký đến khi dung môi đi được 15 cm. Để bản mỏng khô ngoài không khí và quan sát ngay dưới ánh sáng tử ngoại ở bước sóng 254 nm. Vết chính trên sắc ký đồ của dung dịch thử phải tương ứng về vị trí, kích thước với vết chính trên sắc ký đồ của dung dịch đối chiếu (1). Phép thử chỉ có giá trị khi trên sắc ký đồ của dung dịch đối chiếu (2) cho 2 vết tách rõ ràng.
C. Phương pháp sắc ký lớp mỏng (Phụ lục 5.4).
Chuẩn bị các dung dịch ngay trước khi dùng và tránh ánh sáng.
Bản mỏng: Silica gel F254.
Dung môi khai triển: Trộn hỗn hợp gồm 1,2 thể tích nước và 8 thể tích methanol (TT) với hỗn hợp gồm 15 thể tích ether (TT) và 77 thể tích methylen clorid (TT).
Dung dịch thử (1): Hoà tan 10 mg chế phẩm trong methanol (TT) và pha loãng thành 10 ml với cùng dung môi.
Dung dịch thử (2): Trong một bình gạn, hoà tan 10 mg chế phẩm trong 1,5 ml acid acetic băng (TT), thêm 0,5 ml dung dịch crom trioxyd (TT) 2 % và để yên 60 min. Thêm 5 ml nước, 2 ml methylen clorid (TT), lắc mạnh trong 2 min. Để cho tách lớp và sử dụng lớp dưới.
Dung dịch đối chiếu (1): Hoà tan 10 mg triamcinolon acetonid chuẩn trong methanol (TT) và pha loãng thành 10 ml với cùng dung môi.
Dung dịch đối chiếu (2): Trong một bình gạn, hoà tan 10 mg triamcinolon acetonid chuẩn trong 1,5 ml acid acetic băng (TT), thêm 0,5 ml dung dịch crom trioxyd (TT) 2 % và để yên 60 min. Thêm 5 ml nước, 2 ml methylen dorid (TT), lắc mạnh trong 2 min. Để cho tách lớp và sử dụng lớp dưới.
Cách tiến hành:
Chấm riêng biệt lên bản mỏng 5 µl mỗi dung dịch trên. Triển khai sắc ký đến khi dung môi đi được 15 cm. Để bản mỏng khô ngoài không khí và quan sát ngay dưới ánh sáng tử ngoại ở bước sóng 254 nm. vết chính trên sắc ký đồ của dung dịch thử phải tương ứng về vị trí, kích thước với vết chính trên sắc ký đồ của dung dịch đối chiếu tương ứng. Vết chính trên sắc ký đồ của dung dịch thử (2) và dung dịch đối chiếu (2) có giá trị Rf cao hơn rõ rệt so với giá trị Rf của vết chính trên sắc ký đồ của dung dịch thử (1) và dung dịch đối chiếu (1).
D. Trộn khoảng 5 mg chế phim với 45 mg magnesi oxyd nặng (TT) và nung trong chén nung đến khi thu được cắn gần như trắng (thường ít hơn 5 min). Để nguội, thêm 1 ml nước, 0,05 ml dung dịch phenolphtalein (TT) và khoảng 1 ml dung dịch acid hydrocloric loãng (TT) để làm cho dung dịch mất màu. Lọc. Thêm 1,0 ml dịch lọc vào một hỗn hợp mới pha gồm 0,1 ml dung dịch alizarin S (TT) và 0,1 ml dung dịch zirconyl nitrat (TT). Trộn đều, để yên 5 min và so sánh màu của dung dịch thu được với màu của mẫu trắng được chuẩn bị trong cùng điều kiện. Dung dịch thử có màu vàng và dung dịch mẫu trắng có màu đỏ.
Góc quay cực riêng
Từ +100° đến +107°, tính theo chế phẩm khan (Phụ lục 6.4).
Hoà tan 0,100 g chế phẩm trong dioxan (TT) và pha loãng thành 10,0 ml với cùng dung môi.
Tạp chất liên quan
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Quá trình thử được tiến hành tránh ánh sáng.
Pha động: Trong một bình định mức dung tích 1000 ml, trộn 525 ml methanol (TT) với 400 ml nước và để cân bằng, điều chỉnh thể tích đến 1000 ml bằng nước, trộn đều.
Dung dịch thử: Hoà tan 25,0 mg chế phẩm trong 7 ml methanol (TT) và pha loãng thành 10,0 ml với nước.
Dung dịch đối chiếu (1): Hoà tan 2 mg triamcinolon acetonid chuẩn và 2 mg triamcinolon (tạp chất A) trong pha động và pha loãng thành 100,0 ml với cùng pha động
Dung dịch đối chiếu (2): Pha loãng 1,0 ml dung dịch thử thành 100,0 ml với pha động.
Điều kiện sắc ký:
Cột thép không gỉ (25 cm x 4,6 mm) được nhồi pha tĩnh C (5 µm).
Tốc độ dòng: 1,5 ml/min.
Detector quang phổ tử ngoại ở bước sóng 254 nm.
Thể tích tiêm: 20 µl.
Cách tiến hành:
Cân bằng cột với pha động trong khoảng 10 min.
Tiêm dung dịch đối chiếu (1). Thời gian lưu của triamcinolon khoảng 5 min và triamcinolon acetonid khoảng 17 min. Phép thử chỉ có giá trị khi độ phân giải giữa các pic tương ứng với triamcinolon và triamcinolon acetonid không nhỏ hơn 15; nếu cần điều chỉnh nồng độ methanol trong pha động.
Tiêm lần lượt dung dịch thử và dung dịch đối chiếu (2). Tiến hành sắc ký với thời gian gấp 3,5 lần thời gian lưu của triamcinolon acetonid.
Trên sắc ký đồ thu được của dung dịch thử: Diện tích của pic tương ứng với pic triamcinolon (tạp chất A) không được lớn hơn 0,25 lần diện tích pic chính trên sắc ký đồ thu được của dung dịch đối chiếu (2) (0,25 %). Tổng diện tích các pic, ngoài pic chính không được lớn hơn 0,5 lần diện tích của pic chính trên sắc ký đồ thu được từ dung dịch đối chiếu (2) (0,5 %). Bỏ qua các pic có diện tích nhỏ hơn 0,05 lần diện tích của pic chính trên sắc ký đồ thu được từ dung dịch đối chiếu (2) (0,05 %).
Nước
Không được quá 2,0 % (Phụ lục 10.3).
Dùng 0,500 g chế phẩm.
Định lượng
Chú ý tránh ánh sáng trong quá trình định lượng.
Hoà tan 50,0 mg chế phẩm trong ethanol 96 % (TT) và pha loãng thành 50,0 ml với cùng dung môi. Pha loãng 2,0 ml dung dịch này thành 100,0 ml với ethanol 96 % (TT). Đo độ hấp thụ (Phụ lục 4.1) của dung dịch thu được ở bước sóng cực đại 238,5 nm. Tính hàm lượng triamcinolon acetonid, C24H31FO6, theo A (1 %, 1 cm). Lấy 355 là giá trị A (1 %, 1 cm) ở bước sóng 238,5 nm.
Bảo quản
Trong bao bì kín, tránh ánh sáng.
Loại thuốc
Glucocorticoid.
Chế phẩm
Kem bôi da.
TRIMETAZIDIN HYDROCLORID
Trimetazidini hydrochloridum

Trimetazidin hydroclorid là 1-(2,3,4-trimethoxybenzyl)piperazin dihydroclorid, phải chửa từ 98,5 % đến 101,5 % C14H22N2O3.2HCl, tính theo chất đã làm khô.
Tính chất
Bột kết tinh màu trắng hay gần như trắng, hút ẩm nhẹ.
Dễ tan trong nước, hơi tan trong ethanol 96 %.
Định tính
A. Phổ hồng ngoại (Phụ lục 4.2) của chế phẩm phải phù hợp với phổ hồng ngoại đối chiếu của trimetazidin dihydroclorid.
B. Hòa tan 25 mg chế phẩm trong 5 ml nước. 2 ml dung dịch này cho phản ứng (A) của clorid (Phụ lục 8.1).
Độ trong và màu sắc của dung dịch
Hòa tan 1,0 g chế phẩm trong nước và pha loãng thành 10 ml với cùng dung môi.
Dung dịch thu được phải trong (Phụ lục 9.2) và có màu không được đậm màu hơn màu mẫu VN6 (Phụ lục 9.3, phương pháp 2).
Tạp chất liên quan
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động:
Pha động A: Methanol - dung dịch natri heptansulphonat 2,87 g/I được chỉnh đến pH 3,0 bằng dung dịch acid phosphoric 25 % (357 : 643).
Pha động B: Methanol.
Chạy sắc ký với chương trình pha động như sau:
| Thời gian (min) | Pha động A (% tt/tt) | Pha động B (% tt/tt) |
| 0 - 50 | 95 → 75 | 5 → 25 |
| 50 - 52 | 75 → 95 | 25 → 5 |
Dung dịch thử: Hòa tan 0,200 g chế phẩm trong nước và pha loãng thành 50,0 ml với cùng dung môi.
Dung dịch đối chiếu (1): Hòa tan 20,0 mg trimetazidin chuẩn dùng cho thử tính phù hợp của hệ thống trong nước và pha loãng tới 5,0 ml với cùng dung môi.
Dung dịch đối chiếu (2): Pha loãng 2,0 ml dung dịch thử thành 100,0 ml với nước. Pha loãng 5,0 ml dung dịch này thành 100,0 ml với cùng dung môi.
Dung dịch đối chiếu (3): Pha loãng 25,0 ml dung dịch đối chiếu (2) thành 50,0 ml bằng nước.
Điều kiện sắc ký:
Cột thép không gỉ (15 cm x 4,6 mm) được nhồi pha tĩnh là các hạt octadecylsilyl silica gel hình cầu dùng cho sắc ký (5 µm).
Nhiệt độ cột: 30 °C.
Detector quang phổ tử ngoại đặt ở bước sóng 240 nm.
Tốc độ dòng: 1,2 ml/min.
Thể tích tiêm: 10 µl.
Cách tiến hành:
Cân bằng cột với pha động có thành phần ban đầu trong thời gian ít nhất 1 h.
Tiêm mẫu trắng, dung dịch thử và dung dịch đối chiếu (1), (2) và (3).
Thời gian lưu tương đối so với trimetazidin (thời gian lưu khoảng 25 min) của tạp chất D khoảng 0,2; tạp chất C khoảng 0,4; tạp chất H khoảng 0,6; tạp chất A và tạp chất I khoảng 0,9; tạp chất E khoảng 0,95; tạp chất F khoảng 1,4; tạp chất B khoảng 1,8.
Tính phù hợp của hệ thống:
Tỷ số đỉnh - hõm; ít nhất bằng 3,0. Trong đó HP là chiều cao của pic tạp chất E so với đường nền; HV là chiều cao so với đường nền của điểm thấp nhất của đường cong phân tách giữa pic tạp chất E khỏi pic chính thu được trên sắc ký đồ dung dịch đối chiếu (1).
Tỷ số tín hiệu - nhiễu; Phép thử chỉ có giá trị khi pic chính trên sắc ký đồ thu được từ dung dịch đối chiếu (3) có giá trị tỉ số giữa tín hiệu và nhiễu đường nền ít nhất là 10.
Giới hạn:
Hệ số hiệu chỉnh: Để tính toán hàm lượng các tạp chất, nhân diện tích pic của các tạp chất sau với hệ số hiệu chỉnh tương ứng. Tạp chất B có hệ số hiệu chỉnh bằng 0,55; tạp chất C có hệ số hiệu chỉnh bằng 0,37; Tạp chất F có hệ số hiệu chỉnh bằng 0,71
Từng tạp chất A, B, C, D, E, F, H, I, mỗi tạp có diện tích pic không được lớn hơn diện tích pic chính trên sắc ký đồ thu được của dung dịch đối chiếu (2) (0,1 %).
Từng tạp chất khác, mỗi tạp có diện tích pic không được lớn hơn diện tích pic chính trên sắc ký đồ thu được của dung dịch đối chiếu (2) (0,1 %).
Tổng diện tích các pic tạp chất không được lớn hơn 2 lần diện tích pic chính trên sắc ký đồ thu được của dung dịch đối chiếu (2) (0,2 %).
Bỏ qua các pic có diện tích nhỏ hơn diện tích pic chính trên sắc ký đồ thu được của dung dịch đối chiếu (3) (0,05 %).
Ghi chú:
Tạp chất A: 1-(3,4,5-trimethoxybenzyl)piperazin,
Tạp chất E: 1-(2,4,5-trimethoxybenzyl)piperazin,
Tạp chất F: 1-(2,4,6-trimethoxybenzyl)piperazin,
Tạp chất B: 1,4-bis(2,3,4-trimethoxybenzyl)piperazin,
Tạp chất C: 2,3,4-trimethoxybenzaldehyd,
Tạp chất D: (2,3,4-trimethoxyphenyl)methanol,
Tạp chất G: Piperazin,
Tạp chất H: Ethyl 4-(2,3,4-trimethoxybenzyl)piperazin-1-carboxylat,
Tạp chất I: 1-methyl-4-(2,3,4-trimethoxybenzyl)piperazin (N-methyltrimetazidin).
Piperazin (tạp chất G)
Không được quá 0,1 % (tính theo piperazin khan).
Phương pháp sắc ký lớp mỏng (Phụ lục 5.4).
Bản mỏng: Silica gel G.
Dung môi khai triển: Amoniac - ethanol 96 % (20 : 80).
Dung dịch thử: Hoà tan 0,10 g chế phẩm trong methanol (TT) và pha loãng thành 10 ml với cùng dung môi. Dung dịch đối chiếu: Hoà tan 22,6 mg piperazin hydrat (TT) trong methanol (TT) và pha loãng thành 100 ml với cùng dung môi. Pha loãng 10 ml dung dịch này thành 100 ml với methanol (TT).
Cách tiến hành: Chấm riêng biệt lên bản mỏng 10 µl mỗi dung dịch trên. Triển khai sắc ký đến khi dung môi đi được khoảng 2/3 bản mỏng. Lấy bản sắc ký ra và sấy khô bản mỏng ở 100 °C đến 105 °C trong 30 min. Phun thuốc thử iodoplatinat (TT).
Trên sắc ký đồ của dung dịch thử, vết tương ứng với piperazin không được đậm hơn vết chính thu được trên sắc ký đồ của dung dịch đối chiếu.
Mất khối lượng do làm khô
Không được quá 2,5 % (Phụ lục 9.6).
(1,000 g, 105 °C, phosphor pentoxyd, áp suất không quá 15 kPa).
Tro sulfat
Không được quá 0,1 % (Phụ lục 9.9, phương pháp 2).
Dùng 1,0 g chế phẩm.
Định lượng
Hòa tan 0,120 g chế phẩm trong 50 ml nước. Thêm 1 ml acid nitric (TT) và chuẩn độ bằng dung dịch bạc nitrat 0,1 N (CĐ), xác định điểm kết thúc bằng phương pháp chuẩn độ đo điện thế (Phụ lục 10.2).
1 ml dung dịch bạc nitrat 0,1 N (CĐ) tương đương với 16,96 mg C14H22N2O3.2HCl
Bảo quản
Đựng trong bao bì kín.
Loại thuốc
Thuốc giãn mạch.
Chế phẩm
Viên nén.
VERAPAMIL HYDROCLORID
Verapamili hydrochloridum
Verapamil hydroclorid là (2RS)-2-(3,4-dimethoxyphenyl)-5-[[2-(3,4-dimethoxyphenyl)ethyl](methyl) amino]-2-(1-methylethyl)pentannitril hydroclorid, phải chứa từ 99,0 % đến 101,0 % C27H38N2O4.HCl, tính theo chế phẩm đã làm khô.
Tính chất
Bột kết tinh màu trắng hay gần như trắng.
Tan trong nước, dễ tan trong methanol, hơi tan trong ethanol 96 %.
Nhiệt độ nóng chảy khoảng 144 °C.
Định tính
Có thể chọn một trong hai nhóm định tính sau:
Nhóm I: A, D
Nhóm II: B, C, D
A. Phổ hồng ngoại (Phụ lục 4.2) của chế phẩm phải phù hợp với phổ hồng ngoại của verapamil hydroclorid chuẩn. Chuẩn bị mẫu đo dưới dạng đĩa nén.
B. Phổ tử ngoại (Phụ lục 4.1)
Hòa tan 20,0 mg chế phẩm trong dung dịch acid hydrocloric 0,01 M và pha loãng thành 100,0 ml với cùng dung dịch acid. Pha loãng 5,0 ml dung dịch này thành 50,0 ml bằng dung dịch acid hydrocloric 0,01 M. Đo phổ hấp thụ tử ngoại trong khoảng từ 210 nm đến 340 nm, dung dịch phải cho hai cực đại hấp thụ ở 229 nm và 278 nm và vai hấp thụ ở 282 nm. Tỷ lệ độ hấp thụ ở hai bước sóng cực đại (A278/A229) phải từ 0,35 đến 0,39.
C. Phương pháp sắc ký lớp mỏng (Phụ lục 5.4).
Bản mỏng: Silica gel F254.
Dung môi khai triển: Diethylamin - cyclohexan (15 : 85)
Dung dịch thử: Hòa tan 10 mg chế phẩm trong methylen clorid (TT) và pha loãng thành 5 ml với cùng dung môi.
Dung dịch đối chiếu (1): Hòa tan 20 mg verapamil hydroclorid chuẩn trong methylen clorid (TT) và pha loãng thành 10 ml với cùng dung môi.
Dung dịch đối chiếu (2): Hòa tan 5 mg papaverin hydroclorid chuẩn trong dung dịch đối chiếu (1) và pha loãng thành 5 ml với dung dịch đối chiếu (1).
Cách tiến hành: Chấm riêng biệt lên bản mỏng 5 µl các dung dịch thử, dung dịch đối chiếu (1) và dung dịch đối chiếu (2). Triển khai sắc ký đến khi dung môi đi được 15 cm, lấy bản sắc ký ra và để khô ngoài không khí. Kiểm tra dưới ánh sáng đèn tử ngoại ở bước sóng 254 nm. Vết chính thu được trên sắc ký đồ của dung dịch thử phải phù hợp với vết chính trên sắc ký đồ của dung dịch đối chiếu (1) về vị trí và kích thước. Phép thử chỉ có giá trị khi trên sắc ký đồ của dung dịch đối chiếu (2) cho 2 vết tách rõ ràng.
D. Chế phẩm phải cho phản ứng (B) của clorid (Phụ lục 8.1).
Độ trong và màu sắc của dung dịch
Dung dịch S: Hòa tan bằng cách đun nóng nhẹ 1,0 g chế phẩm trong nước không có carbon dioxyd (TT) và pha loãng thành 20,0 ml với cùng dung môi.
Dung dịch S phải trong (Phụ lục 9.2) và không màu (Phụ lục 9.3, phương pháp 2).
pH
Từ 4,5 đến 6,0 (Phụ lục 6.2).
Xác định trên dung dịch S.
Góc quay cực
Góc quay cực (Phụ lục 6.4) của dung dịch S từ -0,10° đến +0,10°.
Tạp chất liên quan
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động A: Hòa tan 6,97 g dikali hydrophosphat (TT) trong 1000 ml nước, điều chỉnh pH tới 7,2 bằng acid phosphoric (TT).
Pha động B: Acetonitril (TT).
Dung môi pha mẫu: Hỗn hợp pha động A - pha động B (63 : 37)
Dung dịch thử: Hòa tan 25,0 mg chế phẩm trong dung môi pha mẫu và pha loãng thành 10,0 ml với cùng dung môi.
Dung dịch đối chiếu (1): Hòa tan 5 mg verapamil hydroclorid chuẩn, 5 mg tạp chất I chuẩn của verapamil và 5 mg tạp chất M chuẩn của verapamil trong dung môi pha mẫu và pha loãng thành 20 ml với cùng dung môi. Pha loãng 1 ml dung dịch này thành 10 ml với dung môi pha mẫu.
Dung dịch đối chiếu (2): Pha loãng 1,0 ml dung dịch thử thành 100,0 ml với dung môi pha mẫu. Pha loãng 1,0 ml dung dịch này thành 10,0 ml với dung môi pha mẫu.
Điều kiện sắc ký:
Cột thép không gỉ (25 cm x 4,6 mm) được nhồi end-capped palmitamidopropylsilyl silica gel dùng cho sắc ký (5 µm).
Tốc độ dòng: 1,5 ml/min.
Detector quang phổ tử ngoại đặt ở bước sóng 278 nm.
Thể tích tiêm: 10 µl.
Cách tiến hành:
Cân bằng cột bằng hỗn hợp pha động A - pha động B (63 : 37) trong khoảng 60 min.
Tiến hành sắc ký với chương trình dung môi như sau:
| Thời gian (min) | Pha động A (% t/tt) | Pha động B (% tt/tt) |
| 0 - 22 | 63 | 37 |
| 22 - 27 | 63 → 35 | 37 → 65 |
| 27 - 35 | 35 | 65 |
| 35 - 36 | 35 → 63 | 65 → 37 |
| 36 - 50 | 63 | 37 |
Trên sắc ký đồ của dung dịch đối chiếu (1), thời gian lưu của verapamil khoảng 16 min, của tạp chất I khoảng 21 min và tạp chất M khoảng 32 min (gấp đôi thời gian lưu của verapamil).
Kiểm tra tính phù hợp của hệ thống: Trên sắc ký đồ của dung dịch đối chiếu (1), độ phân giải giữa hai pic verapamil và tạp chất I không được nhỏ hơn 5,0 và tạp chất M phải được rửa giải ra khỏi cột sắc ký.
Tiến hành sắc ký lần lượt với mẫu trắng là hỗn hợp pha động A - pha động B (63 : 37), dung dịch đối chiếu (2) và dung dịch thử.
Trên sắc ký đồ thu được từ dung dịch thử, diện tích của bất kỳ pic nào khác với pic chính và khác với các pic thu được trên sắc ký đồ của mẫu trắng không được lớn hơn diện tích của pic chính trên sắc ký đồ thu được từ dung dịch đối chiếu (2) (0,1 %); tổng diện tích các pic này không được lớn hơn 3 lần diện tích pic chính trên sắc ký đồ thu được từ dung dịch đối chiếu (2) (0,3 %); bỏ qua các pic có diện tích nhỏ hơn 0,1 lần diện tích của pic chính trên sắc ký đồ thu được từ dung dịch đối chiếu (2) (0,01 %).
Kim loại nặng
Không được quá 10 phần triệu (Phụ lục 9.4.8).
Lấy 1,0 g chế phẩm tiến hành theo phương pháp 3. Dùng 1 ml dung dịch chì mẫu 10 phần triệu Pb (TT) để chuẩn bị mẫu đối chiếu.
Mất khối lượng do làm khô
Không được quá 0,5 % (Phụ lục 9.6).
(1,000 g, 105 °C).
Tro sulfat
Không được quá 0,1 % (Phụ lục 9.9, phương pháp 2).
Dùng 1,0 g chế phẩm.
Định lượng
Hòa tan 0,400 g chế phẩm trong 50 ml ethanol (TT), thêm 5,0 ml dung dịch acid hydroclonc 0,01 M. Chuẩn độ bằng dung dịch natri hydroxyd 0,1 N (CĐ). Xác định điểm kết thúc bằng phương pháp chuẩn độ đo điện thế (Phụ lục 10.2). Đọc thể tích dung dịch natri hydroxyd 0,1 N (CĐ) tiêu thụ giữa hai điểm uốn của đường chuẩn độ.
1 ml dung dịch natri hydroxyd 0,1 N (CĐ) tương đương với 49,11 mg C27H38N2O4.HCl.
Bảo quản
Tránh ánh sáng.
Loại thuốc
Chẹn kênh calci, có tác dụng chống loạn nhịp, đau thắt ngực, điều trị tăng huyết áp.
Chế phẩm
Viên nén.
Mục lục
Lời nói đầu
Lời giới thiệu
1 Phạm vi áp dụng
2 Tài liệu viện dẫn
3 Các tiêu chuẩn
Phần 1: Phương pháp kiểm nghiệm thuốc và chuyên mục
Phụ lục 15
Phụ lục 15.42 Xác định hàm lượng sacharid tổng số bằng phương pháp orcinol
Phụ lục 15.43 Qui trình thử nghiệm công hiệu (in vivo) của vắc xin viêm gan B tái tổ hợp
Bảng liên hệ giữa phần trăm ethanol theo thể tích, phần trăm ethanol theo khối lượng, khối lượng riêng của hỗn hợp ethanol và nước
Phần 2: Nguyên liệu hóa dược
Amiodaron hydroclorid
Carbidopa
Ceftazidim pentahydrat
Fexofenadin hydroclorid
Loratadin
Magnesi lactat dihydrat
Metoclopramid hydroclorid
Niclosamid khan
Oxytetracyclin hydroclorid
Sulbactam natri
Triamcinolon acetonid
Trimetazidin hydroclorid
Verapamil hydroclorid
Phần 3: Thành phầm hóa dược
Kem triamcinolon
Thuốc tiêm ampicilin và sulbactam
Thuốc tiêm diazepam
Thuốc tiêm metoclopramid
Viên nén amiodaron
Viên nén diphenhydramin
Viên nén fexofenadin
Viên nén loratadin
Viên nén metformin và glibenclamid
Viên nén metoclopramid
Viên nén paracetamol và ibuprofen
Viên nén trimetazidin
Phần 4: Dược liệu
Bèo tấm
Bồ kết (Quả)
Cao đặc đinh lăng
Cao khô lá bạch quả
Cao khô chè dây
Cò mần trầu
Lộc giác
Lộc giác giao
Lộc giác sương
Mướp đắng (Quả)
Râu ngô
Thanh bì
Trư linh
Vối (Lá)
Vối (Nụ hoa)
Vừng đen (Hạt)
Phần 5: vắc xin
Vắc xin bạch hầu - uốn ván - ho gà - viêm gan B - Hib (DTPw - HeB - Hib)
Vắc xin Haemophilus influenza typ B cộng hợp
Vắc xin cúm (bất hoạt)
Vắc xin phòng papillomavirus ở người (tái tổ hợp)
Vắc xin quai bị
Vắc xin rubella
Vắc xin viêm gan A (bất hoạt, hấp phụ)
PHẦN 3
THÀNH PHẨM HÓA DƯỢC
KEM TRIAMCINOLON ACETONID
Cremoris Triamcinoloni acetonidi
Là kem bôi trên da có chứa triamcinolon acetonid trong tá dược kem thích hợp.
Chế phẩm phải đáp ứng các yêu cầu trong chuyên luận “Thuốc mềm dùng trên da và niêm mạc" (Phụ lục 1.12) và các yêu cầu sau:
Hàm lượng triamcinolon acetonid, C24H31FO6, từ 90,0 % đến 110,0 % so với lượng ghi trên nhãn.
Tính chất
Thuốc kem có màu trắng hoặc trắng hơi ngà, đồng nhất.
Định tính
A. Trong phần Định lượng, thời gian lưu của pic chính trên sắc ký đồ thu được từ dung dịch thử phải tương ứng với thời gian lưu của pic triamcinolon acetonid trên sắc ký đồ thu được từ dung dịch chuẩn.
B. Phương pháp sắc ký lớp mỏng (Phụ lục 5.4)
Bản mỏng: Silica gel 6.
Dung môi khai triển: Ethyl acetat.
Dung dịch thử: Lấy một lượng chế phẩm tương đương với khoảng 5 mg triamcinolon acetonid cho vào bình nón, thêm 50 ml cloroform (TT) và 15 g natri sulfat khan (TT), lắc mạnh đến khi tan, lọc và làm trong dịch lọc (nếu cần) bằng cách thêm natri sulfat khan (TT) và lọc lại. Làm bay hơi dung dịch thu được đến gần khô và hoà tan cắn bằng 10 ml cloroform (TT).
Dung dịch đối chiếu (1): Dung dịch triamcinolon acetonid chuẩn 0,05 % trong cloroform (TT).
Dung dịch đối chiếu (2): Hỗn hợp đồng thể tích dung dịch thử và dung dịch đối chiếu (1).
Cách tiến hành: Chấm riêng biệt 10 μl mỗi dung dịch trên lên bản mỏng. Triển khai sắc ký đến khi dung môi đi được khoảng 12 cm, lấy bản mỏng ra để ngoài không khí. Phun hỗn hợp đồng thể tích dung dịch natri hydroxyd 20 % (TT) và dung dịch xanh tetrazolium 0,2 % trong methanol (TT) lên bản mỏng. Vết chính trên sắc ký đồ của dung dịch thử phải tương ứng về màu sắc và vị trí với vết chính trên sắc ký đồ của dung dịch đối chiếu (1). Trên sắc ký đồ của dung dịch đối chiếu (2) chỉ có một vết chính.
Định lượng
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động: Acetonitril - nước (30 : 70), điều chỉnh tỷ lệ nếu cần.
Dung dịch chuẩn: Cân chính xác khoảng 37 mg triamcinolon acetonid chuẩn vào bình định mức 50 ml, hòa tan bằng isopropanol (TT) và pha loãng đến định mức với cùng dung môi, lắc đều. Pha loãng 10,0 ml dung dịch thu được thành 100,0 ml với isopropanol (TT). Pha loãng dung dịch thu được với cùng một thể tích pha động.
Dung dịch thử: Cân chính xác một lượng kem chứa khoảng 1,5 mg triamcinolon acetonid trong ống nghiệm 50 ml có nút đậy, thêm 20,0 ml dung dịch isopropanol (TT), đậy chặt nắp. Đun nóng 60 °C trong 5 min trong cách thủy, lắc cẩn thận 30 s. Lặp lại đun và lắc 3 lần. Làm lạnh trong nước đá từ 15 min đến 20 min. Ly tâm trong 15 min ở -5 °C, pha loãng dung dịch ly tâm với đồng lượng thể tích pha động. Làm lạnh trong nước đá từ 10 min đến 15 min. Lọc qua bông thủy tinh và lọc qua giấy lọc.
Điều kiện sắc ký:
Cột thép không gỉ (25 cm x 4,6 mm) được nhồi pha tĩnh C (5 μm).
Detector quang phổ tử ngoại đặt ở bước sóng 254 nm.
Tốc độ dòng: 1 ml/min.
Thể tích tiêm: 20 μI.
Cách tiến hành:
Tiêm lần lượt dung dịch chuẩn và dung dịch thử. Tính hàm lượng triamcinolon acetonid, C24H31FO6, trong mẫu dựa vào diện tích pic thu được từ dung dịch thử, dung dịch chuẩn và hàm lượng C24H31FO6 của triamcinolon acetonid chuẩn.
Bảo quản
Trong bao bì kín, để nơi khô mát, tránh ánh sáng
Loại thuốc
Chống viêm steroid dùng tại chỗ.
Hàm lượng thường dùng
Kem bôi da 0,1 %.
THUỐC TIÊM AMPICILIN VÀ SULBACTAM
Ampicillini et Sulbactami pulvis ad injectionem
Là hỗn hợp bột khô vô khuẩn của ampicilin natri và sulbactam natri để pha thuốc tiêm.
Tỷ lệ hàm lượng trên nhãn giữa ampicilin và sulbactam là 2 : 1.
Chế phẩm phải đáp ứng các yêu cầu trong chuyên luận “Thuốc tiêm, thuốc tiêm truyền” (Phụ lục 1.19) và các yêu cầu sau đây:
Hàm lượng ampicilin, C16H19N3O4S, từ 90,0 % đến 115,0 % so với lượng ghi trên nhãn.
Hàm lượng sulbactam, C8H11NO5S, từ 90,0 % đến 115,0 % so với lượng ghi trên nhãn.
Thuốc tiêm ampicilin và sulbactam phải chứa không ít hơn 563 μg ampicilin và 280 μg sulbactam trong 1 mg chế phẩm, tính theo chế phẩm khan.
Tính chất
Bột màu trắng hoặc gần như trắng.
Định tính
Trong mục Định lượng, sắc ký đồ của dung dịch thử phải cho 2 pic chính có thời gian lưu tương ứng với thời gian lưu của ampicilin và sulbactam trên sắc ký đồ của dung dịch chuẩn.
pH
Dung dịch chứa 10 mg ampicilin và 5 mg sulbactam trong 1 ml nước không có carbon dioxyd (TT) phải có pH từ 8,0 đến 10,0 (Phụ lục 6.2).
Nước
Không được quá 2,0 % (Phụ lục 10.3).
Nội độc tố vi khuẩn (Phụ lục 13.2)
Không được quá 0,17 EU trong 1 mg hỗn hợp ampicilin và sulbactam (tương ứng với 0,67 mg ampicilin và 0,33 mg sulbactam).
Định lượng
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động: Dung dịch tetrabutylamoni hydroxyd 0,005 M - acetonitril (1650 : 350), điều chỉnh tỷ lệ nếu cần.
Dung dịch tetrabutylamoni hydroxyd 0,005 M: Pha loãng 6,6 ml dung dịch tetrabutylamoni hydroxyd 40 % với nước để có 1800 ml dung dịch. Điều chỉnh pH dung dịch đến 5,0 ± 0,1 bằng dung dịch acid phosphoric 1 M (TT), thêm nước vừa đủ 2000 ml.
Dung dịch chuẩn: Cân chính xác một lượng ampicilin chuẩn và sulbactam chuẩn, hòa tan với pha động trong bình định mức phù hợp để thu được dung dịch có nồng độ ampicilin là 0,6 mg/ml và nồng độ của sulbactam là 0,3 mg/ml, dung dịch dùng ngay sau khi pha.
Dung dịch phân giải: Pha dung dịch sulbactam chuẩn có nồng độ 0,3 mg/ml trong dung dịch natri hydroxyd 0,01 M, để yên dung dịch này trong 30 min. Điều chỉnh pH của dung dịch này đến 5,0 ± 0,1 bằng acid phosphoric 1 M (TT). Hút 5 ml dung dịch thu được chuyển vào bình định mức 25 ml, thêm 4,25 ml acetonitril (TT) và thêm dung dịch tetrabutylamoni hydroxyd 0,005 M vừa đủ thể tích. Hút 1 ml dung dịch thu được chuyển vào bình định mức 25 ml, thêm 15 mg ampicilin chuẩn và thêm pha động vừa đủ thể tích, lắc đều. Dung dịch dùng ngay sau khi pha.
Dung dịch thử: Cân thuốc trong 10 lọ, tính khối lượng trung bình của bột thuốc trong một lọ. Cân chính xác một lượng bột thuốc tương ứng với khoảng 60 mg ampicilin và 30 mg sulbactam vào bình định mức 100 ml. Thêm 70 ml pha động, lắc để hòa tan và thêm pha động vừa đủ thể tích, lắc đều. Dung dịch dùng ngay sau khi pha.
Điều kiện sắc ký.
Cột thép không gỉ (25 cm x 4,6 mm) được nhồi pha tĩnh C (5 μm).
Detector quang phổ tử ngoại đặt ở bước sóng 230 nm.
Tốc độ dòng: 2 ml/min.
Thể tích tiêm: 10 μl.
Cách tiến hành:
Kiểm tra tính phù hợp của hệ thống: Tiến hành sắc ký với dung dịch phân giải, trên sắc ký đồ thu được, thời gian lưu tương đối của ampicilin là khoảng 0,7 và của sản phẩm phân hủy của sulbactam trong kiềm là 1,0. Độ phân giải giữa pic ampicilin và pic sản phẩm phân hủy của sulbactam trong kiềm không nhỏ hơn 4,0.
Tiến hành sắc ký với dung dịch chuẩn, trên sắc ký đồ thu được, thời gian lưu tương đối của ampicilin là khoảng 0,35 của sulbactam là 1,0. Hiệu lực cột xác định trên pic sulbactam không ít hơn 3500 đĩa lý thuyết, hệ số đối xứng không lớn hơn 1,5 và độ lệch chuẩn tương đối của các diện tích đáp ứng từ 6 lần tiêm lặp lại không lớn hơn 2,0 %.
Tiến hành sắc ký lần lượt với dung dịch chuẩn và dung dịch thử. Tính hàm lượng ampicilin, C16H19N3O4S, và sulbactam, C8H11NO5S, trong một đơn vị chế phẩm dựa vào diện tích pic thu được trên sắc ký đồ của dung dịch thử, dung dịch chuẩn và hàm lượng C16H19N3O4S của ampicilin và C8H11NO5S của sulbactam chuẩn.
Bảo quản
Trong bao bì kín, để nơi mát, tránh ánh sáng.
Loại thuốc
Kháng sinh.
Hàm lượng thường dùng
Ampicilin 1 g; sulbactam 0,5 g (lọ 1,5 g).
Ampicilin 2 g; sulbactam 1 g (lọ 3 g).
THUỐC TIÊM DIAZEPAM
Injectio Diazepami
Là dung dịch vô khuẩn của diazepam trong nước để pha thuốc tiêm hoặc dung môi thích hợp. Chế phẩm có thể chứa các chất ổn định.
Chế phẩm phải đáp ứng các yêu cầu trong chuyên luận “Thuốc tiêm, thuốc tiêm truyền” (Phụ lục 1.19) và các yêu cầu sau đây:
Hàm lượng diazepam, C16H13CIN2O, từ 90,0 % đến 110,0 % so với lượng ghi trên nhãn.
Tính chất
Dung dịch trong, không màu.
Định tính
A. Trong mục Định lượng, phổ hấp thụ tử ngoại (Phụ lục 4.1) của dung dịch thử phải có cực đại ở 368 nm.
B. Phương pháp sắc ký lớp mỏng (Phụ lục 5.4)
Bản mỏng: Silica gel G.
Dung môi triển khai: Cloroform - methanol (100 : 10)
Dung dịch thử: Pha loãng dung dịch chế phẩm với methanol (TT) để được dung dịch có nồng độ diazepam 0,10 % trong methanol (TT).
Dung dịch đối chiếu: Dung dịch diazepam chuẩn 0,10 % trong methanol (TT).
Cách tiến hành: Chấm riêng biệt lên bảng mỏng 10 μl mỗi dung dịch trên. Sau khi triển khai, lấy bản mỏng ra và phun dung dịch acid sulfuric 10 % trong ethanol (TT). Sấy ở 105 °C trong 10 min. Quan sát dưới ánh sáng tử ngoại ở bước sóng 365 nm. Vết chính trên sắc ký đồ của dung dịch thử phải có Rf, màu sắc và kích thước phù hợp với vết chính trên sắc ký đồ của dung dịch đối chiếu.
pH
Từ 6,2 đến 7,0 (Phụ lục 6.2).
Định lượng
Lấy chính xác một thể tích chế phẩm tương ứng với 10 mg diazepam, thêm 20 ml đệm phosphat hỗn hợp pH 7,0 (TT), lắc đều. Chiết 4 lần, mỗi lần với 20 ml cloroform (TT), lọc từng dịch chiết cloroform qua cùng một phễu lọc có chứa 5 g natri sulfat khan (TT). Tập trung dịch chiết vào bình định mức 100 ml, thêm cloroform (TT) đến vạch, lắc đều. Lấy chính xác 10 ml bốc hơi dưới luồng khí nitrogen đến cắn. Hòa tan cắn trong 25,0 ml dung dịch acid sulfuric 0,05 M trong methanol.
Đo độ hấp thụ (Phụ lục 4.1) của dung dịch thu được ở bước sóng cực đại 368 nm. Tính hàm lượng diazepam, C16H13CIN2O, theo A (1 %, 1 cm), lấy 151 là giá trị A (1 %, 1 cm) của diazepam ở bước sóng 368 nm.
Bảo quản
Tránh ánh sáng.
Loại thuốc
An thần, giải lo, gây ngủ.
Hàm lượng thường dùng
Ống tiêm 10 mg/2ml; lọ 50mg/10ml.
THUỐC TIÊM METOCLOPRAMID
Injectio Metoclopramidi
Là dung dịch vô khuẩn của metoclopramid hydroclorid trong nước để pha tiêm. Chế phẩm phải đáp ứng yêu cầu trong chuyên luận “Thuốc tiêm, thuốc tiêm truyền” (Phụ lục 1.19) và các yêu cầu sau đây:
Hàm lượng metoclopramid, C14H22CIN3O2, từ 90,0 % đến 110,0 % so với lượng ghi trên nhãn.
Tính chất
Dung dịch trong, không màu.
Định tính
A. Trong mục Định lượng, sắc ký đồ của dung dịch thử phải có pic chính có thời gian lưu tương ứng với thời gian lưu của pic metoclopramid thu được trên sắc ký đồ của dung dịch chuẩn.
B. Lấy một thể tích thuốc tiêm tương ứng với 50 mg metoclopramid, thêm 5 ml nước và 5 ml dung dịch 4-dimethylaminobenzaldehyd 1 % trong acid hydrocloric 1 M xuất hiện màu cam vàng.
pH
Từ 2,5 đến 6,5 (Phụ lục 6.2).
Nội độc tố vi khuẩn (Phụ lục 13.2)
Không được quá 2,5 EU trong 1 mg metoclopramid.
Định lượng
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động: Hòa tan 2,7 g natri acetat (TT) trong 500 ml nước, thêm 500 ml acetonitril (TT), 2 ml dung dịch tetramethylamoni hydroxyd 25 %, điều chỉnh tới pH 6,5 bằng acid acetic băng (TT), lắc đều, lọc.
Dung dịch thử: Lấy chính xác một thể tích thuốc tiêm tương đương với 40 mg metoclopramid vào bình định mức 100 ml, thêm dung dịch acid phosphoric 0,01 M đến định mức, lắc đều, lọc. Pha loãng 10,0 ml dịch lọc thành 100,0 ml với dung dịch acid phosphoric 0,01 M.
Dung dịch chuẩn: Cân chính xác khoảng 45 mg metoclopramid hydroclorid chuẩn vào một bình định mức 100 ml, hòa tan bằng dung dịch acid phosphoric 0,01 M và pha loãng đến định mức với cùng dung môi, lắc đều. Pha loãng 10,0 ml dung dịch thu được thành 100,0 ml với dung dịch acid phosphoric 0,01 M.
Điều kiện sắc ký:
Cột thép không gỉ (25 cm x 4,6 mm) được nhồi pha tĩnh C (5 μm đến 10 μm).
Detector quang phổ tử ngoại đặt ở bước sóng 305 nm.
Tốc độ dòng: 1 ml/min.
Thể tích tiêm: 20 μl.
Cách tiến hành:
Tiến hành sắc ký với dung dịch chuẩn, hệ số đối xứng của pic metoclopramid không được lớn hơn 2,0 và độ lệch chuẩn tương đối của diện tích pic từ 6 lần tiêm lặp lại không được lớn hơn 2,0 %.
Tiến hành sắc ký lần lượt đối với dung dịch chuẩn và dung dịch thử.
Tính hàm lượng C14H22CIN3O2 trong thuốc tiêm dựa vào diện tích pic thu được trên sắc ký đồ của dung dịch chuẩn, dung dịch thử và hàm lượng C14H22CIN3O2.HCl của metoclopramid hydroclorid chuẩn.
Bảo quản
Nơi mát, tránh ánh sáng.
Loại thuốc
Thuốc chống nôn.
Hàm lượng thường dùng
Ống 10 mg/2 ml. Hàm lượng tính theo metoclopramid.
VIÊN NÉN AMIODARON
Tabellae Amiodaroni
Là viên nén chứa amiodaron hydroclorid.
Chế phẩm phải đáp ứng các yêu cầu trong chuyên luận “Thuốc viên nén” (Phụ lục 1.20) và các yêu cầu sau đây:
Hàm lượng amiodaron hydroclorid, C25H29I2NO3.HCl, từ 95,0 % đến 105,0 % so với lượng ghi trên nhãn.
Định tính
A. Lắc một lượng bột viên đã nghiền mịn tương ứng khoảng 0,1 g amiodaron hydroclorid với 50 ml ethanol 96 % (TT), lắc kỹ, lọc. Dịch lọc dùng cho các phép thử sau:
Lấy 0,1 ml dịch lọc pha loãng với 20 ml ethanol 96 % (TT), đo phổ hấp thụ tử ngoại (Phụ lục 4.1) của dung dịch ở dải sóng từ 200 nm đến 350 nm, dung dịch có cực đại hấp thụ ở 242 nm và cực tiểu hấp thụ ở 223 nm. Tỷ lệ độ hấp thụ ở 242 nm so với độ hấp thụ ở 223 nm phải từ 1,47 đến 1,61.
Lấy 5 ml dịch lọc, thêm dung dịch amoniac 10 % (TT), dung dịch thu được bị đục, lọc. Thêm tiếp dung dịch amoniac 10 % (TT) vào dịch lọc đến khi dịch lọc không còn đục, lọc để thu được dung dịch trong (lọc qua màng lọc 0,45 μm). Lấy 2 ml dịch lọc này acid hóa bằng dung dịch acid nitric 32 % (TT) (kiểm tra bằng giấy chỉ thị), thêm 2 ml dung dịch bạc nitrat 0,1 M (TT), xuất hiện tủa trắng, tủa này tan trong dung dịch amoniac 10 % (TT), tủa xuất hiện lại khi thêm dung dịch acid nitric 32 % (TT).
B. Trong phần định lượng, pic chính trên sắc ký đồ của dung dịch thử phải có thời gian lưu tương ứng với thời gian lưu của pic amiodaron hydroclorid trên sắc ký đồ của dung dịch chuẩn.
Tạp chất liên quan
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động: Dung dịch đệm pH 4,9 - methanol - acetonitril (30 : 30 : 40).
Dung dịch đệm pH 4,9: Thêm 3,0 ml acid acetic băng (TT) vào 800 ml nước, chỉnh về pH 4,9 bằng dung dịch amoniac 10 % và thêm nước vừa đủ 1000 ml.
Dung môi pha mẫu: Hỗn hợp acetonitril - nước (1 : 1).
Dung dịch thử: Cân chính xác một lượng chế phẩm đã nghiền mịn tương ứng với 25 mg amiodaron hydroclorid vào bình định mức 50 ml, thêm 40 ml hỗn hợp acetonitril - nước (1 : 1), lắc siêu âm 15 min, để nguội, thêm dung môi pha mẫu vừa đủ, lắc đều, lọc.
Dung dịch đối chiếu: Lấy chính xác 1 ml dung dịch thử vào bình định mức 200 ml, pha loãng và làm vừa đủ bằng hỗn hợp acetonitril - nước (1 : 1).
Điều kiện sắc ký:
Cột thép không gỉ (15 cm x 4,6 mm) được nhồi pha tĩnh C (5 μm).
Detector quang phổ tử ngoại đặt ở bước sóng 240 nm.
Tốc độ dòng: 1,5 miymin.
Thể tích tiêm: 10 μl.
Cách tiến hành:
Tiêm dung môi pha mẫu.
Tiêm dung dịch đối chiếu, số đĩa lý thuyết của cột xác định trên pic chính của dung dịch đối chiếu phải không nhỏ hơn 7000.
Tiến hành sắc ký dung dịch thử với thời gian gấp 2,5 lần thời gian lưu của pic amiodaron hydroclorid. Trên sắc ký đồ của dung dịch thử, tổng diện tích của các pic phụ không được lớn hơn diện tích của pic chính trên sắc ký đồ của dung dịch đối chiếu (0,5 %).
Độ hòa tan (Phụ lục 11.4)
Thiết bị: Kiểu cánh khuấy
Môi trường hòa tan: 1000 ml dung dịch natri laurylsulfat 0,25 %.
Tốc độ quay: 75 r/min.
Thời gian: 45 min.
Cách tiến hành:
Dung dịch thử: Lấy một phần môi trường sau khi hòa tan, lọc, bỏ 20 ml dịch lọc đầu. Pha loãng dịch lọc với môi trường hòa tan để được dung dịch có nồng độ tương ứng với dung dịch chuẩn.
Dung dịch chuẩn: Cân chính xác khoảng 20 mg amiodaron hydrociorid chuẩn vào bình định mức 200 ml, hòa tan và pha loãng vừa đủ bằng ethanol 96 % (TT). Hút chính xác 5 ml dung dịch này pha loãng thành 50,0 ml bằng mới trường hòa tan.
Đo độ hấp thụ ánh sáng ở bước sóng 243 nm (Phụ lục 4.1) của dung dịch chuẩn và dung dịch thử, so với mẫu trắng là môi trường hòa tan.
Từ lượng amiodaron hydroclorid chuẩn, độ pha loãng của dung dịch chuẩn và dung dịch thử, tính hàm lượng amiodaron hydroclorid, C25H29I2NO3.HCl, đã hòa tan.
Yêu cầu: Không được ít hơn 70 % hàm lượng amiodaron hydroclorid, C25H29I2NO3.HCl, so với lượng ghi trên nhãn được hòa tan trong 45 min.
Định lượng
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động, điều kiện sắc ký như mô tả trong mục Tạp chất liên quan.
Dung dịch chuẩn: Cân chính xác khoảng 20 mg amiodaron hydroclorid vào bình định mức 200 ml, hòa tan và pha loãng vừa đủ bằng hỗn hợp acetonitril - nước (1 : 1).
Dung dịch thử: Cân 20 viên, tính khối lượng trung bình của viên, nghiền thành bột mịn. Cân chính xác một lượng bột viên tương ứng với 20 mg amiodaron hydroclorid vào bình định mức 200 ml, thêm 170 ml hỗn hợp acetonitril - nước (1 : 1), lắc siêu âm 15 min để hòa tan, để nguội, thêm hỗn hợp acetonitril - nước (1 : 1) tới vừa đủ, lắc đều, lọc.
Cách tiến hành: Tiến hành sắc ký lần lượt với dung dịch chuẩn và dung dịch thử. Số đĩa lý thuyết của cột xác định trên pic chính của dung dịch chuẩn phải không nhỏ hơn 3000. Hệ số phân giải giữa pic amiodaron hydroclorid và pic phụ liền kề phải không nhỏ hơn 1,5.
Tính hàm lượng amiodaron hydroclorid C25H29I2NO3.HCl trong viên dựa vào diện tích pic trên sắc ký đồ của dung dịch chuẩn, dung dịch thử và hàm lượng C25H29l2NO3,HCl trong amiodaron hydroclorid chuẩn.
Bảo quản
Trong bao bì kín, để nơi khô mát, tránh ánh sáng.
Loại thuốc
Thuốc chẹn kênh kali; chống loạn nhịp nhóm III.
Hàm lượng thường dùng
200 mg.
VIÊN NÉN DIPHENHYDRAMIN
Tabellae Diphenhydramini
Là viên nén chứa diphenhydramin hydroclorid.
Chế phẩm phải đáp ứng các yêu cầu trong chuyên luận “Thuốc viên nén” (Phụ lục 1.20) và các yêu cầu sau đây:
Hàm lượng diphenhydramin hydroclorid, C17H21NO.HCl, từ 90,0 % đến 110,0 % so với lượng ghi trên nhãn.
Định tính
A. Lấy một lượng bột viên tương đương với 50 mg diphenhydramin hydroclorid, chiết bằng cloroform (TT) 2 lần, mỗi lần 10 ml. Lọc dịch chiết, bốc hơi dịch lọc đến cắn, lấy khoảng 5 mg cắn hòa tan trong 0,15 ml nước, thêm 2 ml acid sulfuric (TT), màu vàng được tạo thành. Thêm 0,5 ml acid nitric (TT), màu chuyển thành đỏ. Thêm 15 ml nước, để nguội, thêm 5 ml cloroform (TT), lắc và để yên cho tách lớp, lớp cloroform có màu tím.
B. Trong mục Định lượng, pic chính trên sắc ký đồ của dung dịch thử phải có thời gian lưu tương ứng với thời gian lưu của pic chính trên sắc ký đồ của dung dịch chuẩn.
Tạp chất liên quan
Phương pháp sắc ký lớp mỏng (Phụ lục 5.4).
Bản mỏng: Silica gel H.
Dung môi khai triển: Cloroform - methanol - diethylamin (80 : 20 : 1)
Dung dịch thử: Lấy một lượng bột viên tương ứng với 100 mg diphenhydramin hydroclorid, chiết 3 lần, mỗi lần 10 ml cloroform (TT). Gộp và lọc dịch chiết, để bay hơi dịch chiết đến gần khô. Hòa tan cắn trong 5 ml cloroform (TT).
Dung dịch đối chiếu: Pha loãng 1 ml dung dịch thử thành 100 ml bằng cloroform (TT).
Cách tiến hành: Chấm riêng biệt 5 μl mỗi dung dịch trên lên bản mỏng. Triển khai sắc ký đến khi dung môi đi được 10 cm. Để bản mỏng khô ngoài không khí 5 min, phun lên bản mỏng acid sulfuric (TT) và sấy ở 120 °C trong 10 min hoặc đến khi xuất hiện các vết. Trên sắc ký đồ của dung dịch thử không được có vết phụ nào đậm hơn vết thu được trên sắc ký đồ của dung dịch đối chiếu (1,0 %).
Độ hòa tan
Thiết bị: Kiểu giò quay.
Môi trường hòa tan: 500 ml nước.
Tốc độ quay: 100 r/min.
Thời gian: 30 min.
Cách tiến hành:
Dung dịch thử: Lấy một phần môi trường sau khi hòa tan, lọc, bỏ 20 ml dịch lọc đầu.
Dung dịch chuẩn: Dung dịch diphenhydramin hydroclorid chuẩn trong nước có nồng độ tương đương nồng độ diphenhydramin hydroclorid của dung dịch thử.
Xác định hàm lượng diphenhydramin hydroclorid hòa tan bằng phương pháp sắc ký lỏng (Phụ lục 5.3). Sử dụng pha động và các điều kiện sắc ký như ở phần Định lượng, thể tích tiêm là 50 μl.
Yêu cầu: Không được ít hơn 70 % lượng diphenhydramin hydroclorid, C17H21NO.HCl, so với lượng ghi trên nhãn được hòa tan trong 30 min.
Định lượng
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động: Acetonitril - nước - triethylamin (50 : 50 : 0,5), điều chỉnh bằng acid acetic băng (TT) đến pH 6,5. Có thể điều chỉnh tỷ lệ nếu cần.
Dung dịch thử: Cân 20 viên, tính khối lượng trung bình và nghiền thành bột mịn. Cân một lượng bột viên tương đương với 50 mg diphenhydramin hydroclorid, hòa tan bằng nước và thêm nước vừa đủ 100,0 ml, lọc.
Dung dịch chuẩn: Hòa tan một lượng cân chính xác diphenhydramin hydroclorid chuẩn trong nước để thu được dung dịch có nồng độ khoảng 0,5 mg/ml.
Dung dịch phân giải: Hòa tan khoảng 5 mg benzophenon trong 5 ml acetonitril (TT), pha loãng với nước thành 100 ml và lắc đều. Lấy 1,0 ml dung dịch này và 5 mg diphenhydramin hydroclorid chuẩn vào bình định mức 10 ml, thêm nước đến vạch, lắc đều
Điều kiện sắc ký:
Cột thép không gỉ (25 cm x 4,6 mm) nhồi pha tĩnh silica gel được biến đổi hóa học gắn với nhóm cyano (5 μm).
Detector quang phổ tử ngoại đặt ở bước sóng 254 nm.
Tốc độ dòng: 1,0 ml/min.
Thể tích tiêm: 10 μI.
Cách tiến hành:
Kiểm tra tính phù hợp của hệ thống sắc ký: Tiêm dung dịch phân giải. Phép thử chỉ có giá trị khi độ phân giải giữa pic benzophenon và pic diphenhydramin không nhỏ hơn 2.
Tiến hành sắc ký với dung dịch chuẩn, độ lệch chuẩn tương đối của diện tích pic diphenhydramin từ các lần tiêm lặp lại không được lớn hơn 2,0 %. Hệ số đối xứng của pic diphenhydramin không được lớn hơn 2,0.
Tiến hành sắc ký lần lượt với dung dịch chuẩn và dung dịch thử, tính hàm lượng của diphenhydramin hydroclorid, C17H21NO.HCl, trong viên dựa vào diện tích pic trên sắc ký đồ của dung dịch chuẩn, dung dịch thử và hàm lượng C17H21NO.HCl trong diphenhydramin hydroclorid chuẩn.
Bảo quản
Trong bao bì kín.
Loại thuốc
Thuốc kháng histamin.
Hàm lượng thường dùng
25 mg; 50mg.
VIÊN NÉN FEXOFENADIN
Tabellae Fexofenadini
Là viên nén chứa fexofenadin hydroclorid.
Chế phẩm phải đáp ứng các yêu cầu trong chuyên luận “Thuốc viên nén” (Phụ lục 1.20) và các yêu cầu sau đây:
Hàm lượng fexofenadin hydroclorid, C32H39NO4.HCl, từ 95,0 % đến 105,0 % so với lượng ghi trên nhãn.
Định tính
A. Lấy một lượng bột viên tương ứng với khoảng 30 mg fexofenadin, thêm 80 ml dung dịch acid hydrocloric 0,001 M (TT), lắc để hòa tan và pha loãng thành 100 ml với cùng dung môi. Phổ hấp thụ tử ngoại của dung dịch thu được trong khoảng từ 230 nm đến 350 nm có cực đại hấp thụ ở 259 nm ± 1 nm và phải phù hợp với phổ của dung dịch fexofenadin hydroclorid chuẩn có cùng nồng độ pha trong dung dịch acid hydrocloric 0,001 M (TT).
B. Trong phần Định lượng, thời gian lưu của pic chính trên sắc ký đồ thu được của dung dịch thử phải tương ứng với thời gian lưu của pic chính trên sắc ký đồ thu được của dung dịch chuẩn.
Độ hòa tan (Phụ lục 11.4)
Thiết bị: Kiểu cánh khuấy.
Môi trường hòa tan: 900 ml dung dịch acid hydrocloric 0,001 M (TT).
Tốc độ quay: 50 r/min.
Thời gian: 30 min.
Cách tiến hành:
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Dung dịch acid, Dung dịch đệm, Dung môi pha mẫu, Pha động, Dung dịch chuẩn gốc và Điều kiện sắc ký: Như mô tả ở phần Định lượng.
Dung dịch chuẩn: Pha loãng dung dịch chuẩn gốc với pha động để được dung dịch có nồng độ tương đương với nồng độ fexofenadin hydroclorid trong dung dịch thử.
Dung dịch thử: Lấy một thể tích thích hợp môi trường sau khi hòa tan và lọc, loại bỏ dịch lọc đầu. Nếu cần, pha loãng dịch lọc với pha động để thu được dung dịch có nồng độ khoảng 0,06 mg fexofenadin hydroclorid trong 1 ml.
Cách tiến hành:
Tiêm riêng biệt dung dịch chuẩn và dung dịch thử.
Tính hàm lượng fexofenadin hydroclorid, C32H39NO4.HCl, đã hòa tan trong mỗi viên, dựa vào diện tích pic trên sắc ký đồ thu được của dung dịch chuẩn, dung dịch thử và nồng độ C32H39NO4.HCl của dung dịch chuẩn.
Yêu cầu: Không được ít hơn 75 % lượng fexofenadin hydroclorid, C32H39NO4.HCl, so với lượng ghi trên nhãn được hòa tan trong 30 min.
Tạp chất liên quan
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Dung dịch acid, Dung dịch đệm, Dung môi pha mẫu, Pha động, Dung dịch chuẩn gốc và Điều kiện sắc ký: Như mô tả ở phần Định lượng.
Dung dịch thử: Sử dụng dung dịch thử gốc ở phần Định lượng.
Dung dịch đối chiếu: Pha loãng 1,0 ml dung dịch thử thành 100,0 ml với pha động, lắc đều. Pha loãng 5,0 ml dung dịch thu được thành 50,0 ml với pha động, lắc đều.
Cách tiến hành:
Tiến hành sắc ký với dung dịch thử và dung dịch đối chiếu.
Trên sắc ký đồ của dung dịch thử, thời gian lưu tương đối so với fexofenadin của tạp chất A khoảng 1,6; của tạp chất phân hủy decarboxylat hóa khoảng 6,7.
Giới hạn:
Trên sắc ký đồ của dung dịch thử:
Tạp chất A không được có diện tích pic lớn hơn 4 lần diện tích của pic chính trên sắc ký đồ thu được của dung dịch đối chiếu (0,4 %),
Tạp chất phân hủy decarboxylat hóa: Diện tích của pic tương ứng với tạp chất phân hủy decarboxylat hóa nhân với 1,1 không được lớn hơn 1,5 lần diện tích của pic chính trên sắc ký đồ thu được của dung dịch đối chiếu (0,15 %),
Từng tạp chất khác không được có diện tích lớn hơn 2 lần diện tích của pic chính trên sắc ký đồ thu được của dung dịch đối chiếu (0,2 %),
Tổng diện tích của tất cả các pic tạp chất không được lớn hơn 5 lần diện tích của pic chính trên sắc ký đồ thu được của dung dịch đối chiếu (0,5 %),
Bỏ qua các pic có diện tích nhỏ hơn 0,5 lần diện tích của pic chính trên sắc ký đồ thu được của dung dịch đối chiếu (0,05 %).
Định lượng
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Dung dịch acid: Pha loãng 17 ml acid actic băng (TT) thành 1000 ml với nước, lắc đều. Pha loãng 100 ml dung dịch thu được thành 1000 ml với nước, lắc đều.
Dung dịch đệm: Pha loãng 15 ml hỗn hợp acetonitril - triethylamin (1 : 1) thành 1000 ml với dung dịch acid, điều chỉnh đến pH 5,25 với acid phosphoric (TT).
Dung môi pha mẫu: Acetonitril - dung dịch acid (75 : 25).
Pha động: Dung dịch đệm - acetonitril (64 : 36), điều chỉnh tỷ lệ nếu cần.
Dung dịch chuẩn gốc: Cân chính xác khoảng 30 mg fexofenadin hydroclorid chuẩn vào bình định mức 100 ml, hòa tan trong dung môi, thêm dung môi vừa đủ đến vạch, lắc đều.
Dung dịch chuẩn: Pha loãng 5,0 ml dung dịch chuẩn gốc thành 100,0 ml với pha động, lắc đều.
Dung dịch thử gốc: Lấy 10 viên bất kỳ cho vào bình định mức 200 ml, thêm 40 ml dung dịch acid, lắc cơ học 30 min để viên rã hoàn toàn. Thêm 120 ml acetonitril (TT), tiếp tục lắc siêu âm 60 min, để nguội thêm dung môi pha mẫu vừa đủ đến vạch, lắc đều, lọc. Pha loãng nếu cần với dung môi pha mẫu để được dung dịch có nồng độ fexofenadin hydroclorid khoảng 1,2 mg/ml.
Dung dịch thử: Pha loãng 5,0 ml dung dịch thử gốc thành 20,0 ml với dung môi pha mẫu. Pha loãng 5,0 ml dung dịch thu được thành 100,0 ml với pha động.
Điều kiện sắc ký:
Cột thép không gỉ (25 cm x 4,6 mm) được nhồi pha tĩnh phenylsilyl silica gel dùng cho sắc ký (5 μm).
Nhiệt độ cột: 35 °C.
Detector quang phổ tử ngoại đặt ở bước sóng 220 nm.
Tốc độ dòng: 1,5 ml/min.
Thể tích tiêm: 20 μl.
Cách tiến hành:
Tiêm dung dịch chuẩn và ghi lại sắc ký đồ. Phép thử chỉ có giá trị khi hệ số đối xứng không lớn hơn 2,0 và độ lệch chuẩn tương đối của diện tích pic chính của 6 lần tiêm lặp lại không lớn hơn 2,0 %.
Tiêm riêng biệt dung dịch chuẩn và dung dịch thử.
Tính hàm lượng fexofenadin hydroclorid, C32H39NO4.HCl, trong viên, dựa vào diện tích của pic chính trên sắc ký đồ thu được của dung dịch chuẩn, dung dịch thử và nồng độ C32H39NO4.HCl của dung dịch chuẩn.
Bảo quản
Nơi khô mát, tránh ánh sáng.
Loại thuốc
Kháng histamin.
Hàm lượng thường dùng
60 mg; 120 mg; 180 mg.
VIÊN NÉN LORATADIN
Tabellae Loratadini
Là viên nén hoặc viên nén bao phim chứa loratadin.
Chế phẩm phải đáp ứng các yêu cầu trong chuyên luận “Thuốc viên nén” (Phụ lục 1.20) và các yêu cầu sau đây:
Hàm lượng loratadin, C22H23CIN2O2, từ 90,0 % đến 110,0 % so với lượng ghi trên nhãn.
Định tính
A. Phương pháp sắc ký lớp mỏng (Phụ lục 5.4).
Bản mỏng: Silica gel GF254.
Dung môi khai triển: Ether - diethylamin (40 : 1).
Dung dịch thử: Lắc kỹ một lượng bột viên đã nghiền mịn tương ứng với khoảng 20 mg loratadin với 5 ml hỗn hợp cloroform - methanol (1 : 1) trong 30 min và ly tâm.
Dung dịch đối chiếu: Hòa tan 20 mg loratadin chuẩn trong 5 ml hỗn hợp cloroform - methanol (1 : 1).
Cách tiến hành: Chấm riêng biệt lên bản mỏng 5 μl mỗi dung dịch trên và để khô vết. Triển khai sắc ký đến khi dung môi di chuyển được khoảng 3/4 chiều dài bản mỏng (khoảng 15 cm). Sau khi triển khai sắc ký, để bản mỏng khô ngoài không khí và quan sát bản mỏng dưới ánh sáng tử ngoại ở bước sóng 254 nm. Vết chính trên sắc ký đồ của dung dịch thử phải tương ứng về vị trí, màu sắc và kích thước với vết chính trên sắc ký đồ của dung dịch đối chiếu.
B. Trong mục Định lượng, pic chính trên sắc ký đồ của dung dịch thử phải có thời gian lưu tương ứng với thời gian lưu của pic chính trên sắc ký đồ của dung dịch chuẩn.
Độ hòa tan (Phụ lục 11.4)
Thiết bị: Kiểu cánh khuấy.
Môi trường hòa tan: 900 ml dung dịch acid hydrocloric 0,1 M (TT).
Tốc độ quay: 50 r/min.
Thời gian: 60 min.
Cách tiến hành:
Dung dịch thử: Lấy một phần môi trường đã hoà tan mẫu thử, lọc, bỏ 20 ml dịch lọc đầu. Pha loãng dịch lọc thu được tới nồng độ thích hợp với môi trường hòa tan (nếu cần).
Dung dịch chuẩn: Dung dịch loratadin chuẩn trong môi trường hòa tan có nồng độ tương đương nồng độ loratadin trong dung dịch thử.
Đo độ hấp thụ (Phụ lục 4.1) của các dung dịch trên ở bước sóng cực đại khoảng 280 nm, cốc đo dày 1 cm, mẫu trắng là môi trường hòa tan. Tính hàm lượng loratadin, C22H23CIN2O2, hòa tan trong mỗi viên dựa vào độ hấp thụ của dung dịch chuẩn, dung dịch thử và hàm lượng C22H23CIN2O2 của loratadin chuẩn.
Yêu cầu: Không ít hơn 80 % lượng loratadin, C22H23CIN2O2, so với lượng ghi trên nhãn được hoà tan trong 60 min.
Tạp chất liên quan
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Dung dịch dikali hydrophosphat 0,01 M, dung dịch dikali hydrophosphat 0,6 M, pha động, dung môi pha loãng, điều kiện sắc ký: Chuẩn bị như mục Định lượng, với thể tích tiêm là 50 μl.
Dung dịch chuẩn gốc: Sử dụng dung dịch chuẩn trong mục Định lượng.
Dung dịch đối chiếu: Pha loãng dung dịch chuẩn gốc bằng dung môi pha loãng để thu được dung dịch có nồng độ chính xác khoảng 0,8 μg trong 1 ml. Lọc qua màng lọc 0,45 μm.
Dung dịch thử: Sử dụng dung dịch thử trong mục Định lượng.
Cách tiến hành:
Kiểm tra tính phù hợp của hệ thống sắc ký:
Tiến hành sắc ký với dung dịch đối chiếu và ghi lại sắc ký đồ. Phép thử chỉ có giá trị khi độ lệch chuẩn tương đối của diện tích pic loratadin không quá 4,0 %.
Tiến hành sắc ký đối với dung dịch thử và ghi lại sắc ký đồ: Trên sắc ký đồ thu được, thời gian lưu tương đối khoảng 0,79 đối với 4-(8-cloro-11-fluoro-6,11-dihydro-5H-benzo[5,6] cyclohepta[1,2-b]pyridin-11-yl)-1-piperidincarboxylat ethyl và 1,0 đối với loratadin.
Tiến hành sắc ký lần lượt đối với dung dịch đối chiếu và dung dịch thử. Căn cứ vào diện tích các pic tạp thu được từ dung dịch thử, diện tích pic loratadin thu được từ dung dịch đối chiếu và hàm lượng của loratadin chuẩn, tính hàm lượng các tạp chất, so với lượng loratadin ghi trên nhãn.
Yêu cầu:
4-(8-cloro-11-fluoro-6,11-dihydro-5H-benzo[5,6]cyclohepta[1,2-b]pyridin-11-yl)-1-piperidincarboxylat ethyl: Không được quá 0,2 %;
Từng tạp chất khác: Không được quá 0,1 %;
Tổng các tạp chất trừ 4-(8-cloro-11-fluoro-6,11-dihydro-5H-benzo[5,6]cyclohepta[1,2-b]pyridin-11-yl)-1-piperidincarboxylat ethyl: Không được quá 0,1 %.
Định lượng
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Dung dịch dikali hydrophosphat 0,01 M: Hòa tan 1,74 g dikali hydrophosphat khan (TT) trong nước vừa đủ 1000 ml và trộn đều.
Dung dịch dikali hydrophosphat 0,6 M: Hòa tan 105 g dikali hydrophosphat khan (TT) trong nước vừa đủ 1000 ml và trộn đều.
Pha động: Dung dịch dikali hydrophosphat 0,01 M - methanol - acetonitril (7 : 6 : 6), điều chỉnh pH hỗn hợp về 7,2 ± 0,1 bằng dung dịch acid phosphoric 10 % (TT).
Dung môi pha loãng: Chuyển 400 ml dung dịch acid hydrocloric 0,05 M (TT) và 80 ml dung dịch dikali hydrophosphat 0,6 M vào bình định mức 1000 ml và pha loãng bằng hỗn hợp methanol- acetonitril (1 : 1) vừa đủ đến vạch, trộn đều.
Dung dịch chuẩn: Hòa tan một lượng loratadin chuẩn trong dung môi pha loãng để thu được dung dịch có nồng độ chính xác khoảng 0,4 mg trong 1 ml.
Dung dịch thử: Cân 20 viên (loại bỏ vỏ bao, nếu cần), tính khối lượng trung bình viên và nghiền thành bột mịn. Cân chính xác một lượng bột viên tương ứng với khoảng 40 mg loratadin vào bình định mức 100 ml, thêm 70 ml dung môi pha loãng và lắc siêu âm 15 min, thêm dung môi pha loãng vừa đủ đến vạch, trộn đều và lọc.
Điều kiện sắc ký:
Cột thép không gỉ (15 cm x 4,6 mm) được nhồi pha tĩnh B (5 μm).
Nhiệt độ cột: Từ 25 °C đến 35 °C.
Detector quang phổ tử ngoại đặt ở bước sóng 254 nm.
Tốc độ dòng: 1,0 ml/min.
Thể tích tiêm: 10 μl.
Cách tiến hành:
Kiểm tra tính phù hợp của hệ thống sắc ký:
Tiến hành sắc ký với dung dịch chuẩn và ghi lại sắc ký đồ. Phép thử chỉ có giá trị khi thừa số dung lượng, k', không nhỏ hơn 3,5; hệ số đối xứng của pic loratadin không lớn hơn 1,7; và độ lệch chuẩn tương đối của diện tích pic loratadin không lớn hơn 2,0 %.
Tiến hành sắc ký lần lượt đối với dung dịch chuẩn và dung dịch thử.
Căn cứ vào diện tích pic loratadin thu được từ dung dịch thử, dung dịch chuẩn và hàm lượng C22H23CIN2O2 của loratadin chuẩn, tính hàm lượng loratadin, C22H23CIN2O2, có trong một đơn vị chế phẩm.
Bảo quản
Để nơi khô mát, tránh ánh sáng.
Loại thuốc
Thuốc chống dị ứng (kháng histamin).
Hàm lượng thường dùng
5 mg và 10 mg.
VIÊN NÉN METFORMIN VÀ GLIBENCLAMID
Tabellae metformini et glibenclamidi
Viên nén metformin và glyburid
Là viên nén hoặc viên nén bao phim chứa metformin hydrociorid và glibenclamid.
Chế phẩm phải đáp ứng các yêu cầu trong chuyên luận “Thuốc viên nén” (Phụ lục 1.20) và các yêu cầu sau đây:
Hàm lượng metformin hydroclorid, C4H11N5.HCl, từ 90,0 % đến 110,0 % so với lượng ghi trên nhãn.
Hàm lượng glibenclamid, C23H28CIN3O5S, từ 90,0 % đến 110,0 % so với lượng ghi trên nhãn.
Định tính
A. Trong mục Định lượng metformin hydroclorid, pic chính thu được trên sắc ký đồ của dung dịch thử phải có thời gian lưu tương ứng với thời gian lưu của pic chính thu được trên sắc ký đồ của dung dịch chuẩn metformin hydroclorid.
B. Trong mục Định lượng glibenclamid, pic chính thu được trên sắc ký đồ của dung dịch thử phải có thời gian lưu tương ứng với thời gian lưu của pic chính thu được trên sắc ký đồ của dung dịch chuẩn glibenclamid.
Độ hòa tan (Phụ lục 11.4)
Metformin hydroclorid
Thiết bị: Kiểu cánh khuấy.
Môi trường hòa tan: 1000 ml dung dịch đệm phosphat 0,05 M pH 6,8.
Dung dịch đệm phosphat 0,05 M pH 6,8: Hòa tan 6,8 g kali dihydrophosphat (TT) trong 1000 ml nước, chỉnh pH đến 6,8 ± 0,1 bằng dung dịch natri hydroxyd 0,2 M.
Tốc độ quay: 50 r/min.
Thời gian: 30 min.
Cách tiến hành:
Dung dịch thử: Lấy một phần môi trường sau khi hòa tan, lọc, bỏ dịch lọc đầu. Lọc lại qua màng lọc 0,45 μm hoặc 1 μm. Pha loãng (nếu cần) bằng môi trường hòa tan.
Dung dịch chuẩn: Dung dịch metformin hydroclorid chuẩn trong môi trường hòa tan có nồng độ tương đương nồng độ của dung dịch thử.
Đo độ hấp thụ tử ngoại (Phụ lục 4.1) của các dung dịch trên ở bước sóng cực đại khoảng 232 nm, cốc đo dày 1 cm, mẫu trắng là môi trường hòa tan. Từ độ hấp thụ của dung dịch thử, dung dịch chuẩn và hàm lượng C4H11N5.HCl của metformin hydroclorid chuẩn, tính lượng metformin hydroclorid đã hòa tan trong mỗi viên.
Yêu cầu: Không ít hơn 85 % metformin hydroclorid, C4H11N5.HCl, so với lượng ghi trên nhãn được hòa tan trong 30 min.
Glibenclamid
Thiết bị: Kiểu cánh khuấy.
Môi trường hòa tan: 500 ml dung dịch acid boric và kali clorid 0,05 M được chuẩn bị bằng cách hòa tan 3,09 g acid boric (TT) và 3,73 g kali clorid (TT) trong khoảng 250 ml nước. Chỉnh pH đến 9,5 bằng dung dịch natri hydroxyd 1 M (TT), thêm nước vừa đủ 1000 ml.
Tốc độ quay: 75 r/min.
Thời gian: 30 min.
Xác định lượng glibenclamid hòa tan bằng phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động: Dung dịch đệm amoni phosphat - acetonitril (50 : 50), điều chỉnh đến pH 5,3 bằng dung dịch natri hydroxyd 1 M (TT). Điều chỉnh tỷ lệ nếu cần.
Dung dịch đệm amoni phosphat: Hòa tan 28,8 g amoni dihydrophosphat (TT) trong nước và pha loãng với nước vừa đủ 1000 ml.
Dung dịch thử: Lấy một phần môi trường sau khi hòa tan, lọc, bỏ dịch lọc đầu. Lọc lại qua màng lọc 0,45 μm hoặc 1 μm.
Dung dịch chuẩn: Cân chính xác khoảng 25 mg glibenclamid chuẩn vào bình định mức 100 ml. Thêm 20 ml acetonitril (TT), lắc siêu âm để hòa tan. Thêm môi trường hòa tan vừa đủ, lắc đều. Pha loãng dung dịch này với môi trường hòa tan để có nồng độ tương đương dung dịch thử.
Điều kiện sắc ký:
Cột thép không gỉ (15 cm x 4,6 mm) được nhồi pha tĩnh B (5 μm).
Nhiệt độ cột: 30 °C.
Detector quang phổ tử ngoại đặt ở bước sóng 230 nm.
Tốc độ dòng: 1,5 ml/min.
Thể tích tiêm: 200 μl.
Cách tiến hành:
Tiêm dung dịch chuẩn. Trên sắc ký đồ thu được, số đĩa lý thuyết xác định trên pic glibenclamid không ít hơn 5000. Hệ số đối xứng của pic từ 0,8 đến 2,0. Độ lệch chuẩn tương đối của diện tích pic của 6 lần tiêm lặp lại không lớn hơn 2 %.
Tiêm các dung dịch thử. Từ diện tích pic thu được trên sắc ký đồ của dung dịch thử, dung dịch chuẩn và hàm lượng C23H28CIN3O5S của glibendamid chuẩn, tính hàm lượng glibenclamid đã hòa tan trong mỗi viên.
Yêu cầu: Không ít hơn 85 % glibenclamid, C23H28CIN3O5S, so với lượng ghi trên nhãn được hòa tan trong 30 min.
Độ đồng đều hàm lượng glibenclamid (Phụ lục 11.2)
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Dung môi pha mẫu, dung dịch đệm amoni phosphat, dung dịch chuẩn, pha động và đều kiện sắc ký như mô tả ở mục Định lượng glibenclamid.
Dung dịch thử: Cho 1 viên vào bình định mức 100 ml, thêm 2 ml nước, lắc cho viên rã hoàn toàn. Thêm 70 ml dung môi pha mẫu và lắc siêu âm khoảng 30 min. Để nguội và thêm dung môi pha mẫu vừa đủ, lắc đều. Ly tâm với tốc độ 3000 r/min trong 10 min, sử dụng lớp dịch trong phía trên. Pha loãng dung dịch thu được (nếu cần) với dung môi pha mẫu để có nồng độ glibenclamid khoảng 0,025 mg/ml. Tiến hành lặp lại với 9 viên nữa.
Cách tiến hành: Tiêm lần lượt các dung dịch chuẩn và dung dịch thử, ghi lại sắc ký đồ. Từ diện tích pic thu được của dung dịch thử, dung dịch chuẩn và hàm lượng C23H28CIN3O5S của glibenclamid chuẩn, tính hàm lượng glibenclamid, C23H28CIN3O5S, trong mỗi viên.
Định lượng
Metformin hydroclorid
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Dung môi pha mẫu: Dung dịch acetonitril (TT) 2,5 % (theo thể tích) trong nước.
Dung dịch đệm: Hòa tan 1,0 g natri heptansulfonat (TT) và 1,0 g natri clorid (TT) trong 1800 ml nước. Chỉnh pH đến 3,85 bằng dung dịch acid phosphoric 0,06 M. Thêm nước vừa đủ 2000 ml, trộn đều.
Pha động: Dung dịch đệm - acetonitril (90 : 10). Điều chỉnh tỷ lệ nếu cần.
Dung dịch chuần metformin hydroclorid: Pha dung dịch metformin hydroclorid chuẩn trong dung môi pha mẫu để có nồng độ chính xác khoảng 0,05 mg/ml.
Dung dịch thử: Pha loãng dung dịch thử ở mục định lượng glibenclamid với nước để thu được nồng độ metformin hydroclorid khoảng 0,05 mg/ml.
Điều kiện sắc ký:
Cột thép không gỉ (30 cm x 3,9 mm) được nhồi pha tĩnh C (10 μm).
Nhiệt độ cột: 30 °C.
Detector quang phổ tử ngoại đặt ở bước sóng 218 nm.
Tốc độ dòng: 1 ml/min.
Thể tích tiêm: 20 μl.
Cách tiến hành: Tiêm dung dịch chuẩn. Trên sắc ký đồ thu được, hệ số đối xứng của pic metformin hydroclorid từ 0,8 đến 2,0. Độ lệch chuẩn tương đối của diện tích pic của 6 lần tiêm lặp lại không lớn hơn 1,5 %.
Tiêm dung dịch thử. Từ diện tích pic thu được của dung dịch thử, dung dịch chuẩn và hàm lượng C4H11N5.HCl của metformin chuẩn, tính hàm lượng metformin hydroclorid, C4H11N5.HCl, trong chế phẩm.
Glibenclamid
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Dung mới pha mẫu: Acetonitril - nước (1 : 1).
Dung dịch đệm amoni phosphat: Hòa tan 28,8 g amoni dihydrophosphat (TT) trong nước và pha loãng với nước vừa đủ 1000 ml.
Pha động: Dung dịch đệm amoniphosphat - acetonitril (60 : 40), điều chỉnh đến pH 5,3 bằng dung dịch natri hydroxyd 1 M (TT). Điều chỉnh tỷ lệ nếu cần.
Dung dịch chuẩn: Cân chính xác khoảng 25 mg glibenclamid chuẩn vào bình định mức 100 ml. Thêm 50 ml acetonitril (TT), lắc siêu âm để hòa tan. Thêm nước vừa đủ, lắc đều. Pha loãng dung dịch này với dung môi pha mẫu để có nồng độ chính xác khoảng 0,025 mg/ml.
Dung dịch thử: Cân 20 viên (loại bỏ lớp bao nếu cần), xác định khối lượng trung bình viên và nghiền thành bột mịn. Cân chính xác một lượng bột viên tương đương với 2,5 mg glibenclamid vào bình định mức dung tích 100 ml, thêm khoảng 70 ml dung môi pha mẫu, lắc siêu âm khoảng 30 min để hòa tan. Thêm dung môi pha mẫu vừa đủ, lắc đều. Ly tâm với tốc độ 3000 r/min trong 10 min, sử dụng lớp dịch trong phía trên.
Điều kiện sắc ký:
Cột thép không gỉ (15 cm x 4,6 mm) được nhồi pha tĩnh B (5 μm).
Nhiệt độ cột: 40 °C.
Detector quang phổ tử ngoại đặt ở bước sóng 230 nm.
Tốc độ dòng: 1,2 ml/min.
Thể tích tiêm: 100 μl.
Cách tiến hành:
Tiêm dung dịch chuẩn. Độ lệch chuẩn tương đối của diện tích pic của 6 lần tiêm lặp lại không lớn hơn 1,5 %. Số đĩa lý thuyết xác định trên pic glibenclamid không ít hơn 3000.
Tiêm dung dịch thử. Từ diện tích pic thu được của dung dịch thử, dung dịch chuẩn và hàm lượng C23H28CIN3O5S của glibenclamid chuẩn, tính hàm lượng glibenclamid, C23H28CIN3O5S, trong chế phẩm.
Bảo quản
Để nơi khô mát, tránh ánh sáng.
Loại thuốc
Chống đái tháo đường.
Hàm lượng thường dùng
Metformin hydroclorid 500 mg và glibenclamid 5 mg;
Metformin hydroclorid 500 mg và glibenclamid 2,5 mg.
VIÊN NÉN METOCLOPRAMID
Tabellae Metoclopramidi
Là viên nén chứa metoclopramid hydroclorid.
Chế phẩm phải đáp ứng các yêu cầu trong chuyên luận “Thuốc viên nén” (Phụ lục 1.20) và các yêu cầu sau đây:
Hàm lượng metoclopramid, C14H22CIN3O2, từ 90,0 % đến 110,0 % so với lượng ghi trên nhãn.
Định tính
A. Trong mục Định lượng, sắc ký đồ của dung dịch thử phải có pic chính có thời gian lưu tương ứng với thời gian lưu của pic metoclopramid thu được trên sắc ký đồ của dung dịch chuẩn.
B. Lấy một lượng bột viên có chứa khoảng 50 mg metoclopramid, thêm 5 ml nước, lắc kỹ, lọc, thêm vào dịch lọc 5 ml dung dịch 4-dimethylaminobenzaldehyd 1 % trong acid hydrocloric 1 M, màu cam vàng tạo thành.
Độ hòa tan (Phụ lục 11.4)
Thiết bị: Kiểu giỏ quay.
Môi trường hòa tan: 900 ml nước.
Tốc độ quay: 50 r/min.
Thời gian: 30 min.
Cách tiến hành:
Dung dịch thử: Lấy một phần môi trường đã hòa tan mẫu thử, lọc, bỏ 20 ml dịch lọc đầu. Pha loãng dịch lọc thu được tới nồng độ thích hợp với nước, nếu cần.
Dung dịch chuẩn: Dung dịch metoclopramid hydroclorid chuẩn trong nước có nồng độ metoclopramid tương đương với nồng độ của dung dịch thử.
Đo độ hấp thụ (Phụ lục 4.1) của dung dịch thu được ở bước sóng hấp thụ cực đại khoảng 309 nm, cốc đo dày 1 cm, mẫu trắng là nước. Tính hàm lượng metoclopramid, C14H22CIN3O2, đã hòa tan dựa vào độ hấp thụ của dung dịch thử, dung dịch chuẩn và hàm lượng C14H22CIN3O2.HCl của metoclopramid hydroclorid chuẩn.
Yêu cầu: Không ít hơn 75 % lượng metoclopramid, C14H22CIN3O2, so với lượng ghi trên nhãn được hòa tan trong 30 min.
Định lượng
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động: Hòa tan 2,7 g natri acetat (TT) trong 500 ml nước, thêm 500 ml acetonitril (TT), 2 ml dung dịch tetramethylamoni hydroxyd 25 %, điều chỉnh tới pH 6,5 bằng acid acetic băng (TT), lắc đều, lọc.
Dung dịch thử: Cân 20 viên, xác định khối lượng trung bình viên và nghiền thành bột mịn. Cân chính xác một lượng bột viên tương ứng với khoảng 40 mg metoclopramid vào bình định mức 100 ml, thêm 70 ml dung dịch acid phosphoric 0,01 M, lắc siêu âm trong 5 min, để nguội, thêm dung dịch acid phosphoric 0,01 M đến định mức, lắc đều, lọc. Pha loãng 10,0 ml dịch lọc thành 100,0 ml với dung dịch acid phosphoric 0,01 M.
Dung dịch chuẩn: Cân chính xác khoảng 45 mg metoclopramid hydroclorid chuẩn vào một bình định mức 100 ml, hòa tan bằng dung dịch acid phosphoric 0,01 M và pha loãng đến định mức với cùng dung môi, lắc đều. Pha loãng 10,0 ml dung dịch thu được thành 100,0 ml với dung dịch acid phosphoric 0,01 M.
Điều kiện sắc ký:
Cột thép không gỉ (25 cm x 4,6 mm) được nhồi pha tĩnh C.
Detector quang phổ tử ngoại đặt ở bước sóng 305 nm.
Tốc độ dòng: 1 ml/min.
Thể tích tiêm: 20 μl.
Cách tiến hành:
Tiến hành sắc ký với dung dịch chuẩn, hệ số đối xứng của pic metoclopramid không được lớn hơn 2,0 và độ lệch chuẩn của diện tích pic từ 6 lần tiêm lặp lại không được lớn hơn 2,0 %.
Tiến hành sắc ký lần lượt với dung dịch chuẩn và dung dịch thử.
Tính hàm lượng metoclopramid, C14H22CIN3O2, trong viên dựa vào diện tích pic thu được trên sắc ký đồ của dung dịch thử, dung dịch chuẩn và hàm lượng C14H22CIN3O2.HCl của metoclopramid hydroclorid chuẩn.
Bảo quản
Tránh ánh sáng.
Loại thuốc
Phòng và chống nôn.
Hàm lượng thường dùng
5 mg, 10 mg. Hàm lượng tính theo metoclopramid.
VIÊN NÉN PARACETAMOL VÀ IBUPROFEN
Tabellae Paracetamoli et Ibuprofeni
Là viên nén chứa paracetamol và ibuprofen.
Chế phẩm phải đáp ứng các yêu cầu trong chuyên luận “Thuốc viên nén” (Phụ lục 1.20) và các yêu cầu sau đây:
Hàm lượng paracetamol, C8H9NO2, từ 90,0 % đến 110,0 % so với lượng ghi trên nhãn.
Hàm lượng ibuprofen, C13H18O2, từ 90,0 % đến 110,0 % so với lượng ghi trên nhãn.
Định tính
Trong mục Định lượng, sắc ký đồ thu được từ dung dịch thử phải cho hai pic chính có thời gian lưu tương ứng với pic paracetamol và pic ibuprofen trên sắc ký đồ thu được từ dung dịch chuẩn paracetamol và dung dịch chuẩn ibuprofen.
Độ hoà tan (Phụ lục 11.4)
Thiết bị: Kiểu cánh khuấy.
Môi trường hoà tan: 900 ml dung dịch đệm phosphat pH 7,2 (TT).
Tốc độ quay: 50 r/min.
Thời gian: 45 min.
Cách tiến hành:
Dung dịch thử: Lấy một phần môi trường sau khi hòa tan, lọc, bỏ 20 ml dịch lọc đầu.
Dung dịch chuẩn paracetamol: Cân chính xác khoảng 36 mg paracetamol chuẩn cho vào bình định mức 100 ml, thêm 20 ml methanol (TT), lắc kỹ, thêm môi trường hòa tan vừa đủ đến vạch, lắc đều.
Dung dịch chuẩn ibuprofen: Cân chính xác khoảng 44 mg ibuprofen chuẩn cho vào bình định mức 100 ml, thêm 20 ml methanol (TT), lắc kỹ, thêm môi trường hòa tan vừa đủ đến vạch. Pha loãng (nếu cần) một thể tích dung dịch thu được bằng môi trường hòa tan để thu được dung dịch có nồng độ ibuprofen tương ứng với dung dịch thử.
Xác định hàm lượng paracetamol và ibuprofen hòa tan bằng phương pháp sắc ký lỏng (Phụ lục 5.3) với các điều kiện sắc ký như mô tả trong mục Định lượng.
Yêu cầu: Không ít hơn 75 % lượng paracetamol (C8H9NO2) và 75 % lượng ibuprofen (C13H18O2) so với lượng ghi trên nhãn được hòa tan trong 45 min.
Định lượng
Phương pháp sắc ký lỏng (Phự lục 5.3).
Pha động: Acetonitril - dung dịch acid phosphoric 0,01 % (60 : 40), điều chỉnh tỷ lệ nếu cần.
Dung dịch chuẩn paracetamol: Cân chính xác khoảng 32,5 mg paracetamol chuẩn vào bình định mức 100 ml, thêm khoảng 80 ml pha động, lắc siêu âm 15 min, thêm pha động vừa đủ đến vạch, lắc đều.
Dung dịch chuẩn ibuprofen: Cân chính xác một lượng khoảng 40 mg ibuprofen chuẩn cho vào bình định mức 100 ml thêm khoảng 80 ml pha động, lắc siêu âm 15 min, thêm pha động đến vạch, lắc đều.
Pha loãng (nếu cần) một thể tích dung dịch thu được bằng pha động để thu được một dung dịch có nồng độ ibuprofen tương ứng với dung dịch thử.
Dung dịch thử: Cân 20 viên, tính khối lượng trung bình viên và nghiền thành bột mịn. Cân chính xác một lượng bột viên tương ứng khoảng 325 mg paracetamol cho vào bình định mức 100 ml, thêm khoảng 80 ml pha động, lắc siêu âm 15 min, thêm pha động vừa đủ đến vạch, lắc đều, lọc. Pha loãng 10,0 ml dịch lọc thành 100,0 ml bằng pha động.
Điều kiện sắc ký:
Cột thép không gỉ (25 cm x 4,6 mm) được nhồi pha tĩnh C (10 μm).
Detector quang phổ tử ngoại đặt ở bước sóng 220 nm.
Tốc độ dòng: 2 ml/min.
Thể tích tiêm: 20 μl.
Cách tiến hành:
Tiến hành sắc ký lần lượt với các dung dịch chuẩn và thử.
Căn cứ vào diện tích pic thu được từ dung dịch thử và dung dịch chuẩn và hàm lượng của các chất chuẩn, tính hàm lượng phần trăm paracetamol, C8H9O2N, và ibuprofen, C13H18O2, có trong chế phẩm.
Bảo quản
Nơi khô mát, tránh ánh sáng.
Loại thuốc
Hạ nhiệt giảm đau.
Hàm lượng thường dùng
325 mg paracetamol và 400 mg ibuprofen;
325 mg paracetamol và 200 mg ibuprofen;
325 mg paracetamol và 100 mg ibuproten.
VIÊN NÉN TRIMETAZIDIN
Tabellae Trimetazidini
Là viên nén chứa trimetazidin hydroclorid.
Chế phẩm phải đáp ứng các yêu cầu trong chuyên luận “Thuốc viên nén” (Phụ lục 1.20) và các yêu cầu sau đây:
Hàm lượng trimetazidin hydroclorid, C14H22N2O3.2HCl, từ 94,0 % đến 106,0 % so với lượng ghi trên nhãn.
Định tính
A. Lắc một lượng bột viên đã nghiền mịn tương đương khoảng 10 mg trimetazidin hydroclorid với 10 ml hỗn hợp ethanol 95 % - nước (3 : 1), lọc. Bốc hơi dịch lọc đến khô trên cách thủy. Hòa tan cắn bằng 2 ml nước. Lấy 1 ml dung dịch thu được, thêm 1 ml dung dịch p-benzoquinon (TT), đun sôi khoảng 2 đến 3 min, để nguội, xuất hiện màu đỏ.
B. Trong mục Định lượng, trên sắc ký đồ thu được của dung dịch thử phải có pic có thời gian lưu tương ứng với thời gian lưu của pic chính trên sắc ký đồ của dung dịch chuẩn.
Độ đồng đều hàm lượng (Phụ lục 11.2)
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động, điều kiện sắc ký và cách tiến hành như mô tả trong mục Định lượng.
Dung dịch thử: Cho một viên vào một bình định mức dung tích 100 ml, thêm khoảng 70 ml hỗn hợp ethanol - dung dịch acid hydrocloric 0,1 M (1 : 1), lắc đến khi viên rã hoàn toàn, lắc siêu âm khoảng 10 min, thêm cùng dung môi tới vạch, lắc đều, lọc. Pha loãng 5,0 ml dịch lọc thành 100,0 ml với dung dịch acid hydrocloric 0,1 M (TT).
Dung dịch chuẩn: Cân chính xác một lượng trimetazidin hydroclorid chuẩn tương đương với lượng trimetazidin có trong một viên và chuyển vào bình định mức 100 ml, thêm khoảng 70 ml hỗn hợp ethanol - dung dịch acid hydrocloric 0,1 M (1 : 1), lắc siêu âm khoảng 10 min, thêm cùng dung môi tới vạch, lắc đều, lọc. Pha loãng 5,0 ml dịch lọc thành 100,0 ml với dung dịch acid hydroclonc 0,1 M (TT).
Độ hoà tan (Phụ lục 11.4)
Thiết bị: Kiểu cánh khuấy.
Môi trường hoà tan: 900 ml nước.
Tốc độ quay: 50 r/min.
Thời gian: 45 min.
Cách tiến hành:
Dung dịch thử: Lấy một phần môi trường sau khi hoà tan, lọc, bỏ dịch lọc đầu. Pha loãng dịch lọc với dung dịch acid hydrocloric 0,1 M (TT) để được dung dịch có nồng độ trimetazidin hydroclorid khoảng 10 μg/ml.
Dung dịch chuẩn: Cân chính xác khoảng 20,0 mg trimetazidin hydroclorid chuẩn cho vào bình định mức 100 ml, hòa tan và thêm môi trường hòa tan vừa đủ 100,0 ml, pha loãng 5,0 ml dung dịch thu được thành 100,0 ml với dung dịch acid hydrocloric 0,1 M (TT).
Tiến hành phương pháp sắc ký lỏng (Phụ lục 5.3) với pha động, điều kiện sắc ký như mô tả trong mục Định lượng.
Tiến hành sắc ký lần lượt với dung dịch chuẩn và dung dịch thử. Tính lượng trimetazidin hydroclorid, C14H22N2O3.2HCl, đã hòa tan trong mỗi viên.
Yêu cầu: Không ít hơn 80 % lượng trimetazidin hydroclorid, C14H22N2O3.2HCl, so với lượng ghi trên nhãn được hòa tan trong 45 min.
Định lượng
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động: Dung dịch kali dihydrophosphat 0,05 M điều chỉnh đến pH 3,0 bằng acid phosphoric - methanol (17 : 3). Điều chỉnh tỷ lệ nếu cần.
Dung dịch thử: Cân 20 viên, tính khối lượng trung bình và nghiền thành bột mịn. Cân chính xác một lượng bột viên tương ứng với khoảng 20 mg trimetazidin hydroclorid vào bình định mức 100 ml, thêm khoảng 70 ml hỗn hợp gồm ethanol - dung dịch acid hydrocloric 0,1 M (1 : 1), lắc siêu âm trong 10 min, thêm cùng dung môi vừa đủ tới vạch, lắc đều, lọc. Pha loãng 5,0 ml dịch lọc thành 100,0 ml với dung dịch acid hydrocloric 0,1 M (TT).
Dung dịch chuẩn: Cân chính xác 20,0 mg trimetazidin hydroclorid chuẩn và chuyển vào bình định mức 100 ml, hòa tan bằng hỗn hợp ethanol - dung dịch acid hydrocloric 0,1 M (1 : 1) và thêm cùng dung môi vừa đủ tới vạch, lắc đều. Pha loãng 5,0 ml dung dịch thu được thành 100,0 ml với dung dịch acid hydrocloric 0,1 M (TT).
Điều kiện sắc ký:
Cột thép không gỉ (15 cm x 4,6 mm) chứa pha tĩnh C (5 μm).
Nhiệt độ cột: 40 °C.
Detector quang phổ tử ngoại đặt ở bước sóng 230 nm.
Tốc độ dòng: 1,0 ml/min, điều chỉnh tốc độ dòng để thời gian lưu của trimetazidin hydroclorid khoảng 7 min.
Thể tích tiêm: 20 μl.
Cách tiến hành:
Kiểm tra tính phù hợp của hệ thống sắc ký: Tiến hành sắc ký với dung dịch chuẩn, hệ số đối xứng thu được từ pic chính trimetazidin hydroclorid không lớn hơn 1,5; hiệu lực cột xác định trên pic chính trimetazidin hydroclorid không ít hơn 5000 đĩa lý thuyết; độ lệch chuẩn tương đối của các diện tích đáp ứng từ 6 lần tiêm lặp lại không lớn hơn 2,0 %.
Tiến hành sắc ký lần lượt đối với dung dịch chuẩn và dung dịch thử.
Tính hàm lượng trimetazidin hydroclorid, C14H22N2O3.2HCl, có trong chế phẩm dựa vào diện tích pic thu được từ sắc ký đồ của dung dịch thử, dung dịch chuẩn và hàm lượng C14H22N2O3.2HCl trong trimetazidin hydroclorid chuẩn.
Bảo quản
Trong bao bì kín, nơi khô mát.
Loại thuốc
Tim mạch.
Hàm lượng thường dùng
20 mg.
PHẦN 4
DƯỢC LIỆU
BÈO TẤM
Herba Spirodelae polyrrhizae
Phù bình, Tử bình, Bèo tấm tía
Toàn cây phơi sấy khô của cây Bèo tấm (Spirodela polyrrhiza (L.) Schield., họ Bèo tấm (Lemmaceae).
Mô tả
Dược liệu là những búi nhỏ từ những cây bèo họp lại, mỗi cây thường có 2 đến 3 phiến (cánh bèo) hình trứng nhỏ dính với nhau bằng các rễ mảnh dạng sợi.
Soi bột
Bột màu lục xám, vị nhạt, hơi tê lưỡi, mùi hơi tanh. Soi dưới kính hiển vi thấy: mảnh phiến lá có các tế bào thành uốn lượn, mang các lỗ khí, các đảm tinh thể hình kim xếp thành bó. Nhiều lông che chở đa bào gồm 5 đến 7 tế bào xếp thành một dãy, rải rác có sợi thành mỏng kết thành bó. Các tinh thể calci oxalat hình kim riêng lẻ hay xếp thành bó.
Định tính
Phương pháp sắc ký lớp mỏng (Phụ lục 5.4).
Bản mỏng: Silica gel 60 F254.
Dung môi khai triển: Ethyl acetat - butanol - acid formic - nước (6 : 3 : 1 : 1).
Dung dịch thử: Lấy 1 g bột thô dược liệu, ngâm 30 min trong 20 ml methanol (TT) thỉnh thoảng lắc, lọc, cô dịch lọc tới khoảng 1 ml dùng làm dung dịch thử.
Dung dịch đối chiếu: Lấy 1 g bột Bèo tấm (mẫu chuẩn), tiến hành chiết cùng điều kiện như đối với dung dịch thử.
Cách tiến hành: Chấm riêng biệt lên cùng bản mỏng 5 μl đến 10 μl mỗi dung dịch thử và dung dịch đối chiếu. Sau khi khai triển, bản mỏng được để khô ngoài không khí ở nhiệt độ phòng. Quan sát dưới ánh sáng tử ngoại ở bước sóng 254 nm, trên sắc ký đồ của dung dịch thử phải có các vết có cùng giá trị Rf và màu sắc với các vết trên sắc ký đồ của dung dịch đối chiếu.
Độ ẩm
Không quá 13,0 % (Phụ lục 9.6, 1 g, 85 °C, 4 h).
Tạp chất
Không được quá 1 %. (Phụ lục 12.11).
Chất chiết dược trong dược liệu
Không dưới 8,0 % tính theo dược liệu khô kiệt.
Tiến hành theo phương pháp chiết nóng (Phụ lục 12.10). Dùng nước làm dung môi.
Chế biến
Thu hoạch vào mùa hè, rửa sạch, loại bỏ tạp chất, phơi sấy khô.
Bảo quản
Để nơi khô ráo, thoáng mát, định kỳ phơi sấy lại.
Tính vị, quy kinh
Vị cay, tính hàn. Vào kinh phế.
Công năng chủ trị
Giải nhiệt, lợi tiểu. Chữa mẩn ngứa, phủ thũng.
Cách dùng, liều lượng
Ngày dùng 3 g đến 9 g, dạng thuốc sắc để uống hoặc sắc lấy nước để ngâm rửa.
BỒ KẾT (Quả)
Fructus Gleditsiae australis
Tạo giác, Trư nha tạo
Quả chín phơi hay sấy khô của cây Bồ kết (Gleditsia australis Hemsl.), họ Đậu (Fabaceae).
Mô tả
Quả dẹt và hơi cong, dài 5 cm đến 11 cm, rộng 1,5 cm đến 2 cm. Mặt ngoài nâu tía phủ chất sáp màu trắng tro, lấm tấm như bột, lau sạch có màu sáng bóng, dễ thấy các bướu và tuyến nhỏ, các vết nứt dạng vân lưới. Đỉnh quả có gốc vòi nhụy tồn tại dạng mỏ chim, gốc quả có vết sẹo của cuống quả. Chất cứng, giòn, dễ gẫy. Mặt gẫy màu vàng nâu đến lục nhạt, giữa xốp hoặc là khoang chứa hạt. Mùi hăng nhẹ, vị ngọt sau hơi cay.
Bột
Màu vàng nâu, nhiều tế bào thành dày hóa gỗ hình tròn hay hình bầu dục hoặc hình không đều, đường kính 15 μm đến 53 μm. Nhiều sợi thường xếp thành bó, đường kính sợi 10 μm đến 35 μm, thành hơi hoá gỗ, được bao quanh bởi các tế bào mô mềm có chứa tinh thể calci oxalat hình lăng trụ và một vài cụm sợi tinh thể, đi kèm bó sợi thường có tế bào thành dày hình gần vuông. Các tinh thể calci oxalat hình lăng trụ dài 6 μm đến 15 μm, những bó tinh thể đường kính 6 μm đến 14 μm. Nhiều tế bào mô mềm có thành hoá gỗ, có nhiều lỗ (hốc) và ống trao đổi rõ. Tế bào biểu bì vỏ quả màu nâu đỏ, hình đa giác, thành tương đối dày, với lớp cutin có gợn vân dạng hạt.
Định tính
A. Lấy khoảng 1 g bột dược liệu, thêm 8 ml ethanol 95 %(TT), đun hồi lưu trên cách thủy khoảng 5 min, để nguội, lọc. Lấy khoảng 0,5 ml dịch lọc cho vào 1 chén sứ nhỏ, bốc hơi tới khô trên cách thủy, để nguội. Thêm 3 giọt anhydrid acetic (TT), khuấy đều rồi thêm 2 giọt acid sulfuric (TT) dọc theo thành chén, sẽ xuất hiện màu đỏ tía.
B. Đun sôi khoảng 1 g bột dược liệu với 10 ml nước trong 10 min, lọc. Lắc mạnh dịch lọc, lớp bọt tạo thành bền vững trên 15 min.
Độ ẩm
Không quá 14,0 % (Phụ lục 9.6, 1 g, 105 °C, 4 h).
Tro toàn phần
Không quá 5,0 % (Phụ lục 9.7).
Tạp chất
Không quá 1,0 % (Phụ lục 12.11).
Chất chiết được trong dược liệu
Không ít hơn 45,0 % tính theo dược liệu khô kiệt.
Tiến hành theo phương pháp chiết nóng (Phụ lục 12.10), dùng nước làm dung môi.
Chế biến
Thu hoạch vào tháng 10 - 11, hái lấy quả chín (quả có màu hơi vàng), loại bỏ tạp chất, rửa sạch, phơi khô, khi dùng giã nát.
Bảo quản
Để nơi khô, thoáng, tránh mọt.
Tính vị, quy kinh
Tân, hàm, ôn, hơi độc. Vào các kinh phế, đại trường.
Công năng, chủ trị
Khai khiếu, tiêu đờm, tán kết, tiêu thũng. Chủ trị: Trúng phong cắn răng, đàm thịnh, quan khiếu không thông, họng đau tê đờm trướng ngại, ho suyễn khó khạc đờm, đại tiện táo kết.
Dùng ngoài trị nhọt độc sưng tấy.
Cách dùng, liều lượng
Ngày dùng 1 g đến 1,5 g, thường dùng loại hoàn, tán.
Dùng ngoài lượng thích hợp, tán thành bột mịn, thổi nhẹ vào mũi cho hắt hơi, hoặc đắp nơi đau.
Kiêng kỵ
Có thai hoặc thổ huyết, khạc ra huyết cấm dùng.
CAO ĐẶC ĐINH LĂNG
Extractum Polysciacis fruticosae spissum
Cao đặc đinh lăng được bào chế từ rễ cây Đinh lăng (Polyscias fruticosa Harms) họ Nhân sâm (Araliaceae) bằng phương pháp thích hợp để chế phẩm có hàm lượng hoạt chất ổn định.
Chế phẩm phải đáp ứng các yêu cầu trong chuyên luận “Cao thuốc” (Phụ lục 1.1) và các yêu cầu sau đây:
Mô tả
Thể chất mềm dẻo, đồng nhất, màu nâu đen, mùi thơm.
Định tính
A. Hoà tan 1 g chế phẩm trong 20 ml methanol (TT) bằng cách dùng đũa thủy tinh khuấy kỹ, lắc siêu âm trong 15 min, lọc. Được dịch lọc A.
Cho 5 ml dịch lọc A vào ống nghiệm sạch, cô cạn, thêm 10 ml nước cất, bịt miệng ống nghiệm, lắc trong 15 s. Xuất hiện cột bọt bền ít nhất trong vòng 10 min.
Cho 1 ml dịch lọc A vào ống nghiệm sạch, cô cạn, hoà tan cắn bằng 1 ml cloroform (TT). Thêm 1 ml anhydrid acetic (TT), thêm từ từ theo thành ống 1 ml acid sulfuric (TT). Xuất hiện vòng có màu từ hồng đến tím đậm giữa 2 lớp dung dịch thử.
B. Phương pháp sắc ký lớp mỏng (Phụ lục 5.4).
Bản mỏng: Silica gel 60 GF254 đã hoạt hoá ở 100 °C trong 30 min.
Dung môi khai triển: n-Butanol - acid acetic - nước (4 : 1: 5), lắc hỗn hợp, để yên lấy lớp trên.
Dung dịch thử: Lấy 10 ml dịch lọc A cô đến cắn, hòa cắn với 10 ml nước cất. Dịch nước được lắc với diethyl ether (TT) cho đến khi lớp ether không màu hoặc màu rất nhạt. Lớp nước được lắc hai lần, mỗi lần 10 ml n-butanol bão hòa nước, gộp dịch chiết n-butanol, bốc hơi trên cách thủy đến cắn. Hoà cắn với 1 ml methanol (TT) được dịch chấm sắc ký.
Dung dịch đối chiếu: Lấy 10 g rễ Đinh lăng (mẫu chuẩn) đã cắt nhỏ, đun hồi lưu trên cách thủy sôi với 30 ml methanol (TT) trong 2 h, lọc. Lấy dịch methanol cất thu hồi dung môi và cô trên cách thủy đến cắn. Tiếp tục tiến hành chiết như mô tả tại phần Dung dịch thử, bắt đầu từ “hòa cắn với 10 ml nước cất…”
Cách tiến hành: Chấm riêng biệt lên bản mỏng 5 μl mỗi dung dịch trên. Sau khi khai triển, lấy bản mỏng ra, để khô ở nhiệt độ phòng, phun dung dịch acid sulfuric 10 % trong ethanol (TT), sấy bản mỏng ở 105 °C cho tới khi hiện rõ vết. Quan sát dưới ánh sáng thường và dưới ánh sáng tử ngoại bước sóng 366 nm.
Trên sắc ký đồ của dung dịch thử phải có vết có cùng màu sắc và giá trị Rf với các vết trên sắc ký đồ của dung dịch đối chiếu.
C. Phương pháp sắc ký lớp mỏng (Phụ lục 5.4).
Bản mỏng: Silica gel 60 GF254 đã hoạt hoá ở 100 °C trong 30 min.
Dung môi khai triển: Toluen - ethyl acetat (7: 3).
Dung dịch thử: Lấy 0,1 g chế phẩm, thêm 10 ml dung dịch acid hydrocloric 4 M (TT), đun hồi lưu trong 4 h. Lấy dịch chiết lắc 3 lần, mỗi lần 10 ml cloroform (TT). Rửa dịch cloroform với nước cất đến pH trung tính. Tập trung dịch chiết cloroform và cô trên cách thủy đến còn khoảng 1 ml.
Dung dịch đối chiếu: Dung dịch acid oleanolic chuẩn 0,1 % trong cloroform (TT) (dung dịch B)
Cách tiến hành: Chấm riêng biệt lên bản mỏng 5 μI mỗi dung dịch trên. Sau khi khai triển, lấy bản mỏng ra, để khô ở nhiệt độ phòng, phun dung dịch acid sulfuric 10 % trong ethanol (TT), sấy bản mỏng ở 105 °C cho tới khi hiện rõ vết. Quan sát dưới ánh sáng thường và dưới ánh sáng tử ngoại bước sóng 366 nm. Trên sắc ký đồ của dung dịch thử phải cho vết có cùng màu và giá trị Rf với các vết trên sắc ký đồ của dung dịch đối chiếu.
Mất khối lượng do làm khô
Không được quá 20,0 % (Phụ lục 9.6, 1 g, 105 °C đến khối lượng không đổi).
Kim loại nặng
Không được quá 20 phần triệu.
Tiến hành phép thử giới hạn kim loại nặng (Phụ lục 9.4.8, phương pháp 3), sử dụng 1 g chế phẩm và 2 ml dung dịch chì mẫu 10 phần triệu Pb (TT).
Định lượng acid oleanolic
Xác định bằng phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động: Acetonitril - nước (80 : 20).
Dung dịch thử: Cân chính xác khoảng 5 g chế phẩm vào bình nón nút mài 100 ml, thêm 40 ml dung dịch acid hydrocloric 4 M (TT), lắc siêu âm 10 min. Đun sôi hồi lưu trong 3 h, để nguội, lọc dịch thủy phân lấy cắn. Dùng 30 ml nước (chia làm 3 lần) tráng bình thủy phân và gộp nước rửa và lọc qua giấy lọc trên. Dùng nước để rửa giấy lọc và cắn đến khi nước rửa trung tính (thử bằng giấy quỳ). Sấy cắn và giấy lọc ở 60 °C đến khô (khoảng 2 h). Thêm vào cắn 30 ml cloroform (TT), đun sôi nhẹ trên cách thủy 5 min, lọc. Chiết lại cắn như trên 2 lần nữa, Tập trung các dịch chiết cloroform, cô trên cách thủy đến cạn. Hoà tan cắn vừa đủ trong 5 ml methanol (TT), trộn đều, lọc qua màng lọc 0,45 μm.
Dung dịch chuẩn:
Cân chính xác khoảng 10 mg acid oleanolic chuẩn vào bình định mức 10 ml, thêm 8 ml methanol (TT), lắc kỹ để hòa tan, bổ sung methanol vừa đủ đến vạch, trộn đều. Lọc qua màng lọc 0,45 μm.
Điều kiện sắc ký:
Cột thép không gỉ kích thước (25 cm x 4,6 mm) được nhồi pha tĩnh C (5 μm) hoặc tương đương (cột Inertsil C18 là thích hợp).
Detector quang phổ tử ngoại đặt ở bước sóng 205 nm.
Tốc độ dòng: 1,3 ml/min.
Thể tích tiêm: 10 μl
Cách tiến hành:
Tiến hành sắc ký lần lượt với dung dịch thử và dung dịch chuẩn. Tính hàm lượng acid oleanolic dựa vào diện tích pic thu được trên sắc ký đồ của dung dịch thử, dung dịch chuẩn và nồng độ của dung dịch acid oleanolic chuẩn.
Hàm lượng acid oleanolic trong chế phẩm không được ít hơn 0,04 % tính theo chế phẩm khô kiệt.
Bảo quản
Đóng trong bao bì kín, chống ẩm. Để nơi khô ráo, mát.
CAO KHÔ LÁ BẠCH QUẢ
Etractum Folium Ginkgo Siccus
Cao khô lá bạch quả được bào chế từ lá cây Bạch quả (Ginkgo biloba L, ), họ Bạch quả (Ginkgoaceae) theo phương pháp thích hợp để chế phẩm có hàm lượng hoạt chất ổn định.
Chế phẩm phải đáp ứng các yêu cầu trong chuyên luận “Cao thuốc” (Phụ lục 1.1) và các yêu cầu sau đây:
Mô tả
Bột có màu nâu vàng nhạt hoặc nâu đậm. Vị hơi đắng.
Định tính
A. Phương pháp sắc ký lớp mỏng (Phụ lục 5.4).
Bản mỏng: Silica gel G60F254 tráng sẵn (TT).
Dung môi khai triển: Ethyl acetat - butan-2-on - acid formic - nước (5 : 3 : 1 : 1).
Dung dịch thử: Lấy 0,2 g chế phẩm, thêm 15 ml n-butanol (TT), ngâm trong cách thủy ấm 15 min, thỉnh thoảng lắc đều, để nguội, lọc, bay hơi dịch lọc tới cắn khô. Hòa tan cắn trong 6 ml ethanol 95 % (TT) được dung dịch thử.
Dung dịch đối chiếu: Lấy 0,2 g cao khô Bạch quả (mẫu chuẩn), chiết bằng cách tương tự như dung dịch thử, được dung dịch đối chiếu.
Cách tiến hành: Chấm riêng biệt 10 μl mỗi dung dịch trên lên bản mỏng. Sau khi khai triển, lấy bản mỏng ra để khô trong không khí, phun dung dịch nhôm clorid 3 % trong ethanol (TT) sấy bản mỏng ở 120 °C trong 10 min. Kiểm tra dưới ánh sáng tử ngoại ở bước sóng 366 nm. Các vết phát huỳnh quang thu được trên sắc ký đồ của dung dịch thử phải có cùng màu sắc và giá trị Rf với các vết thu được trên sắc ký đồ của dung dịch đối chiếu.
B. Phương pháp sắc ký lớp mỏng (Phụ lục 5.4).
Bản mỏng: Silica gel 60 F254 tráng sẵn (TT) nhúng khoảng 2 s trong dung dịch gồm 8 g natri acetat (TT) hoà trong 200 ml methanol (TT), sau đó sấy ở 70 °C trong 10 min.
Dung môi khai triển: Toluen - ethyl acetat - aceton - methanol (10 : 5 : 5 : 0,6).
Cách tiến hành: Chấm riêng biệt 15 μl mỗi dung dịch thử và dung dịch chuẩn trong mục Định lượng terpen lacton lên bản mỏng. Sau khi khai triển, lấy bản mỏng ra để khô ở nhiệt độ phòng, phun anhydrid acetic (TT), sấy bản mỏng ở 160 °C trong 10 min, để nguội. Kiểm tra dưới ánh sáng tử ngoại ở bước sóng 254 nm.
Các vết thu được trên sắc ký đồ của dung dịch thử phải có cùng màu sắc và giá trị Rf với các vết thu được trên sắc ký đồ của dung dịch chuẩn.
C. Từ sắc ký đồ thu được trong mục Định lượng flavonol glycosid: Thời gian lưu của các pic quercetin, isorhamnetin và kaempferol của dung dịch thử phải tương ứng với thời gian lưu của các chất đó trên sắc ký đồ của dung dịch chuẩn. Tỷ lệ diện tích pic của quercetin và kaempferol là 0,8 đến 1,2 và tỷ lệ diện tích pic của isorhamnetin và quercetin phải lớn hơn 0,15.
Độ ẩm
Không được quá 5,0 % (Phụ lục 12.16, dùng 1 g chế phẩm để tiến hành thử).
Cắn sau khi nung
Không được quá 0,8 %.
Lấy một chén sứ hoặc chén platin nung tới đỏ trong 30 min. Để nguội trong bình hút ẩm rồi cân. Lấy 1 g chế phẩm rải đều vào chén nung, đốt nhẹ để than hóa hoàn toàn, để nguội, làm ẩm cắn bằng 0,5 ml đến 1 ml acid sulfuric (TT). Đốt nhẹ cho đến khi không còn khói trắng bay lên, rồi đem nung trong lò nung ở 500 °C đến 600 °C cho đến khi vô cơ hóa hoàn toàn (cắn màu trắng hay xám nhạt). Để nguội trong bình hút ẩm và cân, nung lại ở 500 °C đến 600 °C đến khối lượng không đổi.
Kim loại nặng
Không được quá 20 phần triệu.
Tiến hành phép thử giới hạn kim loại nặng (Phụ lục 9.4.8, phương pháp 3), sử dụng 1 g chế phẩm và 2 ml dung dịch chì mẫu 10 phần triệu Pb (TT).
Acid ginkgolic toàn phần
Không được quá 10 phần triệu tính theo chế phẩm khô kiệt.
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động: Methanol - dung dịch acid acetic băng 1 % (90 : 10).
Dung dịch thử: Cân chính xác khoảng 10 g chế phẩm vào bình nón nút mài, thêm chính xác 50 ml ether dầu hỏa (60 °C đến 90 °C) (TT) và cân. Đun hồi lưu trong 2 h, để nguội, cân lại, bù khối lượng bị mất bằng ether dầu hỏa (60 °C đến 90 °C) (TT), lắc kỹ, lọc. Lấy chính xác 25 ml dịch lọc, thu hồi dung môi tới khô trong chân không, thêm chính xác 2 ml methanol (TT), đậy kín và lắc đều.
Dung dịch chuẩn:
Hòa tan một lượng acid ginkgoneolic chuẩn (cân chính xác) trong methanol (TT) để có dung dịch chứa 5 μg/ml làm dung dịch chuẩn.
Hòa tan một lượng acid ginkgolic toàn phần trong methanol (TT) để được dung dịch có chứa 100 μg/ml để làm dung dịch chuẩn cho việc nhận dạng các pic.
Điều kiện sắc ký:
Cột thép không gỉ kích thước (25 cm x 4,6 mm) được nhồi pha tĩnh C (10 μm) hoặc tương đương (cột RP 18 là thích hợp).
Detector quang phổ tử ngoại đặt ở bước sóng 310 nm.
Tốc độ dòng: 1,0 ml/min.
Thể tích tiêm: 10 μl
Cách tiến hành:
Sự thích hợp của hệ thống: Tiến hành sắc ký với dung dịch chuẩn. Số đĩa lý thuyết của cột không được ít hơn 4000 tính theo pic acid ginkgoneolic.
Tiến hành sắc ký lần lượt với dung dịch thử và dung dịch chuẩn. Xác định tổng diện tích pic của các acid ginkgolic trong dung dịch thử, xác định những pic này bằng cách đối chiếu với những pic tương ứng đạt được trên sắc ký đồ của dung dịch chuẩn chứa acid ginkgolic toàn phần, tính hàm lượng acid ginkgolic toàn phần theo acid ginkgoneolic.
Định lượng flavonol glycosid toàn phần
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động: Methanol - dung dịch acid phosphoric 0,4% (55 : 45).
Dung dịch thử: Cân chính xác khoảng 35 mg chế phẩm, thêm 25 ml hỗn hợp methanol (TT) và dung dịch acid hydrocloric 25 % (TT) (4 : 1). Đun hồi lưu trên cách thủy trong 30 min, làm nguội đến nhiệt độ phòng ngay lập tức, chuyển toàn bộ hỗn hợp vào bình định mức 50 ml, pha loãng bằng methanol (TT) tới vạch, lắc đều, lọc, dùng dịch lọc làm dung dịch thử.
Dung dịch chuẩn: Hòa tan lần lượt quercetin chuẩn, kaempferol chuẩn và isorhamnetin chuẩn (cân chính xác) trong methanol (TT) để có dung dịch chứa lần lượt khoảng 30 μg, 30 μg và 20 μg/ml mỗi chất trên. Hoặc cân chính xác 35 mg cao khô Bạch quả chuẩn đã biết hàm lượng quercetin, kaempferol và isorhamnetin, tiến hành theo như mô tả ở mục Dung dịch thử để chuẩn bị dung dịch chuẩn.
Điều kiện sắc ký:
Cột thép không gỉ kích thước (25 cm x 4,6 mm) được nhồi pha tĩnh C (5 μm) hoặc tương đương (cột RP 18 là thích hợp).
Detector quang phổ tử ngoại đặt ở bước sóng 360 nm.
Tốc độ dòng: 1,2 ml/min.
Thể tích tiêm: 10 μl
Cách tiến hành:
Sự thích hợp của hệ thống: Tiến hành sắc ký với dung dịch chuẩn. Số đĩa lý thuyết của cột không được ít hơn 2500 tính theo pic quercetin.
Tiến hành sắc ký lần lượt dung dịch dịch thử và dung dịch chuẩn. Tính hàm lượng quercetin, kaempferol và isorhamnetin dựa vào diện tích các pic thu được trên sắc ký đồ của dung dịch thử và dung dịch chuẩn, sau đó chuyển đổi thành hàm lượng flavonol glycosid toàn phần (X %) theo công thức (1) sau đây:
![]()
Trong đó:
Xq là hàm lượng quercetin (%).
Xk là hàm lượng kaempferol (%).
Xiso là hàm lượng isorhamnetin (%).
2,51 là hệ số chuyển đổi.
b là độ ẩm của chế phẩm thử (%).
Hàm lượng flavonoid toàn phần tính theo flavonol glycosid (P.t.l = 756,7) không được ít hơn 24,0 % tính theo chế phẩm khô kiệt.
Terpen lacton
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động: Methanol - nước theo chương trình gradient như sau :
| Thời gian (min) | % nước theo thể tích | % methanol theo thể tích |
| 0 -> 45 | 75 -> 52 | 25 -> 48 |
| 45 -> 45,1 | 52 -> 75 | 48 -> 25 |
| 45 -> 50 | 75 | 25 |
Các dung dịch chuẩn: Hòa tan lần lượt bilobalid chuẩn, ginkgolid A, B, C chuẩn (cân chính xác) trong methanol (TT) để được các dung dịch chuẩn hỗn hợp có nồng độ lần lượt như sau để xây dựng đường chuẩn:
Dung dịch chuẩn 1: Dung dịch có chứa bilobalid 1,0 mg/ml, ginkgolid A 0,5 mg/ml, ginkgolid B 0,5 mg/ml, ginkgolid C 0,5 mg/ml.
Dung dịch chuẩn 2: Dung dịch có chứa bilobalid 0,5 mg/ml, ginkgolid A 0,25 mg/ml, ginkgolid B 0,25 mg/ml, ginkgolid C 0,25 mg/ml.
Dung dịch chuẩn 3: Dung dịch có chứa bilobalid 0,25 mg/ml, ginkgolid A 0,125 mg/ml, ginkgolid B 0,125 mg/ml, ginkgolid C 0,125 mg/ml.
Dung dịch thử: Cân chính xác 0,15 g chế phẩm, thêm 10 ml nước, làm rã trong cách thủy ấm, thêm 2 giọt dung dịch acid hydrocloric 2 % (TT), chiết 4 lần với ethyl acetat (TT), lần thứ nhất với 15 ml, ba lần tiếp theo mỗi lần với 10 ml, gộp các các dịch chiết ethyl acetat và rửa với 20 ml dung dịch natri acetat 5 % (TT), rửa lớp dung dịch natri acetat bằng 10 ml ethyl acetat (TT). Gộp các dịch chiết và dịch rửa ethyl acetat, rửa 2 lần, mỗi lằn bằng 20 ml nước, tách lớp nước và rửa bằng 10 ml ethyl acetat (TT). Gộp tất cả các dịch ethyl acetat, cất thu hồi dung môi tới cắn khô hoặc cô trên cách thủy đến cắn.
Dùng methanol (TT) để hoà tan và chuyển toàn bộ cắn vào bình định mức 5 ml và thêm methanol (TT) đến vạch.
Điều kiện sắc ký:
Cột thép không gỉ (0,25 m x 4,6 mm), nhồi pha tĩnh C (5 μm) dùng cho sắc ký.
Detector tán xạ bay hơi: 105 °C, khí nitrogen 2 L/min.
Tốc độ dòng: 1,0ml/min.
Thể tích tiêm: 20 μl.
Cách tiến hành:
Sự thích hợp của hệ thống: Tiến hành sắc ký với dung dịch chuẩn bilobalid. Số đĩa lý thuyết của cột không ít hơn 2500 tính theo pic bilobalid.
Tiến hành sắc ký lần lượt với các dung dịch chuẩn ở trên, ghi sắc ký đồ, tính diện tích pic. Vẽ đồ thị tương quan giữa logarit (In) của nồng độ và logarit (In) của diện tích pic của từng chất.
Tiêm dung dịch thử vào hệ thống sắc ký, tiến hành sắc ký theo điều kiện đã mô tả, ghi sắc ký đồ, thời gian lưu và diện tích pic từng chất.
Hàm lượng mỗi terpen lacton được tính dựa trên diện tích pic trong dung dịch thử và đường chuẩn tương ứng, cụ thể như sau:
Nồng độ (mg/ml) của terpen lacton trong dung dịch thử được tính theo công thức (2) sau đây:
![]()
Trong đó:
C là nồng độ terpen lacton (mg/ml) trong dung dịch thử,
A là diện tích pic của terpen lacton,
a, b là các giá trị tìm được từ phương trình hồi qui tuyến tính (y = ax + b) của terpen lacton tương ứng thu được từ đường chuẩn sau khi đã chuyển đổi sang In.
Hàm lượng phần trăm của mỗi terpen lacton được tính theo công thức (3) sau đây:
![]()
Trong đó:
P là hàm lượng phần trăm (kl/kl) của mỗi terpen lacton,
C là nồng độ terpen lacton (mg/ml) trong dung dịch thử được tính từ đường chuẩn như trên,
m là khối lượng cân (g) của mẫu thử,
b là độ ẩm của mẫu thử (%).
Hàm lượng terpen lacton toàn phần bằng tổng hàm lượng mỗi terpen lacton được tính ở trên.
Hàm lượng terpen lacton toàn phần trong chế phẩm không được ít hơn 6,0 % tính theo tổng hàm lượng của bilobalid (C15H18O8), ginkgolid A (C20H24O9), ginkgolid B (C20H24O10), ginkgolid C (C20H24O11), tính theo chế phẩm khô kiệt.
Bảo quản
Trong bao bì kín, tránh ánh sáng.
CAO KHÔ CHÈ DÂY
Extractum Ampelopsis siccus
Cao khô chè dây là sản phẩm được điều chế từ lá của cây Chè dây (Ampelopsis cantoniensis Planch.), họ Nho (Vitaceae) bằng phương pháp thích hợp để chế phẩm có hàm lượng hoạt chất ổn định.
Chế phẩm phải đáp ứng các yêu cầu trong chuyên luận “Cao thuốc” (Phụ lục 1.1) và các yêu cầu sau đây:
Mô tả
Bột màu vàng nâu, vị đắng hơi chát.
Định tính
A. Lấy khoảng 1,0 g bột chế phẩm cho vào một ống nghiệm to, thêm 10 ml ethanol 90 % (TT), lắc kỹ, đặt trên cách thủy khoảng 1 min cho tan, lọc. Lấy 1 ml dịch chiết cho vào ống nghiệm nhỏ, thêm một ít bột magnesi (TT) và 2 giọt acid hydrocloric (TT), dung dịch xuất hiện màu đỏ.
B. Phương pháp sắc ký lỏng (Phụ lục 5.3).
Điều kiện sắc ký, Dung dịch thử: Chuẩn bị như mục Định lượng
Dung dịch chuẩn:
(1) Hòa tan dihydromyricetin chuẩn trong methanol (TT) để thu được dung dịch có nồng độ khoảng 0,2 mg/ml.
(2) Hòa tan myricetin chuẩn trong methanol (TT) để thu được dung dịch có nồng độ khoảng 0,01 mg/ml.
Tiêm lần lượt dung dịch thử và các dung dịch chuẩn (1) và (2) vào hệ thống sắc ký theo các điều kiện đã nêu, ghi sắc ký đồ.
Sắc ký đồ của dung dịch thử phải cho 2 pic có thời gian lưu tương tự với thời gian lưu của pic dihydromyricetin và myricetin trên sắc ký đồ của các dung dịch chuẩn (1) và (2).
C. Phương pháp sắc ký lớp mỏng (Phụ lục 5.4).
Bản mỏng Silica gel GF254 tráng sẵn (TT), hoạt hóa bản mỏng ở 105 °C trong 30 min.
Dung môi khai triển: Toluen - ethyl acetat - aceton - acid formic (5 : 2 : 2 : 1).
Dung dịch thử: Lấy 0,1 g chế phẩm, thêm 10 ml ethanol (TT), lắc siêu âm trong 10 min, lọc. Cô dịch lọc trên cách thủy đến cạn. Hòa tan cắn trong 1 ml ethanol (TT) được dung dịch chấm sắc ký.
Dung dịch đối chiếu: Lấy 1 g bột lá Chè dây (mẫu chuẩn), thêm 50 ml ethanol 70 % (TT), đun hồi lưu trên cách thủy 30 min, lọc, chiết lại bã như trên 1 lần nữa. Tập trung dịch chiết ethanol, cô trên cách thủy đến cạn. Khuấy kỹ cắn với n-butanol (TT) 3 lần, mỗi lần 10 ml, lọc, gộp dịch lọc butanol, cất thu hồi dung môi đến cạn, cô trên cách thủy đến cắn. Hòa tan cắn trong 1 ml ethanol (TT) được dung dịch chấm sắc ký.
Cách tiến hành: Chấm riêng biệt lên bản mỏng 10 μl mỗi dung dịch trên. Triển khai sắc ký đến khi dung môi đi được 12 cm đến 14 cm, lấy bản mỏng ra để khô ở nhiệt độ phòng, phun hỗn hợp dung dịch acid boric 10 % và dung dịch acid oxalic 10 % (2 : 1) và sấy bản mỏng ở 100 °C đến khi xuất hiện các vết. Sắc ký đồ của dung dịch thử phải có các vết cùng màu và cùng giá trị Rf với các vết thu được trên sắc ký đồ của dung dịch đối chiếu.
Độ ẩm
Không quá 5,0 % (Phụ lục 9.6, 1 g, 100 °C, đến khối lượng không đổi).
Kim loại nặng
Không quá 25 phần triệu (Phụ lục 9.4.8, phương pháp 3).
Dùng 1,0 g chế phẩm và 2,5 ml dung dịch chì mẫu 10 phần triệu Pb (TT).
Tro sulphat
Không quá 10,0 % (Phụ lục 9.9).
Giới hạn nhiễm khuẩn
Đáp ứng yêu cầu về Giới hạn nhiễm khuẩn đối với thuốc đông dược có nguồn gốc từ động, thực vật (Phụ lục 13.6, phương pháp đĩa thạch).
Tổng số vi khuẩn hiếu khí không được quá 10 000 CFU/1 g chế phẩm.
Tổng số nấm và mốc không được quá 100 CFU/1 g chế phẩm.
Không được có vi khuẩn gây bệnh Escherichia coli, Salmonella, Pseudomonas aeruginosa, Staphylococcus aureus.
Cân chính xác khoảng 5 g chế phẩm vào bình nón nút mài 200 ml đã được tiệt trùng và đã cân bì. Thêm vào đó một lượng dung dịch natri clorid 0,9 % vô trùng vừa đủ để thu được dung dịch có nồng độ 10-1, lắc đều. Từ dung dịch trên pha loãng thành các dung dịch có nồng độ 10-2, 10-3... rồi tiến hành thử theo Phụ lục 13.6.
Định lượng
Phương pháp sắc ký lỏng (Phụ lục 5.3).
Pha động: Acetonitril - dung dịch acid phosphoric 0,01 M (25 : 75).
Dung dịch thử: Cân chính xác khoảng 0,1 g chế phẩm cho vào một bình định mức 50 ml, thêm khoảng 30 ml methanol (TT), lắc siêu âm 15 min, để nguội, thêm methanol (TT) đến vạch, lắc đều. Ly tâm lấy dịch trong, hút chính xác 2 ml dịch trong ở phía trên cho vào bình định mức 25 ml, thêm methanol (TT) đến vạch, lắc đều, lọc qua màng lọc có kích thước lỗ lọc 0,45 μm.
Dung dịch chuẩn: Hòa tan dihydromyricetin và myricetin chuẩn trong methanol (TT) để thu được dung dịch có nồng độ khoảng 0,04 mg dihydromyricetin trong 1 ml và 0,025 mg myricetin trong 1 ml, lọc qua màng lọc có kích thước lỗ lọc 0,45 pm.
Điều kiện sắc ký:
Cột thép không gỉ (250 mm x 4 mm), nhồi pha tĩnh C (5 μm). Cột Lichrosorb RP 18 là thích hợp.
Detector quang phổ tử ngoại đặt ở bước sóng 260 nm.
Tốc độ dòng: 1 ml/min.
Thể tích tiêm: 20 μl.
Nhiệt độ phân tích: Nhiệt độ phòng.
Tiến hành sắc ký theo điều kiện đã nêu. Dựa vào diện tích pic của dihydromyricetin và myricetin trong dung dịch chuẩn, dung dịch thử, nồng độ các dung dịch chuẩn để tính hàm lượng dihydromyricetin và myricetin trong chế phẩm.
Tổng hàm lượng dihydromyricetin và myricetin không dưới 30,0 % (theo khối lượng) tính theo chế phẩm khô kiệt.
Bảo quản
Bảo quản trong bao bì kín, để nơi khô ráo thoáng mát.
CỎ MẦN TRẦU
Herba Eleusinis indicae
Toàn cây mang hoa đã rửa sạch, phơi hay sấy khô của cây Cỏ mần trầu [Eleusine indica (L.) Gaertn.], họ Lúa (Poaceae).
Mô tả
Dược liệu được cắt thành đoạn dài 4 cm đến 6 cm, màu lục vàng nhạt, mùi thơm nhẹ; bao gồm đoạn trục mang cụm hoa, đoạn lá, thân, đốt thân mang lá, cụm thân và lá, cụm gốc thân và rễ.
Cụm hoa gié xếp 2 dãy so le thành 5 đến 7 gié, dải 7 cm đến 9 cm đính ở đỉnh trục phát hoa ở ngọn thân, thường có 1 gié đính ở mức thấp hơn. Các gié ở ngọn gié già hơn ở gốc. Trục phát hoa hình trụ hơi dẹp, nhẵn bóng, có nhiều sọc dọc nổi lên. Gié dài 4 mm, có 3 đến 5 hoa. Hoa ở gốc già hơn. Gié có 2 dĩnh, dĩnh dưới nhỏ hơn dĩnh trên. Dĩnh trên hình mũi mác, thuôn mềm, đầu nhọn, dài 2,5 mm đến 3 mm, rộng khoảng 0,5 mm, màu trong, có lườn, có 4 đến 7 gân màu xanh, mặt lưng có răng cưa nhọn. Dĩnh dưới tương tự, dài 1,5 mm đến 2,0 mm, rộng 0,1 mm đến 1,5 mm, có 1 gân màu xanh, mặt lưng có răng cưa nhọn dài hơn dĩnh trên.
Hoa dài 3 mm đến 4 mm có 2 trấu. Trấu dưới hình mũi mác, trong, thuôn nhọn, có 2 đến 4 gân, dài 2,5 mm đến 3,0 mm, rộng 0,5 mm đến 0,75 mm, mặt lưng có răng cưa nhọn. Trấu trên giống trấu dưới, dài 1,5 mm đến 2,0 mm, rộng 0,2 mm đến 0,4 mm, có 1 gân.
Quả hình trứng hoặc bầu dục, màu xanh bóng hoặc đen dài 1,2 mm đến 1,5 mm.
Đoạn thân nhẵn bóng, hơi dẹt, có nhiều sọc dọc nhô lên. Có đoạn mang đốt, tại mỗi đốt chia thành 2 đến 5 nhánh nhỏ xếp so le, mỗi nhánh có bẹ lá ôm phía ngoài, đôi khi có mang rễ phụ nhỏ.
Cụm gốc thân mang rễ chùm: Gồm 3 đến trên 10 gốc thân nhỏ mang rễ chùm xếp xít nhau. Phần gốc mang các rễ chùm nhỏ màu nâu vàng, đường kính khoảng 0,1 mm đến 0,5 mm.
Vi phẫu
Rễ
Cắt ngang rễ qua vùng lông hút cho thấy rễ có tiết diện tròn, cấu tạo đối xứng qua trục, gồm hai vùng: vùng vỏ và trung trụ.
Vùng vỏ: Chiếm khoảng 1/2 đường kính vi phẫu rễ. Tầng lông hút cấu tạo bởi một lớp tế bào có vách mỏng bằng celulose, mọc dài ra thành lông hút. Tầng suberoid gồm 2 đến 4 lớp tế bào hình đa giác vách tầm suberin, sắp xếp lộn xộn, kích thước không đều nhau, tế bào các lớp phía trong có kích thước nhỏ hơn, khoảng 1/3 đến 1/4 kích thước các tế bào ở lớp ngoài. Mô mềm vỏ gồm những tế bào có vách mỏng bằng celulose, chia thành hai vùng: mô mềm vỏ ngoài có cấu tạo bởi những tế bào hình đa giác gần tròn, sắp xếp lộn xộn chừa những khuyết lớn; mô mềm vỏ trong có cấu tạo bởi những tế bào hình chữ nhật sắp xếp thành dãy xuyên tâm và vòng đồng tâm, để hở những khe nhỏ ở góc tế bào, 1 đến 2 lớp tế bào mô mềm vỏ sát lớp nội bì kích thước nhỏ hơn. Nội bì hình chữ U gồm 1 lớp tế bào hình chữ nhật xếp khít nhau, kích thước bằng các tế bào mô mềm vỏ trong cùng.
Trung trụ: Bó dẫn gồm libe xếp xen kẽ với gỗ trên một vòng theo hướng xuyên tâm, số lượng nhiều (18 đến 22 bó). Quanh tủy còn rải rác 5 đến 7 mạch gỗ cấp I hình đa giác gần tròn, kích thước lớn hơn hẳn gỗ cấp II. Lớp mô mềm tủy hẹp, một phần hóa mô cứng để lại một khối hình sao ở giữa rễ gồm các tế bào mô mềm với vách celulose.
Thân
Vi phẫu hình bầu dục không đối xứng. Từ ngoài vào trong gồm: Biểu bì gồm 1 lớp tế bào hình chữ nhật, kích thước rất nhỏ, lớp cutin khá dày. Mô mềm vỏ cấu tạo bởi 3 đến 4 lớp tế bào hình đa giác gần tròn, vách celulose. Trong vùng mô mềm vỏ rải rác có các cụm mô cứng. Vòng mô cứng gồm 5 đến 7 lớp tế bào hình đa giác vách dày, kích thước nhỏ. Nhiều bó libe gỗ xếp lộn xộn từ vòng mô cứng vào trong, càng vào trong kích thước các bó càng lớn. Mỗi bó gồm một cụm nhỏ libe có tế bào hình đa giác, vách hơi uốn lượn, 1 đến 3 mạch hậu mộc to, hình tròn hoặc bầu dục; 1 đến 2 mạch tiền mộc hình tròn nằm trong vùng mô mềm vách celulose, một số bó có mạch tiền mộc bị hủy để lại một khuyết. Bao bên ngoài mỗi bó dẫn là 1 đến 2 lớp tế bào mô cứng hình đa giác. Mô mềm tủy gồm các tế bào hình đa giác gần tròn, kích thước không đều, sắp xếp chừa các khe nhỏ. Tủy bị hủy tạo khuyết.
Lá
Gân giữa: Biểu bì trên gồm các tế bào hình chữ nhật, kích thước khá đều nhau; biểu bì dưới hóa mô cứng, tế bào hình chữ nhật nhỏ hơn biểu bì trên, sát biểu bì dưới là cụm mô cứng gồm 2 đến 4 lớp tế bào rất nhỏ hình đa giác, khoang hẹp. Mô mềm gồm nhiều lớp tế bào hình đa giác gần tròn, kích thước rất lớn. Các bó dẫn kích thước khác nhau xếp thành hàng dọc theo biểu bì dưới, có một bó lớn ở chính giữa gân. Mỗi bó gồm gỗ ở trên, libe ở dưới; tế bào libe hình đa giác, thành uốn lượn; gỗ có mạch hậu mộc to, hình tròn, 1 đến 2 mạch tiền mộc trong vùng mô mềm vách celulose. Bao bên ngoài bỏ libe gỗ là 2 vòng mỏ, vòng mô cứng bên trong gồm 1 đến 2 lớp tế bào hình đa giác, vòng mô mềm bên ngoài gồm 1 lớp tế bào hình đa giác to; bên ngoài vòng này có 1 đến 2 lớp tế bào mô mềm hình thuôn dài, kích thước không đều.
Phiến lá: Biểu bì trên lồi nhiều ở các vị trí có bó libe-gỗ, lõm ở các vị trí tế bào bọt. Tế bào biểu bì trên và biểu bì dưới hình chữ nhật hóa mô cứng, tế bào biểu bì dưới lớn hơn biểu bì trên, lỗ khí rải rác ở cả hai biểu bì. Trên lớp biểu bì trên có các tế bào bọt, hình đa giác hoặc gần tròn kích thước lớn. Mô cứng tạo thành cụm phía trên và dưới bó libe gỗ, gồm các tế bào hình đa giác, kích thước nhỏ. Nhiều bó dẫn kích thước không đều xếp xen kẽ với các vị trí tế bào bọt. Cấu tạo bó dẫn giống như bó dẫn ở gần giữa. Mô mềm gồm các tế bào hình đa giác xen giữa các các bó dẫn.
Bột
Bột màu vàng xanh, không mùi, khô tơi, có nhiều sợi. Soi kính hiển vi thấy: Mảnh biểu bì gồm các tế bào hình chữ nhật, thành uốn lượn, mang lỗ khí; mảnh mô mềm gồm các tế bào hình đa giác hoặc hình chữ nhật, thành mỏng; mảnh mạch xoắn, mạch mạng, mạch vòng; sợi có 2 loại: loại thành dày khoang rộng và loại thành dày khoang hẹp, ống trao đổi rõ; khối nhựa màu nâu đỏ.
Định tính
A. Lấy 2 g bột dược liệu, thêm 20 ml ether (TT). Ngâm 30 min, thỉnh thoảng lắc, lọc. Lấy 10 ml dịch lọc cho vào chén sứ, bốc hơi đến cắn. Hòa tan cắn với 0,5 ml anhydrid acetic (TT) rồi thêm vào dung dịch 0,5 ml cloroform (TT). Chuyển dung dịch vào một ống nghiệm nhỏ, khô. Dùng pipet Pasteur thêm cẩn thận 1 đến 2 ml acid sulfuric (TT) lên thành ống nghiệm để nghiêng cho acid chảy xuống đáy ống nghiệm. Nơi tiếp xúc giữa hai lớp dung dịch có màu đỏ nâu, lớp dung dịch phía trên dần dần chuyển thành màu xanh lục.
B. Lấy 5 g bột dược liệu cho vào bình nón nút mài, thêm 50 ml ethanol 96 % (TT), đun hồi lưu trên cách thủy trong 30 min, lọc, được dịch lọc A.
Lấy 5 ml dịch lọc A cho vào chén sứ, bốc hơi còn khoảng 2 ml và gạn dịch cồn vào 1 ống nghiệm nhỏ. Thêm vào dung dịch một ít bột magnesi (TT) và 1 đến 2 giọt acid hydrocloric (TT), dung dịch có màu hồng đến đỏ.
Lấy 5 ml dịch lọc A cho vào ống nghiệm. Thêm 2 ml dung dịch acid hydrocloric 10 % (TT) và đun trên cách thủy 10 min, dung dịch có màu hồng tới đỏ.
Lấy 2 ml dịch lọc A, thêm vào vài giọt dung dịch sắt (III) clorid 1 % (TT), xuất hiện màu xanh đen.
C. Đun sôi 2 g dược liệu đã cắt nhỏ với 50 ml nước trong 10 min, lọc. Lấy 3 ml dịch lọc, thêm 0,5 ml dung dịch Fehling A (TT) và 0,5 ml dung dịch Fehling B (TT). Đun cách thủy 5 min, có kết tủa đỏ gạch dưới đáy ống nghiệm.
D. Phương pháp sắc ký lớp mỏng (Phụ lục 5.4)
Bản mỏng: Silica gel GF254
Dung môi khai triển: Cloroform - methanol (7 : 3).
Dung dịch thử: Lấy 5 ml dịch lọc A, đem bốc hơi trên cách thủy còn khoảng 1 ml, được dung dịch thử.
Dung dịch đối chiếu: Lấy 5 g bột Cỏ mần trầu (mẫu chuẩn), tiến hành chiết tương tự như đối với dung dịch thử.
Cách tiến hành: Chấm riêng biệt lên bản mỏng 20 μl mỗi dung dịch trên. Sau khi triển khai sắc ký, lấy bản mỏng ra, để khô ở nhiệt độ phòng, phun dung dịch vanilin 1% trong acid sulfuric (TT), sấy bản mỏng ở 120 °C đến khi các vết hiện rõ, rồi soi dưới đèn tử ngoại tại bước sóng 366 nm. Trên sắc ký đồ của dung dịch thử phải có các vết có cùng màu sắc và giá trị Rf với các vết trên sắc ký đồ của dung dịch đối chiếu.
Độ ẩm
Không được quá 10,0 % (Phụ lục 9.6, 1 g, 100 °C, 4 h).
Tro toàn phần
Không được quá 9,0 % (Phụ lục 9.8).
Tro không tan trong acid
Không được quá 3,0 % (Phụ lục 9.7).
Chất chiết được trong dược liệu
Không ít hơn 4,5 % tính theo dược liệu khô kiệt
Tiến hành theo phương pháp chiết nóng (Phụ lục 12.10), dùng ethanol 96 % (TT) làm dung môi.
Bảo quản
Trong bao bì kín, để nơi khô ráo.
Chế biến
Thu hái quanh năm, tốt nhất là cuối mùa xuân. Nhổ lấy cả cây, rửa sạch đất cát, phơi khô se, cắt đoạn 4 cm đến 6 cm. Có thể dùng tươi hoặc phơi khô để dùng trong năm.
Bảo quản
Đựng trong các túi chống ẩm, để nơi cao ráo, tránh nấm mốc, sâu mọt.
Tính vị, quy kinh
Vị ngọt, tính mát. Vào kinh can, tâm, bàng quang.
Công năng, chủ trị
Thanh nhiệt, phát hãn, hạ sốt, giải độc mát gan, lợi tiểu. Chủ trị: Sốt cao, sốt do cảm nắng, đau đầu, viêm gan hoàng đản, sốt rét, cao huyết áp, mụn nhọt lở ngứa, tiểu tiện vàng, đỏ, bí, dắt.
Cách dùng, liều lượng
Ngày 80 g đến 120 g (cây tươi); 16 g đến 20 g (khô). Dạng thuốc sắc.
Kiêng kỵ
Không có thực nhiệt không dùng.
LỘC GIÁC
Cornu Cervi
Gạc hươu
Sừng già (gạc) đã hoá xương hay gốc sừng (giác cơ) rụng xuống sau khi đã cưa lấy nhung của Hươu sao đực (Cervus nippon Temminck), họ Hươu (Cervidae).
Người ta quen gọi là gạc Hươu sao (Mai hoa lộc giác) và gốc gạc hươu rụng (Lộc giác thoát bàn)
Mô tả
Gạc Hươu sao: Thường chia thành 3 đến 4 nhánh, dài 30 cm đến 60 cm, đường kính 2,5 cm đến 5 cm, hai bên đối xứng. Đa số nhánh cạnh phát triển hướng về hai bên, nhánh thứ nhất tương đối gần gốc sừng (Trân châu bàn), nhánh thứ hai gần nhánh thứ nhất. Đầu nhánh chủ (nhánh chinh) chia thành hai nhánh nhỏ. Mặt ngoài màu nâu vàng hoặc nâu xám. Đầu nhánh màu trắng xám không có lông. Bộ phận giữa và dưới thường có dạng bướu hay mấu nhỏ nổi lên, thường gọi là cốt đinh (đinh xương). Cốt đinh sắp xếp thành cạnh (lăng) dọc, không liên tục; ở dưới gốc sừng có mâm lồi lên gọi là Trân châu bàn. Chất rắn chắc. Cắt ra vòng ngoài màu trắng, giữa màu xám, có những lỗ dạng tổ ong nhỏ. Vị hơi mặn. Gốc gạc hươu rụng (Lộc giác thoát bàn): Hình mũ trụ hoặc mũ trụ dẹt, đường kính 3 cm đến 6 cm. Trân châu bàn, đường kính 4,5 cm đến 6,5 cm, cao 1,5 cm đến 4 cm. Mặt ngoài màu nâu xám hay nâu vàng xám, sáng bóng. Phần giữa có lỗ dạng tổ ong. Mặt đáy phẳng, giống hình tổ ong, hầu hết màu trắng vàng hoặc nâu vàng. Mép chung quanh Trân châu bàn thường có lỗ nhỏ thưa. Mặt trên hơi phẳng, hình bán cầu không đều, chất cứng. Vòng ngoài mặt cắt có chất xương màu trắng xám, phần giữa màu trắng. Vị hơi mặn.
Chất chiết được trong dược liệu
Không ít hơn 17,0 %.
Lấy khoảng 10 g chế phẩm ở dạng miếng thái lát, tán thành bột thô. Cân chính xác khoảng 4 g bột vào cốc có mỏ, thêm 90 ml nước, đun sôi nhẹ trong 1 h (bổ sung lượng nước hao hụt trong quá trình đun), lọc nóng, rửa cắn với 10 ml nước nóng, lọc. Gộp các dịch lọc và chuyển vào bình định mức 100 ml, thêm nước vừa đủ đến vạch, lắc đều. Lấy chính xác 25 ml dung dịch thu được vào cốc thủy tinh đã làm khô và cân bì trước, cô trong cách thủy đến cắn khô, cắn thu được sấy ở 105 °C trong 3 h, lấy ra để nguội trong bình hút ẩm 30 min, cân nhanh để xác định khối lượng cắn. Tính phần trăm lượng chất chiết được bằng nước.
Chế biến
Thường thu lấy gạc hươu vào mùa xuân khi gạc rụng hoặc gốc sừng rụng xuống sau khi đã cưa lấy nhung hươu năm trước (gốc sừng còn lại, sẽ rụng vào mùa xuân năm sau).
Bào chế
Rửa sạch gạc, cưa thành khúc, ngâm tẩm trong nước ấm, vớt gạc ra, chẻ thành phiến, phơi âm can đến khô, hoặc tán thành bột thô.
Bảo quản
Để gạc nơi khô, mát.
Tính vị, quy kinh
Hàm, ôn. Vào các kinh can, thận.
Công năng, chủ trị
Ôn thận dương, mạnh gân xương, hành huyết, tiêu thũng. Chủ trị: Liệt dương di tinh, thắt lưng cột sống đau lạnh, âm thư, mụn nhọt, nhọt vú mới phát, ứ huyết sưng đau.
Cách dùng, liều lượng
Ngày dùng 6 g đến 15 g, dạng thuốc cao, chế tễ lộc giác giao, lộc giác sương.
Kiêng kỵ
Người thận hư có hoả không nên dùng, người thượng tiêu có đờm nhiệt, trung vị có hỏa không nên uống.
LỘC GIÁC GIAO
Colla Cornus Cervi
Cao gạc Hươu, Cao Ban long
Chế phẩm dạng keo rắn, chế từ gạc hươu bằng cách đun nấu với nước và cô đặc lại.
Chế biến
Cắt gạc hươu thành từng miếng nhỏ, ngâm trong nước lạnh và rửa sạch (đến khi nước rửa trong). Nấu với nước vài lần, lọc, gộp các dịch lọc (có thể cho một ít bột phèn), để yên, lọc. Cô dịch lọc cho đến khi thu được một dịch lỏng sánh, có thể thêm rượu gạo, đường tinh, dầu đậu nành tới khi thu được cao đặc. Để nguội, làm đông lạnh, cắt thành từng miếng nhỏ và để khô trong không khí.
Mô tả
Miếng cao hình khối vuông dẹt, cạnh dài từ 3 đến 4 cm, dày 0,6 cm, màu nâu vàng hoặc nâu đỏ, trong mờ, đôi khi mặt trên có một tầng bọt, màu vàng nhạt. Chất giòn, dễ gẫy, mặt gẫy sáng bóng. Vị hơi ngọt.
Độ ẩm
Không được quá 15,0 %.
Cân chính xác khoảng 1 g chế phẩm đã cắt nhỏ, hoà tan trong 2 ml nước nóng, bốc hơi trên cách thủy đến khô. Giữ cho lớp keo không dày quá 2 đến 3 mm, tiếp tục tiến hành xác định độ ẩm theo Phụ lục 9.6 (100 °C đến 105 °C, 5 h).
Tro toàn phần
Không được quá 1,0 % (Phụ lục 9.8).
Dung 1,0 g.
Kim loại nặng
Không được quá 30 phần triệu.
Dùng cắn thu được từ thử nghiệm “Tro toàn phần”, tiến hành xác định giới hạn kim loại nặng theo Phụ lục 9.4.8, phương pháp 3. Dùng 3,0 ml dung dịch chì mẫu 10 phần triệu Pb (TT) để chuẩn bị mẫu đối chiếu.
Arsen
Không được quá 3 phần triệu.
Lấy 1 g chế phẩm đã cắt nhô, thêm 1 g calci hydroxyd (TT) và một ít nước, trộn đều, làm khô, đốt nhẹ cho cháy hết carbon, rồi nung ở 500 °C đến 600 °C đến thành tro hoàn toàn. Để nguội, hoà tan cắn tro trong 5 ml acid hydrocloric (TT) và 2 ml nước. Tiến hành xác định giới hạn arsen (Phụ lục 9.4.2, phương pháp A).
Cắn không tan trong nước
Không được ít hơn 2,0 %.
Cân chính xác 1,0 g chế phẩm đã cắt nhỏ, thêm 10 ml nước, đun nóng để hòa tan rồi chuyển vào một ống ly tâm (đã sấy ở 105 °C đến khối lượng không đổi và cân để xác định khối lượng), ly tâm. Gạn bỏ lớp dầu loang trên thành ống và dung dịch phía trên. Thêm nước ấm dọc theo thành ống đến thể tích ban đầu, khuấy đều và ly tâm, gạn bỏ lớp dầu loang và dung dịch phía trên. Tiếp tục rửa như trên 3 lần nữa. Sấy ống ly tâm và cắn ở 105 °C trong 2 h, lấy ra, để nguội trong bình hút ẩm 30 min, cân và tính phần trăm cắn không tan trong nước.
Giới hạn nhiễm khuẩn
Đáp ứng yêu cầu giới hạn nhiễm khuẩn của thuốc uống có nguồn gốc tự nhiên (Phụ lục 13.6).
Định lượng
Cân chính xác khoảng 0,05 g chế phẩm đã cắt nhỏ, tiến hành theo phương pháp định lượng nitrogen toàn phần trong hợp chất hữu cơ (Phụ lục 10.9, phương pháp 1).
Chế phẩm phải chứa ít nhất 10,0 % nitrogen toàn phần tính theo chế phẩm khô.
Bảo quản
Để nơi khô, mát, trong lọ kín.
Tính vị, quy kinh
Cam, hàm, ôn. Vào các kinh thận, can.
Công năng, chủ trị
Ôn bổ can, thận, ích tinh, dưỡng huyết. Chủ trị: Liệt dương hoạt tinh, thắt lưng đầu gối mỏi có cảm giác lạnh, hư lao gày còm, đại tiểu tiện ra máu, âm thư thũng độc, băng huyết, rong huyết.
Cách dùng, liều lượng
Ngày dùng 3 g đến 6 g, hoà với nước ấm rồi uống hoặc ăn với cháo nóng (hoà tan trước rồi mới uống).
Kiêng kỵ
Người thực nhiệt không nên dùng.
LỘC GIÁC SƯƠNG
Cornu Cervi degelatinatum
Bã gạc hươu sau khi nấu cao phơi hoặc sấy khô. Khi nghiền hoặc tán nhỏ sẽ thành bột trắng.
Mô tả
Khối hình trụ tròn dài hoặc chẻ thành từng miếng, bị vỡ, lớn nhỏ không đều nhau. Mặt ngoài màu trắng, có chất bột, thường có cạnh dọc, đôi khi có điểm chấm nhỏ, màu xám hoặc nâu xám. Thể nhẹ, chất xốp, giòn. Mặt bẻ gẫy có phần ngoài tương đối đặc, màu trắng hoặc trắng xám, phần giữa có lỗ dạng tổ ong, màu nâu xám hoặc vàng xám. Có tính hút ẩm. Vị nhạt, nhai có cảm giác dính răng.
Độ ẩm
Không được quá 8,0 % (Phụ lục 9.6, 2 g, 100 °C - 105 °C, 5 h)
Chế biến
Lấy sừng hoá xương (lộc giác), nấu bỏ chất keo, lấy riêng xương, phơi hoặc sấy khô.
Bào chế
Phơi khô, đập vụn, tán nhỏ trước khi dùng.
Bảo quản
Để nơi khô, tránh ẩm.
Tính vị, quy kinh
Hàm, ôn. Vào các kinh can, thận.
Công năng, chủ trị
Ôn thận, trợ dương, thu liễm, chỉ huyết. Chủ trị: Tỳ thận dương hư, ăn ít, nôn mửa, tiêu chảy, bạch đới, di niệu, băng huyết, rong huyết, ung nhọt, đờm hạch.
Cách dùng, liều lượng
Ngày dùng 9 g đến 15 g, dạng thuốc hoàn, tán.
MƯỚP ĐẮNG (Quả)
Fructus Momordicae charantiae
Khổ qua
Quả còn xanh hoặc quả xanh đã phơi hay sấy khô của cây Mướp đắng (Momordica charantia L.), Họ Bí (Cucurbitaceae).
Mô tả
Quả hình thoi dài 12 cm đến 18 cm, đường kính 3 cm đến 5 cm, gốc và đầu quả thuôn nhọn, mặt ngoài màu xanh có nhiều gai tù, thịt quả dày, vị đắng, trong quả chứa nhiều hạt dẹt dài 13 mm đến 15 mm, rộng 4 mm đến 8 mm, có màng bao quanh hạt.
Sau khi chế biến, dược liệu đã phơi hay sấy khô là những phiến mỏng hình lưỡi liềm, hình gần tròn, thường rỗng ở giữa, có viền màu vàng nâu bên ngoài của vỏ quả, màu trắng hơi vàng bên trong (thịt quả), phiến dày từ 1 mm đến 3 mm, rộng 0,7 mm đến 1,5 mm, dài 5 mm đến 8 mm. Mùi thơm nhẹ.
Bột
Thịt quả phơi sấy khô, tán thành bột mịn, quan sát dưới kính hiển vi có các đặc điểm: Có nhiều hạt tinh bột hình tròn, bầu dục to nhỏ không đều; bó sợi, mô mềm, mạch xoắn, mạch vạch.
Định tính
A. Phương pháp sắc ký lớp mỏng (Phụ lục 5.4).
Bản mỏng Silicagel GF 254 tráng sẵn (TT) hoạt hoá ở 100 °C trong 45 min.
Dung môi khai triển: Cloroform - methanol (10 : 1).
Dung dịch thử: Cho 5 g bột thịt quả đã sấy khô tán nhỏ vào bình nón có dung tích 100 ml, thêm 50 ml ethanol 20 % (TT), trộn đều rồi để qua đêm. Lọc, thêm 10 ml dung dịch chì acetat 10 % (TT) vào dịch lọc, lọc, loại chì thừa trong dịch lọc bằng 3 ml dung dịch natri sufat bão hòa (TT), lọc bỏ tủa, chuyển dịch lọc vào bình gạn, lắc dịch lọc 3 lần, mỗi lần với 10 ml hỗn hợp ethanol - cloroform (1 : 3), gạn lấy lớp dưới, loại nước bằng natri sulfat khan (TT), bốc hơi dịch chiết trên cách thủy đến cắn khô, hòa tan cắn bằng 2 ml ethanol 90 % (TT) được dung dịch thử (dung dịch A).
Dung dịch đối chiếu: Lấy 5 g bột thịt quả mướp đắng (mẫu chuẩn), tiến hành chiết như dung dịch thử.
Cách tiến hành: Chấm riêng biệt lên cùng bản mỏng 10 μl mỗi dung dịch trên. Sau khi khai triển, lấy bản mỏng ra để khô ở nhiệt độ phòng. Quan sát dưới ánh sáng tử ngoại ở bước sóng 366 nm, có các vết phát quang màu xanh lơ. Tiếp tục phun thuốc thử là dung dịch vanilin 1 % trong acid phosphoric (TT), sấy bản mỏng ở 100 °C đến khi xuất hiện các vết. Trên sắc ký đồ của dung dịch thử sẽ xuất hiện các vết có màu sắc và giá trị Rf giống các vết của dung dịch đối chiếu.
B. Lấy 1 ml dung dịch A cho vào ống nghiệm nhỏ, thêm 2 giọt dung dịch thymol 20 % trong ethanol (TT) và thêm 1 ml acid sulfuric (TT), xuất hiện màu đỏ.
Độ ẩm (đối với dược liệu khô)
Không quá 10 % (Phụ lục 9.6, 1 g, 85 °C, 5 h).
Tro toàn phần
Không được quá 8,0 % (Phụ lục 9.8).
Dùng 1,0 g dược liệu khô.
Tạp chất (đối với dược liệu khô)
Không được quá 1 % (Phụ lục 12.11)
Chất chiết được trong dược liệu
Không ít hơn 20,0 %, tính theo dược liệu khô kiệt.
Tiến hành phương pháp chiết nóng (Phụ lục 12.10), dùng ethanol 90 % (TT) làm dung môi. Sử dụng 10 g dược liệu khô đã được tán thành bột thô.
Chế biến
Thu hái quả trưởng thành, còn xanh, loại bỏ chỗ sâu, rửa sạch để ráo nước, bổ đôi và bỏ hạt, có thể dùng tươi hay thái lát mỏng theo chiều vuông góc với quả, dày 3 mm đến 5 mm, phơi hoặc sấy khô.
Bào chế
Sao nhỏ lửa đến khi toàn bộ bề mặt phiến thuốc có mầu hơi vàng, mùi thơm.
Bảo quản
Trong bao bì kín, để nơi khô mát, tránh mốc mọt.
Tính vị, quy kinh
Đắng, tính hàn. Vào các kinh tỳ, phế, thận
Công năng, chủ trị
Thanh nhiệt, nhuận tràng, giải háo khát, lợi tiểu. Chủ trị: Ho do tính nhiệt, sốt, táo bón, tiểu buốt, dắt, tiểu đường. Dùng ngoài tắm, rửa khi bị mụn nhọt, lở ngứa.
Cách dùng, liều lượng
Ngày dùng 12 g đến 16 g (dược liệu khô). Dạng thuốc sắc, hãm.
Dùng ngoài lượng thích hợp.
Kiêng kỵ
Tỳ vị hư hàn, đau bụng, ỉa chảy không dùng.
RÂU NGÔ
Styli et stigmata Maydis
Ngọc mễ tu
Là vòi và đầu nhụy của bắp cây Ngô (Zea mays L.), họ Lúa (Poaceae), được thu hái khi bắp chín, đem phơi khô hoặc sấy khô.
Mô tả
Dược liệu dạng sợi mảnh, khá dai, dài tới 20 cm, mầu vàng nhạt hoặc nâu đậm, gồm những vòi nhụy cong queo, dẹt, phía trên mang đầu nhụy hai thùy. Các thùy đầu nhụy mảnh, có lông mịn.
Bột
Bột có mầu nâu thẫm, vị hơi ngọt, mùi thơm. Soi kính hiển vi thấy: Nhiều sợi dài, có mầu xanh hoặc tím ở một đầu. Hạt tinh bột đơn lẻ hoặc thành đám, hình đa giác hoặc gần tròn, rốn hạt rõ, hơi lệch. Lông che chở đa bào, thắt ở giữa. Mạch xoắn. Mô mềm chứa tinh bột. Bó sợi và mảnh bần.
Định tính
A. Lấy khoảng 10 g bột thô dược liệu, chiết như chỉ dẫn ở mục Định lượng, bắt đầu từ “cho vào bình Soxhlet” đến “thu hồi methanol dưới áp suất giảm rồi cô trên cách thủy tới cắn”. Hòa tan cắn trong 10 ml ethyl acetat (TT). Lọc. Bốc hơi dịch lọc ethyl acetat trên cách thủy sôi tới cắn. Hòa tan cắn trong 10 ml methanol 80 % (TT) được dung dịch A để làm các phản ứng sau đây:
Lấy 4 ml dung dịch A, cô cách thủy đến cạn, hoà cắn trong 1 ml methanol 80 % (TT), thêm 5 giọt acid hydrocloric (TT) và một ít bột magnesi (TT), sau vài phút sẽ xuất hiện màu hồng.
Lấy 1 ml dung dịch A, thêm 1 ml dung dịch natri hydroxyd 0,1 N (TT), màu vàng tăng lên.
Lấy 1 ml dung dịch A, thêm 5 giọt dung dịch sắt (III) clorid 5 % (TT), xuất hiện màu lục.
B. Phương pháp sắc ký lớp mỏng (Phụ lục 5.4)
Bản mỏng silica gel GF254 tráng sẵn (TT).
Dung môi khai triển: Cloroform - ethyl acetat - methanol (15 : 1 : 1).
Dung dịch thử: Dung dịch A.
Dung dịch đối chiếu: Lấy 5 g bột thô Râu ngô (mẫu chuẩn), tiến hành chiết như Dung dịch thử.
Cách tiến hành: Chấm riêng biệt lên bản mỏng 10 μl mỗi dung dịch trên. Triển khai sắc ký, lấy bản mỏng ra để khô ở nhiệt độ phòng, quan sát dưới ánh sáng tử ngoại bước sóng 366 nm. Trên sắc ký đồ của dung dịch thử phải xuất hiện các vết cùng màu sắc và cùng giá trị Rf với các vết của dung dịch đối chiếu.
Độ ẩm
Không được quá 13 % (Phụ lục 9.6, 3 g, 105 °C, 4 h).
Tro toàn phần
Không được quá 5,0 % (Phụ lục 9.8). Dùng 1 g dược liệu.
Tro không tan trong acid
Không được quá 2,0 % (Phụ lục 9.7).
Tạp chất
Không được quá 2,0 % (Phụ lục 12.11).
Tỷ lệ vụn nát
Không được quá 1,5 % (Phụ lục 12.12).
Chất chiết được trong dược liệu
Cân chính xác khoảng 20 g bột thô dược liệu (đã xác định độ ẩm) cho vào bình Soxhlet có dung tích 100 ml, chiết bằng 80 đến 120 ml ether dầu hoả (khoảng sôi 40 °C đến 60 °C) (TT) trên cách thủy sôi để loại tạp trong 1 h. Lấy dược liệu ra làm bay hết hơi ether dầu hỏa. Tiếp tục cho vào bình Soxhlet, chiết với 80 ml đến 120 ml methanol 80 % (TT) 8 h. Lấy dịch chiết, thu hồi methanol dưới áp suất giảm rồi cô trên cách thủy tới cắn. Hòa cắn với 30 ml nước cất, đun trong cách thủy sôi 15 min cho tan hết cắn. Để nguội. Chiết 5 lần, mỗi lằn với 10 ml ethyl acetat (TT) (hoặc cho đến khi hết màu). Gộp dịch chiết ethyl acetat, thu hồi dung môi dưới áp suất giảm. Cho phần dịch còn lại vào một cốc thủy tinh đã được sấy khô và cân bì. Bay hơi trên cách thủy sôi tới cắn. Sấy cắn ở nhiệt độ 70 °C tới khối lượng không đổi. Cân và tính lượng chất chiết được trong dược liệu.
Hàm lượng chất chiết được trong dược liệu được tính theo công thức sau:
![]()
Trong đó:
X là hàm lượng chất chiết được trong dược liệu (%);
m là khối lượng cắn (g);
a là khối lượng dược liệu (g);
d là độ ẩm của dược liệu (%).
Hàm lượng chất chiết được trong dược liệu không dưới 2,0 % tính theo dược liệu khô kiệt.
Chế biến
Sau khi thu hái, phơi nắng đến khô. Phơi nhiều nắng, thường xuyên lật đảo cho khô đều hoặc sấy khô ở nhiệt độ từ 60 °C đến 70 °C.
Bảo quản
Đựng trong các dụng cụ như ró, bị hoặc bao tải. Để nơi cao, khô ráo, thoáng gió. Tránh nấm mốc, sâu mọt.
Tính vị quy kinh
Vị ngọt. Tính bình. Quy kinh thận và bàng quang.
Công năng, chủ trị
Lợi tiểu, thông mật, hạ huyết áp, hạ đường huyết, cầm máu. Chủ trị: Tiểu tiện buốt, dắt; nước tiểu vàng đỏ, sỏi đường tiết niệu, viêm gan, viêm túi mật, sỏi mật, tăng huyết áp cao, tiểu đường, chảy máu cam.
Cách dùng, liều lượng
Ngày dùng 30 g đến 50 g, dưới dạng thuốc sắc, dạng chè; dùng riêng hoặc phối hợp trong các thang thuốc.
Kiêng kỵ
Không dùng cho các trường hợp hư hàn, đái dầm.
THANH BÌ
Pericarpium Citri reticulatae viride
Vỏ quả non hoặc vỏ quả chưa chín, phơi hay sấy khô của cây Quýt (Citrus reticulata Blanco), họ Cam (Rutaceae).
Có 2 loại Thanh bì: Tứ hoa thanh bì và Cá thanh bì.
Mô tả
Tứ hoa thanh bi: Vỏ quả được bổ thành 4 miếng đến đáy gốc, 4 mảnh này hình dạng không giống nhau, phần lớn cong vào phía trong, vỏ mỏng, hình bầu dục dài, chiều dài miếng 4 cm đến 6 cm, dày 0,1 cm đến 0,2 cm. Mặt ngoài màu lục xám hoặc màu lục đen, hơi ráp, có nhiều túi tiết, mặt trong màu trắng hoặc trắng vàng, ráp, có các gân trắng ngà hoặc nâu vàng nhạt. Chất hơi cứng, dễ bẻ gẫy, mặt cắt có 1 hàng đến 2 hàng túi tiết ở phần ngoài. Mùi thơm ngát, vị đắng, cay. Vỏ màu lục đen, mặt trong trắng nhiều tinh dầu là tốt.
Cá thanh bì: Gần hình cầu, đường kính 0,5 cm đến 2,0 cm. Mặt ngoài lục xám hay lục đen, hơi ráp, có nhiều túi tiết nhỏ và chìm. Ở đỉnh quả có vòi nhụy hơi nhô lên, ở gốc quả có vết sẹo tròn của cuống quả. Chất cứng, mặt cắt màu trắng ngà hoặc màu nâu vàng nhạt, dày 1 mm đến 2 mm, có 1 hàng đến 2 hàng túi tiết ở phần ngoài. Mùi thơm ngát, vị đắng cay.
Bột
Tứ hoa thanh bì: Bột màu lục xám hoặc nâu xám, nhiều tế bào mô mềm không đều nhau, thành hơi dày, một số dạng chuỗi hạt. Tế bào biểu bì vỏ quả hình đa giác hoặc hình gần vuông khi nhìn trên bề mặt, thành dày lồi lên. Tinh thể calci oxalat hình lăng trụ có trong tế bào mô mềm gần biểu bì, tế bào hình nhiều cạnh, hình thoi, hoặc vuông, đường kính 8 μm đến 28 μm, dài 24 μm đến 32 μm. Tinh thể hesperidin vàng nâu nhạt, hình bán cầu, tròn hoặc khối không đều. Mảnh mạch vòng, mạch xoắn.
Cá thanh bì: Tế bào biểu bì của múi cơm quả dài, hẹp, thành mỏng, một số hơi uốn lượn, có chứa tinh thể calci oxalat hình lăng trụ kích thước tương tự như ở vỏ quả; cũng có tinh thể hesperidin.
Định tính
A. Lấy 0,3 g bột dược liệu, thêm 10 ml methanol (TT), đun hồi lưu trên cách thủy 20 min. Lọc lấy dịch lọc và làm các phản ứng sau:
Lấy 1 ml dịch lọc, thêm một ít bột magnesi (TT) và vài giọt acid hydrocloric (TT), màu đỏ anh đào sẽ hiện dần ra.
Lấy 1 ml dịch lọc, thêm vài giọt dung dịch natri hydroxyd 5 % (TT), xuất hiện kết tủa màu vàng, tiếp tục thêm 1 ml nước cất, tủa sẽ tan ra.
Lấy 1 ml dịch lọc, thêm vài giọt dung dịch sắt (III) clorid 5 % (TT), xuất hiện màu xanh đen.
B. Phương pháp sắc ký lớp mỏng (Phụ lục 5.4)
Bản mỏng Silica gel G đã hoạt hoá ở 110 °C trong 30 min.
Dung môi khai triển: Cloroform - methanol - acid acetic băng - butanol (13 : 0,4 : 0,1 : 0,1).
Dung dịch thử: Dùng 5 ml dịch lọc ở mục Định tính A, cô trên cách thủy còn 1 ml.
Dung dịch đối chiếu: Dung dịch hesperidin bão hòa trong methanol (TT). Nếu không có hesperidin, lấy 0,3 g bột Thanh bì (mẫu chuẩn) rồi tiến hành chiết như mục Định tính A.
Cách tiến hành: Chấm riêng biệt lên bản mỏng 5 μl mỗi dung dịch thử và dung dịch đối chiếu. Triển khai sắc ký xong, lấy bản mỏng ra, để khô ở nhiệt độ phòng, phun dung dịch nhôm clorid 3 % trong ethanol (TT), quan sát dưới ánh sáng tử ngoại ở bước sóng 366 nm. Trên sắc ký đồ của dung dịch thử phải cho các vết có cùng màu và giá trị Rf với các vết trên sắc đồ của dung dịch đối chiếu.
Độ ẩm
Không được quá 12,0 % (Phụ lục 12.13).
Định lượng
Cân chính xác khoảng 1 g bột dược liệu (qua rây 1,25 mm), cho vào bình Soxhlet, thêm 100 ml ether dầu hỏa (TT) (khoảng sôi 60 °C đến 90 °C), đun hồi lưu trên cách thủy trong 1 h và loại bỏ dịch ether dầu hoả. Sau đó chuyển dược liệu sang 1 bình nón 250 ml và chiết tiếp bằng cách đun hồi lưu trên cách thủy với methanol (TT) cho tới khi hết màu vàng (50 ml x 4 lần). Gộp các dịch chiết và loại bỏ dung môi cho đến cắn. Thêm vào cắn 5 ml nước, khuấy và để yên 10 min, lọc qua phễu lọc xốp, tiếp tục rửa bằng nước (5 ml x 4 lần) và loại bỏ nước rửa. Hoà tan cắn trên phễu bằng những lượng nhỏ dung dịch natri hydroxyd 0,2 % trong ethanol 70 % (TT) đến khi dịch lọc hết màu vàng. Gộp các dịch lọc vào bình định mức 100 ml, thêm dung dịch natri hydroxyd 0,2 % trong ethanol 70 % (TT) đến vạch (dung dịch A). Lắc kỹ, lấy chính xác 1 ml dung dịch A, pha loãng thành 25 ml bằng dung dịch natri hydroxyd 0,2% trong ethanol 70 % (TT), đo độ hấp thụ (Phụ lục 4.1) ở bước sóng (361 ± 1) nm. Tính hàm lượng hesperidin (C28H35O15.H2O) theo A (1 %, 1 cm), lấy 160 là giá trị của A (1 %, 1 cm) ở 361 nm.
Hàm lượng hesperidin trong vỏ quả không được thấp hơn 5,0 % tính theo dược liệu khô kiệt.
Chế biến
Thu hoạch vào tháng 5 - 6, thu thập các quả quýt non tự rơi rụng, rửa sạch, phơi khô (thường gọi là Cá thanh bì). Thu hái quả chưa chín vào tháng 7 - 8, rửa sạch, bổ dọc thành 4 mảnh vỏ dính nhau ở đáy quả, loại bỏ hoàn toàn ruột, phơi khô (thường gọi là Tứ hoa thanh bì).
Bào chế
Lấy thanh bì, loại bỏ tạp chất, rửa sạch, ủ mềm, thái lát dày hoặc thành sợi, phơi khô.
Thố thanh bì (chế giấm): Trộn đều miếng hoặc sợi Thanh bì với giấm, cho vào nồi, sao nhỏ lửa đến có màu hơi vàng, lấy ra phơi khô. Cứ 100 kg Thanh bì dùng 15 lít giấm.
Bảo quản
Bảo quản ở nơi khô mát.
Tính vị, quy kinh
Khổ, tân, ôn. Vào các kinh can, đờm, vị.
Công năng, chủ trị
Sơ can, phá khí, tiêu tích, hoá trệ. Chủ trị: Ngực sườn đau trướng, sán khí, hạch vú, nhọt vú, thực tích đau bụng.
Cách dùng, liều lượng
Ngày dùng 6 g đến 9 g, dạng thuốc sắc hoặc hoàn tán. Thường phối hợp với các vị thuốc khác.
Kiêng kỵ
Người can huyết hư không có khí trệ thì kiêng dùng.
TRƯ LINH
Polyporus
Nám trư linh [Polyporus umbellatus (Pers.) Fries], họ Nấm Lỗ (Polyporaceae).
Mô tả
Dược liệu là những khối hình dạng thay đổi, thường dẹt, phân nhánh có mặt ngoài màu đen, nhiều chỗ lồi lõm, ruột trắng ngà, nhẹ, xốp.
Vi phẫu
Mặt cắt thường hình tròn, dẹt, cấu tạo bởi các sợi nấm đường kính 5 μm đến 10 μm, phía ngoài các sợi nấm đan xen vào nhau chặt, phần trong lỏng lẻo hơn, rải rác có các tinh thể hình khối.
Bột
Bột màu xám nhạt, vị nhạt, mùi hơi tanh. Soi dưới kính hiển vi thấy: các sợi nấm mảnh, ít phân nhánh, rải rác có các bào tử nhỏ hình trứng, các tinh thể hình khối.
Định tính
A. Lấy khoảng 1 g bột dược liệu, thêm 10 ml dung dịch acid hydrocloric loãng (TT), đun sôi trong cách thủy khoảng 15 min, khấy đều sẽ tạo nên dung dịch nhớt.
B. Phương pháp sắc ký lớp mỏng (Phụ lục 5.4)
Bản mỏng: Silica gel 60 F254.
Dung môi khai triển: Ether dầu hoả (khoảng sôi 60 °C đến 90 °C) - ethyl acetat (3 : 1).
Dung dịch thử: Lấy 1 g bột thô dược liệu, ngâm 30 min trong 20 ml methanol (TT) thỉnh thoảng lắc, lọc, cô dịch lọc tới khoảng 1 ml dùng làm dung dịch thử.
Dung dịch đối chiếu: Lấy 1 g bột Trư linh (mẫu chuẩn), tiến hành chiết cùng điều kiện như đối với dung dịch thử.
Cách tiến hành: Chấm riêng biệt lên cùng bản mỏng 5 μl đến 10 μl mỗi dung dịch trên. Sau khi khai triển, bản mỏng được để khô ngoài không khí ở nhiệt độ phòng. Quan sát dưới ánh sáng tử ngoại ở bước sóng 254 nm, trên sắc ký đồ của dung dịch thử phải có các vết có cùng màu sắc và giá trị Rf với các vết trên sắc ký đồ của dung dịch đối chiếu.
Độ ẩm
Không được quá 12,0 % (Phụ lục 9.6, 1 g, 85 °C, 4 h).
Tạp chất
Không được quá 1 % (Phụ lục 12.11).
Tro toàn phần
Không được quá 3,0 % (Phụ lục 9.8).
Chất chiết được trong dược liệu
Không dưới 2,5 % tính theo dược liệu khô kiệt.
Tiến hành theo phương pháp chiết nóng (Phụ lục 12.10). Dùng nước làm dung môi.
Chế biến
Thu hoạch vào mùa xuân hoặc mùa thu, rửa sạch, thái mỏng, phơi khô.
Bảo quản
Để nơi khô ráo, thoáng mát, định kỳ phơi sấy lại.
Tính vị quy kinh
Vị ngọt, nhạt, tính bình, vào các kinh thận, bàng quang.
Công năng chủ trì
Lợi tiểu, tảo thấp, trị sưng phù, tiểu khó, tiểu đục.
Cách dùng liều lượng
Ngày dùng 6 g đến 15 g, dạng thuốc sắc để uống.
Kiêng kỵ
Bệnh nhân đau thận, phụ nữ có thai phải cẩn thận khi dùng Trư linh.
VỐI (Lá)
Folium Cleistocalysis operculati
Lá đã phơi hay sấy khô của cây Vối [Cleistocalyx operculatus (Roxb.) Merr. et Perry], họ Sim (Myrtaceae).
Mô tả
Lá dày, hình trái xoan hay bầu dục dài 8 cm đến 15 cm, rộng 5 cm đến 7 cm, gốc tròn, đầu lá nhọn. Hai mặt lá có hai màu khác nhau, mặt trên màu nâu xám, mặt dưới màu lục nhạt. Không mùi, vị hơi chát.
Vi phẫu
Phần gân lá: Biểu bì trên và biểu bì dưới là một hàng tế bào nhỏ xếp thành hàng đều đặn, ngoài có lớp cutin dày. Mô mềm gồm những tế bào hình tròn thành mỏng, kích thước không đều. Trong mô mềm vỏ có túi tiết tinh dầu nằm sát lớp biểu bì. Vòng mô cứng gần như liên tục bao quanh bó libe-gỗ. Bó libe-gỗ hình cung, libe bao quanh gỗ. Trong libe có tinh thể calci oxalat hình cầu gai nằm rải rác. Gỗ gồm các mạch gỗ, có 1 đến 2 bó mạch gỗ xếp rời cạnh mạch gỗ chính hình cung.
Phiến lá: Biểu bì trên và biểu bì dưới là một hàng tế bào nhỏ xếp thành hàng đều đặn, ngoài có lớp cutin dày. Mô giậu gồm một hàng tế bào xếp vuông góc với biểu bì trên. Mô mềm gồm những tế bào tròn, to nhỏ không đều, thành mỏng. Hạ bì gồm 2 đến 3 lớp tế bào nhỏ sát lớp biểu bì dưới.
Bột
Màu nâu, vị chát. Có các đặc điểm: Mảnh mô mềm, túi tiết tinh dầu, mảnh mạch xoắn, sợi đứng riêng lẻ hay xếp thành bó, tinh thể caclci oxalat hình cầu gai, tế bào mô cứng hình nhiều cạnh thành dày.
Định tính
A. Lấy 3 g bột dược liệu, thêm 30 ml ethanol 90 % (TT), đun sôi 3 min trên cách thủy, lọc, lấy dịch lọc (dung dịch A) làm các phản ứng sau và làm dung dịch thử trong phép thử B.
Lấy 2 ml dung dịch A, thêm 3 giọt dung dịch sắt (III) clorid 5 % (TT), lắc nhẹ, dung dịch có màu xanh đen.
Nhỏ 1 giọt dung dịch A lên miếng giấy lọc, hơ nhẹ cho khô, vết có màu vàng nhạt, hơ lên miệng lọ amoniac đã được mở nút, quan sát thấy màu vàng đậm lên.
Lấy 1 ml dung dịch A, thêm 3 giọt dung dịch natri hydroxyd 10 % (TT), xuất hiện tủa màu vàng nâu.
B. Phương pháp sắc ký lớp mỏng (Phụ lục 5.4).
Bản mỏng silica gel GF254 tráng sẵn (TT).
Dung môi khai triển: Toluen - ethyl acetat - acid formic (6 : 4 : 1).
Dung dịch thử: Lấy 5 ml dung dịch A cô trên cách thủy còn khoảng 1 ml
Dung dịch đối chiếu: Lấy 3 g bột lá vối (mẫu chuẩn), tiến hành chiết và cô đậm đặc như mẫu thử.
Cách tiến hành: Chấm riêng biệt lên bản mỏng 10 μl mỗi dung dịch trên. Triển khai sắc ký, lấy bản mỏng ra để khô ở nhiệt độ phòng, quan sát dưới đèn tử ngoại ở bước sóng 254 nm rồi phun dung dịch acid sulfuric 10 % trong ethanol (TT), sấy bản mỏng ở nhiệt độ 100 °C đến khi xuất hiện các vết có màu. Trên sắc ký đồ của dung dịch thử phải có các vết cùng màu và cùng giá trị Rf với các vết của dung dịch đối chiếu.
Độ ẩm
Không được quá 8,0 % (Phụ lục 9.6, 70 °C, 1 g, 4 h).
Tro toàn phần
Không được quá 9,0 % (Phụ lục 9.8).
Tạp chất
Không được quá 2 % (Phụ lục 12.11).
Chất chiết được trong dược liệu
Cân chính xác khoảng 10 g bột dược liệu cho vào bình Soxhlet, chiết bằng ethanol 90 % (TT) trong 4 h. Lấy dịch chiết, cất thu hồi dung môi rồi cô trên cách thủy đến cắn. Hòa tan cắn 3 lần, mỗi lần với 20 ml nước nóng, lọc. Gộp các dịch lọc vào bình gạn, chiết 5 lần, mỗi lần với 20 ml ethyl acetat (TT), gộp dịch chiết ethyl acetat, cất thu hồi dung môi, chuyển phần còn lại vào một cốc đã cân bì, bay hơi trên cách thủy đến cắn, sấy cắn ở nhiệt độ 60 °C đến khối lượng không đổi. Tính hàm lượng chất chiết được trong dược liệu.
Dược liệu phải chứa không ít hơn 1,0 % chất chiết được trong ethyl acetat tính theo dược liệu khô kiệt.
Chế biến
Thu hái lá, loại bỏ tạp chất, phơi hoặc sấy khô.
Bảo quản
Trong bao bì kín, để nơi khô, tránh nấm mốc.
Bào chế
Thu hái lá bánh tẻ, ngâm trong nước sạch khoảng 20 min đến 30 min. Vớt ra, phơi đến khi lá khô tái đi (độ ẩm khoảng 50 %). Ủ 30 min đến 1 h để lá có màu hơi vàng và có mùi thơm. Tiếp tục phơi khô. Lá vối khô có màu hơi vàng xám, mùi thơm đặc trưng. Cắt đoạn 3 - 5 mm theo chiều vuông góc với lá hoặc tán thành bột thô.
Tính vị, quy kinh
Vị đắng, chát; tính hàn. Vào kinh tỳ, vị.
Công năng, chủ trị
Giải biểu, khử thấp, hóa trệ, tiêu thực, sát trùng. Chủ trị: Ăn uống kém tiêu, đầy bụng, đau bụng, lỵ. Dùng ngoài, nấu nước rửa vết thương, mụn nhọt, lở ngứa.
Cách dùng, liều lượng
Ngày 16 g đến 20 g. Dạng thuốc sắc, chè, uống lúc nóng.
Kiêng kỵ
Tỳ vị hư hàn, ỉa chảy không dùng.
VỐI (Nụ hoa)
Flos Cleistocalysis operculati
Nụ hoa đã phơi hay sấy nhẹ đến khô của cây Vối [Cleistocalyx operculatus (Roxb.) Merr. et Perry], họ Sim (Myrtaceae).
Mô tả
Nụ hoa hình ovan, hai đầu thuôn nhọn, dài 4 mm đến 6 mm, rộng 2 mm đến 3 mm, màu vàng nâu. Đài hoa hình chuông, màu xám dài bằng 1/3 -1/2 hoa, phía trên xẻ thành 4 răng nông. Hoa nhỏ màu trắng lục nhạt lúc tươi, sau khi chế biến có màu hơi xám vàng, mùi thơm đặc trưng. Vị hơi chát.
Bột
Bột màu vàng nhạt, có các đặc điểm: Lông che chở, mảnh mô mềm là những tế bào hình đa giác. Hạt phấn hình cầu có 3 lỗ rãnh. Mảnh cánh hoa, mạch xoắn, mảnh mạch.
Định tính
A. Lấy 2 g bột dược liệu, thêm 20 ml ethanol (90%) (TT), đun sôi 2 min trên cách thủy, lọc. Dịch lọc (dung dịch A) dùng làm các phản ứng sau và làm dung dịch thử trong phép thử B.
Lấy 2 ml dung dịch A, thêm 5 giọt acid hydrocloric (TT) và một ít bột magnesi (TT), sau vài phút dung dịch chuyển từ màu vàng sang màu hồng.
Lấy 1 ml dung dịch A, thêm 3 giọt dung dịch sắt (III) clorid 5 % (TT), lắc nhẹ, dung dịch có màu xanh đen.
Lấy 1 ml dung dịch A, thêm 2 đến 3 giọt dung dịch natri hydroxyd 10 % (TT), xuất hiện tủa màu vàng, tủa sẽ tan trong lượng dư dung dịch natri hydroxyd 10 % .
B. Phương pháp sắc ký lớp mỏng (Phụ lục 5.4)
Bản mỏng silica gel GF254 tráng sẵn (TT).
Dung môi khai triển: Toluen - ethyl acetat - acid formic (6 : 4 : 1).
Dung dịch thử: Lấy 3 ml dung dịch A, cô trên cách thủy còn khoảng 1 ml.
Dung dịch đối chiếu: Lấy 2 g bột Nụ vối (mẫu chuẩn), tiến hành chiết như mẫu thử.
Cách tiến hành: Chấm riêng biệt lên cùng bản mỏng 10 μl mỗi dung dịch trên. Triển khai sắc ký, lấy bản mỏng ra để khô ở nhiệt độ phòng, quan sát dưới đèn tử ngoại tại bước sóng 254 nm có các vết phát quang màu xanh lơ, tiếp tục phun dung dịch acid sulfuric 10 % trong ethanol (TT), sấy bản mỏng ở 100 °C tới khi xuất hiện vết có màu tím đỏ. Trên sắc ký đồ, dung dịch thử phải có các vết cùng màu và cùng giá trị Rf với các vết của dung dịch đối chiếu.
Độ ẩm
Không được quá 10,0 % (Phụ lục 9.6, 70 °C, 1 g, 4 h)
Tro toàn phần
Không được quá 10,0 % (Phụ lục 9.8).
Tạp chất (Phụ lục 12.11)
Tỷ lệ hoa đã nở: Không được quá 10 %.
Tạp chất khác: Không được quá 3 %.
Chất chiết được trong dược liệu
Không ít hơn 15,0 % tính theo dược liệu khô kiệt.
Tiến hành theo phương pháp chiết nóng (Phụ lục 12.10), dùng ethanol 70 % (TT) làm dung môi.
Chế biến
Thu hái các cành mang nụ hoa, ngâm trong nước sạch khoảng 20 - 30 min. Vớt ra, để khô se, tuốt lấy nụ hoa. Phơi khô đến độ ẩm khoảng 50 %. Ủ 30 min đến 1 h để nụ có màu hơi vàng và có mùi thơm. Tiếp tục phơi khô. Nụ vối cho màu hơi xám vàng, mùi thơm đặc trưng.
Bảo quản
Trong bao bì kín, nơi khô mát, thoáng gió, tránh nấm mốc.
Tính vị, quy kinh
Đắng, chát, tính hàn. Vào kinh tỳ, vị, phế, thận.
Công năng, chủ trị
Khử thấp, hóa trệ, kích thích tiêu hóa, giải phiền khát, sát trùng. Chủ trị: Ăn uống kém tiêu, đầy bụng, viêm dạ dày, ruột cấp, lỵ trực trùng, tiểu đường. Dùng ngoài, nấu nước rửa vết thương, mụn nhọt, lở ngứa.
Cách dùng, liều lượng
Ngày dùng 8 g đến 12 g. Dạng thuốc sắc, chè, uống lúc nóng.
Kiêng kỵ
Tỳ vị hư hàn, ỉa chảy không dùng.
VỪNG ĐEN
Semen Sesami Nigrum
Mè đen
Hạt già phơi khô của cây Vừng đen (Sesamum indicum DC.), họ Vừng (Pedaliaceae).
Mô tả
Hạt dẹt, hình trứng dài, 1 đầu nhọn, 1 đầu tròn, dải chừng 3 mm (có khi tới 5mm), rộng 2 mm. Mặt ngoài màu đen, nhẵn bóng hoặc hơi có vân lưới. Có hạt noãn màu nâu ở đỉnh quả (đầu nhọn), vỏ hạt mỏng, 2 lá mầm màu trắng có dầu. Mùi thơm, vị hơi ngọt.
Bột
Bột màu nâu xám hoặc đen nâu, có mùi thơm, vị hơi ngọt, miết lên tay thấy nhờn, bết dính.
Soi kính hiển vi thấy mảnh mô mềm gồm các tế bào hình đa giác, thành mỏng, chứa đầy tinh bột và những giọt dầu; Nhiều hạt tinh bột dính nhau thành đám hoặc nằm riêng rẽ, kích thước thay đổi, hình đa giác hoặc bầu dục, rốn hạt rõ. Tinh thể calci oxalat hình cầu hoặc gần cầu rải rác hoặc nằm trong tế bào biểu bì vỏ quả, đường kính 14 đến 38 μm. Tinh thể calci oxalat hình trụ rải rác, đường kính 2 đến 12 μm, dài 24 μm.
Định tính
A. Lấy 1 g dược liệu đã giã dập, thêm 10 ml ether dầu hoả (60 °C đến 90 °C) (TT), ngâm 1 h. Gạn lớp chất lỏng ở bên trên vào một ống nghiệm, thêm 10 ml acid hydrocloric (TT) có chứa 0,1 g sucrose (TT), lắc trong 30 s, màu hồng xuất hiện trong lớp acid và dần dần chuyển sang màu đỏ khi để yên.
B. Phương pháp sắc ký lớp mỏng (Phụ lục 5.4).
Bản mỏng: Silica gel G
Dung môi khai triển: Cyclohexan - ether - ethyl acetat (20 : 5,5 : 2,5).
Dung dịch thử: Tán nhỏ 0,5 g dược liệu, thêm 20 ml ethanol (TT), lắc siêu âm 20 min, lọc, bay hơi dịch lọc trên cách thủy tới cắn. Hoà tan cắn trong 1 ml ethanol (TT), để yên, dùng lớp dung dịch ở phía trên làm dung dịch chấm sắc ký.
Dung dịch đối chiếu: Dùng 0,5 g hạt Vừng đen (mẫu chuẩn), tiến hành chiết như mẫu thử.
Cách tiến hành: Chấm riêng biệt lên bản mỏng 10 μl mỗi dung dịch trên. Sau khi triển khai sắc ký, lấy bản mỏng ra để khô trong không khí, phun dung dịch acid sulfuric 10 % trong ethanol (TT), sấy bản mỏng ở 100 °C đến 105 °C cho đến khi các vết hiện rõ. Trên sắc ký đồ của dung dịch thử phải xuất hiện các vết có màu sắc và giá trị Rf giống các vết của dung dịch đối chiếu.
Độ ẩm
Không được quá 7,0 % (Phụ lục 12.13).
Tạp chất
Không được quá 3 % (Phụ lục 12.11).
Tro toàn phần
Không được quá 8,0 % (Phụ lục 9.8).
Dùng 1,0 g dược liệu.
Tro không tan trong acid
Không được quá 1,0 % (Phụ lục 9.7).
Hàm lượng chất béo
Không ít hơn 30,0 % tính theo dược liệu khô kiệt
Cân chính xác khoảng 10 g dược liệu (bột nửa thô), đặt vào dụng cụ Soxhlet, dùng 100 ml ether ethylic (TT) làm dung môi chiết, đun trên cách thủy sôi 5 h. Chuyển dịch chiết vào bình thủy tinh đã cân bì trước, cô trên cách thủy đến cạn. Sấy cắn ở 105 °C trong 3 h, lấy ra để nguội trong bình hút ẩm 60 min, cân xác định khối lượng cắn.
Tính phần trăm lượng cắn thu được theo dược liệu khô kiệt.
Chế biến
Thu hoạch vào mùa Thu. Khi quả chín, cắt cả cây đem phơi khô, đập lấy hạt, loại bỏ tạp chất, phơi khô.
Bảo quản
Trong bao bì kín, để nơi khô ráo. Tránh mọt.
Bào chế
Khi dùng, đem hạt vừng sao nhỏ lửa tới khi hạt nổ lách tách, phồng đều, mùi thơm đặc trưng, lấy ra, tãi mỏng cho nguội.
Tính vị, quy kinh
Vị ngọt, tính bình, không độc. Vào các kinh tỳ, can, thận.
Công năng, chủ trị
Bổ can thận, dưỡng huyết, chỉ huyết, nhuận tràng thông tiện, lợi sữa. Chủ trị: Thiếu máu do huyết hư, tóc bạc sớm, xuất huyết do giảm tiểu cầu, táo bón, sau đẻ ít sữa.
Cách dùng, liều lượng
Ngày dùng 12 g đến 60 g. Dạng bột hoặc nấu cháo.
Kiêng kỵ
Tỳ vị hư hàn, ỉa chảy không dùng.
PHẦN 5
VẮC XIN
VẮC XIN BẠCH HẦU - UỐN VÁN - HO GÀ - VIÊM GAN B - Hib (DTPW - HeB - Hib)
Vaccinum diphtheriae - tetani - pertussis - hepatitidis B et HaemophiIus influenzae b adsorbatum
Vắc xin bạch hầu - uốn ván - ho gà - viêm gan B - Hib là một hỗn hợp các kháng nguyên hấp phụ vào tá chất nhôm, gồm các giải độc tố bạch hầu, uốn ván tinh chế, vắc xin ho gà toàn tế bào, kháng nguyên bề mặt (HBsAg) virus viêm gan B tái tổ hợp và kháng nguyên Hib cộng hợp. Tá chất là nhôm.
SẢN XUẤT GIẢI ĐỘC TỐ BẠCH CẦU
Vắc xin bạch hầu được sản xuất dựa vào hệ thống chủng gốc. Chủng Corynebacterium diphtheriae dùng cho sản xuất phải tuân thủ theo quy định về hệ thống chủng gốc và được nuôi cấy trên môi trường lỏng Lingood. Cuối giai đoạn nuôi cấy, cần kiểm tra tính thuần khiết để loại bỏ những loạt nuôi cấy đơn bị nhiễm tạp. Xác định hàm lượng độc tố bạch hầu (Lf/ml) bằng phản ứng lên bông. Các mẻ gặt đơn có thể hỗn hợp lại để giải độc bằng formaldehyd và tinh chế theo phương pháp thích hợp.
Giải độc tố bạch hầu tinh chế được kiểm tra vô khuẩn, tính độc đặc hiệu, tính hồi độc, độ tinh sạch của kháng nguyên trước khi pha chế vắc xin bán thành phẩm cuối cùng.
Vô khuẩn
Tiến hành thử nghiệm vô khuẩn trên môi trường canh thang Thioglycolat và Soybean Casein với 10 ml mẫu giải độc tố bạch hầu tinh chế cho mỗi môi trường.
Cách tiến hành và tiêu chuẩn chấp thuận theo Phụ lục 15.7.
Kiểm tra tính độc đặc hiệu
Tiêm dưới da ít nhất 500 Lf của giải độc tố bạch hầu tinh chế chứa trong thể tích 1 ml vào mỗi trong số 5 chuột lang khối lượng 250 g/con đến 350 g/con, khỏe mạnh, chưa sử dụng vào bất cứ mục đích gì trước đó. Theo dõi chuột trong vòng 42 ngày sau tiêm, nếu thấy chuột có những triệu chứng bất thường hay bị chết do độc tố bạch hầu thì lô giải độc tố bạch hầu tinh chế này không đạt về tính an toàn đặc hiệu. Nếu có hơn một chuột lang thử nghiệm bị chết trong thời gian theo dõi vì bất kỳ nguyên nhân nào không phải do độc tố bạch hầu thì phải nhắc lại thử nghiệm. Nếu có hơn một chuột lang thử nghiệm bị chết trong lần thử nghiệm thứ hai thì lô giải độc tố bạch hầu tinh chế này không đạt về tính an toàn đặc hiệu.
Kiểm tra tính hồi độc
Sử dụng dung dịch đệm giống như dùng để pha vắc xin thành phẩm nhưng không có chất hấp phụ để pha loãng giải độc tố bạch hầu tinh chế sao cho có chứa hàm lượng giải độc tố tương đương như trong vắc xin thành phẩm (35 Lf/ml); chia thành 2 phần tương đương nhau và ủ mỗi phần của dung dịch này ở nhiệt độ khác nhau (5 ± 3) °C và 37 °C trong 6 tuần. Từng mẫu trong 2 mẫu thử sau khi ủ được đưa ra kiểm tra tính hồi độc của độc tố bạch hầu bằng cách tiêm dưới da cho 5 chuột lang khỏe mạnh, khối lượng từ 250 g/con đến 350 g/con.
Giải độc tố bạch hầu tinh chế đạt yêu cầu về thử nghiệm tính hồi độc khi các chuột lang thử nghiệm đều khỏe mạnh, lên cân và không có chuột nào có dấu hiệu về phản ứng do độc tố bạch hầu trong 6 tuần theo dõi.
Kiểm tra độ tinh sạch của kháng nguyên bạch hầu
Giải độc tố bạch hầu tinh chế phải đạt không ít hơn 1500 Lf/mg nitrogen protein.
SẢN XUẤT GIẢI ĐỘC TỐ UỐN VÁN
Vắc xin uốn ván được sản xuất dựa vào hệ thống chủng gốc. Chủng Clotridium tetani dùng cho sản xuất phải tuân thủ theo quy định về hệ thống chủng gốc và được nuôi cấy trên môi trường thích hợp. Cuối giai đoạn nuôi cấy, cần kiểm tra tính thuần khiết để loại bỏ những loạt nuôi cấy đơn bị nhiễm tạp. Xác định hàm lượng độc tố uốn ván (Lf/ml) bằng phản ứng lên bông, xác định độc tính bằng thử nghiệm liều chết 100 % chuột (MLD). Các mẻ gặt đơn có thể hỗn hợp lại để giải độc bằng formaldehyd và nhiệt độ, tinh chế theo phương pháp thích hợp.
Số lượng Lf trong vắc xin uốn ván bán thành phẩm tùy thuộc vào công thức gốc của từng nhà sản xuất nhưng không được quá 25 Lf trong một liều đơn cho người, nếu sử dụng nhiều hơn một liều cho phác đồ tiêm miễn dịch cơ bản.
Giải độc tố uốn ván tinh chế được kiểm tra vô khuẩn, tính độc đặc hiệu, tính hồi độc, độ tinh sạch, hàm lượng kháng nguyên (Lf/ml) trước khi pha chế vắc xin bán thành phẩm cuối cùng.
Vô khuẩn
Tiến hành thử nghiệm vô khuẩn trên môi trường canh thang Thioglycolat và Soybean Casein với 10 ml mẫu giải độc tố uốn ván tinh chế cho mỗi môi trường.
Cách tiến hành và tiêu chuẩn chấp thuận theo Phụ lục 15.7.
Tính độc đặc hiệu
Tiêm dưới da ít nhất 500 Lf của giải độc tố uốn ván tinh chế chứa trong thể tích 1 ml vào mỗi chuột trong số 5 chuột lang khỏe mạnh, khối lượng 250 g/con đến 350 g/con chưa sử dụng vào bất cứ mục đích gì trước đó. Theo dõi chuột trong vòng 21 ngày sau tiêm, nếu thấy chuột có những triệu chứng bất thường hay bị chết do độc tố uốn ván thì lô giải độc tố uốn ván tinh chế này không đạt về tính an toàn đặc hiệu. Nếu có hơn một chuột lang thử nghiệm bị chết trong thời gian theo dõi vì bất kỳ nguyên nhân nào không phải do độc tố uốn ván thì phải nhắc lại thử nghiệm. Nếu có hơn một chuột lang thử nghiệm bị chết trong lần thử nghiệm thứ hai thì lô giải độc tố uốn ván tinh chế này cũng không đạt về tính an toàn đặc hiệu.
Tính hồi độc
Sử dụng dung dịch đệm dùng để pha vắc xin thành phẩm nhưng không có chất hấp phụ để pha loãng giải độc tố uốn ván tinh chế sao cho có chứa hàm lượng giải độc tố tương đương như trong vắc xin thành phẩm (≤ 20 Lf/ml); chia thành 2 phần tương đương nhau và ủ mỗi phần của dung dịch này ở nhiệt độ khác nhau (5 ± 3) °C và 37 °C trong 6 tuần. Từng mẫu trong 2 mẫu thử sau khi ủ được đưa ra kiểm tra tính hồi độc của độc tố uốn ván bằng cách tiêm dưới da cho 5 chuột lang khỏe mạnh, khối lượng từ 250 g/con đến 350 g/con.
Giải độc tố uốn ván tinh chế đạt yêu cầu về thử nghiệm tính hồi độc khi các chuột lang thử nghiệm đều khỏe mạnh, lên cân và không có chuột nào có dấu hiệu về phản ứng do độc tố uốn ván trong 3 tuần theo dõi.
Độ tinh sạch của kháng nguyên uốn ván
Giải độc tố uốn ván tinh chế phải đạt không ít hơn 1000 Lf/mg nitrogen protein.
SẢN XUẤT NƯỚC CỐT HO GÀ BẤT HOẠT
Nước cốt ho gà được sản xuất dựa vào hệ thống chủng gốc. Chủng Bordertella pertussis dùng cho sản xuất phải tuân thủ theo quy định về hệ thống chủng gốc và được nuôi cấy trên môi trường thích hợp. Việc lựa chọn chủng nuôi cấy, môi trường và phương pháp nuôi cấy thích hợp nhằm tạo ra vắc xin ho gà thành phẩm có được 3 ngưng kết nguyên: 1; 2; 3. Từng chủng được nuôi cấy 24 h đến 72 h trong môi trường lỏng hoặc đặc. Không được dùng máu người hoặc các sản phẩm từ máu người trong bất kỳ môi trường nuôi cấy chủng ho gà nào để sản xuất vắc xin ho gà. Môi trường dùng trong giai đoạn nuôi cấy chủng ho gà cuối cùng cũng không được phép có máu hoặc sản phẩm của máu.
Sau khi nuôi cấy, gặt và rửa sinh khối vi khuẩn ho gà để loại bỏ các chất còn tồn dư của môi trường nuôi cấy; pha thành hỗn dịch ho gà với nước muối sinh lý vô khuẩn thành hỗn dịch nước cốt ho gà cô đặc.
Tính thuần khiết của các mẻ gặt đơn
Lấy mẫu từ các mẻ gặt đơn để kiểm tra tính thuần khiết bằng phương pháp nhuộm soi kính hiển vi hoặc cấy vào môi trường nuôi cấy thích hợp. Các mẻ gặt đơn sẽ không được phép sử dụng vào việc pha chế bán thành phẩm khi phát hiện có tạp nhiễm.
Độ đục
Dùng bộ so độ đục chuẩn quốc tế hoặc đo mật độ quang (OD) ở bước sóng 560 nm của hỗn dịch nước cốt ho gà cô đặc (không được muộn hơn hai tuần sau khi gặt và trước khi huyền dịch vi khuẩn được đưa vào bất kỳ quy trình pha chế nào tiếp theo) để xác định đậm độ của nước cốt ho gà cô đặc. Đậm độ nước cốt ho gà được sử dụng làm cơ sở để tính toán khi pha chế vắc xin bán thành phẩm cuối cùng.
Thành phần ho gà trong vắc xin DTPw - HeB - Hib hỗn hợp không vượt quá 15 đơn vị độ đục quốc tế (IOU) trong một liều đơn vắc xin cho người. Tỷ lệ thành phần các chủng B. pertussis không được thay đổi khi hỗn hợp vắc xin, phải đăng ký rõ trong hồ sơ và được sự chấp thuận của cơ quan kiểm định quốc gia.
Độ sống sót
Hỗn dịch vi khuẩn ho gà được giết chết và giải độc bằng phương pháp được sự chấp thuận của cơ quan kiểm định quốc gia. Các hóa chất được sử dụng để giết chết và giải độc vi khuẩn ho gà cũng phải được sự chấp thuận bởi cơ quan kiểm định quốc gia. Hỗn dịch vi khuẩn ho gà được giết chết bằng nhiệt độ trong khoảng thời gian thích hợp và được kiểm tra sự sống sót của các vi khuẩn này trên môi trường Border-Gengou. Sau khi bất hoạt, nước cốt ho gà được bảo quản ở nhiệt độ (5 ± 3) °C trong một khoảng thời gian cần thiết để giảm bớt tính độc.
Mỗi loạt nước cốt ho gà đơn sẽ không được dùng để pha chế vắc xin bán thành phẩm khi không đạt các tiêu chuẩn về vô khuẩn, khả năng bất hoạt hoàn toàn (kiểm tra độ sống sót), nhận dạng, khả năng phát triển, ngưng kết như chủng gốc B. pertussis.
SẢN XUẤT KHÁNG NGUYÊN BỀ MẶT (HBsAg) TÁI TỔ HỢP
Vắc xin viêm gan B tái tổ hợp được điều chế bằng cách sử dụng HBsAg tổng hợp ở tế bào nấm men (Saccharomyces cerevisiae, Pichia pastoris, Hansenula polymorpha), tế bào trứng chuột đất vàng (CHO-Chinese hamster ovary) hoặc các dòng tế bào thích hợp khác đã được biến nạp một plasmid có chứa gen mã hóa HBsAg. HBsAg được thu từ tế bào bằng cách làm ly giải tế bào nấm men và được tinh chế nhờ các kỹ thuật sinh hóa lý.
Vắc xin tái tổ hợp có thể chứa sản phẩm của gen S (protein chủ yếu) hoặc phối hợp sản phẩm của gen S và tiền S2 (protein loại trung bình) hoặc phối hợp cả sản phẩm của gen S, tiền S2 và tiền S1 (protein loại lớn).
Hàm lượng protein
Protein trong mẫu thử được định lượng theo phương pháp Lowry (Phụ lục 15.34).
Nhận dạng và hàm lượng HBsAg
Xác định hàm lượng HBsAg bằng các thử nghiệm hóa miễn dịch phù hợp, như thử nghiệm miễn dịch phóng xạ (RIA), thử nghiệm hấp phụ miễn dịch gắn men (ELISA), thấm miễn dịch hoặc khuếch tán miễn dịch đơn. Vắc xin mẫu thử được so sánh với vắc xin mẫu chuẩn quốc tế hoặc vắc xin mẫu chuẩn quốc gia.
Độ tinh khiết của kháng nguyên
Được xác định bằng phương pháp sắc ký lỏng (Phụ lục 5.3).
Lipid
Không lớn hơn 100 μg/100 μg protein (Phụ lục 15.40).
Cesi clorid (CsCl)
Không lớn hơn 5 μg/20 μg protein (Phụ lục 15.41).
Tween 20
Không lớn hơn 50 μg/100 μg protein (Phụ lục 15.6).
Polysacharid
Không lớn hơn 10 μg/100 μg protein (Phụ lục 15.38). Kiểm định vắc xin bán thành phẩm cuối cùng.
Thimerosal
Không được lớn hơn 0,012 % (Phụ lục 15.29).
Vô khuẩn
Đạt yêu cầu về vô khuẩn (Phụ lục 15.7).
SẢN XUẤT KHÁNG NGUYÊN Hib CỘNG HỢP
Vắc xin phòng HaemophiIus influenzae type b là loại vắc xin hóa học được điều chế từ oligosaccharid tổng hợp giống với thành phần vỏ polysacharid của vi khuẩn trong tự nhiên. Oligosacharid cộng hợp với protein của giải độc tố uốn ván làm giá mang.
Trong mỗi liều đơn tiêm cho người chứa thành phần hoạt chất:
Kháng nguyên PRP-T: 12 μg.
Nhận dạng thành phần Hib
Bằng phản ứng ngưng kết giữa kháng nguyên và kháng thể đặc hiệu trong hệ thống hạt Latex. Sử dụng bộ sinh phẩm đáp ứng được yêu cầu nhận dạng và tiến hành theo hướng dẫn của nhà sản xuất bộ sinh phẩm Latex, hoặc nhận dạng thành phần Hib bằng một phản ứng hóa miễn dịch phù hợp.
Tiêu chuẩn: Có hiện tượng ngưng kết xảy ra, nhận thấy rõ ràng bằng mắt thường.
Hàm lượng sacharid (Polyribosyl Ribitol Phosphat = PRP) tổng số
Xác định hàm lượng PRP tổng số bằng phương pháp orcinol (Phụ lục 15.42) hoặc phương pháp sắc ký lỏng.
Tiêu chuẩn: Ít nhất phải đạt 80 % của hàm lượng sacharid tổng số ghi trên nhãn.
Hàm lượng sacharid tự do
Không được quá 25,0 % (≤ 25,0 %)
Xác định hàm lượng sacharid tự do bằng phương pháp orcinol (Phụ lục 15.42) hoặc phương pháp sắc ký lỏng.
Xác định hoạt tính miễn dịch Hib
Sinh vật phẩm
Thỏ cái F1 (1,8 đến 2,2 kg) được lựa chọn, vận chuyển và chăm sóc trong điều kiện thường.
Chứng dương vắc xin Hib.
Chuẩn bị dung dịch:
Dung dịch 20xPBS (20 x Phosphate Buffer Saline): Dung dịch có chứa 2,74 M natri clorid, 0,054 M kali clorid, 0,16 M dinatri hydrophosphat và 0,028 M kali dihydrophosphat. Cân 320 g natri clorid (TT), 8 g kali clorid (TT), 46 g dinatri hydrophosphat (TT), 8 g kali dihydrophosphat (TT). Hòa tan trong 1500 ml nước cất. Điều chỉnh pH trong khoảng từ 7,2 đến 7,3 bằng dung dịch acid hydrocloric 37 % (TT) hoặc dung dịch natri hydroxyd 2 M (TT). Chuyển vào bình định mức 2 lít, thêm nước cất vừa đủ đến vạch. Dung dịch này có nồng độ gấp 20 lần dung dịch làm việc. Bảo quản ở nhiệt độ phòng trong vòng 1 tháng.
Dung dịch PBS: Pha loãng 20 lần dung dịch 20xPBS bằng nước cất, cụ thể như sau: Lấy 100 ml dung dịch 20xPBS vào bình định mức 2 lít, thêm nước cất đến vạch, lắc đều. Nếu cần, điều chỉnh pH trong khoảng từ 7,2 đến 7,3 bằng dung dịch acid hydrocloric 37 % (TT) hoặc dung dịch natri hydroxyd 2 N (TT). Bảo quản ở 4 °C trong vòng 15 ngày.
Tiến hành
Làm song song mẫu thử và mẫu chứng.
Liều vắc xin 10 μg/0,5 ml.
Gây nhiễm trên 5 thỏ mỗi mẫu với liều vắc xin 10 μg/0,5 ml. Nếu vắc xin có hàm lượng cao hơn thì phải pha loãng bằng dung dịch PBS, sử dụng các vật liệu tiệt trùng.
Nếu vắc xin có hàm lượng thấp hơn, gây nhiễm với thể tích tiêm lớn hơn để đủ 10 μg nhưng không quá 2,5 ml mỗi thỏ.
Gây nhiễm ở ngày 0 và ngày 14, bằng đường tiêm dưới da vùng bụng. Sau khi tiêm theo dõi trong vòng 28 ngày ở vùng cách ly bảo vệ.
Tiến hành lấy máu sau liều tiêm đầu tiên 21 ngày. Lấy máu riêng từng con vào ống nghiệm nhựa 15 ml, không ít hơn 5 ml. Ly tâm 3000 r/min trong 20 min ở nhiệt độ phòng.
Tách huyết thanh cẩn thận bằng pipet (không được làm lẫn huyết thanh giữa các ống khác nhau) sang một ống nghiệm khác. Nếu chưa tiến hành định lượng kháng thể anti-Hib ngay, bảo quản các mẫu huyết thanh ở âm 20 °C để kiểm tra sau.
Định lượng kháng thể trong huyết thanh sau khi ly tâm theo quy trình định lượng kháng thể kháng Hib bằng phương pháp ELISA.
Thiết bị:
Máy đọc ELISA, bước sóng 492 nm.
Tủ an toàn sinh học.
Rửa phiến nhựa ELISA.
Máy đo ELISA đa kênh.
Vật liệu:
Phiến nhựa 96 giếng chuẩn độ vi lượng.
Buồng ẩm (hộp kín bằng nhựa hoặc kim loại bên trong có lót giấy lọc thấm nước cất để tạo độ ẩm)
Thuốc thử:
Tween 20
BSA Fraction V
OPD
Kháng IgG thỏ cộng hợp gắn peroxidase.
Chứng âm huyết thanh anti-Hib.
Chứng dương huyết thanh thỏ anti-Hib.
Oligosacharid của Hib cộng hợp với HSA (phủ phiến ) (HbO-HSA).
Chuẩn bị dung dịch:
Dung dịch 20xPBS: Pha như trên.
Dung dịch đệm phosphat-citrat có chứa 0,048 M acid citric, 0,1 M dinatri hydrophosphat (TT).
Dung dịch rửa phiến có chứa 0,027 M kali clorid (TT), 0,137 M natri clorid (TT), 0,008 M dinatri hydrophosphat (TT), 0,0014 M dikali hydrophosphat (TT), 0,05 % Tween 20, được pha bằng cách: thêm 2,5 ml Tween 20 vào 5 L dung dịch PBS. Bảo quản ở nhiệt độ phòng trong vòng 7 ngày.
Tween 20 pha loãng 1/4: Để có 40 ml dung dịch, lấy 10 ml Tween 20 thêm 30 ml nước cất. Trộn đều. Bảo quản ở nhiệt độ phòng trong vòng 1 tháng.
Dung dịch dừng phản ứng: Cân 10 g natri metabisulfit (TT), hóa tan trong 840 ml nước cất, thêm từ từ 160 ml acid sulfuric (TT). Khuấy đều, đặt trong chậu đá. Pha trong hốt và mang găng. Bảo quản ở nhiệt độ phòng trong vòng 1 tháng.
Dung dịch khóa (chứa 1 % BSA): Pha trước khi dùng. Cân 0,2 g BSA, hòa tan trong 20 ml nước cất.
Dung dịch pha loãng cho ELISA anti-Hib: Cân 1 g BSA, 0,372 g natri edetat (TT), đong 1,2 ml Tween 20 pha loãng 1/4, tất cả được hòa tan trong 80 ml dung dịch PBS. Điều chỉnh pH từ 7,2 đến 7,3 bằng dung dịch acid hydrocloric 37 % (TT) hoặc dung dịch natri hydroxyd 2 N (TT) nếu cần. Thêm dung dịch PBS vừa đủ 100 ml. Bảo quản ở nhiệt độ 2 °C đến 8 °C trong vòng 1 tháng.
Tiến hành:
Chuẩn bị chứng dương huyết thanh thỏ (anti-Hib) và chứng âm huyết thanh cho thử nghiệm ELISA theo cách sau: Pha loãng 1/50 với dung dịch pha loãng. Loại bỏ hết các vật liệu đã sử dụng. Chú ý: Tất cả phải ủ trong tủ ẩm.
Sau khi rửa phiến, nếu chưa dùng ngay, để ngửa phiến trong tủ ẩm, không quá 15 min.
Pha loãng dung dịch phủ phiến HBO-HSA để được nồng độ cuối cùng là 1 μg/ml HBO-HSA trong PBS với thể tích 11 ml. Thể tích này đủ dùng cho 1 phiến 96 giếng.
Ủ phiến ở 37 °C trong 90 min hoặc qua đêm ở 4 °C.
Rửa phiến 3 lần với dung dịch đệm rửa.
Thêm 100 μl dung dịch khóa vào mỗi giếng.
Ủ phiến trong 30 min ở 37 °C.
Rửa phiến 3 lần với dung dịch rửa phiến.
Thiết kế phiến:
Thể tích của mẫu và chứng trong mỗi giếng là 100 μl.
Cho chứng dương và chứng âm ở cột 1, 2 từ hàng A đến H (lặp lại 4 lần).
Cho mẫu từ cột 3 trở đi từ hàng A đến hàng H lặp lại 2 lần.
Ủ phiến 90 min ở nhiệt độ phòng.
Rửa phiến 3 lần với dung dịch rửa phiến.
Pha loãng cộng hợp kháng huyết thanh thỏ với peroxidase bằng dung dịch pha loãng theo hướng dẫn của nhà cung cấp. Sau đó thêm 100 μl dung dịch vừa pha vào tất cả các giếng.
Ủ phiến 1 h ở 37 °C.
Rửa phiến 3 lần với dung dịch rửa phiến.
Chuẩn bị dung dịch cơ chất như sau: Cân 0,1 g OPD và hòa tan trong 25 ml dung dịch đệm phosphat - citrat trong điều kiện tránh ánh sáng. Thêm 10 ml H2O2 lắc đều và thêm 100 μl vào tất cả các giếng.
Ủ 5 min trong tối ở nhiệt độ phòng.
Dừng phản ứng bằng cách thêm 50 μl dung dịch dừng phản ứng vào mỗi giếng.
Đọc phiến ở bước sóng 492 nm (Multiscan).
Phân tích và biện luận kết quả:
Thử nghiệm được chấp thuận khi OD của chứng dương và chứng âm đều nằm trong dải đo đã thiết lập. Nếu quá nửa bị loại, lặp lại test ELISA.
Tính toán giá trị ngưỡng (cutoff) của thử nghiệm để thiết lập tiêu chuẩn quyết định mẫu âm tính hay dương tính theo công thức:
Cutoff = trung bình OD của nền + 2SD
Trong đó SD là độ lệch chuẩn.
Tất cả các giá trị OD lớn hơn hoặc bằng cutoff là dương tính.
Tất cả các giá trị OD nhỏ hơn cutoff là âm tính.
Tính % có đáp ứng như sau:
% đáp ứng = tổng số thỏ có đáp ứng x 100/tổng số thỏ gây nhiễm
Tiêu chuẩn chấp thuận của thử nghiệm:
Thử nghiệm có giá trị khi đối với mẫu vắc xin chứng, số thỏ có đáp ứng miễn dịch không ít hơn 50 % (≥ 50%).
Tiêu chuẩn chấp thuận của mẫu thử.
Mẫu thử được coi là đạt yêu cầu của thử nghiệm khi số thỏ được dùng trong thử nghiệm có đáp ứng miễn dịch không ít hơn 50 % (≥ 50 %).
Phương pháp sản xuất vắc xin DTPW - HeB - Hib phải được thẩm định để chứng minh rằng sản phẩm khi kiểm định sẽ tuân thủ và đạt được các tiêu chuẩn như mô tả dưới đây.
KIỂM ĐỊNH VẮC XIN BÁN THÀNH PHẨM
Vắc xin bán thành phẩm được pha chế và hỗn hợp bởi một lượng thích hợp của giải độc tố bạch hầu, giải độc tố uốn ván, kháng nguyên viêm gan B đã được hấp phụ nhôm phosphat và hỗn hợp thêm một lượng thích hợp của huyền dịch B. pertussis đã được bất hoạt, sau cùng được hỗn hợp với kháng nguyên Hib đã được hấp phụ nhôm phosphat; kết quả của sự hỗn hợp này được tiêm vào cơ thể phải phù hợp về mặt sinh lý với máu. Hàm lượng của B. pertussis của vắc xin bán thành phẩm phải không được vượt quá 15 IOU trong một liều đơn cho người. Nếu sử dụng hai hoặc nhiều hơn số chủng B. pertussis thì khi pha vắc xin bán thành phẩm phải tính toán sao cho tổng số đơn vị độ đục của các chủng ho gà đưa vào phải không thay đổi giữa các loạt vắc xin và không vượt quá 15 IOU trong một liều đơn cho người. Hàm lượng chất bảo quản trong vắc xin DTPw - HeB - Hib hấp phụ phải không ảnh hưởng đến tính sinh miễn dịch của giải độc tố uốn ván, bạch hầu, vắc xin ho gà, kháng nguyên Hib, kháng nguyên HeB và không gây ra những phản ứng có hại cho người sử dụng.
Chỉ vắc xin bán thành phẩm cuối cùng nào tuân thủ và đạt các yêu cầu dưới đây mới được sử dụng để sử dụng sản xuất thành phẩm.
Chất bảo quản kháng khuẩn
Xác định hàm lượng chất bảo quản kháng khuẩn trong vắc xin bán thành phẩm cuối cùng bằng phương pháp thích hợp (Phụ lục 15.29). Hàm lượng chất bảo quản từ 85 % đến 115 % của lượng chất bảo quản ghi trên nhãn.
Vô khuẩn
Tiến hành thử nghiệm vô khuẩn trên môi trường canh thang Thioglycolat và Soybean Casein. Dùng 10 ml vắc xin để kiểm tra trên mỗi môi trường (Phụ lục 15.7).
Công hiệu
Tiến hành các thử nghiệm kiểm tra công hiệu theo Phụ lục 15.22; Phụ lục 15.23; Phụ lục 15.24.
Công hiệu vắc xin viêm gan tái tổ hợp được tiến hành song song giữa vắc xin mẫu thử với vắc xin mẫu chuẩn quốc gia; có thể được xác định bằng phương pháp thực nghiệm trên động vật thí nghiệm (công hiệu in vivo) để xác định hiệu giá kháng thể, hoặc phương pháp miễn dịch trong phòng thí nghiệm (công hiệu in vitro) để xác định hàm lượng kháng nguyên HBsAg có trong vắc xin.
Thử nghiệm công hiệu in vivo
Động vật thí nghiệm
Chuột nhắt trắng giống BALB/C hoặc ICR, khỏe mạnh và từ cùng một đàn, khoảng 5 tuần đến 6 tuần tuổi, tốt nhất là chuột cùng một giới.
Xác định công hiệu tương quan
Vắc xin mẫu chuẩn quốc gia và vắc xin mẫu thử được pha loãng bậc 2 thành 5 độ pha. Dung dịch để pha vắc xin là nước muối sinh lý có chứa nhôm hydroxyd (hàm lượng nhôm hydroxyd không quá 500 μg/ml). Tiêm màng bụng 1 ml mỗi độ pha loãng vắc xin cho mỗi chuột. Mỗi độ pha loãng vắc xin tiêm ít nhất 15 chuột. Tất cả các chuột sau khi gây miễn dịch được nuôi từ 28 đến 32 ngày trong điều kiện như nhau. Tiến hành gây mê và lấy máu tim chuột. Các mẫu máu được li tâm 3000 r/min ở nhiệt độ 4 °C đến 8 °C, tách huyết thanh. Các mẫu huyết thanh được bảo quản ở nhiệt độ âm 20 °C. Xác định hiệu giá kháng thể kháng HBsAg bằng thử nghiệm hấp phụ miễn dịch gắn men (ELISA) trên bộ sinh phẩm chẩn đoán thương mại có sẵn. Kết quả được tính theo chương trình Probit Analysis (WHO).
Thử nghiệm có giá trị khi:
ED50 của vắc xin mẫu chuẩn quốc gia và vắc xin mẫu thử đều nằm trong khoảng giữa liều tiêm lớn nhất và nhỏ nhất.
Phân tích thống kê cho thấy đạt yêu cầu về tuyến tính và song song.
Giới hạn độ tin cậy của công hiệu tương quan nằm trong khoảng 33 % đến 300 %.
Tiêu chuẩn công hiệu trên thực nghiệm
Công hiệu tương quan (P = 95 %) không nhỏ hơn 1.
Thử nghiệm công hiệu in vitro
Định lượng kháng nguyên HBsAg bằng kỹ thuật ELISA
Vật liệu:
Phiến 96 giếng.
Kit Hepanostika HBsAg Uni-Form II (Biomerieux).
Thuốc thử:
BSA (bovin serum albumin).
Kháng nguyên bề mặt virus HBV, cộng hợp.
Chuẩn bị dung dịch:
Dung dịch PBS: Pha như trong phần xác định hoạt tính miễn dịch Hib.
Dung dịch đệm (BSA 0,2%, PBS, Tween 20 0,05 %): Hòa tan 0,2 g BSA trong 100 ml dung dịch PBS, thêm 0,2 ml Tween 20. Bảo quản ở 4 °C. Dung dịch này chỉ pha khi dùng và bỏ phần còn thừa sau khi dùng xong.
Tiến hành:
Pha loãng chuẩn và mẫu để có OD trong khoảng từ 0,8 đến 1,2. Chuẩn bị lặp lại 3 lần riêng rẽ độ pha này của chuẩn và mẫu.
Làm 4 loạt độ pha 1:2.
Chuẩn bị lặp lại 3 lần chứng Maximum và chứng Minimum (Chú ý: Chứng Minimum còn được gọi là chứng âm và chính là đệm pha mẫu. Chứng Maximum là độ pha ban đầu cao hơn nồng độ của mẫu đối chiếu).
Để xác định hàm lượng HBsAg, làm theo quy trình đã hướng dẫn của bộ kit. Tất cả các dung dịch, chứng và thuốc thử, sinh vật phẩm dùng trong thử nghiệm đều phải tương thích với mẫu và phù hợp với kỹ thuật ELISA.
Tất cả các bước ủ phiến phải làm đúng theo mô tả trong quy trình
Bố trí phiến tùy thuộc kỹ thuật viên và cỡ mẫu nhưng nên dự kiến trước.
Phân tích kết quả: Bằng chương trình Parlin, dùng “Logarit” để chuyển đổi với P = 95 %.
Tiêu chuẩn chấp thuận của thử nghiệm: Thử nghiệm được coi là có giá trị khi phân tích thống kê thỏa mãn các tiêu chuẩn về tuyến tính song song, hồi quy và có khác biệt giữa các liều.
Nếu thử nghiệm không có giá trị, phải làm lại.
Tiêu chuẩn chấp thuận: Công hiệu tương quan (P = 95 %) không nhỏ hơn 0,65.
Polysacharid
Không lớn hơn 10 μg/100 μg protein (Phụ lục 15.38).
Sacharid tổng số
Xác định hàm lượng PRP tổng số bằng phương pháp orcinol (Phụ lục 15.42) hoặc phương pháp sắc ký lỏng.
Tiêu chuẩn chấp thuận: Hàm lượng PRP tổng số ít nhất phải đạt 80 % của hàm lượng ghi trên nhãn.
Sacharid tự do
Xác định hàm lượng sacharid (PRP) tự do bằng phương pháp orcinol (Phụ lục 15.42) hoặc sắc ký lỏng.
Tiêu chuẩn chấp thuận: Hàm lượng sacharid (PRP) tự do không được lớn hơn 25 % (≤ 25 %).
Xác định hoạt tính miễn dịch Hib (Như ở mục sản xuất kháng nguyên Hib)
Làm song song mẫu thử và mẫu chứng.
Gây nhiễm trên 5 thỏ mỗi mẫu với liều vắc xin 10 μg/ 0,5 ml.
Gây nhiễm ở ngày 0 và ngày 14, bằng đường tiêm dưới da màng bụng. Sau khi tiêm theo dõi trong vòng 28 ngày ở vùng cách ly bảo vệ.
Tiến hành lấy máu sau liều tiêm đầu tiên 21 ngày. Lấy máu riêng từng con vào ống nhựa 15 ml, không ít hơn 5 ml.
Định lượng kháng thể kháng Hib bằng phương pháp ELISA.
Tiêu chuẩn: ≥ 50 % chuyển đổi huyết thanh miễn dịch.
Tính độc đặc hiệu
Tính độc đặc hiệu của vắc xin DTPw - HeB - Hib được kiểm tra trên mẫu bán thành phẩm cuối cùng hay vắc xin thành phẩm khi cần thiết (Phụ lục 15.4).
Đối với thành phần bạch hầu và uốn ván
Chọn 5 chuột lang, có khối lượng 250 g/con đến 350 g/con, tiêm dưới da một lượng vắc xin tương đương với ít nhất 5 liều đơn cho người. Theo dõi chuột hàng ngày. Vắc xin đạt yêu cầu nếu không có chuột lang nào có dấu hiệu liệt uốn ván hoặc triệu chứng nhiễm độc bạch hầu và ít nhất 80 % chuột sống trong thời gian 6 tuần. Nếu có chuột chết phải mổ để kiểm tra phủ tạng về dấu hiệu nhiễm độc bạch hầu (tuyến thượng thận đỏ).
Đối với thành phần ho gà
Dùng ít nhất 20 chuột nhắt trắng, trọng lượng 14 g đến 16 g, cùng giới (nếu có cả 2 giới cần phân chia đều trong các nhóm) cho mỗi mẫu vắc xin thử và nhóm chứng. Mỗi chuột được tiêm vào ổ bụng 0,5 ml dung dịch chứa tối thiểu nửa liều đơn vắc xin cho người. Nhóm chứng được tiêm 0,5 ml nước muối sinh lý (tốt nhất chứa cùng hàm lượng chất bảo quản như có trong dung dịch tiêm cho nhóm thí nghiệm). Tổng khối lượng các nhóm chuột được xác định vào 72 h và 7 ngày sau tiêm. Vắc xin đạt yêu cầu nếu đạt cả 3 tiêu chuẩn sau:
Sau 72 h tổng khối lượng chuột không ít hơn trước tiêm.
Sau 7 ngày khối lượng trung bình mỗi chuột không ít hơn 60 % so với nhóm chứng.
Số chuột chết không quá 5 % tổng số chuột đã được tiêm.
KIỂM ĐỊNH VẮC XIN THÀNH PHẨM
Nhận dạng thành phần bạch hầu-uốn ván-ho gà
Thành phần bạch hầu-uốn ván-ho gà toàn tế bào trong vắc xin DTPw - HeB - Hib hấp phụ được tách gel bằng cách cho thêm natri citrat (C6H5O7Na3.2H2O) với nồng độ 5 % ủ ở 37 °C trong 48 h. Sau đó ly tâm 2000 r/min trong 15 min. Nước nổi được dùng để nhận dạng thành phần bạch hầu và uốn ván bằng phản ứng lên bông, cặn ly tâm dùng để nhận dạng thành phần ho gà có trong vắc xin bằng phản ứng ngưng kết trên phiến kính với các huyết thanh kháng ho gà đặc hiệu (Phụ lục 15.19).
Nhận dạng thành phần Hib (Như ở mục sản xuất kháng nguyên Hib)
Phương pháp: Phản ứng ngưng kết Latex hoặc một phản ứng hóa miễn dịch phù hợp.
Tiêu chuẩn: Dương tính với kháng huyết thanh đặc hiệu.
Nhận dạng HBsAg
Nhận dạng HBsAg bằng các thử nghiệm hóa miễn dịch phù hợp, như thử nghiệm miễn dịch phóng xạ (RIA), thử nghiệm hấp phụ miễn dịch gắn men (ELISA), thấm miễn dịch hoặc khuếch tán miễn dịch đơn. Vắc xin mẫu thử được so sánh với vắc xin mẫu chuẩn quốc tế hoặc vắc xin mẫu chuẩn quốc gia.
Vô khuẩn
Đạt yêu cầu vô khuẩn (Phụ lục 15.7).
An toàn chung
Thử nghiệm được tiến hành trên chuột nhắt trắng và chuột lang khỏe mạnh. Tiêm vào ổ bụng cho 5 chuột nhắt trắng có khối lượng 17 g/con đến 22 g/con, mỗi con một nửa liều tiêm cho người; tiêm vào ổ bụng 2 chuột lang có khối lượng 250 g đến 350 g; mỗi con một liều tiêm cho người nhưng không quá 1 ml/con.
Vắc xin được coi là không có độc tính bất thường nếu tất cả các động vật thí nghiệm sống khỏe mạnh và lên cân trong thời gian ít nhất 7 ngày thử nghiệm và không có dấu hiệu nhiễm độc.
Công hiệu
Tiến hành kiểm tra ở mẫu vắc xin DTPw - HeB - Hib thành phẩm khi chưa kiểm tra công hiệu trên vắc xin bán thành phẩm hoặc khi có chỉ định cần thiết (Phụ lục 15.22; 15.23; 15.24; 15.43).
Tính chất vật lý, hóa học
Cảm quan
Kiểm tra bằng mắt thường: huyền dịch vắc xin chia thành 2 lớp, phần dung dịch phía trên trong suốt không màu hoặc vàng nhạt; lớp lắng cặn dưới đáy lọ có màu trắng xám.
Nhanh chóng tạo huyền dịch đồng nhất sau khi lắc nhẹ, không lẫn chất lạ.
Tính chất vật lý
Thể tích vắc xin mỗi lọ: Giới hạn cho phép chênh lệch thể tích + 10% so với thể tích ghi trên nhãn.
Tỷ lệ loại bỏ:
Đối với vắc xin đa liều: không quá 3 %.
Đối với vắc xin liều đơn: không quá 5 %.
Không bị đông băng (tiêu chuẩn này chỉ kiểm tra sau khi bảo quản hay vận chuyển theo dây chuyền lạnh, không phải tiêu chuẩn xuất xưởng của nhà sản xuất): Lọ vắc xin mẫu thử phải có tốc độ lắng cặn chậm hơn nhiều so với lọ chứng dương và không có sự tạo hạt hay hình ảnh bông tuyết lơ lửng trong huyền dịch vắc xin hay kết thành cục sau khi lắc.
Chất bảo quản
Hàm lượng thimerosal cho phép là 0,005 % đến 0,02 % (Phụ lục 15.29).
Chất hấp phụ
Hàm lượng Al3+ trong vắc xin DTPw - HeB - Hib hấp phụ từ 0,55 mg/ml đến 0,77 mg/ml; Hàm lượng nhôm phosphat từ 2,5 mg/ml đến 3,5 mg/ml (Phụ lục 15.27).
pH
6,0 đến 7,0 (Phụ lục 15.33).
Formaldehyd tồn dư
Không được quá 0,02 % (Phụ lục 15.25).
Bảo quản và hạn dùng
Bảo quản ở nhiệt độ 2 °C đến 8 °C vắc xin có thể giữ công hiệu 2,5 năm.
Nhà sản xuất phải đưa ra khuyến cáo về điều kiện bảo quản và vận chuyển vắc xin DTPw - HeB - Hib hấp phụ để đảm bảo rằng vắc xin đạt công hiệu theo yêu cầu cho đến khi hết hạn sử dụng như đã đăng ký và ghi trên nhãn. Vắc xin DTPw - HeB - Hib hấp phụ phải được bảo quản sao cho không bị đông băng.
Hạn dùng của vắc xin phải được cơ quan kiểm định quốc gia chấp thuận và cố định, dựa vào các số liệu nghiên cứu tính ổn định của vắc xin và không được quá 2,5 năm tính từ cuối thử nghiệm kiểm tra công hiệu (tính từ ngày tiêm miễn dịch trên động vật thí nghiệm).
Đóng gói
Hộp 10 lọ tương đương 100 liều (mỗi lọ 5 ml chứa 10 liều).
Lọ được đóng kín bằng nút cao su, ngoài nút cao su được đậy kín bởi một nắp nhôm.
Nhãn
Những thông tin đối với nhãn, hộp, tờ hướng dẫn sử dụng phải đáp ứng những yêu cầu của quy định hiện hành.
VẮC XIN HAEMOPHILUS INFLUENZAE TYP B CỘNG HỢP
Vaccinum haemophili stirpi b coniugatum
Vắc xin HaemophiIus influenzae typ b (Hib) cộng hợp là một chế phẩm được tinh chế từ vỏ polysacharid của vi khuẩn H. influenzae typ b, liên kết cộng hóa trị với protein mang (carrier protein).
Vỏ polysacharid của Hib là một chuỗi polyme mạch thẳng gồm các đơn vị lặp lại của 3-β-D-ribofuranosyl (1à1)-D-ribitol-5-phosphat (PRP).
Protein mang là giải độc tố bạch hầu hoặc giải độc tố uốn ván hoặc độc tố bạch hầu của chủng đột biến đã mất tính độc (CRM197), hoặc phức hợp protein màng ngoài của vi khuẩn Neisseria meningitidis nhóm B.
SẢN XUẤT
Chủng sản xuất
Chủng H. influenzae typ b dùng để sản xuất vắc xin H. influenzae typ b cộng hợp phải được cơ quan Kiểm định quốc gia chấp thuận. Chủng sản xuất phải có vỏ polysacharid đặc hiệu và sản sinh với sản lượng ổn định trong quá trình sản xuất, có đáp ứng miễn dịch và an toàn khi sử dụng cho người.
Chỉ có những chủng đạt các đặc tính như sau mới có thể xem xét để sản xuất vắc xin: trong môi trường nuôi cấy thích hợp phải có hình dạng đặc trưng của H. influenzae: trực khuẩn nhỏ, hiếu khí, Gram âm, không di động, không sinh nha bào, không làm tan máu, lên men đường glucose, không lên men đường lactose, sucrose, manose và phản ứng dương tính với catalase và indole.
Hệ thống chủng
Chủng gốc phải có hồ sơ chi tiết bao gồm nguồn gốc, các đặc tính sinh lý, sinh hóa, huyết thanh học và di truyền của chủng. Các nuôi cấy từ chủng sản xuất phải có cùng đặc tính như nuôi cấy từ chủng gốc và phải đạt các tiêu chuẩn như chủng gốc.
Nuôi cấy và mẻ gặt đơn
Sự phát triển của chủng H. influenzae typ b phải có tính ổn định bằng cách giám sát mật độ phát triển của vi khuẩn, pH của môi trường nuôi cấy và sản lượng polysacharid. H. influenzae typ b được nuôi cấy trên môi trường lỏng không chứa các polysacharid có phân tử lượng cao; nếu trong môi trường nuôi cấy chứa bất kỳ sản phẩm nào của máu thì phải chứng minh rằng chúng đã được loại bỏ sau khi tinh chế.
Sự thuần khiết của vi khuẩn trước khi bất hoạt phải được kiểm tra theo phương pháp thích hợp, bao gồm nuôi cấy trên môi trường thạch đĩa phù hợp để kiểm tra đặc điểm hình thái, nhuộm Gram và ngưng kết với kháng huyết thanh đặc hiệu.
Polysacharid tinh chế
Canh trùng nuôi cấy được bất hoạt. PRP được tách ra từ canh trùng nuôi cấy và tinh chế bằng phương pháp thích hợp. Mỗi lô polysacharid đã tinh chế phải được kiểm tra độ thuần khiết. Polysacharid tinh chế phải đạt các chỉ tiêu dưới đây mới được sử dụng để pha chế bán thành phẩm cộng hợp.
Nhận dạng:
Dùng phương pháp huyết thanh học hoặc quang phổ cộng hưởng từ 1H (hoặc 13C); có mặt PRP.
Kích thước phân tử:
Sử dụng phương pháp sắc ký lọc trên gel để xác định sự phân bố theo kích thước phân tử polysacharid. Hệ số phân bố K0 được xác định bằng cách dựa vào các pic chính của polysacharid trên sắc ký đồ theo tiêu chuẩn của nhà sản xuất đã đăng ký và được phê duyệt đối với từng loại vắc xin Hib cộng hợp.
Sắc ký lỏng cũng được sử dụng để xác định sự phân bố theo kích thước phân tử polysacharid.
Độ ẩm: Phương pháp áp dụng phải được cơ quan Kiểm định quốc gia chấp thuận và phải chỉ ra được tính ổn định nằm trong giới hạn chấp thuận theo tiêu chuẩn của nhà sản xuất đối với từng loại vắc xin Hib cộng hợp.
Thành phần polysacharid:
Được tiến hành theo phương pháp đã được phê chuẩn. Hàm lượng polysacharid được tính thông qua hàm lượng đường ribose (sử dụng phương pháp Bial). Hàm lượng đường ribose không ít hơn 32,0 % so với khối lượng polysacharid khô kiệt.
Hàm lượng phosphor:
Sử dụng phương pháp Chen hoặc phương pháp khác đã được thẩm định. Hàm lượng phosphor phải từ 6,8 % đến 9,0 % so với khối lượng polysacharid khô kiệt.
Protein tạp:
Không quá 1,0 % so với khối lượng polysacharid khô kiệt (xác định bằng phương pháp Lowry).
Acid nucleic:
Không quá 1,0 % so với khối lượng polysacharid khô kiệt, được xác định bằng cách đo độ hấp thụ của acid nucleic ở bước sóng 260 nm hoặc phương pháp khác đã được thẩm định.
Nội độc tố vi khuẩn:
Không quá 10,0 IU/μg polysacharid (Phụ lục 13.2).
Protein mang
Protein mang được sử dụng để tăng khả năng đáp ứng miễn dịch ở tế bào B và T. Chủng sản xuất protein mang (cộng hợp) phải có hồ sơ chủng bao gồm nguồn gốc chủng, các đặc tính sinh lý, sinh hóa. Sự phát triển của chủng phải cho thấy có tính ổn định bằng cách giám sát tỷ lệ mọc của vi khuẩn, pH của môi trường nuôi cấy và sản lượng.
Protein mang được sản xuất trên chủng vi khuẩn phù hợp, độ tinh khiết của canh trùng nuôi cấy phải được kiểm tra, canh trùng nuôi cấy được bất hoạt và được tinh chế bằng phương pháp thích hợp.
Chỉ protein mang đạt các chỉ tiêu dưới đây mới được sử dụng để pha chế bán thành phẩm cộng hợp:
Giải độc tố bạch hầu và uốn ván: Hàm lượng không nhỏ hơn 1500 Lf/mg protein.
CRM197: Hàm lượng protein thuần khiết không nhỏ hơn 90,0 %.
Phức hợp protein màng ngoài của Neisseria meningitidis nhóm B đáp ứng yêu cầu:
Protein: Không nhiều hơn 8,0 % khối lượng lipopolysacharid.
Chất gây sốt: Đạt yêu cầu về chất gây sốt (Phụ lục 15.12). Tiêm tĩnh mạch tai thỏ với hàm lượng 0,25 μg/kg khối lượng thỏ
BÁN THÀNH PHẨM CỘNG HỢP
Bán thành phẩm cộng hợp chỉ được phép pha chế thành bán thành phẩm cuối cùng khi đạt các yêu cầu dưới đây:
Hóa chất tồn dư.
Quy trình tinh chế sản phẩm cộng hợp cần phải loại bỏ hóa chất tồn dư, ví dụ: sản phẩm trung gian cyanid cần được tiến hành theo phương pháp thích hợp đã được thẩm định, đạt theo tiêu chuẩn của nhà sản xuất đối với từng loại vắc xin Hib cộng hợp.
Chất đánh dấu cộng hợp:
Xác định bằng số đơn vị lặp lại PRP hoặc hàm lượng PRP tổng số, đạt theo tiêu chuẩn của nhà sản xuất đối với từng loại vắc xin Hib cộng hợp.
Các nhóm chức hoạt hóa tồn dư:
Tiến hành theo phương pháp thích hợp đã được thẩm định, đạt theo tiêu chuẩn của nhà sản xuất đối với từng loại vắc xin Hib cộng hợp.
Hàm lượng PRP:
Tiến hành theo phương pháp thích hợp đã được thẩm định, đạt theo tiêu chuẩn của nhà sản xuất đối với từng loại vắc xin Hib cộng hợp.
Hàm lượng PRP đã cộng hợp và PRP tự do:
Hàm lượng PRP tự do nhỏ hơn 40,0 %, tùy thuộc vào từng loại vắc xin Hib cộng hợp.
Hàm lượng protein:
Tiến hành theo phương pháp thích hợp đã được thẩm định.
Tỉ lệ protein và PRP:
Nằm trong giới hạn chấp thuận của của nhà sản xuất đối với từng loại vắc xin Hib cộng hợp.
Kích thước phân tử:
Tiến hành theo phương pháp thích hợp đã được thẩm định, ví dụ như lọc gel sepharose CL-4B, đạt theo tiêu chuẩn của nhà sản xuất đối với từng loại vắc xin Hib cộng hợp.
Vô khuẩn:
Đạt yêu cầu vô khuẩn (Phụ lục 15.7).
Độc tính đặc hiệu của protein mang trong sản phẩm cộng hợp: Bán thành phẩm cộng hợp không có độc tính đặc hiệu của protein mang (nếu protein mang là giải độc tố uốn ván hoặc giải độc tố bạch hầu).
KIỂM ĐỊNH BÁN THÀNH PHẨM CUỐI CÙNG
Tá dược, chất bảo quản hoặc chất ổn định được bổ sung với một lượng thích hợp bán thành phẩm cộng hợp để được bán thành phẩm cuối cùng. Bán thành phẩm cuối cùng chỉ được phép pha chế thành thành phẩm khi đạt yêu cầu sau:
Vô khuẩn:
Đạt yêu cầu vô khuẩn (Phụ lục 15.7).
KIỂM ĐỊNH VẮC XIN THÀNH PHẨM
Chỉ vắc xin thành phẩm đạt các yêu cầu dưới đây mới được phép xuất xưởng.
Nhận dạng:
Dùng phương pháp miễn dịch học thích hợp, sử dụng kháng thể đặc hiệu kháng polysacharid tinh khiết (khuếch tán miễn dịch kép Ouchterlony hoặc ELISA,...), cho phản ứng đặc hiệu.
Vô khuẩn:
Đạt yêu cầu vô khuẩn (Phụ lục 15.7).
Hàm lượng PRP:
Trong khoảng ± 20,0 % hàm lượng PRP ghi trên nhãn. Sử dụng phương pháp so màu hoặc phương pháp sắc ký lỏng.
Độ ẩm tồn dư:
Không được quá 3,0 % (Phụ lục 15.35).
Chất gây sốt:
Đạt yêu cầu về chất gây sốt. Tiêm tĩnh mạch tai thỏ với hàm lượng 0,025 μg đến 1,0 μg PRP/kg khối lượng thỏ (Phụ lục 15.12).
Tá chất:
Nhôm: Không quá 1,25 mg tính trên 1 liều đơn dùng cho người (Phụ lục 15.27).
Calci: Không quá 1,3 mg tính trên 1 liều đơn dùng cho người. Tiến hành theo phương pháp thích hợp đã được thẩm định.
Hàm lượng chất bảo quản:
Tiến hành theo phương pháp thích hợp đã được thẩm định, tiêu chuẩn phải được cơ quan Kiểm định quốc gia chấp thuận.
An toàn không đặc hiệu:
Vắc xin đạt yêu cầu về an toàn không đặc hiệu khi tất cả các chuột thử nghiệm sống sót và tăng cân sau 7 ngày theo dõi (Phụ lục 15.11).
pH:
Đối với vắc xin là chế phẩm dạng lỏng: Giá trị pH nằm trong khoảng đã cho thấy là an toàn và hiệu quả trong thử nghiệm lâm sàng và nghiên cứu tính ổn định (Phụ lục 15.33).
Đối với vắc xin là chế phẩm đông khô: Tiến hành đo pH sau khi hoàn nguyên với dung dịch thích hợp.
Cảm quan:
Quan sát bằng mắt thường, vắc xin không có dấu hiệu bất thường như: lỏng nút, nắp, hàn không đạt yêu cầu, nứt, vỡ, có vật thể lạ...
Đóng gói
Phải tuân thủ theo các quy định hiện hành.
Nhãn, hộp
Những thông tin ghi trên nhãn, hộp, tờ hướng dẫn sử dụng phải đáp ứng những yêu cầu của các quy định hiện hành và đặc biệt phải ghi đủ các thông tin về hàm lượng PRP; tên và hàm lượng của protein mang của 1 liều sử dụng cho người.
Bảo quản
Nhiệt độ bảo quản từ 2 °C đến 8 °C.
Hạn sử dụng
Các công bố về hạn sử dụng, nhiệt độ bảo quản sẽ phải dựa trên kết quả nghiên cứu về tính ổn định của vắc xin và phải được cơ quan kiểm định quốc gia phê chuẩn.
VẮC XIN CÚM (BẤT HOẠT)
Vaccinum influenzae inactivatum
Vắc xin cúm bất hoạt là một hỗn dịch trong suốt, vô khuẩn chứa một hoặc nhiều chủng virus cúm, typ A hoặc B hoặc hỗn hợp cả hai, đã được bất hoạt bằng các phương pháp phù hợp.
Vắc xin cúm có thể ở 4 dạng:
- Là hỗn dịch các hạt virus hoàn chỉnh được bất hoạt theo phương pháp thích hợp.
- Là hỗn dịch đã được xử lý bằng phương pháp hoá lý sao cho các hạt virus được phân rã hoàn toàn hoặc một phần.
- Là hỗn dịch đã được xử lý sao cho chỉ còn chứa phần lớn các kháng nguyên haemaggIutinin (HA) và neuraminidase (vắc xin tiểu đơn vị).
- Là hỗn dịch của các hạt virus cúm bất hoạt, các hạt virus đã phân rã hoặc các thành phần tiểu đơn vị với tá chất.
Sản phẩm phải đáp ứng các yêu cầu dưới đây:
SẢN XUẤT
Chủng sản xuất
Theo khuyến cáo hàng năm của Tổ chức y tế thế giới và phê chuẩn của cơ quan kiểm định quốc gia. Hiện nay, người ta thường sử dụng những chủng cho sản lượng cao đối với kháng nguyên bề mặt. Nguồn gốc chủng virus và lịch sử cấy chuyển chủng virus phải do cơ quan kiểm định quốc gia phê chuẩn.
Trứng cho sản xuất
Nếu vắc xin được sản xuất trên trứng có phôi thì trứng phải được chọn từ những đàn gà khỏe mạnh, không có bệnh lý và được giám sát bằng các phương pháp do các cơ quan có thẩm quyền về sức khỏe động vật phê chuẩn.
Tế bào sản xuất
Dòng tế bào dùng cho sản xuất vắc xin cúm phải dựa trên hệ thống ngân hàng tế bào phù hợp và được phép dùng cho việc sản xuất các chế phẩm sinh học dùng cho người. Cơ quan kiểm định quốc gia phải phê chuẩn ngân hàng tế bào gốc và thiết lập số lượng tối đa số đời cấy chuyển.
Môi trường nuôi cấy tế bào
Huyết thanh sử dụng cho nuôi cấy tế bào phải không nhiễm vi khuẩn, nấm, Mycoplasma và các virus khác. Penicillin và các beta-lactam khác không được sử dụng trong bất cứ giai đoạn sản xuất nào.
Các kháng sinh khác có thể được sử dụng nhưng phải được cơ quan kiểm định quốc gia chấp thuận.
Các mẻ gặt đơn
Đối với vắc xin sản xuất trên trứng, virus của mỗi chủng phải được phát triển trên khoang niệu của trứng gà có phôi khỏe mạnh. Sau khi ủ ở nhiệt độ thích hợp, tiến hành gặt dịch niệu. Đối với vắc xin sản xuất từ tế bào động vật có vú, virus của mỗi chủng phải được phát triển trên những dòng tế bào đã được phê chuẩn cho sản xuất vắc xin.
Các mẻ gặt đơn của cùng một chủng virus được trộn lại để tạo thành mẻ hỗn dịch virus đơn giá. Hỗn dịch virus đơn giá từ tế bào không được trộn lẫn với hỗn dịch virus đơn giá từ trứng.
Độ tinh khiết của vắc xin sản xuất từ tế bào
Để theo dõi sự ổn định về độ tinh khiết, các mẻ hỗn dịch đơn giá thu hoạch từ tế bào động vật có vú phải được kiểm tra tỷ lệ giữa hàm lượng HA và protein toàn phần. Tỷ lệ này phải nằm trong giới hạn do cơ quan kiểm định quốc gia phê chuẩn.
Đối với virus phát triển trên tế bào thường trực, mẻ trộn đơn giá phải được kiểm tra ADN tồn dư. Hàm lượng ADN phải nhỏ hơn 10 ng/liều ở người.
Thử nghiệm này có thể bỏ qua với sự phê chuẩn của cơ quan kiểm định quốc gia nếu quá trình sản xuất đã được thẩm định là đạt và duy trì được tiêu chuẩn này.
KIỂM ĐỊNH VẮC XIN BÁN THÀNH PHẨM CUỐI CÙNG
Bán thành phẩm được sản xuất bằng cách trộn và pha loãng mẻ hỗn dịch đơn giá của mỗi chủng virus. Chỉ những chất bảo quản, tá chất hoặc dung dịch được cơ quan kiểm định quốc gia phê chuẩn mới được cho vào bán thành phẩm. Những chất này phải đảm bảo không ảnh hưởng đến tính an toàn và hiệu lực của sản phẩm.
Vắc xin sản xuất cho đại dịch chỉ nên chứa 1 chủng virus.
Công hiệu
Thử nghiệm này có thể bỏ qua nếu đã được tiến hành trên mỗi lô thành phẩm cuối cùng.
Nhận dạng và xác định hàm lượng kháng nguyên HA trong vắc xin cúm bằng kỹ thuật khuếch tán miễn dịch đơn (SRD, SRID).
Nguyên lý:
Kháng nguyên cúm khuếch tán trong thạch chứa kháng thể tương ứng, ở vùng có nồng độ kháng nguyên-kháng thể phù hợp, hình thành vòng kết tủa. Độ lớn của vòng này tỷ lệ thuận với hàm lượng kháng nguyên. Căn cứ vào độ lớn của vòng kháng nguyên chuẩn được làm đồng thời, tính ra nồng độ kháng nguyên mẫu thử.
Mẫu thử nghiệm và kháng nguyên chuẩn được xử lý bằng dung dịch tẩy thích hợp, sau đó được pha loãng với PBS ở những độ pha thích hợp. Lượng mẫu và kháng nguyên chuẩn được thêm vào các giếng của tấm thạch đã chứa một lượng kháng thể thích hợp. Giữ tấm thạch này trong tủ mát ở nhiệt độ 20 °C ít nhất 18 h. Kháng nguyên khuếch tán ra xung quanh và kết hợp với kháng thể, tạo nên vùng kết tủa hình tròn. Nhuộm và đo đường kính của các vòng tròn này, so sánh với vòng do kháng nguyên chuẩn tạo ra để tính kết quả.
Tiến hành:
Chuẩn bị khuôn thạch SRD: Một khuôn thạch sẽ sử dụng 13 ml thạch. Làm tan chảy đủ lượng thạch bằng lò vi sóng. Sau đó để ở 60 °C trong 15 min.
Chuẩn bị tấm kính thủy tinh, viết mã hoá lên góc trái của tấm kính. Lau bề mặt kính bằng thạch nóng chảy. Đặt khuôn lên trên tấm kính. Hàn kín cạnh bên trong khuôn thạch bằng thạch nóng chảy và để trong 5 min.
Cho một lượng kháng thể chuẩn nhất định vào thạch ở trên rồi đổ vào khuôn.
Để ở nhiệt độ phòng 30 min, sau đó tiến hành đục lỗ (đường kính 4 mm).
Chuẩn bị kháng nguyên:
Kháng nguyên chuẩn đông khô được hồi chỉnh với 1 ml nước cất và để trong 5 min trước khi sử dụng. Pha loãng kháng nguyên chuẩn với PBS (-) để đạt nồng độ cuối cùng 30 μg HA/ml theo hướng dẫn sử dụng.
Trộn lẫn 450 μl kháng nguyên chuẩn và vắc xin thử với 50 μl Zwittergent 10 % và để trong hộp ẩm trong 30 min ở nhiệt độ phòng.
Ví dụ, có thể pha loãng các độ pha bằng PBS (-) theo Bảng 1 dưới đây:
Bảng 1: Các độ pha loãng bằng PBS (-)
| Nồng độ pha loãng | Thể tích (μl) | |
| Kháng nguyên đã xử lý bằng Zwittergent | PBS (-) | |
| 1.0 | 200 | 0 |
| 0,75 | 150 | 50 |
| 0,5 | 100 | 100 |
| 0,25 | 50 | 150 |
Kháng nguyên thử nghiệm và điều kiện ủ:
Nhỏ 20 μl mỗi nồng độ kháng nguyên vào các giếng tương ứng.
Đặt các tấm kính trong hộp làm ẩm và ủ trong tủ ở nhiệt độ 20 °C ít nhất là 18 h.
Xử lý tấm kính:
Rửa tấm thạch (gel) dưới vòi nước, đặt các tấm giấy lọc cẩn thận trên bề mặt gel để loại bỏ tất cả các bọt.
Ép các gel này trong 30 min bằng tấm kính có khối lượng 600 g.
Làm khô gel trong tủ ấm 37 °C.
Nhuộm gel bằng dung dịch coomasie blue.
Tẩy màu gel bằng dung dịch tẩy màu và làm khô.
Đo đường kính vòng tròn khuếch tán theo hai hướng vuông góc nhau và tính kết quả bằng phần mềm Paranell chuyên dụng (“Bioassay Assit” hoặc phần mềm EDQM Combistats...). Trước hết, phải đánh giá thử nghiệm SRD phải có giá trị hay không dựa vào phân tích thống kê. Nếu thử nghiệm có giá trị thì hàm lượng HA của vắc xin được tính toán bằng cách so sánh số liệu với kháng nguyên mẫu chuẩn.
Đánh giá kết quả: Công hiệu của mỗi loại virus trong mẫu thử nghiệm không được thấp hơn 15 μg HA/liều
Điều kiện để thí nghiệm có giá trị tin cậy:
- Vòng kết tủa đều và rõ.
- Đường kính vòng tròn kết tủa trong khoảng từ 5,0 mm đến 14 mm nếu đo bằng thước đo với mắt thường.
- Khoảng dao động từ 80 % đến 120 %.
Vô khuẩn
Đạt yêu cầu vô khuẩn (Phụ lục 15.7).
Nếu chất bảo quản được thêm vào vắc xin, phải tiến hành bằng phương pháp thích hợp để ngăn chặn sự gây nhiễu đối với thử nghiệm vô khuẩn.
Hàm lượng protein toàn phần
Hàm lượng protein toàn phần phải không vượt quá 6 lần tổng hàm lượng HA của các chủng virus trong vắc xin. Tuy nhiên, trong bất cứ trường hợp nào cũng không được vượt quá 100 μg protein/1 chủng virus/1 liều đơn ở người và không nhiều hơn 300 μg protein/ tổng số chủng virus/1 liều đơn ở người (Phụ lục 15.34)
Ovalbumin
Hàm lượng ovalbumin phải không vượt quá 1 μg/ liều ở người.
Hàm lượng ovalbumin phải được xác định bằng phương pháp thích hợp. Có thể định lượng ovalbumin dựa trên nguyên tắc của ELISA “cặp chả”. Kháng thể đơn dòng kháng ovalbumin được cố định trên phiến, mẫu thử và cộng hợp được ủ trên phiến trong cùng một thời gian. Phản ứng hiện màu khi thêm cơ chất có chứa TMB và H2O2. Dừng phản ứng khi thêm acid sulfuric.
Đọc phản ứng trên máy đo màu.
Chế phẩm chuẩn: Bộ kít Ovalbumin (Serazym)
Mẫu thử: Vắc xin cúm 2 ml/mẫu.
Tiến hành:
Bộ kít Serazym Ovalbumin ELISA sử dụng được trong vòng 2 tháng sau khi mở, bảo quản ở 4 °C đến 8 °C. Để bộ kít ở nhiệt độ phòng trước khi sử dụng.
Pha loãng mẫu sao cho lượng ovalbumin nằm từ 1 đến 20 ng/ml.
Cho 200 μl chất chuẩn, mẫu thử pha loãng vào mỗi giếng.
Cho 100 μl cộng hợp HRT vào mỗi giếng, trộn đều.
Ủ ở nhiệt độ phòng 60 min.
Loại bỏ hết dung dịch trong các giếng.
Cho 300 μl dung dịch rửa vào tất cả các giếng, để 5 giây rồi đổ hết dung dịch trong giếng, thực hiện lặp lại bước này 4 lần.
Cho 100 μl cơ chất vào tất cả các giếng, để ở nhiệt độ phòng 15 min.
Cho 100 μl dung dịch dừng phản ứng vào tất cả các giếng và đọc kết quả bằng máy ELISA ở bước sóng 450 nm.
Tính kết quả bằng phần mềm “Calculation ovalbumin”.
Điều kiện để phản ứng có ý nghĩa:
Mẫu chuẩn 1 (20 ng/ml) có OD ≥ 1,50.
Mẫu chuẩn 6 (0,625 ng/ml) có OD ≤ 0,50.
Mẫu chuẩn có hệ số tương quan không được nhỏ hơn 0,99 ( ≥ 0,99).
Giới hạn phương pháp: Nồng độ ovalbumin trong khoảng từ 5,0 đến 10,0 ng/ml.
Giá trị OD của mẫu pha loãng nên nằm trong giới hạn của mẫu chuẩn (từ 0,625 ng/ml đến 20 ng/ml).
CV của tất cả các mẫu pha loãng không được quá 15 % (≤ 15 %).
Hàm lượng tá chất
Nếu một tá chất được thêm vào vắc xin thì hàm lượng của nó phải được xác định bằng phương pháp do cơ quan kiểm định quốc gia phê chuẩn. Hàm lượng tá chất phải vừa đủ để đảm bảo hiệu lực lâm sàng cao nhất của sản phẩm. Công thức tá chất và kháng nguyên phải hằng định và ổn định trong suốt quá trình sản xuất.
KIỂM ĐỊNH VẮC XIN THÀNH PHẨM
Nhận dạng
Kiểm tra nhận dạng được thực hiện trên ít nhất 1 lọ thành phẩm từ mỗi lô thành phẩm cuối cùng bằng phương pháp thích hợp do cơ quan kiểm định quốc gia phê chuẩn. Dùng kỹ thuật khuếch tán miễn dịch đơn (SRD, SRID) như sau:
Nguyên lý: Một lượng mẫu thử nhất định (kháng nguyên) được thêm vào các giếng của tấm thạch SRD (đã có một lượng kháng thể cúm phù hợp). Sự hình thành vòng tròn khuếch tán đặc hiệu trong thạch cho phép nhận dạng kháng nguyên cúm tương ứng.
Tiến hành: Giống như thử nghiệm SRD được trình bày tại phần Công hiệu của mục Kiểm định vắc xin bán thành phẩm.
Đánh giá kết quả:
- Vắc xin đạt yêu cầu nhận dạng nếu kết quả thử nghiệm có vòng tròn kết tủa.
- Nếu lần thử nghiệm thứ nhất không đạt, phải làm lại lần thứ hai.
- Nếu lần thử nghiệm thứ 2 vẫn không thấy vòng tròn khuếch tán thì loạt vắc xin không đạt yêu cầu.
Nhận dạng kháng nguyên ngưng kết hồng cầu trong vắc xin được xác định bằng phương pháp miễn dịch như khuếch tán miễn dịch, ức chế kháng nguyên, hoặc sử dụng huyết thanh miễn dịch đặc hiệu tương ứng.
Công hiệu
Hàm lượng kháng nguyên HA được xác định theo kỹ thuật khuếch tán miễn dịch đơn như đã trình bày ở mục Kiểm định bán thành phẩm cuối cùng.
Tiêu chuẩn chấp thuận: Vắc xin nên chứa ít nhất 15 μg HA/ liều/ mỗi chủng sản xuất.
Đối với vắc xin đại dịch, có thể chứa những hàm lượng HA khác do tổ chức y tế thế giới khuyến cáo.
An toàn chung
Theo Phụ lục 15.11.
Vắc xin cúm với 1 liều tiêm cho người vào ổ bụng cho mỗi con trong số 5 chuột nhắt trắng khỏe mạnh, khối lượng 17 g/con đến 22 g/con và chưa sử dụng cho bất cứ mục đích gì trước đó; tiêm 10 liều tiêm cho người vào ổ bụng cho mỗi trong số 2 chuột lang khỏe mạnh, khối lượng 250 g/con đến 350 g/con và chưa sử dụng cho bất cứ mục đích gì trước đó.
Vắc xin đạt tính an toàn chung, không có độc tính bất thường nếu toàn bộ chuột thử nghiệm đều khỏe mạnh, lên cân và không có biểu hiện nhiễm độc trong 7 ngày theo dõi liên tục.
Vô khuẩn
Đạt yêu cầu về vô khuẩn (Phụ lục 15.7).
Protein toàn phần
Hàm lượng protein toàn phần phải không vượt quá 6 lần tổng hàm lượng HA của các chủng virus trong vắc xin. Tuy nhiên trong bất cứ trường hợp nào cũng không được vượt quá 100 μg protein/1 chủng virus/1 liều ở người và không nhiều hơn tổng số 300 μg protein/tất cả các chủng virus/1 liều ở người (Phụ lục 15.34).
Nội độc tố vi khuẩn
Không được quá 100 IU/liều ở người.
Hàm lượng nội độc tố phải được xác định bằng phương pháp thích hợp (Phụ lục 13.2).
Hàm lượng nội độc tố ở vắc-xin sản xuất từ tế bào cho phép thấp hơn sản xuất từ trứng.
Yêu cầu
Độ nhạy của chứng dương nằm trong khoảng từ 1/2 đến gấp đôi, thử nghiệm có giá trị.
Nếu độ nhạy của lysate ghi trên nhãn là 0,125 EU/ml thì độ nhạy thực tế của thí nghiệm có thể từ 0,06 đến 0,25 EU/ml.
Nếu hiện tượng đông gel của lysate không rõ ràng, phải làm lại thử nghiệm.
Fonmaldehyd
Không được quá 0,2 g/L (Phụ lục 15.25).
Chất bảo quản
Xác định hàm lượng chất bảo quản bằng phương pháp hoá học thích hợp. Hàm lượng chất bảo quản trong vắc xin không thấp hơn hàm lượng tối thiểu có hiệu lực và không lớn hơn 115 % hàm lượng ghi trên nhãn (Phụ lục 15.29).
Cảm quan
Mỗi loạt vắc xin thành phẩm sau khi sản xuất phải được kiểm tra bằng cảm quan để đảm bảo các lọ hay ống vắc xin trước khi xuất xưởng đều phải đạt yêu cầu, không có dấu hiệu bất thường như: có vật lạ trong lọ vắc xin, nắp hay nút không chặt và/hoặc không đảm bảo tính nguyên vẹn. Trong quá trình kiểm tra, nếu ống hay lọ vắc xin nào không đạt yêu cầu phải được loại bỏ.
Nhãn
Những thông tin đối với nhãn, hộp, tờ hướng dẫn sử dụng phải đáp ứng theo các yêu cầu của quy định hiện hành. Cụ thể như sau:
Vắc xin được sản xuất từ virus phát triển trên phôi trứng gà hay tế bào động vật có vú;
Chủng virus cúm dùng để sản xuất.
Hàm lượng HA tính theo μg/chủng virus/ liều ở người;
Tên và hàm lượng tối đa của bất cứ kháng sinh nào có mặt trong vắc xin;
Nhiệt độ khuyến cáo cho quá trình bảo quản và vận chuyển vắc xin;
Hạn sử dụng;
Đối với vắc xin đại dịch: chỉ rõ các liều đặc biệt (Ví dụ: 2 liều).
Đóng gói và bảo quản
Vắc xin cúm bất hoạt được đóng trong lọ thủy tinh trung tính 0,5 ml/lọ hoặc 0,25 ml/lọ và phải được bảo quản ở nhiệt độ từ 2 °C đến 8 °C.
Nếu sử dụng trong điều kiện bảo quản khác thì điều kiện bảo quản này phải được thẩm định đầy đủ và được phê chuẩn bởi cơ quan kiểm định quốc gia.
Hạn sử dụng
Hạn sử dụng phải được phê chuẩn bởi Cơ quan kiểm định quốc gia. Nói chung hạn sử dụng không vượt quá 1 năm tính từ ngày sản xuất, bởi vì các chủng virus có thể không phù hợp cho năm sau.
Chỉ định, liều dùng
Tiêm dưới da. Thường là vùng cơ delta.
Liều tiêm: từ 6 tháng đến 35 tháng tuổi tiêm 0,25 ml/liều; trên 36 tháng tuổi tiêm 0,5 ml/liều.
VẮC XIN PHÒNG PAPILLOMAVIRUS Ở NGƯỜI (TÁI TỔ HỢP)
Vaccinum papillomaviri humani (ADNr)
Vắc xin phòng Papillomavirus ở người (HPV) là loại vắc xin được sản xuất từ các hạt giống như virus (virus-like particles, VLPs,) nhưng không gây nhiễm; có độ tinh khiết cao, chứa protein capsit chính (L1) của 1 hoặc nhiều typ HPV.
Các kháng nguyên HPV được điều chế theo công nghệ tái tổ hợp DNA. Tùy theo nhà sản xuất, VLPs tinh khiết có thể được hấp phụ vào tá chất dạng phối hợp nhôm hydroxyd và 3-0-desacyl-4-monophosphoryl lipid A (MPL) hoặc nhôm hydroxyphosphat sulfat.
SẢN XUẤT
Vắc xin HPV được sản xuất bằng cách đưa gen mã hóa protein capsid của virus vào tế bào nấm men hoặc tế bào côn trùng/hệ thống vector biểu hiện Baculovirus rồi thu và tinh chế VLPs. Việc sản xuất vắc xin HPV dựa vào hệ thống ngân hàng tế bào và chủng giống gốc.
Vắc xin mẫu chuẩn: Vắc xin HPV chuẩn được lấy từ 1 lô vắc xin hoặc 1 trong các lô vắc xin đã được nghiên cứu lâm sàng và được khẳng định là có hiệu quả bảo vệ. Vắc xin mẫu chuẩn cần phải đạt yêu cầu về tính ổn định.
Đánh giá đặc tính VLPs
Đặc tính của VLPs phải được đánh giá ngay trong quá trình sản xuất vắc xin. Các kỹ thuật thường dùng để đánh giá đặc tính của VLPs bao gồm xác định thành phần protein là kỹ thuật SDS-PAGE (Sodium Dodecyl Sulphate Polyacrylamide Gel Electrophoresis), Western Blot, hấp phụ khối, phân tích trình tự amino acid. Hình thái và mức độ kết tập của các VLPs cũng được xác định để khẳng định các epitop có mặt trong vắc xin và là yếu tố cần thiết tạo hiệu quả cho vắc xin. Bên cạnh đó, các thành phần protein, lipid, acid nucleic và carbohydrat cũng cần được xác định trong quá trình sản xuất vắc xin.
Ngân hàng tế bào và chủng giống gốc
Sản xuất vắc xin trên tế bào nấm men:
Việc sử dụng bất kỳ dòng tế bào nào đều phải dựa vào hệ thống ngân hàng tế bào. Ngân hàng tế bào gốc và ngân hàng tế bào sản xuất phải đạt các yêu cầu về nhận dạng, độ tinh khiết, khả năng mọc và tính ổn định mới được đưa vào sản xuất. Đối với tế bào gốc và tế bào sản xuất, cần được đánh giá về tính đồng nhất gen. Đặc tính của tế bào chủ và vector biểu hiện cần được mô tả rõ. Các phương pháp vật lý được sử dụng trong quá trình sản xuất nhằm kích thích và kiểm soát sự biểu hiện của gen từ tế bào vật chủ.
Các đặc tính của chủng sản xuất tái tổ hợp (tế bào vật chủ phối hợp với hệ thống vector biểu hiện) phải được mô tả đầy đủ, chứng minh không có các yếu tố tự sinh và thông tin về tính đồng nhất gen của các ngân hàng tế bào sản xuất và ngân hàng tế bào gốc. Cần mô tả đầy đủ các đặc tính sinh học của tế bào chủ và các vector biểu hiện.
Sản xuất vắc xin trên tế bào côn trùng/hệ thống biểu hiện Baculovirus:
Trên tế bào côn trùng: Ngân hàng tế bào phải đạt yêu cầu về nhận dạng, độ tinh khiết, khả năng mọc, tính ổn định, các yếu tố ngoại lai mới được đưa vào sản xuất. Các đặc tính này có thể được đánh giá ở các giai đoạn phù hợp trong quá trình sản xuất. Nếu các tế bào côn trùng được sử dụng để sản xuất VLPs thì việc dùng tế bào côn trùng phải dựa vào một hệ thống ngân hàng tế bào gốc. Ngoài ra, ngân hàng tế bào gốc, ngân hàng tế bào sản xuất nếu nhân lên ở số lần tới hoặc vượt quá giới hạn cho phép thì phải được kiểm tra về tính sinh khối u trên một hệ thống thử nghiệm trên động vật và kiểm tra sự có mặt của các Retrovirus và các virus khác trên động vật chân đốt.
Baculovims tái tổ hợp: Việc sử dụng vector Baculovirus tái tổ hợp là dựa vào hệ thống chủng giống gốc với số lần cấy chuyển xác định từ chủng virus ban đầu thành chủng gốc và chủng sản xuất. Vector biểu hiện Baculovirus tái tổ hợp chứa chuỗi mã hóa của kháng nguyên L1 của HPV. Sử dụng kỹ thuật sinh học phân tử kết hợp với một số thử nghiệm khác để xác định các phân đoạn của cấu trúc biểu hiện trong protein tái tổ hợp tinh chế và khẳng định chất lượng cũng như tính ổn định của kháng nguyên L1. Baculovirus tái tổ hợp phải được theo dõi trong quá trình sản xuất vắc xin bao gồm các thông tin như nguồn gốc gen, nhận dạng, cấu trúc, cấu tạo và đặc tính gen. Chủng gốc Baculovirus tái tổ hợp được sản xuất với số lượng lớn và được bảo quản ở điều kiện nhiệt độ phù hợp.
Chỉ những chủng giống gốc nào đạt yêu cầu các thử nghiệm dưới đây mới được sử dụng để nhân giống.
Nhận dạng
Nhận dạng chủng gốc và chủng làm việc bằng cách sử dụng một kỹ thuật phù hợp, ví dụ kỹ thuật khuếch đại gen.
Nồng độ virus
Nồng độ virus trong chủng virus gốc và chủng sản xuất phải đảm bảo tính đồng nhất trong quá trình sản xuất.
Các yếu tố ngoại lai
Chủng virus làm việc cũng phải tuân thủ các tiêu chuẩn như chủng virus giống gốc và tế bào trứng. Các yếu tố ngoại lai cần chú ý là Spiroplasma và virus sinh sản trên côn trùng đặc biệt là những virus sinh sản trên côn trùng có khả năng gây bệnh cho người (ví dụ: Arbovirus).
Vô khuẩn
Chủng Baculovirus tái tổ hợp phải được kiểm tra xem có bị nhiễm vi khuẩn, nấm và Mycoplasma bằng thử nghiệm thích hợp (Phụ lục 15.7).
Mycobacteria
Chủng Baculovirus tái tổ hợp sẽ phải được kiểm tra về Mycobacterium spp.
Kiểm tra các tế bào trứng dùng cho sản xuất chủng
Xem phần kiểm tra tế bào trứng dưới đây.
Nhân giống virus và thu hoạch
Quá trình nuôi cấy tế bào và chủng Baculovirus giống gốc đều phải được thực hiện trong điều kiện vô khuẩn hoàn toàn và không có bất cứ loại tế bào nào khác đang được nuôi cấy.
Tại khu vực dành cho sản xuất nuôi cấy tế bào/hệ thống biểu hiện Baculovirus, virus được nuôi cấy trong môi trường nuôi cấy trung gian và được kiểm tra nghiêm ngặt 5 thử nghiệm dưới đây:
Nhận dạng
Nhận dạng virus bằng cách nhận dạng typ HPV và sử dụng thử nghiệm miễn dịch với các kháng thể đặc hiệu hoặc các kỹ thuật sinh học phân tử như kỹ thuật khuếch đại gen.
Vô khuẩn
Mỗi môi trường nuôi cấy trung gian có chứa virus đều phải được kiểm tra và đạt yêu cầu về vô khuẩn. Kiểm tra với 10 ml cho mỗi môi trường (Phụ Iục 15.7).
Nồng độ virus
Nồng độ virus trong mỗi môi trường nuôi cấy trung gian có chứa virus được xác định bằng các thử nghiệm phù hợp như thử nghiệm tạo đám/quầng hoặc khuếch đại gen, mục đích để đảm bảo tính đồng nhất trong quá trình sản xuất.
Các yếu tố ngoại lai
Tất cả các môi trường nuôi cấy trung gian có chứa virus đều phải đảm bảo đạt yêu cầu khi kiểm tra về yếu tố ngoại lai.
Tế bào trứng
Tế bào trứng được lấy ra từ các môi trường nuôi cấy trung gian chứa virus đều phải đạt yêu cầu khi tiến hành thử nghiệm nhận dạng và kiểm tra các yếu tố ngoại lai.
Mẻ gặt đơn
Một mẻ gặt đơn phải đạt các yêu cầu sau đây mới được sử dụng để tiến hành sản xuất kháng nguyên đơn giá tinh chế.
Nhận dạng
Mỗi mẻ gặt đơn phải được tiến hành thử nghiệm nhận dạng typ HPV, sử dụng thử nghiệm miễn dịch hoặc sinh học phân tử như PCR hoặc lai. Thử nghiệm nhận dạng có thể thay thế bằng một phần của thử nghiệm kiểm tra độ tinh khiết của kháng nguyên.
Vô khuẩn
Mỗi mẻ gặt đơn đều phải được kiểm tra và đáp ứng yêu cầu về tính vô khuẩn (Phụ Iục 15.7).
Các yếu tố ngoại lai
Tất cả các mẻ gặt đơn đều phải được kiểm tra về các yếu tố ngoại lai trong suốt quá trình cấy tế bào/sản xuất hệ thống biểu hiện Baculovirus. Như đã đề cập ở trên, cần đặc biệt chú ý đến những virus sinh sản trên côn trùng trong các ngân hàng tế bào và chủng virus giống gốc có khả năng gây bệnh cho người (ví dụ: Arbovirus).
Tế bào trứng
Trong quá trình cấy tế bào/sản xuất hệ thống biểu hiện Baculovirus, tế bào trứng phải đạt yêu cầu về nhận dạng và yếu tố ngoại lai. Cần đặc biệt chú ý đến những virus sinh sản trên côn trùng trong các ngân hàng tế bào và trong chủng virus giống gốc có khả năng gây bệnh cho người.
Kháng nguyên đơn giá tinh chế
Chỉ các kháng nguyên đơn giá tinh chế đạt yêu cầu mới được đưa vào sản xuất vắc xin bán thành phẩm cuối cùng.
Các thử nghiệm dưới đây có thể không yêu cầu nếu đã được thực hiện ở giai đoạn kháng nguyên đơn giá hấp phụ.
Protein toàn phần
Hàm lượng protein toàn phần được xác định bằng một phương pháp thử nghiệm phù hợp đã được thẩm định. Hàm lượng protein phải nằm trong tiêu chuẩn đăng ký đã được phê duyệt.
Hàm lượng kháng nguyên và nhận dạng
Hàm lượng và tính đặc hiệu của mỗi typ kháng nguyên HPV được xác định bằng phương pháp hóa miễn dịch phù hợp như thử nghiệm miễn dịch phóng xạ (RIA), thử nghiệm hấp phụ miễn dịch gắn men (ELISA). Nên sử dụng kháng thể đơn dòng kháng trực tiếp với các epitop kháng nguyên hoặc kỹ thuật khuếch tán đơn. Tỷ lệ kháng nguyên/protein phải đạt yêu cầu theo tiêu chuẩn cho phép đã được phê duyệt.
Độ tinh khiết kháng nguyên
Độ tinh tinh khiết của kháng nguyên đơn giá tinh khiết được xác định bằng các phương pháp phù hợp như kỹ thuật SDS-PAGE, giới hạn xác định là 1 % các tạp chất hoặc tốt hơn so với tổng protein. Một chế phẩm chuẩn sẽ được sử dụng để đánh giá mỗi phép thử. Độ tinh khiết của protein được tính bằng tỷ lệ giữa protein L1 với tổng protein và đơn vị tính theo phần trăm. Các typ trong vắc xin HPV phải đạt yêu cầu về độ tinh khiết kháng nguyên theo tiêu chuẩn được phê duyệt.
Tỷ lệ monomer L1
Thử nghiệm đánh giá độ tinh khiết của kháng nguyên cũng có mục đích đánh giá tính toàn vẹn của các monomer L1. Tỷ lệ monomer L1 là tỷ lệ giữa monomer L1 nguyên vẹn/tổng protein. Tỷ lệ này được tính theo phần trăm.
Cấu trúc và kích cỡ của VLP
Cấu trúc và kích cỡ của các VLP được xác định và theo dõi bằng phương pháp phù hợp như phương pháp phân bố ánh sáng động (dynamic light scattering). Kích cỡ của VLP phải nằm trong giới hạn cho phép đã được phê duyệt.
Thành phần
Hàm lượng các thành phần protein, lipid, acid nucleic và carbohydrat cũng cần được xác định ở các công đoạn phù hợp.
ADN tồn dư
Không được quá 10 ng ADN tồn dư trong kháng nguyên tinh khiết tính trên mỗi liều đơn dùng cho người, được xác định bằng các phương pháp có độ nhạy cao.
Protein tế bào chủ tồn dư
Hàm lượng protein tế bào chủ tồn dư được xác định bằng các thử nghiệm phù hợp. Kết quả phải nằm trong giới hạn cho phép đã được phê duyệt.
Các hóa chất sử dụng trong quá trình phá vỡ tế bào và tinh chế
Các hóa chất sử dụng trong quá trình tinh chế và các giai đoạn khác của quá trình sản xuất được xác định bằng các thử nghiệm phù hợp. Hàm lượng của các hóa chất này phải nằm trong giới hạn cho phép được phê duyệt.
Albumin
Nếu huyết thanh động vật được dùng trong nuôi cấy tế bào côn trùng hoặc tế bào động vật có vú để sản xuất vắc xin thì hàm lượng albumin tồn dư phải được xác định.
Vô khuẩn
Mỗi kháng nguyên đơn giá tinh khiết đều phải được kiểm tra và đáp ứng yêu cầu vô khuẩn. Kiểm tra với 10 ml cho mỗi mẫu (Phụ lục 15.7).
Kháng nguyên đơn giá hấp phụ
Các kháng nguyên đơn giá tinh khiết được hấp phụ vào một chất hấp phụ phù hợp như muối nhôm. Chỉ những kháng nguyên đơn giá hấp phụ đạt yêu cầu các thử nghiệm dưới đây mới được sử dụng để sản xuất vắc xin bán thành phẩm cuối cùng.
Vô khuẩn
Mỗi kháng nguyên đơn giá hấp phụ đều phải được kiểm tra và đáp ứng yêu cầu vô khuẩn. Kiểm tra với 10 ml cho mỗi mẫu (Phụ lục 15.7).
Nội độc tố vi khuẩn
Mỗi kháng nguyên đơn giá hấp phụ đều phải được kiểm tra hàm lượng nội độc tố vi khuẩn (Phụ lục 13.2). Kết quả kiểm tra phải nằm trong giới hạn cho phép đã được phê duyệt.
Hàm lượng kháng nguyên và nhận dạng
Mỗi typ kháng nguyên HPV được nhận dạng bằng các phương pháp hóa miễn dịch phù hợp như thử nghiệm miễn dịch phóng xạ (RIA), thử nghiệm hấp phụ miễn dịch gắn men (ELISA). Nên sử dụng kháng thể đơn dòng kháng trực tiếp với epitop kháng nguyên. Tỷ lệ kháng nguyên/protein phải đạt yêu cầu theo tiêu chuẩn đã đăng ký của nhà sản xuất.
Nồng độ chất hấp phụ
Mỗi mẫu kháng nguyên đơn giá phải được kiểm tra và xác định nồng độ chất hấp phụ. Nồng độ chất hấp phụ phải nằm trong khoảng cho phép đã được phê duyệt.
KIỂM ĐỊNH VẮC XIN BÁN THÀNH PHẨM CUỐI CÙNG
Vắc xin bán thành phẩm cuối cùng được sản xuất từ các kháng nguyên HPV đơn giá tinh khiết hoặc kháng nguyên HPV đơn giá hấp phụ. Chất bảo quản kháng khuẩn và tá chất dạng phối hợp nhôm hydroxyd và 3-0-desacyl-4-monophosphoryl lipid A (MPL) hoặc nhôm hydroxyphosphat sulfat có thể được thêm vào. Chỉ có những mẫu vắc xin bán thành phẩm cuối cùng đạt yêu cầu các thử nghiệm dưới đây mới được sử dụng để sản xuất vắc xin thành phẩm.
Chất bảo quản kháng khuẩn
Hàm lượng chất bảo quản kháng khuẩn trong vắc xin bán thành phẩm cuối cùng được xác định bằng các phương pháp phù hợp. Tổng hàm lượng chất bảo quản cho phép phải từ 85 % đến 115 % hàm lượng chất bảo quản đã đăng ký của nhà sản xuất.
Vô khuẩn
Đạt yêu cầu về vô khuẩn. Kiểm tra với 10 ml cho mỗi mẫu (Phụ lục 15.7).
Chất hấp phụ
Nếu thành phần nhôm được sử dụng là chất hấp phụ thì hàm lượng nhôm phải nằm trong giới hạn cho phép đối với từng loại vắc xin (Phụ lục 15.27).
Mức độ hấp phụ
Mức độ hấp phụ (khả năng hấp phụ hoàn toàn) của kháng nguyên trong vắc xin bán thành phẩm cuối cùng phải được đánh giá. Tuy nhiên, có thể bỏ qua thử nghiệm này nếu chứng minh được tính ổn định của quy trình hoặc nếu đã tiến hành đánh giá ở vắc xin thành phẩm.
Công hiệu (Có thể tiến hành công hiệu invitro hoặc công hiệu in vivo)
Công hiệu vắc xin HPV được tiến hành song song với vắc xin mẫu chuẩn và chứng (internal control). Có thể dùng phương pháp gây miễn dịch trên chuột để xác định hiệu giá kháng thể thu được (công hiệu in vivo) hoặc phương pháp sử dụng kháng thể đặc hiệu thực hiện trong phòng thí nghiệm để định lượng trực tiếp hàm lượng kháng nguyên có trong vắc xin (công hiệu in vitro).
KIỂM ĐỊNH VẮC XIN THÀNH PHẨM
Chỉ những vắc xin thành phẩm đạt yêu cầu các thử nghiệm dưới đây mới được sử dụng trên người. Thử nghiệm xác định hàm lượng chất bảo quản có thể không yêu cầu nếu đã thực hiện và đạt yêu cầu đối với vắc xin bán thành phẩm cuối cùng. Bên cạnh đó, thử nghiệm công hiệu trên động vật thí nghiệm (in vivo) cũng có thể không yêu cầu nếu đã thực hiện và đạt yêu cầu đối với vắc xin bán thành phẩm cuối cùng.
Thể tích đơn vị phân liều và cảm quan
Thể tích: Kiểm tra ít nhất 3 đơn vị đóng ống về thể tích và độ kín, khít. Mỗi đơn vị đóng ống vắc xin phải đảm bảo có thể tích không được thấp hơn thể tích ghi trên nhãn và trong hồ sơ đăng ký; đảm bảo độ kín, khít.
Cảm quan: Vắc xin phải không có vật thể lạ, có hình thái và màu sắc như đã đăng ký. Quan sát bằng mắt thường về dạng sản phẩm và màu sắc.
Nhận dạng
Các typ HPV khác nhau trong vắc xin được nhận dạng bằng các thử nghiệm hóa miễn dịch phù hợp. (thường bằng phương pháp ELISA sử dụng kháng thể đặc hiệu hoặc bằng thử nghiệm in vivo).Thử nghiệm công hiệu có thể bao gồm cà thử nghiệm nhận dạng.
Vô khuẩn
Đáp ứng yêu cầu về tính vô khuẩn (Phụ lục 15.7).
pH
Phải nằm trong giới hạn cho phép (Phụ lục 15.33).
Chất bảo quản kháng khuẩn
Xác định hàm lượng chất bảo quản trong vắc xin thành phẩm bằng các phương pháp hóa học hoặc hóa lý phù hợp. Hàm lượng chất bảo quản không được nhỏ hơn hàm lượng tối thiểu có tác dụng bảo quản và không được lớn hơn 115 % hàm lượng ghi trên nhãn.
Chất gây sốt (Phụ lục 15.12)
Mỗi lô vắc xin thành phẩm đều phải được kiểm tra chất gây sốt trên thỏ thử nghiệm. Có thể tiến hành cả thử nghiệm kiểm tra nội độc tố nếu có điều kiện thích hợp.
Riêng vắc xin có sử dụng tá chất là MPL thì thử nghiệm này nên được kiểm tra. Thử nghiệm này được tiến hành cho đến khi chứng minh được tính an toàn và ổn định của sản xuất.
Nội độc tố vi khuẩn (Phụ lục 13.2)
Không được quá 5 IU/liều đơn dùng cho người.
Những chế phẩm có chứa chất kích thích miễn dịch (như MPL) thường gây nhiễu thử nghiệm, vì vậy phải kiểm tra chất gây sốt trên thỏ đối với các sản phẩm này.
Chất hấp phụ (Phụ lục 15.27)
Nếu vắc xin có chứa chất hấp phụ, hàm lượng chất hấp phụ phải nằm trong giới hạn cho phép đã được phê duyệt.
Mức độ hấp phụ
Mức độ hấp phụ của mỗi kháng nguyên cũng được đánh giá. Thử nghiệm này có thể không phải tiến hành trong kiểm định xuất xưởng thông thường nếu đã chứng minh được tính ổn định của sản phẩm.
Tá chất (nếu sử dụng MPL)
Xác định bằng phương pháp sắc ký khí.
Tiêu chuẩn chấp thuận: Từ 30 μg/liều đến 50 μg/liều.
An toàn chung
Mỗi lô vắc xin thành phẩm phải được kiểm tra về độc tính không mong muốn (có thể được gọi là độc tính không đặc hiệu) bằng thử nghiệm an toàn chung (Phụ lục 15.11). Thử nghiệm này có thể không phải thực hiện trong kiểm định xuất xưởng thông thường nếu công hiệu của vắc xin được tiến hành theo phương pháp in-vivo.
Công hiệu in vitro:
Công hiệu in vitro của vắc xin phòng HPV được xác định bằng kỹ thuật ELISA, theo phương pháp “sandwich” hai giai đoạn. Các kháng nguyên VLP (L1) kết hợp với kháng thể IgG kháng HPV đa dòng thỏ (hoặc các loại kháng thể đặc hiệu typ HPV khác) đã được gắn trên các phiến nhựa (kháng thể 1). Phức hợp kháng nguyên - kháng thể 1 tiếp tục được gắn kháng thể chuột, đặc hiệu VLP (kháng thể 2) và cộng hợp. Chất hiện màu được gắn với phức hợp kháng thể 1 - kháng nguyên - kháng thể 2. Hàm lượng kháng nguyên được tính toán dựa trên mật độ màu của giếng chứa các mẫu vắc xin.
Phản ứng ELISA được thực hiện với phần nước nổi sau khi đã ly tâm của vắc xin để có được các kháng nguyên không hấp phụ. Quy trình thực hiện công hiệu in vitro của mỗi typ kháng nguyên HPV tương tự nhau và được thực hiện riêng rẽ.
Thử nghiệm công hiệu và nhận dạng đối với vắc xin Cervarix:
Vật liệu:
Phiến nhựa mới, 96 giếng
Vắc xin phòng HPV
HPV 16 và 18 chuẩn
HPV 16 và 18 mẫu chứng
Kháng thể thỏ đa dòng kháng HPV 16 và 18 (kháng thể 1).
Kháng thể chuột đơn dòng kháng HPV 16 và 18 (kháng thể 2, “sơ cấp”).
Cộng hợp kháng thể kháng chuột - Biotin (kháng thể 3),
Phức hợp Streptavidin-biotin-peroxidase.
Tiến hành:
Chuẩn bị phiến: Phiến trắng miễn dịch 96 giếng được gắn kháng thể thỏ đa dòng kháng HPV pha loãng trong dung dịch PBS, ủ phiến 4 °C qua đêm, rửa và được làm bão hòa bằng dung dịch PBS-casein ở 37 °C/1 h.
Kiểm định mẫu vắc xin: vắc xin mẫu chuẩn, vắc xin mẫu thử và mẫu chứng được ly tâm với tốc độ 13.000 r/min trong 10 min để tách toàn bộ phần nước nổi. Pha loãng bậc 2 phần nước nổi các mẫu vắc xin sao cho nồng độ kháng nguyên ở các độ pha thấp nhất đạt khoảng 250 ng/mL đối với HPV-16 và 2000 ng/mL đối với HPV-18.
Rồi pha tiếp bậc 2 ra từ 20 đến 2-10 để làm thử nghiệm công hiệu. Thử nghiệm nhận dạng chỉ cần 1 độ pha là 20. Các mẫu vắc xin đã pha loãng được nhỏ vào các giếng phiến, 3 giếng cho mỗi độ pha, ủ 37 °C/2 h, lắc nhẹ. Rửa phiến rồi nhỏ kháng thể chuột đơn dòng kháng HPV vào tất cả các giếng sau khi đã rửa sạch, ủ 37 °C/1 h. Rửa phiến rồi nhỏ dung dịch cộng hợp kháng thể kháng chuột - Biotin và ủ 37 °C/1 h. Rửa và nhỏ phức hợp chất hiện màu Streptavidin-biotin-peroxidase, ủ 37 °C/30 min. Rửa phiến rồi nhỏ dung dịch chất hiện màu TMB, ủ 15 min ở nhiệt độ phòng tránh ánh sáng. Nhỏ dung dịch dừng phản ứng. Đo mật độ quang học với bước sóng 450/620 nm.
Tiêu chuẩn cho thử nghiệm nhận dạng:
Thử nghiệm có giá trị khi OD của các giếng trống nhỏ hơn 0,2 (< 0,2).
Kháng nguyên HPV trong mẫu thử nghiệm được coi là dương tính khi giá trị trung bình OD mẫu thử lớn hơn OD tương ứng với đường tiệm cận dưới của mẫu chuẩn.
Thử nghiệm công hiệu:
Tính kết quả theo phần mềm Excel. Hệ số tương quan (R2) của mẫu chuẩn phải lớn hơn 95 %.
Hàm lượng kháng nguyên của từng typ trong mẫu thử được tính từ ít nhất 3 độ pha liên tiếp trong số 10 độ pha loãng dùng trong phản ứng.
Tiêu chuẩn cho thử nghiệm công hiệu:
Typ 16: Công hiệu tương quan của vắc xin mẫu thử và vắc xin mẫu chứng phải từ 0,78 đến 1,45.
Typ 18: Công hiệu tương quan của vắc xin mẫu thử và vắc xin mẫu chứng phải từ 0,79 đến 1,47.
Thử nghiệm định lượng và nhận dạng kháng nguyên đối với vắc xin Gardasil:
Vật liệu:
Phiến nhựa mới, 96 giếng
Vắc xin tứ giá phòng HPV
Kháng thể bắt giữ (capture antibody)
Kháng thể đơn dòng đặc hiệu typ HPV-6, 11,16, 18.
Kháng thể đơn dòng chuột - Goat anti-mouse IgG2b-HRP antibody.
Kháng thể cộng hợp - Horseradish peroxidase (HPR-conjugated antibody).
Tetramethylbenzidin (TMB).
Tiến hành:
Chuẩn bị phiến thử nghiệm: Phiến miễn dịch trắng, 96 giếng được gắn bản bằng kháng thể đơn dòng kháng HPV đặc hiệu, pha loãng trong dung dịch PBS. Phiến gắn bản được ủ qua đêm ở nhiệt độ từ 2 °C đến 8 °C và được cố định bằng dung dịch PBS có 1 % BSA, 0,05 % Tween 20. Để ở nhiệt độ từ 22 °C đến 28 °C trong 1 h đến 6 h.
Kiểm định mẫu vắc xin: Vắc xin mẫu chuẩn, vắc xin mẫu thử được ly tâm với tốc độ 650 r/m trong 10 min để tách lấy phần nước nổi. Pha loãng nước nổi bằng dung dịch PBS có 1 % BSA và 0,05 % Tween 20 trong các phiến trắng riêng rẽ với các độ pha loãng bậc 2, sao cho nồng độ kháng nguyên của các typ HPV đạt khoảng 2 μg/mL. Pha tiếp bậc 3 từ 30 đến 3-10 để làm thử nghiệm công hiệu. Thử nghiệm nhận dạng chỉ cần 1 độ pha là 30. Toàn bộ các mẫu vắc xin mẫu chuẩn và vắc xin thử nghiệm với các độ pha loãng ở trên được chuyển tương ứng sang phiến đã gắn bản bằng kháng thể trước đó. Dung dịch đệm citrat được thêm vào các giếng ngay sau đó để một lần nữa loại trừ chất hấp phụ trong vắc xin, ủ các phiến ở nhiệt độ từ 22 °C đến 28 °C qua đêm và lắc nhẹ. Sau đó rửa phiến rồi nhỏ kháng thể đơn dòng chuột vào tất cả các giếng. Ủ 1 h ở nhiệt độ từ 22 °C đến 28 °C. Rửa phiến rồi nhỏ kháng thể cộng hợp, ủ 1 h ở nhiệt độ từ 22 °C đến 28 °C. Rửa rồi nhỏ chất hiện màu là dung dịch TMB không pha loãng. Để 5 min rồi nhỏ dung dịch dừng phản ứng. Đo mật độ quang với bước sóng 450 nm.
Tính kết quả theo chương trình SoftMax Pro hoặc phần mềm Excel.
Tiêu chuẩn chấp thuận:
Hàm lượng của mỗi typ phải nằm trong giới hạn nhà sản xuất đăng ký đã được phê duyệt.
Hàm lượng HPV tổng số phải không được lớn hơn 500 IU/ml ( ≤ 500 IU/ml).
Công hiệu in vivo (Yêu cầu đối với vắc xin nhị giá)
Động vật thí nghiệm:
Chuột nhắt trắng giống BALB/C hoặc các giống chuột khác đã được thẩm định, khỏe mạnh và từ cùng một đàn, khoảng 6 tuần đến 8 tuần tuổi, tốt nhất là chuột cùng một giới.
Chuẩn bị vắc xin thử nghiệm
Vắc xin mẫu chuẩn và vắc xin mẫu thử được pha loãng bậc 2 thành 5 độ pha sao cho nồng độ kháng nguyên của mẫu pha loãng cuối cùng đạt khoảng 0,56 μg/0,5 ml. Dung dịch để pha vắc xin là nước muối sinh lý. Tiêm màng bụng 0,5 ml mỗi độ pha loãng vắc xin mẫu chuẩn và vắc xin mẫu cần kiểm tra cho mỗi chuột. Mỗi độ pha loãng vắc xin tiêm ít nhất 10 chuột. Tất cả các chuột sau gây miễn dịch được nuôi từ 21 ngày đến 22 ngày trong điều kiện như nhau. Tiến hành gây mê và lấy máu tim chuột. Các mẫu máu được ly tâm 3000 r/min trong 10 min ở nhiệt độ 4 °C đến 8 °C, tách huyết thanh. Các mẫu huyết thanh được bảo quản ở nhiệt độ âm 20 °C (-20 °C). Xác định hiệu giá kháng thể kháng HPV bằng kỹ thuật ELISA trên bộ sinh phẩm chẩn đoán đặc hiệu. Kết quả được tính theo chương trình Probit Analysis (WHO).
Thử nghiệm có giá trị khi:
ED50 của vắc xin mẫu chuẩn và vắc xin mẫu thử đều nằm trong khoảng giữa liều tiêm lớn nhất và nhỏ nhất.
Phân tích thống kê cho thấy đạt yêu cầu về tuyến tính và song song.
Giới hạn tin cậy (P=0,95) nằm trong giới hạn cho phép
Tiêu chuẩn chấp thuận:
Công hiệu tương quan không được nhỏ hơn 0,5 (≥ 0,5).
ĐÓNG GÓI
Vắc xin phòng HPV được đóng trong lọ thủy tinh trung tính hoặc bơm tiêm đóng sẵn (thủy tinh loại I) với pit tông có đáy bằng cao su (cao su butyl), có hoặc không có kim tiêm. Mỗi lọ/bơm tiêm chứa 1 liều đơn 0,5 ml huyền dịch. Hộp carton có thể chứa một hoặc nhiều lọ/bơm tiêm đơn liều tùy theo từng nhà sản xuất.
BẢO QUẢN
Vắc xin phòng HPV phải được bảo quản ở nhiệt độ 2 °C đến 8 °C, tuyệt đối không được làm vắc xin đông băng. Giữ nguyên trong hộp để tránh ánh sáng.
NHÃN, HỘP
Thông tin trên vỏ hộp, nhãn lọ, tờ hướng dẫn sử dụng phải đáp ứng những yêu cầu theo quy định hiện hành.
CHỈ ĐỊNH, LIỀU DÙNG
Đường dùng: Tiêm bắp vào vùng cơ delta.
Liều dùng, lịch tiêm: Theo hướng dẫn cụ thể đã đăng ký của nhà sản xuất.
VẮC XIN QUAI BỊ
Vaccinum parotitidis vivum
Vắc xin quai bị là một chế phẩm chứa virus quai bị sống, giảm độc lực, dạng đông khô; được sản xuất từ các virus phát triển trên dòng tế bào thích hợp.
Hoàn nguyên vắc xin ngay trước khi sử dụng bằng nước hồi chỉnh như đã ghi trên nhãn, được dung dịch trong, có thể có màu nếu có chất chỉ thị pH.
Chế phẩm phải thoả mãn tất cả các yêu cầu dưới đây:
SẢN XUẤT
Chủng sản xuất
Sản xuất được dựa trên hệ thống chủng gốc (master seed) virus giảm độc lực, được phê duyệt bởi Cơ quan Kiểm định Quốc gia. Chủng virus quai bị dùng để sản xuất vắc xin phải có hồ sơ ghi chép lịch sử chủng, bao gồm những thông tin về chủng gốc và các đời nhân lên tiếp theo của chủng này. Chủng sản xuất được bảo quản ở dạng đông khô trong điều kiện nhiệt độ dưới âm 20 °C; nếu không đông khô phải được bảo quản ở nhiệt độ dưới âm 60 °C và được giám sát chặt chẽ nhiệt độ trong quá trình bảo quản. Chủng sản xuất phải tuân thủ các điều kiện dưới đây:
Nhận dạng:
Các lô chủng gốc và chủng sản xuất phải được nhận dạng bằng phương pháp trung hòa với kháng huyết thanh đặc hiệu quai bị trên nuôi cấy tế bào hoặc nhận dạng bằng phương pháp RT-PCR.
Hàm lượng virus:
Hàm lượng virus của các lô chủng gốc và chủng sản xuất phải được kiểm tra để đảm bảo tính ổn định của sản xuất.
Các yếu tố ngoại lai:
Lô chủng sản xuất phải tuân thủ các yêu cầu đối với các lô chủng sản xuất vắc xin, không được có các yếu tố ngoại lai.
Độc lực:
Lô chủng sản xuất phải tuân thủ yêu cầu về thử nghiệm độc lực của các vắc xin sống. Khỉ Macaca và Cercopithecus phù hợp với thử nghiệm này.
Tế bào sản xuất
Sử dụng ngân hàng tế bào sản xuất hoặc từ tế bào phôi có nguồn gốc từ trứng không có tác nhân gây bệnh (SPF) và được cơ quan kiểm định quốc gia phê chuẩn.
Huyết thanh dùng trong môi trường nuôi cấy tế bào:
Huyết thanh dùng để nhân tế bào dùng cho sản xuất vắc xin quai bị phải được kiểm tra và chứng minh là đạt yêu cầu vô khuẩn (không có vi khuẩn, nấm và Mycoplasma và chứng minh không có chứa virus). Huyết thanh người không được sử dụng trong tất cả các môi trường nuôi cấy của quá trình sản xuất vắc xin.
Quy trình sản xuất và kiểm định sản xuất
Chủng virus quai bị được phát triển trên tế bào phôi hoặc tế bào từ ngân hàng tế bào sử dụng môi trường thích hợp. Hỗn dịch virus được gặt, trộn, bổ sung chất bảo quản, lọc, pha loãng, đóng lọ và đông khô theo quy trình đã được phê chuẩn. Trong quá trình sản xuất, tất cả các khâu đều được kiểm tra từ nguyên liệu nguồn (trứng, môi trường sử dụng cho sản xuất, huyết thanh bào thai bê, trypsin tách tế bào, ...); tế bào sử dụng cho sản xuất, mẻ gặt đơn, loạt hỗn dịch virus trộn, vắc xin bán thành phẩm trung gian, vắc xin bán thành phẩm cuối cùng, ...được kiểm tra tác nhân ngoại lai, kiểm tra hiệu giá virus, kiểm tra tính vô khuẩn...
Tất cả quá trình sản xuất ngân hàng tế bào và các nuôi cấy tế bào tiếp theo sau đó phục vụ cho quá trình sản xuất vắc xin quai bị đều phải được tiến hành trong các điều kiện vô trùng, trong khu vực không lưu giữ các dòng tế bào khác. Huyết thanh động vật có thể được sử dụng trong môi trường nuôi cấy của quá trình sản xuất. Huyết thanh và trypsin dùng để pha chế huyền dịch tế bào và pha môi trường nuôi cấy sẽ phải cho thấy không chứa các yếu tố ngoại lai. Môi trường nuôi cấy tế bào có thể chứa một chỉ thị pH như đỏ phenol và lượng kháng sinh nhỏ nhất có tác dụng.
KIỂM ĐỊNH MẺ GẶT ĐƠN
Mỗi mẻ gặt đơn phải đạt các tiêu chuẩn dưới đây mới được sử dụng để pha chế vắc xin bán thành phẩm cuối cùng:
Nhận dạng:
Mẻ gặt đơn chứa virus quai bị phải được nhận dạng virus bằng phương pháp trung hòa hoặc bằng phương pháp RT-PCR.
Nồng độ virus:
Nồng độ virus trong mỗi mẻ gặt đơn phải được xác định để giám sát tính ổn định của sản xuất và từ đó xác định độ pha được dùng cho vắc xin bán thành phẩm cuối cùng.
Các yếu tố ngoại lai:
Mỗi mẻ gặt đơn đều phải kiểm tra để xác định không chứa các yếu tố ngoại lai.
Kiểm tra tế bào và trứng:
Nếu sử dụng tế bào lưỡng bội người cho sản xuất, phải kiểm tra để nhận dạng chúng; các tế bào trứng và trứng phải được kiểm tra để xác định không chứa các yếu tố ngoại lai.
Vắc xin quai bị sống giảm độc lực có thể được điều chế với chất ổn định thích hợp và đông khô ở dạng vắc xin đơn hoặc phối hợp với vắc xin sởi và rubella sống giảm độc lực.
KIỂM ĐỊNH VẮC XIN BÁN THÀNH PHẨM CUỐI CÙNG
Các mẻ gặt đơn vắc xin đạt các yêu cầu nêu trên sẽ được trộn lại và lọc để loại bỏ tế bào. Thêm chất ổn định thích hợp và được pha thành độ pha loãng thích hợp.
Mỗi lô vắc xin bán thành phẩm cuối cùng sẽ phải đạt yêu cầu dưới đây mới được tiếp tục tiến hành các bước tiếp theo để sản xuất vắc xin thành phẩm:
Vô khuẩn
Vắc xin bán thành phẩm cuối cùng phải được kiểm tra tính vô khuẩn trên môi trường thích hợp, không có vi khuẩn, nấm và Mycoplasma.
KIỂM ĐỊNH VẮC XIN THÀNH PHẨM
Nhận dạng
Sử dụng phương pháp thích hợp đã được cơ quan kiểm định quốc gia quy định.
Phương pháp trung hòa vi lượng: Dùng kháng thể đặc hiệu trung hòa vắc xin quai bị. Hỗn dịch virus quai bị - kháng thể sau khi trung hòa được gây nhiễm trên tế bào Vero một lớp. Thử nghiệm luôn có chứng âm và chứng dương đi kèm, đọc kết quả sau 2 tuần.
Tiêu chuẩn chấp thuận: Vắc xin đạt yêu cầu khi tế bào Vero không bị hủy hoại ở mẫu vắc xin, giống như mẫu chứng âm.
Cách tiến hành:
Ngày thứ nhất:
Nuôi cấy tế bào trên phiến 6 giếng hoặc 24 giếng. Lượng tế bào 1.105 - 1,5.105 tế bào/ml hỗn dịch.
Ngày thứ 2: Trung hòa kháng nguyên bằng kháng thể đặc hiệu.
Pha loãng kháng thể theo các độ pha loãng khác nhau.
Hoàn nguyên vắc xin.
Kết hợp kháng nguyên, kháng thể theo tỷ lệ thể tích 1 : 1 (phản ứng trung hoà).
Ủ hỗn dịch đã trung hòa (kháng nguyên - kháng thể) và hỗn dịch không trung hòa (chỉ có vắc xin ở các nồng độ 10-1, 10-2, 10-3, 10-4, 10-5; và chỉ có kháng thể theo độ pha phù hợp) trong chu trình nhiệt thích hợp.
Khuyến cáo: có thể dùng chu trình nhiệt như sau: đặt vào bể ổn định nhiệt 37 °C/30 min, 23 °C/30 min, 4 °C trong thời gian từ 18 h trở lên (≥ 18 h).
Ngày thứ 3:
Gây nhiễm tế bào: nhỏ hỗn dịch đã trung hòa và không trung hòa vào các phiến tế bào. Có các giếng chứng tế bào, chứng vắc xin theo các nồng độ, chứng kháng thể theo các độ pha kèm theo.
Ủ ở tủ ấm 37 °C có 5 % CO2.
Theo dõi hàng ngày và đọc kết quả từ ngày thứ 4 cho đến ngày thứ 7.
Thử nghiệm có giá trị khi:
Giếng chứng tế bào vẫn phát triển bình thường.
Có xuất hiện hủy hoại trên tế bào Vero ở các nồng độ vắc xin pha loãng.
Phương pháp RT-PCR:
Dùng mồi đặc hiệu cho virus quai bị.
Có thông tin chi tiết về đoạn mồi này.
Thử nghiệm bao gồm mẫu thử và chứng âm.
Tiêu chuẩn chấp thuận: Vắc xin đạt yêu cầu khi sản phẩm RT-PCR có băng kích cỡ (size) đúng.
Khuyến cáo:
Có thể dùng cặp mồi như sau:
Mồi xuôi 5’-AGT AGT GTC GAT GAT CTC AT-3’,
Mồi ngược 5’-GCT CAA GCC TTG ATC ATT GA-3'.
Kích cỡ sản phẩm: 674 bp.
Chu trình nhiệt/thời gian:
50 °C/30 min;
95 °C/thời gian (theo hướng dẫn của bộ kít RT-PCR);
94 °C/1 min, 40 chu kỳ;
55 °C/1 min, 40 chu kỳ;
72 °C/1 min, 40 chu kỳ;
72 °C/10 min;
4 °C/đến khi điện di.
Hiệu giá vắc xin
Hiệu giá vắc xin quai bị được xác định bởi liều gây hủy hoại 50 % tế bào Vero (CCID50).
Nguyên vật liệu:
Mẫu vắc xin quai bị thử nghiệm: 3 lọ, kèm theo nước hồi chỉnh.
Vắc xin quai bị mẫu chuẩn: 1 lọ
Hai chai tế bào Vero loại 75 cm2 mọc đẹp, kín một lớp.
Các hóa chất:
PBS (Phosphate buffered Saline)
Trysin 0,25 % EDTA.
MEM hoặc M199 có chứa 2 % FBS (huyết thanh bào thai bê).
Tiến hành:
Thử nghiệm được tiến hành trong tủ cấy vô trùng BSC class II, trong khu vực vô trùng.
Tiến hành trên ít nhất 3 thử nghiệm kép cho vắc xin mẫu thử và tính kết quả bằng giá trị trung bình nhân của 3 thử nghiệm đó.
Pha loãng vắc xin mẫu chuẩn và mẫu thử:
Ví dụ: Tiến hành pha loãng theo Bảng 1.
Bảng 1: Ví dụ về cách tiến hành pha loãng vắc xin
| Độ pha loãng | Thể tích môi trường (ml) | Thể tích vắc xin (ml) |
| 10-1,0 (A) | 2,7 | 0,3 |
| 10-1,5 (B) | 2,16 | 1 (từ A) |
| 10-2,0 (C) | 2,16 | 1 (từ B) |
| 10-2,5 (D) | 2,16 | 1 (từ C) |
| 10-3,0 (E) | 2,16 | 1 (từ D) |
| 10-3,5 (F) | 2,16 | 1 (từ E) |
| 10-4,0 (G) | 2,16 | 1 (từ F) |
| 10-4,5 (H) | 2,16 | 1 (từ G) |
| 10-5,0 (K) | 2,16 | 1 (từ H) |
Tiến hành cho môi trường theo bảng trên vào các lọ thủy tinh nhỏ.
Hồi chỉnh vắc xin, lắc kỹ rồi lấy 0,3 ml cho vào độ pha loãng đầu tiên 10-1, lắc kỹ rồi lấy 1 ml nhỏ vào lọ có độ pha 10-1,5, tiếp tục quy trình tương tự đến độ pha cuối cùng. Chú ý thay đầu côn sau mỗi độ pha. Sau khi pha loãng xong tiến hành nhỏ vào phiến theo hàng ngang, mỗi độ pha loãng nhỏ 10 giếng, mỗi giếng 100 μl.
Nhỏ theo độ pha loãng từ thấp đến cao, nếu làm ngược lại phải thay đầu côn ở mỗi độ pha loãng.
Nhỏ vào 2 dãy giếng còn lại mỗi giếng 100 μl môi trường.
Lặp lại quy trình trên với các lọ vắc xin còn lại và vắc xin chuẩn.
Sau khi pha loãng xong, cất phiến vào ngăn mát tủ lạnh (2 °C đến 8 °C).
Tiến hành chuẩn bị hỗn dịch tế bào, lượng tế bào cần là 2 x 105 tế bào/ml.
Tế bào được nuôi cấy, tách, pha đủ lượng tế bào theo đậm độ nêu trên và đổ ra máng
Lấy phiến ra và tiến hành nhỏ tế bào lên tất cả các giếng, mỗi giếng 100 μl.
Cất vào tủ ấm 36 °C có 5 % CO2.
Đọc kết quả từ ngày thứ 7 đến ngày thứ 9.
Cách đọc và tính kết quả:
Khi tiến hành đọc kết quả thì quan sát các giếng chứng dưới kính hiển vi phản pha trước để dễ phân biệt sự hủy hoại tế bào của virus với tế bào Vero phát triển bình thường. Chỉ cần có dấu hiệu hủy hoại tế bào thì giếng đó được tính là “hủy hoại”.
Tính kết quả theo công thức Karber hoặc Reed - Muench như sau:
log CCID50 = L - d x (S - 0,5)
Trong đó:
L là log bậc pha loãng thấp nhất dùng trong phản ứng;
D là log hệ số pha loãng;
S là tổng số phần trăm các giếng hủy hoại.
Thử nghiệm được coi là có giá trị nếu:
Các giếng chứng tế bào mọc đẹp, không bị nhiễm nấm, vi khuẩn.
Hiệu giá của vắc xin chuẩn dao động trong vòng 0,5log10 so với hiệu giá vắc xin đã xác định của chuẩn. Hiệu giá của 3 lọ vắc xin mẫu thử song song không lệch quá 0,5log10.
Kết quả hủy hoại giảm dần theo độ pha loãng tăng dần của vắc xin.
Dãy các độ pha loãng sử dụng phải bao gồm được mức độ hủy hoại tế bào từ 0 % đến 100 %.
Tiêu chuẩn chấp thuận:
Hiệu giá virus của vắc xin quai bị xác định được không được nhỏ hơn lượng ghi trên nhãn; Hiệu giá virus tối thiểu ghi trên nhãn không được nhỏ hơn lg103 CCID50 đối với một liều đơn cho người.
Tính ổn định nhiệt
Thử nghiệm tính ổn định của vắc xin quai bị được tiến hành trên nguyên tắc xác định hiệu giá mẫu thử khi được ủ ở 37 °C, so với mẫu được bảo quản ở (5 ± 3) °C, trong 7 ngày.
Tiến hành xác định hiệu giá virus theo phương pháp tương tự như mô tả ở trên.
Tiêu chuẩn chấp thuận: Mẫu vắc xin đạt yêu cầu khi hiệu giá virus của mẫu ủ ở 37 °C không giảm quá 1 lg so với vắc xin mẫu thử bảo quản ở (5 ± 3) °C. Hiệu giá thấp nhất phải không được nhỏ hơn lg103 CCID50/0,5 ml (1 liều đơn dùng cho người).
An toàn chung (Phụ lục 15.11).
Vắc xin quai bị phải đạt yêu cầu về an toàn khi thử nghiệm trên chuột lang và chuột nhắt. Chuột phải khỏe mạnh và tăng trọng bình thường sau 7 ngày theo dõi.
Vô khuẩn
Đạt yêu cầu vô khuẩn (Phụ lục 15.7).
Độ ẩm tồn dư
Không được quá 3,0 % (Phụ lục 15.35).
Cảm quan
Đạt yêu cầu theo đăng ký của nhà sản xuất.
Mycoplasma
Không được có Mycoplasma (Phụ lục 15.36).
Khuyến cáo: Có thể sử dụng phương pháp PCR để xác định sự có mặt của Mycoplasma trong vắc xin quai bị.
Ovalbumin
Nếu vắc xin được sản xuất từ phôi gà hoặc chim, hàm lượng ovalbumin phải không được quá 1 μg Ovalbumin/ liều đơn cho người, xác định hàm lượng này theo phương pháp hóa miễn dịch.
Albumin tồn dư
Nhỏ hơn 50 ng/liều đơn dùng cho người. Xác định bằng phương pháp hóa miễn dịch thích hợp.
Bảo quản
Vắc xin quai bị được bảo quản ở nhiệt độ 2 °C đến 8 °C, tránh ánh sáng.
Nhãn, hộp
Theo quy định hiện hành, và cần có các thông tin sau đây:
Tên chủng virus được sử dụng sản xuất.
Loại tế bào sử dụng cho sản xuất.
Hiệu giá thấp nhất của virus.
Lượng kháng sinh còn tồn dư trong vắc xin, các chất bảo quản và hàm lượng của chúng (nếu có).
Bảo quản vắc xin trong điều kiện tránh ánh sáng.
Các yếu tố phải tránh tiếp xúc trực tiếp với vắc xin.
Liều lượng và cách dùng
Tiêm dưới da, liều 0,5 ml hoặc 0,7 ml (theo quy định của nhà sản xuất).
VẮC XIN RUBELLA
Vaccinum rubellae vivum
Vắc xin rubella là một chế phẩm chứa virus rubella sống, giảm độc lực, dạng đông khô; được sản xuất từ các virus phát triển trên dòng tế bào thích hợp.
Hoàn nguyên vắc xin ngay trước khi sử dụng bằng nước hồi chỉnh như đã ghi trên nhãn, được dung dịch trong, có thể có màu nếu có chất chỉ thị pH.
Chế phẩm phải thỏa mãn các yêu cầu dưới đây:
SẢN XUẤT
Chủng sản xuất
Sản xuất được dựa trên hệ thống chủng gốc virus giảm độc lực, được phê duyệt bởi Cơ quan Kiểm định quốc gia. Chủng virus rubella dùng để sản xuất vắc xin sẽ phải được xác định bằng hồ sơ ghi chép lịch sử chủng bao gồm những thông tin về chủng gốc và các đời nhân lên tiếp theo của chủng này. Chủng sản xuất được bảo quản ở dạng đông khô trong điều kiện nhiệt độ dưới âm 20 °C (-20 °C); nếu không đông khô phải được bảo quản ở nhiệt độ dưới âm 60 °C (-60 °C) và được giám sát chặt chẽ nhiệt độ trong quá trình bảo quản.
Chủng sản xuất phải tuân thủ các điều kiện dưới đây:
Nhận dạng:
Các lô chủng gốc và chủng sản xuất phải được nhận dạng virus rubella bằng phương pháp trung hòa với kháng huyết thanh đặc hiệu rubella trên nuôi cấy tế bào hoặc nhận dạng bằng phương pháp RT-PCR.
Hàm lượng virus:
Hàm lượng virus của các lô chủng gốc và chủng sản xuất phải được kiểm tra để đảm bảo tính ổn định của sản xuất.
Các yếu tố ngoại lai:
Lô chủng sản xuất phải tuân thủ các yêu cầu đối với đối với các lô chủng sản xuất vắc xin, không được có các yếu tố ngoại lai.
Độc lực:
Lô chủng sản xuất phải tuân thủ yêu cầu về thử nghiệm kiểm tra độc lực của các vắc xin sống. Khỉ Macaca và Cercopithecus phù hợp với thử nghiệm này.
Tế bào sản xuất
Sử dụng ngân hàng tế bào sản xuất hoặc từ tế bào phôi có nguồn gốc từ trứng không có tác nhân gây bệnh (SPF) và được Cơ quan Kiểm định quốc gia phê chuẩn.
Huyết thanh dùng trong môi trường nuôi cấy tế bào
Huyết thanh dùng để nhân tế bào dùng cho sản xuất vắc xin rubella phải được kiểm tra và chứng minh là đạt yêu cầu vô khuẩn (không có vi khuẩn, nấm và Mycoplasma và chứng minh không chứa virus). Huyết thanh người không được sử dụng trong tất cả các nuôi cấy của quá trình sản xuất vắc xin.
Quy trình sản xuất và kiểm định sản xuất
Chủng virus rubella được phát triển trên tế bào phôi hoặc tế bào từ ngân hàng tế bào sử dụng môi trường thích hợp. Hỗn dịch virus được gặt, trộn, bổ sung chất bảo quản, lọc, pha loãng, đóng lọ và đông khô theo quy trình đã được phê chuẩn. Trong quá trình sản xuất, tất cả các khâu đều được kiểm tra từ nguyên liệu nguồn (trứng, môi trường sử dụng cho sản xuất, huyết thanh bào thai bê, trypsin tách tế bào, ...); tế bào sử dụng cho sản xuất, mẻ gặt đơn, loạt hỗn dịch virus trộn, vắc xin bán thành phẩm trung gian, vắc xin bán thành phẩm cuối cùng, ...được kiểm tra tác nhân ngoại lai, kiểm tra hiệu giá virus, kiểm tra tính vô khuẩn...
Tất cả quá trình sản xuất ngân hàng tế bào và các nuôi cấy tế bào tiếp theo sau đó phục vụ cho quá trình sản xuất vắc xin rubella đều phải được tiến hành trong các điều kiện vô trùng, trong khu vực không lưu giữ các dòng tế bào khác. Huyết thanh động vật có thể được sử dụng trong môi trường nuôi cấy của quá trình sản xuất. Huyết thanh và trypsin dùng để pha chế huyền dịch tế bào và pha môi trường nuôi cấy sẽ phải cho thấy không chứa các yếu tố ngoại lai. Môi trường nuôi cấy tế bào có thể chứa một chỉ thị pH như đỏ phenol và lượng kháng sinh nhỏ nhất có tác dụng.
KIỂM ĐỊNH MẺ GẶT ĐƠN
Mỗi mẻ gặt đơn phải đạt các tiêu chuẩn dưới đây mới được sử dụng để pha chế vắc xin bán thành phẩm cuối cùng:
Nhận dạng:
Mẻ gặt đơn chứa virus rubella sẽ phải được nhận dạng virus bằng phương pháp trung hòa huyết thanh trên môi trường nuôi cấy có sử dụng kháng thể đặc hiệu hoặc bằng phương pháp PCR.
Nồng độ virus:
Nồng độ virus trong mỗi mẻ gặt đơn phải được xác định để giám sát tính ổn định của sản xuất và từ đó xác định độ pha được dùng cho vắc xin bán thành phẩm cuối cùng.
Các yếu tố ngoại lai:
Mỗi mẻ gặt đơn đều phải kiểm tra để xác định không chứa các yếu tố ngoại lai.
Kiểm tra tế bào và trứng:
Nếu sử dụng tế bào lưỡng bội người cho sản xuất, phải kiểm tra tế bào trứng để nhận dạng; các tế bào và trứng phải được kiểm tra để xác định không chứa các yếu tố ngoại lai.
Vắc xin rubella sống giảm độc lực có thể được điều chế với chất ổn định thích hợp và đông khô ở dạng vắc xin đơn hoặc phối hợp với vắc xin sởi và quai bị sống giảm độc lực.
KIỂM ĐỊNH VẮC XIN BÁN THÀNH PHẨM CUỐI CÙNG
Các mẻ gặt đơn vắc xin đạt các yêu cầu nêu trên sẽ được trộn lại và lọc để loại bỏ tế bào. Thêm chất ổn định thích hợp và các mẻ gặt đã được trộn sẽ được pha thành độ pha loãng thích hợp.
Mỗi lô vắc xin bán thành phẩm cuối cùng sẽ phải đạt các yêu cầu dưới đây mới được tiếp tục tiến hành các bước tiếp theo để sản xuất vắc xin thành phẩm
Vô khuẩn: Đạt yêu cầu vô khuẩn (Phụ lục 15.7).
KIỂM ĐỊNH VẮC XIN THÀNH PHẨM
Nhận dạng
Sử dụng phương pháp thích hợp đã được Viện Kiểm định quốc gia phê chuẩn.
Phương pháp trung hòa vi lượng:
Dùng kháng thể đặc hiệu trung hòa vắc xin rubella. Hỗn dịch virus rubella - kháng thể sau phản ứng, được dùng để gây nhiễm trên tế bào RK-13 một lớp. Thử nghiệm luôn có chứng âm và chứng dương đi kèm, đọc kết quả sau 2 tuần.
Tiến hành:
Ngày thứ nhất:
Nuôi cấy tế bào trên phiến 6 giếng hoặc 24 giếng.
Lượng tế bào: 1.105 tế bào/ml đến 1,5.105 tế bào/ml hỗn dịch.
Ngày thứ 2:
Pha kháng thể theo các độ pha loãng khác nhau.
Hoàn nguyên vắc xin bằng nước hồi chỉnh kèm theo.
Trộn kháng nguyên, kháng thể theo tỷ lệ thể tích 1 : 1 (phản ứng trung hòa).
Ủ hỗn dịch đã trung hòa (có kháng nguyên và kháng thể) và hỗn dịch không trung hòa (chỉ có vắc xin ở các nồng độ 10-1, 10-2, 10-3, 10-4, 10-5; và chỉ có kháng thể theo độ pha phù hợp) trong chu trình nhiệt thích hợp.
Khuyến cáo: Có thể dùng chu trình nhiệt như sau: đặt vào bể ổn định nhiệt 37 °C/ 30 min, 23 °C/ 30 min, 4°C ≥ 18h.
Ngày thứ 3:
Gây nhiễm trên tế bào: Nhỏ hỗn dịch đã trung hòa và không trung hòa vào các giếng trên phiến tế bào đã chuẩn bị trước. Phải có các giếng chứng tế bào, chứng vắc xin theo các nồng độ, chứng kháng thể theo các độ pha kèm theo.
Đặt vào tủ ấm 32 °C có 5 % CO2.
Theo dõi hàng ngày và đọc kết quả từ ngày thứ 4 cho đến ngày thứ 7.
Thử nghiệm có giá trị khi ở giếng chứng, tế bào vẫn phát triển bình thường; trong khi đó, có xuất hiện hủy hoại tế bào ở các giếng có vắc xin.
Phương pháp RT-PCR:
Dùng mồi đặc hiệu cho virus rubella.
Có thông tin chi tiết về đoạn mồi này.
Thử nghiệm bao gồm mẫu thử và chứng âm.
Tiêu chuẩn chấp thuận: Vắc xin đạt yêu cầu khi sản phẩm RT-PCR có băng kích cỡ (size) đúng.
Khuyến cáo:
Có thể dùng cặp mồi như sau:
Dùng mồi đặc hiệu cho virus quai bị.
Có thông tin chi tiết về đoạn mồi này.
Thử nghiệm bao gồm mẫu thử và chứng âm.
Tiêu chuẩn chấp thuận: Vắc xin đạt yêu cầu khi sản phẩm RT-PCR có băng kích cỡ (size) đúng.
Khuyến cáo:
Có thể dùng cặp mồi như sau:
Mồi xuôi 5’-CAA CAC GCC GCA CGG ACA AC-3',
Mồi ngược 5'-CCA CAA GCC GCG AGC AGT CA-3'.
Kích thước: 185 bp.
Chu trình nhiệt/thời gian:
50 °C/30 min;
95 °C/thời gian (theo hướng dẫn của bộ kít RT-PCR);
94 °C/1 min, 35 chu kỳ;
60 °C/1 min, 35 chu kỳ;
72 °C/1 min, 35 chu kỳ;
72 °C/10 min
4 °C/đến khi điện di.
Tiêu chuẩn chấp thuận: Vắc xin đạt yêu cầu khi tế bào RK-13 không bị hủy hoại ở giếng chứa vắc xin, giống như mẫu chứng âm.
Hiệu giá vắc xin
Nguyên tắc: Hiệu giá vắc xin rubella được xác định bởi liều gây hủy hoại 50 % tế bào RK-13 (CCID50).
Vật liệu:
Mẫu vắc xin rubella thử nghiệm: 3 lọ, kèm theo nước hồi chỉnh.
Vắc xin rubella mẫu chuẩn: 1 lọ
Hai chai tế bào RK-13 loại 75 cm2 mọc đẹp, kín một lớp.
Hóa chất:
PBS: Phosphate buffered Saline
Trysin 0,25 % EDTA
MEM 2 % đến 5 % FBS (huyết thanh bào thai bê)
Tiến hành:
Thử nghiệm được tiến hành trong tủ cấy vô trùng BSC class II, trong khu vực vô trùng.
Tiến hành trên ít nhất 3 thử nghiệm kép cho 3 lọ vắc xin mẫu thử riêng biệt và tính kết quả bằng giá trị trung bình nhân của 3 thử nghiệm đó.
Pha loãng vắc xin mẫu chuẩn và vắc xin mẫu thử từ độ pha từ 10-1 đến 10-5;
Ví dụ: Tiến hành pha loãng như Bảng 1.
Bảng 1: Ví dụ về cách tiến hành pha loãng vắc xin
| Độ pha loãng | Thể tích môi trường (ml) | Thể tích vắc xin (ml) |
| 10-1,0 (A) | 2,7 | 0,3 |
| 10-1,5 (B) | 2,16 | 1 (từ A) |
| 10-2,0 (C) | 2,16 | 1 (từ B) |
| 10-2,5 (D) | 2,16 | 1 (từ C) |
| 10-3,0 (E) | 2,16 | 1 (từ D) |
| 10-3,5 (F) | 2,16 | 1 (từ E) |
| 10-4,0 (G) | 2,16 | 1 (từ F) |
| 10-4,5 (H) | 2,16 | 1 (từ G) |
| 10-5,0 (K) | 2,16 | 1 (từ H) |
Cho môi trường theo bảng trên vào các lọ hoặc ống thủy tinh vô khuẩn có thể tích 3 ml đến 6 ml.
Hồi chỉnh vắc xin, lắc kỹ rồi lấy 0,3 ml cho vào độ pha loãng đầu tiên 10-1.
Lắc kỹ, lấy 1 ml nhỏ vào lọ có độ pha 10-1,5.
Tiếp tục quy trình tương tự đến độ pha cuối cùng. Chú ý thay đầu côn sau mỗi độ pha.
Sau khi pha loãng xong, tiến hành nhỏ vào phiến vi chuẩn độ theo hàng ngang, mỗi độ pha loãng nhỏ 10 giếng, mỗi giếng 100 μl.
Nhỏ theo độ pha loãng từ thấp đến cao, nếu làm ngược lại phải thay đầu côn ở mỗi độ pha loãng.
Nhỏ vào 2 dãy giếng còn lại mỗi giếng 100 μl môi trường.
Mỗi lọ vắc xin thực hiện một quy trình riêng biệt như trên.
Lặp lại quy trình trên với lọ vắc xin còn lại và vắc xin chuẩn.
Cất các phiến đã nhỏ xong vào tủ lạnh (2 °C đến 8 °C).
Tiến hành chuẩn bị hỗn dịch tế bào: Lượng tế bào cần là từ 1 x 105 tế bào/ml đến 2 x 105 tế bào/ ml.
Nuôi cấy, tách tế bào và pha đủ thể tích tế bào cần dùng với đậm độ thích hợp nêu trên rồi đổ ra máng
Lấy phiến ra và tiến hành nhỏ tế bào lên tất cả các giếng, mỗi giếng 100 μl.
Ủ ở tủ ấm 32 °C trong khoảng 12 ngày.
Đọc kết quả từ ngày thứ 10 đến ngày thứ 12.
Cách đọc và tính kết quả:
Khi tiến hành đọc kết quả thì quan sát các giếng chứng trên kính hiển vi phản pha trước để dễ phân biệt sự hủy hoại tế bào của virus với các tế bào RK-13 phát triển bình thường. Dấu hiệu hủy hoại là tế bào co lại tạo thành tế bào khổng lồ đa nhân, tạo những khoảng trống trên mặt đáy phiến, chỉ cần có dấu hiệu hủy hoại tế bào thì giếng đó được tính là “hủy hoại”.
Tính kết quả theo công thức Karber hoặc Reed - Muench:
log CCID50 = L - d (S -0,5)
Trong đó:
L là log bậc pha loãng thấp nhất dùng trong phản ứng;
d là log hệ số pha loãng;
S là tổng số phần trăm các giếng hủy hoại.
Thử nghiệm được coi là có giá trị nếu:
Các giếng chứng tế bào mọc đẹp, không bị nhiễm nấm, vi khuẩn.
Hiệu giá của vắc xin chuẩn dao động trong vòng 0,5log10 so với hiệu giá vắc xin đã xác định của chuẩn.
Hiệu giá của 3 lọ vắc xin mẫu cần kiểm tra song song không lệch quá 0,5log10.
Kết quả hủy hoại giảm dần theo độ pha loãng tăng dần của vắc xin.
Dãy các độ pha loãng sử dụng phải bao gồm được mức độ hủy hoại tế bào từ 0 % đến 100 %.
Tiêu chuẩn chấp thuận:
Hiệu giá virus của vắc xin rubella cần kiểm tra không được nhỏ hơn lượng ghi trên nhãn. Hiệu giá virus tối thiểu ghi trên nhãn không được nhỏ hơn lg103 CCID50 đối với một liều đơn cho người.
Tính ổn định nhiệt
Thử nghiệm tính ổn định của vắc xin rubella được tiến hành bằng cách so sánh hiệu giá của mẫu vắc xin cần kiểm tra được ủ ở 37 °C với mẫu được ủ ở (5 ± 3) °C, trong 7 ngày.
Tiêu chuẩn chấp thuận: Tính ổn định nhiệt của vắc xin đạt yêu cầu khi hiệu giá virus của vắc xin mẫu được ủ ở 37 °C không giảm quá 1 lg so với vắc xin mẫu ủ ở (5 ± 3) °C. Hiệu giá thấp nhất không được nhỏ hơn lg103 CCID50/ 0,5 ml (1 liều tiêm cho người).
An toàn chung (Phụ lục 15.11)
Vắc xin rubella phải an toàn khi thử nghiệm trên chuột lang và chuột nhắt.
Tiêu chuẩn chấp thuận: Chuột phải khỏe mạnh và tăng trọng bình thường sau 7 ngày theo dõi.
Vô khuẩn
Đạt yêu cầu vô khuẩn (Phụ lục 15.7).
Độ ẩm tồn dư
Không được quá 3,0 % (Phụ lục 15.35).
Cảm quan
Đạt yêu cầu theo đăng ký của nhà sản xuất.
Mycoplasma
Không được có Mycoplasma (Phụ lục 15.36).
Khuyến cáo: có thể dùng phương pháp nuôi cấy trực tiếp hoặc PCR để phát hiện Mycoplasma trong vắc xin.
Albumin tồn dư
Nhỏ hơn 50 ng/liều đơn dùng cho người. Xác định bằng phương pháp hoá miễn dịch thích hợp.
Bảo quản
Bảo quản ở nhiệt độ 2 °C đến 8 °C, tránh ánh sáng.
Nhãn, hộp
Theo quy định hiện hành và cần có các thông tin như sau:
Tên chủng virus được sử dụng sản xuất.
Loại tế bào sử dụng cho sản xuất.
Nồng độ thấp nhất của virus.
Lượng kháng sinh còn tồn dư trong vắc xin, các chất bảo quản và liều lượng của chúng (nếu có).
Các yếu tố phải tránh tiếp xúc trực tiếp với vắc xin.
Chú ý: Vắc xin quai bị nhạy cảm với ánh sáng, vì vậy phải bảo quản tránh ánh sáng đối với vắc xin đông khô và vắc xin đã hoàn nguyên.
Phụ nữ mang thai và những phụ nữ sắp có thai trước hai tháng: Không nên tiêm vắc xin này.
Cách dùng và liều lượng
Tiêm dưới da, liều 0,5 ml.
VẮC XIN VIÊM GAN A (BẤT HOẠT, HẤP PHỤ)
Vaccinum hepatitidis A inactivatum adsorbatum
Vắc xin viêm gan A (bất hoạt, hấp phụ) là một chế phẩm chứa một chủng virus viêm gan A nuôi cấy trên tế bào, được bất hoạt bằng một phương pháp đã được phê chuẩn và thường được hấp phụ với nhôm hydroxyd hoặc nhôm phosphat.
SẢN XUẤT
Chủng virus
Phải đạt các tiêu chuẩn sau:
Có đầy đủ hồ sơ, thông tin về nguồn gốc virus.
Đạt được các tiêu chuẩn đặt ra cho virus sử dụng để sản xuất vắc xin bất hoạt.
Đã qua thử nghiệm lâm sàng cho thấy có thể tạo ra vắc xin an toàn và hiệu quả.
Chủng sản xuất được sản xuất dựa trên hệ thống chủng giống gốc đã được phê chuẩn bởi cơ quan có thẩm quyền. Chủng sản xuất được bảo quản ở dưới âm 60 °C (-60 °C).
Tế bào sản xuất:
Gồm tế bào lưỡng bội người, dòng tế bào thường trực hoặc tế bào tiên phát đã được mô tả đặc tính đầy đủ và được phê chuẩn bởi cơ quan kiểm định quốc gia.
Môi trường nuôi cấy tế bào sử dụng trong sản xuất
Phải được thẩm định để đảm bảo năng suất và hiệu quả trong sản xuất vắc xin. Tất cả các thành phần bổ sung vào môi trường nuôi cấy đều phải đảm bảo vô trùng và an toàn (huyết thanh bê, trypsin tách tế bào, chất chỉ thị pH, kháng sinh...).
Quá trình sản xuất
Chủng virus viêm gan A thường được nuôi cấy trên dòng tế bào lưỡng bội người (tế bào MRC5 hoặc KMB17) hoặc dòng tế bào thường trực khác, sử dụng môi trường nuôi cấy thích hợp. Hỗn dịch virus được gặt, hộn lại, tinh sạch, bất hoạt, bổ sung chất bảo quản, lọc, pha loãng, bổ sung tá chất và đóng ống theo quy trình đã được phê duyệt. Trong quá trình sản xuất, tất cả các khâu đều được kiểm tra từ nguyên liệu nguồn như: Chủng virus, tế bào sử dụng cho sản xuất, môi trường nuôi cấy, huyết thanh bê, trypsin tách tế bào, chất chỉ thị pH, kháng sinh, hóa chất bất hoạt, chất bảo quản...
Trong trường hợp sử dụng tế bào thận khỉ tiên phát để sản xuất thì các thử nghiệm đặc hiệu để kiểm soát virus ở khỉ phải được thực hiện bao gồm thử nghiệm: SIV, SV 40, Virus B và Lao.
KIỂM ĐỊNH VẮC XIN BÁN THÀNH PHẨM
Vô khuẩn
Đạt yêu cầu vô khuẩn (Phụ lục 15.7).
Chất bảo quản
Nếu quy trình sản xuất có sử dụng các chất bảo quản, thì việc xác định hàm lượng các chất này được thực hiện bằng một phương pháp hóa hoặc hóa lý. Hàm lượng các chất bảo quản này phải nằm trong giới hạn 85 % đến 115 % lượng ghi trên nhãn.
Hàm lượng nhôm
Nếu sử dụng hydroxyd nhôm hoặc nhôm hydrat phosphat là chất hấp phụ, thì hàm lượng tối đa cho phép là 1,25 mg Al+3 trong một liều đơn dùng cho người (Phụ lục 15.27).
Formaldehyd tồn dư
Không quá 0,2 g/L (Phụ lục 15.25).
KIỂM ĐỊNH VẮC XIN THÀNH PHẨM
Nhận dạng
Vắc xin phải chứa kháng nguyên virus viêm gan A được nhận dạng bằng phương pháp ELISA, sử dụng kháng thể đặc hiệu hoặc bằng thử nghiệm in vivo.
Cảm quan
Khi lắc vắc xin viêm gan A bất hoạt, hỗn dịch có màu trắng đục.
Vô khuẩn
Đạt yêu cầu vô khuẩn (Phụ lục 15.7).
pH
Phải nằm trong giới hạn do nhà sản xuất đăng ký đã được phê duyệt (Phụ lục 15.33).
An toàn chung
Vắc xin viêm gan A bất hoạt hấp phụ phải đạt an toàn trên chuột nhắt và chuột lang. Chuột phải khỏe mạnh, tăng cân sau 7 ngày theo dõi (Phụ lục 15.11).
Chất gây sốt
Vắc xin viêm gan A bất hoạt hấp phụ phải đạt yêu cầu về chất gây sốt trên thỏ. Tổng nhiệt độ chênh lệch của 3 thỏ không được quá 1,3 °C (Phụ lục 15.12).
Nội độc tố
Đạt tiêu chuẩn theo nhà sản xuất đăng ký đã được phê duyệt (Phụ lục 13.2).
Công hiệu
Công hiệu vắc xin viêm gan A bất hoạt, hấp phụ được tiến hành song song với vắc xin mẫu chuẩn. Có thể được xác định theo phương pháp gây miễn dịch trên chuột để xác định hiệu giá kháng thể thu được (công hiệu in vivo) hoặc phương pháp sử dụng kháng thể đặc hiệu thực hiện trong phòng thí nghiệm để định lượng trực tiếp hàm lượng kháng nguyên có trong vắc xin (công hiệu in vitro).
Công hiệu in vivo:
Động vật thí nghiệm: Chuột nhắt trắng (giống chuột tùy thuộc vào quy trình của các nhà sản xuất) khỏe mạnh và từ cùng một đàn, khoảng 5 tuần tuổi, tốt nhất là cùng giới.
Xác định công hiệu tương quan: Vắc xin mẫu chuẩn và vắc xin mẫu thử được pha loãng thành ít nhất 3 độ pha. Dung dịch để pha loãng là nước muối sinh lý (dung dịch natri clorid 0,9 %) có chứa loại tá chất được sử dụng trong mẫu kiểm tra. Tiêm màng bụng 1 mL/chuột, mỗi độ pha tiêm miễn dịch ít nhất 10 chuột. Sử dụng một nhóm chuột tiêm dung dịch pha loãng làm chứng. Tất cả các chuột sau gây miễn dịch được nuôi từ 28 đến 32 ngày trong điều kiện như nhau. Tiến hành gây mê, lấy máu tim chuột. Các mẫu máu được ly tâm ở 3000 r/min trong 10 min ở 4 °C đến 8 °C, tách huyết thanh và cất riêng rẽ mẫu máu của từng chuột ở -20 °C.
Xác định hiệu giá kháng thể đặc hiệu kháng virus viêm gan A bằng thử nghiệm hấp phụ miễn dịch gắn men (ELISA) bằng kit thương phẩm có chất lượng tốt. Kết quả được tính theo chương trình Probit Analysis (WHO).
Thử nghiệm có giá trị khi:
ED50 của vắc xin mẫu chuẩn và vắc xin mẫu thử đều nằm trong khoảng giữa liều tiêm lớn nhất và liều tiêm nhỏ nhất.
Phân tích thống kê cho thấy đạt yêu cầu về tuyến tính và song song.
Giới hạn tin cậy của công hiệu tương quan nằm trong khoảng 33 % đến 300 %.
Tiêu chuẩn công hiệu in vivo: Công hiệu tương quan (p = 95 %) không nhỏ hơn 1 so với mẫu chuẩn.
Hàm lượng nhôm
Nếu sử dụng nhôm hydroxyd hoặc nhôm hydrat phosphat là chất hấp phụ thì hàm lượng tối đa cho phép là 1,25 mg Al+3 trong một liều đơn dùng cho người (Phụ lục 15.27).
Formaldehyd tồn dư
Lượng tối đa cho phép là 0,2 g/L (Phụ lục 15.25).
Chất bảo quản
Nếu quy trình sản xuất có sử dụng các chất bảo quản, thì việc xác định hàm lượng các chất này được thực hiện bằng một phương pháp hóa hoặc hóa lý. Hàm lượng các chất bảo quản này phải từ 85 % đến 115 % lượng ghi trên nhãn.
Hàm lượng protein
Được xác định theo phương pháp phù hợp, thường là dùng phương pháp Lowry. Hàm lượng protein phải nằm trong giới hạn cho phép (Phụ lục 15.34).
Trường hợp các thử nghiệm kiểm tra hàm lượng formaldehyd tồn dư (nếu có sử dụng), hàm lượng chất bảo quản (nếu có) hay các thử nghiệm kiểm tra trên động vật mà đã kiểm tra trên vắc xin bán thành phẩm và cho kết quả đạt yêu cầu thì những thử nghiệm này có thể không cần kiểm tra trên vắc xin thành phẩm.
Bảo quản
Vắc xin được bảo quản ở nhiệt độ 2 °C đến 8 °C, tránh sáng và tránh làm vắc xin đông băng.
Nhãn, hộp
Những thông tin trên nhãn, hộp, tờ hướng dẫn sử dụng phải đáp ứng những yêu cầu quy định hiện hành.
Hạn dùng
Các tuyên bố về hạn sử dụng, nhiệt độ bảo quản sẽ phải dựa trên kết quả nghiên cứu về tính ổn định của vắc xin và phải được cơ quan kiểm định quốc gia phê chuẩn.
Liều tiêm, đường tiêm
Theo hướng dẫn sử dụng (đã được phê duyệt) đi kèm.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN III:2014 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN III:2014 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN III:2014 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN III:2014 DOC (Bản Word)