- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Việt Nam TCVN 6563:1999 CAC/RM 18-1969 Dầu mỡ động vật và thực vật - Xác định hàm lượng vitamin E
| Số hiệu: | TCVN 6563:1999 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học, Công nghệ và Môi trường | Lĩnh vực: | Thực phẩm-Dược phẩm |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
01/01/1999 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 6563:1999
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 6563:1999
TIÊU CHUẨN VIỆT NAM
TCVN 6563 : 1999
CAC/RM 18 – 1969
DẦU MỠ ĐỘNG VẬT VÀ THỰC VẬT - XÁC ĐỊNH HÀM LƯỢNG VITAMIN E (TOCOPHEROL)
Animal and vegetable fats and oils - Determination of vitamin E (tocopherols) content
Lời nói đầu
TCVN 6563 : 1999 hoàn toàn tương đương với CAC/RM 18 – 1969
TCVN 6563 : 1999 do ban kỹ thuật TCVN/TC/F2 Dầu mỡ động vật và thực vật biên soạn, Tổng cục Tiêu chuẩn - Đo lường – Chất lượng đề nghị và được Bộ Khoa học Công nghệ và Môi trường ban hành.
DẦU MỠ ĐỘNG VẬT VÀ THỰC VẬT - XÁC ĐỊNH HÀM LƯỢNG VITAMIN E (TOCOPHEROL)
Animal and vegetable fats and oils - Determination of vitamin E (tocopherols) content
1 Phạm vi áp dụng
Tocopherol có mặt trong thực phẩm được biết dưới hai đặc tính cơ bản:
a) đặc tính dinh dưỡng (hoạt tính vitamin E);
b) ngăn ngừa oxi hoá thực phẩm (hoạt tính chống oxi hoá).
Việc xác định vitamin E bằng phương pháp hoá học gồm cả tocopherol tự nhiên và tocopherol tổng hợp. Kết quả được biểu thị bằng số lượng của mỗi tocopherol (ỏ, õ, γ ...) và cũng có thể biểu thị bằng lượng tocopherol tổng số. Phương pháp này có thể áp dụng cho dầu, mỡ và thích hợp cho việc xác định vi lượng tocopherol. Cũng có thể áp dụng cho các chế phẩm sinh học khác có thể hoà tan trong chất béo. Các tocopherol này đủ bền vững không gây độc hại hoặc trở ngại khi sử dụng một trong các phương pháp chiết chất béo thông thường. Một vài phương pháp như thế được áp dụng cụ thể để xác định tocopherol đã được mô tả (2) (4) (8).
2 Nguyên tắc
Phương pháp này dựa trên phương pháp Emmrie - Engel (5). Nó đề cập đến việc xác định tất cả bẩy tocopherol có mặt trong sản phẩm. Sau khi loại bỏ các chất gây nhiễu, các tocopherol được xử lý với hỗn hợp sắt (III) clorua và dung dịch 2 : 28 - dipyridyl trong dung dịch etanol. Các tocopherol khử sắt (III) thành sắt (II), sau đó sắt (II) kết hợp với dipyridyl tạo thành màu đỏ, được đo bằng quang phổ kế hoặc máy so màu điện tử. Phương pháp này có thể bao gồm tất cả hoặc hầu hết bẩy giai đoạn dưới đây với mục đích:
a) dùng dung môi chiết chất béo để tách hết tất cả các tocopherol có mặt trong mẫu đại diện;
b) xà phòng hoá chất béo nhằm tách chất không xà phòng hoá. Phương pháp này dựa trên phương pháp Tosic và Moose (9);
c) tách khỏi dung dịch phần lớn steroit trong metanol bằng cách cho đóng băng;
d) dùng sắc ký cột floridin để loại bỏ carotenoit và steroit còn lại (6);
e) dùng sắc ký giấy hai chiều (7) để tách các tocopherol thành 5 vùng, và đo giải hấp đặc trưng;
f) xử lý rửa giải bằng thuốc thử Emmerie - Engel, đọc mật độ quang học ở bước sóng 520 nm bằng dụng cụ thích hợp (4). Nồng độ của thuốc thử phải sao cho tất cả các tocopherol có màu sắc tối đa hoặc gần như tối đa trong khoảng thời gian ngắn (2 phút) trước khi đo;
g) tính đương lượng tocopherol từ các mật độ quang bằng cách dùng hệ số đã được thiết lập cho mỗi tocopherol.
Bảy giai đoạn trên có thể không cần thiết tất cả. Giai đoạn a) hoàn toàn có thể bỏ qua khi mẫu cần kiểm tra là dầu hoặc mỡ tinh khiết. Giai đoạn c) chỉ cần thiết đối với nguyên liệu có khả năng thấp. Giai đoạn d) có thể bỏ qua khi phân tích mẫu có chứa nhiều hơn 5 mg - 10 mg tocopherol trên 1 g dầu.
3 Thuốc thử
Thuốc thử phải đạt chất lượng phân tích
3.1 Dung dịch pyrogalol, 5% m/v trong etanol - chuẩn bị dung dịch này trong ngày cho mỗi lần phân tích.
3.2 Dung dịch kali hidroxit - hoà tan 160 g kali hidroxit trong 100 ml nước cất.
3.3 Ete dietyl
Chú thích - Thông thường, ete được ổn định bằng cách bổ sung một lượng nhỏ chất khử để hạn chế tạo thành peroxit. Các chất khử này không ảnh hưởng đến phép phân tích tocopherol; nó được loại bỏ trong quá trình rửa sau khi xà phòng hoá hoặc trong quá trình hoạt hoá floridin. Tuy nhiên, nếu ete đã để lâu trong phòng thí nghiệm nó có thể chứa peroxit. Các peroxit này có thể dùng phương pháp Werner (II) để loại bỏ. Lắc 500ml ete trong 6 phút với hỗn hợp của 4 g bạc nitrat trong 30 ml nước và 2 g natri hidroxit trong 50 ml nước, để yên cho tách pha, gạn bỏ và sử dụng ete không cần chưng cất.
3.4 Etanol tuyệt đối: Làm sạch bằng cách chưng cất trong dụng cụ hoàn toàn bằng thuỷ tinh với kali permanganat và kali hidroxit (1 g và 2 g, tương ứng trên 1lít etanol).
3.5 Etanol loãng: Cho 75 phần thể tích etanol tuyệt đối vào 25 phần thể tích nước cất.
3.6 Floridin XS : Được chọn để dùng trong xác định tocopherol. "Floridin XS để xác định vitamin E", hoặc loại tương đương.
3.7 Thiếc (II) clorua.
3.8 Axit clohidric, d = 1,18.
3.9 Benzen.
3.10 Xyclohexan.
3.11 Kẽm oxit.
3.12 Amoni hidroxit, d = 0,880.
3.13 Amoni cacbonat.
3.14 Natri floresxein, 0,1% m/v dung dịch trong nước.
3.15 Giấy lọc, loại Whatman No 1 "dùng cho sắc ký", hoặc loại tương đương, cỡ 51,2 cm x 46,4 cm (22 1/2 inch x 18 1/4 inch).
3.16 Dung dịch parafin lỏng, 3% m/v dung dịch parafin lỏng, British Pharmacopoela, hoặc loại tương đương.Trong xăng nhẹ, có nhiệt độ sôi từ 60oC đến 80oC.
3.17 Dung dịch sắt (III) clorua ngậm 6 phân tử nước, 0,2% m/v trong etanol. Dung dịch này rất dễ bị oxy khử bởi ánh sáng, phải chuẩn bị trực tiếp trong chai hổ phách để bảo quản luôn. Không để chai này ngoài ánh sáng ban ngày và bọc trong giấy đen hoặc sơn chai màu đen.
3.18 Dung dịch dipyridin, 0,5% m/v dung dịch 2 : 2 - dipyridin trong etanol.
3.19 Phenonphtalein, dung dịch etanol, 1% m/v, được trung hoà trước khi sử dụng.
4 Thiết bị, dụng cụ
4.1 Cột sắc ký
Như mô tả trong 5.3.1.
4.2 Dụng cụ sắc ký hai chiều
Như mô tả trong 5.4.3.
4.3 Dụng cụ thuỷ tinh đặc biệt : pipet tự động, dung tích 3,5 ml, pipet Trenner, xi lanh Agla micromet, ống sắc ký khí dùng cho cột floridin và máy phun bằng thuỷ tinh để phun sắc phổ màu, hoặc có thể dùng loại tương đương.
4.4 Quang phổ kế hoặc máy so màu quang điện thích hợp cho việc đọc mật độ quang ở bước sóng 520 nm.
5 Cách tiến hành
5.1 Xà phóng hoá dầu hoặc mỡ
Cân chính xác khoảng 1 g dầu hoặc mỡ cho vào bình cầu đáy tròn (có dung tích thích hợp là 50 ml - 150 ml). Thêm 4 ml dung dịch pyrogalol, đun nóng trên nồi cách thuỷ, sử dụng bộ sinh hàn hồi lưu nhỏ gắn vào chỗ nối thuỷ tinh mài. Khi hỗn hợp sôi, tháo bộ sinh hàn và thêm 1 ml dung dịch kali hidroxit.
Đặt lại bộ sinh hàn vào, ngâm bình cầu vào trong nồi cách thuỷ đang sôi, và đun mạnh trong 3 phút, thỉnh thoảng lắc.
Lấy bình cầu ra khỏi nồi cách thuỷ, để nguội và thêm 20 ml nước cất. Chiết chất không xà phòng hoá bằng ete dietyl ba lần, dùng khoảng 25 ml cho mỗi lần chiết. Muốn tách pha nhanh, thêm 1 hoặc 2 ml etanol. Nếu các nhũ tương tồn tại bền, tham khảo các chú thích ở 7.1. Rửa các phần chiết ete hỗn hợp với 20 ml nước cất cho đến khi trung hoà với phenolphtalein, trước hết tránh lắc mạnh. Thông thường cần rửa ba hoặc bốn lần. Chuyển dung dịch ete vào bình cầu đáy tròn, và loại bỏ ete bằng cách cho bay hơi dưới dòng khí nitơ, hoặc dưới áp suất thấp, trong khi vẫn làm ấm dung dịch trên nồi cách thủy. Làm khô lượng còn lại, nếu cần, bằng cách thêm một ít etanol tinh khiết và benzen và cho bay hơi lại. Không làm khô dung dịch bằng magiê sunfat hoặc natri sunfat, bởi vì các hoá chất này có thể chứa các vết của sắt. Hoà tan phần cặn khô trong 5 ml benzen đối với giai đoạn 5.3 (hoặc trong metanol đối với giai đoạn 5.2 nếu cần để loại bỏ sterol).
5.2 Loại bỏ sterol
Rất ít khi phải loại bỏ sterol trước khi chạy sắc ký khí. Tuy nhiên, với các chất chiết của một số nguyên liệu, việc tách kém hiệu quả trên giấy có thể do sự có mặt của sterol.
Hoà tan phần không xà phòng hoá trong metanol sôi và chuyển 12 ml dung dịch này vào ống ly tâm dung tích 15 ml. Làm lạnh đến khoảng -10oC trong buồng thích hợp, loại bỏ chất kết tủa bằng cách cho ly tâm trong cốc ly tâm trước đó đã được làm lạnh và rót lớp chất lỏng phía trên vào bình cầu. Hoà tan lại sterol đã kết tủa trong 5 ml metanol nóng và lặp lại quá trình này 2 lần. Cho bay hơi dung dịch metanol hỗn hợp đến khô dưới áp suất giảm. Hoà tan cặn này trong 5 ml benzen.
5.3 Tách bằng cột Floridin
5.3.1 Thiết bị: Các cột được chuẩn bị trong loại ống hấp thụ sắc ký thông thường, có đường kính trong từ 12 mm đến 14 mm và dài khoảng 160 mm - 200 mm. Các ống không được có kích thước nhỏ hơn các kích thước chỉ ra trên đây.
5.3.2 Chuẩn bị cột: Trộn 5 g floridin và 0,5 g thiếc (II) clorua với 20 ml axit clohidric, đun đến sôi.
Khuấy liên tục, rót chất nhão này vào ống sắc ký một cách liên tục, sao cho floridin lắng xuống đều.
Sau khi chất lỏng chảy qua, rửa cột liên tục năm lần, mỗi lần 5 ml etanol, và sau đó năm lần, mỗi lần 5 ml benzen.
5.3.3 Sắc ký cột: Cho dung dịch benzen từ giai đoạn 5.1 (hoặc 5.2) chảy qua cột floridin đã chuẩn bị.
Rửa cột bảy lần mỗi lần rửa bằng 5 ml benzen, thực hiện việc rửa trong thời gian không dưới 45 phút.
Có thể sử dụng nitơ nén hoặc hút nhẹ để làm nhanh việc chuẩn bị cột và sắc ký, với điều kiện là quá trình sau không dưới 45 phút. Nếu cần xác định các chất khử, có thể lấy phần chất lỏng ở giai đoạn này. Bảo quản dung dịch benzen qua đêm trong tủ lạnh.
5.4 Sắc ký giấy
5.4.1 Chuẩn bị dung dịch kẽm amin: Hoà tan 16 g kẽm oxit và 25 g amoni cacbonat trong hỗn hợp 150 ml amoni hidroxit và 600 ml nước cất. Thêm 5 ml dung dịch natri fluorexsein. Dung dịch kẽm amin này bền (ổn định) trong chai đậy kín.
5.4.2 Chuẩn bị giấy tẩm kẽm cacbonat: Vì các dung môi chuyển động theo hướng thẳng đứng của giấy lọc nhanh hơn so với chuyển động ngang, nên tất cả các giấy nên được định hướng giống nhau.
Qui trình mô tả dưới đây đảm bảo cho tất cả các giấy được phủ đều ít nhất là phần làm việc, phần viết số liệu cho phía đầu hướng máy của giấy. Cắt từ các tờ giấy rộng thành bốn phần bằng nhau theo hình 1. Rót dung dịch kẽm amin vào một đĩa rộng. Nhúng từng tờ vào dung dịch này trong khoảng 5 cm của một cạnh ngắn, treo tất cả các tờ này để cho ráo nước ở nhiệt độ phòng trong vòng 1 giờ. Giấy sắc ký khí được cuộn hình êlíp. Làm khô các tờ giấy treo đứng với góc 95o - 100o trong 3 giờ trong tủ sấy có hoặc không cần lưu thông khí cưỡng bức. Lấy giấy ra, cắt mỗi tờ 20 cm2 phần đã tẩm kẽm và viết ngày tháng vào gần mép GH. Giấy đã chuẩn bị có thể được bảo quản nơi khô ráo trong vài tuần, vì chúng dễ bị hỏng do ẩm.
Dùng bút chì kẻ nhẹ các đường mảnh trên mỗi tờ như hình 1. Đục lỗ ở các góc, nếu cần, để dùng trên khung.
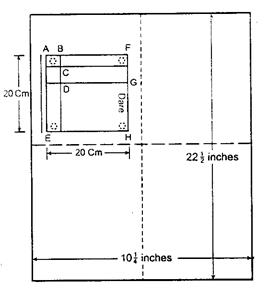
Hình 1 - Kích thước tờ giấy đã tẩm kẽm cacbonat.
Cần chú ý bảo vệ hướng máy của giấy ( như đã chỉ rõ trên bao bì). AB =BC = 2 cm, CD =3 cm. Không cần phải sao chép lại các chữ cái, chúng chỉ dùng ở đây để giải thích cho rõ.
Chú thích 1 - Một vài mẻ giấy sắc ký có chứa chất khử làm tăng giá trị mẫu trắng. Có thể loại bỏ nó bằng cách chiết giấy liên tục bằng metanol nóng trong thiết bị Soxhlet hoặc chiết và gạn trong ống đong.
Chú thích 2 - Giấy kẽm cacbonat có đủ hoạt tính nhờ phơi khô qua đêm ở không khí (với điều kiện là độ ẩm tương đối không quá cao) thay cho dùng tủ sấy, nhưng sấy bằng tủ sấy làm cho giấy có hoạt tính cao hơn.
5.4.3 Thiết bị, dụng cụ: sắc ký hai chiều được thực hiện bằng phương pháp dung môi đi lên và nên tiến hành trong bình thuỷ tinh đủ rộng để chứa các tờ giấy có kích cỡ 20 cm x 20 cm để theo phương thẳng đứng. Tốt nhất là dùng mỗi một bình cho mỗi chiều. Cách khác, cả hai có thể thực hiện trong cùng một bình, trước khi cho chạy chiều thứ hai cần phải thay dung môi. Các thành bên trong của bình phải được lót một lớp giấy lọc đã được làm bão hoà với pha động. Các bình phải có nắp đậy kín khí, phải bảo vệ tránh ánh sáng mạnh.
Khi có ít hơn bốn tờ chạy cùng nhau, và với điều kiện là sắc phổ cần kiểm tra sau này dưới tia cực tím (phương pháp a) của 5.4.6 dưới đây), chúng có thể được giữ bằng đũa thủy tinh, được sắp xếp sao cho các tờ được treo đều đặn, có các mép nhúng vào dung môi. Tuy nhiên, thuận tiện hơn là sử dụng một vài loại khung sắc ký hai chiều để giữ giấy. Nếu vị trí các vết cần phải phun (phương pháp b) của 5.4.6), hoặc có nhiều hơn 4 tờ chạy cùng với nhau, cần thiết phải dùng đến khung. Việc sử dụng khung như thế cho phép thao tác các tờ giấy bằng tay một cách dễ dàng và cùng một lúc trong suốt các giai đoạn khác nhau của việc tách sắc đồ và đảm bảo rằng sắc đồ được đồng nhất và có thể tái lập. Các khung như thế được mô tả trong (3) và (10) và thích hợp nhất là làm bằng nhôm. Các khung có bán sẵn.
5.4.4 Sắc ký chiều thứ nhất- cho bay hơi dung dịch ở 5.3.3 đến khô dưới áp suất giảm hoặc trong khí nitơ. Hoà tan phần khô còn lại trong 0,5 ml - 3 ml benzen trong bình cầu đậy kín, cho dung dịch chứa 0,5 mg - 2,0 mg tocopherol trong 1 ml, nếu có thể (dung môi phân cực không dùng để chuẩn bị dung dịch này). Cho chạy dung dịch tocopherol, bằng cách thêm riêng rẽ từ 10 μl đến 20 μl theo dải hẹp đi qua đường xuất phát CD (hình 1), sao cho có mặt tất cả các tocopherol, mỗi loại từ 5 àg đến 30 àg. Tổng dung dịch không chứa nhiều hơn 100 àg các tocopherol. Dùng ba tờ sao cho mỗi mẫu và tờ thứ tư cho mẫu trắng. Việc cho thêm dung dịch nên dùng ống mao dẫn thuỷ tinh đầu nhỏ, được chia vạch theo khối lượng, bằng pipet 10 μl, bằng pipet Trenner có đầu cong hoặc bằng xi lanh micromet
Agla (xem 4.3). Điều quan trọng là áp dụng dung dịch theo dải đều đặn.
Rót đủ benzen 30% v/v trong xyclohexan vào bình sắc ký thứ nhất để có độ sâu khoảng 1/2 cm đến 1 cm. Giữ giấy thử và giấy thử mẫu trắng có ghi ngày phía trên và chia cạnh AE được nhúng vào dung môi. Để giấy trong bình cho đến khi mặt trước của dung môi di chuyển được khoảng 15 cm. Thông thường mất khoảng 1 giờ.
5.4.5 Sắc ký chiều thứ hai: Nếu không sử dụng khung, lấy từng tờ giấy ra khỏi bình thứ nhất nhất và nhúng từng tờ vào dung dịch parafin lỏng, để cạnh EH xuống đáy đến 1/2 cm của đường DG. Nếu dùng khung, lấy giấy ra khỏi bình thứ nhất, và để cạnh EH xuống phía đáy, nhúng tất cả bộ vào bể parafin lỏng đến 1/2 cm của đường DG. Lấy giấy ra khỏi dung dịch parafin, để ráo nước cho xăng nhẹ vào không khí để làm khô. Sau đó đặt giấy vào tank thứ hai có cạnh AF chỉ mới nhúng vào catanol 75% làm pha động. Cho chạy giấy từ 2 giờ đến 3 giờ hoặc cho đến khi mặt trước dịch đến được 4 cm đến 5 cm từ đỉnh của giấy. Lấy giấy ra khỏi bình, làm khô bằng luồng khí nitơ hoặc không khí.
5.4.6 Loại bỏ các vết, chấm khỏi sắc đồ. Lấy giấy ra khỏi khung nếu có dùng khung. Sử dụng một hoặc cả hai phương pháp đối với vị trí các chấm và lấy ra để phân tích. Phương pháp a) là thích hợp hơn, nhưng phương pháp b) có thể sử dụng được khi không có đèn tia cực tím. Thậm chí phương pháp a) được sử dụng cũng rất tốt để phun một trong các tờ giấy như phần đầu của phương pháp b) để khẳng định vị trí của vết khử.
a) Kiểm tra các tờ giấy khô trong phòng tối dưới ánh sáng cực tím, không để đèn gần giấy quá 10 cm. Các vết tocopherol có thể nhìn thấy như các đốm đen trên nền phát huỳnh quang, dễ dàng phát hiện được nhỏ hơn 1 àg (xem hình 2). Đánh dấu các vết bằng cách khoanh vòng dùng bút chì cứng càng nhanh càng tốt với mỗi vết một vòng tròn. Lấy giấy ra, cắt các vết đã đánh dấu bằng kéo sắc, cắt trong đường kẻ bút chì. Cuộn các mảnh đã cắt cho vào ống đong và cho từng cái vào ống nghiệm đã đánh số (đo khoảng 10 cm x 1,5 cm và đậy bằng nút mài) có chứa 3 ml etanol và 0,5 ml dung dịch dipyridin. Đánh dấu sắc đồ của mẫu trắng tương ứng, và tương tự cắt các vùng của mẫu trắng.
Chú thích 1 - Thích hợp với mục đích này là đèn phát xạ với giải sóng khoảng 254 nm. Phải cho đèn mới chạy từ 2 giờ hoặc 3 giờ trước khi cho tia cực tím vào vị trí của tocopherol trên giấy. Có thể dùng các nguồn chiếu tia cực tím khác.
Chú thích 2 - Khi số lượng lớn các ống cần nạp, thích hợp là dùng 3,5 ml dung dịch 0,07% m/v 2 : 2 –dipyridin thay cho 0,5 ml dung dịch dipyrindin 0,5% m/v cộng với 3 ml etanol. Dung dịch này thuận tiện là phân phối từ pipet tự động 3,5 ml.
b) Dùng máy phun thuỷ tinh phun dày thuốc thử hỗn hợp (các phần dung dịch sắt (III) clorua và dung dịch dipyridin bằng nhau) lên một trong các tờ giấy thử. Tocopherol là các vết đỏ, có thể khoanh vòng bằng bút chì cứng. Nếu không có đèn tia cực tím thì sử dụng các vết này để tìm vị trí tocopherol trên giấy thử. Loại bỏ các vết đã phun và để biên rộng bằng cách cắt mép ngoài vòng kẻ bút chì, và sử dụng hàng loạt các lỗ để làm khuôn mẫu cho các giấy thử khác và giấy thử trắng.
Cách khác, đánh dấu giấy đã phun lên trên tờ giấy mỏng, và dùng tờ này làm mẫu. Đánh dấu các vị trí của tocopherol, cắt các vùng này từ giấy thử và giấy mẫu trắng, cho chúng vào các ống nghiệm chứa dung dịch diyridin, như phương pháp a) trên đây.
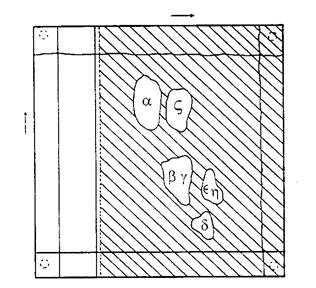
Hình 2 - Bản sao chụp kích cỡ 1/3 của toàn bộ khổ giấy
Điểm đánh dấu cho thấy vị trí của vùng Tocopherol sao chép sắc ký khổ đôi. Vùng tô đậm cho thấy phần giấy được tẩm parafin sau khi chạy trong chiều thứ nhất. Những đường kẻ sóng cho thấy mức gần đạt đến mặt trước của dung môi.
5.5 Vị trí của các vết trên sắc đồ
Bẩy Tocopherol tách rời như trong hình 2. Phụ thuộc vào vật liệu cần phân tích, một vết hoặc một số vết có thể nhìn thấy được. Dẫu sao bằng phương pháp này không tách được β và γ tocopherol cũng như ε và η tocopherol, hướng dẫn về cách phân biệt chúng được đưa ra trong phần chú thích dưới đây.
Các vết khác hiện ra trên giấy thông thường được phân biệt với tocopherol bằng các vị trí của chúng.
Cần nhấn mạnh rằng, phụ thuộc vào độ tinh khiết của mẫu và các tỷ lệ tương đối của các tocopherol khác nhau có mặt có thể xuất hiện một số chuyển động dị dạng của các vết. Các giá trị tuyệt đối R và RF có thể không cần để ý đến, tuy nhiên việc phân tách xuất hiện theo mẫu chung trong hình 2, giai đoạn tiếp theo có thể thực hiện được. Nếu không thoả mãn việc phân tách, hoặc khó nhận biết, tham khảo các chú thích về qui trình (điều 7).
Chú thích - Việc phát hiện γ -, η - và δ - tocopherol bằng o - dianisidin diazo hoá.
Natri cacbonat : Dung dịch 5% m/v trong nước.
o - dianisidin diazo hoá: Hoà tan 0,5 g O - dianisidin dihidro clorua trong 60 ml nước. Thêm 6 ml axit clohidric, d = 1,18 và sau đó thêm 12 ml dung dịch natri nitrit 5% m/v trong nước. Trộn kỹ. Sau 5 phút, thêm 12 ml dung dịch urê 5% m/v.
Dùng natri cacbonat phun dày lên một trong các tờ giấy thử (nên cho chạy thêm giấy nếu nghi ngờ có mặt γ -, η - và δ - tocopherol, và sau đó dùng máy phun thủy tinh phun O - dianisidin diazo hoá .
Các tocopherol có thể nhận biết được bằng các màu sắc : γ - màu xanh da trời chuyển thành màu chàm, η - màu đỏ ánh nâu chuyển thành màu đỏ tía, δ - màu nâu đỏ chuyển sang màu đỏ tía. Các màu này có thể bền khi rửa giấy trong nước sau khi phun.
Việc hiện màu hoặc ở vị trí của γ - hoặc η - không ngoại trừ việc có mặt õ- hoặc ε - tocopherol tương ứng.
5.6 Xác định bằng so màu
Xoay nhẹ các ống nghiệm đã đậy nắp, mỗi ống chứa 3,5 ml dung dịch dipyridin trong etanol (3.18) và cho giấy trượt trong vài giây. Chuyển sang phòng tối, tiến hành xác định tiếp trong ánh sáng nhân tạo mờ. Bằng pipet phân phối nhanh, thêm 0,5 ml dung dịch sắt (III) clorua (3.17) vào một trong các dung dịch, lắc ống đã đậy nắp một lúc và sau đó chuyển lượng chứa trong ống sang cuvet thuỷ tinh của máy đo quang phổ, có chiều dài 1 cm. Đúng 2 phút sau khi thêm sắt (III) clorua, đo mật độ quang ở bước sóng 520 nm dựa vào cuvet tương tự có chứa etanol. Lặp lại qui trình này với mỗi ống nghiệm. Lấy số đọc thu được từ ống nghiệm tương ứng trừ đi số đọc của mỗi "mẫu trắng" cho số đọc "mật độ quang thực". Nhân số đọc của mật độ quang thực này với hệ số quang phổ cho số microgam tocopherol trong vết cắt của tocopherol cần đo.
5.7 Mẫu trắng
Dung dịch chứa tocopherol được đo gián tiếp dựa theo dung dịch thử mẫu trắng. Có thể chỉ thu được độ chính xác cao nhất, do đó, nếu được thừa nhận chắc chắn rằng phản ứng mẫu trắng của thuốc thử hỗn hợp giống hệt trong cả hai ống "thử mẫu trắng" và ống "thử". "Thử mẫu trắng" có hai phần, đó là (i) thu được từ vật liệu khử còn lại trong giấy và (ii) phản ứng giữa dipyridin và vết của sắt (II) trong sắt (III) clorua. Phần (i) lượng mật độ quang khoảng 0,010, phần (ii) có thể bị giảm xuống khoảng 0,050 do phòng ngừa, như vậy việc chuẩn bị và lưu giữ dung dịch sắt (III) clorua nơi tối và tuân thủ tính sạch sẽ trong việc sử dụng pipet để lấy sắt (III) clorua. Sắt (III) clorua sẽ bị chuyển thành sắt (II), do đó dung dịch này không nên để dưới ánh sáng ban ngày trong chai thuỷ tinh trong suốt. Tổng số giá trị mẫu trắng có thể bị giảm xuống khoảng 0,060 - 0,080. Mẫu trắng cho mật độ quang trên 0,100 dường như không bền và nên xem xét lại. Nếu như vẫn tiếp tục cho giá trị mẫu trắng cao, và khử được các dạng nhiễm bẩn, tốt nhất là chuẩn bị dung dịch axit cromic, tráng kỹ với nước cất và sấy khô.
6 Tính toán và biểu thị kết quả
Lượng của mỗi một tocopherol của sản phẩm, tính bằng micro gam trên 1 gam sản phẩm, theo công
thức sau:
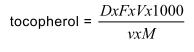
trong đó
V là thể tích của benzen dùng để chuẩn bị dung dịch dùng cho sắc ký giấy, tính bằng mililit;
v là thể tích trên vết trên giấy, tính bằng microlit;
D là mật độ quang thực;
F là hệ số quang phổ cho 4 ml. Các hệ số F nên dùng :
α - tocopherol 98;
β - tocopherol 96;
γ - tocopherol 90;
δ - tocopherol 75;
ε - tocopherol 96;
ς - tocopherol 94;
η - tocopherol 88.
Các β - và ε - tocopherol có thể xác định được khi các vết trong các vị trí tương ứng của chúng cho thấy không màu khi phun bằng thuốc thử dianisidin (xem chú thích của 5.5). Tuy nhiên, nếu phản ứng thuốc thử dianisidin cho thấy sự có mặt của γ - hoặc η - tocopherol thì người phân tích có thể cho rằng không có mặt của β - và ε - tocopherol hoặc thử lại phép phân tích khác về bốn chất bằng tách quang phổ của dẫn xuất nitroso, như mô tả của Marcinkiewicz và Green (7). Hệ số của γ - và η – tocopherol có thể được sử dụng mặc dù có thể có mặt β - hoặc ε - tocopherol, hoặc có mặt cả hai nhưng không phát hiện được.
Kết quả được biểu thị bằng miligam của mỗi một tocopherol trên kilogam sản phẩm.
7 Các lưu ý trong khi tiến hành
Có thể gặp phải một số khó khăn khi thực hiện các pha phân tích khác nhau. Chúng gồm các mô tả và các ý kiến được đưa ra dưới đây:
7.1 Xà phòng hoá và chiết xuất
Sau khi kết thúc xà phòng hoá, việc chiết các tocopherol thành ete phải được tiến hành càng nhanh càng tốt, mục đích phải đạt được là tách hai pha ở từng giai đoạn phải nhanh và rõ ràng. Một vài thể nhũ hình thành, thông thường làm tan chúng bằng cách thêm vài mililit etanol. Nếu chúng vẫn còn, có thể gây ra do không tuân thủ nghiêm ngặt các chỉ dẫn, các tỷ lệ thuốc thử không đúng và cho quá nhiều etanol thậm chí lại làm tăng sự hình thành thể nhũ. Không cần thiết phải lắc mạnh ở bất kỳ giai đoạn nào và nên tránh điều này, đặc biệt đối với một vài sản phẩm giàu tác nhân tạo nhũ.
7.2 Sắc ký Floridin
Thỉnh thoảng có thể thấy bể floridin có tốc độ lọc quá chậm đối với sắc ký cột. Điều này khó khắc phục được, thực tế đơn giản nhất là thay mẻ mới.
Carotenoit, retinol và các dẫn xuất của nó, sterol và một số các chất khác bị hút bám vào floridin, tạo dải màu xanh lá cây, xanh da trời hoặc dải đỏ. Đôi khi, khi nước rửa giải có màu vàng hoặc dải màu chạm tới đáy của cột, sắc ký giấy tiếp có thể không thoả mãn. Điều này có thể do cột phát triển quá nhanh, hoặc sử dụng etanol đã dùng để chuẩn bị có lẫn nước, hoặc có thể cột đã bị quá tải, mẫu của dầu đã bị xà phòng hoá quá nhiều.
"Hoạt tính" hoặc khả năng hấp thụ của cột phụ thuộc chính vào độ mịn của các hoạt tính của hạt và khả năng mất nước khi rửa bằng etanol. Các điều kiện đưa ra trong phương pháp này tạo cho cột có hiệu lực, phù hợp để loại bỏ phần lớn lượng chất gây nhiễu thông thường. Đôi khi chậu sắc ký được hoạt hoá cao, thậm chí 35 ml benzen không đủ để tách được tất cả δ - tocopherol, là loại tocopherol bị hấp thụ mạnh nhất, nếu như vậy, tăng lượng benzen lên đến 40 ml hoặc thậm chí 45 ml.
7.3 Sắc ký giấy
Kỹ thuật thăm dò : Phân tích viên lần đầu thực hành phương pháp này sẽ tìm ra phương án tốt cho sắc ký đầu tiên dung dịch α - tocopherol và sau đó dung dịch chứa hỗn hợp tocopherol đã biết trước.
Các dung dịch chuẩn tốt nhất là được chuẩn bị trong benzen và, để thuận tiện, nên chứa khoảng 1 mg mỗi một tocopherol trong 1 ml. Có thể lưu giữ chúng trong tủ lạnh mà không bị hư hỏng. Khi phân tích mẫu dầu có hàm lượng tocopherol không thể đoán trước thông thường ở bước 5.4.4 sử dụng lượng dung dịch benzen khác nhau cho một trong hai hoặc ba tờ giấy. Khi chạy sắc ký, sau khi tiến hành một thời gian ngắn, mỗi tocopherol với một lượng tối ưu có thể được phát hiện một cách dễ dàng. Đôi khi cũng có ích khi xem xét dung dịch chưa biết bằng cách cho chạy sơ bộ trên dải giấy kẽm cacbonat một chiều hoặc, rất ít khi chạy trên dải phủ parafin. Việc chạy sơ bộ này cho biết thông tin về sự có mặt của tocopherol và việc tách chúng. Phải nhấn mạnh rằng, dùng giấy một chiều chỉ để hướng dẫn.
Sử dụng giải vệt: Đôi khi chất béo có chứa các tỷ lệ tocopherol không rõ hoặc lượng lớn các tạp chất chưa rõ. Các nguyên liệu (sản phẩm) như thế có thể tạo ra sắc đồ không rõ ràng, trên đó các vết chồng chéo nhau gây khó khăn cho việc nhận biết các tocopherol theo vị trí đơn lẻ. Nếu điều này xuất hiện, có thể sử dụng giấy sao, trên đó đã bổ sung các lượng nhỏ ỏ-, γ -, δ - tocopherol để làm vết. Nên chuẩn bị như sau : dùng micro pipet thêm khoảng 10 àg mỗi một tocopherol cần phát hiện, dọc theo đường CD của giấy sắc ký. Dung dịch tocopherol trong benzen như mô tả ở trên, là thích hợp với mục đích này, 10 μl là lượng cần thiết để cho thêm vào giấy. Sau đó bổ sung dung dịch thử theo cách thông thường. Điều quan trọng là các vết được thêm vào đầu tiên, đảm bảo chúng tan đều trong lượng dung dịch thử nhỏ. Chuẩn bị giấy thử, bỏ qua các vết, và cho cả hai tờ chạy cùng nhau. Các tocopherol sẽ di chuyển vào các vị trí giống như trong dung dịch thử khi phân biệt chúng với nhau.
Sắc đồ không đạt yêu cầu : Nếu giấy đã triển khai vẫn còn ướt bởi dung môi lỏng, việc quan sát các vết dưới đèn cực tím là không đạt yêu cầu.
Nếu các tocopherol dường như dịch chuyển quá xa trong chiều thứ nhất hoặc chúng phân tách không rõ ràng, có thể do giấy đã để quá lâu, chất hấp thụ kẽm bị hỏng theo thời gian, đặc biệt trong môi trường không khí ẩm. Nếu các bình nông và không được lót giấy lọc, có thể làm bay hơi quá nhiều dung môi từ phía mặt trước, điều này làm cho chạy nhanh hơn và các dải đo phân tách kém.
Cách khác, dung môi trong bình thứ nhất có thể cần phải thay đổi. Người ta tìm thấy rằng, trong các điều kiện trong một số phòng thí nghiệm thu được, 25% benzen trong xyclohexan là đủ. Nếu các tocopherol xuất hiện không đủ để di chuyển, có thể cần phải tăng benzen lên đến 35%. Có ý kiến cho rằng 0,5% etanol trong xyclohexan cũng giống như các hỗn hợp benzen - xyclohexan cho sắc đồ rõ, nhưng tỷ lệ phần trăm này hơi khó bảo quản trong bình. Nếu việc di chuyển của tocopherol trong chiều thứ hai quá khác thường, có thể dung môi trong bình thứ hai này đã bị hỏng, cần phải thay dung môi.
Nếu như giấy cho thấy các vết có hình dáng không dự kiến không rõ ràng, hoặc ở các vị trí "không đúng", có thể là do giấy bị quá tải, có thể vì tocopherol, nhưng có khả năng hơn là do các chất lỏng khác. Các vết hấp thụ tia cực tím và không khử sắt (III) clorua, cũng như các vết phát huỳnh quang đều không phải là tocopherol. Nếu như trên giấy quan sát thấy các lượng lớn chất gây nhiễu, có thể không kết thúc được quá trình xà phòng hoá hoặc xử lý bằng floridin không đem lại kết quả hoặc cần giai đoạn "loại bỏ sterol".
Khi phân tích chất béo có hàm lượng tocopherol quá thấp (dưới 0,05 mg tocopherol tổng số trong 1 g), trong phép sắc ký giấy gặp hai vấn đề khó khăn, đặc biệt là nếu như chất béo đó được chiết từ các mô động vật nhất định. Thậm chí khi làm sạch theo phương pháp đã nêu (kể cả giai đoạn "tách sterol"), phần tocopherol còn lại có thể chứa hidrocacbon và chất trơ khác. Do hàm lượng tocopherol trong mẫu thấp, phần chiết phải bổ sung vào đường khởi điểm của giấy là một lượng không những làm cản trở khổ thứ nhất vài centimet theo chiều dọc của giấy mà còn hình thành hàng rào chắn dọc theo đường CD. Tocopherol có thể bị giữ lại ở rào chắn, nếu thế việc tách sẽ không tiến hành được. Đôi khi hiện tượng này dẫn đến kẻ sọc trên một diện tích rộng của giấy. Có một cách đã chứng minh thành công có liên quan đến các khó khăn này đó là sửa đổi quá trình làm sạch floridin. Sau khi chuẩn bị cột thông thường, kể cả rửa năm lần, mỗi lần 5 ml benzen, cho 25 ml xăng nhẹ (40o đến 60o) chảy qua cột. Hoà tan tocopherol còn lại ở bước 5.1 (hoặc, thông thường ở bước 5.2) trong 5 ml xăng nhẹ và cho dung dịch này lên đỉnh cột. Phát triển cột với 25 ml xăng nhẹ. Loại bỏ chất lọc có chứa các chất gây nhiễu, và rửa giải tocopherol thông thường bằng 30 ml benzen.
7.4 Hệ số quang phổ
Các hệ số nêu trong phương pháp này thu được là kết quả nghiên cứu rất công phu của một số phòng thí nghiệm. Việc xác định tocopherol bằng phương pháp oxi hoá sắt (III) clorua dipyridin có hơi bị ảnh hưởng do các điều kiện thay đổi từ phòng thí nghiệm này sang phòng thí nghiệm khác, qui trình này hạn chế phần lớn các ảnh hưởng gây ra sai lệch. Những sai lệch ở đây về nhiệt độ, độ ẩm và độ tinh khiết của thuốc thử thông thường không được kiểm tra, trong bất kỳ trường hợp nào, các hệ số cũng sai lệch nhau không quá 2% giữa các phòng thí nghiệm. Nếu phân tích viên mong muống có kết quả chính xác để xác định bất kỳ hệ số nào trong phòng thí nghiệm của mình, người đó nên tìm đủ mẫu tocopherol tinh khiết và hàng ngày tiến hành vài phép xác định một lúc ở hai hoặc ba mức tocopherol khác nhau. Trong thực tế, người phân tích này phải rất quan tâm đến việc xác định chính xác α - tocopherol.
7.5 Các phòng ngừa chung
Tocopherol là các chất bền vừa phải. Phần lớn chúng dễ bị oxy hoá khi có mặt các vết kiềm, và cần phải thận trọng và luôn phải thực hiện nhanh trong giai đoạn xà phòng hoá. ánh sáng mạnh, nhiệt độ cao quá bình thường và sự có mặt của ozon hoặc amoniac trong không khí ảnh hưởng đến tocopherol trong quá trình sắc ký giấy. Không nên để sắc đồ khô lâu quá mức cần thiết. Về thông tin cần thiết cho sắc ký giấy, kể cả về độ sạch khi vận chuyển giấy, tham khảo Mitchell (12).
Nếu phép phân tích không kết thúc được trong ngày, nên ngừng qui trình sau giai đoạn xà phòng hoá và chiết, hoặc sau khi xử lý floridin, và bảo quản dung dịch benzen trong tủ lạnh.
TÀI LIỆU THAM KHẢO
1) Analytical Methods Committee, Report prepared by the Vitamin - E Panel : The Determination of Tocopherol in Oils, Foods and Feeding Stuffs. Analyst, (1959) 84, 356 - 372;
2) Bratzler, J. WW. Loosli,J. K. Krukovsky, V.N., and Maynard, L.A., J. Nutrition, (1950) 42, 59;
3 ) Datta, S. P., Dent, C.E., and Harris, H., Biochem. J., (1950) 46, xiii;
4 ) Eggitt, P.W.R., and Ward, L.D., J. Sci. Food Agric., (1953) 4, 569;
5 ) Emmerie, A., and Engel C., Rec. Trav. Chim. Pays - Bas, (1939) 58, 283;
6 ) Green, J. , J. Sci. Food Agric., (1958) 9, 801;
7 ) Marcinkiewicz, S., and Green, J., Analyst, (1959) 84, 304;
8 ) Quaife, M. L., and Harris, P.L., Anal. Chem., (1948) 20, 1221;
9 ) Tosic, J., and Moore, T., Biochem. J., (1945) 39, 498.
10 ) Watt, P.R., and Green, J., Chem. and Industry, (1959) 49, 1543 - 1545;
11 ) Werner, E.A., Analyst, (1933) 58, 335;
12 ) Mitchenll, L.C., J. Ass. Off. Agric. Chem., (1957) 40, 999.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 6563:1999 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 6563:1999 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 6563:1999 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 6563:1999 DOC (Bản Word)