- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 7686:2007 ISO 16654:2001 - phát hiện Escherichia coli O157 vi sinh vật trong thực phẩm
| Số hiệu: | TCVN 7686:2007 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Thực phẩm-Dược phẩm , Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
26/10/2007 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 7686:2007
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 7686:2007
TCVN 7686:2007
ISO 16654:2001
VI SINH VẬT TRONG THỰC PHẨM VÀ THỨC ĂN CHĂN NUÔI - PHƯƠNG PHÁP PHÁT HIỆN ESCHERICHIA COLI O157
Microbiology of food and animal feeding stuffs - Horizontal method for the detection of Escherichia coli O157
Lời nói đầu
TCVN 7686:2007 hoàn toàn tương đương với ISO 16654:2001;
TCVN 7686:2007 do Ban kỹ thuật tiêu chuẩn TCVN/TC/F13 Phương pháp phân tích và lấy mẫu biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
Lời giới thiệu
Do tính đa dạng của thực phẩm và thức ăn chăn nuôi nên phương pháp này có thể không thích hợp đến từng chi tiết cho từng sản phẩm cụ thể. Trong trường hợp này, có thể sử dụng các phương pháp khác đặc trưng cho từng sản phẩm, nếu hoàn toàn chỉ vì lý do kỹ thuật. Tuy nhiên, cần cố gắng áp dụng phương pháp này khi có thể.
Khi tiêu chuẩn này được soát xét thì cần phải tính đến mọi thông tin liên quan đến phạm vi mà phương pháp đếm đĩa này phải tuân theo và các nguyên nhân gây sai lệch so với phương pháp trong trường hợp các sản phẩm cụ thể.
Việc hài hòa các phương pháp thử có thể không thực hiện được ngay và đối với một vài nhóm sản phẩm có thể tồn tại các tiêu chuẩn quốc tế và/hoặc tiêu chuẩn quốc gia mà không phù hợp với tiêu chuẩn này. Trong trường hợp có sẵn tiêu chuẩn cho sản phẩm cần thử nghiệm thì phải tuân theo tiêu chuẩn đó. Thông thường khi các tiêu chuẩn như thế được soát xét, thì chúng phải được sửa đổi để phù hợp với tiêu chuẩn này, sao cho cuối cùng chỉ còn các sai lệch với phương pháp đếm đĩa này là các lý do kỹ thuật được thừa nhận.
VI SINH VẬT TRONG THỰC PHẨM VÀ THỨC ĂN CHĂN NUÔI - PHƯƠNG PHÁP PHÁT HIỆN ESCHERICHIA COLI O157
Microbiology of food and animal feeding stuffs - Horizontal method for the detection of Escherichia coli O157
CẢNH BÁO - Escherichia coli O157 có thể gây một số bệnh nguy hiểm và có liều lây nhiễm thấp. Khả năng lây nhiễm trong phòng thử nghiệm đã ghi nhận.
Để đảm bảo an toàn cho nhân viên phòng thử nghiệm, phương pháp thử này phải được nhân viên có kinh nghiệm thực hiện sử dụng kỹ thuật thực hành phòng thử nghiệm tốt và tốt nhất là tiến hành trong thiết bị có khả năng bảo vệ. Phải tuân thủ các quy định an toàn có liên quan.
Hết sức thận trọng khi hủy bỏ tất cả các vật liệu đã bị lây nhiễm.
1. Phạm vi áp dụng
Tiêu chuẩn này mô tả phương pháp phát hiện Escherichia coli nhóm huyết thanh O157.
Tiêu chuẩn này có thể áp dụng cho các sản phẩm thực phẩm hoặc thức ăn chăn nuôi như đã nêu trong phần lời giới thiệu.
2. Tài liệu viện dẫn
Các tài liệu viện dẫn sau là rất cần thiết cho việc áp dụng tiêu chuẩn. Đối với các tài liệu viện dẫn ghi năm ban hành thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm ban hành thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi.
TCVN 6507-1 (ISO 6887-1), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử, dung dịch huyền phù ban đầu và các dung dịch pha loãng thập phân để kiểm tra vi sinh vật. Phần 1: Các nguyên tắc chung để chuẩn bị huyền phù ban đầu và các dung dịch pha loãng thập phân.
TCVN 6404 (ISO 7218), Vi sinh vật trong thực phẩm và trong thức ăn chăn nuôi - Nguyên tắc chung về kiểm tra vi sinh vật.
3. Thuật ngữ và định nghĩa
Trong tiêu chuẩn này áp dụng các thuật ngữ và định nghĩa sau đây:
3.1. Escherichia coli O157 (Escherichia coli O157)
(E.coli O157)
Các vi sinh vật hình thành các khuẩn lạc điển hình trên bề mặt môi trường thạch đổ đĩa được sử dụng trong tiêu chuẩn này, có sinh indol và dính kết đặc hiệu với kháng huyết thanh kháng kháng nguyên O157.
CHÚ THÍCH 1: Các chủng E.coli O157 dương tính với sorbitol không xác định được trên môi trường CT-SMAC (5.2).
CHÚ THÍCH 2: Một số đột biến (biến dị) âm tính với indol đã được tìm thấy.
4. Nguyên tắc
Việc phát hiện Escherichia coli O157 cần có bốn giai đoạn liên tiếp (xem Phụ lục A).
a) Tăng sinh phần mẫu thử đã đồng nhất trong canh thang đậu tương trypton cải biến có chứa novobioxin (mTSB + N) có ủ ấm ở 41,5oC ± 1oC trong 6 h và ủ tiếp từ 12 h đến 18 h.
b) Tách và cô đặc các vi sinh vật bằng các hạt từ miễn dịch được phủ bằng các kháng thể với E.coli O157.
c) Phân lập bằng cách cấy truyền các hạt từ miễn dịch có dính các vi khuẩn lên thạch MacConkey sorbitol telurit xefixim (CT-SMAC) và môi trường thạch phân lập chọn lọc thứ hai do người sử dụng tự chọn.
d) Khẳng định các khuẩn lạc âm tính với sorbitol từ CT-SMAC và các khuẩn lạc điển hình của E.coli O157 trên môi trường thạch phân lập thứ hai, từ việc sinh indol và kết dính với kháng huyết thanh E.coli O157.
CHÚ THÍCH: Về các đặc trưng tiếp theo của các khuẩn lạc phân lập dương tính có thể thu được bằng cách, ví dụ như gửi chúng đến phòng thử nghiệm chuẩn thích hợp để khẳng định.
5. Môi trường nuôi cấy, thuốc thử và kháng huyết thanh
Về thực hành thử nghiệm hiện hành, xem TCVN 6404 (ISO 7218).
5.1. Môi trường tăng sinh: Canh thang đậu tương trypton cải biến có novobioxin (mTSB + N)
Xem [1].
5.1.1. Canh thang đậu tương trypton cải biến (mTSB + N)
5.1.1.1. Thành phần
| Dịch thủy phân casein bằng enzym 17,0 g Dịch thủy phân đậu tương bằng enzym 3,0 g D(+)-glucoza 2,5 g Muối mật No.3 1,5 g Natri clorua 5,0 g Dikali hydrophosphat (K2HPO4) 4,0 g Nước 1 000 ml |
5.1.1.2. Chuẩn bị
Hòa tan các thành phần trên hoặc môi trường hoàn chỉnh khô trong nước, bằng cách đun nóng, nếu cần. Chỉnh pH, sử dụng máy đo pH (6.6), sao cho sau khi khử trùng pH là 7,4 ± 0,2 ở 25oC, nếu cần.
Phân phối môi trường với các lượng thích hợp vào các bình cầu hoặc chai (6.7). Khử trùng 15 phút trong nồi hấp áp lực (6.1) ở 121oC.
5.1.2. Dung dịch novobioxin
5.1.2.1. Thành phần
| Novobioxin 0,45 g Nước 100 ml |
5.1.2.2. Chuẩn bị
Hòa tan novobioxin trong nước và lọc qua màng lọc để khử trùng.
Chuẩn bị ngay trong ngày sử dụng.
5.1.2.3. Chuẩn bị môi trường hoàn chỉnh
Ngay trước khi sử dụng, cho 1 ml hoặc 4 ml dung dịch novobioxin (5.1.2) vào 225 ml hoặc 900 ml môi trường mTSB (5.1.1) đã nguội.
Nồng độ cuối cùng của novobioxin của mTSB là 20 mg/l.
5.2. Môi trường phân lập chọn lọc thứ nhất: MacConkey sorbitol telurit xefixim (CT-SMAC)
Xem [2].
5.2.1. Môi trường cơ bản
5.2.1.1. Thành phần
| Dịch thủy phân casein bằng enzym 17,0 g Dịch thủy phân đậu tương bằng enzym 3,0 g Sorbitol 10,0 g Muối mật No.3 1,5 g Natri clorua 5,0 g Đỏ trung tính 0,03 g Tím tinh thể 0,001 g Thạch 9 g đến 18 g a Nước 1 000 ml |
| a Tùy thuộc vào sức đông của thạch. |
5.2.1.2. Chuẩn bị
Hòa tan các thành phần cơ bản hoặc môi trường hoàn chỉnh khô trong nước bằng đun sôi. Chỉnh pH (6.6), sao cho sau khi khử trùng pH là 7,1 ± 0,2 ở 25oC, nếu cần.
Khử trùng 15 phút trong nồi hấp áp lực (6.1) ở 121oC.
5.2.2. Dung dịch kali telurit
5.2.2.1. Thành phần
| Kali telurit dùng cho vi khuẩn 0,25 g Nước 100 ml |
5.2.2.2. Chuẩn bị
Hòa tan kali telurit trong nước và lọc qua màng lọc để khử trùng.
Dung dịch này có thể bền đến 1 tháng khi bảo quản ở nhiệt độ phòng, nhưng khi thấy có kết tủa màu trắng thì loại bỏ.
5.2.3. Dung dịch xefixim
5.2.3.1. Thành phần
| Xefixim 5,0 mg Nước 100,0 ml |
5.2.3.2. Chuẩn bị
Hòa tan xefixim trong nước và lọc qua màng lọc để khử trùng.
CHÚ THÍCH: Xefixim có thể cần phải được hòa tan trong etanol.
Dung dịch này có thể bền đến 1 tuần khi bảo quản ở nhiệt độ 3oC ± 2oC
5.2.4. Môi trường hoàn chỉnh
5.2.4.1. Thành phần
| Môi trường cơ bản (5.2.1) 1 000 ml Dung dịch kali telurit (5.2.2) 1,0 ml Dung dịch xefixim (5.2.3) 1,0 ml |
5.2.4.2. Chuẩn bị
Làm nguội môi trường cơ bản mới khử trùng (5.2.1) đến nhiệt độ khoảng từ 44oC đến 47oC (6.5), hoặc làm tan chảy môi trường cơ bản đông đặc và đã khử trùng bằng hơi nóng, rồi làm nguội đến nhiệt độ khoảng từ 44oC đến 47oC.
Cho 1 ml dung dịch telurit và 1 ml dung dịch xefixim vào 1 000 ml môi trường cơ bản. Trộn đều và rót các lượng 15 ml môi trường này vào các đĩa Petri vô trùng (6.15). Để cho đông đặc.
Nồng độ cuối cùng của telurit là 2,5 mg/l và xefixim là 0,05 mg/l.
Ngay trước khi sử dụng, làm khô các đĩa thạch, tốt nhất là mở nắp và để mặt thạch úp xuống phía dưới, để vào tủ sấy (6.2) ở nhiệt độ từ 25oC đến 50oC cho đến khi bề mặt thạch khô. Không làm khô tiếp. Cũng có thể làm khô các đĩa thạch bằng cách mở một nửa nắp để trong buồng sấy an toàn 30 min, hoặc đậy nắp để qua đêm.
Nếu đã chuẩn bị trước thì các đĩa thạch chưa khô có thể bảo quản được đến 2 tuần trong các túi chất dẻo để nơi tối hoặc để trong các vật chứa khác có thể giữ được độ ẩm, để trong tủ lạnh ở 3oC ± 2oC.
5.3. Môi trường phân lập chọn lọc thứ hai
Môi trường đặc chọn lọc khác do phòng thử nghiệm tự chọn để sử dụng bổ sung cho thạch CT-SMAC và phải thích hợp đặc biệt cho việc phân lập Escherichia coli O157.
Ngay trước khi sử dụng, làm khô các đĩa thạch, tốt nhất là mở nắp và để mặt thạch úp xuống phía dưới, để vào tủ sấy (6.2) ở nhiệt độ từ 25oC đến 50oC cho đến khi bề mặt thạch khô. Không làm khô tiếp. Cũng có thể làm khô các đĩa thạch bằng cách mở một nửa nắp để trong buồng sấy an toàn 30 min, hoặc đậy nắp để qua đêm.
Nếu đã chuẩn bị trước thì các đĩa thạch chưa khô có thể được bảo quản trong các túi chất dẻo để nơi tối hoặc để trong các vật chứa khác có thể giữ được độ ẩm, để trong tủ lạnh ở 3oC ± 2oC trong một khoảng thời gian mà không làm thay đổi các tính năng của nó.
5.4. Thạch dinh dưỡng
5.4.1. Thành phần
| Cao thịt 3,0 g Pepton 5,0 g Thạch 9 g đến 18 g a Nước 1 000 ml |
| a Tùy thuộc vào sức đông của thạch. |
5.4.2. Chuẩn bị
Hòa tan các thành phần hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun nóng, nếu cần. Chỉnh pH sao cho sau khi khử trùng là 7,0 ± 0,2 ở 25oC, nếu cần.
Phân phối môi trường vào các chai hoặc bình (6.7) có dung tích thích hợp.
Khử trùng 15 min trong nồi hấp áp lực (6.1) ở 121oC.
5.4.3. Chuẩn bị các đĩa thạch dinh dưỡng
Chuyển vào mỗi đĩa Petri khoảng 15 ml môi trường đã làm tan chảy và làm nguội đến nhiệt độ khoảng từ 44oC đến 47oC (6.5) và để cho đông đặc.
Ngay trước khi sử dụng, làm khô các đĩa thạch, tốt nhất là mở nắp và để mặt thạch úp xuống phía dưới, để vào tủ sấy (6.2) ở nhiệt độ từ 25oC đến 50oC cho đến khi bề mặt thạch khô. Không làm khô tiếp. Cũng có thể làm khô các đĩa thạch bằng cách mở một nửa nắp để trong buồng sấy an toàn 30 min, hoặc đậy nắp để qua đêm.
Nếu đã chuẩn bị trước thì các đĩa thạch chưa khô có thể được bảo quản đến 2 tuần trong các túi chất dẻo để nơi tối hoặc để trong các vật chứa khác có thể giữ được độ ẩm, để trong tủ lạnh ở 3oC ± 2oC.
5.5. Môi trường trypton/tryptophan
5.5.1. Thành phần
| Trypton 10,0 g Natri clorua 5,0 g DL-tryptophan 1,0 g Nước 1 000 ml |
5.5.2. Chuẩn bị
Hòa tan các thành phần trong nước bằng cách đun sôi, nếu cần. Chỉnh pH (6.6) sao cho sau khi khử trùng pH là 7,5 ± 0,2 ở 25oC.
Phân phối các lượng 5 ml môi trường thu được sang các ống nghiệm hoặc chai (6.7) có dung tích thích hợp. Khử trùng môi trường này 15 min trong nồi hấp áp lực (6.1) ở nhiệt độ 121oC.
5.6. Thuốc thử indol Kovacs
5.6.1. Thành phần
| 4-Dimetylaminobenzaldehyt 5,0 g 2-Metylbutan-1-ol hoặc pentan-1-ol 75,0 ml Axit clohydric (r20 = 1,18 g/ml đến 1,19 g/ml) 25,0 ml |
5.6.2. Chuẩn bị
Hòa tan 4-Dimetylaminobenzaldehyt trong cồn, làm ấm trên nồi cách thủy (6.5) được duy trì ở khoảng 44oC đến 47oC, nếu cần. Làm nguội đến nhiệt độ phòng và bổ sung thêm axit clohydric. Bảo quản trong chai màu nâu tránh ánh sáng và để ở 3oC ± 2oC.
Thuốc thử này phải có màu vàng nhạt đến màu nâu nhạt và không có kết tủa.
5.7. Các hạt từ tính miễn dịch kháng Escherichia coli O157
Các hạt từ tính miễn dịch này được phủ các kháng thể đặc hiệu với E.coli O157 để cô đặc và tách các vi sinh vật này.
CHÚ THÍCH: Các nguồn này có bán sẵn. Cần tuân thủ chặt chẽ các hướng dẫn của nhà sản xuất về việc chuẩn bị để sử dụng.
5.8. Dung dịch đệm rửa: Dung dịch đệm phosphat cải biến 0,01 mol/l, pH 7,2
5.8.1. Thành phần
| Natri clorua 8,0 g Kali clorua 0,2 g Dinatri hydro phosphat (khan) 1,44 g Kali dihydro phosphat (khan) 0,24 g Polyoxyetylen sorbitan monolaurat (xiro Tween 20) 0,2 ml Nước 1 000 ml |
5.8.2. Chuẩn bị
Hòa tan các thành phần trên trong nước. Chỉnh pH (6.6) đến 7,2 ± 0,2 ở 25oC, nếu cần.
Phân phối môi trường vào các bình cầu hoặc chai (6.7) với các lượng thích hợp cho sử dụng.
Khử trùng 15 min trong nồi hấp áp lực (6.1) ở 121oC. Dung dịch này có thể bị đục nhưng khi để yên sẽ trong. Có thể sử dụng dung dịch đệm phosphat bán sẵn có cùng thành phần và cùng tính năng sử dụng.
5.9. Dung dịch muối thông thường
5.9.1. Thành phần
| Natri clorua 8,5 g Nước 1 000 ml |
5.9.2. Chuẩn bị
Hòa tan natri clorua trong nước. Phân phối môi trường vào các bình cầu hoặc chai (6.7) với các lượng thích hợp cho sử dụng.
Khử trùng 15 min trong nồi hấp áp lực (6.1) ở 121oC.
5.10. Kháng huyết thanh Escherichia coli O157, có sẵn từ các phòng thử nghiệm chuyên môn hoặc từ các nguồn bán sẵn ở thể “O” 157 riêng biệt.
Kháng huyết thanh phải được kiểm tra bằng các kiểm chứng dương tính và âm tính trước khi sử dụng với các chủng phân lập chưa biết.
6. Thiết bị và dụng cụ thủy tinh
Sử dụng các thiết bị, dụng cụ phòng thử nghiệm vi sinh thông thường [xem TCVN 6404 (ISO 7218)] và cụ thể như sau:
6.1. Thiết bị để khử trùng khô (tủ sấy) hoặc để khử trùng ướt (nồi hấp áp lực)
Xem TCVN 6404 (ISO 7218).
6.2. Tủ sấy hoặc tủ ấm, có khả năng duy trì nhiệt độ ở khoảng từ 25oC đến 50oC.
6.3. Tủ ấm, có khả năng duy trì ở 37oC ± 1oC.
6.4. Tủ ấm, có khả năng duy trì ở 41,5oC ± 1oC.
6.5. Nồi cách thủy, có khả năng duy trì nhiệt độ ở khoảng từ 44oC đến 47oC.
6.6. Máy đo pH, có đọc đến 0,01 đơn vị pH ở 25oC, có thể đo chính xác đến ± 0,1 đơn vị pH.
6.7. Ống nghiệm, bình cầu hoặc chai có dung tích thích hợp, để khử trùng và bảo quản môi trường nuôi cấy và ủ môi trường lỏng.
6.8. Ống đong, có dung tích thích hợp để chuẩn bị các dung dịch pha loãng và môi trường hoàn chỉnh.
6.9. Pipet chia độ xả hết, dung tích danh định 1 ml và 10 ml được chia độ đến 0,1 ml và 0,5 ml tương ứng.
6.10. Que cấy vòng và que cấy, bằng platin/iridi hoặc niken/crom hoặc pipet Pasteur hoặc que cấy vòng dùng một lần.
6.11. Ống hút cơ học dịch chuyển bằng không khí, vô trùng, dung tích từ 20 µl đến 200 µl được chia vạch 10 µl, hoặc tương tự.
6.12. Thiết bị tách bằng từ tính có giá đỡ từ để cô đặc các hạt từ miễn dịch, để sử dụng với các ống nghiệm bằng chất dẻo Eppendorf (6.13).
6.13. Ống nghiệm bằng chất dẻo kiểu Eppendorf, có nắp vặn, vô trùng, sử dụng một lần, kiểu ly tâm, có dung tích 1,5 ml thích hợp với giá đỡ từ tính.
Tránh sự tạo thành bọt khí khi mở.
6.14. Bộ trộn quay (kiểu máy nghiền quay, máy trộn mẫu huyết), có khả năng quay với tốc độ 15 vòng/min đến 20 vòng/min.
6.15. Đĩa Petri, có đường kính từ 90 mm đến 140 mm.
6.16. Máy trộn Vortex.
7. Lấy mẫu
Điều quan trọng là mẫu gửi đến phòng thử nghiệm đúng là mẫu đại diện và không bị hư hỏng hoặc thay đổi trong quá trình vận chuyển hoặc bảo quản.
Nên làm nguội nhanh mẫu trước khi bảo quản.
Việc lấy mẫu không quy định trong tiêu chuẩn này. Xem tiêu chuẩn cụ thể liên quan đến sản phẩm. Nếu không có tiêu chuẩn riêng liên quan đến việc lấy mẫu sản phẩm thì các bên liên quan nên thỏa thuận với nhau về vấn đề này.
8. Chuẩn bị mẫu thử
Chuẩn bị mẫu thử theo các tiêu chuẩn cụ thể thích hợp với sản phẩm có liên quan. Nếu không có các tiêu chuẩn cụ thể thì các bên có liên quan nên thỏa thuận với nhau về vấn đề này.
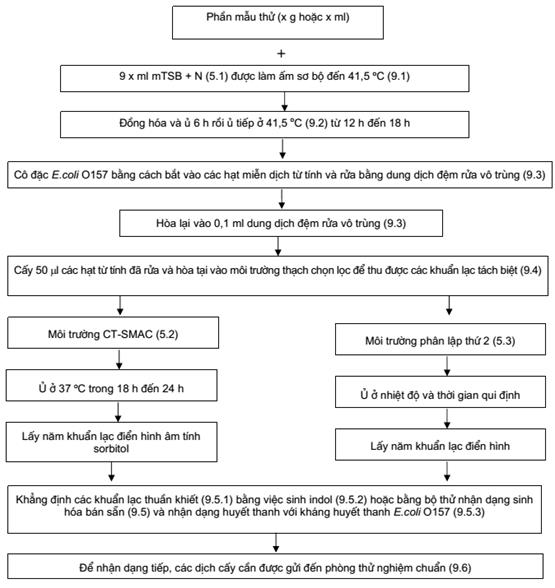
9. Cách tiến hành (xem Phụ lục A)
9.1. Phần mẫu thử và huyền phù ban đầu
Xem TCVN 6507-1 (ISO 6887-1) và tiêu chuẩn cụ thể liên quan đến sản phẩm.
CHÚ THÍCH: Các phần khác của TCVN 6507 (ISO 6887), xem Thư mục tài liệu tham khảo.
Nhìn chung, để chuẩn bị huyền phù ban đầu, cho x g hoặc x ml phần mẫu thử vào 9x ml hoặc 9x g canh thang đậu tương trypton cải biến có novobioxin (mTSB + N) (5.1), đã được làm ấm sơ bộ trong tủ ấm (6.4) ở 41,5oC để thu được tỷ lệ của phần mẫu thử và mTSB + N là 1/10 (khối lượng/thể tích hoặc thể tích/thể tích).
Nên sử dụng các túi nhu động có mắt lưới để giảm việc gây nhiễu của thực phẩm dạng hạt gắn bộ thử hút miễn dịch (9.3).
9.2. Tăng sinh
Ủ huyền phù ban đầu đã chuẩn bị theo 9.1, ở 41,5oC trong 6 h, rồi ủ tiếp 12 h đến 18 h (tức là tổng thời gian từ 18 h đến 24 h).
Việc tách từ miễn dịch và cấy lên đĩa thạch chọn lọc sau khi ủ 6 h có thể cho các kết quả dương tính giả, sau khi ủ tiếp 18 h có thể trở thành âm tính.
9.3. Tách bằng từ miễn dịch (IMS)
9.3.1. Khái quát
Sau khi ủ từ 12 h đến 18 h thì cứ sau 6 h có thể tiến hành IMS, nếu cần.
Các chỉ dẫn dưới đây là để hướng dẫn chung và có thể chưa hoàn chỉnh đến mọi chi tiết. Do đó, cần tuân theo các hướng dẫn của nhà sản xuất liên quan đến cách tiến hành và phương pháp sử dụng các bộ thử bắt giữ miễn dịch và thiết bị cần thiết.
9.3.2. Bắt giữ miễn dịch
CẢNH BÁO - Sử dụng kỹ thuật vô trùng để tránh mọi nhiễm bẩn từ bên ngoài và việc tạo bọt khí. Thực hiện thủ tục này trong tủ an toàn, nếu có sẵn. Mang găng tay bảo vệ.
Việc sử dụng thiết bị tách bằng từ tính (6.12) và các hạt từ miễn dịch được phủ kháng thể (5.7), cần thực hiện quy trình bắt giữ/tách dưới đây:
Trộn dịch cấy tăng sinh (9.2) và để cho nguyên liệu thô lắng xuống. Cho 20 µl các hạt từ miễn dịch đã chuẩn bị (5.7) ở nhiệt độ phòng vào ống nghiệm bằng chất dẻo kiểu Eppendoft (6.13). Lấy 1 ml dịch lỏng phía trên dịch cấy tăng sinh, nếu có thể, tránh hết các hạt thực phẩm hoặc chất béo, cho vào ống nghiệm bằng chất dẻo kiểu Eppendoft.
Trộn huyền phù trên máy trộn quay (6.14) với tốc độ khoảng từ 12 vòng/min đến 20 vòng/min trong 10 min.
9.3.3. Tách
Đặt từng ống nghiệm bằng chất dẻo kiểu Eppendoft (xem 9.3.2) vào giá từ (6.12) và để cho các hạt từ dính kết dựa vào nam châm bằng cách dịch chuyển nhẹ nhàng giá từ qua lại 180o. Mở nắp cẩn thận mà không làm nhiễu loạn các hạt trên thành ống. Dùng pipet Pasteur vô trùng mới (6.10) cho mỗi mẫu và với ống nghiệm vẫn còn trong giá từ, loại bỏ dung dịch bằng cách hút từ từ dịch lỏng từ dưới đáy ống nghiệm. Thêm 1 ml dung dịch đệm rửa vô trùng (5.8) và đậy nắp. Lấy nam châm ra khỏi giá. Trộn phần chứa trong ống bằng cách đảo nhẹ nhàng giá qua 180o và đặt nam châm trở lại giá.
Chú ý để tránh làm nhiễm bẩn chéo khi bổ sung dung dịch đệm mới.
Tiến hành như trên, sử dụng pipet Pasteur mới cho mỗi mẫu để loại bỏ dịch rửa. Lặp lại quy trình rửa vài lần.
Lấy ra khỏi thiết bị tách từ tính và cho 100 µl dung dịch đệm rửa vô trùng (5.8) vào ống nghiệm và hòa lại các hạt từ tính.
CHÚ THÍCH: Quy trình này có thể gặp phải khó khăn đối với các sản phẩm chất béo hoặc phomat tươi.
9.4. Cấy lên đĩa thạch chọn lọc và nhận dạng các khuẩn lạc E.coli O157
9.4.1. Cấy lên đĩa
Sử dụng ống hút kiểu cơ học (6.11), chuyển 50 µl các hạt từ tính đã hòa lại và đã rửa (9.3.3) vào đĩa thạch MacConkey sorbitol telurit (5.2) đã làm khô sơ bộ và 50 µl vào đĩa môi trường phân lập thứ hai (5.3) đã làm khô sơ bộ.
Dùng vòng cấy vô trùng (6.10) ria cấy các hạt này để thu được nhiều khuẩn lạc tách biệt rõ trên khắp đĩa thạch.
Ủ ấm (theo 6.3) môi trường CT-SMAC (5.2) ở 37oC trong 18 h đến 24 h và ủ môi trường thạch chọn lọc thứ hai ở nhiệt độ khuyến cáo và thời gian quy định.
Tùy thuộc vào kiểu loại mẫu thực phẩm và hệ vi khuẩn của mẫu, mà việc ủ canh thang tăng sinh trong 20 h đến 24 h có thể làm tăng việc mọc dày các vi khuẩn khác trên các đĩa thạch chọn lọc làm cho việc phát hiện ra các khuẩn lạc E.coli O157 gặp phải khó khăn. Việc nuôi cấy các đĩa thạch chọn lọc với các dung dịch pha loãng của IMS hoặc các thể tích nhỏ hơn 50 µl trên một đĩa, có thể làm tăng cơ hội thu được các khuẩn lạc tách biệt của E.coli O157, nhưng chú ý rằng điều này cũng có thể làm tăng giới hạn phát hiện.
9.4.2. Thừa nhận các khuẩn lạc E.coli O157 điển hình
Các khuẩn lạc điển hình là trong suốt và gần như không màu, có viền ngoài màu vàng nâu nhạt và đường kính xấp xỉ 1 mm khi ở trên thạch CT-SMAC.
Kiểm tra các khuẩn lạc điển hình của E.coli O157 trên môi trường thạch phân lập chọn lọc thứ hai theo chỉ dẫn của nhà sản xuất.
9.5. Khẳng định
CHÚ THÍCH: Có thể sử dụng các bộ thử nhỏ nhận dạng bằng sinh hóa bán sẵn để nhận dạng E.coli dương tính indol và âm tính sorbitol và các bộ thử kết dính keo tổng hợp về E.coli O157, với điều kiện là các phép thử thích hợp đã có các chủng âm tính và dương tính biết trước đã được thực hiện để khẳng định tính năng.
9.5.1. Chọn khuẩn lạc
Từ mỗi đĩa lấy năm khuẩn lạc điển hình, như đã chọn trong 9.4. Nếu như trên đĩa có ít hơn năm khuẩn lạc thì lấy tất cả các khuẩn lạc có mặt để kiểm tra.
Ria cấy từng khuẩn lạc đã chọn lên đĩa thạch dinh dưỡng (5.4) để cho phát triển các khuẩn lạc tách biệt tốt.
Ủ (trong tủ ấm 6.3) các đĩa trong 18 h đến 24 h ở 37oC.
Chỉ sử dụng các khuẩn lạc thuần khiết từ đĩa thạch dinh dưỡng cho các phép thử trong 9.5.2 và 9.5.3.
9.5.2. Khẳng định bằng sinh hóa: sinh indol
Cấy một khuẩn lạc từ dịch cấy thuần khiết trên đĩa thạch dinh dưỡng (9.5.1) vào ống đựng môi trường trypton/tryptophan (5.5).
Ủ (trong tủ ấm 6.3) ở 37oC trong 24 h.
Thêm 1 ml thuốc thử Kovac’s (5.6) và để yên 10 min ở nhiệt độ phòng.
Việc hình thành màu đỏ chứng tỏ phản ứng dương tính. Màu vàng/nâu chứng tỏ phản ứng âm tính.
9.5.3. Nhận dạng bằng huyết thanh
9.5.3.1. Khái quát
Chỉ kiểm tra các khuẩn lạc dương tính indol bằng phản ứng huyết thanh của chúng với kháng huyết thanh E.coli O157.
9.5.3.2. Loại bỏ các vi khuẩn phân lập tự kết dính
Cho một giọt dung dịch nước muối (5.9) lên một phiến kính thủy tinh sạch.
Dùng vòng cấy (6.10), trộn trong giọt nước muối này một khuẩn lạc lấy từ đĩa thạch dinh dưỡng (9.5.1) sao cho thu được huyền phù đục và đồng nhất.
Di chuyển phiến kính nhẹ nhàng trong 30 s đến 60 s. Quan sát kết quả thu được dựa vào nền màu đen và dùng kính lúp, nếu cần.
Nếu huyền phù tạo thành các mảng có thể nhìn thấy, thì chủng đó được coi là tự kết dính và không được dùng để kiểm tra tiếp, vì không thể xảy ra phản ứng với kháng huyết thanh cụ thể.
9.5.3.3. Phản ứng kháng huyết thanh E.coli O157
Sử dụng một khuẩn lạc thuần khiết từ thạch dinh dưỡng (9.5.1), hòa trong một giọt nước muối mới như trong 9.5.3.2 và thêm một giọt kháng huyết thanh E.coli O157 (5.10).
Nếu trong vòng 1 min thấy xuất hiện dinh kết, thì phản ứng là dương tính.
9.5.3.4. Nhận dạng dương tính
Các vi khuẩn tách riêng cho phản ứng dương tính với indol và phản ứng với kháng huyết thanh O157 hoặc O157 cộng với kháng huyết thanh H7 được coi là các vi khuẩn dương tính.
9.6. Đặc trưng khác
Để nhận dạng các đặc khuẩn lạc dương tính cho việc phát hiện các kháng nguyên roi và các đặc tính gây bệnh, cần gửi các chủng này đến phòng thử nghiệm chuẩn.
10. Đảm bảo chất lượng
10.1. Kiểm tra các chủng về mục đích đảm bảo chất lượng
Các chủng E.coli O157 không mang các yếu tố độc thuộc loại gây bệnh đều có sẵn từ cơ quan lưu giữ vi khuẩn quốc tế hoặc quốc gia. Các chủng này được dùng để kiểm tra về đảm bảo chất lượng môi trường và kháng huyết thanh.
10.2. Phương pháp cấy
Để kiểm tra khả năng của phòng thử nghiệm và môi trường để phát hiện số lượng nhỏ Escherichia coli O157 trong các mẫu thực phẩm cần thử nghiệm bằng phương pháp mô tả trong tiêu chuẩn này, thì các mẫu đối chứng có lượng nhỏ dịch cấy E.coli O157 không gây bệnh và lượng lớn dịch cấy của chủng E.coli khác cần được thực hiện song song với mẫu thử.
11. Biểu thị kết quả
Theo phần diễn giải các kết quả, ghi lại sự có mặt hay không có mặt Escherichia coli O157 trong phần mẫu thử, tính theo gam hoặc tính theo mililit.
12. Báo cáo thử nghiệm
Báo cáo thử nghiệm phải ghi rõ:
a) mọi thông tin cần thiết để nhận biết đầy đủ về mẫu thử;
b) phương pháp lấy mẫu đã sử dụng, nếu biết;
c) phương pháp thử đã sử dụng, viện dẫn tiêu chuẩn này;
d) nhiệt độ ủ đã sử dụng;
e) mọi chi tiết thao tác không quy định trong tiêu chuẩn này, hoặc tùy ý lựa chọn, cùng với các chi tiết bất thường khác có thể ảnh hưởng tới kết quả;
f) các kết quả thử nghiệm thu được;
Báo cáo kết quả cũng phải nêu rõ nếu các phép thử tiếp theo được thực hiện bởi phòng thử nghiệm chuẩn, hoặc nếu đã thực hiện thì nêu kết quả thu được.
Phụ lục A
(Quy định)
Sơ đồ cách tiến hành
Thư mục tài liệu tham khảo
[1] DOYLE M.P. and SCHOENI J.L. Appl. Environ. Microbiol. 53, 1987, pp. 2394-2396.
[2] ZADIK P.M., CHAPMAN P.A. and Siddons J. Med. Microbiol., 39, 1993, phương pháp. 155-158.
[3] TCVN 6507-2 (ISO 6887-2), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử, huyền phù ban đầu và các dung dịch pha loãng thập phân để kiểm tra vi sinh vật - Phần 2: Các nguyên tắc cụ thể để chuẩn bị thịt và sản phẩm thịt.
[4] TCVN 6507-3 (ISO 6887-3), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử, huyền phù ban đầu và các dung dịch pha loãng thập phân để kiểm tra vi sinh vật. Phần 3: Các nguyên tắc cụ thể để chuẩn bị các mẫu thủy sản và sản phẩm thủy sản.
[5] TCVN 6507-4 (ISO 6887-4), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử, huyền phù ban đầu và các dung dịch pha loãng thập phân để kiểm tra vi sinh vật. Phần 4: Các nguyên tắc cụ thể để chuẩn bị các sản phẩm khác với sữa và sản phẩm sữa, thịt và sản phẩm thịt, thủy sản và sản phẩm thủy sản.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 7686:2007 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 7686:2007 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 7686:2007 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 7686:2007 DOC (Bản Word)