- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Việt Nam TCVN 6402:1998 Sữa và sản phẩm sữa - Phát hiện salmonella phương pháp chuẩn
| Số hiệu: | TCVN 6402:1998 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học, Công nghệ và Môi trường | Lĩnh vực: | Thực phẩm-Dược phẩm |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
01/01/1998 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 6402:1998
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
TIÊU CHUẨN VIỆT NAM
TCVN 6402 : 1998
SỮA VÀ SẢN PHẨM SỮA – PHÁT HIỆN SALMONELLA (PHƯƠNG PHÁP CHUẨN)
Milk and milk products – Detection of Salmonella (Reference method)
Lời nói đầu
TCVN 6402 : 1998 hoàn toàn tương đương với ISO 6785 : 1985 (E)
TCVN 6402 : 1998 do Ban Kỹ thuật tiêu chuẩn TCVN/TC/F12 Sữa và sản phẩm sữa biên soạn, Tổng cục Tiêu chuẩn – Đo lường – Chất lượng đề nghị, Bộ Khoa học, Công nghệ và Môi trường ban hành.
1. Phạm vi áp dụng
Tiêu chuẩn này mô tả phương pháp phát hiện Salmonella trong sữa và sản phẩm sữa
Cảnh báo – Phải tuân thủ các lưu ý về an toàn quy định trong điều 4.
2. Định nghĩa
Áp dụng định nghĩa sau đây trong tiêu chuẩn này:
2.1. Salmonella là các vi sinh vật tạo nên các khuẩn lạc đặc trưng trên môi trường đặc chọn lọc và khi tiến hành thử theo tiêu chuẩn này thì cho thấy các đặc tính sinh hóa và huyết thanh đã được mô tả.
2.2. Phát hiện Salmonella và việc xác định sự có mặt hay không của loại vi sinh vật này trong một khối lượng hay một thể tích cụ thể, khi tiến hành thử theo tiêu chuẩn này.
3. Nguyên tắc
3.1. Khái quát
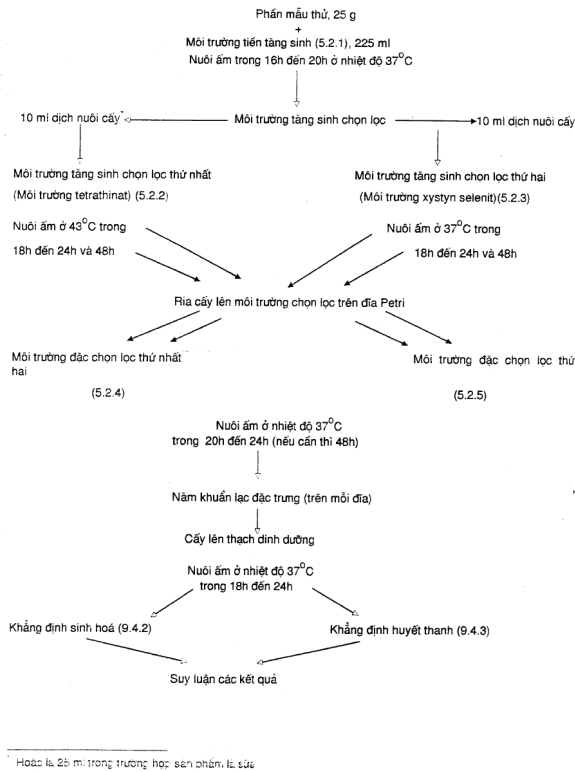
Việc phát hiện Salmonella cần thực hiện bốn giai đoạn liên tục theo mô tả trong các điều từ 3.2 đến 3.5.
Chú thích – Xem thêm sơ đồ tiến hành thử trong phụ lục A.
3.2. Tiền tăng sinh trong môi trường lỏng
Cấy phần mẫu thử vào môi trường tiền tăng sinh thích hợp và nuôi ấm ở 370C từ 16h đến 20h.
3.3. Tăng sinh trong môi trường lỏng chọn lọc
Cấy dịch cấy thu được (xem 3.1) vào môi trường tetrathionat và môi trường selenit xystin và nuôi môi trường tetrathionat ở 430C và môi trường selenit xystin ở 370C trong hai giai đoạn từ 18h đến 24h.
3.4. Ria cấy lên đĩa và nhận dạng
Từ các dịch cấy thu được (3.2), cấy hai môi trường đặc chọn lọc.
Nuôi hai môi trường đặc chọn lọc này ở 370C và kiểm tra sau 20h đến 24h và, nếu cần, sau 40h đến 48h kiểm tra sự có mặt của các khuẩn lạc được coi là Salmonella theo các đặc tính của chúng.
3.5. Khẳng định
Các khuẩn lạc được coi là Salmonella sẽ được cấy truyền tiếp và khẳng định qua các thử nghiệm sinh hóa và huyết thanh học.
4. Lưu ý về an toàn
4.1. Quy trình quy định trong tiêu chuẩn này chỉ được tiến hành trong các phòng thí nghiệm có các điều kiện thích hợp và đặt dưới sự kiểm soát của chuyên gia về vi sinh vật.
4.2. Các quy trình này không được tiến hành trong các phòng thí nghiệm kiểm tra chất lượng, hay trong các cơ sở sản xuất hoặc chế biến thực phẩm, nơi có nguy cơ nhiễm bẩn từ môi trường.
4.3. Phải luôn thực hiện đầy đủ các chú ý về vi khuẩn học trong suốt quá trình tiến hành qui trình. Phải đặc biệt chú ý tới việc khử trùng các trang bị đã sử dụng và môi trường sau khi kiểm tra các mẫu còn nghi ngờ và trước khi loại bỏ hay tái sử dụng.
5. Môi trường nuôi cấy, thuốc thử và huyết thanh
5.1. Nguyên liệu chính
Để làm tăng độ tái lập của kết quả, nên sử dụng các thành phần chính khô, hoặc các môi trường hoàn chỉnh khô để chuẩn bị các môi trường nuôi cấy. Cần tuân thủ nghiêm ngặt các hướng dẫn của nhà sản xuất khi chuẩn bị môi trường nuôi cấy.
Các hóa phẩm sử dụng để chuẩn bị môi trường nuôi cấy phải là loại phân tích.
Nước sử dụng phải là nước cất hoặc nước đã khử ion, không chứa các chất có thể ức chế sự sinh trưởng của các vi sinh vật trong các điều kiện thử nghiệm.
Đo pH bằng pH mét.
Nếu môi trường nuôi cấy và thuốc thử chưa sử dụng ngay thì phải bảo quản chỗ tối và ở nhiệt độ từ 00C đến 50C nhưng không quá 1 tháng và trong các điều kiện không làm biến đổi thành phần của chúng, trừ khi có quy định khác.
5.2. Môi trường và thuốc thử
5.2.1. Môi trường tiền tăng sinh: nước đệm pepton
Thành phần
Pepton: 10,0 g
Natri clorua: 5,0 g
Dinatri hidrooctophophat ngậm 12 phân tử nước (Na2HPO4.12H2O): 9,0 g
Kali hidrooctophophat (KH2PO4): 1,5 g
Nước: 1 000 ml
Chuẩn bị:
Hòa tan các thành phần trong nước bằng cách đun sôi.
Nếu cần, chỉnh pH để sau khi khử trùng pH là 7,0 ± 0,1 ở 250C. Khử trùng môi trường này bằng hấp áp lực 15 phút ở nhiệt độ 1210C±10C.
Phân phối môi trường này một cách vô trùng vào các bình thí nghiệm vô trùng có dung tích thích hợp để có được các phần mẫu thử cần thiết cho thử nghiệm.
5.2.2. Môi trường tăng sinh chọn lọc thứ nhất: môi trường tetrathionat (Muller - Kauffmann)
5.2.2.1. Môi trường cơ bản
Thành phần:
Cao thịt: 5,0 g
Pepton: 10,0 g
Natri clorua: 3,0 g
Canxi cacbonat: 45,0 g
Nước: 1 000 ml
Chuẩn bị:
Thêm các thành phần cơ bản khô hoặc phần cơ bản hoàn chỉnh khô trong nước và đun sôi cho đến khi hòa tan hết các thành phần có thể tan được.
Nếu cần, chỉnh pH để sau khi khử trùng pH là 7,0±0,1 ở nhiệt độ 250C.
Khử trừng phần cơ bản này bằng hấp áp lực 15 phút ở nhiệt độ 1210C±10C.
5.2.2.2. Dung dịch natri thiosunfat
Thành phần
Natri thiosunfat ngậm 5 phân tử nước (Na2S2O3.5H2O): 50,0 g
Nước: 100 ml
Chuẩn bị
Hòa tan natri thiosunfat trong một phần thể tích nước.
Pha loãng bằng nước đến 1 000 ml.
Khử trùng dung dịch này bằng hấp áp lực 15 phút ở nhiệt độ 1210C±10C.
5.2.2.3. Dung dịch iodua
Thành phần
Iốt: 20,0 g
Kali iodua: 25,0 g
Nước: 100 ml
Chuẩn bị
Hòa tan kali iôdua trong một lượng nước tối thiểu và thêm iốt.
Lắc cho đến khi hòa tan hoàn toàn.
Pha loãng đến 100 ml.
Bảo quản dung dịch này trong chai sẫm màu có nút chặt.
5.2.2.4. Dung dịch xanh brillant
Thành phần
Xanh brilliant (xem phụ lục B): 0,5 g (xấp xỉ)
Nước: 100 ml
Chuẩn bị
Pha xanh brilliant vào nước.
Bảo quản dung dịch này ít nhất là 1 ngày trong chỗ tối để quá trình tự khử trùng xảy ra.
5.2.2.5. Dung dịch mật bò
Thành phần
Mật bò khô: 10,0 g
Nước: 100 ml
Chuẩn bị
Hòa tan mật bò khô trong nước bằng cách đun sôi.
Khử trùng dung dịch này bằng hấp áp lực 15 phút ở nhiệt độ 1210C±10C.
5.2.2.6. Môi trường hoàn chỉnh
Thành phần
Môi trường cơ bản: 900 ml
Dung dịch natri thiosunfat: 100 ml
Dung dịch iôdua: 20 ml
Dung dịch xanh brilliant: 2 ml
Dung dịch mật bò: 50 ml
Chuẩn bị
Cho các thành phần khác vào môi trường cơ bản theo thứ tự các thành phần trên, trong điều kiện vô trùng.
Sau mỗi lần thêm phải lắc đều các chất lỏng.
Phân phối môi trường này một cách vô trùng vào các bình thí nghiệm vô trùng có dung dịch thích hợp để có được các phần mẫu thử cần thiết cho thử nghiệm.
Môi trường hoàn chỉnh này chỉ sử dụng trong vòng một tuần.
5.2.3. Môi trường tăng sinh chọn lọc thứ hai: môi trường selenit xystin
Cảnh báo – Phải đặc biệt thận trọng khi sử dụng dung dịch selenit do độc tính tiềm ẩn của chúng. Trong mọi tình huống không được hút bằng miệng.
5.2.3.1. Môi trường cơ bản
Thành phần
Tripton: 5,0 g
Lactoza: 4,0 g
Dinatri hidrooctophophat ngậm 12 phân tử nước (Na2HPO4.12H2O): 10,0 g
Natri hidroselenit: 4,0 g
Nước: 1 000 ml
Chuẩn bị
Hòa tan ba thành phần đầu tiên trong nước bằng cách đun sôi 5 phút. Sau khi để nguội cho thêm natri hidroselenit.
Nếu cần, chỉnh pH để sau khi khử trùng pH là 7,0±0,1 ở nhiệt độ 250C.
Không hấp áp lực.
5.2.3.2. Dung dịch L-xystin
Thành phần
L-xystin: 0,1 g
Dung dịch 40g/l natri hidroxit: 15 ml
Nước: 85 ml
Chuẩn bị
Hòa tan L-xystin trong dung dịch natri hidroxit. Pha loãng bằng nước đã khử trùng cho tới 100 ml trong một bình thí nghiệm vô trùng.
Không hấp áp lực.
5.2.3.3. Môi trường hoàn chỉnh
Thành phần
Môi trường cơ bản: 1 000 ml
Dung dịch L-xystin: 10 ml
Chuẩn bị
Làm nguội môi trường cơ bản và thêm dung dịch L-xystin một cách vô trùng.
Nếu cần, chỉnh pH để sau khi khử trùng pH là 7,0±0,1 ở nhiệt độ 250C.
Không hấp áp lực.
Phân phối môi trường này một cách vô trùng vào các bình thí nghiệm vô trùng có dung tích thích hợp để có được các phần mẫu thử cần thiết cho thử nghiệm.
Chuẩn bị môi trường hoàn chỉnh này trong ngày sử dụng.
5.2.4. Môi trường đặc chọn lọc thứ nhất: Thạch sunfit bismut
Thành phần
Pepton: 10,0 g
Cao thịt bò: 5,0 g
Glucoza: 5,0 g
Dinatri hidrooctophophat ngậm 12 phân tử nước (Na2HPO4.12H2O): 4,0 g
Sắt (II) sunfat: 0,3 g
Amoni xitrat bismut: 1,85 g
Natri sunfit: 6,15 g
Thạch: từ 15 g đến 25 g (theo chỉ dẫn của nhà sản xuất)
Xanh brilliant (Xem phụ lục B) 0,025 g
Nước 1 000 ml
Chuẩn bị
Hòa tan các thành phần trong nước bằng cách đun sôi khoảng 1 phút.
Chỉnh pH đến 7,7±0,1.
Làm nguội đến khoảng 450C đến 500C, khuấy nhẹ các hạt lơ lửng.
Không hấp áp lực.
Chuyển môi trường này theo các lượng 20 ml vào các đĩa Petri vô trùng và để yên cho đông đặc lại.
Ngay trước khi sử dụng, sấy thật khô các đĩa, tốt nhất là mở nắp và để úp bề mặt của thạch xuống dưới, trong tủ sấy hoặc tủ ấm (6.2) đã chỉnh ở 500C±50C trong 30 phút.
Chú thích – Các đĩa này mất tính chọn lọc sau 72h.
5.2.5. Môi trường đặc chọn lọc thứ hai
5.2.5.1. Khái quát: Môi trường đặc chọn lọc thứ hai phải là một trong các môi trường quy định trong các điều từ 5.2.5.2 đến 5.2.5.4, hoặc do thử nghiệm viên chọn, hoặc do người yêu cầu thử nghiệm chọn.
5.2.5.2. Thạch xanh brilliant/đỏ phenol (Edel và Kampeimacher)
5.2.5.2.1. Môi trường cơ bản
Thành phần
Bột cao thịt bò: 5,0 g
Pepton: 10,0 g
Bột cao men: 3,0 g
Dinatri hidrooctophophat ngậm 12 phân tử nước (Na2HPO4.12H2O) 1,0 g
Natri dihidrooctophophat ngậm 2 phân tử nước (NaH2PO4.2H2O): 0,5 g
Thạch: từ 12 g đến 18 g (theo chỉ dẫn của nhà sản xuất)
Nước: 900 ml
Chuẩn bị
Hòa tan các thành phần cơ bản khô hoặc phần cơ bản hoàn chỉnh khô trong nước bằng cách đun sôi.
Nếu cần, chỉnh pH để sau khi khử trùng pH là 7,0±0,1 ở nhiệt độ 250C.
Phân phối môi trường cơ bản này vào các ống nghiệm hoặc các bình thí nghiệm có dung tích không lớn hơn 500 ml.
Khử trùng môi trường cơ bản này bằng hấp áp lực 15 phút ở nhiệt độ 1210C±10C.
5.2.5.2.2. Dung dịch đường/đỏ phenol
Thành phần
Lactoza: 10,0 g
Xacaroza: 10,0 g
Đỏ phenol: 0,09 g
Nước: 100 ml
Chuẩn bị
Hòa tan các thành phần trong nước.
Đun 20 phút trong nồi cách thủy (6.5) ở 700C±10C.
Làm nguội đến 550C và sử dụng ngay.
5.2.5.2.3. Dung dịch xanh brilliant
Thành phần và việc chuẩn bị dung dịch xanh brilliant phải phù hợp với 5.2.2.4.
Thành phần
Môi trường cơ bản: 900 ml
Dung dịch đường/đỏ phenol: 100 ml
Dung dịch xanh brilliant: 1 ml
Chuẩn bị
Cho dung dịch xanh brilliant trong điều kiện vô trùng vào dung dịch đường/đỏ phenol đã được làm nguội đến khoảng 550C. Cho hỗn hợp này vào môi trường cơ bản tan chảy, được giữ ở nhiệt độ từ 500C đến 550C và trộn.
Cho môi trường này theo từng lượng khoảng 15 ml vào các đĩa Peri và để cho đông đặc lại.
Ngay trước khi sử dụng, sấy thật khô các đĩa trong tủ sấy hoặc trong tủ hút ẩm (6.2) để ở 500C±50C trong vòng 30 phút, tốt nhất là bỏ nắp đĩa ra và áp bề mặt của thạch xuống dưới.
Các đĩa đã chuẩn bị không giữ lâu quá 4h ở nhiệt độ phòng hoặc quá 24h trong tủ lạnh.
5.2.5.3. Thạch XLD
Bột cao men: 3,0 g
L-lyxin clorua hidro: 5,0 g
Xyloza: 3,75 g
Lactoza: 7,5 g
Xacaroza: 7,5 g
Natri desoxycolat: 1,0 g
Natri clorua: 5,0 g
Natri thiosunfat: 6,8 g
Amoni sắt (II) xitrat: 0,8 g
Đỏ phenol: 0,08 g
Thạch: từ 12 g đến 18 g (theo chỉ dẫn của nhà sản xuất)
Nước: 1 000 ml
Chuẩn bị
Hòa các thành phần trên vào nước. Đun trong khi vẫn khuấy liên tục cho đến khi môi trường sôi.
Không hấp áp lực.
Nếu cần, chỉnh pH sao cho pH là 7,4±0,1 ở nhiệt độ 250C.
Phân phối môi trường này theo từng lượng 15 ml vào các đĩa Petri vô trùng và để cho đóng lại. Điều quan trọng là không chuẩn bị các thể tích lớn vì sẽ dài thời gian đun.
Ngay trước khi sử dụng, sấy thật khô các đĩa 30 phút trong tủ sấy hoặc trong tủ ấm (6.2) để ở nhiệt độ 500C±50C, tốt hơn nên mở nắp đĩa và úp bề mặt thạch xuống phía dưới.
5.2.5.4. Thạch Hektoen enteric
Thành phần
Pepton proteoza: 12,0 g
Bột cao men: 3,0 g
Lactoza: 12,0 g
Xacaroza: 12,0 g
Salixin: 2,0 g
Muối mật: 9,0 g
Natri clorua: 5,0 g
Natri thiosunfat ngậm 5 phân tử nước (Na2S2O4.5H2O): 5,0 g
Amoni sắt (II) xitrat: 1,5 g
Axit fucxin: 0,1 g
Bromthymol xanh: 0,065 g
Thạch: Từ 12 g đến 18 g (theo chỉ dẫn của nhà sản xuất)
Nước: 1 000 ml
Chuẩn bị
Hòa các thành phần trên vào trong nước và ngâm 10 phút. Đun nhẹ và để sôi trong vài giây cho đến khi thạch tan.
Không hấp áp lực.
Nếu cần, chỉnh pH sao cho pH là 7,5±0,1, ở nhiệt độ 250C.
Phân phối môi trường này theo từng lượng 15 ml vào các đĩa Petri vô trùng và để cho đông lại.
Ngay trước khi sử dụng, sấy thật khô các đĩa 30 phút trong tủ sấy hoặc trong tủ ấm (6.2) đặt ở nhiệt độ 500C± 50C, tốt hơn nên mở nắp đĩa và úp bề mặt thạch xuống phía dưới.
5.2.6. Thạch dinh dưỡng
Thành phần
Cao thịt: 3,0 g
Pepton: 5,0 g
Thạch: Từ 9 g đến 18 g (theo chỉ dẫn của nhà sản xuất)
Nước: 1 000 ml
Chuẩn bị
Hòa tan các thành phần cơ bản khô hoặc phần cơ bản hoàn chỉnh khô trong nước bằng cách đun sôi.
Nếu cần, chỉnh pH để sau khi khử trùng pH là 7,0±0,1 ở nhiệt độ 250C.
Phân phối môi trường này vào các ống nghiệm hoặc các lọ có dung tích không lớn hơn 500 ml.
Khử trùng môi trường bằng hấp áp lực 15 phút ở nhiệt độ 1210C±10C.
Phân phối môi trường này theo từng lượng 15 ml vào các đĩa Petri vô trùng và để yên cho đông lại.
Ngay trước khi sử dụng, sấy thật khô các đĩa 30 phút trong tủ sấy hoặc trong tủ ấm (6.2) để ở nhiệt độ 500C±50C, tốt hơn nên mở nắp đĩa và úp bề mặt thạch xuống phía dưới.
5.2.7. Thạch đường/sắt III
Thành phần
Cao thịt: 3,0 g
Cao men: 3,0 g
Pepton: 20,0 g
Natri clorua: 5,0 g
Lactoza: 10,0 g
Xacaroza: 10,0 g
Glucoza: 1,0 g
Amoni sắt (II) xitrat: 0,3 g
Natri thiosunfat ngậm 5 phân tử nước (Na2S2O4.5H2O): 0,3 g
Đỏ phenol: 0,024 g
Thạch: Từ 12 g đến 18 g (theo chỉ dẫn của nhà sản xuất)
Nước: 1 000 ml
Chuẩn bị
Hòa tan các thành phần môi trường khô hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun sôi.
Nếu cần, chỉnh pH để sau khi khử trùng pH là 7,4±0,1 ở nhiệt độ 250C.
Phân phối môi trường này theo từng lượng 10 ml vào các ống nghiệm có đường kính từ 17 mm đến 18 mm.
Khử trùng môi trường bằng hấp áp lực 15 phút ở nhiệt độ 1210C±10C.
Để các ống nghiệm ở tư thế nghiêng để có được chiều sâu cột thạch là 25 mm và một mặt nghiêng dài 40mm – 50mm.
5.2.8. Thạch ure (Christensen)
5.2.8.1 Môi trường cơ bản
Thành phần
Pepton: 1,0 g
Glucoza: 1,0 g
Natri clorua: 5,0 g
Kali dihidrooctophophat (KH2PO4): 2,0 g
Đỏ phenol: 0,012 g
Thạch: Từ 12 g đến 18 g (theo chỉ dẫn của nhà sản xuất)
Nước: 1 000 ml
Chuẩn bị
Hòa tan các thành phần cơ bản khô hoặc phần cơ bản hoàn chỉnh khô trong nước bằng cách đun sôi.
Nếu cần, chỉnh pH để sau khi khử trùng pH là 6,8±0,1 ở nhiệt độ 250C.
Khử trùng môi trường cơ bản này bằng hấp áp lực 15 phút ở nhiệt độ 1210C±10C.
5.2.8.2. Dung dịch ure
Thành phần
Ure: 400 g
Nước vừa đủ: 1 000 ml
Chuẩn bị
Hòa tan ure trong nước. Khử trùng qua lọc và kiểm tra lại độ vô trùng.
Chú thích – Đối với các chi tiết về kỹ thuật khử trùng qua lọc, tham khảo thêm các sách kỹ thuật về vi sinh vật.
5.2.8.3. Môi trường hoàn chỉnh
Thành phần
Môi trường cơ bản: 950 ml
Dung dịch ure: 50 ml
Chuẩn bị
Trong điều kiện vô trùng, cho dung dịch ure vào môi trường cơ bản trước đó đã được làm tan chảy và làm nguội đến 450C.
Phân phối môi trường này theo từng lượng 10 ml vào các ống nghiệm vô trùng.
Đặt các ống nghiệm ở tư thế nghiêng.
5.2.9. Môi trường lysin decacboxyl
Thành phần
L-lysin monohidroclorua: 5,0 g
Cao men: 3,0 g
Glucoza: 1,0 g
Bromocresol tía: 0,015 g
Nước: 1 000 ml
Chuẩn bị
Hòa tan các thành phần trên trong nước bằng cách đun sôi.
Nếu cần, chỉnh pH để sau khi khử trùng pH là 6,8±0,1 ở nhiệt độ 250C.
Phân phối môi trường này theo từng lượng 5 ml sang các ống nuôi cấy hẹp có đường kính khoảng 8 mm và dài khoảng 160 mm.
Khử trùng môi trường này bằng hấp áp lực 15 phút ở nhiệt độ 1210C±10C.
5.2.10. Thuốc thử để phát hiện β-galactosidaza
Chú thích – Có thể dùng các đĩa giấy được chuẩn bị sẵn theo hướng dẫn của nhà sản xuất để thay thế thuốc thử này.
5.2.10.1. Dung dịch đệm
Thành phần
Natri dihidrooctophophat ngậm 2 phân tử nước (Na2HPO4.2H2O): 6,9 g
Dung dịch natri hidroxit nồng độ xấp xỉ 4g/l: 3 ml (xấp xỉ)
Nước: 50 ml
Chuẩn bị
Hòa tan natri dihidrooctophophat trong 45 ml nước.
Chỉnh pH đến 7,0±0,1 ở nhiệt độ 250C bằng dung dịch natri hidroxit.
Thêm nước cho đến 50 ml. Bảo quản trong tủ lạnh.
5.2.10.2. Dung dịch ONPG
Thành phần
2-nitrophenyl β-D-galactopyrannosid (ONPG): 80 mg
Nước: 15 ml
Chuẩn bị
Hòa tan ONPG trong nước 500C. Làm nguội dung dịch.
5.2.10.3. Thuốc thử hoàn chỉnh
Thành phần
Dung dịch đệm: 5 ml
Dung dịch ONPG: 15 ml
Chuẩn bị
Cho dung dịch đệm vào dung dịch ONPG.
5.2.11. Thuốc thử phản ứng Voges – Proskeuer (VP)
5.2.11.1. Môi trường VP
Thành phần
Pepton: 7,0 g
Glucoza: 5,0 g
Dikali hidrooctophophat (K2HPO4): 5,0 g
Nước: 1 000 ml
Chuẩn bị
Nếu cần, hòa tan các thành phần trong nước bằng cách đun sôi.
Nếu cần, chỉnh pH để sau khi khử trùng pH là 6,9±0,1 ở nhiệt độ 250C.
Phân phối môi trường này theo từng lượng 3 ml sang các ống nghiệm,
Khử trùng môi trường cơ bản này bằng hấp áp lực 15 phút ở nhiệt độ 1210C±10C.
5.2.11.2 Dung dịch creatin (N-amlidinosarcosin)
Thành phần
Creatin ngậm 1 phân tử nước: 0,5 g
Nước: 100 ml
Chuẩn bị
Hòa tan creatin ngậm 1 phân tử nước vào trong nước.
5.2.11.3. Dung dịch 1-naphtol trong cồn
Thành phần
1-naphtol: 6 g
Etanola, 96% (V/V): 100 ml
Chuẩn bị
Hòa tan 1-naphtol trong etanola.
5.2.11.4. Dung dịch kali hidroxit
Thành phần
Kali hidroxit: 40 g
Nước: 100 ml
Chuẩn bị
Hòa tan kali hidroxit trong nước.
5.2.12. Thuốc thử phản ứng indol
5.2.12.1. Môi trường tripton/triptophan (bằng Ljutov)
Thành phần
Tripton: 10 g
Natri clorua: 5 g
DL-tritophan: 1 g
Nước: 1 000 ml
Chuẩn bị
Hòa tan các thành phần trong nước ở 1000C và lọc.
Nếu cần, chỉnh pH để sau khi khử trùng pH là 7,5±0,1 ở nhiệt độ 250C.
Phân phối môi trường này theo từng lượng 5 ml sang các ống nghiệm.
Khử trùng môi trường này bằng hấp áp lực 15 phút ở nhiệt độ 1210C±10C.
5.2.12.2. Thuốc thử Kovacs
Thành phần
4-dimetylamin enaldehyt: 5 g
Dung dịch axit clohidric, ρ = 1,18 g/ml đến 1,19 g/ml: 25 ml
2-metylbutan-2-ol: 75 ml
Chuẩn bị
Trộn đều các thành phần trên.
5.2.13. Thạch dinh dưỡng thể nửa đặc
Thành phần
Cao thịt: 3,0 g
Pepton: 5,0 g
Thạch: Từ 4 g đến 9 g (theo chỉ dẫn của nhà sản xuất)
Nước: 1 000 ml
Chuẩn bị
Hòa tan các thành phần cơ bản khô trong nước bằng cách đun sôi.
Nếu cần, chỉnh pH để sau khi khử trùng pH là 7,0±0,1 ở nhiệt độ 250C.
Phân phối môi trường này vào các bình thí nghiệm dung tích không lớn hơn 500 ml.
Khử trùng môi trường này bằng hấp áp lực 15 phút ở nhiệt độ 1210C±10C.
Chuẩn bị các đĩa thạch
Phân phối môi trường này theo từng lượng 15 ml vào các đĩa Petri vô trùng và để yên cho đóng lại.
Không sấy khô các đĩa thạch này.
5.2.14. Dung dịch muối
Thành phần
Natri clorua: 8,5 g
Nước: 1 000 ml
Chuẩn bị
Đun sôi để hòa tan muối trong nước.
Chỉnh pH để sau khi khử trùng pH là 7,0±0,1 ở nhiệt độ 250C.
Phân phối dung dịch này vào các bình thí nghiệm có dung tích thích hợp.
Khử trùng môi trường này bằng hấp áp lực 20 phút ở nhiệt độ 1210C±10C.
5.2.15. Toluen
5.3. Huyết thanh
Một vài dạng huyết thanh dính kết có chứa kháng thể đối với một hoặc một số kháng nguyên có bán sẵn trên thị trường, thí dụ như kháng huyết thanh có chứa kháng thể đối với một hoặc nhiều nhóm “O” (kháng huyết thanh O đơn giá hoặc đa giá) huyết thanh kháng Vi và kháng huyết thanh có chứa các kháng thể đối với một hoặc một vài nhân tố H (gọi là kháng huyết thanh H đơn giá hoặc đa giá).
Cần thử trước mỗi lần để đảm bảo kháng huyết thanh đem sử dụng đủ điều kiện phát hiện mọi dạng huyết thanh salmonella. Để hỗ trợ cho việc này, dùng kháng huyết thanh của một hãng cung cấp đã được công nhận (thí dụ một đại lý Nhà nước thích hợp).
6. Thiết bị
6.1. Thiết bị của phòng thí nghiệm vi sinh thông thường
6.2. Tủ sấy hoặc tủ ấm, có thể duy trì nhiệt độ ở 500C±50C để làm khô bề mặt các đĩa thạch.
6.3. Tủ ấm, có thể duy trì nhiệt độ ở 370C±10C.
6.4. Nồi cách thủy hoặc tủ ấm, có thể duy trì nhiệt độ ở 430C±0,50C.
6.5. Các nồi cách thủy, có thể duy trì nhiệt độ ở 370C±10C, ở 450C±10C, và ở 700C±10C.
6.6. Máy nghiền trộn Stomacher, hoặc thiết bị khác (xem chú thích 2) để khuyến tán phần mẫu thử trong chất pha loãng.
Chú thích 1 – Stomacher là tên thường gọi của một máy trộn dùng để khuếch tán mẫu vào chất pha loãng đựng trong túi nhựa.
Chú thích 2 – Có thể sử dụng 1 máy trộn kiểu quay. Máy trộn này có tốc độ từ 8 000 vòng/phút đến 45 000 vòng/phút và có bình trộn bằng thủy tinh hoặc bằng kim loại, có nắp đậy khít và chịu được các điều kiện khử trùng.
6.7. pH mét để đo pH của môi trường và thuốc thử chuẩn bị sẵn, có thể đo chính xác đến 0,1 đơn vị pH ở nhiệt độ 250C.
6.8. Chai, bình và ống nghiệm có dung tích thích hợp.
6.9. Pipet chia độ, có dung tích danh định là 10 ml và 1 ml, có chia vạch tương ứng 0,5 ml và 0,1 ml.
6.10. Đĩa Petri.
6.11. Bi thủy tinh.
7. Lấy mẫu
Lấy mẫu thí nghiệm theo TCVN 6400 : 1998 (ISO 707 : 1997)
8. Chuẩn bị mẫu thử
Chuẩn bị mẫu thử từ mẫu thí nghiệm theo TCVN 6263 : 1997 (ISO 8261)
9. Cách tiến hành
Chú thích – Xem điều 4 về các yêu cầu an toàn.
9.1. Phần mẫu thử và tiền tăng sinh
9.1.1. Khái quát
Cho phần mẫu thử vào môi trường tiền tăng sinh theo mô tả dưới đây (từ 9.1.2 đến 9.1.9).
Chú thích – Về quy trình tiền tăng sinh và quy trình tăng sinh, xem bảng 1.
9.1.2. Sữa. Không cần thiết phải tiền tăng sinh đối với sữa. Tiến hành tiếp theo quy định trong 9.2, sử dụng phần mẫu thử 25 ml và môi trường tăng sinh 225 ml.
BẢNG 1 – Tóm tắt quy trình tiền tăng sinh và tăng sinh
| Sản phẩm | Cỡ mẫu | Môi trường tiền tăng sinh * | Phương pháp chuẩn bị | Môi trường tăng sinh chọn lọc thứ nhất và thứ hai |
| Sữa | 50ml (2x25ml) | Không | Trộn | 225 ml tetrathionat 225 ml xixtin selenit |
| Sữa bột | 25 g | Nước cất có dung dịch xanh briliant | Ngâm 60 phút ± 10 phút, không trộn + | 100 ml tetrathionat 100 ml xixtin selenit |
| Bột của dịch tách ra khi sản xuất phomat và bơ, bột bơ loãng | 25 g | Nước cất có dung dịch xanh briliant | Trộn | 100 ml tetrathionat 100 ml xixtin selenit |
| Lactoza | 25 g | 225 ml nước pepton có đệm | Trộn | 100 ml tetrathionat 100 ml xixtin selenit |
| Casein, phomat | 25 g | 225 ml nước pepton dung dịch đệm | Trộn ở nhiệt độ tối đa là 450C | 100 ml tetrathionat 100 ml xixtin selenit |
| Bơ | 25 ml | 225 ml nước pepton có đệm | Trộn | 100 ml tetrathionat 100 ml xixtin selenit |
| Sản phẩm sữa đông lạnh | 25 ml | 225 ml nước pepton có đệm | Trộn | 100 ml tetrathionat 100 ml xixtin selenit |
| Sữa lên men, sữa chua, curstad và món tráng miệng | 25 g | 225 ml nước pepton có đệm | Trộn | 100 ml tetrathionat 100 ml xixtin selenit |
| * khi có sử dụng môi trường tiền tăng sinh, sau khi nuôi ấm ở 370C trong 20h, cấy truyền 10 ml hỗn hợp mẫu đã cấy này vào mỗi bình môi trường tăng sinh. + Nếu sau 3h nuôi ấm mà sữa bột vẫn chưa hòa tan hết thì lắc bình để trộn. | ||||
9.1.3. Sữa bột, chuẩn bị một bình thí nghiệm có nút đựng 225 ml nước cất có thêm 1 ml dung dịch xanh brilliant (5.2.2.4). Cân 25 g mẫu thử một cách vô trùng và đổ lên bề mặt chất lỏng đựng trong bình đậy kín, Không lắc. Để yên ở nhiệt độ phòng trong 60 phút ± 10 phút trước khi đem nuôi ấm.
Không cần chỉnh pH.
9.1.4. Bột của dịch tách ra khi sản xuất phomat và bơ, bột bơ loãng. Cân 25 g mẫu thử một cách vô trùng cho vào 1 bình thí nghiệm có nút chứa 225 ml nước cất vô trùng. Lắc cho đến khi hòa tan và thêm 1 ml dung dịch xanh brilliant (5.2.2.4).
9.1.5. Lactoza. Cân 25 g mẫu thử một cách vô trùng cho vào 1 bình thí nghiệm có nút chứa 225 ml môi trường tiền tăng sinh (5.2.1) và lắc cho đến tan.
9.1.6. Casein, phomat. Cân 25 g mẫu thử một cách vô trùng cho vào cốc đựng mẫu vô trùng của máy nghiền trộn (6.6), và thêm 225 ml môi trường tiền tăng sinh (5.2.1) ở nhiệt độ 450C±10C. Trộn cho đến khi phần mẫu thử phân tán đều (từ 1 phút đến 3 phút). Giữ nhiệt độ không được vượt quá 450C.
9.1.7. Bơ. Làm tan chảy mẫu (một lượng nhiều hơn 25 g) trong 1 cốc đựng vô trùng trên nồi cách thủy (6.5) đã chỉnh nhiệt độ ở 450C±10C.
Lắc mẫu thử đã tan chảy và dùng pipet đã được làm ấm đến khoảng 450C lấy 25 ml phần mẫu thử cho vào bình thí nghiệm có chứa 225 ml môi trường tiền tăng sinh (5.2.1) và trộn.
9.1.8. Sản phẩm sữa đông lạnh (kể cả kem thực phẩm). Làm tan chảy mẫu (lớn hơn 25 g) trong 1 cốc đựng vô trùng trên nồi cách thủy (6.5) đã chỉnh nhiệt độ 450C±10C.
Dùng pipet lấy 25 ml mẫu thử cho vào bình thí nghiệm có chứa 225 ml môi trường tiền tăng sinh (5.2.1) và trộn.
9.1.9. Sữa lên men, sữa chua, bánh kem và món tráng miệng. Cân 25 g mẫu thử một cách vô trùng cho vào bình thí nghiệm có nút chứa bi thủy tinh (6.11) và 225 ml môi trường tiền tăng sinh (5.2.1) và lắc cho tan.
Chú thích 1 – Để đơn giản việc kiểm tra khi mẫu kiểm tra gồm nhiều “phần mẫu thử” 25 g được lấy ra từ 1 lô sữa hoặc sản phẩm sữa xác định, cần kiểm tra, và khi chứng minh được việc tạo thành mẫu chung (gộp chung các phần mẫu thử) không làm ảnh hưởng đến kết quả của sữa hoặc sản phẩm sữa thì có thể gộp lại các phần mẫu thử. Thí dụ, nếu kiểm tra 10 “phần mẫu thử”, mỗi phần 25 g, ta kết hợp 10 đơn vị với nhau để tạo thành một phần mẫu thử là 250 g và đem hòa tan hoặc khuếch tán trong 2,25 l môi trường tiền tăng sinh. Hoặc cách khác, các phần mẫu thử 10 ml của môi trường tiền tăng sinh từ 10 phần mẫu thử riêng rẽ có thể được kết hợp lại đem tăng sinh trong 1l môi trường tăng sinh chọn lọc.
Chú thích 2 – Kiểm tra pH của huyền phù và chỉnh đến 6,8±0,1 nếu thấy cần, trừ khi có quy định khác.
9.1.10. Nuôi ấm. Nuôi ấm các bình thí nghiệm đã chuẩn bị theo 9.1.3 đến 9.1.9 trong khoảng thời gian từ 16h đến 20h, trong tủ ấm ở nhiệt độ 370C±10C.
9.2. Tăng sinh
9.2.1. Cho 10 ml huyền phù đã nuôi ấm (9.1) vào 1 bình thí nghiệm có chứa 100 ml môi trường tăng sinh thứ nhất (5.2.2); lấy 10 ml huyền phù đã nuôi ấm khác cho vào 1 bình thí nghiệm chứa 100 ml môi trường tăng sinh chọn lọc thứ hai (5.2.3). Trong trường hợp đối với sữa, lấy một cách vô trùng 25 ml mẫu thử cho vào 225 ml môi trường tăng sinh thứ nhất (5.2.2) và 25 ml khác sữa cho vào 225 ml môi trường tăng sinh chọn lọc thứ hai (5.2.3).
9.2.2. Nuôi ấm môi trường tăng sinh thứ nhất đã cấy trong khoảng thời gian từ 18h đến 24h trong 1 nồi cách thủy hoặc trong tủ ấm (6.4) ở nhiệt độ 430C±0,50C, và môi trường chọn lọc thứ hai đã cấy trong khoảng thời gian từ 18h đến 24h trong tủ ấm (6.3) ở nhiệt độ 370C±10C.
9.3. Ria cấy và đọc kết quả
9.3.1. Dùng que cấy vòng lấy từ mỗi một bình thí nghiệm (9.2) một vòng đầy ria cấy lên bề mặt 1 đĩa môi trường chọn lọc thứ nhất (5.2.4) và lên bề mặt môi trường chọn lọc thứ hai (5.2.5) sao cho thu được các khuẩn lạc phân tách tốt. Tiếp tục nuôi ấm các bình thí nghiệm (xem 9.3.3).
9.3.2. Nuôi ấm các đĩa từ 20h đến 24h trong tủ ấm (6.3) ở nhiệt độ 370C±10C.
9.3.3. Sau khi nuôi ấm thêm các bình thí nghiệm trong khoảng từ 18h đến 24h, lặp lại việc cấy và quy trình nuôi ấm theo mô tả trong 9.3.1 và 9.3.2.
Chú thích 1 – Khi thời gian hạn chế, có thể nuôi ấm môi trường tăng sinh trong một chu kỳ đơn từ 18h đến 24h.
9.3.4. Sau khi nuôi ấm, kiểm tra sự có mặt của các khuẩn lạc Salmonella điển hình (xem 9.3.5) trên các đĩa (9.3.2 và 9.3.3). Nếu các khuẩn lạc mọc yếu và không điển hình cho Salmonella, nuôi ấm tiếp các đĩa trong 20h đến 24h nữa trong tủ ấm (6.3) ở nhiệt độ 370C±10C và kiểm tra lại các đĩa về sự có mặt của các khuẩn lạc Salmonella điển hình.
Chú thích 1 – Khi thời gian hạn chế, có thể nuôi ấm các môi trường đặc chọn lọc trong một chu kỳ đơn từ 20h đến 24h.
9.3.5. Các khuẩn lạc Salmonella điển hình có thể có các đặc tính sau đây:
a) Trên môi trường đặc chọn lọc thứ nhất (5.2.4) các khuẩn lạc Salmonella điển hình có màu nâu hoặc màu đen có ánh kim. Một số chủng cho ra các khuẩn lạc xanh lá;
b) Trên thạch xanh brilliant/đỏ phenol (5.2.5.2) các khuẩn lạc Salmonella điển hình có màu hồng với vùng môi trường bao quanh đỏ tươi;
c) Trên thạch XLD (5.2.5.3) các khuẩn lạc Salmonella điển hình có màu đỏ, có hoặc không có các điểm đen ở giữa.
d) Trên thạch Hektoen enteric (5.2.5.4) các khuẩn lạc Salmonella điển hình có màu xanh lam, có hoặc không có các điểm đen ở giữa.
Chú thích – Do việc nhận biết các khuẩn lạc Salmonella đòi hỏi phải có nhiều kinh nghiệm, và do vẻ ngoài của chúng trên các môi trường nhận diện có thể thay đổi tùy chủng hoặc tùy lô môi trường, nên phải chọn các khuẩn lạc nghi ngờ và khuẩn lạc điển hình để kiểm tra tiếp.
9.4. Khẳng định
9.4.1. Chọn các khuẩn lạc để khẳng định
Để khẳng định, lấy năm khuẩn lạc điển hình hoặc có nghi ngờ từ mỗi đĩa của từng môi trường chọn lọc (xem 9.3.4).
Nếu trên một đĩa có ít hơn năm khuẩn lạc điển hình hoặc nghi ngờ, thì lấy tất cả các khuẩn lạc điển hình hoặc nghi ngờ đó đem khẳng định.
Ria cấy các khuẩn lạc đã chọn lên bề mặt các địa thạch dinh dưỡng đã được làm khô trước (5.2.6) sao cho các khuẩn lạc mọc phân tách rõ ràng.
Nuôi ấm các đĩa đã cấy thời gian từ 18h đến 24h trong tủ ấm (6.3) ở nhiệt độ 370C±10C.
Lấy các khuẩn lạc thuần khiết để khẳng định đặc tính sinh hóa và huyết thanh.
9.4.2. Khẳng định tính sinh hóa
Chú thích – Có thể sử dụng hệ thống chẩn đoán nhanh có bán sẵn trên thị trường thay cho trình tự mô tả trong 9.4.2.1 đến 9.4.2.8 để khẳng định sinh hóa các khuẩn lạc Salmonella nếu chúng phù hợp với mục đích. Cần tuân theo các chỉ dẫn của nhà sản xuất.
9.4.2.1. Nuôi cấy. Dùng que cấy vòng để cấy từ mỗi giống vi khuẩn thu được từ các khuẩn lạc đã chọn trong 9.4.1, vào các môi trường chỉ định trong 9.4.2.2 đến 9.4.2.7.
9.4.2.2. Thạch TSI (5.2.7). Ria cấy lên bề mặt nghiêng của thạch và chích sâu vào mặt thạch.
Nuôi trong tủ ấm 24h đặt ở nhiệt độ 370C±10C. Diễn giải sự biến đổi ở các môi trường như sau:
Cột thạch:
| Màu vàng: | glucoza dương tính (lên men glucoza) |
| Màu đỏ hoặc không đổi màu: | glucoza âm tính (không lên men glucoza) |
| Màu đen: | có tạo thành sunfua hidro |
| Có bọt khí hoặc có vết nứt: | sinh khí từ glucoza |
Bề mặt thạch nghiêng:
| Màu vàng: | lactoza và/hoặc xacaroza dương tính (có sử dụng lactoza và/hoặc xacaroza) |
| Màu đỏ hoặc không đổi màu: | lactoza và/hoặc xacaroza âm tính (không sử dụng lactoza hoặc xacaroza) |
Các giống Salmonella điển hình cho tính kiềm (màu đỏ) trên thạch nghiêng, có sinh khí và axit (màu vàng), ở cột thạch, và (khoảng 90% trường hợp có sinh sunfua hidro (làm đen thạch).
Khi có 1 chủng Salmonella lactoza dương tính được phân lập, mặt nghiêng thạch TSI sẽ có màu vàng. Do đó, việc khẳng định sơ bộ các giống Salmonella không được chỉ dựa vào kết quả thử trên thạch TSI (xem 9.4.3).
9.4.2.3. Thạch ure (5.2.8). Ria cấy lên bề mặt nghiêng của thạch. Nuôi trong 24h trong tủ ấm (6.3) ở nhiệt độ 370C±10C và thỉnh thoảng kiểm tra.
Nếu phản ứng dương tính, việc phân giải ure sẽ giải phóng amoniac, làm đổi màu đỏ phenol sang màu hoa hồng và sau đó chuyển sang màu đỏ tím.
9.4.2.4. Môi trường lysin decacboxyl (5.2.9). Cấy ngay dưới bề mặt của môi trường lỏng.
Nuôi trong 24h trong tủ ấm (6.3) ở nhiệt độ 370C±10C.
Màu đỏ tía xuất hiện sau khi vi khuẩn sinh trưởng là phản ứng dương tính. Màu vàng là phản ứng âm tính.
9.4.2.5. Phát hiện β-galactosidaza. Hòa 1 vòng que cấy đầy từ khuẩn lạc nghi ngờ vào 1 ống nghiệm có chứa 0,25 ml dung dịch muối (5.2.14).
Thêm 1 giọt toluen (5.2.15) và lắc ống nghiệm. Đặt ống nghiệm này vào nồi cách thủy (6.5) ở nhiệt độ 370C±10C và để yên vài phút.
Thêm 0,25 ml thuốc thử β-galactosidaza (5.2.10) và lắc trộn.
Đặt lại ống nghiệm vào nồi cách thủy để ở nhiệt độ 370C±10C và để yên 24h.
Có màu vàng chứng tỏ phản ứng dương tính. Phản ứng thường xẩy ra sau 20 phút.
9.4.2.6. Môi trường thử phản ứng Voges – Proskeuer (VP) (5.2.11). Hòa một vòng que cấy đầy từ khuẩn lạc nghi ngờ vào 1 ống nghiệm vô trùng chứa 3 ml môi trường VP (5.2.11.1).
Nuôi 24h trong tủ ấm (6.3) ở nhiệt độ 370C±10C.
Sau khi nuôi ấm lấy ra 0,2 ml dịch cấy cho vào 1 ống nghiệm, thêm hai giọt dung dịch creatin (5.2.11.2), ba giọt dung dịch 1-naphtol trong cồn (5.2.11.3), sau đó thêm hai giọt dung dịch kali hidroxit (5.2.11.4); lắc ống sau mỗi lần thêm thuốc thử.
Việc xuất hiện màu hồng đến màu đỏ tươi trong vòng 15 phút là phản ứng dương tính.
9.4.2.7. Môi trường thử phản ứng indol (5.2.12). Cấy khuẩn lạc nghi ngờ vào 1 ống nghiệm chứa 5 ml môi trường tripton/triptophan (5.2.12.1).
Nuôi 24h trong tủ ấm (6.3) ở nhiệt độ 370C±10C.
Sau khi nuôi ấm, thêm 1 ml thuốc thử Kovacs (5.2.12.2).
Có tạo thành vòng màu đỏ là phản ứng dương tính. Vòng màu vàng nâu là phản ứng âm tính.
9.4.2.8. Suy luận từ các thử nghiệm sinh hóa. Salmonella thông thường cho các phản ứng như thấy trong bảng 2 (xem chú thích 1 của bảng 2).
9.4.3. Khẳng định về huyết thanh
9.4.3.1. Khái quát. Việc phát hiện sự có mặt các kháng nguyên Salmonella O, Vi và H được tiến hành bằng sự dính kết trên phiến kính với huyết thanh tương ứng trên các khuẩn lạc thuần khiết (9.4.1) và sau khi đã loại trừ các chủng dính kết.
9.4.3.2. Loại trừ các chủng tự dính kết. Cho một giọt dung dịch muối (5.2.14) lên 1 phiến kính đã rửa sạch. Dàn đều khuẩn lạc cần thử nghiệm trong giọt dung dịch này sao cho thu được 1 thể huyền phù đục đồng nhất.
Lắc nhẹ phiến kính trong 30 giây đến 60 giây.
Quan sát kết quả trên nền đen, tốt nhất nên dùng kính lúp.
Nếu các vi khuẩn vón lại thành các đơn vị ít nhiều có dính kết thì chủng này được coi là tự dính kết và không cần phải thử tiếp vì việc phát hiện kháng nguyên không thể thực hiện được.
9.4.3.3. Kiểm tra kháng nguyên O. Sử dụng một khuẩn lạc thuần khiết không tự ngưng kết, tiến hành theo 9.4.3.2 bằng cách lấy một giọt kháng huyết thanh O (5.3) thay cho dung dịch muối.
Nếu xuất hiện dính kết, phản ứng được coi là dương tính. Sử dụng tuần tự một kháng huyết thanh đa và đơn giá.
9.4.3.4. Kiểm tra kháng nguyên Vi. Tiến hành theo 9.4.3.2, nhưng sử dụng một giọt kháng huyết thanh Vi (5.3) thay cho dung dịch muối.
Nếu xuất hiện dính kết, phản ứng được coi là dương tính.
9.4.3.5. Kiểm tra kháng nguyên H. Cấy từ 1 khuẩn lạc không tự dính kết thuần khiết lên thạch dinh dưỡng thể nửa đặc (5.2.13).
Nuôi môi trường này từ 18h đến 24h ở nhiệt độ 370C±10C.
Dùng giống cây này để kiểm tra kháng nguyên H, tiến hành theo 9.4.3.2, nhưng sử dụng một giọt kháng huyết thanh H (5.3) thay cho dung dịch muối.
Nếu xuất hiện dính kết phản ứng được coi là dương tính.
9.4.4. Suy luận từ các phản ứng sinh hóa và huyết thanh. Bảng 3 cho phép nội suy từ các thử nghiệm khẳng định (xem 9.4.2) và (9.4.3) được tiến hành trên các khuẩn lạc chọn lọc (xem 9.4.1).
9.4.5. Khẳng định cuối cùng. Các chủng được coi là Salmonella, hoặc có thể là Salmonella, (xem bảng 3) gửi đến một trung tâm giữ chuẩn Salmonella đã được công nhận để khẳng định lần cuối.
Việc gửi mẫu này phải kèm theo tất cả các thông tin cần thiết liên quan đến chủng vi khuẩn đó.
10. Các giống vi khuẩn cấy để kiểm chứng
Để kiểm tra về khả năng đảm bảo cho Salmonella phát triển của các môi trường tăng sinh và nhận biết cần cấy một giống Salmonella chuẩn vào các bình thí nghiệm chứa hai loại môi trường tăng sinh (9.2). Tiếp theo tiến hành với các bình kiểm tra như đối với các giống vi khuẩn cấy thử nghiệm để chứng minh rằng giống vi khuẩn đối chứng dương tính có thể phát triển được.
Bảng 2 – Phản ứng sinh hóa của Salmonella
| Môi trường khẳng định sinh hóa | Phản ứng âm tính hoặc dương tính | Phần trăm chủng Salmonella cho phản ứng (xem chú thích 2) |
| TSI glucoza (sinh axit) (9.4.2.2) | + | % 100 |
| TSI glucoza (sinh khí) (9.4.2.2) | + | 91,9 (xem chú thích 3) |
| TSI lactoza (9.4.2.2) | - | 99,2 |
| TSI xacaroza (9.4.2.2) | - | 99,5 |
| TSI hidro sunfua (9.4.2.2) | + | 91,6 |
| Phân giải ure (9.4.2.3) | - | 100 |
| Lyxin decacboxyl (9.4.2.4) | + | 94,6 |
| Phản ứng β-galatoxidaza (9.4.2.5) | - | 98,5 (xem chú thích 4) |
| Phản ứng Voges – Proskauer (9.4.2.6) | - | 100 |
| Phản ứng indol (9.4.2.7) | - | 98,9 |
| Chú thích 1 – W H Ewing và M M Bali. Các phản ứng sinh hóa của Salmonella (1966) Chú thích 2 – Số phần trăm này chỉ chứng tỏ rằng không phải tất cả các chủng Salmonella cho các phản ứng ký hiệu + hoặc -; Phần trăm này có thể thay đổi theo từng nước và theo từng loại sản phẩm thực phẩm. Chú thích 3 – Salmonella typhi là vi sinh vật kỵ khí. Chú thích 4 – Các Salmonella nhóm III (Arizona) cho các phản ứng lactoza dương tính hoặc âm tính nhưng luôn luôn cho phản ứng β-galactosidaza dương tính. Các Salmonella nhóm II có thể cho phản ứng lactoza âm tính nhưng có thể cho phản ứng β-galactosidaza dương tính. | ||
Bảng 3 – Suy luận từ các phép thử khẳng định
| Các phản ứng sinh hóa | Tự dính kết | Các phản ứng huyết thanh | Suy luận |
| Điển hình | Không | Kháng thể O, Vi hoặc H dương tính | Các chủng được coi là Salmonella |
| Điển hình | Không | Tất cả phản ứng âm tính | Có thể là Salmonella |
| Điển hình | Có | Không thử | |
| Phản ứng không điển hình | Không | Kháng nguyên O, Vi hoặc H dương tính | |
| Phản ứng không điển hình | Không | Tất cả phản ứng âm tính | Không được coi là Salmonella |
11. Biểu thị kết quả
Theo kết quả suy luận, ghi lại sự có mặt hay không có mặt Salmonella trong phần mẫu thử xác định theo đơn vị khối lượng tính bằng gam hay thể tích, tính bằng mililit mẫu thử.
12. Báo cáo kết quả
Báo cáo kết quả phải ghi số hiệu của tiêu chuẩn này và kết quả thu được. Cũng phải nêu tên môi trường đặc chọn lọc thứ hai (5.2.5.1) đã sử dụng và tất cả các điều kiện thao tác không quy định trong tiêu chuẩn này, hoặc được xem là tùy ý, cùng với mọi tình huống bất thường có thể ảnh hưởng đến kết quả.
Báo cáo kết quả cũng bao gồm các thông tin cần thiết cho việc nhận biết đầy đủ về mẫu thử.
PHỤ LỤC A
SƠ ĐỒ TIẾN HÀNH THỬ
Phần mẫu thử, 25 g
PHỤ LỤC B
XANH BRILLIANT
B.1. Đặc tính vi khuẩn học
Hạn chế việc phân tán vi khuẩn Proteus lên môi trường thạch xanh brillian/đỏ phenol khi việc phát triển của Salmonella không bị ức chế.
B.2. Phương pháp thử
B.2.1. Môi trường
Chuẩn bị môi trường thạch xanh brillian/đỏ phenol theo 5.2.5.1 nhưng có các nồng độ của xanh brillian khác nhau trong phạm vi từ 4,5 mg/l đến 6 mg/l.
B.2.2. Cách tiến hành
Cấy khuẩn lạc thuần khiết Proteus chuyển động và khuẩn lạc Salmonella thần khiết lên các đĩa thạch có các nồng độ xanh brillian khác nhau và để các đĩa này trong tủ ấm (6.3) ở 370C±10C không quá 24h.
Nồng độ xanh brillian thích hợp cho Salmonella phát triển thành các khuẩn lạc màu hồng điển hình có đường kính từ 1 mm đến 2 mm, còn hạn chế việc phát triển Proteus, tức là loại này không mọc lan rộng.
Nên dùng nồng độ xanh brillian này để chuẩn bị dung dịch xanh brillian (xem 5.2.2.4).
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 6402:1998 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 6402:1998 DOC (Bản Word)