- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 10927:2015 EN 15829:2010 Thực phẩm - Xác định ochratoxin A trong các loại nho khô, hỗn hợp quả khô và quả vả khô - Phương pháp sắc ký lỏng hiệu năng cao sử dụng detector huỳnh quang và làm sạch bằng cột ái lực miễn nhiễm
| Số hiệu: | TCVN 10927:2015 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Thực phẩm-Dược phẩm |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
16/12/2015 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 10927:2015
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 10927:2015
TIÊU CHUẨN QUỐC GIA
TCVN 10927:2015
EN 15829:2010
THỰC PHẨM - XÁC ĐỊNH OCHRATOXINA TRONG CÁC LOẠI NHO KHÔ, HỖN HỢP QUẢ KHÔ VÀ QUÀ VẢ KHÔ - PHƯƠNG PHÁP SÁC KÝ LỎNG HIỆU NĂNG CAO SỬ DỤNG DETECTOR HUỲNH QUANG VÀ LÀM SẠCH BẰNG CỘT ÁI LỰC MIỄN NHIỄM
Foodstuffs. Determination of ochratoxin A in currants, raisins, sultanas, mixed dried fruit and dried figs - HPLC method with immunoaffinity colum cleanup and fluorescence detection
Lời nói đầu
TCVN 10927:2015 hoàn toàn tương đương EN 15829:2010;
TCVN 10927:2015 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC/F13 Phương pháp phân tích và lấy mẫu biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
THỰC PHẨM - XÁC ĐỊNH OCHRATOXINA TRONG CÁC LOẠI NHO KHÔ, HỖN HỢP QUẢ KHÔ VÀ QUÀ VẢ KHÔ - PHƯƠNG PHÁP SÁC KÝ LỎNG HIỆU NĂNG CAO SỬ DỤNG DETECTOR HUỲNH QUANG VÀ LÀM SẠCH BẰNG CỘT ÁI LỰC MIỄN NHIỄM
Foodstuffs - Determination of ochratoxin A in currants, raisins, sultanas, mixed dried fruit and dried figs - HPLC method with immunoaffinity colum cleanup and fluorescence detection
1 Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp xác định ochratoxin A trong một số loại nho khô, hỗn hợp quả khô và quả và khô bằng sắc ký lỏng hiệu năng cao (HPLC) có làm sạch bằng cột ái lực miễn nhiễm và sử dụng detector huỳnh quang. Phương pháp này đã được đánh giá trong nghiên cứu liên phòng thử nghiệm phân tích cả trên mẫu nhiễm tự nhiên và mẫu thêm chuẩn trong dài từ 1,1 μg/kg đến 11 μg/kg.
Thông tin về việc đánh giá xác nhận được nêu trong Điều 9 và Phụ lục B.
CẢNH BÁO - Khi áp dụng tiêu chuẩn này có thể liên quan đến các vật liệu, thiết bị và các thao tác gây nguy hiểm. Tiêu chuẩn này không đưa ra được hết tất cả các vấn đề an toàn liên quan đến việc sử dụng chúng. Người sử dụng tiêu chuẩn này phải tự thiết lập các thao tác an toàn thích hợp và xác định khả năng áp dụng hoặc các giới hạn quy định trước khi sử dụng tiêu chuẩn.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 4851:1989 (ISO 3696:1987), Nước dùng để phân tích trong phòng thí nghiệm - Yêu cầu kỹ thuật và phương pháp thử.
3 Nguyên tắc
Chiết phần mẫu thử bằng hỗn hợp metanol và axit phosphoric. Lọc dịch chiết, pha loãng bằng muối đệm phosphat và được đưa lên cột ái lực miễn nhiễm chứa các kháng thể đặc hiệu đối với ochratoxin A. Ochratoxin A được tách, tinh sạch và cô đặc trên cột sau đó được tách bằng dung môi rửa giải. Định lượng ochratoxin A bằng sắc ký lỏng hiệu năng cao (HPLC) pha đảo có detector huỳnh quang.
4 Thuốc thử
4.1 Yêu cầu chung
Chỉ sử dụng thuốc thử loại tinh khiết phân tích và nước đạt loại 1 trong TCVN 4851:1989 (ISO 3696:1987), trừ khi có quy định khác. Dung môi phải đạt chất lượng dùng cho phép phân tích HPLC. Có thể sử dụng các dung dịch có bán sẵn có các đặc tính tương đương với các loại được liệt kê dưới đây.
CẢNH BÁO - Thải bỏ các dung môi rửa giải phù hợp với quy định về môi trường. Các quy trình khử nhiễm các chất thải phòng thử nghiệm, cần thực hiện theo quy định của Cơ quan nghiên cứu ung thư Quốc tế (IARC), xem [1].
4.2 Khí nén heli đã tinh sạch
4.3 Dinatri hydro phosphat, dạng khan hoặc dinatri hydro phosphat ngậm 12 phân tử nước
(Na2HPO4.12 H2O)
4.4 Kali clorua.
4.5 Kali dihydro phosphat
4.6 Natri clorua.
4.7 Natri hydroxit.
4.8 Dung dịch amoni hydroxit, nồng độ c(NH4OH) = 1,1 mol/l, dùng để điều chỉnh pH sau cột.
Chuẩn bị ngay khi cần dùng (tùy chọn, xem 7.2).
4.9 Dung dịch axit clohydric, phần khối lượng w(HCI) = 37 % trong nước.
4.10 Dung dịch axit phosphoric, c(H3PO4) = 0,1 mol/l.
4.11 Dung dịch axit clohydric, c(HCI) = 0,1 mol/l.
Pha loãng 8,28 ml dung dịch axit clohydric (4.9) bằng nước đến 1 lít.
4.12 Dung dịch natri hydroxit, c(NaOH) = 0,1 mol/l.
Hòa tan 4 g natri hydroxit (4.7) trong 1 lít nước.
4.13 Dung dịch muối đệm phosphat (PBS)
Hòa tan 8,0 g natri clorua (4.6), 1,2 g dinatri hydro phosphat khan hoặc 2,9 g dinatri hydro phosphat ngậm 12 phân tử nước (4.3), 0,2 g kali dihydro phosphat (4.5) và 0,2 g kali clorua (4.4) trong 900 ml nước,
Sau khi hòa tan, chỉnh pH đến 7,4 bằng dung dịch axit clohydric (4.11) hoặc dung dịch natri hydroxit (4.12), sau đó pha loãng bằng nước đến 1 lít. Cách khác, có thể chuẩn bị dung dịch PBS có các đặc tính tương tự từ các vật liệu PBS bán sẵn.
4.14 Axetonitril
CẢNH BÁO - Axetonitril là chất độc và khi trộn mẫu phải dùng máy nghiền trộn chống nổ đặt trong tủ hút. Sau khi trộn, mẫu phải được lọc trong tủ hút.
4.15 Axit axetic băng, w(CH3COOH) ≥ 98 %
4.16 Metanol
4.17 Toluen
4.18 Dung môi bơm
Trộn 80 phần thể tích nước với 20 phần thể tích axetonitril (4.14) và 2 phần thể tích axit axetic băng (4.15).
4.19 Pha động HPLC
Trộn 99 phần thể tích nước với 99 phần thể tích axetonitril (4.14) và hai phần thể tích axit axetic băng (4.15). Khử khí dung môi pha động, ví dụ: bằng khí heli (4.2).
4.20 Hỗn hợp toluen và axit axetic băng
Trộn 99 phần thể tích toluen (4.17) với một phần thể tích axit axetic băng (4.15).
4.21 Cột ái lực miễn nhiễm
Cột ái lực miễn nhiễm phải chứa các kháng thể đặc hiệu đối với ochratoxin A. Cột phải có khả năng giữ được không nhỏ hơn 100 ng ochratoxin A và có độ thu hồi không nhỏ hơn 70 % khi sử dụng 5 ng ochratoxin A trong dung dịch gồm năm phần thể tích axetonitril (4.14) và 95 phần thể tích muối đệm phosphat (4.13).
4.22 Chất lỏng để silan hóa bề mặt (tùy chọn)
Trộn một phần thể tích của chất lỏng silan hóa bề mặt với 19 phần thể tích toluen (4.17).
4.23 Ochratoxin A, dạng tinh thể hoặc dạng màng trong ampoule
4.24 Dung dịch gốc Ochratoxin A
CẢNH BÁO - Ochratoxin A có nguy cơ gây độc đến thận, gây quái thai và có khả năng ảnh hưởng đến di truyền. Tổ chức Quốc tế về nghiên cứu bệnh ung thư (IARC) đã phân loại ochratoxin A là chất có thể gây ung thư cho người (nhóm 2 B). Phải mặc quần áo bảo hộ, găng tay và kính an toàn vào mọi lúc và phải tiến hành tất cả các giai đoạn chuẩn bị mẫu và chuẩn bị các chuẩn trong tủ hút
Hòa tan 1 mg ochratoxin A hoặc lượng chứa trong 1 ampoule (nếu ochratoxin A ở dạng màng mỏng) trong hỗn hợp dung môi (4.20) để thu được dung dịch chứa khoảng từ 20 μg/ml đến 30 μg/ml ochratoxin A.
Để xác định chính xác nồng độ, sử dụng máy đo quang phổ (5.12) ghi đường cong hấp thụ giữa bước sóng từ 300 nm đến 370 nm trong cuvet thạch anh 1 cm dùng hỗn hợp dung môi (4.20) để so sánh. Nhận biết bước sóng có độ hấp thụ tối đa. Tính nồng độ khối lượng của ochratoxin A, ρota, bằng microgam trên mililit, sử dụng Công thức (1):
|
| (1) |
Trong đó:
Amax là độ hấp thụ cực đại xác định được trên đường hấp thụ (bước sóng này là: 333 nm)
M là khối lượng mol của ochratoxin A (M = 403,8 g/mol), tính bằng gam trên mol (g/mol).
ε là hệ số hấp thụ mol của ochratoxin A trong hỗn hợp dung môi (4.20), tính bằng mét vuông trên mol (m2/mol) (trong trường hợp này là: 544 m2/mol, xem [2]);
b là chiều dài đường quang của cuvet thạch anh, tính bằng xentimet (cm).
Bảo quản dung dịch này trong tủ đông lạnh ở nhiệt độ khoảng -18 °C. Đưa nhiệt độ của dung dịch đến nhiệt độ phòng trước khi mở. Dung dịch được bảo quản bằng cách này có thể bền được trong 12 tháng. Cứ sau 6 tháng thi cần kiểm tra lại nồng độ của dung dịch.
4.25 Dung dịch thêm chuẩn ochratoxin A
Chuyển một lượng dung dịch gốc (4.24) chứa 12,5 μg ochratoxin A vào bình định mức 5 ml. Cho bay hơi đến khô dưới dòng khí nitơ ở nhiệt độ không quá 50 °C. Hòa tan lại ngay trong metanol (4.16) và thêm metanol đến vạch. Dung dịch này chứa ochratoxin A nồng độ 2,5 μg/ml.
Bảo quản dung dịch này trong tủ đông lạnh ở nhiệt độ khoảng -18 °C. Đưa nhiệt độ của dung dịch đến nhiệt độ phòng trước khi mở. Dung dịch được bảo quản bằng cách này có thể bền được trong 12 tháng. Cứ sau 6 tháng thì cần kiểm tra lại nồng độ của dung dịch.
4.26 Dung dịch chuẩn ochratoxin A
Chuyển 500 μl dung dịch thêm chuẩn ochratoxin A (4.25) vào bình định mức 5 ml, thêm metanol (4.16) đến vạch. Dung dịch này chứa ochratoxin A nồng độ 0,25 μg/ml.
Bảo quản dung dịch này trong tủ đông lạnh ở nhiệt độ khoảng -18 °C. Đưa nhiệt độ của dung dịch đến nhiệt độ phòng trước khi mở. Dung dịch được bảo quản bằng cách này có thể bền được trong 12 tháng. Cứ sau 6 tháng thì cần kiểm tra lại nồng độ của dung dịch.
5 Thiết bị, dụng cụ
5.1 Yêu cầu chung
Sử dụng các thiết bị và dụng cụ thủy tinh thông thường của phòng thử nghiệm và các thiết bị, dụng cụ sau:
5.2 Lọ thủy tinh nhỏ đã silan hóa (tùy chọn)
Chuẩn bị các lọ nhỏ bằng cách đổ đầy thuốc thử silan hóa bề mặt (4.22) và để thuốc thử này trong lọ nhỏ trong 1 min. Đầu tiên, tráng lọ bằng dung môi có độ phân cực thấp, ví dụ: toluen (4.17) sau đó tráng bằng metanol (4.16) và làm khô trước khi sử dụng.
CẢNH BÁO - Sử dụng thủy tinh đã silan hóa có thể ngăn ochratoxin A dính vào thủy tinh trong quá trình bay hơi.
5.3 Bộ trộn tốc độ cao hoặc bộ đồng hóa.
5.4 Cân phân tích, có thể cân chính xác đến 0,000 1 g.
5.5 Cân phòng thử nghiệm, có thể cân chính xác đến 0,1 g.
5.6 Pipet xả hết, có thể điều chỉnh được, dung tích 10 ml, 5 ml, 1 ml và 200 μl có đầu tip thích hợp.
5.7 Bộ phân phối chân không, thích hợp với cột ái lực miễn nhiễm.
5.8 Bình chứa và bình nối, để gắn với cột ái lực miễn nhiễm.
5.9 Bơm chân không, có thể đạt độ chân không 1 kPa và bơm với tốc độ 18 l/min.
5.10 Giấy lọc, có cỡ lỗ 20 μm đến 25 μm.
5.11 Thiết bị HPLC, gồm các bộ phận sau:
5.11.1 Hệ thống bơm, có thể bơm ví dụ: 100 μl
5.11.2 Bơm pha động, đẳng dòng, không xung, có khả năng duy trì được tốc độ dòng 1 ml/min.
5.11.3 Lò cột (tùy chọn), có thể duy trì nhiệt độ ổn định khi có bất kỳ sự thay đổi nào gây ra do dao động nhiệt độ phòng (ví dụ: (45 ± 1) °C, ± 0,5 °C nhiệt độ lập lại và ổn định).
5.11.4 Cột tách HPLC phân tích pha đảo, ví dụ: C18 octadecylsilan (ODS), dài 25 cm, đường kính trong 4,6 mm và kích cỡ hạt 5 μm, cột này phải đảm bảo phân giải ochratoxin A ra khỏi các pic khác. Mức độ tối đa các pic chồng lên nhau phải nhỏ hơn 10 %. Nếu cần, chỉnh pha động để đường nền đủ độ phân giải. Có thể sử dụng cột bảo vệ pha đào tương ứng phù hợp.
5.11.5 Máy khử khí (tùy chọn)
5.11.6 Detector huỳnh quang, được gắn với cuvet dòng chảy và cài đặt ở bước sóng 333 nm (bước sóng kích thích) và 477 nm (bước sóng phát xạ), hoặc cài đặt ở bước sóng 390 nm (bước sóng kích thích) và 440 nm (bước sóng phát xạ), nếu sử dụng hệ thống sau cột, tùy chọn.
5.11.7 Máy ghi, máy tích phân hoặc máy tính có hệ thống xử lý dữ liệu.
5.11.8 Hệ thống sau cột (tùy chọn), gồm có bơm, đẳng dòng, không xung, có thể duy trì tốc độ dòng thể tích 0,3 ml/min, thể tích khoang chết hình chữ T bằng zero và cuộn phản ứng dài 1 500 mm, đường kính trong 0,25 mm [bằng thép không gỉ hoặc bằng polyetheretherketon (PEEK)].
5.12 Máy đo phổ UV.
6 Cách tiến hành
6.1 Chuẩn bị mẫu dạng hồ nhão
Cân mẫu phòng thử nghiệm nhận được và ghi lại khối lượng. Có thể nghiền nhỏ mẫu để giảm kích cỡ. Thêm nước theo tỷ lệ năm phần quả, bốn phần nước. Đồng hóa mẫu và nước ít nhất 30 min hoặc cho đến khi đạt được dạng hồ nhão sánh.
Trong mọi trường hợp, nếu mẫu ở dạng đông lạnh thi rã đông hoàn toàn mẫu trước khi lấy mẫu. Khuấy kỹ mẫu dạng sệt trước khi lấy phần mẫu thử để phân tích.
6.2 Chiết
Cân 45 g quả dạng hồ nhão, chính xác đến 0,2 g cho vào cốc có mỏ. Thêm 50 ml metanol (4.16) và 5 ml dung dịch axit phosphoric (4.10). Trộn đều bằng bộ đồng hóa (5.3) từ 3 min đến 4 min Lọc hỗn hợp qua giấy lọc (5.10).
CHÚ THÍCH: 45 g quá dạng hồ nhão tương dương với 25 g quả khô và 20 ml nước khi chuẩn mẫu bị dạng hồ nhão sử dụng phương pháp nêu trong 6.1. Thể tích chiết (V1 = 75 ml) gồm nước được thêm vào dung dịch metanol và axit phosphoric.
6.3 Làm sạch bằng cột ái lực miễn nhiễm
Quá trình làm sạch có thể tiến hành bằng cách sử dụng chân không với áp suất dương hoặc cho các thể tích quy định tự chảy qua cột. Không được vượt quá tốc độ dòng quy định tối đa. Đặc biệt chú ý khi dùng bộ phân phối chân không.
Chuẩn bị cột ái lực miễn nhiễm theo hướng dẫn của nhà sản xuất. Lấy chính xác 12 ml dịch lọc cho vào bình định mức 100 ml hoặc bình nón và pha loãng đến 100 ml bằng PBS (4.13) và lắc mạnh để trộn đều.
Thêm 50 ml dịch chiết mẫu đã pha loãng vào bình chứa của cột và cho chảy qua cột ái lực miễn nhiễm (V3 = 6 ml). Tốc độ dòng chảy không vượt quá 5 ml/min. Không được để cột chảy đến khô. Rửa cột bằng 10 ml nước (hoặc bằng PBS theo hướng dẫn của nhả sản xuất cột). Đặt lọ nhỏ (5.2) vào dưới cột ái lực miễn nhiễm.
CHÚ THÍCH: Tiến hành cẩn thận không để vượt quá dung tích của cột ái lực miễn nhiễm.
6.4 Chuẩn bị dung dịch mầu thử
Rửa giải ochratoxin A vào lọ nhỏ (5.2) bằng dung môi thích hợp theo khuyến cáo của nhả sản xuất cột. Đặc biệt cẩn thận khi dùng bộ phân phối chân không. Làm bay hơi dịch rửa giải trong cột đến khô dưới dòng khí nitơ. Hòa tan lại bằng 1,0 ml dung môi bơm (4.18). Chuyển vào lọ HPLC (V2 = 1 ml).
Cách khác, pha loãng dịch lỏng rửa giải cột bằng nước (hoặc nước chứa 2 % axit axetic tùy thuộc vào dung môi rửa giải) để chuẩn bị dung dịch thử phân tích. Thêm 2 ml nước (V2 = 3 ml) vào 1 ml dịch rửa giải. Trộn kỹ.
Việc làm sạch, chuẩn bị dung dịch mẫu thử và các bước HPLC của phương pháp này, có thể được tiến hành bằng hệ thống tự động như hệ thống làm sạch dịch chiết pha rắn tự động (ASPEC) với điều kiện quá trình làm sạch cần tuân thủ các điều kiện mô tả trong phương pháp này, ví dụ: thể tích và tốc độ dòng.
6.5 Quy trình thêm chuẩn
Cân 45 g quả dạng hồ nhão mẫu trắng, chính xác đến 0,2 g cho vào cốc có mỏ hoặc bình trộn. Dùng pipet lấy 50 μl dung dịch thêm chuẩn ochratoxin A (4.25) vào dịch quả dạng hồ nhão mẫu trắng. Để hồ nhão đã thêm chuẩn trong tủ hút ít nhất 30 min. Tiến hành như quy trình nêu trong 6.2.
7 Phân tích HPLC
7.1 Điều kiện vận hành HPLC
Khi sử dụng cột đáp ứng các quy định trong 5.11.4 và pha động quy định trong 4.19 thì cài đặt các thông số như sau được coi là phù hợp. Ochratoxin A rửa giải trong khoảng từ 9 min đến 10 min.
| - Tốc độ dòng pha động (cột): | 1,0 ml/min; |
| - Detector huỳnh quang, bước sóng phát xạ: | 477 nm; |
| - Detector huỳnh quang, bước sóng kích thích: | 333 nm; |
| - Thể tích bơm: | 100 μl đến 200 μl |
| - Mẫu chiết được pha loãng bằng nước: | 300 μl đến 600 μl. |
7.2 Các điều kiện phản ứng sau cột (tùy chọn)
Sử dụng hệ thống phản ứng sau cột có thể làm tăng tín hiệu và cải thiện giới hạn phát hiện ochratoxin A. Nó có thể làm giảm độ nhiễu đường nền đối với một số mẫu. Có thể sử dụng chúng để khẳng định việc nhận biết ochratoxin A trong các mẫu bị nhiễm, sử dụng hệ thống sau cột nêu trong 5.11.8 và cột nêu trong 5.11.4, các điều kiện HPLC sau đây cho thấy làm tăng tín hiệu của ochratoxin A từ 3 lần đến 4 lần.
| - Tốc độ dòng phản ứng sau cột (4.8): | 0,3 ml/min; |
| - Detector huỳnh quang, bước sóng phát xạ: | 440 nm; |
| - Detector huỳnh quang, bước sóng kích thích: | 390 nm; |
| - Vòng phản ứng sau cột: | 1 500 mm x 0,25 mm đường kính trong |
| - Thể tích bơm: | 100 μl đến 200 μl. |
| - Mẫu chiết được pha loãng bằng nước: | 300 μl đến 600 μl. |
CHÚ THÍCH 1: Dịch rửa giải phải có tính kiềm (pH đặc trưng ≈ 9) sau detector. Kiểm tra bằng cách sử dụng giấy chỉ thị pH.
CHÚ THÍCH 2: Làm giảm hơi amoniac bằng cách thêm dung dịch axit xitric bão hòa vào bình thải.
7.3 Chuẩn bị các dung dịch hiệu chuẩn đối với HPLC
Chuẩn bị bốn dung dịch hiệu chuẩn HPLC đựng trong các bình định mức 5 ml riêng rẽ theo Bảng 1. Thêm 5 ml dung môi bơm (4.18) vào mỗi dung dịch hiệu chuẩn đến vạch.
Bảng 1 - Chuẩn bị các dung dịch hiệu chuẩn HPLC
| Dung dịch hiệu chuẩn HPLC | Dung môi bơm (4.18) μl | Dung dịch chuẩn (4.26) μl | Nồng độ khối lượng ochratoxin A cuối cùng trong dung dịch hiệu chuẩn |
| 1 | 4 960 | 40 | 2,0 |
| 2 | 4 900 | 100 | 5,0 |
| 3 | 4 840 | 160 | 8,0 |
| 4 | 4 800 | 200 | 10,0 |
CHÚ THÍCH: Trong trường hợp hàm lượng ochratoxin A trong mẫu nằm ngoài dải hiệu chuẩn thì có thể chuẩn bị đường chuẩn thích hợp. Ngoài ra dung dịch bơm để phân tích HPLC có thể được pha loãng để có hàm lượng ochratoxin A thích hợp để thiết lập đường chuẩn.
7.4 Đường chuẩn
Chuẩn bị đường chuẩn khi bắt đầu mỗi ngày phân tích bằng cách sử dụng dung dịch hiệu chuẩn từ Bảng 1. Dựng đường chuẩn trước khi phân tích mẫu thử bằng cách vẽ nồng độ ochratoxin A, bằng nanogam trên mililit trên trục X dựa theo tín hiệu pic như diện tích hoặc chiều cao trên trục Y và kiểm tra độ tuyến tính của đồ thị sử dụng hồi quy tuyến tính (r2 ≥ 0,998)
7.5 Xác định ochratoxin A trong dung dịch mẫu thử
Bơm các lượng dung dịch mẫu thử (6.4) lên cột sắc ký, sử dụng cùng một điều kiện như đã dùng để chuẩn bị đường chuẩn.
7.6 Nhận biết pic
Nhận biết pic ochratoxin A trong dung dịch mẫu thử bằng cách so sánh thời gian lưu của mẫu với thời gian lưu của các dung dịch hiệu chuẩn. Nồng độ ochratoxin A trong dung dịch mẫu thử phải nằm trong dải hiệu chuẩn. Trong trường hợp, nồng độ khối lượng của ochratoxin A trong dung dịch mẫu thử nằm ngoài dài hiệu chuẩn thì cần chuẩn bị đường chuẩn thích hợp. Ngoài ra, có thể pha loãng dung dịch mẫu thử đến nồng độ khối lượng ochratoxin A thích hợp đối với đường chuẩn đã thiết lập. Hệ số pha loãng phải được tính vào trong tất cả các phép tính tiếp theo.
8 Tính kết quả
Xác định nồng độ khối lượng của ochratoxin A trong dung dịch mẫu thử (6.4), trực tiếp từ đường chuẩn (7.4), tính bằng nanogam trên mililit. Tính phần khối lượng ochratoxin A, wota, bằng microgam trên kilogam, sử dụng Công thức (2):
|
| (2) |
Trong đó:
ρota là nồng độ khối lượng ochratoxin A, trong dung dịch mẫu thử được bơm và tương ứng với diện tích pic ochratoxin A, tính bằng nanogam trên mililit (ng/ml);
V1 là thể tích dung môi được lấy để chiết, tính bằng mililit (ml) (trong trường hợp này là: 75 ml),;
V2 là thể tích thu được sau khi rửa giải từ cột ái lực miễn nhiễm (6.4), tính bằng mililit (ml) (trong trường hợp này là: 1 ml hoặc 3 ml);
V3 là thể tích của dung dịch chiết sử dụng để làm sạch cột ái lực miễn nhiễm, tính bằng mililit (ml) (trong trường hợp này là: 6 ml);
ms là khối lượng của mẫu thử dùng để phân tích, tính bằng gam (g) (trong trường hợp này là: 25 g).
9 Độ chụm
9.1 Yêu cầu chung
Chi tiết của phép thử liên phòng thử nghiệm về độ chụm của phương pháp được nêu trong Bảng B.1. Các giá trị thu được từ các phép thử liên phòng thử nghiệm này có thể không áp dụng được cho các dải nồng độ và/hoặc nền mẫu khác với các dải nồng độ và nền mẫu nêu trong Phụ lục B.
9.1 Độ lập lại
Chênh lệch tuyệt đối giữa hai kết quả thử đơn lẻ thu được khi tiến hành thử trên vật liệu thử giống hệt nhau, do cùng một người phân tích, sử dụng cũng một thiết bị, trong một khoảng thời gian ngắn, không được quả 5 % các trường hợp lớn hơn giới hạn lập lại r.
| Giá trị đối với quả nho Hy-lạp: |
| r = 0,73 μg/kg |
| Giá trị đối với nho Xutan: |
| r = 1,79 μg/kg |
| Giá trị đối với hỗn hợp quả khô: |
| r = 0,27 μg/kg |
| Giá trị đối với quả nho khô: |
| r = 1,04 μg/kg |
| Giá trị đối với quả vả: |
| r = 0,62 μg/kg |
9.2 Độ tái lập
Chênh lệch tuyệt đối giữa hai kết quả thử đơn lẻ, thu được khi tiến hành thử trên vật liệu thử giống hệt nhau, do hai phòng thử nghiệm phân tích, không được quá 5 % các trường hợp lớn hơn giới hạn tái lập R.
| Giá trị đối với nho Hy-lạp: |
| R = 3,59 μg/kg |
| Giá trị đối với nho Xutan: |
| R = 4,55 μg/kg |
| Giá trị đối với hỗn hợp quả khô: |
| R = 0,45 μg/kg |
| Giá trị đối với quả nho khô: |
| R = 2,95 μg/kg |
| Giá trị đối với quả và: |
| R = 1,28 μg/kg |
10 Báo cáo thử nghiệm
Báo cáo thử nghiệm phải bao gồm:
a) mọi thông tin cần thiết để nhận biết mẫu (loại mẫu, nguồn gốc mẫu, ký hiệu);
b) viện dẫn tiêu chuẩn này;
c) ngày và kiểu quy trình lấy mẫu (nếu biết);
d) ngày nhận mẫu;
e) ngày thử nghiệm;
f) kết quả thử nghiệm và các đơn vị biểu thị;
g) các điểm cụ thể quan sát được trong quá trình thử nghiệm;
h) mọi thao tác không quy định trong tiêu chuẩn này, hoặc được xem là tùy chọn, cùng với mọi tình huống bất thường có thể ảnh hưởng đến kết quả thử nghiệm.
Phụ lục A
(Tham khảo)
Sắc ký đồ điển hình
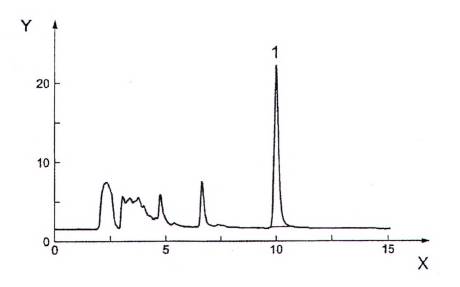
CHÚ DẪN
X thời gian, tính bằng phút (min)
Y tín hiệu, tính bằng milivol (mV)
1 ochratoxin A
Hình 1 - Sắc ký đồ điển hình của nho khô với hàm lượng ochratoxin A xấp xỉ 9 μg/kg
Phụ lục B
(Tham khảo)
Dữ liệu về độ chụm
Các thông số sau đây thu được trong phép thử liên phòng thử nghiệm [3] phù hợp với Hướng dẫn của AOAC về các quy trình nghiên cứu liên phòng để đánh giá các đặc tính của phương pháp phân tích [4],
Bảng B.1 - Dữ liệu về độ chụm
| Mẫu | Nho Hy lạp | Nho Xutan | Hỗn hợp quả khô | Nho | Quả vả khô |
| Năm tiến hành phép thử liên phòng thử nghiệm | 2002 | 2002 | 2002 | 2002 | 2002 |
| Số lượng phòng thử nghiệm | 20 | 24 | 24 | 24 | 24 |
| Số lượng các phòng thử nghiệm còn lại sau khi trừ ngoại lệ | 20 | 22 | 20 | 21 | 22 |
| Số lượng các phòng thử nghiệm ngoại lệ | 0 | 2 | 4 | 3 | 2 |
| Số lượng các kết quả được chấp nhận | 20 | 22 | 20 | 21 | 22 |
| Giá trị trung bình, | 4,51 | 11,39 | 1,14 | 7,55 | 2,55 |
| Độ lệch chuẩn lập lại, sr, μg/kg | 0,26 | 0,64 | 0,10 | 0,37 | 0,22 |
| Độ lệch chuẩn tương đối lập lại, RSDr, % | 5,7 | 5,6 | 8,6 | 4,9 | 8,7 |
| Giới hạn lập lại, r[r = 2,8 x sr] μg/kg | 0,73 | 1,79 | 0,27 | 1,04 | 0,62 |
| Độ lệch chuẩn tái lập, sR, μg/kg | 1,28 | 1,63 | 0,16 | 1,05 | 0,46 |
| Độ lệch chuẩn tương đối tái lập, RSDR, % | 28,4 | 14,3 | 14,2 | 14,0 | 18,0 |
| Giới hạn tái lập, R [R = 2,8 x sR], μg/kg | 3,59 | 4,55 | 0,45 | 2,95 | 1,28 |
| Độ thu hồi, % a |
| 72 | 72 | 73 | 74 |
| Chỉ số HorRat, tính được sử dụng độ lệch chuẩn Predic (PSRDR) từ chỉ số Thompson, xem [5] và [6] | 1,3 | 0,7 | 0,6 | 0,6 | 0,8 |
| a Trong nghiên cứu liên phòng, độ thu hồi của từng nền mẫu (5 μg/kg) được phần chia độc lập tử phép phân tích đơn lẻ có mẫu thêm chuẩn theo từng phòng thử nghiệm tham gia. | |||||
Thư mục tài liệu tham khảo
[1] Castegnaro M., Barek J., Fremy J.M., Lafontaine M., Sansone E.B. and Telling G.M. Laboratory decontamination and destruction of carcinogens in laboratory wastes: some mycotoxins. IARC Scientific Publication No. 113, International Agency for Research on Cancer, Lyon (France), 1991, p. 63
[2] Wood, G. M., Patel, S., Entwisle, A.C. and Boenke, A., 1996, Ochratoxin A in wheat: a second intercomparison of procedures, Food Additives and Contaminants, 13, 519-539
[3] MacDonald, S.J., Anderson, S., Brereton, P., and Wood, R. (2003). Determination of Ochratoxin A in currants, raisins, sultanas, mixed dried fruit, and dried frigs by immunoaffinity colum cleanup with liquyd chromatography: Interlaboratory study, Journal of AOAC International., 86, 1164-1171
[4] AOAC International 1995, AOAC Official Methods Program, Associate Referee's Manual on Development, study, Review, and Approval Process. Part IV AOAC Guidelines for Collaborative Studies p. 23-51
[5] Horwitz, W. and Albert, R., (2006), The Horwitz Ratio (HorRat): A Useful Index of Method Performance with Respect to Precision, Journal of AOAC International, 89, 1095-1109
[6] Thompson, M., 2000, Recent trends in inter-laboratory precision at ppb and sub-ppb concentrations in relation to fitness for purpose criteria in proficiency testing, Analyst, 125, 385-386
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 10927:2015 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 10927:2015 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 10927:2015 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 10927:2015 DOC (Bản Word)