- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn TCVN 8685-9:2022 Quy trình kiểm nghiệm vắc xin – Phần 9: Vắc xin vô hoạt phòng bệnh cúm gia cầm
| Số hiệu: | TCVN 8685-9:2022 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
27/09/2022 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 8685-9:2022
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 8685-9:2022
TIÊU CHUẨN QUỐC GIA
TCVN 8685-9:2022
QUY TRÌNH KIỂM NGHIỆM VẮC XIN - PHẦN 9: VẮC XIN VÔ HOẠT PHÒNG BỆNH CÚM GIA CẦM
Vaccine testing procedure - Part 9: Avian influenza vaccine, inactivated
Lời nói đầu
TCVN 8685-9:2022 thay thế TCVN 8685-9:2014.
TCVN 8685-9:2022 do Trung tâm Kiểm nghiệm thuốc thú y TW1 - Cục Thú y biên soạn, Bộ Nông nghiệp và Phát triển nông thôn đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Bộ TCVN 8685 Quy trình kiểm nghiệm vắc xin gồm các phần:
- TCVN 8685-1:2011, Phần 1: Vắc xin phó thương hàn lợn nhược độc;
- TCVN 8685-2:2011, Phần 2: Vắc xin viêm gan siêu vi trùng vịt;
- TCVN 8685-3:2011, Phần 3: Vắc xin E.coli của lợn;
- TCVN 8685-4:2011, Phần 4: vắc xin vô hoạt phòng hội chứng giảm đẻ ở gà;
- TCVN 8685-5:2011, Phần 5: Vắc xin ung khí thán;
- TCVN 8685-6:2011, Phần 6: Vắc xin Gumboro nhược độc;
- TCVN 8685-7:2011, Phần 7: Vắc xin nhiệt thán nha bào vô độc chủng 34 F2;
- TCVN 8685-8:2011, Phần 8: Vắc xin dịch tả lợn nhược độc;
- TCVN 8685-9:2022, Phần 9: Vắc xin vô hoạt phòng bệnh cúm gia cầm;
- TCVN 8685-10:2022, Phần 10: Vắc xin vô hoạt phòng bệnh lở mồm long móng (FMD);
- TCVN 8685-11:2014, Phần 11: Vắc xin vô hoạt phòng bệnh Phù đầu gà (coryza);
- TCVN 8685-12:2014, Phần 12: Vắc xin nhược độc, đông khô phòng hội chứng rối loạn hô hấp và sinh sản ở lợn (PRRS);
- TCVN 8685-13:2014, Phần 13: Vắc xin vô hoạt phòng hội chứng rối loạn hô hấp và sinh sản ở lợn (PRRS);
- TCVN 8685-14:2017, Phần 14: Vắc xin vô hoạt phòng bệnh viêm phổi thể kính ở lợn;
- TCVN 8685-15:2017, Phần 15: Vắc xin vô hoạt phòng bệnh viêm phổi do pasteurella multocida type D gây ra ở lợn;
- TCVN 8685-16:2017, Phần 16: Vắc xin vô hoạt phòng bệnh viêm teo mũi truyền nhiễm ở lợn;
- TCVN 8685-17:2017, Phần 17: Vắc xin vô hoạt phòng bệnh viêm màng phổi ở lợn;
- TCVN 8685-18:2017, Phần 18: Vắc xin vô hoạt phòng bệnh newcastle;
- TCVN 8685-19:2017, Phần 19: Vắc xin vô hoạt phòng bệnh gumboro;
- TCVN 8685-20:2018, Phần 20: Vắc xin nhược độc phòng bệnh Newcastle;
- TCVN 8685-21:2018, Phần 21: Vắc xin phòng bệnh đậu gà;
- TCVN 8685-22:2018, Phần 22: Vắc xin vô hoạt phòng bệnh tụ huyết trùng ở gia cầm;
- TCVN 8685-23:2018, Phần 23: Vắc xin vô hoạt phòng bệnh Salmonella enteritidis ở gà;
- TCVN 8685-24:2018, Phần 24: Vắc xin vô hoạt phòng bệnh Salmonella typhimurium ở gà;
- TCVN 8685-25:2018, Phần 25: Vắc xin phòng bệnh giả dại ở lợn;
- TCVN 8685-26:2018, Phần 26: Vắc xin nhược độc phòng bệnh viêm thanh khí quản truyền nhiễm ở gà;
- TCVN 8685-27:2018, Phần 27: Vắc xin nhược độc phòng bệnh viêm phế quản truyền nhiễm ở gà;
- TCVN 8685-28:2019, Phần 28: Vắc xin vô hoạt phòng bệnh Tụ huyết trùng ở lợn;
- TCVN 8685-29:2019, Phần 29: Vắc xin vô hoạt phòng bệnh Viêm phế quản truyền nhiễm (IB) ở gà;
- TCVN 8685-30:2019, Phần 30: Vắc xin nhược độc phòng bệnh Viêm não tủy truyền nhiễm ở gà;
- TCVN 8685-31:2019, Phần 31: Vắc xin phòng bệnh Dại ở chó;
- TCVN 8685-32:2019, Phần 32: Vắc xin vô hoạt phòng bệnh Mycoplasma gallisepticum ở gia cầm;
- TCVN 8685-33:2019, Phần 33: Vắc xin vô hoạt phòng bệnh Riermerella anatipestifer;
- TCVN 8685-34:2020, Phần 34: Vắc xin phòng bệnh tiêu chảy thành dịch do Porcine epidemic diarrhea virus (PEDV) gây ra ở lợn;
- TCVN 8685-35:2020, Phần 35: Vắc xin vô hoạt phòng bệnh tụ huyết trùng ở trâu bò;
- TCVN 8685-36:2020, Phần 36: Vắc xin vô hoạt phòng bệnh tụ huyết trùng và bệnh đóng dấu ở lợn;
- TCVN 8685-37:2020, Phần 37: Vắc xin nhược độc phòng bệnh Marek ở gà;
- TCVN 8685-38:2020, Phần 38: Vắc xin vô hoạt phòng bệnh do Leptospira gây ra;
- TCVN 8685-39:2020, Phần 39: Vắc xin vô hoạt phòng hội chứng còi cọc do Circovirus gây ra ở lợn.
QUY TRÌNH KIỂM NGHIỆM VẮC XIN - PHẦN 9: VẮC XIN VÔ HOẠT PHÒNG BỆNH CÚM GIA CẦM
Vaccine testing procedure - Part 9: Avian influenza vaccine, inactivated
1 Phạm vi áp dụng
Tiêu chuẩn này quy định quy trình kiểm nghiệm vắc xin vô hoạt phòng bệnh cúm gia cầm do vi rút Cúm gia cầm type A gây ra đối với gia cầm, thủy cầm và chim hoang dã.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các bản sửa đổi, bổ sung (nếu có).
TCVN 8684 Vắc xin và chế phẩm sinh học dùng trong thú y - Phép thử độ thuần khiết
TCVN 12682:2019 Thuốc thú y - Lấy mẫu
3 Chữ viết tắt
EID50 (Egg Infective Dose 50): Liều gây nhiễm 50 % trứng
HA (Haemagglutination Assay): Phản ứng ngưng kết hồng cầu gà
HI (Haemagglutination Inhibition Assay): Phản ứng ngăn trở ngưng kết hồng cầu gà
TCID50 (Tissue Culture Infectious Dose 50): Liều gây nhiễm 50 % tế bào
4 Nguyên tắc
Vắc xin được kiểm tra các chỉ tiêu cảm quan, độ vô trùng, độ vô hoạt bằng các phương pháp phân tích trong phòng thí nghiệm, các chỉ tiêu độ an toàn và hiệu lực được đánh giá trên động vật thí nghiệm khỏe mạnh, không có kháng thể cúm gia cầm.
5 Vật liệu thử và thuốc thử
5.1 Gà, từ 3 tuần tuổi đến 4 tuần tuổi, 70 con, khỏe mạnh, không có kháng thể cúm gia cầm.
5.2 Vịt, từ 3 tuần tuổi đến 4 tuần tuổi, 70 con, khỏe mạnh, không có kháng thể cúm gia cầm.
5.3 Ngan, từ 3 tuần tuổi đến 4 tuần tuổi, 70 con, khỏe mạnh, không có kháng thể cúm gia cầm.
5.4 Trứng gà có phôi từ 9 ngày tuồi đến 11 ngày tuổi (trứng gà sạch, âm tính với kháng nguyên cúm gia cầm bằng phản ứng HA).
5.5 Nước muối sinh lý vô trùng nồng độ từ 0,85 % đến 0,9 %.
6. Lấy mẫu
Lấy mẫu vắc xin và chế phẩm sinh học theo quy định tại 3.6.4 TCVN 12682:2019.
7 Cách tiến hành
7.1 Kiểm tra cảm quan
- Lắc nhẹ lọ vắc xin và quan sát độ đồng đều của hỗn dịch bằng mắt thường.
- Đánh giá kết quả: vắc xin đạt yêu cầu về cảm quan khi có hỗn dịch đồng đều, không đông vón, không lắng cặn.
7.2 Kiểm tra độ vô trùng
- Kiểm tra các chỉ tiêu tạp nhiễm vi khuẩn, tạp nhiễm nấm mốc, tạp nhiễm Mycoplasma và tạp nhiễm Salmonella theo TCVN 8684.
- Đánh giá kết quả: vắc xin đạt yêu cầu về độ vô trùng khi không có bất cứ tạp khuẩn, nấm mốc, Mycoplasma hay Salmonella nào mọc trên môi trường kiểm tra trong thời gian theo dõi.
7.3 Kiểm tra độ vô hoạt
- Tiêm vắc xin vào xoang niệu mô cho 10 trứng gà có phôi (5.4), mỗi trứng được tiêm 0,2 ml vắc xin. Ấp trứng trong 5 ngày, sau đó mổ trứng kiểm tra bệnh tích phôi và thu hoạch dịch niệu làm phản ứng HA.
- Đánh giá kết quả: vắc xin đạt yêu cầu về độ vô hoạt khi phôi không có bệnh tích, phản ứng HA cho kết quả âm tính. Các bước tiến hành phản ứng HA được nêu tại phụ lục A.
7.4 Kiểm tra độ an toàn
Chọn 1 trong 2 phương pháp sau:
7.4.1 Trên gà
- Tiêm bắp hoặc tiêm dưới da cho 10 gà (5.1), mỗi con được tiêm 2 liều vắc xin ghi trên nhãn.
- Sau khi tiêm vắc xin, theo dõi gà thí nghiệm trong 14 ngày.
- Đánh giá kết quả: vắc xin đạt yêu cầu về độ an toàn khi tất cả gà sống khỏe mạnh, phát triển bình thường và không có biến đổi bất thường về cục bộ hay triệu chứng toàn thân.
7.4.2 Trên vịt hoặc ngan
- Tiêm bắp hoặc tiêm dưới da cho 10 vịt (5.2) hoặc 10 ngan (5.3), mỗi con được tiêm 2 liều vắc xin ghi trên nhãn.
- Sau khi tiêm vắc xin, theo dõi động vật thí nghiệm trong 14 ngày.
- Đánh giá kết quả: vắc xin đạt yêu cầu về độ an toàn khi tất cả vịt hoặc ngan sống khỏe mạnh, phát triển bình thường và không có biến đổi bất thường về cục bộ hay triệu chứng toàn thân.
7.5 Kiểm tra hiệu lực
7.5.1 Kiểm tra hiệu lực vắc xin phòng bệnh cúm gia cầm thể độc lực cao
Chọn 1 trong 2 phương pháp sau:
7.5.1.1 Phương pháp công cường độc
7.5.1.1.1 Trên gà
- Sử dụng 30 gà (5.1), chia làm 2 nhóm:
+ Nhóm 1: gồm 20 gà, mỗi con được tiêm bắp hoặc tiêm dưới da 1 liều vắc xin ghi trên nhãn;
+ Nhóm 2: gồm 10 gà làm đối chứng, tiêm nước muối sinh lý vô trùng (5.5) với liều lượng và đường tiêm như gà nhóm 1.
- Sau khi tiêm vắc xin 21 ngày, tất cả gà nhóm 1 và nhóm 2 được công cường độc với chủng vi rút cúm gia cằm cường độc đang lưu hành bằng phương pháp nhỏ mũi, liều 106 EID50/con.
- Theo dõi gà thí nghiệm trong 10 ngày.
- Đánh giá kết quả: vắc xin đạt yêu cầu về hiệu lực khi:
+ Ít nhất 80 % gà nhóm 1 sống khỏe, không có bất kỳ biểu hiện nào của bệnh cúm gia cầm;
+ Ít nhất 80 % gà nhóm 2 chết hoặc có biểu hiện triệu chứng của bệnh cúm gia cầm như đầu sưng, mắt viêm kết mạc, chảy rớt dãi, triệu chứng thần kinh, phân xanh trắng, xuất huyết đường tiêu hóa (xuất huyết tụy, dạ dày và dạ dày tuyến, ruột, manh tràng), khí quản xuất huyết chứa nhiều dịch nhày.
7.5.1.1.2 Trên vịt hoặc ngan
- Sử dụng 30 vịt (5.2) hoặc 30 ngan (5.3), chia làm 2 nhóm:
+ Nhóm 1: gồm 20 vịt hoặc ngan, mỗi con được tiêm bắp hoặc tiêm dưới da 1 liều vắc xin ghi trên nhãn;
+ Nhóm 2: gồm 10 vịt hoặc ngan làm đối chứng, tiêm nước muối sinh lý vô trùng (5.5) với liều lượng và đường tiêm như vịt hoặc ngan nhóm 1.
- 14 ngày sau khi tiêm vắc xin, tất cả vịt hoặc ngan nhóm 1 và nhóm 2 được tiêm nhắc lại với liều lượng và đường tiêm như lần 1.
- 14 ngày sau khi tiêm vắc xin lần thứ 2, tất cả vịt hoặc ngan nhóm 1 và nhóm 2 được công cường độc với chủng vi rút Cúm gia cầm cường độc hiện hành bằng phương pháp nhỏ mũi, liều 106 EID50/con.
- Theo dõi động vật thí nghiệm sau khi công cường độc trong 10 ngày.
- Đánh giá kết quả: vắc xin đạt yêu cầu về hiệu lực khi:
+ Ít nhất 80 % vịt hoặc ngan nhỏm 1 sống khỏe, không có bất kỳ biểu hiện nào của bệnh cúm gia cầm;
+ Ít nhất 80 % vịt hoặc ngan nhóm 2 chết hoặc có biểu hiện triệu chứng của bệnh cúm gia cầm như mệt mỏi, ủ rũ, triệu chứng thần kinh, xuất huyết đường ruột, dạ dày và dạ dày tuyến, xuất huyết bề mặt tụy và khí quản, viêm túi khí, sung huyết hoặc xuất huyết điểm ở não.
7.5.1.2 Phương pháp HI
7.5.1.2.1 Trên gà
- Sử dụng 30 gà (5.1), chia làm 2 nhóm:
+ Nhóm 1: gồm 20 gà, mỗi con được tiêm bắp hoặc tiêm dưới da 1 liều vắc xin ghi trên nhãn;
+ Nhóm 2: gồm 10 gà làm đối chứng, tiêm nước muối sinh lý vô trùng (5.5) với liều lượng và đường tiêm như gà nhóm 1.
- Sau khi tiêm vắc xin 21 ngày, tất cả gà nhóm 1 và gà nhóm 2 được lấy máu, thu huyết thanh làm phản ứng HI với kháng nguyên tương ứng hoặc kháng nguyên chế từ chủng vi rút phân lập tại Việt Nam. Các bước tiến hành phản ứng HI được nêu tại Phụ lục B.
- Đánh giá kết quả: vắc xin đạt yêu cầu về hiệu lực khi ít nhất 80 % mẫu huyết thanh của gà nhóm 1 có hiệu giá kháng thể HI ≥ 4log2, trong khi đó ít nhất 80 % mẫu huyết thanh của gà nhóm 2 có hiệu giá kháng thể HI âm tính.
7.5.1.2.2 Trên vịt hoặc ngan
- Sử dụng 30 vịt (5.2) hoặc 30 ngan (5.3), chia làm 2 nhóm:
+ Nhóm 1: gồm 20 vịt hoặc ngan, mỗi con được tiêm bắp hoặc tiêm dưới da 1 liều vắc xin ghi trên nhãn;
+ Nhóm 2: gồm 10 vịt hoặc ngan làm đối chứng, tiêm nước muối sinh lý vô trùng (5.5) với liều lượng và đường tiêm như vịt hoặc ngan nhóm 1.
- 14 ngày sau khi tiêm vắc xin, tất cả vịt hoặc ngan nhóm 1 và nhóm 2 được tiêm nhắc lại với liều lượng và đường tiêm như lần 1.
- 14 ngày sau khi tiêm vắc xin lần thứ 2, tất cả vịt hoặc ngan nhóm 1 và nhóm 2 được được lấy máu, thu huyết thanh làm phản ứng HI với kháng nguyên tương ứng hoặc kháng nguyên chế từ chủng vi rút phân lập tại Việt Nam. Các bước tiến hành phản ứng HI được nêu tại Phụ lục B.
- Đánh giá kết quả: vắc xin đạt yêu cầu về hiệu lực khi ít nhất 80 % mẫu huyết thanh của vịt hoặc ngan nhóm 1 có hiệu giá kháng thể HI ≥ 4log2, trong khi đó ít nhất 80 % mẫu huyết thanh của vịt hoặc ngan nhóm 2 có hiệu giá kháng thể HI âm tính.
7.5.2 Kiểm tra hiệu lực vắc xin phòng bệnh cúm gia cầm thể độc lực thấp
- Sử dụng 30 gà (5.1), chia làm 2 nhóm:
+ Nhóm 1: gồm 20 gà, mỗi con được tiêm bắp hoặc tiêm dưới da 1 liều vắc xin ghi trên nhãn;
+ Nhóm 2: gồm 10 gà làm đối chứng, tiêm nước muối sinh lý vô trùng (5.5) với liều lượng và đường tiêm như gà nhóm 1.
- Sau khi tiêm vắc xin 21 ngày, tất cả gà nhóm 1 và gà nhóm 2 được lấy máu, thu huyết thanh làm phản ứng HI với kháng nguyên tương ứng hoặc kháng nguyên chế từ chủng vi rút phân lập tại Việt Nam. Các bước tiến hành phản ứng HI được nêu tại Phụ lục B.
- Đánh giá kết quả: vắc xin đạt yêu cầu về hiệu lực khi ít nhất 80 % mẫu huyết thanh của gà nhóm 1 có hiệu giá kháng thể HI ≥ 4log2, trong khi đó ít nhất 80 % mẫu huyết thanh của gà nhóm 2 có hiệu giá kháng thể HI âm tính.
8 Đánh giá kết quả thử nghiệm
Vắc xin đạt yêu cầu kiểm nghiệm khi đáp ứng được tất cả các yêu cầu về cảm quan, vô trùng, vô hoạt, an toàn và hiệu lực như đã nêu lần lượt ở 7.1, 7.2, 7.3, 7.4 và 7.5.
9 Báo cáo thử nghiệm
Báo cáo thử nghiệm phải nêu rõ:
- Mọi thông tin cần thiết về nhận biết đầy đủ về mẫu thử;
- Phương pháp lấy mẫu đã sử dụng, nếu biết;
- Phương pháp thử đã sử dụng, viện dẫn tiêu chuẩn này;
- Tất cả các điều kiện thao tác không quy định trong tiêu chuẩn này, hoặc được xem là tùy ý, cùng với mọi tình huống bất thường có thể ảnh hưởng đến kết quả;
- Kết quả thử nghiệm thu được.
Phụ lục A
(quy định)
Phản ứng ngưng kết hồng cầu gà (HA)
A.1 Vật liệu thử và thuốc thử
A.1.1 Natri xitrat 5 %.
A.1.2 Máu gà trống, gà khỏe, đã trường thành, không có kháng thể cúm gia cầm.
A.1.3 Kháng nguyên cúm gia cầm tương ứng với chủng vắc xin cần kiểm tra.
A.2 Thiết bị và dụng cụ
A.2.1 Pipet, dung tích từ 1 ml đến 5 ml, từ 5 ml đến 10 ml.
A.2.2 Ống ly tâm, dung tích từ 5 ml đến 10 ml.
A.2.3 Máy ly tâm, có thể quay với tốc độ từ 1000 vòng/phút đến 1500 vòng/phút.
A.2.4 Bình tam giác vô trùng.
A.2.5 Micropipet đơn kênh, dung tích từ 50 μl đến 200 μl, từ 100 μl, đến 1000 μl.
A.2.6 Micropipet đa kênh, dung tích từ 5 μl đến 50 μl, từ 50 μl đến 200 μl.
A.2.7 Đĩa nhựa 96 giếng đáy chữ V.
A.3 Chuẩn bị hồng cầu gà 1 %
- Dùng pipet (A.2.1) hút 2,5 ml dung dịch natri xitrat (A.1.1) vào ống ly tâm (A.2.2), sau đó thêm 5 ml máu gà trống (A.1.2). Ly tâm ống bằng máy ly tâm (A.2.3) với tốc độ từ 1000 vòng/phút đến 1500 vòng/phút trong 15 min, hút bỏ phần dung dịch nổi bên trên, thêm 10ml nước muối sinh lý vô trùng (5.5), lắc đều. Ly tâm lặp lại từ 3 lần đến 4 lần để rửa hồng cầu, hút bỏ dung dịch ở trên sau lần ly tâm cuối để thu được hồng cầu đặc.
- Chuẩn bị dung dịch hồng cầu 1 % bằng cách chuyển 1 ml hồng cầu đặc vào bình tam giác (A.2.4) có chứa 99 ml nước muối sinh lý vô trùng (5.5).
- Bảo quản dung dịch hồng cầu 1 % ở nhiệt độ từ 4 °C đến 8 °C. Hồng cầu sau khi pha có thể dùng trong 4 ngày đến 5 ngày (nếu dung dịch hồng cầu bị vỡ thì loại bỏ).
A.4 Cách tiến hành
Các bước tiến hành thực hiện phản ứng HA được nêu ở bảng A.1.
A.4.1 Dùng micropipet (A.2.6) nhỏ 25 μl nước muối sinh lý vô trùng (5.5) vào đĩa nhựa 96 giếng đáy chữ V (A.2.7) từ giếng thứ 1 đến giếng 12.
A.4.2 Dùng micropipet (A.2.5) nhỏ 25 μl kháng nguyên cúm gia cầm (A.1.3) vào giếng 1.
A.4.3 Pha loãng kháng nguyên: sử dụng micropipet (A.2.5) trộn đều kháng nguyên với nước muối sinh lý vô trùng (5.5) ở giếng 1, hút 25 μl chuyển sang giếng 2, trộn đều, hút 25 μl chuyển sang giếng 3, trộn đều, tiếp tục làm như vậy đến giếng 11 rồi hút bỏ đi 25 μl.
A.4.4 Dùng micropipet (A.2.6) nhỏ tiếp 25 μl nước muối sinh lý vô trùng (5.5) vào tất cả các giếng của đĩa phản ứng.
A.4.5 Dùng micropipet (A.2.6) nhỏ 25 μl hồng cầu gà 1 % (A.3) vào các giếng của đĩa phản ứng.
A.4.6 Lắc nhẹ đĩa phản ứng và ủ đĩa ở nhiệt độ phòng trong thời gian khoảng 30 min, sau đó đọc kết quả.
Bảng A.1 - Các bước tiến hành thực hiện phản ứng HA
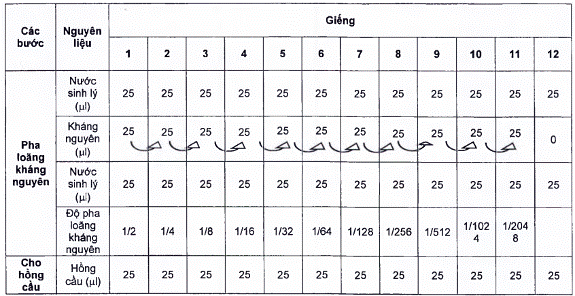
A.5 Đọc kết quả
- Phản ứng âm tính: hồng cầu lắng xuống đáy tạo thành chấm tròn.
- Phản ứng dương tính: xảy ra hiện tượng ngưng kết, hồng cầu ngưng kết thành cụm lấm tấm xung quanh giếng.
- Đọc hiệu giá ngưng kết: hiệu giá ngưng kết kháng nguyên được đánh giá ở độ pha loãng cao nhất còn có phản ứng ngưng kết xảy ra.
Phụ lục B
(quy định)
Phản ứng ngăn trở ngưng kết hồng cầu gà (HI)
B.1 Vật liệu thử và thuốc thử
B.1.1 Kháng nguyên cúm gia cầm tương ứng với chủng vắc xin cần kiểm tra hoặc kháng nguyên chế từ chủng vi rút phân lập tại Việt Nam.
B.1.2 Huyết thanh cần kiểm tra, là huyết thanh thu được sau khi lấy máu động vật thí nghiệm ở mục 7.5.1.2.1, 7.5.1.2.2 và 7.5.2.
B.1.3 Hồng cầu gà 1 % (xem A.3).
B.2 Thiết bị và dụng cụ
B.2.1 Micropipet đơn kênh, dung tích từ 50 μl đến 200 μl, từ 100 μl đến 1000 μl.
B.2.2 Micropipet đa kênh, dung tích từ 5 μl đến 50 μl, từ 50 μl đến 200 μl.
B.2.3 Đĩa nhựa 96 giếng đáy chữ V.
B.3 Chuẩn độ kháng nguyên 4 đơn vị HA
B.3.1 Kháng nguyên được pha 4 đơn vị HA cần phải chuẩn để phản ứng HI cho kết quả chính xác. Ví dụ: nếu HA bằng 1/256 thì 4 HA bằng 1/64 (Pha 4 HA: gồm 1 phần kháng nguyên và 63 phần nước muối sinh lý vô trùng (5.5)).
B.3.2 Kiểm tra kháng nguyên 4 HA đã pha: tiến hành phản ứng HA (xem phụ lục A), nếu kết quả ngưng kết chỉ ở giếng đầu tiên là kháng nguyên pha loãng, nếu kết quả ngưng kết đến giếng thứ 2 là kháng nguyên pha đạt, nếu ngưng kết đến giếng thứ 3 (hoặc hơn) là kháng nguyên pha đặc.
B.4 Cách tiến hành
Các bước tiến hành thực hiện phản ứng HA được nêu ở bảng B. 1.
B.4.1 Dùng micropipet (B.2.2) nhỏ 25 μl nước muối sinh lý vô trùng (5.5) vào đĩa nhựa 96 giếng đáy chữ V (B.2.3) từ giếng thứ 1 đến giếng 12.
B.4.2 Dùng micropipet (B.2.1) nhỏ 25 μl huyết thanh cần kiểm tra (B.1.2) vào giếng 1.
B.4.3 Pha loãng huyết thanh: sử dụng micropipet (B.2.1) trộn đều huyết thanh với nước muối sinh lý vô trùng (5.5) ở giếng 1, rồi hút 25 μl chuyển sang giếng 2, trộn đều, hút 25 μl chuyển sang giếng 3, trộn đều, tiếp tục làm như vậy đến giếng 11 rồi bỏ đi 25 μl.
B.4.4 Dùng micropipet (B.2.2) nhỏ 25 μl dung dịch kháng nguyên 4 đơn vị HA (B.3) vào các giếng từ giếng 1 đến giếng 11. Lắc nhẹ đĩa, để 30 min ở nhiệt độ phòng.
B.4.5 Dùng micropipet (B.2.2) nhỏ 25 μl nước muối sinh lý vô trùng (5.5) vào giếng 12 làm đối chứng hồng cầu.
B.4.6 Dùng micropipet (B.2.2) nhỏ 25 μl hồng cầu gà 1 % (B.1.3) vào các giếng của đĩa phản ứng.
B.4.7 Lắc nhẹ đĩa phản ứng và ủ đĩa ở nhiệt độ phòng trong thời gian khoảng 30 min, sau đó đọc kết quả.
Bảng B.1 - Các bước tiến hành thực hiện phản ứng HI
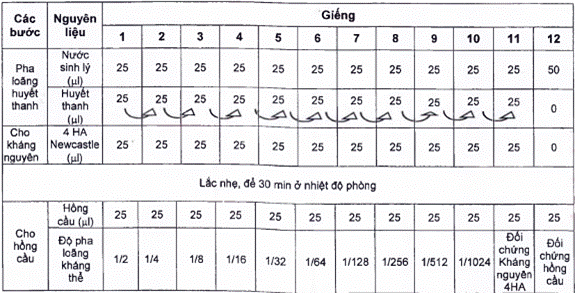
B.5 Đọc kết quả
- Phản ứng âm tính: có hạt ngưng kết lấm chấm.
- Phản ứng dương tính: hồng cầu lắng xuống đáy tạo chấm tròn.
Thư mục tài liệu tham khảo
[1] ASEAN, (2018). Asean standard Requirements for Avian Influenza Vaccine. 3rd edition, p.64 - 65.
[2] OIE Terrestrial Manual (2018). Chapter 3.3.4: Avian Influenza (Infection with avian influenza viruses). Version adopted by the World Assembly of Delegates of the OIE in May 2018.
[3] Trung tâm Kiểm nghiệm thuốc thú y Trung ương I, (2019). 46VR-19KN1 - Quy trình kiểm nghiệm vắc xin Cúm gia cầm thể độc lực cao.
[4] Trung tâm Kiểm nghiệm thuốc thú y Trung ương I, (2019). 47VR-19KN1 - Quy trình kiểm nghiệm vắc xin Cúm gia cầm thể độc lực thấp.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 8685-9:2022 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 8685-9:2022 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 8685-9:2022 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 8685-9:2022 DOC (Bản Word)