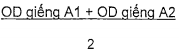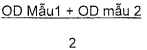- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn quốc gia TCVN 8685-41:2023 Quy trình kiểm nghiệm vắc xin – Phần 41
| Số hiệu: | TCVN 8685-41:2023 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
05/09/2023 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 8685-41:2023
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 8685-41:2023
TIÊU CHUẨN QUỐC GIA
TCVN 8685-41:2023
QUY TRÌNH KIỂM NGHIỆM VẮC XIN
PHẦN 41: VẮC XIN PHÒNG BỆNH VIÊM KHỚP DO AVIAN REOVIRUS Ở GÀ
Vaccine testing procedure - Part 41: Avian Reovirus Vaccine
Lời nói đầu
TCVN 8685-41:2023 do Trung tâm Kiểm nghiệm thuốc Thú y Trung Ương 1 - Cục Thú y biên soạn, Bộ Nông nghiệp và Phát triển nông thôn đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Bộ TCVN 8685 Quy trình kiểm nghiệm vắc xin gồm các phần:
- TCVN 8685-1:2011, Phần 1: Vắc xin phó thương hàn lợn nhược độc;
- TCVN 8685-2:2011, Phần 2: Vắc xin viêm gan siêu vi trùng vịt;
- TCVN 8685-3:2011, Phần 3: Vắc xin E.coli của lợn;
- TCVN 8685-4:2011, Phần 4: Vắc xin vô hoạt phòng hội chứng giảm đẻ ở gà;
- TCVN 8685-5:2011, Phần 5: Vắc xin ung khí thán;
- TCVN 8685-6:2011, Phần 6: Vắc xin Gumboro nhược độc;
- TCVN 8685-7:2011, Phần 7: Vắc xin nhiệt thán nha bào vô độc chủng 34 F2;
- TCVN 8685-8:2011, Phần 8: Vắc xin dịch tả lợn nhược độc,
- TCVN 8685-9:2022, Phần 9: Vắc xin vô hoạt phòng bệnh Cúm gia cầm A/H5N1 (xuất bản lần 2);
- TCVN 8685-10:2022, Phần 10: Vắc xin vô hoạt phòng bệnh Lở mồm long móng (FMD) (xuất bản lần 2);
- TCVN 8685-11:2014, Phần 11: Vắc xin vô hoạt phòng bệnh Phù đầu gà (coryza);
- TCVN 8685-12:2014, Phần 12: Vắc xin nhược độc, đông khô phòng hội chứng rối loạn hô hấp và sinh sản ở lợn (PRRS);
- TCVN 8685-13:2014, Phần 13: Vắc xin vô hoạt phòng hội chứng rối loạn hô hấp và sinh sản ở lợn (PRRS);
- TCVN 8685-14:2017, Phần 14: Vắc xin vô hoạt phòng bệnh viêm phổi thể kính ở lợn;
- TCVN 8685-15:2017, Phần 15: Vắc xin vô hoạt phòng bệnh viêm phổi do pasteurella multocida type D gây ra ở lợn;
- TCVN 8685-16:2017, Phần 16: Vắc xin vô hoạt phòng bệnh viêm teo mũi truyền nhiễm ở lợn;
- TCVN 8685-17:2017, Phần 17: Vắc xin vô hoạt phòng bệnh viêm màng phổi ở lợn;
- TCVN 8685-18:2017, Phần 18: Vắc xin vô hoạt phòng bệnh newcastle;
- TCVN 8685-19:2017, Phần 19: Vắc xin vô hoạt phòng bệnh gumboro;
- TCVN 8685-20:2018, Phần 20: Vắc xin nhược độc phòng bệnh Newcastle;
- TCVN 8685-21:2018, Phần 21: Vắc xin phòng bệnh đậu gà;
- TCVN 8685-22:2018, Phần 22: Vắc xin vô hoạt phòng bệnh tụ huyết trùng ở gia cầm;
- TCVN 8685-23:2018, Phần 23: Vắc xin vô hoạt phòng bệnh Salmonella enteritidis ở gà;
- TCVN 8685-24:2018, Phần 24: Vắc xin vô hoạt phòng bệnh Salmonella typhimurium ở gà;
- TCVN 8685-25:2018, Phần 25: Vắc xin phòng bệnh giả dại ở lợn;
- TCVN 8685-26:2018, Phần 26: Vắc xin nhược độc phòng bệnh viêm thanh khí quản truyền nhiễm ở gà;
- TCVN 8685-27:2018, Phần 27: Vắc xin nhược độc phòng bệnh viêm phế quản truyền nhiễm ở gà;
- TCVN 8685-28:2019, Phần 28: Vắc xin vô hoạt phòng bệnh Tụ huyết trùng ở lợn;
- TCVN 8685-29:2019, Phần 29: Vắc xin vô hoạt phòng bệnh Viêm phế quản truyền nhiễm (IB) ở gà;
- TCVN 8685-30:2019, Phần 30: Vắc xin nhược độc phòng bệnh Viêm não tủy truyền nhiễm ở gà;
- TCVN 8685-31:2019, Phần 31 Vắc xin phòng bệnh Dại ở chó;
- TCVN 8685-32:2019, Phần 32: Vắc xin vô hoạt phòng bệnh Mycoplasma gallisepticum ở gia cầm;
- TCVN 8685-33:2019, Phần 33: Vắc xin vô hoạt phòng bệnh Riermerella anatipestifer;
- TCVN 8685-34:2020, Phần 34: Vắc xin phòng bệnh tiêu chảy thành dịch do Porcine epidemic diarrhea virus (PEDV) gây ra ở lợn;
- TCVN 8685-35:2020, Phần 35: Vắc xin vô hoạt phòng bệnh tụ huyết trùng ở trâu bò;
- TCVN 8685-36:2020, Phần 36: Vắc xin vô hoạt phòng bệnh tụ huyết trùng và bệnh đóng dấu ở lợn;
- TCVN 8685-37:2020, Phần 37: Vắc xin nhược độc phòng bệnh Marek ở gà;
- TCVN 8685-38:2020, Phần 38: Vắc xin vô hoạt phòng bệnh do Leptospira gây ra;
- TCVN 8685-39:2020, Phần 39: Vắc xin vô hoạt phòng hội chứng còi cọc do Circovirus gây ra ở lợn;
- TCVN 8685-40:2023, Phần 40: Vắc xin vô hoạt phòng bệnh viêm não tủy truyền nhiễm do Avian Encephalomyelitis Virus ở gà;
- TCVN 8685-41:2023, Phần 41: Vắc xin phòng bệnh viêm khớp do Avian Reovirus ở gà;
- TCVN 8685-42:2023, Phần 42: Vắc xin phòng bệnh E.coli ở gia cầm;
- TCVN 8685-43:2023, Phần 43: Vắc xin vô hoạt phòng bệnh viêm phổi do Pasteurella multocida type A ở lợn.
QUY TRÌNH KIỂM NGHIỆM VẮC XIN - PHẦN 41: VẮC XIN PHÒNG BỆNH VIÊM KHỚP DO AVIAN REOVIRUS Ở GÀ
Vaccine testing procedure - Part 41: Avian Reovirus Vaccine
1 Phạm vi áp dụng
Tiêu chuẩn này quy định quy trình kiểm nghiệm vắc xin phòng bệnh viêm khớp do Avian Reovirus ở gà.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các bản sửa đổi, bổ sung (nếu có).
TCVN 8684:2022 Vắc xin và chế phẩm sinh học dùng trong thú y - Phép thử độ thuần khiết
3 Chữ viết tắt
ARV (Avian Reovirus): Vi rút Reo gây bệnh viêm khớp ở gà
CEF (Chicken Embryo Fibroblast): Tế bào xơ phôi gà
CPE (Cytopathic Effect): Biến đổi bệnh tích tế bào
DMEM (Dulbecco's Modified Eagle Medium): Môi trường DMEM dùng cho tế bào
EDTA (Ethylenediaminetetraacetic Acid): Chất tạo phức EDTA
ELISA (Enzyme-linked Immunosorbent Assay): Phản ứng miễn dịch gắn enzym
FBS (Fetal Bovine Serum): Huyết thanh thai bê
HGKT: Hiệu giá kháng thể
PBS (Phosphate Buffered Saline): Dung dịch đệm
TCID50 (Tissue Culture Infectious Dose 50 %): Liều gây nhiễm 50 % tế bào
VNT (Viral Neutralization Test): Phản ứng trung hòa vi rút
4 Nguyên tắc
Vắc xin được kiểm tra các chỉ tiêu cảm quan, độ vô trùng, độ vô hoạt, độ thuần khiết bằng các phương pháp phân tích trong phòng thí nghiệm, các chỉ tiêu an toàn và hiệu lực được đánh giá trên động vật thí nghiệm.
5 Vật liệu thử và thuốc thử
5.1 Gà 1 tuần tuổi, gà khỏe mạnh, không có kháng thể kháng ARV.
5.2 Gà 3-4 tuần tuổi, gà khỏe mạnh, không có kháng thể kháng ARV.
5.3 Trứng gà có phôi 5 ngày tuổi đến 6 ngày tuổi, được lấy từ đàn gà âm tính kháng thể ARV.
5.4 Trứng gà có phôi 10 ngày tuổi đến 11 ngày tuổi, được lấy từ đàn gà âm tính kháng thể ARV.
5.5 Nước muối sinh lý vô trùng (dung dịch NaCl 0,9 %).
5.6 Kháng huyết thanh ARV có hiệu giá trung hòa 1/512.
5.7 Kit ELISA kiểm tra kháng thể kháng ARV.
6 Thiết bị, dụng cụ
Sử dụng các thiết bị, dụng cụ của phòng thí nghiệm thông thường và cụ thể như sau:
6.1 Đèn soi trứng.
6.2 Tủ ấp trứng duy trì nhiệt độ 37 °C ± 0,5 °C.
6.3 Cốc có mỏ, dung tích 100 ml, 200 ml.
6.4 Đĩa Petri vô trùng.
6.5 Pipet đơn kênh, thể tích từ 0,5 μl đến 10 μl, từ 50 μl đến 200 μl, từ 100 μl đến 1000 μl.
6.6 Pipet đa kênh, thể tích từ 5 μl đến 50 μl, từ 30 μl đến 300 μl.
6.7 Đầu tip phù hợp với pipet.
6.8 Dao, kéo, panh kẹp vô trùng.
6.9 Xyranh 1 lần, dung tích 1 ml, 3 ml, 5 ml.
6.10 Máy đọc ELISA có bước sóng từ 405 nm đến 650 nm.
6.11 Đĩa nuôi tế bào
6.12 Máy ly tâm, có thể quay với tốc độ từ 1000 rpm đến 3000 rpm.
6.13 Ống ly tâm vô trùng.
6.14 Bình tam giác vô trùng.
6.15 Máy khuấy từ, tốc độ từ 5 rpm đến 200 rpm.
6.16 Kính hiển vi soi ngược có vật kính với độ phóng đại 10 lần, 40 lần, 100 lần.
6.17 Tủ ấm CO2, duy trì nhiệt độ 37 °C, có bổ sung 5 % CO2.
6.18 Bể ủ nhiệt, duy trì nhiệt độ 56 °C.
7 Cách tiến hành
7.1 Kiểm tra cảm quan
7.1.1 Đối với vắc xin vô hoạt
- Lắc nhẹ lọ vắc xin và quan sát độ đồng đều của hỗn dịch bằng mắt thường.
- Đánh giá kết quả: Vắc xin có kết quả kiểm tra cảm quan đạt yêu cầu khi hỗn dịch đồng đều, không đông vón, không lắng cặn.
7.1.2 Đối với vắc xin nhược độc
- Quan sát hình dạng viên vắc xin và độ đồng đều của hỗn dịch sau khi hoàn nguyên với nước muối sinh lý vô trùng (5.5) bằng mắt thường.
- Đánh giá kết quả: Vắc xin có kết quả kiểm tra cảm quan đạt yêu cầu khi có dạng viên xốp, rời khỏi thành lọ, hỗn dịch sau khi hoàn nguyên đồng nhất, không đông vón, không lắng cặn.
7.2 Kiểm tra độ vô trùng
- Kiểm tra tạp nhiễm vi khuẩn, tạp nhiễm nấm mốc, tạp nhiễm Mycoplasma và tạp nhiễm Salmonella theo quy định tại mục 6.2.1, 6.2.2, 6.2.3 và 6.2.4 của TCVN 8684:2022.
- Đánh giá kết quả: Vắc xin có kết quả kiểm tra độ vô trùng đạt yêu cầu khi không có bất cứ tạp khuẩn, nấm mốc, Mycoplasma và Salmonella nào mọc trên môi trường kiểm tra trong thời gian theo dõi.
7.3 Kiểm tra độ vô hoạt (đối với vắc xin vô hoạt)
- Tiêm vào túi lòng đỏ của 10 trứng gà có phôi (5.3), mỗi trứng tiêm 0,2 ml vắc xin, 05 trứng gà có phôi (5.3) làm đối chứng.
- Ấp các trứng đã được tiêm ở tủ ấp trứng (6.2) trong 5 ngày.
- Soi trứng và loại bỏ trứng chết phôi tại thời điểm 24 h sau khi tiêm.
- Kiểm tra bệnh tích của bệnh ARV trên phôi trứng tại thời điểm 5 ngày sau tiêm (phôi có bệnh tích xuất huyết, gan có các ổ dịch màu vàng xanh).
- Đánh giá kết quả: Vắc xin có kết quả kiểm tra độ vô hoạt đạt yêu cầu khi trứng gà có phôi sống sau tiêm 48 h và không có bệnh tích của bệnh ARV tại thời điểm 5 ngày sau tiêm.
7.4 Kiểm tra độ thuần khiết (đối với vắc xin nhược độc)
- Trộn kháng huyết thanh ARV (5.6) với vắc xin theo tỷ lệ 1:1, sau đó ủ huyễn dịch ở 37 °C trong 60 min.
- Tiêm huyễn dịch kháng huyết thanh - vắc xin vào túi lòng đỏ cho 5 trứng gà có phôi (5.4), mỗi trứng 0,2 ml, 05 trứng gà có phôi (5.4) làm đối chứng.
- Ấp các trứng đã được tiêm ở tủ ấp trứng (6.2) trong 7 ngày
- Soi trứng và loại bỏ trứng chết phôi trước 24 h.
- Sau 7 ngày theo dõi, mổ thu hoạch nước trứng làm phản ứng ngưng kết hồng cầu gà và kiểm tra bệnh tích phôi (phôi có bệnh tích xuất huyết, gan có các ổ dịch màu vàng xanh).
- Đánh giá kết quả: Vắc xin có kết quả kiểm tra độ thuần khiết đạt yêu cầu khi trứng gà có phôi sống sau tiêm 48 h, không có bệnh tích của ARV tại thời điểm 7 ngày sau tiêm và nước trứng cho kết quả âm tính trong phản ứng ngưng kết hồng cầu gà.
7.5 Kiểm tra độ an toàn
7.5.1 Vắc xin vô hoạt
- Sử dụng 10 gà (5.2), mỗi con được tiêm dưới da hoặc tiêm bắp 02 liều vắc xin ghi trên nhãn.
- Theo dõi toàn bộ gà trong 21 ngày.
- Đánh giá kết quả: Vắc xin có kết quả kiểm tra độ an toàn đạt yêu cầu khi tất cả gà sống khỏe và không có bất kỳ dấu hiệu phản ứng bất lợi nào.
7.5.2 Vắc xin nhược độc
- Sử dụng 10 gà (5.1), mỗi con được tiêm dưới da hoặc tiêm bắp 10 liều vắc xin ghi trên nhãn.
- Theo dõi toàn bộ gà trong 14 ngày.
- Đánh giá kết quả: Vắc xin có kết quả kiểm tra độ an toàn đạt yêu cầu khi tất cả gà sống khỏe và không có bất kỳ dấu hiệu phản ứng bất lợi nào.
7.6 Kiểm tra hiệu lực
7.6.1 Cách tiến hành
7.6.1.1 Vắc xin vô hoạt
- Sử dụng 30 gà (5.2), chia làm 2 nhóm:
+ Nhóm 1: Gồm 20 gà, mỗi con được tiêm dưới da hoặc tiêm bắp 01 liều vắc xin ghi trên nhãn;
+ Nhóm 2: Gồm 10 gà làm đối chứng, tiêm dưới da hoặc tiêm bắp bằng nước muối sinh lý vô trùng (5.5) với liều lượng như gà nhóm 1.
- Sau khi tiêm vắc xin 28 ngày, tất cả gà nhóm 1 và nhóm 2 được lấy máu, chắt huyết thanh để kiểm tra hiệu giá kháng thể kháng ARV bằng 1 trong 2 phương pháp sau:
+ Phương pháp VNT, các bước thực hiện phản ứng định lượng kháng thể kháng ARV bằng kỹ thuật trung hòa vi rút trên tế bào được nêu tại Phụ lục A;
+ Phương pháp ELISA, sử dụng kit ELISA (5.7) kiểm tra kháng thể kháng ARV.
CHÚ THÍCH: Hiện nay, có nhiều bộ KIT ELISA phát hiện kháng thể kháng ARV bán sẵn trên thị trường. Khi sử dụng phương pháp ELISA cần theo đúng hướng dẫn của nhà sản xuất. Ví dụ về phản ứng ELISA sử dụng KIT thương mại được nêu trong phụ lục B.
7.6.1.2 Vắc xin nhược độc
- Sử dụng 30 gà (5.1), chia làm 2 nhóm:
+ Nhóm 1: Gồm 20 gà, mỗi con được tiêm dưới da hoặc tiêm bắp 01 liều vắc xin ghi trên nhãn;
+ Nhóm 2: Gồm 10 gà làm đối chứng, tiêm dưới da hoặc tiêm bắp bằng nước muối sinh lý vô trùng (5.5) với liều lượng như gà nhóm 1.
- 28 ngày sau khi tiêm vắc xin lần 1, tất cả gà nhóm 1 và nhóm 2 được tiêm nhắc lại với liều lượng và đường tiêm như lần 1.
- 14 ngày sau khi tiêm vắc xin lần 2, tất cả gà nhóm 1 và nhóm 2 được lấy máu, chắt huyết thanh để kiểm tra hiệu giá kháng thể kháng ARV bằng 1 trong 2 phương pháp sau:
+ Phương pháp VNT, các bước thực hiện phản ứng trung hòa vi rút được nêu tại Phụ lục A;
+ Phương pháp ELISA, sử dụng kit ELISA (5.7) kiểm tra kháng thể kháng ARV.
CHÚ THÍCH: Hiện nay, có nhiều bộ KIT ELISA phát hiện kháng thể kháng ARV bán sẵn trên thị trường. Khi sử dụng phương pháp ELISA cần theo đúng hướng dẫn của nhà sản xuất. Ví dụ về phản ứng ELISA sử dụng KIT thương mại được nêu trong phụ lục B.
7.6.2 Đánh giá kết quả
Vắc xin có kết quả kiểm tra hiệu lực đạt yêu cầu khi:
- Phương pháp VNT:
+ Nhóm 1: Ít nhất 80 % mẫu huyết thanh đạt HGKT ≥ 1/32;
+ Nhóm 2: 100 % mẫu huyết thanh đạt giá trị âm tính (HGKT <1/2).
- Phương pháp ELISA:
+ Nhóm 1: Ít nhất 80 % mẫu huyết thanh đạt giá trị dương tính;
+ Nhóm 2: 100 % mẫu huyết thanh đạt giá trị âm tính.
8 Kết luận
- Đối với vắc xin vô hoạt: Vắc xin đạt yêu cầu kiểm nghiệm khi đáp ứng được tất cả các yêu cầu về cảm quan, độ vô trùng, độ vô hoạt, độ an toàn và hiệu lực theo quy định tại mục 7.1, 7.2, 7.3, 7.5 và 7.6.
- Đối với vắc xin nhược độc: Vắc xin đạt yêu cầu kiểm nghiệm khi đáp ứng được tất cả các yêu cầu về cảm quan, độ vô trùng, độ thuần khiết, độ an toàn và hiệu lực theo quy định tại mục 7.1, 7.2, 7.4, 7.5 và 7.6.
9 Báo cáo kết quả kiểm nghiệm
Báo cáo kết quả kiểm nghiệm phải nêu rõ:
- Mọi thông tin cần thiết về nhận biết đầy đủ về mẫu thử;
- Phương pháp lấy mẫu đã sử dụng, nếu biết;
- Phương pháp thử đã sử dụng, viện dẫn tiêu chuẩn này;
- Tất cả các điều kiện thao tác không quy định trong tiêu chuẩn này, hoặc được xem là tùy ý, cùng với mọi tình huống bất thường có thể ảnh hưởng đến kết quả;
- Kết quả kiểm nghiệm thu được.
Phụ lục A
(quy định)
Phương pháp trung hòa vi rút (Viral Neutralization Test - VNT)
A.1 Nguyên vật liệu
A.1.1 Môi trường nuôi cấy tế bào DMEM (Dulbecco's Modified Eagle Medium).
A.1.2 Dung dịch PBS 1X, pH 7,2.
A.1.3 Dung dịch trypsin 1X có 0,05 % EDTA.
A.1.4 Huyết thanh bào thai bê FBS (Fetal bovine serum).
A.1.5 Huyết thanh đối chứng dương.
A.1.6 Huyết thanh đối chứng âm.
A.1.7 Huyết thanh cần kiểm tra (xem mục 7.6.1; 7.6.2).
A.1.8 Tế bào xơ phôi gà 1 lớp CEF (Chicken Embryo Fibroblast).
A.1.9 Vi rút REO (Vi rút vắc xin).
A.2 Cách tiến hành
A.2.1 Xử lý mẫu huyết thanh
Mẫu huyết thanh (A.1.5; A.1.6; A.1.7) được bất hoạt ở 56 °C trong 30 phút trong bể ủ nhiệt (6.18).
A.2.2 Chuẩn bị tế bào
Tế bào xơ phôi gà (A.1.8) pha loãng với mật độ 6 x105 tế bào/ml trong môi trường DMEM với 2 % FBS. Bảo quản tế bào ở nhiệt độ 2 °C đến 8 °C để thực hiện các bước pha loãng huyết thanh.
A.2.3 Chuẩn bị vi rút
Pha loãng dung dịch vi rút sử dụng (A.1.9) đến nồng độ cần trung hòa 100 TCID50/100 μl trong môi trường DMEM 1X. Bảo quản vi rút ở nhiệt độ 2 °C đến 8 °C.
A.2.4 Thực hiện phản ứng VNT
A.2.4.1 Thực hiện trên đĩa phản ứng (Bảng A.1):
- Huyết thanh pha loãng bắt đầu từ 1/2 đến 1/512. Mỗi mẫu huyết thanh cho vào 2 giếng.
Bảng A.1 - Sơ đồ đĩa phản ứng bố trí mẫu thực hiện
| Mẫu Độ pha loãng | Mẫu huyết thanh 01 | Mẫu huyết thanh 02 | Mẫu huyết thanh 03 | Mẫu huyết thanh 04 | Mẫu huyết thanh 05 | Mẫu huyết thanh 06 | |||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | ||
| 1/2 | A |
|
|
|
|
|
|
|
|
|
|
|
|
| 1/4 | B |
|
|
|
|
|
|
|
|
|
|
|
|
| 1/8 | C |
|
|
|
|
|
|
|
|
|
|
|
|
| 1/32 | D |
|
|
|
|
|
|
|
|
|
|
|
|
| 1/64 | E |
|
|
|
|
|
|
|
|
|
|
|
|
| 1/128 | F |
|
|
|
|
|
|
|
|
|
|
|
|
| 1/256 | G |
|
|
|
|
|
|
|
|
|
|
|
|
| 1/512 | H |
|
|
|
|
|
|
|
|
|
|
|
|
Bảng A.2 - Sơ đồ đĩa phản ứng bố trí mẫu đối chứng
| Mẫu
Độ pha loãng | Đối chứng dương | Đối chứng âm |
| Đối chứng tế bào/Đối chứng môi trường |
| Dung dịch vi rút 10-1 | Dung dịch vi rút 10-2 | Dung dịch vi rút 10-3 | Dung dịch vi rút 10-4 | ||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | ||
| 1/2 | A |
|
|
|
|
|
|
|
|
|
|
|
|
| 1/4 | B |
|
|
|
|
|
|
|
|
|
|
|
|
| 1/8 | C |
|
|
|
|
|
|
|
|
|
|
|
|
| 1/32 | D |
|
|
|
|
|
|
|
|
|
|
|
|
| 1/64 | E |
|
|
|
|
|
|
|
|
|
|
|
|
| 1/128 | F |
|
|
|
|
|
|
|
|
|
|
|
|
| 1/256 | G |
|
|
|
|
|
|
|
|
|
|
|
|
| 1/512 | H |
|
|
|
|
|
|
|
|
|
|
|
|
- Dùng pipet (6.6) cho 50 μl môi trường DMEM 1X vào các giếng A1 đến H12 của đĩa phản ứng.
- Dùng pipet (6.5) lần lượt cho 50 μl mẫu huyết thanh 01 vào giếng A1, A2.
- Dùng pipet (6.5) lần lượt cho 50 μl mẫu huyết thanh 02 vào giếng A3, A4.
- Dùng pipet (6.5) lần lượt cho 50 μl mẫu huyết thanh 03 vào giếng A5, A6.
- Dùng pipet (6.5) lần lượt cho 50 μl mẫu huyết thanh 04 vào giếng A7, A8.
- Dùng pipet (6.5) lần lượt cho 50 μl mẫu huyết thanh 05 vào giếng A9, A10.
- Dùng pipet (6.5) lần lượt cho 50 μl mẫu huyết thanh 06 vào giếng A11, A12.
- Dùng pipet (6.6) pha loãng bậc 2 mẫu huyết thanh từ A1 đến H1, từ A2 đến H2, từ A3 đến H3, A4 đến H4, A5 đến H5, A6 đến H6, A7 đến H7, A8 đến H8, A9 đến H9, A10 đến H10, A11 đến H11, A12 đến H12 và loại bỏ 50 μl.
- Dùng pipet (6.6) cho 50 μl dung dịch vi rút (A.3.3) vào tất cả các giếng từ A1 đến H12.
- Ủ đĩa ở tủ ấm (6.17) trong 45 min đến 60 min.
- Sau khi ủ xong, dùng pipet (6.6) cho 100 μl tế bào xơ phôi gà 1 lớp (A.1.8) vào tất cả các giếng.
- Ủ đĩa ở tủ ấm (6.17) trong 48 h đến 72 h.
- Kiểm tra đĩa phản ứng hằng ngày dưới kính hiển vi soi ngược (6.16) để ghi nhận bệnh tích tế bào.
A.3.4.2 Thực hiện trên đĩa đối chứng (Bảng A.2)
* Đối chứng huyết thanh
- Dùng pipet (6.6) cho 50 μl môi trường DMEM 1X vào giếng A1 đến H4.
- Dùng pipet (6.5) cho 50 μl huyết thanh đối chứng dương vào giếng A1 và A2 và cho 50 μl huyết thanh đối chứng âm vào giếng A3 và A4.
- Dùng pipet (6.6) pha loãng bậc 2 mẫu huyết thanh đối chứng từ A1 đến H1, từ A2 đến H2, từ A3 đến H3, A4 đến H4 và loại loại bỏ 50 μl.
* Đối chứng tế bào
- Dùng pipet (6.6) cho 100 μl môi trường DMEM 1X vào giếng A6 đến D6 và A7 đến D7.
- Ủ đĩa ở tủ ẩm CO2 (6.17)trong 45 min đến 60 min.
* Đối chứng môi trường
- Dùng pipet (6.6) cho 150 μl môi trường DMEM 1X vào giếng E6 đến H6 và E7 đến H7.
- Ủ đĩa ở tủ ấm CO2 (6.17) trong 45 min đến 60 min.
* Chuẩn độ lại vi rút sử dụng (A.3.3)
- Pha loãng dung dịch vi rút sử dụng (A.3.3) thành nồng độ 10-1 (100 μl dung dịch vi rút với 900 μl môi trường DMEM), tiếp tục pha loãng đến các nồng độ 10-2, 10-3 và 10-4.
- Dùng pipet (6.5) cho 100 μl dung dịch vi rút pha loãng 10-1 và các giếng từ A9 đến H9.
- Dùng pipet (6.5) cho 100 μl dung dịch vi rút pha loãng 10-2 và các giếng từ A10 đến H10.
- Dùng pipet (6.5) cho 100 μl dung dịch vi rút pha loãng 10-3 và các giếng từ A11 đến H11.
- Dùng pipet (6.5) cho 100 μl dung dịch vi rút pha loãng 10-4 và các giếng từ A12 đến H12.
- Ủ đĩa ở tủ ấm CO2 (6.17) trong 45 min đến 60 min.
- Sau khi ủ xong, dùng pipet (6.6) cho 100 μl tế bào xơ phôi gà 1 lớp (A.1.8) vào tất cả các giếng từ A1 đến H4, từ A6 đến D6, A7 đến D7 và từ A9 đến H12.
- Ủ đĩa ở tủ ấm CO2 (6.17) trong 24 h đến 48 h.
- Kiểm tra tế bào hằng ngày dưới kính hiển vi soi ngược để ghi nhận bệnh tích tế bào.
A.3.5 Đọc kết quả
- Đọc kết quả bằng cách quan sát dưới kính hiển vi soi ngược để ghi nhận bệnh lý tế bào trên từng giếng.
- Điều kiện chấp nhận kết quả:
+ Đối chứng tế bào: Bình thường;
+ Đối chứng môi trường: Bình thường;
+ Hiệu giá của mẫu đối chứng huyết thanh dương chuẩn chỉ chênh lệch ± 1 độ pha loãng bậc 2 so với hiệu giá đã biết.
- Kết quả dương tính là những giếng khi xem dưới kính hiển vi soi ngược không có bệnh tích tế bào (không có CPE).
- Kết quả âm tính là những giếng khi xem dưới kính hiển vi soi ngược có bệnh tích tế bào (có CPE).
- Bệnh tích tế bào được ghi nhận vào phiếu kết quả. Kết quả được tính bằng công thức Karber (1931).
Hiệu giá huyết thanh = a + 0,5 -1/n × Σr1
Trong đó:
a là độ pha loãng cao nhất không có bệnh tích tế bào;
r1 là số giếng có bệnh tích tế bào ở từng độ pha loãng;
n là số giếng sử dụng cho một độ pha loãng.
- Kết luận:
+ Mẫu có hiệu giá kháng thể trung hòa ≥ 1/32 được xem là mẫu dương tính;
+ Mẫu có hiệu giá kháng thể trung hòa <1/2 được xem là mẫu âm tính.
Phụ lục B
(tham khảo)
Ví dụ phương pháp ELISA kiểm tra kháng thể kháng ARV
B.1 Vật liệu thử
B.1.1 Huyết thanh gà cần kiểm tra.
B.1.2 Nước cất 2 lần.
B.1.3 Bộ Kit ELISA của hãng IDEXX (Avian Reovirus Antibody Test Kit)1).
B.2 Cách tiến hành
B.2.1 Pha loãng huyết thanh gà (B.1.1) bằng dung dịch pha mẫu theo tỷ lệ 1/500 (kí hiệu từ S1 đến S46).
B.2.2 Dùng pipet (6.5) nhỏ 100 μl đối chứng âm ARV vào giếng A1 và A2 của đĩa có phủ kháng nguyên ARV.
B.2.3 Dùng pipet (6.5) nhỏ 100 μl đối chứng dương ARV vào giếng B1 và B2 của đĩa có phủ kháng nguyên ARV.
B.2.4 Dùng pipet (6.6) nhỏ 100 μl huyết thanh đã pha loãng (B.2.1) vào các giếng còn lại của đĩa có phủ kháng nguyên ARV, mỗi mẫu cho vào 2 giếng, (ví dụ mẫu S1 cho vào 2 giếng C1, C2, mẫu S2 cho vào 2 giếng D1, D2).
B.2.5 Ủ đĩa ở nhiệt độ phòng trong 30 min (nhiệt độ từ 18 °C đến 25 °C).
B.2.6 Loại bỏ dung dịch trong giếng và rửa các giếng của đĩa bằng nước cất (B.1.2), mỗi giếng 350 μl nước cất, rửa từ 3 lần đến 5 lần, sau khi rửa xong vỗ đĩa vào giấy thấm cho khô nước.
B.2.7 Dùng pipet (6.6) nhỏ 100 μl kháng kháng thể (Kháng thể đã gắn enzym - Anti- chicken) vào tất cả các giếng của đĩa phản ứng, sau đó ủ đĩa ở nhiệt độ phòng trong 30 min (nhiệt độ từ 18 °C đến 25 °C).
B.2.8 Loại bỏ dung dịch trong giếng và rửa các giếng của đĩa bằng nước cất (B.1.2), dùng pipet (6.6) nhỏ mỗi giếng 350 μl nước cất, rửa từ 3 lần đến 5 lần, sau khi rửa xong vỗ đĩa vào giấy thấm cho khô nước.
B.2.9 Dùng pipet (6.6) nhỏ 100 μl cơ chất phù hợp với enzym vào tất cả các giếng của đĩa phản ứng, sau đó ủ đĩa ở nhiệt độ phòng trong 15 min (nhiệt độ từ 18 °C đến 25 °C).
B.2.10 Dùng pipet (6.6) nhỏ 100 μl dung dịch dừng phản ứng vào tất cả các giếng của đĩa phản ứng, sau đó đặt đĩa vào máy đọc ELISA (6.10) và đọc ở bước sóng 650 nm để thu được các giá trị mật độ quang học (Optical density - OD) của các mẫu trong đĩa phản ứng.
Bảng B.1 - Sơ đồ bố trí mẫu trong đĩa ELISA
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| A | NC | NC | S7 | S7 | S15 | S15 | S23 | S23 | S31 | S31 | S39 | S39 |
| B | PC | PC | S8 | S8 | S16 | S46 | S24 | S24 | S32 | S32 | S40 | S40 |
| C | S1 | S1 | S9 | S9 | S17 | S17 | S25 | S25 | S33 | S33 | S41 | S41 |
| D | S2 | S2 | S10 | S10 | S18 | S18 | S26 | S26 | S34 | S34 | S42 | S42 |
| E | S3 | S3 | S11 | S11 | S19 | S19 | S27 | S27 | S35 | S35 | S43 | S43 |
| F | S4 | S4 | S12 | S12 | S20 | S20 | S28 | S28 | S36 | S36 | S44 | S44 |
| G | S5 | S5 | S13 | S13 | S21 | S21 | S29 | S29 | S37 | S37 | S45 | S45 |
| H | S6 | S6 | S14 | S14 | S22 | S22 | S30 | S30 | S38 | S38 | S46 | S46 |
| CHÚ THÍCH: NC: negative control (đối chứng âm) PC: positive control (đối chứng dương) S: samμle (mẫu) S1 đến S46: mẫu kiểm tra số 1 đến mẫu kiểm tra số 46 | ||||||||||||
B.3 Công thức tính kết quả
| - Đối chứng dương trung bình: PCX = |
| |||
| - Đối chứng âm trung bình: NCx = |
| |||
| - OD mẫu trung bình: ODx = |
| |||
| - Giá trị s/p = |
| |||
- Hiệu giá S/P (ở độ pha loãng 1 : 500): log10 Titer = 1,09 (log10S/P) + 3,36
B.4 Điều kiện kết quả
Giá trị OD của đối chứng đạt điều kiện như sau thì phản ứng đạt:
- PCX – NCx > 0,075;
- NCx ≤ 0,150.
B.5 Diễn giải kết quả
+ Mẫu dương tính: S/P ≥ 0,20;
+ Mẫu âm tính: S/P < 0,20.
Thư mục tài liệu tham khảo
[1] Executive Yuan of the Republic of China (R.O.C). Standards for the inspection of medicinal products for animal use published by Council of Agriculture, article 156, 170.
[2] Trung tâm Kiểm nghiệm thuốc thú y Trung ương I, (2010). 30VR - 10KN1 - Quy trình Kiểm nghiêm vắc xin phòng bệnh viêm khớp ở gia cầm (Avian Reovirus).
[3] R.C.Jones (2000). Avian reovirus infectious- Rev.sci.tech.Off.int.Epiz.,2000,1 9(2), p614-625.
1) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các bộ Kit ELISA được chỉ định khác nếu cho kết quả tương đương.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 8685-41:2023 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 8685-41:2023 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 8685-41:2023 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 8685-41:2023 DOC (Bản Word)