- Tổng quan
- Nội dung
- VB gốc
- Tiếng Anh
- Hiệu lực
- VB liên quan
- Lược đồ
-
Nội dung hợp nhất
Tính năng này chỉ có tại LuatVietnam.vn. Nội dung hợp nhất tổng hợp lại tất cả các quy định còn hiệu lực của văn bản gốc và các văn bản sửa đổi, bổ sung, đính chính... trên một trang. Việc hợp nhất văn bản gốc và những văn bản, Thông tư, Nghị định hướng dẫn khác không làm thay đổi thứ tự điều khoản, nội dung.
Khách hàng chỉ cần xem Nội dung hợp nhất là có thể nắm bắt toàn bộ quy định hiện hành đang áp dụng, cho dù văn bản gốc đã qua nhiều lần chỉnh sửa, bổ sung.
- Tải về
Thông tư 34/2018/TT-BYT quy định chi tiết Nghị định 104/2016/NĐ-CP về hoạt động tiêm chủng
| Cơ quan ban hành: | Bộ Y tế |
Số công báo:
Số công báo là mã số ấn phẩm được đăng chính thức trên ấn phẩm thông tin của Nhà nước. Mã số này do Chính phủ thống nhất quản lý.
|
Đã biết
|
| Số hiệu: | 34/2018/TT-BYT | Ngày đăng công báo: |
Đã biết
|
| Loại văn bản: | Thông tư | Người ký: | Nguyễn Thị Kim Tiến |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
16/11/2018 |
Ngày hết hiệu lực:
Ngày hết hiệu lực là ngày, tháng, năm văn bản chính thức không còn hiệu lực (áp dụng).
|
Đang cập nhật |
|
Áp dụng:
Ngày áp dụng là ngày, tháng, năm văn bản chính thức có hiệu lực (áp dụng).
|
Đã biết
|
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
| Lĩnh vực: | Y tế-Sức khỏe |
TÓM TẮT THÔNG TƯ 34/2018/TT-BYT
Ngày 16/11/2018, Bộ Y tế đã ban hành Thông tư 34/2018/TT-BYT quy định chi tiết một số điều của Nghị định 104/2016/NĐ-CP quy định về hoạt động tiêm chủng.
Theo hướng dẫn của Thông tư này, sau khi tiêm chủng, trẻ phải được theo dõi ít nhất 30 phút tại điểm tiêm chủng và tiếp tục theo dõi ít nhất 24 giờ tại nhà về các dấu hiệu: Tinh thần, ăn, ngủ, thở, phát ban, triệu chứng tại chỗ tiêm. Nếu có dấu hiệu bất thường phải báo ngay cho nhân viên y tế.
Đặc biệt, nếu trẻ có những biểu hiện sau phải đưa trẻ đến ngay bệnh viện hoặc các cơ sở y tế khác: Sốt cao trên 39 độ, co giật, trẻ khóc thét, quấy khóc kéo dài, li bì, bú kém, bỏ bú, khó thở, tím tái, phát ban và các biểu hiện bất thường khác…
Thông tư này cũng chỉ rõ, mỗi buổi tiêm chủng tại mỗi điểm tiêm chủng chỉ được thực hiện tiêm với tối đa 50 trẻ; trường hợp chỉ tiêm 01 loại vắc xin thì không quá 100 trẻ/buổi.
Thông tư này có hiệu lực từ ngày 01/01/2019.
Xem chi tiết Thông tư 34/2018/TT-BYT có hiệu lực kể từ ngày 01/01/2019
Tải Thông tư 34/2018/TT-BYT
|
BỘ Y TẾ Số: 34/2018/TT-BYT |
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM Hà Nội, ngày 16 tháng 11 năm 2018 |
THÔNG TƯ
QUY ĐỊNH CHI TIẾT MỘT SỐ ĐIỀU CỦA NGHỊ ĐỊNH SỐ 104/2016/NĐ-CP NGÀY 01 THÁNG 7 NĂM 2016 CỦA CHÍNH PHỦ QUY ĐỊNH VỀ HOẠT ĐỘNG TIÊM CHỦNG
Căn cứ Nghị định số 104/2016/NĐ-CP ngày 01 tháng 7 năm 2016 của Chính phủ quy định về hoạt động tiêm chủng;
Căn cứ Nghị định số 75/2017/NĐ-CP ngày 20 tháng 6 năm 2017 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Xét đề nghị của Cục trưởng Cục Y tế dự phòng;
Bộ trưởng Bộ Y tế ban hành Thông tư hướng dẫn chi tiết một số điều của Nghị định số 104/2016/NĐ-CP ngày 01 tháng 7 năm 2016 của Chính phủ quy định về hoạt động tiêm chủng.
Chương I
QUY ĐỊNH CHUNG
Điều 1. Phạm vi điều chỉnh
Thông tư này quy định về tiếp nhận, vận chuyển, bảo quản vắc xin; tổ chức tiêm chủng; giám sát, điều tra nguyên nhân tai biến nặng sau tiêm chủng; chế độ báo cáo và quản lý hồ sơ về hoạt động tiêm chủng.
Điều 2. Giải thích từ ngữ
Trong Thông tư này, các từ ngữ dưới đây được hiểu như sau:
1. Hòm lạnh là dụng cụ chứa các bình tích lạnh để bảo quản vắc xin và dung môi trong quá trình vận chuyển hoặc bảo quản trong thời hạn từ 4 đến 7 ngày tùy thuộc vào việc sử dụng bình tích lạnh.
2. Phích vắc xin là dụng cụ chứa các bình tích lạnh để bảo quản vắc xin và dung môi trong quá trình vận chuyển hoặc bảo quản trong thời hạn từ 1 đến 2 ngày tùy thuộc vào việc sử dụng bình tích lạnh.
3. Chỉ thị nhiệt độ lọ vắc xin (VVM) là nhãn được dán lên lọ vắc xin, có thể thay đổi màu khi lọ vắc xin tiếp xúc với nhiệt độ cao vượt quá thời gian cho phép tùy vào từng loại vắc xin.
4. Chỉ thị đông băng điện tử là dụng cụ được sử dụng để cho biết phương tiện bảo quản vắc xin đã hoặc đang ở mức nhiệt độ có thể làm đông băng vắc xin.
5. Thẻ theo dõi nhiệt độ là dụng cụ ghi nhận nhiệt độ bảo quản vắc xin trong quá trình vận chuyển, bảo quản.
6. Phản ứng thông thường sau tiêm chủng là các biểu hiện nhẹ và có thể tự khỏi, thường xảy ra sau khi sử dụng vắc xin, bao gồm các triệu chứng tại chỗ như ngứa, đau, sưng hoặc đỏ hoặc vừa sưng vừa đỏ tại chỗ tiêm; triệu chứng toàn thân như sốt dưới 39°C và các triệu chứng khác (khó chịu, mệt mỏi, chán ăn).
Chương II
QUY ĐỊNH VỀ TIẾP NHẬN, VẬN CHUYỂN VÀ BẢO QUẢN VẮC XIN
Điều 3. Cấp phát, tiếp nhận vắc xin
1. Khi cấp phát vắc xin, người cấp phát phải kiểm tra và lưu giữ thông tin theo mẫu quy định tại Phụ lục I ban hành kèm theo Thông tư này tại đơn vị cấp phát. Nếu phát hiện có bất thường về các thông tin liên quan đến vắc xin thì hai bên giao nhận phải lập biên bản về tình trạng thực tế của vắc xin và xử lý theo quy định.
2. Khi tiếp nhận vắc xin, người tiếp nhận phải kiểm tra và lưu giữ thông tin theo mẫu quy định tại Phụ lục I ban hành kèm theo Thông tư này, không tiếp nhận khi có bất thường về thông tin liên quan đến vắc xin.
Điều 4. Bảo quản vắc xin và dung môi trong thiết bị dây chuyền lạnh
1. Bảo quản vắc xin:
Vắc xin phải được bảo quản theo quy định tại Điều 8 Nghị định số 104/2016/NĐ-CP ngày 01 tháng 7 năm 2016 của Chính phủ quy định về hoạt động tiêm chủng (sau đây gọi tắt là Nghị định số 104/2016/NĐ-CP) và các quy định cụ thể sau đây:
a) Vắc xin phải được bảo quản riêng trong thiết bị dây chuyền lạnh, không bảo quản chung với các sản phẩm khác;
b) Sắp xếp vắc xin đúng, vị trí, tránh làm đông băng vắc xin;
c) Bảo đảm vệ sinh khi thực hiện thao tác với hộp, lọ vắc xin;
d) Thực hiện việc theo dõi nhiệt độ dây chuyền lạnh bảo quản vắc xin hằng ngày (kể cả ngày lễ, ngày nghỉ) và ghi vào bảng theo dõi nhiệt độ tối thiểu 2 lần/ ngày vào buổi sáng bắt đầu ngày làm việc và buổi chiều trước khi kết thúc ngày làm việc;
đ) Đối với vắc xin trong chương trình tiêm chủng mở rộng: Ngoài việc thực hiện các quy định tại các điểm a, b, c, d Khoản này, phải có thiết bị cảnh báo nhiệt độ buồng lạnh, có nhật ký tự động ghi lại nhiệt độ đối với kho bảo quản vắc xin trong tiêm chủng mở rộng của trung ương và khu vực; có nhiệt kế và chỉ thị đông băng điện tử đối với kho hoặc tủ lạnh bảo quản vắc xin của tuyến tỉnh và tuyến huyện; có nhiệt kế đối với tủ lạnh, hòm lạnh hoặc phích vắc xin của tuyến xã.
2. Bảo quản dung môi:
Trường hợp không đóng gói cùng vắc xin, dung môi có thể được bảo quản ngoài thiết bị dây chuyền lạnh nhưng phải tuân thủ các yêu cầu bảo quản của nhà sản xuất và đáp ứng các yêu cầu sau:
a) Không được để đông băng dung môi;
b) Phải được làm lạnh từ +2°C đến +8°C trước khi sử dụng 24 giờ để pha hồi chỉnh.
Điều 5. Bảo quản vắc xin trong buổi tiêm chủng
1. Sử dụng phích vắc xin, hòm lạnh hoặc tủ lạnh để bảo quản vắc xin trong suốt buổi tiêm chủng theo quy định tại các điểm a, b, c và điểm đ khoản 1 Điều 4 Thông tư này và phải bảo đảm nhiệt độ từ +2°C đến +8°C.
2. Những lọ vắc xin chưa mở sau buổi tiêm chủng cần được tiếp tục bảo quản trong thiết bị dây chuyền lạnh và sử dụng trước vào buổi tiêm chủng kế tiếp.
Điều 6. Vận chuyển vắc xin
1. Việc vận chuyển vắc xin thực hiện theo quy định tại các điểm b, d khoản 1 Điều 8 Nghị định số 104/2016/NĐ-CP.
2. Bảo quản vắc xin trong quá trình vận chuyển thực hiện theo quy định tại các điểm a, b, c khoản 1 Điều 4 Thông tư này; Phải duy trì nhiệt độ bảo quản liên tục, phù hợp đối với từng loại vắc xin theo hướng dẫn sử dụng ghi trên nhãn hoặc tờ hướng dẫn sử dụng vắc xin trong suốt quá trình vận chuyển.
3. Vắc xin trong chương trình tiêm chủng mở rộng phải theo dõi nhiệt độ bằng nhiệt kế và chỉ thị đông băng điện tử, ghi lại nhiệt độ trong suốt quá trình vận chuyển đối với tuyến trung ương, khu vực và tỉnh. Đối với tuyến huyện và tuyến xã phải thực hiện theo dõi nhiệt độ trong suốt quá trình vận chuyển bằng nhiệt kế.
Điều 7. Bảo dưỡng thiết bị dây chuyền lạnh, giám sát việc bảo quản vắc xin trong dây chuyền lạnh
1. Thiết bị dây chuyền lạnh phải được kiểm tra thường xuyên, theo dõi tình trạng hoạt động, bảo dưỡng định kỳ theo hướng dẫn của nhà sản xuất, được sửa chữa hoặc thay thế phù hợp với yêu cầu kỹ thuật của nhà sản xuất bảo đảm vắc xin luôn được lưu giữ ở đúng nhiệt độ trong suốt quá trình bảo quản, vận chuyển và sử dụng theo hướng dẫn sử dụng ghi trên nhãn hoặc tờ hướng dẫn sử dụng vắc xin.
2. Thực hiện bảo dưỡng định kỳ và hiệu chuẩn định kỳ thiết bị dây chuyền lạnh, thiết bị theo dõi nhiệt độ bảo quản vắc xin theo quy định của Nghị định số 36/2016/NĐ-CP ngày 15 tháng 5 năm 2016 của Chính phủ về quản lý trang thiết bị y tế .
Chương III
TỔ CHỨC TIÊM CHỦNG
Điều 8. Quản lý đối tượng
1. Nội dung quản lý đối tượng thực hiện theo quy định tại Điều 4 Nghị định số 104/2016/NĐ-CP.
2. Việc báo cáo, quản lý đối tượng, ghi chép bằng văn bản và Hệ thống quản lý thông tin tiêm chủng quốc gia. Thời gian triển khai báo cáo bằng Hệ thống quản lý thông tin tiêm chủng quốc gia theo hướng dẫn của Bộ Y tế.
Điều 9. Bố trí, sắp xếp tại điểm tiêm chủng cố định và điểm tiêm chủng lưu động
1. Tổ chức buổi tiêm chủng không quá 50 đối tượng/1 điểm tiêm chủng/1 buổi tiêm chủng. Trong trường hợp điểm tiêm chủng chỉ tiêm một loại vắc xin trong một buổi thì số lượng không quá 100 đối tượng/buổi. Bố trí đủ nhân viên y tế để thực hiện khám sàng lọc.
2. Mỗi cơ sở tiêm chủng được tổ chức từ một đến nhiều điểm tiêm chủng cố định và đều phải bảo đảm đủ diện tích, nhân sự, cơ sở vật chất và trang thiết bị.
3. Tại mỗi điểm tiêm chủng phải có bản phân công nhiệm vụ cụ thể cho từng nhân viên.
4. Bố trí điểm tiêm chủng bảo đảm nguyên tắc một chiều theo thứ tự như sau: Khu vực chờ trước tiêm chủng → Bàn đón tiếp, hướng dẫn → Bàn khám sàng lọc và tư vấn trước tiêm chủng → Bàn tiêm chủng → Bàn ghi chép, vào sổ tiêm chủng → Khu vực theo dõi và xử trí tai biến sau tiêm chủng.
Điều 10. Khám sàng lọc và tư vấn trước tiêm chủng
1. Khám sàng lọc trước tiêm chủng đối với trẻ em theo quy định của Bộ Y tế; Quan sát toàn trạng, đánh giá tình trạng sức khỏe hiện tại đối với người lớn.
2. Hỏi và ghi chép thông tin của đối tượng tiêm chủng về tiền sử bệnh tật, tiền sử dị ứng, tiền sử tiêm chủng trước đây.
3. Tư vấn cho đối tượng tiêm chủng, cha, mẹ, người giám hộ của trẻ về tác dụng, lợi ích của việc sử dụng vắc xin và giải thích những phản ứng có thể gặp sau tiêm chủng.
4. Thông báo cho đối tượng tiêm chủng, cha, mẹ, người giám hộ của trẻ về tác dụng, liều lượng, đường dùng của loại vắc xin được tiêm chủng trước mỗi lần tiêm.
Điều 11. Thực hiện tiêm chủng
1. Liều lượng, đường dùng của từng loại vắc xin phải tuân thủ theo hướng dẫn sử dụng ghi trên nhãn hoặc tờ hướng dẫn sử dụng vắc xin kèm theo.
2. Vắc xin đông khô phải pha hồi chỉnh theo quy định tại Phụ lục II ban hành kèm theo Thông tư này.
3. Vắc xin được sử dụng theo nguyên tắc: hạn ngắn phải được sử dụng trước, tiếp nhận trước phải sử dụng trước hoặc chỉ thị nhiệt độ lọ vắc xin cần phải sử dụng trước theo hướng dẫn của nhà sản xuất hoặc vắc xin từ buổi tiêm chủng trước chưa sử dụng hết được bảo quản theo đúng quy định và sử dụng trước.
4. Vắc xin dạng dung dịch sau khi mở bảo quản ở nhiệt độ từ +2°C đến +8°C và được sử dụng trong buổi tiêm chủng.
5. Dung môi của vắc xin nào chỉ được sử dụng cho vắc xin đó. Vắc xin đông khô sau khi pha hồi chỉnh chỉ được phép sử dụng trong vòng 6 giờ hoặc theo hướng dẫn của nhà sản xuất.
6. Thực hiện tiêm chủng:
a) Kiểm tra vắc xin, dung môi và bơm tiêm, kim tiêm trước khi sử dụng;
b) Cho đối tượng tiêm chủng hoặc cha, mẹ, người giám hộ của trẻ xem lọ vắc xin trước khi tiêm chủng;
c) Thực hiện tiêm đúng đối tượng chỉ định tiêm chủng, đúng vắc xin, đúng liều, đúng đường dùng, đúng thời điểm;
d) Bơm tiêm, kim tiêm và vật sắc, nhọn sau khi sử dụng phải cho vào hộp an toàn ngay sau khi tiêm, không đậy nắp kim.
7. Kết thúc buổi tiêm chủng:
a) Bảo quản vắc xin, dung môi còn nguyên lọ theo quy định tại Điều 4 Thông tư này;
b) Bơm kim tiêm chưa sử dụng phải được bảo quản theo quy định để dùng lần sau;
c) Các lọ vắc xin nhiều liều đã mở nhưng chưa sử dụng hết và các lọ đã sử dụng hết sau buổi tiêm chủng thì xử lý theo quy định tại Thông tư số 58/2015/TTLT-BYT-BTNMT ngày 31 tháng 12 năm 2015 của Liên Bộ Y tế, Tài nguyên và Môi trường quy định về quản lý chất thải y tế;
d) Đối với các trường hợp trì hoãn tiêm chủng trong tiêm chủng mở rộng phải sắp xếp tiêm bù ngay trong tháng.
Điều 12. Theo dõi sau tiêm chủng
1. Theo dõi đối tượng tiêm chủng ít nhất 30 phút sau tiêm chủng tại điểm tiêm chủng.
2. Hướng dẫn gia đình hoặc đối tượng tiêm chủng:
a) Tiếp tục theo dõi tại nhà ít nhất 24 giờ sau tiêm chủng về các dấu hiệu: toàn trạng, tinh thần, ăn, ngủ, thở, phát ban, triệu chứng tại chỗ tiêm, thông báo cho nhân viên y tế nếu có dấu hiệu bất thường;
b) Đưa ngay đối tượng tiêm chủng tới bệnh viện hoặc các cơ sở y tế nếu sau tiêm chủng có một trong các dấu hiệu như sốt cao (≥39°C), co giật, trẻ khóc thét, quấy khóc kéo dài, li bì, bú kém, bỏ bú, khó thở, tím tái, phát ban và các biểu hiện bất thường khác hoặc khi phản ứng thông thường kéo dài trên 24 giờ sau tiêm chủng.
3. Ghi chép:
a) Ghi đầy đủ thông tin vào phiếu hoặc sổ tiêm chủng của đối tượng tiêm chủng và trên Hệ thống quản lý thông tin tiêm chủng quốc gia và hẹn lần tiêm chủng sau;
b) Ghi ngày tiêm chủng đối với từng loại vắc xin đã tiêm chủng cho đối tượng tiêm chủng và ghi chép các phản ứng sau tiêm chủng trên Hệ thống quản lý thông tin tiêm chủng quốc gia.
Điều 13. Tổ chức chiến dịch tiêm chủng và tiêm chủng tại nhà
1. Việc tổ chức chiến dịch tiêm chủng thực hiện theo các hướng dẫn của Bộ Y tế đối với từng chiến dịch.
2. Chỉ những cơ sở tiêm chủng đã công bố đủ điều kiện tiêm chủng theo quy định tại Nghị định số 104/2016/NĐ-CP mới được phép thực hiện chiến dịch.
3. Việc tiêm chủng tại nhà chỉ được áp dụng đối với hoạt động tiêm chủng thuộc Chương trình tiêm chủng mở rộng, tiêm chủng chống dịch tại các xã thuộc vùng sâu, vùng xa, xã có điều kiện kinh tế - xã hội đặc biệt khó khăn.
Chương IV
GIÁM SÁT ĐIỀU TRA NGUYÊN NHÂN TAI BIẾN NẶNG SAU TIÊM CHỦNG
Điều 14. Phát hiện, xử trí và báo cáo tai biến nặng sau tiêm chủng
1. Việc phát hiện và xử trí tai biến nặng sau tiêm chủng khi đang triển khai tiêm chủng được thực hiện theo quy định tại khoản 2, khoản 3 và khoản 4 Điều 5 Nghị định số 104/2016/NĐ-CP.
2. Thống kê các thông tin liên quan đến trường hợp bị tai biến nặng sau tiêm chủng:
a) Họ tên, tuổi, giới, địa chỉ, số điện thoại (nếu có) của đối tượng tiêm chủng hoặc cha, mẹ của trẻ;
b) Ngày, giờ tiêm chủng;
c) Loại vắc xin; tên vắc xin; số đăng ký lưu hành hoặc số giấy phép nhập khẩu; số lô; hạn sử dụng; nhà sản xuất; đơn vị cung cấp; tình trạng bảo quản lúc nhận;
d) Ngày, giờ xuất hiện tai biến nặng sau tiêm chủng; các triệu chứng chính; kết quả điều trị; kết luận nguyên nhân (nếu có).
3. Thống kê toàn bộ số lượng vắc xin (tên vắc xin, số lô, hạn sử dụng) đã sử dụng trong buổi tiêm chủng; số đối tượng đã được sử dụng theo từng loại và lô vắc xin trong buổi tiêm chủng đó, tình trạng sức khỏe của đối tượng tiêm chủng.
4. Cơ sở khám bệnh, chữa bệnh tiếp nhận trường hợp tai biến nặng sau tiêm chủng phải thực hiện:
a) Tiến hành cấp cứu, xử trí và điều trị theo quy định;
b) Báo cáo Sở Y tế theo quy định tại khoản 3 Điều 5 Nghị định số 104/2016/NĐ-CP;
5. Tuyến huyện, tỉnh: tiếp nhận báo cáo, tổng hợp thông tin, báo cáo tuyến trên theo quy định tại Điều 18 và Điều 20 Thông tư này.
Điều 15. Điều tra tai biến nặng sau tiêm chủng
1. Sở Y tế thành lập Đoàn điều tra gồm: Trưởng đoàn là đại diện Lãnh đạo Trung tâm Kiểm soát bệnh tật hoặc Trung tâm Y tế dự phòng tỉnh, thành phố trực thuộc Trung ương (sau đây gọi tắt là Trung tâm kiểm soát bệnh tật), thành viên là đại diện Phòng nghiệp vụ Y - Sở Y tế, đại diện Khoa Kiểm soát bệnh truyền nhiễm của Trung tâm Kiểm soát bệnh tật, đại diện Khoa hồi sức cấp cứu, Khoa Sản/Nhi Bệnh viện đa khoa tỉnh hoặc Bệnh viện Sản/Nhi tỉnh và các chuyên gia, nhân viên liên quan khác.
2. Quy trình điều tra:
a) Các bước điều tra cụ thể theo quy định tại Phụ lục III ban hành kèm theo Thông tư này;
b) Sử dụng phiếu điều tra theo mẫu quy định tại Phụ lục IV ban hành kèm theo Thông tư này;
c) Báo cáo kết quả điều tra về Sở Y tế.
3. Lấy mẫu vắc xin:
a) Lấy mẫu vắc xin đối với tất cả các trường hợp tai biến nặng sau tiêm chủng;
b) Việc lấy mẫu, niêm phong, bảo quản và gửi mẫu vắc xin theo quy định tại Phụ lục V ban hành kèm theo Thông tư này;
c) Kiểm định chất lượng vắc xin khi có nghi ngờ nguyên nhân tai biến nặng do vắc xin hoặc theo yêu cầu của Hội đồng tư vấn chuyên môn đánh giá nguyên nhân tai biến sau tiêm chủng;
d) Nếu mẫu vắc xin không thuộc diện phải gửi kiểm định thì tiếp tục sử dụng tại địa phương.
4. Cơ sở phát hiện, tiếp nhận trường hợp tai biến nặng sau tiêm chủng thực hiện thu thập mẫu bệnh phẩm trong trường hợp cần thiết để xác định nguyên nhân tai biến sau tiêm chủng.
Điều 16. Đánh giá nguyên nhân tai biến nặng sau tiêm chủng và thông báo kết quả
1. Việc đánh giá nguyên nhân thực hiện đối với các trường hợp sau:
a) Tai biến nặng sau tiêm chủng;
b) Tỷ lệ phản ứng thông thường thực tế vượt quá tỷ lệ thống kê thường gặp;
c) Một trường hợp hay một cụm phản ứng có khả năng ảnh hưởng nghiêm trọng tới cộng đồng.
2. Việc đánh giá nguyên nhân tai biến nặng sau tiêm chủng thực hiện theo mẫu quy định tại Phụ lục VI ban hành kèm theo Thông tư này và phân loại nguyên nhân theo quy định tại Phụ lục VII ban hành kèm theo Thông tư này.
3. Sở Y tế có trách nhiệm:
a) Thành lập, tổ chức họp Hội đồng tư vấn chuyên môn đánh giá nguyên nhân tai biến nặng sau tiêm chủng trên địa bàn và thông báo nguyên nhân tai biến nặng sau tiêm chủng theo quy định tại khoản 1, khoản 2 Điều 6 Nghị định số 104/2016/NĐ-CP và hướng dẫn của Bộ Y tế.
b) Đánh giá nguyên nhân đối với các trường hợp quy định tại điểm b và c khoản 1 Điều này.
Chương V
CHẾ ĐỘ BÁO CÁO VÀ QUẢN LÝ HỒ SƠ
Điều 17. Chế độ báo cáo
1. Báo cáo định kỳ: báo cáo tháng, quý và năm về tình hình sử dụng vắc xin, kết quả tiêm chủng, các trường hợp phản ứng thông thường và các trường hợp tai biến nặng sau tiêm chủng.
2. Báo cáo đột xuất: các trường hợp quy định tại khoản 1 Điều 16 Thông tư này.
3. Báo cáo hằng ngày: khi thực hiện tiêm chủng chống dịch.
Điều 18. Hình thức, nội dung báo cáo
1. Hình thức báo cáo:
a) Báo cáo định kỳ: bằng văn bản và báo cáo bằng Hệ thống quản lý thông tin tiêm chủng quốc gia;
b) Báo cáo đột xuất: Trong trường hợp khẩn cấp thì báo cáo trực tiếp hoặc báo cáo qua điện thoại hoặc báo cáo qua thư điện tử và trong vòng 24 giờ phải gửi báo cáo bằng văn bản;
c) Báo cáo hằng ngày: bằng văn bản hoặc thư điện tử.
2. Nội dung báo cáo:
a) Báo cáo định kỳ:
- Báo cáo việc sử dụng vắc xin trong Chương trình tiêm chủng mở rộng theo mẫu số 1 quy định tại Phụ lục VIII ban hành kèm theo Thông tư này;
- Báo cáo việc sử dụng vắc xin tiêm chủng dịch vụ theo mẫu số 2 quy định tại Phụ lục VIII ban hành kèm theo Thông tư này;
- Báo cáo kết quả tiêm chủng theo mẫu số 1, 2, 3 quy định tại Phụ lục IX ban hành kèm theo Thông tư này;
- Báo cáo các trường hợp phản ứng thông thường sau tiêm chủng theo mẫu quy định tại Phụ lục X ban hành kèm theo Thông tư này;
- Báo cáo các trường hợp tai biến nặng sau tiêm chủng theo mẫu quy định tại Phụ lục XI ban hành kèm theo Thông tư này.
b) Báo cáo đột xuất: Đối với cơ sở tiêm chủng báo cáo theo mẫu quy định tại Phụ lục XII ban hành kèm theo Thông tư này hoặc theo yêu cầu của cơ quan có thẩm quyền. Đối với cơ sở khám bệnh, chữa bệnh tiếp nhận trường hợp tai biến nặng sau tiêm chủng thực hiện báo cáo nội dung theo quy định tại khoản 3 Điều 5 Nghị định số 104/2016/NĐ-CP.
c) Báo cáo hàng ngày: Báo cáo số đối tượng, số vắc xin, vật tư tiêm chủng, các trường hợp phản ứng thông thường và các trường hợp tai biến nặng sau tiêm chủng trong tiêm chủng vắc xin chống dịch.
Điều 19. Quy trình và thời gian báo cáo định kỳ
1. Đối với vắc xin trong Chương trình tiêm chủng mở rộng:
a) Cơ sở tiêm chủng: báo cáo Trung tâm Y tế huyện trước ngày 05 của tháng tiếp theo đối với báo cáo tháng, ngày 05 của tháng đầu tiên của quý tiếp theo đối với báo cáo quý, trước ngày 15 tháng 01 của năm tiếp theo đối với báo cáo năm;
b) Trung tâm y tế huyện: báo cáo Trung tâm Kiểm soát bệnh tật trước ngày 10 của tháng tiếp theo đối với báo cáo tháng, ngày 10 của tháng đầu tiên của quý tiếp theo đối với báo cáo quý, trước ngày 25 tháng 01 của năm tiếp theo đối với báo cáo năm;
c) Trung tâm Kiểm soát bệnh tật: báo cáo Sở Y tế, Dự án tiêm chủng mở rộng khu vực tại các Viện Vệ sinh dịch tễ trung ương, Viện Pasteur thành phố Hồ Chí Minh, Viện Pasteur Nha Trang, Viện Vệ sinh tễ Tây Nguyên theo địa bàn được phân công quản lý của Bộ trưởng Bộ Y tế (sau đây gọi tắt là Viện khu vực), đồng thời báo cáo Dự án Tiêm chủng mở rộng quốc gia - Viện Vệ sinh dịch tễ Trung ương trước ngày 15 của tháng tiếp theo đối với báo cáo tháng, trước ngày 15 của tháng đầu tiên của quý tiếp theo đối với báo cáo quý, trước ngày 31 tháng 01 của năm tiếp theo đối với báo cáo năm;
d) Dự án Tiêm chủng mở rộng quốc gia tổng hợp báo cáo Cục Y tế dự phòng trước ngày 20 của tháng tiếp theo đối với báo cáo tháng, trước ngày 20 của tháng đầu tiên của quý tiếp theo đối với báo cáo quý, trước ngày 15 tháng 02 của năm tiếp theo đối với báo cáo năm.
2. Đối với vắc xin tiêm chủng dịch vụ:
a) Cơ sở tiêm chủng: báo cáo Trung tâm Y tế huyện trước ngày 05 của tháng tiếp theo đối với báo cáo tháng, trước ngày 05 của tháng đầu tiên của quý tiếp theo đối với báo cáo quý, trước ngày 15 tháng 01 của năm tiếp theo đối với báo cáo năm;
b) Trung tâm Y tế huyện: báo cáo Trung tâm Kiểm soát bệnh tật trước ngày 10 của tháng tiếp theo đối với báo cáo tháng, trước ngày 10 của tháng đầu tiên của quý tiếp theo đối với báo cáo quý, trước ngày 25 tháng 01 của năm tiếp theo đối với báo cáo năm;
c) Trung tâm Kiểm soát bệnh tật: báo cáo Sở Y tế, các Viện khu vực, Cục Y tế dự phòng; trước ngày 15 của tháng tiếp theo đối với báo cáo tháng, trước ngày 15 của tháng đầu tiên của quý tiếp theo đối với báo cáo quý, trước ngày 31 tháng 01 của năm tiếp theo đối với báo cáo năm.
Điều 20. Quy trình và thời gian báo cáo đột xuất
1. Trong thời gian 24 giờ, kể từ thời điểm ghi nhận tai biến nặng sau tiêm chủng, cơ sở tiêm chủng hoặc cơ sở khám bệnh, chữa bệnh tiếp nhận trường hợp tai biến nặng sau tiêm chủng phải báo cáo Sở Y tế đồng thời báo cáo Trung tâm Kiểm soát bệnh tật, Trung tâm Y tế huyện nơi cơ sở đặt trụ sở.
2. Hằng tuần, sau khi thực hiện việc báo cáo quy định tại khoản 1 Điều này, nếu chưa có kết luận điều tra thì:
a) Cơ sở tiêm chủng phải thực hiện báo cáo diễn biến quá trình điều tra, xử lý trong tuần vào ngày thứ 2 của tuần kế tiếp;
b) Trung tâm Kiểm soát bệnh tật phải thực hiện báo cáo diễn biến quá trình điều tra, xử lý trong tuần vào ngày thứ 4 của tuần kế tiếp.
Điều 21. Quy trình và thời gian báo cáo hằng ngày
1. Cơ sở tiêm chủng: báo cáo Trung tâm Y tế huyện trước 17 giờ chiều hàng ngày.
2. Trung tâm y tế huyện: báo cáo Trung tâm Kiểm soát bệnh tật trước 9 giờ sáng ngày tiếp theo.
3. Trung tâm Kiểm soát bệnh tật: báo cáo Sở Y tế, Viện khu vực và Cục Y tế dự phòng trước 14 giờ ngày tiếp theo.
Điều 22. Quản lý hồ sơ
1. Các cơ sở tiêm chủng phải lưu trữ và quản lý tài liệu chuyên môn và hồ sơ bao gồm:
a) Các quy định, hướng dẫn chuyên môn về sử dụng vắc xin, bản phân công nhiệm vụ;
b) Sổ theo dõi tiêm chủng cho đối tượng tiêm chủng hoặc các thông tin về quản lý đối tượng tiêm chủng nếu quản lý bằng công nghệ thông tin;
c) Sổ theo dõi, báo cáo định kỳ, đột xuất và hằng ngày tại cơ sở.
2. Sở Y tế, Trung tâm Kiểm soát bệnh tật phải lưu trữ và quản lý tài liệu chuyên môn và hồ sơ bao gồm:
a) Các quy định, tài liệu hướng dẫn chuyên môn về tiêm chủng;
b) Báo cáo định kỳ, đột xuất và hàng ngày trên địa bàn quản lý.
3. Các Viện Vệ sinh dịch tễ, Viện Pasteur và Dự án tiêm chủng mở rộng quốc gia phải lưu trữ và quản lý tài liệu chuyên môn và hồ sơ bao gồm:
a) Các quy định, tài liệu hướng dẫn chuyên môn về sử dụng vắc xin, tiêm chủng;
b) Báo cáo định kỳ, đột xuất và hằng ngày thuộc khu vực phụ trách.
4. Hồ sơ, báo cáo, sổ theo dõi phải đầy đủ, dễ tìm kiếm, tra cứu, được quản lý và lưu trữ theo quy định của pháp luật về lưu trữ.
Chương VI
TRÁCH NHIỆM THỰC HIỆN
Điều 23. Trách nhiệm của các Vụ, Cục thuộc Bộ Y tế
1. Cục Y tế dự phòng:
a) Chủ trì, phối hợp với các Vụ, Cục liên quan chỉ đạo, hướng dẫn, kiểm tra, thanh tra chuyên ngành về việc sử dụng vắc xin trên phạm vi cả nước; thông tin tuyên truyền về an toàn tiêm chủng, lợi ích của việc sử dụng vắc xin và các phản ứng có thể gặp sau tiêm chủng;
b) Chủ trì hoặc phối hợp với các đơn vị liên quan xây dựng các hướng dẫn chuyên môn về sử dụng vắc xin, giám sát xử lý và điều tra nguyên nhân các trường hợp tai biến nặng sau tiêm chủng trình cơ quan có thẩm quyền ban hành.
c) Đầu mối quản lý, chỉ đạo hướng dẫn thực hiện Hệ thống quản lý thông tin tiêm chủng quốc gia.
2. Cục Quản lý Dược:
a) Tham mưu cho Lãnh đạo Bộ Y tế về việc tạm dừng và cho phép sử dụng lại vắc xin trên phạm vi cả nước, phối hợp với Sở Y tế xem xét việc tạm dừng lô vắc xin theo quy định;
b) Quản lý cung ứng vắc xin và chất lượng vắc xin lưu hành tại Việt Nam;
c) Phối hợp với các đơn vị liên quan trong việc thanh tra, kiểm tra việc sử dụng vắc xin theo quy định;
d) Hướng dẫn thực hiện việc thu hồi, lưu trữ, hủy vắc xin theo quy định;
đ) Cung cấp danh mục vắc xin, huyết thanh phòng bệnh mới trong vòng 05 ngày làm việc kể từ khi vắc xin được cấp phép lưu hành tại Việt Nam cho Cục Y tế dự phòng để cập nhật vào Hệ thống quản lý thông tin tiêm chủng quốc gia.
3. Cục Quản lý khám, chữa bệnh:
a) Chủ trì phối hợp với Vụ Sức khỏe bà mẹ - trẻ em hướng dẫn khám sàng lọc trước tiêm chủng đối với trẻ em và xử trí tai biến nặng sau tiêm chủng. Chỉ đạo cơ sở khám bệnh, chữa bệnh phối hợp với Trung tâm Kiểm soát bệnh tật hỗ trợ các cơ sở tiêm chủng trong việc khám sàng lọc trước tiêm chủng, xử trí tai biến nặng sau tiêm chủng và điều tra nguyên nhân tai biến nặng sau tiêm chủng;
b) Chỉ đạo và kiểm tra, giám sát hoạt động tiêm chủng trong hệ thống khám bệnh, chữa bệnh;
c) Phối hợp với các đơn vị liên quan trong việc thanh tra, kiểm tra việc sử dụng vắc xin theo quy định;
d) Chỉ đạo các cơ sở khám, chữa bệnh có cơ sở tiêm chủng hoặc các cơ sở y tế được thực hiện tiêm chủng tham gia triển khai áp dụng Hệ thống quản lý thông tin tiêm chủng quốc gia theo hướng dẫn của Bộ Y tế.
Điều 24. Trách nhiệm của Dự án tiêm chủng mở rộng quốc gia và các Viện
1. Trách nhiệm của Dự án tiêm chủng mở rộng quốc gia:
a) Lập kế hoạch nhu cầu sử dụng vắc xin, đề xuất các vắc xin và lịch tiêm chủng trong Chương trình tiêm chủng mở rộng;
b) Tổ chức mua, tiếp nhận, bảo quản và cung ứng vắc xin Chương trình tiêm chủng mở rộng cho các đơn vị sử dụng theo quy định;
c) Xây dựng và thống nhất tài liệu tập huấn về tiêm chủng trình cấp có thẩm quyền phê duyệt. Tổ chức tập huấn về tiêm chủng trong tiêm chủng mở rộng, tiêm chủng chống dịch;
d) Phối hợp điều tra nguyên nhân các trường hợp tai biến nặng sau tiêm chủng, xử trí kịp thời đối với các trường hợp tai biến nặng sau tiêm chủng, lưu trữ số liệu sử dụng vắc xin trong tiêm chủng mở rộng và số liệu về phản ứng sau tiêm chủng;
đ) Phối hợp tập huấn về giám sát, điều tra phản ứng sau tiêm chủng cho Hội đồng tư vấn chuyên môn đánh giá nguyên nhân tai biến nặng sau tiêm chủng cấp tỉnh;
e) Tổng hợp, báo cáo về công tác tiêm chủng theo quy định;
g) Tổ chức việc thông tin tuyên truyền về an toàn tiêm chủng, lợi ích của việc sử dụng vắc xin và các phản ứng sau tiêm chủng theo phân công chỉ đạo của Bộ Y tế;
h) Quản lý, sử dụng kinh phí bồi thường đối với các trường hợp được Nhà nước bồi thường theo quy định tại Nghị định số 104/2016/NĐ-CP;
i) Hướng dẫn, tổ chức thực hiện, kiểm tra, giám sát việc thực hiện công tác tiêm chủng mở rộng và giám sát các bệnh trong tiêm chủng mở rộng;
k) Phối hợp với Cục Y tế dự phòng chỉ đạo, hướng dẫn triển khai thực hiện Hệ thống quản lý thông tin tiêm chủng quốc gia theo hướng dẫn của Bộ Y tế;
l) Làm thường trực Ban Chỉ đạo quốc gia về tiêm chủng.
2. Trách nhiệm của các Viện khu vực:
a) Chỉ đạo chuyên môn kỹ thuật, giám sát sử dụng vắc xin tại các địa phương theo địa bàn được phân công quản lý của Bộ Y tế để bảo đảm chất lượng, an toàn trong công tác tiêm chủng; giám sát phản ứng sau tiêm chủng;
b) Tổ chức tiếp nhận, bảo quản và cung ứng vắc xin Chương trình tiêm chủng mở rộng cho các địa phương theo địa bàn được phân công quản lý của Bộ Y tế;
c) Tổ chức tập huấn về tiêm chủng, sử dụng vắc xin trong tiêm chủng mở rộng và tiêm chủng chống dịch;
d) Tham gia phối hợp điều tra, kết luận nguyên nhân các trường hợp tai biến nặng sau tiêm chủng tại địa phương theo địa bàn được phân công quản lý của Bộ Y tế, xử lý kịp thời đối với các trường hợp tai biến nặng sau tiêm chủng;
đ) Tổng hợp, báo cáo về công tác tiêm chủng trên địa bàn quản lý;
e) Phối hợp với Cục Y tế dự phòng hướng dẫn triển khai thực hiện Hệ thống quản lý thông tin tiêm chủng quốc gia theo hướng dẫn của Bộ Y tế.
3. Trách nhiệm của Viện Kiểm định quốc gia vắc xin, sinh phẩm y tế:
a) Thực hiện giám sát chất lượng, tính an toàn của vắc xin trên phạm vi cả nước;
b) Phối hợp với các đơn vị liên quan trong việc thanh tra, kiểm tra việc sử dụng vắc xin.
Điều 25. Trách nhiệm của Sở Y tế, Trung tâm Kiểm soát bệnh tật, Phòng Y tế huyện, Trung tâm Y tế huyện
1. Trách nhiệm của Sở Y tế:
a) Chỉ đạo việc triển khai các hoạt động tiêm chủng theo các quy định của Bộ Y tế, tổ chức, triển khai kiểm tra, thanh tra việc thực hiện Thông tư này trong phạm vi quản lý;
b) Tổ chức việc đánh giá nguyên nhân, kết luận và công bố nguyên nhân các trường hợp tai biến nặng sau tiêm chủng trên địa bàn tỉnh;
c) Chỉ đạo việc thông tin, tuyên truyền về an toàn tiêm chủng, lợi ích việc sử dụng vắc xin và các phản ứng sau tiêm chủng;
d) Quyết định việc tạm dừng vắc xin trên cơ sở ý kiến của Cục Quản lý Dược và sử dụng lại vắc xin trên địa bàn quản lý thông báo cho Cục quản lý Dược về việc này;
đ) Chỉ đạo triển khai thực hiện Hệ thống quản lý thông tin tiêm chủng quốc gia theo hướng dẫn của Bộ Y tế trên địa bàn quản lý.
2. Trách nhiệm của Trung tâm Kiểm soát bệnh tật:
a) Triển khai việc sử dụng, bảo quản, phân phối vắc xin bảo đảm chất lượng, đáp ứng nhu cầu tiêm chủng phòng bệnh của người dân;
b) Tổ chức tập huấn và tập huấn lại về tiêm chủng, sử dụng vắc xin trong tiêm chủng mở rộng và tiêm chủng chống dịch;
c) Tham gia điều tra, đánh giá nguyên nhân các trường hợp tai biến nặng sau tiêm chủng trên địa bàn tỉnh;
d) Lấy mẫu vắc xin khi xảy ra trường hợp tai biến nặng sau tiêm chủng;
đ) Chỉ đạo, hướng dẫn thực hiện, phối hợp với Thanh tra Sở Y tế kiểm tra, thanh tra hoạt động sử dụng vắc xin tại địa phương;
e) Tổng hợp, báo cáo về công tác tiêm chủng trên địa bàn quản lý;
g) Chỉ đạo, triển khai thực hiện Hệ thống quản lý thông tin tiêm chủng quốc gia theo hướng dẫn của Bộ Y tế trên địa bàn quản lý.
3. Trách nhiệm của Phòng Y tế huyện:
a) Phối hợp với Trung tâm Y tế huyện chỉ đạo việc tổ chức tiêm chủng trên địa bàn theo quy định của Bộ Y tế;
b) Thực hiện kiểm tra, thanh tra hoạt động tiêm chủng trên địa bàn quản lý.
4. Trách nhiệm của Trung tâm Y tế huyện:
a) Thực hiện bảo quản, vận chuyển, phân phối vắc xin bảo đảm chất lượng và chỉ đạo, hướng dẫn Trạm Y tế xã triển khai sử dụng vắc xin theo quy định;
b) Phối hợp với Phòng Y tế huyện kiểm tra, thanh tra các hoạt động tiêm chủng trên địa bàn quản lý;
c) Đối với Trung tâm Y tế huyện có chức năng cung cấp dịch vụ chuyên môn kỹ thuật về y tế dự phòng và khám bệnh, chữa bệnh có trách nhiệm thực hiện quy định tại Điều 26 Thông tư này;
d) Tổng hợp, báo cáo về công tác tiêm chủng trên địa bàn quản lý;
đ) Chỉ đạo, hướng dẫn triển khai Hệ thống quản lý thông tin tiêm chủng quốc gia theo hướng dẫn của Bộ Y tế trên địa bàn quản lý.
Điều 26. Trách nhiệm của các bệnh viện sản, nhi, bệnh viện đa khoa của Nhà nước
1. Tham gia tập huấn về khám sàng lọc cho các cơ sở tiêm chủng theo chỉ đạo của Bộ Y tế, Sở Y tế.
2. Phối hợp điều tra, kết luận nguyên nhân các trường hợp tai biến nặng sau tiêm chủng.
3. Tổ chức thực hiện việc tiêm chủng vắc xin viêm gan B trong vòng 24 giờ sau sinh đối với cơ sở có phòng sinh theo đúng quy định và tổ chức triển khai tiêm chủng các vắc xin khác trong Chương trình tiêm chủng mở rộng khi cơ quan quản lý nhà nước có thẩm quyền yêu cầu.
4. Triển khai thực hiện Hệ thống quản lý thông tin tiêm chủng quốc gia theo hướng dẫn của Bộ Y tế đối với các cơ sở tiêm chủng.
5. Tổng hợp, báo cáo về công tác tiêm chủng của đơn vị (nếu có).
Điều 27. Trách nhiệm của cơ sở tiêm chủng và người thực hiện tiêm chủng
1. Trách nhiệm của cơ sở tiêm chủng:
a) Chịu trách nhiệm trước pháp luật về việc thực hiện các hoạt động chuyên môn theo đúng chức năng, nhiệm vụ được giao;
b) Tuân thủ quy trình chuyên môn kỹ thuật về sử dụng vắc xin và an toàn tiêm chủng;
c) Tổ chức thực hiện việc tiêm chủng vắc xin viêm gan B trong vòng 24 giờ sau sinh đối với các cơ sở y tế có phòng sinh theo đúng quy định và tổ chức triển khai tiêm chủng các vắc xin khác trong chương trình tiêm chủng mở rộng khi cơ quan quản lý nhà nước có thẩm quyền yêu cầu;
d) Phối hợp với các tổ chức, đoàn thể tuyên truyền, vận động người dân tham gia tiêm chủng phòng bệnh;
đ) Phối hợp với các đơn vị liên quan thực hiện và tạo điều kiện thuận lợi cho việc điều tra nguyên nhân tai biến nặng sau tiêm chủng;
e) Triển khai thực hiện Hệ thống quản lý thông tin tiêm chủng quốc gia theo hướng dẫn của Bộ Y tế;
g) Tổng hợp, báo cáo về công tác tiêm chủng của đơn vị.
2. Trách nhiệm của người thực hiện tiêm chủng: tuân thủ đúng các quy trình chuyên môn của Bộ Y tế về tiêm chủng và quy định liên quan tại Thông tư này.
Chương VIII
ĐIỀU KHOẢN THI HÀNH
Điều 28. Hiệu lực thi hành
1. Thông tư này có hiệu lực kể từ ngày 01 tháng 01 năm 2019
2. Thông tư 12/2014/TT-BYT ngày 20 tháng 3 năm 2014 của Bộ trưởng Bộ Y tế hướng dẫn việc sử dụng vắc xin trong tiêm chủng hết hiệu lực kể từ ngày Thông tư này có hiệu lực thi hành.
Điều 29. Điều khoản tham chiếu
Trường hợp các văn bản được dẫn chiếu trong văn bản này bị thay thế hoặc sửa đổi, bổ sung thì thực hiện theo văn bản thay thế hoặc văn bản đã được sửa đổi, bổ sung.
Điều 30. Trách nhiệm thi hành
Chánh Văn phòng Bộ, Cục trưởng Cục Y tế dự phòng, Vụ trưởng, Cục trưởng, Tổng cục trưởng thuộc Bộ Y tế, Thủ trưởng các cơ quan, đơn vị trực thuộc Bộ, Giám đốc Sở Y tế các tỉnh, thành phố trực thuộc Trung ương và Thủ trưởng Đơn vị y tế các Bộ, ngành và các cơ quan, tổ chức, cá nhân chịu trách nhiệm thi hành Thông tư này.
Trong quá trình thực hiện, nếu có khó khăn vướng mắc, đề nghị cơ quan, tổ chức, cá nhân báo cáo về Bộ Y tế để xem xét, giải quyết./.
|
Nơi nhận: |
BỘ TRƯỞNG |
PHỤ LỤC I
BIÊN BẢN GIAO, NHẬN VẮC XIN
(Ban hành kèm theo Thông tư số 34/2018/TT-BYT ngày 16/11/2018 của Bộ trưởng Bộ Y tế)
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM
Độc lập - Tự do - Hạnh phúc
---------------
…….1......., ngày....tháng... năm 20....
|
TT |
Loại vắc xin2 |
Tên vắc xin |
Tên nhà sản xuất, nước sản xuất |
Hàm lượng, quy cách đóng gói |
Số đăng ký lưu hành/Số giấy phép nhập khẩu |
Số lô |
Hạn sử dụng |
Số liệu |
Tình trạng bảo quản (nhiệt độ, VVM, chỉ thị đông băng (nếu có) 3 |
Tình trạng vắc xin/dung môi (bao bì, nhãn mác, màu sắc,…) |
Ghi chú |
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
.... |
|
|
|
|
|
|
|
|
|
|
|
|
ĐẠI DIỆN ĐƠN VỊ GIAO |
ĐẠI DIỆN ĐƠN VỊ NHẬN |
______________________
1 Địa danh
2 Nếu có nước pha hồi chỉnh kèm theo thì phải ghi lại thông tin đối với nhà sản xuất, nước sản xuất, đơn vị cung cấp, số lô, hạn sử dụng của từng lô.
3 Nhiệt độ: ghi nhiệt độ lúc nhận, VVM: ghi giai đoạn (I, II, III, IV), chỉ thị đông băng: ghi tình trạng (V/X)
PHỤ LỤC II
CÁC BƯỚC PHA HỒI CHỈNH VẮC XIN
(Ban hành kèm theo Thông tư số 34/2018/TT-BYT ngày 16/11/2018 của Bộ trưởng Bộ Y tế)
Vắc xin đông khô cần được pha hồi chỉnh trước khi sử dụng.
Bước 1: Kiểm tra nhãn của dung môi và vắc xin để bảo đảm chắc chắn dung môi của đúng nhà sản xuất, đúng loại vắc xin. Không dùng dung môi của vắc xin này pha cho vắc xin khác, không dùng nước cất thay thế cho dung môi.
Bước 2: Kiểm tra hạn sử dụng của dung môi và vắc xin để bảo đảm còn hạn sử dụng. Dung môi phải được bảo quản lạnh ở nhiệt độ +2°C đến + 8°C trước khi pha hồi chỉnh.
Bước 3: Mở ống dung môi và vắc xin: Mở phần giữa của nắp lọ vắc xin hay lọ dung môi nơi có vòng tròn nhỏ, hoặc dùng cưa để mở.
Bước 4: Sử dụng 1 bơm kim tiêm (5ml) vô trùng cho mỗi lần pha hồi chỉnh. Hút lượng dung môi theo hướng dẫn của nhà sản xuất vào bơm kim tiêm vô trùng sau đó bơm toàn bộ dung môi này vào lọ/ống vắc xin. Trộn dung môi và vắc xin bằng cách hút từ từ dung môi vào bơm tiêm sau đó bơm trở lại một vài lần cho đến khi bột vắc xin tan hết. Không lưu kim tiêm trên nắp lọ vắc xin. Bỏ bơm và kim tiêm pha hồi chỉnh vào hộp an toàn sau khi đã sử dụng.
Bước 5: Vắc xin sau khi pha hồi chỉnh bảo quản trên miếng xốp trong phích vắc xin. Sử dụng 1 bơm kim tiêm tự khoá để hút vắc xin và sử dụng chính bơm kim tiêm đó để tiêm vắc xin cho đối tượng.
PHỤ LỤC III
CÁC BƯỚC ĐIỀU TRA TRƯỜNG HỢP TAI BIẾN NẶNG SAU TIÊM CHỦNG
(Ban hành kèm theo Thông tư số 34/2018/TT-BYT ngày 16/11/2018 của Bộ trưởng Bộ Y tế)
|
TT |
Các bước |
Hành động |
|
1 |
Xác minh các thông tin trong báo cáo |
- Thu thập hồ sơ bệnh án (hoặc ghi chép về lâm sàng) - Kiểm tra hồ sơ chi tiết về bệnh nhân, tình trạng diễn biến sức khỏe. - Phỏng vấn nhân viên y tế tiếp nhận, điều trị trường hợp tai biến nặng sau tiêm chủng, rà soát hồ sơ bệnh án hoặc ghi chép về lâm sàng. - Thu thập thêm thông tin còn thiếu trong báo cáo. - Xác định những trường hợp khác cần điều tra. |
|
2 |
Điều tra tai biến nặng sau tiêm chủng |
|
|
|
2.1. Điều tra và thu thập thông tin từ bệnh nhân hoặc người nhà |
- Tiền sử tiêm chủng. - Tiền sử bệnh tật, bao gồm tiền sử về phản ứng tương tự hoặc những tình trạng dị ứng khác. - Tiền sử về gia đình đối với những phản ứng tương tự. - Phỏng vấn trực tiếp cha, mẹ hoặc người chăm sóc trẻ, rà soát hồ sơ liên quan tới trường hợp tai biến nặng sau tiêm chủng do người nhà giữ đối với trẻ em. |
|
|
2.2. Điều tra bệnh cảnh lâm sàng của trường hợp tai biến nặng sau tiêm chủng |
- Bệnh sử, mô tả lâm sàng, tất cả các xét nghiệm liên quan đến tai biến nặng sau tiêm chủng và chẩn đoán - Điều trị, kết quả |
|
|
2.3. Điều tra vắc xin nghi ngờ |
- Điều kiện vận chuyển vắc xin, điều kiện, quá trình bảo quản, tình trạng bảo quản lọ vắc xin, bảng theo dõi nhiệt độ tủ lạnh. - Bảo quản vắc xin trước khi đến cơ sở y tế, biên bản giao nhận vắc xin, thẻ theo dõi nhiệt độ, chỉ thị đông băng điện tử. |
|
|
2.4. Điều tra những người liên quan |
- Những người đã được tiêm chủng cùng loại vắc xin trong cùng một buổi tiêm chủng có phản ứng hay không? phản ứng tương tự hay không? |
|
3 |
Đánh giá thực hành tiêm chủng |
|
|
|
3.1. Đánh giá thực hành tiêm chủng bằng cách hỏi |
- Đánh giá điểm tiêm chủng: Hỏi, quan sát việc cung cấp dịch vụ tiêm chủng, bảo quản vắc xin. - Cách bảo quản vắc xin (kể cả những lọ đã mở), việc phân phối và hủy bỏ vắc xin. - Cách bảo quản và phân phối dung môi. - Việc pha hồi chỉnh vắc xin (kỹ thuật và thời gian sử dụng sau khi pha). - Cách sử dụng và vô trùng bơm, kim tiêm. - Những chi tiết về huấn luyện thực hành tiêm chủng, về giám sát các kỹ thuật tiêm chủng. |
|
|
3.2. Quan sát hiện trạng thực hành tiêm chủng |
- Tủ lạnh: ngoài vắc xin còn bảo quản thêm những gì trong tủ lạnh (cần ghi chép nếu có những lọ tương tự được để cạnh những lọ vắc xin có thể nhầm lẫn); những loại vắc xin hoặc dung môi nào để cùng với những loại thuốc khác; có lọ vắc xin, sinh phẩm y tế nào mất nhãn, quá hạn sử dụng không? - Thực hành tiêm chủng (hồi chỉnh vắc xin, mở nút lọ, kỹ thuật tiêm, bảo đảm an toàn bơm, kim tiêm, vứt bỏ những lọ đã mở). |
|
4 |
Đặt giả thuyết |
- Nguyên nhân có thể xảy ra |
|
5 |
Kiểm tra giả thuyết |
- Trường hợp phản ứng có phù hợp với giả thuyết? - Chỉ lấy mẫu và yêu cầu kiểm định vắc xin nếu nghi ngờ nguyên nhân do chất lượng vắc xin. |
|
6 |
Kết thúc điều tra |
- Hoàn chỉnh phiếu điều tra. - Kết luận của đoàn điều tra và lập biên bản. - Khuyến nghị. |
PHỤ LỤC III
CÁC BƯỚC ĐIỀU TRA TRƯỜNG HỢP TAI BIẾN NẶNG SAU TIÊM CHỦNG
(Ban hành kèm theo Thông tư số 34/2018/TT-BYT ngày 16/11/2018 của Bộ trưởng Bộ Y tế)
|
TT |
Các bước |
Hành động |
|
1 |
Xác minh các thông tin trong báo cáo |
- Thu thập hồ sơ bệnh án (hoặc ghi chép về lâm sàng) - Kiểm tra hồ sơ chi tiết về bệnh nhân, tình trạng diễn biến sức khỏe. - Phỏng vấn nhân viên y tế tiếp nhận, điều trị trường hợp tai biến nặng sau tiêm chủng, rà soát hồ sơ bệnh án hoặc ghi chép về lâm sàng. - Thu thập thêm thông tin còn thiếu trong báo cáo. - Xác định những trường hợp khác cần điều tra. |
|
2 |
Điều tra tai biến nặng sau tiêm chủng |
|
|
|
2.1. Điều tra và thu thập thông tin từ bệnh nhân hoặc người nhà |
- Tiền sử tiêm chủng. - Tiền sử bệnh tật, bao gồm tiền sử về phản ứng tương tự hoặc những tình trạng dị ứng khác. - Tiền sử về gia đình đối với những phản ứng tương tự. - Phỏng vấn trực tiếp cha, mẹ hoặc người chăm sóc trẻ, rà soát hồ sơ liên quan tới trường hợp tai biến nặng sau tiêm chủng do người nhà giữ đối với trẻ em. |
|
|
2.2. Điều tra bệnh cảnh lâm sàng của trường hợp tai biến nặng sau tiêm chủng |
- Bệnh sử, mô tả lâm sàng, tất cả các xét nghiệm liên quan đến tai biến nặng sau tiêm chủng và chẩn đoán - Điều trị, kết quả |
|
|
2.3. Điều tra vắc xin nghi ngờ |
- Điều kiện vận chuyển vắc xin, điều kiện, quá trình bảo quản, tình trạng bảo quản lọ vắc xin, bảng theo dõi nhiệt độ tủ lạnh. - Bảo quản vắc xin trước khi đến cơ sở y tế, biên bản giao nhận vắc xin, thẻ theo dõi nhiệt độ, chỉ thị đông băng điện tử. |
|
|
2.4. Điều tra những người liên quan |
- Những người đã được tiêm chủng cùng loại vắc xin trong cùng một buổi tiêm chủng có phản ứng hay không? phản ứng tương tự hay không? |
|
3 |
Đánh giá thực hành tiêm chủng |
|
|
|
3.1. Đánh giá thực hành tiêm chủng bằng cách hỏi |
- Đánh giá điểm tiêm chủng: Hỏi, quan sát việc cung cấp dịch vụ tiêm chủng, bảo quản vắc xin. - Cách bảo quản vắc xin (kể cả những lọ đã mở), việc phân phối và hủy bỏ vắc xin. - Cách bảo quản và phân phối dung môi. - Việc pha hồi chỉnh vắc xin (kỹ thuật và thời gian sử dụng sau khi pha). - Cách sử dụng và vô trùng bơm, kim tiêm. - Những chi tiết về huấn luyện thực hành tiêm chủng, về giám sát các kỹ thuật tiêm chủng. |
|
|
3.2. Quan sát hiện trạng thực hành tiêm chủng |
- Tủ lạnh: ngoài vắc xin còn bảo quản thêm những gì trong tủ lạnh (cần ghi chép nếu có những lọ tương tự được để cạnh những lọ vắc xin có thể nhầm lẫn); những loại vắc xin hoặc dung môi nào để cùng với những loại thuốc khác; có lọ vắc xin, sinh phẩm y tế nào mất nhãn, quá hạn sử dụng không? - Thực hành tiêm chủng (hồi chỉnh vắc xin, mở nút lọ, kỹ thuật tiêm, bảo đảm an toàn bơm, kim tiêm, vứt bỏ những lọ đã mở). |
|
4 |
Đặt giả thuyết |
- Nguyên nhân có thể xảy ra |
|
5 |
Kiểm tra giả thuyết |
- Trường hợp phản ứng có phù hợp với giả thuyết? - Chỉ lấy mẫu và yêu cầu kiểm định vắc xin nếu nghi ngờ nguyên nhân do chất lượng vắc xin. |
|
6 |
Kết thúc điều tra |
- Hoàn chỉnh phiếu điều tra. - Kết luận của đoàn điều tra và lập biên bản. - Khuyến nghị. |
PHỤ LỤC IV
PHIẾU ĐIỀU TRA TAI BIẾN NẶNG SAU TIÊM CHỦNG
(Ban hành kèm theo Thông tư số 34/2018/TT-BYT ngày 16/11/2018 của Bộ trưởng Bộ Y tế)
Mã số trường hợp tai biến nặng sau tiêm chủng (*)……
Ngày tháng năm nhận được báo cáo: ---/---/----- Ngày điều tra: ---/---/-----
Nơi báo cáo trường hợp phản ứng:..................................................................
Thành phần đoàn điều tra (họ và tên, đơn vị công tác)
1. ...................................................................................................................
2. ...................................................................................................................
3. ...................................................................................................................
4. ...................................................................................................................
5. ...................................................................................................................
1. Thông tin chung
|
Họ và tên: ……………………………….. Giới: ……….Dân tộc ................... Ngày tháng năm sinh : …./…. /……. (…….tháng tuổi, nếu trẻ sơ sinh …….ngày tuổi) Con thứ mấy trong gia đình: .................................................................................................. Họ và tên mẹ (cha): ………………………………Số điện thoại: .................................................. Địa chỉ: Thôn/ấp: …………………………….Xã: ........................................................................ Huyện: …………………………………….Tỉnh: ........................................................................... Cơ sở tiêm chủng: ................................................................................................................ Tiêm chủng mở rộng □ Tiêm chủng dịch vụ □ Tiêm chủng thường xuyên □ Tiêm chủng chiến dịch □ Tại trạm y tế □ Tại bệnh viện/phòng khám □ Ngoài trạm □ Khác □ |
2. Thông tin về tiêm chủng trong lần này
|
Vắc xin |
Liều thứ mấy |
Đường tiêm |
Vị trí tiêm |
Người tiêm |
Giờ, ngày tiêm chủng |
Giờ, ngày bắt đầu xảy ra phản ứng |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. Thông tin về loại vắc xin, dung môi tiêm chủng trong lần này.
|
Loại vắc xin, dung môi |
Tên vắc xin, dung môi |
Nhà sản xuất |
Đơn vị cung cấp |
Số lô |
Hạn sử dụng |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4. Diễn biến tai biến nặng sau tiêm chủng
4.1 Triệu chứng và dấu hiệu lâm sàng
a/ Thông tin từ cha, mẹ hoặc người trực tiếp chăm sóc trẻ và hồ sơ người nhà giữ (Mô tả thời gian xuất hiện, triệu chứng đầu tiên của tai biến, diễn biến triệu chứng từ sau khi tiêm chủng)
.......................................................................................................................
.......................................................................................................................
.......................................................................................................................
b/ Thông tin từ nhân viên y tế và từ hồ sơ bệnh án tại cơ sở y tế (Mô tả thời gian đến cơ sở y tế, tình trạng ban đầu, diễn biến triệu chứng theo trình tự thời gian)
.......................................................................................................................
.......................................................................................................................
4.2 Kết quả xét nghiệm cận lâm sàng (máu/nước tiểu/dịch não tủy...tại các cơ sở y tế nơi trẻ được điều trị)
.......................................................................................................................
4.3 Quá trình chẩn đoán, điều trị và chẩn đoán cuối cùng của cơ sở y tế điều trị
.......................................................................................................................
.......................................................................................................................
4.4 Trường hợp tử vong
a/ Mô tả tình trạng khi phát hiện tử vong (tư thế, vị trí, chất tiết...)
.......................................................................................................................
.......................................................................................................................
b/ Kết quả giám định pháp y (thu thập kết quả giám định bằng văn bản nếu có)
Cơ quan giám định: .........................................................................................
Kết quả giám định: ..........................................................................................
6. Tình trạng tại thời điểm điều tra
□ Đang điều trị
□ Khỏi Sau tiêm chủng bao lâu:…………
□ Tử vong Sau tiêm chủng bao lâu………….
□ Di chứng (ghi rõ)…….Sau tiêm chủng bao lâu………….
7. Tiền sử
a/ Tiền sử sản khoa
- Tiền sử mẹ khi mang thai: ..............................................................................
.......................................................................................................................
- Số tuần thai khi sinh: …………………..Cân nặng khi sinh: ................................
- Các vấn đề sức khỏe của trẻ khi sinh: ............................................................
- Chỉ số APGAR (đối với trẻ sơ sinh): ...............................................................
b/ Tiền sử bệnh tật của trẻ từ khi sinh đến khi được tiêm chủng lần này
.......................................................................................................................
c/ Tiền sử tiêm chủng và phản ứng sau các lần tiêm chủng trước (loại vắc xin thời gian tiêm, nêu rõ phản ứng sau tiêm chủng nếu có).
.......................................................................................................................
d/ Tiền sử dùng thuốc ngay trước khi tiêm chủng lần này (trong vòng 1 tuần trước khi tiêm chủng)
.......................................................................................................................
e/ Trước, trong và sau tiêm chủng lần này trẻ ăn, uống hay bú mẹ có gì bất thường không? có té, ngã không?
.......................................................................................................................
f/ Tiền sử gia đình (dị ứng hoặc phản ứng với vắc xin ...nếu có)
.......................................................................................................................
Điều tra thực hiện quy trình tiêm chủng tại cơ sở tiêm chủng
|
a/ Điều kiện bảo quản vắc xin, dung môi (Nhận vắc xin từ đâu, thời gian nào, phương tiện nhận vắc xin, bảo quản vắc xin tại xã, có thiết bị theo dõi nhiệt độ bảo quản vắc xin? Kiểm tra nhiệt độ bảo quản vắc xin hiện tại, biểu đồ theo dõi nhiệt độ (nếu bảo quản vắc xin bằng tủ lạnh) ............................................................................................................................................. ............................................................................................................................................. b/ Cách tổ chức buổi tiêm chủng (Số đối tượng trong 1 buổi tiêm ? Số nhân viên tham gia tiêm chủng ? Có khám phân loại, tư vấn trước và theo dõi sau tiêm chủng?) ............................................................................................................................................. ............................................................................................................................................. c/ Thực hành tiêm chủng (Nhân viên trực tiếp tiêm chủng được tập huấn không? Kiểm tra kiến thức về thực hành khám chỉ định và chống chỉ định, bảo quản vắc xin, chuẩn bị vắc xin, pha hồi chỉnh (kỹ thuật pha, thời gian sử dụng), sử dụng BKT, kỹ thuật tiêm chủng, hủy vắc xin, BKT sau buổi tiêm chủng) ............................................................................................................................................. ............................................................................................................................................. d/ Ghi chép và quản lý sổ sách (Kiểm tra sổ quản lý vắc xin, sổ quản lý tiêm chủng, sổ theo dõi phản ứng bất thường sau tiêm chủng) ............................................................................................................................................. ............................................................................................................................................. e/ Tình hình tiêm chủng • Số đối tượng cùng tiêm trong buổi tiêm chủng của từng loại vắc xin ............................................................................................................................................. ............................................................................................................................................. • Số trẻ tiêm chủng cùng loại vắc xin: ………cùng lô vắc xin: ……..cùng lọ vắc xin (nếu lọ nhiều liều): …………với trường hợp tai biến sau tiêm chủng. • Số trường hợp tai biến nặng sau tiêm chủng tại cơ sở tiêm chủng trong thời gian gần đây ……………… • Tình hình bệnh tật, tử vong tại địa bàn trong thời gian gần đây có gì đặc biệt ............................................................................................................................................. ............................................................................................................................................. |
8. Điều tra tại cộng đồng (kết hợp hỏi nhân viên y tế và thăm hộ gia đình)
• Tổng số đối tượng được điều tra: ………………
• Số đối tượng có phản ứng với cùng loại vắc xin: …………….
• Các vấn đề khác: ..........................................................................................
9. Tình hình tiếp nhận, bảo quản, phân phối và sử dụng lô vắc xin có trường hợp tai biến nặng sau tiêm chủng tại tuyến tỉnh, huyện
9.1. Tình hình tiếp nhận, bảo quản, phân phối lô vắc xin tại tuyến tỉnh, huyện
|
Thông tin điều tra |
Tuyến tỉnh |
Tuyến huyện |
|
Nguồn gốc lô vắc xin |
|
|
|
Thời gian tiếp nhận |
|
|
|
Số lượng nhận |
|
|
|
Phương tiện vận chuyển |
|
|
|
Số lượng đã cấp cho tuyến dưới |
|
|
|
Số lượng còn tồn tại kho đơn vị |
|
|
|
Phương tiện bảo quản lô vắc xin này |
|
|
|
Nhiệt độ bảo quản lúc kiểm tra |
|
|
|
Chỉ thị đông băng điện tử lúc kiểm tra |
|
|
|
Chỉ thị nhiệt độ lọ vắc xin lúc kiểm tra (nếu có) |
|
|
|
Có bảng theo dõi nhiệt độ hằng ngày |
Có □ Không □ |
Có □ Không □ |
|
Nhiệt độ có trong giới hạn cho phép không? |
Có □ Không □ |
Có □ Không □ |
|
Có sự cố dây chuyền lạnh trong thời gian bảo quản lô vắc xin này không? |
Có □ Không □ |
Có □ Không □ |
|
Có sổ quản lý vắc xin, BKT, HAT |
Có □ Không □ |
Có □ Không □ |
|
Sổ ghi chép đúng quy định không? |
Có □ Không □ |
Có □ Không □ |
|
Lô vắc xin này có được quản lý đúng quy định trong sổ không? |
Có □ Không □ |
Có □ Không □ |
|
Có phiếu xuất, nhập kho không? |
Có □ Không □ |
Có □ Không □ |
|
Phiếu có ghi chép đúng quy định không? |
Có □ Không □ |
Có □ Không □ |
|
Nhân viên quản lý kho vắc xin tại tuyến tỉnh đã được tập huấn về bảo quản vắc xin không ? |
Có □ Không □ |
Có □ Không □ |
|
Kiểm tra kiến thức về bảo quản vắc xin của nhân viên quản lý kho có đạt yêu cầu không? |
Có □ Không □ |
Có □ Không □ |
9.2. Tình hình sử dụng lô vắc xin và tai biến nặng sau tiêm chủng tuyến tỉnh, huyện
|
Thông tin điều tra |
Tuyến tỉnh |
Tuyến huyện |
|
Số đối tượng tiêm chủng cùng loại vắc xin |
|
|
|
Số đối tượng tiêm chủng cùng lô vắc xin |
|
|
|
Số trường hợp phản ứng sau tiêm chủng lô vắc xin này |
|
|
|
Số trường hợp phản ứng sau tiêm chủng khác |
|
|
10. Các hoạt động đã triển khai
a/ Tuyến xã......................................................................................................
b/ Tuyến tỉnh, huyện ........................................................................................
Có lấy mẫu vắc xin gửi kiểm định không? Có □ Không □
Số lượng mẫu: ……………….Tuyến được lấy mẫu: ...........................................
Ngày gửi mẫu …../……/……. Kết quả kiểm định (nếu có) ..................................
11. Nhận định và đánh giá sơ bộ
• Nguồn gốc vắc xin liên quan (vd: là vắc xin thuộc TCMR, được cấp theo hệ thống của TCMR)
• Quá trình vận chuyển, bảo quản vắc xin đúng quy định không? Có □ Không □
• Qui trình thực hành tiêm chủng có bảo đảm an toàn không? Có □ Không □
• Nhận định ban đầu về nguyên nhân của trường hợp tai biến sau tiêm chủng:
.......................................................................................................................
12. Đề xuất, khuyến nghị
.......................................................................................................................
Ghi chú
(*): Điền mã số trường hợp tai biến nặng sau tiêm bao gồm chữ viết tắt của Việt Nam tỉnh, huyện và điểm tiêm chủng cuối cùng là số trường hợp tai biến tại điểm tiêm chủng đó được viết dưới dạng số ví dụ trường hợp thứ nhất tai biến nặng sau tiêm chủng tại xã A huyện B, tỉnh C: mã số được viết như sau: VNCBA01;
|
|
Ngày………tháng……..năm 20………. |
PHỤ LỤC V
QUY TRÌNH LẤY MẪU VẮC XIN
(Ban hành kèm theo Thông tư số 34/2018/TT-BYT ngày 16/11/2018 của Bộ trưởng Bộ Y tế)
1. Lấy mẫu vắc xin đối với tất cả các trường hợp tai biến nặng sau tiêm chủng.
2. Cách lấy mẫu:
a) Lấy đúng lọ vắc xin liên quan tới tai biến nặng sau tiêm chủng, nếu đã dùng hết thì lấy đúng vỏ lọ đã dùng tiêm chủng, trường hợp không xác định được đúng vỏ lọ thì không lấy.
b) Lấy thêm vắc xin cùng loại, cùng số lô, hạn sử dụng, cùng địa điểm xảy ra tai biến nặng sau tiêm chủng với số lọ đủ để kiểm tra an toàn, tối thiểu là 15 ml hoặc theo hướng dẫn của Viện Kiểm định quốc gia vắc xin và sinh phẩm y tế. Trường hợp tại điểm tiêm chủng xảy ra tai biến nặng sau tiêm chủng đã sử dụng hết loại vắc xin liên quan đến tai biến nặng sau tiêm chủng thì lấy vắc xin này cùng số lô, hạn sử dụng ở địa điểm khác cho đủ số lượng nêu trên;
c) Vắc xin đông khô cần lấy thêm dung môi, cách lấy như lấy mẫu vắc xin;
d) Quá trình lấy mẫu vắc xin phải được ghi thành biên bản trong đó nêu rõ số lượng, chủng loại và điều kiện bảo quản lúc lấy mẫu, nhân viên tham gia lấy mẫu phải có ít nhất 02 nhân viên;
đ) Niêm phong mẫu vắc xin đã lấy, ghi rõ ngày, tháng, địa điểm lấy mẫu, người lấy, số lượng. Mẫu vắc xin phải được bảo quản theo quy định của Bộ Y tế.
3. Gửi mẫu vắc xin để kiểm định
a) Gửi mẫu vắc xin để kiểm định theo quy định tại điểm c khoản 3 Điều 15 của Thông tư này.
b) Khi gửi mẫu vắc xin để kiểm định phải kèm theo phiếu điều tra tai biến nặng sau tiêm chủng, phiếu lấy và gửi mẫu kiểm định vắc xin và biên bản lấy mẫu;
4. Đối với mẫu vắc xin không thuộc diện phải gửi kiểm định, nếu còn hạn sử dụng và được bảo quản đúng quy định, Trung tâm Kiểm soát bệnh tật phân phối cho các cơ sở tiêm chủng tại địa phương để sử dụng sau khi có kết luận của Hội đồng tư vấn chuyên môn đánh giá nguyên nhân tai biến sau tiêm chủng cấp tỉnh.
PHỤ LỤC VI
ĐÁNH GIÁ NGUYÊN NHÂN TAI BIẾN NẶNG SAU TIÊM CHỦNG
(Ban hành kèm theo Thông tư số 34/2018/TT-BYT ngày 16/11/2018 của Bộ trưởng Bộ Y tế)
|
I. Có bằng chứng chắc chắn về mối liên quan với nguyên nhân khác không? |
|||||
|
|
Y |
N |
UK |
NA |
|
|
Kết quả xét nghiệm hoặc kiểm tra lâm sàng có mối liên quan với nguyên nhân khác không? |
□ |
□ |
□ |
□ |
|
|
II. Có mối liên quan nào đã được biết tới trước đó với vắc xin/tiêm chủng? |
|||||
|
Vắc xin |
|||||
|
Có bằng chứng nào về loại vắc xin được bảo quản đúng quy định này có liên quan đến các trường hợp tai biến được báo cáo? |
□ |
□ |
□ |
□ |
|
|
Có bằng chứng cụ thể nào chứng minh nguyên nhân là do vắc xin hoặc thành phần của vắc xin? |
□ |
□ |
□ |
□ |
|
|
Lỗi tiêm chủng |
|||||
|
Sai sót trong chỉ định tiêm chủng hoặc không tuân thủ các khuyến cáo sử dụng (sử dụng vắc xin đã quá hạn, chỉ định sai,...)? |
□ |
□ |
□ |
□ |
|
|
Vắc xin hoặc các thành phần của vắc xin được bảo quản riêng biệt? |
□ |
□ |
□ |
□ |
|
|
Vắc xin có thay đổi tính chất vật lý (màu, kết tủa,...)? |
□ |
□ |
□ |
□ |
|
|
Sai sót trong quá trình chuẩn bị (sai loại, không đúng nước pha hồi chỉnh,....)? |
□ |
□ |
□ |
□ |
|
|
Sai sót trong bảo quản, vận chuyển và sử dụng vắc xin? (hỏng, vỡ dây chuyền lạnh trong quá trình vận chuyển, bảo quản,...)? |
□ |
□ |
□ |
□ |
|
|
Sai sót khi tiêm (sai liều, vị trí và đường tiêm, sai kích cỡ bơm kim tiêm,...)? |
□ |
□ |
□ |
□ |
|
|
Lo lắng do tiêm chủng |
|||||
|
Các tai biến do sự lo lắng về tiêm chủng (ngất, thở nhanh hoặc liên quan đến stress)? |
□ |
□ |
□ |
□ |
|
|
II (Thời gian) Nếu trả lời có, tai biến có xảy ra trong khoảng thời gian hợp lý không? |
|||||
|
Tai biến xảy ra trong khoảng thời gian hợp lý sau tiêm chủng ? |
□ |
□ |
□ |
□ |
|
|
III. Có bằng chứng rõ ràng xác định không có mối liên quan tới tiêm chủng không? |
|||||
|
Có bằng chứng rõ ràng xác định không có mối liên quan tới tiêm chủng không? |
□ |
□ |
□ |
□ |
|
|
IV. Các yếu tố chất lượng khác để phân loại |
|||||
|
Tai biến có thể không liên quan đến vắc xin. |
□ |
□ |
□ |
□ |
|
|
Tai biến có liên quan đến điều kiện sức khỏe nào khác không? |
□ |
□ |
□ |
□ |
|
|
So sánh với tiền sử tai biến với các loại vắc xin tương tự đã sử dụng? |
□ |
□ |
□ |
□ |
|
|
Có tiền sử phơi nhiễm với những yếu tố nguy cơ tiềm ẩn/độc hại trước tai biến không? |
□ |
□ |
□ |
□ |
|
|
Có bị ốm trước khi tai biến không ? |
□ |
□ |
□ |
□ |
|
|
Những tai biến trước đây không liên quan đến vắc xin phải không ? |
□ |
□ |
□ |
□ |
|
|
Đối tượng tiêm chủng có đang dùng thuốc hoặc điều trị gì trước khi tiêm vắc xin hay không ? |
□ |
□ |
□ |
□ |
|
|
Có bằng chứng sinh học nào chứng minh vắc xin gây ra tai biến sau tiêm chủng |
□ |
□ |
□ |
□ |
|
Ghi chú: Y: Có; N: Không; UK: Không biết; NA: Không có thông tin.
PHỤ LỤC VII
SƠ ĐỒ PHÂN LOẠI NGUYÊN NHÂN TAI BIẾN SAU TIÊM CHỦNG
(Ban hành kèm theo Thông tư số 34/2018/TT-BYT ngày 16/11/2018 của Bộ trưởng Bộ Y tế)
1. Phân loại các trường hợp dựa vào những thông tin
- Các trường hợp có đầy đủ thông tin để kết luận nguyên nhân có thể được phân loại như sau:
A. Có liên quan tới tiêm chủng
A1: Liên quan tới đặc tính cố hữu của vắc xin
A2: Liên quan tới việc vắc xin không đạt chất lượng
A3: Liên quan tới thực hành tiêm chủng
A4: Liên quan tới những lo sợ do bị tiêm chủng.
B. Chưa xác định
B1: Có mối liên quan tạm thời tới tiêm chủng nhưng chưa có đủ bằng chứng để kết luận (có thể do vắc xin mới), phải tiến hành điều tra thêm.
B2: Không xác định được nguyên nhân.
C. Không liên quan tới tiêm chủng do trùng hợp ngẫu nhiên hoặc do nguyên nhân khác.
- Các trường hợp không có đủ thông tin để kết luận nguyên nhân được coi là “không phân loại được” và cần phải thu thập thêm thông tin để đánh giá nguyên nhân. Trường hợp không thể thu thập thêm thông tin thì kết luận trên cơ sở các thông tin đã có.
2. Thực hiện phân loại theo sơ đồ
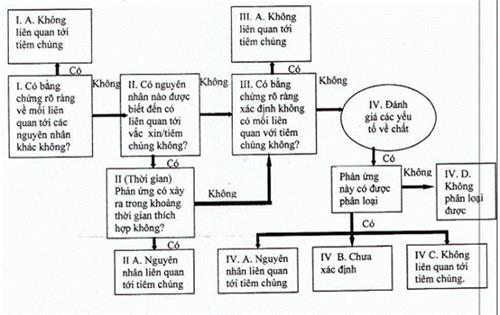
PHỤ LỤC VIII
MẪU BÁO CÁO TÌNH HÌNH SỬ DỤNG VẮC XIN
(Ban hành kèm theo Thông tư số 34/2018/TT-BYT ngày 16/11/2018 của Bộ trưởng Bộ Y tế)
Mẫu số 1
Mẫu báo cáo tình hình sử dụng vắc xin trong Chương trình tiêm chủng mở rộng
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM
Độc lập - Tự do - Hạnh phúc
---------------
…..1….., ngày....tháng... năm 20…….
BÁO CÁO TÌNH HÌNH SỬ DỤNG VẮC XIN TRONG CHƯƠNG TRÌNH TIÊM CHỦNG MỞ RỘNG
Từ ngày…….tháng……đến ngày……tháng…….năm……
|
TT |
Loại vắc xin |
Tên vắc xin |
Tên nhà sản xuất |
Số lô |
Hạn sử dụng |
Tên nhà cung cấp |
Số tồn tháng trước |
Số nhập |
Số tiêm |
Số hủy |
Số sử dụng 2 |
Số hiện còn |
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Người làm báo cáo |
Thủ trưởng đơn vị |
__________
1 Địa danh
2 Bao gồm cả số tiêm và số hủy
PHỤ LỤC VIII
MẪU BÁO CÁO TÌNH HÌNH SỬ DỤNG VẮC XIN
(Ban hành kèm theo Thông tư số 34/2018/TT-BYT ngày 16/11/2018 của Bộ trưởng Bộ Y tế)
Mẫu số 2
Mẫu báo cáo tình hình sử dụng vắc xin tiêm chủng dịch vụ
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM
Độc lập - Tự do - Hạnh phúc
---------------
…..1….., ngày....tháng... năm 20…….
BÁO CÁO TÌNH HÌNH SỬ DỤNG VẮC XIN TIÊM CHỦNG DỊCH VỤ
Từ ngày…..tháng…..đến ngày……tháng……năm…….
|
TT |
Loại vắc xin |
Tên vắc xin |
Tên nhà sản xuất |
Số lô |
Số đăng ký lưu hành/ Số giấy phép nhập khẩu |
Hạn sử dụng |
Tên nhà cung cấp |
Số tồn tháng trước |
Số nhập |
Số tiêm |
Số hủy |
Số sử dụng 2 |
Số hiện còn |
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Người báo cáo |
Thủ trưởng đơn vị |
_______________
1: Địa danh
2: Bao gồm cả số tiêm và số hủy
PHỤ LỤC IX
MẪU BÁO CÁO KẾT QUẢ TIÊM CHỦNG
(Ban hành kèm theo Thông tư số 34/2018/TT-BYT ngày 16/11/2018 của Bộ trưởng Bộ Y tế)
Mẫu số 1
Mẫu báo cáo kết quả tiêm chủng trong tiêm chủng mở rộng
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM
Độc lập - Tự do - Hạnh phúc
---------------
…..1….., ngày....tháng... năm 20….
BÁO CÁO KẾT QUẢ TIÊM CHỦNG
Từ ngày....tháng…… đến ngày....tháng…… năm……..
|
TT |
Địa phương |
Số trẻ < 1=""> |
Miễn dịch cơ bản |
Trẻ được bảo vệ phòng UVSS* |
|||||||||
|
BCG |
Viêm gan B ≤ 24 giờ |
DPT-VGB-Hib |
bOPV |
IPV |
Sởi |
||||||||
|
|
1 |
2 |
3 |
1 |
2 |
3 |
|
|
|
||||
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cộng trong tháng |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cộng dồn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
*: Số trẻ được bảo vệ phòng UVSS là số trẻ có mẹ đã tiêm 2 mũi vắc xin phòng uốn ván khi mang thai hoặc 3 mũi vắc xin phòng uốn ván trở lên trong quá khứ |
|||||||||||||
|
Người làm báo cáo |
Thủ trưởng đơn vị |
_____________
1 Địa danh
PHỤ LỤC IX
MẪU BÁO CÁO KẾT QUẢ TIÊM CHỦNG
(Ban hành kèm theo Thông tư số 34/2018/TT-BYT ngày 16/11/2018 của Bộ trưởng Bộ Y tế)
Mẫu số 2
Mẫu báo cáo kết quả tiêm chủng trong tiêm chủng mở rộng
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM
Độc lập - Tự do - Hạnh phúc
---------------
…..1….., ngày....tháng... năm 20…….
BÁO CÁO KẾT QUẢ TIÊM CHỦNG
Từ ngày....tháng……. đến ngày....tháng …….năm………..
|
TT |
Địa phương |
Vắc xin Sởi-Rubella và DPT |
Vắc xin Viêm não Nhật Bản |
||||||
|
Trẻ 18 tháng |
Sởi-Rubella |
DPT |
Tiêm mũi 1 và 2 |
Tiêm mũi 3 |
|||||
|
Số đối tượng |
Mũi 1 |
Mũi 2 |
Số đối tượng |
Mũi 3 |
|||||
|
1 |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
Cộng trong tháng |
|
|
|
|
|
|
|
|
|
|
Cộng dồn |
|
|
|
|
|
|
|
|
|
|
Người làm báo cáo |
Thủ trưởng đơn vị |
_______________
1 Địa danh
PHỤ LỤC IX
MẪU BÁO CÁO KẾT QUẢ TIÊM CHỦNG
(Ban hành kèm theo Thông tư số 34/2018/TT-BYT ngày 16/11/2018 của Bộ trưởng Bộ Y tế)
Mẫu số 3
Mẫu báo cáo kết quả tiêm chủng cho phụ nữ có thai trong tiêm chủng mở rộng
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM
Độc lập - Tự do - Hạnh phúc
---------------
…..1….., ngày....tháng... năm 20…….
BÁO CÁO KẾT QUẢ TIÊM CHỦNG
Từ ngày.....tháng…. đến ngày......tháng…….. năm ……..
|
TT |
Địa phương |
Phụ nữ có thai |
Số chết sơ sinh |
Số UVSS |
||||||||
|
Số đối tượng |
UV1 |
UV2 |
UV3 |
UV4 |
UV5 |
Tổng số |
Điều tra |
Mắc |
Điều tra |
Chết |
||
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Cộng trong tháng |
|
|
|
|
|
|
|
|
|
|
|
|
|
Cộng dồn |
|
|
|
|
|
|
|
|
|
|
|
|
|
Người làm báo cáo |
Thủ trưởng đơn vị |
________________
1 Địa danh
PHỤ LỤC X
MẪU BÁO CÁO CÁC TRƯỜNG HỢP PHẢN ỨNG THÔNG THƯỜNG SAU TIÊM CHỦNG
(Ban hành kèm theo Thông tư số 34/2018/TT-BYT ngày 16/11/2018 của Bộ trưởng Bộ Y tế)
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM
Độc lập - Tự do - Hạnh phúc
---------------
…..1….., ngày....tháng... năm 20….
BÁO CÁO CÁC TRƯỜNG HỢP PHẢN ỨNG THÔNG THƯỜNG SAU TIÊM CHỦNG
Từ ngày…..tháng……. đến ngày.......tháng……. năm ……..
|
STT |
Thông tin về vắc xin |
Số trường hợp phản ứng thông thường sau tiêm chủng |
Ghi chú |
|||||||
|
Loại vắc xin sử dụng |
Tên vắc xin |
Tên nhà sản xuất |
Số đăng ký lưu hành/ Số giấy phép nhập khẩu |
Số lô |
Hạn sử dụng |
Sốt ≤39 °C |
Sưng, đau tại chỗ tiêm |
Các triệu chứng khác |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
Người làm báo cáo |
Thủ trưởng đơn vị |
_____________
1 Địa danh
PHỤ LỤC XI
MẪU BÁO CÁO CÁC TRƯỜNG HỢP TAI BIẾN NẶNG SAU TIÊM CHỦNG
(Ban hành kèm theo Thông tư số 34/2018/TT-BYT ngày 16/11/2018 của Bộ trưởng Bộ Y tế)
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM
Độc lập - Tự do - Hạnh phúc
---------------
…..1….., ngày....tháng... năm 20…….
BÁO CÁO CÁC TRƯỜNG HỢP TAI BIẾN NẶNG SAU TIÊM CHỦNG
Từ ngày......tháng….. đến ngày....tháng….. năm…….
|
STT |
Thông tin về bệnh nhân |
Thông tin về vắc xin |
Thông tin về tiêm chủng |
Kết luận nguyên nhân |
Ghi chú |
||||||||||||||
|
Họ tên |
Giới |
Ngày sinh |
Địa chỉ |
Tên vắc xin |
Tên nhà sản xuất |
Số đăng ký lưu hành/Số giấy phép nhập khẩu |
Số lô |
Hạn sử dụng |
Nhà cung cấp |
Cơ sở tiêm chủng |
Ngày tiêm |
Vị trí tiêm |
Triệu chứng |
Xử trí |
Kết quả 3 |
||||
|
Nam |
Nữ |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Người làm báo cáo |
Thủ trưởng đơn vị |
__________
1 Địa danh
2 Kết quả:
- Tử vong
- Nhập viện, điều trị lâu dài ở bệnh viện
- Tàn tật, di chứng
- Đe dọa đến tính mạng
PHỤ LỤC XII
MẪU BÁO CÁO TAI BIẾN NẶNG SAU TIÊM CHỦNG
(Ban hành kèm theo Thông tư số 34/2018/TT-BYT ngày 16/11/2018 của Bộ trưởng Bộ Y tế)
Mã số trường hợp tai biến nặng sau tiêm chủng………….
Ngày tháng năm nhận được báo cáo: ----/----/-----
Nơi báo cáo trường hợp phản ứng: .................................................................
1. Thông tin chung
|
Họ và tên: ……………………….Ngày tháng năm sinh: ----/----/------- Giới: Nam □ Nữ □ Dân tộc: ........................................................................... Họ và tên mẹ/cha (khi đối tượng tiêm chủng là trẻ em): ………..Điện thoại................................ Địa chỉ: Thôn/ấp: ……………………………………….Xã: ........................................................... Huyện: ………………………………….Tỉnh: .............................................................................. Cơ sở tiêm chủng: ................................................................................................................ Tiêm chủng mở rộng □ Tiêm chủng dịch vụ □ Tại trạm y tế □ Tại bệnh viện/phòng khám □ Ngoài trạm □ khác □ |
|
Người báo cáo: .................................................................................................................... Đơn vị: ................................................................................................................................. Địa chỉ: ................................................................................................................................. Điện thoại & email: ................................................................................................................ |
2. Thông tin về lần tiêm chủng có tai biến
|
Loại vắc xin |
Liều thứ mấy |
Đường tiêm |
Vị trí tiêm |
Người tiêm |
Ngày, giờ tiêm chủng |
Ngày, giờ bắt đầu xảy ra phản ứng |
3. Thông tin về loại vắc xin, dung môi trong lần tiêm chủng có tai biến
|
Loại vắc xin, dung môi |
Tên vắc xin, dung môi |
Nhà sản xuất |
Đơn vị cung cấp |
Số lô |
Hạn sử dụng |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4. Mô tả phản ứng
|
Sốt cao ≥39°C |
□ |
Bệnh não trong vòng 7 ngày |
□ |
|
Sưng, nóng, đỏ tại vị trí tiêm |
□ |
Những cơn co giật trong vòng 3 ngày |
□ |
|
Áp xe tại chỗ tiêm |
□ |
Sốc trong vòng 72 giờ |
□ |
Khác □ ghi rõ...................................................................................................
.......................................................................................................................
5. Tiền sử về bệnh tật (kể cả tiền sử về phản ứng tương tự hay dị ứng)
.......................................................................................................................
.......................................................................................................................
.......................................................................................................................
.......................................................................................................................
.......................................................................................................................
6. Xử trí phản ứng sau tiêm chủng
|
Có |
□ |
Không |
□ |
|
Nơi xử trí |
|
|
|
|
Tại nhà |
□ |
Trạm Y tế |
□ |
|
Bệnh viện nhà nước |
□ |
Khác |
□ |
|
Y tế tư nhân |
□ |
|
|
Họ và tên người xử trí .....................................................................................
7. Tình trạng hiện tại
Khỏi □
Di chứng □
Tử vong □ Ngày tử vong ------/------/---------
Khác (ghi rõ) □ .........................................................................................................
|
|
……, Ngày…… tháng…… năm 20…….. |
PHỤ LỤC IV
PHIẾU ĐIỀU TRA TAI BIẾN NẶNG SAU TIÊM CHỦNG
(Ban hành kèm theo Thông tư số 34/2018/TT-BYT ngày 16/11/2018 của Bộ trưởng Bộ Y tế)
Mã số trường hợp tai biến nặng sau tiêm chủng (*)……
Ngày tháng năm nhận được báo cáo: ---/---/----- Ngày điều tra: ---/---/-----
Nơi báo cáo trường hợp phản ứng:..................................................................
Thành phần đoàn điều tra (họ và tên, đơn vị công tác)
1. ...................................................................................................................
2. ...................................................................................................................
3. ...................................................................................................................
4. ...................................................................................................................
5. ...................................................................................................................
1. Thông tin chung
|
Họ và tên: ……………………………….. Giới: ……….Dân tộc ................... Ngày tháng năm sinh : …./…. /……. (…….tháng tuổi, nếu trẻ sơ sinh …….ngày tuổi) Con thứ mấy trong gia đình: .................................................................................................. Họ và tên mẹ (cha): ………………………………Số điện thoại: .................................................. Địa chỉ: Thôn/ấp: …………………………….Xã: ........................................................................ Huyện: …………………………………….Tỉnh: ........................................................................... Cơ sở tiêm chủng: ................................................................................................................ Tiêm chủng mở rộng □ Tiêm chủng dịch vụ □ Tiêm chủng thường xuyên □ Tiêm chủng chiến dịch □ Tại trạm y tế □ Tại bệnh viện/phòng khám □ Ngoài trạm □ Khác □ |
2. Thông tin về tiêm chủng trong lần này
|
Vắc xin |
Liều thứ mấy |
Đường tiêm |
Vị trí tiêm |
Người tiêm |
Giờ, ngày tiêm chủng |
Giờ, ngày bắt đầu xảy ra phản ứng |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. Thông tin về loại vắc xin, dung môi tiêm chủng trong lần này.
|
Loại vắc xin, dung môi |
Tên vắc xin, dung môi |
Nhà sản xuất |
Đơn vị cung cấp |
Số lô |
Hạn sử dụng |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4. Diễn biến tai biến nặng sau tiêm chủng
4.1 Triệu chứng và dấu hiệu lâm sàng
a/ Thông tin từ cha, mẹ hoặc người trực tiếp chăm sóc trẻ và hồ sơ người nhà giữ (Mô tả thời gian xuất hiện, triệu chứng đầu tiên của tai biến, diễn biến triệu chứng từ sau khi tiêm chủng)
.......................................................................................................................
.......................................................................................................................
.......................................................................................................................
b/ Thông tin từ nhân viên y tế và từ hồ sơ bệnh án tại cơ sở y tế (Mô tả thời gian đến cơ sở y tế, tình trạng ban đầu, diễn biến triệu chứng theo trình tự thời gian)
.......................................................................................................................
.......................................................................................................................
4.2 Kết quả xét nghiệm cận lâm sàng (máu/nước tiểu/dịch não tủy...tại các cơ sở y tế nơi trẻ được điều trị)
.......................................................................................................................
4.3 Quá trình chẩn đoán, điều trị và chẩn đoán cuối cùng của cơ sở y tế điều trị
.......................................................................................................................
.......................................................................................................................
4.4 Trường hợp tử vong
a/ Mô tả tình trạng khi phát hiện tử vong (tư thế, vị trí, chất tiết...)
.......................................................................................................................
.......................................................................................................................
b/ Kết quả giám định pháp y (thu thập kết quả giám định bằng văn bản nếu có)
Cơ quan giám định: .........................................................................................
Kết quả giám định: ..........................................................................................
6. Tình trạng tại thời điểm điều tra
□ Đang điều trị
□ Khỏi Sau tiêm chủng bao lâu:…………
□ Tử vong Sau tiêm chủng bao lâu………….
□ Di chứng (ghi rõ)…….Sau tiêm chủng bao lâu………….
7. Tiền sử
a/ Tiền sử sản khoa
- Tiền sử mẹ khi mang thai: ..............................................................................
.......................................................................................................................
- Số tuần thai khi sinh: …………………..Cân nặng khi sinh: ................................
- Các vấn đề sức khỏe của trẻ khi sinh: ............................................................
- Chỉ số APGAR (đối với trẻ sơ sinh): ...............................................................
b/ Tiền sử bệnh tật của trẻ từ khi sinh đến khi được tiêm chủng lần này
.......................................................................................................................
c/ Tiền sử tiêm chủng và phản ứng sau các lần tiêm chủng trước (loại vắc xin thời gian tiêm, nêu rõ phản ứng sau tiêm chủng nếu có).
.......................................................................................................................
d/ Tiền sử dùng thuốc ngay trước khi tiêm chủng lần này (trong vòng 1 tuần trước khi tiêm chủng)
.......................................................................................................................
e/ Trước, trong và sau tiêm chủng lần này trẻ ăn, uống hay bú mẹ có gì bất thường không? có té, ngã không?
.......................................................................................................................
f/ Tiền sử gia đình (dị ứng hoặc phản ứng với vắc xin ...nếu có)
.......................................................................................................................
Điều tra thực hiện quy trình tiêm chủng tại cơ sở tiêm chủng
|
a/ Điều kiện bảo quản vắc xin, dung môi (Nhận vắc xin từ đâu, thời gian nào, phương tiện nhận vắc xin, bảo quản vắc xin tại xã, có thiết bị theo dõi nhiệt độ bảo quản vắc xin? Kiểm tra nhiệt độ bảo quản vắc xin hiện tại, biểu đồ theo dõi nhiệt độ (nếu bảo quản vắc xin bằng tủ lạnh) ............................................................................................................................................. ............................................................................................................................................. b/ Cách tổ chức buổi tiêm chủng (Số đối tượng trong 1 buổi tiêm ? Số nhân viên tham gia tiêm chủng ? Có khám phân loại, tư vấn trước và theo dõi sau tiêm chủng?) ............................................................................................................................................. ............................................................................................................................................. c/ Thực hành tiêm chủng (Nhân viên trực tiếp tiêm chủng được tập huấn không? Kiểm tra kiến thức về thực hành khám chỉ định và chống chỉ định, bảo quản vắc xin, chuẩn bị vắc xin, pha hồi chỉnh (kỹ thuật pha, thời gian sử dụng), sử dụng BKT, kỹ thuật tiêm chủng, hủy vắc xin, BKT sau buổi tiêm chủng) ............................................................................................................................................. ............................................................................................................................................. d/ Ghi chép và quản lý sổ sách (Kiểm tra sổ quản lý vắc xin, sổ quản lý tiêm chủng, sổ theo dõi phản ứng bất thường sau tiêm chủng) ............................................................................................................................................. ............................................................................................................................................. e/ Tình hình tiêm chủng • Số đối tượng cùng tiêm trong buổi tiêm chủng của từng loại vắc xin ............................................................................................................................................. ............................................................................................................................................. • Số trẻ tiêm chủng cùng loại vắc xin: ………cùng lô vắc xin: ……..cùng lọ vắc xin (nếu lọ nhiều liều): …………với trường hợp tai biến sau tiêm chủng. • Số trường hợp tai biến nặng sau tiêm chủng tại cơ sở tiêm chủng trong thời gian gần đây ……………… • Tình hình bệnh tật, tử vong tại địa bàn trong thời gian gần đây có gì đặc biệt ............................................................................................................................................. ............................................................................................................................................. |
8. Điều tra tại cộng đồng (kết hợp hỏi nhân viên y tế và thăm hộ gia đình)
• Tổng số đối tượng được điều tra: ………………
• Số đối tượng có phản ứng với cùng loại vắc xin: …………….
• Các vấn đề khác: ..........................................................................................
9. Tình hình tiếp nhận, bảo quản, phân phối và sử dụng lô vắc xin có trường hợp tai biến nặng sau tiêm chủng tại tuyến tỉnh, huyện
9.1. Tình hình tiếp nhận, bảo quản, phân phối lô vắc xin tại tuyến tỉnh, huyện
|
Thông tin điều tra |
Tuyến tỉnh |
Tuyến huyện |
|
Nguồn gốc lô vắc xin |
|
|
|
Thời gian tiếp nhận |
|
|
|
Số lượng nhận |
|
|
|
Phương tiện vận chuyển |
|
|
|
Số lượng đã cấp cho tuyến dưới |
|
|
|
Số lượng còn tồn tại kho đơn vị |
|
|
|
Phương tiện bảo quản lô vắc xin này |
|
|
|
Nhiệt độ bảo quản lúc kiểm tra |
|
|
|
Chỉ thị đông băng điện tử lúc kiểm tra |
|
|
|
Chỉ thị nhiệt độ lọ vắc xin lúc kiểm tra (nếu có) |
|
|
|
Có bảng theo dõi nhiệt độ hằng ngày |
Có □ Không □ |
Có □ Không □ |
|
Nhiệt độ có trong giới hạn cho phép không? |
Có □ Không □ |
Có □ Không □ |
|
Có sự cố dây chuyền lạnh trong thời gian bảo quản lô vắc xin này không? |
Có □ Không □ |
Có □ Không □ |
|
Có sổ quản lý vắc xin, BKT, HAT |
Có □ Không □ |
Có □ Không □ |
|
Sổ ghi chép đúng quy định không? |
Có □ Không □ |
Có □ Không □ |
|
Lô vắc xin này có được quản lý đúng quy định trong sổ không? |
Có □ Không □ |
Có □ Không □ |
|
Có phiếu xuất, nhập kho không? |
Có □ Không □ |
Có □ Không □ |
|
Phiếu có ghi chép đúng quy định không? |
Có □ Không □ |
Có □ Không □ |
|
Nhân viên quản lý kho vắc xin tại tuyến tỉnh đã được tập huấn về bảo quản vắc xin không ? |
Có □ Không □ |
Có □ Không □ |
|
Kiểm tra kiến thức về bảo quản vắc xin của nhân viên quản lý kho có đạt yêu cầu không? |
Có □ Không □ |
Có □ Không □ |
9.2. Tình hình sử dụng lô vắc xin và tai biến nặng sau tiêm chủng tuyến tỉnh, huyện
|
Thông tin điều tra |
Tuyến tỉnh |
Tuyến huyện |
|
Số đối tượng tiêm chủng cùng loại vắc xin |
|
|
|
Số đối tượng tiêm chủng cùng lô vắc xin |
|
|
|
Số trường hợp phản ứng sau tiêm chủng lô vắc xin này |
|
|
|
Số trường hợp phản ứng sau tiêm chủng khác |
|
|
10. Các hoạt động đã triển khai
a/ Tuyến xã......................................................................................................
b/ Tuyến tỉnh, huyện ........................................................................................
Có lấy mẫu vắc xin gửi kiểm định không? Có □ Không □
Số lượng mẫu: ……………….Tuyến được lấy mẫu: ...........................................
Ngày gửi mẫu …../……/……. Kết quả kiểm định (nếu có) ..................................
11. Nhận định và đánh giá sơ bộ
• Nguồn gốc vắc xin liên quan (vd: là vắc xin thuộc TCMR, được cấp theo hệ thống của TCMR)
• Quá trình vận chuyển, bảo quản vắc xin đúng quy định không? Có □ Không □
• Qui trình thực hành tiêm chủng có bảo đảm an toàn không? Có □ Không □
• Nhận định ban đầu về nguyên nhân của trường hợp tai biến sau tiêm chủng:
.......................................................................................................................
12. Đề xuất, khuyến nghị
.......................................................................................................................
Ghi chú
(*): Điền mã số trường hợp tai biến nặng sau tiêm bao gồm chữ viết tắt của Việt Nam tỉnh, huyện và điểm tiêm chủng cuối cùng là số trường hợp tai biến tại điểm tiêm chủng đó được viết dưới dạng số ví dụ trường hợp thứ nhất tai biến nặng sau tiêm chủng tại xã A huyện B, tỉnh C: mã số được viết như sau: VNCBA01;
|
|
Ngày………tháng……..năm 20………. |
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Thông tư 34/2018/TT-BYT PDF (Bản có dấu đỏ)
Thông tư 34/2018/TT-BYT PDF (Bản có dấu đỏ) Thông tư 34/2018/TT-BYT DOC (Bản Word)
Thông tư 34/2018/TT-BYT DOC (Bản Word)