- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn TCVN 8400-13:2019 Quy trình chuẩn đoán bệnh sảy thai truyền nhiễm do Brucella
| Số hiệu: | TCVN 8400-13:2019 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
15/11/2019 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 8400-13:2019
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 8400-13:2019
TIÊU CHUẨN QUỐC GIA
TCVN 8400-13 : 2019
BỆNH ĐỘNG VẬT - QUY TRÌNH CHẨN ĐOÁN - PHẦN 13: BỆNH SẢY THAI TRUYỀN NHIỄM DO BRUCELLA
Animal diseases - Diagnostic procedure - Part 13: Brucellosis
Lời nói đầu
TCVN 8400-13:2019 được thay thế cho TCVN 8400-13 : 2011.
TCVN 8400-13:2019 do Cục Thú y biên soạn trên cơ sở tham khảo tài liệu của Tổ chức Thú y thế giới (OIE) và các bài báo khoa học quốc tế, Bộ Nông nghiệp và Phát triển nông thông đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Bộ tiêu chuẩn TCVN 8400 Bệnh động vật - Quy trình chẩn đoán gồm 47 phần:
- TCVN 8400-1 : 2019, phần 1: Bệnh lở mồm long móng;
- TCVN 8400-2 : 2010, phần 2: Bệnh do vi khuẩn Streptococcus suis gây ra trên lợn;
- TCVN 8400-3 : 2010, phần 3: Bệnh giun xoắn;
- TCVN 8400-4 : 2010, phần 4: Bệnh Niu CátXơn;
- TCVN 8400-5 : 2011, phần 5: Bệnh tiên mao trùng;
- TCVN 8400-6 : 2011, phần 6: Bệnh xuất huyết thỏ;
- TCVN 8400-7 : 2011, phần 7: Bệnh đậu cừu và đậu dê;
- TCVN 8400-8 : 2011, phần 8: Bệnh nấm phổi do Aspergillus ở gia cầm;
- TCVN 8400-9 : 2011, phần 9: Bệnh viêm gan vịt typ I;
- TCVN 8400-10 : 2011, phần 10: Bệnh lao bò;
- TCVN 8400-11 : 2019, phần 11: Bệnh dịch tả vịt;
- TCVN 8400-12 : 2011, phần 12: Bệnh bạch lỵ và thương hàn ở gà;
- TCVN 8400-13 : 2019, phần 13: Bệnh sảy thai truyền nhiễm do Brucella;
- TCVN 8400-14 : 2011, phần 14: Bệnh tụ huyết trùng ở trâu bò;
- TCVN 8400-15 : 2019, phần 15: Bệnh xoắn khuẩn do Leptospira;
- TCVN 8400-16 : 2011, phần 16: Bệnh phù ở lợn do vi khuẩn E.coli;
- TCVN 8400-17 : 2011, phần 17: Bệnh do Staphylococcus aureus ở gà;
- TCVN 8400-18 : 2014, phần 18: Bệnh phù đầu gà (coryza);
- TCVN 8400-19 : 2014, phần 19: Bệnh phó thương hàn lợn;
- TCVN 8400-20 : 2014, phần 20: Bệnh đóng dấu lợn;
- TCVN 8400-21 : 2014, phần 21: Hội chứng rối loạn sinh sản và hô hấp ở lợn (PRRS);
- TCVN 8400-22 : 2014, phần 22: Bệnh giả dại ở lợn;
- TCVN 8400-23 : 2014, phần 23: Bệnh ung khí thán;
- TCVN 8400-24 : 2014, phần 24: Bệnh viêm phế quản truyền nhiễm;
- TCVN 8400-25 : 2014, phần 25: Bệnh cúm lợn;
- TCVN 8400-26 : 2014, phần 26: Bệnh cúm gia cầm H5N1;
- TCVN 8400-27 : 2014, phần 27: Bệnh sán lá gan;
- TCVN 8400-28 : 2014, phần 28: Bệnh viêm ruột hoại tử do Clostridium perfringens;
- TCVN 8400-29 : 2015, phần 29: Bệnh Lympho leuko ở gà;
- TCVN 8400-30 : 2015, phần 30: Bệnh Marek ở gà;
- TCVN 8400-31 : 2015, phần 31: Bệnh tụ huyết trùng gia cầm;
- TCVN 8400-32 : 2015, phần 32: Bệnh gumboro ở gia cầm;
- TCVN 8400-33 : 2015, phần 33: Bệnh lê dạng trùng ở trâu bò;
- TCVN 8400-34 : 2015, phần 34: Bệnh biên trùng ở trâu bò;
- TCVN 8400-35 : 2015, phần 35: Bệnh Theileria ở trâu bò;
- TCVN 8400-36 : 2015, phần 36: Hội chứng suy mòn ở lợn sau cai sữa do Circo virus typ 2;
- TCVN 8400-37 : 2015, phần 37: Bệnh viêm phổi địa phương ở lợn;
- TCVN 8400-38 : 2015, phần 38: Bệnh tiêu chảy ở lợn do Coronavirus;
- TCVN 8400-39 : 2016, phần 39: Bệnh viêm đường hô hấp mãn tính ở gà;
- TCVN 8400-40 : 2016, phần 40: Bệnh nhiễm trùng huyết ở thủy cầm do vi khuẩn Riemerella anatipestifer gây ra.
- TCVN 8400-41 : 2019, phần 41: Bệnh dịch tả lợn Châu Phi.
- TCVN 8400-42 : 2019, phần 42: Bệnh dịch tả loài nhai lại nhỏ;
- TCVN 8400-43 : 2019, phần 43: Bệnh lưỡi xanh;
- TCVN 8400-44 : 2019, phần 44: Bệnh roi trùng Trichomonosis;
- TCVN 8400-45 : 2019, phần 45: Bệnh gạo lợn, bệnh gạo bò;
- TCVN 8400-46 : 2019, phần 46: Bệnh dại;
- TCVN 8400-47 : 2019, phần 47: Bệnh dịch tả lợn cổ điển;
BỆNH ĐỘNG VẬT - QUY TRÌNH CHẨN ĐOÁN - PHẦN 13: BỆNH SẢY THAI TRUYỀN NHIỄM DO BRUCELLA
Animal diseases - Diagnostic procedure - Part 13: Brucellosis
CẢNH BÁO - Việc áp dụng tiêu chuẩn này có thể liên quan đến các vật liệu, thiết bị và các thao tác gây nguy hiểm. Tiêu chuẩn này không thể đưa ra được hết tất cả các vấn đề an toàn liên quan đến việc sử dụng chúng. Người sử dụng tiêu chuẩn này phải tự thiết lập các thao tác an toàn sinh học thích hợp và xác định khả năng áp dụng các giới hạn quy định trước khi sử dụng tiêu chuẩn.
1 Phạm vi áp dụng
Tiêu chuẩn này quy định quy trình chẩn đoán bệnh sảy thai truyền nhiễm đối với động vật do vi khuẩn Brucella gây ra.
2 Tài liệu viện dẫn
TCVN 8402 : 2010. Bệnh động vật - Quy trình mổ khám.
3 Thuật ngữ, định nghĩa và chữ viết tắt
Trong tiêu chuẩn này sử dụng thuật ngữ và định nghĩa sau:
3.1
Bệnh sảy thai truyền nhiễm do vi khuẩn Brucella (Brucellosis):
Bệnh truyền nhiễm mạn tính đối với nhiều loài động vật và lây sang người do vi khuẩn Brucella gây ra. Bệnh thường gây viêm đường sinh dục, sảy thai, chết lưu thai và bất dục.
CHÚ THÍCH: Vi khuẩn Brucella là cầu trực khuẩn bắt màu Gram âm. Đường truyền lây của bệnh sảy thai truyền nhiễm do Brucella chủ yếu qua thức ăn nước uống, qua đường giao phối, qua sữa.
3.2
Bổ thể (Complement-C):
Là một phức hợp phân tử huyết thanh, một số thành phần của bổ thể có thể tự gắn với kháng nguyên đặc hiệu tạo thành phức hợp kháng nguyên-kháng thể.
3.3
Dung huyết tố (Haemolysin-H):
Huyết thanh của động vật gây tối miễn dịch kháng tế bào hồng cầu khác loài ở mức hiệu giá cao và gây dung giải hồng cầu tương ứng khi có sự xuất hiện của bổ thể.
3.4 Chữ viết tắt
- OIESS (OIE International Standard Serum): huyết thanh chuẩn quốc tế theo qui định của Tổ chức Thú y thế giới;
- ADN (acid deoxyribonucleic): axit deoxyribonucleic;
- Ct (threshold cycle): chu kỳ ngưỡng;
- Realtime PCR (polymerase chain reaction): phản ứng chuỗi trùng hợp theo thời gian thực;
- ELISA (enzymed linked immunosorbent assay): phép thử miễn dịch liên kết enzyme;
- RBT (Rose Bengal Test): phản ứng ngưng kết hoa hồng;
- MRT (Milk Ring Test): phản ứng vòng sữa;
- RBT (Rose Bengal Test): phản ứng ngưng kết hoa hồng;
- EDTA-TAT (EDTA-Tube agglutination test): phản ứng ngưng kết trong ống nghiệm
- CFT (Complement Fixation Test): phản ứng kết hợp bổ thể;
- MHD (Minimum haemolytic dose): liều dung huyết tối thiểu;
- ICFTU (International Complement Fixation Test Unit): đơn vị phản ứng kết hợp bổ thể quốc tế.
4 Thuốc thử và vật liệu thử
Chỉ sử dụng thuốc thử loại tinh khiết phân tích và sử dụng nước cất hoặc nước đã khử khoáng hoặc nước có độ tinh khiết tương đương không có RNase và ADNse, trừ khi có quy định khác.
4.1 Thuốc thử và vật liệu thử cho phương pháp nuôi cấy, phân lập
4.1.1 Nước sinh lý, NaCl 0,85 % (w/v)
4.1.2 Metanol, 95 % (v/v)
4.1.3 Kháng huyết thanh chuẩn đa dòng hoặc đơn dòng đặc hiệu
4.1.4 Giấy có tẩm dung dịch 1 % tetra methyl p-phenyl diamine dihydrochloride
4.1.5 Huyết thanh bê hoặc ngựa, vô trùng
4.1.6 Axit-alcohol, 3 %
4.1.7 Dung dịch u rê 40 % (w/v), vô khuẩn
4.2 Thuốc thử và vật liệu thử cho phương pháp realtime PCR
4.2.1 Các cặp mồi, mẫu dò đặc hiệu cho Brucella sp, Brucella abortus, Brucella melitensis, Brucella suis.
4.2.2 Kít chiết tách ADN
4.2.3 Kít nhân gen
4.2.4 Đối chứng dương chuẩn, với giá trị Ct đã biết
4.3 Thuốc thử và vật liệu thử cho phản ứng huyết thanh học
4.3.1 Huyết thanh chuẩn dương, có 1000 đơn vị ICFTU/ml. Ví dụ như sử dụng huyết thanh chuẩn do hãng ID-Vet sản xuất (MRI-BRU, ID-vet)[1].
4.3.2 Kháng nguyên chuẩn Brucella abortus biovar 1, strain 99 hoặc S1119-3, nhuộm màu rose bengal.
4.3.3 Kháng nguyên Brucella abortus biovar 1, strain 99 hoặc S1119-3, nhuộm màu haematoxylin, bảo quản ở nhiệt độ 5 °C ± 3 °C, dùng cho phản ứng ngưng kết vòng sữa.
4.3.4 Kháng nguyên Brucella abortus biovar 1, strain 99 hoặc S1119-3 dùng cho phản ứng kết hợp bổ thể và phản ứng ngưng kết trong ống nghiệm, bảo quản ở nhiệt độ 5 °C ± 3 °C.
4.3.5 Bổ thể (C), được chuẩn bị từ chuột lang.
4.3.6 Hồng cầu cừu (SRBC)
4.3.7 Dung huyết tố (Haemolysin) là kháng thể thỏ kháng tế bào hồng cầu cừu. Ví dụ như sử dụng duy huyết tố do hãng MyBiosourse sản xuất (Cat No. MBS524107), hoặc tương đương.
4.3.8 Hệ thống dung huyết: trộn một lượng bằng nhau của hồng cầu cừu (SRBC) 2.5 % và 2MHD dung huyết tố.
4.3.9 Kít ELISA
5 Thiết bị và dụng cụ
Sử dụng các thiết bị, dụng cụ của phòng thử nghiệm thông thường và cụ thể như sau:
5.1 Thiết bị và dụng cụ chung
5.1.1 Tủ lạnh, duy trì nhiệt độ từ 2 °C đến 8 °C
5.1.2 Tủ lạnh âm sâu, duy trì nhiệt độ tới âm 30 °C
5.1.3 Buồng cấy an toàn sinh học cấp I, II
5.1.4 Máy lắc trộn votex, có thể hoạt động với tốc độ từ 200 rpm đến 2.500 rpm.
5.1.5 Máy ly tâm lạnh, có thể đạt tốc độ 14.000 rpm
5.1.6 Nồi hấp, có thể duy trì nhiệt độ 121 ° C
5.1.7 Pipet đơn kênh, thể tích hút từ 100 µl đến 1000 µl, từ 1 µl đến 10 µl, từ 5 µl đến 50 µl; 20 µl đến 200 µl.
5.1.8 Cối chày sứ, vô trùng
5.1.9 Lọ thủy tinh, sạch và vô trùng
5.1.10 Pipet 5 ml và 10 ml, vô trùng
5.1.11 Túi lynon, sạch và vô trùng
5.1.12 Pank, kéo, sạch và vô trùng
5.1.13 Xy lanh, có dung tích 5 ml hoặc 10 ml
5.2 Thiết bị, dụng cụ cho nuôi cấy phân lập vi khuẩn
5.2.1 Kính hiển vi, có vật kính với độ phóng đại 10 X, 40 X, 100 X
5.2.2 Tủ ấm CO2, có thể duy trì ở nhiệt độ 37 °C ± 1 °C, có bổ sung từ 5 % đến 10 % CO2
5.2.3 Phiến kính, sạch và vô trùng
5.2.4 Ống nghiệm, sạch và vô trùng
5.2.5 Đĩa lồng petri, đường kính 9 mm, sạch và vô trùng
5.2.6 Đèn cồn
5.2.7 Que cấy, vô trùng
5.2.8 Tăm bông, sạch và vô trùng
5.3 Thiết bị và dụng cụ dùng cho phương pháp realtime PCR
5.3.1 Máy realtime PCR
5.3.2 Máy spindown,
5.3.3 Bể điều nhiệt, có thể duy trì nhiệt độ ở 55 °C ± 2 °C
5.3.4 Ống PCR, 0.2 ml
5.3.5 Ống eppendorf, không có RNase và DNase
5.4 Thiết bị và dụng cụ dùng cho phản ứng huyết thanh học
5.4.1 Tủ ấm, duy trì nhiệt độ ở 37 °C ± 2 °C
5.4.2 Bể điều nhiệt, duy trì nhiệt độ ở 37 °C ± 2 °C
5.4.3 Bể điều nhiệt, duy trì nhiệt độ ở 59 °C ± 2 °C
5.4.4 Máy lắc đĩa 96 giếng
5.4.5 Máy đọc ELISA, có thể đọc ở bước sóng 450 nm
5.4.6 Máy ly tâm đĩa 96 giếng, có thể đạt gia tốc 1.000 g
5.4.7 Đĩa 96 giếng, đáy chữ U
5.4.8 Pipet đa kênh, thể tích hút từ 25 µl
5.4.9 Bản phiến kính, que trộn mẫu, đồng hồ phòng thí nghiệm
5.4.10 Ống eppendorf, 1.5 ml
6 Chẩn đoán lâm sàng
6.1 Đặc điểm dịch tễ
Bệnh sảy thai truyền nhiễm là bệnh ở nhiều loài động vật nuôi, động vật hoang dã có khả năng lây sang người. Có ba chủng chính gây bệnh là:
- Brucella abortus (biovars 1 - 6) gây bệnh chủ yếu ở động vật, loài bò, hươu nai.
- Brucellasuis (biovars 1 - 5) gây bệnh chủ yếu ở lợn.
- Brucella melitensis (biovars 1 - 3) gây bệnh chủ yếu ở dê, cừu, đôi khi gây bệnh cho trâu, bò.
- Đường truyền lây của bệnh sảy thai truyền nhiễm do Brucella chủ yếu qua thức ăn nước uống, qua đường giao phối, qua sữa do con bú mẹ.
- Bệnh có hầu hết ở các nước trên thế giới trừ một số nước đã thanh toán được bệnh này.
6.2 Triệu chứng lâm sàng
6.2.1 Bệnh sảy thai truyền nhiễm trên trâu bò.
- Con cái: sảy thai, đẻ non, sát nhau, bất dục. Hiện tượng sảy thai thường vào tháng thứ 6 đến tháng thứ 8 của thai kỳ.
- Con đực: viêm tinh hoàn và mào tinh hoàn, bao dịch hoàn sưng to, túi tinh sưng, sưng khớp gối.
6.2.2 Bệnh sảy thai truyền nhiễm trên dê.
- Con cái: sảy thai ở giai đoạn cuối của thai kỳ, chân đi khập khiễng.
- Con đực: viêm tinh hoàn.
6.2.3 Bệnh sảy thai truyền nhiễm trên cừu
- Con cái: sảy thai vào giai đoạn cuối của thai kỳ, con sinh ra yếu hoặc chết.
- Con đực: bao dịch hoàn sưng to, động vật sốt cao, ủ rũ, mào tinh hoàn sưng to và rắn, tinh hoàn teo nhỏ.
6.2.4 Bệnh sảy thai truyền nhiễm trên lợn
- Con cái: sảy thai, thường bị ở tuần thứ 4 đến tuần 12 của thai kỳ. Có hiện tượng bất dục, tỷ lệ lợn con sinh ra bị chết cao.
- Con đực: viêm sưng hoặc hoại tử tinh hoàn, què hoặc liệt chân sau, viêm tinh hoàn và mào tinh hoàn.
6.3 Bệnh tích đại thể
Bệnh tích ở các loài đều gần giống nhau.
- Con cái: nhau thai có những điểm hoại tử dạng hạt màu vàng trắng, bờ mặt đục. Núm nhau bị biến màu, sờ vào mềm nhũn, có mủ. Cuống rốn có mủ, điểm hoại tử lấm tấm
- Bào thai: vỏ bọc thai dày lên có nhiều điểm xuất huyết.
- Con đực: dịch thượng hoàn sưng to gấp 2 lần đến 3 lần so với bình thường, lượng tinh trùng giảm, màng ngoài đường sinh dục dày, có khi bị viêm khớp u mềm có mủ.
- Cơ quan phủ tạng: gan, lách sưng hoặc hoại tử.
7 Chẩn đoán trong phòng thí nghiệm
7.1 Lấy mẫu và bảo quản mẫu
7.1.1 Lấy mẫu
7.1.1.1 Động vật chết
7.1.1.1.1 Mẫu mô
- Mổ khám động vật theo TCVN 8402 : 2010
- Lấy các mẫu mô bao gồm: mô nhau thai, mô thai bị sảy (tim, phổi, gan, lách), hạch lâm ba (hạch vú, hạch vùng xoang chậu), tuyến sữa, tử cung, tinh hoàn. Dùng panh, kéo (5.1.12) lấy mỗi mô từ 10 g đến 50 g mẫu, cho vào từng lọ (5.1.9) hoặc túi lynon (5.1.11) riêng biệt, đậy kín và ghi ký mã hiệu mẫu.
7.1.1.1.2 Mẫu dịch tiết
- Dịch âm đạo: dùng tăm bông vô trùng (5.2.8) để thấm dịch và cho vào ống nghiệm vô trùng (5.2.4).
- Nước ối: dùng xy lanh (5.1.13) lấy khoảng 05 ml nước ối cho vào ống nghiệm (5.2.4)
- Dịch khớp và dịch áp xe: dùng tăm bông vô trùng (5.2.8) để thấm dịch và cho ống nghiệm vô trùng (5.2.4).
7.1.1.2 Động vật sống
7.1.1.2.1 Mẫu máu: dùng xy lanh (5.1.13) lấy khoảng 05 ml máu từ tĩnh mạch của động vật, rút pit tông tạo khoảng trống, ghi ký hiệu mẫu trên bơm tiêm rồi đặt nằm nghiêng 45° trong hộp đựng mẫu, để đông máu trong 1 h đến 2 h ở nhiệt độ bình thường, tránh ánh nắng chiếu trực tiếp.
7.1.1.2.2 Mẫu dịch tiết
- Dịch âm đạo: thực hiện theo mục 7.1.1.1.2
- Dịch khớp và dịch áp xe: thực hiện theo mục 7.1.1.1.2
7.1.1.2.3 Mẫu tinh dịch: lấy khoảng 3 ml cho vào ống nghiệm vô trùng (5.2.4).
7.1.1.2.4 Mẫu sữa tươi:
+ Đối với cá thể: vệ sinh sạch bầu và cá núm vú, loại bỏ những giọt sữa đầu tiên, sau đó lấy khoảng 10 ml - 20 ml sữa cho vào lọ vô trùng (5.1.9).
+ Đối với quần thể: lấy khoảng 10 ml - 20 ml sữa tươi từ mỗi thùng hoặc téc chứa sữa cho vào lọ vô trùng (5.1.9).
7.1.2 Bảo quản mẫu
Mẫu phải được bao gói, bảo quản trong thùng lạnh ở nhiệt độ 5 °C ± 3 °C và vận chuyển ngay đến phòng thí nghiệm trong vòng 24 h sau khi lấy mẫu.
CHÚ THÍCH: Tất cả các mẫu phải được dán nhãn, ghi kí mã hiệu và gửi kèm theo Phiếu gửi mẫu bệnh phẩm và các thông tin dịch tễ, triệu chứng lâm sàng và bệnh tích của ca bệnh.
7.1.3 Chuẩn bị mẫu
7.1.3.1 Mẫu mô: lấy khoảng 5 g mẫu, loại bỏ các mô mỡ và các tổ chức liên kết. Mẫu được cắt thành những miếng nhỏ, nghiền bệnh phẩm bằng cối chày sứ vô trùng (5.1.8) với 20 ml dung dịch PBS (theo A1 Phụ lục A) thành huyễn dịch 20 %.
7.1.3.2 Mẫu dịch tiết: lắc kỹ ống đựng mẫu bằng máy lắc trộn votex (5.1.4).
7.1.3.3 Mẫu sữa tươi dùng cho phát hiện vi khuẩn: lấy 10 ml mẫu cho vào ống nghiệm (5.2.4) đem ly tâm ở 2.000 g trong 15 min. Loại bỏ váng sữa vào dung dịch sát trùng (tránh bị xáo trộn lớp kem). Lớp kem còn lại và lớp chất lắng dưới đáy được trộn lẫn với nhau.
7.1.3.4 Mẫu máu: chắt lấy huyết thanh và cho vào ống nghiệm eppendort (5.4.10). Huyết thanh được bảo quản trong tủ lạnh (5.1.1) để chờ xét nghiệm.
7.2 Phát hiện vi khuẩn Brucella bằng phương pháp nuôi cấy phân lập
7.2.1 Nuôi cấy trên môi trường tăng sinh chọn lọc
7.2.1.1 Dùng pipet (5.1.7) lấy khoảng 0.1 ml đến 0.2 ml mẫu sữa tươi (7.1.3.5) cấy vào ống nghiệm chứa canh thang Brucella (theo A.6, phụ lục A).
7.2.1.2 Ủ ống nghiệm (7.2.1.1) trong tủ ẩm CO2 (5.2.2) trong khoảng 3 ngày đến 7 ngày.
7.2.2 Nuôi cấy trên môi trường thạch chọn lọc
7.2.2.1 Dùng pipet (5.1.7) lấy 0,1 ml - 0,2 ml hỗn dịch mẫu (7.1.3.1, 7.1.3.4 và 7.1.1.2.3.) hoặc (7.2.1.2) cấy láng trên bề mặt đĩa thạch Farrell’s cải tiến (theo A.7, phụ lục A) và đĩa thạch CITA (xem A.8, phục lục A). Mỗi mẫu cấy từ 02 đến 03 đĩa thạch.
7.2.2.2 Ủ các đĩa thạch (7.2.2.1) vào tủ ấm CO2 (5.2.2) trong 4 ngày.
7.2.2.3 Sau 4 ngày ủ, quan sát các đĩa thạch Farrell’s cải tiến (7.2.2.2) khuẩn lạc Brucella sẽ có kích thước khoảng 1-2 mm, tròn, cong lồi, rìa gọn. Nhìn từ trên xuống, khuẩn lạc có màu trắng đục như màu ngọc trai, khi khuẩn lạc phát triển lớn hơn, màu sẽ đậm hơn.
7.2.2.4 Sau 4 ngày ủ, quan sát các đĩa thạch CITA (7.2.2.2) khuẩn lạc Brucella có đặc điểm tương tự như trên môi trường thạch Farrell’s cải tiến, nhưng màu sắc khuẩn lạc giống như màu mật ong nhạt.
7.2.2.5 Khuẩn lạc đặc trưng (7.2.2.3, 7.2.2.4) được tiếp tục ria cấy lên đĩa thạch TSA (theo A.4, phụ lục A) hoặc thạch máu (theo A.5, phụ lục A). Ủ trong tủ ấm CO2 (5.2.2) trong thời gian ít nhất 03 ngày. Lấy khuẩn lạc để giám định sinh hóa và phản ứng ngưng kết huyết thanh (theo 7.2.4)
7.2.3 Kiểm tra hình thái vi khuẩn Brucella
7.2.3.1 Lấy khuẩn lạc nghi là vi khuẩn Brucella (xem 7.2.2.3, 7.2.2.4) tiến hành làm tiêu bản:
- Nhỏ 1 giọt nước sinh lý (4.1.2) lên phiến kính (5.2.3), dùng que cấy (5.2.7) lấy khuẩn lạc hòa đều vào nước sinh lý.
- Tiêu bản được để khô và cố định trên ngọn lửa đèn cồn (5.2.6).
- Nhuộm Gram theo mục B.2, phụ lục B.
7.2.3.2. Quan sát tiêu bản nhuộm Gram (7.2.3.1) trên kính hiển vi (4.2.1) với độ phóng đại 100X, vi khuẩn Brucella là trực khuẩn nhỏ hoặc đa hình thái (hình trứng, hình gậy...), bắt màu hồng, thường nằm rải rác thành những tế bào đơn, đôi khi tập trung thành từng cặp hoặc chuỗi nhỏ, có kích thước vào khoảng từ 0,5 µm đến 0,7 µm hoặc từ 0,6 µm đến 1,5 µm, không hình thành nha bào và không quan sát thấy giáp mô.
7.2.4 Giám định sinh hóa và huyết thanh học
- Phản ứng urease (theo C.2, phụ lục C).
- Phản ứng oxidase (theo C.3, phụ lục C).
- Phản ứng ngưng kết (theo C.4, phụ lục C).
7.2.5 Đánh giá kết quả
Chủng vi khuẩn được coi là Brucella nếu có các đặc điểm sau:
- Khuẩn lạc có các đặc điểm giống như mô tả (xem 7.2.2.3 và 7.2.2.4)
- Vi khuẩn bắt màu và hình thái như mô tả (xem 7.2.3.2)
- Có đặc điểm sinh hóa và phản ứng huyết thanh học như mục C.1 Phụ lục C.
Mẫu được coi là âm tính khi không có vi khuẩn mọc trên các môi trường nuôi cấy, hoặc không có đặc điểm sinh hóa giống như mô tả trong mục C.1, phụ lục C.
7.3 Phát hiện vi khuẩn Brucella bằng phương pháp realtime PCR
7.3.1 Chiết tách ADN
- Hỗn dịch (7.1.3.1), mẫu canh khuẩn (7.2.1.2, 7.2.2.3) hoặc mẫu dịch tiết (7.1.3.2) dùng để tách chiết ADN bằng kít thương mại. Quy trình chiết tách theo hướng dẫn của nhà sản xuất (tham khảo phụ lục D). Mẫu ADN thu được dùng cho phản ứng realtime PCR.
7.3.2 Chuẩn bị mồi và mẫu dò
Phản ứng khuếch đại được thực hiện trong máy nhân gen (5.3.1) theo phương pháp realtime-PCR khuếch đại đoạn gen đặc hiệu cho vi khuẩn Brucella (tham khảo bảng E.1, phụ lục E).
Chuẩn bị mồi và mẫu dò như sau:
- Chuẩn bị mồi gốc: Mồi gốc và mẫu dò gốc ở trạng thái đông khô phải được ly tâm nhanh bằng máy spindown (5.3.2) ở gia tốc 6000 g trong 30 s để mồi lắng xuống đáy ống trước khi mở và hoàn nguyên. Lần đầu tiên dùng dung dịch đệm TE để hoàn nguyên mồi ở nồng độ 100 µM làm mồi gốc và mẫu dò gốc.
- Chuẩn bị mồi sử dụng: Mồi sử dụng ở nồng độ 20 µM (20 µl mồi gốc được pha với 80 µl nước). Mẫu dò được sử dụng ở nồng độ 6 µM (6µI mẫu dò gốc được pha với 94 µl nước). Trộn cùng 1 thể tích mồi xuôi, mồi ngược và mẫu dò sau khi pha thành hỗn hợp để tiện khi sử dụng.
7.3.3 Thực hiện phản ứng
Sử dụng cặp mồi đã chuẩn bị và bộ kít thương mại theo chỉ dẫn của nhà sản xuất. Ví dụ như bộ kít TaqPath™ qPCR Master Mix, hãng ABI, Cat no: A15297[2]
Pha hỗn hợp nhân gen (Master mix) theo hướng dẫn của bộ kít (tham khảo theo bảng E.2, phụ lục E).
- Hỗn hợp nhân gen: cho 20 µl vào mỗi ống PCR 0,2 ml (5.3.4);
- Mẫu đối chứng dương chuẩn (4.2.4): cho 5 µl mẫu ADN vào ống PCR đã có sẵn hỗn hợp nhân gen;
- Mẫu đối chứng âm: cho 5 µl nước cất vào ống PCR đã có sẵn hỗn hợp nhân gen;
- Mẫu xét nghiệm: cho 5 µl ADN vừa tách chiết vào ống PCR đã có sẵn hỗn hợp nhân gen;
- Trộn đều và ly tâm nhanh (5.3.2), đặt ống PCR vào máy realtime PCR (5.3.1);
- Chu trình nhiệt chạy phản ứng được cài đặt theo hướng dẫn của nhà sản xuất kit sử dụng cho phản ứng (tham khảo bảng E.3, phụ lục E).
CHÚ THÍCH:
1) Mẫu và nguyên liệu cho phản ứng realtime PCR cần đặt trong khay đá lạnh trong suốt quá trình chuẩn bị hỗn hợp phản ứng.
2) Để tiết kiệm chi phí xét nghiệm, tiến hành xét nghiệm sàng lọc phát hiện Brucella sp (gen IS711) trước, nếu âm tính thì kết luận âm tính. Trường hợp dương tính với Brucella sp, tiến hành xác định loài bằng các cặp mồi và mẫu dò đặc hiệu tương ứng cho từng loài (xem Phụ lục E).
7.3.4 Đánh giá kết quả
Phản ứng được công nhận: mẫu đối chứng dương tính (được chuẩn độ trước) phải có giá trị Ct ≤ 35 (± 2 Ct), mẫu đối chứng âm không có Ct.
Với điều kiện phản ứng trên:
1) Mẫu có giá trị Ct ≤ 35 được coi là dương tính;
2) Mẫu không có giá trị Ct là âm tính;
3) Mẫu có giá trị Ct ≤ 40 và > 35 được coi là nghi ngờ;
Những mẫu nghi ngờ này cần được xét nghiệm lại, hoặc xét nghiệm bằng phương pháp khác để khẳng định. Nếu vẫn còn nghi ngờ, cần lấy mẫu lại để xét nghiệm kết hợp với điều tra dịch tễ học để đưa ra kết luận cuối cùng.
7.4 Chẩn đoán bằng phương pháp huyết thanh học
Là phương pháp phổ biến nhất được áp dụng cho việc đánh giá đàn hay quần thể động vật kiểm tra có hay không bệnh sảy thai truyền nhiễm. Các phản ứng huyết thanh dùng để kiểm tra toàn đàn, kiểm tra định kỳ và kiểm tra trong trường hợp có hiện tượng động vật bị sảy thai.
7.4.1 Phản ứng ngưng kết hoa hồng (RBT)
7.4.1.1 Nguyên lý phản ứng
Kháng thể có trong huyết thanh kết hợp với kháng nguyên Brucella đã được gắn màu để tạo thành phức hợp kháng nguyên kháng thể mà có thể quan sát được bằng mắt thường (phức hợp này là những hạt chấm màu đỏ trong dung dịch trong suốt).
7.4.1.2. Tiến hành phản ứng
- Nguyên liệu phản ứng (4.3.1, 4.3.2) và mẫu huyết thanh (7.1.3.4) để ở nhiệt độ phòng (22 °C ± 4 °C) khoảng 1 h trước khi thực hiện phản ứng.
- Lắc đều lọ kháng nguyên (4.3.2) một cách nhẹ nhàng để đồng nhất kháng nguyên.
- Nhỏ 30 µl mẫu huyết thanh lên trên bản phiến kính (5.4.9);
- Nhỏ 30 µl kháng nguyên (4.3.2) lên mẫu huyết thanh;
- Trộn đều mẫu huyết thanh với kháng nguyên bằng que trộn;
- Lặp lại các bước trên với huyết thanh đối chứng âm và đối chứng dương;
- Nhẹ nhàng lắc tròn phiến kính trong khoảng 2 min.
CHÚ Ý: khi tiến hành phản ứng, phải thực hiện đồng thời cả mẫu đối chứng âm và mẫu đối chứng dương.
7.4.1.3 Đánh giá kết quả
- Phản ứng âm tính: không có sự ngưng kết.
- Phản ứng dương tính: có các hạt ngưng kết lấm tấm màu hồng.
7.4.2 Phản ứng vòng sữa (MRT)
7.4.2.1 Nguyên lý phản ứng
Kháng thể có trong sữa kết hợp với kháng nguyên Brucella đã được gắn màu để tạo thành phức hợp kháng nguyên kháng thể. Khi phức hợp này được tạo thành nó kéo theo lớp chất béo có trong sữa nổi lên trên và tạo thành vòng xanh tím. Phương pháp này chỉ áp dụng cho sàng lọc bệnh sảy thai truyền nhiễm trên đàn bò sữa.
7.4.2.2 Tiến hành phản ứng
- Trước khi làm xét nghiệm, mẫu sữa tươi (7.1.1.2.4) và lượng kháng nguyên chuẩn (4.3.3) đủ dùng cho xét nghiệm phải để ở nhiệt độ phòng (22 °C ± 4 °C).
- Cho 1 ml mẫu sữa (7.1.1.2.4) vào ống nghiệm vô trùng (4.2.4);
- Lắc đều và cho 50 pl kháng nguyên Brucella (4.3.3) vào mẫu, sau đó trộn đều;
- Đặt vào tủ ấm (5.4.1) trong 1 h hoặc tủ lạnh ở (5.1.1) từ 18 h đến 20 h, sau đó đánh giá kết quả;
CHÚ THÍCH:
1) Đối với mẫu sữa lấy trong téc sữa, tùy thuộc vào quần thể bò sữa mà lượng mẫu dùng cho phản ứng có thể khác nhau: Đàn <150 con, dùng 1 ml mẫu sữa; đàn từ 150 con - 450 con, dùng 2 ml mẫu sữa: đàn từ 451 con - 700 con, dùng 3 ml mẫu sữa cho phản ứng MRT.
2) Khi sử dụng 2 ml - 3 ml sữa dùng cho phản ứng MRT tùy theo quần thể đàn bò sữa, thì thêm 0.1 ml kem sữa âm tính vào mẫu trước khi tiến hành xét nghiệm.
3) Không sử dụng mẫu sữa non, mẫu sữa từ bò bị viêm vú để tiến hành xét nghiệm.
7.4.2.3 Đánh giá kết quả
- Mẫu dương tính: hình thành lớp vòng sữa màu xanh tím bằng hoặc đậm hơn màu của lớp sữa phía dưới.
- Mẫu âm tính: lớp kem phía trên có màu xanh tím nhạt hơn màu của lớp sữa phía dưới.
CHÚ Ý: Hai phản ứng trên chỉ là phản ứng sàng lọc để phát hiện sự có mặt hay không của kháng thể. Nếu phản ứng MRT cho kết quả dương tính thì phải tiến hành xét nghiệm bằng các phản ứng huyết thanh học khác để khẳng định.
7.4.3 Phản ứng ngưng kết trong ống nghiệm (EDTA-TAT)
7.4.3.1 Nguyên lý phản ứng
Kháng thể có trong huyết thanh kết hợp với kháng nguyên Brucella để tạo thành phức hợp kháng nguyên kháng thể mà có thể quan sát thấy bằng mắt thường. Phản ứng này chỉ sử dụng cho chẩn đoán bệnh sảy thai truyền nhiễm ở trâu, bò.
7.4.3.2 Tiến hành phản ứng
Thực hiện theo mục F.1, phụ lục F.
7.4.3.3 Đánh giá kết quả (theo bảng F.2, phụ lục F)
- Đối với đàn không tiêm phòng vắc xin:
+ Mẫu có hiệu giá ngưng kết ≥ 1/100 được coi là dương tính với kháng thể Brucella;
+ Mẫu có hiệu giá ngưng kết ≤ 1/25 được coi là âm tính với kháng thể Brucella;
+ Mẫu có hiệu giá ngưng kết > 1/25 và < 1/100 được coi là nghi ngờ.
- Đối với đàn tiêm phòng vắc xin:
+ Mẫu có hiệu giá ngưng kết ≥ 1/200 được coi là dương tính với kháng thể Brucella;
+ Mẫu có hiệu giá ngưng kết ≤ 1/50 được coi là âm tính với kháng thể Brucella;
+ Mẫu có hiệu giá ngưng kết > 1/50 và < 1/200 được coi là nghi ngờ.
Đối với những mẫu nghi ngờ, cần được xét nghiệm lại hoặc xét nghiệm bằng phương pháp khác để khẳng định. Ngoài ra, có thể lấy mẫu và xét nghiệm lại kết hợp với điều tra dịch tễ học để đưa ra kết luận cuối cùng.
7.4.4 Phương pháp ELISA
7.4.4.1 Nguyên lý phản ứng
Dùng kháng thể hoặc kháng kháng thể gắn enzym rồi cho kết hợp trực tiếp hay gián tiếp với kháng nguyên. Sau đó cho cơ chất (chất nền) vào, cơ chất sẽ kết hợp với enzym đã gắn tạo nên màu.
7.4.4.2 Tiến hành phản ứng
Thực hiện theo hướng dẫn của nhà sản xuất kit ELISA.
7.4.4.3 Đánh giá kết quả
Theo hướng dẫn của nhà sản xuất kit ELISA.
7.4.5 Phản ứng kết hợp bổ thể (CFT)
7.4.5.1 Nguyên lý phản ứng
Kháng thể trong huyết thanh kết hợp với kháng nguyên và bổ thể sẽ không dung giải tế bào hồng cầu cừu vì vậy hiện tượng dung huyết không xảy ra. Nếu huyết thanh không có kháng thể, bổ thể sẽ gây dung giải hồng cầu và hiện tượng dung huyết tố sẽ xảy ra.
7.4.5.2 Tiến hành phản ứng
- Tiến hành phản ứng theo mục G.2, phụ lục G
7.4.5.3 Đánh giá kết quả
- Đánh giá kết quả theo mục G.3, phụ lục G
8 Kết luận
- Động vật được coi là mắc bệnh sảy thai truyền nhiễm khi có các đặc điểm về dịch tễ, triệu chứng, bệnh tích điển hình và có kết quả xét nghiệm dương tính với vi khuẩn Brucella bằng một trong những phương pháp sau: phương pháp realtime PCR, nuôi cấy phân lập vi khuẩn hoặc dương tính với kháng thể Brucella bằng phương pháp CFT.
- Việc sử dụng phương pháp chẩn đoán trong tiêu chuẩn này phải phù hợp với mục đích và yêu cầu của cơ quan quản lý chuyên ngành thú y (theo Bảng 1)
Bảng 1- Các phương pháp dùng cho chẩn đoán bệnh do Brucella
| Mục đích | Phương pháp xét nghiệm | ||||||
| Phân lập Brucella | Realtime PCR | RBT | MRT | EDTA-TAT | ELISA | CFT | |
| Đánh giá vùng/cơ sở an toàn dịch | - | - | ++ | - | ++ | + | ++ |
| Giám sát để thanh toán dịch bệnh(a) | - | - | +++ | +++ | + | ++ | +++ |
| Giám sát tỷ lệ lưu hành huyết thanh học (đàn) | - | - | +++ | +++ | + | ++ | +++ |
| Giám sát định kỳ | - | - | +++ | +++ | ++ | ++ | +++ |
| Khẳng định ca bệnh nghi ngờ | +++ | ++ | + | + | + | + | ++ |
| CHÚ THÍCH: +++: Phương pháp phù hợp nhất; ++: Phương pháp phù hợp; +: Phương pháp có thể áp dụng, nhưng có những hạn chế; Phương pháp không phù hợp. (a): Khuyến cáo sử dụng song song 02 phương pháp thích hợp để tăng hiệu quả giám sát. | |||||||
Phụ lục A
(Quy định)
Thành phần và chuẩn bị dung dịch thuốc thử
A.1 Dung dịch Phosphate Buffered Saline (PBS)
A.1.1 Thành phần
| Natri clorua (NaCl) | 8,5 g |
| Dipotassium phosphate (K2HPO4) | 2,0 g |
| Monotassium Phosphat (KH2PO4) | 1,0 g |
| Nước cất | 1 000 ml |
A.1.2 Chuẩn bị
Hòa tan các thành phần trong nước, điều chỉnh pH trong khảng 7.0 ± 0.2. Hấp 121 °C trong thời gian 15 min, chia nhỏ và bảo quản ở 4 °C trong khoảng 3 tháng.
A.2 Dung dịch EDTA-PBS
A.2.1 Thành phần
| Natri clorua (NaCl) | 8,0 g |
| Kali clorua (KCl) | 0,20 g |
| Dinatri hydrophosphat (Na2HPO4) | 1,15 g |
| Kali dihydrophosphat (KH2PO4) | 0,20 g |
| EDTA | 3,72 g |
| Nước cất | 1 000 ml |
A.2.2 Chuẩn bị
Hòa tan các thành phần trong nước, điều chỉnh pH trong khảng 7.2 ± 0.2. Hấp 121 °C trong thời gian 15 min, chia nhỏ và bảo quản ở 4 °C trong khoảng 3 tháng.
A.3 Dung dịch Veronal buffer calcium magnesium, pH 7.2 (VB)
A.3.1 Thành phần
| Natri clorua (NaCl) | 8,5 g |
| Barbital | 0,575 g |
| Diethylmalonylurea sodium | 0,185 g |
| Magie clorua (MgCl2.6 H2O) | 0,168 g |
| Can xi clorua (CaCl2) | 0,028 g |
| Nước cất | 1 000 ml |
A.3.2 Chuẩn bị
Hòa tan các thành phần trong nước, điều chỉnh pH trong khảng 7.2 ± 0.2. Hấp 121 °C trong thời gian 15 min, chia nhỏ và bảo quản ở 4 °C trong khoảng 2 tháng.
A.4 Môi trường thạch TSA
Môi trường thạch TSA: sử dụng môi trường thương mại, pha chế theo hướng dẫn của nhà sản xuất.
VÍ DỤ: dùng môi trường thạch TSA (Tryptic soy agar) của hãng Merck (Cat. No. 105458)
Chuẩn bị môi trường theo hướng dẫn của nhà sản xuất.
A.5 Môi trường thạch máu
Môi trường thạch máu: sử dụng môi trường thương mại, pha chế theo hướng dẫn của nhà sản xuất.
VÍ DỤ: dùng môi trường thạch máu cơ bản (Blood agar base) của hãng Merck (Cat. No. 110886)
Chuẩn bị môi trường thạch máu cơ bản theo hướng dẫn của nhà sản xuất.
Vô trùng môi trường thạch máu cơ bản ở 121 °C trong 20 min bằng nồi hấp (5.1.6). Đợi nhiệt độ của môi trường thạch máu cơ bản đã vô trùng khoảng từ 45 °C đến 50 °C thì bổ sung máu từ 5 % đến 8 % máu thỏ, hoặc máu bê đã loại bỏ fibrin. Lắc đều và chia ra đĩa petri (5.2.5) khoảng 10 ml/ đĩa. Kiểm tra vô trùng môi trường trong tủ ấm (5.4.1) trong 24 h. Bảo quản môi trường ở điều kiện 5 °C ± 3 °C.
A.6 Môi trường thạch u rê cơ bản (Urea agar base - Christensen)
A.6.1 Thành phần
| Peptic digest of animal tissue | 1 g |
| Dextrose | 1 g |
| Sodium chloride | 5 g |
| Dinatri hydrophosphat (Na2HPO4) | 1,2 g |
| Monotassium phosphat (KH2PO4) | 0,8 g |
| Phenol Red | 0,012 g |
| Agar | 15 g |
| Nước cất | 950 ml |
A.6.2 Chuẩn bị
Hòa tan 24 g thạch u rê cơ bản trong 950 ml nước, đun nóng cho tới tan hoàn toàn. Điều chỉnh pH: 6.8 ± 0.2 ở 25 °C. Hấp bằng nồi hấp (5.1.6) trong 20 min. Để nguội ở nhiệt độ phòng cho đến khi môi trường còn khoảng 50 °C, thêm 50 ml dung dịch urê 40 % (4.1.7). Lắc đều, chia ra ống nghiệm (5.2.4) khoảng từ 3 ml đến 5 ml và để nghiêng 30° ở nhiệt độ phòng cho môi trường đông lại. Kiểm tra vô trùng môi trường trong tủ ấm (5.4.1) trong 24 h. Bảo quản môi trường ở 5 °C ± 3 °C.
A.7 Môi trường Farrell’s cải tiến
- Lấy 1 lít môi trường thạch cơ bản (có thể dùng thạch TSA), đun thạch và để nguội đến 56 °C, sau đó bổ sung 5 % huyết thanh bê (4.1.5) và thêm các thành phần kháng sinh sau:
| Polymyxin B sulphate: | 5 mg |
| Bacitracin: | 25 mg |
| Natamycin: | 50 mg |
| Nalidixic acid: | 5 mg |
| Nystatin: | 100.000 đơn vị |
| Vancomycin: | 20 mg |
Trộn đều, đổ ra đĩa petri, đậy nắp và bao gói, bảo quản môi trường ở 5 °C ± 3 °C, sử dụng tốt nhất trong vòng 8 ngày.
A.8 Môi trường thạch CITA
- Lấy 1 lít môi trường thạch máu cơ bản, đun thạch và để nguội đến 56 °C, sau đó bổ sung 5 % huyết thanh bê và thêm các thành phần kháng sinh sau:
| Nistatin: | 100.000 đơn vị |
| Nitrofurantoin: | 10 mg |
| Amphotericin B: | 4 mg |
| Colistin methanesulfonate: | 7,5 mg |
| Vancomycin: | 20 mg |
Trộn đều, đổ ra đĩa petri, đậy nắp và bao gói, bảo quản môi trường ở 5 °C ± 3 °C, sử dụng tốt nhất trong khoảng 8 ngày.
A.9 Môi trường canh thang Brucella
A.9.1 Thành phần
| Enzymatic digest of casein: | 10 g |
| Enzymatic digest of animal tissue: | 10 g |
| Yeast extract: | 2 g |
| Sodium chloride: | 5 g |
| Dextrose: | 1 g |
| Sodium bisulfite: | 0,1 g |
| Nước cất | 1.000 ml |
A.9.2 Chuẩn bị
Điều chỉnh pH: 7.0 ± 0.2 ở 25 °C, hấp 121 °C trong thời gian 15 min, để nguội đến 56 °C
Sau đó bổ sung vào 1 lít môi trường những thành phần sau:
| Huyết thanh ngựa: | 50 ml |
| Polymyxin B: | 5.000 đơn vị |
| Bacitracin: | 25.000 đơn vị |
| Nystatin: | 100.000 đơn vị |
| Cycloheximide: | 100 mg |
Trộn đều, đổ ra đĩa petri, đậy nắp và bao gói, bảo quản môi trường ở 5 °C ± 3 °C, sử dụng tốt trong vòng 8 ngày.
Phụ lục B
(Quy định)
Phương pháp nhuộm Gram
B.1 Thuốc thử
B.1.1 Dung dịch tím tinh thể
B.1.1.1 Thành phần
| Tím tinh thể (C25H30N3Cl) | 2,0 g |
| Etanol 95 % (thể tích) | 20 ml |
| Amoni oxalat [(NH4)2C2O4.2H2O] | 0,8 g |
| Nước cất | 80 ml |
B.1.1.2 Chuẩn bị
Hòa tan tím tinh thể trong etanol và hòa tan amoni oxalat trong nước. Sau đó, trộn 2 dung dịch này với nhau và lắc cho tan hết.
B.1.2 Dung dịch fuchsin đậm đặc
B.1.2.1 Thành phần
| Fuchsin cơ bản (C20H20CIN3) | 1,0 g |
| Etanol 95 % (thể tích) | 10 ml |
| Phenol (C6H6O) | 5 g |
| Nước cất | 100 ml |
B.1.1.2 Chuẩn bị
Hòa tan Fuchsin cơ bản trong etanol và hòa tan phenol trong nước. Sau đó trộn 2 dung dịch này với nhau và lắc cho tan hết. Khi dùng, pha loãng dung dịch fuchsin đậm đặc với nước theo tỉ lệ 1:10 (v/v)
B.1.3 Dung dịch lugol
B.1.3.1 Thành phần
| Kali iodua (KI) | 2,0 g |
| Iốt (I2) tinh thể | 1 g |
| Nước cất | 200 ml |
B.1.3.2 Chuẩn bị
Nghiền kali iodua và iốt tinh thể, cho nước vào từ từ và lắc cho tan.
B.1.4 Cồn axeton
B.1.4.1 Thành phần
| Etanol 95 % (thể tích) | 03 phần |
| Axeton (C2H6O) | 01 phần |
B.1.4.2 Chuẩn bị
Hòa tan và lắc đều 2 dung dịch này với nhau theo tỷ lệ
B.2 Cách tiến hành
Bước 1: nhỏ dung dịch tím tinh thể lên tiêu bản, để từ 1 min đến 2 min sau đó rửa nước nhanh và để khô.
Bước 2: nhỏ dung dịch lugol, để 1 min sau đó rửa nước nhanh và để khô.
Bước 3: nhỏ cồn axeton, rửa nước thật nhanh và để khô.
Bước 4: nhỏ dung dịch fuchsin loãng, để 1 min sau đó rửa nước rồi thấm khô hoặc để khô.
B.3 Xem tiêu bản
Nhỏ 1 giọt dầu vào tiêu bản và xem tiêu bản bằng kính hiển vi quang học (5.2.1).
Phụ lục C
(Quy định)
Các phản ứng sinh hóa
C.1 Đặc điểm sinh hóa của các loài vi khuẩn Brucella.
Bảng C.1- Một số đặc trưng của các loài Brucella
| Loài | Biovar | PỨ ngưng kết huyết thanh đơn dòng đặc hiệu | Hình thái khuẩn lạc | Sản sinh H2S | Phản ứng oxidase | Phản ứng urease | ||
| A | M | R | ||||||
| B. abortus | 1, 2, 3 | + | - | - | S | + | + | + |
| 4 | - | + | - | |||||
| 5 | - | + | - | |||||
| 6 | + | - | - | |||||
| 9 | - | + | - | |||||
| B. suis | 1 | + | - | - | S | - | + | + |
| 2 | + | - | - | |||||
| 3 | + | - | - | |||||
| 4 | + | + | - | |||||
| 5 | - | + | - | |||||
| B. melitensis | 1 | - | + | - | S | - | + | + |
| 2 | + | - | - | |||||
| 3 | + | + | - | |||||
| B. ovis | - | - | + | R | - | - | - | |
| B. canis | - | - | + | R | - | - | + | |
| B. neotomae | + | - | - | S | + | + | + | |
| CHÚ THÍCH: S: khuẩn lạc nhẵn, R: khuẩn lạc nhám, +: Dương tính | ||||||||
C.2 Phản ứng phân giải urê
C.2.1 Sử dụng que cấy (5.2.7) lấy vi khuẩn thuần khiết từ các đĩa thạch TSA hoặc thạch máu (7.2.2.5) cấy vào ống nghiệm đựng môi trường urea agar base - Christensen (xem A.6, Phụ lục A)
C.2.2 Ủ ống nghiệm (C.2.1) ở tủ ấm 37 °C (5.2.2). Sau 24 h đánh giá kết quả
C.2.3 Đánh giá kết quả
- Phản ứng âm tính: môi trường (C.2.2) không thay đổi màu.
- Phản ứng dương tính: môi trường (C.2.2) chuyển từ màu vàng sang màu tím.
C.3 Phản ứng oxidaza
Phản ứng được tiến hành trên giấy có tẩm dung dịch 1% tetra methyl p-phenyl diamine dihydrochloride (4.1.4)
C.3.1 Dùng que cấy (5.2.7) lấy khuẩn lạc từ môi trường thạch TSA hoặc thạch máu (7.2.2.5) chà sát lên trên mặt giấy (4.1.4).
C.3.2 Đánh giá kết quả
- Phản ứng dương tính: khi giấy tẩm (C.3.1) xuất hiện màu hồng đậm sau 30 s.
- Phản ứng âm tính: khi giấy tẩm (C.3.1) giữ nguyên màu.
C.4 Phản ứng ngưng kết huyết thanh
- Đặt phiến kính (5.2.3) trong đĩa lồng petri (5.2.5).
- Nhỏ một giọt kháng huyết thanh chuẩn (4.1.3) vào một ô trên phiến kính và nhỏ một giọt nước sinh lý (4.1.1) vào một ô khác làm đối chứng âm.
- Lấy một lượng nhỏ khuẩn lạc trên môi trường thạch TSA hoặc thạch máu (7.2.2.5) trộn đều với kháng huyết thanh chuẩn (4.1.3), một phần khuẩn lạc khác trộn đều với nước sinh lý (4.1.1). Để ở nhiệt độ phòng trong 5 min.
- Đánh giá kết quả:
+ Phản ứng dương tính: khi có hiện tượng ngưng kết với kháng huyết thanh chuẩn.
+ Phản ứng âm tính: không có hiện tượng ngưng kết giống như đối chứng âm tính.
Phụ lục D
(Tham khảo)
Quy trình tách chiết ADN
Tách chiết ADN bằng bộ kít DNeasy Blood Tissue Kit (Code: 69504)
CẢNH BÁO: Việc tách chiết ADN có sử dụng hóa chất nguy hiểm và có khả năng gây hại nếu thao tác không cẩn thận. Do vậy, nên tránh tiếp xúc trực tiếp với da và hít phải hơi của các hóa chất này. Luôn luôn đeo găng tay, khẩu trang, mặc quần áo bảo hộ khi thực hiện các thao tác này.
D.1 Chuẩn bị
- Thêm Ethanol (96-100 %) vào buffers AW1* và AW2+ trước khi sử dụng theo hướng dẫn ở trên nhãn.
- Buffers ATL and AL* có thể kết tủa khi lưu giữ. Nếu có kết tủa, hâm nóng buffer ở 56 °C cho đến khi tan hết.
D.2 Cách tiến hành
D.2.1 Hút 250 µl hỗn dịch (7.1.3.1), mẫu dịch tiết (7.1.3.2) hoặc mẫu canh khuẩn (7.2.1.2) cho vào ống eppendorf 1.5 ml (5.3.5).
D.2.2 Thêm 180 µl buffer ATL vào ống D.2.1.
D.2.3 Thêm 20 µl proteinase K, trộn nhẹ bằng máy lắc trộn vortex (5.1.4), ủ ở bể điều nhiệt (5.3.3) cho đến khi mẫu bị dung giải hoàn toàn. Thỉnh thoảng vortex mẫu trong khoảng 15 s. Thời gian dung giải mẫu có thể từ 1 h - 3 h.
D.2.4 Vortex 15 s. Thêm 200 ul buffer AL vào ống mẫu (D.2.3), vortex 15 s. Thêm 200 µl ethanol (96 % - 100 %), vortex 15 s.
D.2.5 Hút toàn bộ hỗn hợp (D.2.4) vào ống cột lọc đặt trong ống thu. Ly tâm 8000 rpm trong thời gian 1 min. Bỏ ống thu cùng dịch đã qua ly tâm.
D.2.6 Đặt cột lọc vào ống thu mới. Thêm 500 µl buffer AW1. Ly tâm 8000 rpm trong thời gian 1 min. Bỏ ống thu và dịch đã qua ly tâm.
D.2.7 Đặt cột lọc trong ống thu mới. Thêm 500 µl buffer AW2. Ly tâm 8000 rpm trong thời gian 3 min. Bỏ ống thu và dịch đã qua ly tâm.
D.2.8 Đặt cột lọc vào trong ống eppendorf (5.3.5). Thêm 200 µl buffer AE thẳng vào màng ống cột lọc (không được chạm đầu típ vào màng). Để ở nhiệt độ phòng 1 min, rồi ly tâm 8000 rpm trong 1 min. Bỏ cột lọc, giữ và bảo quản mẫu ADN thu được trong ống (5.3.5) trong tủ âm (5.1.2).
CHÚ THÍCH:
1) Bước D.2.1 và D.2.8 ghi mã hiệu mẫu ở cả nắp và thân ống nghiệm để tránh mất nhãn mẫu. Ống nghiệm ở bước D.2.8 là ADN tổng số dùng cho phản ứng PCR và lưu mẫu ở âm 20 °C, nên có thể ghi thêm các thông tin khác nếu cần.
2) Khi chuyển mẫu vào cột lọc (D.2.5), thì không được ghi mã hiệu mẫu vào phần thân cột, để tránh tạp nhiễm mẫu.
3) Chuyển ống cột lọc ra (D.2.7) phải cẩn thận, tránh chạm đáy ống vào dung dịch ở ống thu. Nếu chạm vào, cần ly tâm lại. Nếu dung dịch không xuống hết ống thu, ly tâm lại. Tốt nhất là chuyển sang ống thu mới và ly tâm ở tốc độ tối đa 14.000 rpm thêm 1 min nữa.
4) Mẫu đối chứng âm và mẫu đối chứng dương đều được tách chiết ADN trong cùng thời điểm với mẫu kiểm tra.
Phụ lục E
(Tham khảo)
Trình tự các cặp mồi, mẫu dò và chu trình nhiệt cho phản ứng realtime PCR
Bảng E.1 - Trình tự các cặp mồi, mẫu dò cho phản ứng realtime PCR
| Loài | Cặp mồi, mẫu dò | Trình tự (5’-3’) | Nguồn tham khảo |
| Brucella sp (IS711) | Mồi xuôi | GCTCGGTTGCCAATATCAATGC | William và cs (2004) |
| Mồi ngược | GGGTAAAGCGTCGCCAGAAG | ||
| Mẫu dò | FAM-AAATCTTCCACCTTGCCCTTGCCATCA-BHQ1 | ||
| B. abortus (gen BruAb2-0168) | Mồi xuôi | GCACACTCACCTTCCACAACAA | Hinić và cs (2008) |
| Mồi ngược | CCCCGTTCTGCACCAGACT | ||
| Mẫu dò | FAM-TGGAACGACCTTTGCAGGCGAGATC-BHQ1 | ||
| B. melitensis (gen BME II0466) | Mồi xuôi | TCGCATCGGCAGTTTCAA | Hinić và cs (2008) |
| Mồi ngược | CCAGCTTTTGGCCTTTTCC | ||
| Mẫu dò | Cy5-CCTCGGCATGGCCCGCAA-BHQ2 | ||
| B. suis (gen R0952) | Mồi xuôi | CCTGCAAAAAGCAGGAACCA | Hinić và cs (2008) |
| Mồi ngược | CCTCCGCCAGTCGTGAAA | ||
| Mẫu dò | FAM-ATATGGCCGGCTATCCGCGTTCG-BHQ1 |
GHI CHÚ:
- Trình tự cặp mồi và mẫu dò trong Bảng E.1 được tiêu chuẩn khuyến cáo sử dụng. Các phòng thí nghiệm có thể sử dụng các cặp mồi, mẫu dò khác được Tổ chức Thú y thế giới (OIE) hoặc Phòng Thí nghiệm tham chiếu của OIE về bệnh sảy thai truyền nhiễm khuyến cáo sử dụng.
Bảng E.2 - Thành phần phản ứng realtime PCR
(Sử dụng kit TaqPath™ qPCR Master Mix, hãng ABI, Cat no: A15297)
| Thành phần | Thể tích (µl) |
| Nước tinh khiết không có nuclease | 6,0 |
| Dung dịch đệm (2X) | 12,5 |
| Mồi xuôi (20 µM) | 0,5 |
| Mồi ngược (20 µM) | 0,5 |
| Mẫu dò (6 µM) | 0,5 |
| Tổng thể tích | 20 |
Bảng E.3 - Chu trình nhiệt của phản ứng realtime PCR
(Áp dụng cho kit TaqPath™ qPCR Master Mix, hãng ABI, Cat no: A15297[3])
| Vi khuẩn đích | Nhiệt độ | Thời gian | Số chu kỳ |
| Brucella sp | 95 °C | 5 min | 1 chu kỳ |
| 95 °C | 15 s | 40 chu kỳ | |
| 57 °C | 60 s | ||
| B. abortus/ melitensis/suis | 95 °C | 5 min | 1 chu kỳ |
| 95 °C | 15 s | 40 chu kỳ | |
| 60 °C | 45 s |
Phụ lục F
(Quy định)
Phản ứng ngưng kết trong ống nghiệm (EDTA-TAT)
F.1 Tiến hành phản ứng
- Pha loãng kháng nguyên (4.3.4) với tỷ lệ 1:100 bằng EDTA-PBS (xem A.2, phụ lục A)
- Chuẩn bị 5 ống nghiệm thủy tinh (5.2.4) đánh dấu thứ tự từ 1 đến 5, lấy kháng nguyên đã pha loãng cho vào các ống theo thứ tự từ 1 đến 5 với thể tích như sau: 2,0; 1,0; 1,0; 1,0 và 1,0 ml.
- Cho 0,08 ml huyết thanh kiểm tra (7.1.3.4) vào ống 1.
- Trộn đều và pha loãng bằng cách chuyển 1 ml huyễn dịch từ ống 1 sang ống 2, trộn đều và chuyển 1 ml từ ống 2 sang ống 3, tiếp tục đến ống thứ 5 và bỏ 1 ml cuối cùng. Như vậy các ống có độ pha loãng của huyết thanh theo thứ tự là: 1:25, 1:50, 1:100, 1:200, 1:400.
- Ủ trong tủ ấm (5.4.1) trong thời gian 48 h.
Các bước tiến hành được tóm tắt ở bảng dưới đây:
Bảng F.1 - Sơ đồ các bước tiến hành phản ứng ngưng kết trong ống nghiệm
| Các bước | Nguyên liệu | Thứ tự các ống nghiệm | ||||
| 1 | 2 | 3 | 4 | 5 | ||
| Pha loãng | Kháng nguyên 1:100, (ml) | 2.0 | 1.0 | 1.0 | 1.0 | 1.0 |
| Huyết thanh kiểm tra (µl) | 0.08 | Chuyển 1 ml từ ống 1 sang ống 2, trộn đều, chuyển tiếp tuc đến ống 5 rồi hút bỏ 1 ml | ||||
| Hiệu giá huyết thanh pha loãng | 1:25 | 1:50 | 1:100 | 1:200 | 1:400 | |
| Hiệu giá tính theo ĐV quốc tế (lU/mL) | 25 | 50 | 100 | 200 | 400 | |
| Trộn đều và ủ 37 °C trong thời gian 48 h | ||||||
F.2 Đánh giá kết quả.
Đánh giá kết quả theo Bảng F.2.
Bảng F.2 - Đánh giá kết quả phản ứng ngưng kết trong ống nghiệm
| Độ pha loãng | Đàn không tiêm vắc xin | Đàn tiêm vắc xin | |||
| 1:25 | 1:50 | 1:100 | 1:200 | ||
| - | - | - | - | Âm tính | Âm tính |
| I | - | - | - | Âm tính | Âm tính |
| + | - | - | - | Âm tính | Âm tính |
| + | I | - | - | Nghi ngờ | Âm tính |
| + | + | - | - | Nghi ngờ | Âm tính |
| + | + | I | - | Nghi ngờ | Nghi ngờ |
| + | + | + | - | Dương tính | Nghi ngờ |
| + | + | + | I | Dương tính | Nghi ngờ |
| + | + | + | + | Dương tính | Dương tính |
| CHÚ THÍCH: I: Ngưng kết không hoàn toàn; (+): Ngưng kết; Không ngưng kết | |||||
Phụ lục G
(Quy định)
Phản ứng kết hợp bổ thể (CFT)
G.1 Chuẩn bị nguyên liệu cho phản ứng CFT
G.1.1 Kháng nguyên
- Kháng nguyên (4.3.4) được pha loãng tới nồng độ làm việc và bảo quản theo hướng dẫn của nhà sản xuất.
- Kháng nguyên phải đảm bảo yêu cầu sau:
+ Kháng nguyên được pha loãng trong dung dịch nước sinh lý (4.1.1) và phenol ở nồng độ 0,5 % hoặc dung dịch VB (theo A.3, Phụ lục A).
+ Cho phản ứng ức chế dung huyết 50 % với huyết thanh chuẩn ở độ pha loãng 1/200 (theo H.1, phụ lục H).
G.1.2 Huyết thanh chuẩn
Huyết thanh chuẩn (4.3.1) được pha loãng tới một nồng độ nhất định để đưa ra hiệu giá dương tính dự kiến.
G.1.3 Hồng cầu cừu 2,5 %
Hồng cầu cừu (4.3.6) 50 % được pha loãng 1/20 trong dung dịch VB (xem A.3, Phụ lục A) để được nồng độ 2,5 %.
G.1.4 Chuẩn độ dung huyết tố (H)
G.1.4.1 Pha loãng dung huyết tố (4.3.7) ở nồng độ 1/250 (10 µl dung huyết tố + 2490 µl VB).
G.1.4.2 Từ nồng độ 1/250, pha một dãy các nồng độ khác nhau theo bảng G.1
Bảng G.1 - Sơ đồ pha loãng chuẩn độ dung huyết tố
| Thành phần | Hiệu giá pha loãng thứ cấp | ||||||
| 1/2 | 1/4 | 1/8 | 1/12 | 1/16 | 1/20 | 1/24 | |
| Dung huyết tố 1/250, µl | 50 | 50 | 50 | 50 | 50 | 50 | 50 |
| VBS, µl | 50 | 150 | 350 | 550 | 750 | 950 | 1150 |
| HG pha loãng cuối cùng | 1/500 | 1/1000 | 1/2000 | 1/3000 | 1/4000 | 1/5000 | 1/6000 |
G.1.4.3 Chuẩn bị bổ thể 1/10: bổ thể (4.3.5) được pha loãng 1/10 trong dung dịch VB (theo A.3, phụ lục A).
G.1.4.4 Chuyển 25 µl của mỗi nồng độ pha loãng dung huyết tố sang một dãy giếng trong đĩa 96 giếng (5.4.7) theo bảng G.2
G.1.4.5 Thêm 25 µl hỗn dịch hồng cầu cừu 2,5 % vào tất cả các giếng.
G.1.4.6 Cho 50 µl VB (A.3, phụ lục A) vào tất cả các giếng (riêng giếng đầu tiên cho 75 µl).
G.1.4.7 Thêm 25 µl bổ thể 1/10 (G.1.4.3) vào tất cả các giếng (trừ giếng đầu tiên).
G.1.4.8 Lắc đĩa hoặc vỗ nhẹ vào thành đĩa để trộn đều, đậy nắp và ủ trong tủ ấm (5.4.1) trong 30 min.
G.1.4.9 Ly tâm đĩa 96 giếng ở tốc độ 200 g - 400 g trong thời gian từ 5 min đến 10 min.
G.1.4.10 Đánh giá kết quả:
+ Đối chứng dung huyết tố: không có hiện tượng dung huyết.
+ Tại nồng độ pha loãng cao nhất gây 100 % dung huyết hồng cầu cừu được xác định là 01 đơn vị dung huyết tố (MHD-Minimum Haemolytic Dose).
+ Sử dụng 02MHD để tiến hành phản ứng CFT.
VÍ DỤ: Từ giếng 2 đến giếng 5 có nhiều dung huyết tố làm tan 100% hồng cầu cừu. Từ giếng 6 đến giếng 9 ít dung huyết tố, do đó không tan hết hồng cầu cừu. Vì vậy, giếng thứ 5 được xác định là 01 đơn vị dung huyết tố, tương ứng với độ pha loãng 1/2000. Hai đơn vị MHD = 1/2000 x 2 = 1/1000 (lấy haemolysin ở nồng độ pha loãng 1/1000 được sử dụng làm phản ứng)
Bảng G.2 - Sơ đồ phản ứng chuẩn độ dung huyết tố
| Thành phần | Thứ tự các giếng | ||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| Hiệu giá đã pha loãng | 1/250* | 1/250 | 1/500 | 1/1000 | 1/2000 | 1/3000 | 1/4000 | 1/5000 | 1/6000 |
| Dung huyết tố, µl | 25 | 25 | 25 | 25 | 25 | 25 | 25 | 25 | 25 |
| SRBC 2.5%, µl | 25 | 25 | 25 | 25 | 25 | 25 | 25 | 25 | 25 |
| VB, µl | 75 | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 50 |
| Bổ thể 1/10, | - | 25 | 25 | 25 | 25 | 25 | 25 | 25 | 25 |
| Trộn đều và ủ trong tủ ấm (5.4.1) trong 30 min | |||||||||
| Ly tâm đĩa ở tốc độ 200 g - 400 g/5 min -10 min | |||||||||
| CHÚ THÍCH: * Kiểm soát đối chứng dung huyết tố (H); | |||||||||
G.1.5 Chuẩn độ bổ thể chứa 6 đơn vị dung huyết tố 50 % (6CH50)
G.1.5.1 Bổ thể (4.3.5) được hoàn nguyên theo hướng dẫn của nhà sản xuất. Bổ thể sau khi hoàn nguyên nếu không sử dụng ngay phải bảo quản ở nhiệt độ 5 °C ± 3 °C cho tới khi thực hiện phản ứng trong ngày. Phần còn lại bảo quản ở nhiệt độ ≤ âm 16 °C.
G.1.5.2 Pha loãng bổ thể (4.3.5) ở nồng độ 1/100 trong dung dịch VB (50 µl bổ thể + 4500 µl dung dịch VB).
G.1.5.3 Tiếp tục pha loãng bổ thể thành một dãy nồng độ và cho các thành phần của phản ứng theo sơ đồ trong bảng G.3.
Bảng G.3 - Sơ đồ phản ứng chuẩn độ bổ thể
| Thành phần | Dãy ống nghiệm | Đối chứng | |||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | H100 | H0 | |
| C 1/100, µl | 40 | 50 | 60 | 70 | 80 | 90 | 100 | 110 | 120 | 130 | 140 | 150 | 160 | 400 | 0 |
| VB, µl | 160 | 150 | 140 | 130 | 120 | 110 | 100 | 90 | 80 | 70 | 60 | 50 | 40 | 0 | 0 |
| Kháng nguyên, µl | 200 | 200 | 200 | 200 | 200 | 200 | 200 | 200 | 200 | 200 | 200 | 200 | 200 | 200 | 200 |
| VB, µl | 200 | 200 | 200 | 200 | 200 | 200 | 200 | 200 | 200 | 200 | 200 | 200 | 200 | 0 | 400 |
| Lắc đều và ủ trong bể điều nhiệt (5.4.2) trong 30 min | |||||||||||||||
| CHÚ THÍCH: H100: Ống gây 100 % dung huyết; H0: Ống không gây dung huyết. | |||||||||||||||
G.1.5.4 Cho 400 µl hệ thống dung huyết 2MHD100 (G.1.4.10) vào tất cả các giếng.
G.1.5.5 Lắc đều và ủ trong bể điều nhiệt (5.4.2) trong 30 min.
G.1.5.6 Ly tâm (5.4.6) ở tốc độ 400 g - 800 g/5 min - 10 min.
G.1.5.7 Xác định đơn vị dung huyết 50 % của bổ thể (CH50):
- Trộn một thể tích (500 µl) nước trong của ống H0 hoặc dung dịch VB với một thể tích tương đương (500 µl) nước trong của ống H100. Trong trường hợp không có ống xuất hiện 100 % dung huyết, thì lấy 400 µl trộn với 1600 µl hệ thống dung huyết (SRBCs) để thành ống có 50 % dung huyết (H50). Ống nào trong dãy phản ứng có màu sắc giống với ống H50 được xác định là ống gây 50 % dung huyết.
- Tính toán số lượng bổ thể ban đầu cần cho phản ứng CFT (Vc):
![]()
Trong đó: VCi: Thể tích bổ thể ở nồng độ pha loãng 1/100
ΣV: Tổng thể tích bổ thể ở nồng độ pha loãng 1/100 pha loãng trong dung dịch VB.
Ci: Nồng độ bổ thể pha loãng ban đầu.
6: 6 đơn vị dung huyết của bổ thể (6CH50)
VCFT: Thể tích bổ thể cần cho 01 phản ứng CFT.
n: Số lượng phản ứng
Ví dụ: số lượng giếng phản ứng là 100; mỗi giếng sử dụng 25 µl bổ thể ở hiệu giá pha loãng. Lượng bổ thể cần = 100 x 25 µl = 2500 µl. Trong quá trình chuẩn độ bổ thể, xác định được ống thứ 7 gây 50 % dung huyết (H50),
Thể tích bổ thể ban đầu cần cho phản ứng = ![]() x 6 x 25 x 100 = 75 µl
x 6 x 25 x 100 = 75 µl
Lấy 75 µl bổ thể tinh khiết pha loãng trong 2425 µl trong dung dịch VB được 6CH50
G.2 Cách tiến hành phản ứng CFT (xem sơ đồ tại bảng G.4)
- Vô hoạt mẫu huyết thanh (7.1.3.4) và huyết thanh đối chứng (G.1.2) ở bể điều nhiệt (5.4.2) trong 30 min.
- Cho 50 µl dung dịch VB (A.3, phụ lục A) vào giếng 1 và 25 µl dung dịch VB vào giếng 2,4,5,6,7,8.
- Cho 50 µl huyết thanh kiểm tra (đã vô hoạt 59 °C ± 1 °C trong 30 min) vào giếng 1, trộn đều.
- Chuyển 25 µl huyết thanh đã pha loãng từ giếng 1 sang giếng 2, 3 và 4.
- Trộn đều giếng 2 và hút bỏ đi 25 µl.
- Bổ sung thêm 25 µI dung dịch VB vào giếng 1 và 2 để bù vào lượng còn thiếu (giếng 1 và 2 là đối chứng kháng bổ thể).
- Trộn đều huyết thanh và dung dịch VB ở giếng 4 và chuyển từ giếng 4 sang giếng 5, trộn đều và chuyển sang giếng 6, làm tương tự cho đến giếng 8 rồi hút bỏ 25 µl.
- Cho 25 ul kháng nguyên (G.1.1) vào tất cả các giếng, trừ 02 giếng đầu tiên.
- Cho 25 µl bổ thể 6CH50 (G.1.5) vào tất cả các giếng.
- Ủ đĩa phản ứng ở 4 °C qua đêm, hoặc 37 °C ± 2 °C trong 30 min. Nếu ủ qua đêm ở 4 °C thì trước khi đem làm tiếp phải cho vào tủ ấm (5.4.1) trong khoảng 10 min.
- Chuẩn bị hệ thống dung huyết (SRBCs): trộn 1 phần hồng cầu cừu 2,5 % với 1 phần dung huyết tố 2MHD100. Lắc nhẹ để trộn đều, để ở nhiệt độ phòng trong 20 min trước khi tiến hành phản ứng và thỉnh thoảng lại lắc nhẹ lên.
- Cho 50 µl hệ thống dung huyết vào tất cả các giếng, trộn đều và cho vào tủ ấm (5.4.1) trong 30 mln.
- Ly tâm đĩa (5.4.6) ở nhiệt độ 5 °C ± 3 °C trong 10 min, hoặc để ở nhiệt độ 5 °C ± 3 °C trong 2 h - 3 h, sau đỏ đánh giá kết quả.
Bảng G.4 - Sơ đồ phản ứng CFT
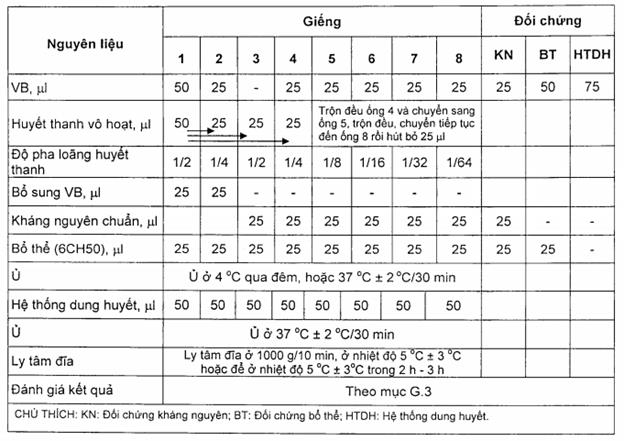
CHÚ THÍCH: Khi tiến hành phản ứng phải có một mẫu đối chứng dương (dùng huyết thanh dương tính chuẩn có độ dương tính thấp) và mẫu đối chứng âm tính được tiến hành song song với mẫu kiểm tra. Cách làm tương tự như với mẫu huyết thanh.
G.3 Đánh giá kết quả
- Điều kiện của phản ứng:
Phản ứng có giá trị khi
+ Đối chứng kháng nguyên: 100 % dung huyết
+ Đối chứng bổ thể: 100 % dung huyết
+ Đối chứng hệ thống dung huyết: 0 % dung huyết
+ Đối chứng âm: 100 % dung huyết
+ Đối chứng dương: có hiệu giá kháng thể trong ngưỡng đã biết.
+ Đối chứng huyết thanh kháng bổ thể: 100 % dung huyết ở giếng 1 và 2.
- Đánh giá kết quả:
Kết quả được đánh giá mức độ dung huyết, hoặc ngưng kết theo Bảng G.5.
Bảng G.5 - Bảng đánh giá phản ứng kết hợp bổ thể
| Mức độ | Dung huyết (%) | Ngưng kết (%) |
| ++++ (4+) | 0 | 100 |
| +++ (3+) | 25 | 75 |
| ++ (2+) | 50 | 50 |
| + (1+) | 75 | 25 |
| 0 | 100 | 0 |
Phản ứng được đọc ở độ pha loãng cao nhất mà tại đó phản ứng vẫn xảy ra ở mức ngưng kết 1+ hoặc lớn hơn. Sau khi đọc kết quả, hiệu giá kháng thể phải được qui đổi sang đơn vị kết hợp bổ thể quốc tế theo Bảng G.6. Mẫu được coi là dương tính khi có hiệu giá ≥ 20 ICFTU/ml.
Bảng G.6 - Qui đổi hiệu giá huyết thanh sang đơn vị ICFTU/ml
| Độ pha loãng huyết thanh | Ức chế dung huyết (Ngưng kết) | |||
| 25 % (+) | 50 % (++) | 75 % (+++) | 100 % (++++) | |
| 1/2 | 8,33 | 10 | 11,67 | 13,33 |
| 1/4 | 16,67 | 20 | 23,33 | 26,67 |
| 1/8 | 33,33 | 40 | 46,67 | 53,33 |
| 1/16 | 66,67 | 80 | 93,33 | 106,67 |
| 1/32 | 133,33 | 160 | 187 | 213,33 |
| 1/64 | 266,67 | 320 | 373,33 | 426,67 |
| 1/128 | 533,33 | 640 | 746,67 | 853,33 |
| 1/256 | 1066,67 | 1280 | 1493,33 | 1706,67 |
Phụ lục H
(Quy định)
Kiểm soát hiệu giá kháng nguyên dùng cho phương pháp CFT, RBT và MRT
Việc kiểm soát kháng nguyên chỉ áp dụng trong trường hợp phòng thí nghiệm tự sản xuất kháng nguyên chuẩn để sử dụng cho phản ứng huyết thanh học, nhằm đánh giá độ nhạy và độ đặc hiệu của kháng nguyên trước khi thực hiện xét nghiệm, đảm bảo tính chính xác của phương pháp thử.
H.1 Kiểm soát kháng nguyên Brucella dùng cho phản ứng CFT
H.1.1 Pha loãng huyết thanh chuẩn (4.3.1) ở nồng độ 1/50 trong dung dịch VB.
H.1.2 Tiếp tục pha loãng (H.1.1) trong một dãy ống nghiệm theo tỷ lệ 0,8 %, 0,7 %, 0,6 %, 0,5 %, 0,4 %, 0,3 %, 0,2 % trong dung dịch VB (theo sơ đồ tại bảng H.1).
Bảng H.1 - Sơ đồ pha loãng huyết thanh chuẩn
| Thành phần | Hiệu giá pha loãng | |||||||
| 1/50 | 0,8 % | 0,7 % | 0,6 % | 0,5 % | 0,4 % | 0,3 % | 0,2 % | |
| Huyết thanh chuẩn, ml | 0,1 | - | - | - | - | - | - | - |
| VB (ml) | 4,9 | 0,6 | 0,65 | 0,7 | 0,75 | 0,8 | 0,85 | 0,9 |
| Huyết thanh chuẩn 1/50, ml | - | 0,4 | 0,35 | 0,3 | 0,25 | 0,2 | 0,15 | 0,1 |
H.1.3 Pha loãng kháng nguyên theo Bảng H.2 (kháng nguyên có thể pha loãng tùy theo nồng độ vi khuẩn).
Bảng H.2 - Sơ đồ pha loãng kháng nguyên
| Thành phần | 1/40 | 1/60 | 1/80 | 1/100 | 1/120 | 1/140 |
| 2,5 % | 1,66 % | 1,25 % | 1% | 0,83 % | 0,71 % | |
| Kháng nguyên chuẩn (ml) | 0,1 | - | - | - | - | - |
| VB (ml) | 3,9 | 0,25 | 0,50 | 0,75 | 1,0 | 1,25 |
| Kháng nguyên chuẩn 2.5% (ml) | - | 0,50 | 0,50 | 0,50 | 0,50 | 0,50 |
H.1.4 Thực hiện phản ứng CFT (theo phụ lục G) bằng cách xét nghiệm từng nồng độ pha loãng huyết thanh với từng nồng độ kháng nguyên pha loãng.
H.1.5 Đánh giá kết quả:
Hiệu giá kháng nguyên trong phản ứng CFT phải cho phản ứng ức chế dung huyết 50 % với huyết thanh chuẩn ở độ pha loãng 1/200 (0,5 %).
Bảng H.3 - Ví dụ về đọc và đánh giá kết quả hiệu giá kháng nguyên
| Huyết thanh chuẩn, ml | 0,8% | 0,7% | 0,6% | 0,5% | 0,4% | 0,3% | 0,2% |
| Hiệu giá kháng nguyên |
| ||||||
| 1/40 | 50% | 25% | 0 | 0 | 0 | 0 | 0 |
| 1/60 | <75% | <50% | 25% | 0 | 0 | 0 | 0 |
| 1/80 | 75% | <75% | <50% | 25% | 0 | 0 | 0 |
| 1/100 | 75% | 75% | >50% | 50%(*) | <25% | 0 | 0 |
| 1/120 | 75% | 75% | >50% | 50% | 25% | 0 | 0 |
| 1/140 | 100% | 75% | >50% | <50% | 25% | 0 | 0 |
| CHÚ THÍCH: (*) Kết quả kháng nguyên ở nồng độ 1/100 cho phản ứng ức chế 50 % với huyết thanh chuẩn ở độ pha loãng 1/200 là đạt yêu cầu | |||||||
H.2 Kiểm soát hiệu giá kháng nguyên dùng cho phản ứng RBT
H.2.1 Pha loãng huyết thanh chuẩn (4.3.1) ở nồng độ 1/25 trong nước sinh lý (4.1.1).
H.2.2 Tiếp tục pha loãng (H.2.1) trong một dãy ống nghiệm theo Bảng H.4 thành các nồng độ pha loãng 1/40, 1/45, 1/50, 1/55, 1/100.
Bảng H.4 - Sơ đồ pha loãng huyết thanh chuẩn

H.2.3 Thực hiện phản ứng RBT (xem 7.4.1).
H.2.4 Đánh giá kết quả:
Kháng nguyên dùng cho phản ứng RBT phải cho kết quả dương tính với huyết thanh chuẩn ở độ pha loãng 1/45 và phản ứng âm tính ở độ pha loãng 1/55 là đạt yêu cầu.
H.3 Kiểm soát kháng nguyên dung cho phản ứng MRI
H.3.1 Pha loãng huyết thanh chuẩn (4.3.1) ở nồng độ 1/5 trong nước sinh lý (4.1.1).
H.3.2 Tiếp tục pha loãng huyết thanh (H.3.1) trong một dãy ống nghiệm thành các nồng độ pha loãng 1/10, 1/20, 1/50, 1/100 (xem Bảng H.5).
Bảng H.5 - Sơ đồ pha loãng huyết thanh chuẩn

H.3.3 Chuyển 05 ống huyết thanh đã pha loãng ở 5 nồng độ tương ứng trên và pha loãng 1/10 trong mẫu sữa âm tính, thành các nồng độ pha loãng tương ứng 1/20, 1/100, 1/200, 1/500 và 1/1000.
H.3.4 Thực hiện phản ứng MRT (xem 7.4.2).
H.4.4 Đánh giá kết quả:
Kháng nguyên dùng cho phản ứng MRT phải cho kết quả dương tính với huyết thanh chuẩn ở độ pha loãng 1/500 và phản ứng âm tính ở độ pha loãng 1/1.000 là đạt yêu cầu.
CHÚ THÍCH:
1) Khi tiến hành đánh giá nồng độ kháng nguyên, phải tiến hành đánh giá trên các mẫu huyết thanh chuẩn âm tính (ít nhất 05 mẫu).
2) Quy trình sản xuất kháng nguyên phải tuân thủ yêu cầu của Tổ chức Thú y thế giới (Manual of Standards for Diagnostic Tests and Vaccines, chương 2.1.4).
Thư mục tài liệu tham khảo
[1]. OIE (Office International des Epizooties). Manual of Standards for Diagnostic Tests and Vaccines (May 2016). Chương 2.1.4. Brucellosis (Brucella abortus, B. melitensis and B. suis) (infection with B. abortus, B. melitensis and B. suis)
[2]. Council Directive 64/432/EEC and Decision 2004/226/EC as regards diagnostic tests for bovine brucellosis.
[3]. TCVN 8400-13:2011. Quy trình chẩn đoán bệnh sảy thai truyền nhiễm do Brucella.
[4]. William S. Probert, Kimmi N. Schrader, and Margot H. Real-Time Multiplex PCR Assay for Detection of Brucella spp., B. abortus, and B. melitensis. Journal of Clinical Microbiology. 2004;42(3):1290-1293.
[5]. Brucellosis: Serological tests. OIE reference laboratory for Brucellosis in Thailand. National Institute of Animal Health.
[6]. Hinić V, Brodard I, Thomann A, Cvetnić Z, Makaya PV, Frey J, Abril C. Novel identification and differentiation of Brucella melitensls, B. abortus, B. suis, B. ovis, B. canis, and B. neotomae suitable for both conventional and real-time PCR systems. J Microbiol Methods. 2008 Oct;75(2):375-8.
[7]. A. Daugaliyeva, S. Peletto, A. Sultanov, S. Baramova, P.L. Acutis, A. Adambaeva O. Tusipkanuly, B. Usserbayev. Development of a Differential PCR Assay for Detection of Brucella abortus and Brucella melitensis: an Analytical Approach for Monitoring of Brucella spp. in Foods of Animal Origin. Journal of Food Quality and Hazards Control 3 (2016) 53-59
[8]. Sung-ll Kang, Moon Her, Jong Wan Kim, Ji-Yeon Kim, Kyung Yuk Ko, Yun-Mi Ha, and Suk Chan Jung. Advanced Multiplex PCR Assay for Differentiation of Brucella Specie. Applied and environmental, Sept. 2011, p. 6726-6728
[9]. Marília Cristina Sola, Eurlone A.G. da Veiga Jardim, Marcius Ribeiro de Freitas, Albenones José de Mesquita. Real-time PCR detection of Brucella spp. ADN in lesions and viscera of bovine carcasses. Journal of Microbiological Methods 104 (2014) 87-91.
[1] Thông tin này đưa ra để tạo điều kiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các sản phẩm thương mại khác nếu cho kết quả tương đương.
[2] Thông tin này đưa ra để tạo điều kiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các sản phẩm thương mại khác nếu cho kết quả tương đương.
[3] Thông tin này đưa ra để tạo điều kiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các sản phẩm thương mại khác nếu cho kết quả tương đương. Khi sử dụng nên tuân thủ theo khuyến cáo của nhà sản xuất về thành phần phản ứng realtime PCR và chu trình nhiệt.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 8400-13:2019 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 8400-13:2019 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 8400-13:2019 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 8400-13:2019 DOC (Bản Word)