- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn TCVN 14387:2025 Phân bón - Định lượng nấm Penicillium spp. bằng kỹ thuật đếm khuẩn lạc và PCR
| Số hiệu: | TCVN 14387:2025 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Nông nghiệp-Lâm nghiệp |
| Trích yếu: | Phân bón - Định lượng nấm Penicillium spp. bằng kỹ thuật đếm khuẩn lạc và khẳng định bằng phản ứng chuỗi polymerase (PCR) | ||
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
18/09/2025 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 14387:2025
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 14387:2025
TIÊU CHUẨN QUỐC GIA
TCVN 14387:2025
PHÂN BÓN - ĐỊNH LƯỢNG NẤM PENICILLIUM SPP. BẰNG KỸ THUẬT ĐẾM KHUẨN LẠC VÀ KHẲNG ĐỊNH BẰNG PHẢN ỨNG CHUỖI POLYMERASE (PCR)
Fertilizers - Enumeration of Penicillium spp. by colony-count method and confirmation by polymerase chain reaction (PCR)
Lời nói đầu
TCVN 14387:2025 do Viện Sinh học - Viện Hàn lâm khoa học và Công nghệ Việt Nam biên soạn, Bộ Nông nghiệp và Môi trường đề nghị, Ủy ban Tiêu chuẩn Đo lường Chất lượng Quốc gia thẩm định, Bộ Khoa học và Công nghệ công bố.
PHÂN BÓN - ĐỊNH LƯỢNG NẤM PENICILLIUM SPP. BẰNG KỸ THUẬT ĐẾM KHUẨN LẠC VÀ KHẲNG ĐỊNH BẰNG PHẢN ỨNG CHUỖI POLYMERASE (PCR)
Fertilizers - Enumeration of Penicillium spp. by colony-count method and confirmation by polymerase chain reaction (PCR)
1 Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp định lượng nấm Penicillium spp. có trong phân bón vi sinh, nguyên liệu sản xuất phân bón bằng kỹ thuật đếm khuẩn lạc và khẳng định bằng phản ứng chuỗi polymerase (PCR).
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau là cần thiết cho việc áp dụng tiêu chuẩn này. Đối với tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với tài liệu viện dẫn không ghi năm công bố thi áp dụng phiên bản mới nhất, bao gồm cả các bản sửa đổi, bổ sung (nếu có).
TCVN 6404:2008 (ISO 7218:2024 WITH AMENDMENT 1:2013), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Yêu cầu chung và hướng dẫn kiểm tra vi sinh vật.
TCVN 8989:2012. Vi sinh vật trong thực phẩm - Phương pháp xác định Aspergillus parasiticus và Aspergillus versicolor giả định.
TCVN 8128:2015 (ISO 11133:2014), Vi sinh vật trong thực phẩm, thức ăn chăn nuôi và nước - Chuẩn bị, sản xuất, bảo quản và thử hiệu năng của môi trường nuôi cấy.
TCVN 12105:2018. Phân bón vi sinh vật - Lấy mẫu
TCVN 13613:2022. Phân bón - Phương pháp định lượng Trichoderma spp - Kỹ thuật đếm khuẩn lạc
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này áp dụng các thuật ngữ, định nghĩa sau đây:
3.1
Penicillium spp.
Là nấm có tầm quan trọng lớn trong môi trường tự nhiên cũng như sản xuất thực phẩm và thuốc. Penicillium spp. có thể phân giải xenluloza, phân giải hợp chất photpho khó tan (phân lân vi sinh) sản xuất từ các vi sinh vật có khả năng chuyển hóa các hợp chất photpho khó tan thành dễ tiêu cho cây trồng sử dụng. Penicillium spp. có đặc điểm cuống sinh bào tử và bào tử được mô tả khi tiến hành các thử nghiệm theo tiêu chuẩn này.
3.2
Penicillium spp. giả định (Putative Penicillium spp.)
Penicillium spp. giả định là những loài nấm mang các đặc điểm hình thái điển hình của Penicillium spp. nhưng chưa được đánh giá thông qua phép thử khẳng định.
3.3
Định lượng Penicillium spp. (Enumeration of Penicillium spp.)
Phương pháp xác định đơn vị hình thành nấm Penicillium spp. (CFU/g hoặc CFU/mL) trong một đơn vị khối lượng hoặc thể tích cụ thể của phân bón, nguyên liệu sản xuất phân bón khi tiến hành các thử nghiệm theo tiêu chuẩn này.
4 Nguyên tắc
Định lượng Penicillium spp. trong phân bón vi sinh, nguyên liệu sản xuất phân bón bằng phương pháp đếm số lượng khuẩn lạc phát triển trên môi trường thạch PDA sau 5-7 ngày nuôi cấy ở 28 ± 1°C và khẳng định bằng PCR sử dụng cặp mồi đặc hiệu.
5 Thiết bị, dụng cụ
Có thể sử dụng các dụng cụ dùng một lần thay cho các dụng cụ sử dụng nhiều lần nếu các thông số kỹ thuật tương tự.
Sử dụng các thiết bị, dụng cụ dùng trong thử nghiệm vi sinh thông thường được quy định trong TCVN 6404:2016 (ISO 7218:2024) và cụ thể như sau:
5.1 Thiết bị
5.1.1 Tủ cấy vi sinh vật, đảm bảo độ vô trùng.
5.1.2 Nồi hấp áp lực, có nhiệt độ hơi nước bão hòa trong buồng có khả năng duy trì nhiệt độ ở 121 °C ± 3 °C tương ứng áp suất tối thiểu 101,3 kPa.
5.1.3 Tủ sấy, thông gió đối lưu, có thể duy trì ở nhiệt độ từ 160 °C đến 180 °C, độ chính xác đến 1 °C.
5.1.4 Tủ ấm, thông gió đối lưu, có thể duy trì ở nhiệt độ lên đến 70 °C, độ chính xác ± 0,2 °C.
5.1.5 Máy lắc, tốc độ đạt 200 vòng/phút.
5.1.6 Cân phân tích, có độ chính xác đến 0,001 g.
5.1.7 Máy trộn Vortex, tốc độ lắc đạt 1 000 vòng/phút, lắc tròn.
5.1.8 Kính hiển vi quang học, có độ phóng đại đến 1000X, sử dụng vật kính soi dầu.
5.1.9 Máy đo pH, có độ chính xác đến ± 0,1 đơn vị pH ở 25 °C.
5.1.10 Máy polymerase chain reaction (PCR), cho phép thể tích mẫu 10 ~ 100 μl.
5.1.11 Bể ổn nhiệt, có thể duy trì ở nhiệt độ từ 25 °C đến 90 °C
5.1.12 Máy khuấy từ gia nhiệt, có tốc độ khuấy từ 0 đến 1500 r/min và có nhiệt độ dao động 0-100 °C
5.1.13 Máy soi ADN, có công suất tới 15W, điện áp tới 12V- 2A, bước sóng 470nm
5.1.14 Máy chụp ảnh thông thường
5.1.15 Bể điện di ngang, kích thước tùy điều kiện phòng thí nghiệm, có thể điều chỉnh cường độ dòng điện và thời gian.
5.1.16 Máy ly tâm, có tốc độ cao lên tới 14000 r/min có thể duy trì ở nhiệt độ từ 4 °C đến 30 °C
5.1.17 Máy NanoDrop, đo nồng độ ADN
5.1.18 Lò vi sóng thông thường
5.2 Dụng cụ
5.2.1 Bình tam giác, thủy tinh có dung tích 250 mL, 500 mL.
5.2.2 Cốc thủy tinh, có dung tích 100 mL, 250mL.
5.2.3 Ống nghiệm, có dung tích 16 × 160 mm.
5.2.4 Que cấy vòng, đầu que cấy bằng chất liệu Volfram.
5.2.5 Que dàn mẫu, bằng thủy tinh hoặc bằng chất dẻo hoặc bằng thép.
5.2.6 Pipets, có dung tích danh định 10 mL, 1 mL, 0,1 mL, 0,01 mL; sử dụng đầu tip vô trùng.
5.2.7 Đĩa Petri, đường kính 90 mm đến 200 mm.
5.2.8 Lam kính, bằng thủy tinh.
5.2.9 Lamen, bằng thủy tinh.
5.2.10 Bông, không thấm nước.
5.2.11 Panh, bằng thép.
5.2.12 Ống eppendorf, có thể tích 0,5 mL, 1,5 mL, 2 mL.
6 Môi trường, hóa chất
6.1 Yêu cầu chung
Sử dụng các loại hóa chất phân tích tinh khiết. Chuẩn bị và khử trùng môi trường nuôi cấy theo TCVN 8128:2015 (ISO 11133:2014).
Ưu tiên sử dụng các thành phần cơ bản dạng khô, hoặc các môi trường hoàn chỉnh dạng khô để chuẩn bị môi trường nuôi cấy; thực hiện theo hướng dẫn của nhà sản xuất.
Nước sử dụng phải là nước cất vô trùng hoặc có chất lượng tương đương quy định trong TCVN 6404:2016 (ISO 7218:2007).
6.2 Môi trường PDA
6.2.1 Thành phần
| Glucose | 20,0 g |
| Agar | 15,0 g |
| Dịch chiết khoai tây (đã chuẩn bị) cho đủ | 1000 mL |
| pH | 6,5 ± 0,2 |
* Khuyến cáo sử dụng môi trường PDA (Potato dextrose agar) thương mại
* Bổ sung thêm chất kháng khuẩn chloramphenicol 0,01%
6.2.2 Chuẩn bị
Chuẩn bị dịch chiết khoai tây: Lấy 200g khoai tây gọt vỏ, rửa sạch, cắt thành dạng hạt lựu, bổ sung 500 mL nước cất và đun sôi trong 20 phút, sau đó lọc chiết lấy nước trong. Thêm nước cất đến 1000 mL.
Cân và hòa tan các thành phần trong dịch chiết khoai tây theo thứ tự đã liệt kê (6.2.1), đun nóng nếu cần. Điều chỉnh pH về 7,0 ± 0,2 ở nhiệt độ phòng bằng dung dịch HCl 1M (36,45 g HCl trong 1 L nước cất) và NaOH 3 M (120 g NaOH trong 1 L nước cất). Phân phối hỗn hợp với lượng thích hợp vào các bình thủy tinh (5.2.1). Không vặn chặt nắp bình thủy tinh. Khử trùng 15 min, trong nồi hấp áp lực (5.1.2) ở 121 °C.
Sau khi khử trùng, làm nguội đến 45 °C đến 50 °C, bổ sung thêm chất kháng khuẩn chloramphenicol 0,01%, lắc đều. Phân phối lượng khoảng từ 18 mL đến 20 mL môi trường PDA vào các đĩa Petri (5.2.7) đã được chuẩn bị như nêu tại 8.1.1 và để cho đông đặc. Các thao tác được tiến hành trong tủ cấy vô trùng (5.1.1);
Khi bề mặt môi trường khô, kiểm tra độ vô trùng bằng cách lật úp các đĩa thạch và để trong tủ ấm (5.1.4) ở nhiệt độ 29 °C ± 1 °C trong 16 h hoặc để qua đêm ở nhiệt độ phòng. Các đĩa môi trường sau đó được sử dụng ngay hoặc bảo quản 4°C trong vòng 1 tuần. Chỉ dùng đĩa petri không nhiễm khuẩn.
6.3 Chuẩn bị dung dịch pha loãng
6.3.1 Thành phần
| Natri clorua (NaCl) | 8,5 g |
| Nước cất (H2O) bổ sung đạt thể tích | 1000 mL |
| pH | 7,0 ±0,2 |
6.3.2 Chuẩn bị
Cân và hòa tan 8,5 g NaCl trong 1000 mL nước cất. Phân phối dung dịch pha loãng thập phân vào các ống nghiệm (5.2.3) sao cho sau khi khử trùng trong mỗi ống nghiệm chứa 9,0 mL. Sai số cho phép đo của thể tích cuối cùng sau khi khử trùng không được vượt quá ± 0,2 %
6.4 Agarose 1 %
6.4.1 Thành phần
| Agarose | 1 g |
| Dung dịch đệm TAE 1X (Pha từ dung dịch gốc 50X) | 100 mL |
| Thành phần dung dịch gốc 50X: |
|
| + Tris base (C4H11NO3) | 242 g |
| + Acid acetic (CH3COOH) | 55,1 mL |
| + Ethylendiamin Tetraacetic Acid (Na2EDTA) | 37,2 g |
| + Nước cất bổ sung đạt thể tích | 1 lít |
6.4.2 Chuẩn bị
Cân và hòa tan agarose trong dung dịch đệm TAE 1X theo thứ tự đã liệt kê (6.4.1), đun nóng trong lò vi sóng (ngưỡng công suất trung bình) cho đến khi agarose hòa tan hết và dung dịch ở trạng thái trong suốt. Sai số cho phép đo của thể tích cuối cùng sau khi sử dụng không được vượt quá ± 0,2 %;
6.5 Hóa chất tách chiết DNA, PCR
Các hóa chất sử dụng trong quy trình tách chiết DNA là những hóa chất tinh khiết của các hãng uy tín trên thị trường như Thermo, Biobasic, Sigma... hoặc các loại kít chiết tách khác nhau được cung cấp trên thị trường. Do đó, tùy thuộc vào điều kiện thực tế của phòng thí nghiệm để lựa chọn.
6.5.1 Thành phần đệm tách chiết ADN (đệm CTAB)
| Cetyltrimethylammonium bromide (CTAB) | 0,5 g |
| Ethylenediaminetetraacetic acid (EDTA) | 1,0 g |
| Tris (hydroxymethyl) aminomethane (Tris base) | 2,5 g |
| NaCl | 5,0 g |
| Nước cất | 100 mL |
6.5.2 Chuẩn bị
Cân và hòa tan các thành phần đã liệt kê (6.5.1). Phân phối hỗn hợp với lượng thích hợp vào các bình thủy tinh (5.2.1). Không vặn chặt nắp bình thủy tinh. Khử trùng 15 min trong nồi hấp áp lực (5.1.2) ở 121 °C và và bảo quản ở nhiệt độ phòng.
6.5.3 Các hoá chất khác
- Lysozyme (N-acetylmuramide glycanhydrolase)
- Chloroform (CHCl3), Isopropanol (CH3CHOHCH3), isoamylalcohol ((CH3)2CHCH2CH2OH)
- Natri dodecyl sulfate (SDS) 10 %
- Proteinase K
- Natri chloride (NaCl) 5M
- Isopropanol (CH3CHOHCH3 (C3H8O))
- Ethanol 70 %
- Đệm TE (10 mM Tris-HCl; 1 mM EDTA)
- Loading dye
- Master Mix
* Sử dụng các bộ kít tách chiết ADN thương mại phù hợp với điều kiện thực tế của phòng thử nghiệm và thực hiện theo hướng dẫn của nhà sản xuất.
6.6 Mồi PCR
Cặp mồi đặc hiệu nhân đoạn gen 5,8S rRNA kích thước khoảng 490 bp:
Pen-ITSI: 5’-ATTACCGAGTGAGGGCCC-3’
Pen-ITS2: 5’-TGACAAAGCCCCATACGC-3’
7 Lấy mẫu
Tiêu chuẩn này không quy định việc lấy mẫu, nên lấy mẫu theo TCVN 12105:2018. Mẫu gửi đến phòng thử nghiệm nên là mẫu đại diện và không bị hư hỏng hoặc biến đổi trong suốt quá trình vận chuyển và bảo quản.
8 Cách tiến hành
8.1 Chuẩn bị
8.1.1 Dụng cụ
Các dụng cụ sử dụng trong nuôi cấy vi sinh vật phải được khử trùng bằng 1 trong 2 cách sau:
- Tiệt trùng khô ở nhiệt độ (170 ± 10) °C không ít hơn 1 h trong tủ sấy (5.1.3).
- Tiệt trùng hơi nước ở nhiệt độ (121 ±3) °C không ít hơn 15 min trong nồi hấp áp lực (5.1.2).
8.1.2 Chuẩn bị mẫu
Dùng cân phân tích (5.1.6) cân khoảng 10 g mẫu (dạng rắn) hoặc dùng pipet với đầu tip vô trùng (6.2.6) hút 10 mL mẫu (dạng lỏng) cho vào bình thủy tinh (5.2.1) chứa 90 mL dung dịch pha loãng đã chuẩn bị (6.3). Lắc trên máy lắc (5.1.5) từ 5 min đến 10 min sao cho vi sinh vật phân bố đồng đều trong dung dịch. Để các phần tử nặng lắng xuống trong thời gian không nhiều hơn 3 min, nếu cần. Dung dịch phía trên được gọi là dung dịch huyền phù ban đầu;
Dùng pipet với đầu típ vô trùng (5.2.6) hút 1 mL dịch huyền phù ban đầu cho vào ống nghiệm (6.2.3) chứa 9 mL dung dịch pha loãng đã chuẩn bị (6.3). Tránh chạm đầu típ vào dung dịch pha loãng. Trộn kỹ trên máy trộn Vortex (5.1.7) từ 5 s đến 10 s để có dung dịch mẫu độ pha loãng 10-2. Lặp lại qui trình để thu được dung dịch mẫu ở các độ pha loãng thập phân tiếp theo 10-3, 10-4, 10-5. Thường sử dụng độ pha loãng 10-5, 10-6, 10-7 đối với phân bón vi sinh.
CHÚ THÍCH 1: Hoạt hóa mẫu (nếu có) theo hướng dẫn của nhà sản xuất để đảm bảo kết quả chính xác.
8.2 Cấy và ủ mẫu
Chỉ được sử dụng đĩa chứa môi trường đã chuẩn bị (6.2.2), không tạp nhiễm.
Dùng pipet với đầu típ vô trùng (5.2.6) lấy 0,1 mL dung dịch mẫu cho vào mỗi đĩa Petri chứa môi trường PDA đã chuẩn bị (6.2). Lặp lại qui trình với các dung dịch mẫu ở các nồng độ pha loãng thập phân tiếp theo; mỗi nồng độ thực hiện 2 đĩa Petri.
Dùng que dàn mẫu (5.2.5) dàn đều dịch cấy trên bề mặt đĩa thạch càng nhanh càng tốt mà không chạm vào thành đĩa Petri. Sử dụng một que dàn mẫu vô trùng cho mỗi đĩa Petri. Đậy nắp đĩa Petri và để yên trong khoảng 15 min ở nhiệt độ phòng.
Nuôi trong tủ ấm (5.1.4) ở (28 ± 1) °C trong 5 ngày đến 7 ngày.
8.3 Đếm khuẩn lạc
Đếm các khuẩn lạc giả định ở hai độ pha loãng liên tiếp, trên các đĩa Petri có chứa không nhiều hơn 50 khuẩn lạc theo TCVN 8989:2012.
Trên môi trường thạch PDA, sau 5 ngày đến 7 ngày nuôi cấy ở (28 ± 1) °C cho thấy Penicillium spp. thường có sợi khuẩn ty khí sinh ngắn, phân nhánh, dày đặc, hình ảnh đại thể thường từ màu trắng chuyển màu xanh lam, xanh xám, xám ô liu, vàng hoặc đế sinh sắc tố. (Hình A.1, Phụ lục A).
![]() Tính mật độ Penicillium spp. ban đầu theo công thức sau:
Tính mật độ Penicillium spp. ban đầu theo công thức sau:
Mật độ vi sinh vật trong một đơn vị kiểm tra (gam hay mililit) được tính theo công thức:
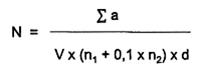
Trong đó:
N: số lượng Penicillium spp. trong một đơn vị kiểm tra, được tính bằng đơn vị hình thành khuẩn lạc ở dạng lỏng trong 1 mL (CFU/mL), hoặc dạng rắn trong 1 g (CFU/g);
Σ a: tổng các khuẩn lạc giả định, đếm được trên tất cả các đĩa được giữ lại từ hai độ pha loãng liên tiếp;
n1: số đĩa được giữ lại ở độ pha loãng thứ nhất;
n2: số đĩa được giữ lại ở độ pha loãng thứ hai;
d: độ pha loãng tương ứng với độ pha loãng thứ nhất được giữ lại [d = 1 khi sản phẩm ở dạng lỏng (mẫu thử) không pha loãng];
V là thể tích dịch cấy đã dùng trên mỗi đĩa, tính bằng mililit (mL) hoặc gam (g). Ở đây V = 1 mL;
Làm tròn kết quả thu được đến hai chữ số sau dấu phẩy, theo quy định chuẩn quốc tế.
8.4 Khẳng định
8.4.1 Đặc điểm hình thái tế bào
Tiến hành kiểm tra ít nhất 5 khuẩn lạc giả định đã được xác định thông qua hình thái khuẩn lạc ở (8.3) để thực hiện phép thử khẳng định (Bước này thực hiện song song với bước (8.3)). Nếu trên đĩa Petri có ít hơn 5 khuẩn lạc thì lấy tất cả các khuẩn lạc có mặt;
Bước 1: Chuẩn bị đĩa Petri, lam kính, lamen, panh, bông ẩm, môi trường PDA và được hấp vô trùng.
Bước 2: Đặt bông và lam kính vào đĩa Petri.
Bước 3: Đổ môi trường PDA vào một đĩa Petri khác để tạo một lớp mỏng 0,5 mm. Sau đó, cắt thành các miếng 1x1 cm, đặt lên trên lam kính.
Bước 4: Chấm điểm các chủng vi sinh vật lên cạnh của các mảnh môi trường, đặt lamen lên trên bề mặt môi trường.
Bước 5: Nuôi trong tủ ấm ở (28 ± 2) °C trong khoảng 5 đến 7 ngày
Quan sát cuống sinh bào tử của nấm bằng kính hiển vi quang học ở độ phóng đại 40 lần.
- Kiểm tra kết quả: Chủng nấm Penicillium spp. thường có sợi khuẩn ty khí sinh ngắn, phân nhánh, dày đặc, Cuống sinh bào tử thể bình, bào tử lúc non hình cầu, xé rách tạo dạng chuỗi dài khi già ...(Hình B.1, Phụ lục B). Dựa trên kết quả thu được, chiếu theo khoá phân loại của Maren A Klich (2002) và bước đầu xác định được chủng nấm giả định thuộc chi Penicillium.
* Có thể nhuộm tế bào nấm bằng thuốc nhuộm LPCB (Lactophenol cotton blue) để dễ quan sát hình thái tế bào nấm hơn theo TCVN 13613:2022.
8.4.2 Phương pháp PCR
Lựa chọn khuẩn lạc đã được xác định thuộc chi Penicillium spp. (8.4.1) để khẳng định bằng phương pháp PCR bằng cặp mồi đặc hiệu cho chi Penicillium spp. (Phụ lục C).
Sử dụng các chủng nấm Penicillium herquei (VCCM 33912) (giả định), Penicillium spp. NM7 (VCCM 33911) (đối chứng dương) và Penicillium chrysogenum (ATCC 10106) (đối chứng dương) Aspergillus oryzea (VTCC 31635) (đối chứng âm), Aspergillus niger (VTCC 16404) (đối chứng âm), Aspergillus fumigatus (ATCC 204305) (đối chứng âm); giếng 4: chủng Trichpoderma sp.(VCCM 31807) (đối chứng âm) hoặc các chủng chuẩn khác từ các Bảo tàng giống chuẩn trên Thế giới.
9 Tính và biểu thị kết quả
Mật độ nấm Penicillium spp. trong mẫu phân bón được tính toán theo công thức sau:
M = N × B × C
Trong đó:
M: số lượng nấm Penicillium spp. trong mẫu phân bón, được tính bằng đơn vị hình thành khuẩn lạc trên gam hay mililit (CFU/g (/mL)
N: mật độ được tính trên nhóm nấm giả định là Penicillium spp. ở (8.3)
B: tỷ lệ nấm có hình thái tế bào của Penicillium spp.
C: tỷ lệ nấm có sản phẩm phản ứng PCR dương tính với cặp mồi đặc hiệu chi Penicillium spp.
10 Báo cáo thử nghiệm
Báo cáo thử nghiệm phải bao gồm ít nhất các thông tin sau:
a) mọi thông tin cần thiết để nhận biết đầy đủ mẫu thử;
b) phương pháp lấy mẫu đã sử dụng, nếu biết;
c) phương pháp thử nghiệm đã dùng hoặc viện dẫn tiêu chuẩn này;
d) mọi thao tác không được quy định trong tiêu chuẩn này, hoặc những điều được coi là tự chọn, và bất kỳ chi tiết nào có ảnh hưởng tới kết quả;
e) các kết quả thử nghiệm thu được.
PHỤ LỤC A
(Quy định)
Phát hiện nấm Penicillium spp. nuôi trên môi trường thạch PDA
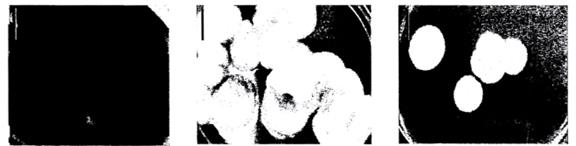
| Penicillium herquei | Penicillium NM7 | Penicillium chrysogenum |
Hình A.1 - Hình thái các chủng nấm Penicillium spp. sau 7 ngày được nuôi trên môi trường thạch PDA. Thanh kích thước 2 cm.
Phụ lục B
(Quy định)
Đặc điểm bào tử Penicillium spp. nuôi cấy trên môi trường PDA

| Penicillium herquei | Penicillium NM7 | Penicillium chrysogenum |
Hình B.1-Hình thái cuống sinh bào tử của Penicillium spp. dưới kính hiển vi quang học ở độ phóng đại 40 lần. Thanh kích thước 20 μm.
Phụ lục C
(Tham khảo)
Quy trình tách chiết DNA và PCR
(Theo phương pháp của Trần Nhân Dũng (2011) có bổ sung)
![]() Tách chiết DNA
Tách chiết DNA
Thu sinh khối nghiền mịn trong nitơ lỏng. Sau đó sinh khối nấm được hòa trong 1000 μl nước muối sinh lý đã tiệt trùng trong ống eppendorf. Vortex mạnh để trộn đều sinh khối.
• Ly tâm để thu cặn nấm với tốc độ 13000 vòng/phút trong 7 phút ở nhiệt độ phòng.
• Hòa tan cặn nấm trong 600 pl đệm TE.
• Bổ sung 15 μl lysozyme 100 mg/mL, ủ tại 37 °C trong 1 h.
• Bổ sung 40 μl SDS 10 %, trộn đều.
• Bổ sung 8 μl proteinase K (20 mg/mL), trộn đều.
• Ủ ở 56 °C trong 30 phút.
• Tiếp tục bổ sung thêm 100 pl CTAB/NaCl, trộn đều.
• Bổ sung 100 μl NaCl 5M, trộn đều.
• Ủ ở 65 °C trong 10 phút.
• Bổ sung 650 μl hỗn hợp Clorotorm/isoamylalcohol (24:1) (đảo nhẹ nhàng), sau đó ly tâm 12000 vòng/phút trong 10 phút. Hút 500 μl dịch nổi ở trên sang một ống mới.
• Bổ sung 500 μl isopropanol để kết tủa ADN. Đảo ống và ủ ở -20 °C trong 1 giờ.
• Ly tâm với tốc độ 12000 vòng/phút trong 15 phút ở 4 °C, loại dịch.
• Rửa tủa bằng 500 μl ethanol 70% và ly tâm với tốc độ 12000 vòng/phút trong 15 phút ở 4 °C.
• Loại bỏ dịch nổi phía trên và để khô. Hòa phần tủa khô với 60 μl dung dịch TE/nước cất vô trùng.
• DNA được đo nồng độ và độ tinh sạch bằng máy NanoDrop. Nồng độ ADN thu được cần đạt tối thiểu là 50 ng/μl , giá trị A260/280 ≥ 1,8, A260/230 tốt nhất trong khoảng từ 2,0 đến 2,2. Kiểm tra bằng điện di trên agarose 1% và bảo quản ở -20 °C. Nếu nồng độ ADN thu được nhỏ hơn 50 ng trong 1 μl dịch ADN thì có thể tăng lượng sản phẩm ban đầu đưa vào để tách chiết DNA.
* Thực hiện phản ứng PCR sử dụng cặp mồi đặc hiệu cho chi Penicillium spp.
Pen-ITSI: 5-ATTACCGAGTGAGGGCCC-3’
Pen-ITS2: 5’-TGACAAAGCCCCATACGC-3’
- Thành phần phản ứng khuếch đại đoạn 5,8S rRNA
| Thành phần | Thể tích |
| DNA vi sinh vật (50 ng/pl) | 1,5 μl |
| Mồi xuôi (100 pM) | 1 μl |
| Mồi ngược (100 pM) | 1 μl |
| 2X Master Mix | 12,5 μl |
| H2O | 9,5 μl |
| Tổng | 25 l |
Chu trình nhiệt cho phản ứng PCR
|
| Nhiệt độ (°C) | Thời gian | Số chu kỳ |
| Biến tính ban đầu | 94 | 5 phút | 1 |
| Biến tính | 94 | 30 giây | 35 |
| Gắn mồi | 55 | 30 giây | |
| Tổng hợp chuỗi | 72 | 30 giây | |
| Kéo dài | 72 | 10 phút | 1 |
| Bảo quản | 4 | ∞ |
|
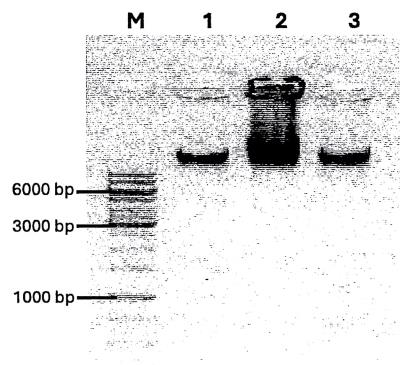
Hình C.1 - Kết quả điện di kiểm tra sản phẩm tách DNA tổng số Penicillium spp.
M: DNA ladder 1kb (Thermo Fisher Scientific); giếng 1-3: Penicillium herquei (VCCM 33912), Penicillium spp. NM7 (VCCM 33911) và Penicillium chrysogenum (ATCC 10106)
- Kiểm tra sản phẩm của phản ứng PCR bằng phương pháp điện di DNA trên gel agarose 1,0 %. Kích thước sản phẩm PCR của Penicillium herquei (VCCM 33912) (mẫu giả định), Penicillium NM7 (VCCM 33911) (đối chứng dương), Penicillium chrysogenum (ATCC 10106) (đối chứng dương) có độ dài khoảng 490 bp phù hợp với kích thước tính toán của cặp mồi đặc hiệu. Trong khi đó, các chủng Aspergillus oryzea (VTCC 31635) (đối chứng âm), Aspergillus niger (VTCC 16404) (đối chứng âm), Aspergillus fumigatus (ATCC 204305) (đối chứng âm) đều cho âm tính, điều này thể hiện tính đặc hiệu của mồi sử dụng chỉ bắt cặp với DNA của các chủng thuộc chi Penicillium.

Hình C.2 - Sản phẩm PCR với mồi đặc hiệu Penicillium spp,
M: DNA ladder 1kb (Thermo Fisher Scientific); giếng (-): đối chứng âm (nước), giếng 1, 2, 3: chủng Aspergillus oryzea (VTCC 31635) (đối chứng âm), Aspergillus niger (VTCC 16404) (đối chứng âm), Aspergillus fumigatus (ATCC 204305)(đối chứng âm) ; giếng 4: chủng Trichpoderma sp.(VCCM 31807) (đối chứng âm); giếng 5, 6,7: Penicillium herquei (VCCM 33912) (mẫu giả định), Penicillium NM7 (VCCM 33911) (đối chứng dương), Penicillium chrysogenum (ATCC 10106) (đối chứng dương).
Thư mục tài liệu tham khảo
[1] Trần Nhân Dũng (2011). Sổ tay thực hành sinh học phân tử. Nhà xuất bản Đại học Cần Thơ, 175 trang.
[2] TCVN 1-2:2008 Xây dựng tiêu chuẩn - Phần 2: Quy định về trình bày và thể hiện nội dung tiêu chuẩn quốc gia
[3] Nghị định số 86/2012/NĐ-CP của Chính phủ: Quy định chi tiết và hướng dẫn thi hành một số điều của Luật đo lường
[4] TCVN 7715-2:2007 (ISO 10272-2: 2006) về Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp phát hiện và định lượng Campylobacter spp - Phần 2: Kỹ thuật đếm khuẩn lạc.
[5] Nguyễn Xuân Trường, Nguyễn Thị Thu, Vũ Hiền Anh, Nông Thị Huệ, Nguyễn Xuân Cảnh, Phạm Hồng Hiển (2024). Phân lập và tuyền chọn nấm Penicillium spp. có khả năng phân giải hợp chất kali khó tan. Tạp chí Khoa học và Công nghệ Nông nghiệp Việt Nam, số 01 (152): 57-63.
[6] Maren A Klich (2002). Identification of common Aspergillus species. Pulished by the Central bureau voor Schimmelcutues, Utrecht, the Nethrlands. 107 pp.
[7] TCVN 12365-2:2018 (ISO 16140-2:2016), Vi sinh vật trong chuỗi thực phẩm - Xác nhận giá trị sử dụng phương pháp - Phần 2: Quy trình xác nhận giá trị sử dụng phương pháp thay thế so với phương pháp chuẩn (năm 2018)
[8] Hamid Ur Rahman , Xiaofeng Yue , Xianfeng Ren , Wen Zhang , Qi Zhang & Peiwu Li (2020): Multiplex PCR assay to detect Aspergillus, Penicillium and Fusarium species simultaneously, Food Additives & Contaminants: Part A, https://doi.org/10.1080/19440049.2020.1810860
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 14387:2025 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 14387:2025 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 14387:2025 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 14387:2025 DOC (Bản Word)