- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 12272:2018 Đũa ăn
| Số hiệu: | TCVN 12272:2018 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Y tế-Sức khỏe , Công nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
2018 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 12272:2018
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 12272:2018
TIÊU CHUẨN QUỐC GIA
TCVN 12272:2018
ĐŨA ĂN
Chopsticks
Lời nói đầu
TCVN 12272:2018 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC 166 Dụng cụ bằng đồ gốm sứ và gốm thủy tinh tiếp xúc với thực phẩm biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
ĐŨA ĂN
Chopsticks
1 Phạm vi áp dụng
Tiêu chuẩn này quy định các yêu cầu cho đũa ăn thành phẩm làm bằng tre, gỗ, nhựa tổng hợp và kim loại.
2 Thuật ngữ định nghĩa
Trong tiêu chuẩn này áp dụng thuật ngữ và định nghĩa sau:
2.1
Đũa ăn (chopsticks)
Dụng cụ bao gồm một cặp thanh có cùng hình dạng và kích thước, được làm bằng tre, gỗ, nhựa tổng hợp và kim loại, tiếp xúc trực tiếp với thực phẩm.
3 Yêu cầu
3.1 Ngoại quan
a) đũa ăn phải có bề mặt sạch, trơn nhẵn, không bị rạn, nứt, xước và không có mùi khó chịu.
b) đũa ăn phải có kết cấu cân đối trừ trường hợp đặc biệt theo thỏa thuận của các bên liên quan;
c) các mép phải được bo tròn, không có bạt mép hoặc gờ sắc;
d) đũa bằng kim loại phải bóng đều, không có vết rỗ hoặc dây màu, không han gỉ.
3.2 Yêu cầu hóa học
3.2.1 Đũa ăn bằng tre, gỗ
Đũa ăn bằng tre, gỗ phải đáp ứng các yêu cầu quy định trong Bảng 1.
Bảng 1 - Yêu cầu đối với đũa ăn bằng tre, gỗ
| Thứ tự | Chỉ tiêu | Mức giới hạn mg/kg | Phương pháp thử |
| 1 | Lưu huỳnh dioxit (SO2) | 600 | Phụ lục A |
| 2 | Formaldehyt | 80 | |
| 3 | Antimon (Sb) | 0,2 | |
| 4 | Arsen (As) | 0,2 | |
| 5 | Cadimi (Cd) | 0,2 | |
| 6 | Chì (Pb) | 2 |
3.2.2 Đũa ăn bằng nhựa tổng hợp
3.2.2.1 Yêu cầu chung
Đũa ăn bằng nhựa tổng hợp phải đáp ứng các yêu chung được quy định trong Bảng 2 và Bảng 3.
Bảng 2 - Thử vật liệu
| Thứ tự | Chỉ tiêu | Mức giới hạn μg/g | Phương pháp thử |
| 1 | Cadimi (Cd) | 100 | Phụ lục B |
| 2 | Chì (Pb) | 100 |
Bảng 3 - Thử thôi nhiễm
| Thứ tự | Chỉ tiêu | Điều kiện thử | Dung dịch ngâm thôi | Mức giới hạn μg/ml | Phương pháp thử |
| 1 | Tổng hàm lượng kim loại nặng | 95 °C trong 30 min | Axit axetic 4% | 1 | Phụ lục B |
| 2 | Hàm lượng kali permanganat (KMnO4) tiêu tốn [1] | Nước [2] | 10 | ||
| [1] Không áp dụng cho đũa ăn có thành phần chính là nhựa phenol, nhựa melamin và nhựa ure. [2] Nước cất Loại 2 phù hợp với TCVN 4851:1989 (ISO 3696:1987). | |||||
3.2.2.2 Đũa ăn làm từ nhựa phenol, melamin và ure
Đũa ăn được làm từ nhựa phenol, melamin và ure phải phù hợp với các yêu cầu quy định trong Bảng 4.
Bảng 4 - Thử thôi nhiễm
| Thứ tự | Chỉ tiêu | Điều kiện ngâm thôi | Dung dịch ngâm thôi | Mức giới hạn μg/ml | Phương pháp thử |
| 1 | Phenol | 95°C trong 30 min | Nước [1] | 5 | Phụ lục B |
| 2 | Formaldehyt | Âm tính | |||
| 3 | Cặn khô | 25°C trong 1 h | Heptan | 30 | |
| 60°C trong 30 min | Etanol 20% | ||||
| 95°C trong 30 min | Nước [1] | ||||
| Axit axetic 4% | |||||
| [1] Nước cất Loại 2 phù hợp với TCVN 4851:1989 (ISO 3696:1987) | |||||
3.2.2.3 Đũa ăn làm từ nhựa formaldehyt
Đũa ăn được làm từ nhựa formaldehyt phải phù hợp với các yêu cầu quy định trong Bảng 5.
Bảng 5 - Thử thôi nhiễm
| Thứ tự | Chỉ tiêu | Điều kiện ngâm thôi | Dung dịch ngâm thôi | Mức giới hạn μg/ml | Phương pháp thử |
| 1 | Phenol | 95 °C trong 30 min | Nước [1] | Âm tính | Phụ lục B |
| 2 | Formaldehyt | Âm tính | |||
| 3 | Cặn khô | Axit axetic 4 % | 30 | ||
| [1] Nước cất Loại 2 phù hợp với TCVN 4851:1989 (ISO 3696:1987). | |||||
3.2.2.4 Đũa ăn làm từ nhựa polyvinyl clorua (PVC)
Đũa ăn làm từ nhựa polyvinyl clorua (PVC) phải phù hợp với các yêu cầu quy định tại Bảng 6 và Bảng 7.
Bảng 6 - Thử vật liệu
| Thứ tự | Chỉ tiêu | Mức giới hạn μg/g | Phương pháp thử |
| 1 | Vinyl clorua | 1 | Phụ lục B |
| 2 | Cresyl phosphat | 1 | |
| 3 | Các hợp chất dibutyl thiếc | 50 |
Bảng 7 - Thử thôi nhiễm
| Thứ tự | Chỉ tiêu | Điều kiện thử | Dung dịch ngâm thôi | Mức giới hạn μg/ml | Phương pháp thử |
| 1 | Cặn khô | 25 °C trong 1 h | Heptan | 150 | Phụ lục B |
| 60 °C trong 30 min | Etanol 20% | 30 | |||
| Nước[1] | |||||
| Axit axetic 4% | |||||
| [1] Nước cất Loại 2 phù hợp với TCVN 4851:1989 (ISO 3696:1987). | |||||
3.2.2.5 Đũa ăn làm từ nhựa polyetylen và polypropylen (PE và PP)
Đũa ăn làm từ nhựa polyetylen và polypropylen (PE và PP) phải phù hợp với các yêu cầu quy định trong Bảng 8:
Bảng 8 - Thử thôi nhiễm
| Thứ tự | Chỉ tiêu kiểm tra | Điều kiện ngâm thôi | Dung dịch ngâm thôi | Mức giới hạn μg/ml | Phương pháp thử |
| 1 | Cặn khô | 25 °C trong 1 h | Heptan | 30 | Phụ lục B |
| 60 °C trong 30 min | Etanol 20 % | ||||
| 95 °C trong 30 min | Nước[1] | ||||
| Axit axetic 4% | |||||
| [1] Nước cất Loại 2 phù hợp với TCVN 4851:1989 (ISO 3696:1987). | |||||
3.2.2.6 Đũa ăn làm từ nhựa polystyren (PS)
Đũa ăn làm từ nhựa polystyren (PS) phải phù hợp với các yêu cầu quy định tại Bảng 9 và Bảng 10.
Bảng 9 - Thử vật liệu
| Thứ tự | Chỉ tiêu | Mức giới hạn mg/g | Phương pháp thử |
| 1 | Tổng số chất bay hơi (styren, tuluen, etylbenzen, n- propyl benzen) | 5 | Phụ lục B |
| 2 | Polylstyren trương nở (khi dùng nước sôi) | 2 | |
| 3 | Styre và etylbenzen | 1 |
Bảng 10 - Thử thôi nhiễm
| Thứ tự | Chỉ tiêu kiểm tra | Điều kiện ngâm thôi | Dung dịch ngâm thôi | Mức giới hạn μg/ml | Phương pháp thử |
| 1 | Cặn khô | 25 °C trong 1 h | Heptan | 240 | Phụ lục B |
| 60 °C trong 30 min | Etanol 20 % | 30 | |||
| 95 °C trong 30 min | Nước[1] | ||||
| Axit axetic 4% | |||||
| [1] Nước cất Loại 2 phù hợp với TCVN 4851:1989 (ISO 3696:1987). | |||||
3.2.2.7 Đũa ăn làm từ nhựa polyvinyliden clorua (PVDC)
Đũa ăn làm từ nhựa polyvinylden vlorua (PVDC) phải phù hợp với các yêu cầu quy định tại Bảng 11 và Bảng 12.
Bảng 11 - Thử vật liệu
| Thứ tự | Chỉ tiêu | Mức giới hạn μg/g | Phương pháp thử |
| 1 | Bari | 100 | Phụ lục B |
| 2 | Vinyliden clorua | 6 |
Bảng 12 - Thử thôi nhiễm
| Thứ tự | Chỉ tiêu kiểm tra | Điều kiện ngâm thôi | Dung dịch ngâm thôi | Mức giới hạn μg/ml | Phương pháp thử |
| 1 | Cặn khô | 25 °C trong 1 h | Heptan | 30 | Phụ lục B |
| 60 °C trong 30 min | Etanol 20 % | ||||
| 95 °C trong 30 min | Nước[1] | ||||
| Axit axetic 4% | |||||
| [1] Nước cất Loại 2 phù hợp với TCVN 4851:1989 (ISO 3696:1987). | |||||
3.2.2.8 Đũa ăn làm từ nhựa polyetylen terephtalat (PET)
Đũa ăn làm từ nhựa polyetylen terephtalat (PET) phải phù hợp với các yêu cầu quy định tại Bảng 13.
Bảng 13 - Thử thôi nhiễm
| Thứ tự | Chỉ tiêu | Điều kiện ngâm thôi | Dung dịch ngâm thôi | Mức giới hạn μg/ml | Phương pháp thử |
| 1 | Antimony | 60 °C trong 30 min | Axit axetic 4% | 0,05 | Phụ lục B |
| 2 | Germani | 0,1 | |||
| 3 | Cặn khô | 25 °C trong 1 h | Heptan | 30 | |
| 60 °C trong 30 min | Etanol 20 % | ||||
| 95 °C trong 30 min | Nước [1] | ||||
| Axit axetic 4% | |||||
| [1] Nước cất Loại 2 phù hợp với TCVN 4851:1989 (ISO 3696:1987). | |||||
3.2.2.9 Đũa ăn làm từ nhựa polymetyl metacrylat (PMMA)
Đũa ăn làm từ nhựa polymetyl metacrylat (PMMA) phải phù hợp với các yêu cầu quy định tại Bảng 14.
Bảng 14 - Thử thôi nhiễm
| Thứ tự | Chỉ tiêu | Điều kiện ngâm thôi | Dung dịch ngâm thôi | Mức giới hạn μg/ml | Phương pháp thử |
| 1 | Metyl metacrylat | 60 °C trong 30 min | Etanol 20 % | 15 | Phụ lục B |
| 2 | Cặn khô | 25 °C trong 1 h | Heptan | 30 | |
| 60 °C trong 30 min | Etanol 20 % | ||||
| 95°C trong 30 min | Nước [1] | ||||
| Axit axetic 4 % | |||||
| [1] Nước cất Loại 2 phù hợp với TCVN 4851:1989 (ISO 3696:1987). | |||||
3.2.2.10 Đũa ăn làm từ nhựa nylon (PA)
Đũa ăn làm từ nhựa nylon phải phù hợp với các yêu cầu quy định tại Bảng 15.
Bảng 15 - Thử thôi nhiễm
| Thứ tự | Chỉ tiêu | Điều kiện ngâm thôi | Dung dịch ngâm thôi | Mức giới hạn μg/ml | Phương pháp thử |
| 1 | Caprolactam | 25 °C trong 1 h | Etanol 20 % | 15 | Phụ lục B |
| 2 | Cặn khô | 25 °C trong 1 h | Heptan | 30 | |
| 60 °C trong 30 min | Etanol 20 % | ||||
| 95 °C trong 30 min | Nước[1] | ||||
| Axit axetic 4 % | |||||
| [1] Nước cất Loại 2 phù hợp với TCVN 4851:1989 (ISO 3696:1987). | |||||
3.2.2.11 Đũa ăn làm từ nhựa polymetyl penten (PMP)
Đũa ăn làm từ nhựa polymetyl penten (PMP) phải phù hợp với các yêu cầu quy định tại Bảng 16.
Bảng 16 - Thử thôi nhiễm
| Thứ tự | Chỉ tiêu | Điều kiện ngâm thôi | Dung dịch ngâm thôi | Mức giới hạn μg/ml | Phương pháp thử |
| 1 | Cặn khô | 25 °C trong 1 h | Heptan | 120 | Phụ lục B |
| 60 °C trong 30 min | Etanol 20 % | 30 | |||
| 95 °C trong 30 min | Nước[1] | ||||
| Axit axetic 4 % | |||||
| [1] Nước cất Loại 2 phù hợp với TCVN 4851:1989 (ISO 3696:1987). | |||||
3.2.2.12 Đũa ăn làm từ nhựa polycacbonat (PC)
Đũa ăn làm từ nhựa Polycacbonat phải phù hợp với các yêu cầu quy định tại Bảng 17 và Bảng 18.
Bảng 17 - Thử vật liệu
| Thứ tự | Chỉ tiêu | Mức giới hạn μg/g | Phương pháp thử |
| 1 | Bis-phenol A (phenol, p-t-butylphenol) | 500 | Phụ lục B |
| 2 | Diphenyl cacbonat | 500 | |
| 3 | Amin (trietylamin và tributyiamin) | 1 |
Bảng 18 - Thử thôi nhiễm
| Thứ tự | Chỉ tiêu | Điều kiện ngâm thôi | Dung dịch ngâm thôi | Mức giới hạn μg/ml | Phương pháp thử |
| 1 | Bisphenol A (Phenol, p-t-butylphenol) | 25 °C trong 1 h | Heptan | 2,5 | Phụ lục B |
| 60 °C trong 30 min | Etanol 20 % | ||||
| 95 °C trong 30 min | Nước[1] | ||||
| Axit axetic 4 % | |||||
| 2 | Cặn khô | 25 °C trong 1 h | Heptan | 30 | |
| 60 °C trong 30 min | Etanol 20 % | ||||
| 95 °C trong 30 min | Nước [1] | ||||
| Axit axetic 4 % | |||||
| [1] Nước cất Loại 2 phù hợp với TCVN 4851:1989 (ISO 3696:1987). | |||||
3.2.2.13 Đũa ăn làm từ nhựa polylactic axit (PLA)
Đũa ăn làm từ nhựa polylactic axit (PLA) phải phù hợp với các yêu cầu quy định tại Bảng 19:
Bảng 19 - Thử thôi nhiễm
| Thứ tự | Chỉ tiêu | Điều kiện ngâm thôi | Dung dịch ngâm thôi | Mức giới hạn μg/ml | Phương pháp thử |
| 1 | Axit lactic tổng số | 60 °C trong 30 min | Nước[1] | 30 | Phụ lục B |
| 2 | Cặn khô | 25 °C trong 1 h | Heptan | 30 | |
| 60 °C trong 30 min | Etanol 20 % | ||||
| 95 °C trong 30 min | Nước[1] | ||||
| Axit axetic 4 % | |||||
| [1] Nước cất Loại 2 phù hợp với TCVN 4851:1989 (ISO 3696:1987). | |||||
3.2.2.14 Đũa ăn làm từ nhựa polyvinyl alcol (PVA)
Đũa ăn làm từ nhựa polyvinyl alcol (PVA) phải phù hợp với các yêu cầu quy định tại Bảng 20.
Bảng 20 - Thử thôi nhiễm
| Thứ tự | Chỉ tiêu | Điều kiện ngâm thôi | Dung dịch ngâm thôi | Mức giới hạn μg/ml | Phương pháp thử |
| 1 | Cặn khô | 25 °C trong 1 h | Heptan | 30 | Phụ lục B |
| 60 °C trong 30 min | Etanol 20 % | ||||
| 95 °C trong 30 min | Nước[1] | ||||
| Axit axetic 4 % | |||||
| [1] Nước cất Loại 2 phù hợp với TCVN 4851:1989 (ISO 3696:1987). | |||||
3.2.3 Đũa ăn bằng kim loại
Đũa ăn bằng kim loại phải đáp ứng yêu cầu quy định trong Bảng 21.
Bảng 21 - Thử thôi nhiễm
| Thứ tự | Chỉ tiêu | Điều kiện thử | Dung dịch ngâm thôi | Mức giới hạn μg/ml | Phương pháp thử |
| 1 | Arsen (As) | 95 °C trong 30 min | Nước[1] | 0,2 | Phụ lục C |
| 60 °C trong 30 min | axit xitric 0,5% | ||||
| 2 | Cadimi (Cd) | 95 °C trong 30 min | Nước [1] | 0,1 | |
| 60 °C trong 30 min | axit xitric 0,5% | ||||
| 3 | Chì (Pb) | 95 °C trong 30 min | Nước[1] | 0,4 | |
| 60 °C trong 30 min | axit xitric 0,5% | ||||
| 4 | Phenol [2] | 95 °C trong 30 min | Nước [1] | 5 | |
| 5 | Formaldehyt [2] | Nước [1] | Âm tính | ||
| 6 | Cặn khô [2] | 25 °C trong 1 h | Heptan | 30 | |
| 60 °C trong 30 min | Etanol 20 % | ||||
| 95 °C trong 30 min | Nước [1] | ||||
| Axit axetic 4 % | |||||
| 7 | Epiclorohyđrin [2], [3] | 25 °C trong 2 h | Pentan | 0,5 | |
| 8 | Vinylclorua [2] | Không quá 5°C trong 24 h | Etanol 20 % | 0,05 | |
| [1] Nước cất Loại 2 phù hợp với TCVN 4851:1989 (ISO 3696:1987). [2] Chỉ áp dụng cho đũa ăn được phủ một lớp nhựa tổng hợp tiếp xúc trực tiếp với thực phẩm. [3] Dung dịch rửa giải đã được cô đặc 5 lần, miễn là nồng độ trong dung dịch rửa giải không quá 25 μg/ml. | |||||
3.3 Yêu cầu vi sinh
Đũa ăn bằng tre, gỗ phải phải đáp ứng các yêu cầu quy định trong Bảng 22.
Bảng 22 - Yêu cầu vi sinh
| Thứ tự | Tên chỉ tiêu | Mức giới hạn | Phương pháp thử |
| 1 | Tổng số vi sinh vật hiếu khí, CFU/g | 1 000 | Phụ lục D |
| 2 | Vi sinh vật gây bệnh (P. aeruginosa, S. aureus, Salmonella), CFU/g | Không phát hiện | Phụ lục E |
| 3 | Nấm mốc, CFU/g | 100 | Phụ lục D |
4 Lấy mẫu
Tử một lô sản phẩm lấy ngẫu nhiên, đại diện các gói đũa ăn. Các gói đũa ăn được dùng để thử phải là gói nguyên, chưa được mở. Mẫu thử được lấy từ đơn vị bao gói nhỏ nhất, số lượng mẫu phụ thuộc vào các chỉ tiêu cần thử đối với mỗi loại đũa ăn.
5 Ghi nhãn, bao gói và bảo quản
5.1 Ghi nhãn
Trên bao gói của đũa ăn phải được ghi nhãn bền, đầy đủ và rõ ràng với ít nhất các thông tin sau:
a) tên, thương hiệu, địa chỉ nhà sản xuất hoặc nhập khẩu, phân phối;
b) tên và nhãn hiệu sản phẩm
c) kích thước, số lượng đôi đũa ăn trong mỗi bao gói;
d) vật liệu chế tạo sản phẩm;
e) viện dẫn tiêu chuẩn này.
5.2 Bao gói
Vật liệu bao gói tiếp xúc trực tiếp với sản phẩm phải không ảnh hưởng đến chất lượng sản phẩm. Bao gói phải kín và chắc chắn để không bị rách vỡ khi vận chuyển và nhiễm bẩn trong điều kiện bảo quản thông thường.
5.3 Bảo quản
Đũa ăn phải được bảo quản tại nơi thoáng mát, khô ráo sạch sẽ, tránh côn trùng gặm nhấm, không gần nguồn nhiệt, và tránh ánh sáng mặt trời chiếu trực tiếp.
Phụ lục A
(quy định)
Phương pháp thử các chỉ tiêu hóa học cho đũa ăn bằng tre, gỗ
CHÚ THÍCH Trừ khi có quy định khác, hóa chất, thuốc thử được sử dụng trong các phép phân tích này phải có chất lượng tinh khiết phân tích đã được công nhận.
A.1 Xác định hàm lượng lưu huỳnh dioxit (SO2)
A.1.1 Nguyên tắc: Axit hóa và làm nóng phần mẫu thử, sau đó tách cuốn lưu huỳnh dioxit qua luồng khí nitơ. Hấp thụ và oxi hóa lưu huỳnh dioxit bằng cách sục qua dung dịch hydro peroxit loãng trung tính. Sử dụng dung dịch chuẩn natri hydroxit để xác định axit sulfuric được tạo thành.
Kiểm tra việc xác định hàm lượng lưu huỳnh dioxit bằng cách cho bari sunfat kết tủa từ dung dịch được tạo thành.
A.1.2 Chuẩn bị mẫu thử: Chuyển 50 g mẫu đũa đã được cắt nhỏ hoặc lượng mẫu đũa có hàm lượng SO2 khoảng từ 500 μg đến 1500 μg vào bình C chưng cất Monier-Williams (xem Hình A.1).
A.1.3 Tiến hành tách cuốn: Sử dụng hệ tách cuốn Monier-Williams như Hình A.1, mở phễu tách B và chuyển định lượng phần mẫu thử vào bình C. Cho dòng khí nitơ thổi qua liên tục thông qua đầu vào D. Dòng nước lạnh chảy liên tục qua sinh hàn E. Kiểm tra các điểm nối để đảm bảo hệ thống hoàn toàn kín. Mở khóa bình B để axit clohydric chảy vào bình C và axit hóa mẫu.
Đun sôi từ từ các chất chứa trong bình, và duy trì điểm sôi, cho luồng khí nitơ lưu thông đều liên tục để có từ 1 đến 2 bọt khí/giây trong khoảng 30 min, tốc độ hồi lưu từ sinh hàn E đạt từ 80 giọt/phút đến 90 giọt/phút.
A.1.4 Xác định hàm lượng lưu huỳnh dioxit:
a) Phương pháp chuẩn độ
Chuẩn độ axit sulfuric được tạo ra ở ống G bằng dung dịch natri hydroxit 0,01 mol/l hoặc 0,1 mol/l tùy theo hàm lượng lưu huỳnh dioxit dự đoán với chỉ thị metyl đỏ.
Hàm lượng lưu huỳnh dioxit, tính bằng miligam trên kilôgam đũa ăn, được tính theo công thức sau:
![]()
trong đó
| 32,03: | là đương lượng gam của SO2 |
| V: | là thể tích của dung dịch natri hydroxit chuẩn độ, tính bằng ml; |
| M: | là nồng độ mol của dung dịch natri hydroxit; |
| M: | là khối lượng phần mẫu thử, tính bằng gam |
| 1 000: | là hệ số chuyển đơn vị sang kilôgam. |
b) phương pháp khối lượng
Chuyển toàn bộ dung dịch sau chuẩn độ ở a) vào cốc thủy tinh dung tích 400 ml, thêm 4 giọt axit clohydric 1M, thêm 10 ml bari clorua 10 %, để qua đêm. Lọc dung dịch qua chén Gooch hoặc giấy lọc chảy chậm. Tráng rửa bằng nước nóng 3 lần. Sấy khô ở nhiệt độ từ 105 °C đến 110 °C.
Hàm lượng lưu huỳnh dioxit, tính bằng miligam trên kilôgam đũa ăn, được tính theo công thức sau:
![]()
trong đó
mBaSO4: là khối lượng bari sunfat thu được, tính bằng miligam;
m: là khối lượng phần mẫu thử, tính bằng gam.
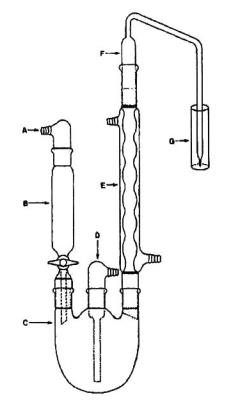
CHÚ DẪN
| A | Nắp đậy phễu chiết; | E | Sinh hàn |
| B | Phễu chiết | F | Ống thổi khí |
| C | Bình cầu ba cổ | G | Ống ngưng và đựng dung dịch hấp thụ |
| D | Nắp có lối thổi khí nitơ |
|
|
Hình A.1 - Hệ tách cuốn Monier-Williams
A.1.5 Xác định mẫu trắng: Xác định phép thử trắng bằng cả phương pháp chuẩn độ và khối lượng, hiệu chỉnh kết quả tương ứng.
A.2 Xác định hàm lượng formaldehyt
A.2.1 Nguyên tắc: Formaldehyt được chiết từ mẫu bằng nước ở 40°C. Sau đó lượng formaldehyt được xác định bằng cách đo độ hấp thụ quang tại bước sóng 412 nm.
A.2.2 Chuẩn bị mẫu: Từ mẫu ban đầu, cắt hai mẫu thử thành các mẩu vụn, và cân khoảng 2,5 g các mẩu vụn này với độ chính xác đến 10 mg. Nếu hàm lượng formaldehyt thấp thì tăng khối lượng mẫu thử lên 5 g để đạt được độ chính xác theo yêu cầu.
Tiếp theo, cho các mẩu vụn đã cân vào trong một bình tam giác bằng thủy tinh dung tích 250 ml có nút nhám và thêm vào 100 ml nước. Đậy chặt nút và đặt bình vào bể cách thủy ở nhiệt độ (40 ± 2) °C trong (60 ± 5) min. Lắc bình ít nhất cứ 5 min một lần, đảm bảo rằng mẫu thử được ngấm ướt hoàn toàn. Sau đó lọc dung dịch vào một bình khác qua phễu lọc. Nếu mẫu thử khó đạt được ngấm ướt hoàn toàn, thì phải sử dụng bể cách thủy có lắc cơ học.
A.2.3 Chuẩn bị thuốc thử
A.2.3.1 Thuốc thử axetylaxeton (thuốc thử Nash): Hòa tan 150 g amoni axetat trong khoảng 800 ml nước, cho thêm 3 ml axit axetic băng và 2 ml axetyl axeton, chuyển hỗn hợp vào bình định mức 1000 ml và định mức tới vạch bằng nước. Bảo quản dung dịch vừa pha trong chai tối màu. Bảo quản thuốc thử này 12 h trước khi sử dụng. Thuốc thử này cũng có thể sử dụng được sau một khoảng thời gian bảo quản dài, ít nhất sáu tuần.
A.2.3.2 Dung dịch formaldehyt chuẩn: Chuẩn bị dung dịch formaldehyt gốc có nồng độ khoảng 1500 mg/l bằng cách pha loãng 3,8 ml dung dịch formaldehyt 37 % trong nước thành 1 lít.
A.2.3.3 Xác định chính xác nồng độ của formaldehyt chuẩn gốc: Dung dịch formaldehyt chuẩn gốc được xác định nồng độ chính xác bằng phương pháp cho một phần dung dịch gốc tác dụng với natri sulfit dư rồi chuẩn độ ngược với dung dịch axit tiêu chuẩn với chất chỉ thị thymolphtalein. Tiến hành như sau:
Dùng pipet 50 ml lấy dung dịch natri sulfit nồng độ 1 mol/l cho vào bình tam giác bằng thủy tinh dung tích 150 ml. Cho thêm hai giọt chất chỉ thị thymolphtalein. Thêm vài giọt axit sulfuric chuẩn 0,01 mol/l nếu cần thiết, cho đến khi màu xanh biến mất.
Dùng pipet 10 ml lấy dung dịch gốc formaldehyt cho vào bình tam giác (màu xanh sẽ xuất hiện lại). Tiến hành chuẩn độ với axit sulfuric chuẩn 0,01 mol/l cho đến khi màu xanh biến mất. Ghi lại lượng axit sulfuric đã dùng để chuẩn độ. Lượng axit sulfuric dùng để chuẩn độ khoảng 25 ml. Thực hiện ít nhất hai lần để lấy kết quả trung bình.
CHÚ THÍCH Có thể sử dụng máy đo pH đã hiệu chuẩn thay thế cho chất chỉ thị thymolphtalein, trong trường hợp đó điểm cuối của quá trình chuẩn độ đạt được ở pH = 9,5.
1 ml axit sulfuric chuẩn 0,01 mol/l tương đương với 0,6 mg formaldehyt.
Ghi lại nồng độ chính xác của dung dịch gốc đã được chuẩn hóa. Dung dịch gốc này được lưu giữ trong bốn tuần và dùng để chuẩn bị pha loãng dung dịch chuẩn.
A.2.3.4 Dung dịch dimedon trong etanol: Hòa tan 1 g dimedon (dimetyl-dihyđro resorcinol hoặc 5,5-dimetyl xyclohexanedion) trong dung dịch etanol rồi thêm etanol đến 100 ml. Chuẩn bị dung dịch này ngay trước khi sử dụng.
A.2.4 Cách tiến hành:
Cho 5 ml dung dịch chiết từ mẫu thử đã lọc vào một ống nghiệm thủy tinh và 5 ml dung dịch formaldehyt chuẩn vào các ống khác. Thêm 5 ml thuốc thử axetyl axeton vào mỗi ống nghiệm và lắc đều. Đặt các ống nghiệm này vào bể cách thủy ở (40 ± 2) °C trong khoảng thời gian (30 ± 5) min và sau đó để ở nhiệt độ phòng trong khoảng (30 ± 5) min nữa. Cho 5 ml dung dịch thuốc thử axetyl axeton vào ống nghiệm chứa 5 ml nước đã được xử lý theo cùng một cách như với mẫu thuốc thử trắng. Sử dụng máy đo quang phổ có cuvet dày 10 mm để đo độ hấp thụ đối chứng với nước tại bước sóng 412 nm.
Tiến hành ít nhất hai phép thử song song.
Nếu hàm lượng formaldehyt trong mẫu lớn hơn 500 mg/kg, hoặc nếu các mức tính toán được từ phép thử sử dụng tỉ lệ 5:5 lớn hơn 500 mg/kg thì pha loãng dung dịch chiết để thu được độ hấp thụ trong dải của đường chuẩn (hệ số pha loãng được sử dụng khi tính toán kết quả).
Để tính toán các ảnh hưởng do dung dịch mẫu thử bị nhiễm bẩn hoặc bị biến màu, cho 5 ml dung dịch thử vào một ống nghiệm riêng biệt, và thêm 5 ml nước thay cho thuốc thử axetyl axeton và tiến hành xử lý giống như trên. Xác định độ hấp thụ của dung dịch này giống như trên nhưng sử dụng nước làm dung dịch đối chứng.
A.2.5 Tính toán và biểu thị kết quả
Đối với từng mẫu thử, hiệu chỉnh độ hấp thụ của mẫu thử như sau:
A = As - Ab - Ad
Trong đó
| A: | là độ hấp thụ đã được hiệu chỉnh; |
| As: | là độ hấp thụ đo được của mẫu thử; |
| Ab | là độ hấp thụ đo được của thuốc thử trắng; |
| Ad | là độ hấp thụ đo được của mẫu thử trắng (chỉ trong trường hợp dung dịch thử bị nhiễm bẩn hoặc biến màu). |
Xác định lượng formaldehyt theo μg/ml từ đường chuẩn, sử dụng giá trị độ hấp thụ đã được hiệu chỉnh.
Hàm lượng formaldehyt chiết được từ mỗi mẫu thử (WF), tính bằng mg/kg, được tính theo công thức sau:
![]()
trong đó
ρ: là nồng độ của formaldehyt trong dung dịch theo mg/l, đọc từ đồ thị đường chuẩn;
m: là khối lượng của mẫu thử, tính bằng gam.
A.2.6 Phép thử khẳng định
Nếu có nghi ngờ về độ hấp thụ không phải do formaldehyt mà do các tác nhân mang màu khác được chiết ra thì tiến hành một phép thử để xác nhận, sử dụng dimedon.
CHÚ THÍCH Dimedon phản ứng với formaldehyt do đó dung dịch sẽ không thấy màu.
Tiến hành phép thử xác nhận với dimedon, cho 5 ml dung dịch mẫu thử vào một ống nghiệm (nếu cần pha loãng), thêm 1 ml dung dịch dimedon trong etanol và lắc.
Đặt ống nghiệm vào bể cách thủy ở nhiệt độ (40 ± 2) °C trong khoảng (10 ± 1) min, sau đó thêm 5 ml thuốc thử axetyi axeton, lắc ống nghiệm và tiếp tục làm nóng dung dịch trong bể cách thủy ở nhiệt độ (40 ± 2) °C trong khoảng (30 ± 5) min. Để yên dung dịch ở nhiệt độ phòng trong khoảng thời gian (30 ± 5) min. Xác định độ hấp thụ của dung dịch, sử dụng dung dịch đối chứng được chuẩn bị theo cách nêu trên, nhưng sử dụng nước thay cho dung dịch mẫu. Không xác định được độ hấp thụ của formaldehyt ở bước sóng 412 nm.
A.3 Xác định hàm lượng antimon (Sn)
A.3.1 Chuẩn bị dung dịch thử: rửa sạch mẫu bằng nước cất. Ngâm mẫu trong dung dịch axit axetic theo tỷ lệ 2 ml/1cm2 mẫu tại 95 °C trong thời gian 30 min.
A.3.2 Chuẩn bị dung dịch antimon chuẩn gốc: cân chính xác 1,874 g triclorua antimon và hòa tan trong một lượng nhỏ axit clohydric (1:2, V/V), sau đó thêm axit clohydric (1:10, V/V) để định mức đến đủ 1 000 ml. Dung dịch antimon chuẩn gốc có nồng độ 1 mg/ml.
A.3.3 Chuẩn bị dung dịch antimon chuẩn làm việc: lấy 1 ml dung dịch antimon chuẩn gốc, cho thêm axit axetic 4% định mức đến đủ 100 ml, lấy 1 ml dung dịch này và thêm axit axetic 4 % định mức đến đủ 200 ml. Dung dịch antimon chuẩn làm việc có nồng độ 0,05 μg/ml.
A.3.4 Cách tiến hành
Thực hiện phép phân tích antimon bằng phương pháp quang phổ hấp thụ nguyên tử hoặc quang phổ phát xạ plasma với dung dịch thử và dung dịch antimon chuẩn làm việc và so sánh các kết quả.
A.4. Xác định hàm lượng arsen (As)
A.4.1 Chuẩn bị dung dịch thử: rửa sạch mẫu bằng nước cất. Ngâm mẫu trong nước cất theo tỷ lệ 2 ml/1 cm2 mẫu tại 95 °C trong thời gian 30 min.
A.4.2 Chuẩn bị dung dịch arsen chuẩn gốc: nghiền mịn arsen trioxit, sấy khô trong 4 h ở 105 °C, sau đó lấy 0,10 g, thêm 5 ml dung dịch NaOH (1:5, V/V) và hòa tan. Trung hòa dung dịch này bằng axit sulfuric (1:20, V/V), thêm 10 ml axit sulfuric dư (1:20, V/V), cho thêm nước vừa đun sôi và để nguội định mức đến đủ 1 000 ml. Nồng độ dung dịch chuẩn gốc là 0,1 μg /ml.
A.4.3 Chuẩn bị dung dịch arsen chuẩn làm việc: lấy 10 ml dung dịch arsen chuẩn gốc, thêm 10 ml axit sulfuric (1:20, V/V), cho thêm nước vừa đun sôi và để nguội định mức đến đủ 1 000 ml. Nồng độ dung dịch chuẩn làm việc là 0,1 μg /ml. Chỉ chuẩn bị dung dịch chuẩn làm việc ngay trước khi sử dụng và lưu trữ trong bình kín.
A.4.4 Chuẩn bị dung dịch hấp thụ arsen: hòa tan 0,5 g bạc N,N-đietyl đithiocacbamat đến vừa đủ 100 ml và bảo quản dung dịch này trong lọ thủy tinh sẫm màu có nút nhám ở chỗ mát.
A.4.5 Bình phản ứng
Kích thước tính bằng milimét
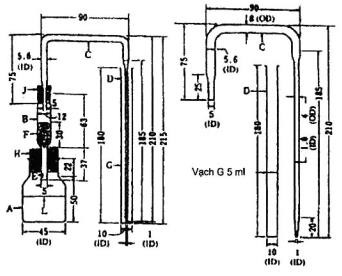
CHÚ DẪN
| A: | bình phản ứng (dung tích đến vai bình khoảng 70 ml) |
| B: | ống dẫn hơi |
| C: | ống thủy tinh (đường kính trong 5,6 mm); đường kính trong của đầu chuôi của phần cắm vào ống hấp thụ là 1mm. |
| D: | ống hấp thụ (đường kính trong 10mm) |
| E: | lỗ nhỏ trên ống B |
| F: | bông thủy tinh (khoảng 0,2 g) |
| G: | vạch chia độ 5 ml trên ống hấp thụ |
| H và J: | nút thủy tinh |
| L: | vạch chia độ 40 ml trên bình A |
Hình A.2 - Hệ thống bình phản ứng phù hợp
A.4.6 Xác định asen bằng phương pháp so màu
Tiến hành phép thử trên thiết bị được mô tả ở A.4.5, cho một ít bông thủy tinh vào ống dẫn hơi B đến độ cao khoảng 30 ml. Sau khi làm ẩm đều bằng hỗn hợp đồng thể tích của thuốc thử chì axetat và nước, dùng một lực hút nhẹ để loại bỏ giọt chất lỏng thừa. Nạp ống dẫn hơi thẳng đứng qua tâm của nút cao su H vào bình phản ứng A sao cho lỗ nhỏ E vừa ở phía dưới của nút cao su. Đậy chặt nút cao su J vào miệng ống B. Lắp ống thủy tinh C thẳng đứng qua nút J. Lắp ống dẫn hơi C qua nút cao su J. Rót dung dịch thử vào bình phản ứng và thêm một giọt thuốc thử xanh brom phenol. Thêm vào dung dịch này 5 ml axit clohydric (1:2, V/V) và 5 ml kali iođua. Đợi từ 2 đến 3 min, thêm 5 ml thiếc (II) clorua và để 10 min ở nhiệt độ phòng. Thêm nước đến đủ 40 ml, thêm 2 g kẽm (loại dùng để thử arsen) và ngay lập tức đóng nút cao su nối ống thoát khí và ống thủy tinh. Đưa mũi hẹp của ống thủy tinh gần chạm đáy ống hấp thụ, trong ống hấp thụ đã chứa sẵn 5 ml dung dịch hấp thụ arsen.
Tiếp theo, đặt bình phản ứng trong nước ngập đến vai bình ở 25 °C và để yên trong 1 h. Tháo ống hấp thụ và nếu cần thiết, thêm pyriđin đến đủ 5 ml. Dung dịch hấp thụ của dung dịch thử không được xuất hiện đậm màu hơn so với các màu dung dịch hấp thụ của dung dịch chuẩn.
Để xác định màu chuẩn, thực hiện các bước tương tự với dung dịch chuẩn như đối với dung dịch thử. Đặt cùng một lượng dung dịch thôi nhiễm như với dung dịch thử và 2,0 ml dung dịch arsen chuẩn vào bình phản ứng. Màu sắc biểu hiện bởi dung dịch hấp thụ là màu chuẩn.
A.4.7 Xác định asen bằng phương pháp quang phổ hấp thụ nguyên tử
Thực hiện phép phân tích asen được chiết như ở điều kiện (A.4.1) bằng phương pháp quang phổ hấp thụ nguyên tử với kỹ thuật hydrua hóa hoặc phương pháp quang phổ hấp thụ nguyên tử với kỹ thuật hóa hơi nguyên tử bằng nhiệt điện không ngọn lửa.
A.5 Xác định hàm lượng cadimi (Cd) và chì (Pb)
A.5.1 Chuẩn bị dung dịch thử: Rửa sạch mẫu bằng nước cất. Ngâm mẫu trong axit axetic 4 % theo tỷ lệ 2 ml/1 cm2 mẫu tại 95 °C trong thời gian 30 min.
A.5.2 Chuẩn bị dung dịch cadimi chuẩn gốc: Cân 100 mg cadimi, hòa tan trong 50 ml axit nitric 10%, cô trên bếp cách thủy. Sau đó thêm axit nitric 0,1 mol/l để hòa tan và định mức đến đủ 100 ml. Dung dịch cadimi chuẩn gốc này có nồng độ 1 mg/ml.
A.5.3 Chuẩn bị dung dịch cadimi chuẩn làm việc: Lấy chính xác 2 ml dung dịch cadimi chuẩn gốc, và thêm axit axetic 4 %, định mức đến đủ 100 ml. Lấy 1 ml dung dịch này và thêm axit axetic 4 % định mức đến đủ 200 ml. Nồng độ dung dịch cadimi chuẩn làm việc là 0,1 μg/ml.
A.5.4 Chuẩn bị dung dịch chì chuẩn gốc: Hòa tan 159,8 mg chì (II) nitrat trong 10 ml axit nitric 10 %, và thêm nước cất định mức đến đủ 100 ml. Dung dịch chì chuẩn gốc này có nồng độ 1 mg/ml.
A.5.5 Chuẩn bị dung dịch chì chuẩn làm việc: Lấy chính xác 8 ml dung dịch chì chuẩn gốc, thêm axit axetic 4 % và định mức đến đủ 100 ml. Lấy 1 ml dung dịch này và thêm axit axetic 4 % định mức đến đủ 200 ml. Dung dịch chì chuẩn làm việc có nồng độ 0,4 μg/ml.
A.5.6 Cách tiến hành
Xác định cadimi và chì trong dung dịch thử bằng phương pháp quang phổ hấp thụ nguyên tử hoặc quang phổ phát xạ plasma.
Phụ lục B
(quy định)
Phương pháp thử các chỉ tiêu hóa học cho đũa ăn bằng nhựa tổng hợp
CHÚ THÍCH Trừ khi có quy định khác, hóa chất, thuốc thử được sử dụng trong các phép phân tích này phải có chất lượng tinh khiết phân tích đã được công nhận.
B.1 Thử vật liệu
B.1.1 Xác định hàm lượng cadimi (Cd) và chì (Pb)
B.1.1.1 Chuẩn bị dung dịch thử: Cân 1,0 g mẫu (chính xác đến mg) cho vào đĩa bay hơi bằng sứ hoặc thủy tinh chịu nhiệt, thêm 2 ml axit sulfuric, gia nhiệt từ từ cho đến khi hết khói trắng bay ra từ axit sulfuric và phần lớn mẫu đã bị than hóa. Sau đó, cho đĩa vào nung trong lò tại 450 °C để quá trình than hóa xảy ra hoàn toàn, lặp lại quá trình thêm axit sulfuric và nung đối với cặn trên đĩa, để nguội. Thêm vào cặn 5 ml axit clohydric (1:2, V/V), trộn đều, và cho bay hơi trên bể cách thủy. Sau khi để nguội, thêm 20 ml axit nitric 0,1 mol/l, hòa tan, lọc và loại bỏ phần không tan, thu phần dịch lọc làm dung dịch thử.
B.1.1.2 Chuẩn bị dung dịch cadimi chuẩn gốc: Cân 100 mg cadimi, hòa tan trong 50 ml axit nitric 10%, cô trên bếp cách thủy. Sau đó thêm axit nitric 0,1 mol/l để hòa tan và định mức đến đủ 100 ml. Dung dịch cadimi chuẩn gốc này có nồng độ 1 mg/ml.
B.1.1.3 Chuẩn bị dung dịch cadimi chuẩn làm việc: Lấy chính xác 1 ml dung dịch cadimi chuẩn gốc, thêm axit nitric 0,1 mol/l đến đủ 200 ml. Dung dịch cadimi chuẩn làm việc này có nồng độ 5 μg/ml.
B.1.1.4 Chuẩn bị dung dịch chì chuẩn gốc: Hòa tan 159,8 mg chì (II) nitrat trong 10 ml axit nitric 10 %, và thêm nước cất định mức đến đủ 100 ml. Dung dịch chì chuẩn gốc này có nồng độ 1 mg/ml.
B.1.1.5 Chuẩn bị dung dịch chì chuẩn làm việc: Lấy chính xác 1 ml dung dịch chì chuẩn gốc, thêm axit nitric 0,1 mol/l định mức đến đủ 200 ml. Dung dịch chì chuẩn làm việc này có nồng độ 5 μg/ml.
B.1.1.6 Cách tiến hành
Dùng quang phổ hấp thụ nguyên tử hoặc quang phổ phát xạ plasma để xác định cadimi và chì trong dung dịch thử.
B.1.2 Xác định các hợp chất dibutyl thiếc
B.1.2.1 Chuẩn bị dung dịch thử: Cân 0,5 g mẫu (đã được cắt hoặc nghiền nhỏ) cho vào bình thủy tinh có nắp mài. Thêm 20 ml hỗn hợp axeton và hexan tỷ lệ 3:7 và một giọt axit clohydric, đậy chặt nắp bình và để qua đêm ở khoảng 40 °C, thỉnh thoảng lắc để trộn đều. Sau khi làm nguội, lọc lấy dịch, thu dịch lọc và dịch rửa, cô đến khoảng 1 ml trên máy cô quay chân không ở nhiệt độ không quá 40 °C. Sau đó, dùng hexan chuyển vào bình định mức 25 ml, thêm hexan đến 25 ml. Ly tâm hỗn hợp trong khoảng 10 min với tốc độ 2500 r/min và sử dụng lớp trên làm dung dịch thử. Thêm axeton và từ 2 đến 3 giọt axit clohydric vào 100 ml dibutyl thiếc diclorua và hòa tan, sau đó thêm axeton đến vừa đủ 100 ml. Lấy 1 ml dung dịch này, thêm hexan và từ 2 đến 3 giọt axit clohydric đến vừa đủ 1 000 ml, dung dịch chuẩn dibutyl thiếc có nồng độ 1 μg/ml.
B.1.2.2 Cách tiến hành
Lấy 2 ml mỗi loại dung dịch thử và dung dịch chuẩn dibutyltin, thêm 5 ml dung dịch đệm axit axetic - natri axetat và 1 ml thuốc thử natri tetraetylborat, sau đó đóng nút ngay và lắc mạnh trong 20 min. Để yên hỗn hợp trong khoảng 1 h ở nhiệt độ phòng, và loại bỏ lớp hexan. Lấy 1 μl dung dịch này, chạy sắc ký khí và khối phổ theo điều kiện sau.
| Cột sắc ký: | Sử dụng cột bằng thủy tinh silicat dài 30 m đường kính trong 0,25 mm được phủ một lớp dày 0,25 dimetylpolysiloxan chứa diphenylpolysiloxan 5%; |
| Nhiệt độ cột: | Làm nóng cột đến 45 °C trong 4 min, sau đó tăng tốc độ gia nhiệt 15 °C/min cho đến khi đạt 300 °C, duy trì nhiệt độ này trong 10 min; |
| Nhiệt độ buồng tiêm mẫu: | 250 °C; |
| Detector: | Dùng detector khối phổ cài đặt số khối là 263; |
| Khí mang: | Sử dụng khí Heli. Điều chỉnh tốc độ dòng khí để dibutyltin xuất hiện ở thời điểm khoảng 1 min. |
B.1.3 Xác định tricresyl phosphat trong đũa ăn bằng nhựa PVC
B.1.3.1 Chuẩn bị dung dịch thử: Cân 0,5g mẫu (đã được cắt hoặc nghiền nhỏ) và cho vào bình thủy tinh có nút mài. Thêm 15 ml axetonitril, đậy chặt nút bình và để qua đêm ở khoảng 40 °C. Sau đó, lọc lấy dịch, thu dịch lọc và dịch rửa, thêm axetonitril đến 25 ml và sử dụng dịch này là dịch chiết axetonitril.
Lấy cột mini nhồi sẵn silica gel đã được octadexyl silyl hóa, luyện cột bằng 5ml axetonitril và 5ml hỗn hợp axetonitril: nước (1:1).
Lấy 5ml dịch chiết axetonitril và 5ml nước trộn đều và nạp vào đầu cột đã luyện ở trên.
Rửa giải bằng hỗn hợp axetonitril:nước tỷ lệ 2:1 và thu lấy 10 ml dịch rửa giải là dung dịch thử.
B.1.3.2 Chuẩn bị dung dịch chuẩn: Cân chính xác 100 mg tricresyl phosphat, thêm axetonitril hòa tan và định mức đến đủ 100 ml. Lấy 1 ml dung dịch với 60 ml axetonitril, sau đó thêm nước cất và định mức đến đủ 100 ml. Dung dịch chuẩn tricresyl phosphate có nồng độ 10 μg/ ml.
B.1.3.3 Cách tiến hành:
Lấy 20 μl mỗi loại, dung dịch thử và dung dịch chuẩn tricresyl phosphat. Chạy sắc ký lỏng theo điều kiện sau.
| Cột sắc ký: | Cột thép không gỉ dài 250 mm có đường kính 4,6 mm; |
| Nhiệt độ cột: | 50 °C; |
| Detector: | Detector quang phổ tử ngoại, hoạt động ở bước sóng 264 nm; |
| Pha động: | Dùng hỗn hợp axetonitril và nước trộn với tỷ lệ 2:1. Điều chỉnh tốc độ dòng chảy để tricresyl phosphat xuất hiện ở thời điểm khoảng 9 min. |
B.1.4 Xác định vinyl clorua trong đũa ăn bằng nhựa PVC
B.1.4.1 Chuẩn bị dung dịch thử: Cân 0,5 g mẫu đã được (cắt mỏng) và cho vào bình thủy tinh dung tích 20 ml có nắp kín. Sau đó, thêm 2,5 ml N,N-dimetyl axetamit và đậy nắp ngay, lắc đều được dung dịch thử. Tuy nhiên, đối với các mẫu không dễ dàng hòa tan thì sau khi đậy nắp, cần lắc kỹ để trộn đều ở nhiệt độ phòng, để qua đêm và sử dụng làm dung dịch thử.
B.1.4.2 Dung dịch vinyl clorua chuẩn: Lấy khoảng 190 ml etanol vào bình định mức 200 ml, đậy bình bằng nút cao su silicon và cân khối lượng. Làm lạnh bình định mức bằng metanol băng khô và tiêm vào 200 mg vinyl clorua đã được hóa lỏng. Tiêm etanol đã được làm lạnh bằng metanol băng khô vào bình, định mức đến đủ 200 ml. Tiếp tục làm lạnh bình bằng metanol băng khô. Lấy 1 ml dung dịch trên, và thêm etanol đã được làm lạnh bằng metanol băng khô, định mức đến đủ 100 ml và bảo quản trong metanol băng khô. Dung dịch vinyl clorua chuẩn có nồng độ 10 μg/ ml. Etanol (99,5) dùng trong thí nghiệm không được chứa những chất có ảnh hưởng đến các chất dùng trong phép thử.
B.1.4.3 Cách tiến hành
Rót 50 μl dung dịch chuẩn vinyl clorua vào bình thủy tinh có nút đậy đã có 2,5 ml N, N dimetylaxetamit, và đậy nắp ngay. Làm tương tự với mẫu thử. Sau đó, đun nóng bình chứa dung dịch mẫu và bình chứa dung dịch chuẩn trong 1 h, duy trì ở nhiệt độ 90°C, thỉnh thoảng lắc đều bình. Tiếp theo, lấy 0,5 ml hơi trong mỗi bình, chạy sắc ký khí theo điều kiện sau.
| Cột sắc ký: | Sử dụng cột bằng thủy tinh silicat dài 25 m đường kính 0,25 mm được phủ một lớp dày 3 μm nhựa xốp divinylbenzen styren |
| Nhiệt độ cột: | Đun nóng cột đến 80 °C trong 1 min, sau đó tăng nhiệt độ từ từ, cứ 10 °C mỗi min cho đến khi đạt 250 °C, duy trì trong 10 min. |
| Nhiệt độ buồng tiêm mẫu: | 200 °C |
| Detector: | Detector ion hóa bằng ngọn lửa hyđro. Vận hành ở nhiệt độ khoảng 250 °C. Điều chỉnh lưu lượng của không khí và hyđro sao cho độ nhạy phát hiện tối đa |
| Khí mang: | Sử dụng khí nitơ hoặc heli. Điều chỉnh tốc độ dòng khí để các vinyl clorua xuất hiện ở thời điểm khoảng 5 min. |
B.1.5 Xác định các chất bay hơi trong đũa ăn bằng nhựa PS
B.1.5.1 Chuẩn bị dung dịch thử: Cân chính xác khoảng 0,5 g mẫu, cho vào bình định mức 20 ml và thêm một lượng thích hợp tetrahyđrofuran. Sau khi hòa tan hết mẫu, thêm 1ml dung dịch thử dietylbenzen và thêm tetrahyđrofuran định mức cho đủ 20 ml.
B.1.5.2 Chuẩn bị dung dịch chuẩn: Cho 90 ml dung dịch tetrahyđrofuran vào bình định mức 100 ml. Cân chính xác 50 mg mỗi loại các chất sau: styren, toluen, etylbenzen, isopropyl benzen, và propyl benzen. Sau đó thêm tetrahyđrofuran định mức đến đủ 100 ml. Lấy 1 ml, 2 ml, 3 ml, 4 ml, và 5 ml dung dịch trên lần lượt cho vào các bình định mức 20 ml riêng biệt và thêm vào mỗi bình 1 ml dung dịch thử dietylbenzen, sau đó thêm dung dịch tetrahyđrofuran định mức đến đủ 20 ml.
B.1.5.3 Dung dịch thử dietylbenzen: Cho tetrahyđrofuran vào 1 ml dietylbenzen, định mức đến đủ 100 ml. Lấy 10 ml dung dịch này và thêm tetrahyđrofuran tiếp tục định mức đến đủ 100 ml.
B.1.5.4 Xây dựng đường chuẩn
Lấy 1 μl mỗi dung dịch chuẩn, chạy sắc ký khí theo hướng dẫn mô tả dưới đây. Sử dụng sắc ký đồ thu được để tính các tỷ lệ diện tích pic của styren, toluen, etylbenzen, isopropyl benzen và propyl benzen với diện tích pic của dietylbenzen, sau đó vẽ đường chuẩn.
| Cột sắc ký: | Cột thủy tinh silicat có chiều dài 30 m, đường kính 0,5 mm được phủ một lớp dày 0,5 μm polyetylen glycol |
| Nhiệt độ cột: | Đun nóng từ 60 °C, sau đó tăng nhiệt từ từ, cứ 4 °C mỗi min cho đến khi đạt 100 °C, và tiếp tục tăng mỗi 10 °C mỗi min cho đến khi đạt 150 °C |
| Nhiệt độ buồng tiêm mẫu | 220 °C |
| Detector | Detector ion hóa bằng ngọn lửa hydro. Vận hành ở nhiệt độ khoảng 220 °C. Điều chỉnh lưu lượng của không khí và hydro sao cho độ nhạy phát hiện tối đa |
| Khí mang: | Sử dụng khí nitơ hoặc heli. Điều chỉnh tốc độ dòng khí để các dietylbenzen xuất hiện ở thời điểm khoảng 11 min |
B.1.5.5 Cách tiến hành
Dùng 1 ml dung dịch thử, chạy sắc ký khí theo hướng dẫn mô tả như trên. Sử dụng sắc ký đồ thu được để tính các tỷ lệ diện tích pic của các chất với diện tích pic của dietylbenzen. Tiếp theo, sử dụng các đường chuẩn tương ứng để xác định nồng độ styren, toluen, etylbenzen, isopropyl benzen và propyl benzen, sau đó sử dụng các phương trình sau đây để xác định hàm lượng của từng chất.
![]()
Trong đó
m là hàm lượng chất, tính bằng microgam trên gam;
C là nồng độ chất trong dung dịch mẫu thử, tính bằng microgam trên mililít;
m1 khối lượng mẫu thử, tính bằng gam.
B.1.6 Xác định bari trong đũa ăn bằng nhựa PVDC
B.1.6.1 Chuẩn bị dung dịch thử: Cân 0,5 g mẫu, cho vào chén nung bằng sứ hoặc thủy tinh chịu nhiệt; vô cơ hóa từ từ trực tiếp trên ngọn lửa ở khoảng 300 °C, sau đó nung ở khoảng 450 °C để chuyển thành tro. Thêm 50 ml dung dịch axit nitric 0,1 mol/l vào cặn và hòa tan.
B.1.6.2 Chuẩn bị dung dịch bari chuẩn
B.1.6.2.1 Dung dịch bari chuẩn gốc: Hòa tan 190,3 mg bari nitrat trong axit nitric 0,1 mol/l định mức đến đủ 100 ml. Nồng độ của bari trong dung dịch chuẩn gốc là 1 mg/ml.
B.1.6.2.2 Dung dịch bari chuẩn làm việc: Lấy 1 ml dung dịch bari chuẩn gốc và thêm axit nitric 0,1 mol/l định mức đến đủ 1 000 ml. Nồng độ của bari trong dung dịch chuẩn làm việc là 1 μg/ml.
B.1.6.3 Cách tiến hành
Phân tích bari trong dung dịch thử bằng quang phổ hấp thụ nguyên tử hoặc quang phổ phát xạ plasma.
B.1.7 Xác định vinyliden clorua trong đũa ăn bằng nhựa PVDC
B.1.7.1 Chuẩn bị dung dịch thử: Cắt nhỏ mẫu, cân 0,5 g và cho vào bình thủy tinh 20 ml có nắp đậy. Sau đó, thêm 2,5 ml N,N-dimetyl axetamit và đóng nắp ngay.
B.1.7.2 Dung dịch chuẩn: Cho khoảng 98 ml dung dịch N,N-dimetyl axetamit vào bình định mức 100 ml có nút cao su silicon. Tiêm 250 ml vinyliden clorua vào bình. Sau đó tiêm N,N-dimetyl axetamit qua nút cao su silicon định mức đến đủ 100 ml. Tiếp tục lấy 1 ml dung dịch này và thêm N, N-dimetyl axetamit định mức đến đủ 50 ml. Nồng độ của vinyliden clorua trong dung dịch chuẩn làm việc là 60 μg/ml. Dung dịch vinyliden clorua chuẩn làm việc có nồng độ là 60 μg/ml.
B.1.7.3 Cách tiến hành
Rót 50 μl dung dịch vinyliden clorua chuẩn vào một chai thủy tinh có nút đậy đã chứa 2,5 ml dung dịch N,N-dimetyl axetamit, và đậy nắp ngay. Làm tương tự với mẫu thử. Sau đó, đun nóng bình chứa dung dịch mẫu và bình chứa dung dịch chuẩn trong 1 h, duy trì ở nhiệt độ 90 °C, thỉnh thoảng lắc đều bình. Tiếp theo, lấy 0,5 ml hơi trong mỗi bình, chạy sắc ký khí theo các điều kiện sau.
| Cột sắc ký: | Sử dụng cột bằng thủy tinh silicat dài 25 m đường kính 0,25 mm được phủ một lớp dày 3 μm nhựa xốp divinylbenzen styren |
| Nhiệt độ cột: | Làm nóng cột đến 80 °C trong 1 min, tăng nhiệt độ với tốc độ gia nhiệt 10°C/min cho đến khi đạt 250°C, duy trì trong 10 min |
| Nhiệt độ buồng tiêm mẫu: | 200 °C |
| Detector: | Detector ion hóa ngọn lửa hyđro. Vận hành ở nhiệt độ khoảng 250 °C. Điều chỉnh lưu lượng của không khí và hyđro sao cho độ nhạy phát hiện tối đa |
| Khí mang: | Sử dụng khí nitơ hoặc heli. Điều chỉnh tốc độ dòng khí để vinyliden clorua xuất hiện ở thời điểm khoảng 9 min. |
B.1.8 Xác định bisphenol A trong đũa ăn bằng nhựa PC
B.1.8.1 Chuẩn bị dung dịch thử: Lấy 1,0 g mẫu, cho vào bình nón 200 ml và thêm 20 ml diclorometan. Sau khi mẫu hòa tan hoàn toàn, thêm 100 ml axeton bằng dụng cụ nhỏ giọt, vừa thêm vừa lắc kỹ, ly tâm hỗn hợp trong 10 min với tốc độ 3 000 vòng/min, cô lớp trên đến khoảng 2 ml bằng máy cô quay chân không. Sau đó, thêm 10 ml axetonitril và thêm nước cất đến 20 ml. Lấy 1 ml dịch này và lọc qua màng lọc với đường kính lỗ lọc không lớn hơn 0,5 μm.
B.1.8.2 Chuẩn bị dung dịch chuẩn: Cân chính xác 10 mg mỗi loại các chất sau: bisphenol A, phenol, và p-tert-butylphenol vào một bình định mức 100 ml, sau đó thêm metanol định mức đến đủ 100 ml. Lấy 1 ml, 2 ml, 3 ml, 4 ml, và 5 ml dung dịch trên lần lượt cho vào các bình định mức 20 ml riêng biệt và thêm nước đến đủ 20 ml. Đây là những dung dịch chuẩn (5 μg / ml, 10 μg / ml, 15 μg / ml, 20 μg / ml, và 25 μg / ml).
B.1.8.3 Vẽ đường chuẩn
Sử dụng 20 μl các dung dịch chuẩn, chạy sắc ký lỏng theo các điều kiện dưới đây. Sử dụng sắc ký đồ thu được để tính toán chiều cao và diện tích các pic của bisphenol A, phenol, và p-tert-butylphenol, sau đó vẽ đường chuẩn cho từng chất.
| Detector: | Detector quang phổ hồng ngoại. Vận hành ở bước sóng 217 nm |
| Pha động: | A = axetonitril; B= nước cất |
| Chương trình dung môi: | Gradient dung môi tuyến tính với tỷ lệ A :B từ 30 :70 đến 100 :0 trong thời gian 35 min ; sau đó duy trì dung môi A thêm 10 min. |
B.1.8.4 Cách tiến hành
Sử dụng 20 μl dung dịch mẫu, chạy sắc ký lỏng theo các điều kiện ở trên, dùng đường chuẩn để xác định nồng độ của bisphenol A, phenol, và p-tert-butylphenol trong dung dịch mẫu thử, sau đó sử dụng phương trình dưới đây tính hàm lượng các chất.
![]()
Trong đó
m là hàm lượng chất, tính bằng microgam trên gam;
C là nồng độ chất trong dung dịch mẫu thử, tính bằng microgam trên mililít;
m1 khối lượng mẫu thử, tính bằng gam.
B.1.9 Xác định diphenyl cacbonat trong đũa ăn bằng nhựa PC
B.1.9.1 Chuẩn bị dung dịch thử: Lấy 1,0 g mẫu, cho vào bình nón 200 ml và thêm 20 ml diclometan. Sau khi mẫu hòa tan hoàn toàn, thêm 100 ml axeton bằng dụng cụ nhỏ giọt, vừa thêm vừa lắc kỹ, ly tâm hỗn hợp trong 10 min với tốc độ 3000 vòng/min, cô lớp trên đến khoảng 2ml bằng máy cô quay chân không. Sau đó, thêm 10 ml axetonitril và thêm nước đến 20 ml. Lấy 1 ml dịch này và lọc qua màng lọc với đường kính lỗ lọc không lớn hơn 0,5 μm.
B.1.9.2 Chuẩn bị dung dịch chuẩn
Cân chính xác 10 mg diphenyl cacbonat cho vào bình định mức 100 ml, và thêm metanol đến đủ 100 ml. Lấy 1 ml, 2 ml, 3 ml, 4 ml, và 5 ml dung dịch trên lần lượt cho vào các bình định mức 20 ml riêng biệt và thêm nước đến đủ 20 ml.
B.1.9.3 Xây dựng đường chuẩn
Sử dụng 20 μl các dung dịch chuẩn, chạy sắc ký lỏng theo điều kiện dưới đây. Sử dụng sắc ký đồ thu được để tính toán chiều cao và diện tích pic của diphenyl cacbonat, sau đó vẽ đường chuẩn.
| Chất nhồi: | Sử dụng gel silica octadexylsilyl |
| Cột sắc ký: | Sử dụng cột bằng thép không gỉ dài 250 mm có đường kính trong là 4,6 mm |
| Nhiệt độ cột: | 40 °C |
| Detector: | Sử dụng detector quang phổ tử ngoại. Vận hành ở bước sóng 217 nm |
| Pha động: | A = axetonitril; B = nước cất |
| Chương trình dung môi: | Sau khi tiến hành gradien nồng độ theo tỷ lệ A: B từ (3:07) đến (100:0) trong 35 min, để cho dòng chảy axetonitrile trong 10 min. |
B.1.9.4 Cách tiến hành
Dùng 20 μl dung dịch thử, chạy sắc ký lỏng theo điều kiện ở trên. Sử dụng sắc ký đồ để tính chiều cao và diện tích các píc. Tiếp theo dùng đường chuẩn để xác định nồng độ của diphenyl cacbonat trong dung dịch thử, sau đó sử dụng phương trình dưới đây tính hàm lượng các chất này:
![]()
Trong đó
m là hàm lượng chất, tính bằng microgam trên gam;
C là nồng độ chất trong dung dịch mẫu thử, tính bằng microgam trên mililít;
m1 khối lượng mẫu thử, tính bằng gam.
B.1.10 Xác định các amin trong đũa ăn bằng nhựa PC
B.1.10.1 Chuẩn bị dung dịch thử: Lấy 1,0 g mẫu, cho vào bình nón 200 ml và thêm 20 ml diclorometan. Sau khi mẫu hòa tan hoàn toàn, thêm 100 ml axeton bằng dụng cụ nhỏ giọt, vừa thêm vừa lắc kỹ, ly tâm hỗn hợp trong 10 min với tốc độ 3000 vòng/min, cô lớp trên đến khoảng 2 ml bằng máy cô quay chân không. Sử dụng dịch này làm dung dịch thử (chỉ áp dụng với trietylamin và tributylamin).
B.1.10.2 Chuẩn bị dung dịch chuẩn: Cân chính xác các chất trietylamin và tributylamin 10 mg mỗi loại. Cho vào bình định mức 100 ml, sau đó thêm đicloroetan định mức đến đủ 100 ml. Tiếp theo, lấy ra 4 ml dung dịch này vào bình định mức 100 ml, và thêm đicloroetan đến đủ 100 ml. Lấy 1 ml, 2 ml, 3 ml, 4 ml, và 5 ml dung dịch trên lần lượt cho vào các bình định mức 20 ml riêng biệt và thêm nước định mức đến đủ 20 ml. Đây là những dung dịch chuẩn (0,2 μg/ml, 0,4 μ/g ml, 0,6 μ/g ml, 0,8 μg/ml, và 1,0 μg/ml).
B.1.10.3 Xây dựng đường chuẩn
Sử dụng 1 μl các dung dịch chuẩn, chạy sắc ký khí theo điều kiện dưới đây. Sử dụng sắc ký đồ thu được để tính chiều cao và diện tích các pic của trietylamin và tributylamin, sau đó vẽ đường chuẩn cho từng chất.
| Cột sắc ký: | Sử dụng cột thủy tinh silicat dài 30 m đường kính 0,32 mm được phủ một lớp dimetylpolysiloxan dày 5 μm |
| Nhiệt độ cột: | đun nóng cột đến 150 °C trong 5 min, sau đó tăng nhiệt độ từ từ, cứ 20°C mỗi min cho đến khi đạt 250°C. Giữ ở nhiệt độ này trong 5 min |
| Nhiệt độ buồng tiêm mẫu: | 200 °C |
| Detector: | detector nhiệt ion ngọn lửa kiềm hoặc một detector nitơ-phospho độ nhạy cao. Vận hành ở nhiệt độ gần 250 °C. Điều chỉnh lưu lượng của không khí và hyđro sao cho độ nhạy phát hiện tối đa. |
B.1.10.4 Cách tiến hành
Dùng 1 ml dung dịch thử, thực hiện sắc ký khí theo điều kiện ở trên. Sử dụng sắc ký đồ thu được để tính toán chiều cao và diện tích của mỗi pic. Tiếp theo, sử dụng các đường chuẩn tương ứng để xác định nồng độ trietylamin và tributylamin, sau đó sử dụng các phương trình sau đây để xác định hàm lượng của từng chất:
![]()
Trong đó
m là hàm lượng chất, tính bằng microgam trên gam;
C là nồng độ chất trong dung dịch mẫu thử, tính bằng microgam trên mililít;
m1 khối lượng mẫu thử, tính bằng gam.
B.2 Thử thôi nhiễm
B.2.1 Xác định tổng hàm lượng kim loại nặng
B.2.1.1 Chuẩn bị dung dịch thử: Rửa sạch mẫu bằng nước cất, sau đó ngâm mẫu trong dung dịch axit axetic theo tỷ lệ 2 ml/1 cm2 mẫu tại 95 °C trong 30 min.
B.2.1.2 Chuẩn bị dung dịch chì chuẩn gốc: Hòa tan 159,8 mg chì (II) nitrat trong 10 ml axit nitric 10%, và thêm nước cất định mức đến đủ 100 ml. Dung dịch chì chuẩn gốc này có nồng độ 1 mg/ml.
B.2.1.3 Chuẩn bị dung dịch chì chuẩn làm việc: Lấy chính xác 1 ml dung dịch chì chuẩn gốc, thêm axit nitric 0,1 mol/l định mức đến đủ 100 ml. Dung dịch chuẩn làm việc này có nồng độ 10 μg/ml.
B.2.1.4 Cách tiến hành
Ống thử: Cho 20 ml dung dịch thử vào ống Nessler, thêm nước cất đến đủ 50 ml.
Ống so sánh: Tiến hành đồng thời với 1 ống Nessler khác, cho 2 ml dung dịch chuẩn chì, thêm 20 ml dung dịch axit axetic 4 %, thêm nước cất đến đủ 50 ml.
Nhỏ vào mỗi ống 2 giọt thuốc thử natri sulfit, để yên trong 5 min, sau đó quan sát cả 2 ống trên nền trắng. Dung dịch trong ống thử không được thẫm màu hơn dung dịch trong ống so sánh.
B.2.2 Xác định hàm lượng kali permanganat (KMnO4) tiêu tốn
B.2.2.1 Chuẩn bị dung dịch thử: Rửa sạch mẫu bằng nước cất, sau đó ngâm mẫu trong nước cất theo tỷ lệ 2 ml/1 cm2 mẫu tại 95 °C trong 30 min.
B.2.2.2 Cách tiến hành
Cho 100 ml nước, 5 ml axit sulfuric (1:3, V/V), và 5 ml dung dịch KMnO4 0,002 mol/l vào bình định mức. Đun sôi khoảng 5 min, sau đó loại bỏ dung dịch và rửa bình bằng nước. Cho vào bình 100 ml dung dịch thử, 5 ml axit sulfuric (1:3, V/V), và 10 ml dung dịch KMnO4 0,002 mol/l và đun sôi trong 5 min. Ngay sau khi ngừng đun, thêm 10 ml dung dịch natri oxalat 0,005 mol/l để làm mất màu dung dịch. Chuẩn độ với dung dịch KMnO4 0,002 mol/l cho đến khi có màu đỏ nhạt bền. Tiến hành với mẫu trắng và tính lượng KMnO4 tiêu tốn, tính bằng microgam trên mililít, theo công thức sau:
![]()
trong đó
a: là lượng dung dịch KMnO4 0,002 mol/I dùng tiến hành với mẫu thử, tính bằng mililít;
b: là lượng (ml) dung dịch KMnO4 0,002 mol/l dùng tiến hành với mẫu trắng, tính bằng mililít;
f: là hệ số hiệu chỉnh của dung dịch KMnO4 0,002 mol/l.
B.2.3 Xác định phenol trong đũa ăn bằng nhựa phenol, melamin và ure
B.2.3.1 Chuẩn bị dung dịch thử: Rửa sạch mẫu bằng nước cất, sau đó ngâm mẫu trong nước cất theo tỷ lệ 2ml/1cm2 mẫu tại nhiệt độ 95 °C trong 30 min.
B.2.3.2 Chuẩn bị dung dịch phenol chuẩn
B.2.3.2.1 Dung dịch chuẩn phenol gốc: Cân chính xác 1,0 g phenol, hòa tan trong 100 ml nước.
B.2.3.2.2 Dung dịch chuẩn trung gian: Lấy chính xác 1 ml dung dịch chuẩn gốc vào bình định mức và thêm nước cất đến đủ 100 ml.
B.2.3.2.3 Dung dịch chuẩn làm việc: Lấy chính xác 1ml dung dịch chuẩn trung gian vào bình định mức 20ml và thêm nước đến vạch. Dung dịch chuẩn làm việc có nồng độ 5 μg/ml.
B.2.3.3 Chuẩn bị dung dịch đệm axit boric
Chuẩn bị 2 dung dịch.
Dung dịch số 1: Hoà tan 4,0 g NaOH trong nước, thêm nước định mức đến đủ 100 ml.
Dung dịch số 2: Hòa tan 6,2 g axit boric trong nước, thêm nước định mức đến đủ 100 ml. Lấy mỗi dung dịch một lượng bằng nhau rồi lắc đều
B.2.3.4 Cách tiến hành
Lấy chính xác 20 ml dung dịch thử, thêm 3 ml dung dịch đệm axit boric và trộn đều, sau đó thêm 5 ml dung dịch antipyrin 4-amin và 2,5 ml dung dịch kali fericyanit và nước để đủ 100 ml. Trộn đều và để trong 10 min ở nhiệt độ phòng.
Tiến hành tương tự với 20 ml dung dịch chuẩn làm việc thay cho 20 ml dung dịch thử. Đo độ hấp thụ quang của 2 hỗn hợp ở bước sóng 510 nm.
B.2.4 Xác định formaldehyt
B.2.4.1 Chuẩn bị dung dịch thử: Rửa sạch mẫu bằng nước cất, sau đó ngâm mẫu trong nước cất theo tỷ lệ 2ml/1cm2 mẫu tại nhiệt độ 95 °C trong 30 min.
B.2.4.2 Cách tiến hành: Cho vào ống đo có chia vạch 200 ml một lượng 10 ml dung dịch mẫu thử với 1 ml axit phosphoric 20 %, sau đó thêm 5 ml đến 10 ml nước và tiến hành cất kéo hơi nước với ống sinh hàn ngập trong nước. Khi chưng cất được khoảng 190 ml thì ngừng và thêm nước định mức đủ 200 ml. Lấy 5 ml dung dịch này cho vào ống nghiệm có đường kính 15 mm và thêm 5 ml thuốc thử axetylaxeton. Khuấy đều và gia nhiệt trong cách thủy sôi 10 min.
Dung dịch so sánh: Một ống nghiệm có đường kính 15 mm khác, cho vào 5 ml nước và 5 ml thuốc thử axetylaxeton. Khuấy đều và gia nhiệt trong cách thủy sôi 10 min.
Quan sát các ống nghiệm trên nền trắng, dung dịch mẫu thử phải không tối mầu hơn dung dịch so sánh.
B.2.5 Xác định cặn khô
B.2.5.1 Chuẩn bị dung dịch thử: Rửa sạch các mẫu bằng nước cất, sau đó ngâm mẫu trong dung dịch ngâm thôi theo tỷ lệ 2ml/cm2 mẫu. Sử dụng dung dịch ngâm và điều kiện ngâm theo quy định đối với từng loại nhựa.
B.2.5.2 Cách tiến hành
Lấy từ 200 ml đến 300 ml dung dịch thử (nếu sử dụng heptan là dung dịch ngâm thôi, thì chuyển 200 ml đến 300 ml dung dịch thử vào một bình hình quả lê, cô chân không đến còn một vài ml, chuyển phần dịch cô vào một chén bạch kim, thạch anh, hoặc cốc thủy tinh chịu nhiệt (đã gia nhiệt đến 105°C và cân bì) sau đó tráng bình cất hai lần, mỗi lần với khoảng 5 ml heptan và gộp dịch rửa vào dịch cô đặc. Cho bay hơi trên bể cách thủy đến khi bốc hơi hết dung dịch và còn lại cặn cứng. Sấy khô cặn trong 2 h ở 105 °C, để nguội trong bình hút ẩm, cân chén và cặn để xác định khối lượng cặn (là chênh lệch khối lượng của chén chứa cặn và khối lượng bì).
Tiến hành đồng thời đối với mẫu trắng, trong đó thay thể tích dung dịch thử bằng thể tích nước cất tương đương.
Tính khối lượng cặn theo công thức sau:
| mcặn = | (a - b) x 1000 |
| V |
Trong đó:
| a | là chênh lệch khối lượng giữa chén chứa cặn và khối lượng bì trong thử nghiệm với dung dịch thử, tính bằng miligam; |
| b | là chênh lệch khối lượng giữa chén chứa cặn và khối lượng bì trong thử nghiệm với mẫu trắng, tính bằng miligam; |
| V | là thể tích dung dịch thử, tính bằng mililít |
B.2.6 Xác định antimon
B.2.6.1 Chuẩn bị dung dịch thử: Rửa sạch mẫu bằng nước cất, ngâm thôi trong axit axetic 4 % theo tỷ lệ 2ml/1cm2 mẫu tại nhiệt độ 95 °C trong 30 min.
B.2.6.2 Chuẩn bị dung dịch chuẩn gốc antimon: Cân chính xác 1,874 g triclorua antimon và hòa tan trong một ít axit clohydric (1:2, V/V), sau đó thêm axit clohydric (1:10, V/V) để định mức đến đủ 1 000 ml. Dung dịch chuẩn antimon có nồng độ 1 mg/ml.
B.2.6.3 Chuẩn bị dung dịch antimon chuẩn làm việc: Lấy 1 ml dung dịch antimon chuẩn gốc, thêm axit axetic 4% định mức đến đủ 100 ml, lấy 1 ml dung dịch này và thêm axit axetic 4% định mức đến đủ 200 ml. Dung dịch Antimon chuẩn làm việc có nồng độ 0,05 μg/ml.
B.2.6.3 Cách tiến hành
Thực hiện phép phân tích antimon bằng phương pháp quang phổ hấp thụ nguyên tử hoặc quang phổ phát xạ plasma với dung dịch thử và dung dịch antimon chuẩn làm việc, so sánh các kết quả với nhau.
B.2.7 Xác định germani
B.2.7.1 Chuẩn bị dung dịch thử: Rửa sạch mẫu bằng nước cất, sau đó ngâm mẫu trong axit axetic 4 % theo tỷ lệ 2ml/1cm2 mẫu tại nhiệt độ 95 °C trong 30 min.
B.2.7.2 Chuẩn bị dung dịch chuẩn: Cân chính xác 144 mg germani dioxit cho vào một chén nung bằng sứ hoặc thủy tinh chịu nhiệt, thêm 1g natri cacbonat và trộn đều. Gia nhiệt làm tan chảy hỗn hợp, sau đó làm lạnh và thêm nước để hòa tan. Trung hòa dung dịch bằng axit clohydric, thêm 1 ml axit clohydric nữa và sau đó thêm nước định mức đến đủ 100 ml. Nồng độ germani trong dung dịch này là 1 mg/ ml.
Lấy 1 ml dung dịch chuẩn germani cho vào bình định mức 100 ml thêm dung dịch axit axetic 4 % cho đến vạch. Lấy 1 ml dung dịch này pha loãng bằng dung dịch ací ace tie 4% đến 100 ml trong bình định mức. Dung dịch germani chuẩn làm việc có nồng độ 1 μg/ml.
B.2.7.3 Cách tiến hành
Dùng quang phổ hấp thụ nguyên tử hoặc quang phổ phát xạ plasma để xác định Germani trong dung dịch thử.
B.2.8 Xác định methyl metacrylat
B.2.8.1 Chuẩn bị dung dịch thử: Rửa sạch mẫu bằng nước cất, sau đó ngâm mẫu trong etanol 20 % theo tỷ lệ 2ml/1cm2 mẫu tại nhiệt độ 60 °C trong 30 min.
B.2.8.2 Dung dịch chuẩn có nồng độ metyl metacrylat là 15 μg/ml.
B.2.8.3 Cách tiến hành
Sử dụng 1 μl dung dịch thử và 1 μl dung dịch chuẩn metyl metacrylat, chạy sắc ký khí theo các điều kiện sau.
| Cột sắc khí: | Sử dụng cột bằng thủy tinh silicat dài 30 m đường kính trong 0,32 mm được phủ một lớp dimetylpolysiloxan dày 5 μm |
| Nhiệt độ cột: | Đun nóng cột đến 120 °C trong 1 min, sau đó tăng nhiệt độ từ từ, cứ 5 °C mỗi min cho đến khi đạt 170 °C |
| Nhiệt độ buồng tiêm mẫu: | 200 °C |
| Detector: | Detector ion hóa bằng ngọn lửa hyđro. Vận hành ở nhiệt độ khoảng 25 °C. Điều chỉnh lưu lượng của không khí và hyđro sao cho độ nhạy phát hiện tối đa |
| Khí mang: | Sử dụng khí nitơ hoặc heli. Điều chỉnh tốc độ dòng khí để methyl methacrylat xuất hiện ở thời điểm khoảng 4 đến 5 min. |
B.2.9 Xác định caprolactam
B.2.9.1 Chuẩn bị dung dịch thử: Rửa sạch mẫu bằng nước cất, sau đó ngâm mẫu trong etanol 20 % theo tỷ lệ 2 ml/1 cm2 mẫu tại nhiệt độ 60 °C trong 30 min.
B.2.9.2 Chuẩn bị dung dịch chuẩn: Cân 1,5 g caprolactam và hòa tan trong etanol 20% định mức đến đủ 1 000 ml. Tiếp tục lấy 1 ml dung dịch này và thêm etanol 20% định mức đến đủ 100 ml. Dung dịch chuẩn có nồng độ caprolactam là 15 μg/ml.
B.2.9.3 Cách tiến hành
Sử dụng 1 μl dung dịch thử và 1 μl dung dịch chuẩn caprolactam, chạy sắc ký khí theo hướng dẫn mô tả dưới đây, sau đó so sánh thời gian lưu trong sắc ký đồ của dung dịch thử và thời gian lưu của caprolactam trong sắc ký đồ của dung dịch caprolactam chuẩn.
| Cột sắc ký: | sử dụng cột bằng thủy tinh silicat dài 30 m đường kính 0,32 mm được phủ một lớp dimetylpolysiloxan dày 5 μm |
| Nhiệt độ cột: | 240 °C |
| Nhiệt độ buồng tiêm mẫu: | 240 °C |
| Detector: | detector ion hóa bằng ngọn lửa hyđro. Vận hành ở nhiệt độ khoảng 240 °C. Điều chỉnh lưu lượng của không khí và hyđro sao cho độ nhạy phát hiện tối đa |
| Khí mang: | Sử dụng khí nitơ hoặc heli. Điều chỉnh tốc độ dòng khí để caprolactam xuất hiện ở thời điểm khoảng 5 min. |
B.2.10 Xác định bisphenol A (phenol và p-tert-butylphenol)
B.2.10.1 Chuẩn bị dung dịch thử: Rửa kỹ mẫu bằng nước cất, sau đó ngâm mẫu trong dung dịch ngâm với tỷ lệ 2 ml/cm2 diện tích bề mặt mẫu. Sử dụng dung dịch ngâm và điều kiện ngâm theo các điều kiện quy định trong Bảng 14.
Chuyển 25 ml dịch này vào phễu chiết, thêm 10 ml axetonitril, lắc kỹ để trộn đều trong 5 min, để cho ổn định và chuyển lớp axetonitril vào bình định mức 25 ml. Thêm 10 ml axetonitril vào lớp heptan, thực hiện quá trình chiết như trên và lấy lớp axetonitril vào bình định mức trên. Sau đó, bổ sung axetonitril đến 25 ml.
B.2.10.2 Chuẩn bị dung dịch chuẩn: Cân chính xác 10 mg mỗi loại các chất sau: bisphenol A, phenol, và p-tert-butylphenol vào một bình định mức 100 ml, sau đó thêm metanol đến đủ 100 ml. Lấy 1 ml, 2 ml, 3 ml, 4 ml, và 5 ml dung dịch trên lần lượt cho vào các bình định mức 20 ml riêng biệt và thêm nước định mức đến đủ 20 ml. Đây là những dung dịch chuẩn (5 μg/ml, 10 μg/ml, 15 μg/ml, 20 μg/ml, và 25 μg/ml).
B.2.10.3 Chuẩn bị dung dịch chuẩn làm việc: lấy 2 ml của các dung dịch chuẩn gốc trên vào bình định mức 20 ml thêm nước định mức đến đủ 20 ml. Nồng độ của từng dung dịch này (0,5 μg/ml; 1,0 μg/ml; 1,5 μg/ml; 2,0 μg/ml và 2,5 μg/ml).
B.2.10.4 Vẽ đường chuẩn
Sử dụng 100 μl các dung dịch chuẩn làm việc, chạy sắc ký lỏng theo điều kiện dưới đây. Sử dụng sắc ký đồ thu được để tính chiều cao và diện tích píc của bisphenol A, phenol, và p-tert-butylphenol, sau đó vẽ đường chuẩn cho từng chất.
| Cột nạp: | Sử dụng gel silica octadexylsily |
| Cột sắc ký: | Sử dụng cột bằng thép không gỉ dài 250 mm có đường kính trong là 4,6 mm |
| Nhiệt độ cột: | 40 °C |
| Detector: | Sử dụng detector quang phổ tử ngoại. Vận hành ở bước sóng 217 nm |
| Pha động: | A = axetonitril; B= nước cất |
| Chương trình dung môi: | gradien dung môi tuyến tính với tỷ lệ A:B từ (30:70) đến (100:0) trong thời gian 35 min, sau đó duy trì dòng dung môi A thêm 10 min nữa. |
B.2.10.5 Cách tiến hành: Sử dụng 20 μl dung dịch thử, chạy sắc ký lỏng theo điều kiện ở trên. Sử dụng sắc ký đồ thu được để tính chiều cao và diện tích các píc. Tiếp theo dùng đường chuẩn để xác định nồng độ của bisphenol A, phenol, và p-tert-butylphenol trong dung dịch mẫu thử, sau đó sử dụng công thức dưới đây tính hàm lượng các chất:
Hàm lượng (μg/g) = Nồng độ chất trong dung dịch mẫu thử (μg/ml) x 20 (ml)/khối lượng mẫu (g).
B.2.11 Xác định tổng axit lactic
B.2.11.1 Chuẩn bị dung dịch thử: Rửa sạch các mẫu bằng nước cất, sau đó ngâm mẫu trong nước cất theo tỷ lệ 2ml/1cm2 mẫu tại nhiệt độ 60 °C trong 30 min.
B.2.11.2 Dung dịch chuẩn có nồng độ axit lactic là 30 μg/ml
B.2.11.3 Cách tiến hành
Lấy 1 ml dung dịch thử và 1 ml dung dịch axit lactic chuẩn vào cột, thêm vào mỗi cột 100 μl natri hydroxit 0,2 mol/l, để yên ở 60 °C trong 15 min, thỉnh thoảng lắc đều. Sau đó làm nguội cột, thêm vào mỗi cột 100 μl axit phosphoric 0,2 mol/l. Sử dụng 100 μl mỗi dung dịch, chạy sắc ký lỏng theo các điều kiện sau.
| Chất nhồi cột: | Sử dụng gel silica octadexylsilyl |
| Cột sắc ký: | Sử dụng cột bằng thép không gỉ dài 250 mm có đường kính trong là 4,6 mm |
| Nhiệt độ cột: | 40 °C |
| Detector | detector quang phổ tử ngoại. Vận hành ở bước sóng 210 nm |
| Pha động: | sử dụng dung dịch axit phosphoric, axetonitril và nước với tỷ lệ 0,1:1:99. Điều chỉnh tốc độ dòng chảy để axit lactic xuất hiện ở thời điểm khoảng 5 min. |
Phụ lục C
(quy định)
Phương pháp thử các chỉ tiêu hóa học cho đũa ăn bằng kim loại
CHÚ THÍCH Trừ khi có quy định khác, hóa chất, thuốc thử được sử dụng trong các phép phân tích này phải có chất lượng tinh khiết phân tích đã được công nhận.
C.1 Chuẩn bị dung dịch thử
Rửa sạch mẫu bằng nước cất, sau đó ngâm mẫu ngập trong dung dịch ngâm thôi và điều kiện ngâm tương ứng được quy định trong Bảng 21 theo tỷ lệ 2 ml/cm2 diện tích bề mặt mẫu thử.
C.2 Xác định hàm lượng arsen (As)
Thực hiện xác định theo A.4 với dung dịch ngâm thôi và điều kiện ngâm tương ứng được quy định trong Bảng 21.
C.3 Xác định hàm lượng cadimi (Cd) và chì (Pb)
Thực hiện xác định theo A.5 với dung dịch ngâm thôi và điều kiện ngâm tương ứng được quy định trong Bảng 21.
C.4 Xác định hàm lượng phenol
C.4.1 Chuẩn bị dung dịch phenol chuẩn gốc: Cân chính xác 1,0 g phenol, hòa tan trong 100 ml nước.
C.4.2 Chuẩn bị dung dịch phenol chuẩn trung gian: Lấy chính xác 1 ml dung dịch chuẩn gốc vào bình định mức và thêm nước cất đến đủ 100 ml.
C.4.3 Chuẩn bị dung dịch phenol chuẩn làm việc: Lấy chính xác 1 ml dung dịch chuẩn trung gian và thêm nước cất đến đủ 20 ml. Dung dịch phenol chuẩn làm việc có nồng độ 5 μg/ml.
C.4.4 Chuẩn bị dung dịch đệm axit boric: Chuẩn bị 2 dung dịch.
Dung dịch số 1: Hoà tan 4,0 g NaOH trong nước, thêm nước định mức đến đủ 100 ml.
Dung dịch số 2: Hòa tan 6,2 g axit boric trong nước, thêm nước định mức đến đủ 100 ml. Lấy mỗi dung dịch một lượng bằng nhau rồi lắc đều.
C.4.5 Cách tiến hành
Lấy chính xác 20 ml dung dịch thử, thêm 3 ml dung dịch đệm axit boric và trộn đều, sau đó thêm 5 ml dung dịch antipyrin 4-amin và 2,5 ml dung dịch fericyanua và nước để đủ 100 ml. Trộn đều và để yên trong 10 min ở nhiệt độ phòng.
Tiến hành tương tự với 20 ml dung dịch chuẩn làm việc thay cho 20 ml dung dịch thử. Đo độ hấp thụ quang của 2 hỗn hợp ở bước sóng 510 nm; độ hấp thụ quang của mẫu thử không được lớn hơn độ hấp thụ quang của mẫu chuẩn.
C.5 Formaldehyt
C.5.1 Cách tiến hành
Cho vào ống đong có chia vạch 200 ml một lượng 10 ml dung dịch mẫu với 1 ml axit phosphoric 20 %, sau đó thêm từ 5 ml đến 10 ml nước và tiến hành chưng cất lôi kéo hơi nước với ống sinh hàn ngập trong nước. Khi chưng cất được khoảng 190 ml thì ngừng và thêm nước định mức đủ 200 ml. Lấy 5 ml dung dịch này cho vào ống nghiệm có đường kính 15 mm và thêm 5 ml thuốc thử axetyl axeton. Khuấy đều và gia nhiệt cách thủy trên bể nước sôi trong 10 min.
Dung dịch so sánh: Sử dụng một ống nghiệm có đường kính 15 mm, cho vào 5 ml nước và 5 ml thuốc thử axetyl axeton. Khuấy đều và gia nhiệt cách thủy trên bể nước sôi trong 10 min. Quan sát các ống nghiệm trên nền trắng dung dịch mẫu thử phải không tối màu hơn dung dịch so sánh.
C.6 Cặn khô
C.6.1 Cách tiến hành
Lấy từ 200 ml đến 300 ml dung dịch thử (nếu sử dụng heptan là dung dịch ngâm thôi) thì chuyển từ 200 ml đến 300 ml dung dịch thử vào bình hình quả lê, cô chân không đến còn vài ml, chuyển phần dịch cô vào chén sứ, hoặc cốc thủy tinh chịu nhiệt (đã gia nhiệt đến 105 °C và cân bì trước) sau đó tráng bình cất hai lần, mỗi lần với khoảng 5 ml heptan và gộp dịch rửa vào dịch đã cô đặc. Cho bay hơi trên bể cách thủy đến khi bốc hơi hết dung dịch và còn lại cặn cứng. Sấy khô cặn trong 2 h ở 105 °C, để nguội trong bình hút ẩm, cân chén và cặn xác định khối lượng cặn là sự chênh lệch của khối lượng chén và cặn với khối lượng bì.
Tiến hành đồng thời đối với mẫu trắng, trong đó thay thể tích dung dịch thử bằng thể tích nước cất tương đương.
Tính lượng cặn theo công thức sau:
| Cặn khô (μg/ml) | = | (a-b)x1000 |
| V |
trong đó:
| a | là chênh lệch khối lượng giữa chén có cặn và bì trong thử nghiệm với dung dịch thử, tính bằng mg; |
| b | là chênh lệch khối lượng giữa chén có cặn và bì trong thử nghiệm với mẫu trắng, tính bằng mg; |
| V | là thể tích dung dịch thử, tính bằng ml. |
Nếu dùng nước làm dung dịch ngâm thôi mà lượng cặn khô lớn hơn 30 μg/ml thì thực hiện như sau: thêm 30 ml cloroform vào phần cặn khô thu được, gia nhiệt, lọc và sau đó cân chất lỏng thu được sau lọc trong chén bằng thạch anh, bạch kim, hoặc thủy tinh chịu nhiệt đã biết khối lượng. Rửa cặn khô vừa lọc hai lần, sử dụng 10 ml chloroform mỗi lần, gia nhiệt, lọc, đưa chất lỏng được lọc vào bể bay hơi cách thủy. Sau khi làm nguội, cân chén và cặn xác định khối lượng cặn. Tiến hành đồng thời đối với mẫu trắng, trong đó thay thể tích dung dịch thử bằng thể tích nước cất tương đương.
C.7 Epiclorohyđrin
C.7.1 Chuẩn bị dung dịch epiclorohyđrin chuẩn
Hòa tan 100 mg epiclorohyđrin trong pentan, thêm pentan định mức đến đủ 100 ml, lấy 1 ml dung dịch này và thêm pentan định mức đến đủ 100 ml. Sau đó lấy 5 ml dung dịch này và thêm pentan định mức đến 100 ml. Dung dịch epiclorohyđrin chuẩn có nồng độ 0,5 μg/ml.
C.7.2 Cách tiến hành
Lấy 5 μl mỗi loại, dung dịch mẫu và dung dịch chuẩn epiclorohyđrin. Chạy sắc ký khí như sau:
| Cột sắc ký: | Sử dụng cột bằng thủy tinh silicat dài 30 m đường kính trong 0,53 mm được phủ một lớp dày 1 μm polyetylen; |
| Nhiệt độ cột: | Đun nóng cột đến 80 °C trong 1 min, sau đó tăng nhiệt độ từ từ, cứ 10°C mỗi phút cho đến khi đạt 250 °C, duy trì trong 10 min; |
| Nhiệt độ buồng tiêm mẫu: | 200 °C; |
| Thiết bị đo: | Sử dụng detector ion hóa ngọn lửa hyđro. Vận hành ở nhiệt độ khoảng 220 °C. Điều chỉnh lưu lượng của không khí và hyđro sao cho độ nhạy phát hiện tối đa; |
| Khí mang: | Sử dụng khí nitơ hoặc heli. Điều chỉnh tốc độ dòng khí để epiclorohyđrin xuất hiện trong khoảng 7 min. |
C.8 Vinyl clorua
C.8.1 Chuẩn bị dung dịch vinyl clorua chuẩn
Lấy khoảng 190 ml etanol vào bình định mức 200 ml, đậy bình bằng nút cao su silicon và cân khối lượng. Làm lạnh bình định mức bằng metanol băng khô và tiêm vào 200 mg vinyl clorua đã được hóa lỏng. Tiêm etanol đã được làm lạnh bằng metanol băng khô vào bình, định mức đến đủ 200 ml. Tiếp tục làm lạnh bình bằng metanol băng khô. Lấy 1 ml dung dịch trên, và thêm etanol đã được làm lạnh bằng metanol băng khô, định mức đến đủ 100 ml và bảo quản trong metanol băng khô. Dung dịch thu được có nồng độ 10 μg/ ml. Etanol (99,5 %) dùng trong thí nghiệm không được chứa tạp chất có ảnh hưởng đến các chất dùng trong phép thử.
C.8.2 Cách tiến hành
Rót 50 μl dung dịch chuẩn vinyl clorua vào bình thủy tinh có nút đậy đã có 2,5 ml N, N dimetyl axetamit, và đậy nắp ngay. Làm tương tự với mẫu thử. Sau đó, đun nóng bình chứa dung dịch mẫu và bình chứa dung dịch chuẩn trong 1 h, duy trì ở nhiệt độ 90 °C, thỉnh thoảng lắc đều bình. Tiếp theo, lấy 0,5 ml hơi trong mỗi bình, chạy sắc ký khí theo hướng dẫn được mô tả dưới đây, sau đó so sánh thời gian lưu của píc trong sắc ký đồ của dung dịch thử và dung dịch chuẩn vinyl clorua.
| Cột sắc ký: | Sử dụng cột bằng thủy tinh silicat dài 25 m đường kính 0,25 mm được phủ một lớp dày 3 μm nhựa xốp divinylbenzen styren; |
| Nhiệt độ cột: | Đun nóng cột đến 80 °C trong 1 min, sau đó tăng nhiệt độ từ từ, cứ 10 °C mỗi phút cho đến khi đạt 250 °C, duy trì trong 10 min; |
| Nhiệt độ buồng tiêm: | 200 °C |
| Detector: | Sử dụng detector ion hóa bằng ngọn lửa hyđro. Vận hành ở nhiệt độ khoảng 250 °C. Điều chỉnh lưu lượng của không khí và hyđro sao cho độ nhạy phát hiện tối đa; |
| Khí mang: | Sử dụng khí nitơ hoặc heli. Điều chỉnh tốc độ dòng khí để vinyl clorua xuất hiện trong khoảng 5 min. |
CHÚ THÍCH Diện tích pic vinyl clorua của mẫu thử không được lớn hơn diện tích pic vinyl clorua của dung dịch chuẩn.
Phụ lục D
(quy định)
Xác định tổng số vi sinh vật hiếu khí và nấm
D.1 Nguyên tắc
Xác định tổng số vi khuẩn hiếu khí và nấm trong đũa ăn trong môi trường dinh dưỡng thích hợp và ủ trong các điều kiện quy định. Tổng số vi khuẩn hiếu khí và nấm trên gam mẫu thử được xác định từ số lượng khuẩn lạc đếm được.
D.2 Môi trường và thuốc thử
Sử dụng các môi trường dinh dưỡng và dung dịch pha loãng thích hợp trong phương pháp đếm số lượng vi khuẩn hiếu khí, nấm men và nấm mốc. Các môi trường và dung dịch pha loãng thích hợp khác cũng có thể được sử dụng nếu chúng được chứng minh là phù hợp. Có thể chuẩn bị từ môi trường khô loại thương mại theo chỉ dẫn của nhà sản xuất.
D.2.1 Môi trường đếm vi khuẩn hiếu khí và nấm
- Môi trường thạch casein đậu tương (CSA): để đếm tổng số vi khuẩn hiếu khí.
| Casein thủy phân bởi pancreatin | 15,0 g |
| Bột đậu tương thủy phân bởi papain | 5,0 g |
| Natri clorua | 5,0 g |
| Thạch | 15,0 g |
| Nước cất | 1 000 ml |
Điều chỉnh pH sao cho sau khi hấp tiệt khuẩn, môi trường có pH 7,3 ± 0,2 ở 25 °C.
- Môi trường thạch Sabouraud dextrose (SA): để đếm tổng số nấm mốc và nấm men
| Dextrose | 40,0 g |
| Casein thủy phân bởi pancreatin | 5,0 g |
| Pepton từ mô động vật | 5,0 g |
| Cloramphenicol | 0,05 g |
| Thạch | 15,0 g |
| Nước cất | 1 000 ml |
Điều chỉnh pH sao cho sau khi hấp tiệt khuẩn, môi trường có pH 5,6 ± 0,2 ở 25 °C.
D.2.2 Hóa chất và thuốc thử
- Dung dịch đệm phosphat pH 7,2 vô khuẩn.
Dung dịch đệm gốc: Cân 34 g kali đihyđro phosphat và cho vào bình định mức 1 000 ml, thêm 500 ml nước cất, điều chỉnh pH 7,2 ± 0,2 bằng natri hydroxit. Thêm nước cất tới vạch, trộn đều. Phân chia vào các bình, tiệt khuẩn, bảo quản ở 2 °C đến 8 °C.
Dung dịch đệm phosphat pH 7,2: Pha loãng dung dịch đệm gốc với nước cất theo tỷ lệ 1:800 (V/V) và tiệt khuẩn.
- Dung dịch etanol 70 % (V/V).
- Dung dịch nước muối sinh lý vô khuẩn 0,9 % (m/V).
D.3 Thiết bị, dụng cụ
D.3.1 Pipet chia vạch vô trùng 1 ml, 5 ml, 10 ml
D.3.2 Các dụng cụ vô trùng: kẹp, kéo, gạc
D.3.3 Ống nghiệm nút xoáy 16 x 125 và 20 x 150 mm
D.3.4 Bình có nút xoáy
D.3.5 Cân có độ nhạy 0,01 g
D.3.6 Đĩa petri (15 x 100) mm
D.3.7 Tủ ấm
D.3.8 Tủ vô trùng luồng tầng hoặc tủ an toàn sinh học
D.4 Bảo quản mẫu thử
Tiến hành thử nghiệm trong thời gian sớm nhất sau khi nhận mẫu. Bảo quản mẫu theo điều kiện ghi trên nhãn. Không được ủ ấm, để lạnh hoặc làm đông mẫu trước hoặc sau khi thử nghiệm.
Kiểm tra mẫu cẩn thận trước khi mở bao gói và lưu ý những bất thường trên bao bì sản phẩm.
D.5 Cách tiến hành
Tiến hành thao tác trong tủ vô trùng luồng tầng hoặc tủ an toàn sinh học. Các thao tác với vi sinh vật gây bệnh được thực hiện trong tủ an toàn sinh học.
D.5.1 Lấy mẫu và chuẩn bị mẫu thử
Trước khi mở và lấy mẫu, tiệt trùng bề mặt bao bì sản phẩm bằng dung dịch etanol 70 % (V/V). Để khô bề mặt bao bì trước khi mở.
Trong điều kiện vô trùng, cân 10 g mẫu thử vào bình có nút xoáy, có thể cắt nhỏ mẫu bằng kéo vô trùng nếu cần. Thêm 90 ml dung dịch đệm phosphat pH 7,2 vô trùng và khuấy trộn đều thu được dung dịch có độ pha loãng 10-1. Có thể tiếp tục pha loãng mẫu theo tỷ lệ 1:10 nếu số lượng vi sinh vật trong mẫu thử quá lớn hoặc khả năng kháng khuẩn của mẫu thử ở độ pha loãng 10-1 vẫn hiện diện.
D.5.2 Xác định số lượng
D.5.2.1 Kĩ thuật cấy trải bề mặt thạch
Sử dụng kĩ thuật cấy trải bề mặt thạch giúp dễ dàng nhận thấy sự khác biệt giữa các loại khuẩn lạc khác nhau và số lượng của chúng. Chuẩn bị và ghi nhãn các đĩa chứa môi trường (Ví dụ: ghi nhãn từ 10-1 đến 10-3), độ pha loãng tùy thuộc vào mức độ tạp nhiễm của mẫu thử, mỗi độ pha loãng sử dụng 2 đĩa petri. Thêm 1 ml hoặc 2 ml dung dịch có độ pha loãng 10-1 đã chuẩn bị (tham khảo ở D.5.1) sau đó thêm 9 ml hoặc 18 ml dung dịch đệm phosphat pH 7,2, trộn đều bằng máy vortex, để được dung dịch có độ pha loãng 10-2. Tiếp tục pha loãng mẫu thử như trên để thu được dung dịch có độ pha loãng 10-3.
Đổ vào mỗi đĩa petri khoảng 15 ml đến 20 ml môi trường đã được tiệt trùng và để nguội xuống 48 °C, để môi trường trong đĩa đông tự nhiên ở nhiệt độ phòng (chú ý thao tác này được tiến hành trong tủ vô trùng luồng tầng hoặc tủ an toàn sinh học).
Trộn kĩ từng độ pha loãng và lấy không dưới 0,1 ml của từng độ pha loãng để cấy lên bề mặt đĩa thạch.
Dùng que gạt vô khuẩn trải đều dung dịch mẫu thử trên bề mặt thạch. Sử dụng que gạt mới đối với mỗi độ pha loãng.
D.5.2.2 Kĩ thuật đổ đĩa thạch
Sử dụng kĩ thuật đổ đĩa thạch có thể phát hiện số lượng nhỏ vi sinh vật. Chuẩn bị và ghi nhãn các đĩa chứa môi trường (Ví dụ: ghi nhãn từ 10-1 đến 10-3), độ pha loãng tùy thuộc vào mức độ tạp nhiễm của mẫu thử, mỗi độ pha loãng sử dụng 2 đĩa petri.
Chuẩn bị dãy các độ pha loãng giống như mô tả trong D.5.2.1.
Lấy 1 ml của từng độ pha loãng vào các đĩa petri tương ứng.
Thêm khoảng 15 ml đến 20 ml môi trường vào các đĩa petri. Đậy nắp và cẩn thận lắc nhẹ các đĩa petri để môi trường và mẫu trộn lẫn với nhau.
Để môi trường trong đĩa đông tự nhiên ở nhiệt độ phòng.
D.5.3 Nuôi cấy
Để xác định tổng số vi khuẩn: Lật úp đĩa thạch, ủ trong tủ ấm (32,5 ± 2,5) °C trong (72 ± 6) h.
Để xác định tổng số nấm mốc, nấm men: Lật úp đĩa thạch, ủ trong tủ ấm (25 ± 2,5) °C trong 3 ngày đến 5 ngày hoặc (22,5 ± 2,5) °C trong 5 ngày đến 7 ngày (trong trường hợp sử dụng môi trường không chứa kháng sinh).
D.5.4 Đếm khuẩn lạc
Sau thời gian nuôi cấy, đếm số khuẩn lạc ở từng độ pha loãng. Sử dụng số khuẩn lạc đáp ứng tiêu chí sau để tính toán kết quả:
Đối với đếm tổng số vi khuẩn: chọn đĩa petri có từ 30 đến 300 khuẩn lạc
Đối với đếm tổng số nấm mốc và nấm men: chọn đĩa petri có từ 15 đến 150 khuẩn lạc
Tính số lượng trung bình của số khuẩn lạc trong đĩa đáp ứng tiêu chí trên, nhân với độ pha loãng và báo cáo kết quả số lượng vi khuẩn hiếu khí, nấm mốc và nấm men trong 1 g mẫu thử ban đầu.
D.5.5 Trung hòa tác dụng của chất ức chế trong mẫu thử
Các mẫu thử có chứa chất ức chế (hay chất bảo quản) phải được trung hòa một cách thích hợp trước khi tiến hành thử nghiệm. Cần kiểm tra dư lượng chất bảo quản còn trong mẫu thử bằng cách cho tiếp xúc với các vi sinh vật thích hợp.
Sử dụng hai chủng đại diện cho vi khuẩn Gram dương và vi khuẩn Gram âm là Staphylococcus aureus ATCC 6538, Pseudomonas aeruginosa ATCC 9027 (có thể thay chủng vi khuẩn Gram âm bằng chủng Escherichia coli ATCC 8739) và một chủng nấm men là Candida albicans ATCC 10231 để xác định hiệu quả của chất trung hòa.
D.5.5.1 Chuẩn bị chủng
Đối với chủng vi khuẩn, cấy vào bề mặt môi trường CSA. Đối với nấm Candida albicans, cấy vào môi trường SA. Ủ ở (32,5 ± 2,5) °C trong 18 h đến 24 h. Để thu được vi sinh vật, sử dụng que cấy vô trùng gạt lên bề mặt môi trường và hòa vi sinh vật vào dung dịch nước muối sinh lý vô khuẩn 0,9 % và điều chỉnh sao cho hỗn dịch chủng có nồng độ 108 CFU/ml (đối với vi khuẩn) và 106 CFU/ml (đối với Candida albicans).
D.5.5.2 Kĩ thuật cấy trải bề mặt thạch
Trộn 9 ml mẫu thử có độ pha loãng 10-1 và/hoặc các độ pha loãng khác với 1 ml hỗn dịch chủng có chứa 10 000 CFU/ml đến 30 000 CFU/ml (có thể sử dụng hỗn dịch chủng có nồng độ nhỏ hơn nếu lượng mẫu cấy trải là 0,5 ml hoặc 1 ml). Lấy không dưới 0,1 ml mẫu thử này cấy trải lên bề mặt môi trường trong đĩa petri (sử dụng 2 đĩa petri đối với mỗi chủng vi sinh vật).
Song song làm mẫu đối chứng chỉ chứa vi sinh vật và môi trường mà không chứa mẫu thử. Đậy nắp, lật úp đĩa thạch, ủ trong tủ ấm (32,5 ± 2,5) °C trong 24 h đến 72 h đối với vi khuẩn và (25 ± 2,5) °C trong 3 đến 5 ngày đối với Candida albicans.
Sau thời gian nuôi cấy, đếm số lượng khuẩn lạc trên các đĩa petri và so sánh số lượng khuẩn lạc thu được trên mẫu thử và mẫu đối chứng. Tổng số vi sinh vật đếm được trên mẫu thử phải không dưới 50 % so với mẫu đối chứng.
D.5.5.3 Kĩ thuật đổ đĩa thạch
Trộn 9 ml mẫu thử có độ pha loãng 10-1 và/hoặc các độ pha loãng khác với 1 ml hỗn dịch chủng có chứa 1 000 CFU/ml đến 3 000 CFU/ml. Lấy 1 ml mẫu thử này cho vào đĩa petri (sử dụng 2 đĩa petri đối với mỗi chủng vi sinh vật). Thêm khoảng 15 ml đến 20 ml môi trường vào các đĩa petri.
Song song làm mẫu đối chứng chỉ chứa vi sinh vật và môi trường mà không chứa mẫu thử. Đậy nắp và cẩn thận lắc nhẹ các đĩa petri để môi trường, mẫu và chủng vi sinh vật trộn lẫn với nhau. Để môi trường trong đĩa đông tự nhiên ở nhiệt độ phòng.
Lật úp đĩa thạch, ủ trong tủ ấm (32,5 ± 2,5) °C trong 24 h đến 72 h đối với vi khuẩn và (25 ± 2,5) °C trong 3 đến 5 ngày đối với Candida albicans.
Sau thời gian nuôi cấy, đếm số lượng khuẩn lạc trên các đĩa petri và so sánh số lượng khuẩn lạc thu được trên mẫu thử và mẫu đối chứng. Tổng số vi sinh vật đếm được trên mẫu thử phải không dưới 50 % so với mẫu đối chứng.
Phụ lục E
(quy định)
Xác định sự có mặt của các vi sinh vật gây bệnh
E.1 Nguyên tắc
Xác định sự có mặt của vi sinh vật gây bệnh dựa trên các đặc tính sinh hóa của chúng trên môi trường đặc hiệu. Có thể sử dụng quy trình vi sinh khác, bao gồm cả các phương pháp tự động, nếu chúng được chứng minh là phù hợp.
E.2 Môi trường
Sử dụng các môi trường đặc hiệu thích hợp. Các môi trường khác cũng có thể được sử dụng nếu chúng được chứng minh là phù hợp. Có thể chuẩn bị từ môi trường khô loại thương mại theo chỉ dẫn của nhà sản xuất.
- Môi trường lỏng casein đậu tương.
| Casein thủy phân bởi pancreatin | 17,0 g |
| Bột đậu tương thủy phân bởi papain | 3,0 g |
| Natri clorua | 5,0 g |
| Dikali hydrophosphat | 2,5 g |
| Glucose monohyđrat | 2,5 g |
| Nước cất | 1 000 ml |
Điều chỉnh pH sao cho sau khi hấp tiệt khuẩn, môi trường có pH 7,3 ± 0,2 ở 25 °C.
- Môi trường thạch cetrimid
| Gelatin thủy phân bởi pancreatin | 20,0 g |
| Magnesi clorid | 1,4 g |
| Dikali sulfat | 10,0 g |
| Cetrimid | 0,3 g |
| Thạch | 13,6 g |
| Nước cất | 1 000 ml |
| Glycerol | 10 ml |
Đun sôi trong 1 min, khuấy đều. Điều chỉnh pH sao cho sau khi hấp tiệt khuẩn, môi trường có pH 7,2 ± 0,2 ở 25 °C.
- Môi trường thạch muối manitol
| Casein thủy phân bởi pancreatin | 5,0 g |
| Pepton từ mô động vật | 5,0 g |
| Cao thịt bò | 1,0 g |
| D-Manitol | 10,0 g |
| Natri clorua | 75,0 g |
| Thạch | 15,0 g |
| Phenol đỏ | 0,025 g |
| Nước cất | 1 000 ml |
Đun sôi trong 1 min, lắc đều. Điều chỉnh pH sao cho sau khi hấp tiệt khuẩn, môi trường có pH 7,4 ± 0,2 ở 25 °C.
E.3 Thiết bị, dụng cụ
E.3.1 Pipet chia vạch vô trùng 1 ml
E.3.2 Kẹp vô trùng
E.3.3 Ống nghiệm nút xoáy 16 mm x 125 mm
E.3.4 Đĩa petri 15 mm x 100 mm
E.3.5 Tủ ấm
E.3.6 Bể điều nhiệt
E.3.7 Tủ vô trùng luồng tầng (Laminar flow cabinet) hoặc tủ an toàn sinh học
E.4 Cách tiến hành
Các thao tác được thực hiện trong tủ vô trùng luồng tầng hoặc tủ an toàn sinh học. Các thao tác với vi sinh vật gây bệnh được thực hiện trong tủ an toàn sinh học.
E.4.1 Xác định sự có mặt của Pseudomonas aeruginosa
Cấy 1 ml dung dịch có độ pha loãng 10-1 đã chuẩn bị ở Điều D.5.1 vào ít nhất 10 ml môi trường lỏng casein đậu tương, trộn đều. Ủ ở 30 °C đến 35 °C trong 18 h đến 24 h.
Nếu có dấu hiệu phát triển của vi sinh vật, cấy chuyển sang đĩa môi trường thạch cetrimid và ủ ở 30 °C đến 35 °C trong 18 h đến 72 h.
Khuẩn lạc mọc trên môi trường cho thấy mẫu thử có thể có P. aeruginosa. Tiếp tục xác định bằng nhiều phản ứng sinh hóa khác, ví dụ: kit API 20 NE (Bio Merieux) v.v....
Mẫu thử không có P. aeruginosa nếu không có khuẩn lạc mọc trên môi trường hoặc các phản ứng sinh hóa để xác định P. aeruginosa có kết quả âm tính.
E.4.2 Xác định sự có mặt của Staphylococcus aureus
Sử dụng ống môi trường lỏng casein đậu tương thu được ở Điều E.4.1. (sau khi ủ ở 30 °C đến 35 °C trong 18 h đến 24 h).
Nếu có dấu hiệu phát triển của vi sinh vật, cấy chuyển sang đĩa môi trường thạch muối manitol và ủ ở 30 °C đến 35 °C trong 18 h đến 72 h.
Khuẩn lạc màu vàng hoặc trắng có vòng màu vàng bao quanh mọc trên môi trường cho thấy mẫu thử có thể có S. aureus. Tiếp tục xác định bằng nhiều phản ứng sinh hóa khác, ví dụ: kit API Staph (Bio Merieux) v.v....
Mẫu thử không có S. aureus nếu không có khuẩn lạc có đặc điểm mô tả ở trên mọc trên môi trường hoặc các phản ứng sinh hóa để xác định S. aureus có kết quả âm tính.
E.4.3 Xác định sự có mặt của Salmonella
E.4.3.1 Nguyên tắc
Quy trình kiểm tra Salmonella bắt buộc phải qua 4 giai đoạn, và phải sử dụng chủng đối chứng trong toàn bộ quá trình phân tích.
- Tiền tăng sinh: Mẫu được tiền tăng sinh trong môi trường tăng sinh không chọn lọc (Peptone đệm) ở 37 °C trong khoảng 18 h.
- Tăng sinh: Mẫu sau khi tiền tăng sinh chuyển qua tăng sinh trong môi trường tăng sinh chọn lọc (canh Rapparport Vassiliadis soy peptone), ủ ở 42 °C trong 24 h.
- Phân lập: từ môi trường tăng sinh chọn lọc, cấy ria sang môi trường rắn chọn lọc (XLD agar và Hektoen), ủ ở 37 °C trong 24 h.
- Khẳng định: Cấy chuyển khuẩn lạc nghi ngờ Salmonella sang môi trường thích hợp, kiểm tra bằng các thử nghiệm sinh hóa và kháng huyết thanh.
Việc khẳng định dựa trên các kết quả thử nghiệm sinh hóa và kháng huyết thanh phù hợp.
E.4.3.2 Môi trường và thuốc thử:
- Canh Buffer Peptone Water (BPW)
- Canh Rappaport-Vassiliadis soy peptone
- Thạch Xylose lysine desoxycholate (XLD Agar)
- Thạch Hektoen enteric agar (Hektoen)
- TSI
- TSA
- Canh Urea broth
- Canh Lysine decarboxylase
- Canh Manitol Phenol red base
- Salmonella Polyvalent O antiserum
- Salmonella Polyvalent H antiserum
E.4.3.3 Cách tiến hành
E.4.3.3.1 Tiền tăng sinh
Cân 25 g mẫu, thêm 225 ml Peptone đệm, ủ ở 37 °C ± 1 °C trong (18 ± 2) h.
E.4.3.3.2 Tăng sinh
Cấy chuyển 0,1 ml dịch tiền tăng sinh sang môi trường Rappaport-Vassiliadis, ủ trong bể điều nhiệt ở (42 ± 2) °C trong (24 ± 3)h.
E.4.3.3.3 Phân lập
Từ môi trường tăng sinh, dùng khuyên cấy cấy chuyển khuẩn dịch (canh tăng sinh) lên bề mặt môi trường phân lập (XLD và Hektoen) sao cho có thể tạo được những khuẩn lạc tách rời. Lật ngược đĩa ủ ở 37 °C ± 1 °C trong (24 ± 3) h.
Trên môi trường XLD: Khuẩn lạc Salmonella điển hình trong suốt, hơi nhuốm màu đỏ do sự thay đổi của chất chỉ thị trong môi trường, phần lớn có tâm đen. Bao giờ cũng có thể nhận thấy một vùng môi trường đỏ lớn hoặc nhỏ, đặc biệt khi Salmonella mọc dày quanh khuẩn lạc.
Trên môi trường Hektoen. Khuẩn lạc Salmonella điển hình trong suốt, có màu xanh (blue-green), tâm đen.
E.4.3.3.4 Khẳng định
Những khuẩn lạc nghi ngờ phải được kiểm tra khẳng định bằng các thử nghiệm sinh hóa và huyết thanh kháng.
Chọn ít nhất 5 khuẩn lạc điển hình hay nghi ngờ ở mỗi đĩa cấy chuyển sang môi trường rắn không chọn lọc (TSA), ủ ở 37 °C ± 1 °C trong (18 ± 2) h.
a) Thử nghiệm sinh hóa
Các phép thử sinh hóa được dùng để dùng khẳng định Salmonella như Bảng E.1:
Bảng E.1 - Kết quả thử sinh hóa
| Phép thử | Kết quả |
| Triple sugar iron agar Manitol Ureaza LDC | K/A; H2S (+); khí (+) + - + |
b) Khẳng định bằng huyết thanh kháng
Thử nghiệm huyết thanh kháng nên được dùng song song với nước muối sinh lý. Huyết thanh kháng sử dụng là Salmonella polyvalent O- antiserum và Salmonella polyvalent H-antiserum.
Thư mục tài liệu tham khảo
| [1] | QCVN 12-1:2011, Quy chuẩn kỹ thuật quốc gia về an toàn vệ sinh bao bì, dụng cụ bằng nhựa tổng hợp tiếp xúc trực tiếp với thực phẩm |
| [2] | QCVN 12-3:2011, Quy chuẩn kỹ thuật quốc gia về an toàn vệ sinh bao bì, dụng cụ bằng kim loại tiếp xúc trực tiếp với thực phẩm. |
| [3] | Quyết định 46/2007/QĐ-BYT, Quy định mức giới hạn ô nhiễm sinh học và hóa học trong thực phẩm |
| [4] | TCVN 6238-3 (ISO 8124-3), An toàn đồ chơi trẻ em - Phần 3: Mức giới hạn xâm nhập của các độc tố |
| [5] | TCVN 6238-9 (EN 71-9), An toàn đồ chơi trẻ em - Phần 9: Hợp chất hóa học hữu cơ - Yêu cầu chung |
| [6] | TCVN 6641:2000 (ISO 5522:1981), Rau, quả và sản phẩm rau quả - xác định hàm lượng sunfua dioxit tổng số |
| [7] | TCVN 7852 (AOAC 997.02), Thực phẩm - Đếm nấm men và nấm mốc bằng phương pháp màng khô có thể hoàn nước (phương pháp Perrifilm TM) |
| [8] | TCVN 8275-2:2010, Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp định lượng nấm men và nấm mốc - Phần 2: Kỹ thuật đếm khuẩn lạc trong các sản phẩm có hoạt độ nước nhỏ hơn hoặc bằng 0,95. |
| [9] | TCVN 8308:2010 (EN 1541:2001), Giấy và cáctông tiếp xúc với thực phẩm - Xác định Formaldehyt trong dung dịch nước chiết |
| [10] | TCVN 11528:2016, Khăn ướt sử dụng một lần |
| [11] | KS G 3223-1997, Knives, forks, spoons, chopstick, ladles for table |
| [12] | GB 19790.1-2005, Disposable Wooden Chopsticks |
| [13] | GB 19790.2-2005, Disposable Bamboo Chopsticks |
| [14] | GB/T 5009.61, Method for analysis of hygienic standard of products of tripolycyanamide for food packaging |
| [15] | Commission Regulation (EU) No. 10/2011 on plastic materials and articles intended to come into contact with food. |
| [16] | Enumeration of aerobic mesophilic bacteria, yeast and mould, ngày 04 tháng 10 năm 2013 |
| [17] | NMKL 71, 5. Ed., 1999, Salmonella. Detection in foods. |
MỤC LỤC
Lời nói đầu
1 Phạm vi áp dụng
2 Thuật ngữ định nghĩa
3 Yêu cầu
3.1 Ngoại quan
3.2 Yêu cầu hóa học
3.3 Yêu cầu vi sinh
4 Lấy mẫu
5 Ghi nhãn, bao gói và bảo quản
5.1 Ghi nhãn
5.2 Bao gói
5.3 Bảo quản
Phụ lục A (quy định) Phương pháp thử các chỉ tiêu hóa học cho đũa ăn bằng tre, gỗ
Phụ lục B (quy định) Phương pháp thử các chỉ tiêu hóa học cho đũa ăn bằng nhựa tổng hợp
Phụ lục C (quy định) Phương pháp thử các chỉ tiêu hóa học cho đũa ăn bằng kim loại
Phụ lục D (quy định) Xác định tổng số vi sinh vật hiếu khí và nấm
Phụ lục E (quy định) Xác định sự có mặt của các vi sinh vật gây bệnh
Thư mục tài liệu tham khảo
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 12272:2018 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 12272:2018 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 12272:2018 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 12272:2018 DOC (Bản Word)