- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 11528:2016 Khăn ướt sử dụng một lần
| Số hiệu: | TCVN 11528:2016 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Công nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
2016 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 11528:2016
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 11528:2016
TIÊU CHUẨN QUỐC GIA
TCVN 11528:2016
KHĂN ƯỚT SỬ DỤNG MỘT LẦN
Disposable wet wipes
Lời nói đầu
TCVN 11528:2016 do Ban kỹ thuật Tiêu chuẩn quốc gia TCVN/TC 38 Vật liệu dệt biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
KHĂN ƯỚT SỬ DỤNG MỘT LẦN
Disposable wet wipes
1 Phạm vi áp dụng
Tiêu chuẩn này áp dụng cho các sản phẩm khăn ướt làm từ vải không dệt, sử dụng một lần, dùng cho người.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi.
TCVN 7421-1:2013 (ISO 14184-1:2011), Vật liệu dệt - Xác định formaldehyt - Phần 1: Formaldehyt tự do và thủy phân (phương pháp chiết trong nước).
TCVN 10041-3:2013 (ISO 9073-3:1989), Vật liệu dệt - Phương pháp thử cho vải không dệt - Phần 3: Xác định độ bền và độ giãn dài khi kéo.
ISO 10993-10:2010, Biological evaluation of medical devices - Part 10: Tests for irritation and skin sensitization (Đánh giá sinh học đối với trang thiết bị y tế - Phần 10: Phép thử kích thích và độ nhạy của da)
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này áp dụng các thuật ngữ và định nghĩa sau:
3.1
Vải không dệt (nonwovens)
Sản phẩm dạng tấm xơ hoặc sợi được gắn kết với nhau, nhưng không phải bằng cách đan, dệt sợi như vải dệt kim, vải dệt thoi, đăng ten hoặc vải tết.
CHÚ THÍCH Các cấu trúc dạng màng và giấy không được coi là vải không dệt.
3.2
Khăn ướt (wet wipes)
Sản phẩm được làm từ vải không dệt, được ngâm tẩm các dung dịch phù hợp, sử dụng an toàn cho người.
4 Yêu cầu
4.1 Sai lệch kích thước
Khăn ướt dạng hình vuông hoặc hình chữ nhật, có kích thước tùy theo quy định của nhà sản xuất. Sai lệch kích thước như sau:
- Theo chiều dài: - 5 %
- Theo chiều rộng: - 5 %
4.2 Ngoại quan
Khăn ướt không được có các khuyết tật cơ học như vết thủng, rách.
Khăn ướt phải sạch, không có vết ố, không có các tạp chất lạ. Bề mặt khăn không được có các xơ sợi còn bám lại.
Hình dáng khăn ướt phẳng, cân đối, các nếp gấp thẳng, đều.
4.3 Yêu cầu hóa lý
Khăn ướt phải đáp ứng các yêu cầu hóa lý quy định ở Bảng 1.
Bảng 1 - Yêu cầu hóa lý
| Tên chỉ tiêu | Mức quy định | Phương pháp thử |
| 1. Lượng chất lỏng, %, không nhỏ hơn | 170 | Điều 5.4 |
| 2. pH nước ép | 4,5 đến 7,5 | Điều 5.5 |
| 3. Hàm lượng formaldehyt mg/kg, không lớn hơn |
| TCVN 7421-1:2013 (ISO 14184-1:2011) |
| - Khăn ướt dùng cho trẻ em dưới 36 tháng tuổi | 30 | |
| - Khăn ướt dùng cho các đối tượng khác | 75 | |
| 4. Chất tăng trắng quang học | Không phát hiện | Phụ lục B |
| 5. Độ kích ứng da | Không đáng kể | ISO 10993-10:2010 |
| 6. Tính năng đóng gói kín | Đạt | Phụ lục A |
| 7. Độ bền kéo đứt, N, không nhỏ hơn |
| TCVN 10041-3:2013 (ISO 9073-3:1989) |
| - Theo chiều dọc | 60 | |
| - Theo chiều ngang | 15 |
4.4 Giới hạn vi sinh vật
Khăn ướt phải đáp ứng các giới hạn vi sinh vật quy định ở Bảng 2.
Bảng 2 - Giới hạn vi sinh vật
| Tên chỉ tiêu | Mức qui định | Phương pháp thử | |
| Khăn ướt dùng cho trẻ em dưới 36 tháng tuổi | Khăn ướt dùng cho các đối tượng khác | ||
| 1. Tổng số vi sinh vật đếm được, CFU/g, không lớn hơn | 500 | 1 000 | Phụ lục C |
| 2. Sự có mặt của vi sinh vật gây bệnh: P. aeruginosa, S. aureus, C. albicans. | Không được có trong 0,1 g mẫu thử | Phụ lục D | |
5 Phương pháp thử
5.1 Lấy mẫu
Trừ khi có quy định khác, từ một lô sản phẩm lấy ngẫu nhiên, đại diện các gói khăn ướt để có được số lượng khăn ướt đủ để thử và lưu mẫu đối với các chỉ tiêu được quy định trong tiêu chuẩn này.
CHÚ THÍCH Các gói khăn ướt được dùng để thử hàm lượng chất lỏng, pH nước ép, hàm lượng formaldehyt, độ kích ứng da, tính năng đóng gói kín và xác định chỉ tiêu vi sinh phải là gói nguyên, chưa được mở. Mẫu thử được lấy từ đơn vị bao gói nhỏ nhất.
5.2 Ngoại quan
Kiểm tra yêu cầu ngoại quan của khăn ướt bằng mắt thường.
5.3 Xác định sai lệch kích thước
5.3.1 Cách tiến hành
Bỏ lớp bao gói ngoài, lấy khăn ướt ra trong trạng thái không biến dạng. Đặt tờ khăn ướt phẳng đều, không bị kéo căng, không còn nếp gấp trên một bề mặt phẳng.
Dùng thước thẳng, có độ chính xác 1 mm, đo:
- kích thước chiều dài của từng mẫu: khi xác định sai lệch theo chiều dài.
- kích thước chiều rộng của từng mẫu: khi xác định sai lệch theo chiều rộng.
Thực hiện phép đo với sáu miếng khăn ướt. Tính giá trị trung bình các kết quả thu được của 6 mẫu thử, tính bằng phần trăm, theo công thức (1). Kết quả được làm tròn đến hai chữ số sau dấu phẩy.
CHÚ THÍCH Có thể sử dụng cùng một mẫu thử để đo cả chiều dài và chiều rộng của mẫu.
5.3.2 Tính kết quả
Sai lệch theo chiều dài và sai lệch theo chiều rộng của khăn ướt, tính theo công thức (1):
| Sai lệch = | Giá trị trung bình - Giá trị danh định | x 100 | (1) |
| Giá trị danh định |
5.4 Xác định lượng chất lỏng
Từ một gói khăn ướt lấy theo 5.1, dùng kẹp lấy một tờ ở trên cùng, một tờ ở giữa và một tờ ở dưới cùng để tạo thành mẫu thử (nếu số lượng tờ trong một gói khăn ướt nhỏ hơn ba thì lấy theo số lượng thực tế). Ngay sau đó sử dụng cân phân tích có độ chính xác 0,01 g để cân. Sau đó dùng nước cất hoặc nước khử ion để rửa mẫu cho đến khi không nhìn thấy bọt. Đặt mẫu vào tủ sấy sao cho mẫu thử không tiếp xúc với thành tủ và sấy ở nhiệt độ (85 ± 2) °C trong 4 h. Kết thúc thời gian sấy, lấy mẫu ra, để trong bình hút ẩm và cân lại khối lượng. Lượng chất lỏng của mẫu, tính bằng phần trăm, được xác định theo công thức (2). Kết quả được làm tròn đến hai chữ số sau dấu phẩy.
| Lượng chất lỏng = | mts - mss | x 100 | (2) |
| mss |
trong đó:
mts là khối lượng mẫu thử trước khi sấy, tính bằng gam.
mss là khối lượng mẫu thử sau khi sấy, tính bằng gam.
Thực hiện ba phép thử như trên với các mẫu thử được lấy từ các gói khăn ướt khác nhau. Kết quả phép thử là giá trị trung bình lượng chất lỏng của 3 lần thử được xác định là lượng chất lỏng của sản phẩm đó.
CHÚ THÍCH Để đơn giản hơn, có thể lấy 9 mẫu thử ở 3 gói khăn ướt (với gói khăn ướt có nhiều hơn ba tờ khăn) hoặc ở 9 gói khăn ướt (với gói khăn ướt có ít hơn ba tờ khăn) và thực hiện theo cách tiến hành ở trên.
5.5 Xác định pH nước ép
5.5.1 Thiết bị, dụng cụ và thuốc thử
Sử dụng các thiết bị, dụng cụ thông thường trong phòng thí nghiệm và thuốc thử cấp phân tích.
5.5.1.1 Máy đo pH có điện cực thủy tinh và điện cực calomen và có độ chính xác ± 0,05 đơn vị pH.
5.5.1.2 Bình thủy tinh có nút nhám, dung tích 200 mL.
5.5.2 Chuẩn bị mẫu thử
Lấy ngẫu nhiên một số tờ khăn ướt sao cho có thể ép được 50 ml nước ép từ các mẫu theo 5.1.
5.5.3 Cách tiến hành
Cho mẫu thử đã được chuẩn bị theo 5.5.2. Dùng dụng cụ ép để ép lấy khoảng 50 ml nước ép, cho vào bình (5.5.1.2). Đậy nắp bình và để trong 1 h ở nhiệt độ (25 ± 2) °C. Sau thời gian trên, tiến hành đo pH của dung dịch này bằng máy đo pH (5.5.1.1).
5.5.4 Tính kết quả
Kết quả cuối cùng là giá trị trung bình các kết quả thu được từ ba lần thử, với độ chính xác đến ± 0,1 đơn vị pH.
6 Ghi nhãn, bao gói, vận chuyển và bảo quản
6.1 Ghi nhãn
Trên bao gói của khăn ướt phải được ghi nhãn bền, đầy đủ và rõ ràng với ít nhất các nội dung sau:
- Tên, thương hiệu, địa chỉ nhà sản xuất hoặc nhập khẩu, phân phối;
- Tên và nhãn hiệu sản phẩm;
- Đối tượng sử dụng (trẻ em dưới 36 tháng hoặc các đối tượng khác);
- Mục đích sử dụng khăn ướt;
- Kích thước, số lượng miếng khăn ướt trong mỗi gói;
- Thành phần chính cấu tạo sản phẩm;
- Hướng dẫn cách sử dụng;
- Ngày sản xuất, hạn sử dụng;
- Số hiệu tiêu chuẩn công bố áp dụng.
6.2 Bao gói
Vật liệu bao gói trực tiếp và tiếp xúc với sản phẩm không được gây ảnh hưởng đến chất lượng sản phẩm. Vật liệu đóng gói phải kín và chắc chắn, để đạt được mục đích vận chuyển và bảo quản sản phẩm trong điều kiện bình thường không bị dính bẩn.
6.3 Vận chuyển và bảo quản
Khi vận chuyển phải sử dụng các phương tiện vận chuyển sạch, tránh làm bẩn sản phẩm.
Sản phẩm khăn ướt phải được bảo quản tại nơi thoáng mát, khô ráo sạch sẽ, tránh côn trùng gặm nhấm, không gần nguồn nhiệt, tránh bụi và ánh sáng mặt trời trực tiếp.
Phụ lục A
(quy định)
Phương pháp thử tính năng đóng gói kín
A.1 Nguyên tắc
Đặt mẫu thử vào bên trong bình chân không của thiết bị thử độ kín, để mẫu thử ngập trong nước. Hút chân không trong bình chân không, xuất hiện sự chênh lệch áp suất bên trong và bên ngoài mẫu thử.
Quan sát hiện tượng khí bên trong mẫu thử thoát ra ngoài hoặc nước thấm vào bên trong mẫu thử để kết luận bao gói của mẫu thử có kín hay không.
A.2 Thiết bị, dụng cụ
A.2.1 Thiết bị thử độ kín
Thiết bị gồm một bình chân không có thể duy trì áp suất chân không từ 0 kPa đến 90 kPa, độ chính xác 1,5 % giá trị thang đo. Thời gian duy trì áp suất chân không từ 0,1 min đến 60 min. Hình A.1 là một ví dụ của thiết bị thử độ kín.
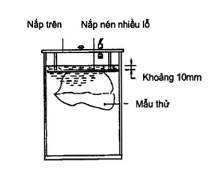
Hình A.1 - Thiết bị thử độ kín
A.2.2 Máy nén khí, cung cấp không khí áp suất dương, áp suất nguồn khí phải ≤ 0,7 MPa.
A.3 Lấy mẫu
A.3.1 Mẫu thử phải là đơn vị bao gói khăn ướt nhỏ nhất còn nguyên vẹn, đại diện cho một lô sản phẩm.
A.3.2 Số lượng mẫu thử cho cùng một lô hàng không ít hơn ba gói.
A.4 Cách tiến hành
A.4.1 Mở bình chân không, đổ một lượng nước sạch thích hợp vào trong bình và cho thêm một chút hóa chất vào bình để tạo cho nước có màu xanh hoặc đỏ. Lượng nước đổ vào phải sao cho sau khi đặt mẫu thử vào trong bình và đóng nắp trên lại, mức nước cao hơn mặt trên của nắp nhiều lỗ khoảng 10 mm là thích hợp.
A.4.2 Mở máy nén khí (A.2.2) được nối với thiết bị thử độ kín, đặt áp suất chân không cho thiết bị thử độ kín là 10 kPa ± 1 kPa, thời gian duy trì áp suất chân không là 30 s.
A.4.3 Đặt mẫu thử vào bên trong bình chân không, sau khi đậy nắp trên lại thì bắt đầu tiến hành thử nghiệm.
A.4.4 Quan sát hiện tượng rò rỉ khí của mẫu thử khi hút chân không và trong thời gian duy trì chân không, xem có xuất hiện bọt khí liên tục hay không. Nếu chỉ có một bọt khí thì coi như mẫu thử không bị rò rỉ. Trong quá trình thử, không tính đến các bọt khí xuất hiện bên ngoài bao bì.
CHÚ THÍCH Đảm bảo trong thời gian duy trì áp suất chân không, có thể quan sát được tất cả các vị trí của mẫu thử, mỗi lần có thể thử 2 mẫu hoặc 3 mẫu.
A.4.5 Kết thúc phép thử, mở nắp thiết bị, lấy mẫu thử ra, lau sạch nước bám trên bề mặt, mở bao bì để kiểm tra bên trong mẫu thử xem có nước thử tràn vào hay không.
A.4.6 Lặp lại các bước từ A.4.3 đến A.4.4 với hai mẫu thử còn lại.
A.5 Đánh giá kết quả thử
Khi hút chân không và trong thời gian duy trì chân không, nếu cả ba mẫu thử không phát sinh bọt khí liên tục và khi mở bao bì để kiểm tra bên trong mẫu thử không có nước thử tràn vào, thì kết luận mẫu thử “đạt” về tính năng đóng gói kín.
Nếu trong ba mẫu thử có hai mẫu trở lên không đạt, thì kết luận mẫu thử “không đạt” về tính năng đóng gói kín.
Nếu trong ba mẫu thử có một mẫu không đạt, thì thực hiện thử nghiệm lại trên ba mẫu thử mới. Sau khi thử nghiệm lại, nếu ba mẫu thử đều đạt thì kết luận mẫu thử “đạt” về tính năng đóng gói kín, nếu không thì kết luận mẫu thử “không đạt” về tính năng đóng gói kín.
Phụ lục B
(quy định)
Xác định chất tăng trắng quang học
B.1 Thiết bị, dụng cụ
Đèn tử ngoại, bước sóng 254 nm và 365 nm, có thiết bị bảo vệ mắt.
B.2 Cách tiến hành
Để mẫu thử dưới đèn tử ngoại (B.1), quan sát hiện tượng phát huỳnh quang.
Kiểm tra xem có hiện tượng phát huỳnh quang hay không.
B.3 Biểu thị kết quả
Nếu mẫu thử khi soi dưới đèn tử ngoại không có hiện tượng phát huỳnh quang thì kết luận là mẫu thử “không có chất tăng trắng quang học”.
Nếu có hiện tượng phát huỳnh quang thì kết luận là mẫu thử “có chất tăng trắng quang học”.
Phụ lục C
(quy định)
Xác định tổng số vi sinh vật hiếu khí
C.1 Nguyên tắc
Xác định tổng số vi khuẩn hiếu khí và nấm trong khăn ướt trong môi trường dinh dưỡng thích hợp và ủ trong các điều kiện quy định. Tổng số vi khuẩn hiếu khí và nấm trên gam mẫu thử được xác định từ số lượng khuẩn lạc đếm được.
C.2 Môi trường và thuốc thử
Sử dụng các môi trường dinh dưỡng và dung dịch pha loãng thích hợp trong phương pháp đếm số lượng vi khuẩn hiếu khí, nấm men và nấm mốc. Các môi trường và dung dịch pha loãng thích hợp khác cũng có thể được sử dụng nếu chúng được chứng minh là phù hợp. Có thể chuẩn bị từ môi trường khô loại thương mại theo chỉ dẫn của nhà sản xuất.
C.2.1 Môi trường đếm vi khuẩn hiếu khí và nấm
— Môi trường thạch casein đậu tương (CSA): để đếm tổng số vi khuẩn hiếu khí.
| Casein thủy phân bởi pancreatin | 15,0 g |
|
| Bột đậu tương thủy phân bởi papain | 5,0 g |
|
| Natri clorua | 5,0 g |
|
| Thạch | 15,0 g |
|
| Nước tinh khiết | 1 000 ml |
|
Điều chỉnh pH sao cho sau khi hấp tiệt khuẩn, môi trường có pH 7,3 ± 0,2 ở 25 °C.
— Môi trường thạch Sabouraud dextrose (SA): để đếm tổng số nấm mốc và nấm men.
| Dextrose | 40,0 g |
|
| Casein thủy phân bởi pancreatin | 5,0 g |
|
| Pepton từ mô động vật | 5,0 g |
|
| Cloramphenicol | 0,05 g |
|
| Thạch | 15,0 g |
|
| Nước tinh khiết | 1 000 ml |
|
Điều chỉnh pH sao cho sau khi hấp tiệt khuẩn, môi trường có pH 5,6 ± 0,2 ở 25 °C.
C.2.2 Hóa chất và thuốc thử
- Dung dịch đệm phosphat pH 7,2 vô khuẩn. -
Dung dịch đệm gốc: Cân 34 g kali dihydrophosphat và cho vào bình định mức 1 000 ml, thêm 500 ml nước tinh khiết, điều chỉnh pH 7,2 ± 0,2 bằng natri hydroxit. Thêm nước tinh khiết tới vạch, trộn đều. Phân chia vào các bình, tiệt khuẩn, bảo quản ở 2 °C đến 8 °C.
Dung dịch đệm phosphat pH 7,2: Pha loãng dung dịch đệm gốc với nước tinh khiết theo tỷ lệ 1:800 (V/V) và tiệt khuẩn.
- Dung dịch etanol 70 % (V/V).
- Dung dịch nước muối sinh lí vô khuẩn 0,9 % (m/V).
C.3 Thiết bị, dụng cụ
C.3.1 Pipet chia vạch vô trùng 1 ml, 5 ml, 10 ml
C.3.2 Các dụng cụ vô trùng: kẹp, kéo, gạc
C.3.3 Ống nghiệm nút xoáy 16 x 125 và 20 x 150 mm
C.3.4 Bình có nút xoáy
C.3.5 Cân có độ nhạy 0,01 g
C.3.6 Đĩa petri (15 x 100) mm
C.3.7 Tủ ấm
C.3.8 Laminar flow hoặc tủ an toàn sinh học
C.4 Bảo quản mẫu thử nghiệm
Tiến hành thử nghiệm trong thời gian sớm nhất sau khi nhận mẫu. Bảo quản mẫu theo điều kiện ghi trên nhãn. Không được ủ ấm, để lạnh hoặc làm đông mẫu trước hoặc sau khi thử nghiệm.
Kiểm tra mẫu cẩn thận trước khi mở bao gói và lưu ý những bất thường trên bao bì sản phẩm.
C.5 Cách tiến hành:
Tiến hành thao tác trong Laminar flow hoặc tủ an toàn sinh học. Các thao tác với vi sinh vật gây bệnh được thực hiện trong tủ an toàn sinh học.
C.5.1 Lấy mẫu và chuẩn bị mẫu thử
Trước khi mở và lấy mẫu, tiệt trùng bề mặt bao bì sản phẩm bằng dung dịch etanol 70 % (V/V). Để khô bề mặt bao bì trước khi mở.
Trong điều kiện vô trùng, cân 10 g mẫu thử vào bình có nút xoáy, có thể cắt nhỏ mẫu bằng kéo vô trùng nếu cần. Thêm 90 ml dung dịch đệm phosphat pH 7,2 vô trùng và khuấy trộn đều thu được dung dịch có độ pha loãng 10-1. Có thể tiếp tục pha loãng mẫu theo tỷ lệ 1:10 nếu số lượng vi sinh vật trong mẫu thử quá lớn hoặc khả năng kháng khuẩn của mẫu thử ở độ pha loãng 10-1 vẫn hiện diện.
C.5.2 Xác định số lượng
C.5.2.1 Kĩ thuật cấy trải bề mặt thạch
Sử dụng kĩ thuật cấy trải bề mặt thạch giúp dễ dàng nhận thấy sự khác biệt giữa các loại khuẩn lạc khác nhau và số lượng của chúng. Chuẩn bị và ghi nhãn các đĩa chứa môi trường (Ví dụ: ghi nhãn từ 10-1 đến 10-3), độ pha loãng tùy thuộc vào mức độ tạp nhiễm của mẫu thử, mỗi độ pha loãng sử dụng 2 đĩa petri. Thêm 1 ml hoặc 2 ml dung dịch có độ pha loãng 10-1 đã chuẩn bị (tham khảo ở Điều C.5.1) sau đó thêm 9 ml hoặc 18 ml dung dịch đệm phosphat pH 7,2, trộn đều bằng máy vortex, để được dung dịch có độ pha loãng 10-2. Tiếp tục pha loãng mẫu thử như trên để thu được dung dịch có độ pha loãng 10-3.
Đổ vào mỗi đĩa petri khoảng 15 ml đến 20 ml môi trường đã được tiệt trùng và để nguội xuống 48 °C, để môi trường trong đĩa đông tự nhiên ở nhiệt độ phòng (chú ý thao tác này được tiến hành trong Laminar flow hoặc tủ an toàn sinh học).
Trộn kĩ từng độ pha loãng và lấy không dưới 0,1 ml của từng độ pha loãng để cấy lên bề mặt đĩa thạch.
Dùng que gạt vô khuẩn trải đều dung dịch mẫu thử trên bề mặt thạch. Sử dụng que gạt mới đối với mỗi độ pha loãng.
C.5.2.2 Kĩ thuật đổ đĩa thạch
Sử dụng kĩ thuật đổ đĩa thạch có thể phát hiện số lượng nhỏ vi sinh vật. Chuẩn bị và ghi nhãn các đĩa chứa môi trường (Ví dụ: ghi nhãn từ 10-1 đến 10-3), độ pha loãng tùy thuộc vào mức độ tạp nhiễm của mẫu thử, mỗi độ pha loãng sử dụng 2 đĩa petri.
Chuẩn bị dãy các độ pha loãng giống như mô tả trong Điều C.5.2.1.
Lấy 1 ml của từng độ pha loãng vào các đĩa petri tương ứng.
Thêm khoảng 15 ml đến 20 ml môi trường vào các đĩa petri. Đậy nắp và cẩn thận lắc nhẹ các đĩa petri để môi trường và mẫu trộn lẫn với nhau.
Để môi trường trong đĩa đông tự nhiên ở nhiệt độ phòng.
C.5.3 Nuôi cấy
Để xác định tổng số vi khuẩn: Lật úp đĩa thạch, ủ trong tủ ấm (32,5 ± 2,5) °C trong (72 ± 6) h.
Để xác định tổng số nấm mốc, nấm men: Lật úp đĩa thạch, ủ trong tủ ấm (25 ± 2,5) °C trong 3 ngày đến 5 ngày hoặc (22,5 ± 2,5) °C trong 5 ngày đến 7 ngày (trong trường hợp sử dụng môi trường không chứa kháng sinh).
C.5.4 Đếm khuẩn lạc
Sau thời gian nuôi cấy, đếm số khuẩn lạc ở từng độ pha loãng. Sử dụng số khuẩn lạc đáp ứng tiêu chí sau để tính toán kết quả:
Đối với đếm tổng số vi khuẩn: chọn đĩa petri có từ 30 đến 300 khuẩn lạc
Đối với đếm tổng số nấm mốc và nấm men: chọn đĩa petri có từ 15 đến 150 khuẩn lạc
Tính số lượng trung bình của số khuẩn lạc trong đĩa đáp ứng tiêu chí trên, nhân với độ pha loãng và báo cáo kết quả số lượng vi khuẩn hiếu khí, nấm mốc và nấm men trong 1 g mẫu thử ban đầu.
C.5.5 Trung hòa tác dụng của chất ức chế trong mẫu thử
Các mẫu thử có chứa chất ức chế (hay chất bảo quản) phải được trung hòa một cách thích hợp trước khi tiến hành thử nghiệm, cần kiểm tra dư lượng chất bảo quản còn trong mẫu thử bằng cách cho tiếp xúc với các vi sinh vật thích hợp.
Sử dụng hai chủng đại diện cho vi khuẩn Gram dương và vi khuẩn Gram âm là Staphylococcus aureus ATCC 6538, Pseudomonas aeruginosa ATCC 9027 (có thể thay chủng vi khuẩn Gram âm bằng chủng Escherichia coli ATCC 8739) và một chủng nấm men là Candida albicans ATCC 10231 để thẩm định hiệu quả của chất trung hòa.
C.5.5.1 Chuẩn bị chủng
Đối với chủng vi khuẩn, cấy vào bề mặt môi trường CSA. Đối với nấm Candida albicans, cấy vào môi trường SA. Ủ ở (32,5 ± 2,5) °C trong 18 h đến 24 h. Để thu được vi sinh vật, sử dụng que cấy vô trùng gạt lên bề mặt môi trường và hòa vi sinh vật vào dung dịch nước muối sinh lí vô khuẩn 0,9 % và điều chỉnh sao cho hỗn dịch chủng có nồng độ 108 CFU/ml (đối với vi khuẩn) và 106 CFU/ml (đối với Candida albicans).
C.5.5.2 Kĩ thuật cấy trải bề mặt thạch
Trộn 9 ml mẫu thử có độ pha loãng 10-1 và/hoặc các độ pha loãng khác với 1 ml hỗn dịch chủng có chứa 10 000 CFU/ml đến 30 000 CFU/ml (có thể sử dụng hỗn dịch chủng có nồng độ nhỏ hơn nếu lượng mẫu cấy trải là 0,5 ml hoặc 1 ml). Lấy không dưới 0,1 ml mẫu thử này cấy trải lên bề mặt môi trường trong đĩa petri (sử dụng 2 đĩa petri đối với mỗi chủng vi sinh vật).
Song song làm mẫu đối chứng chỉ chứa vi sinh vật và môi trường mà không chứa mẫu thử. Đậy nắp, lật úp đĩa thạch, ủ trong tủ ấm (32,5 ± 2,5) °C trong 24 h đến 72 h đối với vi khuẩn và (25 ± 2,5) °C trong 3 đến 5 ngày đối với Candida albicans.
Sau thời gian nuôi cấy, đếm số lượng khuẩn lạc trên các đĩa petri và so sánh số lượng khuẩn lạc thu được trên mẫu thử và mẫu đối chứng. Tổng số vi sinh vật đếm được trên mẫu thử phải không dưới 50 % so với mẫu đối chứng.
C.5.5.3 Kĩ thuật đổ đĩa thạch
Trộn 9 ml mẫu thử có độ pha loãng 10-1 và/hoặc các độ pha loãng khác với 1 ml hỗn dịch chủng có chứa 1 000 CFU/ml đến 3 000 CFU/ml. Lấy 1 ml mẫu thử này cho vào đĩa petri (sử dụng 2 đĩa petri đối với mỗi chủng vi sinh vật). Thêm khoảng 15 ml đến 20 ml môi trường vào các đĩa petri.
Song song làm mẫu đối chứng chỉ chứa vi sinh vật và môi trường mà không chứa mẫu thử. Đậy nắp và cẩn thận lắc nhẹ các đĩa petri để môi trường, mẫu và chủng vi sinh vật trộn lẫn với nhau. Để môi trường trong đĩa đông tự nhiên ở nhiệt độ phòng.
Lật úp đĩa thạch, ủ trong tủ ấm (32,5 ± 2,5) °C trong 24 h đến 72 h đối với vi khuẩn và (25 ± 2,5) °C trong 3 đến 5 ngày đối với Candida albicans.
Sau thời gian nuôi cấy, đếm số lượng khuẩn lạc trên các đĩa petri và so sánh số lượng khuẩn lạc thu được trên mẫu thử và mẫu đối chứng. Tổng số vi sinh vật đếm được trên mẫu thử phải không dưới 50 % so với mẫu đối chứng.
Phụ lục D
(quy định)
Xác định sự có mặt của vi sinh vật gây bệnh
D.1 Nguyên tắc
Xác định sự có mặt của vi sinh vật gây bệnh dựa trên các đặc tính sinh hóa của chúng trên môi trường đặc hiệu. Có thể sử dụng qui trình vi sinh khác, bao gồm cả các phương pháp tự động, nếu chúng được chứng minh là phù hợp.
D.2 Môi trường
Sử dụng các môi trường đặc hiệu thích hợp. Các môi trường khác cũng có thể được sử dụng nếu chúng được chứng minh là phù hợp. Có thể chuẩn bị từ môi trường khô loại thương mại theo chỉ dẫn của nhà sản xuất.
— Môi trường lỏng casein đậu tương.
| Casein thủy phân bởi pancreatin | 17,0 g |
|
| Bột đậu tương thủy phân bởi papain | 3,0 g |
|
| Natri clorua | 5,0 g |
|
| Dikali hydrophosphat | 2,5 g |
|
| Glucose monohydrat | 2,5 g |
|
| Nước tinh khiết | 1 000 ml |
|
Điều chỉnh pH sao cho sau khi hấp tiệt khuẩn, môi trường có pH 7,3 ± 0,2 ở 25 °C.
— Môi trường thạch cetrimid
| Gelatin thủy phân bởi pancreatin | 20,0 g |
|
| Magnesi clorid | 1,4 g |
|
| Dikali sulfat | 10,0 g |
|
| Cetrimid | 0,3 g |
|
| Thạch | 13,6 g |
|
| Nước tinh khiết | 1 000 ml |
|
| Glycerol | 10 ml |
|
Đun sôi trong 1 min, khuấy đều. Điều chỉnh pH sao cho sau khi hấp tiệt khuẩn, môi trường có pH 7,2 ± 0,2 ở 25 °C.
— Môi trường thạch muối manitol
| Casein thủy phân bởi pancreatin | 5,0 g |
|
| Pepton từ mô động vật | 5,0 g |
|
| Cao thịt bò | 1,0 g |
|
| D-Manitol | 10,0 g |
|
| Natri clorua | 75,0 g |
|
| Thạch | 15,0 g |
|
| Phenol đỏ | 0,025 g |
|
| Nước tinh khiết | 1 000 ml |
|
Đun sôi trong 1 min, lắc đều. Điều chỉnh pH sao cho sau khi hấp tiệt khuẩn, môi trường có pH 7,4 ± 0,2 ở 25 °C.
— Môi trường lỏng sabouraud-dextrose
| Dextrose | 20,0 g |
|
| Casein thủy phân bởi pancreatin | 5,0 g |
|
| Pepton từ mô động vật | 5,0 g |
|
| Nước tinh khiết | 1000 ml |
|
Điều chỉnh pH sao cho sau khi hấp tiệt khuẩn, môi trường có pH 5,6 ± 0,2 ở 25 °C.
— Môi trường thạch sabouraud-dextrose (xem Điều C.2.1)
D.3 Thiết bị, dụng cụ
D.3.1 Pipet chia vạch vô trùng 1 ml
D.3.2 Gạc vô trùng kích thước 4x4 inch
D.3.3 Kẹp vô trùng
D.3.4 Ống nghiệm nút xoáy 16 x 125 mm
D.3.5 Đĩa petri 15 x 100 mm
D.3.6 Tủ ấm
D.3.7 Laminar flow hoặc tủ an toàn sinh học
D.4 Cách tiến hành
Các thao tác được thực hiện trong Laminar flow hoặc tủ an toàn sinh học. Các thao tác với vi sinh vật gây bệnh được thực hiện trong tủ an toàn sinh học.
D.4.1 Xác định sự có mặt của Pseudomonas aeruginosa
Cấy 1 ml dung dịch có độ pha loãng 10-1 đã chuẩn bị ở Điều C.5.1 vào ít nhất 10 ml môi trường lỏng casein đậu tương, trộn đều. Ủ ở 30 °C đến 35 °C trong 18 h đến 24 h.
Nếu có dấu hiệu phát triển của vi sinh vật, cấy chuyển sang đĩa môi trường thạch cetrimid và ủ ở 30 °C đến 35 °C trong 18 h đến 72 h.
Khuẩn lạc mọc trên môi trường cho thấy mẫu thử có thể có P. aeruginosa. Tiếp tục xác định bằng nhiều phản ứng sinh hóa khác, ví dụ: kit API 20 NE (Bio Merieux) v.v....
Mẫu thử không có P. aeruginosa nếu không có khuẩn lạc mọc trên môi trường hoặc các phản ứng sinh hóa để xác định P. aeruginosa có kết quả âm tính.
D.4.2 Xác định sự có mặt của Staphylococcus aureus
Sử dụng ống môi trường lỏng casein đậu tương thu được ở Điều D.4.1. (sau khi ủ ở 30 °C đến 35 °C trong 18 h đến 24 h).
Nếu có dấu hiệu phát triển của vi sinh vật, cấy chuyển sang đĩa môi trường thạch muối manitol và ủ ở 30 °C đến 35 °C trong 18 h đến 72 h.
Khuẩn lạc màu vàng hoặc trắng có vòng màu vàng bao quanh mọc trên môi trường cho thấy mẫu thử có thể có S. aureus. Tiếp tục xác định bằng nhiều phản ứng sinh hóa khác, ví dụ: kit API Staph (Bio Merieux) v.v....
Mẫu thử không có S. aureus nếu không có khuẩn lạc có đặc điểm mô tả ở trên mọc trên môi trường hoặc các phản ứng sinh hóa để xác định S. aureus có kết quả âm tính.
D.4.3 Xác định sự có mặt của Candida albicans
Cấy 1 ml dung dịch có độ pha loãng 10-1 đã chuẩn bị ở Điều C.5.1 vào ít nhất 10 ml môi trường lỏng Sabouraud-dextrose, trộn đều. Ủ ở 30 °C đến 35 °C trong 3 ngày đến 5 ngày.
Nếu có dấu hiệu phát triển của vi sinh vật, cấy chuyển sang môi trường thạch Sabouraud-dextrose và ủ ở 30 °C đến 35 °C trong 24 h đến 48 h.
Khuẩn lạc màu trắng mọc trên môi trường cho thấy mẫu thử có thể có C. albicans. Tiếp tục xác định bằng nhiều phản ứng sinh hóa khác, ví dụ: kit API 20C AUX (Bio Merieux) v.v...
Mẫu thử không có C. albicans nếu không có khuẩn lạc có đặc điểm mô tả ở trên mọc trên môi trường hoặc các phản ứng sinh hóa để xác định C. albicans có kết quả âm tính.
Thư mục tài liệu tham khảo
[1] Thông tư số 37/2015/TT-BCT ngày 30 tháng 10 năm 2015 của Bộ công thương qui định về mức giới hạn và kiểm tra hàm lượng formaldehyt và amin thơm chuyển hóa từ thuốc nhuộm azo trong sản phẩm dệt may.
[2] Thông tư số 06/2011/TT-BYT ngày 25 tháng 01 năm 2011 của Bộ y tế quy định về quản lý mỹ phẩm.
[3] Nghị định 89/2006/NĐ-CP ngày 30 tháng 8 năm 2006 của Chính phủ về nhãn hàng hóa.
[4] GB/T 27728:2011, Wet wipes.
[5] TCVN 10042:2013 (ISO 9092:2011), Vật liệu dệt - Vải không dệt - Thuật ngữ, định nghĩa.
[6] Enumeration of aerobic mesophilic bacteria, yeast and mould, ngày 04 tháng 10 năm 2013.
MỤC LỤC
Lời nói đầu
1 Phạm vi áp dụng
2 Tài liệu viện dẫn
3 Thuật ngữ và định nghĩa
4 Yêu cầu
4.1 Sai lệch kích thước
4.2 Ngoại quan
4.3 Yêu cầu hóa lý
4.4 Giới hạn vi sinh vật
5 Phương pháp thử
5.1 Lấy mẫu
5.2 Ngoại quan
5.3 Xác định sai lệch kích thước
5.4 Xác định lượng chất lỏng
5.5 Xác định pH nước ép
6 Ghi nhãn, bao gói, vận chuyển và bảo quản
6.1 Ghi nhãn
6.2 Bao gói
6.3 Vận chuyển và bảo quản
Phụ lục A (quy định) Phương pháp thử tính năng đóng gói kín
Phụ lục B (quy định) Xác định chất tăng trắng quang học
Phụ lục C (quy định) Xác định tổng số vi sinh vật hiếu khí
Phụ lục D (quy định) Xác định sự có mặt của vi sinh vật gây bệnh
Thư mục tài liệu tham khảo
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 11528:2016 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 11528:2016 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 11528:2016 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 11528:2016 DOC (Bản Word)