- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn quốc gia TCVN 8710-28:2023 Bệnh thủy sản - Quy trình chẩn đoán - Phần 28
| Số hiệu: | TCVN 8710-28:2023 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
13/11/2023 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 8710-28:2023
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 8710-28:2023
TIÊU CHUẨN QUỐC GIA
TCVN 8710-28:2023
BỆNH THỦY SẢN - QUY TRÌNH CHẨN ĐOÁN - PHẦN 28: BỆNH DO RSIV Ở CÁ BIỂN
Aquatic animal disease - Diagnostic procedure - Part 28: Red sea bream iridoviral disease
Lời nói đầu
TCVN 8710-28:2023 được xây dựng trên cơ sở tham khảo OIE/WOAH (2019) Manual of Diagnostic Tests for Aquatic Animal, Chapter 2.3.8 Red Seabream Iridoviral Disease.
TCVN 8710-28:2023 do Trung tâm Chẩn đoán thú y Trung ương, Cục Thú y biên soạn, Bộ Nông nghiệp và Phát triển nông thôn đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Bộ tiêu chuẩn TCVN 8710 Bệnh thủy sản - Quy trình chẩn đoán gồm các phần sau đây:
- TCVN 8710-1:2011, Phần 1: Bệnh còi do vi rút ở tôm;
- TCVN 8710-2:2019, Phần 2: Bệnh hoại tử thần kinh ở cá biển;
- TCVN 8710-3:2019, Phần 3: Bệnh đốm trắng ở tôm;
- TCVN 8710-4:2019, Phần 4: Bệnh đầu vàng ở tôm;
- TCVN 8710-5:2023, Phần 5: Hội chứng taura ở tôm;
- TCVN 8710-6:2019, Phần 6: Bệnh do Koi herpes vi rút ở cá chép;
- TCVN 8710-7:2019, Phần 7: Bệnh xuất huyết mùa xuân ở cá chép;
- TCVN 8710-8:2023, Phần 8: Bệnh hoại tử cơ ở tôm(IMNV);
- TCVN 8710-9:2012, Phần 9: Bệnh hoại tử gan tụy ở tôm;
- TCVN 8710 10:2015, Phần 10: Bệnh do Perkinsus marinus ở nhuyễn thể hai mảnh vỏ;
- TCVN 8710-11:2015, Phần 11: Bệnh do Perkinsus olseni ở nhuyễn thể hai mảnh vỏ;
- TCVN 8710-12:2019, Phần 12: Bệnh vi bào tử do Enterocytozoon hepatopenaei ở tôm;
- TCVN 8710-13:2015, Phần 13: Bệnh gan tụy do Parvovirus ở tôm;
- TCVN 8710 14:2015, Phần 14: Hội chứng lở loét (EUS) ở cá;
- TCVN 8710-15:2015, Phần 15: Bệnh nhiễm trùng do Aeromonas hydrophila ở cá;
- TCVN 8710-16:2016, Phần 16: Bệnh gan thận mủ ở cá da trơn;
- TCVN 8710-17:2016, Phần 17: Bệnh sữa trên tôm hùm;
- TCVN 8710-19:2019, Phần 19: Bệnh hoại tử gan tụy cấp tính ở tôm;
- TCVN 8710-20:2019, Phần 20: Bệnh hoại tử dưới vỏ và cơ quan tạo máu ở tôm;
- TCVN 8710-21:2019, Phần 21: Bệnh do vi khuẩn Streptococcus agalactiae ở cá;
- TCVN 8710-22:2022, Phần 22: Bệnh sán lá 16 móc ở cá;
- TCVN 8710-23:2022, Phần 23: Bệnh hoại tử cơ quan tạo máu do IHNV ở cá hồi;
- TCVN 8710-24:2022, Phần 24: Bệnh do sán lá Dollfustrema sp. ở cá da trơn;
- TCVN 8710-25:2022, Phần 25: Bệnh do ký sinh trùng Bonamia ostreae và Bonamia exitiosa ở hàu;
- TCVN 8710-26:2023, Phần 26: Bệnh hoại tử cơ quan tạo máu do EHNV ở cá;
- TCVN 8710-27:2023, Phần 27: Bệnh do vi rút Tilapia lake (TiLV) ở cá rô phi
- TCVN 8710-28:2023, Phần 28: Bệnh do RSIV ở cá biển.
BỆNH THỦY SẢN - QUY TRÌNH CHẨN ĐOÁN - PHẦN 28: BỆNH DO RSIV Ở CÁ BIỂN
Aquatic animal disease - Diagnostic procedure - Part 28: Red sea bream iridoviral disease
CẢNH BÁO - Việc áp dụng tiêu chuẩn này có thể liên quan đến các vật liệu, thiết bị và các thao tác gây nguy hiểm. Tiêu chuẩn này không thể đưa ra được hết tất cả các vấn đề an toàn liên quan đến việc sử dụng chúng. Người sử dụng tiêu chuẩn này phải tự thiết lập các thao tác an toàn sức khỏe thích hợp và xác định khả năng áp dụng các giới hạn quy định trước khi sử dụng tiêu chuẩn.
1 Phạm vi áp dụng
Tiêu chuẩn này quy định quy trình chẩn đoán bệnh do RSIV ở cá biển.
2 Thuật ngữ, định nghĩa và các từ viết tắt
2.1 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng các thuật ngữ và định nghĩa sau:
2.1.1
Bệnh do RSIV ở cá biển (Red sea bream iridoviral disease)
Bệnh truyền nhiễm nguy hiểm do tác nhân RSIV (red sea bream iridovirus) gây ra ở cá tráp biển đỏ nuôi (Pagrus major) và ở hơn 30 loài cá biển thuộc họ Perciformes và Pleuronectiformes. Cá bị mắc bệnh trở nên lờ đờ, biểu hiện thiếu máu nghiêm trọng, đốm xuất huyết ở mang và lách to.
2.1.2
Vi rút Red sea bream iridovirus - RSIV
Là vi rút thuộc chi Megalocytivirus trong họ Iridoviridae, có hệ gen là một ADN mạch kép thẳng có kích thước ~ 112 kbp với hàm lượng G + C từ 53-55%, vi rút hình đa diện có 20 mặt, đường kính nhân 140-160nm, vỏ bao quanh đường kính 220-240nm. Chi Megalocytivirus bao gồm Vi rút RSIV (Red sea bream iridovirus), vi rút ISKNV (Infectious spleen and kidney necrosis virus) và vi rút TRBIV (Turbot reddish body iridovirus).
CHÚ THÍCH: Theo OIE/WOAH (2019) Manual of Diagnostic Tests for Aquatic Animal, Chapter 2.3.8 Red Seabream Iridoviral Disease, vi rút RSIV và ISKNV đều là tác nhân gây bệnh RSIVD, vi rút TRBIV là tác nhân gây bệnh cho một số loài cá Bơn nhưng chưa có nghiên cứu về vai trò của vi rút TRBIV đối với bệnh RSIVD. Tiêu chuẩn này tập trung đến tác nhân vi rút RSIV gây bệnh RSIVD. Cặp mồi phát hiện ISKNV và TRBIV có được đề cập để chẩn đoán phân biệt với vi rút RSIV trong trường hợp cần thiết.
2.2 Các từ viết tắt
| - RSIV. | Red sea bream iridovirus; |
| - ISKNV: | Infectious spleen and kidney necrosis virus; |
| - TRBIV: | Turbot reddish body iridovirus; |
| - ADN (Deoxyribonucleic acid): | Axit deoxyribonucleic; |
| - ARN (Ribonucleic acid): | Axit ribonucleic; |
| - CPE (cytopathic effect): | Bệnh tích tế bào; |
| - FBS (Fetal bovine serum): | Huyết thanh nhau thai bò; |
| - PBS (Phosphate buffered saline): | Dung dịch muối đệm phosphat; |
| - PCR (Polymerase Chain Reaction): | Phản ứng chuỗi trùng hợp; |
| - TAE (Tris-acetate-EDTA): | Tris-axetat-axit etylendiamintetraaxetic; |
| - TBE (Tris-borate-EDTA): | Tris-borat-axit etylendiamintetraaxetic; |
| - TE (Tris-EDTA): | Tris-axit etylendiamintetraaxetic; |
| - GF (Grun fin): | Dòng tế bào Grun fin; |
| - BME (Eagle’s basal medium): | Môi trường BME. |
3 Thuốc thử và vật liệu thử
Chỉ sử dụng thuốc thử loại tinh khiết phân tích, sử dụng nước cất, nước khử khoáng hoặc nước có độ tinh khiết tương đương, trừ các trường hợp có quy định khác.
3.1 Thuốc thử và vật liệu thử dùng chung
3.1.1 Ethanol, từ 70 % đến ethanol tuyệt đối.
3.1.2 Dung dịch muối đệm phosphate (PBS), (xem A.2).
3.2 Thuốc thử và vật liệu thử dùng cho phương pháp sinh học phân tử
3.2.1 Cặp mồi (primes), gồm mồi xuôi và mồi ngược PCR
3.2.2 Cặp mồi (primes), gồm mồi xuôi và mồi ngược, Dò (Probe) realtime PCR
3.2.3 Kít tách chiết ADN
3.2.4 Kít nhân gen PCR
3.2.5 Kít nhân gen realtime PCR
3.2.6 Dung dịch đệm TE
3.2.7 Thang chuẩn ADN (ladder/ marker)
3.2.8 Nước tinh khiết, không có nuclease
3.2.9 Thạch agarose
3.2.10 Dung dịch đệm TAE hoặc TBE (xem A.1)
3.2.11 Chất nhuộm màu, Ví dụ: sybr safe
3.2.12 Chất đệm tải mẫu (loading dye 6X)
3.3 Thuốc thử và vật liệu dùng cho phương pháp nuôi cấy phân lập vi rút trên môi trường tế bào
3.3.1 FBS
3.3.2 GF
3.3.3 BME
4 Thiết bị, dụng cụ
Sử dụng thiết bị, dụng cụ thông thường của phòng thử nghiệm sinh học và những thiết bị, dụng cụ sau:
4.1 Thiết bị, dụng cụ dùng chung
4.1.1 Tủ lạnh, có thể duy trì ở nhiệt độ từ 2 °C đến 8 °C
4.1.2 Tủ lạnh âm sâu, có thể duy trì ở nhiệt độ từ âm 20 °C tới âm 80 °C
4.1.3 Buồng cấy an toàn sinh học cấp 2
4.1.4 Pipet đơn kênh các loại
4.1.5 Ống đong, dung tích 100 mL; 500 mL; 1000 mL
4.1.6 Máy ly tâm, có thể hoạt động với gia tốc 2 000 g đến 4 000 g và gia tốc 12 000 g
4.1.7 Máy nghiền mẫu
4.1.8 Cân phân tích, có thể cân chính xác đến 0,1 mg
4.1.9 Lọ dụng cụ chứa mẫu, kín, có nắp đậy, không rò rỉ, vô trùng
4.1.10 Panh, kéo, vô trùng
4.1.11 Máy ủ nhiệt, từ 0°C đến 100 °C
4.2 Thiết bị, dụng cụ dùng cho phương pháp sinh học phân tử
4.2.1 Máy nhân gen PCR
4.2.2 Máy realtime PCR
4.2.3 Máy tách chiết ADN/ARN
4.2.4 Máy lắc trộn vortex
4.2.5 Bộ điện di, gồm bộ nguồn và bể chạy điện di
4.2.6 Máy đọc sản phẩm PCR
4.3 Thiết bị, dụng cụ dùng cho phương pháp phân lập vi rút trên môi trường tế bào
4.3.1 Đĩa nuôi cấy 24 giếng (hoặc đĩa nuôi cấy 96 giếng)
4.3.2 Chai nuôi cấy tế bào, 25 cm2 (hoặc 75 cm2 hoặc 150 cm2)
4.3.3 Màng lọc, 0,45 μM
4.3.4 Tủ ấm lạnh, có thể duy trì ở nhiệt độ từ 0 °C đến 100 °C
4.3.5 Kính hiển vi soi ngược, vật kính có độ phóng đại 4 X và 10 X
5 Chẩn đoán lâm sàng
5.1 Đặc điểm dịch tễ
Bệnh RSIVD đã lan rộng đến các nước như: Nhật Bản, Đài Loan, Trung Quốc Hồng Kông, Hàn Quốc, Malaysia, Philippines, Singapore và Thái Lan.
Loài cảm nhiễm RSIV: Cá tráp đỏ (Pagrus major), cá tráp đen (Acanthopagrus schlegeli), cá tráp vây vàng (Acanthopagrus latus), cá tráp đỏ (Evynnis japonica), Cá cam Nhật Bản (Seriola quinqueradiata), cá thu lớn (Seriola dumerili), cá thu (Seriola lalandi), cá háo sọc (Pseudocaranx dentex), cá ngừ vây xanh đại tây dương (Thunnus thynnus), cá thu Nhật Bản (Scomberomorus niphonius), Cá sa ba (Scomber japonicus), Cá Sòng Nhật Bản (Trachurus japonicus), Cá vẹt Nhật Bản (Oplegnathus fasciatus), cá trác đá (Oplegnathus punctatus), cá giò (Rachycentron canadum), Cá chim vây vàng (Trachinotus blochii), cá Sạo xám (Parapristipoma trilineatum), cá Kẽm lang (Plectorhinchus cinctus), cá hè Trung Hoa (Lethrinus haematopterus), cá hè dài (Lethrinus nebulosus), largescale blackfish (Girella punctata), cá đá (Sebastes schlegeli), cá đỏ dạ lớn (Pseudosciaena crocea), cá Vược Nhật (Lateolabrax japonicus), Lateolabrax sp, cá vược (Lates calcarifer), cá vược đen (Micropterus salmoides), cá bơn vằn răng thưa (Paralichthys olivaceus), spotted halibut (Verasper variegatus), Cá nóc hổ (Takifugu rubripes), cá rô Trung Quốc (Siniperca chuatsi), cá hồng Mỹ (Sciaenops ocellatus), cá đối mục (Mugil cephalus), cá mú (Epinephelus spp).
Loài cảm nhiễm ISKNV: cá rô Trung Quốc (Siniperca chuatsi), cá đù đỏ (Sciaenops ocellatus), cá đối đầu dẹt (Mugil cephalus) và cá mú (Epinephelus sp).
Loài cảm nhiễm TRBIV: các loài Cá bơn (Paralichthys olivaceus).
- Cá ở mọi lứa tuổi đều có thể mắc bệnh, tuy nhiên giai đoạn cá giống dễ bị nhiễm hơn giai đoạn trưởng thành.
- Tỷ lệ chết tùy thuộc vào loài cá nhiễm bệnh, kích thước, tuổi cá, nhiệt độ mà khác nhau (từ 0% đến 100%).
- Dịch bùng phát chủ yếu vào mùa hè ở nhiệt độ nước thích hợp từ 25 °C trở lên.
- Bệnh lây truyền chủ yếu theo phương thức truyền ngang trong môi trường nước, khả năng truyền dọc (từ cá bố mẹ) của vi rút chưa được nghiên cứu
5.2 Triệu chứng lâm sàng và dấu hiệu bệnh tích
- Cá bị nhiễm RSIV có biểu hiện lờ đờ, bơi bất thường, cơ thể chuyển màu đen, đặc biệt là phần cuối thân, mang nhợt nhạt. Cá bệnh nặng nổi lên tầng mặt sau đó từ từ chìm xuống đáy và chết, nên gọi là bệnh “cá ngủ”.
- Cá bị bệnh có biểu hiện loét vây, xuất huyết ở da và mang, lá lách và thận, sưng to, tích dịch trong xoang bụng. Các đại thực bào bắt màu bazơ khi nhuộm Giemsa trong mô lách, thận, mang, tim và gan.
6 Chẩn đoán trong phòng thí nghiệm
6.1 Phương pháp sinh học phân tử
6.1.1 Lấy mẫu
- Cá có kích thước < 4 cm: Lấy nguyên con, từ 10 đến 15 con.
- Cá có kích thước từ 4 đến 6 cm: Lấy nguyên con, từ 5 đến 10 con hoặc lấy lách, thận, tim, ruột, mang của từ 5 đến 10 con
- Cá có kích thước > 6 cm: Lấy nguyên con, từ 3 đến 5 con hoặc lấy lách, thận, tim, ruột, mang của từ 3 đến 5 con
- Cá bố mẹ: Lấy mang của từ 1 đến 3 con.
Thu mẫu cá có dấu hiệu bệnh lý, còn sống hoặc mới chết. Mẫu bệnh phẩm phải được lấy vô trùng và để riêng biệt trong lọ dụng cụ chứa mẫu (4.1.9).
6.1.2 Bảo quản mẫu
Bảo quản vận chuyển: Bảo quản mẫu ở nhiệt độ từ 2 °C đến 8 °C không quá 48 h từ khi lấy mẫu đến khi vận chuyển về phòng thí nghiệm hoặc bảo quản trong ethanol 70 % đến ethanol tuyệt đối với tỷ lệ 1:10 (1 phần mẫu : 9 phần ethanol). Đối với các mẫu bệnh phẩm xét nghiệm bằng phương pháp nuôi cấy vi rút trên môi trường nuôi cấy tế bào cần giữ trong các dụng cụ chứa môi trường nuôi cấy tế bào và bảo quản ở nhiệt độ từ 2 °C đến 8 °C.
Bảo quản tại phòng thí nghiệm: Mẫu được được bảo quản ở nhiệt độ từ 2 °C đến 8 °C chuyển đến phòng thí nghiệm chưa phân tích ngay phải được bảo quản ở nhiệt độ âm 20 °C đến âm 80 °C hoặc được bảo quản trong dung dịch PBS (3.1.2) theo tỷ lệ 1:10 (1 phần mẫu : 9 phần PBS) ở nhiệt độ âm 20 °C đến âm 80 °C hoặc bảo quản trong ethanol 70 % đến ethanol tuyệt đối.
6.1.3 Chuẩn bị mẫu
Dùng panh, kéo (4,1.10) vô trùng để thực hiện các thao tác: tách, cắt lấy mẫu. Mẫu được chia thành hai phần: một phần cho thực hiện xét nghiệm và một phần lưu trữ.
Lượng mẫu lấy để tách chiết ADN khoảng 30 mg.
Cho 30 mg mẫu (6.1.1) vào dung dịch PBS (3.1.2) với tỷ lệ 1:10 (1 phần mẫu : 9 phần PBS), đồng nhất mẫu bằng máy nghiền mẫu (4.1.7) hoặc bằng cối, chày nghiền mẫu để tạo thành huyễn dịch 10 %. Chuyển huyễn dịch vào 2 ống vô trùng đóng nắp, một ống mẫu để xét nghiệm và một ống lưu mẫu.
CHÚ Ý: Với mẫu đã bảo quản ở nhiệt độ âm 20 °C đến âm 80 °C cần rã đông ngoài nhiệt độ phòng trước khi thực hiện đồng nhất mẫu.
6.1.4. Tách chiết ADN
Sử dụng bộ kít tách chiết (3.2.3) thích hợp và an toàn theo hướng dẫn của nhà sản xuất.
VÍ DỤ: Sử dụng kit tách chiết ADN của Qiagen: DNeasy® Blood & Tissue Kit (250) (Cat No 69506) (xem phụ lục B1).
Hoặc sử dụng kít tách chiết TACO RNA/DNA extraction Kit (GeneReach Cat. No. atc-d/rna, 320 tests) (xem phụ lục B2)1).
6.1.5 Phương pháp PCR phát hiện RSIV
6.1.5.1 Chuẩn bị mồi
Phương pháp PCR sử dụng cặp mồi đặc hiệu 4 - F và 4 - R (3.2.1) để phát hiện vi rút RSIV.
Trình tự cặp mồi (xem phụ lục C, Bảng C1).
Mồi được chuẩn bị như sau:
- Mồi ở trạng thái đông khô phải được ly tâm nhanh bằng máy ly tâm (4.1.6) trong 30 s để mồi lắng xuống đáy ống trước khi mở và hoàn nguyên. Dùng dung dịch đệm TE (3.2.6) để hoàn nguyên mồi ở nồng độ 100 μM làm gốc.
- Mồi được sử dụng ở nồng độ 20 μM: Pha loãng mồi gốc bằng nước tinh khiết không có nuclease (3.2.6) (20 μl mồi gốc và 80 μl nước tinh khiết không có nuclease).
6.1.5.2 Tiến hành phản ứng PCR
Phân ứng khuếch đại được thực hiện trong máy nhân gen (4.2.1) theo phương pháp PCR sử dụng cặp mồi 4 - F/4 - R, sử dụng kít nhân gen (3.2.4) theo hướng dẫn của nhà sản xuất.
6.1.5.3 Điện di
6.1.5.3.1 Chuẩn bị bản thạch
Pha thạch với nồng độ agarose (3.2.9) từ 1,5 % đến 2 % bằng dung dịch đệm TBE 1X hoặc TAE 1X (3.2.8) vào chai thủy tinh 250 ml, lắc đều rồi đun sôi;
Khi nhiệt độ giảm xuống khoảng 40 °C đến 50 °C thì bổ sung 10 μl chất nhuộm màu (3.2.9) vào mỗi 100 ml thạch. Lắc nhẹ tránh tạo bọt để chất nhuộm màu tan đều.
Tiến hành đổ thạch vào khay điện di đã được cài lược; không nên đổ bản thạch dày quá 0,8 cm.
Khi bản thạch đông lại thì tiến hành gỡ lược khỏi bản thạch.
Chuyển bản thạch vào bể điện di (4.2.5), đổ dung dịch đệm (TBE 1X hoặc TAE 1X) cùng loại với dung dịch pha agarose đã đun vào bể điện di cho tới khi ngập bản thạch.
CHÚ THÍCH: Có thể dùng các sản phẩm có sẵn chất nhuộm ADN để pha chế thạch agarose (VÍ DỤ: Sybr safe DNA gel stain và sử dụng theo quy định của nhà sản xuất)2).
6.1.5.3.2 Chạy điện di
Hút 2 μl chất đệm tải mẫu (Loading dye 6X) (3.2.12) vào 8 μl sản phẩm PCR trộn đều và cho vào các giếng trên bản thạch. Thực hiện điện di trong bộ điện di, chạy kèm theo thang chuẩn ADN (3.2.7) để so sánh kích thước sản phẩm khuếch đại. Hút 10 μl thang chuẩn ADN (3.2.7) vào một giếng trên bản thạch.
Điện di ở hiệu điện thế 100 V trong thời gian 30 min.
6.1.5.4 Đọc kết quả
Sau khi điện di, đọc kết quả trên máy đọc sản phẩm PCR (4.2.6).
Điều kiện của phản ứng được công nhận khi:
- Đối chứng âm không có vạch sáng (không có sản phẩm khuếch đại);
- Đối chứng dương có vạch sáng kích thước 568 bp phát hiện vi rút RSIV gây bệnh RSIVD.
- Thang chuẩn ADN sáng và chia vạch rõ ràng
Với điều kiện phản ứng trên
Mẫu xét nghiệm âm tính với RSIV khi:
- Tại giếng của mẫu thử không xuất hiện vạch sáng (không có sản phẩm khuếch đại);
Mẫu xét nghiệm dương tính với RISV khi:
- Tại giếng của mẫu thử có xuất hiện vạch sáng kích thước 568 bp.
6.1.6 Phương pháp realtime PCR phát hiện Megalocityvirus
6.1.6.1 Chuẩn bị mồi
Phản ứng khuếch đại được thực hiện theo phương pháp realtime PCR khuếch đại đoạn gen MCP của Megalocityvirus sử dụng cặp mồi RSIV RT F / RSIV RT R và RSIV Probe (3.2.2). (xem phụ lục E, bảng E1).
Mồi được chuẩn bị như sau:
- Mồi ở trạng thái đông khô phải được ly tâm nhanh bằng máy ly tâm (4.1.6) trong 30 s để mồi lắng xuống đáy ống trước khi mở và hoàn nguyên. Khi hoàn nguyên, nên dùng dung dịch đệm TE (3.2.6) để hoàn nguyên mồi ở nồng độ 100 μM làm gốc.
- Mồi được sử dụng ở nồng độ 20 μM: pha loãng mồi gốc bằng nước tinh khiết không có nuclease (3.2.8) (20 μl mồi gốc và 80 μl nước tinh khiết không có nuclease).
- Đoạn dò RSIV Probe sử dụng ở nồng độ 10 μM: pha loãng đoạn dò bằng nước tinh khiết không có nuclease (3.2.8) (10 μl mồi gốc và 90 μl nước tinh khiết không có nuclease)
6.1.6.2 Tiến hành phản ứng realtime PCR
Kỹ thuật realtime PCR sử dụng cặp mồi RSIV RT F / RSIV RT R đã được chuẩn bị (6.2.3.2) sử dụng kít nhân gen (3.2.5) theo hướng dẫn của nhà sản xuất. (Xem phụ lục C)
VÍ DỤ: Kít nhân gen Quantitect probe PCR Kit (200): Catalogue Number: 2043433)
6.1.6.3 Đọc kết quả
Kết quả của phản ứng realtime PCR được xác định dựa vào chu kỳ ngưỡng (Cycle threshold: Ct).
- Mẫu đối chứng âm phải cho kết quả âm tính
- Mẫu đối chứng dương (có giá trị Ct đã biết trước) phải cho kết quả dương tính và có giá trị Ct ±2 Ct đã biết trước.
Kết quả phản ứng realtime PCR phát hiện vi rút Megalocityvirus:
- Mẫu có giá trị Ct < 38 được xem là dương tính
- Mẫu không có giá trị Ct là âm tính
- Mẫu có giá trị Ct trong khoảng 38 ≤ Ct ≤ 45 được xem là nghi ngờ.
Giải thích kết quả
- Mẫu âm tính với phản ứng real-time PCR, kết luận là âm tính với vi rút Megalocityvirus (âm tính với RSIV, ISKNV và TRBIV.)
- Mẫu dương tính với phản ứng real-time PCR kết luận mẫu dương tính với vi rút Megalocityvirus, tiến hành các phản ứng PCR để phân biệt và khẳng định RSIV, ISKNV hoặc TRBIV (Xem 6.1.6.4 và Phụ lục F).
CHÚ Ý:
- Những mẫu nghi ngờ, cần được thực hiện lại xét nghiệm hoặc sử dụng phương pháp xét nghiêm tương đương khác để khẳng định kết quả.
- Phản ứng realtime PCR phải bao gồm: mẫu kiểm tra, mẫu kiểm chứng dương và mẫu kiểm chứng âm;
- Mẫu và nguyên liệu cho phản ứng realtime PCR cần đặt trong khay đá lạnh trong suốt quá trình chuẩn bị hỗn hợp phản ứng.
6.1.6.4 Phương pháp PCR phát hiện và phân biệt RSIV, ISKNV và TRBIV
6.1.6.4.1 Chuẩn bị mồi
Phương pháp PCR để phát hiện và phân biệt RSIV, ISKNV và TRBIV. Trình tự cặp mồi (xem Bảng E1, Phụ lục E).
Chuẩn bị mồi (Theo 6.1.5.1)
6.1.6.4.2 Tiến hành phản ứng PCR
Phản ứng khuếch đại được thực hiện trong máy nhân gen (4.2.1) theo phương pháp PCR sử dụng cặp mồi 4 - F/4 - R (phát hiện RSIV), cặp mồi ISKN -F/R (phát hiện ISKNV) và cặp mồi TRBIV-F/R (phát hiện TRBIV), sử dụng kít nhân gen (3.2.4) theo hướng dẫn của nhà sân xuất (Xem phụ lục E).
6.1.6.4.3 Chạy điện di (Theo 6.1.5.3)
6.1.6.4.4 Đọc kết quả
Điều kiện của phản ứng được công nhận khi;
- Đối chứng âm không có vạch sáng (không có sản phẩm khuếch đại);
- Đối chứng dương có vạch sáng kích thước 568 bp phát hiện vi rút RSIV, có vạch sáng kích thước 415 bp phát hiện vi rút ISKNV, có vạch sáng kích thước 453 bp phát hiện vi rút TRBIV.
Với điều kiện phản ứng trên
Mẫu xét nghiệm âm tính khi;
- Tại giếng của mẫu thử không xuất hiện vạch sáng (không có sản phẩm khuếch đại);
- Thang chuẩn ADN sáng và chia vạch rõ ràng.
Mẫu xét nghiệm dương tính khi: Xem Bảng 1
Bảng 1- Diễn giải kết quả xét nghiệm Megalocytivirus, RSIV, ISKNV và TRBIV
| Gen đích | Kích thước SP | Diễn giải kết quả | |||
| RSIV RT F/R và RSIV Probe (phát hiện Megalocityvirus) | 125 bp | (-) | (+) | (+) | (+) |
| 4-F/4- R (phát hiện RSIV) | 568 bp | (X) | (+) | (-) | (-) |
| ISKN -F/R (phát hiện ISKNV) | 415 bp | (X) | (-) | (+) | (-) |
| TRBIV-F/R (phát hiện TRBIV) | 453 bp | (X) | (-) | (-) | (+) |
| Kết luận | Âm tính | RSIV | ISKNV | TRBIV | |
CHÚ THÍCH: (X): Không xét nghiệm; (-): Âm tính; (+): Dương tính
+ Mẫu xét nghiệm dương tính với vi rút RSIV khi tại giếng của mẫu thử xuất hiện vạch sáng có kích thước 568 bp
+ Mẫu xét nghiệm dương tính với vi rút ISKNV khi tại giếng của mẫu thử xuất hiện vạch sáng có kích thước 415 bp.
+ Mẫu xét nghiệm dương tính với vi rút TRBIV khi tại giếng của mẫu thử xuất hiện vạch sáng có kích thước 453 bp.
6.2 Phân lập RSIV trên môi trường tế bào
6.2.1 Chuẩn bị tế bào một lớp
Chuẩn bị tế bào dòng Grunt Fin (GF) (3.3.2) một lớp trên dĩa 24 giếng (4.3.1) hoặc chai nuôi tế bào 25 cm2 (4.3.2) trong môi trường BME (3.3.3) có bổ sung 10 % FBS (3.3.1), nuôi ở 25 °C khoảng 48 h trước khi thực hiện quá trình phân lập vi rút. Mật độ tế bào nuôi cấy với đĩa 24 giếng là khoảng 500.000 tế bào/giếng (mỗi giếng chứa 1,5 ml môi trường nuôi cấy tế bào); chai 25 cm2 là 2.000.000 tế bào/chai (5ml môi trường nuôi cấy tế bào/chai). Sau 2 ngày, tế bào phủ đều khoảng từ 80 % đến 90 % diện tích đáy chai hay giếng nuôi cấy tế bào, môi trường nuôi cấy tế bào trong, màu đỏ cam là đạt yêu cầu.
6.2.2 Môi trường phát triển tế bào
Môi trường phát triển tế bào BME phải được chuẩn bị trước, lượng môi trường chuẩn bị căn cứ vào số mẫu cần phân lập vi rút.
6.2.3 Lấy mẫu (theo 6.1.1)
6.2.4 Bảo quản mẫu (theo 6.1.2)
6.2.5 Chuẩn bị mẫu
Nghiền mẫu bệnh phẩm trong môi trường phân lập vi rút, tạo thành huyễn dịch có độ pha loãng 1/10 (0,1g/1mL)
Pha loãng mẫu bệnh phẩm:
- Ly tâm huyễn dịch mẫu bệnh phẩm (có nồng độ pha loãng 1/10) với tốc độ từ 2.000 g đến 4.000 g trong 15 min, ở 4 °C.
- Thu dịch trong phía trên và lọc qua màng lọc 0,45 μM (4.3.3). Tiến hành pha loãng với môi trường BME (3.3.3) bổ sung 2 % FBS (3.3.1) để tạo ra huyễn dịch có nồng độ 1/100.
Bảo quản mẫu và mẫu đã pha loãng ở âm 80 °C để có thể tiếp tục gây nhiễm tế bào ở lần sau.
LƯU Ý: Thực hiện xử lý mẫu trên đá lạnh.
Hệ thống đối chứng:
- Đối chứng âm (đối chứng tế bào); Chỉ gồm tế bào và môi trường phân lập vi rút.
- Đối chứng dương: Gồm vi rút RISV đã biết và môi trường phân lập vi rút.
6.2.6 Gây nhiễm vi rút từ mẫu trên tế bào một lớp GF
Hút bỏ môi trường nuôi cấy tế bào trong đĩa 24 giếng (4.3.1)
Gây nhiễm vi rút với 02 nồng độ (1/10; 1/100) lên tố bào một lớp GF (3.3.2) đã được nuôi trên đĩa 24 giếng (4.3.1). Mỗi nồng độ pha loãng vi rút được đưa vào 02 giếng, mỗi giếng là 150 μl. Ủ các đĩa đã gây nhiễm vi rút từ 0,5 h đến 1 h ở nhiệt độ 25 °C, sau đó bổ sung vào mỗi giếng 1,5mL môi trường phân lập vi rút (Lưu ý: Thực hiện với giếng chứa hệ thống đối chứng âm trước, tiếp theo từ giếng có nồng độ vi rút thấp đến nồng độ cao). Nồng độ pha loãng vi rút cuối cùng là 1/10; 1/100.
Chuyển đĩa 24 giếng cấy vi rút vào tù ấm lạnh (4.3.4) và ủ ở nhiệt độ 25 °C trong 10 ngày.
Sau 24 h gây nhiễm vi rút, theo dõi hàng ngày sự xuất hiện bệnh tích tế bào (cytopathic effect - CPE) bằng kính hiển vi soi ngược (4.3.5) với vật kính 4X và 10 X.
Trên môi trường tế bào một lớp GF, vi rút RISV gây ra CPE như xuất hiện nhiều các hốc ở nội bào, tế bào phồng to, lớp tế bào bị bong.
Tiếp tục theo dõi bệnh lý tế bào đến ngày thứ 10 sau khi gây nhiễm, nếu xuất hiện CPE tiến hành thu dịch tế bào đem ly tâm từ 2.000 g đến 4.000 g (4.1.6) trong 15 min, ở 4°C, lấy phần dịch trong, tách chiết ADN và thực hiện phản ứng PCR để xác nhận sự hiện diện của vi rút.
Nếu không xuất hiện CPE, thu hồi dịch tế bào và tế bào đơn lớp bám ở đáy giếng ở các nồng độ (1/10; 1/100) của cùng 1 mẫu vào ống ly tâm 15 ml, ly tâm từ 2.000 đến 4.000 g (4.1.6) trong 15 min. Sau đó hút phần dịch trong và tiếp tục pha loãng thành nồng độ (1/10) và gây nhiễm lại trên tế bào một lớp GF (3.3.2) của đĩa 24 giếng. Có thể gây nhiễm 1 đến 2 lần từ dịch tế bào của lần cấy truyền thứ nhất. Nếu không xuất hiện CPE sau 3 lần gây nhiễm mẫu được xem là âm tính.
6.2.7 Đánh giá kết quả
Kiểm tra hệ thống đối chứng âm (đối chứng tế bào): Tế bào phát triển bình thường.
Mẫu âm tính là mẫu sau 3 lần gây nhiễm không xuất hiện CPE.
Mẫu dương tính là mẫu xuất hiện CPE và có kết quả thử nghiệm dương tính RSIV bằng kỹ thuật PCR.
7 Kết luận
Cá được xác định mắc bệnh do RSIV ở cá biển (Red sea bream iridovirus) khi có những đặc điểm dịch tễ, triệu chứng lâm sàng, bệnh tích đặc trưng của bệnh và:
- Có kết quả dương tính với RSIV bằng phương pháp PCR hoặc
- Có kết quả dương tính với Megalocityvirus bằng phương pháp realtime PCR đồng thời có kết quả dương tính với RSIV bằng phương pháp PCR hoặc
- Có kết quả dương tính bằng phương pháp phân lập RSIV từ bệnh phẩm trên môi trường tế bào.
Phụ lục A
(Quy định)
Thành phần và chuẩn bị thuốc thử
A.1 Dung dịch đệm TAE 1X hoặc TBE 1X
A.1.1 Thành phần
| Dung dịch TAE (hoặc TBE) 10X: | 100 ml |
| Nước khử ion: | 900 ml |
Tổng: 1000 ml dung dịch TAE (TBE) 1 X
A.1.2 Chuẩn bị
Lấy 100 ml dung dịch TAE (TBE) 10 X hoà chung với 900 ml nước khử ion, khuấy và lắc đều.
Bảo quản ở nhiệt độ phòng.
A.2 Dung dịch muối đệm phosphat (PBS)
A.2.1 Thành phần
| - Natri clorua (NaCI) | 8 g |
| - Natri hydro phosphat dihydrat (Na2HPO4.2H2O) | 2,9 g |
| - Kali dihydro phosphat (KH2PO4) | 0,2 g |
| - Kali clorua (KCI) | 0,2 g |
| - Nước cất | 1000ml |
A.2.2 Chuẩn bị
Hòa tan các thành phần trên vào 1000 ml nước cất, khuấy và lắc đều.
Chỉnh pH về trung tính bằng dung dịch natri hydroxit 1 N hoặc dung dịch axit clohydric 1 N. Hấp vô trùng ở 121 °C trong 30 min.
Phụ lục B
(Tham khảo)
Quy trình tách chiết ADN
CẢNH BÁO: Việc tách chiết ADN có sử dụng hoá chất nguy hiểm và có khả năng gây hại nếu thao tác không cẩn thận. Do vậy, nên tránh tiếp xúc trực tiếp với da và hít phải hơi của các hoá chất này. Luôn luôn đeo găng tay, khẩu trang, mặc quần áo bảo hộ khi thực hiện các thao tác này.
B1. Quy trình tách chiết ADN sử dụng kit tách chiết DNeasy® Blood & Tissue Kit (250) (Cat No. 69506):
- Chuyển 30 mg bệnh phẩm vào ống eppendorf, thêm 180 μl dung dịch ATL, thêm 20 μl protease K vào, lắc đều bằng máy lắc trộn vortex (4.2.4);
- Ủ ở 56 °C qua đêm cho đến khi hoàn toàn đồng nhất (thỉnh thoảng lắc bằng máy lắc trộn vortex trong quá trình ủ). Lắc đều bằng máy lắc trộn vortex;
- Thêm 200 μl dung dịch AL (Lysis buffer). Lắc đều bằng máy lắc trộn vortex;
- Ủ ấm ở 56 °C trong 10 min;
- Thêm 200 μl ethanol (từ 96 % đến tuyệt đối) vào ống eppendorf. Lắc đều bằng máy lắc trộn vortex;
- Hút huyễn dịch trong ống eppendorf, chuyển sang cột lọc có ống thu ở dưới;
- Ly tâm bằng máy ly tâm (4.1.6) với gia tốc 6 000 g trong 1 min ở nhiệt độ phòng;
- Thay ống thu ở dưới cột lọc;
- Thêm 500 μl dung dịch AW1 (Wash buffer 1) vào cột lọc có ống thu ở dưới;
- Ly tâm bằng máy ly tâm (4.1.6) với gia tốc 6 000 g trong 1 min ở nhiệt độ phòng;
- Thay ống thu ở dưới cột lọc;
- Thêm 500 μl dung dịch AW2 (Wash buffer 2) vào cột lọc có ống thu ở dưới;
- Ly tâm bằng máy ly tâm với gia tốc 20 000 g trong 3 min ở nhiệt độ phòng;
- Chuyển cột lọc sang ống eppendorf 1,5 ml;
- Nhỏ 200 μl dung dịch AE (Elution buffer) vào cột ly tâm và giữ ở nhiệt độ phòng 1 min;
- Ly tâm bằng máy ly tâm với gia tốc 6 000 g trong 1 min;
- Chuyển ADN đã thu được sang ống eppendorf 1,5 ml khác;
- Bảo quản mẫu ADN ở 2 đến 8 °C trong vài tuần và bảo quản ở âm 20 °C đến âm 80 °C trong thời gian lâu hơn.
CHÚ Ý: Mẫu đối chứng âm và mẫu đối chứng dương đều được tách chiết ADN trong cùng thời điểm với mẫu xét nghiệm.
B.2. Tách chiết ADN bằng TACO RNA/DNA extraction Kít
B.2.1 Vật liệu: Bộ kít chiết tách TACO RNA/DNA extraction Kít (GeneReach Cat. No. atc-d/rna, 320 tests)
Ethanol tuyệt đối
B.2.2 Chuẩn bị:
- Pha dung dịch đệm rửa A (washing buffer A) với 135 ml ethanol tuyệt đối
- Pha dung dịch đệm rửa B (washing buffer B) với 230 ml ethanol tuyệt đối
- Tiến hành theo sơ đồ
| Thuốc Thử | Lượng (μl) | Thuốc thử | Lượng (μl) |
| H | G | F | E | D | C | B | A |
| Ethanol tuyệt đối | 250 | - | - | ► 1 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa A | 750 | Hạt từ | 50 | ► 2 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa A | 750 | - | - | ► 3 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa B | 750 | - | - | ► 4 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa B | 750 | - | - | ► 5 |
|
|
|
|
|
|
|
|
| Nước đệm | 100 | - | - | ► 6 |
|
|
|
|
|
|
|
|
| Ethanol tuyệt đối | 250 | - | - | ► 7 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa A | 750 | Hạt từ | 50 | ► 8 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa A | 750 | - | - | ► 9 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa B | 750 | - | - | ► 10 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa B | 750 | - | - | ► 11 |
|
|
|
|
|
|
|
|
| Nước đệm | 100 | - | - | ► 12 |
|
|
|
|
|
|
|
|
B.2.3 Chuẩn bị mẫu:
- Cho 250 μL/mẫu dung dịch đệm vào các ống eppendorf.
- Cho 100 μL/mẫu vào ống eppendorf chứa dung đệm.
- Lắc bằng máy votex (4.2.4) trong 15 s.
- Ly tâm 12000 g trong 1 min.
- Cho 350 μL (mẫu và dung dịch đệm) vào các giếng ở cột 1 hoặc 7.
B.2.4 Đưa mẫu vào máy TACO
- Đặt đĩa vào máy TACO
- Đặt lược vào máy TACO.
- Sử dụng máy TACO theo hướng dẫn sử dụng: Máy TACO tự động chiết tách trong khoảng 50 min.
- Thu 100 μL ADN từ các giếng trong cột 6 hoặc 12 sang các ống eppendorf mới.
CHÚ Ý: Mẫu đối chứng âm và mẫu đối chứng dương đều được tách chiết ADN trong cùng thời điểm với mẫu cần phát hiện vi rút gây bệnh do RSIV ở cá biển
Phụ lục C
(Quy định)
Phương pháp PCR phát hiện RSIV
C.1 Trình tự cặp mồi
Bảng C.1 - Trình tự cặp mồi[2]
| Tên mồi | Trình tự | Kích thước sản phẩm khuếch đại (bp) |
| 4-F | 5’-CGG-GGG-CAA-TGA-CGA-CTA-CA-3’ | 568 |
| 4-R | 5’-CCG-CCT-GTG-CCT-TTT-CTG-GA-3’ |
C.2 Thực hiện phản ứng PCR
Kỹ thuật PCR sử dụng cặp mồi 4-F/4-R bao gồm:
Chuẩn bị dung dịch cho phản ứng sử dụng cặp mồi 4-F/4-R đã được chuẩn bị (3.2.1) và kít nhân gen (3.2.4) theo hướng dẫn của nhà sản xuất.
VÍ DỤ: Kít Thermo Scienetific Dream Taq PCR Master Mix (2X), Cat. No: K 10714) và hướng dẫn của nhà sản xuất (3.2.1)
Thành phần cho 1 phản ứng (xem bảng C.2).
Bảng C.2 - Thành phần phản ứng PCR
| STT | Thành phần | Nồng độ (μM) | Thể tích cho 1 phản ứng (μl) |
| 1 | Nước không có ARN/DNA |
| 6,5 |
| 2 | Dung dịch Master Mix 2X |
| 12,5 |
| 3 | Mồi 4-F | 20 | 0,5 |
| 4 | Mồi 4-R | 20 | 0,5 |
|
| Tổng thể tích dung dịch đệm thực hiện phản ứng | 20 | |
Chuyển 20 μl hỗn hợp nhân gen vào mỗi ống phản ứng:
Mẫu đối chứng dương: Cho 5 μl mẫu ADN đã được giám định hoặc sử dụng các chủng chuẩn.
Mẫu đối chứng âm: Cho 5 μl nước tinh khiết không có nuclease.
Mẫu thử: Cho 5 μl mẫu kiểm tra vào ống phản ứng.
Tiến hành phản ứng PCR bằng máy nhân gen (4.2.1) đã cài đặt chu trình nhiệt (xem Bảng C.3).
Bảng C.3 - Chu trình nhiệt của phản ứng PCR
| Nhiệt độ (°C) | Thời gian | Số chu kỳ (vòng) |
| 94 | 03 min | 1 |
| 94 | 30 s | 30 |
| 58 | 30 s | |
| 72 | 60s | |
| 72 | 5 min | 1 |
Phụ lục D
(Quy định)
Phương pháp realtime PCR phát hiện Megalocityvirus
D.1 Trình tự cặp mồi
Bảng D1 - Trình tự cặp mồi[5]
| Tên mồi và đoạn dò | Trình tự |
| RSIV RT F | 5’ - TGA CCA GCG AGT TCC TTG ACT T -3 |
| RSIV RT R | 5’- CAT AGT CTG ACC GTT GGT GAT ACC -3’ |
| RSIV Probe | 5’- 6 FAM AAC GCC TGC ATG ATG CCT GGC TAMRA -3’ |
D.2 Thực hiện phản ứng realtime PCR
Phương pháp realtime PCR khuếch đại đoạn gen đặc hiệu của Megalocityvirus, sử dụng cặp mồi đã được chuẩn bị (3.2.1) và kít nhân gen (3.2.4) theo hướng dẫn của nhà sản xuất.
VÍ DỤ: theo kít nhân gen QuantiTect Probe RT-PCR kít, Cat.No: 2043435)
Thành phần cho 1 phản ứng được nêu trong bảng D.2:
Bảng D.2 - Thành phần phản ứng realtime PCR
| STT | Thành phần | Nồng độ, μM | Thể tích cho 1 phản ứng, μl |
| 1 | Nước không có ARN/ADN |
| 6 |
| 2 | Dung dịch SuperMix |
| 12.5 |
| 3 | RSIV RT F | 20 | 0,5 |
| 4 | RSIV RT R | 20 | 0,5 |
| 5 | RSIV Probe | 10 | 0,5 |
| Tổng thể tích dung dịch đệm thực hiện phản ứng | 20 | ||
Chuyển 20 μl hỗn hợp nhân gen vào mỗi ống phản ứng:
- Mẫu kiểm chứng dương: Cho 5 μl mẫu ADN đã được giám định hoặc sử dụng các chủng RSIV chuẩn.
- Mẫu kiểm chứng âm: Cho 5 μl nước tinh khiết không có nuclease.
- Mẫu thử: Cho 5 μl mẫu ADN kiểm tra vào ống phản ứng.
Tiến hành phản ứng trong máy realtime PCR (4.2.2) đã cài đặt chu trình nhiệt được nêu trong bảng D3:
Bảng D.3 - Chu trình nhiệt của phản ứng realtime PCR
| Nhiệt độ, °C | Thời gian | Số chu kỳ (vòng) |
| 50 | 02 min | 01 |
| 95 | 15 min | 01 |
| 95 | 15 s | 45 |
| 60 (*) | 60 s |
CHÚ THÍCH: (*) Nhiệt độ và thời gian này phù hợp với máy Realtime PCR ABI 7500
Phụ lục E
(Quy định)
Phương pháp PCR phát hiện và phân biệt RSIV, ISKNV, TRBIV
E.1 Trình tự mồi, mẫu dò
Bảng E. 1 - Trình tự cặp mồi, mẫu dò phát hiện RSIV [1,4]
| Gen đích | KH mồi | Trình tự nucleotide (5’-3’) | Kích thước SP (bp) |
| RSIV | RSIV-4-F | CGGGGGCAATGACGACTACA | 568 |
| RSIV-4-R | CCGCCTGTGCCTTTTCTGGA | ||
| TRBIV | TRBIV-F | TTCATCGACATCTCCGCTTTC | 453 |
| TRBIV-R | TSTGACCGTTGGTGATACCGGAG | ||
| ISKNV | ISKN-F | GGTGGCCGGCATCACCAACGGC | 415 |
| ISKN-R | CACGGGGTGACTGAACCTG |
E.2 Thành phần phản ứng PCR
Chuẩn bị dung dịch cho phản ứng sử dụng 03 cặp mồi RSIV 4-F/4-R, TRBIV-F/R và ISKN-F/R đã được chuẩn bị (3.2.1) và kít nhân gen (3.2.4) theo hướng dẫn của nhà sản xuất.
VÍ DỤ: Kit Thermo Scienetific Dream Taq PCR Master Mix (2X), Cat. No: K 10716) và hướng dẫn của nhà sản xuất.
Thành phần cho 1 phản ứng với từng cặp mồi RSIV 4-F/4-R hoặc TRBIV-F/R hoặc ISKN-F/R (xem bảng E.2).
Bảng E.2 - Thành phần phản ứng PCR
| STT | Thành phần | Nồng độ (μM) | Thể tích cho 1 phản ứng (μl) |
| 1 | Nước không có ARN/DNA |
| 6,5 |
| 2 | Dung dịch Master Mix 2X |
| 12,5 |
| 3 | Mồi xuôi | 20 | 0,5 |
| 4 | Mồi ngược | 20 | 0,5 |
|
| Tổng thể tích dung dịch đệm thực hiện phản ứng | 20 | |
Chuyển 20 μl hỗn hợp nhân gen vào mỗi ống phản ứng:
Mẫu đối chứng đương: Cho 5 μl mẫu ADN đã được giám định hoặc sử dụng các chủng chuẩn.
Mẫu đối chứng âm: Cho 5 μl nước tinh khiết không có nuclease.
Mẫu thử: Cho 5 μl mẫu kiểm tra vào ống phản ứng.
Tiến hành phản ứng PCR bằng máy nhân gen (4.2.1) đã cài đặt chu trình nhiệt (xem Bảng E.3).
Bảng E.3 - Chu trình nhiệt của phản ứng PCR
| Nhiệt độ (°C) | Thời gian | Số chu kỳ (vòng) |
| 94 | 03 min | 1 |
| 94 | 30 s | 30 |
| 58 | 30 s | |
| 72 | 60 s | |
| 72 | 5 min | 1 |
CHÚ THÍCH
1) Việc lựa chọn các mồi cho phản ứng cần tham khảo theo hướng dẫn của Tổ chức Thú y thế giới (OIE), hoặc quy trình của Phòng thí nghiệm tham chiếu về bệnh để cập nhật mồi cho phù hợp.
2) Tùy theo kít sử dụng mà thành phần hỗn hợp phản ứng có thể khác nhau, việc thực hiện chuẩn bị hỗn hợp phản ứng nên tuân thủ theo hướng dẫn của kít được sử dụng.
Phụ lục F
(Tham khảo)
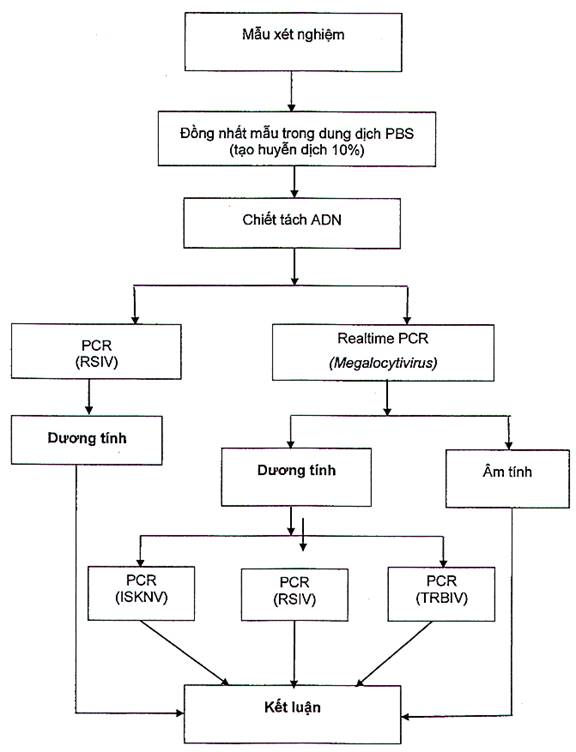
Sơ đồ xét nghiệm vi rút RSIV và Megalocytivirus
Thư mục tài liệu tham khảo
[1] CSIRO Livestock Industries (CLI) Australian Animal Health Laboratory (AAHL) Quality Assurance (QA) Manual. Methods AFDL In-House Tests For Emergency Disease Diagnosis And Test Protocols Under Development - Red Sea Bream Iridovirus. Real-time PCR; CSIRO RSIV qPCR Worksheet.
[2] OIE/WOAH (2019) Manual of Diagnostic Tests for Aquatic Animal, Chapter 2.3.8 Red Seabream Iridoviral Disease.
[3] Fan Shuang, Yongwen Luo, Xiao-peng Xiong, Shaoping Weng, Yig Li, Jianguo He, Chuanfu Dong; Virions proteins of an RSIV-type megalocytivirus from spotted knifejaw Oplegnathus punctatus (SKIV-ZJ07); Virology 437 (2013) 89-99.
[4] Jun Kurita, and Kazuhiro Nakajima, Review Megalocytiviruses, Viruses 2012, 4, 521-538; doi:10.3390/v4040521, ISSN 1999-4915 www.mdpi.com/iournal/viruses.
[5] Mark St. J. Crane and Kelly R. Davies, Aquatic Animal Health Subprogram: Establishment of Diagnostic Expertise for Detection and Identification of Red Sea Bream Iridovirus (RSIV), June 2006 FRDC Project No. 2003/620
1) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
2) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương
3) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
4) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
5) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
6) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 8710-28:2023 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 8710-28:2023 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 8710-28:2023 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 8710-28:2023 DOC (Bản Word)