- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 7391-4:2020 ISO 10993-4:2017 Đánh giá sinh học trang thiết bị y tế - Phần 4: Lựa chọn phép thử tương tác với máu
| Số hiệu: | TCVN 7391-4:2020 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Y tế-Sức khỏe |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
31/12/2020 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 7391-4:2020
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 7391-4:2020
TIÊU CHUẨN QUỐC GIA
TCVN 7391-4:2020
ISO 10993-4:2017
ĐÁNH GIÁ SINH HỌC TRANG THIẾT BỊ Y TẾ - PHẦN 4: LỰA CHỌN PHÉP THỬ TƯƠNG TÁC VỚI MÁU
Biological evaluation of medical devices - Part 4: Selection of tests for interactions with blood
Lời nói đầu
TCVN 7391-4:2020 thay thế cho TCVN 7391-4:2005.
TCVN 7391-4:2020 hoàn toàn tương đương với ISO 10993-4:2017.
TCVN 7391-4:2020 do Ban Kỹ thuật Tiêu chuẩn quốc gia TCVN/TC194 Đánh giá sinh học và lâm sàng trang thiết bị y tế biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
Bộ TCVN 7391 (ISO 10993), Đánh giá sinh học trang thiết bị y tế, gồm các tiêu chuẩn sau:
- TCVN 7391-1:2004 (ISO 10993-1:2003), Phần 1: Đánh giá và thử nghiệm
- TCVN 7391-2:2020 (ISO 10993-2:2006), Phần 2: Yêu cầu sử dụng động vật
- TCVN 7391-3:2020 (ISO 10993-3:2014), Phần 3: Phép thử độc tính di truyền, khả năng gây ung thư và độc tính sinh sản
- TCVN 7391-4:2020 (ISO 10993-4:2017), Phần 4: Lựa chọn phép thử tương tác với máu
- TCVN 7391-5:2020 (ISO 10993-5:2009), Phần 5: Phép thử độc tính tế bào in vitro
- TCVN 7391-6:2020 (ISO 10993-6:2016), Phần 6: Phép thử hiệu ứng tại chỗ sau cấy ghép
- TCVN 7391-7:2004 (ISO 10993-7:1995), Phần 7: Dư lượng sau tiệt trùng bằng etylen oxit
- TCVN 7391-10:2002 (ISO 10993-10:2007), Phần 10: Phép thử kích thích và quá mẫn muộn
- TCVN 7391-11:2020 (ISO 10993-11:2017), Phần 11: Phép thử độc tính toàn thân
- TCVN 7391-12:2002 (ISO 10993-12:2007), Phần 12: Chuẩn bị mẫu và vật liệu chuẩn
- TCVN 7391-14:2001 (ISO 10993-14:2007), Phần 14: Nhận dạng và định lượng sản phẩm phân hủy từ gốm sứ
- TCVN 7391-15:2007 (ISO 10993-15:2000), Phần 15: Nhận dạng và định lượng sản phẩm phân hủy từ kim loại và hợp kim
- TCVN 7391-16:2020 (ISO 10993-16:2017), Phần 16: Thiết kế nghiên cứu độc lực cho sản phẩm phân hủy và ngâm chiết
- TCVN 7391-17:2002 (ISO 10993-17:2007), Phần 17: Thiết lập giới hạn cho phép của chất ngâm chiết
- TCVN 7391-18:2005 (ISO 10993-18:2007), Phần 18: Đặc trưng hóa học của vật liệu
Bộ ISO 10993 còn các tiêu chuẩn sau:
- ISO 10993-9:2019, Biological evaluation of medical devices - Part 9: Framework for identification and quantification of potential degradation products
- ISO 10993-13:2010, Biological evaluation of medical devices - Part 13: Identification and quantification of degradation products from polymeric medical devices
- ISO/TS 10993-19:2020, Biological evaluation of medical devices - Part 19: Physicochemical, morphological and topographical characterization of materials
- ISO/TS 10993-20:2006, Biological evaluation of medical devices - Part 20: Principles and methods for immunotoxicology testing of medical devices
- ISO/TR 10993-22:2017, Biological evaluation of medical devices - Part 22: Guidance on nanomaterials
- ISO/TR 10993-33:2015, Biological evaluation of medical devices - Part 33: Guidance on tests to evaluate genotoxicity - Supplement to ISO 10993-3
Lời giới thiệu
Việc lựa chọn và thiết kế các phương pháp thử đối với sự tương tác của các trang thiết bị y tế với máu nên được coi là thiết kế thiết bị, vật liệu, tiện ích lâm sàng, môi trường sử dụng và lợi ích rủi ro. Mức độ đặc hiệu này chỉ có thể được bao phủ trong các tiêu chuẩn cụ thể.
Nguồn ban đầu để xây dựng tiêu chuẩn này là ấn phẩm, Hướng dẫn về tương tác máu/vật liệu, Báo cáo của Viện Tim, Phổi và Máu Quốc gia[14] chương 9 và 10. Ấn phẩm này sau đó đã được sửa đổi[15].
ĐÁNH GIÁ SINH HỌC TRANG THIẾT BỊ Y TẾ - PHẦN 4: LỰA CHỌN PHÉP THỬ TƯƠNG TÁC VỚI MÁU
Biological evaluation of medical devices - Part 4: Selection of tests for interactions with blood
1 Phạm vi áp dụng
Tiêu chuẩn này quy định các yêu cầu chung để đánh giá sự tương tác của các trang thiết bị y tế với máu.
Tiêu chuẩn này đưa ra:
a) cách phân loại các trang thiết bị y tế được thiết kế để sử dụng tiếp xúc với máu, dựa trên mục đích sử dụng và thời gian tiếp xúc như được định nghĩa trong TCVN 7391-1 (ISO 10993-1),
b) các nguyên tắc cơ bản chi phối việc đánh giá sự tương tác của các trang thiết bị với máu,
c) cơ sở lựa chọn cấu trúc các phép thử theo loại cụ thể, cùng với các nguyên tắc và cơ sở khoa học của các phép thử này.
Các yêu cầu thử nghiệm chi tiết không được quy định do những hạn chế hiểu biết và độ chính xác của các phép thử để đánh giá tương tác của các trang thiết bị với máu. Tiêu chuẩn này mô tả đánh giá sinh học theo thuật ngữ chung và có thể không nhất thiết cung cấp hướng dẫn đầy đủ cho các phương pháp thử đối với một trang thiết bị cụ thể.
Những thay đổi trong tiêu chuẩn này không chỉ ra thử nghiệm được tiến hành theo các phiên bản trước của tiêu chuẩn này là không hợp lệ. Đối với các trang thiết bị được bán trên thị trường có lịch sử sử dụng lâm sàng an toàn, không cần thử nghiệm bổ sung theo sửa đổi này.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau đây là cần thiết để áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 7391-1 (ISO 10993-1), Đánh giá sinh học trang thiết bị y tế - Phần 1: Đánh giá và thử nghiệm trong quy trình quản lý rủi ro
TCVN 7391-12 (ISO 10993-12), Đánh giá sinh học trang thiết bị y tế - Phần 12: Chuẩn bị mẫu và vật liệu chuẩn.
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này, áp dụng các thuật ngữ và định nghĩa nêu trong TCVN 7391-1 (ISO 10993-1), TCVN 7391-12 (ISO 10993-12) và các thuật ngữ, định nghĩa sau:
3.1
chất chống đông (anticoagulant)
tác nhân ngăn cản hoặc làm chậm sự đông máu
VÍ DỤ: Heparin, axit ethylenediaminetetraacetic (EDTA), natri xitrat.
3.2
tương tác máu/trang thiết bị (blood/device interaction)
tương tác giữa máu hoặc thành phần máu với trang thiết bị
3.3
đông máu (coagulation)
hiện tượng xảy ra do hoạt hóa tầng yếu tố đông máu (đông máu)
CHÚ THÍCH: Các yếu tố của tầng đông máu và hệ thống tiêu sợi huyết có thể được đo sau khi tiếp xúc với các trang thiết bị in vitro hoặc in vivo.
3.4
hệ thống bổ thể (complement system)
một phần của hệ miễn dịch bẩm sinh bao gồm hơn 30 protein huyết tương riêng biệt, bao gồm enzym, cofactor và thụ thể tế bào có thể liên quan đến việc thúc đẩy huyết khối
CHÚ THÍCH 1: Các phân tử Effector được sản xuất từ các thành phần bổ sung là các thành phần có thể có trong hiện tượng viêm, thực bào và ly giải tế bào. Hoạt hóa bổ thể liên quan đến độc tính miễn dịch, quá mẫn và tạo ra phản vệ không được đề cập trong tiêu chuẩn này. (Xem ISO/TR 10993-20.)
CHÚ THÍCH 2: Trọng tâm trong tiêu chuẩn này là hoạt hóa bổ thể vì nó có thể thúc đẩy và tăng tốc tan huyết, hoạt hóa tiểu cầu, bạch cầu và huyết khối trên bề mặt vật liệu trang thiết bị. (Xem thêm Phụ lục E về hoạt hóa bổ thể).
3.5
tiếp xúc máu trực tiếp (direct blood contact)
thuật ngữ được sử dụng khi trang thiết bị hoặc vật liệu trang thiết bị tiếp xúc vật lý với máu hoặc thành phần máu
3.6
thuyên tắc (embolization)
quá trình trong đó một huyết khối, hoặc vật lạ, được mang trong máu và có thể bị tắc nghẽn và gây ra dòng chảy của máu bị tắc nghẽn ở phía sau
3.7
hệ thống thử nghiệm ex vivo (ex vivo test system)
thuật ngữ áp dụng cho một hệ thống thử nghiệm đưa máu trực tiếp từ đối tượng người hoặc động vật thử nghiệm vào buồng thử nghiệm nằm bên ngoài cơ thể
CHÚ THÍCH: Nếu sử dụng mô hình động vật, máu có thể được đưa trực tiếp vào động vật (tuần hoàn) hoặc thu thập trong các ống nghiệm để đánh giá (qua một lần). Trong cả hai trường hợp, buồng thử nghiệm được đặt bên ngoài cơ thể.
3.8
huyết học (haematology)
nghiên cứu về máu bao gồm việc định lượng các thành phần tế bào và huyết tương của máu
3.9
dung tích hồng cầu (haematocrit)
tỷ lệ phần trăm thể tích của hồng cầu trong máu toàn phần trong một mẫu nhất định
3.10
tan huyết (haemolysis)
sự giải phóng haemoglobin khỏi hồng cầu, bằng cách phá hủy hoặc thông qua màng tế bào bị phá hủy một phần nhưng còn nguyên vẹn
3.11
tương hợp máu (haemocompatible)
<trang thiết bị hoặc vật liệu trang thiết bị> có thể tiếp xúc với máu mà không có bất kỳ phản ứng bất lợi đáng kể nào về mặt lâm sàng như huyết khối, tan huyết (3.10), tiểu cầu, bạch cầu và hoạt hóa bổ thể và/hoặc sự kiện bất lợi liên quan đến máu khác xảy ra
3.12
tiếp xúc máu gián tiếp (indirect blood contact)
bản chất của các trang thiết bị tiếp xúc với đường máu của bệnh nhân tại một điểm và đóng vai trò là ống dẫn để xâm nhập vào hệ thống mạch máu
VÍ DỤ: Thiết bị phân phối dung dịch dinh dưỡng thuốc và tiêm.
3.13
trang thiết bị so sánh được bán trên thị trường hợp pháp (legally-marketed comparator device)
LMCD
trang thiết bị y tế đã phê duyệt hoặc đã được thiết lập một cách minh bạch từ lâu và được công nhận là an toàn, được sử dụng làm đối chứng chuẩn trong đánh giá an toàn in vitro hoặc in vivo của một trang thiết bị thử nghiệm có thiết kế, vật liệu và sử dụng lâm sàng tương tự
CHÚ THÍCH: Có thể cần LMCD được bán trên thị trường hợp pháp trong cùng khu vực khi gửi cơ quan có thẩm quyền về trang thiết bị thử nghiệm.
3.14
không tiếp xúc với máu (non-blood-contact)
bản chất của trang thiết bị hoặc vật liệu tiếp xúc với cơ thể bệnh nhân, khi trang thiết bị hoặc vật liệu có khả năng chiết xuất không có tiếp xúc trực tiếp hoặc gián tiếp với máu
3.15
áp lực thẩm thấu (colloidal osmotic pressure)
tổng ảnh hưởng của protein hoặc các chất có khối lượng phân tử lớn khác đến hoạt động thẩm thấu của huyết tương
3.16
tiểu cầu (platelets)
cơ quan hạt nhân, tế bào có trong máu và góp phần vào quá trình huyết khối bằng cách kết dính vào bề mặt, giải phóng các yếu tố và/hoặc tập hợp lại để tạo thành một nút cầm máu
3.17
kết dính tiểu cầu (platelet adherent)
<vật liệu hoặc trang thiết bị> có xu hướng cho phép hoặc thúc đẩy tiểu cầu (3.16) để gắn vào bề mặt của nó
CHÚ THÍCH: Điều này thường được đặc trưng liên quan đến đối chứng âm tính, đối chứng dương tính và/hoặc LMCD khi tiếp xúc với máu do đặc tính bề mặt của nó.
CHÚ THÍCH: Kết dính tiểu cầu không nhất thiết có nghĩa là hoạt hóa tiểu cầu, nghĩa là tiểu cầu trên một bề mặt có thể hoặc không thể được hoạt hóa.
3.18
tạo thrombin (thrombin generating)
<vật liệu hoặc trang thiết bị> do đặc tính bề mặt của nó, có xu hướng thúc đẩy hoặc hiển thị sự hình thành thrombin tăng
CHÚ THÍCH: Điều này thường được đặc trưng liên quan đến đối chứng âm tính, đối chứng dương tính và/hoặc LMCD khi tiếp xúc với máu.
3.19
gây huyết khối (thrombogenic)
<vật liệu hoặc trang thiết bị> do đặc tính bề mặt của nó, có xu hướng hình thành hoặc thúc đẩy sự hình thành huyết khối
CHÚ THÍCH: Điều này thường được đặc trưng liên quan đến đối chứng âm tính, đối chứng dương tính và/hoặc LMCD khi tiếp xúc với máu.
3.20
thuyên tắc huyết khối (thromboembolization)
quá trình trong đó một huyết khối (3.21) bị đánh bật ra được đẩy theo dòng chảy, nơi nó có thể gây ra tắc nghẽn mạch máu hoặc tắc nghẽn tiếp theo
3.21
huyết khối (thrombus)
hỗn hợp đông tụ của các tế bào hồng cầu, tiểu cầu tổng hợp (3.16), sợi huyết và các yếu tố tế bào khác
3.22
chứng huyết khối (thrombosis)
sự hình thành huyết khối (3.21) trong điều kiện mô phỏng in vivo, ex vivo hoặc in vitro, gây ra bởi sự hoạt hóa hệ thống đông máu và tiểu cầu (3.16) trong dòng chảy của máu toàn phần
CHÚ THÍCH: Chứng huyết khối cũng có thể xảy ra ở các khu vực của mạch máu hoặc trang thiết bị khi có ứ máu.
3.23
máu toàn phần (whole blood)
máu không phân tách, được rút ra từ một người hiến máu hoặc động vật thử nghiệm
CHÚ THÍCH: Máu có thể không được chống đông hoặc chống đông, ví dụ: chứa natri xitrat hoặc heparin như một chất chống đông.
4 Thuật ngữ viết tắt
| Bb | đoạn hoạt tính enzym của yếu tố B được tạo ra bởi sự phân tách (bởi yếu tố D) trong quá trình hoạt hóa theo con đường nhánh |
| β-TG | beta-thromboglobulin |
| C4d | sản phẩm phân hủy của C4 bằng cách hoạt hóa bổ thể theo con đường cổ điển |
| C3a, C5a | các sản phẩm do phân tách bổ thể từ C3 và C5 |
| CH-50 | lượng bổ thể cần thiết để dung giải 50 % huyền phù RBC |
| D-Dimer | các sản phẩm phân hủy sợi huyết đặc hiệu (F XIII sợi huyết liên kết ngang) bao gồm dimer mảnh D |
| ELISA | khảo nghiệm hấp thụ miễn dịch liên kết enzym |
| FDP | sản phẩm phân hủy sợi huyết/tiền sợi huyết |
| FPA | fibrino peptide A |
| F1.2 | đoạn không xúc tác tách ra từ prothrombin khi chuyển thành thrombin (còn được gọi là F1+2) |
| iC3b | dạng không hoạt hóa của C3b, một phân đoạn của C3 |
| IFU | hướng dẫn sử dụng |
| IVC | tĩnh mạch chủ dưới |
| MRI | chụp cộng hưởng từ |
| PET | chụp bức xạ positron cắt lớp |
| PF-4 | yếu tố tiểu cầu 4 |
| PRP | huyết tương giàu tiểu cầu |
| PT | thời gian prothrombin |
| PTT | thời gian thromboplastin từng phần |
| SC5b-9 | sản phẩm hoạt hóa bổ thể theo con đường cuối cùng |
| SEM | kính hiển vi điện tử quét |
| TAT | phức hợp thrombin-antithrombin |
| TCC | phức hợp bổ thể cuối cùng; còn được gọi là phức hợp tấn công màng (MAC); ước tính bằng cách đo SC5b-9 |
| TT | thời gian thrombin |
| TxB2 | thromboxane B2 |
5 Loại trang thiết bị tiếp xúc với máu (theo phân loại trong TCVN 7391-1 (ISO 10993-1))
5.1 Trang thiết bị không tiếp xúc với máu
Các trang thiết bị không tiếp xúc với máu là các trang thiết bị không có tiếp xúc trực tiếp hoặc gián tiếp với các thành phần máu hoặc máu trú ngụ trong cơ thể hoặc được đưa trở lại cơ thể.
Một trang thiết bị chẩn đoán in vitro và ống lấy máu là những ví dụ về các trang thiết bị không tiếp xúc với máu. Một số trang thiết bị, chẳng hạn như hệ thống dẫn đường cho cấy ghép, có thể chứa cả các thành phần tiếp xúc với máu và không tiếp xúc với máu.
5.2 Trang thiết bị truyền bên ngoài cơ thể
5.2.1 Quy định chung
Đây là những trang thiết bị tiếp xúc với hệ tuần hoàn và giữ vai trò như một ống dẫn vào hệ thống mạch máu. Một số trang thiết bị có thể có các thành phần hoặc các phần có các loại tiếp xúc khác nhau (trực tiếp và gián tiếp). Các ví dụ bao gồm nhưng không giới hạn như sau.
5.2.2 Trang thiết bị truyền bên ngoài cơ thể giữ vai trò như một đường máu gián tiếp
- dụng cụ lấy máu;
- ống thông;
- màng lọc tế bào;
- dụng cụ lưu giữ và bảo quản máu và các sản phẩm máu (ví dụ: ống và túi);
- bộ kéo dãn;
- ống thông nội mạch.
5.2.3 Trang thiết bị truyền bên ngoài cơ thể tiếp xúc trực tiếp với hệ tuần hoàn
- dụng cụ lấy nội mạc;
- bộ theo dõi máu có tiếp xúc với máu trực tiếp hoặc gián tiếp;
- tuần hoàn tim phổi nhân tạo;
- quả lọc hấp phụ các chất riêng biệt từ máu;
- thiết bị phân tách điều trị và lấy máu;
- thiết bị trao đổi oxy qua màng ngoài cơ thể (máy tim phổi nhân tạo);
- thiết bị thẩm tách máu/lọc máu;
- thiết bị can thiệp tim và mạch;
- ống thông nội mạch (bóng, hình ảnh, laser, siêu âm);
- bộ lọc loại bỏ bạch cầu;
- thiết bị hỗ trợ tuần hoàn dưới da;;
- ống thông để chụp động mạch vành ngược dòng;
- dây dẫn mạch máu.
5.3 Trang thiết bị cấy ghép
Các trang thiết bị cấy ghép được đặt chủ yếu hoặc toàn bộ trong hệ thống mạch máu. Các ví dụ bao gồm nhưng không giới hạn sau đây:
- van tim nhân tạo;
- nhánh nối động tĩnh mạch;
- bộ theo dõi máu (cấy ghép);
- trang thiết bị trợ giúp tuần hoàn (dụng cụ trợ giúp tâm thất, tim nhân tạo, bơm bóng nội động mạch chủ);
- bộ dụng cụ nút mạch;
- ghép mạch máu tổng hợp nội mạch;
- máy khử rung tim cấy ghép và các dây điện cực phá rung-tạo nhịp;
- bộ lọc tĩnh mạch chủ dưới;
- ống thông truyền thuốc bên trong;
- thiết bị trao đổi oxy nội mạch (phổi nhân tạo);
- van tim dạng cơ học hoặc dạng mô;
- dây điện cực của máy tạo nhịp tim;
- phẫu thuật ghép mạch máu tổng hợp hoặc mô;
- stent mạch máu.
6 Đặc điểm tương tác máu
6.1 Yêu cầu chung
QUAN TRỌNG - Vì đây là tiêu chuẩn chung, nên có thể cung cấp các cơ sở hợp lý để chứng minh sự lựa chọn đúng các loại thử nghiệm dựa trên trang thiết bị được đặc trưng. Ví dụ, thử nghiệm in vivo cho bằng chứng về chứng huyết khối thường là phương pháp được thích hợp hơn để mô tả đặc tính của trang thiết bị trong danh mục chứng huyết khối. Tuy nhiên, trong một số trường hợp, các lý do bằng văn bản bao gồm sự kết hợp các thử nghiệm từ các loại đông máu, tiểu cầu, huyết học và bổ thể có thể được sử dụng thay thế cho thử nghiệm chứng huyết khối.
6.1.1 Hình 1 minh họa một sơ đồ nhánh quyết định có thể được sử dụng để xác định xem thử nghiệm tương tác với máu có cần thiết hay không. Tương tác máu có thể được chia thành nhiều loại dựa trên quá trình chính hoặc hệ thống được đo. Bảng 1 liệt kê các ví dụ về các trang thiết bị tiếp xúc với hệ tuần hoàn và các loại thử nghiệm phù hợp với từng thiết bị. Danh sách này không bao gồm tất cả và đánh giá hợp lý phải được áp dụng cho các trang thiết bị không được liệt kê trong các bảng.
Đối với các trang thiết bị y tế đã có tiêu chuẩn riêng thì các yêu cầu đánh giá sinh học và phương pháp thử được quy định trong tiêu chuẩn riêng đó sẽ được ưu tiên hơn các yêu cầu chung được đề xuất trong tiêu chuẩn này.
6.1.2 Khi có thể, các thử nghiệm sẽ sử dụng một mô hình hoặc hệ thống phù hợp mô phỏng dạng hình học và điều kiện tiếp xúc của trang thiết bị với máu trong các ứng dụng lâm sàng. Việc mô phỏng phải bao gồm thời gian tiếp xúc, nhiệt độ, điều kiện vô trùng, chất chống đông (và mức độ thích hợp, xem 6.1.12) và điều kiện dòng chảy. Ví dụ, đối với các trang thiết bị có hình dạng xác định như stent mạch máu, diện tích bề mặt được sử dụng trong thử nghiệm, tính bằng cm2, phải được xem xét liên quan đến thể tích dịch của hệ thống thử nghiệm in vitro. Đối với các thiết bị có dạng hình học không xác định hoặc phức tạp (chẳng hạn như sự phân tán các hạt PVA được sử dụng làm tác nhân thuyên tắc), nên sử dụng khối lượng thay vì diện tích bề mặt để xác định lượng mẫu được sử dụng trong hệ thống thử nghiệm.
Chỉ nên thử nghiệm các bộ phận tiếp xúc với máu trực tiếp hoặc gián tiếp. Các phương pháp và thông số thử nghiệm được chọn phải phù hợp với trình độ phát triển khoa học kỹ thuật hiện tại.
Loại thích hợp và mức độ chống đông máu có thể là trường hợp cụ thể tùy thuộc vào cả chỉ định sử dụng thiết bị và loại thử nghiệm được tiến hành. Bao gồm thông tin về loại và mức độ cụ thể của chất chống đông được sử dụng và cung cấp tranh luận về khả năng phân biệt các phản ứng dương tính và âm tính. Để biết thêm thông tin, xem 6.1.6 và C.2 đối với các nghiên cứu trên động vật, 6.1.12 đối với các thử nghiệm in vivo và ex vivo, 6.3.1 đối với các thử nghiệm in vitro và A.3 đối với ống thông và vòng dẫn.
Vì nhiều thử nghiệm về khả năng tương hợp máu được công nhận là phụ thuộc hoàn toàn vào bề mặt, các thử nghiệm như vậy (ví dụ: hoạt hóa bổ thể) sẽ không áp dụng cho các ứng dụng tiếp xúc gián tiếp.
6.1.3 Đối chứng (dương tính và âm tính) phải được sử dụng trừ khi xác định thấy là không cần thiết. Khi có thể, việc thử nghiệm phải bao gồm một thiết bị dự đoán có liên quan đã được sử dụng lâm sàng (nghĩa là LMCD) hoặc vật liệu được đặc trưng hóa[6].
Đối chứng nên bao gồm các vật liệu chuẩn âm tính và dương tính. Tất cả các vật liệu và LMCD được thử nghiệm phải đáp ứng tất cả các quy định kỹ thuật kiểm soát chất lượng và đảm bảo chất lượng của nhà sản xuất và phòng thử nghiệm. Tất cả các vật liệu và thiết bị được thử nghiệm phải được nhận biết về nguồn gốc, nhà sản xuất, hạng và loại.
6.1.4 Thử nghiệm vật liệu sẽ dùng cho các thành phần của trang thiết bị có thể được tiến hành với mục đích sàng lọc. Tuy nhiên, các phép thử ban đầu như vậy không thể thay thế cho yêu cầu mà một trang thiết bị tiệt trùng hoàn chỉnh hoặc thành phần thiết bị nên được thử nghiệm dưới các điều kiện mô phỏng hoặc phóng đại ứng dụng lâm sàng.
CHÚ THÍCH 1: Những thay đổi trong quy trình sản xuất (bao gồm sử dụng các chất hỗ trợ sản xuất) có thể ảnh hưởng đến các tính chất bề mặt hoặc hóa học của trang thiết bị tiệt trùng hoàn chỉnh cũng có thể ảnh hưởng đến khả năng tương hợp máu.
CHÚ THÍCH 2: Trong trường hợp lão hóa có thể ảnh hưởng đến các đặc tính của trang thiết bị cuối cùng, việc sử dụng các mẫu cũ cũng có thể cần thiết. (Ví dụ, các thuộc tính của lớp phủ hoạt tính sinh học như heparin có thể thay đổi theo thời gian.)
6.1.5 Các phép thử không mô phỏng các điều kiện của trang thiết bị trong quá trình sử dụng có thể không dự đoán chính xác bản chất của các tương tác máu/trang thiết bị có thể xảy ra trong các ứng dụng lâm sàng. Ngoài ra, khả năng của các thử nghiệm in vitro hoặc ex vivo ngắn hạn để dự đoán tính năng trong các ứng dụng lâm sàng thực tế được cho là cao hơn khi ứng dụng lâm sàng liên quan đến phơi nhiễm hạn chế thay vì phơi nhiễm kéo dài hoặc vĩnh viễn.
CHÚ THÍCH: Thử nghiệm đơn giản hóa các vật liệu trang thiết bị dự định sử dụng (ví dụ: sửa đổi hóa học hình học và chức năng bề mặt) có thể đóng vai trò là một bước quan trọng trong việc xác định, tối ưu hóa và lựa chọn vật liệu thiết bị.
6.1.6 Nếu thực hiện một nghiên cứu trên động vật, các trang thiết bị có mục đích sử dụng là ex vivo (truyền bên ngoài cơ thể) nên được thử nghiệm ex vivo và các thiết bị có mục đích sử dụng là in vivo (cấy ghép) nên được thử nghiệm in vivo trên mô hình động vật mô phỏng càng gần với các điều kiện có thể sử dụng lâm sàng càng tốt. Các thủ tục trong các cuộc nghiên cứu như vậy cần đặc biệt gọi ra từng loại thử nghiệm (xem 6.2.1) được đánh giá và mô tả phương pháp đánh giá cụ thể.
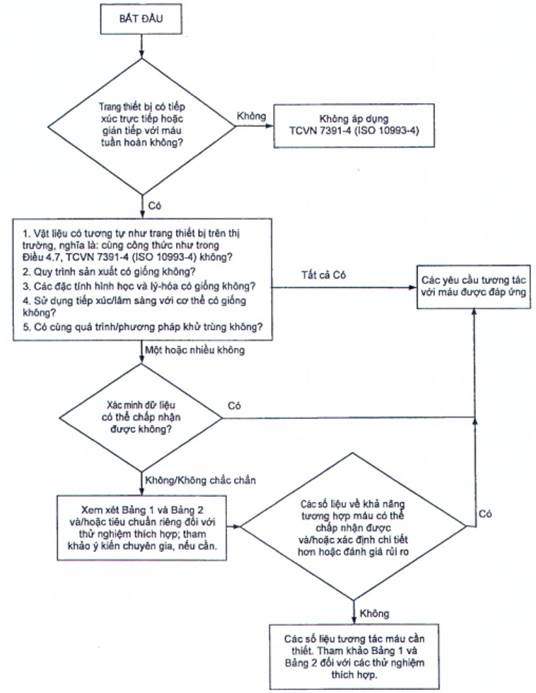
a Đối với các thiết bị tiếp xúc trực tiếp và gián tiếp, cần xem xét sự cần thiết phải thử nghiệm khả năng tương hợp máu dựa trên phân tích rủi ro thích hợp, bao gồm thử nghiệm khả năng tương hợp máu trước đó, dữ liệu lâm sàng, dữ liệu có thể trích xuất/thông tin và/hoặc thông tin về các đặc điểm bề mặt. Ví dụ, đối với các thiết bị có tiếp xúc trực tiếp, thử nghiệm chiết/tách có thể không đủ nếu hình thái bề mặt bị thay đổi, ngay cả khi hóa học có thể chiết/tách được là như nhau (xem TCVN 7391-1 (ISO 10993-1)).
Hình 1 - Sơ đồ nhánh quyết định giúp xác định sự cần thiết thử nghiệm tương tác với máu
Bảng 1 - Lưu hành các thiết bị tiếp xúc máu hoặc các thành phần thiết bị và các loại thử nghiệm thích hợp để xem xét - Trang thiết bị truyền bên ngoài cơ thể và thiết bị cấy ghép
| Ví dụ thiết bị | Loại phép thử | ||||||
| Tan huyết | Chứng huyết khối | ||||||
|
| in vitro |
| |||||
| Vật liệu gây ra | Cơ học gây ra | Đông máu | Hoạt hóa tiểu cầu | Bổ thể | Huyết học | In vivo / Ex vivo | |
| Trang thiết bị truyền bên ngoài cơ thể | |||||||
| Bộ theo dõi máu (tạm thời/ex vivo)b | X |
| X | X |
| X |
|
| Thiết bị lưu trữ và bảo quản máu (ví dụ: bộ truyền/truyền máu), dụng cụ lấy máu, bộ kéo dãn | X |
| X | X |
| X |
|
| Các ống thông tại chỗ trong khoảng thời gian ít hơn 24 h (ví dụ: các dụng cụ lấy nội mạc, ống thông siêu âm nội mạch, antegrade/ống thông để chụp động mạnh vành antegrade/ngược dòng, vòng dẫn); ống thông | X |
| XC | XC |
| XC | XC |
| Các ống thông tại chỗ trong khoảng thời gian lâu hơn 24 h (ví dụ: ống thông dinh dưỡng, ống thông tĩnh mạch trung tâm); ống thông | X |
| XC | XC |
| XC | XC |
| Màng lọc tế bào b | X |
| X | X |
|
|
|
| Quả lọc hấp phụ các chất riêng biệt từ máu b | X | X | X | X | X |
|
|
| Thiết bị phân tách điều trị và lấy máu b | X | X | X | X | X |
|
|
| Hệ thống tim phổi nhân tạob | X | X | XC | XC | X | XC | XC |
| Thiết bị thẩm tách máu/lọc máub | X | X | XC | XC | X | XC | XC |
| Bộ lọc loại bỏ bạch cầub | X |
| XC | XC | X | XC | XC |
| Thiết bị hỗ trợ tuần hoàn qua dab | X | X | XC | XC | X | XC | XC |
| Trang thiết bị cấy ghép | |||||||
| Vòng tạo hình khuyên, van tim cơ học | X | X |
|
|
|
| X |
| Bộ dụng cụ nút mạch | X |
|
|
|
|
| X |
| Mảnh ghép nội mạch | X |
|
|
|
|
| X |
| Máy khử rung tim cấy ghép và các dây điện cực phá rung - tạo nhịp | X |
|
|
|
|
| X |
| Bơm bóng nội động mạch chủ b | X | X |
|
|
|
| X |
| Dây điện cực của máy tạo nhịp | X |
|
|
|
|
| X |
| Miếng ghép và miếng vá mạch nhân tạo (tổng hợp), bao gồm nhánh chuyển động tĩnh mạch | X |
|
|
|
|
| X |
| Stent (mạch máu) | X |
|
|
|
|
| X |
| Van tim, miếng ghép, miếng vá mạch và nhánh chuyển động tĩnh mạch bằng mô | X |
|
|
|
|
| X |
| Tim nhân tạo | X | X |
|
|
|
| X |
| Màng lọc tĩnh mạch chủ dưới | X |
|
|
|
|
| X |
| Dụng cụ trợ giúp tâm thất | X | X |
|
|
|
| X |
| a Chứng huyết khối là một hiện tượng in vivo hoặc ex vivo, nhưng có thể được mô phỏng với các điều kiện in vitro. Thử nghiệm in vivo hoặc ex vivo có thể không cần thiết nếu thử nghiệm chứng huyết khối in vitro có liên quan đến lâm sàng được thực hiện. b Chỉ các thành phần tiếp xúc máu trực tiếp hoặc gián tiếp. Đối với các thành phần chỉ tiếp xúc với máu gián tiếp, quá trình tạo huyết khối in vivo và tan huyết cơ học hoặc hoạt hóa bổ thể có thể không cần thiết. c Người ta nhận ra rằng phản ứng đông máu, tiểu cầu và bạch cầu chủ yếu liên quan đến quá trình của chứng huyết khối. Do đó, tùy thuộc vào nhà sản xuất để quyết định xem thử nghiệm cụ thể trong đông máu, tiểu cầu và các loại thử nghiệm huyết học thích hợp như là một thay thế cho thử nghiệm in vivo. d Xem thêm ISO/TS 10993-20 để biết thông tin về thời điểm hoạt hóa bổ thể nên được xem xét cho các điểm cuối khác như sốc phản vệ. | |||||||
6.1.7 Thử nghiệm in vitro được coi là hữu ích trong việc sàng lọc các trang thiết bị truyền bên ngoài cơ thể hoặc cấy ghép và khả năng tương tác sớm giữa các trang thiết bị/vật liệu với máu, nhưng có thể không phải là yếu tố dự đoán chính xác về tương tác máu/trang thiết bị xảy ra khi phơi nhiễm kéo dài hoặc lặp đi lặp lại hoặc tiếp xúc lâu dài (xem 6.3.1).
CHÚ THÍCH: Đối với các trang thiết bị mới hoặc trang thiết bị có sự thay đổi về dạng hình học, có thể cần thử nghiệm theo dòng chảy sinh lý. Đối với ống thông dài hoặc cấy ghép vĩnh viễn, hệ thống thử nghiệm in vitro có thể không đủ do vấn đề ổn định máu.
6.1.8 Các trang thiết bị hoặc bộ phận thiết bị tiếp xúc rất ngắn/thoáng qua với hệ tuần hoàn (ví dụ: lưỡi trích, kim tiêm dưới da, ống mao quản được sử dụng dưới 1 min) thường không yêu cầu thử nghiệm tương tác máu/trang thiết bị.
CHÚ THÍCH 1: Đối với các sản phẩm được làm bằng vật liệu như lớp phủ có thể tiếp xúc với máu sau khi tháo trang thiết bị, có thể cần phải thử nghiệm tương tác máu/trang thiết bị.
CHÚ THÍCH 2: Nếu một số thành phần thiết bị (ví dụ như thân ống tiêm) tiếp xúc với chất lỏng cuối cùng sẽ được tiêm vào bệnh nhân và thời gian lưu trữ không xác định hoặc lớn hơn 1 min, thậm chí sẽ cần phải thử nghiệm tan huyết của thành phần tiếp xúc với chất lỏng mặc dù thiết bị sẽ tiếp xúc với hệ tuần hoàn trong ít hơn 1 min.
6.1.9 Thiết bị phòng thí nghiệm dùng một lần được sử dụng để lấy máu và thực hiện thử nghiệm in vitro trên máu phải được đánh giá để xác định rằng không có sự can thiệp đáng kể nào đến thử nghiệm được thực hiện.
6.1.10 Nếu các phép thử được chọn theo cách mô tả và thử nghiệm được tiến hành trong các điều kiện mô phỏng các ứng dụng lâm sàng, kết quả thử nghiệm đó có xác suất dự đoán hiệu suất lâm sàng cao nhất của các trang thiết bị. Đối với các trang thiết bị vận hành trong một loạt các điều kiện, nên xem xét các điều kiện khắc nghiệt và trung bình. Tuy nhiên, sự khác biệt về loài và các yếu tố khác có thể hạn chế khả năng dự đoán của bất kỳ phép thử nào.
6.1.11 Do sự khác biệt về loài trong phản ứng máu, nên sử dụng máu người nếu có thể (ngoại trừ các phương pháp thử nghiệm đã được thiết lập với máu động vật, chẳng hạn như một số thử nghiệm tan huyết). Khi các mô hình động vật là cần thiết, ví dụ để đánh giá các trang thiết bị được sử dụng trong khoảng thời gian phơi nhiễm kéo dài hoặc lặp đi lặp lại hoặc tiếp xúc lâu dài, sự khác biệt của loài trong phản ứng máu sẽ được xem xét.
Giá trị máu và khả năng phản ứng ở người và linh trưởng không phải người rất giống nhau[204]. Việc sử dụng động vật, chẳng hạn như thỏ, lợn, bê, cừu hoặc chó, cũng có thể được chấp nhận cho một loại thử nghiệm cụ thể. Tuy nhiên, vì sự khác biệt về loài có thể là đáng kể (ví dụ, sự kết dính tiểu cầu [148] [150], chứng huyết khối [44] và tan huyết [47] có xu hướng xảy ra dễ dàng hơn ở chó so với ở người), tất cả các kết quả nghiên cứu trên động vật sẽ được giải thích một cách thận trọng. Các loài được chọn và số lượng động vật được sử dụng phải được chứng minh (xem thêm TCVN 7391-2 (ISO 10993-2)).
CHÚ THÍCH: Việc sử dụng các loài linh trưởng không phải người để thử nghiệm khả năng tương thích máu và trang thiết bị y tế in vivo bị cấm theo luật EU (86/609/EEC) và một số luật pháp quốc gia.
6.1.12 Nên tránh sử dụng các chất chống đông trong các thử nghiệm in vivo và ex vivo trừ khi trang thiết bị được thiết kế để thực hiện khi có mặt chúng. Loại và nồng độ của chất chống đông được sử dụng ảnh hưởng đến tương tác máu/trang thiết bị và lựa chọn của chủng phải được chứng minh. Các trang thiết bị được sử dụng với chất chống đông nên được đánh giá bằng cách sử dụng chất chống đông trong phạm vi nồng độ được sử dụng lâm sàng và/hoặc được mô tả trong sản phẩm IFU hoặc tài liệu thích hợp khác. Sự khác biệt của loài cũng cần được xem xét khi xác định mức độ chống đông thích hợp.
6.1.13 Sửa đổi trong một trang thiết bị được chấp nhận lâm sàng phải được xem xét về tác dụng của chúng đối với các tương tác máu/trang thiết bị và chức năng lâm sàng. Ví dụ về các sửa đổi như vậy bao gồm các thay đổi về thiết kế, hình học, thay đổi thành phần hóa học bề mặt hoặc khối lượng lớn của vật liệu và thay đổi về kết cấu, độ xốp hoặc các tính chất khác. Một mô hình dòng chảy in vitro với các điều kiện phơi nhiễm phù hợp với ứng dụng và các phép đo liên quan có thể được sử dụng để đánh giá hiệu quả của các sửa đổi đối với một trang thiết bị được chấp nhận lâm sàng.
6.1.14 Một số bản sao đủ của một thử nghiệm bao gồm các đối chứng phù hợp phải được thực hiện để cho phép đánh giá thống kê dữ liệu. Sự thay đổi trong một số phương pháp thử đòi hỏi những thử nghiệm đó phải được lặp lại đủ số lần để xác định tầm quan trọng. Ngoài ra, các nghiên cứu lặp đi lặp lại trong một thời gian dài tiếp xúc với máu/trang thiết bị cung cấp thông tin về sự phụ thuộc thời gian của các tương tác máu [213] - [216]. Cân bằng nên được xem xét giữa đánh giá thống kê và phúc lợi động vật khi áp dụng thử nghiệm in vivo; xem TCVN 7391-2 (ISO 10993-2).
6.1.15 Các khuyến nghị trong 6.1, cùng với Hình 1 và Bảng 1, đóng vai trò là một hướng dẫn cho việc lựa chọn các thử nghiệm được liệt kê trong Bảng 2. Hướng dẫn thêm về đánh giá tiền lâm sàng được đưa ra trong Phụ lục A đến Phụ lục G. Tóm lại, quy trình sau đây phải được thực hiện:
a) xác định loại tương tác máu tiềm năng (xem 6.2) phù hợp để xem xét nhằm thiết lập sự an toàn của trang thiết bị cụ thể (xem ví dụ trong Bảng 1);
b) đánh giá thông tin hiện có trong từng loại thử nghiệm đối với trang thiết bị;
c) khi có đủ thông tin an toàn, chuẩn bị một lý do thích hợp để hỗ trợ cho kết luận này và việc kiểm tra thêm là không cần thiết;
CHÚ THÍCH: Bất kỳ sự khác biệt nào về công thức, dạng hình học, tính chất bề mặt, phương pháp chế tạo, kỹ thuật khử trùng và/hoặc sử dụng lâm sàng đều có thể hạn chế việc sử dụng thông tin an toàn trên một sản phẩm tương tự.
d) khi không có đủ thông tin trong danh mục thử nghiệm, hãy chọn các thử nghiệm thích hợp, dựa trên các ví dụ trong Bảng 1 và Bảng 2, để cung cấp thông tin an toàn bổ sung.
6.2 Các loại phép thử và tương tác máu
6.2.1 Phép thử được khuyến nghị cho tương tác giữa trang thiết bị với máu
Các phép thử nghiệm khuyến nghị được tổ chức trên cơ sở loại trang thiết bị (xem ví dụ trong Bảng 1). Các phép thử được chia thành các loại sau dựa trên quy trình chính hoặc hệ thống được đo:
- tan huyết
- vật liệu gây ra
- cơ học gây ra
- chứng huyết khối
- in vitro
- đông máu
- hoạt hóa tiểu cầu
- bổ thể
- huyết học
- in vivo/ex vivo
Các nguyên tắc và cơ sở khoa học cho các phép thử này được nêu trong Phụ lục A đến Phụ lục E.
Bảng 2 - Các phép thử phổ biến được sử dụng để đánh giá tương tác với máu
| Kiểm tra theo thể loại | |
| Tan huyết | Vật liệu gây ra (ví dụ: ASTM [17], NIH [28], MHLW [22]) |
| Cơ học gây ra | |
| Chứng huyết khối (in vivo, ex vivo) | Phân tích tổng, tỷ lệ phần trăm, kính hiển vi quang học, SEM |
| Chứng huyết khối in vitro | |
| Đông máu | Các xét nghiệm Thrombin (ví dụ: TAT, F1.2), sợi huyết (ví dụ: FPA), xét nghiệm PTT |
| Hoạt hóa tiểu cầu | Đếm tiểu cầu (% hao hụt) và một số chỉ số hoạt hóa (ví dụ: sản phẩm giải phóng hoặc các dấu hiệu bề mặt tiểu cầu như βTG, PF4, TxB2) hoặc SEM (hình thái tiểu cầu) |
| Huyết học | Công thức máu toàn phần (CBC), hoạt hóa bạch cầu |
| Hệ thống bổ thể | SC5b-9 (tùy chọn C3a) |
| a Bao gồm trong tất cả các nghiên cứu trên động vật (xem B.2.1 và ISO 10993-6). Không phải tất cả các phép thử là cần thiết cho mỗi loại và thử nghiệm trong mỗi loại có thể không tương đương. | |
6.2.2 Trang thiết bị không tiếp xúc
Các trang thiết bị này không yêu cầu thử nghiệm tương tác máu/trang thiết bị.
6.2.3 Trang thiết bị truyền bên ngoài cơ thể và trang thiết bị cấy ghép
Sau khi sử dụng Bảng 1 để căn chỉnh một trang thiết bị mới đang được nghiên cứu với các trang thiết bị hiện có tương tự và lưu ý các loại phép thử để xem xét, sử dụng Bảng 2, Phụ lục A và Phụ lục E để hướng dẫn lựa chọn các phép thử thích hợp để đánh giá tương tác máu.
6.2.4 Hạn chế
Thử nghiệm và nghiên cứu các thông số thiết kế có thể đưa ra một số hạn chế/xem xét thực tế dựa trên khoa học, công nghệ và ứng dụng cụ thể. Ví dụ:
a) vật liệu/trang thiết bị trong môi trường lưu lượng máu cao (động mạch) có thể tương tác với máu khác nhau trong môi trường lưu lượng máu thấp (tĩnh mạch);
b) các tương tác máu có thể xảy ra với tất cả các vật liệu, nghĩa là các vật liệu thử nghiệm/trang thiết bị thử nghiệm và các vật liệu không thử nghiệm (ví dụ: hệ thống thử nghiệm). Cần thận trọng để không gây nhiễu các tương tác máu liên quan đến các vật liệu thử nghiệm với các yếu tố được đóng góp bởi các yếu tố khác;
c) các nghiên cứu chỉ dựa vào một loại thử nghiệm về tương tác máu có thể ít dự đoán về đáp ứng thực sự hơn so với các nghiên cứu bao gồm một số thử nghiệm khác nhau về tương tác máu;
d) các xét nghiệm miễn dịch để phát hiện các chỉ số protein về khả năng tương hợp máu, ví dụ: TAT, C3a, v.v., thường có sẵn để thử nghiệm máu người nhưng thường không có sẵn để sử dụng hoặc có chức năng với máu từ các loài khác.
6.3 Loại thử nghiệm
6.3.1 Thử nghiệm in vitro
Thử nghiệm in vitro (mô hình) nên xem xét các thiết kế để mô phỏng các điều kiện sử dụng lâm sàng trong trường hợp xấu nhất dự kiến của từng ứng dụng trang thiết bị. Các biến số phải được xem xét khi sử dụng các phương pháp thử in vitro bao gồm dung tích hồng cầu, chất chống đông (loại và lượng), chuẩn bị mẫu thử, tuổi mẫu thử, tuổi thành phần máu/máu, lưu mẫu thử, sục khí và pH, nhiệt độ, ngẫu nhiên thích hợp, diện tích bề mặt mẫu thử so với tỷ lệ thể tích máu và đối với các nghiên cứu động, điều kiện dòng chảy dịch lỏng, đặc biệt là tốc độ dòng chảy, tốc độ dịch chuyển vách và áp suất. Các thử nghiệm phải được bắt đầu với độ trễ tối thiểu, thường là trong vòng 4 h sau khi lấy máu, vì một số tính chất của máu thay đổi nhanh chóng sau khi thu thập. Các lựa chọn thay thế sau này có thể khả thi nếu được xác nhận. Trong một số trường hợp, các mẫu thu được cũng có thể được đông lạnh bằng cách sử dụng các kỹ thuật thích hợp để phân tích trong tương lai nếu quá trình đóng băng/tan băng không ảnh hưởng đến chất phân tích được đánh giá.
CHÚ THÍCH: Các loại và lượng chất chống đông có liên quan về mặt lâm sàng có thể hoặc không phù hợp, tùy thuộc vào hệ thống thử nghiệm và khả năng phân biệt phản ứng dương tính và âm tính.
Khi được sử dụng để đánh giá khả năng tương hợp máu của sửa đổi trang thiết bị, thử nghiệm in vitro đối với tan huyết, hình thành huyết khối, phản ứng tiểu cầu và đông máu có thể được đánh giá và so sánh giữa trang thiết bị được sửa đổi và trang thiết bị được chấp nhận lâm sàng (xem A.1.4).
6.3.2 Thử nghiệm ex vivo
Các thử nghiệm ex vivo phải được thực hiện khi mục đích sử dụng của trang thiết bị là ex vivo, ví dụ: một trang thiết bị truyền bên ngoài cơ thể. Thử nghiệm ex vivo cũng có thể hữu ích khi mục đích sử dụng là in vivo, ví dụ: để đánh giá đáp ứng cấp tính với cấy ghép như miếng ghép mạch. Tuy nhiên, việc sử dụng như vậy không nên thay thế cho phép thử cấy ghép.
Các hệ thống thử nghiệm ex vivo có sẵn để theo dõi sự kết dính tiểu cầu, tạo cục máu đông, lắng tiền sợi huyết, khối lượng huyết khối, kết dính tế bào bạch cầu, tiêu thụ tiểu cầu và hoạt hóa tiểu cầu [44] [46] [47] [50] [54] [70] [78] [80]. Tốc độ dòng máu có thể được đo bằng đầu dò Doppler hoặc dòng điện từ. Sự thay đổi trong tốc độ dòng chảy có thể chỉ ra mức độ và quá trình lắng đọng huyết khối và thuyên tắc. Căn cứ vào huyết khối đơn giản có thể được đánh giá bằng hình ảnh thô và hoặc hiển vi. Các công cụ đòi hỏi kỹ thuật và tiên tiến hơn khác cũng đã được sử dụng [53] [69] [73] [74] [79].
6.3.3 Phép thử in vivo
Thử nghiệm in vivo liên quan đến việc cấy ghép vật liệu hoặc trang thiết bị ở động vật. Các miếng vá mạch, ống thông mạch máu, miếng ghép mạch, stent mạch máu, vòng tạo hình khuyên, van tim và các trang thiết bị hỗ trợ tuần hoàn là những ví dụ về các trang thiết bị được thử nghiệm in vivo. Với sự đa dạng của các ứng dụng trang thiết bị y tế tiếp xúc với máu, các mô hình thử nghiệm in vivo dự kiến sẽ đa dạng như nhau, để bắt chước một cách thích hợp từng ứng dụng lâm sàng.
“Sự thông suốt của một ống dẫn hoặc trang thiết bị (nghĩa là dòng máu chảy qua trang thiết bị)” là một phép đo phổ biến nhất về sự thành công hay thất bại đối với một số thực nghiệm in vivo. Tỷ lệ phần trăm tắc mạch và khối lượng huyết khối được xác định sau khi trang thiết bị vừa được loại bỏ. Xu hướng của thrombi hình thành trên một trang thiết bị gây ra tắc mạch đối với các cơ quan đích nên được đánh giá bằng cách kiểm tra tổng thể cẩn thận cũng như đánh giá vi thể các cơ quan ở phía sau trang thiết bị. Ngoài ra, đánh giá mô bệnh học của các mô và cơ quan xung quanh là hữu ích. Thận là cơ quan đặc biệt có khả năng dễ bị các cục máu đông dẫn đến tắc mạch từ các trang thiết bị được cấy ghép ngược trở lại so với động mạch thận (ví dụ: dụng cụ trợ giúp tâm thất, tim nhân tạo, mảnh ghép động mạch chủ) [184] [187] [236] [237].
Các phương pháp đánh giá tương tác in vivo mà không cần dùng thực nghiệm đều có sẵn. Động mạch đồ hoặc hình ảnh từ ống thông siêu âm nội mạch (IVUS) được sử dụng để xác định mức độ ổn định hoặc lắng đọng huyết khối trên các trang thiết bị. Tạo hình ảnh bằng phóng xạ có thể được sử dụng để theo dõi sự lắng đọng tiểu cầu ở các thời điểm khác nhau in vivo; sự sống sót và tiêu thụ tiểu cầu có thể được sử dụng như là chỉ số của tương tác máu/trang thiết bị và sự thụ động do sự hình thành nội mạc non hoặc sự hấp phụ protein [46] [72] [79].
Trong một số hệ thống thử nghiệm in vivo, các tính chất của vật liệu có thể không phải là yếu tố chính xác định các tương tác máu/trang thiết bị. Thay vào đó, các thông số về dòng chảy, sự phù hợp, độ xốp và thiết kế cấy ghép có thể quan trọng hơn tính tương hợp của máu với chính vật liệu. Ví dụ, các hệ thống tốc độ dòng chảy thấp có thể cho kết quả khác biệt đáng kể khi so sánh với cùng một vật liệu được đánh giá trong một hệ thống tốc độ dòng chảy cao. Trong những trường hợp như vậy, tính năng hệ thống thử nghiệm in vivo sẽ quan trọng hơn kết quả thử nghiệm in vitro.
Các thủ tục thử nghiệm in vivo nên bao gồm các phần chính xác và độc lập cho biết từng loại thử nghiệm được xác định để thử nghiệm, nghĩa là: phải đánh giá tan huyết, chứng huyết khối, đông máu, tiểu cầu, huyết học và hệ thống bổ thể.
Phụ lục A
(tham khảo)
Đánh giá tiền lâm sàng các trang thiết bị tim mạch và bộ phận nhân tạo
A.1 Xem xét chung
A.1.1 Cơ sở
Phụ lục này cung cấp cơ sở để chọn các phép thử đánh giá tương tác trang thiết bị tim mạch với máu. Điều 6 bao gồm các hướng dẫn để xác định khi nào cần thử nghiệm, loại tương tác máu nào có thể phù hợp với các trang thiết bị cụ thể và danh mục các phép thử để đánh giá tương tác máu/trang thiết bị của các trang thiết bị cấy ghép, không tiếp xúc, truyền bên ngoài cơ thể. Việc phân loại các tương tác máu/trang thiết bị trong A.1.2 được cung cấp làm cơ sở.
A.1.2 Phân loại
A.1.2.1 Các tương tác chủ yếu ảnh hưởng đến trang thiết bị và có thể có hoặc không có ảnh hưởng không mong muốn đến động vật hoặc con người như sau:
a) sự hấp phụ của protein huyết tương, lipit, canxi hoặc các chất khác từ máu lên bề mặt của trang thiết bị; hoặc sự hấp thụ các chất đó vào trang thiết bị;
b) sự kết dính tiểu cầu, bạch cầu hoặc hồng cầu lên bề mặt trang thiết bị hoặc sự hấp thụ các thành phần của chúng vào trang thiết bị;
c) sự hình thành nội mạc giả hoặc bào mô trên bề mặt tiếp xúc với máu và nang mô trên bề mặt của trang thiết bị;
d) thay đổi tính chất cơ học và các tính chất khác của trang thiết bị.
A.1.2.2 Các tương tác có ảnh hưởng không mong muốn tiềm tàng đến động vật hoặc con người như sau:
a) sự hoạt hóa tiểu cầu, bạch cầu hoặc các tế bào khác, hoặc sự hoạt hóa quá trình đông máu, tiêu sợi huyết hoặc đường dẫn bổ thể;
b) hình thành huyết khối trên bề mặt trang thiết bị;
c) thuyên tắc huyết khối hoặc vật liệu khác từ bề mặt trang thiết bị đến một vị trí khác bên trong hệ tuần hoàn;
d) tổn thương các tế bào huyết đang tuần hoàn dẫn đến bệnh thiếu máu, bệnh tan huyết, giảm bạch cầu, giảm tiểu cầu hoặc thay đổi chức năng của các tế bào máu;
e) tổn thương cho các tế bào và mô liền kề với trang thiết bị;
f) sự tăng sinh quá mức hoặc sự tích lũy các mô khác trên hoặc liền kề với trang thiết bị, dẫn đến giảm lưu lượng hoặc ảnh hưởng đến các chức năng khác của trang thiết bị;
g) sự kết dính và tăng trưởng của vi khuẩn hoặc các tác nhân truyền nhiễm khác trên hoặc gần trang thiết bị.
CHÚ THÍCH: Đối với các mục b), c) và d) ở trên, một số trang thiết bị như cuộn dây thuyên tắc đòi hỏi phải hình thành huyết khối để hoạt động.
A.1.3 Các ưu thế và hạn chế của mô hình động vật
Các mô hình động vật cho phép mô phỏng sử dụng các trang thiết bị lâm sàng gần nhất trước khi thử nghiệm thực tế ở người. Chúng cho phép giám sát trang thiết bị liên tục và nghiên cứu có kiểm soát theo hệ thống các biến số quan trọng. Tuy nhiên, việc lựa chọn một mô hình động vật có thể bị hạn chế bởi các yêu cầu về kích thước, sự sẵn có của một số loài và chi phí. Ví dụ, một trang thiết bị có thể không được vận hành trong toàn bộ các điều kiện sử dụng lâm sàng trong mô hình động vật do những hạn chế về mặt giải phẫu. Điều quan trọng là các nhà nghiên cứu phải chú ý đến sự khác biệt về sinh lý và sự tương đồng của các loài được chọn với sinh lý của loài người, đặc biệt là sự giống nhau liên quan đến đông máu, các chức năng tiểu cầu và tiêu sợi huyết, và phản ứng với các tác nhân dược lý như thuốc gây mê, chất chống đông, tan huyết khối, chất kháng tiểu cầu và kháng sinh. Do có sự khác biệt trong phản ứng của loài, sự khác biệt của chủ thể trong phản ứng và phản ứng thay đổi đối với các trang thiết bị khác nhau, dữ liệu thu được từ một loài duy nhất nên được giải thích một cách thận trọng. Các loài linh trưởng không phải người như khỉ đầu chó thể hiện sự tương đồng gần gũi với con người về các giá trị huyết học, cơ chế đông máu và hệ tim mạch [50]. Một lợi thế nữa của một loài linh trưởng không phải là con người là nhiều đầu dò miễn dịch đối với các xét nghiệm chứng huyết khối được phát triển cho con người phù hợp để sử dụng cho các loài linh trưởng. Các đầu dò này bao gồm PF-4, β-TG, FPA, TAT và F1.2. Chó là một loài thường được sử dụng và đã cung cấp thông tin hữu ích; tuy nhiên, chứng huyết khối liên quan đến trang thiết bị bị phân hủy ở chó có xu hướng xảy ra dễ dàng hơn ở người, một sự khác biệt có thể được xem là một lợi thế (như một mô hình đầy thách thức hoặc tăng tốc) khi đánh giá biến chứng này. Lợn và cừu thường được coi là mô hình động vật phù hợp vì sự tương đồng về huyết học và tim mạch của chúng với con người [71] [148] [149] [150]. Cần lưu ý hiệu quả của quy trình cấy ghép phẫu thuật đối với các kết quả và các biện pháp kiểm soát thích hợp. Quyết định cuối cùng về việc sử dụng động vật hoặc mô hình in vitro cuối cùng liên quan đến việc xem xét tính khả dụng và sử dụng đạo đức của động vật (xem TCVN 7391-2 (ISO 10993-2)), tính khả dụng và giới hạn của mô hình máu in vitro và khả năng áp dụng thống kê thích hợp để đưa ra kết luận hợp lý [213] [214] [215] [216].
A.1.4 Các ưu thế và hạn chế của mô hình in vitro
Các mô hình tiếp xúc với máu in vitro là cách tiếp cận hấp dẫn để thử nghiệm khả năng tương hợp máu của các vật liệu y tế và các trang thiết bị tim mạch vì chúng cho phép:
a) tránh các mô hình động vật tốn kém,
b) thử nghiệm lặp lại cao đối tượng thử nghiệm bên cạnh các đối chứng và vật liệu chuẩn sử dụng cùng một lô máu và cùng một lúc,
c) sử dụng máu người hoặc động vật khi lưu lượng, nhiệt độ và chống đông máu được chuẩn hóa,
d) thử nghiệm trường hợp xấu nhất, trong đó các sản phẩm hoạt hóa tích lũy mà không được giải phóng bởi thận hoặc gan hoặc các cơ quan khác và chức năng ức chế hoạt hóa của các tế bào nội mô không có, và
e) cách ly với các yếu tố gây nhiễu liên quan đến cấy ghép trang thiết bị/tổn thương mô liên quan đến việc sử dụng in vivo.
Việc thử nghiệm các vật liệu và trang thiết bị y tế như vậy sẽ mô phỏng tốt nhất có thể phạm vi điều kiện lâm sàng tiếp xúc với máu của trang thiết bị, vì thử nghiệm máu trong điều kiện không thể áp dụng lâm sàng, ví dụ: chống đông máu không lâm sàng (loại hoặc mức độ) và điều kiện dòng chảy, có thể làm cho việc giải thích kết quả khó khăn. Bất cứ khi nào có thể, cần tham khảo tài liệu giới thiệu sản phẩm IFU hoặc tài liệu thực hành y tế thông thường để biết loại và chất chống đông áp dụng. Khi thích hợp, nên xem xét toàn bộ các điều kiện sử dụng có nhãn cho trang thiết bị. Ví dụ, để đánh giá sự tan huyết cơ học và hoạt hóa tiểu cầu, thử nghiệm thường được thực hiện ở tốc độ dòng máu cao nhất. Đối với thử nghiệm chứng huyết khối, tốc độ dòng máu được đánh dấu tối thiểu có thể rất quan trọng để mô tả sự an toàn của trang thiết bị. Vì nó đã được chứng minh rằng các phản ứng trong máu có thể khác nhau đáng kể giữa các loài khác nhau [47] [148] [149] [150], việc sử dụng máu người có liên quan nhiều hơn đến việc giải thích kết quả. Một lợi thế khác trong việc sử dụng máu người là nó cung cấp một loạt các phương pháp thử nghiệm chi tiết hơn, vì hầu hết các phương pháp phân tích sinh học đồng thời đều dựa trên các thành phần/epitopes máu của con người. Ngược lại, có một số hạn chế nhất định về thể tích máu có thể nhận được từ một người hiến tặng. Do đó, việc sử dụng máu từ một động vật lớn có thể thực tế hơn trong trường hợp mô hình được thiết kế để mô phỏng các điều kiện liên quan đến lâm sàng có dung lượng lớn.
Để thử nghiệm khả năng tương hợp máu của vật liệu/trang thiết bị nói chung, mô hình thử nghiệm in vitro vòng lặp Chandler cổ điển [43] hoặc sửa đổi [193] [194] [195] [199] [200] [203] để truyền đạt sinh lý và/hoặc bán sinh lý dòng chảy đã được sử dụng. Ngoài ra, tiếp xúc với vật liệu máu (trang thiết bị) bằng cách khuấy nhẹ cũng có thể hữu ích trong một số trường hợp để đánh giá sự tương tác của máu với vật liệu. Để đánh giá tác động của mô hình lên máu, tan huyết và số lượng tế bào chung có thể được theo dõi để kiểm tra sự bình thường của máu. Những mô hình này xuất hiện hiệu quả cho các nghiên cứu sàng lọc, đặc biệt đối với những ứng dụng liên quan đến phơi nhiễm máu trong thời gian ngắn.
A.1.5 Các thủ tục thử nghiệm để thử nghiệm trên động vật
Chứng huyết khối, huyết khối, chảy máu và nhiễm trùng là những yếu tố ngăn cản chính đối với việc sử dụng và phát triển hơn nữa của các bộ phận tim mạch nhân tạo tiên tiến. Đối với các trang thiết bị có thời gian tiếp xúc với máu hạn chế (< 24 h), các phép đo quan trọng có liên quan đến phạm vi biến thiên cấp của các biến số huyết học, huyết động và hiệu suất, hình thành huyết khối và thuyên tắc có thể xảy ra. Với phơi nhiễm kéo dài hoặc lặp đi lặp lại hoặc tiếp xúc lâu dài (tương ứng > 24 h và > 30 ngày), cần nhấn mạnh vào các kỹ thuật đo theo chuỗi có thể mang lại thông tin về quá trình của chứng huyết khối và thuyên tắc huyết khối, tiêu thụ các thành phần máu tuần hoàn và sự phát triển hiện tượng tăng sản nội mạc mạch và nhiễm trùng. Trong cả hai loại phơi nhiễm và tiếp xúc này, việc đánh giá tan huyết và chức năng tiểu cầu là rất quan trọng. Sự hình thành huyết khối có thể bị ảnh hưởng rất lớn bởi kỹ thuật phẫu thuật, hiện tượng tan huyết khối và huyết khối phụ thuộc thời gian thay đổi, nhiễm trùng trang thiết bị bội nhiễm và các thay đổi có thể có trên bề mặt tiếp xúc, ví dụ sự tăng sinh nội mạc mạch, đóng gói fibrotic và nội mô hóa. Điều quan trọng, loại và số lượng chất chống đông có thể có tác động sâu sắc đến kết quả. Ví dụ, ở mức độ phù hợp lâm sàng, chất chống đông và thuốc chống tiểu cầu có thể làm giảm đáng kể hoặc loại bỏ tiểu cầu, đông máu và phản ứng huyết khối.
Hậu quả của sự tương tác giữa các bề mặt nhân tạo với máu có thể bao gồm từ chứng huyết khối thô và thuyên tắc đến các ảnh hưởng không thể phát hiện như tăng tốc tiêu thụ các yếu tố liên quan đến cầm máu thông thường. Các yếu tố này có thể không đáng kể về mặt lâm sàng, ví dụ tổng số tiểu cầu bị tiêu thụ bởi trang thiết bị có thể nhỏ đến mức nó không ảnh hưởng đến tổng số lượng tiểu cầu. Ngoài ra, một trang thiết bị có diện tích bề mặt lớn có thể dẫn đến hiện tượng cạn kiệt tiểu cầu hoặc các yếu tố đông huyết tương, do đó tổng số lượng tiểu cầu có thể bị ảnh hưởng đáng kể và việc cầm máu bình thường có thể bị thay đổi.
Bất kể mô hình động vật được sử dụng và loại thử nghiệm cụ thể được đánh giá, ví dụ như tan huyết, chứng huyết khối, đông máu, tiểu cầu, huyết học và hệ thống bổ thể, thủ tục nghiên cứu in vivo nên cung cấp đủ chi tiết trong các phương pháp và tiêu chí được sử dụng để đánh giá cho từng loại thử nghiệm đang được nghiên cứu. Một báo cáo hồi cứu về kết quả cho một loại thử nghiệm cụ thể, mà không hỗ trợ các kế hoạch ban đầu trong thủ tục, thường được coi là không thể chấp nhận như tài liệu trình quy định.
A.2 Ống thông được sử dụng để lồng vào mạch máu trực tiếp và ống thông được sử dụng để lồng gián tiếp
Thuật ngữ “ống thông” có thể được sử dụng chung trong hai ứng dụng lâm sàng khá khác nhau. Trong một ứng dụng, ống thông được đưa trực tiếp qua da và vào một hoặc nhiều mạch máu chính. Điều này được thực hiện để cung cấp lượng lớn liên tục và trực tiếp vào máu. Ví dụ, loại ống thông đường kính lớn này được sử dụng trong phẫu thuật tim phổi nhân tạo như một trang thiết bị truy cập phơi nhiễm hạn chế giúp đưa máu đến và ra khỏi cơ thể để oxy hóa máu. Thử nghiệm ống thông, trong ví dụ này, nên diễn ra bằng cách sử dụng các điều kiện phơi nhiễm lặp lại gần giống sử dụng lâm sàng, vì các trang thiết bị đó có khả năng gây ra một số thay đổi về mức độ của các tế bào máu tuần hoàn cũng như tăng các yếu tố trong hệ thống đông máu hoặc bổ thể. Phản ứng đặc biệt thường là đa yếu tố vì nó phụ thuộc vào nhiều yếu tố khác nhau như vị trí cấy ghép, kỹ thuật đưa vào, yếu tố chủ thể và chế độ chống đông máu. Thuật ngữ ống thông cũng đã được sử dụng để mô tả các ống có đường kính nhỏ hơn nhiều chỉ được đặt dưới da và có thể được sử dụng để tiếp xúc gián tiếp (< 24 h) hoặc kéo dài (< 30 d) trong máu. Ví dụ những ống thông này được sử dụng để truyền insulin từ bơm thuốc và trong cảm biến dưới da đối với các mức đường huyết. Các loại ống thông sử dụng trong cảm biến dưới da, giống như các trang thiết bị đường máu gián tiếp khác (xem 5.2.2), thường yêu cầu thử nghiệm ít hơn so với các trang thiết bị tiếp xúc trực tiếp với hệ tuần hoàn (xem 5.2.3 và 5.3).
A.3 Ống thông và vòng dẫn
Hầu hết các thử nghiệm được xem xét phía sau ống thông tiếp xúc với máu có liên quan đến nghiên cứu về ống thông tiếp xúc máu và vòng dẫn. Vị trí hoặc chỗ đặt của ống thông trong hệ thống động mạch hoặc tĩnh mạch có thể có ảnh hưởng lớn đến tương tác máu/trang thiết bị. Các nghiên cứu nên đối chứng đồng thời, sử dụng một trang thiết bị được phê duyệt lâm sàng có kích thước và vật liệu tương tự, được thực hiện bằng cách sử dụng động mạch hoặc tĩnh mạch đối diện. Cần thận trọng không lấy hết huyết khối khi rút ống thông. Đánh giá trang thiết bị tại chỗ có thể cho phép đánh giá mức độ thương tích nghiêm trọng hoặc tại chỗ đóng góp vào quá trình huyết khối. Nói chung, các phép đo lưu lượng máu Doppler có nhiều thông tin hơn so với chụp X quang động mạch. Một mô hình cấy ghép tĩnh mạch hoặc động mạch có chống đông phù hợp với ứng dụng lâm sàng có thể là một công cụ hữu ích để đánh giá phản ứng tiếp xúc với máu của trang thiết bị, đặc biệt là khi đánh giá vật liệu trang thiết bị mới hoặc được phát triển thêm lớp phủ có đặc tính chống gây huyết khối [143] [161] [162] [163]. Xem C.3. Ngoài ra, một mô hình in vitro thích hợp có thể nhạy hơn để phát hiện sự khác biệt bề mặt vật liệu như vậy.
Trong trường hợp cần chất chống đông, lý do về loại và mức độ của chất chống đông được sử dụng trong thử nghiệm phải dựa trên ứng dụng lâm sàng, nhưng vẫn có thể cung cấp đủ bằng chứng cho thấy thử nghiệm có thể phân biệt giữa phản ứng dương tính và âm tính. Ví dụ, theo động lực học liều đáp ứng đơn giản, tính kháng huyết khối của lớp phủ heparin của trang thiết bị y tế có thể được che dấu hoàn toàn bằng mức độ chống đông máu của dung dịch heparin bình thường (trên lâm sàng). Tuy nhiên, dưới mức độ giảm/thử thách của dung dịch heparin, hiệu quả của lớp phủ heparin để giảm sự hình thành huyết khối trở nên rõ ràng hơn. Trong trường hợp ứng dụng có thể không liên quan đến việc sử dụng chất chống đông, nên tiến hành thử nghiệm mà không cần chất chống đông.
Thông tin đánh giá xác nhận để thử nghiệm với một loại và mức độ của chất chống đông cụ thể phải thể hiện khả năng phân biệt giữa phản ứng dương tính và âm tính.
A.4 Thiết bị trao đổi oxy qua màng ngoài cơ thể (máy tim phổi nhân tạo), thiết bị thẩm tách máu/lọc máu, thiết bị phân tách điều trị và lấy máu, quả lọc hấp phụ các chất riêng biệt từ máu
Các phản ứng cầm máu với tim phổi nhân tạo có thể là đáng kể và cấp tính. Nhiều biến số như sử dụng hút máu, thành phần của chất lỏng mồi bơm máu, hạ thân nhiệt, sự tiếp xúc của máu với không khí và thời gian phơi nhiễm đều ảnh hưởng đến các giá trị thử nghiệm. Các huyết khối trong các đường chảy ra có thể được phát hiện bằng cách đặt định kỳ các bộ lọc máu ex vivo hoặc sử dụng kỹ thuật siêu âm hoặc các kỹ thuật không xâm nhập khác. Sự tích lũy huyết khối có thể được đánh giá trực tiếp trong các đường phụ bằng cách theo dõi các yếu tố hiệu suất như giảm áp suất trên thiết bị trao đổi oxy và tốc độ truyền oxy. Một rối loạn chức năng tiểu cầu thoáng qua có liên quan đến giải phóng hạt alpha chọn lọc đã được quan sát thấy ở những bệnh nhân sử dụng tim phổi nhân tạo [158]; các xét nghiệm khác về chức năng tiểu cầu và sự giải phóng tiểu cầu là đặc biệt hữu ích.
Sự hoạt hóa bổ thể được gây ra bởi cả hai thiết bị thẩm tách máu và tim phổi nhân tạo. Chấn thương phổi và sự ứ đọng bạch cầu phổi nghiêm trọng về mặt lâm sàng cùng với rối loạn chức năng có thể xảy ra [5] [11] [16] [129] - [147]. Vì những lý do này, rất hữu ích để định lượng hoạt hóa bổ thể hoặc giảm bạch cầu với các thiết bị này. Xem thêm Phụ lục E.
Thiết bị phân tách điều trị và lấy máu và các trang thiết bị để hấp phụ các chất đặc hiệu từ máu, do tỷ lệ bề mặt so với thể tích cao, có khả năng hoạt hóa các con đường bổ thể, đông máu, tiểu cầu và bạch cầu. Việc kiểm tra các tương tác máu/trang thiết bị trong các trang thiết bị này và bất kỳ trang thiết bị có diện tích bề mặt lớn nào khác phải tuân theo các nguyên tắc tương tự như đối với thiết bị trao đổi oxy qua màng ngoài cơ thể (máy tim phổi nhân tạo) và máy tạo máu.
A.5 Trang thiết bị trợ giúp tâm thất và toàn bộ tim nhân tạo
Những trang thiết bị này có thể gây ra sự thay đổi đáng kể trong các thành phần máu khác nhau.
Các yếu tố góp phần vào những ảnh hưởng này bao gồm diện tích bề mặt bên ngoài lớn mà máu phơi nhiễm được, chế độ dòng chảy cao và các khu vực dòng chảy bị xáo trộn như nhiễu loạn hoặc dòng chảy tách biệt. Các thử nghiệm của các trang thiết bị này có thể bao gồm các phép đo tan huyết, hình thành huyết khối, hình thành sợi huyết, thuyên tắc huyết khối, tạo thrombin, sống sót và hoạt hóa tiểu cầu, hoạt hóa bổ thể và theo dõi chặt chẽ các tác động của gan, thận, phổi và hệ thần kinh trung ương. Kiểm tra bệnh lý chi tiết khi phục hồi sau phẫu thuật là một thành phần quan trọng của đánh giá [236] [237].
A.6 Bộ phận van tim nhân tạo
Các nghiên cứu xâm nhập, không xâm nhập và thủy lực học in vitro đều quan trọng trong việc đánh giá các bộ phận van tim nhân tạo.
Một trong số các sàng lọc hiệu quả nhất đối với rối loạn chức năng van nhân tạo là sử dụng ống nghe [186]. Siêu âm tim 2D và Mode M sử dụng kỹ thuật siêu âm để tạo hình ảnh tim. Tín hiệu phản xạ từ các vật liệu có trở kháng âm học khác nhau nhận được và được xử lý để tạo hình ảnh. Cấu trúc của các van nhân tạo có thể được kiểm tra. Các bộ phận nhân tạo cơ học phát ra các tín hiệu âm mạnh và sự dịch chuyển của cục máu đông thường có thể được chụp rõ ràng. Tuy nhiên, chất lượng của hình ảnh có thể phụ thuộc vào van cụ thể đang được kiểm tra. Siêu âm tim cũng có thể hữu ích trong việc đánh giá chức năng của các van tim nhân tạo có nguồn gốc từ mô. Hiện tượng sùi, huyết khối và bằng chứng về sự dày lên của các lá van được làm sáng tỏ. Sử dụng siêu âm Doppler dòng máu chảy thông thường và dòng chảy màu có thể nhận biết và định lượng sơ bộ sự dồn ngược máu do hở van tim [2] [185] [186] [187].
Các phép đo sự sống sót và sự ngưng tập tiểu cầu, phép thử tắc mạch máu và tan huyết, đo huyết áp và dòng máu chảy và sinh thiết van tim và các mô liền kề được khuyến nghị [205] [206].
A.7 Các mô ghép mạch máu
Cả hai vật liệu xốp và không xốp đều có thể được cấy ghép tại các vị trí khác nhau trong hệ thống động mạch hoặc tĩnh mạch. Sự lựa chọn vị trí cấy ghép được xác định chủ yếu bởi những xem xét về mặt giải phẫu của mô hình và vị trí sử dụng lâm sàng. Độ lưu thông của một mảnh ghép nhất định được tăng lên bởi đường kính lớn hơn và chiều dài ngắn hơn. Độ lưu thông có thể được kiểm chứng bằng cách bắt mạch ngoại vi tại một số vị trí và bằng cách chụp X quang động mạch định kỳ. Sóng siêu âm, MRI và PET cũng có thể hữu ích. Các phép đo theo chuỗi số lượng tiểu cầu, thành phần giải phóng tiểu cầu, các sản phẩm phân hủy tiền sợi huyết/sợi huyết và protein đông máu được hoạt hóa cũng được khuyến nghị. Giải phẫu các mô ghép và các đoạn mạch máu liền kề đối với các phản ứng mô mạch máu có thể cung cấp thông tin có giá trị. Một đánh giá có hệ thống các mặt cắt dọc và cắt ngang của các vùng giữa đoạn ghép đại diện à được nối mạch máu ở đầu cạn và ngoại vi là cần thiết để đánh giá kỹ lưỡng trang thiết bị [4] [205].
Cũng như nhiều trang thiết bị mạch máu, chế độ chống đông lâm sàng thích hợp rất quan trọng đối với chức năng và hiệu suất của trang thiết bị.
A.8 Bộ lọc IVC, stent và ghép stent
Những trang thiết bị này có thể được nghiên cứu bằng chụp X quang động mạch và kỹ thuật siêu âm. Các kỹ thuật khác hữu ích cho đánh giá ghép mạch máu (xem A.7) cũng thích hợp ở đây [205].
Phụ lục B
(tham khảo)
Các phép thử phòng thí nghiệm được khuyến nghị - Nguyên lý, cơ sở khoa học và giải thích
B.1 Xem xét chung
B.1.1 Cơ sở
Các nguyên lý chung và cơ sở khoa học của các thử nghiệm thường được sử dụng để đánh giá các loại tan huyết, chứng huyết khối, đông máu, tiểu cầu, huyết học và hệ thống bổ thể (xem 6.2) được nêu trong B.1 đến B.3. Xem Phụ lục C, D và E để biết thêm thông tin về các loại thử nghiệm chứng huyết khối, tan huyết và bổ thể.
Ngoài ra, mặc dù các phương pháp ít phổ biến hơn, có thể có giá trị hơn nữa trong việc đánh giá các tương tác máu/trang thiết bị cụ thể được nêu trong Phụ lục F. Do các biến đổi sinh học và giới hạn kỹ thuật, độ chính xác và dự đoán của nhiều thử nghiệm này đòi hỏi phải chú ý cẩn thận về phương pháp và thận trọng trong việc giải thích kết quả. Phụ lục G liệt kê các thử nghiệm không được khuyến nghị.
B.4 trình bày các xem xét về phương pháp để kiểm tra các yếu tố huyết tương đặc hiệu cho đông máu, hoạt hóa tiểu cầu và bạch cầu và hoạt hóa bổ thể bằng kỹ thuật ELISA (hoặc tương tự khác).
Tất cả các tài liệu tham khảo trong thư mục mô tả chi tiết hơn và đưa ra các ví dụ về các tiêu chuẩn, thử nghiệm và mô hình khác nhau để xem xét.
B.1.2 Thử nghiệm in vitro so với ex vivo so với in vivo
B.1.2.1 Một loạt các mô hình in vitro, ex vivo và in vivo đã được sử dụng rộng rãi để ước tính các tương tác vật liệu máu [1]-[30][42]-[147][157]-[237]. Điều thích hợp là chọn mô hình phù hợp nhất cho ứng dụng trang thiết bị và mục tiêu thử nghiệm và tham khảo TCVN 7391-12 (ISO 10993-12) về việc xem xét nhóm chuẩn bị và kiểm soát mẫu thích hợp.
Không có mẫu in vitro, ex vivo hoặc in vivo nào phù hợp cho tất cả các ứng dụng. Vì vậy, sự phù hợp của mô hình với ứng dụng đang được xem xét nên được chứng minh.
Các thử nghiệm in vivo trình bày một mô phỏng mục đích sử dụng thực tế hơn, nhưng vẫn phức tạp bởi các yếu tố như:
- lựa chọn mô hình động vật phù hợp;
- xen kẽ và biến đổi liên chủ thể trong các phản ứng [47] [71] [148] [149] [150];
- sự khan hiếm của các bộ thử nghiệm thương mại đặc trưng cho loài đối với các chỉ số phổ biến về chứng huyết khối và đông máu [58] [59] [60];
- chi phí cao và mối quan tâm về đạo đức và thống kê liên quan đến việc sử dụng mô hình động vật.
B.1.2.2 Tham khảo các tiêu chuẩn riêng cho các mô hình ưu tiên [1]-[41]. Xem thêm Tài liệu tham khảo [186] đối với cừu con chưa trưởng thành như một mô hình tăng tốc để nghiên cứu vôi hóa van nhân tạo sinh học, Tài liệu tham khảo [187] đối với lợn hoặc cừu trưởng thành để nghiên cứu van đặt xuyên mạch và van được phẫu thuật cấy ghép, Tài liệu tham khảo [217] đến [231] đối với các mô hình thay thế xương đùi và cừu trưởng thành được sử dụng trong thử nghiệm trên mô hình ghép mạch máu đường kính nhỏ và lớn, và Tài liệu tham khảo [232] - [235] đối với mô hình mạch vành của lợn được sử dụng rộng rãi để nghiên cứu các thiết kế stent.
B.1.2.3 Như được nêu trong các phần khác của TCVN 7391 (ISO 10993), các thử nghiệm in vitro được tiến hành cẩn thận cung cấp các công cụ sàng lọc hợp lệ để đánh giá sự an toàn sinh học của các trang thiết bị và vật liệu y tế.
Các yếu tố quan trọng trong mô hình in vitro yêu cầu quy định kỹ thuật sau:
- thể tích máu toàn phần trong hệ thống thử nghiệm cơ bản, ví dụ: ống, vòng lặp, hoặc mô hình khác,
- thời gian tiếp xúc với máu,
- nhiệt độ máu,
- tình trạng lưu lượng máu,
- loại và mức độ chống đông máu,
- tỷ lệ phơi nhiễm, nghĩa là tỷ lệ diện tích bề mặt vật liệu/trang thiết bị (cm2) so với thể tích máu toàn phần trong hệ thống (mL) và
- diện tích bề mặt tiếp xúc với máu của chính hệ thống thử nghiệm (cm2).
CHÚ THÍCH 1: “Giai đoạn tiếp xúc với máu” trong nghiên cứu in vitro yêu cầu một định nghĩa chính xác về các điều kiện phơi nhiễm của vật liệu/trang thiết bị thử nghiệm với máu. Các điều kiện thử nghiệm càng gần với ứng dụng lâm sàng, khả năng dự đoán của mô hình càng lớn và các phản ứng được đánh giá.
CHÚ THÍCH 2: “Giai đoạn thử nghiệm” tiếp theo giai đoạn phơi nhiễm trong đó các thử nghiệm cụ thể được tiến hành trên máu, huyết tương hoặc chính vật liệu/trang thiết bị đã tiếp xúc. Một thử nghiệm trong giai đoạn thử nghiệm thường được nhắm mục tiêu vào một hoặc nhiều loại chung, nghĩa là tan huyết, chứng huyết khối, đông máu, tiểu cầu, huyết học và hệ thống bổ thể.
B.2 và B.3 kiểm tra các phương pháp phổ biến được sử dụng để đánh giá các loại chính của tương tác vật liệu/trang thiết bị với máu (xem Bảng 2).
B.2 Chứng huyết khối
B.2.1 Phân tích tổng thể - Phục hồi, kiểm tra trang thiết bị và sinh thiết các cơ quan ngoại vi
Phân tích tổng thể phải luôn được đưa vào như một phần của đánh giá trang thiết bị cơ bản, vì phân đoạn đánh giá trang thiết bị này có tầm quan trọng trung tâm trong việc đánh giá các phản ứng sinh học in vivo đối với các trang thiết bị cấy ghép. Sự phân bố, kích thước có thể nhìn thấy và bản chất của lắng cặn tế bào và protein, và bất kỳ thuyên tắc nào, có thể được xác định tốt nhất bằng cách kiểm tra tổng thể cẩn thận và chi tiết. Các thủ tục đề xuất đã được công bố [7] [205] [206] [207].
Lý do phía sau sự hoại tử của các cơ quan ngoại vi là để kiểm tra các tác động ngoại vi (như thuyên tắc) của các trang thiết bị cấy ghép. Tầm quan trọng của phân tích này thay đổi theo ứng dụng trang thiết bị và bị giới hạn ở các ứng dụng có nguy cơ thuyên tắc huyết khối hoặc thuyên tắc vật liệu/trang thiết bị, ví dụ với van tim cơ học và bơm bóng động mạch chủ, ở mức trung bình cao [206].
Trong loại nghiên cứu này, phim màu hoặc hình ảnh kỹ thuật số có độ phân giải cao, độ phóng đại thấp và/hoặc cao ở các điểm quan tâm chính (của trang thiết bị và các mô xung quanh, v.v...) được chụp và đánh dấu thích hợp.
B.2.2 Độ tắc mạch tính theo phần trăm, diện tích bề mặt được bao phủ bởi huyết khối và diện tích bề mặt không có huyết khối
Độ tắc mạch tính theo phần trăm có thể được đánh giá định lượng trong phần cuộc sống đang nghiên cứu sử dụng kỹ thuật chụp X quang tương phản và siêu âm. Độ tắc mạch tính theo phần trăm cũng có thể được đánh giá bằng mắt thường sau khi một trang thiết bị cấy ghép vừa được loại bỏ. Độ tắc mạch tính theo phần trăm có thể là phép đo mức độ nghiêm trọng của quá trình tắc mạch trong ống dẫn. Tuy nhiên, thiếu sự tắc mạch không nhất thiết loại bỏ được sự tồn tại của quá trình tắc mạch, vì huyết khối có thể đã bị thuyên tắc hoặc bị đánh bật ra trước khi đo độ tắc mạch tính theo phần trăm. Loại trừ có thể được gây ra không chỉ do chứng huyết khối, mà còn do sự tăng sinh nội mạc mạch, đặc biệt là tại các vị trí quanh hậu môn trong ghép mạch máu. Do đó, kiểm tra vi thể hỗ trợ rất hữu ích để nhận biết bản chất của quá trình tắc mạch. Xác định diện tích bề mặt được bao phủ bởi huyết khối và diện tích bề mặt không có huyết khối là các thử nghiệm bán định lượng hoặc định lượng có thể được sử dụng trên cơ sở so sánh với các phép thử và/hoặc trang thiết bị đối chứng.
B.2.3 Kính hiển vi quang học
Bằng kỹ thuật này, có thể thu được thông tin về mật độ tế bào, sự có mặt của các ngưng tập tế bào, thành phần mô bao bọc, cường độ phản ứng của cơ thể ngoại lai và huyết khối hoặc sợi huyết dính vào vật liệu. Việc đánh giá phân bố địa lý của các lắng đọng này cũng có thể trên các vật liệu hoặc trang thiết bị. Phương pháp này là phương pháp bán định lượng.
Đối với các vật liệu và trang thiết bị có nguồn gốc từ polyme hoặc sinh học, phương pháp nhúng sáp parafin và vết bẩn đặc biệt có thể được sử dụng để đánh giá giao diện sinh học của trang thiết bị.
Đối với các trang thiết bị và vật liệu kim loại và gốm, các kỹ thuật nhúng và cắt nhựa cứng tinh vi hơn rất hữu ích để chụp giao diện vật liệu/trang thiết bị sinh học nguyên vẹn [207] - [211].
B.2.4 Kính hiển vi điện tử quét (SEM)
Đối với SEM, lý do và giải thích giống như đối với kính hiển vi quang học (xem B.2.3). Phương pháp này có ưu điểm so với kính hiển vi quang học, cung cấp chi tiết hơn về cấu trúc tinh vi của các thành phần được kiểm tra. Kết luận về định lượng đòi hỏi phải xác định lặp lại đủ để thiết lập được độ tái lập. Loại kính hiển vi này phản ánh tốt nhất những gì có thể nhìn thấy ở các bề mặt. Các phân tích mặt cắt ngang cũng có thể được sử dụng để hỗ trợ các quan sát bề mặt nếu các chi tiết bổ sung liên quan đến tương tác bề mặt tế bào và huyết khối là tham khảo [70] [71] [143] [205] [206]. Đánh giá hình thái của hoạt hóa tiểu cầu và bạch cầu, hình thành sợi huyết và huyết khối sau khi tiếp xúc với máu hoặc thành phần máu (ví dụ như huyết tương giàu tiểu cầu) so với đối chứng chuẩn là có giá trị [143] [173].
B.3 Khả năng tương hợp máu in vitro
B.3.1 Sự tan huyết - Phương pháp thử
Sự tan huyết được coi là một thử nghiệm sàng lọc quan trọng bởi vì nồng độ hemoglobin trong huyết tương tăng cao là bất thường và có thể là dấu hiệu của một vấn đề về huyết học hoặc bệnh mạch máu tiềm ẩn. Thực hiện đúng cách, nồng độ haemoglobin trong huyết tương tăng cao cho thấy sự tan huyết, nghĩa là sự giải phóng hàm lượng của các tế bào hồng cầu (RBC) và có thể phản ánh sự mỏng manh của màng hồng cầu hoặc tổn thương đối với hồng cầu. Trong đánh giá các tương tác giữa vật liệu/trang thiết bị máu, tan huyết có thể do:
a) tiếp xúc máu trực tiếp với các vật liệu/bề mặt trang thiết bị (vật liệu gây ra);
b) tiếp xúc gián tiếp khi tiếp xúc với hóa chất chiết xuất từ vật liệu trang thiết bị (vật liệu gây ra);
c) tiếp xúc với nhiễu loạn và ứng suất cắt tăng (nghĩa là không sinh lý) từ hoạt động của trang thiết bị (cơ học gây ra).
Xem Phụ lục D để biết thêm chi tiết về thử nghiệm tan huyết.
B.3.2 Sự đông máu - Phương pháp thử
B.3.2.1 Quy định chung
Tầng đông máu có hai con đường song song, con đường hoạt hóa liên lạc (con đường nội sinh) và con đường yếu tố mô (con đường ngoại sinh) hợp nhất để tạo thành một con đường chung. Loại thứ hai bao gồm protein thrombin, xúc tác cho sự hình thành của sợi huyết, thành phần chính của huyết khối. Mặc dù được biết rằng con đường chính cho sự khởi đầu của quá trình đông máu là con đường yếu tố mô, sự đông máu liên quan đến các trang thiết bị và vật liệu tiếp xúc với máu xảy ra thông qua con đường hoạt hóa liên lạc. Bản thân các con đường là một chuỗi các phản ứng trong đó các tiền chất enzym không hoạt hóa liên tiếp (được gọi là zymogens) tương tác với các yếu tố glycoprotein của chúng để trở thành các thành phần hoạt động trong một loạt các sự kiện hoạt hóa. Các phản ứng lên đến đỉnh điểm trong sự hình thành của thrombin hoạt động sau đó xúc tác cho sự hình thành của sợi huyết. Các yếu tố đông máu thường được biểu thị bằng chữ số La Mã, với chữ viết thường là chữ viết hoa được gắn để biểu thị dạng hoạt động. Xem Hình B.1.
Đánh giá hoạt động đông máu, nghĩa là mức độ thay đổi nồng độ protein trong máu dẫn đến sự hình thành thrombin và sợi huyết (xem Hình B.1), từ lâu đã dựa vào các xét nghiệm lâm sàng đo mức protein huyết tương trong tầng đông máu. Mức độ nghỉ ngơi bình thường (cân bằng nội môi) của hoạt động đông máu được thiết lập tốt, cũng như một số mức độ cao được quan sát thấy trong các rối loạn đông máu lâm sàng khác nhau. Giả định cho việc thử nghiệm như vậy với các trang thiết bị y tế là các vật liệu và thiết kế trang thiết bị phù hợp không nên liên quan đến hoạt động đông máu quá mức có thể gây rủi ro cho bệnh nhân. Mức độ hoạt động đông máu cao có thể là một chỉ số về xu hướng cao hơn đối với vật liệu hoặc trang thiết bị gây ra hoặc có liên quan đến chứng huyết khối cấp tính hoặc thuyên tắc huyết khối. Để đo hoạt động đông máu, các phòng thí nghiệm lâm sàng thường dựa vào các bộ thử nghiệm sử dụng kỹ thuật xét nghiệm miễn dịch hấp thụ liên kết với enzym thông thường. Trong một nghiên cứu cơ bản, có thể là in vivo hoặc in vitro và sẽ phụ thuộc vào lượng kháng thể thích hợp với các epitope protein đông máu đặc hiệu của loài, các mẫu máu được lấy trong các điều kiện xác định và được chuẩn bị và phân tích theo hướng dẫn xét nghiệm. Các điều kiện hoặc yếu tố xác định điển hình quan trọng trong mô hình in vitro được nêu trong B.1.2.3. So sánh kết quả với các đối chứng thích hợp, chẳng hạn như đối chứng âm tính (ví dụ: mức cơ sở hoặc không tiếp xúc với vật liệu/trang thiết bị) và kết quả trên các trang thiết bị/vật liệu dự đoán là rất quan trọng. Hoạt động đông máu trong máu có ý nghĩa thống kê và sinh học - cao hơn đáng kể so với nhóm đối chứng có thể là một chỉ số của thiết kế vật liệu/trang thiết bị có nguy cơ biến chứng liên quan đến đông máu cao hơn. Ví dụ các protein hoạt hóa đông máu có bộ dụng cụ ELISA thương mại có sẵn bao gồm TAT (phức hợp thrombin-antithrombin), F.1.2 (đoạn protein được giải phóng từ prothrombin khi hình thành thrombin) và FPA (đoạn protein được giải phóng từ tiền sợi huyết).
Các protein biểu thị hoạt hóa đông máu thường thể hiện giai đoạn bắt đầu, lan truyền và kết thúc [56) [57]. Điều này phản ánh các phản ứng hình thành ban đầu, giai đoạn khuếch tán tầng/phản hồi và thời gian chậm/ngừng hoạt động trong đó tiền chất quan trọng có thể được tiêu thụ hoặc protein được đo bị vô hiệu hóa bởi các protein phản hồi đối chứng âm tính. Vì vậy, sự khác biệt về thứ tự theo mức độ của các protein hoạt hóa đông máu sẽ được dự kiến theo thời gian. Do đó, một yếu tố quan trọng cần xem xét là khi giai đoạn hoạt hóa thực sự xảy ra trong thời gian tiếp xúc với vật chất/trang thiết bị. Ví dụ, tác động của vật liệu thử nghiệm khi trộn với máu có thể khá khác nhau ở mỗi giai đoạn. Ngoài ra, do hoạt hóa protein đông máu thường tỷ lệ thuận với diện tích bề mặt tiếp xúc với máu, diện tích bề mặt (SA) của trang thiết bị hoặc vật liệu trang thiết bị có thể ảnh hưởng rất lớn đến kết quả. Vì lý do này, điều quan trọng là quy định tỷ lệ SA so với thể tích máu thử nghiệm (tỷ lệ phơi nhiễm) trong mỗi nghiên cứu. Nếu có thể, tỷ lệ phơi nhiễm có thể được coi là một biến số để giúp hiểu được tính đặc hiệu của hiệu ứng vật liệu. Tỷ lệ phơi nhiễm từ 3,0 cm2 đến 6,0 cm2/mL máu (dựa trên độ dày của trang thiết bị) phù hợp với TCVN 7391-12 (ISO 10993-12). Các tỷ lệ phơi nhiễm khác như 1,5 lần và 2,0 lần tỷ lệ này có thể đáng xem xét vì diện tích bề mặt cao hơn về mặt lý thuyết sẽ làm tăng độ nhạy của các phản ứng đông máu đối với vật liệu thử.
Sẽ có giới hạn vật lý về số lượng vật liệu thử nghiệm có thể được thử nghiệm do thể tích của hệ thống thử nghiệm, ví dụ: một ống nghiệm, và tỷ lệ phơi nhiễm mục tiêu. Trong trường hợp này, có thể thích hợp sử dụng các phần cắt của vật liệu trang thiết bị. Nếu trang thiết bị chứa nhiều hơn một vật liệu, cần duy trì tỷ lệ của từng loại trong trang thiết bị hoàn chỉnh. Cũng nên quan tâm đến việc thực hiện khi phơi nhiễm để tránh dẫn đến việc đưa ra các mặt cắt có bề mặt không tiếp xúc với máu với số lượng đáng kể.
Đương nhiên, có một số cơ chế đã phát triển để giữ cho tầng đông máu được kiểm tra. Một trong những cơ chế liên quan đến protein antithrombin. Antithrombin là một chất ức chế protease serine có thể liên kết và vô hiệu hóa các protease serine thrombin, FIXa, FXa, FXIa và FXIIa. Trong khi antithrombin liên tục hoạt động, sự tương tác của nó với heparin làm thay đổi cấu trúc của nó, điều này làm tăng đáng kể tốc độ ức chế các protease.
CHÚ THÍCH: Thử nghiệm ELISA cho các yếu tố đông máu đại diện cho giai đoạn thử nghiệm, được thảo luận trong B.1.2, nghĩa là để thử nghiệm trên các mẫu máu thu được sau khi phơi nhiễm máu in vitro hoặc in vivo với trang thiết bị hoặc vật liệu y tế.
Nhiều xét nghiệm đông máu tiêu chuẩn được thiết kế để phát hiện các rối loạn đông máu lâm sàng dẫn đến chậm đông máu hoặc chảy máu quá nhiều, thay vì các điều kiện làm tăng đông máu/chứng huyết khối. Các thủ tục để đánh giá các tương tác máu/trang thiết bị phải được sửa đổi một cách thích hợp để đánh giá sự đông máu tăng tốc gây ra bởi các vật liệu sinh học.
Tương tác giữa các hệ thống đông máu và hệ thống bổ thể được công nhận [143] - [147].
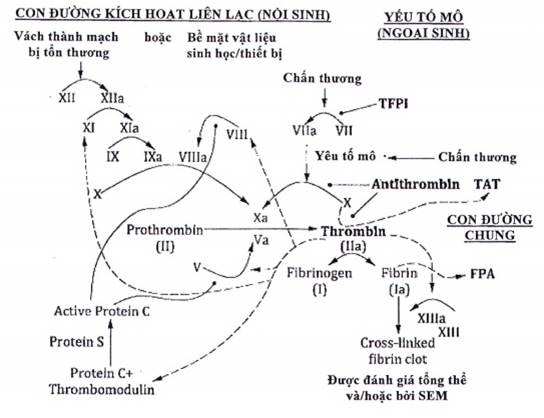
Hình B.1 - Tầng đông máu
B.3.2.2 Các xét nghiệm ELISA Thrombin-antithrombin (TAT), F1.2 và sợi huyết (FPA)
Các xét nghiệm ELISA phản ánh trực tiếp sự hình thành thrombin (TAT, F1.2) và sợi huyết (FPA) có sẵn trên thị trường. Đầu ra là một ước tính định lượng về lượng thrombin hiện tại và lượng sợi huyết được hình thành, cả hai đều phản ánh mức độ hoạt động đông máu đang diễn ra và có thể phản ánh chứng huyết khối đang diễn ra. Xem B.4 để biết chi tiết về phương pháp ELISA chung.
B.3.2.3 Thời gian thromboplastin từng phần (PTT)
Thời gian thromboplastin từng phần là thời gian đông máu của huyết tương được khử lại khi bổ sung thromboplastin từng phần không chứa chất hoạt hóa. Thromboplastin từng phần là một dịch huyền phù phospholipid thường được chiết xuất từ thromboplastin mô, đó là một dịch đồng nhất từ não hoặc phổi của động vật có vú. Việc rút ngắn PTT sau khi tiếp xúc với vật liệu trong điều kiện tiêu chuẩn cho thấy sự hoạt hóa giai đoạn đông máu nội tại của đông máu. Heparin và các chất chống đông khác gây ra PTT kéo dài. Xem tài liệu tham khảo [23].
Thuốc thử cho các thử nghiệm dựa trên thời gian thromboplastin từng phần được hoạt hóa (APTT) bao gồm một chất hoạt hóa, chẳng hạn như kaolin, celite hoặc axit ellagic. Nên tránh dùng thuốc thử có chất hoạt hóa như vậy khi đánh giá tác động của các trang thiết bị tiếp xúc với máu hoặc vật liệu trang thiết bị vì chúng che dấu sự đông máu do vật liệu hoặc trang thiết bị gây ra.
Trong thử nghiệm đông máu của vật liệu và trang thiết bị y tế, chính trang thiết bị hoặc vật liệu đóng vai trò là chất hoạt hóa đông máu. Các vật liệu đối chứng dương tính và âm tính thích hợp nên được sử dụng bất cứ khi nào có sẵn. Nên bao gồm một đối chứng âm tính, huyết tương mà không có vật liệu/trang thiết bị.
B.3.3 Tiểu cầu - Phương pháp thử
B.3.3.1 Quy định chung
Đánh giá tiểu cầu và trạng thái hoạt hóa của chúng đã được nêu trong suốt tài liệu, ví dụ: xem Tài liệu tham khảo [69] - [94] dưới dạng danh mục từng phần. Tuy nhiên, đối với các trang thiết bị và vật liệu y tế tiếp xúc với máu, các phương pháp được sử dụng phổ biến nhất được cho là đơn giản là đếm tiểu cầu và đo protein phân hủy tiểu cầu sau khi phơi nhiễm có kiểm soát các trang thiết bị y tế hoặc vật liệu với máu. Mức độ nghỉ ngơi bình thường (cân bằng nội môi) của tiểu cầu và protein phân hủy được thiết lập tốt (xem tài liệu sản phẩm bộ dụng cụ ELISA thương mại), cũng như một số mức độ bất thường được quan sát thấy trong các bệnh huyết khối lâm sàng khác nhau. Giả định cho việc thử nghiệm như vậy với các trang thiết bị y tế là các vật liệu và thiết kế trang thiết bị phù hợp không nên liên quan đến việc tiêu thụ quá nhiều tiểu cầu và/hoặc hoạt hóa có thể gây rủi ro cho bệnh nhân. Mức độ mất tiểu cầu và/hoặc phân hủy cao có thể là một chỉ số về xu hướng vật liệu/trang thiết bị gây ra hoặc thúc đẩy các tình trạng này có thể dẫn đến các biến chứng chảy máu hoặc chứng huyết khối. Để đo số lượng tiểu cầu và sự phân hủy tiểu cầu, việc đếm được thực hiện bằng cách sử dụng bộ đếm tế bào vi phân thường quy và sự phân hủy được đánh giá bằng cách sử dụng các xét nghiệm miễn dịch hấp thụ liên kết với enzym tiêu chuẩn (ELISA) đối với các protein hạt tiểu cầu được công nhận. Các phòng thí nghiệm lâm sàng thường dựa vào các bộ thử nghiệm sử dụng kỹ thuật xét nghiệm miễn dịch hấp thụ liên kết với enzym thông thường để đo các protein hạt alpha. Trong một nghiên cứu cơ bản, có thể là in vivo hoặc in vitro và sẽ phụ thuộc vào sự sẵn có của các kháng thể thích hợp với các epitopes protein hạt tiểu cầu đặc hiệu của loài, các mẫu máu được lấy trong các điều kiện xác định và được chuẩn bị và phân tích theo hướng dẫn xét nghiệm. Các điều kiện hoặc yếu tố xác định điển hình quan trọng trong mô hình in vitro được nêu trong B.1.2.3. So sánh kết quả với các đối chứng thích hợp như đối chứng âm tính (ví dụ: mức cơ sở hoặc hệ thống thử nghiệm không có phơi nhiễm vật liệu/trang thiết bị) và kết quả trên các trang thiết bị/vật liệu dự đoán là rất quan trọng. Số lượng tiểu cầu giảm và protein phân hủy máu tăng khác biệt đáng kể về mặt thống kê và khác biệt đáng kể về mặt sinh học so với nhóm đối chứng có thể là một chỉ số của thiết kế vật liệu/trang thiết bị có nguy cơ tiêu thụ và hoạt hóa tiểu cầu cao hơn. Ví dụ các protein dạng hạt alpha có bộ dụng cụ ELISA thương mại có sẵn bao gồm:
- PF4 (yếu tố tiểu cầu 4, protein 70 axit amin liên kết với ái lực cao với heparin; vai trò sinh lý chính của PF4 dường như là trung hòa các phân tử giống như heparin trên bề mặt nội mô của mạch máu, do đó ức chế hoạt động antithrombin III cục bộ và thúc đẩy đông máu), và
- βTG (beta-thromboglobulin, một chemokine cho nguyên bào sợi và bạch cầu trung tính).
CHÚ THÍCH: Thrombin từ tầng đông máu là một chất chủ vận tiểu cầu mạnh có thể dễ dàng gây phân hủy tiểu cầu. Do đó, mức độ cao của thrombin sẽ tương quan với mức độ phân hủy tiểu cầu cao.
Như trong đông máu, tiêu thụ tiểu cầu (mất) thường được xem là bị ảnh hưởng bởi diện tích bề mặt tiếp xúc với máu. Do đó, diện tích bề mặt (SA) của trang thiết bị hoặc vật liệu trang thiết bị có thể ảnh hưởng đến dữ liệu đếm tiểu cầu. Vì lý do này, điều quan trọng là quy định tỷ lệ SA so với thể tích máu (tỷ lệ phơi nhiễm) trong mỗi nghiên cứu. Nếu có thể, tỷ lệ phơi nhiễm có thể được coi là một biến số để giúp hiểu được tính đặc hiệu của hiệu ứng vật liệu. Tỷ lệ phơi nhiễm từ 3,0 cm2 đến 6,0 cm2/mL máu (dựa trên độ dày của trang thiết bị) phù hợp với TCVN 7391-12 (ISO 10993-12). Các tỷ lệ phơi nhiễm khác như 1,5 lần và 2,0 lần tỷ lệ này có thể đáng xem xét vì diện tích bề mặt cao hơn về mặt lý thuyết sẽ làm tăng độ nhạy của phản ứng tiểu cầu với vật liệu thử nghiệm.
Hoạt hóa tiểu cầu là một quá trình xảy ra trong một thời gian (vài phút đến vài giờ) và được công nhận là có khả năng hồi phục đến một điểm, hoặc một khi được bắt đầu, nó có thể tiến triển không thể đảo ngược đến mức thể hiện biến dạng hình dạng đáng kể, mất các thành phần tế bào chất, bong tróc các vi hạt và phá hủy hoàn toàn. Quá trình này phụ thuộc vào loại và số lượng kích thích. Có rất nhiều chất kích thích mạnh được biết đến, được gọi là chất chủ vận tiểu cầu, ví dụ trong số đó là thrombin, ADP và collagen. Bản thân các bề mặt ngoại lai, chẳng hạn như các trang thiết bị y tế tiếp xúc với máu, cũng có thể hoạt động giống như chất chủ vận vì chúng có thể gây ra thrombin. Ngoài ra, tiểu cầu có thể kết dính vào các bề mặt này, vẫn kết dính hoặc tách ra ở trạng thái hoạt hóa hoặc không hoạt hóa và trải qua những thay đổi hình dạng dẫn đến phá hủy tiểu cầu. Do đó, việc đánh giá tình trạng tổng thể hoạt hóa tiểu cầu tại bất kỳ thời điểm nào cũng có thể được hưởng lợi từ việc sử dụng các tác nhân giúp “bắt giữ” tiểu cầu ở trạng thái vật lý và sinh hóa tại một thời điểm cụ thể. Do đó, nếu đánh giá tiểu cầu không thể được thực hiện ngay sau khi loại bỏ vật liệu hoặc trang thiết bị thử nghiệm khỏi hệ thống thử nghiệm, một số tác nhân đã được đề xuất để chống lại sự hoạt hóa tiểu cầu hơn nữa và để ổn định tiểu cầu [88] [89] [90] [91]. Ví dụ về các tác nhân này là axit xitrate dextrose (ACD), xitrate, theophylline, adenosine, dipyridimol (CTAD) và các thuốc thử ổn định tiểu cầu khác, như ThomboFix™ 1). Ở mức độ mà các chất ổn định như vậy có thể giảm thiểu hoạt hóa tiểu cầu nhân tạo và không giải thích được các phản ứng hoạt hóa tiểu cầu đặc hiệu vật liệu sinh học, việc sử dụng các chất ổn định này đáng được xem xét, nếu được xác nhận để xác nhận rằng các điểm cuối có liên quan không bị ảnh hưởng xấu.
B.3.3.2 Số lượng tiểu cầu
Điều quan trọng là xác định số lượng tiểu cầu [45] [121] vì vai trò chính của tiểu cầu có trong việc ngăn ngừa chảy máu và trong quá trình chung của chứng huyết khối. Sự sụt giảm đáng kể số lượng tiểu cầu trong máu tiếp xúc với trang thiết bị có thể do sự kết dính tiểu cầu, ngưng tập tiểu cầu, cô lập tiểu cầu (ví dụ như trong lá lách) hoặc hình thành huyết khối trên vật liệu hoặc trang thiết bị. Việc giảm số lượng tiểu cầu trong quá trình sử dụng một trang thiết bị cấy ghép cũng có thể do sự phân hủy nhanh hoặc loại bỏ tiểu cầu khỏi hệ tuần hoàn. Các chất chống đông khác nhau có thể phù hợp để làm rõ tiểu cầu [151] - [156].
Các kỹ thuật lấy máu nên tái lập được. Tiểu cầu có thể trở nên hoạt động mạnh/hoạt hóa dưới các điều kiện khác nhau, bao gồm cả việc lấy máu không đúng cách. Các phép thử như đo khối lượng tiểu cầu và tế bào học dòng chảy có thể được xem xét để xác minh khả năng phản ứng và hoạt hóa tiểu cầu bình thường.
B.3.3.3 Hoạt hóa tiểu cầu: Protein giải phóng tiểu cầu beta-thromboglobulin (β-TG) và yếu tố tiểu cầu 4 (PF4), thromboxane B2 (TxB2) và thay đổi hình thái tiểu cầu
Việc sử dụng một số vật liệu hoặc trang thiết bị có thể gây hoạt hóa tiểu cầu, có thể dẫn đến:
a) giải phóng các chất hạt tiểu cầu, như βTG, PF4, TxB2 và serotonin;
b) hình thái học tiểu cầu biến đổi;
c) sự hình thành các vi hạt tiểu cầu.
Các tiểu cầu được hoạt hóa là tiền thrombo. Hoạt hóa tiểu cầu có thể được đánh giá bằng các biện pháp khác nhau, chẳng hạn như kiểm tra vi thể (kính hiển vi quang học và điện tử) về hình thái của tiểu cầu kết dính với vật liệu hoặc trang thiết bị, đo βTG, PF4 và TxB2 được giải phóng từ tiểu cầu đã hoạt hóa.
βTG và PF4 là các protein được lưu trữ trong các hạt alpha của tiểu cầu và được giải phóng với số lượng lớn sau khi hoạt hóa tiểu cầu [85] [86] [87] [106]. Cả hai loại protein này đều có thể được đánh giá bằng các xét nghiệm ELISA có bán trên thị trường. Tăng hoạt hóa tiểu cầu có thể xảy ra thông qua nhiều con đường liên quan đến các trang thiết bị và vật liệu y tế. Trang thiết bị/vật liệu có thể hoạt hóa tiểu cầu, nhiễu loạn và lực cắt quá mức có thể gây hoạt hóa tiểu cầu và hoạt hóa tiểu cầu có thể do các chất chủ vận mạnh như thrombin, có thể hình thành do chứng huyết khối liên quan đến vật liệu/trang thiết bị hoặc chấn thương cục bộ. Mức độ TxB2 cao, cũng có thể đo được bằng ELISA, cho thấy mức độ cao của hợp chất tiền chất thromboxane A2, một chất chủ vận tiểu cầu mạnh được tạo ra là do tiểu cầu hoạt hóa; TxB2 cũng được cho là dấu hiệu độc lập đáng tin cậy của loài hoạt hóa tiểu cầu. Xem B.3.3.1 và B.4 để biết chi tiết về phương pháp ELISA chung. Nó cũng có thể có giá trị để đánh giá hoạt hóa tiểu cầu thông qua việc đánh giá các thay đổi hình thái tiểu cầu trải qua khi được hoạt hóa trên bề mặt vật liệu/thiết bị [70] [71] [173].
B.3.4 Huyết học - Phương pháp thử
B.3.4.1 Công thức máu toàn phần (CBC)
Phân tích công thức máu toàn phần điện tử (thường được gọi là CBC) là một thử nghiệm quan trọng được sử dụng hàng ngày trong các phòng thí nghiệm huyết học bệnh viện. Mục đích chính của nó là liệt kê nhanh chóng và chính xác nồng độ của các quần thể tế bào khác nhau trong bệnh nhân, trong đó các số đọc bất thường có thể cung cấp thông tin sớm và quan trọng về một loạt các rối loạn tiềm năng. CBC được sử dụng để xác định số lượng hoặc tỷ lệ tế bào bạch cầu và hồng cầu trong cơ thể. Các phân tích bao gồm đếm tiểu cầu. Trong các phân tích về tương tác máu-vật liệu/trang thiết bị, dữ liệu CBC cung cấp thông tin cơ bản về tác động của tương tác trang thiết bị/vật liệu với các yếu tố máu hình thành. Đếm tiểu cầu và bạch cầu trong máu trước và sau phơi nhiễm với vật liệu/trang thiết bị có giá trị trong việc suy giảm sự mất mát của tiểu cầu và bạch cầu được hoạt hóa trong sự hình thành cục máu đông bởi bề mặt huyết khối và do đó cung cấp ước tính về khả năng gây huyết khối bề mặt [24].
B.3.4.2 Hoạt hóa bạch cầu
Hoạt hóa bạch cầu có thể được xác định bằng cách kiểm tra vi thể bề mặt trang thiết bị để tìm bạch cầu hoạt hóa. Một phương pháp định lượng đơn giản hơn liên quan đến việc sử dụng xét nghiệm ELISA thương mại để xác định lượng elastase bạch cầu đa nhân (PMN) được giải phóng vào huyết tương sau khi hoạt hóa từ tương tác của vật liệu hoặc trang thiết bị với máu. Một cách tiếp cận khác dựa trên nguyên tắc thrombi bám vào vật liệu sẽ chứa một lượng lớn tiểu cầu và bạch cầu liên quan đến việc đánh giá sự giảm số lượng trong máu của chúng [24].
B.3.5 Hệ thống bổ thể - Phương pháp thử đối với C3a và SC5b-9
Hệ thống bổ thể nằm trong huyết tương dưới dạng tầng sinh hóa có chức năng như một cơ chế bảo vệ được thiết kế để bổ sung hoặc “bổ thể” cho khả năng của kháng thể để loại bỏ mầm bệnh khỏi cơ thể. Nó là một phần của hệ miễn dịch được gọi là “hệ miễn dịch bẩm sinh”. Ở đây, không giống như bảo vệ kháng thể, hoạt động đáp ứng không thu được cũng không thích nghi theo thời gian. Hệ thống bổ thể tạo thành một tuyến phòng thủ cơ bản hoạt động song song và có thể làm trung gian cho các cơ chế kháng thể cụ thể. Tuy nhiên, hệ thống bổ thể cũng có thể được đưa vào hoạt động bởi các bề mặt vật liệu ngoại lai với cơ thể, bao gồm các trang thiết bị y tế tiếp xúc với máu [129] [138].
Hệ thống này bao gồm một số protein được tìm thấy trong máu thường tuần hoàn dưới dạng tiền chất không hoạt hóa. Danh pháp cho các protein bổ thể là chữ “C” theo sau là một chữ số Ả Rập đơn giản đối với protein tự nhiên, và nếu được phân cách, một chữ “a” nhỏ hay “b” nhỏ để chỉ ra từng mảnh. Khi có mức C3b phản ứng tự phát được hình thành ở mức thấp, sự có mặt của vật liệu sinh học có thể kích hoạt phản ứng khuếch tán mà kết quả cuối cùng là tạo ra các chất trung gian gây viêm, ví dụ: C5a và các phức hợp protein gây độc tế bào, ví dụ: phức hợp tấn công màng (MAC), có thể kích thích một loạt các phản ứng viêm bao gồm hóa trị liệu bạch cầu (WBC), sản xuất các loại oxy phản ứng (ROS) và biểu hiện cytokine [129] [130]. Xem Hình B.2.
Có rất nhiều protein và các đoạn protein tạo nên hệ thống bổ thể và chúng có thể được chia thành ba con đường hoạt hóa riêng biệt: hoạt hóa bổ thể theo con đường cổ điển, hoạt hóa bổ thể theo con đường nhánh và con đường lectin liên kết với mannose. Con đường nhánh được coi là bị ảnh hưởng và phản ứng với sự có mặt của vật liệu y tế.
Một số xét nghiệm ELISA thương mại có sẵn để đánh giá lượng protein bổ thể trong máu. Vì C3a là một mảnh phổ biến được khuếch tán trong quá trình hoạt hóa, protein bổ thể này được coi là một chỉ số chung tốt về hoạt hóa bổ thể. Ngoài ra, một dạng hòa tan của trang thiết bị đầu cuối MAC viết tắt SC5b-9 cũng có thể được đánh giá bằng xét nghiệm ELISA. SC5b-9 thường được coi là dấu hiệu đại diện quan trọng hơn về toàn bộ phạm vi hoạt hóa bổ thể. Mức tăng cao của bất kỳ thành phần bổ thể nào cho thấy hoạt hóa hệ thống bổ thể. Các trang thiết bị có diện tích bề mặt cao như thiết bị lọc thẩm tách máu và thiết bị tim phổi nhân tạo có liên quan đến các thành phần hoạt hóa bổ thể cao [129] - [138] [143] và hiện tượng này đã được liên kết để hoạt hóa bạch cầu và cô lập bạch cầu trong phổi [130] [137].
Đo các mảnh bổ thể có một số nhược điểm. Đầu tiên, bộ dụng cụ ELISA chỉ xét nghiệm các thành phần bổ thể trong pha lỏng (huyết thanh hoặc huyết tương); chúng không đo các thành phần bổ thể được hoạt hóa và bám vào bề mặt trang thiết bị. Tùy thuộc vào bản chất của vật liệu trang thiết bị, có thể có một lượng bổ thể đáng kể được hoạt hóa trên bề mặt trang thiết bị/vật liệu mà không bị phát hiện bởi bộ dụng cụ ELISA thương mại. Thứ hai, có tính đặc thù của loài đối với nhiều bộ dụng cụ thương mại và mức cơ bản cao được quan sát thấy trong thử nghiệm in vitro điển hình. Vì vậy, các đối chứng thích hợp cần được đưa vào và so sánh. Phương pháp CH-50 cổ điển có vẻ hữu ích với huyết thanh người, bò, nhím và thỏ. Tuy nhiên, độ nhạy của CH-50 để phát hiện hoạt hóa bổ thể sau khi tiếp xúc với vật liệu/trang thiết bị là thấp, do thử nghiệm CH-50 đo hoạt động bổ thể tồn dư và thường chỉ một phần nhỏ của hệ thống bổ thể được hoạt hóa bằng vật liệu/trang thiết bị. Một phương pháp chức năng khác để đo hoạt hóa bổ thể in vitro là tạo ra bổ thể C3- hoặc C5-chuyển đổi được xác định bằng cách chuyển đổi chất nền. Tài liệu tham khảo [18] [19] cũng giải quyết việc hoạt hóa bổ thể. Phụ lục E cung cấp thêm thông tin về các xem xét để thử nghiệm bổ thể các vật liệu và trang thiết bị y tế. Xem B.4 để biết chi tiết về phương pháp ELISA chung.

CHÚ DẪN:
![]() bề mặt vật liệu/trang thiết bị
bề mặt vật liệu/trang thiết bị
CHÚ THÍCH: Các yếu tố được thể hiện bằng in đậm có thể đo được bằng các bộ xét nghiệm có bán trên thị trường.
Hình B.2 - Hoạt hóa bổ thể theo con đường nhánh
B.4 Xem xét phương pháp để thử nghiệm các yếu tố huyết tương đặc hiệu cho đông máu, hoạt hóa tiểu cầu và bạch cầu và hoạt hóa bổ thể bằng kỹ thuật ELISA (hoặc tương tự khác)
B.4.1 Quy định chung
Đánh giá sự đông máu, tiểu cầu, tế bào máu và hoạt hóa bổ thể từ lâu đã dựa vào các xét nghiệm lâm sàng đo mức protein huyết tương được hình thành trong các tầng hoạt hóa hoặc giải phóng từ hoạt hóa hoặc làm hỏng các loại tế bào khác nhau. Ở đây, các phòng thí nghiệm lâm sàng thường dựa vào các bộ thử nghiệm sử dụng kỹ thuật xét nghiệm miễn dịch hấp thụ liên kết với enzym thông thường. Trong một nghiên cứu cơ bản, có thể là in vivo hoặc in vitro, việc thực hiện sẽ phụ thuộc vào sự sẵn có của các kháng thể/bộ thử nghiệm thích hợp cho các epitopes protein cụ thể của loài. Ngoài ra, các mẫu máu sẽ được lấy trong các điều kiện xác định và được chuẩn bị và phân tích theo hướng dẫn xét nghiệm. Các điều kiện được xác định có thể bao gồm thời gian phơi nhiễm với máu, chống đông máu và mức độ chống đông máu, nhiệt độ, dòng chảy, dung tích hồng cầu và các yếu tố khác. So sánh kết quả với các đối chứng thích hợp, chẳng hạn như đối chứng âm tính (ví dụ: mức cơ sở hoặc không phơi nhiễm với vật liệu/trang thiết bị) và LMCD dự đoán là rất quan trọng. Các dấu hiệu hoạt hóa trong máu có ý nghĩa thống kê và ý nghĩa sinh học cao hơn đáng kể so với các đối chứng có thể chỉ ra một thiết kế vật liệu/trang thiết bị có rủi ro đông máu, tiểu cầu hoặc bổ thể qua trung gian đối với bệnh nhân ở mức cao hơn. Ví dụ các protein đông máu mà bộ dụng cụ ELISA có sẵn trên thị trường bao gồm TAT (phức hợp thrombin-antithrombin), F1.2 (đoạn được giải phóng từ prothrombin khi hình thành thrombin) và FPA (fibrino peptide A được giải phóng từ tiền sợi huyết). Tương tự, bộ dụng cụ ELISA thương mại có sẵn để đánh giá hoạt hóa tiểu cầu (ví dụ: giải phóng hạt alpha của BTG và PF4) và hoạt hóa bổ thể (ví dụ: hình thành C3a và SC5b9).
B.4.2 Phương pháp và tài liệu xét nghiệm chung
B.4.2.1 Quy định chung
Với các báo cáo thử nghiệm, bao gồm những điều sau đây.
B.4.2.1.1 Tài liệu tham khảo
Nhà sản xuất thủ tục ELISA IFU trong bộ dụng cụ.
B.4.2.2 Bảo quản và ổn định
Mô tả tất cả các điều kiện bảo quản và ổn định của các thuốc thử bộ dụng, cụ và máu/huyết tương được sử dụng.
B.4.2.3 Quy trình
B.4.2.3.1 Chuẩn bị mẫu
Cung cấp hướng dẫn chung.
Kết quả thử nghiệm như vậy phụ thuộc vào diện tích bề mặt (SA) của trang thiết bị hoặc vật liệu thử nghiệm trang thiết bị đang được thử nghiệm. Vì lý do này, tỷ lệ SA so với thể tích máu (tỷ lệ phơi nhiễm) nên được quy định trong mỗi nghiên cứu. Tỷ lệ phơi nhiễm từ 3,0 cm2 đến 6,0 cm2/mL máu (dựa trên độ dày của trang thiết bị) phù hợp với TCVN 7391-12 (ISO 10993-12). Các tỷ lệ phơi nhiễm khác như 1,5 lần và 2,0 lần tỷ lệ này có thể đáng xem xét vì diện tích bề mặt cao hơn về mặt lý thuyết sẽ làm tăng độ nhạy của phản ứng với bề mặt thử nghiệm.
Điều quan trọng là quy định các phương tiện dập tắt phản ứng sau thời gian ủ, nghĩa là liệt kê tên và nồng độ của chất làm nguội.
B.4.2.3.2 Hệ số pha loãng (DF)
Cung cấp chi tiết về các yếu tố pha loãng được sử dụng, chất pha loãng được sử dụng, v.v....
CẢNH BÁO - Có thể quan sát được sự thay đổi đáng kể giữa các nhà tài trợ và nội bộ của nhà tài trợ, khiến cho một DF lý tưởng duy nhất khó xác định. Do đó, tối thiểu hai yếu tố pha loãng mẫu thử được khuyến nghị để nắm bắt tất cả các giá trị mẫu trên đường cong chuẩn. Độ hấp thụ mẫu phải nằm trong phạm vi được xác định theo tiêu chuẩn thấp nhất và cao nhất. Nếu không, các mẫu nên được kiểm tra lại bằng DF mới để kết quả nằm trong phạm vi của đường cong tiêu chuẩn.
B.4.2.3.3 Lựa chọn dữ liệu trong các trường hợp thử nghiệm với nhiều DF
Nếu tất cả hoặc một số mẫu được thử nghiệm trong các điều kiện không pha loãng, pha loãng thấp và pha loãng cao, báo cáo các giá trị yêu cầu DF nhỏ nhất nằm trên đường cong tiêu chuẩn. Cũng có thể chấp nhận được nếu các mẫu “không pha loãng” có thể chứa một số giá trị ngoài đường cong, tất cả các mẫu có độ “pha loãng thấp” nằm trên đường cong và các mẫu có độ “pha loãng cao” chứa một số giá trị dưới đường cong, để báo cáo đơn giản số đọc “pha loãng thấp” trong đó tất cả các giá trị nằm trên đường cong dưới cùng một DF.
B.4.2.3.4 Chuẩn bị tiêu chuẩn
Mô tả chi tiết cách chuẩn bị đường cong tiêu chuẩn và đối chứng.
B.4.2.3.5 Phương pháp
Mô tả chi tiết các phương pháp tổng thể theo thứ tự sau, bao gồm làm nổi bật bất kỳ độ lệch nào so với hướng dẫn của bộ ELISA.
B.4.2.3.6 Đánh giá
Mô tả chi tiết các tính toán được thực hiện để xác định mức độ huyết tương của protein được đo.
B.4.2.3.7 Phân tích thống kê
Mô tả chi tiết các phương pháp phân tích thống kê.
B.4.2.3.8 Hạn chế và can thiệp
Liệt kê tất cả các giới hạn hoặc các yếu tố can thiệp, chẳng hạn như kỹ thuật lấy máu không chính xác, ví dụ: trộn không đầy đủ mẫu và dung dịch xitrate (hoặc chất chống đông khác như heparin) có thể dẫn đến giá trị protein đông máu giả; một chất chống đông sai có thể dẫn đến độ tăng cao của tất cả các giá trị nền, v.v.
B.4.2.3.9 Khoảng tham chiếu
Liệt kê mức độ huyết tương bình thường và bất thường của protein được đo và giá trị đối chứng dự kiến.
B.4.3 Tài liệu đính kèm
Bao gồm thông tin về yếu tố pha loãng được đề xuất, biểu mẫu dữ liệu xét nghiệm ELISA, danh sách kiểm tra đối với quy trình ELISA, v.v...
Phụ lục C
(tham khảo)
Chứng huyết khối - Phương pháp thử in vivo
C.1 Xem xét chung
Nhiều phương pháp đã được áp dụng để đánh giá quá trình và các sự kiện của chứng huyết khối. Tuy nhiên, đối với các trang thiết bị và vật liệu y tế tiếp xúc với máu, bản chất của chứng huyết khối in vivo đã dẫn đến các phương pháp được nêu trong C.2 và C.3 được sử dụng phổ biến hơn để đánh giá chứng huyết khối liên quan đến trang thiết bị. Những phương pháp này được sử dụng để đánh giá các trang thiết bị tiếp xúc vĩnh viễn và tạm thời. Như đã chỉ ra trong tiêu chuẩn này, sự đa dạng của các ứng dụng trang thiết bị y tế tiếp xúc với máu cho thấy rằng các mô hình thử nghiệm in vivo sẽ nhất thiết phải đa dạng, để bắt chước một cách thích hợp từng ứng dụng lâm sàng.
Phương pháp trong C.2 được chấp nhận là cách thức phù hợp nhất để đánh giá các trang thiết bị cho chứng huyết khối, vì ở đây trang thiết bị thực tế được đánh giá trong cấu hình cấy ghép lâm sàng dự định của nó trong mô hình động vật. Các yếu tố chính trong công việc này là sự điều chỉnh của thủ tục động vật theo TCVN 7391-2 (ISO 10993-2), mô phỏng chính xác ứng dụng lâm sàng của con người và đưa vào thủ tục của một phương pháp chi tiết và sử dụng phân tích để đánh giá mức độ của chứng huyết khối.
Phương pháp trong C.3 được sử dụng ít phổ biến hơn và không được chấp nhận rộng rãi trên toàn thế giới. Tuy nhiên, nó có thể được yêu cầu hoặc yêu cầu bởi một số cơ quan có thẩm quyền. Phương pháp này được gọi là mô hình cấy ghép tĩnh mạch không chống đông (NAVI) (khi không sử dụng chất chống đông) và mô hình cấy ghép tĩnh mạch chống đông máu (AVI) (khi bao gồm chống đông máu). Phương pháp này bao gồm việc chèn các thiết bị hình ống thông, hoặc vật liệu trang thiết bị được tạo thành hình dạng ống thông, vào tĩnh mạch của động vật trong tối đa 4 h sau đó là đánh giá tổng thể lượng huyết khối trên bề mặt vật liệu/ống thông. Các cảnh báo với phương pháp được thể hiện trong Bảng C.3 cùng với các ưu điểm đã nêu trong Bảng C.4. Do những cảnh báo này và để tránh việc đánh dấu sai cho vật liệu và trang thiết bị là gây huyết khối theo tự nhiên, dữ liệu được tạo bằng mô hình này đòi hỏi hết sức thận trọng khi giải thích [143]. Xem thêm A.3.
Khi trang thiết bị thử nghiệm là trang thiết bị loại ống thông được sử dụng trong ứng dụng tĩnh mạch, các phương pháp trong C.2 và C.3 là tương đương.
C.2 Nghiên cứu cấy ghép in vivo trên trang thiết bị cuối cùng trong nghiên cứu động vật tiền lâm sàng
Như đã nêu trong tiêu chuẩn này, thử nghiệm in vivo nên được thực hiện trên các trang thiết bị dành cho các ứng dụng in vivo/cấy ghép (xem 6.1.6, 6.3.2 và 6.3.3). Các thủ tục nên bao gồm các phương pháp chi tiết để đánh giá thích hợp các tương tác máu/trang thiết bị, ví dụ: phân tích về:
a) chính trang thiết bị,
b) mẫu máu từ đối tượng thử nghiệm và
c) các mô nhạy cảm và các cơ quan cuối.
Thử nghiệm tiền lâm sàng như vậy nên sử dụng các mô hình mô phỏng các điều kiện ứng dụng đang sử dụng thực tế, ví dụ: cùng vị trí cấy ghép, dạng hình học, lưu lượng, thời gian tiếp xúc, nhiệt độ, độ vô trùng, v.v... (xem 6.1.2) và bao gồm các đối chứng truy nguyên phù hợp, ví dụ: một trang thiết bị dự đoán (xem 6.1.3). Điều quan trọng, chỉ nên thực hiện thử nghiệm trên các thiết bị hoặc linh kiện hoàn chỉnh (đã hoàn thành) thực tế (xem 6.1.4), vì thử nghiệm trên các sản phẩm chưa hoàn thành và thử nghiệm trong điều kiện sử dụng mô phỏng kém sẽ không mang tính dự đoán cao về hiệu suất trong các ứng dụng lâm sàng (xem 6.1.6).
Theo đó, các trang thiết bị có ứng dụng ex vivo và các trang thiết bị có ứng dụng in vivo nên được thử nghiệm tương ứng trong các mẫu ex vivo và in vivo. Sử dụng chất chống đông trong các mẫu ex vivo/in vivo phù hợp với loại và số lượng được sử dụng trong ứng dụng trang thiết bị lâm sàng thông thường và sản phẩm IFU (xem 6.1.12). Nên xem xét sử dụng các phương pháp lặp lại, thiết kế thống kê và phân tích thích hợp trong các nghiên cứu trên động vật (xem 6.1.14 và Tài liệu tham khảo [213], [214], [215] và [216]).
Xem xét các thử nghiệm, khi thích hợp, trong các loại: chứng huyết khối, đông máu, tiểu cầu, huyết học và hoạt hóa bổ thể, như nêu trong Bảng 2. Ví dụ, một phân tích có thể bao gồm kiểm tra tổng thể và SEM trên trang thiết bị để đánh giá mức độ của chứng huyết khối liên quan đến trang thiết bị. Kiểm tra các cơ quan phía sau nhạy cảm, ví dụ phổi và thận, bằng chứng của huyết khối sẽ giúp đánh giá tiềm năng của bệnh huyết khối liên quan đến trang thiết bị. Nếu có kháng thể thích hợp, có thể đánh giá đông máu bằng cách đo nồng độ trong huyết tương của các chỉ số về đông máu và hình thành sợi huyết, ví dụ: TAT và FPA được đo thông qua kỹ thuật ELISA. Tương tự, đếm tiểu cầu đơn giản và hoặc đo các dấu hiệu hoạt hóa tiểu cầu, ví dụ: βTG, có thể được sử dụng để đánh giá tác động của trang thiết bị lên tiểu cầu. Đếm tế bào máu khác biệt định kỳ và haemoglobin tự do trong huyết tương có thể được sử dụng để đánh giá chung các yếu tố huyết học và đánh giá thiệt hại vật lý tế bào máu. Cuối cùng, đối với các trang thiết bị có diện tích bề mặt lớn, cung cấp sẵn kháng thể, nồng độ trong huyết tương của các yếu tố bổ sung khác nhau có thể được sử dụng để đánh giá hoạt hóa bổ thể theo con đường nhánh.
Nói chung, mong muốn trang thiết bị thử nghiệm không có tác động, tác động thấp hoặc tương đương đến yếu tố được đo liên quan đến kết quả quan sát được trong một trang thiết bị dự đoán. Kết quả cao hơn trong trang thiết bị dự đoán có thể được chứng minh dựa trên phân tích rủi ro/lợi ích. Các trang thiết bị không có dự đoán nên sử dụng một đối chứng thích hợp, với sự biện minh được cung cấp để lựa chọn đối chứng đó. Các đánh giá như vậy được ưu tiên hơn so với việc sử dụng phương pháp được nêu trong C.3, vì phương pháp này bắt chước một cách thích hợp nhất ứng dụng in vivo. Như mọi khi, các tiêu chuẩn dọc nên được tư vấn trong các lĩnh vực trang thiết bị khác nhau. Đối với sau này, nhiều ví dụ có thể được tìm thấy trong số các tài liệu tham khảo.
CHÚ THÍCH 1: Đối với các trang thiết bị có hình dạng ống thông dự định được cấy vào môi trường tĩnh mạch trong điều kiện không chống đông máu hoặc chống đông máu, các mô hình cấy ghép NAVI và AVI, tương ứng như được nêu trong C.3, mô tả phương pháp nghiên cứu in vivo thích hợp cho các trang thiết bị này.
CHÚ THÍCH 2: Đối với các trang thiết bị có hình dạng ống thông dự định được cấy trong môi trường động mạch trong điều kiện không chống đông máu hoặc chống đông máu, cấy ghép động mạch không chống đông (NAAI) hoặc động mạch chống đông
Mô hình cấy ghép (AAI), ở các vị trí cấy ghép động mạch thích hợp tương tự như nêu trong C.3, mô tả phương pháp nghiên cứu lý tưởng cho các trang thiết bị cấy ghép động mạch.
Xem thêm 6.3.3 và Phụ lục A và B.
C.3 Thử nghiệm huyết khối in vivo NAVI và AVI
Thử nghiệm NAVI và AVI liên quan đến việc đặt một ống thông (hoặc trang thiết bị có hình dạng phù hợp khác) hoặc vật liệu trang thiết bị được tạo thành hình dạng ống thông, vào tĩnh mạch của một động vật lớn. Nó đã được kêu gọi trong các tình huống, ví dụ, đặc trưng cho một ống thông mới, đánh giá lớp phủ trang thiết bị mới, đặc trưng cho vật liệu mới và trong trường hợp thay đổi bước xử lý của nhà cung cấp hoặc vật liệu/trang thiết bị. Trong chính mô hình, một số vị trí tĩnh mạch đã được sử dụng (xem Hình C.1 và C.2). Trong trường hợp không có (NAVI) hoặc sự có mặt (AVI) của chất chống đông, cho phép cấy ghép hai lần hoặc ba lần để ủ in situ trong thời gian tối đa 4 h. (Các trường hợp ít hơn và nhiều thời gian hơn có thể được giải thích, được đưa ra ứng dụng cụ thể.) Sau đó, bộ cấy được loại bỏ và đánh giá lượng huyết khối rõ ràng trên bề mặt. Mô hình tĩnh mạch xương đùi hoặc xương hàm được sử dụng phổ biến nhất, trong đó vật liệu/trang thiết bị thử nghiệm được đặt trong một tĩnh mạch và vật liệu đối chứng hoặc trang thiết bị dự đoán được đặt ở vị trí đối diện. Phép thử yêu cầu hai đến ba động vật lớn, với các vị trí cấy thử nghiệm và đối chứng xen kẽ để tránh sai lệch và đánh giá huyết khối trên trang thiết bị bằng phương pháp tính điểm như trong Bảng C.1 và C.2. Kết quả có thể được bổ sung với phân tích trọng lực của huyết khối quan sát và quan sát độ bền của mạch. Kết quả của trang thiết bị thử nghiệm phải tương đương hoặc ít gây huyết khối hơn so với LMCD thích hợp, nếu có hoặc trừ khi có lý do khác. Điều quan trọng là đảm bảo rằng tất cả các thành phần trang thiết bị tiếp xúc với máu lâm sàng được đánh giá. Các cơ quan có thẩm quyền khác nhau trên toàn thế giới đã đề nghị rằng cấy ghép và đối chứng lên đến 15 cm để đảm bảo phơi nhiễm đầy đủ trong quá trình thử nghiệm. Tùy thuộc vào cấu hình trang thiết bị, điều này có thể yêu cầu trang thiết bị tùy chỉnh được tạo ra để giảm chiều dài của các thành phần, trong khi vẫn duy trì tỷ lệ vật liệu tương tự như trang thiết bị hoàn chỉnh. Thay thế, một trang thiết bị có thể được chia thành nhiều mẫu thử nếu cần thiết.
Đối với các trang thiết bị và vật liệu dành cho cấy ghép động mạch, các phương pháp có thể được điều chỉnh phù hợp để sử dụng các vị trí cấy ghép động mạch.
THẬN TRỌNG - Sự thay đổi trong kết quả đã được quan sát giữa:
a) cơ sở thử nghiệm,
b) người đánh giá thử nghiệm,
c) lặp lại trên cùng một vật liệu và
d) điểm đạt được trên các đối chứng [143].
Bảng C.3 đưa ra một bản tóm tắt về các tranh cãi chính của các mô hình NAVI và AVI. Bảng C.4 cung cấp một số lợi thế đáng chú ý của các mô hình NAVI và AVI. Tiện ích lớn nhất của mô hình có thể là đánh giá các vật liệu thử nghiệm được sửa đổi có chủ ý để giảm sự hình thành huyết khối cấp tính, ví dụ như trong việc đánh giá lớp phủ heparin.
CHÚ DẪN:
1 xương đùi
2 tĩnh mạch
Hình C.1 - Các vị trí cấy ghép chính được sử dụng trong mô hình NAVI/AVI
CHÚ DẪN:
1 IVC-IVC
2 SVC-IVC
3 IVC-AA
AA động mạch chủ bụng
IVC tĩnh mạch chủ dưới
SVC tĩnh mạch chủ trên
THẬN TRỌNG - Việc sử dụng các vị trí cấy ghép này đòi hỏi phải xem xét cẩn thận đối với vật phẩm do tương tác giữa trang thiết bị và/hoặc độ chệch đối với sự khác biệt về vị trí trong hình thành huyết khối.
Hình C.2 - Các vị trí cấy ghép NAVI và AVI ít được sử dụng khác
Bảng C.1 - Sơ đồ tính điểm NAVI/AVI A
| Mô tả điểm hình thành huyết khối | Điểm số |
| Không có chứng huyết khối đáng kể (một cục máu rất nhỏ được chấp nhận khi chèn). | 0 |
| Chứng huyết khối tối thiểu, một vị trí. | 1 |
| Chứng huyết khối tối thiểu, nhiều vị trí. | 2 |
| Chứng huyết khối đáng kể, > 1/4 đến ≤ 1/2 bề mặt cấy ghép, độ bền mạch. | 3 |
| Chứng huyết khối đáng kể, > 1/2 bề mặt cấy ghép, độ bền mạch. | 4 |
| Mạch hoàn toàn bị chặn. | 5 |
Bảng C.2 - Sơ đồ chấm điểm NAVI/AVI B
| Mô tả điểm hình thành huyết khối | Điểm số |
| Thrombus không tồn tại hoặc tối thiểu và, nếu có, dường như là liên kết với trang web cấy ghép tĩnh mạch. | 0 |
| Thrombus tối thiểu, được quan sát là bao phủ 1 % đến 25 % vật liệu bề mặt. | 1 |
| Huyết khối vừa phải, được quan sát là bao phủ 26 % đến 50 % vật liệu bề mặt. | 2 |
| Huyết khối nặng, được quan sát là bao phủ 51 % đến 75 % vật liệu bề mặt. | 3 |
| Thrombus rộng rãi, bao phủ 76 % đến 100 % bề mặt vật liệu. | 4 |
Bảng C.3 - Hãy cẩn thận khi sử dụng các mô hình NAVI hoặc AVI [143]
| Hệ số | Sự mô tả | Mối quan ngại |
| 1 | Vị trí cấy ghép | Môi trường dòng chảy cao dẫn đến mức độ thấp của huyết khối liên quan đến bề mặt và ngược lại. Do đó, sự khác biệt nhỏ về các yếu tố giải phẫu như đường kính mạch đích và/hoặc vị trí van tĩnh mạch có thể có tác động tiềm tàng đến lượng huyết khối quan sát được. Ngoài ra, nếu cấy ghép được đặt ở một góc hoặc vị trí làm thay đổi lưu lượng máu để tạo ra dòng điện xoáy dẫn đến ứ máu, sự hình thành huyết khối có thể xảy ra không liên quan đến tính chất vật liệu của trang thiết bị thử nghiệm. |
| 2 | Kỹ thuật cấy ghép | Mỗi thử nghiệm và đối chứng phải được chèn chính xác và chính xác vào các tĩnh mạch đích với mỗi vị trí ở một vị trí giống hệt nhau (tốt nhất là nằm ở trung tâm không có tiếp xúc với thành mạch). |
| 3 | Mức độ tiếp xúc với thành mạch của trang thiết bị | Yếu tố này liên quan đến tổn thương thành mạch/sự từ chối nội mô trong thời gian cấy ghép và ủ bệnh. Bản thân mô cấy có thể góp phần gây chứng huyết khối do tiếp xúc cơ học với thành mạch, gây tổn thương và hoạt hóa yếu tố mô. Ở đây, yếu tố vật chất có thể đóng một vai trò nhỏ trong phạm vi huyết khối quan sát được và dạng hình học của trang thiết bị có thể đóng vai trò chính. |
| 4 | Thời gian/thời gian ủ | Đáp ứng đo chính của phạm vi của huyết khối liên quan đến bề mặt có xu hướng dữ dội trong vòng 1/2 h đến 2 h đầu tiên. Một thời gian sau giai đoạn này, hệ thống tan huyết khối (fibrinolytic) có thể bắt đầu và loại bỏ sinh hóa một số huyết khối liên quan. |
| 5 | kỹ thuật giải thích | Tùy thuộc vào trang điểm và mức độ của huyết khối liên quan đến bề mặt trên mẫu, vật liệu huyết khối được đo/ghi có thể dễ vỡ và dễ bong ra trong quá trình phục hồi/phơi nhiễm trang thiết bị. Nếu không có biện pháp phòng ngừa đặc biệt, tiêu chuẩn này, thường được gọi là thrombus tay áo, có thể được vắt ra khỏi đường nếu mẫu bị rút lại hoặc bị xáo trộn trong vị trí cấy ghép của nó. Một số nhà nghiên cứu sử dụng phương pháp cố định tưới máu tại chỗ để loại bỏ các yếu tố máu không kết dính và liên kết chéo trang thiết bị/huyết khối/mạch thành dạng hình học khó khăn hơn (và sinh lý hơn). |
| 6 | Vật liệu/bề mặt vật liệu | Mô hình này đã được sử dụng để đánh giá tiềm năng gây huyết khối của vật liệu mới, đánh giá sự thay đổi quy trình trên các vật liệu được phê duyệt hiện có và để đủ điều kiện cho các nhà cung cấp mới. Thông thường, một trang thiết bị so sánh được bán trên thị trường hợp pháp (LMCD) hoặc vật liệu được sử dụng làm đối chứng, mang lại kết quả khác nhau. |
| 7 | Các vật liệu kết dính không thrombo được đánh dấu không gây huyết khối | Công việc mở rộng của các chuyên gia trong lĩnh vực [177] [178] [179] đã chứng minh rằng các bề mặt ưa nước có thể gây huyết khối (và huyết khối) nhưng không phải là huyết khối. Phép thử này sẽ cho điểm vượt qua cho các trang thiết bị và vật liệu gây huyết khối và không gây huyết khối. |
| 8 | Người nhận/đối tượng tiềm năng huyết khối | Các bài báo về chủ đề này [56] [57] [180] chỉ ra rằng các đối tượng thử nghiệm có thể có tiềm năng huyết khối khác nhau đáng kể, nghĩa là khả năng khác nhau để hình thành huyết khối khi tiếp xúc với cấy ghép y tế và các kích thích khác. Điều này có thể dẫn đến sự khác biệt đáng kể trong việc ghi điểm giữa các đối tượng thử nghiệm. |
| 9 | Sức mạnh thống kê | Khi tuân thủ TCVN 7391-2 (ISO 10993-2), kết hợp với sự thay đổi trong các phản ứng nhìn thấy giữa các trang thiết bị và vật liệu dự đoán và giữa các đối tượng thử nghiệm, thường không thể có được kết luận có ý nghĩa thống kê. |
| 10 | chuyên gia đánh giá | Việc đào tạo và kỹ năng của người đánh giá chỉ định điểm số thrombus là vô cùng quan trọng. Một số có thể gặp khó khăn trong việc phân biệt giữa huyết khối in vivo thật và huyết khối giả [post/ante-mortem (agonal) hình thành cục máu đông]. |
| 11 | Tác động chống đông máu | Gần như tất cả các trang thiết bị và vật liệu được thử nghiệm trong mô hình AVI đều nhận được điểm 0 và vượt qua phép thử. Điều này đặt ra câu hỏi về mục đích và lý do sử dụng mô hình AVI. Trong mô hình NAVI, hầu hết các vật liệu kỵ nước cho thấy mức độ khác nhau của huyết khối trong khi vật liệu ưa nước cho thấy mức độ huyết khối phút. |
| 12 | Kích thước cấy ghép cho đường kính mạch | Bên cạnh khả năng gây tổn thương thành mạch, nếu kích thước của mô cấy so với đường kính của mạch quá lớn, lưu lượng máu có thể bị ảnh hưởng (ứ đọng), dẫn đến chứng huyết khối. Nói chung, diện tích mặt cắt ngang cấy ghép không được chiếm quá 50 % trong lòng mạch. |
Bảng C.4 - Ưu điểm trong việc sử dụng các mô hình NAVI hoặc AVI
| Hệ số | Sự mô tả | Mối quan ngại |
| 1 | Nghiên cứu hình thành huyết khối | Mô hình NAVI đã được biết là luôn thể hiện sự hình thành huyết khối in vivo đáng kể trên các polyme kỵ nước, đặc biệt là sau 1 h hoặc ít tiếp xúc với máu. Như vậy, mô hình NAVI là một mô hình tốt để nghiên cứu sự hình thành huyết khối. Ví dụ, nó có thể là một công cụ hữu ích để nghiên cứu tác động của huyết khối lên các trang thiết bị, chẳng hạn như cảm biến nội mạch [143]. |
| 2 | Đánh giá lớp phủ nhằm mục đích giảm huyết khối | Các lớp phủ được áp dụng cho các bề mặt trang thiết bị để giảm sự gây huyết khối sẽ cho thấy các phản ứng nhất quán và khác nhau có thể đo được, nghĩa là thấp hơn các đối chứng không được sửa đổi, khi được thử nghiệm trong mô hình NAVI. Thận trọng: Thử nghiệm phải bao gồm các bước để đánh giá tiềm năng huyết khối, vì các bề mặt không kết dính huyết khối vẫn có thể gây huyết khối. |
| 3 | Đánh giá lớp phủ nhằm tăng cường huyết khối | Các lớp phủ được áp dụng cho các bề mặt trang thiết bị để tăng cường khả năng tạo huyết khối sẽ cho thấy các phản ứng nhất quán và khác nhau có thể đo được, nghĩa là cao hơn các đối chứng không được sửa đổi, khi được thử nghiệm trong mô hình NAVI hoặc AVI. Thận trọng: Thử nghiệm nên bao gồm các bước để đánh giá tiềm năng huyết khối, vì bề mặt tạo huyết khối có thể làm bong ra. |
| 4 | Sàng lọc vật liệu cho các ứng dụng tim mạch | Các mô hình NAVI và AVI thích hợp nhất để thử nghiệm các trang thiết bị loại ống thông dự định được đưa vào mạch máu trong thời gian ngắn. Nhiều vật liệu và thiết kế trang thiết bị có thể được thử nghiệm trong mô hình này với mạch đối diện đang được sử dụng để đánh giá phiên bản đối chứng hoặc không sửa đổi của trang thiết bị thử nghiệm. |
Phụ lục D
(tham khảo)
Huyết học/tan huyết - Phương pháp thử nghiệm - Đánh giá tính chất tan huyết của trang thiết bị y tế và vật liệu trang thiết bị y tế
D.1 Xem xét chung
Tài liệu mở rộng có sẵn mô tả các tương tác máu/vật chất. Tuy nhiên có rất ít phương pháp tồn tại đáng tin cậy, có thể tái tạo và dự đoán hiệu suất lâm sàng. Phụ lục này sẽ xem xét các phương pháp thử tan huyết đã biết và thảo luận về các yếu tố liên quan đến khả năng đặc trưng của vật liệu và trang thiết bị y tế. Tan huyết là một chức năng của thời gian tiếp xúc với vật liệu máu và tính chất vật liệu như năng lượng bề mặt, hình thái bề mặt và hóa học bề mặt. Tan huyết cũng là một chức năng của các lực cơ học cục bộ và các yếu tố sinh hóa.
D.2 Nguyên nhân gây tan huyết
D.2.1 Áp lực thẩm thấu (tan huyết do áp lực thẩm thấu)
Màng hồng cầu là màng bán thấm. Một chênh lệch áp suất sẽ xảy ra khi hai dung dịch có nồng độ khác nhau bị ngăn cách bởi màng hồng cầu. Áp lực thẩm thấu xảy ra khi màng không thẩm được chuyển động của chất tan thụ động, nhưng nó cho phép một dung môi tinh khiết đi qua, chẳng hạn như nước. Sự chênh lệch áp suất như vậy có thể làm hồng cầu phồng lên và màng tế bào vỡ ra cùng với sự giải phóng hemoglobin tự do [175]. Cũng cần lưu ý rằng sự mong manh thẩm thấu giữa các tế bào hồng cầu của động vật có vú có thể thay đổi [95] - [98].
D.2.2 Lực cơ học (tan huyết do cơ học)
Các yếu tố động học của dịch như tốc độ dòng máu, nhiễu loạn và lực cắt không sinh lý có thể làm biến dạng màng hồng cầu và có khả năng gây vỡ màng. Khả năng gây vỡ màng có khả năng bị làm trầm trọng thêm bởi các trang thiết bị có hoạt động cơ học và/hoặc đường dẫn dòng chảy phức tạp. Ví dụ về các trang thiết bị như vậy bao gồm:
- hệ thống gạn máu và phân tách tế bào,
- bộ lọc máu động mạch [11] [36],
- bơm máu [29] [30] [124] [157],
- hệ thống tim phổi nhân tạo [5] [10] [11] [13] [37] [41],
- hệ tim mạch/bể chứa tĩnh mạch [10] [11],
- thiết bị hỗ trợ tuần hoàn [9],
- hệ thống thẩm tách máu [16] [28] [41],
- van tim cơ học [2], và
- thiết bị hỗ trợ tâm thất [236] [237].
D.2.3 Các yếu tố sinh hóa (tan huyết do nguyên liệu)
Những thay đổi cấu trúc màng ở cấp độ phân tử có thể thay đổi các tính chất độ bền và độ đàn hồi của màng hồng cầu. Sự suy giảm các yếu tố dinh dưỡng hoặc năng lượng trao đổi chất (ATP) có thể dẫn đến mất hình dạng đĩa và sự hình thành bọng nhỏ của hemoglobin. Các hóa chất khác, ví dụ: chiết xuất từ một trang thiết bị y tế, độc tố vi khuẩn, pH và thay đổi trao đổi chất gây ra bởi nhiệt độ, có thể làm tổn thương màng hồng cầu [95]. Những thay đổi này có thể gây vỡ màng ở mức áp lực thẩm thấu thấp hơn mong đợi. Một phép thử để xác định áp lực mà tại đó màng hồng cầu bị vỡ (tính mong manh thẩm thấu) có thể được thực hiện.
D.3 Ý nghĩa lâm sàng của hiện tượng tan huyết
D.3.1 Tác động độc
Mức độ tăng của haemoglobin tự do trong huyết tương có thể gây độc hoặc bắt đầu các quá trình có thể gây ảnh hưởng cho thận hoặc các cơ quan khác [175]. Nồng độ haemoglobin tự do trong huyết tương không chỉ là thước đo mức độ tổn thương hồng cầu, mà còn gián tiếp chỉ ra sự tổn hại cho đến các yếu tố khác trong máu.
D.3.2 Chứng huyết khối và thiếu máu
Tan huyết nội mạch có thể thúc đẩy chứng huyết khối bằng một loạt các sự kiện liên quan đến giải phóng RBC ADP và phospholipids [106] gây ra hoạt hóa tiểu cầu và phân hủy các tác nhân prothrombotic. Khi tan huyết gây giảm số lượng hồng cầu đáng kể trên lâm sàng, thiếu máu và khả năng oxy hóa bị tổn thương với các tác động tiếp theo của nó lên não và các cơ quan hoặc mô khác có thể xảy ra.
D.4 Xác định việc đánh giá đạt/không đạt đối với hiện tượng tan huyết
Tan huyết là một hàm số của thời gian tiếp xúc và tính chất vật liệu, chẳng như năng lượng bề mặt, hình thái bề mặt và hóa học bề mặt. Tan huyết cũng là một hàm số của ứng suất trượt, tương tác giữa thành tế bào, đặc tính của các tầng protein được hấp phụ, độ ổn định của dòng, sự xâm nhập của khí và các biến thể của nguồn máu, tuổi và thành phần hóa học của máu [108] [112] [113]. Những biến số này cần được kiểm soát đầy đủ để so sánh tiềm năng tan huyết giữa các vật liệu và trang thiết bị y tế. Phổ của các phương pháp đánh giá tan huyết thay đổi từ các mô hình đơn giản đến phức tạp cao. Các mô hình in vitro và in vivo cụ thể với máu chảy đã được công bố. Các nghiên cứu tiềm năng tan huyết là những so sánh tương đối áp vào các vật liệu hoặc trang thiết bị y tế được thử nghiệm trong cùng một mô hình bởi một phòng thí nghiệm cụ thể hơn là phép đo tuyệt đối. Các phương pháp thử in vitro có thể định lượng được mức độ nhỏ lượng hemoglobin huyết tương mà có thể không đo được mức độ đó trong điều kiện in vivo (ví dụ: do gắn kết hemoglobin huyết tương với haptoglobin và loại bỏ nhanh khỏi cơ thể). Có thể áp dụng việc đo lactate dehydrogenase và haptoglobin như các chỉ định của hiện tượng tan huyết trong môi trường thử nghiệm in vivo.
Không thể xác định được mức độ phổ biến cho lượng tan huyết có thể chấp nhận được và không thể chấp nhận được với tất cả các trang thiết bị và ứng dụng y tế. Hiệu quả của một trang thiết bị đến sự tan huyết có thể được che dấu trong thời gian ngắn bởi chấn thương của quá trình phẫu thuật. Một trang thiết bị có thể gây ra một lượng tan huyết đáng kể, nhưng là phương pháp điều trị duy nhất có sẵn trong tình huống đe dọa tính mạng. Theo trực giác, một vật liệu tương thích với máu là không tan huyết. Trong thực tế, nhiều trang thiết bị gây tan huyết, nhưng vì lợi ích lâm sàng của chúng lớn hơn nguy cơ liên quan đến tan huyết. Do đó, khi một trang thiết bị gây tan huyết, điều quan trọng là phải xác nhận rằng trang thiết bị mang lại lợi ích lâm sàng và việc tan huyết nằm trong giới hạn có thể chấp nhận được về mặt lâm sàng. Tiêu chí chấp nhận có thể được xác minh là đúng dựa trên một số hình thức đánh giá rủi ro và lợi ích. Các câu hỏi sau đây là những gợi ý để phát triển một đánh giá như vậy:
- Thời gian tiếp xúc của trang thiết bị với bệnh nhân là bao lâu?
- Vật liệu hoặc trang thiết bị gây tan huyết như thế nào? Tan huyết có tiếp diễn trong suốt thời gian trang thiết bị tiếp xúc với bệnh nhân hay không? Tan huyết có tiếp diễn sau khi loại bỏ các trang thiết bị hay không?
- Những rủi ro và lợi ích tương đối của các phương pháp có sẵn khác để xử lý tình trạng này là gì?
- Các đặc tính tan huyết của các phương pháp điều trị đã biết là gì? Trang thiết bị đang bị đặt câu hỏi so với các phương pháp điều trị khác như thế nào?
- Trang thiết bị thử nghiệm có hiệu quả như thế nào so với các hình thức điều trị khác? Một trang thiết bị hiệu quả hơn có thể gây ra tan huyết nhiều hơn trong quá trình sử dụng nhưng hiệu quả bổ sung có thể làm tăng lợi ích cho bệnh nhân.
D.5 Thử nghiệm tan huyết - Xem xét chung
D.5.1 Phương pháp
D.5.1.1 Quy định chung
Sự tan huyết của các tế bào hồng cầu (hồng cầu) được đánh giá bằng các thử nghiệm in vitro. Các phương pháp trực tiếp xác định tan huyết do tương tác vật lý và hóa học với hồng cầu.
Phương pháp gián tiếp xác định tan huyết do các chất có thể chiết được từ các vật phẩm đưa thử. Tài liệu tham khảo [17] là một tiêu chuẩn dành riêng cho việc thử nghiệm tính chất tan huyết của vật liệu (chủ yếu là do yếu tố hóa học) và tùy thuộc vào kích thước và độ phức tạp của trang thiết bị, có thể không đủ để thử nghiệm toàn bộ trang thiết bị y tế còn nguyên vẹn. Tài liệu tham khảo [17], [22] và [28] là những ví dụ về phương pháp được phát triển đặc biệt để thử nghiệm tan huyết của các trang thiết bị y tế và các vật liệu thành phần của chúng. Tài liệu tham khảo [20] đã được phát triển để đánh giá sự tan huyết do các hạt nano y tế. Ở dạng đơn giản nhất, đối với các huyền phù bị pha loãng nhiều lần của hồng cầu khi tiếp xúc với các vật liệu thử nghiệm, sự tan huyết thường được báo cáo là tỷ lệ phần trăm của hemoglobin đã được giải phóng vào chất nổi được chuẩn hóa bởi toàn bộ hemoglobin có sẵn tại thời điểm ban đầu của phép thử, nghĩa là (nồng độ haemoglobin tự do/ nồng độ haemoglobin toàn phần) x 100 %. Nếu tất cả các hồng cầu có mặt tại thời điểm ban đầu của thực nghiệm bị phá hủy, có khả năng tan huyết 100 %.
Ngoài thử nghiệm vật liệu của trang thiết bị, thử nghiệm động toàn bộ trang thiết bị y tế trong điều kiện sử dụng lâm sàng để đánh giá tác động của cấu trúc trang thiết bị, tương tác vật lý của máu với vật liệu, phạm vi điều kiện sử dụng phù hợp lâm sàng (ví dụ: lưu lượng máu, rpm, áp lực, thời gian phơi nhiễm), mục đích sử dụng và các yếu tố huyết động trên tan huyết nên được xem xét. Đối với nhiều trang thiết bị, quá trình tan huyết gây ra bởi lực thủy động lực và tương tác động với các bề mặt vượt quá mức gây ra bởi tác động hóa học của vật liệu. Để mô phỏng một cách thích hợp các điều kiện sử dụng lâm sàng, dung tích hồng cầu và các yếu tố khác cần được tính đến trong quá trình thử nghiệm tan huyết động [30] [37] [41] [124]. Để xác định một trường hợp tan huyết tồi tệ nhất có thể xảy ra, thử nghiệm in vitro thường được tiến hành ở lưu lượng máu cao nhất mà trang thiết bị dự kiến sẽ được sử dụng. Các tài liệu tham khảo cung cấp các thủ tục để thử nghiệm tan huyết cơ học của các trang thiết bị bao gồm Tài liệu tham khảo [5], [37], [41] và [124].
Nồng độ của hemoglobin trong huyết tương thấp hơn đáng kể so với tổng nồng độ hemoglobin trong máu. Nồng độ haemoglobin tự do trong huyết tương thường là 0 mg/dl đến 10 mg/dl in vivo, trong khi đó, phạm vi bình thường của tổng nồng độ hemoglobin trong máu là 11 000 mg/dl đến 18 000 mg/dl. Vì lý do này, các phương pháp khác nhau đã được sử dụng để đo phạm vi nồng độ hemoglobin lớn gặp phải trong quá trình thử nghiệm tan huyết. Một lưu ý thận trọng:
THẬN TRỌNG - Một số xét nghiệm tan huyết thông thường cho thấy mức giới hạn đối với tan huyết do nguyên liệu dưới đây không có/nguy cơ lo ngại thấp dựa trên các giá trị được chấp nhận trong lịch sử nhưng không được đánh giá xác nhận giá trị [14] [17] [28]. Tuy nhiên, mức độ tan huyết do nguyên liệu cao hơn có thể được chấp nhận dựa trên phân tích rủi ro/lợi ích phù hợp.
Các nhà nghiên cứu cần lưu ý rằng các thử nghiệm tan huyết có thể bị ảnh hưởng bất lợi bởi các hóa chất trong vật liệu y tế hoặc các giải pháp có thể làm thay đổi tính dễ vỡ của hồng cầu (ví dụ như một số chất đệm và chất cố định, như formaldehyd hoặc glutaraldehyd), làm cho hemoglobin bị kết tủa (ví dụ như các ion đồng hoặc kẽm) thay đổi quang phổ hấp thụ của hemoglobin (ví dụ bằng polyethylen glycol hoặc ethanol) [115] [170].
D.5.1.2 Đo nồng độ hemoglobin toàn phần trong máu
Về mặt kinh điển, các phương pháp phân tích được nêu trong D.5.1.2.1 và D.5.1.2.2 đã được sử dụng để xác định nồng độ hemoglobin toàn phần trong máu (Hb) [106]. Nồng độ haemoglobin toàn phần trong máu cũng có thể được đo bằng cách sử dụng bộ đếm tế bào máu hoàn chỉnh đã được hiệu chuẩn và máy đo haemoglobin.
D.5.1.2.1 Phương pháp cyanmethaemoglobin
Phương pháp cổ điển đầu tiên, phát hiện cyanmethaemoglobin, được ban hành bởi Ban kỹ thuật Tiêu chuẩn quốc tế về huyết học [121]. Phân tích cyanmethaemoglobin (hemiglobincyanide; HiCN) có ưu điểm là thuận tiện, dễ tự động hóa và có sẵn một tiêu chuẩn tham chiếu chính (HiCN). Phương pháp này dựa trên quá trình oxy hóa Hb và sự hình thành tiếp theo của haemoglobincyanide có mức hấp thụ tối đa rộng ở bước sóng 540 nm. Các tác nhân dung giải như chất tẩy rửa được sử dụng, ngoài việc giải phóng Hb từ hồng cầu, làm giảm độ đục (một nguồn gây nhiễu được xem là sự hấp thụ giả ở bước sóng 540 nm) từ sự kết tủa protein. Đối với nồng độ hemoglobin toàn phần, nhiễu quang phổ do huyết tương là thấp nhất và độ hấp thụ mẫu có thể được so sánh trực tiếp với dung dịch chuẩn HiCN.
Dải hấp thụ rộng của HiCN trong vùng này cho phép sử dụng quang kế loại bộ lọc đơn giản cũng như quang phổ kế dải hẹp để phát hiện thủ công hoặc tự động. Việc sử dụng tiêu chuẩn tham khảo HiCN cung cấp khả năng so sánh giữa tất cả các phòng thí nghiệm sử dụng phương pháp này. Nhược điểm chính là nguy cơ sức khỏe tiềm ẩn trong việc sử dụng các dung dịch xyanua. Thuốc thử Xyano bản thân nó là độc bởi nhiều cách phơi nhiễm khác nhau và thêm nữa là giải phóng HCN khi axit hóa. Việc xử lý thuốc thử và sản phẩm cũng trở thành mối quan tâm và chi phí đáng kể.
D.5.1.2.2 Phương pháp sắt
Phương pháp cổ điển thứ hai để xác định nồng độ hemoglobin toàn phần dựa trên việc xác định nồng độ sắt hemoglobin trong dung dịch. Sắt trước tiên được tách ra khỏi Hb, thường bằng axit hoặc bằng tro. Sau đó, sắt được chuẩn độ bằng TiCl3 hoặc được tạo phức với thuốc thử để tạo màu sắc có thể được đo bằng phương pháp quang phổ. Phương pháp này quá phức tạp cho công việc thường quy và hiếm khi được sử dụng.
D.5.1.3 Đo nồng độ hemoglobin huyết tương hoặc nổi trên bề mặt
Hai phương pháp sau đây đã được sử dụng để đo nồng độ hemoglobin huyết tương hoặc nổi trên bề mặt.
D.5.1.3.1 Kỹ thuật hóa học và quang hóa trực tiếp
Do nhiều yếu tố khác nhau (ví dụ: truyền thống, dễ sử dụng, xử lý hóa chất thải, có sẵn các dung dịch tiêu chuẩn), đã có một loạt các xét nghiệm khác nhau được sử dụng để đo haemoglobin huyết tương như là một chất chỉ thị của hiện tượng tan huyết, nhưng không có một phương pháp nào được chấp nhận rộng rãi. Các xét nghiệm có thể được phân thành hai loại chính: đó là các kỹ thuật quang học trực tiếp (nghĩa là dựa trên định lượng đỉnh hấp thụ oxyhaemoglobin ở bước sóng 415nm, 541 nm hoặc 577 nm, trực tiếp hoặc thông qua sử dụng phương pháp quang phổ dẫn xuất) và các kỹ thuật được bổ sung (nghĩa là định lượng hemoglobin dựa trên phản ứng hóa học với các thuốc thử như chất tạo sắc giống như benzidine và hydro peroxide hoặc sự hình thành cyanmethaemoglobin) [109]. Tất cả các xét nghiệm có thể được thực hiện thủ công hoặc có thể được tự động.
Một phương pháp phổ biến để xác định nồng độ của hemoglobin dựa trên tác dụng xúc tác của nó đối với quá trình oxy hóa của một dẫn xuất của benzidine, như tetramethylbenzidene, bằng hydro peroxide. Tốc độ hình thành của một sản phẩm có màu (được phát hiện bằng phương pháp quang phổ ở bước sóng 600 nm) tỷ lệ thuận với nồng độ hemoglobin. Ưu điểm của phương pháp này là dễ dàng tự động hóa (trang thiết bị thương mại), loại bỏ các thuốc thử xyano có khả năng độc hại và không an toàn với môi trường và có sẵn các bộ tiêu chuẩn Hb được hiệu chuẩn theo các tiêu chuẩn tham chiếu chính của HiCN.
Giới hạn phát hiện của xét nghiệm (thấp tới 5,0 mg/dl) có thể so sánh với phương pháp hemoglobin cyanide [106]. Những nhược điểm chính là vẫn có nguy cơ tiềm ẩn đối với sức khỏe khi sử dụng thuốc nhuộm benzidine và chi phí liên quan đến việc thải bỏ thuốc thử và sản phẩm. Hơn nữa, phạm vi động được báo cáo của phương pháp này là thấp (5 mg/dl đến 50 mg/dl) [116] và sự ức chế phản ứng có thể (tới 40 %) [117] có thể xảy ra từ chất chống đông canxi (ví dụ xitrat, oxalate, EDTA) [116], albumin [104] hoặc các thành phần huyết tương không đặc hiệu khác [106] có thể can thiệp vào quá trình oxy hóa H2O2.
Vì những lý do này, các phương pháp quang học trực tiếp, như các phương pháp của Tài liệu tham khảo [102], [105] hoặc [118] có độ nhạy và độ tái lập tương đương có thể được thay thế. Tuy nhiên, như đã lưu ý ở trên, những thay đổi về mặt hóa học đối với hemoglobin và quang phổ của nó có thể xảy ra có thể làm mất hiệu lực một số xét nghiệm hemoglobin. Hơn nữa, sự bù cần phải được thực hiện đối với nhiễu nền huyết tương nội sinh, vì sự bù này cũng có thể làm thay đổi quang phổ haemoglobin [109]. Nhà phân tích cần lưu ý về những hạn chế này trong các xét nghiệm haemoglobin huyết tương và xác định xem họ có đang sử dụng một kỹ thuật thích hợp [104] [109] [115] [170]. Điều này bao gồm việc đánh giá chất nổi trên bề mặt thử nghiệm đối với sự có mặt của chất kết tủa và so sánh quang phổ của nó (ví dụ: 400 nm đến 700 nm) với oxyhaemoglobin bị cô lập.
D.5.1.3.2 Phương pháp đo tủa miễn dịch
Phương pháp đo tủa miễn dịch tế bào dựa trên việc xác định haemoglobin huyết tương bằng phương pháp đo tủa bằng cách sử dụng một kháng thể thương mại có sẵn. Phương pháp này là dành cho công việc thường quy. Có một mối tương quan và so sánh tốt với các kỹ thuật quang học [107].
D.5.2 Bảo quản máu và các thành phần của máu
Điều này trình bày các thực tiễn được chứng minh tốt nhất để bảo tồn các thành phần máu của con người bởi Hiệp hội các ngân hàng máu của Mỹ [99] và Hội đồng châu Âu [101]. Nói chung, các vật liệu và trang thiết bị nên được thử nghiệm bằng cách sử dụng máu có mô phỏng tình trạng hóa học mà trang thiết bị sẽ gặp phải trên lâm sàng, ví dụ: lựa chọn đúng chất chống đông, sử dụng tối thiểu chất bảo quản máu và pH máu thích hợp [151] - [156].
Các dung dịch chống đông máu đã được phát triển để sử dụng trong thu thập máu nhằm ngăn cản sự đông máu và cho phép lưu trữ hồng cầu trong một khoảng thời gian nhất định. Những dung dịch này đều chứa natri xitrat, axit citric và glucose; Ngoài ra, một số có chứa adenine, guanosine, mannitol, sucrose, sorbitol và/hoặc phosphate, trong số những người khác [151] - [156]. Mặc dù heparin không được sử dụng để bảo quản máu, nhưng nó thường được sử dụng để chống đông máu lâm sàng với bệnh nhân tiếp xúc với các trang thiết bị y tế.
Sự đông máu được ngăn chặn bằng liên kết xitrate của canxi. Erythrocytes chuyển hóa glucose trong quá trình lưu trữ. Hai phân tử adenosine triphosphate (ATP) được tạo ra bởi sự phosphoryl hóa adenosine diphosphate (ADP) cho mỗi phân tử glucose được chuyển hóa qua chu trình glycolysis kỵ khí Embden-Myerhoff-Parnas. Các phân tử ATP hỗ trợ các yêu cầu năng lượng của hồng cầu trong việc duy trì tính linh hoạt của màng và các chức năng vận chuyển màng nhất định. Chuyển đổi ATP sang ADP giải phóng năng lượng cần thiết để hỗ trợ các chức năng này. Để kéo dài thời gian bảo quản, cần giảm độ kiềm bằng cách thêm axit citric vào dung dịch chống đông máu. Điều này cung cấp nồng độ ion hydro cao phù hợp khi bắt đầu lưu trữ hồng cầu ở 4 °C. Tăng độ axit trong quá trình lưu trữ làm giảm tốc độ glycolysis. Các nucleotide adenosine (ATP, ADP, AMP) bị cạn kiệt trong quá trình lưu trữ và việc bổ sung adenosine vào dung dịch chống đông máu cho phép tổng hợp AMP, ADP và ATP thay thế.
Một phần đáng kể glucose và adenine được loại bỏ bằng huyết tương khi cô đặc hồng cầu được điều chế. Khả năng tồn tại của hồng cầu chỉ có thể được duy trì sau khi loại bỏ huyết tương nếu các tế bào không quá cô đặc. Bình thường xitrate phosphate dextrose (CPD) -adenine cô đặc hồng cầu không nên có một phần khối lượng hồng cầu lớn hơn 0,80. Ngay cả khi hơn 90 % huyết tương được loại bỏ, khả năng tồn tại hồng cầu có thể được duy trì bằng cách bổ sung môi trường phụ gia hoặc huyền phù. Natri clorua, adenine và glucose là cần thiết cho khả năng tồn tại trong khi mannitol hoặc sucrose có thể được sử dụng để ổn định hơn nữa màng tế bào và ngăn ngừa tan huyết [99].
Sự phù hợp của các vật chứa để lưu trữ các sản phẩm máu được đánh giá bằng các phương pháp khác nhau để đo lường chất lượng của sản phẩm máu [103] [106]. Vật chứa sản phẩm máu chứa chất chống đông thích hợp được bảo quản thẳng đứng ở 1 °C đến 6 °C trong điều kiện tĩnh. Theo các khoảng thời gian định trước, lượng haemoglobin tự do trong tế bào được đo để đánh giá khả năng tồn tại và chất lượng của sản phẩm được lưu trữ. Chất lượng của sản phẩm được lưu trữ có thể được tăng cường bằng cách trộn nhẹ mỗi tuần một lần. Đánh giá việc lưu trữ trong vật chứa gián tiếp đánh giá tính thấm của vật chứa để thải carbon dioxide từ quá trình chuyển hóa hồng cầu trong trường hợp không có các yếu tố gây xáo trộn khác.
D.5.3 Bảo vệ các nhân viên xử lý máu
Các quy trình bằng văn bản là cần thiết để bảo vệ nhân viên tiếp nhận, xử lý và làm việc với máu người có khả năng bị nhiễm khuẩn. Các vật liệu có khả năng bị nhiễm khuẩn bao gồm máu và các chất dịch cơ thể khác và các sản phẩm, trang thiết bị đã hoặc có thể tiếp xúc với máu hoặc các chất dịch cơ thể khác và các vật liệu được sử dụng trong nuôi cấy các sinh vật gây nhiễm trùng máu [114].
D.5.4 Lấy máu (trích máu từ tĩnh mạch)
Mặc dù không thể đảm bảo vô trùng 100 % bề mặt da cho phẫu thuật cắt bỏ, nhưng nên có một quy trình nghiêm ngặt, được chuẩn hóa để chuẩn bị cho vùng da sẽ lấy máu tĩnh mạch. Điều đặc biệt quan trọng là cho phép dung dịch sát khuẩn phải khô trên bề mặt da trước khi lấy máu tĩnh mạch và không tiếp xúc với bề mặt da trước khi lồng kim lấy máu tĩnh mạch [99].
Một hệ thống lấy máu kín (nghĩa là không chứa không khí trong phòng) được ưu tiên để lấy máu nhằm ngăn ngừa nhiễm vi khuẩn. Các lỗ kim trong vòng đệm cao su của lọ mẫu thử phải được đóng hoàn toàn sau khi rút kim, nếu không, một phần chân không được tạo ra sau khi làm mát có thể hút không khí bị nhiễm [99].
CHÚ THÍCH: Sử dụng ống chân không có khả năng gây tan huyết nhẹ [125] [126] [127].
Máu được lấy trong một hệ thống mở có thể bị nhiễm do phơi nhiễm với không khí trong phòng và không được coi là vô trùng. Nhiễm vi khuẩn là một nguyên nhân gây tan huyết.
D.5.5 Chọn loài
Lý tưởng nhất là thử nghiệm tan huyết nên được thực hiện với hồng cầu của người. Tuy nhiên, một số yếu tố có thể làm cho một lựa chọn như vậy khó khăn hoặc không thể. Ở một số quốc gia, nguồn cung cấp máu của con người bị hạn chế và nên được dành riêng cho truyền máu người. Tiêu chí sức khỏe cho người hiến máu và động vật cũng nên được xem xét. Tất cả máu đều có “thời hạn sử dụng” hạn chế và có thể khó lấy được tế bào máu của con người một cách kịp thời. Nếu sử dụng hồng cầu động vật, cần chú ý để đảm bảo tan huyết 100 % để có được hàm lượng haemoglobin toàn phần do sự khác biệt về độ ổn định màng giữa các loài động vật. Đối chứng âm tính nên gây tan huyết tối thiểu để hoạt động của vật liệu thử không bị che đậy. Hồng cầu của thỏ và người được báo cáo là có đặc tính tan huyết tương tự trong khi hồng cầu của khỉ nhạy cảm hơn và hồng cầu chuột lang ít nhạy cảm hơn [95] [96] [97] [98] [123].
D.5.6 Đánh giá khả năng tan huyết - In vitro, ex vivo và in vivo tiếp xúc với máu hoặc các thành phần máu
Tan huyết có thể được đánh giá bằng cách tiếp xúc với các vật liệu hoặc trang thiết bị trong điều kiện in vitro, in vivo và ex vivo. Điều kiện in vitro được sử dụng để đánh giá vật liệu cũng như trang thiết bị. Các điều kiện ex vivo và in vivo được sử dụng để đánh giá các trang thiết bị có thể chứa nhiều hơn một vật liệu.
Đánh giá in vivo và ex vivo trên mô hình động vật hoặc trong các thử nghiệm lâm sàng là có thể. Biện minh có thể được thực hiện cho một trong các thiết kế nghiên cứu sau đây. Trong trường hợp đầu tiên, trang thiết bị thử nghiệm được so sánh với các trang thiết bị bán trên thị trường đối chứng chuẩn với mức độ tan huyết được chấp nhận. Trong trường hợp thứ hai, đối tượng thử nghiệm được đánh giá về hậu quả có ý nghĩa lâm sàng của tan huyết.
Mục đích của các thử nghiệm in vivo hoặc ex vivo là để mô tả tiềm năng tan huyết của trang thiết bị y tế. Các nghiên cứu sơ bộ có thể là in vitro và có thể sử dụng máu người mới lấy hoặc máu người đã để lâu hoặc máu từ một loài động vật. Đối với các trang thiết bị y tế được chỉ định dùng cho ex vivo thì thực tế chung là tái tuần hoàn máu qua trang thiết bị bằng các điều kiện mô phỏng việc sử dụng lâm sàng trong trường hợp xấu nhất có liên quan đến lâm sàng (ví dụ như lưu lượng máu cao nhất). Những nghiên cứu này được tiếp theo bởi các mô phỏng ex vivo trên mô hình động vật cho một số trang thiết bị y tế hoặc bằng các nghiên cứu hạn chế, có kiểm soát ở người. Kích cỡ của trang thiết bị y tế và chức năng dự định ảnh hưởng đến thiết kế của những nghiên cứu này.
D.5.7 Tiếp xúc trực tiếp so với phương pháp gián tiếp
Các điều kiện chiết đã sử dụng được nêu trong TCVN 7391-12 (ISO 10993-12). Một số phương pháp thử yêu cầu tiếp xúc trực tiếp của trang thiết bị với hồng cầu, trong khi các phương pháp khác mô tả việc chuẩn bị một chất chiết sau đó sẽ phơi nhiễm với hồng cầu. Lựa chọn phép thử phải dựa trên chính trang thiết bị và các điều kiện sẽ sử dụng trang thiết bị. Các điều kiện chiết được xem xét khi sử dụng nhiệt độ tăng cao được nêu trong TCVN 7391-12 (ISO 10993-12).
Phụ lục E
(tham khảo)
Bổ thể - Phương pháp thử
E.1 Thông tin cơ bản
Hoạt hóa bổ thể đã được liên quan đến một số phản ứng bất lợi trong các liệu pháp ngoại bào lâm sàng, đặc biệt là thẩm tách máu [129] [130] [131] [132] và các ứng dụng tim phổi nhân tạo [133] [134] [135] [136]. Những liệu pháp này đáng chú ý liên quan đến các trang thiết bị có diện tích bề mặt tiếp xúc với máu cao và thời gian tiếp xúc tương đối ngắn. Hoạt hóa bổ thể thường xảy ra trong giai đoạn đầu ngay sau khi máu tiếp xúc với bề mặt vật liệu của trang thiết bị; nó vẫn chưa được xem xét tiếp trong một thời gian dài hơn. Ở đây, hoạt hóa được ghi nhận để bắt đầu tiếp xúc với máu với các vật liệu trang thiết bị và sự lắng đọng của nhiều protein huyết tương, bao gồm các protein bổ thể quan trọng C3 và C3b. Sự tiếp xúc của các protein cụ thể này dẫn đến sự hình thành con đường nhánh của các enzym convertase C3 và C5 quan trọng (tương ứng C3b•Bb, C3b•C3b•Bb; xem Hình B.2). Protein chuyển đổi C5 xúc tác sự phân cắt của C5 dẫn đến việc tạo ra C5a và C5b. Protein C5a là một tác nhân được công nhận của hoạt hóa bạch cầu trung tính và bạch cầu đơn nhân qua trung gian thụ thể và đoạn C5b là thành phần bổ sung ban đầu được công nhận dẫn đến sự hình thành phức hợp gắn màng bổ sung (MAC) liên kết và hoạt hóa và/hoặc phá hủy các tế bào bên ngoài bằng cách gây ra ly giải. WBC có thể phát hiện các mảnh C3 và C4 liên kết bề mặt vật liệu, dẫn đến sự kết dính và hoạt hóa bề mặt tiếp theo của chúng. Hoạt hóa bạch cầu trung tính và bạch cầu đơn nhân, hình thành và hoạt động MAC, và sự kết dính và hoạt hóa WBC trên các vật liệu chiếm tỷ lệ sinh lý bệnh học được thấy trên lâm sàng trong các ứng dụng trang thiết bị diện tích bề mặt cao [136]. Điều quan trọng, Tài liệu tham khảo [138] đã chỉ ra vai trò quan trọng của mảnh C5a trong việc làm trung gian cho nhiều phản ứng bất lợi này. Ở đây, các phản ứng phụ thuộc vào liều giống hệt với các phản ứng được lọc máu thực tế đã được quan sát trong thẩm tách máu mô phỏng và truyền dịch C5a tinh khiết. Công việc tiếp tục trong lĩnh vực này đã chỉ ra rằng các vật liệu có bề mặt có tính nucleophilic cao (chứa hydroxyland amin) có khả năng hoạt hóa bổ thể cao nhất và các sửa đổi bề mặt khác nhau làm giảm loại hóa học bề mặt này làm vô hiệu hóa rất nhiều di chứng lâm sàng cổ điển. Công việc này được hỗ trợ bởi các nhà nghiên cứu khác nghiên cứu mối quan hệ hoạt hóa bổ thể bằng vật liệu trang thiết bị y tế và phản ứng sinh học [136] [137].
May mắn là việc phát hiện ra các vật liệu tiếp xúc với máu chứa hydroxyl và amin là nguồn hoạt hóa bổ thể đã dẫn đến sự phát triển của các vật liệu mới loại bỏ hoặc che dấu các nhóm này. Sửa đổi vật liệu này làm giảm đáng kề hoạt hóa bổ thể trong diện tích bề mặt lớn hơn/ứng dụng tiếp xúc cấp tính. Tuy nhiên, sự chú ý này đối với hoạt hóa bổ thể trong các vùng trang thiết bị lớn này đã thúc đẩy thử nghiệm như vậy trở nên phổ biến hơn trên tất cả các trang thiết bị bất kể diện tích bề mặt tiếp xúc với máu và thời gian cấy ghép. Cho đến nay, không có bài báo khoa học hoặc báo cáo lâm sàng nào về các tác dụng phụ liên quan đến bổ thể đã được Nhóm công tác này xác định trong các ứng dụng trang thiết bị khác, nghĩa là tất cả các trang thiết bị diện tích bề mặt trung bình đến nhỏ. Do đó, các tài liệu tham khảo phù hợp liên kết hoạt hóa bổ thể liên quan đến trang thiết bị với các sự kiện bất lợi ở người, cùng với diện tích bề mặt trang thiết bị ngưỡng quan tâm là không có sẵn. Có thể đáng chú ý là các phản ứng phản vệ cổ điển đã xảy ra liên quan đến việc sử dụng các trang thiết bị y tế. Tuy nhiên, ở đây, phản ứng này thường được quy cho một tác nhân được phân phối, thay vì một trang thiết bị hoặc vật liệu trang thiết bị [139] - [142]. Một số liên kết giả về hoạt hóa bổ thể cho các trang thiết bị liên quan có thể phát sinh từ các báo cáo đó [143].
Như theo đánh giá đông máu, chứng huyết khối và hoạt hóa tiểu cầu, một số công cụ sinh học phân tử (ví dụ như xét nghiệm ELISA) tồn tại để theo dõi mức độ hoạt hóa con đường bổ thể trong máu. Ví dụ các protein bổ thể có bộ dụng cụ ELISA thương mại có sẵn bao gồm nhưng không giới hạn ở C3a, C5a và SC5b9. Mặc dù có mối liên hệ mạnh mẽ của sinh lý bệnh qua trung gian bổ thể với đoạn C5a, thử nghiệm bổ thể cổ điển đã tập trung vào việc đánh giá phức hợp C3a và SC5b9. Kết hợp với các công cụ này, các phương pháp tồn tại để đánh giá các phản ứng có liên quan như sự kết dính WBC (sử dụng SEM) và hoạt hóa WBC, ví dụ, sử dụng các xét nghiệm sinh học để giải phóng PMN elastase.
E.2 Phép thử hoạt hóa bổ thể và tài liệu (đề nghị xem xét trong báo cáo kết quả thử nghiệm bổ thể đối với các mục đích khoa học hoặc quy định)
Các phương pháp và tài liệu chung được sử dụng trong thử nghiệm bổ thể bằng các xét nghiệm ELISA được nêu trong B.4.
Giống như các phản ứng sinh học khác, chẳng hạn như sự hình thành protein đông máu, sự hình thành bổ thể thường thể hiện giai đoạn bắt đầu, nhân giống và kết thúc [56] [57] [137]. Điều này phản ánh các phản ứng hình thành chuyển đổi C3 và C5 ban đầu, khuếch tán tầng/phản hồi và thời gian chậm/ngừng hoạt động trong đó các tiền chất quan trọng có thể bị tiêu thụ hoặc các protein hoạt động bị mất hoạt động do thời gian bán hủy ngắn hoặc ngừng hoạt động bởi các protein phản hồi đối chứng âm tính. Do đó, sự khác biệt về mức độ lớn của các protein bổ thể sẽ được dự kiến theo thời gian. Do đó, giai đoạn của tầng bổ thể trong máu tại thời điểm tiếp xúc với vật liệu/trang thiết bị thực sự xảy ra là một yếu tố quan trọng. Đó là, tác động của vật liệu thử nghiệm khi trộn với máu có thể khá khác nhau ở mỗi giai đoạn. Ngoài ra, do hoạt hóa bổ thể thường tỷ lệ thuận với diện tích bề mặt tiếp xúc với máu, diện tích bề mặt (SA) của trang thiết bị hoặc vật liệu trang thiết bị có thể ảnh hưởng rất lớn đến kết quả. Vì lý do này, tỷ lệ thể tích SA với máu (toàn phần, huyết tương hoặc huyết thanh) nên được quy định trong mỗi nghiên cứu. Nếu có thể, tỷ lệ phơi nhiễm có thể được coi là một biến số để giúp hiểu được tính đặc hiệu của hiệu ứng vật liệu. Tỷ lệ phơi nhiễm từ 3,0 cm2 đến 6,0 cm2/mL máu (dựa trên độ dày của trang thiết bị) phù hợp với TCVN 7391-12 (ISO 10993-12). Các tỷ lệ phơi nhiễm khác như 1,5 lần và 2,0 lần tỷ lệ này có thể đáng xem xét vì diện tích bề mặt cao hơn về mặt lý thuyết sẽ làm tăng độ nhạy của phản ứng với vật liệu thử nghiệm.
CHÚ THÍCH: Sẽ có giới hạn vật lý về số lượng vật liệu thử nghiệm có thể được kiểm tra do khối lượng của hệ thống thử nghiệm, ví dụ: một ống nghiệm, và tỷ lệ phơi nhiễm mục tiêu.
E.3 Xem xét phương pháp thử hoạt hóa bổ thể
Một đánh giá về nhiều phương pháp thử bổ thể trong phòng thí nghiệm đã chỉ ra rằng việc sử dụng bộ dụng cụ thử nghiệm có sẵn trên thị trường là phổ biến. Tuy nhiên, một số sự không nhất quán giữa các phương pháp phòng thí nghiệm đã được quan sát. Bao gồm những điều sau đây:
a) Chuẩn bị máu và sử dụng chống đông máu: máu được sử dụng để tiếp xúc với vật liệu thử nghiệm thay đổi đáng kể giữa các phòng thí nghiệm. Ví dụ, huyết thanh người thương mại có sẵn đặc biệt, huyết tương người tươi và đông lạnh, huyết thanh người tươi và máu toàn phần phơi nhiễm trực tiếp với máu người đã được sử dụng. Tác động của các chế phẩm khác nhau này đối với kết quả bổ thể chưa được đánh giá, ngoại trừ việc sử dụng EDTA làm chất chống đông. Về sau, thường biết rằng hoạt hóa bổ thể thông qua con đường cổ điển là phụ thuộc vào canxi và thông qua con đường nhánh là phụ thuộc magiê. Do đó, việc sử dụng các chelator canxi/magiê mạnh như EDTA sẽ liên kết với canxi và magiê có sẵn và ngắt hoạt hóa bổ thể, thực hiện hầu hết các phép đo sử dụng các chất chống đông này dẫn đến mức gần với mức nền của protein bổ thể.
Như đã nêu ở trên, hiện nay không có sự chuẩn bị máu chuẩn hoặc sự chuẩn bị máu nào được xác định để sử dụng trong thử nghiệm bổ thể. Tuy nhiên, khi huyết thanh được sử dụng, huyết thanh phải còn nguyên vẹn về chức năng và duy trì khả năng hiển thị hoạt hóa bổ thể. Nếu máu toàn phần hoặc huyết tương được sử dụng, loại chất chống đông nên được lựa chọn cẩn thận để đảm bảo rằng nó không ức chế hoặc tăng cường hoạt hóa bổ thể gây ra bởi chính trang thiết bị thử nghiệm.
b) Tỷ lệ thể tích bề mặt vật phẩm thử với thể tích máu (toàn phần, huyết tương hoặc huyết thanh): một số phòng thí nghiệm chỉ định theo tỷ lệ TCVN 7391-12 (ISO 10993-12) theo đó thể tích máu (toàn bộ, huyết tương hoặc huyết thanh) được sử dụng thay cho dịch chiết. Một số phòng thí nghiệm không quy định tỷ lệ và/hoặc tỷ lệ biến số được sử dụng. Vì hoạt hóa bổ thể bị ảnh hưởng bởi diện tích bề mặt (SA), các SA được tiêu chuẩn hóa và được báo cáo rất quan trọng đối với việc giải thích kết quả giữa một phòng thử nghiệm và liên phòng thử nghiệm.
c) Sử dụng các đối chứng: sử dụng đối chứng vật liệu sinh học âm tính, chẳng hạn như polypropylen và đối chứng vật liệu sinh học dương tính, chẳng hạn như latex hoặc cellulose acetate, có phần phù hợp; sử dụng đối chứng âm tính lỏng, như nước muối và đối chứng lỏng dương tính, như yếu tố nọc độc của rắn hổ mang, không nhất quán; việc sử dụng các biện pháp đối chứng âm tính và dương tính được cung cấp trong các bộ dụng cụ thương mại là khá nhất quán.
d) Hoạt hóa bổ thể trên các trang thiết bị y tế tiếp xúc với máu được công nhận là một hiện tượng bề mặt. Như vậy, thử nghiệm với một chất chiết trang thiết bị là không phù hợp. Thay vào đó, thử nghiệm bổ thể trên các trang thiết bị hoặc vật liệu phải luôn được tiến hành bằng phương pháp tiếp xúc trực tiếp [máu hoặc thành phần máu]. Một vật liệu đối chứng âm tính như polyetylen (PE) phải được đưa vào xét nghiệm cùng với vật liệu đối chứng dương tính như cellulose không biến đổi, ví dụ: Cuprophan2) (nếu có). Tương ứng, việc sử dụng một đối chứng âm tính lỏng như nước muối không phải là một đối chứng âm tính thích hợp cho thử nghiệm hoạt hóa bổ thể trang thiết bị y tế. Mặt khác, một chất hoạt hóa bổ thể lỏng mạnh như yếu tố nọc độc rắn hổ mang có thể được sử dụng để chứng minh rằng hệ thống thử nghiệm đang hoạt động ở các điều kiện quy định.
e) Chuẩn bị/pha loãng đường cong tiêu chuẩn: các phòng thí nghiệm đã sử dụng các độ pha loãng khác nhau của tiêu chuẩn để tạo ra đường cong tiêu chuẩn thu được hầu hết các mức mẫu thử nghiệm và đối chứng. Ví dụ, pha loãng 1:100, 1:200, 1:1 000 và 1:10 000 trên tiêu chuẩn cao nhất đã được báo cáo. Yếu tố quan trọng nhất ở đây là tất cả các mẫu cuối cùng nằm giữa giá trị thấp và cao trên đường cong tiêu chuẩn.
f) Thời gian ủ đối với các vật phẩm thử và đối chứng: thời gian ủ khác nhau giữa các phòng thí nghiệm, với các phòng thí nghiệm báo cáo sử dụng 60 min, 90 min hoặc 30 min và 60 min và thời gian ủ 90 min.
g) Thời gian ủ sau khi bổ sung chất nền chromogen: thời gian ủ 15 min đến 30 min đã được báo cáo.
h) Đánh giá mẫu thử: phương pháp đánh giá liệu một vật liệu thử nghiệm cho kết quả dương tính hay âm tính không nhất quán giữa các phòng thí nghiệm. Hầu hết các phòng thí nghiệm đã thực hiện một so sánh thống kê về kết quả mẫu thử với các biện pháp đối chứng chất lỏng và/hoặc vật liệu sinh học dương tính và âm tính. Một số phòng thí nghiệm bao gồm so sánh với các giá trị lịch sử, kết quả trên một trang thiết bị dự đoán và/hoặc một công thức toán học đặc biệt liên quan đến các đối chứng âm tính và dương tính như là một phần của đánh giá cuối cùng.
Không có tiêu chí đạt/không đạt nào được thiết lập cho mức độ hoạt hóa bổ thể được chấp nhận trên lâm sàng. Việc bao gồm một trang thiết bị so sánh được bán trên thị trường hợp pháp trong thử nghiệm hoạt hóa bổ thể sẽ hữu ích cho việc giải thích dữ liệu. Dữ liệu trang thiết bị so sánh có thể được sử dụng để đánh giá mức độ phù hợp lâm sàng của dữ liệu trang thiết bị thử nghiệm.
Nếu trang thiết bị so sánh không được bán trên thị trường hợp pháp trong khu vực quy định nơi trang thiết bị sẽ được gửi để tiếp thị, cơ quan có thẩm quyền tại khu vực có thể yêu cầu thử nghiệm so sánh đối với một trang thiết bị đã được bán trên thị trường hợp pháp trong khu vực đó.
Phụ lục F
(tham khảo)
Các phép thử trong phòng thí nghiệm ít phổ biến hơn
F.1 Tổng quan
Phụ lục này và Bảng F.1 mô tả các thử nghiệm đã được sử dụng chủ yếu trong nghiên cứu để đánh giá sự tương tác giữa trang thiết bị/vật liệu với máu. Tuy nhiên, những thử nghiệm này đã không được sử dụng rộng rãi trong việc đăng ký các trang thiết bị theo quy định. Các thử nghiệm được đề cập ở đây là dành cho mục đích thông tin với sự cảnh báo rằng chúng có thể không được tiêu chuẩn hóa cũng như không tương quan với sự phù hợp lâm sàng. Vì chiến lược đánh giá sinh học tiền lâm sàng của trang thiết bị y tế nên tập trung vào các thử nghiệm có ý nghĩa nhất và được chấp nhận rộng rãi (xem Phụ lục B), nên thận trọng trong việc đưa vào bất kỳ phương pháp nào trong Phụ lục F trong việc đăng ký trang thiết bị. Các thử nghiệm trong phòng thí nghiệm không được khuyến nghị rõ có thể được nêu trong Phụ lục G.
Bảng F.1 - Các phép thử ít phổ biến hơn được sử dụng để đánh giá tương tác với máu
| Phép thử theo loại | |
| Chứng huyết khối | Giảm lưu lượng, phân tích trọng lượng, giảm áp suất trên trang thiết bị, phân tích protein hấp phụ, kỹ thuật hình ảnh |
| Huyết khối in vitro | |
| Đông máu | Xét nghiệm tạo thrombin sử dụng chất nền tạo màu, sản phẩm phân hủy tiền sợi huyết và sợi huyết (FDP), D-dimer |
| Tiểu cầu | Đánh giá sự kết dính của tiểu cầu, phân tích tế bào học dòng chảy của hoạt hóa tiểu cầu, hình thành vi hạt tiểu cầu, hình ảnh gamma của tiểu cầu phóng xạ, ngưng tập tiểu cầu |
| Huyết học | Hoạt hóa bạch cầu bằng phương pháp tế bào học dòng chảy, đánh giá sự kết dính của tế bào máu, phức hợp tiểu cầu-leucoyte (PLC) |
| Hệ thống bổ thể | Bb, C3bBb, C5a |
| a Do tính biến đổi sinh học và giới hạn kỹ thuật, tính chính xác và dự đoán của nhiều thử nghiệm này, thường được sử dụng cho mục đích nghiên cứu, đòi hỏi phải chú ý cẩn thận đến phương pháp và thận trọng khi giải thích kết quả. | |
F.2 Chứng huyết khối
F.2.1 Giảm dòng máu chảy
Dòng máu chảy (tốc độ hoặc thể tích) được đo sau một thời gian sử dụng. Các phép đo có thể được thực hiện trong quá trình sử dụng hoặc trước và sau khi sử dụng. Cơ sở lý luận và giải thích giống như đối với B.2.1.
F.2.2 Phân tích trọng lực (khối lượng huyết khối)
Điều này được tiến hành sau khi loại bỏ trang thiết bị khỏi vị trí đang được sử dụng. Cơ sở lý luận và giải thích được nêu trong B.2.1. Ở đây, sự khác biệt về trọng lượng giữa trọng lượng trước khi cấy ghép của trang thiết bị và trọng lượng ngay sau khi cấy ghép có thể phản ánh lượng huyết khối hiện có. Một cảnh báo quan trọng là tất cả các mô hiện tại có thể không phải là huyết khối.
F.2.3 Giảm áp qua trang thiết bị
Điều này được đo trước và sau một thời gian sử dụng.
F.2.4 Phân tích protein hấp phụ (thông qua liên kết kháng thể)
Sự hấp phụ protein vào các vật liệu hoặc trang thiết bị thử nghiệm xảy ra sau khi tiếp xúc với máu, ví dụ: lớp đầu tiên hoặc lớp bề mặt khi đạt đến trạng thái cân bằng, được cho là có khả năng ảnh hưởng đến hiệu suất trang thiết bị và/hoặc kết quả lâm sàng. Bên cạnh đánh giá vi thể định tính của sợi huyết và lắng đọng tiểu cầu trên vật liệu, có thể ước tính định lượng protein bề mặt bằng cách đo lượng kháng thể được đánh dấu đặc hiệu cho các protein như tiền sợi huyết hoặc thụ thể màng tiểu cầu. Với mục đích này, các vật liệu được rửa trước tiên sau khi tiếp xúc với máu để loại bỏ các protein và thành phần máu không kết dính. Các bề mặt hoặc chiết xuất của các bề mặt sau đó được kết hợp với liên kết kháng thể có nhãn để phân tích định tính hoặc định lượng. Ngoài ra, có thể đo trực tiếp tổng lượng protein được hấp phụ mà không cần sử dụng kháng thể [164] [181] [182] [183].
F.2.5 Kỹ thuật hình ảnh - Chụp X quang động mạch, siêu âm nội mạch, siêu âm Doppler, CT và MRI
Các lựa chọn có thể được thực hiện trong số các phương pháp này để xác định mức độ ổn định hoặc mức độ thu hẹp của mảnh ghép hoặc ống dẫn khác và để phát hiện sự lắng đọng huyết khối trên các trang thiết bị trong hiệu suất in vivo của chúng.
F.3 Sự đông máu
F.3.1 Xét nghiệm tạo thrombin sử dụng chất nền tạo màu
Các vật liệu phơi nhiễm với hệ thống đông máu nguyên vẹn với sự hiện diện của phospholipid sẽ tạo ra thrombin có thể được đo bằng cách chuyển đổi chất nền tạo màu [61] [62] [63].
F.3.2 Các sản phẩm phân hủy tiền sợi huyết và sợi huyết (FDP)
Tiêu sợi huyết sinh lý bình thường mang lại FDPs X, Y, C, D và E ở nồng độ dưới 2 mg/mL huyết tương. Mức FDP thấp thông thường được duy trì nhờ tốc độ thấp của phản ứng phân hủy và tốc độ cao của quá trình thải FDP khỏi hệ tuần hoàn. Sự phân hủy bệnh lý của sợi huyết và tiền sợi huyết, do hoạt hóa plasminogen tăng tạo ra FDP ở nồng độ từ 2 mg/mL đến 40 mg/mL hoặc lớn hơn[64]. Thử nghiệm chủ yếu hữu ích để đánh giá các trang thiết bị cấy ghép. Nên sử dụng các phương pháp thương mại như ELISA.
Rối loạn mỡ máu, afibrinogenaemia và hypofibrinogenaemia gây ra kết quả PT, PTT và TT kéo dài [45].
F.3.3 D-dimer
Mức độ D-dimer tăng cao cho thấy hoạt hóa cơ chế đông máu. D-dimers là các sản phẩm phân hủy được tiêu hóa plasmin của sợi huyết liên kết ngang FXIII (đông máu và tiêu sợi huyết). Nên sử dụng xét nghiệm ELISA và/hoặc RIA để định lượng các protein đó [65] [66].
F.4 Tiểu cầu
F.4.1 Đánh giá sự kết dính của tiểu cầu
Sự kết dính tế bào máu [167] là một phép đo tính tương hợp của máu với vật liệu khi được xem xét kết hợp với nguyên tắc ngoại biên hoặc bằng chứng hoạt hóa một hoặc nhiều yếu tố huyết học.
Các phương pháp khác nhau đã được thiết kế để đo sự kết dính của các tế bào với các bề mặt, ví dụ như phương pháp Kunicki K-score K [75]. Hầu hết các phương pháp này dựa trên quan sát một tỷ lệ tiểu cầu nhất định được loại bỏ khỏi máu toàn phần bình thường do kết quả của việc đi qua một cột chứa các hạt thủy tinh trong điều kiện dòng chảy hoặc áp lực được kiểm soát.
Một phương pháp thay thế để đếm trực tiếp các tiểu cầu kết dính vào bề mặt thử nghiệm. Sau khi phơi nhiễm với máu hoặc huyết tương giàu tiểu cầu trong điều kiện tiêu chuẩn, bề mặt thử nghiệm được rửa sạch để loại bỏ các tế bào không kết dính, sau đó cố định và quan sát dưới kính hiển vi quang học hoặc kính hiển vi điện tử quét. Số lượng tiểu cầu kết dính trên một đơn vị diện tích được tính trực tiếp và hình thái học của các tiểu cầu này (ví dụ: lượng phân bố, mức độ tạo thành cụm) được ghi lại. Ngoài ra, tiểu cầu được đánh dấu trước 51Cr hoặc 111ln có thể được sử dụng [70] [71] [73]. Một phương pháp không đồng vị thay thế, LDH và phương pháp phosphatase axit, đánh giá hoạt động của enzym sau khi phân tách tiểu cầu kết dính, cũng đã được báo cáo như một công cụ hữu ích để đánh giá tiểu cầu trên bề mặt [83] [84].
F.4.2 Phân tích tế bào học dòng hoạt hóa tiểu cầu
Việc sử dụng một số vật liệu hoặc trang thiết bị nhất định có thể gây ra hoạt hóa tiểu cầu và biểu hiện các dấu hiệu hoạt hóa ở bề mặt tiểu cầu hoặc tạo ra các vi hạt tiểu cầu [173]. Các dấu hiệu hoạt hóa bề mặt tiểu cầu đã được đánh giá bằng phương pháp tế bào học dòng chảy cho biểu hiện P-selectin (GMP-140) hoặc biểu hiện glycoprotein Ib và IIB/IIIa hoạt hóa bằng kháng thể đơn dòng. Các epitope khác nhau của tiểu cầu được hoạt hóa được nhận dạng bằng phương pháp tế bào học dòng chảy bằng cách sử dụng hai kháng thể: một loại đặc hiệu cho tiểu cầu (nghĩa là GP IIb hoặc GP IIb/IIIa) và một loại đặc hiệu để hoạt hóa tiểu cầu (P-Selectin) [69].
F.4.3 Hình ảnh gamma của tiểu cầu phóng xạ
Phát xạ gamma cao của đồng vị phóng xạ 111ln cho phép nó được sử dụng cho mục đích này [46] [47] [50] [72]. Phương pháp này cho phép định vị và định lượng tiểu cầu lắng trên một trang thiết bị. Kỹ thuật này rất hữu ích cho các trang thiết bị truyền bên ngoài cơ thể cũng như các trang thiết bị cấy ghép.
F.4.4 Ngưng tập tiểu cầu
Sự ngưng tập tiểu cầu [74] được tạo ra bằng cách thêm các yếu tố gây ngưng tập (ví dụ: ADP, epinephrine, collagen và thrombin) vào huyết tương giàu tiểu cầu (PRP) đang được khuấy liên tục. Khi các tiểu cầu ngưng tập lại, huyết tương sẽ dần dần trở nên trong hơn. Một hệ thống quang học (máy đo ngưng tập tiểu cầu) được sử dụng để phát hiện sự thay đổi trong truyền ánh sáng và một máy ghi hiển thị bằng đồ họa các biến đổi độ truyền ánh sáng từ cài đặt đường nền. Sự ngưng tập tiểu cầu bị chậm hoặc bị giảm có thể do hoạt hóa tiểu cầu và tạo hạt, tăng FDP hoặc một số loại thuốc (ví dụ: aspirin, các loại thuốc chống viêm nhiễm không phải steriot). Điều quan trọng phải ghi nhớ là sự ngưng tập tiểu cầu sử dụng một số tác nhân khác nhau hoặc có thể không có trong một số loài động vật. Sự ngưng tập tiểu cầu tự phát, xảy ra trong trường hợp khi không thêm chất kích thích là một điều kiện bất thường cho thấy hoạt hóa tiểu cầu. Ngưng hợp tiểu cầu cũng có thể được sàng lọc bằng phương pháp WU/HOAK [79].
F.5 Huyết học
F.5.1 Trạng thái bạch cầu và hình thái
Sự thay đổi trạng thái hoạt hóa bạch cầu có thể được xác định bằng phương pháp tế bào học dòng chảy để đánh giá các dấu hiệu tăng bạch cầu, như L-selectin và CD 11b, và bằng sự rối loạn về lượng trong nhóm tế bào lympho. Cũng có thể đánh giá hoạt hóa bạch cầu thông qua đánh giá các thay đổi hình thái của bạch cầu trải qua khi được hoạt hóa trên bề mặt trang thiết bị y tế. Điều này thường được thực hiện thông qua SEM [173].
F.5.2 Đánh giá sự kết dính của tế bào máu
Sự kết dính tế bào máu [167] là thước đo khả năng tương thích máu của vật liệu khi được xem xét kết hợp với thuyên tắc ngoại biên hoặc bằng chứng hoạt hóa một hoặc nhiều yếu tố huyết học. Bằng phương pháp như vậy, người ta đã báo cáo [167] rằng sự kết dính của các tế bào lympho ngoại vi và PMN của các loài chó được bọc bằng poly (hydroxyethyl methacrylate) (PHema) thấp hơn so với các hạt được phủ bằng polystyrene và một số polyme khác. Tế bào lympho và PMN đơn độc được sử dụng trong nghiên cứu này.
F.5.3 Phức hợp bạch cầu tiểu cầu (PLC)
PLC có thể được đo bằng phương pháp tế bào học dòng chảy và có thể là một chỉ số hoạt hóa tế bào bạch cầu và tiểu cầu sau khi tiếp xúc với các trang thiết bị và vật liệu y tế [85].
F.6 Hệ thống bổ thể
F.6.1 Đánh giá hoạt hóa bổ thể của Bb, C3bBb và C5a
Trong số ba protein bổ thể này, đoạn C5a được coi là một trong những yếu tố bổ thể quan trọng nhất trong việc hoạt hóa bổ thể liên quan đến trang thiết bị tiếp xúc với máu [145]. Tuy nhiên, thử nghiệm thường quy đối với C5a là không bắt buộc do độ nhạy thấp của bộ dụng cụ ELISA có bán trên thị trường để đánh giá in vitro của protein này.
Phụ lục G
(tham khảo)
Các phép thử không được khuyến nghị
G.1 Quy định chung
Các thử nghiệm được nêu trong Bảng G.1 dưới đây là các thử nghiêm thường không được các cơ quan có thẩm quyền sử dụng hoặc chấp nhận như là một phần của đánh giá tiền lâm sàng trong đánh giá an toàn trang thiết bị y tế tiếp xúc với máu. Các thử nghiệm này được coi là lỗi thời hoặc không đủ/không có giá trị khoa học áp dụng cho các đánh giá đó.
Bảng G.1 - Các phép thử không được sử dụng trong đánh giá tiền lâm sàng về an toàn trang thiết bị y tế
| Phép thử theo loại | |
| Khả năng tương hợp máu in vitro | |
| Đông máu | APTT, PT và TT |
| Tiểu cầu | thời gian chảy máu mẫu, tuổi thọ tiểu cầu (sống sót) |
| Huyết học | số lượng hồng cầu lưới |
| Hệ thống bổ thể | CH-50, chuyển đổi C3, chuyển đổi C5 |
G.2 Đông máu
G.2.1 Thời gian thromboplastin từng phần được hoạt hóa (APTT), thời gian prothrombin (PT) và thời gian thrombin (TT)
Những phép thử này thường đo các rối loạn đông máu thông thường liên quan đến mức độ bất thường của các yếu tố đông máu của bệnh nhân.
Thuốc thử thromboplastin từng phần sử dụng các chất hoạt hóa khác nhau, như kaolin hoặc celite, có sẵn trên thị trường. Sử dụng các thuốc thử này, thử nghiệm được gọi là thời gian thromboplastin từng phần được hoạt hóa (APTT). APTT hiếm khi hữu ích trong việc đánh giá in vitro các đặc tính gây huyết khối của các trang thiết bị/vật liệu tiếp xúc với máu vì các chất hoạt hóa che dấu mọi hoạt hóa gây ra bởi trang thiết bị hoặc vật liệu thành phần của nó.
Chúng không được sử dụng chung trong đánh giá các trang thiết bị y tế và/hoặc vật liệu tiếp xúc với máu.
G.3 Tiểu cầu
G.3.1 Thời gian chảy máu
Tính khả dụng thương mại của một trang thiết bị dùng một lần vô trùng để tạo ra vết rạch da có độ sâu và chiều dài tiêu chuẩn trong điều kiện tiêu chuẩn đã cải thiện đáng kể độ tái lập và giá trị của thử nghiệm này [67]. Một kết quả kéo dài cho thấy chức năng tiểu cầu giảm hoặc số lượng tiểu cầu giảm; số lượng tiểu cầu giảm có thể được xác định riêng. Thời gian chảy máu kéo dài kết hợp với số lượng tiểu cầu bình thường đã được quan sát cùng với một số trang thiết bị truyền bên ngoài cơ thể với độ phơi nhiễm hạn chế (ví dụ: tim phổi nhân tạo) [158]. Các thử nghiệm phù hợp để sử dụng với một số động vật thí nghiệm. Đo thời gian chảy máu in vitro cũng phù hợp. Thử nghiệm này không được sử dụng trong đánh giá các trang thiết bị y tế và/hoặc vật liệu tiếp xúc với máu.
G.3.2 Tuổi thọ của tiểu cẩu
Sự phát xạ gamma cao của tiểu cầu 111ln thu được từ máu bệnh nhân và được đánh dấu với các đồng vị phóng xạ 51Cr hoặc 111ln [46] [15] [72] [148]. Cả hai nguyên tố này đều đánh dấu tiểu cầu ở tất cả các độ tuổi có trong mẫu, không rửa giải quá mức từ tiểu cầu và không được các tế bào khác đưa lên hoặc tái sử dụng trong quá trình tạo huyết khối. 111ln có lợi thế là một máy phát gamma cao, yêu cầu ghi nhãn ít tiểu cầu hơn và cho phép đếm cơ thể bề mặt để đánh giá sự lắng đọng tiểu cầu cục bộ được kết hợp với nghiên cứu tuổi thọ. Tuổi thọ tiểu cầu giảm cho thấy loại bỏ nhanh khỏi hệ tuần hoàn bằng các quá trình miễn dịch, huyết khối hoặc các quá trình khác. Thử nghiệm này không được khuyến nghị trong đánh giá phi lâm sàng các trang thiết bị y tế và/hoặc vật liệu tiếp xúc với máu.
G.4 Huyết học
G.4.1 Đếm hồng cầu lưới
Đếm hồng cầu lưới tăng cao cho thấy sự sản xuất hồng cầu trong tủy xương. Điều này có thể là để đáp ứng với giảm khối lượng hồng cầu do mất máu trường diễn (chảy máu), tan huyết hoặc các cơ chế khác [55] [77] [111]. Phép thử này không được sử dụng trong đánh giá các trang thiết bị y tế và/hoặc vật liệu tiếp xúc với máu.
G.5 Hệ thống bổ thể
G.5.1 Đánh giá hoạt hóa bổ thể của CH-50, chuyển đổi C3, chuyển đổi C5
Sự giảm CH-50 là chỉ thị của tổng mức tiêu thụ bổ thể. Mức độ cao của bất kỳ thành phần bổ thể nào cho thấy hoạt hóa hệ thống bổ thể. Một số vật liệu hoạt hóa bổ thể và hoạt hóa các thành phần bổ thể lần lượt hoạt hóa bạch cầu, gây ngưng tập bạch cầu và bị cô lập trong phổi [129] [130] [132] [137].
Phép đo các sản phẩm tách bổ thể có nhược điểm về đặc hiệu loài và mức độ nền cao khi được thực hiện sau khi thử nghiệm in vitro. Phương pháp CH-50 cổ điển có ích với huyết thanh người, bò, nhím và thỏ.
Một phương pháp chức năng khác để đo hoạt hóa bổ thể in vitro là sự hình thành bổ thể chuyển đổi C3- hoặc C5-, được xác định bằng quá trình biến đổi chất. Hiện có bộ dụng cụ ELISA thương mại có sẵn cho các thành phần bổ thể quan trọng.
Các thử nghiệm này nói chung không được sử dụng trong đánh giá hoạt hóa bổ thể các trang thiết bị và/hoặc vật liệu y tế tiếp xúc với máu.
Thư mục tài liệu tham khảo
Tiêu chuẩn quốc tế
[1] ISO 3826-3, Plastics collapsible containers for human blood and blood components - Part 3: Blood bag systems with integrated features (Hộp đựng bằng nhựa có thể đóng mở cho các thành phần máu và máu người - Phần 3: Hệ thống túi máu với các tính năng tích hợp)
[2] ISO 5840 (tất cả các phần), Cardiovascular implants - Cardiac valve prostheses (Cấy ghép tim mạch - Chân giả van tim)
[3] ISO 5841-3, Implants for surgery - Cardiac pacemakers - Part 3: Low-profile connectors (IS-1) for implantable pacemakers (Cấy ghép cho phẫu thuật - Máy tạo nhịp tim - Phần 3: Đầu nối cấu hình thấp (IS-1) cho máy tạo nhịp tim cấy ghép)
[4] ISO 7198, Cardiovascular implants and extracorporeal systems - Vascular prostheses - Tubular vascular grafts and vascular patches (Cấy ghép tim mạch và hệ thống ngoại bào - Chân giả mạch máu - Ghép mạch máu hình ống và các miếng vá mạch)
[5] ISO 7199, Cardiovascular implants and artificial organs - Blood-gas exchangers (oxygenators) (Cấy ghép tim mạch và các cơ quan nhân tạo - Bộ trao đổi khí máu (thiết bị trao đổi oxy))
[6] ISO 10993 (tất cả các phần), Biological evaluation of medical devices (Đánh giá sinh học của các trang thiết bị y tế)
[7] ISO 12891-1, Retrieval and analysis of surgical implants - Part 1: Retrieval and handling (Lấy lại và phân tích cấy ghép phẫu thuật - Phần 1: Lấy lại và xử lý)
[8] ISO 14708-2, Implants for surgery - Active implantable medical devices - Part 2: Cardiac pacemakers (Cấy ghép để phẫu thuật - Trang thiết bị y tế cấy ghép tích cực - Phần 2: Máy tạo nhịp tim)
[9] ISO 14708-5, Implants for surgery - Active implantable medical devices - Part 5: Circulatory support devices (Cấy ghép để phẫu thuật - Trang thiết bị y tế cấy ghép tích cực - Phần 5: Thiết bị hỗ trợ tuần hoàn)
[10] ISO 15674, Cardiovascular implants and artificial organs - Hard-shell cardiotomy/venous reservoir systems (with/without filter) and soft venous reservoir bags (Cấy ghép tim mạch và các cơ quan nhân tạo - Hệ thống lưu trữ tim cứng/hệ thống hồ chứa tĩnh mạch (có/không có bộ lọc) và túi chứa tĩnh mạch mềm)
[11] ISO 15675, Cardiovascular implants and artificial organs - Cardiopulmonary bypass systems - Arterial blood line filters (Cấy ghép tim mạch và các cơ quan nhân tạo - Hệ thống bắc cầu tim phổi - Bộ lọc dòng máu động mạch)
[12] ISO/IEC 17025, General requirements for the competence of testing and calibration laboratories (Yêu cầu chung về năng lực của các phòng thử nghiệm và hiệu chuẩn)
[13] ISO 8637, Cardiovascular implants and extracorporeal systems - Haemodialysers, haemodiafilters, haemofilters and haemoconcentrators (Cấy ghép tim mạch và hệ thống ngoại bào - Haemodialysers, haemodiafilters, haemofilters và haemoconcentrators)
Tiêu chuẩn quốc gia
[14] Guidelines for blood/material interactions. Report of the National Heart, Lung, and Blood Institute Working Group, U.S. Department of Health and Human Services, Public Health Service, National Institutes of Health. NIH Publication No. 85-2185, revised September 1985. Available from Biomaterials Program, Bioengineering Research Group, Division of Heart and Vascular Diseases, NHLBI, Two Rockledge Center, 6701 Rockledge Drive, Bethesda, MD 20892, USA
[15] Harker L.A., Ratner B.D., Didisheim P. eds. Cardiovascular Biomaterials and Biocompatibility. Supplement to Cardiovasc. Pathol. 2 (3). Suppl, Jul-Sept 1993, pp. 1S-224S.
[16] ANSI/AAMI RD16. Hemodialyzers, hemodiafilters, and hemoconcentrators. In: International Organization for Standardization and Association for the Advancement of Medical Instrumentation, editor. Cardiovascular implants and artificial organs. American National Standards Institute; 2007. p. 30
[17] ASTM F756-13, Standard practice for assessment of hemolytic properties of materials
[18] ASTM F1984-99, Standard practice for testing whole blood complement activation in serum by solid materials
[19] ASTM F2065-00E1, Standard practice for testing for alternative pathway complement activation in serum by solid materials
[20] ASTM E2524-08(2013), Standard test method for analysis of hemolytic properties of nanoparticles
[21] GB/T 16175, Biological evaluation test methods for medical organic silicon materials
[22] MHLW Notification by Director, OMDE, Yakushokuki-hatsu 0301 No. 20, March 1, 2012, Basic Principles of Biological Safety Evaluation Required for Application for Approval to Market Medical Devices
[23] ASTM 2382, Standard test method for assessment of intravascular medical device materials on partial thromboplastin time (PTT)
[24] ASTM F2888-13, Standard test method for platelet leukocyte count - An in-vitro measure for haemocompatibility assessment of cardiovascular materials
[25] Anticoagulant Sodium Xitrate Solution U.S.P. In: Larry Callahan, editor, USP 28: (USP Citric Acid RS); Assay, U.S. Pharmacopeia; 2006d. p 168; PF 31(3), p. 731
[26] NIH. Public Health Service Policy on Humane Care and Use of Laboratory Animals; Health Research Extension Act of 1985: Public Law 89-544. In: Office of Extramural Research; OLAW, editor. Office of Laboratory Animal Welfare; 2002. (a/k/a OLAW, 2002)
[27] USDA. 9 CFR: Code of Federal Regulations: Chapter 1; Subchapter A - Animal Welfare. In: Animal Welfare Information Center U, editor. Government Printing Office; 2004
[28] NIH. Evaluation of hemodialyzers and dialysis membranes. Report of a Study Group for the Artificial Kidney-Chronic Uremia Program NIAMDD-1977. Chapter two. In vitro characterization of hemodialyzers. Artif. Organs. 1977, 1 (2) pp. 59-77
[29] ASTM F1830-97, Standard practice for selection of blood for in vitro evaluation of blood pumps
[30] ASTM F1841-97, Standard practice for assessment of haemolysis in continuous flow blood pumps
Tài liệu hướng dẫn của FDA Hoa Kỳ
[31] CDRH. Class II special controls guidance document for certain percutaneous transluminal coronary angioplasty (PTCA) catheters-Document No. 1605. In: Office of Device Evaluation (ODE); Division of Cardiovascular Devices; Interventional Cardiology Devices Branch, editor. DRAFT guidance for industry and FDA staff: FDA; 2008. p. 34
[32] CDRH. Class II special controls guidance document: indwelling blood gas analyzers - Document No. 1126. In: Office of Device Evaluation (ODE); Division of Cardiovascular and Respiratory Devices; Anesthesiology and Respiratory Devices Branch, editor. Final guidance for industry and FDA staff: FDA; 2001. p. 16
[33] CDRH. Coronary drug-eluting stents: nonclinical and clinical studies. In: Center for Devices and Radiological Health (CDRH); Center for Drug Evaluation and Research (CDER); and Office of Combination Products (OCP), editor. DRAFT guidance for industry: FDA; 2008. p. 89
[34] CDRH. Coronary drug-eluting stents: nonclinical and clinical studies-Companion Document No. 6255. In: Center for Devices and Radiological Health (CDRH); Center for Drug Evaluation and Research (CDER); and Office of Combination Products (OCP), editor. DRAFT guidance for industry: FDA; 2008. p. 32
[35] CDRH. Guidance for annuloplasty rings 510(k) submissions-Document No. 1358. In: Office of Device Evaluation (ODE); Division of Cardiovascular and Respiratory Devices; Circulatory Support and Prosthetic Devices Branch, editor. Final guidance for industry and FDA staff: FDA; 2001. p. 17
[36] CDRH. Guidance for cardiopulmonary bypass arterial line blood filter 510(k) submissions - Document No. 1622. In: Office of Device Evaluation (ODE); Division of Cardiovascular Respiratory and Neurology Devices; Circulatory Support and Prosthetic Devices Branch, editor. Final guidance for industry and FDA staff: FDA; 2000. p. 8
[37] CDRH. Guidance for cardiopulmonary bypass oxygenators 510(k) submissions - Document No. 1361. In: Office of Device Evaluation (ODE); Division of Cardiovascular and Respiratory Devices; Circulatory Support and Prosthetic Devices Branch, editor. Final guidance for industry and FDA staff: FDA; 2000. p. 23
[38] G95-1. 1997 Blue Book Memorandum: Use of International Standard ISO-10993, “Biological Evaluation of Medical Devices Part 1: Evaluation and Testing” (Replaces #G87- 1 #8294). FDA <http:// www.fda .gov/ MedicalDevices/ DeviceRegulationandGuidance/ GuidanceDocuments/ucm080735 .htm>. Accessed 04/15/ 2010
[39] Tripartite Subcommittee for Medical Devices. Tripartite Biocompatibility Guidance for Medical Devices. In: Office of Device Evaluation (ODE) in FDA's Center for Devices and Radiological Health (CDRH), editor. General Program Memorandum #G87-1. FDA; 1986
[40] FDA. 21 CFR 58(b) (3): Good Laboratory Practices (GLP) for Non-Clinical Laboratory Studies, In: Department of Health and Human Services, editor. Volume 1, Code of Federal Regulations. FDA; 2004
[41] Implanted Blood Access Devices for Hemodialysis - Draft Guidance for Industry and Food and Drug Administration staff. January 21, 2016, available at http:// www.fda.gov/ ucm/ groups/ fdagov -public/© fdagov -meddev -gen/ documents/ document/ ucm308598 .pdf
Chứng huyết khối
[42] Bosch T., Schmidt B., Blumenstein M., Gurland H.J. Thrombogenicity markers in clinical and ex vivo assessment of membrane biocompatibility. Contrib. Nephrol. 1987, 59 pp. 90-98
[43] CHANDLER A.B. In vitro thrombotic coagulation of the blood; a method for producing a thrombus. Lab. Invest. 1958, 7 (2) pp. 110-114
[44] Cooper S.L., Fabrizius D.J., Grasel T.G. Methods of assessment of thrombosis ex vivo. Ann. N. Y. Acad. Sci. 1987, 516 pp. 572 585
[45] Corriveau D.M., & F ritsma G.A. Hemostasis and thrombosis in the clinical laboratory. Lippincott, Philadelphia, 1988, p.
[46] Dewanjee M.K. Methods of assessment of Thrombosis in vivo. In: Blood in contact with natural and artificial surfaces: Annals of the New York Academy of Sciences, (Leonard E.F., Turitto V.T., Vroman L. eds.). New York Academy of Sciences, New York, N.Y., 1987, pp. 541-71.
[47] Dewanjee M.K., K apadvanjwala M., Sanchez A., Elson R., Serafini A N., Zilleruelo G.E. Quantitation of comparative thrombogenicity of dog, pig, and human platelets in a hemodialyzer. ASAIO J. 1992, 38 (2) pp. 88-90
[48] Didisheim P., Olsen D.B., Farrar D.J., Portner P.M., G riffith B.P., Pennington D.G. Infections and thromboembolism with implantable cardiovascular devices. ASAIO Trans. 1989, 35 (1) pp. 54-70
[49] Grotemeyer K.H., Viand R., Beykirch K. [Thrombocyte function in vasomotor and migraine headaches]. Dtsch. Med. Wochenschr. 1983, 108 (20) pp. 775-778
[50] Harker L.A., Kelly A.B., Hanson S.R. Experimental arterial thrombosis in nonhuman primates. Circulation. 1991, 83 (6) pp. IV41-IV55
[51] Hoch J.R., & Silver D. Hemostasis and Thrombosis. In: Moore WS, editor. Vascular Surgery: A Comprehensive Review. 3rd ed. Philedelphia: W. B. Saunders; 1991. pp. 63-79
[52] Kay L. Essentials of Haemostasis and Thrombosis. Churchill Livingstone, Edinburgh, 1988, p.
[53] Lewis J., Sweeney J., Baldini L., Friedland G.H., Salzman E.W. Assessment of thromboresistance of intravenous cannulae by 125l-fibrinogen scanning. J. Biomed. Mater. Res. 1985, 19 (2) pp. 99-113
[54] Zingg W., Ip W.F., Sefton M .V., M ancer K. A chronic arteriovenous shunt for the testing of biomaterials and devices in dogs. Life Support Syst. 1986, 4 (3) pp. 221-229
Đông máu
[55] Henry J.B. Haematology and Coagulation. In: Clinical Diagnosis and Management By Laboratory Methods. (Henry J.B. ed.). W. B. Saunders, Philadelphia, Eighteenth Edition, 1991, pp. 556-603.
[56] Brummel-Ziedens K.E., Orfeo T., Rosendaal F.R., Undas A., Rivard G.E., Butenas S. Empirical and theoretical phenotype discrimination. J. Thromb. Haemost. 2009, 7 (1) pp. 181-186
[57] Brummel-Ziedens K.E., Vossen C.Y., Rosendaal F.R., Umezaki K., M ann K.G. The plasma hemostatic proteome: thrombin generation in healthy individuals. J. Thromb. Haemost. 2005, 3 pp. 1472-1481
[58] Boisclair M.D., L ane D.A., Wilde J.T., Ireland H., Preston F.E., Ofosu F.A A comparative evaluation of assays for markers of activated coagulation and/or fibrinolysis: thrombinantithrombin complex, D-dimer and fibrinogen/fibrin fragment E antigen. Br. J. Haematol. 1990, 74 (4) pp. 471-479
[59] Pelzer H., Schwarz A., Heimburger N. Determination of human thrombin-aniithrombin III complex in plasma with an enzyme-linked immunosorbent assay. Thromb. Haemost. 1988, 59 (1) pp. 101-106
[60] Sommeijer D.W., Van Oerle R., Reitsma P.H., Timmerman J.J., Meijers J.C., Spronk H.M., Cate H.T. Analysis of blood coagulation in mice: pre-analytical conditions and evaluation of a homemade assay for thrombin-antithrombin complexes. Thromb. J. 2005, 3 p. 12
[61] Gatt A., van Veen J.J., Woolley A.M., Kitchen S., Cooper P., Makris M. Thrombin generation assays are superior to traditional tests in assessing anticoagulation reversal in vitro. Thromb. Haemost. 2008, 100 pp. 350-355
[62] Hemker H.C., Giesen P., AI Dieri R., Regnault V., de Smedt E., Wagenvoord R. Calibrated automated thrombin generation measurement in clotting plasma. Pathophysiol. Haemost. Thromb. 2003, 33 pp. 4-15
[63] Hemker H.C., Giesen P., AIDieri R., Reanault V., de Smed E., Wagenvoord R. The calibrated automated thrombogram (CAT): a universal routine test for hyper- and hypocoagulability. Pathophysiol. Haemost. Thromb. 2002, 32 pp. 249-253
[64] Gaffney P.J., Edgell T., Creighton-Kempsford L.J., Wheeler S., Tarelli E. Fibrin degradation product (PnDP) assays: analysis of standardization issues and target antigens in plasma. Br. J. Haematol. 1995 May, 90 (1) pp. 187-194
[65] Nieuwenhuizen W. A reference material for harmonisation of D-dimer assays. Fibrinogen subcommittee of the Scientific and Standardization Committee of the International Society of Thrombosis and Hemostasis. Thromb. Haemost. 1997, 77 pp. 1031-1033
[66] Spannagl M., Haverkate F., Reinauer H., Meijer P. The performance of quantitative D- dimer assays in laboratory routine. Blood Coagul. Fibrinolysis. 2005, 16 pp. 439-443
[67] Lethagen S., & K ling S. New bleeding time devices with retractable blades evaluated in children, healthy volunteers and patients with prolonged bleeding time. Thromb. Haemost. 1993 Oct 18, 70 (4) pp. 595-597
[68] Kottke-Marchant K. Performance and interpretation of routine coagulation assays. In: Laboratory Haematology Practice. Wiley. Blackwell, Oxford, England, May 15, 2012, pp. 420-34
Tiểu cầu
[69] Chignier E., Parise M., M cgregor L., Delabre C., Faucompret S., M cgregor J. A P- selectin/CD62P monoclonal antibody (LYP-20), in tandem with flow cytometry, detects in vivo activated circulating rat platelets in severe vascular trauma. Thromb. Haemost. 1994, 72 (5) pp. 745-749
[70] Goodman S.L., Lelah M.D, Lambrecht L.K., Cooper S.L., Albrecht R.M. In vitro vs. ex vivo platelet deposition on polymer surfaces. Scan. Electron Microsc. 1984, (Pt 1) pp. 279-290
[71] Goodman S.L., Cooper S.L., Albrecht R.M. Activation of platelets from humans, canines, and macaques on polymer surfaces. In: Nosé Y, Kjellstrand C.M., Ivanovich P., International Society for Artificial Organs. World Congress, editors. Progress in artificial organs, 1985. Cleveland: ISAO Press; 1986. p. xxi, 1204
[72] ICSH. Recommended method for indium-111 platelet survival studies, international Committee for Standardization in Haematology. Panel on Diagnostic Applications of Radionuclides. J. Nucl. Med. 1988, 29 (4) pp. 564-566
[73] Karwath R., Schurer M., W olf H. Measurement o f p latelet adhesiveness o nto artificial surfaces using Cr-51 and In-111 labeled platelets, Studia Biophysica. 1989, 131 pp. 117-123
[74] Kundu S.K., Heilmann E.J., Sio R., Garcia C., Ostgaard R.A. Characterization of an In vitro Platelet Function Analyzer, PFA-100TM. Clin. Appl. Thromb. Hemost. 1996, 2 (4) pp. 241-249
[75] Kunicki T.J., Tuccelli M., Becker G.A., Aster R.H. A study of variables affecting the quality of platelets stored at “room temperature”. Transfusion. 1975, 15 (5) pp. 414-421
[76] Lewis S.M., Rowan R.M., Kubota F. Evaluation of a prototype for a reference platelet counter. J. Clin. Pathol. 1990, 43 (11) pp. 932-936
[77] NCCLS. Methods for reticulocyte counting (Flow cytometry and supervitwal dyes); Approved Guideline (H44-A, Vol. 17 No. 15). Volume H44-A, Vol. 17. Clinical and Laboratory Standards Institute; 1997
[78] Palatianos G.M., Dewanjee M.K., Robinson R.P., Novak S., Dewanjee P.K., Kapadvanjwala M., Hsu L.C., Sfakianakis G.N., Kaiser G-A. Quantitation of platelet loss with indium-111 labeled platelets in a hollow-fiber membrane oxygenator and arterial filter during extracorporeal circulation in a pig model. ASAIO Trans. 1989, 35 (3) pp. 667-670
[79] Wu K.K., & Hoak J.C. A new method for the quantitative detection of platelet aggregates in patients with arterial insufficiency. Lancet. 1974, 2 (7886) pp. 924-926
[80] Zingg W., Ip W.F., Sefton M.V., M ancer K. A chronic arteriovenous shunt for the testing of biomaterials and devices in dogs. Life Support Syst. 1986, 4 (3) pp. 221-229
[81] Best Collaborative. Platelet radiolabelling procedure: The Biomedical Excellence for Safer Transfusion (BEST) Collaborative. Transfusion. 2006, 46 () pp. 59-66
[82] Holme S., Heaton A., Roodt J. Concurrent label method with 111ln and 51Cr allows accurate evaluation of platelet viability of stored concentrates. Br. J. Haematol. 1993, 84 pp. 717-723
[83] Fushimi F., Nakayama M., N ishimura K., Hiyoshi T. Platelet adhesion, contact phase coagulation activation, and C5a generation of polyethylene glycol acid-grafted high flux cellulosic membrane with varieties of grafting amounts. Artif. Organs. 1998 Oct, 22 (10) pp. 821-826
[84] Tamada Y., Kulik E., Ikada Y. Simple method for platelet counting, in Biomaterials, Vol 16, Issue 3, 1995, pp. 259-261
[85] Gorbet M.B., & Sefton M.V. Biomaterial-associated thrombosis: roles of coagulation factors, complement, platelets and leukocytes, Maud B. Gorbet, Michael V. Sefton, in Biomaterials 25 (2004), pp. 5681-5703
[86] Kottke-Marchant K. Clinical perspectives on platelet function testing. Medical Laboratory Observer, May, 44(5): 8-14 (2012)
[87] Anderson J.M., & Kottke-Marchant K. Platelet interactions with biomaterials and artificial devices. CRC Critical Reviews in Biocompatibility. 1985, 1 pp. 111-204
[88] Schmidt V., & Hilberg T. ThromboFix platelet stabilizer: advances in clinical platelet analyses by flow cytometry? Platelets. 2006 Jun, 17 (4) pp. 266-273
[89] Hu H., Daleskog M., Li N. Influences of fixatives on flow cytometric measurements of platelet P-selectin expression and fibrinogen binding. Thromb. Res. 2000 Nov 1, 100 (3) pp. 161-166
[90] Muriithi E.W., Belcher P.R., M enys V.C., Chaudhry M.A., R aco L., Day S.P. Quantitative detection of platelet aggregates in whole blood without fixation. Platelets. 2000 Feb, 11 (1) pp. 33-37
[91] Macey M., Azam U., McCarthy D., Webb L., Chapman E.S., Okrongly D. Evaluation of the anticoagulants EDTA and xitrate, theophylline, adenosine, and dipyridamole (CTAD) for assessing platelet activation on the ADVIA 120 haematology system. Clin. Chem. 2002 Jun, 48 (6 Pt1) pp. 891-899
[92] Dimitrievska S., M aire M., D iaz-Quijada G.A., Robitaille L., Ajji A., Y ahia L. Low thrombogenicity coating of nonwoven PET fiber structures for vascular grafts. Macromol. Biosci. 2011 Apr 8, 11 (4) pp. 493-502
[93] De Somer F., Van Belleghem Y., Foubert L., Frangois K., Dubrulle F., De Wolf D. In vivo evaluation of a phosphorylcholine coated cardiopulmonary bypass circuit. J. Extra Corpor. Technol. 1999 Jun, 31 (2) pp. 62-66
[94] Cenni E., Granchi D., Verri E., Cavedagna D., Gamberini S., Falsone G. CD62, thromboxane B2, and beta thromboglobulin: a comparison between different markers of platelet activation after contact with biomaterials. J. Biomed. Mater. Res. 1997 Sep 5, 36 (3) pp. 289-294
Huyết học (bao gồm cả tan huyết)
[95] Coldman M.F., Gent M., Good W. The identical effect of electrolyte and non-electrolyte on the osmotic fragility of mammalian erythrocytes. Comp. Biochem. Physiol., 1970, Pergamon Press, printed in Great Britain, Vol. 33, pp. 157-165
[96] Coldman M.F., Gent M., G ood W. Relationships between osmotic fragility and other speciesspecific variables of mammalian erythrocytes, Comp. Biochem. Physiol., 1970, Pergamon Press, printed in Great Britain, Vol. 34, pp. 759-772
[97] Matsuzawa T., Ikarashi Y. Haemolysis of various mammalian erythrocytes in sodium chloride, glucose and phosphate-buffer solutions. Lab. Anim. 1979, 13 pp. 329-331
[98] Coldman M.F., Gent M., Good W. The osmotic fragility of mammalian erythrocytes in hypotonic solutions of sodium chloride. Comp. Biochem. Physiol., 1969, Pergamon Press, printed in Great Britain, Vol. 31, pp. 605-609
[99] AABB. Standards for blood banks and transfusion services. In: AABB Committee on Standards, editor. Washington, DC: American Association of Blood Banks 1994. p. v
[100] Bednar R., Bayer P.M. C orrection: m easurements o f p lasma h emoglobin. C lin. C hem. 1993, 39 (9) pp. 2027-2028
[101] Council of Europe. Recommendation No. R (95) 15: Guide to the preparation, use and quality assurance of blood components. In: Committee of Ministers to Member States, editor. 13th ed. 13th ed. Strasbourg: Council of Europe Pub.; 2007. p. 271
[102] Cripps C.M. Rapid method for the estimation of plasma haemoglobin levels. J. Clin. Pathol. 1968, 21 (1) pp. 110-112
[103] EDQM. Sterile plastic containers for human blood and blood components (3.2.3). European Pharmacopoeia 5.0: European Directorate for the Quality of Medicines and Healthcare; 1997b. pp. 175-179
[104] Fairbanks V.F., Ziesmer S.C., O’Brien P.C. M ethods f or m easuring p lasma h emoglobin in micromolar concentration compared. Clin. Chem. 1992, 38 (1) pp. 132-140
[105] Harboe M. A method for determination of hemoglobin in plasma by near-ultraviolet spectrophotometry. Scand. J. Clin. Lab. Invest. 1959, 11 (1) pp. 66-70
[106] Henry J.B Haematology and Coagulation. In: Clinical Diagnosis and Management by Laboratory Methods. (Henry J.B. ed.). W. B. Saunders, Philadelphia, Eighteenth Edition, 1991, pp. 556-603.
[107] Lammers M., Gressner A.M. Immunonephelometric quantification of free haemoglobin. J. Clin. Chem. Clin. Biochem. 1987, 25 (6) pp. 363-367
[108] Lampert R.H., Williams M.C. Effect of surface materials on shear-induced haemolysis. J. Biomed. Mater. Res. 1972, 6 (6) pp. 499-532
[109] Malinauskas R.A. Plasma hemoglobin measurement techniques for the in vitro evaluation of blood damage caused by medical devices. Artif. Organs. 1997, 21 (12) pp. 1255-1267
[110] Miale J.B. Laboratory medicine, haematology. St. Louis: Mosby; 1982. [64] p. of plates; xi, 1084 pp
[111] Mosby Year Book. A Color Atlas of Comparative, Diagnostic and Experimental Haematology. Mosby-Year Book Europe Ltd, London, England, 1994
[112] Obeng E.K., Cadwallader D.E. In vitro dynamic method for evaluating the hemolytic potential of intravenous solutions. J. Parenter. Sci. Technol. 1989, 43 (4) pp. 167-173
[113] Offeman R.D., Williams M.C. Material effects in shear-induced haemolysis. Biomater. Med. Devices Artif. Organs. 1979, 7 (3) pp. 359-391
[114] OSHA. 29 CFR Regulation Part 1910: Occupational Safety and Health Standards - 1910.1030: Bloodborne pathogens. In: National Archives and Records Administration, editor. Washington, DC: US Department of Labor; 2008
[115] Reed K.W., Yalkowsky S.H. Lysis of human red blood cells in the presence of various cosolvents. J. Parenter. Sci. Technol. 1985, 39 (2) pp. 64-69
[116] SIGMA DIAGNOSTICS. Plasma Hemoglobin: Quantitative, colormetric determination in plasma at 600 nm (Procedure No. 527, April 1991). Sigma Diagnostics, St. Louis, MO, 1991
[117] Standefer J.C., Vanderjagt D. U se of tetramethylbenzidine in plasma hemoglobin assay. Clin. Chem. 1977, 23 (4) pp. 749-751
[118] Taulier A., Levillain P., Lemonnier A. Value of derivative spectrophotometry for the determination of plasma and urinary hemoglobin. Comparison with the method using Allen's correction], Ann. Biol. Clin. (Paris). 1986, 44 (3) pp. 242-248
[119] Kottke Marchant K. ed. Laboratory Haematology Practice. John Wiley & Sons, Ltd, Oxford, England, 2012
[120] Dudash L.A., Klingman F.L., Bastijanic J.M., Kottke March ant K., Marchant R.E. Crossreactivity of cell selective CRETAWAC peptide with human and porcine endothelial cells. J. Biomed. Mater. Res. A. 2014 Aug, 102 (8) pp. 2857-2863
[121] WHO. Recommended methods for the visual determination of white cells and platelet counts. In: Expert panel of Cytometry of the International Committee for Standardization in Haematology, editor. WHO/LAB/88.3: World Health Organization; 1988. p. 8
[122] Zwart A., Van Assendelft O.W., Bull B.S., England J.M., Lewis S.M., Zijlstra W.G. Recommendations for reference method for haemoglobinometry in human blood (ICSH standard 1995) and specifications for international haemiglobinocyanide standard (4th edition). J Clin Pathol 1996;49(4):271-4. (PREVIOUSLY CITED AS International Committee for Standardization in Haematology)
[123] Wennberg A., Hensten-Pettersen A. Sensitivity of erythrocytes from various species to in vitro hemolyzation. J. Biomed. Mater. Res. 1981, 15 (3) pp. 433-435
[124] Mueller M.R., & Schima H. In vitro hematological testing of rotary blood pumps: Remarks on standardization and data interpretation. Artif. Organs. 1993, 17 (2) pp. 103-110
[125] Lippi G., Blanckaert N., Bonini P., Green S., Kitchen S., Palicka V. Haemolysis: an overview of the leading cause of unsuitable specimens in clinical laboratories. Clin. Chem. Lab. Med. 2008, 46 pp. 764-772. Available at: http:// dx.doi .org/ 10 .1515/ CCLM .2008 .170
[126] Sharp M.K., & Mohammad S.F. Scaling of haemolysis in needles and catheters. Ann Biochem Engineer. 1998, 26 pp. 788-797
[127] Savory J., & Bill J.G. Haemolysis of specimens drawn in the ER [Q&A], Lab. Med. 1996, 27 p. 802
[128] Kennedy C., Angemuller S., King R. A comparison o f haemolysis r ates using intravenous catheters versus venipuncture tubes for obtaining blood samples. J. Emerg. Nurs. 1996, 22 pp. 566-569
Bổ sung
[129] Chenoweth D.E. Complement activation produced by biomaterials. ASAIO Trans. 1986, 32 (1) pp. 226-232
[130] Craddock P.R., Fehr J., Brigham K.L., Kronenberg R.S., Jacob H.S. Complement and leukocytemediated pulmonary dysfunction in hemodialysis. N. Engl. J. Med. 1977, 296 pp. 769-774
[131] Chenoweth D.E. Complement activation during hemodialysis: clinical observations, proposed mechanisms and theoretical implications. Artif. Organs. 1984, 8 pp. 231-287
[132] Hakim R.M., Breillatt J., Lazarus J.M., Port F.K. Complement activation and hypersensitivity reactions to dialysis membranes. N Engl. J. Med. 1984, 311 pp. 878-882
[133] Chenoweth D.E., Cooper S.W., Hugli T.E., Stewart R.W., Biackstone E.H., Kirlin J.W. Complement activation during cardiopulmonary bypass: evidence for generation of C3a and C5a anaphylatoxins. N. Engl. J. Med. 1981, 304 (9) pp. 497-503
[134] Velthuis H., Jansen P.G., Hack C.E., Eijsman L, Wildevuur C.R. Specific complement inhibition with heparin-coated extracorporeal circuits. Ann. Thorac. Surg. 1996, 61 pp. 1153-1157
[135] Fitch J.C., Rollins S., Matis L, Alford B. Pharmacology and biological efficacy of a recombinant, humanized, single chain antibody C5 complement inhibitor in patients undergoing coronary artery bypass surgery with cardiopulmonary bypass. Circulation. 1999, 100 pp. 2499-2506
[136] Hsu L.C. Heparin-coated cardiopulmonary bypass circuits: current status. Perfusion. 2001, 16 pp. 417-428
[137] Johnson R.J. 2013 ‘The complement system’, in Ratner B, Hoffman A, Schoen F, and Lemons J (eds), Biomaterials Science: An Introduction to Materials in Medicine, 3rd Ed., Oxford, UK, Elsevier Academic Press, 533-545
[138] Johnson R.J., Burhop K.E., Van Epps D.E. Infusion of ovine C5a into sheep mimics the inflammatory response of hemodialysis. J. Lab. Clin. Med. 1996, 127 pp. 456-469
[139] Neidhart P.P., Meier B., Polla B.S., Schifferli J.A., More! D.R. Fatal anaphylactoid response to protamine after percutaneous transluminal coronary angioplasty. Eur. Heart J. 1992, 13 (6) pp. 856-858
[140] Laroche D., Aimone-Gastin L, Dubois F. M echanisms o f s evere, i mmediate r eactions t o iodinated contrast material. Radiology. 1998, 209 (1) pp. 183-190
[141] Bergamaschini L., M annucci P.M., F ederici A.B., Coppola R., Guzzoni S., Agostini A. Posttransfusion anaphylactic reactions in a patient with severe von Willebrand disease: role of c omplement a nd a lloantibodies t o v on W illebrand f actor. J. L ab. C lin. M ed. 1 995, 125 (3) pp. 348-355
[142] Bergamaschini L., Santangelo T., Faricciotti A., Ciavarella N., Mannucci P.M., Agostoni A. Study of complement-mediated anaphylaxis in humans. The role of IgG subclasses (IgG1 and/or IgG4) in the complement-activating capacity of immune complexes. J. Immunol. 1996, 156 (3) pp. 1256-1261
[143] Wolf M.F., & A nderson J.M. Practical approach to blood compatibility assessments: general considerations and standards. In: Biocompatibility and performance of medical devices, (Boutrand J.-P. ed.). Woodhead Publishing Ltd, 2012
[144] Blajchman M.A., & Ozge-Anwar A H. The role of the complement system in hemostasis. Prog. Hematol. 1986, XIV pp. 149-182
[145] Johnson R.J. Complement activation during extracorporeal therapy: biochemistry, cell biology and clinical relevance. Nephrol. Dial. Transplant. 1994, 9 pp. 36-45
[146] Fiane A.E., Videm V., Lingaas P.S., Heggelund L, Nielsen E.W., Geiran O.R. Mechanism of complement activation and its role in the inflammatory response after thoracoabdominal aortic aneurysm repair. Circulation. 2003 Aug 19, 108 (7) pp. 849-856
[147] Speidl W.S., Katsaros K.M., K astl S.P., Zorn G., Huber K., M aurer G. c oronary I ate lumen loss of drug eluting stents is associated with increased serum levels of the complement components C3a and C5a. Atherosclerosis. 2010 Jan, 208 (1) pp. 285-289
Mô hình động vật
[148] Dewanjee M.K., Kapadvanjwala M., Sanchez A., Elson R., Serafini A.N., Zilleruelo G.E., Sfakianakis G.N. Quantitation of comparative thrombogenicity of dog, pig, and human platelets in a hemodialyzer. ASAIO J. 1992, 38 (2) pp. 88-90
[149] Didisheim P., Dewanjee M.K., Frisk C.S., Kaye M.P., Fass D.N. Animal Models for predicting clinical performance of biomaterials for cardiovascular use. In: Boretos J.W, Eden M., National Institutes of Health (U.S.), editors. Contemporary biomaterials: material and host response, linical applications, new technology, and legal aspects. Park Ridge, N.J., U.S.A.: Noyes Publications; 1984a. pp. 132-179
[150] Didisheim P., Stropp J.Q., Borowick J.H., Grabowski E.F. Species differences in platelet adhesion to biomaterials: Investigation by a two-stage technique. Trans. Am. Soc. Artif. Intern. Organs. 1979, 2 pp. 124-132
Chống đông máu
[151] EDQM. Anticoagulant and Preservative solutions for human blood: Anticoagulant acid-xitrateglucose solutions (ACD) and Anticoagulant xitrate-phosphate-glucose solution (CPD). European Pharmacopoeia 5.0: European Directorate for the Quality of Medicines and Healthcare; 1997a. pp. 400-403
[152] Anticoagulant Xitrate Dextrose Solution In U.S.P. Ian DeVeau, editor. USP 28: (USP Citric Acid RS); Assay for total xitrate. U.S. Pharmacopeia; 2006a. p 165; PF 31(3), p. 727
[153] Anticoagulant Xitrate Phosphate Dextrose U.S.P. In: Larry Callahan, editor. USP 28: (USP Citric Acid RS); Assay for total xitrate and total phosphate, U.S. Pharmacopeia; 2006b. p 165; PF 31(3), p. 730
[154] Anticoagulant Xitrate Phosphate Dextrose Adenine Solution U.S.P. In: Larry Callahan, editor. USP 28: (USP Citric Acid RS); Assay for total xitrate and total phosphate, U.S. Pharmacopeia; 2006c. p 166; PF 31(3), p. 728
[155] Anticoagulant Heparin Solution U.S.P. In: Biologies and Biotechnology-Blood and Blood Products Committee, editor. USP 11: (USP Endotoxin RS) Assay for heparin sodium; Assay for sodium chloride (RB 1-Oct-2009), U.S. Pharmacopeia; 2009
[156] Anticoagulant Sodium Xitrate Solution U.S.P. In: Larry Callahan, editor. USP 28: (USP Citric Acid RS); Assay. U.S. Pharmacopeia; 2006d. p 168; PF 31(3), p. 731
Bơm máu
[157] Mueller M.R., Schima H., Engelhardt H., Salat A., Olsen D.B., Losert U., Wolner E. In vitro hematological testing of rotary blood pumps: remarks on standardization and data interpretation. Artif. Organs. 1993, 17 (2) pp. 103-110
Phẫu thuật tim phổi
[158] Marker L.A., M alpass T.W., Branson H.E., Hessel E.A 2NDSIichter S.J. Mechanism of abnormal bleeding in patients undergoing cardiopulmonary bypass: acquired transient platelet dysfunction associated with selective alpha-granule release. Blood. 1980, 56 (5) pp. 824-834
[159] Moen O., Fosse E., Dregelid E., Brockmeier V., Andersson C., Hogasen K., Venge P., Mollnes T.E., Kierulf P. C entrifugal pump a nd heparin coating improves c ardiopulmonary bypass biocompatibility. Ann. Thorac. Surg. 1996, 62 (4) pp. 1134-1140
[160] Palatianos G.M., Dewanjee M.K., Robinson R.P., Novak S., Dewanjee P.K., Kapadvanjwala M., Hsu L.C., Sfakianakis G.N., Kaiser G.A. Quantitation of platelet loss with indium-111 labeled platelets in a hollow-fiber membrane oxygenator and arterial filter during extracorporeal circulation in a pig model. ASAIO Trans. 1989, 35 (3) pp. 667-670
Ống thông
[161] Leach K.R., Kurisu Y., Carlson J.E., Repa I., Epstein D.H., Rness M., Sahatjian R., Hunter D.W., Casteneda-Zuniga W.R., Amplatz K. Thrombogenicity of hydrophilically coated guide wires and catheters. Radiology. 1990, 175 (3) pp. 675-677
[162] Lee K.H., Han J.K., Byun Y, M oon H.T., Y oon C.J., Kim S.J., Choi B.l. Heparin-coated angiographic catheters: an in vivo comparison of three coating methods with different heparin release profiles. Cardiovasc. Intervent. Radiol. 2004, 27 (5) pp. 507-511
[163] Roberts G.M., Roberts E.E., Davies R.L., Lawrie B.W. Thrombogenicity of arterial catheters and guidewires. Br. J. Radiol. 1977, 50 (594) pp. 415-418
Chung
[164] Cao L, Chang M., Lee C.Y., C astner D.G., Sukavaneshvar S., Ratner B.D., Horbett T.A. Plasma-deposited tetraglyme surfaces greatly reduce total blood protein adsorption, contact activation, platelet adhesion, platelet procoagulant activity, and in vitro thrombus deposition. J. Biomed. Mater. Res. A. 2007, 81 (4) pp. 827-837
[165] Dawids S.G. Test procedures for the blood compatibility of biomaterials. Dordrecht; Boston: Kluwer Academic Publishers; 1993. xii, 684 p
[166] EMEA. Validation of Analytical Procedures: Text and Methodology-Q 2 (R1), (CPMP/ICH/381/95); and Note for guidance on Validation of Analytical Procedures: Methodology-Q 2 B (CPMP/ICH/281/95). In: ICH Harmonised Tripartite Guideline, (Unit H.M.E. e d.). European Medicines Agency, 1995
[167] Kataoka KMaeda MNishimura TNitadori YTsuruta TAkaike TSakurai Y. Estimation of cell adhesion on polymer surfaces with the use of “column-method”. J. Biomed. Mater. Res. 1980, 14 (6) pp. 817-823
[168] Levy R.J Cardiovascular Biomaterials and Biocompatibility. In: Cardiovascular Pathology, No. 3. (Ratner B.D., & Didisheim P. eds.). Suppl, Harker, LA, Vol. 2, 1993, pp. 1S-224S.
[169] NHLBI. Guidelines for blood/material interactions. Bethesda, MD: National Heart Lung and Blood Institute; 1985 September 1985. Report nr NIH: 85-2185
[170] Northup S.J Hemocompatilbility: Not all devices are created equal. MDDI. 1997 January, 1997 pp. 145-150
[171] Ratner B.D., Hoffman A.S., Schoen F.J., Lemons J.E. Biomaterials Science, Third Edition: An Introduction to Materials in Medicine. Elsevier Academic Press; 2012. 864 p
[172] Sefton M.V., Gemmell C.H., Gorbet M.B. What really is blood compatibility? J. Biomater. Sci. Polym. Ed. 2000, 11 (11) pp. 1165-1182
[173] Sefton M.V., Sawyer A., Gorbet M., Black J.P., Cheng E., Gemmell C., Pottinger-Cooper E. Does surface chemistry affect thrombogenicity of surface modified polymers? J. Biomed. Mater. Res. 2001, 55 (4) pp. 447-459
[174] Seyfert U.T., Biehl V., Schenk J. In vitro haemocompatibility testing of biomaterials according to the ISO 10993- 4. Biomol. Eng. 2002, 19 (2-6) pp. 91-96
[175] Taber C.W., & Thomas C.L. Taber's Cyclopedic Medical Dictionary. In: Thomas CL, M.D., editor. Taber's Cyclopedic Medical Dictionary. 17th ed. Philadelphia: F.A. Davis Co.; 1993. p. 2600
[176] TRIPARTITE SUBCOMMITTEE FOR MEDICAL DEVICES. Tripartite Biocompatibility Guidance for Medical Devices. In: Office of Device Evaluation (ODE) in FDA's Center for Devices and Radiological Health (CDRH), editor. General Program Memorandum #G87-1. FDA; 1986
[177] Ratner B.D. B lood c ompatibility - a p erspective. J. Biomater. Sci. Polym. Ed. 2000, 11 pp. 1107-1119
[178] Hoffman A.S., Horbett T.A., Ratner B.D., Hanson S.R., Harker L A. 1982) ‘Thrombotic events on grafted polyacrylamide silastic surfaces as studied in a baboon’, in Cooper S L, Peppas N A and Hoffman A S (eds), Biomaterials: interfacial Phenomena and Applications, 6, 59-80, American Chemical Society
[179] Llanos G.R., & Sefton M.V. I mmobilization of poly(ethylene g lycol) onto poly(vinyl a icohol) hydrogel: evaluation of thrombogenicity. J. Biomed. Mater. Res. 1993, 27 (11) pp. 1383-1391
[180] Kaplan S., Marcoe K.F., Sauvage L.R., Wu H.D., Mathesen S.R., Walker M.W. The effect of predetermined thrombotic potential of the recipient on small-caliber graft performance. J. Vase. Surg. 1986, 3 (2) pp. 311-321
[181] Akizawa T., Kino K., Kinugasa E., Koshikawa S., Ikada Y., Kishida A., Hatanaka Y., Imamura K. Clinical effects of a polyethylene glycol grafted cellulose membrane on thrombogenicity and biocompatibility during hemodialysis. ASAIO Trans. 1990 Jul-Sep, 36 (3) pp. M640-M642
[182] Ishihara K., Ziats N.P., Tierney B.P., Nakabayashi N., Anderson J.M. p rotein adsorption from human plasma is reduced on phospholipid polymers. J. Biomed. Mater. Res. 1991, 25 pp. 1397-1407
[183] Mulvihill J.N., Faradji A., Oberling F., Cazenave J.P. Surface passivation by human albumin of plasmapheresis circuits reduces platelet accumulation and thrombus formation. Experimental and clinical studies. J. Biomed. Mater. Res. 1990, 24 pp. 155-163
Van tim
[184] Burns G.L., Pantalos G.M., Olsen D.B. The calf as a model for thromboembolic events with the total artificial heart. ASAIO Trans. 1987, 33 (3) pp. 398-403
[185] Rosengart T.K., Lang S.J. Valvular Heart Disease. In: Surgical Intensive CareBarrie P .S., & Shires G.T. eds.). Little, Brown and Company, Boston, 1993, pp. 577-612.
[186] Schoen F.J., Hirsch D., Bianco R.W., Levy R.J. Onset and progression of calcification in porcine aortic bio prosthetic valves implanted as orthotopic mitral valve replacements in juvenile sheep. J. Thorac. Cardiovasc. Surg. 1994 Nov, 108 (5) pp. 880-887
[187] Gallegos R.P., Nockel P.J., Rivard A.L., Bianco R.W. The current state of in-vivo pre- clinical heart valve evaluation. J of Heart Valve Disease, May;14(3) 2005
Chạy thận nhân tạo
[188] Kishida A., Akatsuka Y., Yanagi M., Aikou T, Maruyama I., Akashi M. In vivo and ex vivo evaluation of the antithrombogenicity of human thrombomodulin immobilized biomaterials. ASAIO J. 1995, 41 (3) pp. M369-M374
[189] Mahiout A., Meinhold H., Jorres A., Krieg R., Kessel M., Tretzel J., Baurmeister U. Ex vivo model for pre-clinical evaluation of dialyzers containing new membranes. Life Support Syst. 1985, 3 () pp. 448-452
[190] Spencer P.C., Schmidt B., Samtleben W., Bosch T., Gurland H.J. Ex vivo model of hemodialysis membrane biocompatibility. Trans. Am. Soc. Artif. Intern. Organs. 1985, 31 pp.495-498
[191] Ward R.A., Schmidt B., Blumenstein M., Gurland H.J. Evaluation of phagocytic cell function in an ex vivo model of hemodialysis. Kidney Int. 1990, 37 (2) pp. 776-782
Mô hình in vitro
[192] Chandler A.B. In vitro thrombotic coagulation of the blood; a method for producing a thrombus. Lab. Invest. 1958, 7 (2) pp. 110-114
[193] Munch K., Wolf M.F., Gruffaz P., Ottenwaelter C., Bergan M., SchroedeR P., Fogt E.J. Use of simple and complex in vitro models for multiparameter characterization of human blood-material/device interactions. J. Biomater. Sci. Polym. Ed. 2000, 11 (11) pp. 1147-1163
[194] Yoshizaki T., Tabuchi N., Van Oeveren W., Shibamiya A., Koyama T., Sunamori M. PMEA polymer-coated PVC tubing maintains anti-thrombogenic properties during in vitro whole blood circulation. Int. J. Artif. Organs. 2005, 28 (8) pp. 834-840
[195] Zimmermann A.K., Weber N., Aebert H., Ziemer G., Wendel H.P. Effect of biopassive and bioactive surface-coatings on the haemocompatibility of membrane oxygenators. J. Biomed. Mater. Res. B Appl. Biomater. 2007, 80 (2) pp. 433-439
[196] Tayama E., Ohtsubo S., Nakazawa T., Takami Y., Niimi Y., Makinouchi K., Glueck J.A., Nose Y. The simple in vitro thrombogenic test: modified methods for same priming pumps. Artif. Organs. 1997, 21 (12) pp. 1305-1308
[197] Amrani D.L., Lee C., Earle K., DiOrio J., Murphy M., Yang J. LiVecchi A. An In vitro Bovine percardial Haemocompatibility Testing System. J. Heart Valve Dis. 1998, 7 pp. 268-272
[198] Boswald M., Lugauer S., Bechert T., Greil J., Regenfus A., Guggenbichler J.P. Thrombogenicity testing of central venous catheters in vitro. Infection. 1999, 27 () pp. S30-S33
[199] Van Oeveren W., Tielliu I.F., De Hart J. Comparison of modified chandler, roller pump, and ball valve circulation models for in vitro testing in high flow conditions: application in thrombogenicity testing of different materials for vascular applications. Int. J of Biomaterials 2012; 673163, 7 pages
[200] Kolandaivelu K., Edelman E.R., Background L. Pulsatile, In Vitro Flow Circuit for Modeling Coronary Implant Thrombosis, in Transactions of the ASME, Vol. 124, Dec. 2002
[201] Kolandaivelu K., & Edelman E.R. E nvironmental influences on endovascular stent platelet reactivity: An in vitro comparison of stainless steel and gold surfaces, 2004 Wiley Periodicals, Inc. J. Biomed. Mater. Res. 2004, 70A pp. 186-193
[202] Kolandaivelu K., Leiden, Benjamin B,, Edelman, Elazer R. Predicting response to endovascular therapies: Dissecting the roles of local lesion complexity, systemic comorbidity, and clinical uncertainty. J. Biomech. 2014, 47 pp. 908-921
[203] Stang K., Krajewski S., Neumann B., Kurz J., Post M., Stoppelkamp S. Haemocompatibility testing according to ISO 10993-4: Discrimination between pyrogen- and device-induced hemostatic activation. Mater. Sci. Eng. C. 2014, 42 pp. 422-428
Mô hình in vitro so với in vivo
[204] Didisheim P., Dewanjee M.K., K aye M.P., F risk C.S., Fass D.N., Wahner H.W., Tirrell M.V., Zollman P.E. Nonpredictability of long-term in vivo response from short-term in vitro or ex vivo blood-material interactions. Trans. Am. Soc. Artif. Intern. Organs. 1984b, 30 pp. 370-376
Bệnh lý
[205] Anderson J.M., Cardiovascular Device Retrieval and Evaluation. In: Cardiovascular Biomaterials and Biocompatibility. Cardiovascular Pathology, No. 3. (Ratner B.D., & Didisheim P. eds.). Suppl, Harker, LA, Vol. 2, 1993, pp. 199S-208S.
[206] Schoen F.J., Appendix: Pathology analysis of the cardiovascular system and prosthetic devices. Interventional and surgical cardiovascular pathology: clinical correlations and basic principles. Saunders, Philadelphia, 1989, pp. 369-96.
[207] Grewe P.H., Thomas D., M achraoui A., Barmeyer J., M uller K.M. Coronary morphologic findings after stent implantation. Am. J. Cardiol. 2000, 85 (5) pp. 554-558
[208] Prado C.M., V iaro F., Baldo C.F., Augusto Vdos S., Rodrigues A.J., Evora P.R. Glycol methacrylate-embedding medium to study morphological alterations of saphenous vein under brief and crescent pressurizations. Acta Cir. Bras. 2008, 23 () pp. 77-82, discussion 82
[209] Rippstein P., Black M.K., Boivin M., Veinot J.P., Ma X., Chen Y.X., Human P., Zilla P., O'Brien E.R. Comparison of processing and sectioning methodologies for arteries containing metallic stents. J. Histochem. Cytochem. 2006, 54 (6) pp. 673-681
[210] Singhrao S.K., Muller C.T., Gilbert S.J., Duance V.C., Archer C.W. An immunofluorescence method for postembedded tissue in the acrylic resin Technovit 9100 New using fluorescein isothiocyanate secondary detection. Microsc. Res. Tech. 2009, 72 (7) pp. 501-506
[211] Zhang Q., Wang J., Wu H., Zhang L., Zhou J., Ye Q., Shao X., Guan C., Xu J., Yang Y. et al. Lowtemperature glycol methacrylate resin embedding method: A protocol suitable for bone marrow immunohistochemistry, PCR, and FISH analysis. Microsc Res Tech
[212] Mitrecić D. Cunko VF, Gajović S. Semi-thin sections of epoxy resin-embedded mouse embryos in morphological analysis of whole mount in situ RNA hybridization. J. Microsc. 2008, 232 (3) pp. 504-507
Số liệu thống kê
[213] Festing MF. The design and statistical analysis of animal experiments. ILAR J. 2002, 43 (4)
[214] Festing MF. Altman DG. Guidelines for the design and statistical analysis of experiments using laboratory animals. ILAR J. 2002, 43 (4)
[215] Festing MF. Design and statistical methods in studies using animal models of development. ILAR J. 2006, 47 (1)
[216] Design and Analysis of Animal Studies in Pharmaceutical Development. Shein-Chung Chow and Jen-pei Liu, Editors, Chapman & Hall CRC Biostatistics Series, 1998
Ghép mạch máu
[217] Guidoin R., Douville Y. B asle M.F., K ing M., M arinov G.R., Traore A., Zhang Z., Guillemot F., Dionne G., Sumanasinghe R. Biocompatibility studies of the Anaconda stent-graft and observations of nitinol corrosion resistance. J. Endovasc. Ther. 2004, 11 (4) pp. 385-403
[218] Guidoin R., Gosselin C. Martin L., Marois M., Laroche F., King M., Gunasekera K., Domurado D., Sigot-Luizard M.F., Blais P. Polyester prostheses as substitutes in the thoracic aorta of dogs. I. Evaluation of commercial prostheses. J. Biomed. Mater. Res. 1983, 17 (6) pp. 1049-1077
[219] Hoch JR. SilVER D. Hemostasis and Thrombosis. In: Vascular Surgery: A Conprehensive Review, (Moore W.S. ed.). W. B. Saunders, Philadelphia, Third Edition, 1991, pp. 63-79.
[220] Koskas F., Brocheriou I. Cluzel P., Singland J.D., Regnier B., Bonnot M., Kieffer E. Custommade stent-grafts for aortic aneurysm repair using gianturco Z stents and woven polyester: healing in an animal model. Vase. Endovascular Surg. 2005, 39 (1) pp. 55-65
[221] Toes G.J. Van M uiswinkel K.W., Van Oeveren W., Suurmeijer A.J., Timens W., Stokroos I., Van Den Dungen J.J. Superhydrophobic modification fails to improve the performance of small diameter expanded polytetrafluoroethylene vascular grafts. Biomaterials. 2002, 23 (1) pp. 255-262
[222] White R.A. Diagnosis and therapy of emergent vascular diseases. In: Textbook of critical care, (Shoemaker W.C., Society of Critical Care Medicine, ed.). Saunders, Philadelphia, Second Edition, 1989, pp. 447-452
[223] Wilson G.J. M acgregor D.C., Bridgeman J., Weber B.A., Binnington A.G., Pinchuk L. A Corethane/polyester composite vascular prosthesis for vascular access. Comparison with expanded polytetrafluoroethylene grafts in a canine model. ASAIO J. 1995, 41 (3) pp. M728- M734
[224] Yoneyama T., Ishihara K. Nakabayashi N., Ito M., M ishima Y. Short-term in vivo evaluation of small-diameter vascular prosthesis composed of segmented poly(etherurethane)/2-methacryloyloxyethyl phosphorylcholine polymer blend. J. Biomed. Mater. Res. 1998, 43 (1) pp. 15-20
[225] Zilla P., Greisler H.P. Tissue engineering of vascular prosthetic grafts (Tissue Engineering Intelligence Unit). Landes Bioscience, 1999, p. [226] Dudash L.A., Klingman F., Sarett S.M., Kottke-Marchant K., Marchant R.E. Endothelial cell attachment and shear response on biomimetic polymer-coated vascular grafts. J. Biomed. Mater. Res. A. 2012 Aug, 100 (8) pp. 2204-2210
[227] Tang C., Klingman F., Larsen C.C., Kottke-Marchant K., M archant R.E. Platelet and endothelial adhesion on fluorosurfactant polymers designed for vascular graft modification. J. Biomed. Mater. Res. A. 2009, 88 (2) pp. 348-358
[228] Kottke Marchant K., Anderson J.M., R abinovitch A., Huskey R.A., Herzig R. The effect of heparin vs. xitrate on the interaction of platelets with vascular graft materials. Thromb. Haemost. 1985, 54 pp. 842-848
[229] Kottke Marchant K., Anderson J.M., R abinovitch A. The platelet reactivity of vascular graft prostheses: An in vitro model to test the effect of preclotting. Biomaterials. 1986, 7 pp. 441-448
[230] Kottke-Marchant K., Anderson J .M., Miller K .M., Marchant R.E., Lazarus H. Vascular graft associated complement activation and leukocyte adhesion in an artificial circulation. J. Biomed. Mater. Res. 1987, 21 pp. 379-397
[231] Kottke-Marchant K., Anderson J.M., Umemura Y., M archant R.E. The effect of albumin coating on the in vitro blood compatibility of Dacron arterial prostheses. Biomaterials. 1989, 10 pp. 147-155
Stent mạch máu
[232] Grewe PH. Thomas D., M achraoui A,, Barmeyer J., M uller K.M. Coronary morphologic findings after stent implantation. Am. J. Cardiol. 2000, 85 (5) pp. 554-558
[233] Rippstein P., Black MK. B oivin M., Veinot J.P., M a X., Chen Y.X., Human P., Zilla P., O'Brien E.R. Comparison of processing and sectioning methodologies for arteries containing metallic stents. J. Histochem. Cytochem. 2006, 54 (6) pp. 673-681
[234] Schwartz R.S. Edelman E.R., CarteR A., Chronos N.A., Rogers C., Robinson K.A., Waksman R., Machan L., Weinberger J., Wilensky R.L. Preclinical evaluation of drug-eluting stents for peripheral applications: recommendations from an expert consensus group. Circulation. 2004, 110 (16) pp. 2498-2505
[235] Kolandaivelu K., Leiden, Benjamin B., Edelman, Elazer R. Predicting response to endovascular therapies: Dissecting the roles of local lesion complexity, systemic comorbidity, and clinical uncertainty. J. Biomech. 2014, 47 pp. 908-921
Thiết bị hỗ trợ tâm thất
[236] Schoen F.J. Anderson J.M., Didisheim P., Dobbins J.J., Gristina A.G., Harasaki H., Simmons R.L. Ventricular assist device (VAD) pathology analyses: guidelines for clinical studies. J. Appl. Biomater. 1990, 1 pp. 49-56
[237] Wagner W.R. Schaub R.D., Sorensen E.N., Snyder T.A., Wilhelm C.R., Winowich S., Borovetz H.S., Kormos R.L. Blood biocompatibility analysis in the setting of ventricular assist devices. J. Biomater. Sci. Polym. Ed. 2000, 11 pp. 1239-1259
MỤC LỤC
Lời nói đầu
Lời giới thiệu
1 Phạm vi áp dụng
2 Tài liệu viện dẫn
3 Thuật ngữ và định nghĩa
4 Thuật ngữ viết tắt
5 Loại trang thiết bị tiếp xúc với máu (theo phân loại trong TCVN 7391-1 (ISO 10993-1))
6 Đặc điểm tương tác máu
Phụ lục A (tham khảo) Đánh giá tiền lâm sàng các trang thiết bị tim mạch và bộ phận nhân tạo.
Phụ lục B (tham khảo) Các phép thử phòng thí nghiệm được khuyến nghị - Nguyên lý, cơ sở khoa học và giải thích
Phụ lục C (tham khảo) Chứng huyết khối - Phương pháp thử in vivo
Phụ lục D (tham khảo) Huyết học/tan huyết - Phương pháp thử nghiệm - Đánh giá tính chất tan huyết của trang thiết bị y tế và vật liệu trang thiết bị y tế
Phụ lục E (tham khảo) Bổ thể - Phương pháp thử
Phụ lục F (tham khảo) Các phép thử trong phòng thí nghiệm ít phổ biến hơn
Phụ lục G (tham khảo) Các phép thử không được khuyến nghị
Thư mục tài liệu tham khảo
1) ThomboFixTM là một ví dụ về một sản phẩm phù hợp có sẵn trên thị trường. Thông tin này được cung cấp để thuận tiện cho người dùng tài liệu này và không cấu thành và chứng thực bởi ISO về sản phẩm này.
2) Cuprophan là một ví dụ về một sản phẩm phù hợp có sẵn trên thị trường. Thông tin này được cung cấp để thuận tiện cho người dùng tài liệu này và không cấu thành và chứng thực bởi ISO về sản phẩm này.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 7391-4:2020 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 7391-4:2020 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 7391-4:2020 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 7391-4:2020 DOC (Bản Word)