- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 10697:2015 EN 12146:1996 Nước rau, quả-Xác định hàm lượng sucrose sử dụng enzym-Phương pháp đo phổ NADP
| Số hiệu: | TCVN 10697:2015 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Thực phẩm-Dược phẩm |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
24/04/2015 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 10697:2015
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 10697:2015
TIÊU CHUẨN QUỐC GIA
TCVN 10697:2015
EN 12146:1996
NƯỚC RAU, QUẢ - XÁC ĐỊNH - HÀM LƯỢNG SUCROSE SỬ DỤNG ENZYM - PHƯƠNG PHÁP ĐO PHỔ NADP
Fruit and vegetable juices - Enzymatic determination of sucrose content - NADP spectrometric method
Lời nói đầu
TCVN 10697:2015 hoàn toàn tương đương EN 12146:1996;
TCVN 10697:2015 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC/F10 Rau quả và sản phẩm rau quả biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
NƯỚC RAU, QUẢ - XÁC ĐỊNH - HÀM LƯỢNG SUCROSE SỬ DỤNG ENZYM - PHƯƠNG PHÁP ĐO PHỔ NADP
Fruit and vegetable juices - Enzymatic determination of sucrose content - NADP spectrometric method
1. Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp đo phổ NADP sử dụng enzym để xác định hàm lượng sucrose trong nước rau, quả và các sản phẩm liên quan.
2. Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 4851:1989 (ISO 3696:1987), Nước dùng để phân tích trong phòng thí nghiệm - Yêu cầu kỹ thuật và phương pháp thử.
ISO 5725:1986*), Precision of test methods - Determination of repeatability and reproducibility for a standard test method by inter-laboratory tests (Độ chụm của phương pháp thử - Xác định độ lặp lại và độ tái lập đối với phương pháp thử chuẩn bằng phép thử liên phòng thử nghiệm).
3. Ký hiệu và chữ viết tắt
Trong tiêu chuẩn này sử dụng ký hiệu và các chữ viết tắt sau:
| ATP | Adenosin-5'-triphosphat; |
| ADP | Adenosin-5'-diphosphat; |
| NADP | β-Nicotinamid-adenin-dinucleotidephosphat; |
| NADPH | β-Nicotinamid-adenin-dinucleotidephosphat (dạng khử); |
| G-6-P | Glucose-6-phosphat; |
| HK | Hexokinase (EC 2.7.1.1)1); |
| G6P-DH | Glucose-6-phosphat dehydrogenase (EC 1.1.1.49) 1); |
| BF | β-Fructosidase (EC 3.2.1.26) 1) |
| IU | 1 đơn vị quốc tế (IU) của hoạt độ enzym, xúc tác để chuyển hóa 1 µmol cơ chất trong 1 min ở 25 °C; |
| c | là nồng độ chất; |
| r | là nồng độ khối lượng. |
4. Nguyên tắc và phản ứng
4.1. Nguyên tắc
Sucrose được thủy phân bằng enzym thích hợp (chuyển hóa) bởi phản ứng của BF trong mẫu thử đã pha loãng, để có các lượng D-glucose và D-fructose bằng nhau. D-glucose tạo thành sau đó được phosphoryl hóa tại vị trí cacbon số 6 (C-6) trong phản ứng xúc tác enzym bao gồm ATP và HK.
Trong phản ứng trùng hợp, G-6-P được chuyển thành 6-phosphogluconat khi có mặt NADP, phản ứng được xúc tác bởi enzym G6P-DH và lượng NADPH được tạo thành tương đương với lượng D-glucose có trong mẫu thử (4.2).
Tiến hành định lượng NADPH tạo thành và hàm lượng D-glucose và sucrose bằng đo phổ.
Trong nước quả có mức sucrose thấp (nhỏ hơn 5 g/l) và mức glucose cao hơn không thể thu được lượng sucrose chính xác qua phép xác định enzym chuyển hóa. Khi đó, cần loại bỏ glucose bằng phản ứng với iot ở pH kiềm, trước khi định lượng sucrose.
4.2. Phản ứng

5. Thuốc thử
5.1. Yêu cầu chung
Chỉ sử dụng thuốc thử loại tinh khiết phân tích và nước đạt loại 3 trong TCVN 4851:1989 (ISO 3696:1987).
5.2. Dung dịch natri hydroxit
Dung dịch natri hydroxit được chuẩn bị ở nồng độ c(NaOH) = 5 mol/l, c(NaOH) = 4 mol/l và c(NaOH) = 2 mol/l.
5.3. Dung dịch đệm xitrat, pH = 4,6
Hòa tan 6,9 g axit xitric ngậm một phân tử nước (C6H8O7.H2O) và 9,1 g trinatri xitrat ngậm hai phân tử nước (C6H5Na3O7.2H2O) trong 150 ml nước, chỉnh đến pH = 4,6 bằng dung dịch natri hydroxit [c(NaOH) = 2,0 mol/l] (5.2) và pha loãng bằng nước đến 200 ml. Khi bảo quản ở 4 °C dung dịch này bền trong ít nhất 1 năm.
5.4. Dung dịch β-fructosidase
Hòa tan 10 mg β-fructosidase, r = 5 mg/ml, khoảng 750 IU/ml, trong 2 ml đệm xitrat (5.3). Khi bảo quản ở 4 °C dung dịch này bền trong ít nhất 1 tuần.
5.5. Đệm triethanolamine, pH = 7,6
Hòa tan 14,0 g triethanolamin hydroclorua và 0,25 g magie sulfat ngậm bảy phân tử nước (MgSO4.7H2O) trong 80 ml nước, chỉnh đến pH = 7,6 dùng khoảng 5 ml dung dịch natri hydroxit [c(NaOH) = 5 mol/l] và thêm nước đến 100 ml. Khi bảo quản ở 4 °C dung dịch này bền trong ít nhất 4 tuần.
5.6. Dung dịch NADP
Hòa tan 60 mg muối dinatri β-nicotinamid-adenin-dinucleotit phosphat (β-NADP-Na2) trong 6 ml nước. Khi bảo quản ở 4 °C dung dịch này bền trong ít nhất 4 tuần.
5.7. Dung dịch ATP
Hòa tan 300 mg muối dinatri adenosin-5'-triphosphat ngậm ba phân tử nước (ATP-Na2H2.3H2O) và 300 mg natri hydro cacbonat (NaHCO3) trong 6 ml nước. Khi bảo quản ở 4 °C dung dịch này bền trong ít nhất 4 tuần.
5.8. Huyền phù enzym HK/G6P- DH
Tạo huyền phù hexokinase, r(HK) = 2 mg/ml, khoảng 280 IU/ml (D-glucose làm cơ chất với sự có mặt của ATP) và G6P-DH, r(G6P-DH) = 1 mg/ml, khoảng 140 IU/ml (với G-6-P làm cơ chất) trong dung dịch amoni sulfat, c[(NH4)2SO4] = 3,2 mol/l. Khi bảo quản ở 4 °C dung dịch này bền trong ít nhất 1 năm.
5.9. Dung dịch iot
Hòa tan 130 g iot và 150 g kali iotdua trong một lượng nước vừa đủ đựng trong bình định mức 1 lít, sau khi hòa tan, thêm nước đến vạch.
5.10. Axit sulfuric
Chuẩn bị dung dịch axit sulfuric ở nồng độ c(H2SO4) = 0,5 mol/l từ dung dịch chuẩn đậm đặc thích hợp.
5.11. Dung dịch natri sulfit
Chuẩn bị dung dịch natri sulfit bão hòa trong nước (hòa tan r(Na2SO3) = 12,54 g/100 ml ở 0 0C và 28,3 g/100 ml ở 80 0C). Từ dung dịch đặc này, chuẩn bị các dung dịch pha loãng bằng cách pha loãng từ 1 lần đến 10 lần trong nước.
5.12. Dung dịch phenolphtalein
Chuẩn bị dung dịch phenolphtalein (r = 0,5 g/100 ml) trong etanol.
6. Thiết bị, dụng cụ
Sử dụng các thiết bị dụng cụ thông thường của phòng thử nghiệm và các thiết bị, dụng cụ sau:
6.1. Pipet dùng cho enzym, chia độ dọc theo thân, có đầu phân phối dài không chia độ.
6.2. Pipet, có độ chính xác tương đương với 6.1 (có thể dùng thay thế cho 6.1), ví dụ: pipet mao quản dịch chuyển dương.
6.3. Cuvet, bằng thạch anh, thủy tinh hoặc chất dẻo, chiều dài đường quang 10 mm và hấp thụ không đáng kể ở bước sóng yêu cầu (ví dụ: 334 nm, 340 nm hoặc 365 nm).
6.4. Máy đo phổ vạch, có đèn thủy ngân và bộ lọc để đo ở bước sóng 334 nm hoặc 365 nm.
6.5. Máy đo phổ, (bước sóng có thể thay đổi được) để đo ở bước sóng 340 nm (có thể dùng thay thế cho 6.4).
7. Cách tiến hành
7.1. Chuẩn bị mẫu thử
7.1.1. Chuẩn bị mẫu thông thường
Nước quả phải được pha loãng sao cho nồng độ sucrose/glucose trong khoảng từ 0,1 g/l đến 1,5 g/l. Dung dịch này phải được sử dụng ngay và thông thường không cần xử lý trước. Phép phân tích theo phương pháp này nên dựa vào thể tích, các kết quả được biểu thị trên 1 lít mẫu. Đối với các mẫu cô đặc, có thể cũng tiến hành phân tích dựa vào thể tích, sau khi pha loãng đến tỷ trọng tương đối đã biết. Trong trường hợp này, tỷ trọng tương đối phải được nêu rõ. Dựa vào lượng mẫu đã cân và hệ số pha loãng, các kết quả có thể cũng được biểu thị trên 1 kg mẫu. Đối với các sản phẩm có độ nhớt cao và/hoặc có chứa lượng thịt quả rất cao thì thường tiến hành phép xác định theo khối lượng mẫu thử.
Trộn kỹ nước quả đục trước khi pha loãng và mẫu cũng có màu rất đậm, do đó có thể cần pha loãng tiếp nếu xác định hàm lượng sucrose.
Phân loại mẫu đục chứa nồng độ sucrose rất thấp bằng cách ly tâm trước hoặc lọc qua bộ lọc màng cỡ lỗ 0,2 µm.
7.1.2. Chuẩn bị mẫu cải biến để định lượng sucrose có nồng độ glucose cao
Chuẩn bị 1 trong 5 độ pha loãng của nước quả (được phân loại bằng cách lọc hoặc ly tâm như 7.1.1). Lấy 10 ml nước quả đã pha loãng/đã phân loại, cho vào bình định mức 50 ml, thêm 10 ml dung dịch iot (5.9) và 2,5 ml dung dịch natri hydroxit nồng độ 4 mol/l (5.2) (phải thêm dung dịch vào bước này). Để bình ở nơi tối 10 min. Thêm vào dung dịch này 10 ml dung dịch axit sulfuric (5.10). Loại bỏ iot dư bằng cách thêm dung dịch natri sulfit bão hòa đã pha loãng (5.11) và lắc cho đến khi không còn màu vàng/nâu.
Chỉnh pH của dung dịch trong khoảng từ 8 đến 9 bằng cách chuẩn độ với dung dịch natri hydroxit 4 mol/l (5.2), sử dụng dung dịch chỉ thị phenolphtalein (5.12) cho đến khi vẫn còn màu hồng nhạt. Dung dịch này được thêm đến vạch 50 ml, sau đó được dùng để xác định sucrose.
7.2. Qui trình thử nghiệm
7.2.1. Yêu cầu chung
Phép xác định phải được tiến hành ở nhiệt độ không đổi trong khoảng từ 20 °C đến 25 °C hoặc nhiệt độ lên đến 37 °C để thu được các kết quả tương tự.
NADPH hấp thụ tối đa ở bước sóng 340 nm. Khi sử dụng máy đo phổ có bước sóng thay đổi thì chỉ đo ở độ hấp thụ tối đa. Khi sử dụng đèn hơi thủy ngân thì sử dụng máy đo phổ vạch để đo ở bước sóng 334 nm hoặc 365 nm.
Không dùng pipet một vạch để lấy các dung dịch. Các dung dịch enzym, coenzym và dung dịch đệm có thể được bổ sung từ pipet tự động thích hợp. Dùng pipet thử enzym (6.1) hoặc loại tương đương (6.2) để lấy dung dịch mẫu.
Phép xác định cũng có thể được tiến hành sử dụng bộ kít thử kết hợp có bán sẵn trên thị trường.
Nên dùng sucrose kèm theo bộ kit làm dung dịch chuẩn trong phép phân tích này.
7.2.2. Dung dịch mẫu trắng sucrose
Dùng pipet lấy 0,20 ml dung dịch đệm xitrat (5.3) và 0,02 ml dụng dịch BF (5.4) cho vào cuvet. Trộn và sau 15 min thêm 1,00 ml dung dịch đệm triethanolamin (5.5), 1,70 ml nước, 0,1 ml dung dịch NADP (5.6) và 0,1 ml dung dịch ATP (5.7). Trộn và sau 3 min đọc độ hấp thụ (A1) của dung dịch so với không khí (không có cuvet trong đường quang).
7.2.3. Dung dịch mẫu trắng glucose
Dùng pipet lấy 1,00 ml dung dịch đệm (5.5), 1,92 ml nước, 0,10 ml dung dịch NADP (5.6) và 0,1 ml dung dịch ATP (5.7) cho vào cuvet. Trộn và sau 3 min đọc độ hấp thụ (A2) của dung dịch so với không khí (không có cuvet trong đường quang).
7.2.4. Dung dịch mẫu sucrose
Dùng pipet lấy 0,20 ml dung dịch đệm xitrat (5.3), 0,10 ml dung dịch mẫu và 0,02 ml dung dịch BF (5.4) cho vào cuvet. Trộn và giữ trong 15 min. Thêm vào dung dịch này 1,00 ml dung dịch đệm (5.5), 1,60 ml nước, 0,1 ml dung dịch NADP (5.6) và 0,10 ml dung dịch ATP (5.7). Trộn và sau 3 min đọc độ hấp thụ (A3) của dung dịch so với không khí (không có cuvet trong đường quang).
7.2.5. Dung dịch mẫu glucose
Dùng pipet lấy 0,1 ml dung dịch mẫu, 1,0 ml dung dịch đệm (5.5), 1,82 ml nước, 0,10 ml dung dịch NADP (5.6) và 0,1 ml dung dịch ATP (5.7) cho vào cuvet. Trộn và sau 3 min đọc độ hấp thụ (A4) của dung dịch so với không khí (không có cuvet trong đường quang).
7.2.6. Qui trình thay thế đối với phép xác định sucrose sau khi loại bỏ glucose tự do
Chuẩn bị mẫu thử trắng sucrose, như mô tả trong 7.2.2 và dung dịch thử như sau:
Dùng pipet lấy 0,20 ml dung dịch đệm xitrat (5.3), 0,10 ml dung dịch mẫu đã xử lý (7.1.2) và 0,02 ml dung dịch BF (5.4) cho vào cuvet. Trộn và giữ trong 15 min. Thêm vào dung dịch này 1,00 ml dung dịch đệm (5.5), 1,60 ml nước, 0,1 ml dung dịch NADP (5.6) và 0,10 ml dung dịch ATP (5.7). Trộn và sau 3 min đọc độ hấp thụ (A9) của dung dịch so với không khí (không có cuvet trong đường quang).
7.2.7. Phản ứng enzym và định lượng sucrose
Thực hiện qui trình sau cho từng dung dịch (7.2.2, 7.2.3, 7.2.4, 7.2.5 và 7.2.6) riêng rẽ.
Thêm 0,02 ml huyền phù enzym HK/G6P-DH (5.8). Trộn đều, đợi cho đến khi phản ứng kết thúc (10 min đến 15 min) và đọc độ hấp thụ của các dung dịch (A5 đối với 7.2.2, A6 đối với 7.2.3, A7 đối với 7.2.4, A8 đối với 7.2.5 và A10 đối với 7.2.6). Kiểm tra việc kết thúc phản ứng bằng cách cứ 2 min đọc độ hấp thụ cuối cùng sau 15 min. Nếu phản ứng chưa kết thúc sau thời gian này và tiếp tục tăng ở tốc độ không đổi, thì ngoại suy độ hấp thụ ngược trở lại thời điểm bổ sung huyền phù enzym HK/G6P-DH (5.8).
CHÚ THÍCH: Qui trình này cho phép có phản ứng phụ, thường được coi là “độ trượt”, chi tiết hơn xem Phụ lục A.
8. Tính kết quả
Dựa vào các phản ứng thực hiện phép xác định, có sự tỷ lệ tuyến tính giữa lượng NADPH tạo thành (và do chênh lệch độ hấp thụ ΔA) và nồng độ của sucrose.
ΔAsucrose = ΔAtổng glucrose - ΔAglucrose (4)
ΔAtổng glucrose = (A8 - A3)mẫu sucrose - (A5 - A1)mẫu trắng sucrose (5)
ΔAglucrose = (A7 - A4)mẫu glucrose - (A6 - A2)mẫu trắng glucose (6)
Nếu loại bỏ glucose, bằng cách cho phản ứng với iot thì phép tính được đơn giản hóa và trở thành:
ΔAsucrose = (A10 - A9)mẫu sucrose - (A5 - A1)mẫu trắng sucrose (7)
Phép tính nồng độ của sucrose trong dung dịch pha loãng bằng phép đo độ hấp thụ nguyên tử theo định luật Beer-Lambert.
Hàm lượng sucrose, r, tính bằng gam trên lít của mẫu, tính được theo Công thức sau:
![]() (8)
(8)
Trong đó:
M là khối lượng phân tử sucrose (342,3 g/mol);
V1 là tổng thể tích của dung dịch trong cuvet, tính bằng mililit (ml);
V2 là thể tích của dung dịch mẫu thử bổ sung vào cuvet, tính bằng mililit (ml);
F là hệ số pha loãng của dung dịch mẫu (xem 7.1.1 hoặc 7.1.2);
d là đường quang của cuvet, tính bằng xentimet (cm);
ɛ là hệ số tắt của NADPH;
ở 340 nm = 6,3 ℓ mmol-1 cm-1;
ở 365 nm = 3,5 ℓ mmol -1 cm-1;
ở 334 nm = 6,18 ℓ mmol -1 cm-1.
ΔAsucrose là chênh lệch độ hấp thụ.
Nếu thể tích đã cho trong 7.2.2 và 7.2.3, 7.2.4, 7.2.5 và 7.2.6 không thay đổi thì hàm lượng sucrose, tính bằng gam/lít, theo Công thức sau:
![]() (9)
(9)
Báo cáo nồng độ của sucrose, bằng gam trên lít, đến một chữ số thập phân.
Cần tính đến mọi hệ số pha loãng và mối liên hệ với khối lượng hoặc thể tích. Nếu mẫu cô đặc đã được pha loãng đến nồng độ đơn (nồng độ ban đầu) thì phải ghi lại tỷ trọng tương đối của mẫu có nồng độ đơn đó.
9. Độ chụm
Chi tiết của phép thử liên phòng thử nghiệm về độ chụm của phương pháp được nêu trong Phụ lục B. Các giá trị thu được từ các phép thử liên phòng thử nghiệm này có thể không áp dụng được cho các dải nồng độ và nền mẫu khác với các dải nồng độ và nền mẫu đã nêu trong Phụ lục B.
9.1. Độ lặp lại
Chênh lệch tuyệt đối giữa hai kết quả thử nghiệm đơn lẻ thu được khi tiến hành thử trên vật liệu thử giống hệt nhau, do cùng một người phân tích, sử dụng cùng một thiết bị, trong một khoảng thời gian ngắn, không được quá 5 % các trường hợp lớn hơn giới hạn lặp lại r.
Đối với việc chuẩn bị mẫu thông thường (7.1.1), các giá trị đó là:
Nước táo: r = 1,9 g/l
Necta lý chua đen: r = 3,2 g/l
Necta mơ: r = 3,9 g/l
Đối với việc chuẩn bị mẫu cải biến (7.1.2), giá trị đó là:
r = 0,4 g/l
9.2. Độ tái lập
Chênh lệch tuyệt đối giữa hai kết quả thử nghiệm đơn lẻ thu được khi tiến hành thử trên vật liệu thử giống hệt nhau, do hai phòng thử nghiệm phân tích, không được quá 5 % các trường hợp lớn hơn giới hạn tái lập R.
Đối với việc chuẩn bị mẫu thông thường (7.1.1), các giá trị đó là:
Nước táo: R = 3,2 g/l
Necta lý chua đen: R = 5,6 g/l
Necta mơ: R = 6,9 g/l
Đối với việc chuẩn bị mẫu cải biến (7.1.2) giá trị đó là:
R = 0,9 g/l
10. Báo cáo thử nghiệm
Báo cáo thử nghiệm phải bao gồm:
- mọi thông tin cần thiết để nhận biết mẫu (loại mẫu, nguồn gốc mẫu, ký hiệu);
- viện dẫn tiêu chuẩn này;
- ngày và kiểu quy trình lấy mẫu (nếu biết);
- ngày nhận mẫu;
- ngày thử nghiệm;
- kết quả thử nghiệm và các đơn vị biểu thị;
- độ lặp lại của phương pháp đã được đánh giá;
- các điểm cụ thể quan sát được trong quá trình thử nghiệm;
- mọi thao tác không quy định trong tiêu chuẩn này, hoặc được xem là tùy chọn, cùng với mọi tình huống bất thường có thể ảnh hưởng đến kết quả thử nghiệm.
Phụ lục A
(Tham khảo)
Thông tin về việc xử lý phản ứng “trượt”
Phản ứng “trượt“ là phản ứng phụ của phản ứng enzym, khi có mặt enzym khác trong nền mẫu, hoặc tác động tương hỗ của một hoặc nhiều thành phần nền mẫu với thuốc thử.
Trong phản ứng thông thường, độ hấp thụ trở thành giá trị không đổi sau thời gian nhất định, điển hình từ 10 min đến 20 min, tùy thuộc vào tốc độ của phản ứng enzym cụ thể. Tuy nhiên, khi xuất hiện phản ứng phụ thì độ hấp thụ không đạt đến giá trị ổn định nhưng tăng đều theo thời gian và qui trình này thường được gọi là phản ứng “trượt”.
Nếu có vấn đề thì độ hấp thụ của dung dịch sẽ được đo ở khoảng thời gian đều nhau (2 min đến 5 min) sau thời gian cần để dung dịch chuẩn đạt đến độ hấp thụ cuối cùng. Khi độ hấp thụ tăng ở tốc độ không đổi (dA/dt = không đổi) thì lấy 5 số đọc đến 6 số đọc và sau đó ngoại suy bằng đồ thị hoặc phép toán học để độ hấp thụ của dung dịch gặp nhau tại 1 điểm khi enzym cuối cùng được thêm vào (t0). Chênh lệch độ hấp thụ ngoại suy ở điểm (Af - Ai) được sử dụng trong phép tính nồng độ cơ chất.
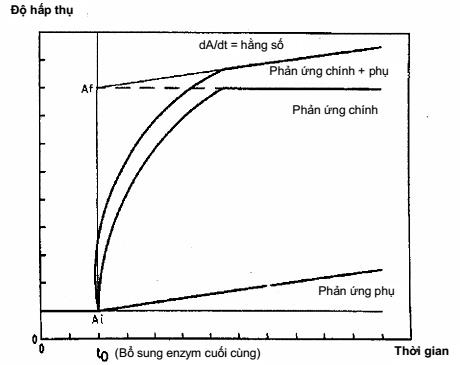
Hình A.1 - Phản ứng trượt
Phụ lục B
(Tham khảo)
Các kết quả thống kê của phép thử liên phòng thử nghiệm
Các thông số sau đây thu được trong phép thử liên phòng thử nghiệm phù hợp với ISO 5725:1986 (Đối với tài liệu đánh giá phương pháp, xem Thư mục Tài liệu tham khảo). Phép thử do Cục hóa thực phẩm Frankfurt, Đức tổ chức thực hiện.
B.1. Chuẩn bị mẫu thông thường (7.1.1)
| Năm tiến hành phép thử liên phòng thử nghiệm | 1983 |
| Số lượng các phòng thử nghiệm | 22 |
| Số lượng mẫu Loại mẫu: | 3 |
A nước táo;
B nước lý chua đen;
C nectar mơ
Bảng B.1 - Kết quả của phép thử liên phòng thử nghiệm đối với mẫu thông thường
| Mẫu | A | B | C |
| Số lượng phòng thử nghiệm được giữ lại sau khi trừ ngoại lệ | 19 | 17 | 18 |
| Số lượng phòng thử nghiệm ngoại lệ | 3 | 5 | 4 |
| Số lượng các kết quả được chấp nhận | 99 | 88 | 90 |
| Giá trị trung bình ( | 10,2 | 22,9 | 63,6 |
| Độ lệch chuẩn lặp lại (sr) (g/l) Độ lệch chuẩn tương đối lặp lại (RSDr), (%) | 0,6656 6,5 | 1,1355 5,0 | 1,3803 2,2 |
| Giới hạn lặp lại (r) (g/l) | 1,9 | 3,2 | 3,9 |
| Độ lệch chuẩn tái lập (sR) (g/l) Độ lệch chuẩn tương đối tái lập (RSDR), (%) | 1,1257 8,7 | 2,0084 8,8 | 2,4636 3,9 |
| Giới hạn tái lập (R) (g/l) | 3,2 | 5,6 | 6,9 |
B.2. Chuẩn bị mẫu cải biến (7.1.2)
Năm tiến hành phép thử liên phòng thử nghiệm 1993
Số lượng các phòng thử nghiệm 11
Số lượng mẫu 4 không bổ sung sucrose
Loại mẫu:
A nước nho, đỏ;
B nước nho, trắng;
C nước cà chua;
D nước anh đào.
Bảng B.2 - Kết quả của phép thử liên phòng thử nghiệm đối với mẫu cải biến
| Mẫu | A | B | C | D |
| Số lượng phòng thử nghiệm được giữ lại sau khi trừ ngoại lệ | 10 | 9 | 11 | 9 |
| Số lượng phòng thử nghiệm ngoại lệ | 1 | 2 | - | 2 |
| Số lượng các kết quả được chấp nhận | 50 | 45 | 55 | 45 |
| Giá trị trung bình ( | 2,6 | 4,8 | 4,1 | 2,2 |
| Độ lệch chuẩn lặp lại (sr) (g/l) Độ lệch chuẩn tương đối lặp lại (RSDr), (%) | 0,1005 2,9 | 0,1750 3,6 | 0,1631 4,0 | 0,0895 4,1 |
| Giới hạn lặp lại (r) (g/l) | 0,3 | 0,5 | 0,5 | 0,3 |
| Độ lệch chuẩn tái lập (sR) (g/l) Độ lệch chuẩn tương đối tái lập (RSDR), (%) | 0,3957 15,2 | 0,2919 6,1 | 0,3350 8,2 | 0,1211 5,5 |
| Giới hạn tái lập (R) (g/l) | 1,1 | 0,8 | 0,9 | 0,3 |
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] Determination of sucrose: Enzymatic method: No 56, 1985. In: The collected analyses of the International Federation of Fruit Juice Producers.Loose-leaf edition of 1996. Zug: Swiss Fruit Union.
[2] Methods of enzymatic foods anaylysis. Mannheim: Boehringer. 1980.
[3] Methode 31.00-13 der Amtlichen Sammlung von Untersuchungsverfahren nach § 35 LMBG: Verfahren zur Probenahme und Untersuchung von Lebensmitteln, Tabakerzeugnissen, kosmetischen Mitteln und Bedarfsgegenstanden/Bundesgesundheitsamt. Loseblattausgabe, Stand Aug. 1995 Bd. 1 Berlin, Koln: Beuth Verlag GmbH.
(Methods of sampling and analysis of foods, tobacco products, cosmetics and commodity goods).
Method 31.00-13 of the Collection of Official Methods under Article 35 of the German Federal Foods Act. Federal Health Office. Loose leaf edition of 1995. 08, vol.I. Berlin, Cologne: Beuth Verlag GmbH).
*) ISO 5725:1986 đã hủy và được thay bằng bộ tiêu chuẩn ISO 5725 (gồm 6 phần) và đã được chấp nhận thành bộ tiêu chuẩn TCVN 6910 (ISO 5725).
1) Hiệp hội enzym (EC): hệ thống phân loại. Sổ tay enzym, Springer, Đức 1969.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 10697:2015 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 10697:2015 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 10697:2015 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 10697:2015 DOC (Bản Word)