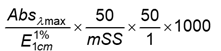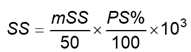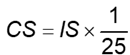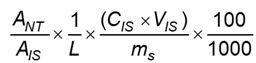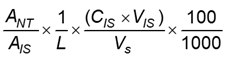- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn TCVN 9515:2017 Xác định nucleotid trong thức ăn dành cho trẻ sơ sinh
| Số hiệu: | TCVN 9515:2017 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Thực phẩm-Dược phẩm |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
2017 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 9515:2017
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 9515:2017
TIÊU CHUẨN QUỐC GIA
TCVN 9515:2017
ISO 20638:2015
THỨC ĂN CÔNG THỨC DÀNH CHO TRẺ SƠ SINH - XÁC ĐỊNH CÁC NUCLEOTID BẰNG SẮC KÝ LỎNG
Infant formula - Determination of nucleotides by liquid chromatography
Lời nói đầu
TCVN 9515:2017 thay thế TCVN 9515:2012;
TCVN 9515:2017 hoàn toàn tương đương với ISO 20638:2015;
TCVN 9515:2017 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC/F12 Sữa và sản phẩm sữa biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
THỨC ĂN CÔNG THỨC DÀNH CHO TRẺ SƠ SINH - XÁC ĐỊNH CÁC NUCLEOTID BẰNG SẮC KÝ LỎNG
Infant formula - Determination of nucleotides by liquid chromatography
CẢNH BÁO - Khi áp dụng tiêu chuẩn này có thể liên quan đến các vật liệu, thiết bị và các thao tác gây nguy hiểm. Tiêu chuẩn này không đưa ra được tất cả các vấn đề an toàn liên quan đến việc sử dụng chúng. Người sử dụng tiêu chuẩn này phải tự thiết lập các thao tác an toàn thích hợp và xác định khả năng áp dụng hoặc các giới hạn quy định trước khi sử dụng tiêu chuẩn.
1 Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp xác định các hợp chất 5‘-mononucleotid trong thức ăn công thức dạng khô (dạng bột) hoặc dạng lỏng (sản phẩm dạng lỏng ăn liền và dạng đặc) dành cho trẻ nhỏ, bằng sắc ký lỏng.
2 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng các thuật ngữ và định nghĩa sau:
2.1
Thức ăn công thức dành cho trẻ sơ sinh (infant formula)
Sản phẩm thay thế sữa mẹ được chế biến đặc biệt đáp ứng được các nhu cầu về dinh dưỡng của trẻ trong những tháng đầu đời đến giai đoạn ăn thức ăn bổ sung thích hợp.
[Nguồn TCVN 7218:2008 (CODEX STAN 72-1981)]
3 Nguyên tắc
Mẫu thử được hòa tan trong dung dịch có nồng độ muối cao để ức chế sự tương tác giữa protein và chất béo. Các hợp chất 5'-mononucleotid gồm uridin 5-monophosphat (UMP), inosin 5'-monophosphat (IMP), adenosin 5'-monophosphat (AMP), guanosin 5'-monophosphat (GMP) và cytidin 5'-phosphat (CMP) được tách khỏi nền mẫu bằng phương pháp chiết pha rắn trao đổi anion mạnh (SPE) sau đó phân tích bằng sắc ký dùng cột pha tĩnh C18, có gradient rửa giải, detector UV và định lượng bằng kỹ thuật nội chuẩn dùng thymidin 5'-monophosphat (TMP).
4 Thuốc thử và vật liệu thử
Chỉ sử dụng thuốc thử loại tinh khiết phân tích và chỉ sử dụng nước cất hoặc nước đã loại khoáng hoặc nước có độ tinh khiết tương đương, trừ khi có quy định khác.
4.1 Chất chuẩn, có độ tinh khiết ≥ 99% (của Sigma1) hoặc tương đương). Các muối natri nucleotid hoặc muối natri hydrat có thể được sử dụng thay thế nếu không có sẵn các dạng axit tự do.
4.1.1 TMP, thymidin 5'-monophosphat, CAS số. 365-07-1.
4.1. 2 AMP, adenosin 5'-monophosphat, CAS số. 61-19-8.
4.1.3 CMP, cytidin 5’-phosphat, CAS số. 63-37-6.
4.1.4 GMP, guanosin 5'-monophosphat, CAS số. 85-32-5.
4.1.5 IMP, inosin 5'-monophosphat, CAS số. 131-99-7.
4.1.6 UMP, uridin 5'-monophosphat, CAS số. 58-97-9.
4.2 Kali bromua (KBr).
4.3 Kali dihydro phosphat (KH2PO4).
4.4 Axit orthophosphoric (H3PO4).
4.5 Kali hydroxit (KOH).
4.6 Axit etylendiamintetraaxetic (EDTA), muối dinatri dihydrat
4.7 Natri clorua (NaCI).
4.8 Metanol (CH3OH).
4.9 Chuẩn bị thuốc thử
4.9.1 Dung dịch đệm chuẩn hóa [KH2PO4), c = 0,25 mol/l, pH 3,5]
Hòa tan 34,0 g kali dihydro phosphat (4.3) trong 900 ml nước và chỉnh pH đến 3,5 bằng axit orthophosphoric (4.4). Pha loãng đến 1 lít.
4.9.2 Dung dịch chiết, (NaCI, c = 1 mol/l và EDTA c = 4 mmol/l)
Hòa tan 58,5 g natri clorua (4.7) và 1,5 g EDTA (4.6) trong nước. Pha loãng đến 1 lít.
4.9.3 Dung dịch rửa (KBr, c = 0,3 mol/l).
Hòa tan 3,6 g kali bromua (4.2) trong 100 ml nước.
4.9.4 Dung dịch rửa giải (KH2PO4, c = 0,5 mol/l, pH = 3,0)
Hòa tan 6,8 g kali dihydro phosphat (4.3) trong 90 ml nước và chỉnh pH đến 3,0 bằng axit orthophosphoric (4.4). Pha loãng đến 100 ml.
4.9.5 Pha động A (KH2PO4, c = 10 mmol/l, pH = 5,6)
Hòa tan 1,4 g kali dihydro phosphat (4.3) trong 900 ml nước và chỉnh pH đến 5,6 ±0,1 bằng dung dịch kali hydroxit [10% (khối lượng/thể tích)]. Pha loãng bằng nước đến 1 lít. Chuẩn bị dung dịch trong ngày sử dụng để tránh sự phát triển của vi sinh vật trong đệm phosphat ở nhiệt độ phòng khi dung dịch đệm chứa hàm lượng dung môi vô cơ thấp hoặc không chứa dung môi vô cơ.
4.9.6 Pha động B, 100% metanol (4.8).
4.10 Chuẩn bị dung dịch chuẩn
4.10.1 Dung dịch chuẩn gốc, ρ ≈ 1 mg/ml
Cân chính xác khoảng 50 mg mỗi chất chuẩn 5’-monophosphat nucleotid cho vào các bình định mức 50 ml riêng rẽ. Thêm 40 ml nước, trộn đến khi hòa tan và thêm nước đến vạch.
4.10.2 Dung dịch chuẩn tinh khiết
Dùng pipet lấy 1,0 ml mỗi dung dịch chuẩn gốc (4.10.1) cho vào các bình định mức 50 ml riêng rẽ, thêm dung dịch đệm chuẩn hóa (4.9.1) đến vạch và đo độ hấp thụ tại bước sóng hấp thụ cực đại λmax để xác định nồng độ của mỗi dung dịch chuẩn gốc nucleotid. Xem Bảng 1 và Tài liệu tham khảo [1] và [2].
Bảng 1 - Bước sóng hấp thụ cực đại và hệ số tắt của các 5'-monophosphat nucleotid
| 5'-monophosphat nucleotid | λmax nm | Hệ số tắt |
| Adenosin 5'-monophosphat | 257 | 428,6 |
| Cytidin 5'-monophosphat | 280 | 390,9 |
| Guanosin 5’-monophosphat | 254 | 392,0 |
| Inosin 5'-monophosphat | 249 | 356,5 |
| Uridin 5'-monophosphat | 262 | 312,7 |
| Thymidin 5'-monophosphat | 267 | 288,5 |
4.10.3 Dung dịch nội chuẩn, ρ ≈ 80 μg/ml
Pha loãng 4 ml dung dịch chuẩn gốc TMP (4.10.1) trong 50 ml nước.
4.10.4 Dung dịch chuẩn làm việc, ρ ≈ 40 μg/ml
Dùng pipet lấy 2 ml mỗi dung dịch chuẩn gốc (4.10.1) (AMP, CMP, GMP, IMP và UMP) cho vào một bình định mức 50 ml và thêm nước đến vạch.
4.10.5 Dung dịch chuẩn hiệu chuẩn. Xem Bảng 2 về các nồng độ danh nghĩa nucleotid của các dung dịch chuẩn hiệu chuẩn.
Bảng 2 - Nồng độ danh nghĩa của các dung dịch chuẩn hiệu chuẩn
| Dung dịch hiệu chuẩn | Nồng độ của mỗi nucleotid: | Nồng độ của TMP |
| 1 | 0,4 | 3,2 |
| 2 | 0,8 | 3,2 |
| 3 | 3,2 | 3,2 |
| 4 | 8,0 | 3,2 |
4.10.5.1 Dung dịch hiệu chuẩn 1
Dùng pipet lấy 0,25 ml dung dịch chuẩn làm việc (4.10.4) và 1 ml dung dịch nội chuẩn (4.10.3) cho vào bình định mức 25 ml và thêm nước đến vạch.
4.10.5.2 Dung dịch hiệu chuẩn 2
Dùng pipet lấy 0,5 ml dung dịch chuẩn làm việc (4.10.4) và 1 ml dung dịch nội chuẩn (4.10.3) cho vào bình định mức 25 ml và thêm nước đến vạch.
4.10.5.3 Dung dịch hiệu chuẩn 3
Dùng pipet lấy 2 ml dung dịch chuẩn làm việc (4.10.4) và 1 ml dung dịch nội chuẩn (4.10.3) cho vào bình định mức 25 ml và thêm nước đến vạch.
4.10.5.4 Dung dịch hiệu chuẩn 4
Dùng pipet lấy 5 ml dung dịch chuẩn làm việc (4.10.4) và 1 ml dung dịch nội chuẩn (4.10.3) cho vào bình định mức 25 ml và thêm nước đến vạch.
5 Thiết bị, dụng cụ
Sử dụng các thiết bị, dụng cụ của phòng thử nghiệm thông thường và cụ thể như sau:
5.1 Hệ thống HPLC, được trang bị bơm, bộ bơm mẫu với vòng bơm 50 μl, bộ khử khí, buồng cột và detector mảng diot quang.
5.2 Cột C18, loại Gemini2) có cỡ hạt 5 μm, kích thước 250 mm x 4,6 mm (Phenomenex2)).
5.3 Máy đo phổ, có thể cho số đọc đến ba chữ số sau dấu phẩy.
5.4 Dụng cụ đo pH.
5.5 Máy ly tâm.
5.6 Ống ly tâm, Amicon Ultra MWCO 3k, dung tích 4 ml (Millipore)2).
5.7 Ống ly tâm polypropylen, dung tích 50 ml.
5.8 Xyranh sử dụng một lần, dung tích 3 ml.
5.9 Bộ lọc xyranh, với màng lọc bằng xenlulo axetat, cỡ lỗ 0,2 μm.
5.10 Bộ bơm chân không SPE.
5.11 Cột SPE trao đổi anion mạnh polypropylen, 6 ml x 1 000 mg, Chromabond SB2).
5.12 Màng lọc, bằng nylon cỡ lỗ 0,45 μm.
6 Chuẩn bị mẫu thử
a) Lắc hoặc trộn mẫu trước khi mở vật chứa.
b) Cân chính xác khoảng 1 g mẫu thử dạng bột hoặc 10 ml thức ăn công thức dành cho trẻ nhỏ từ sữa dạng lỏng/ăn liền, cho vào ống ly tâm 50 ml.
c) Thêm 30 ml dung dịch chiết (4.9.2).
d) Thêm 1,0 ml dung dịch nội chuẩn TMP (4.10.3).
e) Đậy nắp ống và trộn bằng máy Vortex cho đến khi bột hòa tan.
f) Để yên mẫu trong 10 min để đảm bảo quá trình hydrat hóa xảy ra hoàn toàn.
g) Pha loãng bằng nước đến thể tích cuối cùng xấp xỉ 50 ml.
h) Đậy nắp ống ly tâm và trộn bằng máy Vortex.
i) Đối với các sản phẩm từ tinh bột, chuyển vào hai ống siêu ly tâm, mỗi ống 4 ml mẫu đã chuẩn bị và ly tâm ở 3500g trong 60 min, sau đó rót dịch lọc ra khỏi hai ống.
7 Cách tiến hành
7.1 Chiết mẫu
Trong quá trình chiết, không để cột bị khô mà cho chảy từng giọt vào cột.
Khi tháo dịch chiết ra khỏi cột, tốc độ dòng cần nhỏ hơn 2 ml/min.
a) Đối với mỗi mẫu thử, đặt cột SPE lên nhánh hút của bộ bơm chân không.
b) Ổn định cột bằng cách thêm 4 ml metanol và cho chảy đến đáy cột, sau đó thêm hai lần bằng nước, (mỗi lần dùng 5 ml) và cho chảy đến đáy cột.
c) Cho 4 ml dung dịch mẫu thử lên cột và cho chảy đến đáy cột.
d) Rửa cột bằng 4 ml dung dịch rửa (4.9.3) để loại bỏ các chất gây nhiễu và cho chảy đến đáy cột.
e) Đưa ống thu nhận mẫu vào bộ bơm chân không SPE.
f) Rửa giải các nucleotid bằng 4 ml dung dịch rửa giải (4.9.4) vào ống thu nhận mẫu và cho cột chảy hết.
g) Lọc khoảng 2 ml dịch rửa giải qua bộ lọc xyranh 0,2 μm vào lọ lấy mẫu tự động.
7.2 Chạy sắc ký
a) Tạo gradient bằng cách trộn nhẹ pha động A và pha động B để tách các nucleotid theo quy trình nêu trong Bảng 3.
Bảng 3 - Quy trình gradient để phân tách bằng sắc ký
| Thời gian min | Tốc độ dòng ml/min | Pha động A % | Pha động B % |
| 0 | 0,6 | 100 | 0 |
| 25 | 0,6 | 80 | 20 |
| 26 | 0,6 | 100 | 0 |
| 40 | 0,6 | 100 | 0 |
b) Dải phổ yêu cầu trong khoảng từ 210 nm đến 300 nm, dùng detector mảng diot quang với chương trình sắc ký được kiểm soát ở các bước sóng quy định sau đây trước khi định lượng.
1) IMP ở bước sóng 250 nm;
2) AMP, GMP và TMP ở bước sóng: 260 nm;
3) CMP và UMP ở bước sóng: 270 nm.
c) Cài đặt nhiệt độ buồng cột đến 40 °C.
Ví dụ về sắc ký đồ được nêu trong Phụ lục A.
8 Tính kết quả
8.1 Tính độ tinh khiết của mỗi nucleotid (tính theo axit tự do) của dung dịch chuẩn tinh khiết (4.10.2), bằng phần trăm (%), theo Công thức (1):
| Độ tinh khiết = | (1) |
Trong đó:
Absλmax là độ hấp thụ tia UV tại bước sóng cực đại;
![]() là hệ số tắt của nucleotid;
là hệ số tắt của nucleotid;
mSS là khối lượng nucleotid trong dung dịch chuẩn gốc, tính bằng miligam (mg);
50 là tổng thể tích của dung dịch chuẩn gốc, tính bằng mililit (ml):
50 là tổng thể tích của dung dịch chuẩn tinh khiết, tính bằng mililit (ml);
1 là thể tích của dung dịch chuẩn gốc bổ sung vào chất chuẩn tinh khiết, tính bằng mililit (ml).
1000 là khối lượng chuyển đổi từ miligam sang gam.
8.2 Tính nồng độ của nucleotid trong các dung dịch chuẩn gốc (SS) (4.10.1), bằng microgam trên mililit (μg/ml), theo Công thức (2):
|
| (2) |
Trong đó:
mSS là khối lượng nucleotid trong dung dịch chuẩn gốc, tính bằng miligam (mg);
50 là tổng thể tích của dung dịch chuẩn gốc SS, tính bằng mililit (ml);
103 là hệ số chuyển đổi nồng độ từ miligam trên mililit (mg/ml) sang microgam trên mililit (μg/ml).
PS% là phần trăm độ tinh khiết;
100 là hệ số chuyển đổi khối lượng từ phần trăm sang số thập phân.
8.3 Tính nồng độ của TMP trong dung dịch nội chuẩn (IS) (4.10.3), bằng microgam trên mililit (μg/ml), theo Công thức (3):
|
| (3) |
Trong đó:
SS là nồng độ của TMP trong dung dịch chuẩn gốc, tính bằng microgam trên mililit (μg/ml);
4 là thể tích dung dịch chuẩn gốc TMP trong dung dịch nội chuẩn, tính bằng mililit (ml);
50 là tổng thể tích dung dịch nội chuẩn, tính bằng mililit (ml).
8.4 Tính nồng độ các nucleotid trong dung dịch chuẩn làm việc (WS) (4.10.4), tính bằng microgam trên mililit (μg/ml), theo công thức (4):
|
| (4) |
Trong đó:
SS là nồng độ của nucleotid trong dung dịch chuẩn gốc, tính bằng microgam trên mililit (μg/ml);
2 là thể tích dung dịch chuẩn gốc nucleotid trong dung dịch chuẩn làm việc, tính bằng mililit (ml);
50 là tổng thể tích dung dịch chuẩn làm việc, tính bằng mililit (ml);
8.5 Tính nồng độ của TMP trong các dung dịch chuẩn hiệu chuẩn (CS) (4.10.5), bằng microgam trên mililit (μg/ml), theo Công thức (5):
|
| (5) |
Trong đó:
IS là nồng độ của nucleotid trong dung dịch nội chuẩn, tính bằng microgam trên mililit (μg/ml);
1 là thể tích của IS trong dung dịch chuẩn hiệu chuẩn, tính bằng mililit (ml);
25 là tổng thể tích dung dịch chuẩn hiệu chuẩn, tính bằng mililit (ml).
8.6 Tính nồng độ các nucleotid trong các dung dịch chuẩn hiệu chuẩn (CS) (4.10.5), bằng microgam trên mililit (μg/ml), theo Công thức (6):
|
| (6) |
Trong đó:
WS là nồng độ của nucleotid trong dung dịch chuẩn làm việc, tính bằng microgam trên mililit (μg/ml);
Vws là thể tích dung dịch chuẩn làm việc trong dung dịch chuẩn hiệu chuẩn, tính bằng mililit (ml);
25 là tổng thể tích dung dịch hiệu chuẩn, tính bằng mililit (ml).
8.7 Xác định đường hồi quy tuyến tính về tỷ lệ các diện tích pic (nucleotid/TMP; trục y) với tỷ lệ các nồng độ (nucleotid/TMP; trục x) đối với các chất chuẩn hiệu chuẩn và tính độ dốc có điểm cắt với trục y phải đi qua tọa độ 0.
8.8 Nội suy các hàm lượng nucleotid có trong các mẫu chưa biết từ đường chuẩn.
a) Đối với mẫu dạng bột:
Hàm lượng nucleotid, bằng miligam trên 100 g, tính được theo Công thức (7):
|
| (7) |
b) Đối với mẫu dạng lỏng ăn liền:
Hàm lượng nucleotid, bằng miligam trên 100 g, tính được theo Công thức (8):
|
| (8) |
Trong đó:
ANT là diện tích pic nucleotid trong mẫu thử;
AIS là diện tích pic TMP trong mẫu thử;
L là độ dốc của đường chuẩn hồi quy tuyến tính;
CIS là nồng độ của chất nội chuẩn bổ sung vào mẫu thử, tính bằng microgam trên mililit (μg/ml);
VIS là thể tích chất nội chuẩn bổ sung vào mẫu thử, tính bằng mililit (ml);
ms là khối lượng mẫu thử, tính bằng gam (g);
100 là hệ số chuyển đổi kết quả từ miligam sang miligam;
Vs là thể tích mẫu thử, tính bằng mililit (ml);
100 là hệ số chuyển đổi khối lượng hoặc thể tích từ gam sang 100 gam hoặc từ mililit sang 100 mililit.
9 Biểu thị kết quả
Báo cáo kết quả thử nghiệm bằng mg/100 g hoặc mg/100 ml đến một chữ số sau dấu phẩy.
Phụ lục A
(Tham khảo)
Các ví dụ về sắc ký đồ
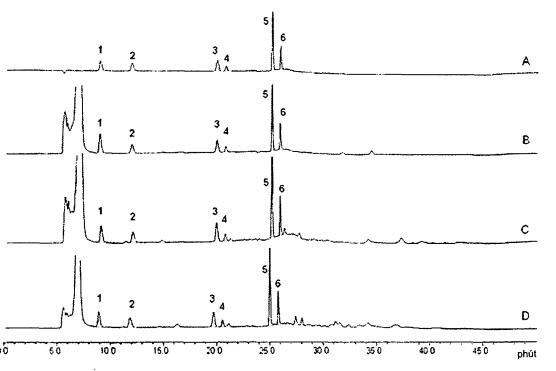
CHÚ DẪN
| A hỗn hợp các chất chuẩn nucleotid B thức ăn công thức dành cho trẻ sơ sinh từ sữa bò C thức ăn công thức dành cho trẻ sơ sinh từ đậu nành D thức ăn công thức cho trẻ sơ sinh từ protein sữa đã thủy phân | 1 cytidin 5’-monophosphat (CMP) 2 uridin 5'-monophosphat (UMP) 3 guanosin 5'-monophosphat (GMP) 4 inosin 5'-monophosphat (IMP) 5 thymidin 5'-monophosphat (TMP) 6 adenosine 5‘-monophosphat (AMP) |
Hình A.1 - Ví dụ về các sắc ký đồ
Phụ lục B
(Tham khảo)
Dữ liệu về độ chụm
Các dữ liệu nêu trong các Bảng B.1 đến Bảng B.7 thu được từ nghiên cứu liên phòng thử nghiệm và đã được công bố năm 2015 [3,4] phù hợp với TCVN 6910-2 (ISO 5725-2)[5] và AOAC-IUPAC đối với quy trình nghiên cứu cộng tác để đánh giá độ chụm của phương pháp phân tích[6]. Nghiên cứu đã được thực hiện dựa trên các yêu cầu nêu trong tài liệu tham khảo [7].
Bảng B.1 - Dữ liệu độ chụm đối với mẫu thực hành trên chất chuẩn NIST 1849a được chứng nhận
| Thông số | CMP | UMP | GMP | IMP | AMP |
| Tổng số phòng thí nghiệm, n | 12 | 12 | 12 | 11a | 12 |
| Tổng số phép lặp lại, 2n | 24 | 24 | 24 | 22 | 24 |
| Trung bình tổng các dữ liệu, | 28,14 | 11,76 | 15,07 | n/a | 10,87 |
| Độ lệch chuẩn lặp lại, sr, mg/100 g | 0,46 | 0,30 | 0,38 | n/a | 0,22 |
| Độ lệch chuẩn tái lập, sR, mg/100 g | 1,36 | 0,59 | 0,68 | n/a | 0,47 |
| Giới hạn lặp lại trong SMPR | ≤ 6% | ≤ 6% | ≤ 6% | n/a | ≤ 6% |
| Hệ số biến thiên lặp lại, Cv,r,% | 1,6 | 2,5 | 2,5 | n/a | 2,1 |
| Giới hạn tái lập trong SMPR | ≤ 11% | ≤ 11% | ≤ 11% | n/a | ≤ 11% |
| Hệ số biến thiên tái lập, CV,R,% | 4,8 | 5,0 | 4,5 | n/a | 4,4 |
| Trị số HorRat | 0,7 | 0,6 | 0,6 | n/a | 0,6 |
| a Không quá 2/9 phòng thử nghiệm loại trừ khỏi phép phân tích thống kê. n/a Không xác định. | |||||
Bảng B.2 - Dữ liệu độ chụm đối với mẫu thức ăn công thức cho trẻ sơ sinh không chứa lactose
| Thông số | CMP | UMP | GMP | IMP | AMP |
| Tổng số phòng thí nghiệm, n | 12 | 12 | 24 | 12 | 12 |
| Tổng số phép lặp lại, 2n | 24 | 24 | 1,45 | 24 | 24 |
| Trung bình tổng các dữ liệu, | 11,42 | 3,84 | 0,03 | 1,65 | 3,34 |
| Độ lệch chuẩn lặp lại, sr, mg/100 g | 0.12 | 0,09 | 0,04 | 0,05 | 0,05 |
| Độ lệch chuẩn tái lập, sR, mg/100 g | 0,89 | 0,30 | 24 | 0,10 | 0,09 |
| Giới hạn lặp lại trong SMPR | ≤ 6% | ≤ 6% | ≤ 6% | ≤ 6% | ≤ 6% |
| Hệ số biến thiên lặp lại, Cv,r,% | 1,1% | 2,4% | 1,8% | 2,8% | 1,4% |
| Giới hạn tái lập trong SMPR | ≤ 11% | ≤ 11% | ≤ 11% | ≤ 11% | ≤ 11% |
| Hệ số biến thiên tái lập, CV,R,% | 7,8% | 7,9% | 2,8% | 6,1% | 2,7% |
| Trị số HorRat | 1,0 | 0,9 | 0,3 | 0,6 | 0,3 |
Bảng B.3 - Dữ liệu độ chụm đối với mẫu thức ăn công thức cho trẻ sơ sinh từ tinh bột
| Thông số | CMP | UMP | GMP | IMP | AMP |
| Tổng số phòng thí nghiệm, n | 11a | 11a | 11a | 11a | 11a |
| Tổng số phép lặp lại, 2n | 22 | 22 | 22 | 22 | 22 |
| Trung bình tổng các dữ liệu, | 10,99 | 3,88 | 1,67 | 1,66 | 3,54 |
| Độ lệch chuẩn lặp lại, sr, mg/100 g | 0,30 | 0,21 | 0,03 | 0,02 | 0,08 |
| Độ lệch chuẩn tái lập, sR, mg/100 g | 0,81 | 0,31 | 0,07 | 0,17 | 0,11 |
| Giới hạn lặp lại trong SMPR | ≤ 6% | ≤ 6% | ≤ 6% | ≤ 6% | ≤ 6% |
| Hệ số biến thiên lặp lại, Cv,r,% | 2,7% | 5,4% | 1,6% | 1,4% | 2,1% |
| Giới hạn tái lập trong SMPR | ≤ 11% | ≤ 11% | ≤ 11% | ≤ 11% | ≤ 11% |
| Hệ số biến thiên tái lập, CV,R,% | 7,4% | 8,4% | 4,2% | 10,3% | 3,0% |
| Trị số HorRat | 0,9 | 0,9 | 0,4 | 1,0 | 0,3 |
| a Không quá 2/9 phòng thử nghiệm loại trừ khỏi phép phân tích thống kê. | |||||
Bảng B.4 - Dữ liệu độ chụm đối với mẫu thức ăn công thức cho trẻ sơ sinh có chất thủy phân
| Thông số | CMP | UMP | GMP | IMP | AMP |
| Tổng số phòng thí nghiệm, n | 12 | 12 | 12 | 11a | 12 |
| Tổng số phép lặp lại, 2n | 24 | 24 | 24 | 22 | 24 |
| Trung bình tổng các dữ liệu, | 9,72 | 4,15 | 1,38 | 2,46 | 4,73 |
| Độ lệch chuẩn lặp lại, sr, mg/100 g | 0,26 | 0,13 | 0,05 | 0,04 | 0,19 |
| Độ lệch chuẩn tái lập, sR, mg/100 g | 0,69 | 0,36 | 0,11 | 0,13 | 0,30 |
| Giới hạn lặp lại trong SMPR | ≤ 6% | ≤ 6% | ≤ 6% | ≤ 6% | ≤ 6% |
| Hệ số biến thiên lặp lại, Cv,r,% | 2,7% | 3,1% | 3,9% | 1,8% | 3,9% |
| Giới hạn tái lập trong SMPR | ≤ 11% | ≤ 11% | ≤ 11% | ≤ 11% | ≤ 11% |
| Hệ số biến thiên tái lập, CV,R,% | 7,1% | 8,7% | 7,7% | 5,5% | 6,2% |
| Trị số HorRat | 0,9 | 1,0 | 0,7 | 0,6 | 0,7 |
| a Không quá 2/9 phòng thử nghiệm loại trừ khỏi phép phân tích thống kê. | |||||
Bảng B.5 - Dữ liệu độ chụm đối với mẫu thức ăn công thức cho trẻ sơ sinh từ đậu nành
| Thông số | CMPa | UMPa | GMPa | IMPa | AMPa |
| Tổng số phòng thí nghiệm, n | 12 | 12 | 12 | 12 | 12 |
| Tổng số phép lặp lại, 2n | 24 | 24 | 24 | 24 | 24 |
| Trung bình tổng các dữ liệu, | 0,50 | 0,19 | 0,22 | 0,16 | 0,54 |
| Độ lệch chuẩn lặp lại, sr, mg/100 g | 0,19 | 0,05 | 0,05 | 0,07 | 0,11 |
| Độ lệch chuẩn tái lập, sR, mg/100 g | 0,34 | 0,14 | 0,18 | 0,25 | 0,30 |
| Giới hạn lặp lại trong SMPR | ≤ 8% | ≤ 10% | ≤ 10% | ≤ 10% | ≤ 8% |
| Hệ số biến thiên lặp lại, Cv,r,% | 38,5% | 25,0% | 22,9 | 43,7% | 20,4% |
| Giới hạn tái lập trong SMPR | ≤ 16% | ≤ 20% | ≤ 20% | ≤ 20% | ≤ 16% |
| Hệ số biến thiên tái lập, CV,R,% | 67,1% | 72,0% | 82,7% | 156,2% | 55,7% |
| Trị số HorRat | 5,3 | 5,0 | 5,8 | 10,5 | 4,5 |
| CHÚ THÍCH: Thức ăn công thức từ đậu tương không được thêm chuẩn bằng nucleotid và chỉ chứa mức nội sinh. a Không quá 2/9 phòng thử nghiệm loại trừ khỏi phép phân tích thống kê. | |||||
Bảng B.6 - Dữ liệu độ chụm đối với mẫu 1 thức ăn công thức cho trẻ sơ sinh chứa whey
| Thông số | CMP | UMP | GMP | IMP | AMP |
| Giá trị | Giá trị | Giá trị | Giá trị | Giá trị | |
| Tổng số phòng thí nghiệm, n | 12 | 12 | 12 | 10a | 12 |
| Tổng số phép lặp lại, 2n | 24 | 24 | 24 | 18 | 24 |
| Trung bình tổng các dữ liệu, | 5,47 | 3,52 | 1,05 | n/a | 3,51 |
| Độ lệch chuẩn lặp lại, sr, mg/100 g | 0,15 | 0,05 | 0,02 | n/a | 0,06 |
| Độ lệch chuẩn tái lập, sR, mg/100 g | 0,48 | 0,31 | 0,04 | n/a | 0,18 |
| Giới hạn lặp lại trong SMPR | ≤ 6% | ≤ 6% | ≤ 6% | n/a | ≤ 6% |
| Hệ số biến thiên lặp lại, Cv,r,% | 2,7% | 1,5% | 2,2% | n/a | 1,7% |
| Giới hạn tái lập trong SMPR | ≤ 11% | ≤ 11% | ≤ 11% | n/a | ≤ 11% |
| Hệ số biến thiên tái lập, CV,R,% | 8,7% | 8,8% | 4,1% | n/a | 5,0% |
| Trị số HorRat | 1,0 | 0,9 | 0,4 | n/a | 0,5 |
| a Không quá 2/9 phòng thử nghiệm loại trừ khỏi phép phân tích thống kê. n/a Không xác định. | |||||
Bảng B.7 - Dữ liệu độ chụm đối với mẫu 2 thức ăn công thức cho trẻ sơ sinh chứa whey
| Thông số | CMP | UMP | GMP | IMP | AMP |
| Giá trị | Giá trị | Giá trị | Giá trị | Giá trị | |
| Tổng số phòng thí nghiệm, n | 11a | 12 | 11a | 10a | 11a |
| Tổng số phép lặp lại, 2n | 22 | 24 | 22 | 22 | 22 |
| Trung bình tổng các dữ liệu, | 5,43 | 3,54 | 1,05 | n/a | 3,51 |
| Độ lệch chuẩn lặp lại, sr, mg/100 g | 0,09 | 0,11 | 0,04 | n/a | 0,05 |
| Độ lệch chuẩn tái lập, sR, mg/100 g | 0,43 | 0,32 | 0,05 | n/a | 0,15 |
| Giới hạn lặp lại trong SMPR | ≤ 6% | ≤ 6% | ≤ 6% | n/a | ≤ 6% |
| Hệ số biến thiên lặp lại, Cv,r,% | 1,6% | 3,2 | 3,4% | n/a | 1,3% |
| Giới hạn tái lập trong SMPR | ≤ 11% | ≤ 11% | ≤ 11% | n/a | ≤ 11% |
| Hệ số biến thiên tái lập, CV,R,% | 7,9% | 9,0% | 5,2% | n/a | 4,3% |
| Trị số HorRat | 0,9 | 1,0 | 0,5 | n/a | 0,5 |
| a Không quá 2/9 phòng thử nghiệm loại trừ khỏi phép phân tích thống kê. n/a Không xác định. | |||||
Thư mục tài liệu tham khảo
[1] GILL B.D., INDYK H.E., KUMAR M.C., SIEVWRIGHT N.K., MANLEY-HARRIS M. A liquid chromatographic method for routine analysis of 5'-mononucleotides in pediatric formulas. J. AOAC Int. 2010, 93 pp. 966-973
[2] GILL B.D., INDYK H.E., MANLEY-HARRIS M. Analysis of nucleosides and nucleotides in infant formula by liquid chromatography-tandem mass spectrometry. Anal. Bioanal. Chem. 2013, 405 pp. 5311-5319
[3] OMA 2011.20, Analysis of Nucleotide 5'-Monophosphates in Infant Formulas by HPLC-UV: Collaborative Study
[4] GILL B.D., INDYK H.E. Analysis of Nucleotide 5'-Monophosphates in Infant Formulas by HPLC-UV: Collaborative Study, Final Action 2011.20. J. AOAC Int. 2015, 98 pp. 971-979
[5] TCVN 6910-2 (ISO 5725-2) Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo. Phần 2: Phương pháp cơ bản xác định độ lặp lại và độ tái lập của phương pháp đo tiêu chuẩn.
[6] AOAC INTERNATIONAL AOAC Official Methods Program, Associate Referee's Manual on development, Study, Review, and Approval Process. Part IV AOAC Guidelines for Collaborative Studies, 1995, pp. 23-51.
[7] AOAC SMPR 2011.008, Standard method performance requirements for nucleotides in infant formula and adult/pediatric nutritional formula
1) Ví dụ về sản phẩm thích hợp có bán sẵn. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng chúng. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
2) Ví dụ về sản phẩm thích hợp có bán sẵn. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn, tiêu chuẩn này không ấn định phải sử dụng chúng. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 9515:2017 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 9515:2017 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 9515:2017 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 9515:2017 DOC (Bản Word)