- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn TCVN 13633:2023 Mỹ phẩm - Vi sinh vật - Định lượng nấm men và nấm mốc
| Số hiệu: | TCVN 13633:2023 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Thực phẩm-Dược phẩm |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
25/04/2023 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 13633:2023
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 13633:2023
TIÊU CHUẨN QUỐC GIA
TCVN 13633:2023
ISO 16212:2017
WITH AMENDMENT 1:2022
MỸ PHẨM - VI SINH VẬT - ĐỊNH LƯỢNG NẤM MEN VÀ NẤM MỐC
Cosmetics - Microbiology - Enumeration of yeast and mould
Lời nói đầu
TCVN 13633:2023 hoàn toàn tương đương với ISO 16212:2017 và sửa đổi 1:2022.
TCVN 13633:2023 do Viện Kiểm nghiệm Thuốc thành phố Hồ Chí Minh biên soạn, Bộ Y tế đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Lời giới thiệu
Vi sinh vật (vi khuẩn, nấm men và nấm mốc) xuất hiện khá phổ biến trong môi trường tự nhiên.
Chúng có thể nhiễm vào sản phẩm mỹ phẩm từ các nguyên liệu đầu vào hay trong quá trình sản xuất. Mỹ phẩm khi bị nhiễm vi sinh vật vượt quá mức quy định có thể làm giảm chất lượng và gây hại cho người sử dụng.
Do đó, để đảm bảo chất lượng sản phẩm và an toàn cho người sử dụng, cần định lượng nấm men, nấm mốc có trong sản phẩm mỹ phẩm.
Tiêu chuẩn này đưa ra các hướng dẫn chung để định lượng nấm men và nấm mốc có trong mỹ phẩm bằng cách đếm các khuẩn lạc trên môi trường thạch chọn lọc sau khi ủ hiếu khí.
MỸ PHẨM - VI SINH VẬT - ĐỊNH LƯỢNG NẤM MEN VÀ NẤM MỐC
Cosmetics - Microbiology - Enumeration of yeast and mould
1 Phạm vi áp dụng
Tiêu chuẩn này đưa ra các hướng dẫn chung để định lượng nấm men và nấm mốc có trong mỹ phẩm bằng cách đếm các khuẩn lạc trên môi trường thạch chọn lọc sau khi ủ hiếu khí.
Để đảm bảo chất lượng và độ an toàn cho người dùng, thực hiện phân tích rủi ro vi sinh vật phù hợp để xác định loại sản phẩm mỹ phẩm áp dụng tiêu chuẩn này. Các sản phẩm được coi là có rủi ro vi sinh thấp, dựa trên đánh giá rủi ro được mô tả trong TCVN 13641:2023 (ISO 29621) như các sản phẩm có hoạt độ nước thấp, sản phẩm chứa cồn hoặc giá trị pH cực đoan, .v.v.
Do có rất nhiều loại sản phẩm mỹ phẩm, nên phương pháp này có thể không phù hợp để phân tích một số sản phẩm (ví dụ một số sản phẩm có khả năng tan trong nước). Các phương pháp khác (ví dụ như phương pháp tự động) có thể thay thế cho các thử nghiệm sinh hóa trình bày ở đây với điều kiện phương pháp đó được chứng minh là tương đương hoặc phù hợp.
Nấm men đã được định lượng có thể được định danh bằng các phép thử định danh thích hợp, ví dụ các phép thử được mô tả trong các tiêu chuẩn được liệt kê trong Thư mục tài liệu tham khảo. Nấm mốc được định lượng có thể được định danh bằng các phương pháp thích hợp khác, nếu cần.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau đây rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả sửa đổi, bổ sung (nếu có).
TCVN 13637, Mỹ phẩm - Vi sinh - Hướng dẫn chung về kiểm tra vi sinh vật (ISO 21148, Cosmetics - Microbiology - General instructions for microbiological examination).
EN 12353, Chemical disinfectants and antiseptics - Preservation of test organisms used for the determination of bactericidal (including Legionella), mycobactericidal, sporicidal, fungicidal and virucidal (including bacteriophages) activity (Thuốc khử khuẩn và chất khử khuẩn hoá học - Bảo quản các sinh vật thử nghiệm dùng để xác định hoạt tính diệt khuẩn (bao gồm Legionella), diệt khuẩn nấm, diệt bào tử khuẩn, diệt virus (bao gồm cả thực khuẩn thể)
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này áp dụng các thuật ngữ và định nghĩa sau.
3.1
Nấm men (yeast)
Một loại nấm đơn bào, có tế bào sinh dưỡng có khả năng phát triển trong điều kiện thử nghiệm chuyên biệt được quy định trong tiêu chuẩn này.
3.2
Nấm mốc (mould)
Vi nấm hình thành hệ sợi, bao gồm các bào tử và bào tử đính, có khả năng phát triển theo các điều kiện thử nghiệm chuyên biệt được quy định trong tiêu chuẩn này.
3.3
Sản phẩm (product)
Phần sản phẩm mỹ phẩm xác định nhận được trong phòng thí nghiệm để thử nghiệm.
3.4
Mẫu (sample)
Một phần của sản phẩm (3.3) (ít nhất 1 g hoặc 1 ml) được dùng để chuẩn bị hỗn dịch ban đầu.
3.5
Hỗn dịch ban đầu (initial suspension)
Hỗn dịch hay dung dịch của mẫu (3.4) trong thể tích nhất định của môi trường tăng sinh lỏng phù hợp.
3.6
Mẫu pha loãng (sample dilution)
Mẫu được pha loãng từ hỗn dịch ban đầu (3.5).
4 Nguyên tắc
4.1 Quy định chung
Phương pháp thử này liên quan đến việc đếm các khuẩn lạc trên môi trường thạch chọn lọc. Phải trung hòa các yếu tố có thể ức chế sự phát triển của nấm có trong mẫu để có thể đếm được vi sinh vật sống.
Trong tất cả các trường hợp và với bất cứ phương pháp nào việc trung hòa các chất kháng vi sinh vật trong sản phẩm phải được kiểm tra và chứng minh.
4.2 Phương pháp đĩa thạch
Phương pháp đĩa thạch bao gồm các bước sau:
— Chuẩn bị đĩa petri cho phương pháp trài hoặc trộn, sử dụng môi trường nuôi cấy theo quy định và cấy một lượng xác định hỗn dịch ban đầu hoặc dịch pha loãng của sản phẩm vào các đĩa.
— Ủ hiếu khí các đĩa ở 22,5 °C ± 2,5 °C trong 3 đến 5 ngày.
— Đếm số khuẩn lạc (CFU) và tính số lượng nấm men và nấm mốc trong một gram hay một ml sản phẩm.
CHÚ THÍCH: Thay đổi điều kiện ủ 22,5 °C ± 2,5 °C trong 5 đến 7 ngày khi sử dụng môi trường nuôi cấy không bổ sung kháng sinh.
4.3 Phương pháp màng lọc
Phương pháp màng lọc bao gồm các bước sau:
— Thấm ướt màng lọc bằng một lượng nhỏ dung dịch pha loãng vô khuẩn, chuyển một lượng mẫu thích hợp như mô tả tại Điều 12 lên màng lọc. Tiến hành lọc ngay sau đó và rửa lại màng lọc theo quy trình theo hướng dẫn (12.3.4). Chuyển màng lọc lên bề mặt đĩa thạch chứa môi trường quy định theo hướng dẫn trong TCVN 13637 (ISO 21148).
— Ủ hiếu khí đĩa chứa màng lọc ở 22,5 °C ± 2,5 °C trong 3 đến 5 ngày.
— Đếm số lượng khuẩn lạc (CFU) và tính toán số lượng nấm men nấm mốc trong 1 g hoặc 1 ml sản phẩm.
CHÚ THÍCH: Thay đổi điều kiện ủ 22,5 °C ± 2,5 °C trong 5 đến 7 ngày khi sử dụng môi trường nuôi cấy không bổ sung kháng sinh.
5 Dung dịch pha loãng, chất trung hoà và môi trường nuôi cấy
5.1 Quy định chung
Chỉ dẫn chung được đưa ra trong TCVN 13637 (ISO 21148). Nước được đề cập trong tiêu chuẩn này là nước cất hoặc nước tinh khiết theo quy định trong TCVN 13637 (ISO 21148).
Các dung dịch pha loãng, chất trung hòa và môi trường nuôi cấy sau đây phù hợp để định lượng nấm men và nấm mốc. Các dung dịch pha loãng, chất trung hòa và môi trường nuôi cấy khác có thể được sử dụng nếu được chứng minh là phù hợp để sử dụng.
5.2 Dung dịch pha loãng có chất trung hòa và dung dịch pha loãng
5.2.1 Quy định chung
Dịch pha loãng được sử dụng để phân tán mẫu. Có thể chứa chất trung hòa nếu mẫu có đặc tính kháng khuẩn. Hiệu quả của việc trung hòa cần được chứng minh trước khi thực hiện bước đếm (xem 12). Thông tin liên quan đến chất trung hòa thích hợp được nêu trong Phụ lục D.
5.2.2 Dung dịch pha loãng có chất trung hòa
5.2.2.1 Môi trường casein thủy phân - lecithin đậu tương - polysorbat 20 (SCDLP 20 broth)
5.2.2.1.1 Thành phần
| Casein thủy phân bởi pancreatin | 20,0 g |
|
| Lecithin đậu tương | 5,0 g |
|
| Polysorbat 20 | 40,0 ml |
|
| Nước | 960 ml |
|
5.2.2.1.2 Chuẩn bị
Hòa tan polysorbate 20 trong 960 ml nước bằng cách vừa khuấy vừa đun nóng trong bể cách thủy ở 49 °C ± 2 °C. Thêm casein thủy phân bởi pancreatin và lecithin đậu tương. Đun nóng khoảng 30 min để tan hoàn toàn. Phân phối môi trường vào bình có thể tích thích hợp. Hấp tiệt khuẩn ở 121 °C trong 15 min. Sau khi hấp và để nguội, pH phải đạt khoảng 7,3 ± 0,2 khi đo ở nhiệt độ phòng.
5.2.2.2 Dung dịch pha loãng có chất trung hòa khác
Các dung dịch pha loãng có chất trung hòa khác có thể được sử dụng thích hựp (xem Phụ lục A và Phụ lục D).
5.2.3 Dung dịch pha loãng
5.2.3.1 Dung dịch A
5.2.3.1.1 Thành phần
| Pepton từ mô động vật | 1,0 g |
|
| Nước | 1 000 ml |
|
5.2.3.1.2 Chuẩn bị
Hoà tan 1 g pepton vào 1 000 ml nước bằng cách vừa khuấy vừa đun nóng. Phân phối môi trường vào các bình chứa có thể tích thích hợp. Hấp tiệt khuẩn ở 121 °C trong 15 min. Sau khi hấp và để nguội, pH phải đạt khoảng 7,1 ± 0,2 khi đo ở nhiệt độ phòng.
5.2.3.2 Dịch pha loãng khác
Các dịch pha loãng khác có thể được sử dụng thích hợp (xem Phụ lục B).
5.3 Dung dịch pha loãng cho hỗn dịch nấm men (Dung dịch Natri tryptone chlorid)
5.3.1 Thành phần
| Tryptone, casein thủy phân bởi pancreatin | 1,0 g |
|
| Natri clorua | 8.5 g |
|
| Nước | 1 000 ml |
|
5.3.2 Chuẩn bị
Hoà tan các thành phần trong nước bằng cách vừa khuấy vừa đun nóng. Phân phối môi trường vào bình chứa có thể tích thích hợp. Hấp tiệt khuẩn ở 121 °C trong 15 min. Sau khi hấp và để nguội, pH phải đạt khoảng 7,0 ± 0,2 khi đo ở nhiệt độ phòng.
5.4 Môi trường nuôi cấy
5.4.1 Yêu cầu chung
Môi trường nuôi cấy có thể được chuẩn bị như sau, hoặc chuẩn bị từ môi trường khô theo hướng dẫn của nhà sản xuất. Môi trường pha sẵn có thể được sử dụng khi các thành phần và / hoặc hiệu suất sinh trưởng của chúng tương đương với các công thức được đưa ra ở đây.
5.4.2 Môi trường thạch sabouraud dextrose chloramphenicol (SDCA)
| Dextrose | 40,0 g |
|
| Pepton từ mô động vật | 5,0 g |
|
| Casein thủy phân bởi pancreatin | 5,0 g |
|
| Chloramphenicol | 0,05 g |
|
| Thạch | 15,0 g |
|
| Nước | 1 000ml |
|
5.4.2.1 Chuẩn bị
Hòa tan các thành phần (bao gồm chloramphenicol) hoặc môi trường khô hoàn chỉnh trong nước bằng cách vừa khuấy vừa đun nóng. Phân phối môi trường vào các bình có thể tích thích hợp. Hấp tiệt khuẩn ở 121 °C trong 15 min. Sau khi hấp và để nguội, pH phải đạt khoảng 5,6 ± 0,2 khi đo ở nhiệt độ phòng.
LƯU Ý: Đối với các sản phẩm đã biết là không có khả năng tạp nhiễm (vi khuẩn), sử dụng môi trường không chứa kháng sinh chloramphenicol.
5.4.3 Các môi trường nuôi cấy khác
Có thể sử dụng môi trường thích hợp khác (xem Phụ lục C).
5.4.4 Môi trường thạch để nuôi cấy chủng vi sinh vật chuẩn: Môi trường thạch Sabouraud dextrose (SDA)
5.4.4.1 Thành phần
| Dextrose | 40,0 g |
|
| Pepton từ mô động vật | 5,0 g |
|
| Casein thủy phân bởi pancreatin | 5,0 g |
|
| Chloramphenicol | 0,05 g |
|
| Thạch | 15,0 g |
|
| Nước | 1 000ml |
|
5.4.4.2 Chuẩn bị
Hòa tan các thành phần trên hoặc môi trường khô hoàn chỉnh trong nước bằng cách vừa khuấy vừa đun nóng. Phân phối môi trường vào các bình có thể tích thích hợp. Hấp tiệt khuẩn ở 121 °C trong 15 min. Sau khi hấp và để nguội, pH phải đạt khoảng 5,6 ± 0,2 khi đo ở nhiệt độ phòng.
6 Thiết bị và dụng cụ thủy tinh
Sử dụng thiết bị phòng thí nghiệm, thiết bị và dụng cụ thủy tinh được mô tả trong TCVN 13637 (ISO 21148).
7 Chủng vi sinh vật
Để xác nhận hiệu quả của chất trung hòa, sử dụng chủng nấm men sau:
— Candida albicans ATCC[1]) 10231 hoặc chủng tương đương: CIP[2]) 48.72 hoặc NCPF[3]) 3179 hoặc NBRC[4]) 1594 hoặc KCTC[5]) 17205 hoặc TISTR[6]) 5779 hoặc các chủng tương đương trong bộ sưu tập chủng giống quốc gia khác.
Các chủng nấm men được lựa chọn đang được xem là có độ nhạy cảm với hoạt tính kháng nấm hơn là nấm mốc và được chấp nhận như là loài đại diện cho nhóm nấm để thực hiện phép thử xác định sự phù hợp của phương pháp. Tuy nhiên trong trường hợp đặc biệt, trong TCVN/ISO có hướng dẫn về lựa chọn chủng nấm mốc và sử dụng quy trình phù hợp để tạo thành một hỗn dịch chủng đối chứng (ví dụ xem EN13624:2013, mục 5.4.1.4).
Các chủng trên cần được hoàn nguyên theo quy trình hướng dẫn của nhà cung cấp.
Các chủng có thể được lưu giữ trong phòng thí nghiệm theo (EN 12353).
8 Xử lý sản phẩm mỹ phẩm và mẫu thử phòng thí nghiệm
Nếu cần thiết, giữ sản phẩm thử nghiệm ở nhiệt độ phòng.
Không được ủ, làm lạnh hoặc cấp đông sản phẩm (3.3) và mẫu (3.4) trước hoặc sau khi phân tích.
Mẫu thử của các sản phẩm mỹ phẩm chuẩn bị để phân tích nên được tiến hành như mô tả trong TCVN 13637 (ISO 21148). Mẫu phân tích như mô tả trong TCVN 13637 (ISO 21148) và theo quy trình đưa ra trong Điều 9.
9 Cách tiến hành
9.1 Khuyến cáo chung
Sử dụng vật liệu vô khuẩn, thiết bị và kỹ thuật vô khuẩn để chuẩn bị mẫu thử nghiệm, hỗn dịch mẫu ban đầu và các dung dịch pha loãng. Khi chuẩn bị hỗn dịch mẫu ban đầu, khoảng thời gian từ lúc hoàn tất việc chuẩn bị đến lúc hỗn dịch mẫu ban đầu và / hoặc mẫu pha loãng bắt đầu tiếp xúc với môi trường nuôi cấy không nên quá 45 min, trừ khi có yêu cầu đặc biệt khác trong quy trình hoặc tài liệu đã thiết lập.
9.2 Chuẩn bị hỗn dịch ban đầu
9.2.1 Quy định chung
Hỗn dịch mẫu ban đầu được chuẩn bị từ ít nhất 1 g hoặc 1 ml sản phẩm được trộn đều dưới điều kiện thử nghiệm.
CHÚ THÍCH: S, khối lượng hay thể tích chính xác của mẫu thử nghiệm.
Hỗn dịch mẫu ban đầu thường có độ pha loãng 1:10. Lượng dung dịch pha loãng hoặc môi trường lớn hơn có thể được sử dụng nếu mẫu có nguy cơ nhiễm vi sinh vật cao và / hoặc nếu hoạt tính kháng khuẩn vẫn còn ở độ pha loãng 1:10.
9.2.2 Các sản phẩm trộn lẫn được trong nước
Chuyển lượng mẫu, S, của sản phẩm vào một thể tích phù hợp (ví dụ 9 ml) của dung dịch pha loãng trung hòa (5.2.2) hoặc dung dịch pha loãng (5.2.3).
CHÚ THÍCH: d là hệ số pha loãng.
9.2.3 Các sản phẩm không trộn lẫn được trong nước
Chuyển lượng mẫu, S, của sản phẩm vào trong một bình chứa phù hợp với một lượng thích hợp tác nhân phân tán (ví dụ polysorbat 80). Phân tán mẫu thử trong tác nhân hòa tan và thêm một thể tích (ví dụ 9 ml) dung dịch pha loãng trung hòa (5.2.2) hoặc dung dịch pha loãng (5.2.3).
CHÚ THÍCH: d là hệ số pha loãng
9.3 Phương pháp đếm
9.3.1 Pha loãng cho phương pháp đếm
Hỗn dịch mẫu ban đầu được tính là độ pha loãng đầu tiên. Nếu cần thiết, có thể thực hiện một dãy pha loãng tiếp theo (ví dụ 1:10) từ hỗn dịch mẫu ban đầu, sử dụng cùng một chất pha loãng (tùy theo mức độ tạp nhiễm dự kiến của sản phẩm).
Thông thường, thực hiện đếm khuẩn lạc trên ít nhất hai đĩa petri cho cùng một hệ số pha loãng. Nhưng có thể sử dụng một đĩa Petri trong trường hợp kiểm tra thường xuyên hoặc nếu phương pháp đếm được thực hiện trên các độ pha loãng liên tiếp của cùng một mẫu hoặc dựa theo các kết quả trước đó.
9.3.2 Phương pháp đĩa thạch
9.3.2.1 Phương pháp đổ đĩa thạch
Chuyển 1 ml hỗn dịch chủng ban đầu và / hoặc mẫu pha loãng đã được chuẩn bị như phần thẩm định vào các đĩa petri có đường kính từ 85 mm đến 100 mm (Điều 12), thêm vào mỗi đĩa từ 15 ml đến 20 ml môi trường thạch đã được làm nóng chảy và giữ trong bể ổn nhiệt không quá 48 °C. Nếu sử dụng các đĩa petri lớn hơn, lượng môi trường thạch cần tăng lên tương ứng.
Trộn hỗn dịch mẫu ban đầu và / hoặc dịch pha loãng mẫu với môi trường cẩn thận bằng cách xoay hoặc nghiêng các đĩa để phân tán đều. Để các đĩa trên bề mặt nằm ngang, hỗn hợp trong đĩa đông lại ở nhiệt độ phòng.
9.3.2.2 Phương pháp cấy trải
Trong các đĩa petri có đường kính từ 85 mm đến 100 mm, cho 15 ml đến 20 ml môi trường thạch đã được làm nóng chảy (5.4.2) và giữ trong bể ổn nhiệt không quá 48 °C. Nếu sử dụng các đĩa Petri lớn hơn, thể tích môi trường tăng lên tương ứng.
Để nguội và làm đông các đĩa trong tủ an toàn sinh học hoặc tủ ủ. Cấy trải lên bề mặt đĩa thạch một thể tích xác định không ít hơn 0,1 ml một lượng của hỗn dịch mẫu ban đầu và / hoặc mẫu pha loãng đã được chuẩn bị như mô tả tại Điều 12.
9.3.2.3 Phương pháp màng lọc
Sử dụng màng lọc có kích thước lỗ không lớn hơn 0,45 µm.
Chuyển một lượng hỗn dịch mẫu ban đầu hoặc mẫu pha loãng thích hợp (đại diện ít nhất 1 g hoặc 1 ml sản phẩm) lên màng.
Lọc và rửa màng (tiến hành theo quy trình thực hiện đánh giá sự phù hợp trong Điều 12).
Chuyển màng lọc lên bề mặt môi trường thạch (5.4.2).
9.3.2.4 Ủ mẫu
Trừ khi có quy định khác, lật ngược các đĩa đã có mẫu và đặt chúng vào trong tủ ấm ở 22,5 °C ± 2,5 °C trong 3 đến 5 ngày hoặc sử dụng điều kiện thay thế (xem chú thích 4.2 và 4.3). Sau khi ủ, các đĩa phải được kiểm tra ngay nếu có thể. Nếu không có quy định khác có thể bảo quản các đĩa này trong tủ lạnh ở 5 °C ± 3 °C tối đa là 24 h.
CHÚ THÍCH 1. Trong một số trường hợp nhất định, khi có khả năng gây nhầm lẫn trong việc đếm khuẩn lạc với các tiểu phân từ sản phẩm, có thể chuẩn bị các đĩa tương tự về độ pha loãng mẫu và môi trường thạch và được bảo quản trong tủ lạnh để so sánh với các đĩa đem ủ.
CHÚ THÍCH 2: Nếu nghi ngờ có cả nấm mốc và nấm men, cần đọc kết quả ở các thời điểm trung gian (mà không cần phải đợi đủ 3 đến 5 ngày).
10 Đếm khuẩn lạc (phương pháp đếm trên đĩa và phương pháp màng lọc)
Sau khi ủ, đếm khuẩn lạc.
- Trong các đĩa Petri chứa 15 khuẩn lạc đến 150 khuẩn lạc; nếu có ít hơn 15 khuẩn lạc (11.2.3).
- Trên màng lọc chứa 15 khuẩn lạc đến 150 khuẩn lạc; nếu có ít hơn 15 khuẩn lạc (11.2.3).
11 Biểu thị kết quả
11.1 Phương pháp tính toán kết quả cho phương pháp đĩa thạch.
Tính số N của các vi sinh vật có trong mẫu s, bằng cách sử dụng
- m, là số khuẩn lạc trung bình đếm trên hai đĩa cùng nồng độ tính theo Công thức (1);
- c, là số khuẩn lạc đếm trên một đĩa tính theo Công thức (2);
- ![]() , là số trung bình đã cân chỉnh từ hai độ pha loãng liên tiếp có số khuẩn lạc phù hợp tính theo công thức (3).
, là số trung bình đã cân chỉnh từ hai độ pha loãng liên tiếp có số khuẩn lạc phù hợp tính theo công thức (3).
| N = m / (V x d) | (1) |
| N = c / (V x d) | (2) |
|
| (3) |
| Trong đó: | m | là số khuẩn lạc trung bình đếm được từ hai đĩa có cùng nồng độ; |
|
| V | là thể tích của mẫu sau pha loãng vào mỗi đĩa, tính bằng ml; |
|
| d | là hệ số pha loãng tương ứng với độ pha loãng ở bước chuẩn bị hỗn dịch ban đầu (9.2) hoặc cho độ pha loãng lần đầu tiên; |
|
| c | là số khuẩn lạc đếm trên một đĩa đơn. |
![]() là trung bình đã cân chỉnh từ hai độ pha loãng liên tiếp có số khuẩn lạc phù hợp được tính như sau:
là trung bình đã cân chỉnh từ hai độ pha loãng liên tiếp có số khuẩn lạc phù hợp được tính như sau:
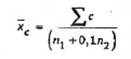
| Trong đó: | ∑c | là tổng các khuẩn lạc đếm trên tất cả các đĩa từ hai độ pha loãng liên tiếp; |
|
| n1 | là số lượng đĩa đếm được từ hỗn dịch mẫu ban đầu (hoặc đối với lần pha loãng đầu tiên); |
|
| n2 | là số lượng các đĩa được tính độ pha loãng 1/10 của hỗn dịch mẫu ban đầu (hoặc cho lần pha loãng thứ hai). |
Kết quả được làm tròn đến 2 chữ số có nghĩa. Khi số cần làm tròn nhỏ hơn 5 thì số đứng trước nó sẽ không phải thay đổi, khi số cuối cùng là 5 hoặc lớn hơn thì làm tròn số đứng ngay trước nó lên 1 đơn vị, tiếp tục cho đến khi thu được 2 chữ số có nghĩa. Ghi lại số N thu được.
11.2 Diễn giải kết quả
11.2.1 Cần xác định độ sai lệch trong phương pháp đếm đĩa.
Hai kết quả được coi là khác nhau khi có sự khác biệt trên 50 % hoặc, khi được thể hiện bằng log thì sự khác biệt vượt quá 0,3.
Để kết quả đếm chính xác, chỉ nên sử dụng các đĩa hoặc màng lọc có trên 15 khuẩn lạc và dưới 150 khuẩn lạc. Chọn kết quả đếm từ các độ pha loãng, mà tại đó sự phù hợp của phương pháp đã được chứng minh (Điều 12).
11.2.2 Trường hợp các đĩa có trên 15 khuẩn lạc và dưới 150 khuẩn lạc trên đĩa hoặc trên màng, biểu thị kết quả như sau:
- Nếu S ít nhất là 1 g hoặc 1 ml, và V là ít nhất 1 ml. Số lượng nấm men và nấm mốc trên mỗi mililit hoặc trên một gram mẫu = N / S.
- Nếu S dưới 1 g hoặc 1 ml, và / hoặc V ít hơn 1 ml. Số lượng nấm men và nấm mốc trong mẫu (lưu ý lượng mẫu đem thử, được coi là S và V) là = N.
Trong đó S là khối lượng hoặc là thể tích của mẫu thử.
Biểu diễn kết quả dưới dạng số giữa 1,0 và 9,9 nhân lên theo cấp số 10 (xem ví dụ).
11.2.3 Trường hợp các đĩa có dưới 15 khuẩn lạc trên đĩa hoặc trên màng lọc, biểu thị kết quả như sau:
- Nếu S ít nhất là 1 g hoặc 1 ml, và V là ít nhất 1 ml, ước tính số lượng nấm men và nấm mốc trên mỗi mililit hoặc trên một gram mẫu = N / S.
- Nếu S dưới 1 g hoặc 1 ml, và / hoặc ít hơn 1 ml, ước tính số nấm men và nấm mốc trong mẫu là = N.
Trong đó:
S là khối lượng hoặc thể tích của mẫu (9.2).
Biểu diễn kết quả dưới dạng số giữa 1,0 và 9,9 nhân lên theo cấp số 10 (xem ví dụ).
11.2.4 Trường hợp không thấy xuất hiện khuẩn lạc, kết quả được báo cáo như sau:
- Ít hơn 1 / d x V x S nấm men và nấm mốc trên mỗi gram hoặc mililít của sản phẩm (S ít nhất 1 g hoặc 1 ml).
- Ít hơn 1 / d x V nấm men và nấm mốc trong mẫu S (lưu ý lượng mẫu được thử, được coi là S và V và S ít hơn 1 g hoặc 1 ml).
Trong đó:
d là hệ số pha loãng của hỗn dịch mẫu ban đầu (xem 9.2).
V là 1 (đếm bằng phương pháp đổ đĩa thạch và lọc qua màng) hoặc 0,1 (đối với phương pháp cấy trải) (xem ví dụ).
VÍ DỤ 1: Một độ pha loãng cấy lên hai đĩa
S = 1 g ; V = 1; Số khuẩn lạc đếm được ở độ pha loãng 10-1 là 38 CFU và 42 CFU.
Nhập vào công thức (1):
N = m/(V x d) = 40 / (1 x 10-1) = 40 / (1 x 0,1) = 400 hoặc 4 x 102 tế bào nấm men và nấm mốc trên mỗi mililit hoặc trên một gram mẫu.
VÍ DỤ 2: Một độ pha loãng cấy lên một đĩa
S = 1g, V = 1, Số khuẩn lạc đếm được ở độ pha loãng 10-1 là 60 CFU.
Nhập vào công thức (2):
N = c / (V x d) = 60/(1 x 10-1) = 60 / (1 x 0,1) = 600 hoặc 6 x 102 tế bào nấm men và nấm mốc trên mỗi mililit hoặc trên một gram mẫu.
VÍ DỤ 3: Hai độ pha loãng cấy lên 2 đĩa
S = 1 g, V = 1, Số khuẩn lạc đếm được ở độ pha loãng 10-2 là 235 CFU và 282 CFU; độ pha loãng 10-3 là 31 CFU và 39 CFU.
Nhập vào công thức (3):
![]() = /(V x d) =( 235 + 282 + 31 + 39) / [(2 + 0,1 x 2) x (1 x 10-2)]= 587 / 0,022 = 26682.
= /(V x d) =( 235 + 282 + 31 + 39) / [(2 + 0,1 x 2) x (1 x 10-2)]= 587 / 0,022 = 26682.
Làm tròn kết quả như đã nêu ở trên 27000 hoặc 2,7 x 104 tế bào nấm men và nấm mốc trên mỗi mililit hoặc trên một gram mẫu.
VÍ DỤ 4: Một độ pha loãng cấy lên hai màng lọc
S = 1 g; V = 1; Số khuẩn lạc đếm được ở độ pha loãng 10-1 là 18 CFU và 22 CFU.
Nhập vào công thức (1):
N = m / (V x d)= 20 / (1 x 10-1) = 20 / (1 x 0,1) = 200 hoặc 2 x 102 tế bào nấm men và nấm mốc trên mỗi mililit hoặc trên một gram mẫu.
VÍ DỤ 5: Một độ pha loãng cấy lên một màng lọc
S = 1 g; V = 1; Số khuẩn lạc đếm được ở độ pha loãng 10-1 là 65 CFU.
Nhập vào công thức (2):
N = c / (V x d ) = 65 / (1 x 10-1) = 65 / 0,1 = 650 hoặc 6,5 x 102 tế bào nấm men và nấm mốc trên mỗi mililit hoặc trên một gram mẫu.
VÍ DỤ 6: Hai độ pha loãng cấy lên hai màng lọc
S = 1 g, V = 1; Số khuẩn lạc đếm được ở độ pha loãng 10-1 là 121 CFU và 105 CFU; Số khuẩn lạc đếm được ở độ pha loãng 10-2 là 15 CFU và 25 CFU.
Nhập vào công thức (3):
![]() = 121 + 105 + 15 + 25 /[(2 + 0,1 x 2) x (1 x 10-1)] = 266 / 0,22 = 1209.
= 121 + 105 + 15 + 25 /[(2 + 0,1 x 2) x (1 x 10-1)] = 266 / 0,22 = 1209.
Làm tròn kết quả như đã nêu ở trên cho phép 1200 hoặc 1,2 x 103 nấm men và nấm mốc trên mỗi mililit hoặc trên một gram mẫu.
VÍ DỤ 7: Một độ pha loãng cấy lên hai đĩa
S = 1 g; V = 1, Số khuẩn lạc đếm được ở độ pha loãng 10-1 là 28 CFU và 22 CFU.
Nhập vào công thức (1):
N = m / (V x d) = 25 / (1 x 10-1) = 25/(1 x 0,1) = 250.
Con số ước tính là 250 hoặc 2,5 x 102 nấm men và nấm mốc trên mỗi mililit hoặc trên một gram mẫu.
VÍ DỤ 8:
S = 1 g; i = 1, Số khuẩn lạc đếm được ở độ pha loãng 10-1 là 0 CFU và 0 CFU.
Nhập vào công thức (1):
N = ≤ 1 /d.v, S, ≤ (1 / 0,1).1,1 ≤ 10 tế bào nấm men và nấm mốc trên mỗi mililit hoặc trên một gram mẫu.
Con số ước tính ít hơn 10 nấm men và nấm mốc trên mỗi mililit hoặc trên một gram mẫu.
12 Trung hòa chất kháng nấm trong sản phẩm
12.1 Quy định chung
Các thử nghiệm khác nhau được mô tả dưới đây nhằm chứng minh các vi sinh vật có thể phát triển trong điều kiện phân tích.
12.2 Chuẩn bị nuôi cấy
Trước khi thử nghiệm, nuôi cấy bề mặt Candida albicans trên môi trường thạch không chọn lọc - Sabouraud dextrose agar (SDA). Ủ ở 32,5 °C ± 2,5 °C trong 18 h đến 24 h.
Để gặt chủng, dùng một que cấy vô khuẩn lấy khuẩn lạc trên bề mặt môi trường sau nuôi cấy ở trên và cho vào dịch pha loãng (5.2) để tạo ra hỗn dịch chủng có nồng độ tế bào vào khoảng 1x106 CFU/ml (ví dụ xác định nồng độ bằng máy quang phổ trong TCVN 13637 (ISO 21148).
Sử dụng hỗn dịch chuẩn này và các dung dịch pha loãng trong vòng 2 h.
12.3 Tính phù hợp của phương pháp đếm trên đĩa thạch
12.3.1 Nguyên tắc
Trộn với mẫu đã trung hòa (hỗn dịch mẫu ban đầu, hoặc mẫu pha loãng tùy theo hoạt tính kháng nấm hoặc khả năng hòa tan kém của sản phẩm) với chủng chuẩn đã pha loãng. Chuyển lên đĩa Petri hoặc lọc qua màng lọc. Sau khi ủ, kiểm tra đếm khuẩn lạc và so sánh với đĩa kiểm tra dương tính (không có mẫu thử).
Nếu số lượng đếm được ít hơn 50 % (0,3 log) so với đối chứng, cần phải thay đổi quy trình để loại bỏ các chất ức chế (pha loãng, dùng các chất trung hòa hoặc kết hợp cả hai, xem phụ lục D). Thử nghiệm được xem như không có giá trị khi vi sinh vật cấy vào không mọc, trừ khi sản phẩm không thể nhiễm bởi vi sinh vật này.
12.3.2 Thử nghiệm xác định tính phù hợp của phương pháp đổ đĩa thạch
Trộn 9 ml hỗn dịch mẫu ban đầu và / hoặc mẫu pha loãng trong dung dịch pha loãng có chất trung hòa (hoặc các dung dịch pha loãng khác, xem 5.2) với 1 ml hỗn dịch vi sinh vật có nồng độ 1 000 CFU/ml đến 3 000 CFU/ml. Chuyển 1 ml hỗn dịch trên vào đĩa petri (tốt nhất là lặp lại trên 2 đĩa), thêm vào mỗi dĩa 15 ml đến 20 ml môi trường đã được đun chảy (5.4.2) và giữ trong bể ổn nhiệt không quá 48 °C. Tiến hành song song đĩa kiểm tra dương tính sử dụng cùng chất pha loãng và bổ sung một lượng hỗn dịch vi sinh vật tương tự, nhưng không có mẫu.
Sau khi ủ 3 ngày đến 5 ngày ở nhiệt độ 22,5 °C ± 2,5 °C, hoặc sử dụng điều kiện thay thế (xem CHÚ THÍCH trong 4.2 và 4.3), đếm khuẩn lạc trên các đĩa và so sánh khuẩn lạc thu được từ mẫu thử và mẫu kiểm tra dương tính. Phương pháp pha loãng và đếm được chấp nhận tại độ pha loãng 1:10 (khi 1ml hỗn dịch mẫu ban đầu được sử dụng) nếu mẫu thử tính phù hợp đạt 50 % (0,3 log) so với mẫu kiểm tra dương tính.
12.3.3 Thử nghiệm xác định tính phù hợp của phương pháp cấy trải
Trộn 9 ml hỗn dịch mẫu ban đầu trong dung dịch pha loãng có chất trung hòa (hoặc dung dịch khác, xem 5.2) với 1 ml hỗn dịch vi sinh vật có chứa 10 000 CFU/ml đến 30 000 CFU/ml (hoặc thấp hơn nếu trải 0,5 ml hoặc 1 ml). Trải ít nhất 0,1 ml vào một đĩa thạch đã đông cứng (5.4.2) (tốt nhất là lặp lại trên 2 đĩa). Tiến hành song song với đĩa kiểm tra dương tính sử dụng cùng chất pha loãng và bổ sung một lượng hỗn dịch vi sinh vật tương tự, nhưng không có mẫu.
Sau khi ủ 3 ngày đến 5 ngày ở nhiệt độ 22,5 °C ± 2,5 °C, hoặc sử dụng điều kiện thay thế (xem CHÚ THÍCH trong 4.2 và 4.3), đếm khuẩn lạc trên các đĩa và so sánh khuẩn lạc thu được từ mẫu thử và mẫu kiểm tra dương tính. Phương pháp pha loãng và đếm được chấp nhận tại độ pha loãng 1:10 (khi 1ml hỗn dịch mẫu ban đầu được sử dụng) nếu mẫu thử tính phù hợp đạt 50 % (0,3 log) so với mẫu kiểm tra dương tính.
12.3.4 Thử nghiệm xác định tính phù hợp của phương pháp màng lọc
Trộn một thể tích hỗn dịch mẫu ban đầu hoặc mẫu đã pha loãng (9.3.2.3) với một lượng phù hợp của một hỗn dịch vi sinh vật đã chuẩn hóa tương ứng với khoảng 100 CFU.
Lọc ngay toàn bộ thể tích và rửa màng với một thể tích xác định của nước (5.1), dung dịch pha loãng (5.2.3) hoặc dung dịch pha loãng có chất trung hòa (5.2.2). Chuyển màng lên bề mặt môi trường thạch thích hợp (5.4.2).
Tiến hành song song với mẫu kiểm tra dương tính trong cùng điều kiện như trên, nhưng không có sản phẩm. Lọc và rửa mẫu kiểm tra dương tính như mẫu thử.
Sau khi ủ 3 ngày đến 5 ngày ở nhiệt độ 22,5 °C ± 2,5 °C hoặc sử dụng điều kiện thay thế (xem CHÚ THÍCH 4.2 và 4.3), đếm các khuẩn lạc trên màng và so sánh số khuẩn lạc thu được từ mẫu thử và mẫu kiểm tra dương tính. Phương pháp màng lọc và chất pha loãng được chấp nhận tại độ pha loãng 1:10 (khi 1 ml hỗn dịch mẫu ban đầu được sử dụng) nếu mẫu thử tính phù hợp đạt 50 % (0,3 log) so với mẫu kiểm tra dương tính.
13 Báo cáo thử nghiệm
Báo cáo thử nghiệm bao gồm:
a) Viện dẫn tiêu chuẩn này, nghĩa là TCVN 13633 (ISO 16212:2017); Amendment 1:2022;
b) Tất cả các thông tin cần thiết cho việc nhận diện sản phẩm;
c) Phương pháp đã sử dụng;
d) Các kết quả đã thu được;
e) Tất cả các chi tiết thực hiện để chuẩn bị hỗn dịch mẫu ban đầu;
f) Mô tả phương pháp với chất trung hòa và môi trường đã sử dụng;
g) Chứng minh sự phù hợp của phương pháp, ngay cả khi thử nghiệm đã được thực hiện riêng;
h) Bất kỳ điểm nào không được nêu trong tiêu chuẩn này, hoặc được coi là tùy chọn (không bắt buộc), cùng với các chi tiết về bất kỳ sự cố nào có thể ảnh hưởng đến kết quả.
Phụ lục A
(Tham khảo)
Các dung dịch pha loãng có chất trung hòa khác
A.1 Quy định chung
Bất cứ dung dịch trung hòa nào được sử dụng để tạo hỗn dịch mẫu ban đầu đều được kiểm tra và thẩm định. Các dung dịch trung hòa sau đây là các ví dụ về các dung dịch phù hợp. Thông tin chung về sự trung hòa được đưa ra ở Phụ lục D.
A.2 Môi trường lỏng Eugon LT100
A.2.1 Yêu cầu chung
Thành phần môi trường có chứa chất các chất trung hòa chất ức chế có trong mẫu (lecithin và polysorbat 80) chất phân tán (octoxynol 9).
A.2.2 Thành phần
| Casein thủy phân bởi pancreatin | 15,0 g |
|
| Pepton đậu tương hoặc Bột đậu tương thủy phân bởi Papaic | 5,0 g |
|
| L- cystin | 0,7 g |
|
| Natri clorid | 4,0 g |
|
| Sodium sulfit | 0,2 g |
|
| Glucose | 5,5 g |
|
| Lecithin từ trứng | 1,0 g |
|
| Polysorbat 80 | 5,0 g |
|
| Octoxynol 9 | 5,0 g |
|
| Nước | 1 000 ml |
|
A.2.3 Chuẩn bị
Hòa tan polysorbat 80, octoxynol 9 và lecithin từ trứng vào nước sôi cho đến khi tan hoàn toàn. Hòa tan các thành phần còn lại khác vào bằng cách vừa khuấy vừa đun nóng. Phân phối môi trường vào bình có thể tích thích hợp. Hấp tiệt khuẩn ở 121 °C trong 15 min. Sau khi hấp và để nguội, pH phải đạt khoảng 7,0 ± 0,2 khi đo ở nhiệt độ phòng.
A.3 Dung djch Lecithin polysorbate (LP)
A.3.1 Thành phần
| Polypepton | 1,0 g |
|
| Lecithin từ trứng | 0,7 g |
|
| Polysorbat 80 | 20,0 g |
|
| Nước | 980 ml |
|
A.3.2 Chuẩn bị
Hòa tan các thành phần trên trong nước bằng cách vừa khuấy vừa đun nóng. Phân phối môi trường vào bình có thể tích thích hợp. Hấp tiệt khuẩn ở 121 °C trong 15 min. Sau khi hấp và để nguội, pH phải đạt khoảng 7,2 ± 0,2 khi đo ở nhiệt độ phòng.
A.4 Môi trường Eugon LT lỏng cải tiến
A.4.1 Thành phần
| Casein thủy phân bởi prancreatin | 15,0 g |
|
| Bột đậu tương thủy phân bởi papain | 5,0 g |
|
| L-cystine | 0,7 g |
|
| Natri clorid | 4,0 g |
|
| Natri sulfit | 0,2 g |
|
| Glucose | 5,5 g |
|
| Lecithin từ trứng | 1,0 g |
|
| Polysorbat 80 | 5,0 g |
|
| Natri lauryl eter sulphate | 1,56 g |
|
| Nước | 1 000 ml |
|
A.4.2 Chuẩn bị
Hòa tan lần lượt từng thành phần polysorbate 80, lecithin từ trứng trong nước sôi để tan hoàn toàn. Hòa tan các thành phần còn lại khác bằng cách vừa khuấy vừa đun nóng. Phân phối vào các bình có thể tích thích hợp. Hấp tiệt khuẩn ở 121 °C trong 15 min. Sau khi hấp và để nguội, pH phải đạt khoảng khoảng 7,0 ± 0,2 khi đo ở nhiệt độ phòng.
Phụ lục B
(Tham khảo)
Các dung dịch pha loãng khác
B.1 Quy định chung
Bất cứ dung dịch nào được sử dụng để tạo ra hỗn dịch mẫu ban đầu đều được kiểm tra và thẩm định. Các dung dịch sau là ví dụ về các dung dịch phù hợp.
B.2 Dung dịch đệm pepton pH 7
B.2.1 Thành phần
| Pepton từ thịt | 1,0 g |
|
| Natri clorid | 4,3 g |
|
| Mono kali photphat | 3,6 g |
|
| Dinatri phosphate dihydrat | 7,2 g |
|
| Nước | 1 000 ml |
|
B.2.2 Chuẩn bị
Hòa tan các thành phần trên trong nước bằng cách vừa khuấy vừa đun nóng. Phân phối môi trường vào bình có thể tích thích hợp. Hấp tiệt khuẩn ở 121 °C trong 15 min. Sau khi hấp và để nguội, pH phải đạt khoảng 7,1 ± 0,2 khi đo ở nhiệt độ phòng.
B.3 Đệm photphat (pH 7,2)
B.3.1 Thành phần
| Kali dihydrogen phosphat | 34 g |
|
| Nước | 500 ml |
|
B.3.2 Chuẩn bị
Hòa tan các thành phần trong nước vào bình 1000 ml. Điều chỉnh pH 7,2 ± 0,1 với 175 ml Natri hydroxid (4,3 g/100 ml). Sau đó thêm nước vào để đạt được thể tích cuối cùng là 1000 ml. Nồng độ cuối cùng đạt 0,05 mol/l. Đây là dung dịch gốc. Bảo quản trong tủ lạnh.
Trước khi sử dụng, pha loãng dung dịch này với nước tỷ lệ 1:800 và hấp tiệt khuẩn ở 121 °C trong 15 min.
Phụ lục C
(Tham khảo)
Các môi trường nuôi cấy khác
C.1 Quy định chung
Bất cứ môi trường nuôi cấy nào được sử dụng cũng đã được kiểm tra và thẩm định. Các môi trường dưới đây là ví dụ về các môi trường phù hợp.
C.2 Môi trường thạch dùng để đếm
C.2.1 Môi trường thạch khoai tây dextrose bổ sung kháng sinh
C.2.1.1 Thành phần
| Dịch chiết từ khoai tây | 4,0 g |
|
| Glucose | 20,0 g |
|
| Thạch | 15,0 g |
|
| Chloramphenicol | 0,05 g |
|
| Nước | 1 000 ml |
|
C.2.1.2 Chuẩn bị
Hòa tan các thành phần trên trong nước bằng cách vừa khuấy vừa đun nóng. Phân phối môi trường vào bình có thể tích thích hợp. Hấp tiệt khuẩn ở 121 °C trong 15 min. Sau khi hấp và để nguội, pH phải đạt khoảng 5,6 ± 0,2 khi đo ở nhiệt độ phòng.
Có thể thay chloramphenicol bằng 0,10 g Kali benzylpenicillin và 0,10 g tetracillin cho 1 lít môi trường được thêm vào dưới dạng dung dịch vô khuẩn ngay trước khi sử dụng.
C.2.2 Môi trường Glucose-pepton (GP) có kháng sinh
C.2.2.1 Thành phần
| Glucose | 20,0 g |
|
| Cao nấm men | 2,0 g |
|
| Magnesi sulfat | 0,5 g |
|
| Pepton | 5,0 g |
|
| Monokali phosphat | 1.0 g |
|
| Thạch | 15,0 g |
|
| Chloramphenicol | 0,05 g |
|
| Nước | 1 000ml |
|
C.2.2.2 Chuẩn bị
Trộn các thành phần và phân phối vào bình có thể tích thích hợp. Hấp tiệt khuẩn ở 121 °C trong 15 min. Sau khi hấp và để nguội, pH phải đạt khoảng 5,7 ± 0,2 khi đo ở nhiệt độ phòng.
Có thể thay chloramphenicol bằng 0,10 g Kali benzylpenicillin và 0,10 g tetracillin cho 1 lít môi trường được thêm vào dưới dạng dung dịch vô khuẩn ngay trước khi sử dụng.
C.3 Môi trường thạch cao nấm men
C.3.1 Thành phần
| Cao nấm men | 30,0 g |
|
| Pepton đậu tương, bột đậu tương thủy phân bởi papaic | 3,0 g |
|
| Thạch | 15,0 g |
|
| Chloramphenicol | 0,05 g |
|
| Nước | 1 000 ml |
|
C.3.2 Chuẩn bị
Hòa tan các thành phần (bao gồm cả chloramphenicol) hoặc môi trường khô hoàn chỉnh trong nước bằng cách vừa khuấy vừa đun nóng. Phân phối môi trường vào các bình có thể tích thích hợp. Hấp tiệt khuẩn ở 115 °C trong 10 min. Sau khi hấp và làm nguội, pH phải đạt khoảng 5,6 ± 0,2 khi đo ở nhiệt độ phòng.
Phụ lục D
(Tham khảo)
Các chất trung hòa hoạt tính kháng vi sinh vật của chất bảo quản và các dung dịch rửa/ lọc
| Chất bảo quản | Hợp chất hóa học có thể trung hòa hoạt tính kháng khuẩn của chất bảo quản | Ví dụ về thành phần chất trung hòa thích hợp và các dung dịch rửa (dùng cho phương pháp màng lọc) |
| Các hợp chất phenol: Các paraben, phenoxyethanol, Phenylethanol, v.v... Các anilin | Lecithin, Polysorbat 80, Ethylen oxid ngưng tụ của cồn béo (fatty alcohol) Chất hoạt động bề mặt không ion | 30 g/l Polysorbat 80 + 3 g/l lecithin. 7 g/l Ethylen oxid ngưng tụ của cồn béo + 20 g/l lecithin + 4 g/l polysorbate 80. Môi trường lỏng trung hòa D/E. Dung dịch rửa: nước cất vô khuẩn; 1 g/1 trypton, + 9 g/l NaCI; 5 g/l polysorbat 80. |
| Các hợp chất amoni bậc bốn Các chất hoạt động bề mặt cation | Lecithin, saponin, polysorbat 80, natri dodecyl sulphat Ethylen oxid ngưng tụ của cồn béo (fatty alcohol) | 30 g/l Polysorbat 80 + 4 g/l natri dodecyl sulphat + 3 g/1 lecithin. 30 g/l Polysorbat 80 + 30 g/l saponin + 3 g/l lecithin. Môi trường lỏng trung hòa D/Ea Dung dịch rửa: 1 g/l trypton, + 9 g/l NaCI; 5 g/l polysorbat 80. |
| Các andehit Các chất giải phóng formaldehyd | Glycin, histidin | 3 g/l Lecithin + 30 g/l polysorbat 80+1 g/l L-histidin. 30 g/l Polysorbat 80 + 30 g/l saponin + 1 g/l L- histidin + 1 g/l L-cystein. Môi trường lỏng trung hòa D/E. Dung dịch rửa: 3 g/l polysorbat 80 + 0,5 g/l L- histidin. |
| Các hợp chất oxy hóa | Natri thiosulfat | 5 g/I Natri thiosulfat. Dung dịch rửa: 3 g/l Natri thiosulfat. |
| Các isothiazolinon, imidazol | Lecithin, saponin Các amin, sulfat, mercaptan, natri bisulfit, natri thioglycolat | 30 g/l Polysorbat 80 + 30 g/l saponin + 3 g/l lecithin. Dung dịch rửa: 1 g/l trypton + 9 g/l NaCI; 5 g/l polysorbat 80. |
| Các biguanide | Lecithin, saponin, polysorbat 80 | 30 g/l Polysorbat 80 + 30 g/l saponin + 3 g/l lecithin. Dung dịch rửa: 1 g/l trypton + 9 g/l NaCI; 5 g/l polysorbat 80. |
| Các muối kim loại (Cu, Zn, Hg) Các muối thủy ngân hữu cơ | Natri bisulfat, L-cystein Các hợp chất sulfhydryl, axít thloglycollc | 0,5 g/l hay 5 g/l Natri thloglycolat. 0,8 g/l hay 1,5 g/l L-cystein. Môi trường lỏng trung hòa D/E. Dung dịch rửa: 0,5 g/l Natri thioglycolat. |
| GHI CHÚ: Theo pH của sản phẩm mỹ phẩm, pH của chất trung hòa có thể được điều chỉnh tới giá trị phù hợp. | ||
Thư mục tài liệu tham khảo
[1] ISO 18415, Cosmetics - Microbiology - Detection of specified and non - specified microorganisms
[2] ISO 18416:2015, Cosmetics - Microbiology - Detection of Candida albicans
[3] EN 13624:2013, Chemical disinfectants and antiseptics - Quantitative suspension test for the evaluation of fungicidal or yeasticidal activity in the medical area - test method and requirements (phase 2, step 1)
[4] COLIPA, Guidelines on Microbial Quality Management, European Cosmetics, Toiletry and Perfumery Association, 1997
[5] CTFA, Microbiology Guidelines, Toiletry and Tragrance Association, 2001.
[6] EP, Microbiological Examination of non-sterile products, European Pharmacopoeia, Fourth Edition, 2002
[7] FDA, Bacteriological Analytical Manual, 8th edition, U.S. Food and Drug Administration, 1995, http://www.fda.gov/FoodScienceResearch/LaboratoryMethods/ucm2006949.htm
[8] JP 14, General Tests - Microbial Limit test, published by the Japanese Pharmacopoeia, 2001
[9] USP 28, Microbial Limit test (61), U.S. Pharmacopoeia, 2005
[10] ATLAS R.M., Handbook of Microbiological Media, CRC Press, 1993
[11] SINGER S., The Use of Preservative Neutralizers in Diluents and Plating Media, Cosmetics and Toiletries,102, p.55, December, 1987
[12] ISO 29621, Cosmetics - Microbiology - Guidelines for the risk assessment and identification of microbiologically low - risk products
Mục lục
Lời nói đầu
1 Phạm vi áp dụng
2 Tài liệu viện dẫn
3 Thuật ngữ và định nghĩa
3.1 Nấm men (yeast)
3.2 Nấm mốc (mould)
3.3 Sản phẩm (product)
3.4 Mẫu (sample)
3.5 Hỗn dịch ban đầu (initial suspension)
3.6 Mẫu pha loãng (sample dilution)
4 Nguyên tắc
4.1 Quy định chung
4.2 Phương pháp đĩa thạch
4.3 Phương pháp màng lọc
5 Dung dịch pha loãng, chất trung hoà và môi trường nuôi cấy
5.1 Quy định chung
5.2 Dung dịch pha loãng có chất trung hòa và dung dịch pha loãng
5.3 Dung dịch pha loãng cho hỗn dịch nấm men (Dung dịch Natri tryptone chlorid)
5.4 Môi trường nuôi cấy
6 Thiết bị và dụng cụ thủy tinh
7 Chủng vi sinh vật
8 Xử lý sản phẩm mỹ phẩm và mẫu thử phòng thí nghiệm
9 Cách tiến hành
9.1 Khuyến cáo chung
9.2 Chuẩn bị hỗn dịch ban đầu
9.3 Phương pháp đếm
10 Đếm khuẩn lạc (phương pháp đếm trên đĩa và phương pháp màng lọc)
11 Biểu thị kết quả
11.1 Phương pháp tính toán kết quả cho phương pháp đĩa thạch
11.2 Diễn giải kết quả
12 Trung hòa chất kháng nấm trong sản phẩm
12.1 Quy định chung
12.2 Chuẩn bị nuôi cấy
12.3 Tính phù hợp của phương pháp đếm trên đĩa thạch
13 Báo cáo thử nghiệm
Phụ lục A (Tham khảo) Các dung dịch pha loãng có chất trung hòa khác
Phụ lục B (Tham khảo) Các dung dịch pha loãng khác
Phụ lục C (Tham khảo) Các môi trường nuôi cấy khác
Phụ lục D (Tham khảo) Các chất trung hòa hoạt tính kháng vi sinh vật của chất bảo quản và các dung dịch rửa/ lọc
Thư mục tài liệu tham khảo
[1]) ATCC = American Type Culture Collection = Bộ sưu tập chủng chuẩn Mỹ.
[2]) IP = Bộ sưu tập Viện Pasteur, Pháp.
[3]) NCPF = National Collection of Pathogenic Fungi = Bộ sưu tập nấm gây bệnh quốc gia, Anh Quốc.
[4]) NBRC = National Biological Resource Center = Trung tâm tài nguyên sinh vật quốc gia, Nhật Bản
[5]) KCTC = Korean Collection for Type Culture = Bộ sưu tập chủng chuẩn Hàn Quốc
[6]) TISTR = Thailand Institute of Scientific and Technological Research = Viện khoa học và nghiên cứu công nghệ Thái lan
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 13633:2023 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 13633:2023 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 13633:2023 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 13633:2023 DOC (Bản Word)