- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn TCVN 13632:2023 Mỹ phẩm - Vi sinh vật - Đánh giá tính kháng vi sinh vật của sản phẩm mỹ phẩm
| Số hiệu: | TCVN 13632:2023 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Thực phẩm-Dược phẩm |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
25/04/2023 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 13632:2023
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 13632:2023
TIÊU CHUẨN QUỐC GIA
TCVN 13632:2023
ISO 11930:2019
WITH AMENDMENT 1:2022
MỸ PHẨM - VI SINH VẬT - ĐÁNH GIÁ TÍNH KHÁNG VI SINH VẬT CỦA SẢN PHẨM MỸ PHẨM
Cosmetics - Microbiology - Evaluation of the antimicrobial protection of a cosmetic product
Lời nói đầu
TCVN 13632:2023 hoàn toàn tương đương với ISO 11930:2019 và Sửa đổi 1:2022.
TCVN 13632:2023 do Viện Kiểm nghiệm Thuốc thành phố Hồ Chí Minh biên soạn, Bộ Y tế đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Lời giới thiệu
Tiêu chuẩn này được xây dựng nhằm đánh giá tổng thể về tính bảo vệ kháng vi sinh vật của một sản phẩm mỹ phẩm.
Tính bảo vệ kháng vi sinh vật của một sản phẩm có thể đến từ nhiều nguồn:
- Hóa chất bảo quản;
- Các đặc tính vốn có của công thức;
- Thiết kế bao bì;
- Quá trình sản xuất.
Tiêu chuẩn này xác định một loạt các bước cần thực hiện khi đánh giá khả năng bảo vệ kháng vi sinh vật tổng thể của một sản phẩm mỹ phẩm. Tiêu chuẩn này cũng mô tả một phương pháp đối chứng để thử nghiệm hiệu quả bảo quản (thử nghiệm kiểm chứng) cùng với các tiêu chí đánh giá.
Phép thử được mô tả trong tiêu chuẩn này, đối với mỗi vi sinh vật thử nghiệm, bao gồm cho sản phẩm tiếp xúc với vi sinh vật thử nghiệm đã được chuẩn hóa, sau đó xác định sự thay đổi về số lượng vi sinh vật ở những chu kỳ lặp lại đã định trong một khoảng thời gian nhất định và ở nhiệt độ cài đặt.
Dữ liệu được tạo ra bởi đánh giá rủi ro (TCVN 13641 (ISO 29621)) hoặc bởi thử nghiệm hiệu quả bảo quản, hoặc cả hai, được sử dụng để thiết lập mức độ bảo vệ kháng vi sinh vật cần thiết để giảm thiểu rủi ro cho người sử dụng.
MỸ PHẨM - VI SINH VẬT - ĐÁNH GIÁ TÍNH KHÁNG VI SINH VẬT CỦA SẢN PHẨM MỸ PHẨM
Cosmetics - Microbiology - Evaluation of the antimicrobial protection of a cosmetic product
1 Phạm vi áp dụng
Tiêu chuẩn này quy định quy trình để giải thích dữ liệu thu được bởi phép thử đánh giá hiệu quả bảo quản hoặc bằng đánh giá rủi ro vi sinh, hoặc cả hai khi đánh giá tổng quát tính kháng vi sinh vật của một sản phẩm mỹ phẩm. Tiêu chuẩn này bao gồm:
- Thử nghiệm hiệu quả bảo quản.
- Quy trình đánh giá hiệu quả kháng lại vi sinh vật đối với mỹ phẩm không được đánh giá có mức độ rủi ro thấp, dựa trên đánh giá rủi ro được mô tả trong TCVN 13641:2023 (ISO 29621).
Thử nghiệm hiệu quả bảo quản là một phương pháp đối chứng được sử dụng để đánh giá hiệu quả bảo quản của một công thức mỹ phẩm. Thử nghiệm này có thể áp dụng cho các sản phẩm mỹ phẩm trên thị trường.
Thử nghiệm này không áp dụng đối với những sản phẩm mỹ phẩm mà nguy cơ nhiễm vi sinh đã được xác định là thấp theo Phụ lục A và TCVN 13641:2023 (ISO 29621).
Thử nghiệm này chủ yếu được thiết kế cho các sản phẩm mỹ phẩm tan được trong nước hoặc có thể trộn lẫn với nước và có thể thay đổi để thử nghiệm các sản phẩm trong đó nước là pha nội (không liên tục).
CHÚ THÍCH: Phép thử này có thể được sử dụng như một hướng dẫn để phát triển phương pháp trong tiêu chuẩn cơ sở trong suốt chu kỳ phát triển của sản phẩm mỹ phẩm. Trong trường hợp này, phép thử có thể được sửa đổi hoặc mở rộng, hoặc cả hai, ví dụ để xem xét dữ liệu trước và các biến khác nhau (chủng vi khuẩn, môi trường, thời gian ủ, v.v...). Tiêu chí áp dụng có thể phù hợp với các mục tiêu cụ thể.Trong quá trình phát triển sản phẩm mỹ phẩm, các phương pháp khác có thể được sử dụng nếu thích hợp để xác định hiệu quả bảo quản của các công thức.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau đây là rất cần thiết khi áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các bản sửa đổi, bổ sung (nếu có).
TCVN 13633, Mỹ phẩm - Vi sinh - Định lượng nấm men và nấm mốc (ISO 16212, Cosmetics - Microbiology - Enumeration of yeast and mould).
TCVN 13635, Mỹ phẩm - Vi sinh vật - Phát hiện các vi sinh vật và vi sinh vật chỉ định (ISO 18415, Cosmetics - Microbiology - Detection of specified and non-specified microrganisms).
TCVN 13637, Mỹ phẩm - Vi sinh - Hướng dẫn chung về kiểm tra vi sinh (ISO 21148:2017, Cosmetics - Microbiology - General instructions for microbiological examination).
TCVN 13638, Mỹ phẩm - Vi sinh - Định lượng và phát hiện vi khuẩn hiếu khí ưa nhiệt trung bình (ISO 21149, Cosmetics - Microbiology - Enumeration and detection of aerobic mesophilic bacteria).
TCVN 13641, Mỹ phẩm - Vi sinh - Hướng dẫn đánh giá rủi ro và xác định các sản phẩm có nguy cơ thấp về mặt vi sinh (ISO 29621, Cosmetics - Microbiology - Guidelines for the risk assessment and identification of microbiologically low-risk products).
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này áp dụng các thuật ngữ và định nghĩa sau.
3.1
Công thức mỹ phẩm (cosmetic formulation)
Sự tạo thành sản phẩm từ các nguyên liệu có thành phần và chất lượng xác định.
3.2
Sản phẩm mỹ phẩm (cosmetic product)
Khi các nguyên liệu trong công thức mỹ phẩm (3.1) đã qua tất cả các khâu sản xuất, cho đến bao bì đóng gói cuối cùng.
3.3
Tính kháng vi sinh vật của sản phẩm mỹ phẩm (antimicrobial protection of a cosmetic product)
Khả năng của một sản phẩm mỹ phẩm (3.2) kháng lại sự tạp nhiễm vi sinh vật có thể gây nguy cơ cho người sử dụng hoặc tính toàn vẹn về mặt thẩm mỹ hoặc chức năng của sản phẩm trong quá trình sử dụng.
CHÚ THÍCH: Khả năng kháng vi sinh vật tổng thể bao gồm chất bảo quản có trong công thức, quy trình sản xuất cụ thể và bao bì bảo vệ.
3.4
Sự bảo quản của một công thức mỹ phẩm (preservation of a cosmetic formulation)
Các phương thức được sử dụng để tránh sự gia tăng vi sinh vật trong một công thức mỹ phẩm (3.1).
VÍ DỤ: Những chất bảo quản, những hợp chất đa chức năng, nguyên liệu gốc đối kháng, pH khắc nghiệt, hoạt độ nước thấp ...
3.5
Phương pháp đối chứng (reference method)
Phương pháp được áp dụng bởi các bên liên quan để đánh giá một sản phẩm trên thị trường và trong trường hợp tranh chấp
3.6
Phương pháp phát triển (development method)
Phương pháp được sử dụng trong giai đoạn phát triển của một sản phẩm trước khi sản phẩm được đưa ra thị trường
3.7
Người dùng (consumer)
Người sử dụng cuối cùng của một sản phẩm mỹ phẩm (3.2)
4 Nguyên tắc
Việc đánh giá tính kháng vi sinh vật của một sản phẩm mỹ phẩm kết hợp các yếu tố sau (xem Phụ lục A):
a) Các đặc tính của công thức (TCVN 13641 (ISO 29621)) hoặc kết quả của thử nghiệm hiệu quả chất bảo quản (nếu thực hiện), hoặc cả hai. Thử nghiệm hiệu quả chất bảo quản được mô tả trong Điều 5.
b) Nếu cần thiết các đặc tính của sản phẩm kết hợp với các điều kiện sản xuất (ISO 22716 và TCVN 13641 (ISO 29621)), các vật liệu đóng gói, khuyến cáo sử dụng sản phẩm (TCVN 13641 (ISO 29621)) cũng được xem xét. Tiêu chuẩn này mô tả một quy trình để giải thích dữ liệu thu được bởi việc thực hiện phép thử đánh giá hiệu quả chất bảo quản (nếu phù hợp) và đánh giá rủi ro vi sinh.
5 Thử nghiệm hiệu quả bảo quản
5.1 Quy định chung
Việc đánh giá hiệu quả ức chế vi sinh vật của chất bảo quản trong một công thức mỹ phẩm dựa trên việc thêm chủng chuẩn (5.3) vào công thức, số lượng vi sinh vật sống lại được theo dõi với khoảng thời gian xác định trong suốt 28 ngày. Đối với mỗi thời điểm và từng chủng vi sinh, giá trị giảm log được tính và so sánh với các giá trị nhỏ nhất trong tiêu chí đánh giá A hoặc B (xem Phụ lục B).
Khi sử dụng như một phương pháp đối chứng, phải tuân thủ các bước của quy trình để tránh sự thay đổi trong kết quả. Để xác định hiệu quả bảo quản của công thức trong quá trình phát triển sản phẩm, có thể phát triển các phương pháp phù hợp khác để sử dụng.
Trước khi tiến hành thử nghiệm, hiệu quả của biện pháp trung hòa phải được xác định, chất lượng vi sinh vật của sản phẩm sẽ được xác định theo TCVN 13638 (ISO 21149) và TCVN 13633 (ISO 16212), hoặc với TCVN 13636 (ISO 18416) - để đảm bảo rằng bất cứ vi sinh vật nào hiện diện trong mẫu thử không gây ảnh hưởng đến độ phục hồi của các chủng thử nghiệm.
5.2 Vật liệu, thiết bị, thuốc thử và môi trường nuôi cấy
5.2.1 Quy định chung
Khi sử dụng nước làm dung môi pha loãng, pha chất trung hoà hay môi trường nuôi cấy thì cần sử dụng nước cất hoặc nước tinh khiết theo quy định trong mục 8.2 của TCVN 13640 (ISO 21148).
5.2.2 Vật liệu, thiết bị, thuốc thử và môi trường nuôi cấy
Sử dụng những thiết bị thông thường trong phòng thí nghiệm vi sinh (TCVN 13640 (ISO 21148)) và:
5.2.2.1 Bi thủy tinh; đường kính khoảng từ 3 mm đến 4 mm.
5.2.2.2 Lọc thủy tinh xốp; đường kính lỗ xốp loại 2 (từ 40 µm đến 100 µm).
5.2.2.3 Bình thủy tinh tiệt khuẩn có nắp, với thể tích thích hợp.
5.2.2.4 Máy li tâm, có khả năng tạo lực ly tâm là 2 000 g.
5.2.3 Dung dịch pha loãng
5.2.3.1 Quy định chung
Trừ khi có quy định khác, tất cả thuốc thử phải được cân bằng ở nhiệt độ phòng trước khi sử dụng. Nếu có thể, môi trường và thuốc thử pha sẵn có thể được sử dụng.
5.2.3.2 Dung dịch pha loãng cho vi khuẩn và Candida albicans
5.2.3.2.1 Thành phần 1
| Natri clorid | 8,5 g |
| Nước | 1 000 ml |
5.2.3.2.2 Chuẩn bị
Hòa tan natri clorid vào trong nước bằng cách vừa khuấy vừa đun nóng. Phân phối vào các bình có thể tích thích hợp. Hấp tiệt khuẩn ở 121 °C trong 15 min.
5.2.3.2.3 Thành phần 2
| Tryptone, từ casein thủy phân bởi pancreatin | 1,0 g |
| Natri clorid | 8,5 g |
| Nước | 1 000 ml |
5.2.3.2.4 Chuẩn bị
Hòa tan các thành phần vào trong nước bằng cách vừa khuấy vừa đun nóng. Phân phối môi trường vào các bình có thể tích thích hợp. Hấp tiệt khuẩn ở 121 °C trong 15 min. Sau khi hấp và để nguội, pH môi trường phải đạt khoảng 7,0 ± 0,2 khi đo ở nhiệt độ phòng.
5.2.3.3 Dung dịch để chuẩn bị cho hỗn dịch bào tử A. brasiliensis: dung dịch polysorbat
Chuẩn bị dung dịch polysorbat 80 (nồng độ 0,5 g/l). Hòa tan bằng cách vừa khuấy vừa đun nóng đến khi dung dịch tan hoàn toàn. Phân phối vào các bình có thể tích thích hợp. Hấp tiệt khuẩn ở 121 °C trong 15 min.
5.2.4 Dung dịch trung hòa
5.2.4.1 Quy định chung
Sự phù hợp và hiệu quả của chất trung hòa phải được chứng minh đối với các chủng và công thức thử nghiệm như mô tả trong mục 5.5.
Các chất trung hòa thường được sử dụng được mô tả trong mục 5.2.4. Các ví dụ về các chất trung hòa thích hợp khác được đưa ra trong Phụ lục C (xem bảng C.1). Môi trường Eugon LT100 lỏng cải tiến có thể được chọn sử dụng thay thế
5.2.4.2 Môi trường lỏng Eugon LT 100
5.2.4.2.1 Quy định chung
Môi trường chứa các thành phần trung hoà các chất ức chế có trong mẫu (lecithin và polysorbat 80) và chất phân tán octoxynol 9 (Triton X100®[1])). Có thể được chuẩn bị như mô tả trong mục 5.2.4.2.2, hoặc theo hướng dẫn của nhà sản xuất đối với môi trường khô hoàn chỉnh. Môi trường pha sẵn có thể được sử dụng.
5.2.4.2.2 Thành phần
| Casein thủy phân bởi pancreatin | 15 g |
|
| Bột đậu tương thủy phân bởi papain | 5 g |
|
| Natri clorid | 4g |
|
| L-cystin | 0,7 g |
|
| Natri sulphit | 0,2 g |
|
| Glucose | 5,5 g |
|
| Lecithin từ trứng | 1 g |
|
| Polysorbat 80 | 5 g |
|
| Octoxynol 9 | 1 g |
|
| Nước | 1 000 ml |
|
5.2.4.2.3 Chuẩn bị
Hòa tan lần lượt polysorbat 80, octoxynol 9 và lecithin từ trứng trong nước sôi cho đến khi tan hoàn toàn. Thêm các thành phần còn lại vào hỗn hợp vừa thu được bằng cách khuấy và đun nóng. Phân phối môi trường vào các bình có thể tích thích hợp. Hấp tiệt khuẩn ở 121 °C trong 15 min. Sau khi hấp, trộn đều trong khi chất lỏng vẫn còn nóng để hòa tan lại các chất đã lắng. Sau khi hấp và để nguội, pH môi trường phải đạt khoảng 7,0 ± 0,2 khi đo ở nhiệt độ phòng.
5.2.4.3 Môi trường Eugon LT lỏng cải tiến
5.2.4.3.1 Thành phần
| Casein thủy phân bởi prancreatin | 15,0 g |
|
| Bột đậu tương thủy phân bởi papain | 5,0 g |
|
| L-cystine | 0,7 g |
|
| Natri clorid | 4,0 g |
|
| Natri sulfit | 0,2 g |
|
| Glucose | 5,5 g |
|
| Lecithin từ trứng | 1,0 g |
|
| Polysorbat 80 | 5,0 g |
|
| Natri lauryl eter sulphate | 1,56 g |
|
| Nước | 1 000 ml |
|
5.2.4.3.2 Chuẩn bị
Hòa tan lần lượt từng thành phần polysorbate 80 và lecithin từ trứng trong nước sôi để tan hoàn toàn. Hòa tan các thành phần khác vào hỗn hợp thu được bằng cách vừa khuấy vừa đun nóng. Phân phối vào các bình có thể tích thích hợp. Hấp tiệt khuẩn ở 121 °C trong 15 min. Sau khi hấp và để nguội, pH phải đạt khoảng khoảng 7,0 ± 0,2 khi đo ở nhiệt độ phòng.
5.2.5 Môi trường nuôi cấy
5.2.5.1 Quy định chung
Môi trường nuôi cấy có thể được chuẩn bị như trong mục 5.2.5.2, 5.2.5.3 và 5.2.5.4 hoặc từ môi trường khô hoàn chỉnh theo hướng dẫn của nhà sản xuất. Các môi trường pha sẵn có thể được sử dụng khi thành phần và / hoặc hiệu suất sinh trưởng của chúng có thể so sánh được với các công thức môi trường trong mục 5.2.5.2.1, 5.2.5.3.1, 5.2.5.4.1.
5.2.5.2 Môi trường nuôi cấy cho vi khuẩn: Môi trường thạch Tryptic đậu tương (TSA) hoặc môi trường thạch casein đậu tương
5.2.5.2.1 Thành phần
| Casein thủy phân bởi pancreatin | 15 g |
|
| Bột đậu tương thủy phân bởi papain | 5 g |
|
| Natri clorid | 5 g |
|
| Thạch | 15 g |
|
| Nước | 1 000 ml |
|
5.2.5.2.2 Chuẩn bị
Hoà tan các thành phần trên hoặc môi trường khô trong nước bằng cách vừa khuấy vừa đun nóng. Phân phối môi trường vào các bình có thể tích phù hợp. Hấp tiệt khuẩn ở 121 °C trong 15 min. Sau khi hấp, trộn đều trong khi chất lỏng vẫn còn nóng để hòa tan lại các chất đã lắng. Sau khi hấp và để nguội, pH môi trường phải đạt khoảng 7,3 ± 0,2 khi đo ở nhiệt độ phòng.
5.2.5.3 Môi trường nuôi cấy cho C. albicans: Môi trường thạch Sabouraud dextrose (SDA)
5.2.5.3.1 Thành phần
| Dextrose | 40,0 g |
|
| Mô động vật thủy phân bởi peptic | 5,0 g |
|
| Casein thủy phân bởi pancreatin | 5,0 g |
|
| Thạch | 15,0 g |
|
| Nước | 1 000 ml |
|
5.2.5.3.2 Chuẩn bị
Hoà tan các thành phần trên hoặc môi trường hoàn chỉnh khô trong nước bằng cách vừa khuấy vừa đun nóng. Phân phối môi trường vào các bình có thể tích phù hợp. Hấp tiệt khuẩn ở 121 °C trong 15 min. Sau khi hấp và để nguội, pH môi trường phải đạt khoảng 5,6 ± 0,2 khi đo ở nhiệt độ phòng.
5.2.5.4 Môi trường nuôi cấy cho A. brasiliensis: thạch khoai tây - dextrose (PDA)
5.2.5.4.1 Thành phần
| Nước chiết khoai tây | 200,0 g |
|
| Dextrose | 20,0 g |
|
| Thạch (xem 5.2.5.4.2, chú thích 1) | 20,0 g |
|
| Nước | 1 000 ml |
|
5.2.5.4.2 Chuẩn bị
Hoà tan các thành phần trên hoặc môi trường khô hoàn chỉnh trong nước bằng cách vừa khuấy vừa đun nóng. Phân phối môi trường vào các bình có thể tích thích hợp. Hấp tiệt khuẩn ở 121 °C trong 15 min. Sau khi hấp và để nguội, pH môi trường phải đạt khoảng 5,6 ± 0,2 khi đo ở nhiệt độ phòng.
CHÚ THÍCH 1: Các loại môi trường dạng hoàn chỉnh khô thương mại có chứa ít hơn 20 g/l thạch có thể được bổ sung thêm thạch đến nồng độ cuối cùng là 20 g/l nếu cần.
5.3 Chủng vi sinh vật
Thử nghiệm được tiến hành sử dụng các chủng vi sinh vật sau đây như:
- Pseudomonas aeruginosa ATCC®9027™[2]) (chủng tương đương: CIP®82.118™[3]) hoặc NCIMB®8626™[4]) hoặc NBRC®13275™[5]) hoặc KCTC®2513™[6]) hoặc các chủng quốc gia khác tương đương);
- Staphylococcus aureus A7CC®6538™ (chủng tương đương: CIP®4.83™ hoặc NCIMB®9518™ hoặc NBRC®13276™ hoặc KCTC®3881™ hoặc NCTC®10788™[7]) hoặc các chủng quốc gia khác tương đương);
- Escherichia coli ATCC®8739™ (chủng tương đương: CIP®53.126™ hoặc NCIMB®8545™ hoặc NBRC®3972™ hoặc KCTC®2571™ hoặc NCTC®12923™ hoặc các chủng quốc gia khác tương đương);
- Candida albicans ATCC®10231™ (chủng tương đương: IP®48.72™[8]) hoặc NCPF®3179™[9]) hoặc NBRC®1594™ hoặc KCTC®7965™ hoặc các chủng quốc gia khác tương đương);
- Aspergillus brasiliensis (tên khác A. niger) ATCC®16404™ (chủng tương đương: IP®1431 hoặc IMI®14900™[10]) hoặc NBRC® hoặc KCTC®6196™ hoặc các chủng quốc gia khác tương đương).
Các chủng trên cần được hoàn nguyên theo quy trình được đưa ra bởi nhà cung cấp các chủng.
Các chủng có thể được lưu giữ trong phòng thí nghiệm theo (EN 12353).
Chuẩn bị và đếm chủng vi sinh vật
5.4 Chuẩn bị và đếm chủng vi sinh vật
5.4.1 Quy định chung
Để thực hiện các phép thử, sử dụng các chủng bảo quản trong phòng thí nghiệm (5.3) để thu được chủng gốc và các chủng làm việc.
Chủng gốc là chủng đồng nhất thu được bằng cách cấy chuyền chủng bảo quản (trong ống dùng một lần hoặc dạng hạt), vào các ống thạch nghiêng hoặc đĩa Sau khi ủ, chủng gốc có thể giữ trong khoảng từ 2 °C đến 8 °C trong hai tháng và được sử dụng để tạo chủng làm việc.
Chủng làm việc, được chuẩn bị trước khi thực hiện phép thử, được sử dụng để thu được chủng dạng hỗn dịch chuẩn.
Chủng gốc và chủng làm việc phải được chuẩn bị trong cùng một điều kiện sinh trưởng (môi trường, điều kiện nuôi cấy) (5.4.2 và 5.4.3).
CHÚ THÍCH 1: Việc giới hạn số lần cấy truyền và việc sử dụng các chủng đồng nhất thay vì các khuẩn lạc riêng rẽ sẽ làm giảm nguy cơ thay đổi tính nhạy cảm của các chủng. Việc chuẩn hóa các điều kiện sinh trưởng và quá trình nuôi cấy sẽ tăng khả năng lặp lại của phép thử.
CHÚ THÍCH 2: Tránh rã đông nhiều lần khi sử dụng các bình chứa đa liều (ví dụ: bình chứa có nhiều hạt đưa ra khỏi tủ đông để lấy một hạt, sau đó được để lại trong tủ đông).
5.4.2 Chuẩn bị hỗn dịch vi khuẩn và hỗn dịch Candida albicans
5.4.2.1 Để chuẩn bị chủng làm việc, cấy chuyền chủng cấp 1 từ chủng gốc bằng cách cấy ria trên các ống thạch nghiêng hoặc đĩa (TSA cho vi khuẩn, SDA cho C. albicans) để được chủng thuần chủng, ủ ở 32,5 °C ± 2,5 °C trong 18 h đến 24 h.
Chuẩn bị theo cách tương tự để được chủng cấp hai từ chủng cấp một, và ủ ở 32,5 °C ± 2,5 °C trong 18 h đến 24 h. Chủng cấp ba được chuẩn bị tương tự từ chủng cấp hai. Chủng cấp hai và cấp ba (nếu được thực hiện) tạo thành chủng làm việc.
Nếu chủng cấp hai không thể nuôi cấy đúng thời điểm, thì chủng cấp một đã được nuôi cấy trong 48 h ở tủ ấm 32,5 °C ± 2,5 °C được sử dụng để cấy chuyền thành chủng cấp hai. Trong trường hợp này, cấy chuyền tiếp thành chủng cấp ba từ 18 h đến 24 h và sử dụng chủng này trong thử nghiệm.
LƯU Ý: Không sử dụng chủng cấy truyền 4 lần từ chủng gốc ban đầu cho phép thử
5.4.2.2 Lấy 10 ml dung dịch pha loãng (5.2.3.2) cho vào bình chứa đã tiệt khuẩn thích hợp với khoảng 5 g bi thủy tinh vô khuẩn. Chuyển một vòng que cấy tế bào gặt được từ đĩa môi trường vào dung dịch pha loãng, dùng đầu que cấy đánh đều tế bào vào thành ống để phân tán đều tế bào trong dung dịch pha loãng.
5.4.2.3 Lắc bình chứa bằng tay hay máy lắc trong một khoảng thời gian tối đa khoảng 3 min để đồng nhất hỗn dịch. Hút phần trên của phần hỗn dịch (tránh tiếp xúc với những viên bi thủy tinh) và chuyển hỗn dịch qua một bình chứa vô khuẩn khác.
5.4.2.4 Điều chỉnh số lượng tế bào trong hỗn dịch từ 1 x 107 CFU/ml đến 1 x 108 CFU/ml (vi khuẩn) hoặc 1 x 106 CFU/ml đến 1 x 107 CFU/ml (C. albicans) bằng cách sử dụng dịch pha loãng (5.2.3.2) và phương pháp định lượng thích hợp (ví dụ sử dụng máy quang phổ, xem Phụ lục C trong ISO 21148 : 2017,). Sử dụng hỗn dịch chuẩn này trong vòng 2 h.
5.4.2.5 Tại thời điểm thử nghiệm, kiểm tra số lượng ban đầu của hỗn dịch chủng, N. Thực hiện các bước pha loãng mười lần đối với hỗn dịch chuẩn bằng dung dịch pha loãng (5.2.3.2). Thực hiện đếm chủng bằng cách lấy 1 ml hỗn dịch đã được pha loãng phù hợp lần lượt cho vào đĩa petri (5.6.2) thêm môi trường TSA đối với vi khuẩn và môi trường SDA đối với C.albicans. Mỗi nồng độ sử dụng 2 dĩa petri, mỗi đĩa petri 1 ml. Ủ các dĩa ở 32,5 °C ± 2,5 °C trong thời gian từ 24 h đến 48 h.
5.4.3 Chuẩn bị hỗn dịch bào từ A. brasiliensis.
5.4.3.1 Để thu được chủng làm việc, sử dụng một chủng gốc (trên PDA) không được quá 2 tháng tuổi và chuẩn bị một hỗn dịch chủng trong dung dịch pha loãng (5.2.3.3). cấy trải hỗn dịch chủng lên bề mặt môi trường PDA trong bình Roux (hoặc sử dụng các dĩa Petri), để có được một chủng nuôi cấy đồng nhất. Ủ ở 22,5 °C ± 2,5 °C trong 7 ngày đến 11 ngày.
5.4.3.2 Sau khi ủ, chuyển 10 ml dung dịch polysorbat (5.2.3.3) lên bề mặt môi trường PDA. Nhẹ nhàng tách các bào tử ra khỏi bề mặt chủng nuôi cấy, ví dụ như sử dụng thìa hoặc bi thủy tinh. Chuyển hỗn dịch vào bình thích hợp và khuấy nhẹ nhàng trong khoảng một min với sự có mặt của bi thủy tinh. Lọc hỗn dịch qua bộ lọc thủy tinh có độ rỗng xốp 2 (tức là 40 µm ÷ 100 µm).
5.4.3.3 Tiến hành kiểm tra bằng kính hiển vi (phóng đại x 400) để phát hiện sự hiện diện của bào tử nảy mầm hoặc các mảnh nấm.
— Nếu có bào tử nảy mầm, thì phải loại bỏ hỗn dịch vừa mới thu được.
— Nếu sợi nấm có mặt trong một phần mười, rửa hỗn dịch bằng cách ly tâm với tốc độ (theo vận hành của thiết bị) trong 20 min. Rửa các bào tử ít nhất hai lần bằng cách phân tán chúng lại trong dung dịch polysorbate (5.2.3.3) và ly tâm.
5.4.3.4 Điều chỉnh số lượng bào tử trong hỗn dịch đến khoảng 1 x 106 bào tử/ml đến 1 x 107 bào tử/ml bằng dung dịch pha loãng (5.2.3.3) và bất kỳ phương pháp nào thích hợp.
Sử dụng một thiết bị đếm tế bào (ví dụ như máy đếm tế bào) được khuyến cáo để điều chỉnh số lượng bào tử. Nếu sử dụng một buồng đếm tế bào thích hợp thì nên tuân theo chính xác các hướng dẫn.
Hỗn dịch phải được sử dụng trong cùng một ngày làm việc hoặc có thể được sử dụng vào ngày hôm sau nếu được bảo quản trong khoảng từ 2 °C đến 8 °C, nhưng tại thời điểm thử nghiệm, phải kiểm tra sự hiện diện của bào tử nảy mầm.
5.4.3.5 Tại thời điểm thử nghiệm, kiểm tra số lượng ban đầu của hỗn dịch chủng, N. Thực hiện pha loãng mười lần hỗn dịch chủng trong dịch pha loãng (5.2.3.3). Thực hiện bước đếm bằng cách lấy 1 ml hỗn dịch đã được pha loãng phù hợp cho vào đĩa petri (5.6.2), thêm môi trường PDA vào đĩa. Mỗi nồng độ sử dụng 2 đĩa petri, mỗi đĩa chứa 1 ml (sử dụng số lượng dĩa petri thích hợp). Ủ các đĩa ở 22.5 °C ± 2,5 °C trong 3 ngày đến 5 ngày.
5.5 Chứng minh hiệu quả của chất trung hòa
5.5.1 Nguyên tắc
Xác định hiệu quả của chất trung hòa để trung hòa hoạt tính kháng khuẩn của mẫu thử với sự có mặt của mỗi vi sinh của công thức được kiểm tra mà không ức chế các vi sinh thử nghiệm.
Cấy vào dung dịch chất trung hòa một lượng hỗn dịch chủng có nồng độ xác định (khoảng 103 CFU/ml) với sự có mặt của mẫu thử (ống mẫu thử) và không có mặt của mẫu thử (ống đối chứng dương). Hiệu quả của chất trung hòa được chứng minh nếu kết quả số lượng vi sinh vật đếm lại từ ống hỗn dịch chủng ban đầu Nv và từ ống đối chứng dương Nvn (hỗn hợp của dung dịch chất trung hòa với dung dịch pha loãng, không có mặt mẫu) là tương đương nhau, và nếu kết quả đếm từ ống mẫu thử Nvf (hỗn hợp của dung dịch chất trung hòa và mẫu) đạt ít nhất 50 % so với kết quả đếm từ ống đối chứng dương Nvn (5.5.4).
5.5.2 Cách tiến hành
Thực hiện phép thử với từng chủng riêng biệt.
a) Chuẩn bị 1 dãy pha loãng đối với hỗn dịch chủng chuẩn vi sinh vật: N khoảng 1 x 107 CFU/ml đến 1 x 108 CFU/ml đối với vi khuẩn và khoảng 1x108 CFU/ml đến 1 x 107 CFU/ml đối với C. albicans và A. brasiliensis (5.4.2 và 5.4.3) để có được một hỗn dịch có chứa khoảng 103 CFU/ml (vi sinh vật).
b) Chuyển 1 g hoặc 1 ml chế phẩm thử vào 9 ml chất trung hòa (5.2.4). Lắc để phân tán mẫu. Nếu những điều kiện pha loãng ban đầu hoặc chất trung hoà chứng minh không đủ cho hiệu quả trung hoà, lặp lại quy trình theo hướng dẫn ở mục 5.5.4, đoạn 4 (thay đổi chất trung hòa hoặc pha loãng mẫu nhiều hơn, sử dụng phương pháp màng lọc nếu có thể). Các điều kiện thử nghiệm khác có thể chấp nhận được với điều kiện ít nhất 1 g hoặc 1 ml mẫu được sử dụng và thực hiện pha loãng tối thiểu mười lần.
c) Để ống thử nghiệm ở 30 min ±15 min ở nhiệt độ phòng. Tiến hành một “ống đối chứng dương” song song với cùng một chất trung hòa, thay thế mẫu đã được thử nghiệm với 1 ml dịch pha loãng (5.2.3).
d) Cấy vào “ống mẫu thử” (pha loãng mười lần và nếu cần thiết pha loãng thêm như hướng dẫn ở mục b) và cấy 1 ml dung dịch chủng chuẩn (a) vào “ống đối chứng dương”, (thể tích cuối cùng là 11 ml). Trộn đều.
e) Chuẩn bị "ống hỗn dịch chủng ban đầu": Thêm 1 ml dung dịch chủng (a) vào 10 ml dung dịch pha loãng (thể tích cuối cùng là 11 ml). Trộn đều.
f) Đếm 2 lần bằng cách thêm 1 ml mỗi dung dịch ("ống mẫu thử","ống đối chứng dương" và "ống hỗn dịch chủng ban đầu") vào một lượng môi trường thạch (TSA cho vi khuẩn hiếu khí, SDA cho C. albicans và PDA cho A. brasiliensis). Khuyến cáo nên sử dụng lượng chủng chuẩn thêm vào là 1 ml nhằm tăng cường độ chính xác của phép đếm ("ống mẫu thử", "ống đối chứng dương" và "ống hỗn dịch chủng ban đầu")
g) Ủ ở 32,5 °C ± 2,5 °C trong 48 h đến 72 h đối với vi khuẩn hiếu khí và C.albicans và ủ ở 22,5 °C ± 2,5 °C trong 3 ngày đến 5 ngày đối với A. brasiliensis.
5.5.3 Công thức tính
Tính số lượng vi sinh vật có trong “ống hỗn dịch chủng ban đầu”: Nv (CFU/ml) (5.5.2.5).
— ![]() là số khuẩn lạc trung bình đếm được trong hai lần lặp lại, với 1 ml dung dịch trong 1 đĩa.
là số khuẩn lạc trung bình đếm được trong hai lần lặp lại, với 1 ml dung dịch trong 1 đĩa.
— Nv khoảng 100 CFU/ml.
Tính số lượng vi sinh vật có trong “ống mẫu thử” (mẫu trộn cùng với chất trung hòa): Nvf (CFU/ml).
Tính số lượng vi sinh vật có trong “ống kiểm soát” (dung dịch pha loãng trộn với chất trung hòa, không có mẫu thử): Nvn (CFU/ml).
Nvf và Nvn là số khuẩn lạc trung bình đếm được trên 2 đĩa lặp lại của 1 ml dung dịch mẫu thử hoặc dung dịch kiểm soát.
5.5.4 Giải thích kết quả và kết luận hiệu quả của chất trung hòa
Hiệu quả của chất trung hòa được chứng minh nếu Nvf ≥ 0,5 Nvn và nếu Nvn gần bằng Nv.
Nếu Nvf không gần bằng Nv, chất trung hòa được coi là có hại đối với vi sinh vật.
Sai số của phương pháp đếm trên đĩa thạch phải được tính đến. Hai lần đếm thường được coi là khác nhau khi sự khác biệt của chúng vượt quá 50 %.
LƯU Ý: Các điều kiện kiểm tra hiệu quả của chất trung hòa (chất trung hoà, thể tích,...) và đặc biệt là độ pha loãng của mẫu (1/10, 1/100 hoặc pha loãng khác) mà ở điều kiện đó hiệu quả trung hòa được chứng minh.
Nếu kết quả không thỏa mãn các yêu cầu, cần phải:
— Thay đổi chất trung hòa (xem Phụ lục C) hoặc pha loãng mẫu nhiều hơn;
— Nếu có thể thì thực hiện phương pháp màng lọc.
Nếu kết quả vẫn không đáp ứng với yêu cầu, thì có khả năng mẫu thử không bị nhiễm những chủng đã thử nghiệm. Trong trường hợp này, cần phải có báo cáo thử nghiệm (5.7 và 5.8 f).
5.6 Xác định hiệu quả bảo quản của công thức
5.6.1 Tiến hành
Tiến hành thử nghiệm riêng cho từng chủng
5.6.1.1 Mở bao bì và ước lượng mẫu thử
Đối với mỗi chủng, cân / hút 20 g hoặc 20 ml chế phẩm thử vào một bình chứa vô khuẩn (5.2.2.3).
5.6.1.2 Nuôi cấy vi sinh thử nghiệm
Thêm vào mỗi bình chứa 0,2 ml chủng chuẩn (5.4.2 và 5.4.3) để có được nồng độ chủng cuối cùng trong bình mẫu thử là từ 1 x 105 CFU/ml đến 1 x 106 CFU/ml hoặc g cho vi khuẩn và từ 1 x 104 CFU/ml đến 1x105 CFU/ml hoặc g đối với C. albicans và A. brasiliensis. Trộn đều để đảm bảo sự phân bố đồng đều của chủng.
Nồng độ chủng ban đầu được cấy vào ống mẫu thử có chứa mẫu được cấy, No, được tính bằng cách sử dụng các kết quả đếm của dung dịch chủng chuẩn, N (5.6.3.2.b).
5.6.1.3 Nuôi cấy mẫu thử đã được thêm chủng
Bảo quản các bình chứa chứa mẫu đã thêm chủng ở nhiệt độ 22,5 °C ± 2,5 °C.
5.6.1.4 Lấy mẫu và đếm mẫu
a) Tại mỗi thời điểm lấy mẫu quy định, 7 ngày (T7), 14 ngày (T14) và 28 ngày (T28), theo chủng thử nghiệm (xem Phụ lục B), lấy 1 g mẫu đã được cấy chủng và pha loãng đến nồng độ mà hiệu quả chất trung hoà đã được chứng minh (5.5). Đảm bảo hệ số pha loãng chính xác khi sử dụng để tính giá trị Nx (5.6.3.3).
Để tiếp xúc trong 30 min ±15 min ở nhiệt độ phòng.
b) Bắt đầu từ độ pha loãng mà ở đó hiệu quả chất trung hòa được chứng minh, pha loãng gấp 10 lần trong dung dịch pha loãng (5.2.3).
c) Quá trình đếm vi sinh vật sẽ được tiến hành lặp lại 2 lần ở môi trường thích hợp (TSA cho vi khuẩn, SDA cho C. albicans và PDA cho A. brasiliensis) cho tất cả độ pha loãng vào thời điểm T7. Vào thời điểm T14 và T28, số lần pha loãng có thể được điều chỉnh dựa theo kết quả thu được tại thời điểm T7.
d) Cho mỗi 1 ml dung dịch mẫu pha loãng vào đĩa pertri có đường kính 85 mm ÷ 100 mm, thêm 15 ml đến 25 ml môi trường thạch được làm nóng chảy (5.4.2) và giữ trong bể ổn nhiệt không quá 48 °C. Nếu sử dụng đĩa petri lớn hơn thì sử dụng lượng thạch tăng thêm sao cho phù hợp. Trộn cẩn thận dung dịch với môi trường bằng cách xoay và nghiêng đĩa petri đủ để phân tán đều hỗn dịch chủng. Để đĩa pertri trên bề mặt phẳng ở nhiệt độ phòng đến khi hỗn hợp đông lại thành thể rắn. Các phương pháp đếm khác có thể được sử dụng (phương pháp trải và màng lọc) tuân theo các thông số đã đưa ra ở trên.
Nên sử dụng 1 ml dung dịch để đếm nhằm tăng cường độ chính xác của phép đếm.
e) Đối với vi khuẩn và C. albicans ủ ở 32,5 °C ± 2,5 °C trong 48 h đến 72 h và đối với A. brasiliensis ủ ở 22,5 °C ± 2,5 °C từ 3 ngày đến 5 ngày.
5.6.2 Đếm khuẩn lạc
Sau khi ủ, tiến hành đếm các khuẩn lạc trên các đĩa petri. Đối với tất cả các phép đếm (5.4.2.5, 5.4.3.5, 5.6.1.4 c) số lượng các khuẩn lạc trong các đĩa phải từ 30 ÷ 300 khuẩn lạc cho vi khuẩn hiếu khí và từ 15 ÷ 150 khuẩn lạc đối với A. brasiliensis.
Khi số lượng vi sinh vật sống lại trong mục 5.6.1.4 c) nhiều hơn 300 (150 đối với A.brasiliensis), lưu ý kết quả là > 300 (> 150 đối với A. brasiliensis).
Khi xuất hiện kết quả nhỏ hơn 30 khuẩn lạc đối với vi khuẩn và C. albicans, hoặc nhỏ hơn 15 khuẩn lạc đối với A. brasiliensis ở độ pha loãng mà sự trung hoà đã được xác nhận thì ghi lại số lượng khuẩn lạc trên đĩa petri và biểu thị kết quả bằng việc nhân với hệ số pha loãng.
Nếu không phát hiện khuẩn lạc nào ở độ pha loãng đã xác định hiệu quả chất trung hoà thì kết quả ghi là < 1 và nhân với hệ số pha loãng.
Xác định số lượng vi sinh vật có trong mẫu ở thời điểm t0 (N0 = N/100) theo như trong mục 5.6.3.2 và số vi khuẩn sống lại ở mỗi thời điểm lấy mẫu Nx theo mục 5.6.3.3.
5.6.3 Tính toán
5.6.3.1 Quy định chung
Cần kiểm tra rằng hiệu quả ức chế vi sinh vật của chất bảo quản đã được xác nhận (5.5.4) và các số liệu thực nghiệm tuân theo nguyên tắc được nêu trong mục 5.6.2.
5.6.3.2 Xác định số lượng chủng vi sinh ban đầu N và N0
a) Tính số lượng vi sinh vật trong hỗn dịch chủng chuẩn (5.4.2 và 5.4.3) ở dạng khuẩn lạc ở trong mỗi mililit, sử dụng công thức (1):
|
| (1) |
| Trong đó: |
| là số khuẩn lạc trung bình tính trên 2 đĩa (5.6.2) |
|
| V | là thể tích chủng thêm vào mỗi đĩa petri (1 ml theo 5.4.2 và 5.4.3) |
|
| d | là hệ số pha loãng của dung dịch được đếm |
|
| N | phải từ 1 x 107 CFU/ml đến 1 x 108 CFU/ml cho vi khuẩn và từ 1 x 106 CFU/ml đến 1 x 107 CFU/ml đối với C. albicans và A. brasiliensis |
b) Xác định N0 là số lượng vi sinh vật được thêm vào tại thời gian t0 sử dụng công thức (2):
| N0 = N/100 | (2) |
N0 sẽ từ 1 x 105 CFU/ml đến 1 x 106 CFU/ml hoặc g cho vi khuẩn và từ 1 x 104 CFU/ml đến 1 x 105 CFU/ml hoặc g cho C. albicans và A. brasiliensis.
5.6.3.3 Đếm số lượng vi sinh ở mỗi thời điểm lấy mẫu, Nx
Tính Nx là số lượng vi sinh sống lại được trong mẫu đã được tạp nhiễm các chủng thử nghiệm theo đơn vị khuẩn lạc trên mỗi ml hoặc gam tại mỗi điểm thời gian (T7, T14 hay T28) sử dụng công thức (3):
| Nx = C / (V x d) | (3) |
| Trong đó: | C | là số khuẩn lạc trung bình tính trên 2 đĩa (5.6.2) |
|
| V | là thể tích chủng thêm vào mỗi đĩa petri (1 ml theo 5.6.1.4 a) |
|
| d | là hệ số pha loãng của dung dịch được đếm (5.6.1.4.c) |
5.6.3.4 Sự giảm trong phép đếm vi sinh
Tính giá trị giảm Rx, được biểu thị qua đơn vị log, thu được tại mỗi thời điểm của mẫu sử dụng công thức (4):
| Rx = lgN0 - lgNx | (4) |
| Trong đó: | N0 | số lượng vi sinh tại thời điểm t0 (5.6.3.2 b) |
|
| Nx | số lượng vi sinh tại thời điểm tx (5.6.3.3) |
Có thể có trường hợp không có sự giảm số lượng vi sinh, thậm chí có trường hợp tăng số lượng vi sinh.
5.7 Giải thích kết quả và kết luận
5.7.1 Tiêu chí chấp nhận
Giá trị giảm log Rx (5.6.3.4) được so sánh với giá trị nhỏ nhất được yêu cầu cho tiêu chuẩn đánh giá A hay B được nêu trong mục Phụ lục B.
Tiêu chuẩn chấp nhận diễn tả hiệu quả kháng vi sinh vật của công thức mỹ phẩm như sau:
— Tiêu chuẩn A: Công thức mỹ phẩm được bảo quản kháng lại sự sinh trưởng của vi sinh vật có thể xem như là một yếu tố nguy cơ cho người sử dụng và không có những yếu tố bổ sung nào được xem xét. (6.2 a).
— Tiêu chuẩn B: theo đó mức độ kháng vi sinh vật có thể chấp nhận được nếu phân tích rủi ro chứng minh sự tồn tại của các yếu tố kiểm soát không liên quan đến công thức cho thấy rủi ro vi sinh có thể chấp nhận đối với sản phẩm mỹ phẩm.(6.2 b).
Tiêu chuẩn chấp nhận được diễn tả bằng giá trị giảm log nhỏ nhất hay bằng “NI" khi sự yêu cầu là không có sự gia tăng về số lượng vi sinh vật.
Sai số của phương pháp vi sinh được sử dụng để xác định các giá trị Rx là giá trị sẽ được xem xét khi so sánh các giá trị Rx đã thu được và các tiêu chí A hoặc B. Trong tiêu chuẩn này, độ lệch khoảng 0,5 log so với các giá trị tiêu chuẩn được coi là chấp nhận được.
5.7.2 Trường hợp tổng quát (hiệu quả của chất trung hòa được chứng minh với tất cả các chủng vi sinh)
Đối với mỗi chủng vi sinh so sánh giá trị Rx với các giá trị tiêu chuẩn A hay B (Phụ lục B và 5.7).
a) Nếu tất cả các giá trị giảm phù hợp với tiêu chí A, công thức đáp ứng những yêu cầu A của phép thử hiệu quả chất bảo quản và phù hợp (6.2 a) đáp ứng những yêu cầu của tiêu chuẩn này.
b) Nếu tất cả các giá trị giảm chỉ phù hợp với tiêu chí B thì công thức đáp ứng yêu cầu B của kiểm tra hiệu quả chất bảo quản, cần phải bổ sung thêm bằng chứng để chỉ ra rằng sản phẩm đáp ứng các yêu cầu của tiêu chuẩn này (6.2 b).
c) Nếu một hoặc nhiều giá trị giảm không phù hợp với tiêu chí A hoặc B, thì công thức không đáp ứng các yêu cầu của kiểm tra hiệu quả chất bảo quản. Tình trạng của sản phẩm chỉ được đánh giá theo đánh giá rủi ro vi sinh học (6.2 c).
5.7.3 Trường hợp đối với công thức mà hiệu quả của chất trung hòa không chứng minh được cho một số chủng
Nếu hiệu quả của chất trung hòa không chứng minh được đối với một số chủng mặc dù có thêm các phép thử bổ sung (5.5.4), công thức có thể được coi là không dễ bị nhiễm các dòng vi khuẩn này. Lưu ý kết quả là "không dễ bị nhiễm". Kết quả này được coi là tương đương với Rx được đưa ra bởi giá trị tiêu chuẩn về độ giảm log trong Phụ lục B.
Giải thích các kết quả cho các chủng mà hiệu quả của chất trung hòa được chứng minh và so sánh các giá trị của Rx với giá trị tiêu chuẩn A hoặc B đã được thiết lập (Phụ lục B và 5.7).
Nếu tất cả các giá trị giảm phù hợp với tiêu chí A (hoặc B), công thức thỏa mãn bởi phép ngoại suy các yêu cầu A (hoặc B) của việc kiểm tra hiệu quả chất bảo quản.
Nếu một hoặc nhiều giá trị giảm không tuân theo tiêu chí A (hoặc B), công thức không đáp ứng các yêu cầu của kiểm tra hiệu quả chất bảo quản.
5.8 Báo cáo thử nghiệm
Báo cáo thử nghiệm bao gồm các thông tin sau:
a) Viện dẫn tiêu chuẩn này, nghĩa là TCVN 13632 (ISO 11930:2019, Amendment 1-08/2022);
b) Tên của phòng thí nghiệm tiến hành phép thử;
c) Nhận diện sản phẩm mỹ phẩm (hoặc công thức):
1) Tên của sản phẩm;
2) Số lô hoặc ngày sản xuất của lô;
3) Tên của các tổ chức chịu trách nhiệm về tiếp thị sản phẩm và tên của các nhà sản xuất, nếu biết;
4) Ngày nhận ở phòng thí nghiệm;
5) Điều kiện lưu trữ tại phòng thí nghiệm.
d) Phương pháp đếm được sử dụng;
e) Các điều kiện thử nghiệm;
1) Thời gian phân tích;
2) Điều kiện ủ của mẫu đã thêm chủng;
3) Thành phần của chất trung hòa;
4) Nhiệt độ ủ của đĩa Petri;
5) Môi trường sử dụng;
6) Chủng kiểm tra (chủng gốc và những điều kiện lưu trữ);
7) Các cách thức gây nhiễm của mẫu với các vi sinh thử nghiệm (khối lượng / thể tích của sản phẩm, thể tích của hỗn dịch chuẩn).
f) Kết quả phép thử:
1) Số lượng ban đầu của các vi sinh vật, N và N0 (5.6.3.2 a và 5.6.3.2 b);
2) Các kết quả chứng minh hiệu quả chất trung hòa đối với mỗi chủng thử và nồng độ của mẫu mà hiệu quả trung hòa được chứng minh (trong trường hợp không thể hiện được đối với một số chủng, cho biết các kết quả thử nghiệm thu được và các thử nghiệm thực hiện để đạt được sự trung hòa);
3) Những kết quả thử nghiệm (kết quả đếm, kết quả tính giá trị giảm log cho mỗi chủng thừ và tại mỗi thời điểm lấy mẫu;
g) Kết luận.
6 Đánh giá tổng thể cho hiệu quả kháng vi sinh vật của các sản phẩm mỹ phẩm
6.1 Nguyên tắc
Việc kháng vi sinh vật dựa trên sự kết hợp của đặc điểm công thức, điều kiện sản xuất và bao bì cuối cùng. Đánh giá tổng thể có tính đến việc đánh giá rủi ro vi sinh cùng với kết quả kiểm tra hiệu quả bảo quản, nếu thích hợp, như được nêu trong sơ đồ quyết định (xem Phụ lục A). Nhà sản xuất có trách nhiệm cung cấp thông tin để chứng minh rằng sự an toàn đã được chứng minh một cách thỏa đáng và mức độ rủi ro là chấp nhận được.
6.2 Trường hợp 1 - Phép thử hiệu quả bảo quản được thực hiện trên công thức
a) Nếu công thức đáp ứng tiêu chí A, rủi ro về vi sinh được coi là có thể chấp nhận được (sản phẩm mỹ phẩm được bảo vệ kháng lại sự tăng sinh vi sinh vật có thể gây nguy hiểm cho người sử dụng) và sản phẩm mỹ phẩm được coi là đáp ứng yêu cầu của tiêu chuẩn này mà không cần có lý do bổ sung.
b) Nếu công thức này đáp ứng tiêu chí B, phân tích rủi ro vi sinh phải chứng minh có các yếu tố kiểm soát không liên quan đến công thức; ví dụ, bao bì đóng gói là dạng bơm sẽ có mức độ bảo vệ cao hơn so với bình (xem Phụ lục D). Đây sẽ là dạng đóng gói bảo vệ để giảm nguy cơ. Do đó, nếu phân tích rủi ro chứng minh là có các yếu tố kiểm soát, sản phẩm mỹ phẩm được coi là đáp ứng các yêu cầu của tiêu chuẩn này trên cơ sở tiêu chí B với các đặc điểm bổ sung cho thấy rủi ro vi sinh có thể chấp nhận được.
c) Nếu công thức không đáp ứng tiêu chí A hoặc B, thì tình trạng của sản phẩm sẽ được đánh giá theo đánh giá rủi ro vi sinh. Ví dụ, một sản phẩm đơn liều sẽ được coi là có nguy cơ vi sinh có thể chấp nhận được, ngay cả khi công thức không đáp ứng yêu cầu của tiêu chí A hoặc B, với điều kiện chất lượng vi sinh của sản phẩm hoàn thiện được đảm bảo tại thời điểm xuất xưởng.
CHÚ THÍCH: Các dữ liệu khác như dữ liệu khách hàng đang sử dụng sản phẩm có thể được sử dụng để chứng minh rủi ro vi sinh của một sản phẩm.
Do đó, nếu phân tích rủi ro cho thấy sự tồn tại của các yếu tố kiểm soát được tăng cường (giảm rủi ro) thì sản phẩm mỹ phẩm được coi là đáp ứng các yêu cầu của tiêu chuẩn này.
d) Nếu sản phẩm mỹ phẩm không đáp ứng với bất kỳ với tình huống nào trong 3 trường hợp vừa nêu thì nó không thỏa mãn với những yêu cầu của tiêu chuẩn này.
6.3 Trường hợp 2 - Phép thử hiệu quả bảo quản không được thực hiện trên công thức
Theo tiêu chuẩn TCVN 13641 (ISO 29621), các tổ chức chịu trách nhiệm về sản xuất và / hoặc tiếp thị của sản phẩm mỹ phẩm phải xác định những đặc điểm của công thức hoặc các thành phẩm mỹ phẩm các yếu tố kiểm soát nhằm đảm bảo rằng nguy cơ vi sinh là thấp.
Những đặc điểm, và với bất kỳ tài liệu hỗ trợ nào nhằm chứng tỏ rằng nguy cơ vi sinh là chấp nhận được, phải được báo cáo.
Do đó nếu những kết quả phân tích rủi ro vi sinh chỉ ra rằng công thức hay thành phẩm được xem là có nguy cơ thấp thì sản phẩm mỹ phẩm được coi là đáp ứng các yêu cầu của các yêu cầu của tiêu chuẩn này trên cơ sở đánh giá rủi ro vi sinh vật, với điều kiện là quy trình sản xuất sản phẩm tuân thủ thực hành sản xuất tốt.
Nếu kết quả đánh giá rủi ro vi sinh cho thấy một công thức hoặc thành phẩm có mức độ rủi ro không chấp chận được thì sản phẩm đó không đáp ứng được với các yêu cầu của tiêu chuẩn này. Việc giảm rủi ro sẽ phải được thực hiện, nhằm đảm bảo sản phẩm này tuân thủ theo yêu cầu.
PHỤ LỤC A
(Quy định)
Hình A.1: Sơ đồ quyết định
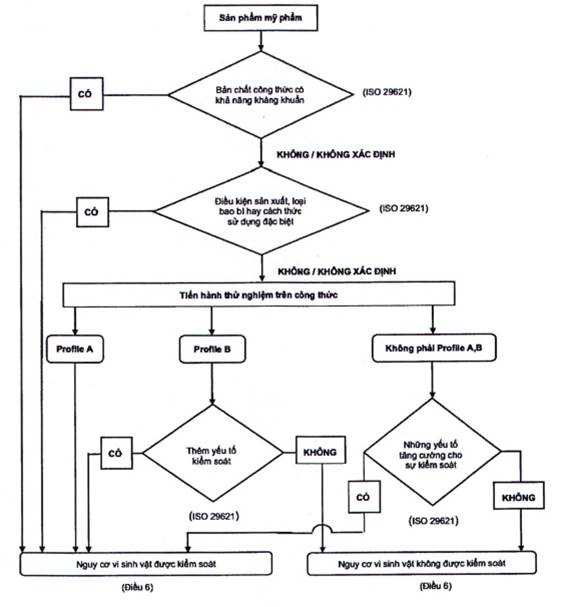
PHỤ LỤC B
(Quy định)
Tiêu chí đánh giá cho thử nghiệm kiểm tra hiệu quả bảo quản
Bảng B.1 - Đánh giá hiệu quả kháng vi sinh vật
| Yêu cầu về giá trị giảm log (Rx = logN0 - logNx) yêu cầua | ||||||||
| Vi sinh vật | Vi khuẩn | C.albicans | A. brasiliensis | |||||
| Thời điểm về lấy mẫu thử nghiệm | T7 | T14 | T28 | T7 | T14 | T28 | T14 | T28 |
| Tiêu chuẩn A | ≥ 3 | ≥ 3 và Nlb | ≥ 3 và NI | ≥ 1 | ≥ 1 và NI | ≥ 1 và NI | ≥ 0c | ≥ 1 |
| Tiêu chuẩn B | Không thực hiện | ≥ 3 | ≥ 3 và NI | Không thực hiện | ≥ 1 | ≥ 1 và NI | ≥ 0 | ≥ 0 và NI |
| a Trong thử nghiệm này, một dãy giá trị chênh lệch của 0,5 log được chấp nhận (5.7) b NI: không tăng số lượng từ thời điểm tiếp xúc mẫu c Rx= 0 khi Ig N0 = Ig Nx (không tăng từ khi đếm ban đầu) | ||||||||
PHỤ LỤC C
(Tham khảo)
Ví dụ về chất trung hòa chất kháng vi sinh vật và dung dịch rửa
Bảng C.1 - Các chất trung hòa tương ứng với hoạt tính kháng vi sinh vật của chất bảo quản và các dung dịch rửa / lọc
| Chất bảo quản | Hợp chất hóa học có thể trung hòa hoạt tính kháng khuẩn của chất bảo quản | Ví dụ về thành phần chất trung hòa thích hợp và các dung dịch rửa (dùng cho phương pháp màng lọc) |
| Các hợp chất phenol: Các paraben, phenoxyethanol, Phenylethanol, v.v... Các anilin | Lecithin, Polysorbat 80, Ethylen oxid ngưng tụ của cồn béo (fatty alcohol) Chất hoạt động bề mặt không ion | 30 g/l Polysorbat 80 + 3 g/l lecithin 7 g/l Ethylen oxid ngưng tụ của cồn béo + 20 g/l lecithin + 4 g/l polysorbate 80 Môi trường lỏng trung hòa D/Ea, môi trường lỏng SDCLPb Dung dịch rửa: nước cất vô khuẩn; 1 g/l trypton, + 9 g/l NaCI; 5 g/l polysorbat 80 |
| Các hợp chất amoni bậc bốn Các chất hoạt động bề mặt cation | Lecithin, saponin, polysorbat 80, natri dodecyl sulphat Ethylen oxid ngưng tụ của cồn béo (fatty alcohol) | 30 g/l Polysorbat 80 + 4 g/l natri dodecyl sulphat + 3 g/l lecithin 30 g/l Polysorbat 80 + 30 g/l saponin + 3 g/l lecithin Môi trường lỏng trung hòa D/Ea, môi trường lỏng SDCLPb Dung dịch rửa: nước cất vô khuẩn; 1 g/l trypton, + 9 g/l NaCI; 5 g/l polysorbat 80 |
| Các andehit Các chất giải phóng formaldehyd | Glycin, histidin | 3 g/l Lecithin + 30 g/l polysorbat 80 + 1 g/l L-histidin 30 g/l Polysorbat 80 + 30 g/l saponin + 1 g/l L- histidin + 1 g/l L-cystein Môi trường lỏng trung hòa D/Ea, môi trường lỏng SDCLPb Dung dịch rửa: nước cất vô khuẩn; 3 g/l polysorbat 80 + 0,5 g/l L-histidin |
| Các hợp chất oxy hóa | Natri thiosulfat | 5 g/l Natri thiosulfat Dung dịch rửa: 3 g/l Natri thlosulfat |
| Các isothiazolinon, imidazol | Lecithin, saponin Các amin, sulfat, mercaptan, natri blsulfit, natri thioglycolat | 30 g/l Polysorbat 80 + 30 g/l saponin + 3 g/l lecithin Dung dịch rửa; 1 g/l trypton + 9 g/l NaCI; 5 g/l polysorbat 80 |
| Các biguanide | Lecithin, saponin, polysorbat 80 | 30 g/l Polysorbat 80 + 30 g/l saponin + 3 g/l lecithin Dung dịch rửa: 1 g/l trypton + 9 g/l NaCI; 5 g/l polysorbat 80 |
| Các muối kim loại (Cu, Zn, Hg) Các muối thủy ngân hữu cơ | Natri bisulfat, L-cystein Các hợp chất sulfhydryl, axlt thioglycolic | 0,5 g/l hay 5 g/l Natri thioglycolat 0,8 g/l hay 1,5 g/l L-cystein Môi trường lỏng trung hòa D/Ea, môi trường lỏng SDCLPb Dung dịch rửa: 0,5 g/l Natri thloglycolat |
| a Môi trường lỏng trung hòa D/E (Môi trường lỏng trung hòa Dey/Engley) - xem Phụ lục B b Môi trường lỏng casein thủy phân từ đậu tương bổ sung lecithin và polysorbat | ||
PHỤ LỤC D
(Tham khảo)
Đặc tính đóng gói
Cần cân nhắc đến đặc tính của bao bì. Thiết kế bao bì đóng một vai trò quan trọng trong kế hoạch đánh giá rủi ro và trong việc xác định khả năng kháng lại vi sinh vật của một sản phẩm mỹ phẩm.
Đặc tính của bao bì, hoặc việc sử dụng một loại bao bì có thể dùng lại, có thể ảnh hưởng đến việc lựa chọn hệ thống bảo quản. Khả năng nhiễm vi sinh vật do người dùng sẽ tăng lên khi bao bì cỏ miệng rộng và phải chịu sự tiếp xúc trực tiếp của người dùng. Tương tự như vậy, nguy cơ nhiễm vi sinh bởi người dùng sẽ giảm khi bao bì là dạng đơn liều, ống nhỏ mắt một chiều hoặc khi ngăn ngừa việc tiếp xúc trực tiếp giữa sản phẩm với người dùng. Kích thước bao bì so với số lượng được sử dụng cho mỗi lần dùng nên được xem xét vì việc sử dụng một bao bì lớn có chứa nhiều sản phẩm hơn và kéo dài thời gian sử dụng trong một khoảng thời gian dài làm tăng khả năng lây nhiễm. Sự có mặt của các vật dụng bổ sung như bàn chải, miếng đệm hoặc miếng bông phấn cũng sẽ ảnh hưởng đến nhu cầu bảo vệ kháng vi sinh.
Các yếu tố sau đây nằm trong số những yếu tố được xem xét khi đánh giá rủi ro sản phẩm liên quan đến bao bì:
— Dạng đóng gói đơn liều hay đa liều;
— Kích cỡ đóng gói;
— Cách thức bào chế sản phẩm;
— Thời gian sử dụng ước đoán;
— Khả năng bao bì cho phép tiếp xúc trực tiếp với người sử dụng hay không;
— Khả năng bao bì có bị áp lực hay không.
Thư mục tài liệu tham khảo
[1] TCVN 12976 (ISO 22716), Mỹ phẩm - Thực hành sản xuất tốt (GMP) - Hướng dẫn thực hành sản xuất tốt
[2] TCVN 6844 (ISO/IEC Guide 51), Hướng dẫn việc đề cập khía cạnh an toàn trong tiêu chuẩn
[3] EN 12353, Chemical disinfectants and antiseptics — Preservation of test organisms used for the determination of bactericidal, mycobactericidal, sporicidal and fungicidal activity (Hóa chất khử khuẩn và chất khử khuẩn — Bảo quản các sinh vật thử nghiệm được sử dụng để xác định hoạt tính diệt khuẩn, diệt khuẩn, diệt khuẩn và diệt nấm)
[4] IBRAHIM Y.K.E., GEISS H.K., SONNAG H.-G, Alternatives to the traditional preservatives, SoFW, 118, June 1192
[5] LUCK E., JAGER M., Antimicrobial food additives; characteristics, uses, effects, Springer (ed), 1995, pp. 122-124
[6] Application of Water Activity Determination to Nonsterile Pharmaceuticals Products. USPC, Inc., 30(5), 2006, in-process revision: <1112>
[7] CTFA Microbiology guidelines 2007
[8] RUSSELL N.J., GOULD G.W., Food preservatives, Blackie and Son Ltd., 1991, pp. 16-17
[9] DENYERS S., BAIRD R., Guide to microbiological control in pharmaceuticals, 1990, pp.16-17 and p.285
[10] RAHMAN M.S., Handbook of food preservation, Marcel Dekker, Inc., 1999, pp. 95-172 and p.386
[11] MEIER M., FISHER F.X., KELLER M., HALFMANN H.J., Influence of alternative propellants on microbial viability in comparison to chlorofluorocarbons, Pharm. Ind., 58, pp.78-82, 1996
[12] DECLERCK J., CAIRE-MAURISIER F, GENOT P., LEVACHER E., MICHAUT A., SCHEIBER G., TARDIVET S., Les gaz propulseurs: les HFC (hydrofluorocarbones) alternatives aux CFC (chlorofluorocarbones) pour les preparations pharmaceutiques pressurisees, SFSTP Pharmapratiques, 16(1), January/February 2006, pp.61-72
[13] BLOOMFIELD S.F., BAIRD R., LEAK R.E., LEECH R., Microbial Quality Assurance in Pharmaceuticals, Cosmetics and Toiletries, Ellis Horwood Series in Pharmaceutical Technology, 1988, p.78
[14] SAWYER E., GREEN B., COLTON H., Microorganisms survival in non-CFC propellant P134a and a combination of CFC propellants P11 and P12, Pharmaceutical Technology, March 2001, pp.90-96
[15] BRANNAN D.K., Packaging’s role in preservation, Cosmetics and Toiletries, 113, Abilene Christian University, Abilene, TX, April 1998
[16] SHARPELL F., & MANOWITZ M., Preservation of cosmetics, Disinfection, sterilization and preservation, fourth edition, Seymour S. Block — Lea & Febiger, 1991
[17] IBRAHIM Y.K.E., & SONNAG H.-G., Preservative potentials of some aerosol propellants, Effectiveness in some pharmaceutical oils, Drugs made in Germany, 2, 1995
[18] KABARA J.J., & ORTH D.S., Principles for product preservation, Preservative-free and self- preserving cosmetics and drugs, principles and practice, Marcel Dekker, Inc. (ed.), New York, 1997, pp.1-14
[19] FRIEDELR R., & CUNDELL A.M., The application of water activity measurement to the microbiological attributes testing of nonsterile over-the-counter drug products, Pharmacopeial Forum, 24(2), March-April 1998
[20] BRANNAN D.K., & DILLE J.C., Type of closure prevents microbial contamination of cosmetics during consumer use, Appl. Environ. Microbiol., 56, 1990, pp. 1476-1479
[21] ENIGLD C., & SORRELS K.M., Water activity and self-preserving formulas, Preservative- free and self-preserving cosmetics and drugs, principles and practice, Marcel Dekker, lnc.(ed.), New York, 1997, pp.45-71
[22] MISOCK J. "Report For International Cooperation On Cosmetics Regulation Regulators & Industry Joint Working Group (JWG): Review of ISO Microbiological Standards: Guidelines for Cosmetic Preservation and Product Protection", June 6, 2017
Mục lục
Lời nói đầu
Lời giới thiệu
1 Phạm vi áp dụng
2 Tài liệu viện dẫn
3 Thuật ngữ và định nghĩa
3.1 Công thức mỹ phẩm (cosmetic formulation)
3.2 Sản phẩm mỹ phẩm (cosmetic product)
3.3 Tính kháng vi sinh vật của sản phẩm mỹ phẩm (antimicrobial protection of a cosmetic product)
3.4 Sự bảo quản của một công thức mỹ phẩm (preservation of a cosmetic formulation)
3.5 Phương pháp đối chứng (reference method)
3.6 Phương pháp phát triển (development method)
3.7 Người dùng (consumer)
4 Nguyên tắc
5 Thử nghiệm hiệu quả bảo quản
5.1 Quy định chung
5.2 Vật liệu, thiết bị, thuốc thử và môi trường nuôi cấy
5.3 Chủng vi sinh vật
5.4 Chuẩn bị và đếm chủng vi sinh vật
5.5 Chứng minh hiệu quả của chất trung hòa
5.6 Xác định hiệu quả bảo quản của công thức
5.7 Giải thích kết quả và kết luận
5.8 Báo cáo thử nghiệm
6 Đánh giá tổng thể cho hiệu quả kháng vi sinh vật của các sản phẩm mỹ phẩm
6.1 Nguyên tắc
6.2 Trường hợp 1 - Phép thử hiệu quả bảo quản được thực hiện trên công thức
6.3 Trường hợp 2 - Phép thử hiệu quả bảo quản không được thực hiện trên công thức
PHỤ LỤC A (Quy định) Hình A.1: Sơ đồ quyết định
PHỤ LỤC B (Quy định) Tiêu chí đánh giá cho thử nghiệm kiểm tra hiệu quả bảo quản
PHỤ LỤC C (Tham khảo) Ví dụ về chất trung hòa chất kháng vi sinh vật và dung dịch rửa
PHỤ LỤC D (Tham khảo) Đặc tính đóng gói
Thư mục tài liệu tham khảo
[1]) Triton X100® là một ví dụ về một sản phẩm phù hợp có sẵn trên thị trường. Thông tin này được cung cấp để tạo sự thuận tiện cho người sử dụng tài liệu này và xác lập sự chứng thực của ISO đối với sản phẩm nay.
[2]) ATCC®: American Type Culture Collection
[3]) CIP®: Collection de I’Instiut Pasteur
[4]) NCIMB®: National Collection of Industrial Marine Bacteria
[5]) NBRC®: NITE Biological Resource Center, JP
[6]) KCTC®: Korean Collection for Type Cultures
[7]) NCTC®: National Collection of Type Cultures
[8]) IP®: Institut Pasteur
[9]) NCPF®: National Collection of Pathogenic Fungi
[10]) IMI®: International Mycological institute, UK
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 13632:2023 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 13632:2023 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 13632:2023 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 13632:2023 DOC (Bản Word)