- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn TCVN 14438:2025 Thực phẩm - Xác định benzo[a]pyren, benz[a]anthracen, chrysen và benzo[b]fluoranthen bằng GC-MS
| Số hiệu: | TCVN 14438:2025 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Thực phẩm-Dược phẩm |
| Trích yếu: | BS EN 16619:2015 Thực phẩm - Xác định benzo[a]pyren, benz[a]anthracen, chrysen và benzo[b]fluoranthen bằng sắc ký khí - khối phổ (GC-MS) | ||
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
22/05/2025 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 14438:2025
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 14438:2025
TIÊU CHUẨN QUỐC GIA
TCVN 14438:2025
BS EN 16619:2015
THỰC PHẨM-XÁC ĐỊNH BENZO [a] PYREN, BENZ [a] ANTHRACEN, CHRYSEN VÀ BENZO [b] FLUORANTHEN BẰNG SẮC KÝ KHÍ-KHỐI PHỔ (GC-MS)
Food analysis - Determination of benzo[a]pyrene, benz[a]anthracene, chrysene and benzo[b]fluoranthene in foodstuffs by gas chromatography-mass spectrometry (GC-MS)
Lời nói đầu
TCVN 14438:2025 hoàn toàn tương đương với BS EN 16619:2015;
TCVN 14438:2025 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC/F13 Phương pháp phân tích và lấy mẫu biên soạn, Viện Tiêu chuẩn Chất lượng Việt Nam đề nghị, Ủy ban Tiêu chuẩn Đo lường Chất lượng Quốc gia thẩm định, Bộ Khoa học và Công nghệ công bố.
THỰC PHẨM-XÁC ĐỊNH BENZO[a]PYREN, BENZ[a]ANTHRACEN, CHRYSEN VÀ BENZO[b]FLUORANTHEN BẰNG SẮC KÝ KHÍ-KHỐI PHỔ (GC-MS)
Food analysis - Determination of benzo[a]pyrene, benz[a]anthracene, chrysene and benzo[b]fluoranthene in foodstuffs by gas chromatography-mass spectrometry (GC-MS)
CẢNH BÁO - Việc sử dụng tiêu chuẩn này có thể liên quan đến các vật liệu, thao tác và thiết bị, dụng cụ nguy hiểm. Tiêu chuẩn này không nhằm mục đích giải quyết tất cả các vấn đề an toàn liên quan đến việc sử dụng chúng. Người sử dụng có trách nhiệm thiết lập các biện pháp an toàn và sức khỏe phù hợp trước khi sử dụng.
1 Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp xác định 4 hydrocarbon thơm đa vòng (PAH): benz[a]anthracen (BaA), benzo[a]pyren (BaP), benzo [b] fluoranthen (BbF) và chrysen (CHR). Phương pháp này cho phép định lượng với sự có mặt của 12 PAH khác [benzo[j]fluoranthen (BjF), cyclopenta[cd]pyren (CPP), benzo[k]fluoranthen (BkF), dibenz[a,h]anthracen (DhA), benzo[c]fluoren (BcL), dibenzo[a,e]pyren (DeP), benzo[ghi]perylen (BgP), dibenzo[a,h]pyren (DhP), dibenzo[a,i]pyren (DiP), dibenzo[a,l]pyren (DIP), indeno[1,2,3-cd]pyren (IcP), 5-metylchrysen (5MC)] trong bột mì ép đùn, cá xông khói, sữa bột cho trẻ sơ sinh, xúc xích thịt, hến đông khô, dầu ăn và bột mì bằng sắc ký khí-khối phổ (GC-MS). Việc chiết các PAH ra khỏi các mẫu dạng rắn được thực hiện bằng phương pháp chiết áp lực (PLE). Chiết Soxhlet đã được một số phòng thử nghiệm tham gia sử dụng trong nghiên cứu xác nhận giá trị sử dụng của phương pháp để thay thế cho PLE. Việc làm sạch mẫu được thực hiện bằng cách sử dụng các kỹ thuật sau đây: sắc ký rây phân tử (SEC) và chiết pha rắn (SPE).
Phương pháp này đáp ứng các đặc tính hiệu năng (xem Tài liệu tham khảo [1]). Cụ thể là các thông số kỹ thuật cho giới hạn phát hiện (LOD) và giới hạn định lượng (LOQ) (tương ứng là 0,30 μg/kg và 0,90 μg/kg) đã được đáp ứng.
Phương pháp này đã được xác nhận giá trị sử dụng trong một nghiên cứu liên phòng thử nghiệm thông qua phân tích cả hai mẫu nhiễm tự nhiên và mẫu thêm chuẩn với nồng độ trong khoảng từ 0,5 μg/kg đến 11,9 μg/kg. Tuy nhiên, tín hiệu trong thiết bị tỷ lệ tuyến tính với nồng độ trong khoảng từ 0,5 μg/kg đến 20 μg/kg.
Để xác định các PAH trong dầu và mỡ ăn, sử dụng hai tiêu chuẩn khác là TCVN 10482 (ISO 22959) và TCVN 9531 (ISO 15753) (xem Tài liệu tham khảo [2] và [3]).
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 4851:1989 (ISO 3696:1987), Nước dùng để phân tích trong phòng thí nghiệm - Yêu cầu kỹ thuật và phương pháp thử
TCVN 7153:2002 (ISO 1042:1998), Dụng cụ thí nghiệm bằng thủy tinh - Bình định mức một vạch
3 Nguyên tắc
Mẫu được đồng nhất. Phần mẫu thử được trộn với chất hút ẩm, cát và dung dịch nội chuẩn có gắn đồng vị bền. Sau đó, chiết mẫu với n-hexan hoặc cyclohexan bằng kỹ thuật chiết chất lỏng dưới áp lực hoặc chiết Soxhlet. Nếu có thể, tách nước đã được đồng chiết ra khỏi pha hữu cơ của dịch chiết. Phần chiết hữu cơ được làm bay hơi đến thể tích nhỏ, được lọc và tinh sạch bằng SEC, sử dụng hỗn hợp ethyl acetat và cyclohexan làm dung môi rửa giải.
Sau bước sử dụng SEC, thêm 200 μL toluen vào để thu phân đoạn đã chiết bằng SEC. Phân đoạn đã chiết bằng SEC được cho bay hơi đến khoảng 200 μL và được làm sạch bằng SPE trên silica, sử dụng cyclohexan làm dung môi rửa giải. Dung dịch mẫu đã làm sạch được làm bay hơi lại đến khoảng 200 μL. Cuối cùng, dung dịch chuẩn được thêm vào mẫu trước khi đo bằng GC-MS.
Việc bơm mẫu được thực hiện bằng PTV hoặc cổng bơm phân chia dòng/không phân chia dòng. Việc phân tách sắc ký thu được trên cột mao quản phân cực trung bình có độ chọn lọc cao đối với PAH. Các chất phân tích được ion hóa bằng ion hóa điện tử (El) ở 70 eV. Các PAH đích được ghi lại ở chế độ kiểm soát một ion (SIM) và được định lượng bằng cách so sánh với các chất tương tự có gắn đồng vị bền.
4 Thuốc thử
4.1 Yêu cầu chung
Chỉ sử dụng các thuốc thử loại tinh khiết phân tích và nước phù hợp với loại 1 của TCVN 4851:1989 (ISO 3696:1987), trừ khi có quy định khác. Tất cả thuốc thử và dung dịch chuẩn phải được bảo quản theo quy định của nhà cung cấp. Các thông số kỹ thuật nêu trong quy trình này dành cho các dung dịch thương mại hoặc các dung dịch được chuẩn bị sẵn nhằm giảm thiểu bay hơi dung môi và bảo vệ các chất phân tích (PAH) khỏi sự suy giảm chất lượng.
Các dung dịch chuẩn tốt nhất được chuẩn bị bằng phương pháp khối lượng. Tùy thuộc vào lượng chất cần xử lý, sử dụng cân vi phân tích (6.4) và/hoặc cân phân tích (6.5) để chuẩn bị các dung dịch nhiễm tự nhiên và các dung dịch PAH có gắn đồng vị bền. Tất cả các nồng độ được biểu thị theo phần khối lượng. Nồng độ được biểu thị dưới dạng khối lượng trên thể tích có thể thu được bằng cách áp dụng phương trình tỷ trọng sử dụng Công thức (1), nếu cần.
|
| (1) |
Trong đó:
p là tỷ trọng, tính bằng gam trên mililit (g/mL);
m là khối lượng của chất, tính bằng gam (g);
V là thể tích dung dịch, tính bằng mililit (mL).
Tỷ trọng của toluen ở 20 °C là 0,8669 g/mL. Thông tin đầy đủ về tỷ trọng dung môi ở các nhiệt độ khác nhau được nêu trong Tài liệu tham khảo [4].
Tất cả các dung dịch và các chất được sử dụng ở nhiệt độ phòng.
CẢNH BÁO 1 - Một số PAH được coi là chất gây ung thư. Những người sử dụng tiêu chuẩn này cần nắm rõ các thực hành phòng thử nghiệm. Người sử dụng tiêu chuẩn này có trách nhiệm áp dụng các thực hành phù hợp với các biện pháp an toàn và sức khỏe nghề nghiệp.
CẢNH BÁO 2 - Việc thải bỏ chất thải hóa chất cần thực hiện theo các quy trình và quy định về môi trường hiện hành.
CẢNH BÁO 3 - Các PAH bị biến đổi bởi ánh sáng UV. Bảo vệ các dung dịch PAH tránh ánh sáng (giữ ở nơi tối, sử dụng giấy nhôm hoặc bình thủy tinh màu nâu).
CẢNH BÁO 4 - Cần sử dụng một số biện pháp phòng ngừa khi sử dụng chất dẻo như polypropylen hoặc PTFE vì các chất phân tích có thể được hấp thụ vào các vật liệu này.
4.2 Khí nén heli đã tinh sạch (độ tinh khiết tương đương 99,995 % hoặc cao hơn).
4.3 Khí nén nitơ đã tinh sạch (độ tinh khiết tương đương 99,995 % hoặc cao hơn).
4.4 Dinatri sulfat (Na 2 SO 4 ), khan, dạng hạt.
4.5 Poly(acid acrylic), muối natri-ghép-poly(ethylen oxide), dạng hạt, cỡ hạt từ 90 μm đến 850 μm.
4.6 Cát, cỡ hạt từ 50 mesh đến 70 mesh.
4.7 n-Hexan.
4.8 Aceton.
4.9 Cyclohexan.
4.10 Toluen.
4.11 Ethyl acetat.
4.12 Dung môi rửa giải SEC
Trộn 1 phần thể tích cyclohexan (4.9) với 1 phần thể tích ethyl acetat (4.11).
4.13 Cột SPE
Để làm sạch chiết pha rắn, sử dụng cột silica SPE. Các cột thương mại 500 mg, 4 mL hoặc cột tự nhồi có cùng kích cỡ chứa 500 mg silica hoạt tính được sử dụng. Diện tích bề mặt của silica ở khoảng 500 m 2 /g.
CHÚ THÍCH Các cột SPE thương mại bằng polypropylen đã được sử dụng trong nghiên cứu xác nhận giá trị sử dụng của phương pháp bằng thử nghiệm cộng tác.
4.14 Mẫu chuẩn để kiểm soát chất lượng
Mẫu chuẩn đã được chứng nhận hoặc mẫu kiểm soát chất lượng bất kỳ khác phù hợp (ví dụ: mẫu thử nghiệm thành thạo) có thể được sử dụng cho mục đích này.
Phân tích mẫu chuẩn này theo từng mẻ mẫu và sử dụng để kiểm soát hiệu năng của phương pháp theo thời gian (xem 10.4).
4.15 Các chất chuẩn tự nhiên - vật liệu hoặc các dung dịch PAH có bán sẵn trên thị trường
Danh mục các chất tự nhiên được phân tích bằng phương pháp này được nêu trong Bảng 1. Các chất phân tích đích được in đậm. Nên ưu tiên các dung dịch chuẩn đã được chứng nhận do mức độ an toàn cao hơn trong việc xử lý.
Triphenylen, benzo[/]fluoranthen và benzo[k]fluoranthen có khả năng gây nhiễu các chất phân tích đích và do đó được sử dụng để đánh giá độ chọn lọc.
Bảng 1 - Tên và cấu trúc của các PAH tự nhiên
| Tên a | Số CAS | Cấu trúc | Tên a | Số CAS | Cấu trúc |
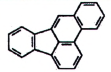
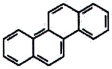
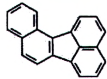
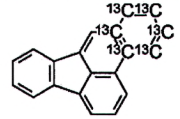
| Benz[a]anthracen (BaA) | 56-55-3 |
Hình 1 | Benzo[b]fluoranthen (BbF) | 205-99-2 |
Hình 2 |
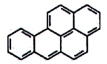
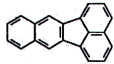
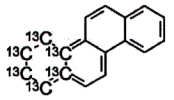
| Benzo[a]pyren (BaP) | 50-32-8 |
Hình 3 | Chrysen (CHR) | 218-01-9 |
Hình 4 |
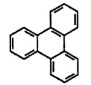
| Triphenylen (TRP) | 217-59-4 |
Hình 5 | Benzo[j]fluoranthen (BjF) | 205-82-3 |
Hình 6 |
| Benzo[k]fluoranthen (BkF) | 207-03-9 |
Hình 7 |
|
|
|
| a Tên viết tắt được nêu trong ngoặc đơn, tên các chất phân tích đích được in đậm. | |||||
4.16 Các chuẩn đối chứng có gắn đồng vị bền (dưới dạng các dung dịch PAH có gắn đồng vị bền có bán sẵn)
Các chất tương tự có gắn đồng vị bền được sử dụng để định lượng các PAH đích được liệt kê trong Bảng 2. Các dung dịch thương mại được sử dụng trong nghiên cứu xác nhận giá trị sử dụng của phương pháp bằng thử nghiệm cộng tác chứa PAH có gắn đồng vị bền ở mức khoảng 100 μg/kg trong nonan.
Ưu tiên cho các chất tương tự có gắn 13 C vì các đặc tính hóa học của chúng phù hợp nhất với các chất phân tích tự nhiên.
Tuy nhiên, có thể sử dụng các chất tương tự chất phân tích đích đã deuteri hóa thay cho chất có gắn 13 C. Mức nồng độ của các dung dịch này phải tương tự với mức nồng độ được quy định cho các dung dịch PAH có gắn đồng vị 13 C.
CHÚ THÍCH 1 Các PAH đã deuteri hóa cao được tách ra trên cột GC quy định ít nhất một phần từ các chất tương tự chất tự nhiên.
CHÚ THÍCH 2 Cả hai dạng benz[a]anthracen- 13 C 6 , được nêu trong Bảng 2, đều phù hợp với mục đích của tiêu chuẩn này. Chất chuẩn có gắn 13 C thậm chí có thể được cung cấp dưới dạng hỗn hợp, đó là trường hợp trong nghiên cứu xác nhận giá trị sử dụng của phương pháp bằng thử nghiệm cộng tác.
Bảng 2 - Tên và cấu trúc của các PAH có gắn 13 C
| Tên | Số CAS | Cấu trúc |
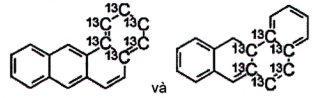
| Benz[a]anthracen- 13 C 6 | Chưa có |
Hình 8 |
| Benzo[a]pyren- 13 C 4 | Chưa có |
Hình 9 |
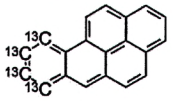
| Benzo[b]fluoranthen- 13 C 6 | Chưa có |
Hình 10 |
| Chrysen- 13 C 6 | Chưa có |
Hình 11 |
Độ thu hồi của phương pháp được tính toán dựa trên các chất chuẩn có gắn đồng vị bền (xem 10.2). Các đặc tính hóa lý của chúng được coi là tương đương với các PAH tự nhiên. Bảng 3 đưa ra mối tương quan giữa từng PAH tự nhiên và các chất tương tự có gắn đồng vị bền dùng cho phép định lượng.
Bảng 3 - PAH tự nhiên và các PAH có gắn đồng vị bền tương ứng
| Các PAH có gắn đồng vị bền | PAH tự nhiên 3 |
| Benz[a]anthracen 13 C 6 | Benz[a]anthracen (BaA) |
| Benzo[a]pyren 13 C 4 | Benzo[a]pyren (BaP) |
| Benzo[b]fluoranthen 13 C 6 | Benzo[b]fluoranthen (BbF) |
| Chrysen 13 C 6 | Chrysen (CHR) |
| a Tên viết tắt được nêu trong ngoặc đơn. | |
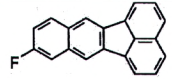
4.17 9-fluorobenzo[k]fluoranthen (FBkF), chất chuẩn dạng nguyên chất hoặc dung dịch bán sẵn 9-fluorobenzo [k] fluoranthen (FBkF) được sử dụng làm chất chuẩn để bơm mẫu và được thêm vào dịch chiết mẫu trước khi bơm vào GC-MS. Có thể sử dụng cả hai vật liệu nguyên chất và dung dịch có bán sẵn. Nồng độ của dung dịch thương mại tốt nhất là 100 μg/kg trong toluen.
Bảng 4 - Tên và cấu trúc của chất chuẩn đề bơm mẫu
| Tên a | Số CAS | Cấu trúc |
| 9-fluorobenzo[k]fluoranthen (FBkF) | 113600-15-0 |
Hình 12 |
| a Tên viết tắt được nêu trong ngoặc đơn. | ||
5 Chuẩn bị chất chuẩn
5.1 Yêu cầu chung
Tốt nhất là tất cả các dung dịch được chuẩn bị bằng phương pháp khối lượng. Khối lượng của tất cả bình chứa và khối lượng sau mỗi bước chuẩn bị được ghi lại và sử dụng để tính nồng độ chất chuẩn.
Có thể chuẩn bị các dung dịch chuẩn theo phương pháp thể tích, với điều kiện là sử dụng dụng cụ thủy tinh phù hợp với TCVN 7153:2002 (ISO 1042:1999).
Các dung dịch chuẩn có thể được chuẩn bị từ các vật liệu nguyên chất, từ các dung dịch các chất đơn lẻ hoặc từ hỗn hợp thương mại. Tuy nhiên, phải tính đến khả năng tương thích của các dung môi của các dung dịch bán sẵn với toluen.
Tốt nhất là sử dụng dung dịch chuẩn PAH hỗn hợp thương mại để chuẩn bị dung dịch chuẩn trung gian (5.7) và dung dịch hiệu chuẩn (5.8). Nồng độ của dung dịch này phải phù hợp với dung dịch gốc PAH hỗn hợp (5.4).
5.2 Dung dịch chuẩn dùng để bơm mẫu
Chuẩn bị dung dịch FBkF (4.17) trong toluen (4.10) với nồng độ khoảng 400 ng/g. Việc chuyển đổi đơn vị khối lượng trên khối lượng (ng/g) sang đơn vị khối lượng trên thể tích (ng/mL) được thực hiện bằng công thức tính tỷ trọng (Công thức (1)). Đối với toluen, sử dụng giá trị tỷ trọng là 0,866 9 g/mL.
Dung dịch này sẽ được sử dụng để thêm vào dịch chiết mẫu trước khi đo bằng GC-MS (xem 7.9) để đánh giá độ thu hồi của các PAH có gắn đồng vị bền (xem 10.2).
Bảo quản dung dịch này nơi tối và ở nhiệt độ dưới 10 °C. Dung dịch được bảo quản theo cách này bền trong ít nhất sáu tháng. Nếu chứng minh được độ ổn định dài hơn thì có thể tiếp tục sử dụng dung dịch.
5.3 Các dung dịch gốc PAH
Dung dịch trong toluen (4.10) có nồng độ trong dải từ 50 μg/g đến 150 μg/g phải được chuẩn bị cho từng PAH tự nhiên được liệt kê trong Bảng 1 trong trường hợp vật liệu đối chứng nguyên chất được sử dụng để chuẩn bị các chất hiệu chuẩn. Các dung dịch gốc PAH này được chuẩn bị bằng cách dùng cân vi phân tích (6.4) để cân từ 1 mg đến 5 mg từng chất, cho vào các ống đong thủy tinh (6.1). Dùng kẹp để chuyển ống đong thủy tinh (6.1) vào bình định mức bằng thủy tinh màu nâu 100 mL (6.2). Thêm khoảng 40 mL toluen, dùng cân phân tích (6.5) để cân toluen. Có thể sử dụng các lọ thu nhận bằng thủy tinh màu nâu khác, với điều kiện là giảm thiểu được sự bay hơi dung môi trong quá trình chuẩn bị chất chuẩn. Siêu âm từng bình vài phút để hòa tan hoàn toàn các PAH tự nhiên trong dung môi.
Khi dung dịch đã đồng nhất, chuyển dung dịch này vào các lọ thủy tinh màu nâu 40 mL (6.3) để bảo quản. Các dung dịch này được sử dụng để chuẩn bị dung dịch gốc PAH hỗn hợp (5.4) và cuối cùng là các dung dịch hiệu chuẩn (xem 5.8).
Bảo quản các dung dịch này nơi tối và ở nhiệt độ dưới 10 °C. Dung dịch được bảo quản theo cách này bền trong ít nhất 12 tháng. Nếu chứng minh được độ ổn định dài hơn thì có thể tiếp tục sử dụng dung dịch.
5.4 Các dung dịch gốc PAH hỗn hợp
Từ các dung dịch gốc PAH (5.3), chuẩn bị dung dịch trong toluen (4.10) với nồng độ khoảng 2 μg/g. Sử dụng cân phân tích (6.5) để cân các dung dịch gốc PAH (5.3) và toluen (4.10).
Dung dịch này sẽ được sử dụng để chuẩn bị dung dịch chuẩn trung gian (5.7) và cuối cùng là dung dịch hiệu chuẩn (xem 5.8).
Bảo quản dung dịch này nơi tối và ở nhiệt độ dưới 10 °C. Dung dịch được bảo quản theo cách này bền trong ít nhất 12 tháng. Nếu chứng minh được độ ổn định dài hơn thì có thể tiếp tục sử dụng dung dịch.
5.5 Dung dịch gốc PAH có gắn đồng vị
Từ các dung dịch riêng lẻ của các PAH có gắn đồng vị bền (4.16) được liệt kê trong Bảng 2, chuẩn bị dung dịch trong toluen (4.10) với nồng độ khoảng 700 ng/g. Sử dụng cân phân tích (6.5) để cân.
Dung dịch này được sử dụng để chuẩn bị dung dịch kiểm soát quá trình (5.6).
Bảo quản dung dịch này nơi tối và ở nhiệt độ dưới 10 °C. Dung dịch được bảo quản theo cách này bền trong ít nhất 12 tháng. Nếu chứng minh được độ ổn định dài hơn thì có thể tiếp tục sử dụng dung dịch.
5.6 Dung dịch kiểm soát quá trình
Từ dung dịch gốc PAH có gắn đồng vị (5.5), chuẩn bị dung dịch trong toluen (4.10) với nồng độ khoảng 150 ng/g. Nồng độ này thu được bằng cách thêm 4,5 mL dung dịch gốc PAH có gắn đồng vị (5.5) vào 16 mL toluen (4.10). Dùng cân phân tích (6.5) để cân chính xác hai thành phần này.
Dung dịch này sẽ được sử dụng để thêm chuẩn cho mẫu thử (xem 7.2).
Bảo quản dung dịch này nơi tối và ở nhiệt độ dưới 10 °C. Dung dịch được bảo quản theo cách này bền trong ít nhất sáu tháng. Nếu chứng minh được độ ổn định dài hơn thì có thể tiếp tục sử dụng dung dịch.
5.7 Các dung dịch chuẩn trung gian
Chuẩn bị các dung dịch chuẩn trung gian bằng cách pha loãng dung dịch gốc PAH hỗn hợp (5.4) trong toluen (4.10).
Các dung dịch này được sử dụng để chuẩn bị dung dịch hiệu chuẩn (xem 5.8).
Nồng độ PAH trong dung dịch này phải xấp xỉ hai lần nồng độ PAH trong dung dịch hiệu chuẩn (xem 5.8), do đó nằm trong khoảng từ 10 ng/g đến 250 ng/g. Lượng dung dịch gốc PAH hỗn hợp (5.4) cần thiết được nêu trong Bảng 5. Dùng pipet chuyển các lượng vào bình định mức thủy tinh màu nâu 100 mL (6.2) và định mức đến vạch bằng toluen (4.10). Nồng độ chuẩn được tính từ khối lượng đã được ghi lại ở mỗi bước chuẩn bị. Sử dụng cân phân tích (6.5) để cân.
Bảng 5 - Thể tích danh nghĩa của dung dịch gốc PAH hỗn hợp (5.4) được lấy bằng pipet để chuẩn bị 100 mL của từng mức nồng độ được liệt kê của các dung dịch chuẩn trung gian
| Dung dịch chuẩn trung gian | Thể tích danh nghĩa của dung dịch gốc hỗn hợp PAH (5.4) ml | Nồng độ danh nghĩa của PAH a trong dung dịch chuẩn trung gian ng/g b |
| IS 1 | 0,5 | 10 |
| IS 2 | 1,0 | 20 |
| IS 3 | 2,5 | 50 |
| IS 4 | 4,0 | 80 |
| IS 5 | 5,5 | 110 |
| IS 6 | 7,0 | 140 |
| IS 7 | 6,5 | 170 |
| IS 8 | 10,0 | 200 |
| IS 9 | 12,5 | 250 |
| a Mức nồng độ liên quan đến từng PAH đích. b Nồng độ đã cho là chỉ thị. Nồng độ thực được xác định từ dữ liệu. | ||
Bảo quản các dung dịch này nơi tối và ở nhiệt độ dưới 10 °C. Dung dịch được bảo quản theo cách này bền trong ít nhất 12 tháng. Nếu chứng minh được độ ổn định dài hơn thì có thể tiếp tục sử dụng dung dịch.
5.8 Các dung dịch hiệu chuẩn
Chuẩn bị các dung dịch hiệu chuẩn từ các dung dịch chuẩn trung gian (5.7), dung dịch kiểm soát quá trình (5.6) và dung dịch chuẩn dùng để bơm mẫu (5.2). Ghi lại khối lượng của các lọ lấy mẫu tự động GC được sử dụng. Dùng pipet lấy trực tiếp vào các lọ lấy mẫu tự động GC (6.21.4), khoảng 500 μL dung dịch chuẩn trung gian (IS 1 đến IS 9) (5.7), khoảng 400 μL dung dịch kiểm soát quá trình (5.6) và khoảng 100 μL dung dịch chuẩn dùng để bơm mẫu (5.2). Dùng cân phân tích (6.5) để cân tất cả các dung dịch. Tính nồng độ từ các giá trị khối lượng đã cân. Các mức nồng độ của các dung dịch hiệu chuẩn được tóm tắt trong Bảng 6.
Bảng 6 - Thành phần chỉ định của dung dịch hiệu chuẩn PAH
| Dung dịch hiệu chuẩn | Nồng độ của PAH a trong dung dịch hiệu chuẩn ng/g b | Tương ứng với nồng độ PAH a trong mẫu μg/kg | PAH có gắn đồng vị bền trong dung dịch hiệu chuẩn ng/g b | Nồng độ của FBkF trong dung dịch hiệu chuẩn ng/g b |
| CS 1 | 5 | 0,5 | 60,0 | 40,0 |
| CS 2 | 10 | 1,0 | 60,0 | 40,0 |
| CS 3 | 25 | 2,5 | 60,0 | 40,0 |
| CS 4 | 40 | 4,0 | 60,0 | 40,0 |
| CS 5 | 55 | 5,5 | 60,0 | 40,0 |
| CS 6 | 70 | 7,0 | 60,0 | 40,0 |
| CS 7 | 85 | 8,5 | 60,0 | 40,0 |
| CS 8 | 100 | 10,0 | 60,0 | 40,0 |
| CS 9 | 125 | 12,5 | 60,0 | 40,0 |
| a Mức nồng độ liên quan đến 4 PAH đích. b Nồng độ cuối cùng phải được điều chỉnh tương ứng với khối lượng và nồng độ PAH chính xác trong dung dịch gốc PAH hỗn hợp (5.4). | ||||
5.9 Dung dịch chuẩn để đánh giá tính chọn lọc sắc ký
Chuẩn bị dung dịch chuẩn trong toluen chứa tất cả PAH được liệt kê trong Bảng 1 (bao gồm triphenylen, benzo[l]fluoranthen và benzo[k]fluoranthen) ở nồng độ từ 10 ng/g đến 100 ng/g. Dung dịch này chỉ được sử dụng cho đặc trưng của tách sắc ký (xem 10.3).
6 Thiết bị, dụng cụ
CẢNH BÁO - Tất cả các dụng cụ thủy tinh phải được làm sạch cẩn thận (trừ dụng cụ thủy tinh dùng một lần). Dụng cụ thủy tinh được rửa kỹ bằng chất tẩy rửa trong phòng thử nghiệm và nước nóng. Tất cả các dụng cụ thủy tinh được sử dụng để chuẩn bị và bảo quản các chất chuẩn (ví dụ: ống đong thủy tinh định lượng (6.1) và bình định mức bằng thủy tinh màu nâu (6.2)) được tráng rửa bằng toluen (4.10) trước khi sử dụng và làm khô trong tủ hút trong điều kiện môi trường. Dụng cụ thủy tinh được sử dụng cho các mục đích khác (ví dụ: chai thu nhận dung môi PLE (6.8.6)) được tráng rửa bằng cyclohexan và aceton (4.8) trước khi sử dụng và làm khô trong tủ hút hoặc trong tủ sấy.
Sử dụng thiết bị và dụng cụ thủy tinh thông thường của phòng thử nghiệm và cụ thể như sau:
6.1 Ống đong bằng thủy tinh, để cân các PAH, dung tích khoảng 1 mL, tốt nhất là được làm từ thủy tinh màu nâu.
Ống kiểu này không được thương mại hóa cho mục đích cụ thể. Tuy nhiên, một số nhà cung cấp ống thủy tinh không có cổ, đáy phẳng với đường kính ngoài 8 mm và chiều dài khoảng 30 mm đến 40 mm, thích hợp cho việc cân một lượng nhỏ chất rắn.
6.2 Bình định mức bằng thủy tinh màu nâu, có các dung tích khác nhau (5 mL đến 100 mL), theo TCVN 7153:2002 (ISO 1042:1999).
6.3 Lọ thủy tinh màu nâu, dung tích 40 mL, có nắp vặn với lớp lót PTFE.
6.4 Cân vi phân tích, có thể cân chính xác đến 0,000 001 g.
6.5 Cân phân tích, có thể cân chính xác đến 0,000 01 g.
6.6 Cân phòng thử nghiệm, có thể cân chính xác đến 0,01 g.
6.7 Cối và chày, dung tích cối tối thiểu 200 mL.
6.8 Thiết bị chiết chất lỏng áp lực (PLE) 1) , gồm:
6.8.1 Cuvet PLE, dung tích 33 mL.
6.8.2 Bộ lọc cellulose, đường kính 30 mm.
6.8.3 Bộ lấy mẫu tự động.
6.8.4 Bộ khử khí.
6.8.5 Buồng chiết.
6.8.6 Chai thu nhận dung môi, tương thích với thiết bị PLE, có khả năng thu nhận được khoảng 50 mL dịch chiết, có bảo vệ tránh ánh sáng.
6.8.7 Bộ kiểm soát áp suất, để cung cấp và giải phóng khí nén (4.3) trong cuvet chiết.
6.8.8 Dụng cụ kiểm soát nhiệt độ.
6.8.9 Hệ thống xử lý dữ liệu và kiểm soát thiết bị.
6.9 Thiết bị Soxhlet (thay cho thiết bị PLE)
Thiết bị bao gồm ống gia nhiệt, bình cầu đáy tròn 250 mL, bộ chiết Soxhlet dung tích 85 mL, ống dẫn cellulose thích hợp, bình ngưng thích hợp và một thiết bị làm lạnh hoặc thiết bị làm mát khác.
6.10 Thiết bị làm bay hơi
Thiết bị này có khả năng làm bay hơi dưới nhiệt độ được kiểm soát và điều kiện chân không, hoặc trạm làm việc thay thế phải được sử dụng để làm bay hơi các chất chiết. Thiết bị làm bay hơi phải được trang bị bình cầu đáy tròn hoặc ống thủy tinh có dung tích thích hợp: khoảng 250 mL để làm bay hơi các dịch chiết PLE (khoảng 100 mL) và 100 mL để làm bay hơi dung dịch rửa giải thu được của SEC (khoảng 50 mL).
6.11 Pipet mao quản Pasteur bằng thủy tinh, dài 230 mm.
6.12 Ống nghiệm thủy tinh, dung tích 10 mL.
6.13 Xyranh thủy tinh, đầu tip luer, dung tích 10 mL.
6.14 Bộ lọc màng polytetrafluoroethylen (PTFE), đường kính 25 mm và cỡ lỗ 5 μm.
6.15 Thiết bị sắc ký rây phân tử (SEC), gồm:
6.15.1 Bơm chất lỏng, cung cấp tốc độ dòng 4,0 mL/min.
6.15.2 Thiết bị làm bay hơi (tùy chọn).
6.15.3 Bộ lấy mẫu tự động, dùng cho lọ dung tích 10 mL (tùy chọn).
6.15.4 Lọ nhỏ màu nâu để lấy mẫu, dung tích khoảng 5 mL.
6.15.5 Hệ thống bơm thủ công hoặc tự động, có khả năng bơm 5 mL.
6.15.6 Cột SEC 2) , với các đặc điểm sau: 50 g polyme styren-divenylbenzen với 3 % liên kết ngang, cỡ hạt 40 μm đến 80 μm, cột thủy tinh 25 mm x 500 mm, được ổn định trước trong hỗn hợp của 1 phần thể tích cyclohexan và 1 phần thể tích ethyl acetat.
Cột SEC phải giữ được các thông số kỹ thuật của nhà cung cấp.
6.15.7 Chai thu nhận dung môi.
6.15.8 Hệ thống kiểm soát thiết bị, ví dụ: sử dụng máy tính.
6.15.9 Lọ lẩy mẫu tự động dùng cho thiết bị SEC.
6.16 Bộ cô mẫu, có khả năng làm bay hơi các thể tích nhỏ dưới dòng nitơ (4.3) ở nhiệt độ được kiểm soát.
6.17 Ống chiết pha rắn.
6.18 Xyranh dùng một lần (tùy chọn), được sử dụng làm bể chứa dung môi trong khi làm sạch bằng SEC, dung tích 20 mL, có khóa luer và các phần đính kèm để lắp vào cột SPE (4.13).
6.19 Bơm tay hoặc dụng cụ tương tự, để tăng lưu lượng qua cột SPE bằng áp suất nhỏ.
6.20 Xyranh microlit hoặc pipet microlit đã hiệu chuẩn, dung tích từ 25 μL đến 500 μL.
6.21 Thiết bị sắc ký khí-khối phổ (GC-MS), bao gồm:
6.21.1 Hệ thống bơm, bộ bơm hóa hơi cài đặt chương trình nhiệt độ (PTV), thích hợp cho nhiệt độ lên đến 400 °C.
Cách khác, có thể sử dụng bơm chia dòng/không chia dòng, thích hợp cho nhiệt độ lên đến 350 °C.
CHÚ THÍCH Việc bơm PTV cho phép bơm các thể tích chiết lớn hơn so với bơm chia dòng/không chia dòng. Việc bơm này này cung cấp cường độ tín hiệu lớn hơn và có thể thuận lợi hơn đối với LOD. Tuy nhiên, bơm chia dòng/không chia dòng đã được chứng minh trong nghiên cứu xác nhận giá trị sử dụng của phương pháp bằng thử nghiệm cộng tác phù hợp với phạm vi của tiêu chuẩn này.
6.21.2 Lò GC, thích hợp cho nhiệt độ lên đến 325 °C và có khả năng lập trình nhiệt độ.
6.21.3 Bộ lấy mẫu tự động.
6.21.4 Lọ thủy tinh lấy mẫu màu nâu dùng cho bộ lấy mẫu tự động (6.21.3), có dung tích khoảng 2mL.
6.21.5 Cột mao quản GC, cột mao quản chọn lọc PAH 3) dài 15 m, đường kính trong 0,15 mm, df = 0,10 μm (β = 375) hoặc cột bất kỳ có đặc tính tách tương tự.
Cột này được sử dụng với các điều kiện bơm và điều kiện lò như trong 8.1, phải đảm bảo ít nhất các độ phân giải sau:
BbF/BkF R s ≥ 0,8
BkF/BjF R s ≥ 0,4
CHR/TRP R s ≥ 0,6
6.21.6 Giao diện với thiết bị đo khối phổ, có bộ phận kiểm soát nhiệt độ, thích hợp cho nhiệt độ lên đến 350 °C (xem 8.1.6).
6.21.7 Thiết bị đo khối phổ, có các đặc tính sau:
- nguồn ion hóa điện tử;
- năng lượng ion hóa 70 eV;
- độ phân giải khối lượng: ít nhất 1 u;
- bộ phận kiểm soát nhiệt độ cho nguồn ion (300 °C) và giao diện GC-MS (325 °C). Tùy chọn bộ phận kiểm soát nhiệt độ cho đầu dò khối phổ tứ cực (150 °C);
- điều chỉnh độ ổn định ít nhất 48 h (cho phép phần tích chuỗi các mẫu hoặc các chất chuẩn);
- dải tuyến tính tín hiệu của ít nhất hai bậc độ lớn.
6.21.8 Hệ thống kiểm soát thiết bị theo máy tính, có khả năng lập trình dạng sắc ký khí và khối phổ theo thời gian chạy.
6.21.9 Hệ thống xử lý dữ liệu, theo máy tính.
7 Cách tiến hành
7.1 Xử lý mẫu
Cần lưu ý phòng thử nghiệm nhận được là mẫu đại diện, từ đó lấy mẫu thử đồng nhất mà không gây ô nhiễm thứ cấp.
7.2 Chuẩn bị phần mẫu thử
Cân 5,0 g ± 0,1 g mẫu thử đã đồng nhất trên đĩa cân bằng nhôm hoặc dụng cụ tương đương, chú ý tránh dùng các vật liệu bằng chất dẻo hoặc PTFE để giảm nguy cơ ô nhiễm mẫu thử.
Chuyển phần mẫu thử vào cối (6.7) và thêm 5,0 g ± 0,2 g acid polyacrylic (4,5), 15,0 g ± 0,2 g cát (4.6). Trộn kỹ cho đến khi mẫu đồng nhất. Cân cát và acid polyacrylic bằng cân phòng thử nghiệm (6.6).
Thêm 200 μL dung dịch kiểm soát quá trình (5.6) bằng xyranh microlit, hoặc pipet microlit đã hiệu chuẩn (6.20), trộn đều và chuyển hỗn hợp mẫu vào cuvet chiết PLE. Nồng độ danh nghĩa của các chất có gắn đồng vị bền trong mỗi mẫu thử ở khoảng 5,2 μg/kg.
Khối lượng mẫu có thể thấp hơn nếu hàm lượng chất phân tích nằm ngoài dải làm việc của phương pháp này.
7.3 Chiết mẫu bằng PLE và chuẩn bị cho chạy SEC
Đặt bộ lọc cellulose (6.8.2) vào trong cuvet chiết. Sau đó chuyển hỗn hợp mẫu đã thêm chuẩn với các PAH có gắn đồng vị bền (5.6) vào cuvet chiết của thiết bị PLE (6.8.1). Thêm khoảng 5 g Na 2 SO 4 khan (4.4) vào từng chai thu nhận trước khi bắt đầu chiết để liên kết với nước có khả năng được chiết bằng PLE, thể tích nhỏ trống còn lại trong cuvet chiết có thể được đổ đầy bằng cát (4.6).
Tiến hành quá trình chiết trong các điều kiện sau:
| Áp suất: | 10 342 kPa (1 500 psi) |
| Nhiệt độ: | 100 °C |
| Thời gian làm nóng sơ bộ: | 0 min |
| Thời gian gia nhiệt: | 5 min |
| Thời gian tĩnh: | 10 min |
| Thể tích thổi: | 60 % |
| Thời gian làm sạch: | 180 s |
| Chu kỳ tĩnh: | 2 |
| Dung môi: | n-hexan 100 % (4.7) (có thể dùng cyclohexan 100 % (4.9)). |
Sau khi chiết, dịch chiết được gạn vào bình làm bay hơi và rửa hai lần lượng Na 2 SO 4 còn lại, mỗi lần bằng 10 mL n-hexan (có thể dùng cyclohexan), dùng pipet Pasteur để chuyển vào bình làm bay hơi và được gộp với dịch chiết. Sử dụng pipet Pasteur (6.11) để trộn dung môi rửa với Na 2 SO 4 (và để rửa thành chai thu nhận trong trường hợp có các giọt chất béo) và chuyển dung môi rửa vào bình làm bay hơi. Tránh chuyển Na 2 SO 4 vào bình. Dịch chiết đã chuẩn bị được cô đến thể tích nhỏ (khoảng 0,5 mL) trong thiết bị làm bay hơi (6.10).
Dịch chiết đã cô được chuyển vào ống nghiệm (6,12), rửa bình làm bay hơi với tổng cộng khoảng 4 mL dung dịch rửa giải SEC (4.12), nước rửa được gộp vào dịch chiết mẫu trong cùng ống nghiệm. Thể tích cuối cùng được điều chỉnh bằng dung môi rửa giải SEC đến khoảng 5 mL.
7.4 Chiết Soxhlet thay thế cho PLE
Chuyển hỗn hợp mẫu đã chuẩn bị trong 7.2 vào ống chiết của thiết bị Soxhlet (6.9). Đặt bông thủy tinh lên trên mẫu để tránh mẫu bị thất thoát trong quá trình ngưng tụ lại và hồi lưu dung môi chiết. Đặt ống vào buồng chiết Soxhlet. Thêm 200 mL n-hexan (4.7) vào bình cầu đáy tròn 250 mL (6.9). Cài đặt các điều kiện chiết sao cho có được khoảng 6 chu kỳ chiết mỗi giờ. Thời gian chiết phải ít nhất 7 h.
Khi kết thúc quá trình chiết, thêm khoảng 5 g Na 2 SO 4 khan (4.4) vào dịch chiết trong bình cầu đáy tròn và trộn với dịch chiết để liên kết với nước có khả năng chiết được. Đổ dịch chiết vào bình làm bay hơi của thiết bị làm bay hơi (6.10). Rửa hai lần lượng Na 2 SO 4 còn lại trong chai thu nhận, mỗi lần tăng 10 mL n-hexan (có thể dùng cyclohexan), dùng pipet Pasteur để chuyển vào bình làm bay hơi và được gộp với dịch chiết. Sử dụng pipet Pasteur (6.11) để trộn dung môi rửa với Na 2 SO 4 (và để rửa thành chai thu nhận trong trường hợp có các giọt chất béo) và chuyển dung môi rửa vào bình làm bay hơi. Tránh chuyển Na 2 SO 4 vào bình.
Làm bay hơi dung môi trong thiết bị làm bay hơi (6.10) đến còn ít hơn 2 mL. Không để bay hơi đến khô, vì có thể dẫn đến hao hụt chất phân tích. Chuyển dịch chiết đã cô vào ống nghiệm (6,12). Rửa bình làm bay hơi bằng khoảng 3 mL dung dịch rửa giải SEC (4.12), gộp nước rửa với dịch chiết mẫu vào cùng ống nghiệm. Chỉnh thể tích cuối cùng bằng dung môi rửa giải SEC đến khoảng 5 mL.
7.5 Làm sạch bằng SEC
Lọc 5 mL mẫu thử, đã được chuẩn bị theo 7.2 và 7.3 hoặc 7.4, qua bộ lọc PTFE (6.14) bằng xyranh thủy tinh (6.13) vào lọ lấy mẫu tự động SEC (6.15.9).
SEC thực hiện trong các điều kiện sau:
Tốc độ dòng: 4 mL/min;
Dung môi rửa giải: cyclohexan: ethyl acetat 1:1 (4.12).
Thời gian rửa giải của phần PAH thu được phải được điều chỉnh theo các đặc tính rửa giải của cột SEC được sử dụng. Điều này đòi hỏi phải xác định profile rửa giải của PAH, bằng cách thu thập các phần của dung dịch rửa giải theo khoảng thời gian đều đặn và xác định hàm lượng PAH của từng phần.
7.6 Bước cô đặc sau khi làm sạch bằng SEC
Làm bay hơi phần đã thu được ở phần cuối của quá trình làm sạch bằng SEC ở 40 °C đến khi còn khoảng 5 mL.
7.7 Chuẩn bị mẫu để làm sạch bằng SEC
Chuyển dịch chiết SEC cô đặc vào ống nghiệm (6.12) và thêm 200 μL toluen (4.10), đóng vai trò chất lưu giữ trong các bước làm bay hơi sau đây. Làm bay hơi dịch chiết đến khoảng 200 μL trong bộ cô mẫu (6.16) ở 40 °C, sử dụng dòng khí nitơ nhẹ (4.3) (bề mặt chất lỏng không được tách ra thành giọt). Sau đó, cho 800 μL cyclohexan (4.9) vào 200 μL còn lại.
7.8 Làm sạch bằng SEC
Tất cả các bước rửa giải thường được thực hiện bằng trọng lực, không sử dụng bất kỳ dụng cụ chân không hoặc áp suất nào. Chỉ dùng trong trường hợp tốc độ dòng cao chịu được chân không thấp hoặc áp suất quá cao để thuận tiện cho việc rửa giải. Trong trường hợp này, có thể sử dụng dụng cụ tạo áp suất (6.19) hoặc ống SPE (6.17) có gắn hệ thống chân không.
Đặt các cột SPE lên ống SPE (6.17) hoặc giá đỡ thích hợp khác, ổn định cột SPE (4.13) bằng 2 mL cyclohexan (4.9) và loại bỏ chất rửa giải.
Nạp khoảng 1 000 μL dịch chiết mẫu, thu được như trong 7.7, lên cột SPE và để thấm vào chất hấp phụ. Loại bỏ dịch rửa giải.
Rửa giải các PAH bằng 10 mL cyclohexan (4.9). Sử dụng 2 mL đầu tiên để rửa ống nghiệm. Sau đó nạp lên cột SPE. Tiếp theo 8 mL được nạp thành các phần, mỗi lần 2 mL hoặc, nếu sử dụng xyranh (6.18), trong một bước nạp lên cột SPE. Để dung môi rửa giải bằng trọng lực (khoảng 1 mL/min) và thu hết dịch rửa giải trong ống nghiệm (6.12) cho đến khi dòng chảy dừng lại.
7.9 Chuẩn bị mẫu để phân tích GC-MS
Làm bay hơi phần SPE thu được ở 40 °C bằng bộ cô mẫu (6.16) đến khoảng 200 μL, và chuyển vào lọ lấy mẫu tự động 2 mL (6.21.4) dùng xyranh microlit (6.20) hoặc dụng cụ thích hợp khác. Rửa ống nghiệm hai lần, mỗi lần với 100 μL, sử dụng cùng xyranh microlit và cho cả hai phần vào mẫu đựng trong lọ 2 mL (6.21.4). Cuối cùng, dùng xyranh microlit (6.20) sạch hoặc thiết bị phù hợp khác để lấy 100 μL dung dịch chuẩn dùng để bơm mẫu (5.2) cho vào mẫu trong lọ lấy mẫu tự động.
Dịch chiết cuối cùng trong toluen này thường chứa lượng chất béo còn sót lại từ nền mẫu thực phẩm rất thấp (dưới 0,01 %).
8 Phân tích GC-MS
8.1 Điều kiện vận hành GC-MS
8.1.1 Yêu cầu chung
Việc tách thỏa đáng bốn PAH có gắn đồng vị ra khỏi các PAH không phải đích đạt được bằng cột sắc ký khí (6.21.5) và các điều kiện cần cài đặt sau đây. Tuy nhiên, thông số đã cho có thể không áp dụng được với tất cả các loại thiết bị. Có thể cần phải sửa đổi và tối ưu hóa để đạt được sự tách thỏa đáng.
CHÚ THÍCH 1 Thông tin về việc cài đặt thông số thiết bị do người tham gia sử dụng trong nghiên cứu xác nhận giá trị giá trị sử dụng phương pháp bằng thử nghiệm cộng tác có thể tham khảo EUR 25016 EN, xem Tài liệu tham khảo [9].
CHÚ THÍCH 2 Việc cải tiến chương trình lò cho phép tách tất cả 16 PAH ưu tiên của EU theo quy định của Ủy ban châu Âu (EC) số 1881/2006, xem Tài liệu tham khảo [6], Chúng rửa giải trong khoảng từ 10 min đến 45 min.
8.1.2 Điều kiện bơm đối với bộ bơm PTV
| - Chế độ bơm: | phun dung môi |
| - Thể tích bơm: | 3 μL |
| - Tốc độ bơm: | 5 μL/s |
| - Độ trễ trước bơm: | 500 ms |
| - Độ trễ sau bơm : | 500 ms |
| - Nhiệt độ ban đầu: | 55 °C |
| - Thời gian ban đầu: | 1,0 min |
| - Bước tăng đầu tiên: | 60 °C/min đến 400 °C, thời gian giữ 15 min |
| - Bước tăng thứ hai: | 15 °C/min tối đa 70 °C, thời gian giữ 0 min |
| - Thời gian phun: | 0,50 min |
| - Tốc độ dòng: | 100 mL/min |
| - Áp suất phun: | 50 kPa |
| - Tố độ thổi sạch: | 30 mL/min |
| - Thời gian thổi sạch: | 3 min |
| - Loại khí: | Heli (4.2) |
8.1.3 Điều kiện bom, đối với bộ bơm phân dòng-không phân dòng
| - Chế độ bơm: | không phân dòng |
| - Thể tích bơm: | 1 μL |
| - Nhiệt độ: | 300 °C |
| - Tốc độ thổi sạch: | 30 mL/min |
| - Thời gian thổi sạch: | 2 min |
| - Tổng lưu lượng: | 34,1 mL/min |
| - Loại khí: | Heli (4.2) |
8.1.4 Điều kiện của lò
| - Nhiệt độ ban đầu: | 70 °C |
| - Thời gian ban đầu: | 1 min |
| - Bước tăng đầu tiên: | 60 °C/min đến 180 °C, thời gian tĩnh 0 min |
| - Bước tăng thứ hai: | 4 °C/min đến 230 °C, thời gian tĩnh 10 min |
| - Bước tăng thứ ba: | 28 °C/min đến 280 °C, thời gian tĩnh 5 min [10 min] |
| - Bước tăng thứ tư: | 60 °C/min đến 340 °C, thời gian tĩnh 5 min [14 °C/min đến 340 °C, thời gian tĩnh 5 min] |
8.1.5 Điều kiện cột
| - Tốc độ dòng khí mang: | 1 mL/min, tốc độ dòng không đổi |
| - Loại khí: | Heli (4.2) |
8.1.6 Điều kiện của ống dẫn mẫu
| - Nhiệt độ: | 325 °C |
8.1.7 Điều kiện khối phổ
| - Nhiệt độ nguồn MS: | 300 °C |
| - Nhiệt độ tứ cực MS: | 150 °C |
| - Thời gian ngừng thu tín hiệu: | 7 min |
| - Năng lượng ion hóa điện tử: | 70 eV |
8.1.8 Thông số thiết bị đo khối phổ và nhận dạng pic
Việc thu nhận tín hiệu m/z được thực hiện trong chế độ SIM theo Bảng 7. Để định lượng tất cả các PAH, sử dụng các diện tích pic của ion định lượng. Tuy nhiên, pic chỉ được xem xét khi ion định lượng có mặt và tỷ số giữa các diện tích pic của các ion định lượng và các ion định tính nằm trong dải chấp nhận được (xem Bảng 8). Các ion định lượng và ion định tính được chọn và tỷ số của chúng ở nồng độ tương ứng với CS 5 (xem Bảng 6) được liệt kê trong Bảng 8.
Sắc ký đồ GC-MS điển hình của 4 PAH đích khi có mặt 12 PAH khác ở nồng độ 100 ng/mL được nêu trong Hình A.1, Phụ lục A.
Bảng 7 - Chương trình ghi nhận trong SIM
| Số nhóm | Thời gian đầu min | Thời gian dừng ms | Các ion m/z |
| Nhóm 1 | 15 | 40 | 114, 116 a |
| 15 | 80 | 228, 234 a | |
| Nhóm 2 | 24 | 40 | 126, 128 a , 129 a , 135 |
| 24 | 80 | 252, 256, 258 a , 270 | |
| a Tỷ số m/z có hiệu lực đối với các PAH có gắn đồng vị bền 13 C. Chúng cần được điều chỉnh nếu PAH có gắn đồng vị bền khác với PAH có gắn đồng vị bền được sử dụng nêu trong Bảng 3. | |||
Bảng 8 - Thời gian lưu chỉ thị và các ion để nhận dạng và định lượng 4 PAH đích trong SIM
| Tên chất a | Thời gian lưu chỉ thị min | Ion định lượng Q1 m/z | Ion định lượng Q2 m/z | Tỷ số diện tích pic Q1/Q2 | Tỷ số diện tích pic - giới hạn dưới | Tỷ số diện tích pic - giới hạn trên |
| Benz[a]anthracen (BaA) | 19,01 | 228 | 114 | 12 | 6 | 18 |
| Benzo[a]pyren (BaP) | 29,35 | 252 | 126 | 20 | 10 | 29 |
| Benzojbjfluoranthen (BbF) | 26,65 | 252 | 126 | 13 | 6 | 20 |
| Chrysen (CHR) | 19,55 | 228 | 114 | 12 | 6 | 18 |
| 9-fluorobenzo[k]fluoranthen | 25,76 | 270 | 135 | 15 | 7 | 22 |
| Benz[a]anthracen 13 C 6 | 19,01 | 234 | 116 | 10 | 5 | 15 |
| Benzo[a]pyren 13 C 4 | 29,35 | 256 | 128 | 13 | 10 | 16 |
| Benzo[b]fluoranthen 13 C 6 | 26,66 | 258 | 129 | 12 | 10 | 14 |
| Chrysen 13 C 6 | 19,55 | 234 | 116 | 11 | 9 | 13 |
| a Đối với PAH tự nhiên, từ viết tắt được nêu trong dấu ngoặc đơn. b Theo Quyết định của Ủy ban châu Âu (EC) 2002/657 (xem Tài liệu tham khảo [7]), dung sai ± 10 % đến ± 50 % trong giá trị của tỷ số được chấp nhận, tùy thuộc vào lượng ion dự đoán liên quan đến ion đích (đối với ion định lượng phương pháp này và ion định tính tương ứng). Chất rửa giải khỏi cột sắc ki được xác định là một trong các chất phân tích đích chỉ khi: - Nếu thời gian lưu tương đối của chất chưa biết và chất nội chuẩn có gắn đồng vị tương ứng nằm trong khoảng ±0,5 % thời gian lưu tương đối của chất phân tích và chất nội chuẩn có gắn đồng vị trong dung dịch hiệu chuẩn: - Nếu phát hiện cả Q 1 và Q 2 ; - Nếu tỷ số diện tích pic Q 1 và diện tích pic Q 2 nằm trong giới hạn dưới và trên được liệt kê trong Bảng 8. Các giới hạn này được tính toán theo các tiêu chí của EU. | ||||||
8.2 Dựng đường chuẩn
Bơm các dung dịch hiệu chuẩn được liệt kê trong Bảng 6 khi bắt đầu mỗi dãy phân tích. Tất cả các dung dịch phải được đưa về nhiệt độ phòng trước khi bơm. Việc bơm dung dịch hiệu chuẩn phải được thực hiện từ nồng độ thấp đến nồng độ cao để giảm nguy cơ nhiễm chéo.
Đường chuẩn thu được bằng cách vẽ tỷ lệ diện tích pic của PAH đích và đồng vị bền tương ứng có gắn tương tự với nồng độ PAH đích trong dung dịch hiệu chuẩn. Hàm hiệu chuẩn được xác định đối với mỗi chất phân tích bằng phép hồi quy tuyến tính và có thể được mô tả theo Công thức (2).
|
| (2) |
Trong đó:
| A PAH-C | là diện tích pic của ion định lượng đối với hợp chất tự nhiên trong dung dịch hiệu chuẩn; |
| A LPAH-C | diện tích pic của ion định lượng đối với PAH có gắn đồng vị bền trong dung dịch hiệu chuẩn; |
| a | là độ dốc của đường chuẩn; |
| b | là giao điểm của đường chuẩn với trục tung; |
| [PAH] C | là nồng độ của hợp chất tự nhiên trong dung dịch hiệu chuẩn, tính bằng nanogam trên gam (ng/g); |
| [LPAH] C | là nồng độ của PAH có gắn đồng vị bền trong dung dịch hiệu chuẩn, tính bằng nanogam trên gam (ng/g). |
Đường chuẩn không mặc định đi qua gốc tọa độ.
8.3 Phân tích mẫu
Mỗi dãy bao gồm các dung dịch hiệu chuẩn, dịch chiết mẫu trắng kiểm soát quá trình và dịch chiết mẫu kiểm soát chất lượng thích hợp (QC) (10.4).
CHÚ THÍCH: Mẫu trắng kiểm soát quá trình là mẫu trắng được tạo thành từ tất cả các thuốc thử được dự kiến để chuẩn bị phần mẫu thử và được xử lý ở tất cả các khía cạnh như mẫu thử. Loại mẫu trắng này kiểm tra độ tinh khiết của thuốc thử cũng như xác định các nguồn ô nhiễm khác, như dụng cụ thủy tinh và thiết bị phân tích (đối với tiêu chuẩn này, mẫu trắng kiểm soát quá trình bao gồm 5 g acid polyacrylic (5.5), 15 g cát (4.6) và 200 μL dung dịch kiểm soát quá trình (5.6)).
Trước khi bắt đầu phân tích, cần đánh giá tính phù hợp của hệ thống dựa trên ít nhất một mẫu trắng dung môi và dung dịch hiệu chuẩn CS 5. Bơm dung dịch hiệu chuẩn theo thứ tự tăng dần nồng độ (CS 1 đến CS 9). Trong trình tự này, có thể bổ sung các mẫu trắng dung môi nếu người phân tích thấy cần.
Sau khi bơm các dung dịch hiệu chuẩn, bơm dịch chiết mẫu, mẫu trắng kiểm soát quá trình và mẫu QC (10.4) theo thứ tự ngẫu nhiên. Bơm dung dịch hiệu chuẩn CS 1 và CS 5 vào cuối cùng, hoặc sau ít nhất 10 lần bơm mẫu.
Một chuỗi phân tích điển hình có thể là:
a) Kiểm tra xác nhận hiệu năng của thiết bị:
1) mẫu trắng dung môi (toluen):
2) CS 5;
b) Dung dịch hiệu chuẩn:
1) Mẫu trắng dung môi (toluen, tùy chọn):
2) CS 1 đến CS 9 theo thứ nồng độ tự tăng dần;
3) Mẫu trắng dung môi (toluen, tùy chọn);
c) Phân tích mẫu;
1) Mẫu trắng dung môi (toluen, tùy chọn);
2) Dịch chiết mẫu, mẫu trắng kiểm soát quá trình, mẫu kiểm soát chất lượng (QC) (theo thứ tự ngẫu nhiên, tối đa 10 lần bơm);
3) CS 1;
4) CS 5;
5) Lặp lại các bước c) 2) đến c) 4) nếu cần;
6) Mẫu trắng dung môi (toluen, tùy chọn).
9 Tính và báo cáo kết quả
9.1 Tính kết quả
Để tính hàm lượng PAH của mẫu, sử dụng Công thức (3), trong đó “a” (độ dốc của đường chuẩn) và “b” (giao điểm của đường chuẩn) thu được từ hiệu chuẩn thiết bị như quy định trong 8.2.
|
| (3) |
Trong đó:
| [PAH] MẪU | là nồng độ của hợp chất tự nhiên trong mẫu, tính bằng microgam trên kilôgam (μg/kg); |
| A PAH-S | là diện tích pic của ion định lượng đối với hợp chất tự nhiên trong mẫu; |
| A LPAH-S | là diện tích pic của ion định lượng đối với chất chuẩn có gắn đồng vị bền trong mẫu; |
| a | là độ dốc của đường chuẩn; |
| b | là giao điểm của đường chuẩn; |
| [LPAH] | là nồng độ của PAH có gắn đồng vị bền trong dung dịch kiểm soát quá trình (5.6), tính bằng nanogam trên gam (ng/g); |
| 0,8669 | là tỷ trọng của toluen ở 20 °C, tính bằng gam trên mililit (g/mL); |
| V LPAH-S | là thể tích của dung dịch kiểm soát quá trình (5.6) được thêm vào mẫu, tính bằng mililit (mL); |
| W MẪU | khối lượng của phần mẫu thử (7.2), tính bằng gam (g). |
9.2 Báo cáo kết quả
Không báo cáo kết quả phân tích nếu tiêu chí kiểm soát chất lượng không được đáp ứng (xem Điều 10). Báo cáo kết quả phân tích chính xác đến 0,10 μg/kg. Báo cáo tất cả các kết quả cùng với độ không đảm bảo đo mở rộng tương ứng để áp dụng hệ số phù (coverage factor) bằng 2. Trong trường hợp hàm lượng chất phân tích dưới giới hạn phát hiện (LOD) hoặc giới hạn định lượng (LOQ) thì báo cáo kết quả là dưới LOD hoặc dưới LOQ tương ứng và đưa ra nồng độ tương ứng với LOD/LOQ của phương pháp.
Nếu hàm lượng chất phân tích tính được vượt quá giới hạn trên của dải làm việc, thì phân tích lại mẫu với khối lượng mẫu được điều chỉnh thấp hơn.
10 Kiểm soát chất lượng
10.1 Yêu cầu chung
Nếu các tiêu chí kiểm soát chất lượng quy định trong 10.2, 10.3 và 10.4 được đáp ứng, thì chấp nhận và báo cáo kết quả phân tích cho các hợp chất tự nhiên. Trong trường hợp một hoặc hơn một tiêu chí không được đáp ứng, thì xem xét quá trình phân tích để xác định nguồn và lặp lại việc phân tích mẫu có liên quan.
10.2 Độ thu hồi
Cần nhấn mạnh rằng độ thu hồi chỉ được kiểm tra để đánh giá sự phù hợp với quy định. Giá trị độ thu hồi không được sử dụng để hiệu chỉnh kết quả. Độ thu hồi hàm lượng PAH trong mẫu thử được xác định dựa trên các PAH có gắn đồng vị bền, có đặc điểm được coi là giống với các PAH tự nhiên.
Độ thu hồi được ước tính từ tỷ lệ của các hệ số tín hiệu tương đối (RRF) của các PAH có gắn đồng vị bền và chất chuẩn bơm (FBkF), được xác định đối với mẫu thử và dung dịch hiệu chuẩn. RRF đối chứng thu được từ các dung dịch hiệu chuẩn CS 1 và CS 5 và được tính bằng Công thức (4) đối với mỗi 4 PAH đích.
|
| (4) |
Trong đó:
| RRF m | là RRF trung bình của các PAH có gắn đồng vị bền trong dung dịch hiệu chuẩn; |
| A LPAH, i | là diện tích pic của ion định lượng của PAH có gắn đồng vị bền trong dung dịch hiệu chuẩn thứ i; |
| [IS] i | nồng độ của dung dịch chuẩn dùng để bơm mẫu (FBkF) (4.17) trong dung dịch hiệu chuẩn thứ i, tính bằng nanogam trên gam (ng/g); |
| A IS,i | là diện tích pic của ion định lượng của chất chuẩn bơm trong dung dịch hiệu chuẩn thứ i; |
| [LPAH] i | là nồng độ của PAH có gắn đồng vị bền trong dung dịch hiệu chuẩn /, tính bằng nanogam trên gam (ng/g). |
Độ thu hồi của PAH có gắn đồng vị bền, được tính bằng tỷ lệ phần trăm giữa lượng PAH có gắn đồng vị bền được tìm thấy trong mẫu và lượng thêm chuẩn vào mẫu khi bắt đầu chuẩn bị mẫu, thu được bằng Công thức (5).
|
| (5) |
Trong đó:
| %REC L | là phần trăm độ thu hồi của PAH có gắn đồng vị bền trong mẫu; |
| A LPAH-S | là diện tích pic của ion định lượng của PAH có gắn đồng vị bền trong dịch chiết mẫu GC-MS; |
| [IS] | là nồng độ của chất chuẩn (FBkF) (4.17) trong dung dịch chuẩn dùng để bơm mẫu (xem 5.2), tính bằng nanogam trên gam (ng/g); |
| VIS-S | là thể tích dung dịch chuẩn bơm được thêm vào mẫu (xem 7.9), tính bằng mililit (mL); |
| RFF m | là giá trị trung bình của RRF đo được đối với PAFI có gắn đồng vị bền trong dung dịch hiệu chuẩn (từ Công thức (4)); |
| A IS-S | là diện tích pic của ion định lượng của dung dịch chuẩn bơm vào dịch chiết mẫu GC-MS; |
| [LPAH] | là nồng độ của PAFI có gắn đồng vị bền trong dung dịch kiểm soát quá trình (5.6), tính bằng nanogam trên gam (ng/g); |
| V LPAH-S | là thể tích của dung dịch quy trình được thêm vào mẫu trước khi chiết, tính bằng mililit (mL). |
Giá trị độ thu hồi từ 50 % đến 120 % được coi là có thể chấp nhận được (Quy định của Ủy ban châu Âu (EU) số 836/2011, xem Tài liệu tham khảo [1]).
10.3 Độ phân giải sắc ký
Đặc biệt chú ý đến độ phân giải giữa các PAFI khác nhau và độ ổn định của thời gian lưu. Độ phân giải giữa benzo[b]fluoranthen và benzo[k]fluoranthen cũng như độ phân giải giữa benzo[k]fluoranthen và benzo[/]fluoranthen phải được theo dõi. Độ phân giải được kiểm tra bằng dung dịch chuẩn quy định trong 5.9 đối với các cặp pic benzo[b]fluoranthen (BbF)/benzo[k]fluoranthen (BkF), cặp pic benzo[k]fluoranthen (BkF)/benzo[j]fluoranthen (BjF) và cặp pic chrysen (CHR)/triphenylen (TRP). Ví dụ về sắc ký đồ được nêu trong Phụ lục A.
Giá trị độ phân giải đích là:
- BbF/BkF R s ≥ 0,8;
- BkF/BjF R s ≥ 0,4;
- CHR/TRP R s ≥ 0,6.
Nếu độ phân giải này không đạt được, thì thực hiện phân tích nguyên nhân gốc rễ và khởi động lại chuỗi phân tích sau khi thực hiện hành động khắc phục. Đánh giá độ phân giải sắc ký bất cứ khi nào các thay đổi của hệ thống sắc ký có thể gây ra những thay đổi về giá trị độ phân giải, ví dụ: cắt cột phân tích, cài đặt cột mới, v.v...
10.4 Mẫu chuẩn để kiểm tra hiệu năng của phương pháp
Để kiểm tra hiệu năng của phương pháp theo thời gian, phân tích mẫu chuẩn trong chuỗi phân tích và vẽ kết quả trong biểu đồ kiểm soát chất lượng. Mẫu chuẩn được chứng nhận hoặc mẫu chuẩn kiểm tra thành thạo (PT), hoặc mẫu chuẩn do phòng thí nghiệm tự chuẩn bị có thể được sử dụng cho mục đích này. Hướng dẫn về việc thiết lập và diễn giải biểu đồ kiểm soát chất lượng có thể được lấy từ các tài liệu hướng dẫn có liên quan.
10.5 Mẫu trắng kiểm soát quá trình
Hàm lượng chất phân tích của mẫu trắng kiểm soát quá trình không được vượt quá mức 0,20 μg/kg trên mỗi chất phân tích. Tính hàm lượng chất phân tích của mẫu trắng kiểm soát quá trình với hàm hiệu chuẩn nêu trong 8.2. Trong trường hợp vượt quá mức, phải xác định nguồn ô nhiễm và phải được khắc phục.
10.6 Kiểm tra tính toàn vẹn của các chất chuẩn
Khối lượng của mỗi lần chuẩn bị chất chuẩn (lượng chứa trong lọ bảo quản cộng với nắp) cần được ghi lại trước khi bảo quản. Trước khi sử dụng dung dịch chuẩn, cần xác định khối lượng. So sánh khối lượng thực tế với khối lượng ghi lại sau khi chuẩn bị/sử dụng trước đó, có thể xác định khả năng thất thoát dung môi. Nếu độ lệch giữa khối lượng thực tế và khối lượng trước khi bảo quản lớn hơn 0,5 % khối lượng trước khi bảo quản, thì phải tính nồng độ thực tế từ nồng độ khối lượng.
11 Dữ liệu về độ chụm
11.1 Yêu cầu chung
Các chi tiết của phép thử liên phòng thử nghiệm về độ chụm của phương pháp được tóm tắt trong Phụ lục B. Các giá trị thu được từ phép thử liên phòng thử nghiệm có thể không áp dụng được cho các dải nồng độ chất phân tích và/hoặc nền mẫu khác với các giá trị được nêu trong Phụ lục B.
11.2 Độ lặp lại
Chênh lệch tuyệt đối giữa hai kết quả thử nghiệm đơn lẻ thu được trên vật liệu thử nghiệm giống nhau do cùng một người thực hiện sử dụng cùng một thiết bị trong khoảng thời gian ngắn nhất không được quá 5 % các trường hợp vượt quá giới hạn lặp lại r.
Các giá trị của benz[a]anthracen là:
|
| r = 0,1 μg/kg (bột mì ép đùn) |
|
| r = 0,8 μg/kg (cá xông khói) |
|
| r = 0,3 μg/kg (sữa bột cho trẻ sơ sinh khô A) |
|
| r = 0,6 μg/kg (công thức cho trẻ sơ sinh dạng bột B) |
|
| r = 0,3 μg/kg (xúc xích thịt) |
|
| r = 0,7 μg/kg (vẹm đông khô) |
|
| r = 1,0 μg/kg (dầu ăn A) |
|
| r = 2,6 μg/kg (dầu ăn B) |
|
| r = 0,2 μg/kg (bột mì) |
Các giá trị của benzo[a]pyren là:
|
| r = 0,2 μg/kg (bột mì ép đùn) |
|
| r = 0,7 μg/kg (cá xông khói) |
|
| r = 0,3 μg/kg (công thức cho trẻ sơ sinh dạng bột A) |
|
| r = 0,7 μg/kg (công thức cho trẻ sơ sinh dạng bột B) |
|
| r = 0,2 μg/kg (xúc xích thịt) |
|
| r = 0,2 μg/kg (vẹm đông khô) |
|
| r = 0,7 μg/kg (dầu ăn A) |
|
| r = 0,7 μg/kg (dầu ăn B) |
|
| r = 0,2 μg/kg (bột mì) |
Các giá trị của benzo[b]fluoranthen là:
|
| r = 0,1 μg/kg (bột mì ép đùn) |
|
| r = 0,7 μg/kg (cá xông khói) |
|
| r = 1,0 μg/kg (công thức cho trẻ sơ sinh dạng bột A) |
|
| r = 0,7 μg/kg (công thức cho trẻ sơ sinh dạng bột B) |
|
| r = 0,2 μg/kg (xúc xích thịt) |
|
| r = 1,0 μg/kg (vẹm đông khô) |
|
| r = 0,7 μg/kg (dầu ăn A) |
|
| r = 0,6 μg/kg |
|
| r = 0,8 μg/kg |
Các giá trị của chrysen là:
|
| r = 0,3 μg/kg |
|
| r = 1,3 μg/kg |
|
| r = 0,3 μg/kg |
|
| r =1,2 μg/kg |
|
| r = 1,0 μg/kg |
|
| r = 2,6 μg/kg |
|
| r = 1,0 μg/kg |
|
| r = 3,2 μg/kg |
|
| r = 0,4 μg/kg |
|
| r = 1,2 μg/kg |
|
| r = 0,5 μg/kg |
|
| r = 2,0 μg/kg |
|
| r = 0,6 μg/kg |
11.3 Độ tái lập
Chênh lệch tuyệt đối giữa hai kết quả kiểm tra đơn lẻ thu được trên các vật liệu thử nghiệm giống nhau trong hai phòng thử nghiệm không quá 5 % trường hợp vượt quá giới hạn tái lập R.
Các giá trị của benz[a]anthracen là:
|
| R = 0,3 μg/kg (bột mì ép đùn) |
|
| R = 1,3 μg/kg (cá xông khói) |
|
| R = 0,6 μg/kg (công thức cho trẻ sơ sinh dạng bột A) |
|
| R = 1,2 μg/kg (công thức cho trẻ sơ sinh dạng bột B) |
|
| R = 1,0 μg/kg (xúc xích thịt) |
|
| R = 2,6 μg/kg (vẹm đông khô) |
|
| R = 1,0 μg/kg (dầu ăn A) |
|
| R = 3,2 μg/kg (dầu ăn B) |
|
| R = 0,4 μg/kg (bột mì) |
Các giá trị của benzo[a]pyren là:
|
| R = 0,4 μg/kg (bột mì ép đùn) |
|
| R = 2,4 μg/kg (cá xông khói) |
|
| R = 0,5 μg/kg (công thức cho trẻ sơ sinh dạng bột A) |
|
| R = 1,4 μg/kg (công thức cho trẻ sơ sinh dạng bột B) |
|
| R = 0,7 μg/kg (xúc xích thịt) |
|
| R = 1,3 μg/kg (vẹm đông khô) |
|
| R = 1,3 μg/kg (dầu ăn A) |
|
| R = 2,4 μg/kg (dầu ăn B) |
|
| R = 0,3 μg/kg (bột mì) |
Các giá trị đối với benzo[b]fluoranthen là:
|
| R = 0,5 μg/kg (bột mì ép đùn) |
|
| R = 1,4 μg/kg (cá xông khói) |
|
| R = 1,4 μg/kg (công thức cho trẻ sơ sinh dạng bột A) |
|
| R = 1,4 μg/kg (công thức cho trẻ sơ sinh dạng bột B) |
|
| R = 0,8 μg/kg (xúc xích thịt) |
|
| R = 2,0 μg/kg (vẹm đông khô) |
|
| R = 2,4 μg/kg (dầu ăn A) |
| X = 5,3 μg/kg | R = 1,5 μg/kg (dầu ăn B) |
| X = 1,6 μg/kg | R = 1,1 μg/kg (bột mì) |
Các giá trị đối với chrysen là:
|
| R = 0,4 μg/kg (bột mì ép đùn) |
|
| R = 1,6 μg/kg (cá xông khói) |
|
| R = 0,8 μg/kg (công thức cho trẻ sơ sinh dạng bột) |
|
| R = 0,9 μg/kg (công thức cho trẻ sơ sinh dạng bột) |
|
| R = 1,3 μg/kg (xúc xích thịt) |
|
| R = 4,6 μg/kg (vẹm đông khô) |
|
| R = 1,9 μg/kg (dầu ăn A) |
|
| R = 3,0 μg/kg (dầu ăn B) |
|
| R = 1,3 μg/kg (bột mì) |
12 Báo cáo thử nghiệm
Báo cáo thử nghiệm phải bao gồm các nội dung sau:
a) mọi thông tin cần thiết để xác định mẫu (loại mẫu, nguồn tự nhiên và tên mẫu);
b) viện dẫn tiêu chuẩn này;
c) ngày và quy trình lấy mẫu (nếu biết);
d) ngày nhận mẫu;
e) ngày thử nghiệm;
f) kết quả thử nghiệm và các đơn vị biểu thị kết quả;
g) mọi thao tác không quy định trong tiêu chuẩn này hoặc được coi là tùy chọn, có thể ảnh hưởng đến kết quả.
Phụ lục A
(tham khảo)
Sắc ký đồ điển hình
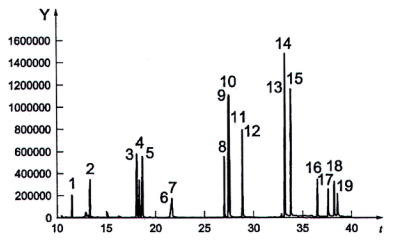
CHÚ DẪN
t thời gian, tính bằng phút (min)
Y abundance
Nhận dạng các pic nêu trong Bảng A.1 (TIC: dòng ion tổng).
Hình A.1 - Sắc ký đồ GC-MS điển hình của PAH 15+1 và PAH có gắn đồng vị bền thu được trong các điều kiện nêu trong Điều 8 và sử dụng bơm PTV
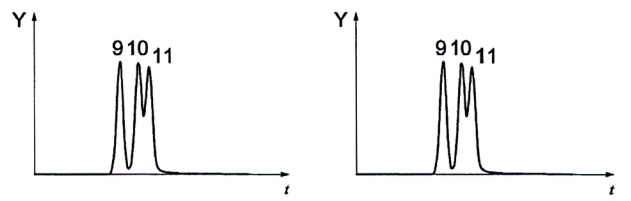
| a) Tách các đồng phân benzofluoranthen (pic sắc ký đồ ion bazơ ở m/z = 252) | b) Tách triphenylen (TRP) khỏi chrysen (5) (pic sắc ký đồ ion bazơ ở m/z = 228) |
CHÚ DẪN
t thời gian, tính bằng min
Y abundance
Hình A.2 - Dịch chiết từ sắc ký đồ của dung dịch chuẩn PAH trong toluen
Bảng A.1 - Nhận biết các pic sắc ký
| Tên chất | Số pic | Tên chất a | Số pic | Tên chất a | Số pic |
| Pyren 13 C 3 | 1 | Benzo[b]fluoranthen (BbF) | 9 | Dibenz[a,h]anthracen 13 C 6 | 14 |
| Benzo[c]fluoren (BcL) | 2 | Benzo[b]fluoranthen 13 C 6 | 9 | Benzo[ghi]perylen (BgP) | 15 |
| Benz[a]anthracen (BaA) | 3 | Benzo[k]fluoranthen (BkF) | 10 | Benzo[ghi]perylen 13 C 1 2 | 15 |
| Benz[a]anthracen 13 C 6 | 3 | Benzo[k]fluoranthen 13 C 6 | 10 | Dibenzo[a,l]pyren (DIP) | 16 |
| Cyclopenta[cd]pyren (CPP) | 4 | Benzo[j]lfluoranthen (BJF) | 11 | Dibenzo[a,e]pyren (DeP) | 17 |
| Chrysen (CHR) | 5 | Benzo[a]pyren (BaP) | 12 | Dibenzo[a,e]pyren 13 C 6 | 17 |
| Chrysen 13 C e | 5 | Benzo[a]pyren 13 C 4 | 12 | Dibenzo[a,i]pyren (DiP) | 18 |
| 5-Methylchrysen methylD3 | 6 | lndeno[1,2,3-cd]pyren (IcP) | 13 | Dibenzo[a,i]pyren 13 C 1 2 | 18 |
| 5-Methylchrysen (5MC) | 7 | lndeno[1,2,3-cd]pyren 13 C 6 | 13 | Dibenzo[a,h]pyren (DhP) | 19 |
| 9-Fluorobenzo[k]fluoranthen | 8 | Dibenz[a,h]anthracen (DhA) | 14 |
|
|
| a Đối với PAH tự nhiên, tên viết tắt trong dấu ngoặc đơn. | |||||
Điều kiện hoạt động cho Hình A.1:
| Cột: | PAH lựa chọn, dài 15m, đường kính trong 0,15 mm, df = 0,10 μm |
| Tốc độ dòng ban đầu: | 1 mL/min |
| Khí mang: | Heli (4.2) |
| Nhiệt độ cột: | Xem chương trình lò (8.1.4) |
| Thể tích bơm: | 3 μL (cho bơm hóa hơi được lập trình nhiệt độ (PTV)) |
| Detector: | các ion m/z nêu trong Bảng 7 ở điều kiện nêu trong 8.1.7 và 8.1.8. |
Phụ lục B
(tham khảo)
Dữ liệu về độ chụm
Dữ liệu được nêu trong Bảng B.1, B.2, B.3 và B.4 thu được từ nghiên cứu liên phòng thử nghiệm (xem Tài liệu tham khảo[9]), được tổ chức bởi Viện Chất chuẩn và Đo lường (IRMM) thuộc Trung tâm nghiên cứu của Ủy ban châu Âu (JRC-IRMM) phù hợp với TCVN 6910-2 (ISO 5725-2) (Tài liệu tham khảo [10]) đối với các quy trình nghiên cứu cộng tác để xác nhận các đặc tính giá trị sử dụng của phương pháp phân tích.
Bảng B.1 - Đánh giá thống kê kết quả nghiên cứu liên phòng đối với benz[a]anthracen trong các loại thực phẩm khác nhau
| Mẫu | Bột mì ép đùn | Cá xông khói | Thức ăn công thức dành cho trẻ sơ sinh dạng bột A | Thức ăn công thức dành cho trẻ sơ sinh dạng bột B | Xúc xích thịt | Thịt vẹm đông khô | Dầu thực vật A | Dầu thực vật B | Bột mì |
| Chuẩn bị vật liệu thử nghiệm | Nhiễm tự nhiên | Thêm chuẩn | Thêm chuẩn | Thêm chuẩn | Thêm chuẩn | Nhiễm tự nhiên | Thêm chuẩn | Thêm chuẩn | Nhiễm tự nhiên |
| Năm thử nghiệm liên phòng | 2010 | 2010 | 2010 | 2010 | 2010 | 2010 | 2010 | 2010 | 2010 |
| Số phòng thử nghiệm | 11 | 11 | 11 | 11 | 11 | 10 | 11 | 11 | 11 |
| Số phòng thử nghiệm không phù hợp | 0 | 0 | 1 | 0 | 2 | 0 | 0 | 0 | 0 |
| Số phòng thử nghiệm còn lại sau khi trừ ngoại lệ | 10 | 11 | 9 | 10 | 9 | 10 | 10 | 11 | 10 |
| Số ngoại lệ (phòng thử nghiệm) | 1 | 0 | 1 | 1 | 0 | 0 | 1 | 0 | 1 |
| Số kết quả được chấp nhận | 10 | 11 | 9 | 10 | 9 | 10 | 10 | 11 | 10 |
| Giá trị trung bình, | 0,6 | 3,5 | 1.3 | 5,0 | 2,8 | 2,7 | 4,1 | 7,9 | 1,0 |
| Độ lệch chuẩn lặp lại s r , μg/kg | 0,04 | 0,3 | 0,1 | 0,2 | 0,1 | 0,2 | 0,3 | 0,9 | 0,1 |
| Độ lệch chuẩn lặp lại tương đối, RSD r , % | 7 | 8 | 9 | 4 | 5 | 9 | 8 | 12 | 8 |
| Giới hạn lặp lại r[r = 2,8 × s r ], μg/kg | 0,1 | 0,8 | 0,3 | 0,6 | 0,3 | 0,7 | 1,0 | 2,6 | 0,2 |
| Độ lệch chuẩn tái lập s R , μg/kg | 0,1 | 0,5 | 0,2 | 0,4 | 0,4 | 0,9 | 0,4 | 1,1 | 0,1 |
| Độ lệch chuẩn tái lập tương đối, RSD R , % | 20 | 13 | 16 | 9 | 13 | 35 | 9 | 14 | 14 |
| Giới hạn tái lập R[R = 2,8 × s R ], μg/kg | 0,3 | 1,3 | 0,6 | 1,2 | 1,0 | 2,6 | 1,0 | 3,2 | 0,4 |
| Độ thu hồi a , % | 66 | 67 | 66 | 65 | 71 | Không tính được | 73 | 74 | 66 |
| Giá tộ HorRat, theo Tài liệu tham khảo [11] | 0,92 | 0,59 | 0,73 | 0,40 | 0,60 | 1,57 | 0,40 | 0,66 | 0,66 |
| a Độ thu hồi dựa theo độ thu hồi của PAH có gắn đồng vị bền. | |||||||||
Bảng B.2 - Đánh giá thống kê kết quả nghiên cứu liên phòng đối với benzo[a]pyren trong các loại thực phẩm khác nhau
| Mẫu | Bột mì ép đùn | Cá xông khói | Thức ăn công thức dành cho trẻ sơ sinh A | Thức ăn công thức dành cho trẻ sơ sinh B | Xúc xích thịt | Thịt vẹm đông khô | Dầu ăn A | Dầu ăn B | Bột mì |
| Chuẩn bị vật liệu thử nghiệm | nhiễm tự nhiên | thêm chuẩn | thêm chuẩn | thêm chuẩn | thêm chuẩn | nhiễm tự nhiên | thêm chuẩn | thêm chuẩn | nhiễm tự nhiên |
| Năm thử nghiệm liên phòng | 2010 | 2010 | 2010 | 2010 | 2010 | 2010 | 2010 | 2010 | 2010 |
| Số phòng thử nghiệm | 11 | 11 | 11 | 11 | 11 | 10 | 11 | 11 | 11 |
| Số phòng thử nghiệm không phù hợp | 0 | 0 | 2 | 0 | 2 | 1 | 0 | 0 | 0 |
| Số phòng thử nghiệm còn lại sau khi trừ ngoại lệ | 9 | 9 | 8 | 10 | 9 | 8 | 10 | 9 | 9 |
| Số ngoại lệ (phòng thử nghiệm) | 2 | 2 | 1 | 1 | 0 | 1 | 1 | 2 | 2 |
| Số kết quả được chấp nhận | 9 | 9 | 8 | 10 | 9 | 8 | 10 | 9 | 9 |
| Giá trị trung bình, | 0,5 | 9,2 | 0,6 | 4,8 | 2,2 | 0,9 | 4,7 | 11,9 | 0,7 |
| Độ lệch chuẩn lặp lại s r , μg/kg | 0,1 | 0,3 | 0,1 | 0,2 | 0,1 | 0,1 | 0,2 | 0,3 | 0,1 |
| Độ lệch chuẩn lặp lại tương đối, RSD r , % | 12 | 3 | 15 | 5 | 4 | 8 | 5 | 2 | 13 |
| Giới hạn lặp lại r[r = 2,8 × s r ], μg/kg | 0,2 | 0,7 | 0,3 | 0,7 | 0,2 | 0,2 | 0,7 | 0,7 | 0,2 |
| Độ lệch chuẩn tái lập s R , μg/kg | 0,1 | 0,9 | 0,2 | 0,5 | 0,3 | 0,5 | 0,5 | 0,8 | 0,1 |
| Độ lệch chuẩn tái lập tương đối, RSD R , % | 24 | 9 | 30 | 11 | 12 | 54 | 10 | 7 | 18 |
| Giới hạn tái lập R[R = 2,8 × s r ], μg/kg | 0,4 | 2,4 | 0,5 | 1,4 | 0,7 | 1,3 | 1,3 | 2,4 | 0,3 |
| Độ thu hồi a , % | 79 | 78 | 72 | 75 | 76 | Không tính được | 80 | 78 | 78 |
| Giá trị HorRat, theo Tài liệu tham khảo [11] | 1,09 | 0,43 | 1,37 | 0,49 | 0,56 | 2,46 | 0,44 | 0,32 | 0,84 |
| a Độ thu hồi dựa theo độ thu hồi của PAH có gắn đồng vị bền. | |||||||||
Bảng B.3 - Đánh giá thống kê kết quả nghiên cứu liên phòng đối với benzo[b]fluoranthen trong các loại thực phẩm khác nhau
| Mẫu | Bột mì ép đùn | Cá xông khói | Thức ăn công thức dành cho trẻ sơ sinh dạng bột A | Thức ăn công thức dành cho trẻ sơ sinh dạng bột B | Xúc xích thịt | Thịt vẹm đông khô | Dầu ăn A | Dầu ăn B | Bột mì |
| Chuẩn bị vật liệu thử nghiệm | Nhiễm tự nhiên | thêm chuẩn | thêm chuẩn | thêm chuẩn | thêm chuẩn | Nhiễm tự nhiên | thêm chuẩn | thêm chuẩn | Nhiễm tự nhiên |
| Năm thử nghiệm liên phòng | 2010 | 2010 | 2010 | 2010 | 2010 | 2010 | 2010 | 2010 | 2010 |
| Số phòng thử nghiệm | 11 | 11 | 11 | 11 | 11 | 10 | 11 | 11 | 11 |
| Số phòng thử nghiệm không phù hợp | 1 | 1 | 2 | 1 | 2 | 1 | 1 | 1 | 1 |
| Số phòng thử nghiệm còn lại sau khi trừ ngoại lệ | 8 | 9 | 9 | 10 | 9 | 8 | 9 | 9 | 10 |
| Số ngoại lệ (phòng thử nghiệm) | 2 | 1 | 0 | 0 | 0 | 1 | 1 | 1 | 0 |
| Số kết quả được chấp nhận | 8 | 9 | 9 | 10 | 9 | 8 | 9 | 9 | 10 |
| Giá trị trung bình, | 0,8 | 4,7 | 2,7 | 4,2 | 2,2 | 4,4 | 10,4 | 5,3 | 1,6 |
| Độ lệch chuẩn lặp lại s r , μg/kg | 0,04 | 0,3 | 0,4 | 0,2 | 0,1 | 0,4 | 0,2 | 0,2 | 0,3 |
| Độ lệch chuẩn lặp lại tương đối, RSD r , % | 5 | 5 | 14 | 6 | 4 | 8 | 2 | 4 | 17 |
| Giới hạn lặp lại r[r = 2,8 × s r ], μg/kg | 0,1 | 0,7 | 1,0 | 0,7 | 0,2 | 1,0 | 0,7 | 0,6 | 0,8 |
| Độ lệch chuẩn tái lập s R , μg/kg | 0,2 | 0,5 | 0,5 | 0,5 | 0,3 | 0,7 | 0,9 | 0,5 | 0,4 |
| Độ lệch chuẩn tái lập tương đối, RSD R , % | 22 | 10 | 18 | 12 | 13 | 16 | 8 | 10 | 25 |
| Giới hạn tái lập R[R = 2,8 × s r ], μg/kg | 0,5 | 1,4 | 1,4 | 1,4 | 0,8 | 2,0 | 2,4 | 1,5 | 1,1 |
| Độ thu hồi a , % | 77 | 71 | 74 | 75 | 72 | Không tính được | 79 | 79 | 74 |
| Giá trị HorRat, theo[11] | 0,99 | 0,47 | 0,81 | 0,53 | 0,60 | 0,75 | 0,38 | 0,45 | 1,15 |
| a Độ thu hồi dựa theo độ thu hồi của PAH có gắn đồng vị bền. | |||||||||
Bảng B.4 -Đánh giá thống kê kết quả nghiên cứu liên phòng đối với chrysen trong các loại thực phẩm khác nhau
| Mẫu | Bột mì ép đùn | Cá xông khói | Thức ăn công thức dành cho trẻ sơ sinh dạng bột A | Thức ăn công thức dành cho trẻ sơ sinh dạng bột B | Xúc xích thịt | Thịt vẹm đông khô | Dầu ăn A | Dầu ăn B | Bột mì |
| Chuẩn bị vật liệu thử nghiệm | Nhiễm tự nhiên | thêm chuẩn | thêm chuẩn | thêm chuẩn | thêm chuẩn | Nhiễm tự nhiên | thêm chuẩn | thêm chuẩn | Nhiễm tự nhiên |
| Năm thử nghiệm liên phòng | 2010 | 2010 | 2010 | 2010 | 2010 | 2010 | 2010 | 2010 | 2010 |
| Số phòng thử nghiệm | 11 | 11 | 11 | 11 | 11 | 10 | 11 | 11 | 11 |
| Số phòng thử nghiệm không phù hợp | 0 | 0 | 1 | 0 | 2 | 0 | 0 | 0 | 0 |
| Số phòng thử nghiệm còn lại sau khi trừ ngoại lệ | 9 | 10 | 10 | 9 | 9 | 10 | 9 | 10 | 10 |
| Số ngoại lệ (phòng thử nghiệm) | 2 | 1 | 0 | 2 | 0 | 0 | 2 | 1 | 0 |
| Số kết quả được chấp nhận | 9 | 10 | 10 | 9 | 9 | 10 | 9 | 10 | 10 |
| Giá trị trung bình, | 0,8 | 5,4 | 0,9 | 3,3 | 3,1 | 4,7 | 6,2 | 7,7 | 1,6 |
| Độ lệch chuẩn lặp lại s r , μg/kg | 0,0 | 0,3 | 0,2 | 0,1 | 0,2 | 0,4 | 0,2 | 0,7 | 0,2 |
| Độ lệch chuẩn lặp lại tương đối, RSD r , % | 5 | 5 | 17 | 4 | 8 | 9 | 3 | 9 | 12 |
| Giới hạn lặp lại r[r = 2,8 × s r ], μg/kg | 0,1 | 0,8 | 0,4 | 0,4 | 0,7 | 1,2 | 0,5 | 2,0 | 0,6 |
| Độ lệch chuẩn tái lập s R , μg/kg | 0,1 | 0,6 | 0,3 | 0,3 | 0,4 | 1,6 | 0,7 | 1,1 | 0,5 |
| Độ lệch chuẩn tái lập tương đối, RSD R , % | 18 | 11 | 32 | 10 | 14 | 35 | 11 | 14 | 29 |
| Giới hạn tải lập R [R = 2,8 × s R ], Mg/kg | 0,4 | 1,6 | 0,8 | 0,9 | 1,3 | 4,6 | 1,9 | 3,0 | 1,3 |
| Độ thu hồi a , % | 65 | 60 | 70 | 62 | 65 | Không tính được | 73 | 72 | 64 |
| Giá trị HorRat, theo[11] | 0,81 | 0,48 | 1,43 | 0,47 | 0,65 | 1,59 | 0,49 | 0,64 | 1,34 |
| a Độ thu hồi dựa theo độ thu hồi của PAH có gắn đồng vị bền. | |||||||||
Phụ lục C
(tham khảo)
Dữ liệu về độ chụm từ đánh giá xác nhận giá trị sử dụng của phòng thử nghiệm đơn lẻ
Thực phẩm bổ sung thảo dược bao gồm một nhóm sản phẩm không được đề cập trong phương pháp đánh giá xác nhận giá trị sử dụng bằng thử nghiệm cộng tác. Tuy nhiên, có thể sử dụng quy trình phân tích này cho nhóm thực phẩm đó. Việc đánh giá xác nhận giá trị sử dụng của phòng thử nghiệm đơn lẻ cho phương pháp phân tích này được thực hiện dựa trên việc xác định 4 PAH có gắn đồng vị trong chất chiết khô của loài Hypericum perforatum chứa khoảng 6 % Hypericum và chất chiết nhân sâm khô (Gingsen panax), chứa khoảng 6 % nhân sâm. Chất chiết này không chứa hàm lượng đáng kể các PAH với và do đó đã thêm chuẩn lên hai mức. Kết quả việc đánh giá xác nhận giá trị sử dụng của phòng thử nghiệm đơn lẻ được nêu trong Bảng C.1 và Bảng C.2.
Bảng C.1 - Các kết quả từ việc đánh giá xác nhận giá trị sử dụng của phòng thử nghiệm đơn lẻ đối với BaA và BaP
|
| Benz[a]anthracen | Benzo[a]pyren | ||||
|
| Gingsen panax | Hypericum perforatum | Gingsen panax | Gingsen panax | Hypericum perforatum | Gingsen panax |
| Giá trị trung bình, | 1,0 | 3,0 | 11,56 | 0,94 | 1,57 | 11,28 |
| Độ lệch chuẩn lặp lại (SD r ), μg/kg | 0,05 | 0,29 | 0,28 | 0,06 | 0,11 | 0,39 |
| Độ lệch chuẩn lặp lại tương đối (RSD r ), % | 4,39 | 8,51 | 2,42 | 6,15 | 5,72 | 3,45 |
| Độ lệch chuẩn của độ chụm trung gian (SD i ), μg/kg | 0,14 | 0,29 | 0,42 | 0,08 | 0,17 | 0,58 |
| Độ lệch chuẩn tương đối của độ chụm trung gian (RSD i ), % | 13,12 | 8,51 | 3,59 | 8,48 | 8,91 | 5,13 |
| Giới hạn tái lập nội bộ (2,8 × SD i ), μg/kg | 0,39 | 0,81 | 1,18 | 0,22 | 0,48 | 1,62 |
| Hàm lượng dự kiến, μg/kg | 0,89 a | 2,98 b | 11,52 a | 0,89 a | 1,65 b | 11,52 a |
| a Thêm chuẩn. b Nhiễm tự nhiên (bằng giá trị được chỉ định tử phép thử thành thạo). | ||||||
Bảng C.2 - Các kết quả từ việc đánh giá xác nhận giá trị sử dụng của phòng thử nghiệm đơn lẻ đối với BbF và CHR
|
| Benzo[b]fluoranthen | Chrysen | ||||
|
| Gingsen panax | Hypericum perforatum | Gingsen panax | Gingsen panax | Hypericum perforatum | Gingsen panax |
| Giá trị trung bình, | 1,16 | 2,92 | 11,92 | 1,09 | 4,24 | 12,11 |
| Độ lệch chuẩn lặp lại (SD r ), μg/kg | 0,08 | 0,2 | 0,22 | 0,08 | 0,33 | 0,42 |
| Độ lệch chuẩn lặp lại tương đối (RSD r ), % | 7,05 | 6,08 | 1,88 | 7,61 | 6,46 | 3,44 |
| Độ lệch chuẩn của độ chụm trung gian (SD i ), μg/kg | 0,25 | 0,24 | 0,6 | 0,08 | 0,36 | 0,63 |
| Độ lệch chuẩn tương đối của độ chụm trung gian (RSD i ), % | 21,36 | 7,36 | 5,02 | 7,61 | 7,1 | 5,21 |
| Giới hạn tái lập nội bộ (2,8 × SD i ), μg/kg | 0,70 | 0,67 | 1,68 | 0,22 | 1,01 | 1,76 |
| Hàm lượng dự kiến, μg/kg | 0,89 a | 2,92 b | 11,52 a | 0,89 a | 4,07 b | 11,52 a |
| a Thêm chuẩn. b Nhiễm tự nhiên (bằng giá trị được ấn định từ phép thử thành thạo). | ||||||
Thư mục tài liệu tham khảo
[1] Commission Regulation (EU) No 836/2011 of 19 August 2011 amending Regulation (EC) No 333/2007 laying down the methods of sampling and analysis for the official control of the levels of lead, cadmium, mercury, inorganic tin, 3-MCPD and benzo(a)pyrene in foodstuffs
[2] TCVN 10482 (ISO 22959), Dầu mỡ động vật và thực vật - Xác định hydrocacbon thơm đa vòng bằng sắc ký phức chất cho - nhận trực tiếp và sắc ký lỏng hiệu năng cao (HPLC) có detector huỳnh quang
[3] TCVN 9531 (ISO 15753), Dầu mỡ động vật và thực vật - Xác định các hydrocacbon thơm đa vòng
[4] CRC Handbook of Chemistry and PhysiCS 93rd Edition, edited by William M Haynes, CRC Press, Taylor and Francis Group
[5] CITAC/Eurachem Guide (2002) Guide to Quality in Analytical Chemistry, An Aid to Accreditation
[6] Commission Regulation (EC) No 1881/2006 of 19 December 2006 setting maximum levels for certain contaminants in foodstuffs, amended by Commission Regulation (EC) No 836/2011 of 19 August 2011
[7] Commission Decision (EC) 2002/657 of 12 August 2002 implementing Council Directive 96/23/EC concerning the performance of analytical methods and the interpretation of results
[8] IUPAC HARMONIZED GUIDELINES FOR INTERNAL QUALITY CONTROL IN ANALYTICAL CHEMISTRY LABORATORIES. PureAppl. Chem. 1995, 67 (4) pp. 649-666
[9] D. Lerda, P. Lopez Sanchez, S. Szilagyi, T. Wenzl (2011) Report on the inter-laboratory comparison organised by the European Union Reference Laboratory for Polycyclic Aromatic Hydrocarbons for the validation of a method for quantifying the four EU marker PAHs in Food. EUR 25016 EN
[10] TCVN 6910-2:2001 (ISO 5725-2:1994), Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo - Phần 2: Phương pháp cơ bản xác định độ lặp lại và độ tái lập của phương pháp đo tiêu chuẩn
[11] THOMPSON M.Recent Trends in Inter-Laboratory Precision at ppb and sub-ppb Concentrations in Relation to Fitness for Purpose Criteria in Proficiency Testing. Analyst (Lond.). 2000,125 pp. 385-386
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 14438:2025 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 14438:2025 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 14438:2025 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 14438:2025 DOC (Bản Word)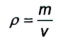
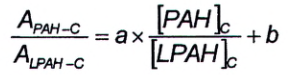
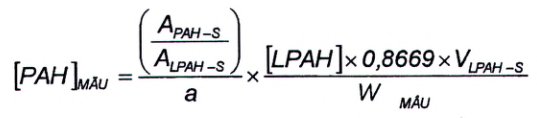
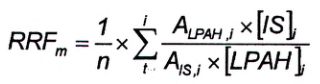
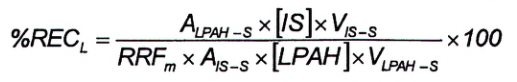
 = 0,6 μg/kg
= 0,6 μg/kg 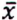 = 3,5 μg/kg
= 3,5 μg/kg 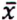 = 1,3 μg/kg
= 1,3 μg/kg 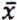 = 5,0 μg/kg
= 5,0 μg/kg 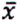 = 2,8 μg/kg
= 2,8 μg/kg 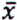 = 2,7 μg/kg
= 2,7 μg/kg 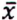 = 4,1 μg/kg
= 4,1 μg/kg 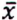 = 7,9 μg/kg
= 7,9 μg/kg 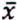 = 1,0 μg/kg
= 1,0 μg/kg 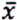 = 0,5 μg/kg
= 0,5 μg/kg 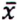 = 9,2 μg/kg
= 9,2 μg/kg 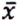 = 0,6 μg/kg
= 0,6 μg/kg 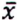 = 4,8 μg/kg
= 4,8 μg/kg 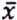 = 2,2 μg/kg
= 2,2 μg/kg 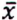 = 0,9 μg/kg
= 0,9 μg/kg 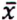 = 4,7 μg/kg
= 4,7 μg/kg 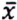 = 11,9 μg/kg
= 11,9 μg/kg 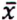 = 0,7 μg/kg
= 0,7 μg/kg 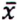 = 0,8 μg/kg
= 0,8 μg/kg 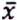 = 4,7 μg/kg
= 4,7 μg/kg 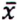 = 2,7 μg/kg
= 2,7 μg/kg 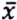 = 4,2 μg/kg
= 4,2 μg/kg 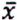 = 2,2 μg/kg
= 2,2 μg/kg 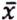 = 4,4 μg/kg
= 4,4 μg/kg 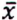 = 10,4 μg/kg
= 10,4 μg/kg 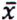 = 5,3 μg/kg
= 5,3 μg/kg 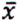 = 1,6 μg/kg
= 1,6 μg/kg 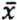 = 0,6 μg/kg
= 0,6 μg/kg 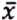 = 3,5 μg/kg
= 3,5 μg/kg 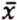 =1,3 μg/kg
=1,3 μg/kg 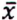 = 5,0 μg/kg
= 5,0 μg/kg 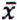 = 2,8 μg/kg
= 2,8 μg/kg 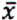 = 2,7 μg/kg
= 2,7 μg/kg 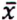 =4,1 μg/kg
=4,1 μg/kg 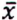 = 7,9 μg/kg
= 7,9 μg/kg 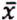 =1,0 μg/kg
=1,0 μg/kg 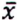 = 4,7 μg/kg
= 4,7 μg/kg 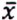 = 6,2 μg/kg
= 6,2 μg/kg 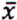 = 7,7 μg/kg
= 7,7 μg/kg 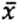 = 1,6 μg/kg
= 1,6 μg/kg 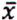 = 0,6 μg/kg
= 0,6 μg/kg 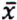 = 3,5 μg/kg
= 3,5 μg/kg 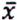 = 1,3 μg/kg
= 1,3 μg/kg 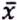 = 5,0 μg/kg
= 5,0 μg/kg 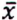 = 2,8 μg/kg
= 2,8 μg/kg 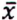 = 2,7 μg/kg
= 2,7 μg/kg 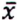 = 4,1 μg/kg
= 4,1 μg/kg 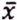 = 7,9 μg/kg
= 7,9 μg/kg 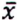 = 1,0 μg/kg
= 1,0 μg/kg 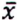 = 0,5 μg/kg
= 0,5 μg/kg 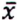 = 9,2 μg/kg
= 9,2 μg/kg 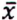 = 0,6 μg/kg
= 0,6 μg/kg 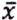 = 4,8 μg/kg
= 4,8 μg/kg 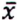 = 2,2 μg/kg
= 2,2 μg/kg 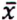 = 0,9 μg/kg
= 0,9 μg/kg 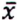 = 4,7 μg/kg
= 4,7 μg/kg 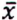 = 11,9 μg/kg
= 11,9 μg/kg 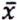 = 0,7 μg/kg
= 0,7 μg/kg 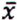 = 0,8 μg/kg
= 0,8 μg/kg 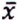 = 4,7 μg/kg
= 4,7 μg/kg 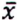 = 2,7 μg/kg
= 2,7 μg/kg 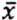 = 4,2 μg/kg
= 4,2 μg/kg 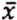 = 2,2 μg/kg
= 2,2 μg/kg 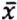 = 4,4 μg/kg
= 4,4 μg/kg 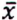 = 10,4 μg/kg
= 10,4 μg/kg 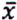 = 0,8 μg/kg
= 0,8 μg/kg 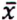 = 5,4 μg/kg
= 5,4 μg/kg 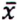 = 0,9 μg/kg
= 0,9 μg/kg 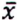 = 3,3 μg/kg
= 3,3 μg/kg 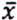 = 3,1 μg/kg
= 3,1 μg/kg 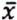 = 4,7 μg/kg
= 4,7 μg/kg 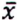 = 6,2 μg/kg
= 6,2 μg/kg 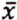 = 7,7 μg/kg
= 7,7 μg/kg 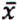 =1,6 μg/kg
=1,6 μg/kg 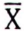 , μg/kg
, μg/kg 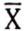 , μg/kg
, μg/kg 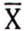 , μg/kg
, μg/kg 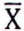 , μg/kg
, μg/kg 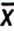 , μg/kg
, μg/kg 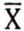 , μg/kg
, μg/kg 