- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn quốc gia TCVN 7595:2024 ISO 15141:2018 Ngũ cốc và sản phẩm ngũ cốc - Xác định ochratoxin A - Phương pháp sắc ký lỏng hiệu năng cao làm sạch bằng cột ái lực miễn dịch và sử dụng detector huỳnh quang
| Số hiệu: | TCVN 7595:2024 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Thực phẩm-Dược phẩm |
| Trích yếu: | ISO 15141:2018 Ngũ cốc và sản phẩm ngũ cốc - Xác định ochratoxin A - Phương pháp sắc ký lỏng hiệu năng cao làm sạch bằng cột ái lực miễn dịch và sử dụng detector huỳnh quang | ||
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
31/12/2024 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 7595:2024
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 7595:2024
TIÊU CHUẨN QUỐC GIA
TCVN 7595:2024
ISO 15141:2018
NGŨ CỐC VÀ SẢN PHẨM NGŨ CỐC - XÁC ĐỊNH OCHRATOXIN A - PHƯƠNG PHÁP SẮC KÝ LỎNG HIỆU NĂNG CAO LÀM SẠCH BẰNG CỘT ÁI LỰC MIỄN DỊCH VÀ SỬ DỤNG DETECTOR HUỲNH QUANG
Cereals and cereal products - Determination of ochratoxin A - High performance liquid chromatographic method with immunoaffinity column cleanup and fluorescence detection
Lời nói đầu
TCVN 7595:2024 thay thế TCVN 7595-1:2007 và TCVN 7595-2:2007;
TCVN 7595:2024 hoàn toàn tương đương với ISO 15141:2018;
TCVN 7595:2024 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC/F1 Ngũ cốc và đậu đỗ biên soạn, Viện Tiêu chuẩn Chất lượng Việt Nam đề nghị, Ủy ban Tiêu chuẩn Đo lường Chất lượng Quốc gia thẩm định, Bộ Khoa học và Công nghệ công bố.
NGŨ CỐC VÀ SẢN PHẨM NGŨ CỐC - XÁC ĐỊNH OCHRATOXIN A - PHƯƠNG PHÁP SẮC KÝ LỎNG HIỆU NĂNG CAO LÀM SẠCH BẰNG CỘT ÁI LỰC MIỄN DỊCH VÀ SỬ DỤNG DETECTOR HUỲNH QUANG
Cereals and cereal products - Determination of ochratoxin A - High performance liquid chromatographic method with immunoaffinity column cleanup and fluorescence detection
1 Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp sắc ký lỏng hiệu năng cao có cột làm sạch ái lực miễn dịch để xác định ochratoxin A trong ngũ cốc và các sản phẩm ngũ cốc.
Giới hạn định lượng phương pháp này là 0,2 μg /kg. Giới hạn phát hiện của phương pháp này phụ thuộc vào nền mẫu cũng như thiết bị được sử dụng.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 4851 (ISO 3696), Nước dùng để phân tích trong phòng thí nghiệm - Yêu cầu kỹ thuật và phương pháp thử
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này không đưa ra các thuật ngữ và định nghĩa.
4 Nguyên tắc
Ochratoxin A (OTA) được chiết bằng axetonitril trong nước. Dịch chiết được tinh sạch bằng cách sử dụng cột ái lực miễn dịch và ochratoxin A được xác định bằng sắc ký lỏng hiệu năng cao (HPLC) trên cột pha đảo và sử dụng detector huỳnh quang. Kết quả được đánh giá, nếu cần, bằng cách tạo dẫn xuất với bo triflorua trong dung dịch metanol.
CẢNH BÁO Ochratoxin A gây tổn thương thận và gan và có thể là chất gây ung thư. Tuân thủ các biện pháp phòng ngừa an toàn thích hợp [1] để xử lý các hợp chất như vậy và đặc biệt tránh xử lý ở dạng khô vì bản chất tĩnh điện có thể làm phát tán và người liên quan hít phải. Dụng cụ thủy tinh có thể được khử nhiễm bằng dung dịch natri hypoclorit 4 %. Cần lưu ý đến công bố của Cơ quan Nghiên cứu Ung thư Quốc tế (WHO) [2][3].
5 Thuốc thử
Trong quá trình phân tích, trừ khi có quy định khác, chỉ sử dụng thuốc thử đạt chất lượng phân tích và chỉ sử dụng nước cất hoặc nước loại 1 theo TCVN 4851 (ISO 3696). Dung môi phải đạt chất lượng dùng cho phân tích HPLC.
5.1 Axetonitril.
5.2 Metanol.
5.3 Natri clorua (NaCl).
5.4 Axit axetic băng, φ (CH3COOH) ≥ 98 %.
5.5 Tween-20.
5.6 Natri bicacbonat (NaHCO3).
5.7 Dinatri hydro phosphat (Na2HPO4).
5.8 Kali dihydro phosphat (KH2PO4).
5.9 Kali clorua (KCl)
5.10 Axit clohydric, c(HCl) = 12 mol/l.
5.11 Ochratoxin A, ở dạng tinh thể hoặc dạng màng đựng trong ống ampun.
5.12 Dung môi chiết, trộn 60 phần thể tích axetonitril (5.1) và 40 phần thể tích nước.
5.13 Dung dịch muối đệm phosphat(PBS), hòa tan 8 g NaCl (5.3), 1,2 g Na2HPO4 (5.7), 0,2 g KH2PO4 (5.8) và 0,2 g KCl (5.9) trong khoảng 990 ml nước. Chỉnh pH đến 7 bằng HCl (5.10) và pha loãng bằng nước đến 1 L.
5.14 Dung dịch rửa, hòa tan 25 g NaCl (5.3), 5 g NaHCO3 (5.6) và 0,1 ml Tween-20 (5.5) trong 1 L nước.
5.15 Pha động, trộn 48 phần thể tích axetonitril (5.1) với 51 phần thể tích nước và 1 phần thể tích axit axetic băng (5.4), khử khí dung dịch này trước khi sử dụng.
5.16 Toluen.
5.17 Hỗn hợp dung môi, trộn 99 phần thể tích toluen (5.16) với 1 phần thể tích axit axetic băng (5.4).
5.18 Dung dịch gốc ochratoxin A
Hòa tan 1 mg ochratoxin A (tinh thể) (5.11) hoặc lượng chứa trong 1 ống (nếu thu được ochratoxin A ở dạng màng) (5.11) trong hỗn hợp dung môi (5.17) để thu được dung dịch chứa khoảng 20 μg/ml đến 30 μg/ml ochratoxin A.
Để xác định nồng độ chính xác, ghi lại đường hấp thụ giữa bước sóng 300 nm và 370 nm, với từng bước 5 nm, trong cuvet thạch anh 1 cm (6.12) với hỗn hợp dung môi (5.17) làm dung dịch chuẩn. Nhận biết bước sóng hấp thụ cực đại bằng cách ghi lại độ hấp thụ theo từng bước 1 nm ở quanh mức hấp thụ cực đại làm chuẩn.
Tính nồng độ khối lượng của ochratoxin A, ρOTA, bằng microgam trên mililit dung dịch theo Công thức (1):
|
| (1) |
Trong đó:
| Amax | là độ hấp thụ xác định được ở mức cực đại của đường hấp thụ (ở đây bước sóng là 333 nm); |
| M | là khối lượng phân tử tương đối của ochratoxin A (M = 403 g/mol); |
| K | là hệ số hấp thụ mol của ochratoxin A, trong hỗn hợp dung môi (ở đây hệ số là: 544 m2/mol); |
| δ | là chiều dài đường quang của cuvet tính bằng centimet. |
Bảo quản dung dịch này ở khoảng -18 °C. Dung dịch được bảo quản theo cách này thường ổn định trong 12 tháng. Kiểm tra nồng độ của dung dịch nếu quá 6 tháng.
5.19 Dung dịch chuẩn ochratoxin A, ρOTA = 1 μg/ml.
Cho bay hơi dưới dòng khí nitơ 1 ml dung dịch gốc (5.18) hoặc phần dịch lỏng tương đương với lượng tuyệt đối ochratoxin A 100 μg đến khô và pha loãng thành 100 ml bằng pha động (5.15).
Dung dịch này có thể được bảo quản trong tủ lạnh ở 4 °C. Cần kiểm tra độ ổn định của dung dịch.
5.20 Dung dịch hiệu chuẩn ochratoxin A
Dùng pipet lấy một lượng thích hợp dung dịch chuẩn ochratoxin A (5.19), ví dụ: 0,05 ml, 0,1 ml, 0,25 ml, 0,5 ml và 1 ml, cho vào bình định mức 100 ml (6.15) và pha loãng đến vạch bằng pha động (5.15). Lượng ochratoxin A trong dung dịch hiệu chuẩn phải nằm trong dải từ 0,05 ng đến 1,0 ng trên 100 μl thể tích bơm. Dung dịch hiệu chuẩn phải được chuẩn bị mới từ dung dịch chuẩn ochratoxin A (5.19) trước mỗi lần phân tích HPLC.
5.21 Dung dịch natri hypoclorit, ρ(NaOCl) = 4 g/100 ml.
5.22 Bo triflorua.
5.23 Bo triflorua trong dung dịch metanol, ρ(BF3) = 14 g/100 ml.
5.24 Diclometan.
5.25 Natri sulfat, khan.
5.26 Dung môi rửa giải, trộn 98 phần thể tích metanol (5.2) và 2 phần thể tích axit axetic băng (5.4).
CẢNH BÁO - Sử dụng tủ hút được bảo dưỡng tốt. Tránh tiếp xúc với da, mắt và đường hô hấp.
6 Thiết bị, dụng cụ
Sử dụng các thiết bị phòng thử nghiệm thông thường và các thiết bị, dụng cụ cụ thể sau.
6.1 Cân phân tích, chính xác đến 10 mg.
6.2 Máy trộn, có bình 1 L và nắp đậy, chống nổ.
6.3 Giấy lọc
a) giấy lọc gấp nếp, hoặc
b) giấy lọc vi sợi thủy tinh
6.4 Ống ly tâm, dung tích 50 ml.
6.5 Màng lọc dung dịch nước, làm bằng polytetrafluoroetylen (PTFE), có đường kính 25 mm và cỡ lỗ 0,2 μm.
6.6 Cột ái lực miễn dịch, chứa các kháng thể có khả năng bắt giữ ochratoxin A. Cột ái lực miễn dịch toxinfast ® Ochratoxin A (Huaan Magnech)[1] hoặc tương đương.
6.7 Xyranh thủy tinh, dung tích 10 ml.
6.8 Bơm chân không.
6.9 Thiết bị cô quay, có nồi cách thủy có khả năng kiểm soát nhiệt độ từ 20 °C đến 50 °C.
6.10 Máy nghiền phòng thử nghiệm, thích hợp để nghiền đến cỡ hạt 1 mm.
6.11 Máy quang phổ UV, thích hợp để đo ở bước sóng từ 300 nm đến 370 nm, có chiều rộng dải phổ không quá ± 2 nm.
6.12 Cuvet thạch anh, có chiều dài đường quang 1 cm và không có sự hấp thụ đáng kể giữa các bước sóng 300 nm và 370 nm.
6.13 Bình nón, dung tích 150 ml.
6.14 Sàng, có kích cỡ lỗ không lớn hơn 1 mm.
6.15 Bình định mức, dung tích 100 ml.
6.16 Microxyranh, dung tích 500 μl.
6.17 Thiết bị HPLC, bao gồm
a) Máy sắc ký lỏng hiệu năng cao, bình chứa dung dịch rửa giải, bơm, hệ thống bơm, detector huỳnh quang có cài đặt bước sóng thay đổi và xử lý dữ liệu, ví dụ: bộ tích phân có máy vẽ, và
b) Cột tách HPLC pha đảo phân tích, C18, đảm bảo tách pic ochratoxin A ra khỏi đường nền và tất cả các pic khác.
Chiều dài cột: 150 mm
Đường kính trong: 4,6 mm
Cỡ hạt hình cầu: 5 μm
CHÚ THÍCH Cũng có thể sử dụng các cột có chiều dài thích hợp khác.
6.18 Máy ly tâm, có lực ly tâm là 8 000 g.
7 Cách tiến hành
7.1 Yêu cầu chung
Toàn bộ quy trình phân tích phải được thực hiện trong ngày làm việc. Nếu một số mẫu được xử lý cùng lúc thì tất cả các mẫu phải được phân tích liên tục cho đến khi hết bằng cách sử dụng bộ bơm mẫu tự động.
7.2 Lấy mẫu
Việc lấy mẫu không được quy định trong tiêu chuẩn này. Nên lấy mẫu theo TCVN 9027 (ISO 24333) [4].
7.3 Chuẩn bị mẫu thử
Nghiền mẫu phòng thử nghiệm bằng máy nghiền phòng thử nghiệm (6.10) cho đến khi mẫu lọt qua sàng (6.14) và trộn kỹ.
7.4 Chiết ochratoxin A ra khỏi mẫu
7.4.1 Chiết
Cho 25 g mẫu (m) được cân chính xác đến 0,1 g vào bình nón hoặc máy trộn (6.2), thêm 100 ml dung môi chiết (5.12) (V1). Đậy nắp và lắc trong 30 min hoặc trộn trong 3 min. Ly tâm dịch chiết ở 8 000 g trong 5 min hoặc lọc qua giấy lọc gấp nếp [6.3 a)].
CHÚ THÍCH Đối với mẫu nhẹ (ví dụ cám lúa mì), khối lượng khuyến nghị là 12,5 g và dung môi chiết là 100 ml.
7.4.2 Pha loãng
Dùng pipet lấy 4,0 ml dịch chiết đã lọc (V2) cho vào ống ly tâm 50 ml (6.4) và pha loãng bằng 26,0 ml dung dịch PBS (5.13) (V3). Dịch chiết đã pha loãng được ly tâm ở 8000 g trong 5 min, thu được dịch chiết A.
Ngoài ra, dùng pipet lấy 6,0 ml dịch chiết đã lọc (V2) cho vào ống ly tâm 50 ml (6.4) và pha loãng bằng 39,0 ml dung dịch PBS (5.13) (V3). Dịch chiết đã pha loãng được lọc qua bộ lọc vi sợi thủy tinh [6.3 b)], thu được dịch chiết B.
7.5 Làm sạch cột ái lực miễn dịch
Cho tất cả dịch chiết A hoặc 30,0 ml dịch chiết B (V4) đi qua cột ái lực miễn dịch OTA với tốc độ dòng khoảng 1 giọt đến 2 giọt mỗi giây, tiếp theo là 10 ml dung dịch rửa (5.14) và 10 ml nước cất với tốc độ 2 giọt mỗi giây. Rửa giải OTA bằng 1,5 ml dung môi rửa giải (5.26). Cho bay hơi dịch rửa giải đến khô trên nồi cách thủy ở nhiệt độ không vượt quá 40 °C dưới dòng N2. Hòa tan lại mẫu trong 0,5 ml (V5) pha động (5.15). Chuyển sang lọ sắc ký lỏng (LC). Nếu cần, mẫu có thể được lọc qua màng lọc PTFE (6.5) trước khi phân tích bằng LC. Quá trình rửa giải ochratoxin A và các bước tiếp theo trong quy trình được mô tả trong điều này có thể phụ thuộc vào loại cột ái lực miễn dịch được sử dụng. Ví dụ, cần kiểm tra thể tích rửa giải để đảm bảo phù hợp với loại cột được sử dụng.
Cẩn thận để không làm quá tải cột ái lực miễn dịch.
7.6 Điều kiện vận hành HPLC
Khi sử dụng cột [6.17 b)] và pha động (5.15) thì các cài đặt sau được cho là phù hợp.
| Tốc độ dòng | 1 ml/min |
|
| Detector huỳnh quang: | Bước sóng kích thích: | 333 nm |
| Bước sóng phát xạ | 460 nm |
|
| Thể tích bơm | 50 μl |
|
| Nhiệt độ cột | 35 °C |
|
7.7 Đường chuẩn
Chuẩn bị đường chuẩn khi bắt đầu phân tích và khi thay đổi điều kiện sắc ký.
Bơm ít nhất bốn dung dịch hiệu chuẩn có nồng độ thích hợp khác nhau (xem 5.20). Dựng đồ thị giá trị huỳnh quang (chiều cao pic hoặc diện tích pic) của dung dịch hiệu chuẩn ochratoxin A (5.20) theo nồng độ ochratoxin A tính bằng nanogam. Cần tiến hành kiểm tra độ tuyến tính [5].
7.8 Nhận biết
Nhận biết ochratoxin A bằng cách so sánh thời gian lưu của mẫu với thời gian lưu của chất chuẩn. Đôi khi, có thể cần nhận biết pic ochratoxin A bằng cách bơm đồng thời dung dịch mẫu thử và dung dịch chuẩn.
7.9 Phép xác định
Tiến hành sắc ký trên mẫu. Thực hiện phép xác định bằng phương pháp ngoại chuẩn, tích phân diện tích pic hoặc xác định chiều cao pic và so sánh kết quả với các giá trị tương ứng với chất chuẩn có diện tích/chiều cao pic gần nhất hoặc sử dụng đồ thị hiệu chuẩn. Trong trường hợp sử dụng đường chuẩn, có thể cần bổ sung các dung dịch với nồng độ nằm trong dải tuyến tính của đường chuẩn.
Bơm các thể tích bằng nhau của dung dịch mẫu thử và dung dịch chuẩn được dùng cho đường chuẩn.
Đọc khối lượng của ochratoxin A, tính bằng nanogam, tương ứng với huỳnh quang của dung dịch mẫu thử từ đường chuẩn.
Nếu đáp ứng ochratoxin A của mẫu nằm ngoài đường chuẩn thì chỉnh lượng mẫu được bơm bằng cách cô đặc hoặc pha loãng dung dịch mẫu thử.
7.10 Khẳng định
Nếu cần, khẳng định sự biến mất pic tại thời gian lưu của ochratoxin A và sự xuất hiện một pic mới tại cùng thời gian lưu đó khi sử dụng chất chuẩn metyl este của ochratoxin A.
Lấy 20D μl dung dịch mẫu thử đã chuẩn bị như trong 7.5, chuyển vào bình hình quả lê và cho bay hơi đến khô trong thiết bị cô quay (6.9). Hòa tan phần cặn thu được trong 0,5 ml diclorometan (5.24) và thêm 1 ml dung dịch bo triflorua trong dung dịch metanol (5.23).
Đậy chặt nắp bình và đun nóng 15 min trong nồi cách thủy ở 50 °C đến 60 °C. Sau khi nguội, chuyển dung dịch vào phễu chiết 50 ml chứa 15 ml nước, lắc ba lần với 5 ml diclorometan, mỗi lần 30 s. Gộp các pha hữu cơ vào phễu chiết 50 ml thứ hai, thêm 10 ml nước để rửa và lắc trong 30 s.
Sau đó lọc pha diclorometan qua natri sulfat khan (5.25) vào bình hình quả lê, cho bay hơi đến khô rồi hoà tan bằng 500 μl pha động (5.15) và đưa dung dịch này vào hệ thống phân tách sắc ký, trong các điều kiện như mô tả trong 7.6. Có thể kiểm tra tính đầy đủ của quá trình tạo dẫn xuất từ sắc ký đồ. Với quy trình này, có thể xác nhận phần khối lượng của ochratoxin A không nhỏ hơn 0,4 μg/kg.
Dung dịch chuẩn thích hợp (5.20) cần được xử lý riêng để kiểm tra thời gian lưu của ochratoxin A metyl este và tính đầy đủ của quá trình tạo dẫn xuất.
8 Tính kết quả
Tính phần khối lượng X1 của ochratoxin A, biểu thị bằng microgam trên kilogam, sử dụng Công thức (2) (phương pháp ngoại chuẩn).
|
| (2) |
Trong đó:
| V1 | là thể tích dung môi dùng để chiết, tính bằng mililit (V1 = 100 ml); |
| V2 | là thể tích dịch chiết dùng để pha loãng, tính bằng mililit (dịch chiết A V2 = 4 ml hoặc dịch chiết B V2 = 6 ml); |
| V3 | là thể tích dung dịch PBS dùng để pha loãng tính bằng mililit (dịch chiết A V3 = 26 ml hoặc dịch chiết B V3 = 39 ml); |
| V4 | là thể tích dịch chiết đã pha loãng dùng để làm sạch, tính bằng mililit (V4 = 30 ml); |
| V5 | là thể tích pha động dùng để hòa tan, tính bằng mililit (V5 = 0,5 ml); |
| c | là nồng độ của ochratoxin A trong dung dịch cuối cùng được sử dụng để xác định LC, tính bằng μg/l; |
| m | là khối lượng của phần mẫu thử, tính bằng gam (g). |
Báo cáo kết quả theo định dạng phù hợp và sau khi làm tròn đến hai chữ số thập phân.
CHÚ THÍCH Có thể áp dụng các quy định có liên quan.
Nhận biết có hoặc không áp dụng việc hiệu chỉnh đối với độ thu hồi.
9 Độ chụm
9.1 Yêu cầu chung
Các chi tiết về phép thử liên phòng thử nghiệm về độ chụm của phương pháp theo ISO 5725:1986[6] được nêu trong Phụ lục A. Các giá trị thu được từ phép thử liên phòng thử nghiệm này có thể không áp dụng được cho các dải nồng độ và nền mẫu khác với dải nồng độ và nền mẫu đã nêu trong Phụ lục A.
9.2 Độ lặp lại
Chênh lệch tuyệt đối giữa hai kết quả thử nghiệm đơn lẻ, thu được khi sử dụng cùng một phương pháp, trên vật liệu thử giống hệt nhau, trong cùng một phòng thử nghiệm, do cùng một người thực hiện, sử dụng cùng thiết bị, trong cùng một khoảng thời gian ngắn, không quá 5 % các trường hợp vượt quá giới hạn lặp lại nêu trong Công thức (3):
|
| (3) |
Trong đó:
sr là độ lệch chuẩn lặp lại;
![]() là nồng độ trung bình của ochratoxin A, tính bằng microgam/kilogam (μg/kg).
là nồng độ trung bình của ochratoxin A, tính bằng microgam/kilogam (μg/kg).
9.3 Độ tái lập
Chênh lệch tuyệt đối giữa hai kết quả thử nghiệm đơn lẻ, thu được khi sử dụng cùng một phương pháp, trên vật liệu thử giống hệt nhau, trong các phòng thử nghiệm khác nhau, do những người khác nhau thực hiện, sử dụng thiết bị khác nhau, không quá 5 % các trường hợp lớn hơn giá trị giới hạn tái lập R nêu trong Công thức (4):
|
| (4) |
Trong đó:
sR là độ lệch chuẩn tái lập;
![]() là nồng độ trung bình của ochratoxin A, tính bằng microgam/kilogam (μg/kg).
là nồng độ trung bình của ochratoxin A, tính bằng microgam/kilogam (μg/kg).
10 Báo cáo thử nghiệm
Báo cáo thử nghiệm phải bao gồm ít nhất các thông tin dưới đây:
- mọi thông tin cần thiết để nhận biết về mẫu thử;
- kết quả và đơn vị biểu thị kết quả;
- ngày lấy mẫu và phương pháp lấy mẫu (nếu biết);
- ngày nhận mẫu thử nghiệm;
- ngày thử nghiệm;
- mọi thao tác không quy định trong tiêu chuẩn này hoặc được coi là tùy chọn, cùng với các chi tiết về bất kỳ sự cố nào có thể ảnh hưởng đến kết quả thử nghiệm.
Phụ lục A
(tham khảo)
Kết quả thử nghiệm liên phòng
A.1 Khái quát
Các giá trị của giới hạn lặp lại và giới hạn tái lập đối với phương pháp này được lấy từ kết quả của chương trình thử nghiệm liên phòng thử nghiệm quốc tế thực hiện theo ISO 5725:1986[16].
Các thử nghiệm được thực hiện trên 10 mẫu ngũ cốc và sản phẩm ngũ cốc (mẫu tự nhiên và mẫu thêm chuẩn). Mười bốn phòng thử nghiệm ở ba quốc gia đã tham gia. Chương trình thử nghiệm được tổ chức bởi Viện nghiên cứu lương thực và dự trữ quốc gia, Trung Quốc vào tháng 3 năm 2016.
Các kết quả thử nghiệm đã được phân tích thống kê theo TCVN 6910-1:2001 (ISO 5725-1:1994)[7], TCVN 6910-2:2001 (ISO 5725-2:1994)[8] và TCVN 6910-3:2001 (ISO 5725-6:1994)[9] để đưa ra dữ liệu về độ chụm như trong Bảng A.1. Do sự phân bố không đồng nhất của ochratoxin A trong các mẫu bị ô nhiễm tự nhiên là một phần quan trọng và không thể tách rời của tính biến thiên của các kết quả thử nghiệm, mối quan hệ giữa giá trị độ chụm và mức trung bình (Hình A.1 và Bảng A.2) được thiết lập trên mẫu bị ô nhiễm tự nhiên, cho thấy các kết quả thống kê của các mẫu “thực”. Các mẫu thêm chuẩn trong các phép thử liên phòng thử nghiệm được sử dụng để đánh giá độ thu hồi và xác nhận khả năng ứng dụng trong các nền mẫu khác nhau.
A.2 Dữ liệu về độ chụm
Bảng A.1 - Kết quả của phép thử liên phòng thử nghiệm về hàm lượng ochratoxin A
| Mẫu | Lúa mì bị ô nhiễm tự nhiên | Ngô bị ô nhiễm tự nhiên | Mẫu thêm chuẩn | |||||||
| Cao | Thấp | Mẫu trắng | Cao | Thấp | Mẫu trắng | Gạo lứt | Lúa mạch | Cám lúa mì | Bột mì | |
| Năm thử nghiệm liên phòng | 2016 | 2016 | 2016 | 2016 | 2016 | 2016 | 2016 | 2016 | 2016 | 2016 |
| Số phòng thử nghiệm | 14 | 14 | 14 | 14 | 14 | 14 | 14 | 14 | 14 | 14 |
| Số lượng mẫu | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 |
| Số phòng thử nghiệm còn lại sau khi trừ ngoại lệ | 14 | 14 | 14 | 14 | 13 | 14 | 13 | 13 | 12 | 14 |
| Số ngoại lệ (phòng thử nghiệm) | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 2 | 0 |
| Số kết quả được chấp nhận | 42 | 42 | 42 | 42 | 39 | 42 | 39 | 39 | 36 | 42 |
| Giá trị trung bình, | 6,7 | 2,8 | <0,2 | 4,1 | 2,4 | <0,2 | 4,2 | 4,2 | 4,3 | 1,7 |
| Độ lệch chuẩn lặp lại, sr (μg/kg) | 0,28 | 0,10 | - | 0,17 | 0,09 | - | 0,11 | 0,09 | 0,09 | 0,06 |
| Hệ số biến thiên lặp lại, Cv,r (%) | 4,2 | 3,6 | - | 4,2 | 3,8 | - | 2,6 | 2,1 | 2,1 | 3,6 |
| Giới hạn lặp lại, r (μg/kg) | 0,79 | 0,28 | - | 0,49 | 0,26 | - | 0,31 | 0,27 | 0,25 | 0,18 |
| Độ lệch chuẩn tái lập, sR (μg/kg) | 0,79 | 0,26 | - | 0,54 | 0,29 | - | 0,33 | 0,28 | 0,19 | 0,19 |
| Hệ số biến thiên tái lập, CV,R (%) | 11,80 | 9,50 | - | 13,30 | 12,30 | - | 7,90 | 5,60 | 4,40 | 11,30 |
| Giới hạn tái lập, R (μg/kg) | 2,24 | 0,74 | - | 1,52 | 0,82 | - | 0,94 | 0,79 | 0,54 | 0,55 |
| Độ thu hồi (%) | - | - | - | - | - | - | 91 | 93 | 93 | 92 |
| Giá trị HorRat[10][11] | 0,53 | 0,43 | - | 0,60 | 0,56 | - | 0,36 | 0,30 | 0,20 | 0,51 |
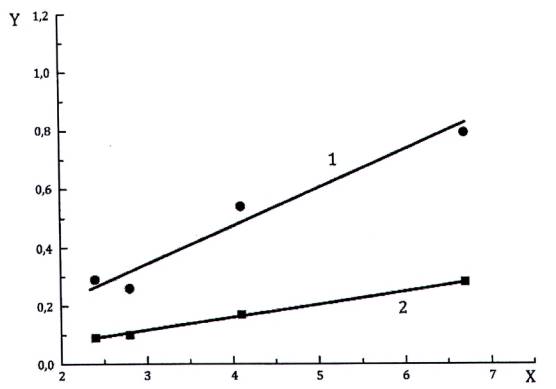
Hình A.1 - Mối quan hệ giữa độ lệch chuẩn lặp lại và độ lệch chuẩn tái lập với nồng độ OTA trong các mẫu bị ô nhiễm tự nhiên
CHÚ DẪN
X nồng độ trung bình của OTA (μg/kg)
Y độ lệch chuẩn
1 độ lệch chuẩn tái lập
2 độ lệch chuẩn lặp lại
Bảng A.2 - Thống kê dữ liệu về độ chụm
| Thông số | Dải | Mối quan hệ | Độ lặp lại | Độ tái lập |
| Nồng độ trung bình của OTA (μg/kg) | Từ 2,4 đến 6,7 | r: tuyến tính R: tuyến tính | sr = 0,044 3 | sR = 0,122 8 |
| Hệ số tương quan R2 = 0,995 | Hệ số tương quan R2= 0,938 |
Thư mục tài liệu tham khảo
[1] Tauchmann F.; Mintzlaff H.-J., Leistner L. Schutzmaßnahmen beim Arbeiten mitMykotoxinen (Protective measures for working with mycotoxins). Alimenta. 1972, 11, p. 85
[2] Castegnaro M., Hunt D.C., Sansone E.B., Schuller P.L., Siriwardana M.G., Telling G.M., van Egmond H.P., Walker E.A. Laboratory decontamination and destruction of aflatoxins B1, B2, G1 and G2 in laboratory wastes. In: IARC Scientific publication no 37 International Agency for Research on Cancer (WHO), Lyon, France. 1980, p. 59
[3] Castegnaro M., Barek J., Fremy J.M., Lafontaine M., Miraglia M., Sansone E.B., Telling G.M. Laboratory decontamination and destruction of carcinogens in laboratory wastes. In: IARC Scientific publication no 113. International Agency for Research on Cancer (WHO), Lyon, France. 1991, p. 63
[4] TCVN 9027 (ISO 24333), Ngũ cốc và sản phẩm ngũ cốc - Lấy mẫu
[5] ISO 5725:1986, Độ chính xác của các phương pháp thử nghiệm - Xác định độ lặp lại và độ tái lập đối với một phương pháp thử nghiệm tiêu chuẩn bằng các thử nghiệm liên phòng thí nghiệm
[6] Van Trijp J.M.P., Roos A.H. Model for the calculation of calibration curves. RIKILT Report 91,02. 1991
[7] TCVN 6910-1:2001 (ISO 5725-1:1994), Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo - Phần 1: Nguyên tắc và định nghĩa chung
[8] TCVN 6910-2:2001 (ISO 5725-2:1994), Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo - Phần 2: Phương pháp cơ bản xác định độ lặp lại và độ tái lập của phương pháp đo tiêu chuẩn
[9] TCVN 6910-6:2001 (ISO 5725-6:1994), Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo - Phần 6: Sử dụng các giá trị độ chính xác trong thực tế
[10] Horwitz W., Albert R. Tỷ lệ Horwitz (HorRat): A Useful Index of Method Performance with Respect to Precision. Journal of AOAC International. 2006, 89, pp. 1095-1109
[11] Thompson M. Recent trends in inter-laboratory precision at ppb and sub-ppb concentrations in relation to fitness for purpose criteria in proficiency testing. Analyst. 2000, 125, pp. 385-386
[1] Ví dụ về sản phẩm phù hợp có sẵn trên thị trường. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn này và không ấn định sử dụng chúng. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 7595:2024 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 7595:2024 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 7595:2024 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 7595:2024 DOC (Bản Word)