- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 8400-40:2016 Bệnh động vật-Quy trình chẩn đoán-Phần 40: Bệnh nhiễm trùng huyết ở thủy cầm do vi khuẩn Riemerella anatipestifer gây ra
| Số hiệu: | TCVN 8400-40:2016 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
30/12/2016 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 8400-40:2016
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 8400-40:2016
TIÊU CHUẨN QUỐC GIA
TCVN 8400-40:2016
BỆNH ĐỘNG VẬT - QUY TRÌNH CHẨN ĐOÁN - PHẦN 40: BỆNH NHIỄM TRÙNG HUYẾT Ở THỦY CẦM DO VI KHUẨN RIEMERELLA ANATIPESTIFER GÂY RA
Animal diseases - Diagnostic procedure - Part 40: Septicemia in waterfowl
Lời nói đầu
TCVN 8400-4:2016 do Trung tâm Chẩn đoán Thú y Trung ương - Cục Thú y biên soạn, Bộ Nông nghiệp và Phát triển nông thôn đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Bộ tiêu chuẩn TCVN 8400 Bệnh động vật - Quy trình chẩn đoán gồm các phần sau:
- TCVN 8400-1 : 2010, phần 1: Bệnh lở mồm long móng;
- TCVN 8400-2 : 2010, phần 2: Bệnh do vi khuẩn Streptococcus suis gây ra trên lợn;
- TCVN 8400-3 : 2010, phần 3: Bệnh giun xoắn;
- TCVN 8400-4 : 2010, phần 4: Bệnh Niu CátXơn;
- TCVN 8400-5 : 2011, phần 5: Bệnh tiên mao trùng;
- TCVN 8400-6 : 2011, phần 6: Bệnh xuất huyết thỏ;
- TCVN 8400-7 : 2011, phần 7: Bệnh đậu cừu và đậu dê;
- TCVN 8400-8 : 2011, phần 8: Bệnh nấm phổi do Aspergillus ở gia cầm;
- TCVN 8400-9 : 2011, phần 9: Bệnh viêm gan vịt typ I;
- TCVN 8400-10 : 2011, phần 10: Bệnh lao bò;
- TCVN 8400-11 : 2011, phần 11: Bệnh dịch tả vịt;
- TCVN 8400-12 : 2011, phần 12: Bệnh bạch lỵ và thương hàn ở gà;
- TCVN 8400-13 ; 2011, phần 13: Bệnh sảy thai truyền nhiễm do Brucella;
- TCVN 8400-14 : 2011, phần 14: Bệnh tụ huyết trùng ở trâu bò;
- TCVN 8400-15 : 2011, phần 15: Bệnh xoắn khuẩn do Leptospira;
- TCVN 8400-16 : 2011, phần 16: Bệnh phù ở lợn do vi khuẩn E.coli;
- TCVN 8400-17 : 2011, phần 17: Bệnh do Staphylococcus aureus ở gà;
- TCVN 8400-18 : 2014, phần 18: Bệnh phù đầu gà (coryza);
- TCVN 8400-19 : 2014, phần 19: Bệnh phó thương hàn lợn;
- TCVN 8400-20 : 2014, phần 20: Bệnh đóng dấu lợn;
- TCVN 8400-21 : 2014, phần 21: Hội chứng rối loạn sinh sản và hô hấp ở lợn (PRRS);
- TCVN 8400-22 : 2014, phần 22: Bệnh giả dại ở lợn;
- TCVN 8400-23 : 2014, phần 23: Bệnh ung khí thán;
- TCVN 8400-24 : 2014, phần 24: Bệnh viêm phế quản truyền nhiễm;
- TCVN 8400-25 : 2014, phần 25: Bệnh cúm lợn;
- TCVN 8400-26 : 2014, phần 26: Bệnh cúm gia cầm H5N1;
- TCVN 8400-27 : 2014, phần 27: Bệnh sán lá gan;
- TCVN 8400-28 : 2014, phần 28: Bệnh viêm ruột hoại tử do Clostridium perfringens;
- TCVN 8400-29 : 2015, phần 29: Bệnh Lympho leuko ở gà;
- TCVN 8400-30 : 2015, phần 30: Bệnh Marek ở gà;
- TCVN 8400-31 : 2015, phần 31: Bệnh tụ huyết trùng gia cầm;
- TCVN 8400-32 : 2015, phần 32: Bệnh gumboro ở gia cầm;
- TCVN 8400-33 : 2015, phần 33: Bệnh lê dạng trùng ở trâu bò;
- TCVN 8400-34 : 2015, phần 34: Bệnh biên trùng ở trâu bò;
- TCVN 8400-35 : 2015, phần 35: Bệnh Theileria ở trâu bò;
- TCVN 8400-36 : 2015, phần 36: Hội chứng suy mòn ở lợn sau cai sữa do Circo virus typ 2;
- TCVN 8400-37 : 2015, phần 37: Bệnh viêm phổi địa phương ở lợn;
- TCVN 8400-38 : 2015, phần 38: Bệnh tiêu chảy ở lợn do Corona virus;
- TCVN 8400-39 : 2016: phần 39: Bệnh viêm đường hô hấp mãn tính ở gà và gà tây;
- TCVN 8400-40 : 2016: phần 40: Bệnh nhiễm trùng huyết ở thủy cầm do vi khuẩn Riemerella anatipestifer gây ra.
BỆNH ĐỘNG VẬT - QUY TRÌNH CHẨN ĐOÁN - PHẦN 40: BỆNH NHIỄM TRÙNG HUYẾT Ở THỦY CẦM DO VI KHUẨN RIEMERELLA ANATIPESTIFER GÂY RA
Animal diseases - Diagnostic procedure - Part 40: Septicemia in waterfowl
CẢNH BÁO - Việc áp dụng tiêu chuẩn này có thể liên quan đến các vật liệu, thiết bị và các thao tác gây nguy hiểm cho người xét nghiệm. Tiêu chuẩn này không thể đưa ra được tất cả các vấn đề an toàn liên quan đến việc sử dụng chúng. Khi áp dụng tiêu chuẩn người sử dụng tiêu chuẩn phải tự thiết lập các thao tác phù hợp để đảm bảo an toàn sức khỏe và xác định khả năng áp dụng các giới hạn quy định.
1 Phạm vi áp dụng
Tiêu chuẩn này quy định quy trình chẩn đoán bệnh nhiễm trùng huyết ở thủy cầm (hay còn gọi là bệnh bại huyết) do vi khuẩn Riemerella anatipestifer gây ra.
2 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng thuật ngữ và định nghĩa sau:
Bệnh nhiễm trùng huyết ở thủy cầm (Septicemia in waterfowl)
- Bệnh nhiễm trùng huyết ở thủy cầm do vi khuẩn Riemerella anatipestifer gây ra.
- Vi khuẩn Riemerella anatipestifer là trực khuẩn Gram âm, hiếu khí, không hình thành nha bào, không di động, kích thước (0,3 - 0,5 μm) x (1 - 2,5 μm), có thể kết nhóm đôi hay chuỗi ngắn.
3 Thuốc thử và vật liệu thử
Chỉ sử dụng thuốc thử loại tinh khiết phân tích; sử dụng nước cất hoặc nước đã khử khoáng hoặc nước có độ tinh khiết tương đương không có Rnase, trừ các trường hợp có quy định khác.
3.1 Môi trường nước thịt (xem Phụ lục B.1)
3.2 Môi trường thạch máu (xem Phụ lục B.2)
3.3 Môi trường Sô-cô-la (xem Phụ lục B.3)
3.4 Huyết thanh, là huyết thanh thai bê hoặc huyết thanh ngựa hoặc huyết thanh lợn vô trùng, đã được bất hoạt ở 56 °C trong 30 min, được bổ sung 5 % thể tích vào môi trường.
3.5 Cao nấm men, vô trùng, dùng ở nồng độ 25 %.
3.6 NADH (Nicotinamide Adenin dinucleotit), vô trùng, dùng ở nồng độ 1 %.
3.7 Máu, là máu cừu hoặc máu bê hoặc máu thỏ, vô trùng.
3.8 Môi trường thạch MacConkey (xem Phụ lục B.4)
3.9 Môi trường xác định các đặc tính sinh hóa (xem phụ lục C)
3.10 Nguyên liệu cho PCR (Phụ lục D)
3.11 Nước muối sinh lý, là muối natri clorid (NaCl) được pha trong nước thành dung dịch 0,9 %, vô trùng.
3.12 Chất chống đông, bổ sung theo tỷ lệ 1 phần thể tích chất chống đông và 9 phần thể tích máu. Thường dùng chất chống đông máu là heparin hoặc natri citrat 3,8 %.
4 Thiết bị, dụng cụ
Sử dụng các thiết bị, dụng cụ của phòng thí nghiệm sinh học và cụ thể như sau:
4.1 Tủ ấm, có bổ sung từ 5 % - 10 % CO2 và duy trì nhiệt độ 37 °C.
4.2 Kính hiển vi, có vật kính với độ phóng đại 10 lần, 40 lần, 100 lần.
4.3 Nồi hấp, duy trì ở các nhiệt độ 100 °C , 110 °C, 121 °C trong thời gian 10 min, 15 min, 20 min.
4.4 Máy lắc, có tốc độ lắc từ 50 đến 2400 vòng / phút.
4.5 Máy li tâm, li tâm với gia tốc 12 000 g.
4.6 Máy PCR (máy nhân gen)
4.7 Bộ điện di, điện di ở 100 V trong khoảng 20 min đến 30 min.
4.8 Panh, kéo, vô trùng.
4.9 Bể ủ nhiệt, duy trì nhiệt độ từ 55 °C đến 70 °C.
4.10 Màng lọc, có kích thước lỗ lọc 0,45 μm.
4.11 Pipet các loại 100 μl, 200 μl, 1000 μl
4.12 Ống nghiệm, vô trùng.
4.13 Đĩa petri (hộp lồng), vô trùng.
4.14 Que cấy, vô trùng.
4.15 Bông cồn, bông cot-ton đã được tẩm cồn 70 %
4.16 Xi-lanh, loại 5 ml hoặc 10 ml, có gắn kim lấy máu, vô trùng, có chứa chất chống đông máu
4.17 Phiến kính, sạch.
4.18 Đèn cồn
4.19 Cối chày sứ nghiền mẫu, vô trùng.
4.20 Ống li tâm (hay ống eppendoff), vô trùng, có thể tích 0,2 ml, 1,5 ml.
4.21 Tủ lạnh, có thể duy trì nhiệt độ từ 4 °C đến 8 °C
5 Chẩn đoán lâm sàng
5.1 Đặc điểm dịch tễ
- Bệnh nhiễm trùng huyết ở thủy cầm là bệnh truyền nhiễm, thường xảy ra ở vịt, ngan, ngỗng do vi khuẩn Riemerella anatipestifer gây ra.
- Bệnh chủ yếu ở thủy cầm từ 1 tuần tuổi đến 8 tuần tuổi.
- Bệnh xuất hiện quanh năm nhưng hay gặp nhất là khi giao mùa, thời tiết thay đổi, như ở miền Bắc là chuyển từ mùa xuân sang mùa hè và mùa thu sang mùa đông; ở miền Nam là từ mùa mưa sang mùa khô và ngược lại.
- Bệnh lây nhiễm trực tiếp từ thủy cầm ốm sang thủy cầm khỏe qua đường hố hấp hoặc gián tiếp qua thức ăn, nước uống, các dụng cụ chăn nuôi, người chăn nuôi,....
- Tỷ lệ mắc bệnh cao, có thể từ 80 % đến 100 %.
- Tỷ lệ chết của bệnh cao, có thể lên tới 75 %.
5.2 Triệu chứng lâm sàng
Thời gian ủ bệnh thường từ 2 ngày đến 5 ngày. Triệu chứng lâm sàng của bệnh thường thấy là:
- Dấu hiệu đầu tiên có thể thấy là thủy cầm bị tiêu chảy, phân màu xanh xám hoặc màu trắng.
- Thủy cầm sốt, ủ rũ, chảy nước mắt, nước mũi, hít thở khó khăn, có ho nhẹ.
- Thủy cầm đi lại khó khăn, kéo lê chân hoặc không đi lại được.
- Thủy cầm mất cân bằng, sưng phù đầu, nghoẹo cổ, đầu và cổ bị run, dễ bị kích thích bởi tiếng động, hai chân duỗi ra như bơi.
- Thủy cầm chết sau vài ngày có triệu chứng của bệnh.
5.3 Bệnh tích
- Xác thủy cầm gầy.
- Viêm màng bao tim có sợi tơ huyết.
- Gan sưng và màng bao gan bị viêm có màu trắng đục, bở, không bám dính vào các cơ quan khác.
- Túi khí vùng ngực và vùng bụng viêm dạng tơ huyết.
- Phổi sung huyết.
- Lách phì đại, hơi dài và hơi nhạt màu hoặc có vân đá hoa.
- Khớp sưng, phù nề, có dịch viêm.
- Ở thể thần kinh, viêm màng não có sợi tơ huyết.
- Ở giai đoạn sau thì các cơ quan nội tạng được bao phủ bởi lớp tơ huyết.
- Ở thủy cầm đẻ: viêm ống dẫn trứng, bên trong ống dẫn trứng có dịch màu vàng.
5.4 Chẩn đoán phân biệt
Chẩn đoán phân biệt bệnh nhiễm trùng huyết ở thủy cầm với một số bệnh khác ở thủy cầm theo Bảng 1.
Bảng 1 - Chẩn đoán phân biệt bệnh nhiễm trùng huyết ở thủy cầm với một số bệnh khác
| Bệnh | Biểu hiện |
| Bệnh tụ huyết trùng do vi khuẩn Pasteurella multocida gây ra | Mắc ở mọi lứa tuổi. Thường chết đột ngột khi chưa có triệu chứng. Triệu chứng có thể thấy là sốt cao, bỏ ăn, thở khó, lười vận động. Tiêu chảy phân trắng có thể kèm theo nhớt. Bệnh tích đặc trưng: Gan có các điểm hoại tử nhỏ li ti bằng đầu đinh ghim, có màu trắng xám hoặc vàng nhạt; Phổi, gan, lách ruột xuất huyết; Bao tim tích nước vàng; Cơ tim và lớp mỡ vành tim xuất huyết. |
| Bệnh do vi khuẩn E.coli gây ra | Mắc chủ yếu ở 2 tuần đến 12 tuần. Biểu hiện không rõ, lúc đầu sốt, sau giảm dần. Khi bị nặng, thủy cầm tiêu chảy, phân màu vàng, xanh lẫn nhiều bọt khí. Thủy cầm đẻ: giảm đẻ, gầy ốm và thường kèm theo chứng sưng khớp. Bệnh tích đặc trưng: Viêm màng bao tim, viêm màng bụng, viêm màng quanh gan. Ngoài ra, còn thấy viêm đường ruột, viêm túi khí. Thủy cầm đẻ còn thấy viêm, hoại tử buồng trứng. |
| Bệnh do vi khuẩn Salmonella gây ra | Mắc chủ yếu dưới 3 tuần tuổi. Tiêu chảy phân trắng, dính bết vào lỗ huyệt. Có thể có viêm khớp. Bệnh tích đặc trưng: Không tiêu lòng đỏ. Viêm bao tim. Xoang bao tim tích nước nhày, màu vàng. Viêm xoang bụng, có thể dính với các cơ quan khác. |
| Bệnh viêm gan vịt | Mắc ở vịt dưới 6 tuần tuổi, chủ yếu từ 1 đến 3 tuần tuổi. Vịt có triệu chứng thần kinh, đi liêu siêu hoặc bị ngã, khi nằm thì hai chân co giật. Bệnh tích đặc trưng: Vịt chết: hai chân duỗi thẳng như bơi chèo, đầu ngửa hết về phía sau. Gan sưng, nhũn, dễ nát khi ấn nhẹ. Bề mặt gan có nhiều điểm xuất huyết lan rộng không ranh giới. Viêm màng bao tim, cơ tim nhạt màu. |
6 Chẩn đoán trong phòng thí nghiệm
6.1 Lấy mẫu
Bệnh phẩm là não, máu tim, gan, lách, phổi.
Cách lấy mẫu:
- Lấy mẫu máu tim: dùng xi lanh (4.16) có chất chống đông máu (3.12) đâm vào tim để hút lấy máu, khoảng 0,5 ml đến 1 ml, ghi ký hiệu mẫu.
- Lấy mẫu gan, lách, phổi: dùng panh, kéo (4.8) lấy khoảng 10 g đến 50 g, cho vào từng lọ hay túi ni lon vô trùng riêng biệt, đậy kín, ghi ký hiệu mẫu.
- Lấy mẫu là não: dùng panh, kéo (4.8) bộc lộ hộp sọ thủy cầm, rồi lấy khoảng 5 g đến 10 g não cho vào từng lọ hay túi ni lon vô trùng riêng biệt, đậy kín, ghi ký hiệu mẫu.
Mẫu bệnh phẩm nên được nuôi cấy trên môi trường càng nhanh càng tốt. Trong trường hợp phải vận chuyển đến phòng thí nghiệm thì mẫu bệnh phẩm phải được bảo quản trong điều kiện lạnh từ 2 °C đến 8 °C và gửi về phòng thí nghiệm trong vòng 24 h sau khi lấy mẫu.
Gửi kèm theo bệnh phẩm giấy yêu cầu xét nghiệm có ghi rõ triệu chứng, bệnh tích và đặc điểm dịch tễ.
6.2 Xác định vi khuẩn Riemerella anatipestifer bằng phương pháp PCR từ bệnh phẩm
6.2.1 Xử lý mẫu
- Dùng panh kéo (4.8) cắt nhỏ và nghiền mẫu bệnh phẩm với nước muối sinh lý (3.11) theo tỷ lệ 1 : 9 (phần thể tích) bằng cối chày sứ (4.11).
- Dùng pipet hút huyễn dịch vừa nghiền chuyển sang 2 ống 1,5 ml. Một ống dùng để tách ADN tiến hành phản ứng PCR; ống còn lại dùng làm mẫu lưu, bảo quản ở nhiệt độ 4 °C.
6.2.2 Tách chiết ADN
Tách chiết ADN bằng kít thương mại. Quy trình tách chiết theo hướng dẫn của nhà sản xuất.
6.2.3 Tiến hành
Xác định vi khuẩn Riemerella anatipestifer bằng phương pháp PCR với cặp mồi đặc hiệu và chu trình nhiệt được nêu trong bảng 2 và bảng D.2 (xem Phụ lục D).
Bảng 2 - Cặp mồi xác định vi khuẩn Riemerella anatipestifer [3]
| Gen đích | Tên mồi | Trình tự từ đầu 5’ tới 3’ | Kích thước sản phẩm (bp) |
| 16S rRNA | 669AF | TTA CCG ACT GAT TGC CTT CTA G | 546 |
| 669AR | AGA GGA AGA CCGA GGA CAT C |
- Chuẩn bị mẫu, các bước tiến hành phản ứng PCR, chu trình nhiệt của phản ứng PCR được quy định tại Phụ lục D
6.3 Nuôi cấy, phân lập vi khuẩn vi khuẩn Riemerella anatipestifer
6.3.1 Xử lý mẫu và nuôi cấy vi khuẩn Riemerella anatipestifer
- Với mẫu máu tim được hút bằng xi lanh vô trùng: nuôi cấy vào môi trường nước thịt (3.1), môi trường thạch máu (3.2), môi trường thạch sô-cô-la (3.3), môi trường thạch MacConkey (3.8).
- Với mẫu lá gan, lách, phổi, não: sát trùng bề mặt ngoài bằng bông cồn (4.15), rồi dùng kéo (4.8) cắt sâu vào tổ chức bên trong lấy một mẫu nhỏ hoặc dùng que cấy (4.14) lấy tổ chức bên trong nuôi cấy vào môi trường nước thịt (3.1), môi trường thạch máu (3.2), môi trường thạch sô-cô-la (3.3), môi trường thạch MacConkey (3.8).
- Sau đó nuôi cấy vi khuẩn trong tủ ấm (4.1). Sau từ 24 h đến 48 h, kiểm tra kết quả nuôi cấy.
6.3.2 Phân lập vi khuẩn Riemerella anatipestifer
Sau từ 24 h đến 48 h, kiểm tra kết quả nuôi cấy:
- Môi trường nước thịt: vi khuẩn mọc yếu, không có cặn ở đáy, lắc ống nghiệm có vẩn nhẹ;
- Trên thạch máu: khuẩn lạc Riemerella anatipestifer không gây dung huyết, rìa gọn, có kích thước từ 1 mm đến 2mm, màu trắng hơi xám, nhầy, hơi ướt.
- Trên thạch Sô-cô-la: khuẩn lạc Riemerella anatipestifer mọc tốt hơn (so với trên thạch máu), không gây dung huyết, rìa gọn, có kích thước từ 1 mm đến 2mm, màu trắng hơi xám, nhầy, hơi ướt.
- Trên thạch MacConkey: vi khuẩn Riemerella anatipestifer không mọc.
Chọn khuẩn lạc nghi ngờ cấy vào môi trường nước thịt (3.1) hoặc thạch máu (3.2) hoặc thạch Sô-cô-la, nuôi trong tủ ấm (4.1) để xác định hình thái vi khuẩn, xác định các đặc tính sinh hóa của vi khuẩn, xác định vi khuẩn bằng phản ứng PCR.
6.4 Xác định hình thái vi khuẩn Riemerella anatipestifer
Từ canh khuẩn hoặc khuẩn lạc nghi là vi khuẩn Riemerella anatipestifer (xem 6.3.2) tiến hành làm tiêu bản:
- Từ khuẩn lạc: nhỏ 1 giọt nước muối sinh lý (3.11) lên phiến kính (4.17), dùng que cấy (4.14) lấy khuẩn lạc hòa đều vào giọt nước muối sinh lý.
- Từ canh khuẩn (nước thịt đã nuôi cấy vi khuẩn): dùng que cấy (4.14) lấy một vòng canh khuẩn dàn mỏng lên trên phiến kính (4.17).
Tiêu bản được để khô và cố định trên ngọn lửa đèn cồn (4.18);
Tiêu bản được nhuộm bằng phương pháp Gram (xem Phụ lục A);
Vi khuẩn Riemerella anatipestifer bắt màu hồng (Gram âm), đa hình thái (hình cầu, hình cầu trực khuẩn, hình trực khuẩn ngắn), thường đứng riêng lẻ hay thành cặp.
6.5 Xác định vi khuẩn Riemerella anatipestifer bằng phản ứng sinh hóa
Từ canh khuẩn hoặc khuẩn lạc nghi là vi khuẩn Riemerella anatipestifer (xem 6.3.2) tiến hành xác định một số đặc tính sinh hóa đặc trưng được nêu trong Bảng 3.
Môi trường xác định các đặc tính sinh hóa của vi khuẩn Riemerella anatipestifer và cách tiến hành các phản ứng được nêu trong Phụ lục C.
Bảng 3 - Một số đặc tính sinh hoá đặc trưng của vi khuẩn Riemerella anatipestifer
| Tính chất | Riemerella an atipestifer |
| Sinh indol | ± |
| Lên men glucose | - |
| Lên men lactose | - |
| Lên men sucrose | - |
| Sinh H2S | - |
| Lên men mannitol | - |
| Khả năng di động | - |
| Sử dụng urê | ± |
| Sử dụng Cimon citrat | Không mọc |
| Phản ứng catalase | + |
| Phản ứng oxidase | + |
6.6 Xác định vi khuẩn Riemerella anatipestifer bằng phương pháp PCR
- Xác định vi khuẩn Riemerella anatipestifer bằng phương pháp PCR với cặp mồi đặc hiệu được nêu trong bảng 2 và chu trình nhiệt được nêu trong bảng 5.
- Chuẩn bị mẫu và các bước tiến hành phản ứng PCR được quy định tại Phụ lục D.
7 Kết luận
Thủy cầm được kết luận mắc bệnh nhiễm trùng huyết khi có đặc điểm dịch tễ, triệu chứng lâm sàng, bệnh tích đặc trưng của bệnh và phân lập, xác định vi khuẩn bằng các phản ứng sinh hoá hoặc phương pháp PCR dương tính với vi khuẩn Riemerella anatipestifer.
Phụ lục A
(Quy định)
Phương pháp nhuộm Gram
A.1 Thuốc thử
A.1.1 Dung dịch tím tinh thể
| Tím tinh thể (C25H30N3Cl) | 2,0 g |
| Etanol 95 % (thể tích) | 20,0 ml |
| Amoni oxalat [(NH4)2C2O4.2H2O] | 0,8 g |
| Nước cất | 80,0 ml |
Hòa tan tím tinh thể trong etanol và hòa tan amoni oxalat trong nước. Sau đó, trộn 2 dung dịch này với nhau và lắc cho tan hết.
A.1.2 Dung dịch fuchsin đậm đặc
| Fuchsin basic (C20H20ClN3) | 1g |
| Etanol 95 % (thể tích) | 10 ml |
| Phenol (C6H6O) | 5g |
| Nước cất | 100 ml |
Khi dùng, pha loãng dung dịch fuchsin đậm đặc với nước theo tỉ lệ 1 : 10 (thể tích)
A.1.3 Dung dịch lugol
| Kali iodua (KI) | 2 g |
| Iốt (I2) tinh thể | 1 g |
| Nước cất | 200 ml |
Nghiền kali iodua và iốt tinh thể, cho nước vào từ từ và lắc cho tan.
A.1.4 Cồn axeton
| Etanol 95 % (thể tích) | 3 phần |
| Axeton (C2H6O) | 1 phần |
A.2 Cách tiến hành
Nhỏ dung dịch tím tinh thể lên tiêu bản, để từ 1 min đến 2 min sau đó rửa nước nhanh và để khô.
Nhỏ dung dịch lugol, để 1 min sau đó rửa nước nhanh và để khô.
Nhỏ cồn axeton, rửa nước thật nhanh và để khô.
Nhỏ dung dịch fuchsin loãng, để 1 min sau đó rửa nước rồi thấm khô hoặc để khô.
A.3 Xem tiêu bản
Nhỏ 1 giọt dầu vào tiêu bản và xem tiêu bản bằng kính hiển vi quang học (4.2).
Phụ lục B
(Quy định)
Môi trường nuôi cấy vi khuẩn Riemerella anatipestifer
B.1 Môi trường nước thịt
B.1.1 Nguyên liệu
Thành phần:
| Môi trường nước thịt (*) | 3,7 g |
| Huyết thanh (xem 3.4) | 5 ml |
| Cao nấm men 25 % (xem 3.5) | 5 ml |
| NADH 1 % (xem 3.6) | 1 ml |
| Nước cất vừa đủ | 100 ml |
| Chỉnh pH = 7,4 ± 0,2 ở 25 °C |
|
VÍ DỤ: dùng môi trường BHI (Brain Heart infusion) của hãng Merck (Cat. No. 110493) 1), thành phần cho môi trường nước thịt được nêu ở mục B.1.1.
B.1.2 Cách tiến hành
Chuẩn bị môi trường nước thịt (1) theo hướng dẫn của nhà sản xuất.
Vô trùng môi trường nước thịt ở 121 °C trong 20 min bằng nồi hấp (xem 4.3).
Đợi nhiệt độ của môi trường nước thịt đã vô trùng khoảng 40 °C thì bổ sung huyết thanh, cao nấm men và NADH.
Lắc đều và chia ra ống nghiệm (4.12) khoảng 5 ml / ống.
Kiểm tra vô trùng môi trường. Bảo quản môi trường ở điều kiện (xem 4.21).
B.2 Môi trường thạch máu
B.2.1 Nguyên liệu
Môi trường thạch máu: sử dụng môi trường thương mại, pha chế theo hướng dẫn của nhà sản xuất.
VÍ DỤ: dùng môi trường thạch máu cơ bản (Blood agar base) của hãng Merck (Cat. No. 110886) 2), thành phần cho môi trường thạch máu bổ sung được nêu ở mục B.2.1.
B.2.2 Cách tiến hành
Chuẩn bị môi trường thạch máu cơ bản theo hướng dẫn của nhà sản xuất.
Vô trùng môi trường thạch máu cơ bản ở 121 °C trong 20 min bằng nồi hấp (xem 4.3).
Đợi nhiệt độ của môi trường thạch máu cơ bản đã vô trùng khoảng 40 °C thì bổ sung máu.
Lắc đều và chia ra đĩa petri (4.13) khoảng 20 ml / đĩa.
Kiểm tra vô trùng môi trường. Bảo quản môi trường ở điều kiện (xem 4.21).
B.3 Môi trường thạch Sô-cô-la
Thành phần môi trường thạch Sô-cô-la:
| Môi trường thạch máu cơ bản (**) | 4g |
| Máu (xem 3.7) | 5 ml |
| Huyết thanh (xem 3.4) | 5 ml |
| Cao nấm men 25 % (xem 3.5) | 5 ml |
| NADH 1 % (xem 3.6) | 1 ml |
| Nước cất vừa đủ | 100 ml |
| Chỉnh pH = 7,4 ± 0,2 ở 25 °C |
|
Chuẩn bị môi trường thạch máu cơ bản (**) theo hướng dẫn của nhà sản xuất.
Môi trường thạch máu cơ bản sau khi đã vô trùng xong, để nhiệt độ môi trường giảm xuống khoảng 70 °C thì bổ sung máu (xem 3.7) vào. Duy trì nhiệt độ của môi trường này bằng bể ủ nhiệt (4.9) ở 70 °C trong 20 min và có lắc đều.
Sau đó để môi trường nguội xuống khoảng 40 °C bổ sung huyết thanh, cao nấm men và NAHD.
Lắc đều và chia ra đĩa petri (4.13) khoảng 20 ml / đĩa.
Kiểm tra vô trùng môi trường. Bảo quản môi trường ở điều kiện (xem 4.21).
B.4 Môi trường thạch MacConkey
B.4.1 Nguyên liệu
Thành phần:
| Môi trường thạch MacConkey | 5 g |
| Nước cất vừa đủ | 100 ml |
| Chỉnh pH = 7,4 ± 0,2 ở 25 °C |
|
VÍ DỤ: dùng môi trường thạch MacConkey (MacConkey agar) của hãng Merck (Cat. No. 105465) 3), thành phần cho môi trường thạch MacConkey được nêu ở mục B.4.1.
B.1.2 Cách tiến hành
Chuẩn bị môi trường thạch MacConkey (***) theo hướng dẫn của nhà sản xuất.
Vô trùng môi trường thạch MacConkey ở 121 °C trong 20 min bằng nồi hấp (xem 4.3).
Lắc đều và chia ra đĩa petri (4.13) khoảng 20 ml / đĩa.
Kiểm tra vô trùng môi trường. Bảo quản môi trường ở điều kiện 4 °C (xem 4.21).
Phụ lục C
(Quy định)
Xác định các đặc tính sinh hóa của vi khuẩn Riemerella anatipestifer
C.1 Môi trường và thuốc thử
C.1.1 Môi trường nước pepton
Chuẩn bị môi trường nước pepton theo hướng dẫn của nhà sản xuất.
C.1.2 Thuốc thử Kovac’s
C.1.2.1 Thành phần
| Paradimetyl aminobenzaldehyt | 5g |
| Cồn amyl (2-Metylbutan-2-ol) | 75 ml |
| Axit clohydric đặc | 25 ml |
C.1.2.2 Chuẩn bị
Trộn dung dịch paradimetyl aminobenzaldehyt vào cồn amyl cho tan hết và để trong tủ lạnh 4 °C. Thêm từ từ 5 ml đến 10 ml axit clohydric đặc, trộn đều rồi để tủ lạnh, sau đó tiếp tục bổ sung axit clohydric.
Bảo quản thuốc thử trong lọ tối màu, ở 4 °C.
CHÚ THÍCH: Có thể sử dụng thuốc thử Kovac’s thương mại và làm theo hướng dẫn của nhà sản xuất.
C.1.3 Thuốc thử H2O2, 3 % (thể tích)
C.1.4 Thuốc thử Tetrammethyl-P. phenylene diamin hydrochloride, 1 % (thể tích).
C.1.5 Môi trường nước pepton - đường
C.1.5.1 Thành phần
- Nước pepton.
- Dung dịch chỉ thị màu bromocrezol: cho 0,2 g bromocrezol vào 100 ml etanol 90 % (thể tích) và lắc cho tan hết.
- Dung dịch đường: glucose, sucrose, lactose, mannitol.
Pha glucose (hoặc sucrose, lactose, mannitol) thành dung dịch 10 % (thể tích) trong nước, hấp tiệt trùng môi trường bằng nồi hấp (4.3) ở 110 °C trong 15 min đến 20 min hoặc hấp cách quãng 3 lần ở 100 °C trong 30 min hoặc lọc qua màng lọc có kích thước lỗ lọc 0,45 μm.
C.1.5.2 Chuẩn bị
Cho 1 ml chỉ thị màu bromocrezol vào 100 ml môi trường nước pepton, chia ra các ống (4 ml mỗi ống). Vô trùng môi trường ở 121 °C trong 20 min bằng nồi hấp (xem 4.3). Chỉnh pH môi trường ở 6,8 ± 0,2.
Thêm 0,4 ml dung dịch glucose 10 % (thể tích) hoặc sucrose 10 % (thể tích) hoặc lactose 10 % (thể tích) hoặc mannitol 10 % (thể tích) vào ống chứa 4 ml môi trường pepton đã có chất chỉ thị.
C.1.6 Môi trường thạch urê
Có thể sử dụng môi trường urê cơ bản (urea agar base - Christensen). Pha chế môi trường và bổ sung urê theo hướng dẫn của nhà sản xuất.
C.1.7 Môi trường thạch lỏng kiểm tra khả năng di động
C.1.7.1 Thành phần
| Pepton | 10 g |
| Chất chiết thịt | 3 g |
| Natri clorua (NaCl) | 5 g |
| Thạch | 4 g |
| Gelatin | 80 g |
| Nước cất | 1000 ml |
C.1.7.2 Chuẩn bị
Hòa gelatin vào nước để 30 min, bổ sung các thành phần khác, đun cho tan hoàn toàn.
Chia ra các ống nghiệm (4.7), khoảng 6 ml cho mỗi ống nghiệm.
Vô trùng môi trường ở 115 °C trong 20 min bằng nồi hấp (xem 4.3).
C.1.8 Môi trường thạch sắt ba đường -TSI (Trip-sugar Iron agar)
Chuẩn bị môi trường thạch TSI theo hướng dẫn của nhà sản xuất.
Môi trường sau khi đồng nhất bằng cách đun sôi được chia ra các ống, 6 ml môi trường cho mỗi ống.
Vô trùng môi trường ở 121 °C trong 20 min bằng nồi hấp (xem 4.3).
Môi trường sau khi tiệt trùng được để nghiêng khoảng 30° để tạo được một phần thạch đứng và một phần thạch nghiêng.
C.2 Cách tiến hành
C.2.1 Phản ứng sinh indol
Dùng que cấy (4.14) lấy canh khuẩn hoặc khuẩn lạc của vi khuẩn nghi ngờ (xem 6.3.2) cấy vào môi trường nước pepton (C.1.1). Nuôi trong tủ ấm (4.1). Sau 24 h nuôi cấy, nhỏ từ 0,2 ml đến 0,3 ml dung dịch thuốc thử Kovac’s (C.1.2) vào môi trường, lắc nhẹ.
Đọc kết quả:
- Phản ứng dương tính (sinh indol): xuất hiện vòng màu đỏ phía trên môi trường.
- Phản ứng âm tính (không sinh indol): không xuất hiện vòng màu đỏ.
C.2.2 Phản ứng catalase
Nhỏ một giọt dung dịch H2O2 (C.1.3) lên phiến kính (4.17).
Dùng que cấy (4.14) lấy khuẩn lạc của vi khuẩn nghi ngờ (xem 6.3.2) cho vào giọt dung dịch H2O2.
Đọc kết quả sau 5 s:
- Phản ứng dương tính: có hiện tượng sủi bọt;
- Phản ứng âm tính: không có hiện tượng sủi bọt.
C.2.3 Phản ứng oxidase
Tiến hành trên giấy có tẩm dung dịch 1% Tetrammethyl-P. phenylene diamin hydrochloride.
Dùng que cấy (4.14) lấy canh khuẩn hoặc khuẩn lạc của vi khuẩn nghi ngờ (xem 6.3.2) phết lên mặt giấy đã thấm thuốc thử.
Đọc kết quả sau 30 s:
- Dương tính: tại chỗ phết khuẩn lạc có xuất hiện màu tím;
- Âm tính: không xuất hiện màu tím.
C.2.4 Kiểm tra đặc tính lên men đường
Dùng que cấy (4.14) lấy canh khuẩn hoặc khuẩn lạc của vi khuẩn nghi ngờ (xem 6.3.2) cấy vào ống môi trường nước pepton có đường glucose (hoặc sucrose, lactose, mannitol) (xem C.1.5).
Nuôi trong tủ ấm (4.1), đọc kết quả sau 24 h.
- Phản ứng dương tính: môi trường chuyển màu vàng;
- Phản ứng âm tính: môi trường không thay đổi màu.
C.2.5 Kiểm tra khả năng phân giải urê
Dùng que cấy (4.14) lấy canh khuẩn hoặc khuẩn lạc của vi khuẩn nghi ngờ (xem 6.3.2) cấy vào môi trường thạch urê (C.1.6). Nuôi trong tủ ấm (4.1), đọc kết quả sau 24 h.
- Phản ứng dương tính: môi trường chuyển sang màu hồng;
- Phản ứng âm tính: môi trường không chuyển màu.
C.2.6 Kiểm tra khả năng di động của vi khuẩn bằng môi trường thạch lỏng
Dùng que cấy (4.14) lấy canh khuẩn hoặc khuẩn lạc của vi khuẩn nghi ngờ (xem 6.3.2) cấy thẳng xuống gần đáy của ống nghiệm có môi trường thạch lỏng (C.1.7). Nuôi trong tủ ấm (4.1), đọc kết quả sau 24 h.
- Phản ứng dương tính (có khả năng di động): môi trường đục, không nhìn rõ đường cấy chích sâu;
- Phản ứng âm tính: môi trường trong và nhìn thấy đường cấy chích sâu.
C.2.7 Kiểm tra khả năng lên men đường, sinh H2S trên môi trường thạch TSI
Dùng que cấy (4.14) lấy canh khuẩn hoặc khuẩn lạc của vi khuẩn nghi ngờ (xem 6.3.2) cấy vào môi trường thạch TSI. Nuôi trong tủ ấm (4.1), sau 24 h đọc kết quả.
Lên men đường glucose:
- Phản ứng dương tính: phần đứng của môi trường thạch chuyển sang màu vàng;
- Phản ứng âm tính: phần đứng của môi trường thạch không chuyển màu.
Lên men đường lactose:
- Phản ứng dương tính: phần nghiêng của môi trường thạch chuyển sang màu vàng;
- Phản ứng âm tính: phần nghiêng của môi trường thạch không chuyển màu.
Khả năng sinh H2S:
- Phản ứng dương tính: đáy ống nghiệm có màu đen;
- Phản ứng âm tính: đáy ống nghiệm không có màu đen.
Phụ lục D
(Quy định)
Xác định vi khuẩn Riemerella anatipestifer bằng phương pháp PCR
D.1 Nguyên liệu PCR
D. 1.1 Taq PCR Master Mix Kit;
D.1.2 Cặp mồi (primers): mồi xuôi (669AF) và mồi ngược (669AR) (Bảng 2);
D.1.3 Nước tinh khiết không có nuclease;
D.1.4 Dung dịch đệm điện di: có thể dùng dung dịch đệm TAE (Tris - Borate - Ethylenediaminetetraacetic acid) hoặc TBE (Tris - Acetate - Ethylenediaminetetraacetic acid)
D.1.5 Chất nhuộm màu ADN;
VÍ DỤ: Chất nhuộm màu SYBR safe ADN gel stain của hãng Invitrogen; hoặc chất nhuộm màu Gel Red của hãng Biotium.
KHUYẾN CÁO: Chất nhuộm màu Ethidi bromua có thể gây ung thư nên khuyến cáo không sử dụng.
D.1.6 Loading dye (Đệm tải mẫu);
D.1.7 ADN (Acid Deoxyribo Nucleic) chuẩn (Ladder, marker), thang 100 bp;
D.1.8 Dung dịch đệm TE (Tris- etylendiamintetraaxetic acid).
D.2 Chuẩn bị mẫu
Mẫu kiểm tra: canh khuẩn hoặc khuẩn lạc nghi là vi khuẩn Riemerella anatipestifer (xem 6.3.2).
Mẫu đối chứng dương: chủng vi khuẩn đã được xác định là Riemerella anatipestifer hoặc sử dụng các chủng Riemerella anatipestifer chuẩn.
Tách chiết ADN
Tách chiết ADN bằng các kít thương mại đối với mẫu kiểm tra là huyễn dịch bệnh phẩm hoặc vi khuẩn thì các bước tiến hành theo hướng dẫn của nhà sản xuất.
Đối với vi khuẩn còn có thể tách chiết ADN bằng phương pháp sốc nhiệt.
Phương pháp sốc nhiệt tách chiết ADN: Lấy từ 3 khuẩn lạc đến 4 khuẩn lạc, hòa vào 100 μl nước vô trùng không chứa nuclease (nuclease free water). Đun sôi cách thủy trong 10 min rồi làm lạnh nhanh huyễn dịch trong đá 5 min. Ly tâm huyễn dịch bằng máy ly tâm (4.5) với gia tốc 12 000 g trong 4 min. Thu hoạch phần trong phía trên để thực hiện phản ứng PCR.
D.3 Chuẩn bị mồi
Mồi được chuẩn bị như sau:
- Chuẩn bị mồi gốc: mồi gốc ở trạng thái đông khô phải được ly tâm nhanh bằng máy li tâm (4.5) ở gia tốc 6 000 g trong 30 s để mồi lắng xuống đáy ống trước khi mở và hoàn nguyên. Lần đầu tiên nên dùng dung dịch đệm TE (B.1.8) để hoàn nguyên mồi ở nồng độ 100 μM / μl làm mồi gốc;
- Chuẩn bị mồi sử dụng ở nồng độ 20 μM / μl: pha loãng mồi gốc bằng nước tinh khiết không có nuclease (B.1.3).
VÍ DỤ: lấy 20 μl mồi gốc có nồng độ 100 μl và thêm 80 μl nước sẽ được mồi sử dụng có nồng độ 20 μM / μl
D.4 Tiến hành
Sử dụng cặp mồi đã được chuẩn bị (xem B.3). Hỗn hợp phản ứng được chuẩn bị trong ống 0,2 ml.
Sử dụng kít nhân gen theo hướng dẫn của nhà sản xuất.
VÍ DỤ: dùng kít nhân gen Taq PCR Mastermix kit Qiagen (Cat. No. 201443) 4), thành phần cho 1 phản ứng được nêu trong bảng 5.
Bảng D.1 - Thành phần của phản ứng PCR xác định vi khuẩn Riemerella anatipestifer
| Thành phần | Thể tích (μl) |
| Taq PCR Mastermix | 12,5 |
| Nước không có nuclease | 6,5 |
| Mồi xuôi 20 μM | 0,5 |
| Mồi ngược 20 μM | 0,5 |
| Tổng thể tích | 20,0 |
Chuyển 20 μl hỗn hợp nhân gen vào mỗi ống phản ứng.
- Mẫu đối chứng dương: cho 5 μl mẫu ADN của vi khuẩn Riemerella anatipestiter vào ống phản ứng.
- Mẫu đối chứng âm: cho 5 μl nước tinh khiết không có nuclease vào ống phản ứng.
- Mẫu bệnh phẩm: cho 5 μl mẫu ADN cần kiểm tra vào ống phản ứng.
CHÚ Ý:
- Phản ứng PCR phải bao gồm: mẫu bệnh phẩm, mẫu đối chứng dương, mẫu đối chứng âm.
- Mẫu và nguyên vật liệu cho phản ứng PCR cần đặt trong khay đá lạnh trong suốt quá trình chuẩn bị hỗn hợp phản ứng.
Tiến hành phản ứng PCR bằng máy nhân gen (4.6) với chu trình nhiệt như nêu trong bảng 5.
Bảng D.2 - Chu trình nhiệt xác định vi khuẩn Riemerella anatipestifer[4]
| Nhiệt độ | Thời gian | Số chu kỳ |
| 94 °C | 2 min | 1 vòng |
| 94 °C | 30 s | 35 vòng |
| 54 °C | 30 s | |
| 72 °C | 30 s | |
| 72 °C | 10 min | 1 vòng |
GHI CHÚ: [4] Theo tài liệu tham khảo “Evaluation of different diagnostic tools for the detection and identification of Riemerella anatipestifef”)
CHÚ Ý: Chu trình nhiệt và thời gian phản ứng có thể thay đổi tùy theo bộ kít nhân gen. Khi sử dụng các bộ kít khác nhau cần thực hiện theo hướng dẫn của nhà sản xuất.
D.5 Chạy điện di
Sản phẩm PCR được chạy điện di trên thạch agarose 1,5 % đến 2 % trong dung dịch đệm TAE hoặc TBE có bổ sung chất nhuộm màu (D.1.5). Cách pha chế thạch agarose và bổ sung chất nhuộm màu, sử dụng theo hướng dẫn của nhà sản xuất.
Cho 2 μl dung dịch loading dye vào 8 μl sản phẩm PCR, trộn đều cho vào từng giếng trên bản thạch. Cho 10 μl thang chuẩn (marker) vào một giếng.
Bản thạch được chạy điện di trong môi trường dung dịch đệm TAE hoặc TBE (tùy thuộc vào loại dung dịch đệm sử dụng khi pha thạch) ở bộ điện di (4.7), trong thời gian từ 20 min đến 30 min, ở 100 V.
D.6 Đọc kết quả
Phản ứng dương tính khi:
- Mẫu đối chứng dương có một vạch duy nhất đúng kích cỡ của sản phẩm.
- Mẫu đối chứng âm: không xuất hiện vạch.
- Mẫu kiểm tra có vạch giống mẫu đối chứng dương.
Phản ứng âm tính khi:
- Mẫu đối chứng dương có một vạch duy nhất đúng kích cỡ của sản phẩm.
- Mẫu đối chứng âm: không xuất hiện vạch.
- Mẫu kiểm tra không có vạch giống mẫu đối chứng dương.
Phụ lục E
(Tham khảo)
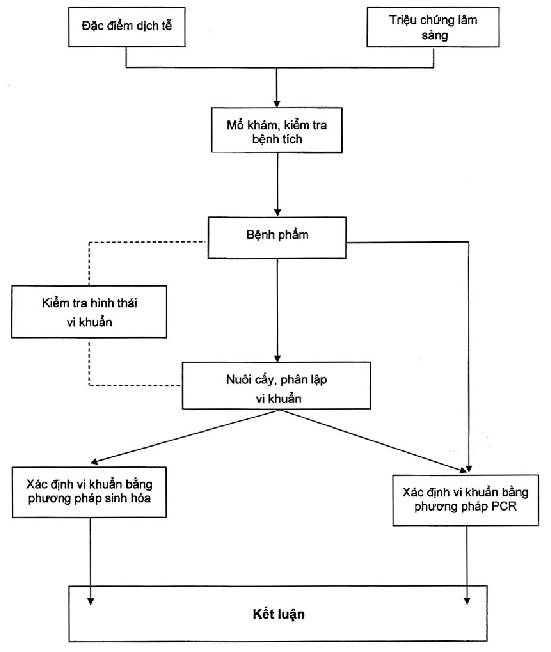
Sơ đồ chẩn đoán bệnh nhiễm trùng huyết ở thủy cầm
Thư mục tài liệu tham khảo
[1] Tirath S. Sandhu, 2008. Diseases of poultry, Chapter 19: Pasteurella and Other Respiratory Bacterial Infections - Riemerella anatipestifer infection. 12th Edition, Blackwell Publishing, p. 758 -764.
[2] JICA, 2003. Standard Diagnostic Manual for livestock diseases in Thailand. Chapter 74: Anatipestifer infection. Third edition, p.171-172.
[3] G. Kardos et al, 2007. Development of a novel PCR assay specific for Riemerella anatipestifer. Letters in Applied Microbiology, 44, p. 145 - 148.
[4] Dennis Rubbenstroth, Martin Ryll, Johannes Karl-Mark Knobloch, Bernd Ko”hler and Silke Rautenschlein, 2013. Evaluation of different diagnostic tools for the detection and identification of Riemerella anatipestifer. Avian Pathology, Vol.42, No.1, p.17 -26.
[5] Nguyễn Bá Hiên, Huỳnh Thị Mỹ Lệ, Lê Văn Lãnh, Đỗ Ngọc Thúy, 2011. Giáo trình bệnh truyền nhiễm thú y, trang 439 - 443.
1) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
2) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
3) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
4) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 8400-40:2016 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 8400-40:2016 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 8400-40:2016 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 8400-40:2016 DOC (Bản Word)