- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn TCVN 8400-55:2022 Bệnh động vật - Quy trình chẩn đoán - Phần 55: Bệnh u nhày ở thỏ
| Số hiệu: | TCVN 8400-55:2022 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
27/09/2022 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 8400-55:2022
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 8400-55:2022
TIÊU CHUẨN QUỐC GIA
TCVN 8400-55:2022
BỆNH ĐỘNG VẬT - QUY TRÌNH CHẨN ĐOÁN - PHẦN 55: BỆNH U NHÀY Ở THỎ
Animal diseases - Diagnostic procedure - Part 55: Myxomatosis in rabbit
Lời nói đầu
TCVN 8400-55:2022 do Chi cục Thú y vùng II - Cục Thú y biên soạn, Bộ Nông nghiệp và Phát triển nông thôn đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Bộ tiêu chuẩn TCVN 8400 Bệnh động vật- Quy trình chẩn đoán gồm các phần sau:
- TCVN 8400-1:2019, Phần 1: Bệnh lở mồm long móng;
- TCVN 8400-2:2010, Phần 2: Bệnh do vi khuẩn Streptococcus suis gây ra trên lợn;
- TCVN 8400-3:2010, Phần 3: Bệnh giun xoắn;
- TCVN 8400-4:2010, Phần 4: Bệnh Niu cát xơn;
- TCVN 8400-5:2011, Phần 5: Bệnh tiên mao trùng;
- TCVN 8400-6:2011, Phần 6: Bệnh xuất huyết thỏ;
- TCVN 8400-7:2011, Phần 7: Bệnh đậu cừu và đậu dê;
- TCVN 8400-8:2011, Phần 8: Bệnh nấm phổi do Aspergillus ở gia cầm;
- TCVN 8400-9:2011, Phần 9: Bệnh viêm gan vịt typ I;
- TCVN 8400-10:2022, Phần 10: Bệnh lao bò;
- TCVN 8400-11:2019, Phần 11: Bệnh dịch tả vịt;
- TCVN 8400-12:2011, Phần 12: Bệnh bạch lỵ và thương hàn ở gà;
- TCVN 8400-13:2019, Phần 13: Bệnh sảy thai truyền nhiễm do Brucella;
- TCVN 8400-14:2011, Phần 14: Bệnh tụ huyết trùng ở trâu bò;
- TCVN 8400-15:2019, Phần 15: Bệnh xoắn khuẩn do Leptospira;
- TCVN 8400-16:2011, Phần 16: Bệnh phù ở lợn do vi khuẩn E. coli;
- TCVN 8400-17:2011, Phần 17: Bệnh do Staphylococcus aureus ở gà;
- TCVN 8400-18:2014, Phần 18: Bệnh phù đầu gà (coryza);
- TCVN 8400-19:2014, Phần 19: Bệnh phó thương hàn lợn;
- TCVN 8400-20:2014, Phần 20: Bệnh đóng dấu lợn;
- TCVN 8400-21:2014, Phần 21: Hội chứng rối loạn sinh sản và hô hấp ở lợn (PRRS);
- TCVN 8400-22:2014, Phần 22: Bệnh giả dại ở lợn;
- TCVN 8400-23:2014, Phần 23: Bệnh ung khí thán;
- TCVN 8400-24:2014, Phần 24: Bệnh viêm phế quản truyền nhiễm;
- TCVN 8400-25:2014, Phần 25: Bệnh cúm lợn;
- TCVN 8400-26:2014, Phần 26: Bệnh cúm gia cầm H5N1;
- TCVN 8400-27:2014, Phần 27: Bệnh sán lá gan;
- TCVN 8400-28:2014, Phần 28: Bệnh viêm ruột hoại tử do Clostridium perfringens;
- TCVN 8400-29:2015, Phần 29: Bệnh Lympho leuko ở gà;
- TCVN 8400-30:2015, Phần 30: Bệnh Marek ở gà;
- TCVN 8400-31:2015, Phần 31: Bệnh tụ huyết trùng gia cầm;
- TCVN 8400-32:2015, Phần 32: Bệnh gumboro ở gia cầm;
- TCVN 8400-33:2015, Phần 33: Bệnh lê dạng trùng ở trâu bò;
- TCVN 8400-34:2015, Phần 34: Bệnh biên trùng ở trâu bò;
- TCVN 8400-35:2015, Phần 35: Bệnh Theileria ở trâu bò;
- TCVN 8400-36:2015, Phần 36: Hội chứng suy mòn ở lợn sau cai sữa do Circo vi rút typ 2;
- TCVN 8400-37:2015, Phần 37: Bệnh viêm phổi địa phương ở lợn;
- TCVN 8400-38:2015, Phần 38: Bệnh tiêu chảy ở lợn do Corona vi rút;
- TCVN 8400-39:2016, Phần 39: Bệnh viêm đường hô hấp mãn tính ở gà;
- TCVN 8400-40:2016, Phần 40: Bệnh nhiễm trùng huyết ở thủy cầm do vi khuẩn Riemerella anatipestifer gây ra;
- TCVN 8400-41:2019, Phần 41: Bệnh dịch tả lợn châu Phi;
- TCVN 8400-42:2019, Phần 42: Bệnh dịch tả loài nhai lại nhỏ;
- TCVN 8400-43:2019, Phần 43: Bệnh lưỡi xanh;
- TCVN 8400-44:2019, Phần 44: Bệnh roi trùng Trichomonosis;
- TCVN 8400-45:2019, Phần 45: Bệnh gạo lợn, bệnh gạo bò;
- TCVN 8400-46:2019, Phần 46: Bệnh dại;
- TCVN 8400-47:2019, Phần 47: Bệnh dịch tả lợn cổ điển;
- TCVN 8400-48:2020, Phần 48: Bệnh tiêu chảy có màng nhày do vi rút ở bò;
- TCVN 8400-49:2020, Phần 49: Bệnh viêm mũi khí quản truyền nhiễm ở bò;
- TCVN 8400-50:2020, Phần 50: Bệnh viêm não Nhật Bản;
- TCVN 8400-51:2020, Phần 51: Bệnh viêm phổi, màng phổi truyền nhiễm ở bò;
- TCVN 8400-52:2022, Phần 52: Bệnh nhiệt thán ở gia súc;
- TCVN 8400-53:2022, Phần 53: Bệnh viêm phổi hóa mủ do vi khuẩn Ornithobacterium rhinotracheale ở gà;
- TCVN 8400-54:2022, Phần 54: Bệnh tỵ thư ở gia súc;
- TCVN 8400-55:2022, Phần 55: Bệnh u nhày ở thỏ.
BỆNH ĐỘNG VẬT - QUY TRÌNH CHẨN ĐOÁN - PHẦN 55: BỆNH U NHÀY Ở THỎ
Animal diseases - Diagnostic procedure - Part 55: Myxomatosis in rabbit
CẢNH BÁO - Việc áp dụng tiêu chuẩn này có thể liên quan đến các vật liệu, thiết bị và các thao tác gây nguy hiểm. Tiêu chuẩn này không thể đưa ra được hết tất cả các vấn đề an toàn liên quan đến việc sử dụng chúng. Người sử dụng tiêu chuẩn này phải tự thiết lập các thao tác an toàn sức khỏe thích hợp và xác định khả năng áp dụng các giới hạn quy định trước khi sử dụng tiêu chuẩn.
1 Phạm vi áp dụng
Tiêu chuẩn này quy định quy trình chẩn đoán bệnh u nhày ở thỏ do virus Myxoma gây ra.
2 Tài liệu viện dẫn
Tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các bản sửa đổi, bổ sung (nếu có).
TCVN 8402:2010, Bệnh động vật - Quy trình mổ khám.
3 Thuật ngữ, định nghĩa và các từ viết tắt
3.1 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng các thuật ngữ và định nghĩa sau:
3.1.1
Bệnh u nhày ở thỏ (Myxomatosis)
Bệnh truyền nhiễm xảy ra trên thỏ ở mọi lứa tuổi và tính biệt, do virus Myxoma gây ra với đặc trưng là viêm sưng mí mắt, viêm kết mạc, rối loạn hô hấp và hình thành các khối u nhày trên da.
3.1.2
Virus Myxoma (Myxoma virus)
Virus Myxoma thuộc phân họ Chordopoxviridae, họ Poxviridae, chi Leporipoxvirus; virus có hệ gen là ADN mạch đôi, có vỏ bọc, bao gồm khoảng 170 gen trong đó có khoảng 70 gen có vai trò điều hòa miễn dịch và liên quan đến các yếu tố tương tác với vật chủ.
CHÚ THÍCH: Độc lực của virus được chia làm 5 nhóm, từ I đến V, độc lực giảm dần theo thứ tự.
3.2 Các từ viết tắt
| Từ viết tắt | Tên tiếng Anh | Tên tiếng Việt |
| ADN | Deoxyribonucleic acid | Axit deoxyribonucleic |
| AGID | Agar gel immunodiffusion | Khuếch tán miễn dịch gel trong thạch |
| CPE | Cytopathic effect | Bệnh tích tế bào |
| Ct | Threshold cycle | Chu kỳ ngưỡng |
| DMSO | Dimethyl sulfoxide | Dimetyl sulfoxide |
| DPBS | Dulbecco's phosphate buffered saline | Muối đệm phosphat Dulbecco |
| EDTA | Ethylenediaminetetraacetic acid | Axit etylendiamintetraaxetic |
| ELISA | Enzyme-linked immunosorbent assay | Phản ứng miễn dịch hấp thụ liên kết enzym |
| FCS | Fetal calf serum | Huyết thanh thai bê |
| MEM | Minimum essential medium | Môi trường thiết yếu tối thiểu |
| NC | Negative control | Đối chứng âm |
| OD | Optical density | Mật độ quang |
| PBS | Phosphate buffered saline | Muối đệm phosphat |
| PC | Positive control | Đối chứng dương |
| PCR | Polymerase Chain reaction | Phản ứng chuỗi polymerase |
| Realtime PCR | Realtime polymerase Chain reaction | Phản ứng chuỗi polymerase thời gian thực |
| RK-13 | Rabbit Kidney-13 | Tế bào thận thỏ 13 |
| TAE | Tris-acetate-ethylenediaminetetraacetic acid | Tris-axetat-axit etylendiamintetraaxetic |
| TBE | Tris-borate-ethylenediaminetetraacetic acid | Tris-borat-axit etylendiamintetraaxetic |
| TE | Tris-ethylendiamintetraacetic acid | Tris-axit etylendiamintetraaxetic |
4 Thuốc thử và vật liệu thử
Chỉ sử dụng các thuốc thử tinh khiết phân tích, sử dụng nước cất, nước khử khoáng hoặc nước có độ tinh khiết tương đương, trừ khi có quy định khác.
4.1 Thuốc thử và vật liệu chung
4.1.1 Etanol, từ 70 % (thể tích) đến etanol tuyệt đối
4.1.2 Nước muối sinh lý (natri clorua 0,9 %), vô trùng
4.1.3 Dung dịch đệm PBS (xem A.1, Phụ lục A)
4.1.4 Dung dịch axit clohydric (HCl), 1 N
4.1.5 Dung dịch natri hydroxit (NaOH), 1 N
4.1.6 Nước cất, khử ion
4.2 Thuốc thử và vật liệu thử dùng cho phương pháp PCR và realtime PCR
4.2.1 Kit tách chiết ADN
4.2.2 Kit nhân gen cho phản ứng PCR
4.2.2 Kít nhân gen cho phản ứng realtime PCR
4.2.3 Mồi xuôi, mồi ngược cho phản ứng PCR
4.2.4 Mồi xuôi, mồi ngược và mẫu dò cho phản ứng realtime PCR
4.2.5 Mẫu chuẩn dương, được chứng nhận là dương tính, hoặc ADN chuẩn dương tách chiết từ virus Myxoma có giá trị Ct (Chu kỳ ngưỡng đã biết trước).
4.2.6 Thạch agarose
4.2.7 Đệm TBE 1 X hoặc TAE 1 X
4.2.8 Đệm tải mẫu (Loading dye)
4.2.9 Thang ADN chuẩn (Maker/ladder)
4.2.10 Nước tinh khiết, không có Rnase và DNase
4.2.11 Chất nhuộm màu ADN
4.3 Nguyên liệu và thuốc thử dùng cho phân lập virus
4.3.1 Tế bào RK-13
4.3.2 Virus Myxoma
4.3.3 Dung dịch MEM
4.3.4 FCS
4.3.5 Dung dịch kháng sinh Penicilin/streptomycin
4.4 Nguyên liệu và vật liệu thử dùng cho phương pháp huyết thanh học
4.4.1 Kít ELISA
4.4.2 Thạch Noble
4.4.3 EDTA
5 Thiết bị, dụng cụ
Sử dụng các thiết bị, dụng cụ thông thường của phòng thử nghiệm sinh học và các thiết bị, dụng cụ sau
5.1 Thiết bị, dụng cụ chung
5.1.1 Tủ lạnh âm sâu, có thể duy trì nhiệt độ từ - 20 °C đến - 80 °C
5.1.2 Tủ lạnh, có thể duy trì nhiệt độ từ 2 °C đến 8 °C
5.1.3 Buồng cấy an toàn sinh học cấp II
5.1.4 Máy lắc trộn (Votex).
5.1.5 Máy đồng nhất mẫu, hoặc cối chày sứ, vô trùng
5.1.6 Panh, kéo, vô trùng
5.1.7 Bể điều nhiệt, có thể duy trì nhiệt độ 37 °C, 56 °C
5.1.8 Ống nghiệm chịu nhiệt, đáy hình nón 2 ml, 15 ml, 50 ml, sạch và vô trùng
5.1.9 Tăm bông, vô trùng
5.1.10 Bơm tiêm, loại 5 ml và kim tiêm loại 24 G, vô trùng
5.2 Thiết bị, dụng cụ dùng cho phương pháp realtime PCR/PCR
5.2.1 Máy PCR
5.2.2 Máy realtime-PCR
5.2.3 Máy ly tâm, có thể đạt tốc độ tới 14 000 rpm
5.2.4 Máy ly tâm lắng, có thể đạt tốc độ 8 000 rpm
5.2.5 Máy đọc gel
5.2.6 Bể điện di, khay điện di
5.2.7 Nguồn điện di
5.2.8 Lò vi sóng
5.2.9 Ống PCR, 0,2 ml, không có RNase và DNase
5.2.10 Ống eppendorf, không có RNase và DNase
5.3 Thiết bị, dụng cụ dùng cho phân lập virus
5.3.1 Kính hiển vi đảo ngược
5.3.2 Tủ ấm, có chứa 5 % CO2, duy trì được ở 37 °C
5.3.3 Chai nuôi tế bào, có tiết diện 25 cm2
5.3.4 Màng lọc, có kích thước lỗ lọc 0,45 μm
5.4 Thiết bị, dụng cụ dùng cho phương pháp huyết thanh học
5.4.1 Máy đọc ELISA, có thể đọc đĩa ở bước sóng 450 nm
5.4.2 Thiết bị ủ mẫu, có thể duy trì nhiệt độ ở 56 °C
5.4.3 Khuôn đục giếng thạch, đường kính giếng 6 mm
5.4.4 Đĩa lồng petri, đường kính 10 mm, sạch và vô trùng
5.4.5 Chai thủy tinh, 150 ml, sạch và vô trùng.
6 Chẩn đoán lâm sàng
6.1 Đặc điểm dịch tễ
- Bệnh u nhày xảy ra trên các loài thỏ, ở mọi lửa tuổi và tính biệt. Thỏ hoang dã được coi là động vật mang trùng. Bệnh phân bố rộng rãi trên các vùng lãnh thổ, đặc biệt là khu vực châu Âu, Nam Mỹ và châu Úc.
- Đường truyền lây: Các loài côn trùng hút máu như muỗi, ve, bọ chét là loài trung gian mang virus. Virus không nhân lên trong các loài côn trùng. Côn trùng mang virus như yếu tố cơ học vận chuyển mầm bệnh làm lây lan virus trong quần thể thỏ. Bệnh có thể lây trực tiếp từ con bệnh sang con khỏe qua đường hô hấp, hoặc tiếp xúc trực tiếp đối với chất tiết của con bệnh.
- Tỷ lệ mắc bệnh cao, tỷ lệ chết có thể lên tới 100 % tùy thuộc vào độc lực của chủng virus gây bệnh.
6.2 Triệu chứng lâm sàng
Bệnh được chia thành hai thể: Thể u nhày và thể hô hấp.
- Thể u nhày: Bệnh ở thể này thường do bị lây nhiễm qua vết cắn của côn trùng, gây nên các tổn thương trên da đặc trưng, đặc biệt là các vùng da mỏng như mí mắt, tai, bẹn. Virus tác động gây rối loạn chức năng các cơ quan và suy giảm miễn dịch, dẫn đến nhiễm trùng kế phát.
Triệu chứng lâm sàng phụ thuộc vào độc lực của virus gây bệnh. Khi thỏ bị nhiễm virus nhóm I (có độc lực mạnh nhất), tại vị trí nhiễm trùng xuất hiện triệu chứng viêm, sưng to và bị lở loét. Mí mắt sưng, viêm kết mạc và niêm mạc mắt. Vùng mặt và tai sưng to, tai bị dày lên và sưng phù vùng sinh dục. Mũi có nhiều dịch nhày dẫn đến khó thở. Sau 6 ngày đến 7 ngày thỏ bị nhiễm virus, các tổn thương trên da xuất hiện và thỏ chết trong khoảng thời gian 8 ngày đến 15 ngày.
Khi thỏ bị nhiễm virus có độc lực thấp hơn, bệnh tiến triển chậm hơn, các dấu hiệu lâm sàng giống nhau nhưng bệnh nhẹ hơn. Thỏ bệnh sống sót có thể bị nhiễm trùng kế phát đường hô hấp, viêm phổi làm tăng tỷ lệ chết của bệnh.
- Thể hô hấp: Các dấu hiệu lâm sàng của thể hô hấp nhẹ hơn so với thể u nhày và thường xảy ra trên thỏ nuôi ở trang trại. Các tổn thương trên da ít hơn, mí mắt sưng và phù, viêm kết mặc mắt và viêm mũi. Thỏ dễ bị nhiễm trùng kế phát đường hô hấp, làm bệnh trầm trọng hơn.
6.3 Bệnh tích
- Thỏ chết vì bệnh u nhày thường có các bệnh tích đặc trưng là phù quanh mũi, miệng, hậu môn và cơ quan sinh dục.
- Ban đỏ mí mắt, viêm bờ mi, viêm kết mạc. Tiết dịch mắt và mũi nhiều. Trên da có nhiều các khối u nhày.
- Phổi bị viêm và xuất huyết, xung huyết và phù ở các phế nang.
- Hạch lympho sưng to, có hiện tượng tắc nghẽn và xuất huyết các cơ quan nội tạng.
- Thoái hóa và hoại tử, xuất huyết cơ tim.
- Tăng sinh nguyên bào sợi và các tế bào bạch cầu đơn nhân trong lớp hạ bì. Tăng sản thượng bì và thoái hóa không bào.
6.4 Chẩn đoán phân biệt
- Bệnh do Herpesvirrus trên thỏ: Bệnh có tỷ lệ chết cao, đầu sưng to, viêm kết mạc và có hiện tượng xuất huyết trên da.
- Bệnh xuất huyết thỏ: Bệnh do Calicivirus gây ra, thỏ mắc bệnh có biểu hiện chết nhanh và xuất huyết nặng ở gan, khí quản và phổi. Xem thêm TCVN 8400-6.
- Bệnh tụ huyết trùng thỏ: Bệnh do vi khuẩn Pasteurella multocida gây ra với triệu chứng lâm sàng của bệnh là gầy yếu, kém ăn, sốt cao 41 °C đến 42 °C, khó thở, kết mạc mắt đỏ, chảy nước mũi có lẫn dịch nhờn. Không có hiện tượng sưng và xuất hiện các khối u trên da.
- Viêm kết mạc do vi khuẩn ở thỏ: Thỏ mắc bệnh xuất hiện các triệu chứng như chảy nhiều nước mắt, niêm mạc mắt sưng đỏ, tiết dịch. Thỏ thường lấy chân để dụi mắt khiến mắt càng bị nhiễm khuẩn nặng thêm. Không có tổn thương và hình thành khối u trên da. Bệnh điều trị được bằng kháng sinh.
- Bệnh u xơ trên thỏ do Shope fibroma virus gây ra với triệu chứng xuất hiện các khối u xơ lành tính trên da và hiếm khi gây chết thỏ.
7 Chẩn đoán trong phòng thí nghiệm
7.1 Lấy mẫu
7.1.1 Mẫu dịch tiết
Trong trường hợp nghi ngờ con vật mắc bệnh ở thể hô hấp, dùng tăm bông (5.1.9) lấy dịch mũi và dịch mắt, đặt tăm bông vào trong ống nghiệm 15 ml (5.1.8) chứa dung dịch PBS (xem A.1, Phụ lục A)
7.1.2 Mẫu mô
Trong trường hợp mổ khám động vật nghi mắc bệnh, thực hiện theo TCVN 8402:2010.
Dùng pank, kéo (5.1.6) lấy các mẫu bệnh phẩm bao gồm: các khối u trên da, hạch lâm ba, phổi, gan, lách, thận cho vào ống nghiệm 50 ml (5.1.8).
7.1.3 Mẫu huyết thanh
Sát trùng vị trí lấy máu bằng cồn 70°, dùng bơm tiêm (5.1.10) lấy khoảng 2 ml đến 3 ml máu từ tĩnh mạch. Sau khi lấy, kéo pittông để tạo khoảng trống, ghi ký hiệu mẫu trên cả pittông và thành ống bơm tiêm rồi đặt nằm nghiêng 45° trong hộp đựng mẫu, để đông máu trong 30 min đến 45 min ở nhiệt độ thường, tránh ánh nắng trực tiếp.
7.2 Bảo quản mẫu
Mẫu bệnh phẩm (xem 7.1) phải được bao gói bằng dụng cụ vô trùng, bảo quản ở nhiệt độ từ 2 °C đến 8 °C trong thùng bảo ôn, vận chuyển đến phòng thí nghiệm trong vòng không quá 24 h. Trong phòng thí nghiệm, nếu chưa xét nghiệm ngay, mẫu phải được giữ trong tủ lạnh âm sâu - 80 °C (5.1.1)
CHÚ THÍCH: Tất cả các mẫu phải được dán nhãn, ghi mã kí hiệu và gửi kèm theo Phiếu gửi mẫu bệnh phẩm và các thông tin dịch tễ, triệu chứng lâm sàng và bệnh tích của ca bệnh.
7.3 Phát hiện virus Myxoma
7.3.1 Phát hiện virus Myxoma bằng phương pháp phân lập virus trên môi trường tế bào
7.3.1.1 Xử lý mẫu
- Mẫu dịch tiết (7.1.1) được trộn đều bằng máy lắc (5.1.4), để ở nhiệt độ phòng trong 30 min. Ly tâm với tốc độ 2 500 rpm trong 5 min đến 10 min. Dùng bơm tiêm (5.1.10) hút 1 ml dịch nổi phía trên, lọc qua mảng lọc (5.3.4). Lưu mẫu trong ống nghiệm 2 ml vô trùng (5.1.8).
- Mẫu mô (7.1.3) được đồng nhất trong cối chày sứ hoặc máy đồng nhất mẫu (5.1.5) với dung dịch MEM (4.3.3) có bổ sung kháng sinh tạo thành hỗn dịch 10 %, ly tâm với tốc độ 2 500 rpm trong 5 min đến 10 min. Lấy 1 ml dịch nổi và lọc qua màng lọc (5.3.4). Lưu mẫu trong ống nghiệm 2 ml (5.1.8).
7.3.1.2 Cách tiến hành
Bước 1: Chuẩn bị tế bào RK-13
- Rã đông nhanh tế bào RK-13 trong bể điều nhiệt ở 37 °C (5.1.7).
- Chuyển hỗn hợp tế bào vào ống ly tâm 50 ml vô trùng (5.1.8) chứa sẵn 10 ml môi trường phát triển tế bào MEM.
- Trộn đều bằng pipet, ly tâm với tốc độ 200 g trong 5 min ở nhiệt độ phòng. Loại bỏ phần dịch nổi phía trên.
- Bổ sung 5 ml dung dịch MEM có 10 % FCS (A.2.1, Phụ lục A) vào ống, trộn đều bằng pipet.
- Hút chuyển dung dịch này vào chai nuôi tế bào 25 cm2. Ủ trong tủ ấm có 5 % CO2 (5.3.2).
Quan sát sự phát triển của tế bào hàng ngày dưới kính hiển vi đảo ngược (5.3.1). Sau từ 2 ngày đến 4 ngày sẽ thu được một thảm tế bào. Khi tế bào bao phủ khoảng 80 % chai nuôi cấy thì dùng cho phân lập virus.
Bước 2: Gây nhiễm
- Hút 0,2 ml dung dịch mẫu đã được xử lý (xem 7.3.1.1) vào chai tế bào 1 lớp 25 cm2 đã được chuẩn bị tại bước 1.
- Ủ trong tủ ấm (5.3.2) ở 37 °C trong 1 h. Rửa thảm tế bào bằng 5 ml dung dịch MEM (4.3.3), lặp lại 2 lần
- Bổ sung 5 ml môi trường nuôi tế bào MEM chứa kháng sinh (xem A.2.1, Phụ lục A). Ủ ở 37 °C trong tủ ấm có 5 % CO2 (5.3.2 ) trong 7 ngày.
- Kiểm tra bệnh tích tế bào (CPE) hàng ngày bằng kính hiển vi đảo ngược (5.3.1).
7.3.1.3 Đánh giá kết quả
- Bệnh tích tế bào thường xuất hiện trong khoảng 24 h đến 48 h sau khi nuôi cấy, có khi lên tới 7 ngày tùy thuộc vào độc lực và chủng virus gây bệnh. CPE có đặc điểm là các tế bào RK-13 tròn to lên, bị dung giải và tách khỏi lớp thảm tế bào, sau đó tất cả tế bào đều bị ảnh hưởng và tách khỏi chai.
- Trong trường hợp quan sát thấy CPE, tiến hành thu hoạch hết hỗn dịch trong chai nuôi tế bào vào ống ly tâm 50 ml (5.1.8), thu dịch nuôi cấy vào ống nghiệm, để đông lạnh rồi rã đông lặp lại 3 lần (đông lạnh dịch nuôi cấy 30 min ở nhiệt độ - 80 °C, rã đông 20 min ở nhiệt độ phòng), đem ly tâm thu dịch nổi để xác định virus bằng phương pháp realtime PCR hoặc PCR.
- Khẳng định virus bằng phương pháp realtime PCR (xem 7.3.2) hoặc PCR (xem 7.3.3)
+ Nếu kết quả realtime PCR/PCR dương tính thì kết luận có virus Myxoma trong mẫu,
+ Nếu kết quả realtime PCR/PCR âm tính, tiến hành phân lập lần 2.
- Trong trường hợp không quan sát thấy bệnh tích tế bào trong 7 ngày nuôi cấy, thu hoạch hỗn dịch tế bào nuôi cấy lần 1 vào ống ly tâm 50 ml (5.1.8), thực hiện đông lạnh và rã đông lặp lại 3 lần, ly tâm với tốc độ 1 500 rpm trong 1 min, thu lấy dịch nổi để nuôi cấy lại lần 2 trên chai tế bào mới. Theo dõi bệnh tích tế bào hàng ngày, nếu trong 7 ngày không xuất hiện bệnh tích tế bào thì kết luận mẫu âm tính với virus Myxoma.
7.3.2 Phát hiện virus Myxoma bằng phương pháp realtime PCR
7.3.2.1 Xử lý mẫu
- Mẫu dịch tiết: Đồng nhất mẫu dịch tiết (xem 7.1.1) bằng máy lắc trộn (5.1.4). Loại bỏ tăm bông, ly tâm ống mẫu với tốc độ 2 500 rpm trong 10 min, loại bỏ cặn thu lấy dịch nổi phía trên vào ống 2 ml (5.1.8) để làm xét nghiệm.
- Mẫu mô (xem 6.1.3) được cắt nhỏ rồi đồng nhất bằng máy đồng nhất hoặc cối chày sứ vô trùng (5.1.5) với dung dịch PBS (xem A.1, Phụ lục A) để thu được huyễn dịch 10 %. Cho huyễn dịch vào ống ly tâm 15 ml, đặt vào máy ly tâm (5.2.3), ly tâm với tốc độ 2 500 rpm trong 10 min. Thu lấy dịch nổi phía trên cho vào ống 2 ml (5.1.8).
7.3.2.2 Tách chiết ADN
- Chiết tách ADN từ huyễn dịch (xem 7.3.2.1) được bằng các kít thương mại theo chỉ dẫn của nhà sản xuất (tham khảo Phụ lục C) và bảo quản mẫu ADN ở 4 °C nếu xét nghiệm ngay, hoặc bảo quản - 20 °C trong thời gian dài.
7.3.2.3 Chuẩn bị mồi, mẫu dò
Phản ứng khuếch đại được thực hiện trong máy nhân gen theo phương pháp realtime PCR phát hiện đoạn gen M0005L của tất cả các chủng virus Myxoma. Trình tự cặp mồi xuôi, mồi ngược và mẫu dò (xem Bảng D.1, Phụ lục D).
Chuẩn bị mồi như sau:
- Chuẩn bị mồi gốc: Mồi gốc và mẫu dò gốc ở trạng thái đông khô phải được ly tâm với tốc độ 8 000 rpm trong 30 s để mồi lắng xuống đáy ống trước khi mở và hoàn nguyên. Lần đầu tiên dùng dung dịch đệm TE để hoàn nguyên mồi ở nồng độ 100 pM làm mồi gốc và mẫu dò gốc.
- Chuẩn bị mồi, mẫu dò làm việc:
+ Mồi sử dụng được dùng ở nồng độ 20 μM: Lấy 20 μl mồi gốc pha với 80 μI nước (4.2.10).
+ Mẫu dò được sử dụng ở nồng độ 6 μM: Lấy 6 μl mẫu dò gốc pha với 94 μl nước (4.2.10).
7.3.2.4 Tiến hành phản ứng realtime PCR
Sử dụng cặp mồi, mẫu dò đã chuẩn bị (xem 7.3.2.3) và bộ kít thương mại, pha hỗn hợp nhân gen (Master mix) và cài đặt chu trình nhiệt theo hướng dẫn của nhà sản xuất. Lượng hỗn hợp nhân gen dùng cho một phản ứng (xem Bảng D.2, Phụ lục D).
Sau khi chuẩn bị xong hỗn hợp nguyên liệu:
- Hỗn hợp nhân gen: Cho 20 μl hỗn hợp nguyên liệu vào mỗi ống PCR 0,2 ml (5.2.9).
- Đối chứng dương: Cho 5 μl ADN chuẩn dương (4.2.5) vào ống PCR đã có sẵn hỗn hợp nhân gen
- Đối chứng âm: Cho 5 μI nước (4.2.10) vào ống PCR đã có sẵn hỗn hợp nhân gen
- Mẫu xét nghiệm: Cho 5 μl ADN vừa tách chiết (7.3.2.2) vào ống PCR đã có sẵn hỗn hợp nhân gen
- Ly tâm nhẹ cho hỗn hợp không bám trên thành ống
- Đặt ống PCR vào máy realtime PCR (5.2.2)
- Chạy chu trình nhiệt phản ứng (xem Bảng D.3, Phụ lục D).
LƯU Ý: Phản ứng Realtime PCR phải bao gồm: mẫu thử, mẫu đối chứng dương, mẫu đối chứng âm. Mẫu và nguyên vật liệu cho phản ứng Realtime PCR cần đặt trong khay đá lạnh trong suốt quá trình chuẩn bị hỗn hợp phản ứng.
7.3.2.5 Đọc kết quả
Phản ứng được công nhận: Mẫu đối chứng dương tính (được chuẩn độ trước) phải có giá trị Ct tương đương giá trị Ct đã biết (± 2 Ct), mẫu đối chứng âm không có Ct.
Với điều kiện phản ứng trên:
1) Mẫu có giá trị Ct ≤ 40 được coi là dương tính.
2) Mẫu không có giá trị Ct là âm tính.
3) Mẫu có giá trị 40 < Ct ≤ 45 được coi là nghi ngờ.
Những mẫu nghi ngờ này cần được xét nghiệm lại lần 2 hoặc xét nghiệm bằng phương pháp khác có độ nhạy và độ chính xác cao hơn để khẳng định và đưa ra kết luận cuối cùng.
7.3.3 Phát hiện virus Myxoma bằng phương pháp PCR
7.3.3.1 Xử lý mẫu
Thực hiện theo 7.3.2.1.
7.3.3.2 Tách chiết ADN
Thực hiện theo 7.3.2.2.
7.3.3.3 Chuẩn bị mồi
Phương pháp PCR sử dụng 03 cặp mồi để phát hiện và phân biệt các chủng virus gây bệnh và chủng virus vắc xin. Tùy thuộc vào đặc điểm dịch tễ cụ thể của từng ca bệnh và mục đích xét nghiệm mà lựa chọn cặp mồi cho phù hợp.
+ Cặp mồi M071F/R: Phát hiện tất cả các chủng virus Myxoma.
+ Cặp mồi VAX-F/M144R: Phát hiện các chủng virus vắc xin.
+ Cặp mồi M140F/R: Phát hiện chủng virus gây bệnh thực địa
Chuẩn bị mồi: xem 7.3.2.3.
7.3.3.4 Tiến hành phản ứng PCR
Sử dụng cặp mồi đã chuẩn bị (xem 7.3.3.3) và bộ kít thương mại, pha hỗn hợp nhân gen (Master mix) và cài đặt chu trình nhiệt theo hướng dẫn của nhà sản xuất. Lượng hỗn hợp nhân gen dùng cho một phản ứng (xem Bảng E.2, Phụ lục E).
Sau khi chuẩn bị xong hỗn hợp nguyên liệu:
- Hỗn hợp nhân gen: Cho 18 μl hỗn hợp nhân gen vào ống PCR 0,2 ml (5.2.9).
- Đối chứng dương: Cho 2 μl ADN chuẩn dương (4.2.5) vào ống PCR đã có sẵn hỗn hợp nhân gen
- Đối chứng âm: Cho 2 μl nước (4.2.10) vào ống PCR đã có sẵn hỗn hợp nhân gen
- Mẫu xét nghiệm: Cho 2 μl ADN vừa tách chiết (7.3.2.2) vào ống PCR đã có sẵn hỗn hợp nhân gen
- Ly tâm (5.2.4) cho hỗn hợp không bám trên thành ống
- Đặt ống PCR vào máy nhân gen (5.2.1)
- Chạy chu trình nhiệt phản ứng (xem Bảng E.3, Phụ lục E).
LƯU Ý: Phản ứng PCR phải bao gồm: mẫu thử, mẫu đối chứng dương, mẫu đối chứng âm. Mẫu và nguyên vật liệu cho phản ứng PCR cần đặt trong khay đá lạnh trong suốt quá trình chuẩn bị hỗn hợp phản ứng.
7.3.3.5 Điện di sản phẩm
7.3.3.5.1 Chuẩn bị thạch điện di (bản gel)
- Pha thạch agarose 1,5 %: Lấy 1,5 g agarose (4.2.6) hòa trong 100 ml dung dịch đệm TAE 1 X hoặc TBE 1 X (4.2.7) vào chai thủy tinh 250 ml, lắc đều rồi đun nóng trong lò vi sóng cho đến khi tan hoàn toàn.
- Để nguội đến khoảng 50 °C đến 60 °C, bổ sung chất nhuộm màu (4.2.11) theo hướng dẫn của nhà sản xuất. Lắc nhẹ đề chất nhuộm màu tan đều, tránh tạo bọt. Tiến hành đổ thạch agarose 1,5 % vào khay điện di đã được cài lược (5.2.6), độ dày của bản gel không lớn hơn 8 mm. Khi bản gel đông lại thì tiến hành gỡ lược khỏi bản gel.
- Chuyển bản gel vào bể điện di (5.2.6), đổ dung dịch đệm TBE 1 X hoặc TAE 1 X (4.2.7) (cùng loại với dung dịch pha agarose) vào bể điện di cho tới khi ngập bản gel.
7.3.3.5.2 Chạy điện di
- Cho 2 μl đệm tài mẫu (4.2.8) vào 8 μl sản phẩm PCR mỗi loại mẫu: mẫu kiểm tra, mẫu đối chứng dương, đối chứng âm (7.3.3.4), trộn đều và cho vào các giếng trên bản gel (xem 7.3.3.5.1).
- Cho 2 μl thang chuẩn ADN (4.2.9) vào một giếng trên bản gel.
- Đặt gel trong bể điện di (5.2.6) và điện di ở hiệu điện thế 100 V trong thời gian 30 min đến 40 min. Sau khi điện di xong, phân tích kết quả trên máy đọc gel (5.2.5).
7.3.3.6 Đọc kết quả
Đọc bản gel vừa điện di (7.3.3.5.2) bằng máy đọc gel (5.2.5):
- Mẫu dương tính: Có hiển thị vạch sản phẩm giống như mẫu đối chứng dương; kích thước sản phẩm tùy thuộc vào cặp mồi sử dụng (xem Bảng E.1, Phụ lục E)
- Mẫu âm tính: Không có vạch sản phẩm xuất hiện giống mẫu đối chứng âm hoặc có hiển thị vạch sản phẩm nhưng không giống kích thước như đối chứng dương.
- Mẫu nghi ngờ: hiển thị vạch sản phẩm không rõ nét hoặc hiển thị nhiều hơn 1 vạch sản phẩm. Trường hợp này cần xét nghiệm lại hoặc sử dụng các phương pháp khác để khẳng định.
7.4 Phát hiện kháng thể kháng virus Myxoma gây bệnh u nhày ở thỏ
7.4.1 Yêu cầu chung
Các phản ứng huyết thanh học có ý nghĩa chẩn đoán trong trường hợp con vật mắc bệnh có triệu chứng, bệnh tích nghi ngờ do virus Myxoma gây ra và chưa tiêm phòng vắc xin. Mặt khác, có thể sử dụng phản ứng huyết thanh học để xác định tình trạng nhiễm virus Myxoma cho mục đích thương mại quốc tế hoặc sử dụng trong đánh giá kết quả sau tiêm phòng vắc xin.
7.4.2 Xử lý mẫu
Mẫu huyết thanh: Chắt huyết thanh từ xy lanh chứa mẫu máu (xem 7.1.2) sang ống nghiệm 2 ml (5.1.8). Thời gian từ lúc lấy máu đến lúc chắt huyết thanh không quá 24 h, ghi ký hiệu của mẫu lên ống chứa huyết thanh. Mẫu huyết thanh được vô hoạt bổ thể ở 56 °C trong 30 min.
7.4.3 Phát hiện kháng thể kháng virus Myxoma bằng phản ứng AGID
7.4.3.1 Chuẩn bị
a) Chuẩn bị kháng nguyên
Virus Myxoma (4.3.2) được nuôi cấy trong tế bào RK-13 (xem 7.3.1) và thu hoạch tế bào khi xuất hiện khoảng 80 % CPE vào trong ống nghiệm 50 ml (5.1.8). Ly tâm 1 500 rpm trong 1 min, thu dịch nổi phía trên, để đông lạnh rồi rã đông lặp lại 3 lần, tiếp tục ly tâm với tốc độ 1 500 rpm trong 1 min và thu lấy dịch nổi làm kháng nguyên. Bảo quản kháng nguyên ở nhiệt độ -70 °C (5.1.1).
b) Chuẩn bị giếng thạch
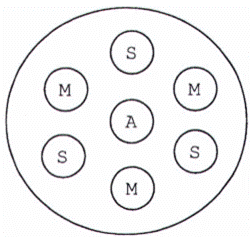
Thạch được chuẩn bị theo điều A.5, Phụ lục A. Dùng khuôn đục thạch (5.4.3) đục giếng thạch theo cụm, mỗi cụm có 7 giếng gồm một giếng ở giữa và 6 giếng xung quanh. Giếng có đường kính 6 mm, các giếng cách đều nhau 5 mm, sâu 3 mm. Dùng máy hút chân không, hoặc dùng panh có mấu láy thạch đã đục để tạo giếng. Quá trình thao tác phải cẩn thận để tránh vỡ thành giếng.
7.4.3.2 Tiến hành phản ứng
- Cho 50 μl kháng nguyên chuẩn vào giếng giữa (xem Hình 1b)
- Cho 50 μl kháng huyết thanh chuẩn và huyết thanh cần kiểm tra vào các giếng xung quanh theo sơ đồ Hình 1b.
- Hút 50 μl PBS vào một giếng bất kỳ ở vị trí của mẫu.
- Đặt đĩa vào trong hộp ẩm và ủ ở 37 °C trong thời gian 24 h đến 48 h, sau đó đọc kết quả.
|
|
|
| a) Sơ đồ cụm các giếng trên đĩa thạch phản ứng AGID | b) Vị trí của kháng nguyên chuẩn (A), kháng thể chuẩn (S) và mẫu kiểm tra (M) |
Hình 1 - Sơ đồ cụm các giếng trên đĩa thạch phản ứng AGID
CHÚ THÍCH 1: Cho lượng vừa đủ đầy giếng, tránh nhỏ quá nhiều làm tràn qua thành giếng, hoặc quá ít làm ảnh hưởng đến kết quả phản ứng.
CHÚ THÍCH 2: Để tăng độ chính xác của kết quả, mỗi mẫu huyết thanh nên kiểm tra lặp lại 03 lần (mỗi cụm giếng chỉ xét nghiệm 01 mẫu).
Phản ứng AGID phải bao gồm cả mẫu đối chứng dương và mẫu đối chứng âm. Quy trình thực hiện tương tự như mẫu kiểm tra.
7.4.3.3 Đánh giá kết quả
Phản ứng có giá trị khi xuất hiện 3 đường kết tủa giữa kháng nguyên và kháng thể chuẩn, đồng thời không xuất hiện vạch kết tủa giữa PBS với kháng nguyên chuẩn
Mẫu dương tính: Có đường kết tủa màu trắng hướng về phía kháng nguyên chuẩn
Mẫu âm tính: Không xuất hiện đường kết tủa màu trắng
7.4.4 Phát hiện kháng thể kháng virus Myxoma bằng phản ứng ELISA
Hiện nay, có nhiều bộ kít ELISA phát hiện kháng thể kháng virus Myxoma có bán sẵn trên thị trường. Khi sử dụng phương pháp ELISA cần theo đúng hướng dẫn của nhà sản xuất.
7.4.4.1 Tiến hành phản ứng
Theo hướng dẫn của nhà sản xuất kit ELISA (tham khảo F.2, Phụ lục F).
7.4.4.2 Đánh giá kết quả
Theo hướng dẫn của nhà sản xuất kit ELISA (tham khảo F.4, Phụ lục F).
8 Kết luận
Thỏ nghi mắc bệnh được cho là dương tính với bệnh u nhày khi có các đặc điểm về triệu chứng, bệnh tích điển hình và có kết quả xét nghiệm dương tính với virus Myxoma hoặc dương tính với kháng thể kháng virus Myxoma (trong trường hợp chưa tiêm phòng vắc xin) bằng các phương pháp trong tiêu chuẩn này.
Phụ lục A
(Quy định)
Thành phần và chuẩn bị dung dịch thuốc thử và môi trường
A.1 Dung dịch đệm phosphat (PBS), pH ≈ 7,4.
A.1.1 Thành phần
| Natri clorua (NaCl) | 8,5 g |
| Dikali hydrophosphat (K2HPO4) | 2,0 g |
| Monokali dihydrophosphat (KH2PO4) | 1,0 g |
| Nước cất | 1000 ml |
A.1.2 Cách chuẩn bị
Hòa tan các thành phần trong 1000 ml nước cất. Chỉnh pH trong khoảng 7,4 ± 0,2 bằng HCl 1 N (4.1.4) hoặc NaOH 1 N (4.1.5). Phân phối vào các dụng cụ chứa phù hợp, hấp 121 °C trong thời gian 15 min và bảo quản ở 4 °C, sử dụng trong khoảng 3 tháng.
CHÚ THÍCH: Có thể sử dụng PBS thương mại và chuẩn bị theo hướng dẫn của nhà sản xuất.
A.2 Môi trường nuôi tế bào (Sử dụng trong quá trình cấy chuyển và nuôi tế bào)
A.2.1 Thành phần
Dung dịch MEM (4.3.3) 440 ml
FCS (4.3.4) 50 ml
Kháng sinh (Penicillin/Streptomycin, 10 000 Ul/ml) 5 ml
Chất chống nấm (Fungizon, 250 μg/ml) 5 ml
A.2.2 Chuẩn bị
Trộn đều cách thành phần theo tỷ lệ trên, bảo quản ở nhiệt độ từ 4 °C đến 8 °C. Sử dụng tốt nhất trong 2 tuần.
A.3 Chuẩn bị Trypsin-EDTA 1X
A.3.1 Thành phần
Trypsin-EDTA 10 X 100 ml
PBS (xem A.1, Phụ lục A) 900 ml
A.3.2 Cách chuẩn bị
Lắc đều trypsin trong dung dịch PBS (A.1, Phụ lục A) rồi lọc qua màng lọc có kích thước lỗ lọc 0,45 μm (5.3.4), sau đó phân phối vào các ống và bảo quản ở nhiệt độ - 20 °C. Sử dụng tốt nhất trong 6 tháng.
A.4 Dung dịch DPBS để duy trì và cấy chuyển tế bào
Hòa tan 9,55 g bột DPBS trong 1000 ml nước cất 2 lần, hấp vô trùng ở 121 °C trong 30 min. Sử dụng tốt nhất trong 2 tuần, bảo quản ở nhiệt độ từ 4 °C đến 8 °C.
A.5 Chuẩn bị môi trường thạch cho phản ứng AGID
A.5.1 Thành phần
| Thạch Noble (4.4.2) | 0,6 g |
| EDTA (4.4.3) | 2,5 g |
| NaCl | 4,5 g |
| Thiomersal | 50 μl |
| Nước cất vừa đủ | 500 ml |
A.5.2 Cách chuẩn bị
Cân đầy đủ các thành phần trên, cho vào cốc thủy tinh và đặt trên máy khuấy từ gia nhiệt cho đến khi thạch tan chảy hoàn toàn, lọc môi trường qua nhiều lớp vải gạc, sau đó chia môi trường vào chai thủy tinh, hấp vô trùng ở nhiệt độ 115 °C trong 15 min. Khi thạch nguội xuống khoảng 50 °C đến 60 °C, đổ thạch ra đĩa petri đường kính 10 cm (5.4.4) với lượng 15 ml/đĩa. Khi thạch nguội, đậy nắp, bao gói bảo quản ở 4 °C đến 8 °C, dùng trong 7 ngày. Có thể dùng ngay sau 30 min đến 1 h.
Phụ lục B
(Quy định)
Cấy chuyển, nuôi và bảo quản tế bào
B.1 Nguyên vật liệu
- Chai nuôi tế bào 25 cm2 đã phát triển thành 1 lớp đạt 90 % bề mặt chai
- Môi trường nuôi tế bào (xem A.2, Phụ lục A)
- Trypsin - EDTA (xem A.3, Phụ lục A)
- DPBS (xem A.4, Phụ lục A)
- Dung dịch DMSO
Tất cả các môi trường phải được cân bằng ở 37 °C và các vật tư dùng cho tế bào đều phải đảm bảo vô trùng trước khi sử dụng.
B.2 Cấy chuyển và nuôi tế bào trong chai tế bào
B.2.1 Hút bỏ môi trường trong chai tế bào 25 cm2 đang nuôi tế bào RK-13 một lớp đã phủ 90 % bề mặt chai.
B.2.2 Rửa bề mặt thảm tế bào bằng 5 ml DPBS 1 X, tráng qua và hút bỏ DPBS.
B.2.3 Thêm 1 ml trypsin 1X-EDTA vào chai tế bào 25 cm2 láng đều lên bề mặt tế bào sao cho bề mặt tế bào được phủ trypsin 1X-EDTA. Ủ trong thời gian từ 5 min đến 10 min trong tủ ấm ở 37 °C (5.3.2). Khi tế bào đã tách hết, bổ sung 5 ml môi trường MEM đã có 10 % FCS vào chai để vô hoạt trypsin, trộn đều và chuyển toàn bộ huyễn dịch tế bào sang ống ly tâm 50 ml (5.1.8).
B.2.4 Ly tâm huyễn dịch tế bào với tốc độ 250 rpm trong 5 min. Loại bỏ phần dung dịch ở trên, giữ lại cặn tế bào.
B.2.5 Hoàn nguyên cặn với 5 ml MEM bổ sung 10 % FCS, sau đó chuyển vào chai nuôi cấy 25 cm2 với lượng phù hợp.
B.2.6 Nuôi chai tế bào trong tủ ấm 37 °C có 5 % CO2.
B.2.7 Theo dõi sự phát triển hàng ngày của tế bào trên kính hiển vi đảo ngược. Sau 3 ngày lại thay môi trường nuôi cấy mới. Đến khi tế bào phát triển thành một lớp bao phủ 90 % đĩa nuôi cấy thì lại tiến thành cấy chuyển lặp lại như quy trình trên đây.
B.3 Bảo quản tế bào
B.3.1 Thực hiện cấy chuyển tế bào theo các bước từ B.2.1 đến B.2.4.
B.3.2 Hoàn nguyên cặn với 5 ml MEM có bổ sung 20 % FCS và 10 % dung dịch DMSO
B.3.3 Chia nhỏ tế bào ra ống nghiệm 2 ml (5.1.8), mỗi ống 01 ml.
B.3.4 Làm đông tế bào theo các mức nhiệt độ giảm dần tới -80 °C và bảo quản trong bình ni tơ lỏng.
CHÚ THÍCH: Bảo quản tế bào theo các mức nhiệt độ giảm dàn để tránh làm chết tế bào do sốc nhiệt. Có thể thực hiện theo những cách sau:
1) Làm đông tế bào tốt nhất ở tốc độ nhiệt độ giảm dần - 1 °C/min. Vi dụ: sử dụng hộp chứa Nalgene® Mr. Frosty, hãng Sigma 1).
2) Sau khi chia nhỏ tế bào, bảo quản ở nhiệt độ 4 °C trong khoảng 3 h đến 5 h, sau đó để qua đêm ở nhiệt độ - 20 °C, tiếp tục để qua đêm ở nhiệt độ - 80 °C và chuyển sang bảo quản ở bình nitơ lỏng.
Phụ lục C
(Tham khảo)
Quy trình tách chiết ADN
CẢNH BÁO: Việc tách chiết ADN có sử dụng hóa chất nguy hiểm và có khả năng gây hại nếu thao tác không cẩn thận. Do vậy, nên tránh tiếp xúc trực tiếp với da và hít phải hơi của các hóa chất này. Luôn luôn đeo găng tay, khẩu trang, mặc quần áo bảo hộ khi thực hiện chiết tách.
Quy trình tách chiết ADN sử dụng kít QIAGEN DNeasy Blood & Tissue kit (Cat. No. 69506)2) như sau:
C.1 Chuẩn bị
- Dung dịch AW1: thêm 130 ml etanol tuyệt đối (4.1.1) vào 98 ml dung dịch AW1 đậm đặc.
- Dung dịch AW2: thêm 160 ml etanol tuyệt đối (4.1.1) vào 66 ml dung dịch AW2 đậm đặc.
- Chuẩn bị dung dịch đệm X2 theo hướng dẫn của bộ kít.
C.2 Cách tiến hành
- Hút 200 μl huyễn dịch mẫu (7.3.2.1), hoặc hỗn dịch phân lập virus (7.3.1.3) cho vào ống eppendorf 1,5 ml (5.2.10). Thêm vào 180 μl dung dịch đệm ATL.
- Thêm 20 μl proteinase K, trộn nhẹ bằng máy lắc (5.1.4), ủ ấm ở 56 °C cho đến khi mẫu bị dung giải hoàn toàn. Thỉnh thoảng trộn mẫu hoặc đặt mẫu trong bể điều nhiệt có đảo lắc (5.1.7). Thời gian dung giải mẫu có thể từ 1 h đến 3 h.
- Thêm 200 μl đệm AL vào ống mẫu, trộn đều bằng máy lắc (5.1.4). Thêm 200 μl cồn tuyệt đối vào mẫu, lắc và trộn đều.
- Hút toàn bộ hỗn hợp trong bước 3 vào cột lọc (spin column) đặt trong ống thu (collection tube). Ly tâm với tốc độ 8 000 rpm trong thời gian 1 min. Bỏ ống thu cùng dịch đã qua ly tâm.
- Đặt cột lọc vào ống thu mới. Thêm 500 μl đệm AW1. Ly tâm 8 000 rpm trong thời gian 1 min. Bỏ ống thu và dịch đã qua ly tâm.
- Đặt cột lọc vào ống thu mới. Thêm 500 μl đệm AW2. Ly tâm tốc độ tối đa 14 000 rpm trong thời gian 3 min để làm khô màng cột lọc. Bỏ ống thu và dịch đã qua ly tâm.
- Đặt cột lọc vào ống eppendorf (5.2.10). Thêm 200 μI đệm AE vào màng cột lọc (không được chạm đầu tip vào màng). Để ở nhiệt độ phòng 1 min, rồi ly tâm 8 000 rpm trong 1 min. Bỏ cột lọc.
- Chuyển ADN đã thu sang ống eppendorf mới (5.2.10).
- Bảo quản mẫu ADN ở 4 °C trong ngày nếu tiến hành xét nghiệm ngay và bảo quản ở nhiệt độ - 20 °C (5.1.1) để lưu giữ trong thời gian dài.
Phụ lục D
(Quy định)
Trình tự cặp mồi, mẫu dò, thành phần phản ứng và chu trình nhiệt sử dụng cho phương pháp realtime PCR phát hiện virus Myxoma
D.1 Trình tự cặp mồi và mẫu dò phát hiện virus Myxoma theo phương pháp realtime PCR được nêu trong Bảng D.1. Các phòng thí nghiệm có thể sử dụng các cặp mồi, mẫu dò khác được Tổ chức Thú y thế giới (OIE) hoặc Phòng Thí nghiệm tham chiếu của OIE về bệnh u nhày ở thỏ khuyến cáo sử dụng.
Bảng D.1 - Trình tự cặp mồi và mẫu dò phát hiện virus Myxoma [6]
| Mẫu dò, mồi | Kí hiệu | Trình tự (5’-3’) |
| Mồi xuôi | M000.5L-F | CGACGTAGATTTATCGTATACC |
| Mồi ngược | M000.5L-R | GTCTGTCTATGTATTCTATCTCC |
| Mẫu dò | MYXV-probe | FAM-TCGGTCTATCCTCGGGCAGACATAGA-TAMRA |
D.2 Thành phần phản ứng realtime PCR được nêu trong Bảng D.2.
Bảng D.2 - Thành phần phản ứng realtime PCR
| TT | Thành phần | Thể tích (μl) cho một phản ứng |
| 1 | Nước tinh khiết không có nuclease | 8,5 |
| 2 | Dung dịch đệm phản ứng 2X | 10,0 |
| 3 | Mồi xuôi (20 μM) | 0,5 |
| 4 | Mồi ngược (20 μM) | 0,5 |
| 5 | Mẫu dò (6 μM) | 0,5 |
| 6 | Mẫu ADN | 5,0 |
| Tổng thể tích | 25 | |
D.3 Thành phần phản ứng realtime PCR được nêu trong Bảng D.3.
Bảng D.3 - Chu trình nhiệt của phản ứng realtime PCR
| Nhiệt độ | Thời gian | Số chu kỳ |
| 95 °C | 5 min | 1 chu kỳ |
| 95 °C | 15 s | 45 chu kỳ |
| 50 °C (*) | 30 s | |
| 60 °C | 30 s | |
| (*) Thời điểm ghi nhận tín hiệu huỳnh quang. CHÚ THÍCH: Nhiệt độ và thời gian đã được tối ưu hóa phù hợp với The SensiFAST™ Probe No-ROX Kit3). Việc thực hiện cài đặt nhiệt độ và thời gian nên tuân thủ theo hướng dẫn của từng bộ kít được sử dụng. | ||
Phụ lục E
(Quy định)
Trình tự cặp mồi, thành phần phản ứng và chu trình nhiệt của phương pháp PCR
E.1 Trình tự cặp mồi và mẫu dò phát hiện virus Myxoma theo phương pháp PCR được nêu trong Bảng E.1. Các phòng thí nghiệm có thể sử dụng các cặp mồi khác được OIE hoặc Phòng thí nghiệm tham chiếu của OIE về bệnh u nhày ở thỏ khuyến cáo sử dụng.
Bảng E.1 - Trình tự cặp mồi phát hiện virus Myxoma
| Gen đích | Kí hiệu mồi | Trình tự (5'-3') | Kích thước sản phẩm (bp) |
| Phát hiện tất cả các chủng MXV [1] | M071-F | ACCCGCCAAGAACCACAGTAGT | 471 |
| M071-R | TAACGCGAGGAATATCCTGTACCA | ||
| Phát hiện chủng virus vaccine[3] | VAX-F | ACAAGAATATACTAAAGAATACCACG | 735 |
| M144-R | CCGCGTCGTGTCGATGATACAT | ||
| Phát hiện chủng virus thực địa[3] | M140-F | TGGTCTTGCGAGACAAACTG | 309 |
| M140-R | AAATGTTTGTAAGGCGCCAC |
E.2 Thành phần hỗn hợp phản ứng PCR được nêu trong Bảng E.2.
Bảng E.2 - Thành phần hỗn hợp phản ứng PCR
| TT | Thành phần | Thể tích (μl) |
| 1 | Nước tinh khiết không có nuclease | 7,0 |
| 2 | Đệm 2 X | 10,0 |
| 3 | Mồi xuôi (20 μM) | 0,5 |
| 4 | Mồi ngược (20 μM) | 0,5 |
| 5 | Mẫu chiết tách (ADN) | 2,0 |
| Tổng thể tích cho một phản ứng: | 20 | |
E.3 Chu trình nhiệt của phản ứng PCR được nêu trong Bảng E.3.
Bảng E.3 - Chu trình nhiệt của phản ứng PCR
| Nhiệt độ | Thời gian | Số chu kỳ |
| 98°C | 30 s | 1 chu kỳ |
| 98 °C | 10 s | 35 chu kỳ |
| 62 °C; 58 °C (*) | 30 s | |
| 72 °C | 15 s | |
| 72 °C | 1 min | 1 chu kỳ |
| (*) Tùy thuộc vào từng cặp mồi mà phản ứng PCR có nhiệt độ bắt cặp khác nhau: cặp mồi M071F/R có nhiệt độ bắt cặp 62 °C; VAXF/M144R và M140 F/R có nhiệt độ bắt cặp là 58 °C. CHÚ THÍCH: Nhiệt độ và thời gian chỉ phù hợp với ThermoScientific - Phire™Hot Star II PCR4. Việc thực hiện cài đặt nhiệt độ và thời gian nên tuân thủ theo hướng dẫn của từng bộ kít được sử dụng. | ||
Phụ lục F
(Tham khảo)
Quy trình thực hiện phản ứng ELISA để phát hiện kháng thể kháng virus Myxoma
Hiện nay, có nhiều bộ kít ELISA phát hiện kháng thể kháng virus Myxoma bán sẵn trên thị trường. Khi sử dụng phương pháp ELISA cần theo đúng hướng dẫn của nhà sản xuất. Ví dụ: có thể sử dụng bộ kít Civtest Cuni Mixomatosis5).
F.1 Chuẩn bị nguyên liệu
- Nguyên liệu trong bộ kít để ở nhiệt độ phòng trước khi làm phản ứng.
- Pha dung dịch rửa 1 X: pha dung dịch nước rửa đặc 10 X (N.0) với nước cất khử ion (4.1.6) theo tỷ lệ 1 : 10 (phần thể tích). Tính thể tích dung dịch nước rửa cần pha: 300 μl/giếng x 3 lần rửa x 2 bước rửa x số giếng sử dụng. Dung dịch rửa có thể sử dụng trong thời gian 7 ngày khi được bảo quản ở nhiệt độ phù hợp.
- Thiết lập sơ đồ bố trí mẫu: trong sơ đồ bố trí mẫu phải có đối chứng âm (NC), đối chứng dương (PC).
- Pha loãng mẫu: Mẫu huyết thanh cần kiểm tra được pha loãng với dung dịch pha loãng mẫu theo tỷ lệ 1/40 (ví dụ: 5 μl mẫu với 195 μl dung dịch pha loãng mẫu)
F.2 Cách tiến hành
F.2.1 Ủ mẫu
- Cho 100 μl đối chứng dương (PC) vào hai giếng A1 và B1.
- Cho 100 μl đối chứng âm (NC) vào hai giếng C1 và D1.
- Cho 100 μl huyết thanh cần kiểm tra đã được pha loãng vào các giếng còn lại, vỗ nhẹ vào cạnh đĩa, tránh đọng mẫu trên thành giếng.
- Đậy nắp đĩa và đặt trong khay ẩm. Ủ trong tủ ấm ở nhiệt độ 37 °C ± 2 °C trong 20 min.
F.2.2 Đổ bỏ dung dịch trong đĩa, rửa đĩa bằng cách thêm 300 μl dung dịch nước rửa vào các giếng, rồi đổ bỏ đi. Lặp lại 3 lần, tránh làm khô đĩa giữa các lần rửa.
F.2.3 Nhỏ 100 μl dung dịch Conjugate (N.2) vào các giếng.
F.2.4 Ủ đĩa thí nghiệm ở nhiệt độ 37 °C ± 2 °C trong 20 min.
F.2.5 Đổ bỏ dung dịch trong đĩa. Rửa đĩa bằng cách thêm 300 μl dung dịch rửa 1 X vào các giếng, rồi đổ bỏ đi. Lặp lại 3 lần, tránh làm khô đĩa giữa các lần rửa
F.2.6 Nhỏ 100 μl dung dịch TMB Subtrate (N.3) vào các giếng.
F.2.7 Ủ đĩa thí nghiệm ở nhiệt độ phòng (20 °C đến 25 °C) trong 10 min (tránh ánh sáng).
F.2.8 Nhỏ 100 pl dung dịch dừng phản ứng (Stop Solution-N.4) vào các giếng để dừng phản ứng.
F.2.9 Đo giá trị OD (mật độ quang) bằng máy đọc (5.4.1) ở bước sóng 450 nm.
F.3 Tính kết quả
Giá trị OD trung bình ở bước sóng 450 nm của mẫu đối chứng âm, NCTB, được tính theo Công thức (F.1):
![]()
Giá trị OD trung bình ở bước sóng 450 nm của mẫu đối chứng dương, PCTB, được tính theo Công thức (F.2):
![]()
Trong đó:
ODNC1,2 là giá trị OD của mẫu đối chứng âm thứ 1, 2 đo được ở bước sóng 450 nm
ODPC1, 2 là giá trị OD của mẫu đối chứng dương thứ 1, 2 đo được ở bước sóng 450 nm
- Phản ứng được công nhận khi thỏa mãn đồng thời hai điều kiện sau:
+ ODPC > 0,6
+ ODPC / ODNC > 6,0
- Sự có mặt của kháng thể kháng virus Myxoma được đánh giá theo chỉ số tương đối (Relative Index) theo Công thức (F.3):
![]()
Trong đó:
ODm là giá trị OD của mẫu xét nghiệm đo được ở bước sóng 450 nm
F.4 Đánh giá kết quả
| Âm tính | Nghi ngờ | Dương tính |
| IR < 1,0 | 1,0 ≤ IR ≤ 2,0 | IR > 2,0 |
Những mẫu nghi ngờ, cần được lấy mẫu lại sau ít nhất 3 tuần để khẳng định lại.
Thư mục tài liệu tham khảo
[1] OIE (Office International des Epizooties), 2017. Manual of Standards for Diagnostic Tests and Vaccines. Chapter 3.6.1. Myxomatosis.
[2] Ana Águeda-Pinto, Ana Lemos de Matos, Mário Abrantes, Simona Kraberger, Maria A. Risalde, Christian Gortázar, Grant McFadden, 2019. Genetic Characterization of a Recombinant Myxoma Virus in the Iberian Hare (Lepus granatensis). Viruses, 11, 530; doi:10.3390/v11060530
[3] Cavadini Patrizia, Gipliana Botti, Maria Barbieri, Antonio Lavazza, Lorenzo Capucci, 2010. Molecular characterization of SG33 and Borghi vaccines used against myxomatosis. Vaccine 28, 5414-5420.
[4] Thea Brabb, Ronald F. Di Giacomo, 2012. Chapter 14-Viral Diseases. Myxomatosis. The Laboratory Rabbit, Guinea Pig, Hamster, and other Rodents. Academic Press.
[5] Salem H.M, Morsy E.A., Hassane E.I., Shehata A.A., 2019. Outbreaks of Myxomatosis in Egyptian domestic rabbit farrms. World Rabbit Sci, 27: 85-91
[6] Margarida Dias Duarte, Silvia Carla Barros, Ana Margarida Flenriques, Maria Teresa Fagulha, Fernanda RamosTiago, Luis Migue IFevereiro, 2014. Development and validation of a real time PCR for the detection of myxoma virus based on the diploid gene M000.5L/R. Journal of Virological Methods, Volume 196, February 2014, Pages 219-224.
[7] TCVN 8400-6, Bệnh động vật - Quy trình chẩn đoán - Phần 6: Bệnh xuất huyết thỏ
1) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
2) Thông tin này đưa ra để tạo điều kiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các sản phẩm thương mại khác nếu cho kết quả tương đương.
3) Thông tin này đưa ra để tạo điều kiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các sản phẩm khác nếu cho kết quả tương đương.
4 Thông tin này đưa ra để tạo điều kiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm này. Có thể sử dụng các sản phẩm thương mại khác nếu cho kết quả tương đương.
5) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 8400-55:2022 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 8400-55:2022 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 8400-55:2022 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 8400-55:2022 DOC (Bản Word)