- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn TCVN 8400-54:2022 Bệnh động vật - Quy trình chẩn đoán - Phần 54: Bệnh tỵ thư ở gia súc
| Số hiệu: | TCVN 8400-54:2022 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
27/09/2022 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 8400-54:2022
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 8400-54:2022
TIÊU CHUẨN QUỐC GIA
TCVN 8400-54:2022
BỆNH ĐỘNG VẬT - QUY TRÌNH CHẨN ĐOÁN - PHẦN 54: BỆNH TỴ THƯ Ở GIA SÚC
Animal disease - Diagnostic procedure - Part 54: Glanders in cattle
Lời nói đầu
TCVN 8400-54:2022 do Trung tâm Chẩn đoán Thú y Trung ương - Cục Thú y biên soạn, Bộ Nông nghiệp và Phát triển nông thôn đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Bộ tiêu chuẩn TCVN 8400 Bệnh động vật - Quy trình chẩn đoán gồm các phần sau:
- TCVN 8400-1:2019, Phần 1: Bệnh lở mồm long móng;
- TCVN 8400-2:2010, Phần 2: Bệnh do vi khuẩn Streptococcus suis gây ra trên lợn;
- TCVN 8400-3:2010, Phần 3: Bệnh giun xoắn;
- TCVN 8400-4:2010, Phần 4: Bệnh Niu cát xơn;
- TCVN 8400-5:2011, Phần 5: Bệnh tiên mao trùng;
- TCVN 8400-6:2011, Phần 6: Bệnh xuất huyết thỏ;
- TCVN 8400-7:2011, Phần 7: Bệnh đậu cừu và đậu dê;
- TCVN 8400-8:2011, Phần 8: Bệnh nấm phổi do Aspergillus ở gia cầm;
- TCVN 8400-9:2011, Phần 9: Bệnh viêm gan vịt typ I;
- TCVN 8400-10:2022, Phần 10: Bệnh lao bò;
- TCVN 8400-11:2019, Phần 11: Bệnh dịch tả vịt;
- TCVN 8400-12:2011, Phần 12: Bệnh bạch lỵ và thương hàn ở gà;
- TCVN 8400-13:2019, Phần 13: Bệnh sảy thai truyền nhiễm do Brucella;
- TCVN 8400-14:2011, Phần 14: Bệnh tụ huyết trùng ở trâu bò;
- TCVN 8400-15:2019, Phần 15: Bệnh xoắn khuẩn do Leptospira;
- TCVN 8400-16:2011, Phần 16: Bệnh phù ở lợn do vi khuẩn E. coli;
- TCVN 8400-17:2011, Phần 17: Bệnh do Staphylococcus aureus ở gà;
- TCVN 8400-18:2014, Phần 18: Bệnh phù đầu gà (coryza);
- TCVN 8400-19:2014, Phần 19: Bệnh phó thương hàn lợn;
- TCVN 8400-20:2014, Phần 20: Bệnh đóng dấu lợn;
- TCVN 8400-21:2014, Phần 21: Hội chứng rối loạn sinh sản và hô hấp ở lợn (PRRS);
- TCVN 8400-22:2014, Phần 22: Bệnh giả dại ở lợn;
- TCVN 8400-23:2014, Phần 23: Bệnh ung khí thán;
- TCVN 8400-24:2014, Phần 24: Bệnh viêm phế quản truyền nhiễm;
- TCVN 8400-25:2014, Phần 25: Bệnh cúm lợn;
- TCVN 8400-26:2014, Phần 26: Bệnh cúm gia cầm H5N1;
- TCVN 8400-27:2014, Phần 27: Bệnh sán lá gan;
- TCVN 8400-28:2014, Phần 28: Bệnh viêm ruột hoại tử do Clostridium perfringens;
- TCVN 8400-29:2015, Phần 29: Bệnh Lympho leuko ở gà;
- TCVN 8400-30:2015, Phần 30: Bệnh Marek ở gà;
- TCVN 8400-31:2015, Phần 31: Bệnh tụ huyết trùng gia cầm;
- TCVN 8400-32:2015, Phần 32: Bệnh gumboro ở gia cầm;
- TCVN 8400-33:2015, Phần 33: Bệnh lê dạng trùng ở trâu bò;
- TCVN 8400-34:2015, Phần 34: Bệnh biên trùng ở trâu bò;
- TCVN 8400-35:2015, Phần 35: Bệnh Theileria ở trâu bò;
- TCVN 8400-36:2015, Phần 36: Hội chứng suy mòn ở lợn sau cai sữa do Circo vi rút typ 2;
- TCVN 8400-37:2015, Phần 37: Bệnh viêm phổi địa phương ở lợn;
- TCVN 8400-38:2015, Phần 38: Bệnh tiêu chảy ở lợn do Corona vi rút;
- TCVN 8400-39:2016, Phần 39: Bệnh viêm đường hô hấp mãn tính ở gà;
- TCVN 8400-40:2016, Phần 40: Bệnh nhiễm trùng huyết ở thủy cầm do vi khuẩn Riemerella anatipestifer gây ra;
- TCVN 8400-41:2019, Phần 41: Bệnh dịch tả lợn châu Phi;
- TCVN 8400-42:2019, Phần 42: Bệnh dịch tả loài nhai lại nhỏ;
- TCVN 8400-43:2019, Phần 43: Bệnh lưỡi xanh;
- TCVN 8400-44:2019, Phần 44: Bệnh roi trùng Trichomonosis;
- TCVN 8400-45:2019, Phần 45: Bệnh gạo lợn, bệnh gạo bò;
- TCVN 8400-46:2019, Phần 46: Bệnh dại;
- TCVN 8400-47:2019, Phần 47: Bệnh dịch tả lợn cổ điển;
- TCVN 8400-48:2020, Phần 48: Bệnh tiêu chảy có màng nhày do vi rút ở bò;
- TCVN 8400-49:2020, Phần 49: Bệnh viêm mũi khí quản truyền nhiễm ở bò;
- TCVN 8400-50:2020, Phần 50: Bệnh viêm não Nhật Bản;
- TCVN 8400-51:2020, Phần 51: Bệnh viêm phổi, màng phổi truyền nhiễm ở bò;
- TCVN 8400-52:2022, Phần 52: Bệnh nhiệt thán ở gia súc;
- TCVN 8400-53:2022, Phần 53: Bệnh viêm phổi hóa mủ do vi khuẩn Ornithobacterium rhinotracheale ở gà;
- TCVN 8400-54:2022, Phần 54: Bệnh tỵ thư ở gia súc;
- TCVN 8400-55:2022, Phần 55: Bệnh u nhày ở thỏ.
BỆNH ĐỘNG VẬT - QUY TRÌNH CHẨN ĐOÁN - PHẦN 54: BỆNH TỴ THƯ Ở GIA SÚC
Animal disease - Diagnostic procedure - Part 54: Glanders in cattle
CẢNH BÁO - Việc áp dụng tiêu chuẩn này có thể liên quan đến các vật liệu, thiết bị và các thao tác gây nguy hiểm. Tiêu chuẩn này không thể đưa ra được hết tất cả các vấn đề an toàn liên quan đến việc sử dụng chúng. Người sử dụng tiêu chuẩn này phải tự thiết lập các thao tác an toàn sức khỏe thích hợp và xác định khả năng áp dụng các giới hạn quy định trước khi sử dụng tiêu chuẩn.
1 Phạm vi áp dụng
Tiêu chuẩn này quy định quy trình chẩn đoán bệnh tỵ thư ở gia súc do vi khuẩn Burkholderia mallei gây ra.
2 Tài liệu viện dẫn
Tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này
TCVN 8128 (ISO 11133) Vi sinh vật trong thực phẩm, thức ăn chăn nuôi và nước - Chuẩn bị, sản xuất, bảo quản và thử hiệu năng của môi trường nuôi cấy
3 Thuật ngữ, định nghĩa và các từ viết tắt
3.1 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng các thuật ngữ và định nghĩa sau:
3.1.1
Bệnh tỵ thư (glanders)
Bệnh truyền nhiễm của nhiều loài gia súc, chủ yếu ở ngựa, la, lừa và có thể lây sang người với đặc trưng là các nốt loét ở mũi, đường hô hấp trên, phổi và trên da.
3.1.2
Burkholderia mallei
Trực khuẩn Gram âm, hiếu khí, không di động, không sinh nha bào và giáp mô, hai đầu hơi tròn, hơi cong, chiều dài có kích thước từ 2 μl đến 5 μl và chiều rộng có kích thước từ 0,3 μl đến 0,8 μl.
CHÚ THÍCH: Tên cũ của Buikholderia mallei là Pseudomonas mallei.
3.2 Các từ viết tắt
| Từ viết tắt | Tên tiếng Anh | Tên tiếng Việt | |
| ADN | Deoxyribonucleic acid | Axit deoxyribonucleic | |
| B. | Burkholderia | Burkholderia | |
| BHI | Brain heart infusion | Dịch tim não | |
| CFT | Complement fixation test | Phép thử kết hợp bổ thể | |
| Ct | Threshold cycle | Chu kỳ ngưỡng | |
| HAU | Haemaglutination unit | Đơn vị ngưng kết hồng cầu | |
| PCR | Polymerase chain reaction | Phản ứng chuỗi polymerase | |
| Realtime PCR | Realtime polymerase chain reaction | Phản ứng chuỗi polymerase thời gian thực | |
| RBT | Rose Bengal test | Phép thử ngưng kết hoa hồng | |
| TAE | Tris-acetate-ethylenediaminetetraacetic acid | Tris-axetat-axit etylendiamintetraaxetic | |
| TBE | Tris-borate-ethylenediaminetetraacetic acid | Tris-borat-axit etylendiamintetraaxetic | |
| TE | Tris-ethylendiamintetraacetic acid | Tris-axit etylendiamintetraaxetic | |
| Thạch TSI | Triple sugar iron agar | Thạch sắt và ba loại đường | |
| VBS | Veronal buffered saline | Muối đệm veronal | |
4 Thuốc thử, vật liệu thử và môi trường nuôi cấy
Chỉ sử dụng thuốc thử loại tinh khiết phân tích; sử dụng nước cất hoặc nước khử ion hoặc nước có độ tinh khiết tương đương không có Rnase, trừ các trường hợp có quy định khác.
Thực hiện thử hiệu năng của môi trường nuôi cấy theo quy định trong TCVN 8128 (ISO 11133).
4.1 Bộ nhuộm Gram (Xem Phụ lục A);
4.2 Môi trường nuôi cấy vi khuẩn (Xem Phụ lục B);
4.3 Môi trường xác định các đặc tính sinh hóa (Xem Phụ lục C);
4.4 Nguyên liệu cho phương pháp PCR (Xem Phụ lục D);
4.5 Nguyên liệu cho phương pháp Realtime PCR (Xem Phụ lục E);
4.6 Nguyên liệu cho phản ứng Mallein (Xem Phụ lục F);
4.7 Nguyên liệu cho phản ứng kết hợp bổ thể - CFT (Xem Phụ lục G);
4.8 Nguyên liệu cho phản ứng ngưng kết hoa hồng - RBT (Xem Phụ lục H).
4.9 Nước muối sinh lý (natri clorua 0,9 %), vô trùng.
5 Thiết bị, dụng cụ
Sử dụng các thiết bị, dụng cụ thông thường của phòng thử nghiệm sinh học và các thiết bị, dụng cụ sau:
5.1 Tủ ấm, duy trì nhiệt độ 37 °C ± 0,5 °C
5.2 Kính hiển vi, có vật kính với độ phóng đại 10 X, 40 X, 100 X
5.3 Nồi hấp, duy trì ở các nhiệt độ 100 °C, 110 °C, 121 °C
5.4 Máy ly tâm, có thể ly tâm với gia tốc 6 000 g, 8 000 g, 12 000 g
5.5 Bộ điện di, gồm bộ nguồn điện di, bể điện di, khay điện di
5.6 Máy PCR
5.7 Máy Realtime PCR
5.8 Bông cồn, bằng cottông được tẩm cồn 70 %
5.9 Màng lọc, có kích thước lỗ lọc 0,45 μm
5.10 Tăm bông, vô trùng
5.11 Pipet các loại 10 μl, 100 μl, 200 μl, 1 000 μl
5.12 Ống nghiệm, có thể tích từ 10 ml đến 15 ml, sạch và vô trùng
5.13 Đĩa petri (hộp lồng), có đường kính từ 90 mm đến 100 mm, sạch và vô trùng
5.14 Que cấy, vô trùng
5.15 Phiến kính, sạch
5.16 Pank, kéo, vô trùng
5.17 Bơm tiêm, loại 5 ml hoặc 10 ml, có gắn kim lấy máu loại 18 G hoặc 20 G, vô trùng
5.18 Cối chày sứ nghiền mẫu, sạch và vô trùng
5.19 Ống ly tâm (hay ống eppendorf), có dung tích 0,2 ml, 1,5 ml, 15 ml, vô trùng
5.20 Tủ lạnh, duy trì nhiệt độ từ 4 °C đến 8 °C
5.21 Dụng cụ đựng mẫu, là các ống, hộp có nắp kín, không rò rỉ, không dễ vỡ và vô trùng
5.22 Tủ an toàn sinh học cấp II.
6 Chẩn đoán lâm sàng.
6.1 Đặc điểm dịch tễ
- Bệnh tỵ thư là bệnh truyền nhiễm của nhiều loài gia súc do vi khuẩn B. mallei gây ra. Bệnh chủ yếu xảy ra ở ngựa, la, lừa, có thể ở dê, chó, chó sói, mèo, lạc đà, gấu và có thể lây sang người;
- Đặc trưng của bệnh đó là các nốt loét ở mũi, đường hô hấp trên và phổi. Có trường hợp bệnh được biểu hiện ở thể ngoài da (thể “farcy”) là các nốt loét trên da;
- Bệnh có thể lây sang người qua tiếp xúc trực tiếp với động vật mắc bệnh, lây nhiễm trực tiếp từ gia súc ốm sang gia súc khỏe qua đường hô hấp hoặc gián tiếp qua thức ăn, nước uống, các dụng cụ chăn nuôi, người chăn nuôi;
- Tỷ lệ chết của bệnh trong trường hợp cấp tính có thể lên đến 95 % trong 3 tuần.
6.2 Triệu chứng lâm sàng
Căn cứ vào các vị trí gây bệnh và biến đổi bệnh lý, chia thành 5 thể bệnh sau đây:
Thể cấp tính:
- Thể này ít phổ biến, thường gặp ở ngựa, la, lừa;
- Thời gian ủ bệnh ngắn, từ 2 ngày đến 4 ngày và diễn biến bệnh từ 2 đến 3 ngày;
- Gia súc có biểu hiện viêm mũi chảy dịch màu xanh vàng hoặc chảy dịch có lẫn máu. Viêm mũi tiến triển rất nhanh với sự hình thành màng giả trong xoang mũi, nổi các cục nhỏ, các áp xe, các nốt loét trên niêm mạc mũi;
- Hạch lâm ba vùng mũi sưng to cả hai bên thành các ổ áp xe mủ rồi vỡ ra qua cả lớp da bên ngoài;
- Gia súc thường chết sau 8 ngày đến 10 ngày kể từ khi có triệu chứng đầu tiên.
Thể mũi:
- Loét niêm mạc mũi, chảy nước mũi và viêm hạch giống như thể cấp tính. Nước mũi thường chảy từ một bên mũi, lúc đầu nhầy, có ít mủ, màu trắng đục, lẫn tia máu, sau có màu rỉ sắt, xung quanh lỗ mũi có mủ lẫn máu khô;
- Các vết loét, các ổ áp xe trên niêm mạc mũi vỡ ra làm cho hai lỗ mũi đầy ắp dịch nhầy xanh vàng, trong đó có những đám tổ chức hoại tử và rớm máu. Các nốt loét có bờ này rộng dần tạo ra các ổ loét lớn. Khi nốt loét được hồi phục sẽ để lại vết sẹo trên niêm mạc mũi và vách ngăn hai lỗ mũi. Cánh mũi và môi của gia súc bị bệnh có sưng thũng và nốt loét.
Thể phổi:
Thường phát triển chậm trong khoảng thời gian vài tháng. Gia súc mắc bệnh giảm tăng trọng, thở khó tăng dần, ho và có thể hình thành tiếng khò khè nếu như thanh quản bị viêm. Sau đó, bệnh tích xuất hiện ở vùng quanh mũi và da.
Thể da:
- Còn gọi là bệnh “farcy” - bệnh loét da: Đặc trưng của thể này là có rất nhiều mụn sưng có đường kính từ 1 cm đến 3 cm ở trên da, thường thấy ở da ở vùng đầu, cổ, vai, chân, mông có nhiều vùng sưng, phù thũng. Chỗ mụn sưng chạm vào thấy nóng, gia súc đau, sau mềm ra, vỡ chảy dịch trên da, sau tạo thành các ổ loét, các u cục trên da;
- Chỗ loét chảy ra nhiều dịch đặc màu vàng nghệ, có lẫn máu, tạo ra các ổ loét trở thành mãn tính và hình thành các cục ở trên da. Các mụn và nốt loét khác cũng xuất hiện quanh vùng hạch lâm ba tạo ra các bệnh tích giống như viêm hạch lâm ba truyền nhiễm.
Thể mãn tính:
- Thể mãn tính thường xảy ra ở ngựa, là giai đoạn sau của thể cấp tính hoặc phát ra ngay hoặc mang trùng nhiều tháng, nhiều năm và không có các triệu chứng lâm sàng rõ ràng;
- Triệu chứng chung: Gia súc gầy, các hoạt động chậm, làm việc yếu, sốt cách quãng, què chân. Một số triệu chứng có thể thấy ở mũi và trên da của gia súc;
- Hạch lâm ba ở vùng có nốt loét bị viêm. Những nốt loét này thấy ở trên da, dầy lên, màu vàng và chảy dịch.
6.3 Bệnh tích
Bệnh tích của bệnh thấy rõ nhất là ở thể cấp tính và thể mãn tính.
Thể cấp tính:
- Trên da: Nội bì tụ máu, tổ chức liên kết dưới da và lâm ba quản cũng tụ máu và có thủy thũng;
- Hạch tụ máu, sưng, phù thũng;
- Đường hô hấp: Niêm mạc tụ máu đỏ thẫm, hình thành các ổ loét tỵ thư (rìa cao, giữa lõm chứa mủ đặc, màu vàng) ở xoang mũi, niêm mạc đường hô hấp;
- Phổi tụ máu, có những ổ gan hóa, màng phổi đầy bạch huyết cầu vàng hay xám;
- Ở gan, lách sưng to, xuất huyết, có những hạt vàng xám, xung quanh có một vầng màu hồng;
- Dịch hoàn: Dịch hoàn và màng bọc bị viêm, thủy thũng. Trên bề mặt màng bọc có những chấm nhỏ màu xám hay trắng;
- Thận bị viêm và có những điểm thoái hóa.
Thể mũi:
- Niêm mạc ở mũi sưng, có các nốt loét. Các nốt loét này có bờ rộng dần tạo ra các ổ loét lớn;
- Ở giai đoạn phục hồi của thể mũi, các ổ loét để lại sẹo.
Thể phổi:
- Màng phổi bị viêm. Trong tổ chức phổi có các nốt sưng cứng còn gọi là hạt tỵ thư. Khi cắt các nốt sưng thấy có vỏ chất xơ, trong chứa đầy bã đậu màu trắng nhạt.
Thể da:
Trên da vùng đầu, cổ, vai, chân, mông có nhiều vùng bị sưng nóng, phù thũng, sau vỡ ra tạo thành các ổ loét. Khi phục hồi các vết loét sẽ để lại sẹo, giống như các u cục trên da.
Thể mãn tính:
- Trên da thường ở vùng da mỏng có những nốt sưng (to bằng hạt đậu hoặc quả trứng gà) sau mềm ra và loét. Chích nốt sưng đã mềm thấy chảy dịch dính, màu vàng đỏ, mụn loét không thành sẹo, bờ dựng đứng;
- Hạch sưng, ít khi có mủ;
- Niêm mạc đường hô hấp tụ máu đỏ thẫm, hình thành các ổ loét tỵ thư (rìa cao, giữa lõm chứa mủ đặc, màu vàng) ở xoang mũi, niêm mạc đường hô hấp;
- Màng phổi bị viêm. Trong tổ chức phổi có các nốt sưng cứng còn gọi là hạt tỵ thư. Khi cắt các nốt sưng thấy có vỏ chất xơ, trong chứa đầy bã đậu màu trắng nhạt;
- Gan, lách, thận cũng có hạt tỵ thư nhưng ít gặp.
6.4 Chẩn đoán phân biệt
Chẩn đoán phân biệt bệnh tỵ thư với các bệnh khác có cùng triệu chứng:
- Bệnh tỵ thư: Do Burkholderia mallei gây ra với đặc trưng của bệnh là các nốt loét ở mũi, đường hô hấp trên, phổi và trên da.
- Bệnh Melioidosis (Whitmore): Do Burkholderia pseudomallei gây ra. Đặc trưng của bệnh là trên da có những chỗ bị viêm, ổ áp - xe, vết loét. Đồng thời gây viêm ở phổi, xương khớp, hệ thần kinh, gan, lách, tuyến tiền liệt, nhiễm trùng huyết.
- Bệnh viêm hạch lâm ba truyền nhiễm: Do nấm Histoplasma farciminosum gây ra. Đặc trưng của bệnh là có các nốt trên mặt da, chảy dịch vàng giống như bệnh tỵ thư thể da.
- Bệnh viêm đường hô hấp cấp tính của ngựa non: Do vi khuẩn Streptococcus equi gây ra. Bệnh này có dấu hiệu lâm sàng giống bệnh tỵ thư thể phổi như chảy dịch mủ ở mũi, thở khó, ho và khịt mũi.
- Bệnh tiêm la ngựa: Do tiên mao trùng Trypanosoma equiperdum gây ra. Bệnh có thể được phát hiện khi kiểm tra máu tươi. Bệnh tích đặc trưng là có hiện tượng viêm hạch lâm ba và viêm thũng cơ quan sinh dục giống thể da của bệnh tỵ thư.
7 Chẩn đoán trong phòng thí nghiệm
7.1 Lấy mẫu, bảo quản và vận chuyển mẫu bệnh phẩm
7.1.1 Lấy mẫu
Bệnh phẩm là dịch của các mụn và vết loét (ở đường hô hấp trên, ở da), phổi, gan, lách.
Cách lấy mẫu:
- Lấy mẫu máu: Sát trùng vị trí lấy mẫu bằng bông cồn (5.8). Dùng bơm tiêm (5.17) lấy máu ở tĩnh mạch cổ hoặc tĩnh mạch tai. Lấy khoảng 3 ml máu. Sát trùng kỹ nơi lấy máu bằng bông cồn (5.8). Mẫu máu được chuyển sang ống ly tâm 15 ml (5.19) và để nghiêng ống hoặc mẫu máu được để nguyên trong bơm tiêm và kéo dài pit tông của bơm tiêm để có khoảng trống tách huyết thanh.
- Lấy dịch ngoáy mũi: Dùng 1 tăm bông (5.10) đưa vào mũi gia súc, xoay tròn tăm bông và từ từ rút ra; Lấy tăm bông thứ 2 làm tương tự ở mũi còn lại. Cho cả 2 tăm bông vào ống đã có môi trường bảo quản (xem Phụ lục B.5).
- Lấy mẫu dịch của các mụn và vết loét: Dùng tăm bông (5.10) ngoáy vào ổ mụn hoặc vết loét rồi cho vào từng dụng cụ đựng mẫu riêng, đậy kín, ghi ký hiệu mẫu.
- Lấy mẫu da: Dùng pank, kéo (5.16) cắt khoảng 3 cm2 da ở vùng có nốt loét cho vào từng dụng cụ đựng mẫu riêng, đậy kín, ghi ký hiệu mẫu.
- Lấy mẫu là phủ tạng (phổi, gan, lách): Dùng pank, kéo (5.16) cắt khoảng 10 g đến 50 g cho vào từng dụng cụ đựng mẫu riêng, đậy kín, ghi ký hiệu mẫu.
7.1.2 Bảo quản mẫu
- Các dụng cụ đựng mẫu được giữ trong điều kiện lạnh khoảng 2 °C đến 8 °C.
Bệnh phẩm được gửi kèm theo một giấy yêu cầu xét nghiệm có ghi rõ bệnh sử, triệu chứng, bệnh tích, đặc điểm dịch tễ của gia súc.
7.1.3 Đóng gói và vận chuyển mẫu
Mẫu bệnh phẩm nghi mắc bệnh được đóng gói 3 lớp, đảm bảo an toàn sinh học trong quá trình vận chuyển đến phòng xét nghiệm.
- Lớp thứ 1 (lớp đựng mẫu bệnh phẩm): Có thể là hộp nhựa cứng có nắp xoáy, đảm bảo không rò rỉ, không thấm nước, không dễ vỡ, được đóng kín, dán nhãn bên ngoài (loại mẫu, ngày, chủ gia súc, nơi lấy mẫu...).
Lớp thứ 1 được bao bằng vật liệu dễ thấm hút (bông, giấy thấm...) đặt vào trong lớp thứ 2. Nếu có nhiều ống đựng mẫu thì mỗi ống cần được bao, bọc riêng để tránh tiếp xúc và có lớp vật liệu thấm hút bên ngoài.
- Lớp thứ 2: Bảo vệ lớp thứ 1, có thể là hộp nhựa hoặc túi nylon, đảm bảo không rò rỉ, không thấm nước, không dễ vỡ, được đóng kín, dán nhãn ghi thông tin mẫu ở bên ngoài (loại mẫu, ngày, chủ gia súc, nơi lấy mẫu...). Giữa lớp thứ 1 và thứ 2 có lớp vật liệu thấm hút để tránh rò rỉ mẫu.
- Lớp thứ 3 (là lớp ngoài cùng): Bao quanh lớp thứ 2, có thể là thùng bảo ôn hoặc hộp xốp, đảm bảo đủ cứng, không bục vỡ mẫu trong quá trình vận chuyển. Bên ngoài lớp thứ 3 cần được ghi nhãn đảm bảo các thông tin: thông tin của người gửi mẫu (Tên, số điện thoại, địa chỉ); Thông tin của người nhận mẫu (Tên, số điện thoại, địa chỉ); Có thể thêm số điện thoại khẩn cấp của người chịu trách nhiệm mẫu bệnh phẩm; Nhãn cảnh báo mẫu.
CHÚ THÍCH: Trong quá trình đóng gói và vận chuyển nếu dùng đá chuyên dụng để đảm bảo nhiệt độ bảo quản thì có thể để đá ở giữa lớp thứ 1 và lớp thứ 2 hoặc giữa lớp thứ 2 và lớp thứ 3.
7.2 Nuôi cấy, phân lập và xác định vi khuẩn B. mallei
7.2.1 Nuôi cấy vi khuẩn B. mallei
Quá trình nuôi cấy phải được tiến hành trong tủ an toàn sinh học cấp II (5.22)
- Mẫu dịch ổ mụn hay vết loét: Lấy tăm bông đã có mẫu dịch phết lên môi trường thạch máu (xem B.1), thạch glycerol (xem B.2), thạch khoai tây glycerol (xem B.3) và thả tăm bông đó vào canh thang glycerol (xem B.4).
- Với mẫu là phủ tạng: Sát trùng bề mặt ngoài bằng bông cồn (5.8), rồi dùng kéo (5.16) cắt sâu vào tổ chức bên trong lấy một mẫu nhỏ hoặc dùng que cấy (5.14) lấy tổ chức bên trong nuôi cấy vào môi trường thạch máu (xem B.1), thạch glycerol (xem B.2), thạch khoai tây glycerol (xem B.3) và mẫu bệnh phẩm đó vào canh thang glycerol (xem B.4).
Sau đó ủ các đĩa petri và ống môi trường đã cấy mẫu vào trong tủ ấm (5.1). Kiểm tra kết quả nuôi cấy sau 72 h.
7.2.2 Phân lập vi khuẩn B. mallei
Sau 72 h, kiểm tra kết quả nuôi cấy:
- Trên thạch máu: Khuẩn lạc B. mallei nhỏ, xám, hơi sáng bóng, không dung huyết và không sinh sắc tố.
- Trên thạch glycerol: Khuẩn lạc B. mallei có màu trắng kem, trơn, nhẵn và nhày. Nếu tiếp tục nuôi sẽ thấy khuẩn lạc dầy lên, hơi cứng, dính vào mặt thạch và có màu nâu sẫm.
- Trên thạch khoai tây glycerol: Vi khuẩn B. mallei mọc tốt. Khuẩn lạc nhỏ, trong suốt như giọt mật ong, màu vàng, dần dần tập trung lại thành từng mảng to lan khắp mặt môi trường, khuẩn lạc có màu nâu hay sô-cô-la, có thể có viền màu xanh.
- Trong canh khuẩn glycerol: Lúc đầu vi khuẩn mọc làm môi trường vẩn đục, sau lắng xuống thành cặn màu trắng, dính. Khi lắc nhẹ ống nghiệm, cặn bẩn lên theo hình xoáy trôn ốc. Sau từ 10 ngày đến 15 ngày nuôi cấy, trên bề mặt môi trường có lớp màng dính, màu tro, sau dày lên, trĩu xuống giống thạch nhũ, môi trường đen dần, để thêm vài tuần có màu cà phê sữa.
Chọn khuẩn lạc nghi ngờ cấy vào môi trường canh thang glycerol (xem B.4) hoặc thạch máu (xem B.1), hoặc thạch glycerol (xem B.2) hoặc thạch khoai tây glycerol (xem B.3), nuôi trong tủ ấm (5.1) ở nhiệt độ 37 °C trong 72 h để xác định hình thái vi khuẩn, xác định các đặc tính sinh hóa của vi khuẩn, xác định vi khuẩn bằng phản ứng PCR, Realtime PCR.
7.3 Xác định vi khuẩn B. mallei
7.3.1 Xác định hình thái vi khuẩn B. mallei
Từ canh khuẩn nghi ngờ có B. mallei phát triển hoặc khuẩn lạc nghi ngờ là B. mallei trên các môi trường thạch máu (xem B.1), thạch glycerol (xem B.2), thạch khoai tây glycerol (xem B.3), nuôi trong tủ (xem 7.2.2) tiến hành làm tiêu bản:
- Từ khuẩn lạc: Nhỏ 1 giọt nước muối sinh lý (4.9) lên phiến kính (5.15) rồi dùng que cấy (5.14) lấy khuẩn lạc trộn đều giọt nước muối sinh lý.
- Từ canh khuẩn (xem 7.2.2): Dùng que cấy (5.14) lấy một vòng canh khuẩn dàn mỏng lên trên phiến kính (5.15).
Tiêu bản được để khô và cố định trên ngọn lửa đèn cồn;
Sử dụng phương pháp nhuộm Gram (xem Phụ lục A).
Soi tiêu bản dưới kính hiển vi:
Vi khuẩn B. mallei là trực khuẩn Gram âm, hai đầu hơi tròn, hơi cong. Vi khuẩn không sinh nha bào và giáp mô. Trong canh khuẩn vi khuẩn đứng riêng lẻ, có hình thái khác nhau. Canh khuẩn non, vi khuẩn có hình gậy (trực khuẩn); canh trùng già vi khuẩn đa hình thái (hình tròn, hình gậy, hình sợi, hình sợi phình ra thành quả chùy).
7.3.2 Xác định vi khuẩn B. mallei bằng phản ứng sinh hóa
Từ canh khuẩn nghi ngờ có vi khuẩn B. mallei phát triển hoặc khuẩn lạc nghi ngờ là vi khuẩn B. mallei (xem 7.2.2) tiến hành xác định một số đặc tính sinh hóa đặc trưng được nêu trong Bảng 1.
Môi trường xác định các đặc tính sinh hóa của vi khuẩn B. mallei và cách tiến hành các phản ứng được nêu trong Phụ lục C.
Bảng 1 - Một số đặc tính sinh hóa của vi khuẩn B. mallei
| Đặc tính sinh hóa | Vi khuẩn B. mallei |
| Phản ứng KOH | Dương tính |
| Khử nitrat (reduce nitrate) | Dương tính |
| Phân hủy arginin | Dương tính |
| Sinh indol | Âm tính |
| Lên men glucose | Dương tính |
| Lên men lactose | Âm tính |
| Sinh H2S | Dương tính |
| Khả năng di động | Âm tính |
| Phản ứng catalase | Dương tính |
| Phản ứng oxidase | Có thể âm tính hoặc dương tính |
7.3.3 Xác định vi khuẩn B. mallei bằng phương pháp PCR
7.3.3.1 Xử lý mẫu
Mẫu có thể là mẫu bệnh phẩm (xem 7.1.1) hoặc là canh khuẩn nghi ngờ có B. mallei phát triển hoặc khuẩn lạc nghi ngờ là B. mallei (xem 7.2.2)
- Mẫu bệnh phẩm là dịch của các mụn, vết loét (xem 7.1.1): Chuyển tăm bông đã lấy mẫu sang ống thu mẫu có sẵn nước muối sinh lý và lắc kỹ. Dùng pipet (5.11) hút huyễn dịch vừa nghiền chuyển sang 2 ống ly tâm 1,5 ml (5.19). Một ống dùng để tách ADN tiến hành phản ứng PCR, Realtime PCR; ống còn lại dùng làm mẫu lưu, bảo quản ở nhiệt độ 4 °C.
- Mẫu bệnh phẩm là phổi, gan, lách: Dùng pank kéo (5.16) cắt nhỏ và nghiền mẫu bệnh phẩm với nước muối sinh lý (4.9) theo tỷ lệ 1 : 9 (1 phần mẫu và 9 phần thể tích nước muối sinh lý) bằng cối chày sứ (5.18) thành huyễn dịch. Chuyển huyễn dịch vào 2 ống ly tâm 1,5 ml (5.19) bằng pipet (5.11). Một ống dùng để tách ADN tiến hành phản ứng PCR, Realtime PCR; ống còn lại dùng làm mẫu lưu, bảo quản ở nhiệt độ 4 °C.
- Mẫu bệnh phẩm là khuẩn lạc: Dùng pipet (5.11) hút 200 μl nước cất vào ống ly tâm 1,5 ml (5.19). Dùng que cấy (5.14) lấy từ 2 khuẩn lạc đến 3 khuẩn lạc nghi ngờ là vi khuẩn B. mallei (xem 7.2.2) hòa vào 200 μl nước cất vô trùng, được bất hoạt bằng nhiệt độ trước khi tách chiết ADN (xem Phụ lục D.2).
- Mẫu bệnh phẩm là canh khuẩn: Dùng pipet (5.11) hút 200 μl canh khuẩn nghi ngờ là vi khuẩn B. mallei (xem 7.2.2) vào ống ly tâm 1,5 ml (5.19), được bất hoạt bằng nhiệt độ trước khi tách chiết ADN (xem Phụ lục D.2).
7.3.3.2 Tách chiết ADN
Xem Phụ lục D.2.
Tách chiết ADN bằng kít thương mại. Quy trình tách chiết theo hướng dẫn của nhà sản xuất.
VÍ DỤ: Kít tách chiết ADN của hãng Qiagen (DNeasy Blood & Tissue Kit, Catalog number: 69504); Kít tách chiết ADN của hãng Invitrogen (PureLink™ Genomic DNA Mini Kit, Catalog number: K182002) 1).
7.3.3.3 Cách tiến hành
Xác định vi khuẩn B. mallei bằng phương pháp PCR với cặp mồi đặc hiệu và chu trình nhiệt được nêu trong Bảng 2 và Bảng D.2 (xem Phụ lục D).
Bảng 2 - Cặp mồi xác định vi khuẩn B. mallei
| Gen đích | Tên mồi | Trình tự từ đầu 5’ tới 3’ | Kích thước sản phẩm (bp) |
| fliP | Bma-IS407-flip-f | TCAGGTTTGTATGTCGCTCGG | 989 bp |
| Bma-IS407-flip-r | CTAGGTGAAGCTCTGCGCGAG |
Chuẩn bị mẫu, các bước tiến hành phản ứng PCR, chu trình nhiệt của phản ứng PCR được quy định tại Phụ lục D.
7.3.3.4 Đọc kết quả
Xem Phụ lục D.6.
- Phản ứng được công nhận khi: Mẫu đối chứng dương tính có vạch đúng kích cỡ sản phẩm (sản phẩm 989 bp); mẫu đối chứng âm không có vạch sản phẩm.
- Mẫu được coi là dương tính khi có vạch sản phẩm giống đối chứng dương hoặc âm tính khi không có vạch sản phẩm giống đối chứng âm.
7.3.4 Xác định vi khuẩn B. mallei bằng phương pháp Realtime PCR
7.3.4.1 Xử lý mẫu
Xem 7.3.3.1.
7.3.4.2 Tách chiết ADN
Tách chiết ADN từ bệnh phẩm bằng kít thương mại. Quy trình tách chiết theo hướng dẫn của nhà sản xuất.
VÍ DỤ: Kít tách chiết ADN của hãng Qiagen (DNeasy Blood & Tissue Kit. Catalog number: 69504): Kít tách chiết ADN của hãng Invitrogen (PureLink™ Genomic DNA Mini Kit, Catalog number: K182002) 2).
7.3.4.3 Cách tiến hành
Xác định vi khuẩn B. mallei bằng phương pháp Realtime PCR với cặp mồi, mẫu dò đặc hiệu và chu trình nhiệt được nêu trong Bảng 3 và Bảng E.2 (xem Phụ lục E).
Bảng 3 - Cặp mồi và mẫu dò xác định vi khuẩn B. mallei
| Gen đích | Mẫu dò, mồi | Trình tự từ 5’ đến 3’ |
| fliP | Mẫu dò (Bma-flip) | 6FAM -CAGGTCAACGAGCTTCACGCGGATC-BHQ1 |
| Mồi xuôi F (Bma-flip-f) | CCCATTGGCCCTATCGAAG | |
| Mồi ngược R (Bma-flip-r) | GCCCGACGAGCACCTGATT |
Chuẩn bị mẫu, các bước tiến hành phản ứng, chu trình nhiệt của phản ứng Realtime PCR được quy định tại Phụ lục E.
7.3.4.4 Đọc kết quả
Xem Phụ lục E.5.
Mẫu kiểm tra dương tính khi có giá trị Ct ≤ 40.
7.3.5 Phản ứng huyết thanh học
7.3.5.1 Phản ứng Mallein (Phản ứng dị ứng)
a) Nguyên lý phản ứng
Kháng nguyên vào cơ thể động vật mẫn cảm sẽ kết hợp với kháng thể tạo tổ hợp kháng nguyên - kháng thể, kích thích tế bào giải phóng ra histamin và các chất hóa học gây ra phản ứng viêm: Trong trường hợp nhỏ mắt thì niêm mạc mắt bị viêm, sưng có mủ; trong trường hợp tiêm dưới da thì chỗ tiêm sẽ sưng, nóng, đỏ, đau.
b) Chuẩn bị kháng nguyên, cách tiến hành phản ứng và đọc kết quả
Xem Phụ lục F.
c) Đọc kết quả
Gia súc mắc bệnh tỵ thư (phản ứng Mallein dương tính) khi quan sát thấy:
- Với phương pháp nhỏ mắt: Kết mạc có mủ, sưng hoặc hơi sưng, đầu khóe mắt có mủ chảy ra thành hình sợi nhỏ.
- Với phương pháp tiêm dưới da: Sau 15 h tiêm kháng nguyên, thân nhiệt gia súc tăng (trên 39,5 °C), chỗ tiêm sưng, nóng và có biểu hiện đau. Sau 24 h đến 36 h tiêm, chỗ tiêm tiếp tục sưng to, đo độ sưng da từ 10 mm đến 20 mm và giữ nguyên trong 2 ngày đến 3 ngày. Gia súc mệt mỏi, không ăn, mạch đập nhanh.
7.3.5.2 Phản ứng kết hợp bổ thể (CFT - Complement Fixation Test)
a) Nguyên lý phản ứng
Trong mẫu huyết thanh nếu có kháng thể sẽ kết hợp với kháng nguyên và bổ thể, bổ thể không còn để dung giải hồng cầu cừu (không xảy ra hiện tượng dung huyết). Và nếu trong mẫu huyết thanh không có kháng thể, bổ thể sẽ gây dung giải hồng cầu cừu (xảy ra hiện tượng dung huyết).
b) Xử lý mẫu máu thu huyết thanh
Mẫu máu được chuyển sang ống ly tâm 1,5 ml (5.19), ly tâm với gia tốc khoảng 6000 g trong 10 min.
Dùng pipet (5.11) hút phần huyết thanh màu vàng nhạt phía trên cục máu đông và cho vào ống ly tâm khác.
c) Chuẩn bị kháng nguyên, cách tiến hành phản ứng và đọc kết quả
Xem Phụ lục G.
d) Đọc kết quả
Mẫu huyết thanh dương tính khi các nồng độ pha loãng đều không dung huyết (hồng cầu ngưng kết).
7.3.5.3 Phản ứng ngưng kết hoa hồng (Phản ứng RBT - Rose Bengal Test)
a) Nguyên lý phản ứng
Kháng thể có trong huyết thanh kết hợp với kháng nguyên B. mallei đã được gắn màu để tạo thành phức hợp kháng nguyên kháng thể mà có thể quan sát thấy (là các chấm màu hồng trong dung dịch trong suốt).
b) Xử lý mẫu máu thu huyết thanh
Mẫu máu được chuyển sang ống ly tâm 1,5 ml (5.19), ly tâm với gia tốc khoảng 6 000 g trong 10 min.
Dùng pipet (5.11) hút phần huyết thanh màu vàng nhạt phía trên cục máu đông và cho vào ống ly tâm khác.
c) Tiến hành phản ứng và đọc kết quả
Xem Phụ lục H.
d) Đọc kết quả
Phản ứng có ý nghĩa khi đối chứng dương có xuất hiện ngưng kết là các chấm màu hồng và đối chứng âm không xuất hiện ngưng kết.
Mẫu huyết thanh dương tính khi có xuất hiện ngưng kết là các chấm màu hồng.
8 Kết luận
Gia súc được kết luận mắc bệnh tỵ thư khi có đặc điểm dịch tễ, triệu chứng lâm sàng, bệnh tích đặc trưng của bệnh và có một trong những kết quả sau đây:
- Phân lập và xác định được vi khuẩn B. mallei bằng các phản ứng sinh hóa (xem 7.3.2);
- Kết quả PCR dương tính với vi khuẩn B. mallei (xem 7.3.3);
- Kết quả Realtime PCR dương tính với vi khuẩn B. mallei (xem 7.3.4);
- Kết quả huyết thanh học dương tính (xem 7.3.5.1 hoặc 7.3.5.2 hoặc 7.3.5.3).
Phụ lục A
(Quy định)
Phương pháp nhuộm Gram
A.1 Thuốc thử
A.1.1 Dung dịch tím tinh thể
| Tím tinh thể (C25H30N3Cl) | 2,0 g |
| Etanol 95 % (thể tích) | 20,0 ml |
| Amoni oxalat [(NH4)2C2O4.2H2O] | 0,8 g |
| Nước cất | 80,0 ml |
Hòa tan tím tinh thể trong etanol và hòa tan amoni oxalat trong nước. Sau đó, trộn 2 dung dịch này với nhau và lắc cho tan hết.
A.1.2 Dung dịch fuchsin đậm đặc
| Fuchsin basic (C20H20ClN3) | 1 g |
| Etanol 95 % (thể tích) | 10 ml |
| Phenol (C6H6O) | 5g |
| Nước cất | 100 ml |
Khi dùng, pha loãng dung dịch fuchsin đậm đặc với nước theo tỷ lệ 1 : 10 (thể tích).
A.1.3 Dung dịch lugol
| Kali iodua (KI) | 2g |
| Iốt (I2) tinh thể | 1 g |
| Nước cất | 200 ml |
Nghiền kali iodua và iốt tinh thể, cho nước vào từ từ và lắc cho tan.
A.1.4 Cồn axeton
| Etanol 95 % (thể tích) | 3 phần |
| Axeton (C2H6O) | 1 phần |
A.2 Cách tiến hành
Nhỏ dung dịch tím tinh thể lên tiêu bản, để từ 1 min đến 2 min sau đó rửa nước nhanh và để khô.
Nhỏ dung dịch lugol, để 1 min sau đó rửa nước nhanh và để khô.
Nhỏ cồn axeton, rửa nước thật nhanh và để khô.
Nhỏ dung dịch fuchsin loãng, để 1 min sau đó rửa nước rồi thấm khô hoặc để khô.
A.3 Soi tiêu bản
Nhỏ 1 giọt dầu vào tiêu bản và quan sát tiêu bản bằng kính hiển vi quang học (5.2).
Tiêu bản từ bệnh phẩm, vi khuẩn B. mallei thường tập hợp thành từng đám, từng chùm.
Tiêu bản làm từ canh khuẩn nuôi trong thời gian 24 h đến 72 h, vi khuẩn đứng riêng lẻ, có hình que; từ canh khuẩn nuôi trên 72 h, vi khuẩn đứng riêng lẻ, đa hình thái (hình tròn, hình gậy, hình sợi, hình sợi phình ra thành quả chùy).
Phụ lục B
(Quy định)
Môi trường nuôi cấy vi khuẩn B. mallei
B.1 Môi trường thạch máu
B.1.1 Nguyên liệu
Môi trường thạch máu: Sử dụng môi trường thương mại, pha chế theo hướng dẫn của nhà sản xuất.
VÍ DỤ: Dùng môi trường thạch máu cơ bản (Blood agar base) của hãng Merck (Cat. No. 110886) 3).
B.1.2 Cách tiến hành
Chuẩn bị môi trường thạch máu cơ bản theo hướng dẫn của nhà sản xuất.
Vô trùng môi trường thạch máu cơ bản ở 121 °C trong 20 min bằng nồi hấp (5.3).
Đợi nhiệt độ của môi trường thạch máu cơ bản đã vô trùng còn khoảng 40 °C thì bổ sung máu.
Lắc đều và chia ra đĩa petri (5.13) khoảng 20 ml/đĩa.
Đặt ít nhất một đĩa môi trường thạch máu vào trong tủ ấm (5.1) ủ ở 37 °C với điều kiện hiếu khí để kiểm tra vô trùng. Sau từ 18 h đến 24 h, trên bề mặt môi trường thạch máu không có khuẩn lạc mọc là đảm bảo vô trùng sẽ được bảo quản và sử dụng.
Bảo quản các đĩa thạch máu trong tủ lạnh (5.20) ở nhiệt độ 4 °C.
B.2 Môi trường thạch glycerol
B.2.1 Nguyên liệu
Thành phần:
| Môi trường thạch máu cơ bản | 4g |
| Glycerol | 2 ml |
| Nước cất vừa đủ | 100 ml |
| Chỉnh pH = 7,4 ± 0,2 ở 25 °C |
|
VÍ DỤ: dùng môi trường thạch máu cơ bản (Blood agar base) của hãng Merck (Cat. No. 110886) 4).
B.2.2 Cách tiến hành
Chuẩn bị môi trường thạch máu cơ bản theo hướng dẫn của nhà sản xuất.
Hòa tan các thành phần trên.
Vô trùng môi môi trường ở 121 °C trong 20 min bằng nồi hấp (5.3).
Lắc đều và chia ra đĩa petri (5.13) khoảng 20 ml/đĩa.
Đặt ít nhất một đĩa môi trường thạch glycerol vào trong tủ ấm (5.1) ủ ở 37 °C với điều kiện hiếu khí để kiểm tra vô trùng. Sau từ 18 h đến 24 h, trên bề mặt môi trường thạch không có khuẩn lạc mọc là đảm bảo vô trùng sẽ được bảo quản và sử dụng.
Bảo quản các đĩa môi trường trong tủ lạnh (5.20) ở nhiệt độ 4 °C.
B.3 Môi trường thạch khoai tây glycerol
B.3.1 Nguyên liệu
Thành phần:
| Môi trường thạch máu cơ bản | 4 g |
| Bột khoai tây (potato extract) | 4 g |
| Glycerol | 5 ml |
| Nước cất vừa đủ | 100 ml |
| Chỉnh pH = 7,4 ± 0,2 ở 25 °C |
|
VÍ DỤ: dùng môi trường thạch máu cơ bản (Blood agar base) của hãng Merck (Cat. No. 110886) 4).
B.3.2 Cách tiến hành
Chuẩn bị môi trường thạch máu cơ bản theo hướng dẫn của nhà sản xuất.
Hòa tan các thành phần trên.
Vô trùng môi môi trường ở 121 °C trong 20 min bằng nồi hấp (5.3).
Lắc đều và chia ra đĩa petri (5.13) khoảng 20 ml/đĩa.
Đặt ít nhất một đĩa môi trường thạch khoai tây glycerol vào trong tủ ấm (5.1) ủ ở 37 °C với điều kiện hiếu khí để kiểm tra vô trùng. Sau từ 18 h đến 24 h, trên bề mặt môi trường thạch không có khuẩn lạc mọc là đảm bảo vô trùng sẽ được bảo quản và sử dụng.
Bảo quản các đĩa môi trường trong tủ lạnh (5.20) ở nhiệt độ 4 °C.
B.4 Môi trường canh thang glycerol
B.4.1 Nguyên liệu
Thành phần:
| Môi trường BHI 5) | 3,7 g |
| Glycerol | 4 ml |
| Nước cất vừa đủ | 100 ml |
| Chỉnh pH = 7,4 ± 0,2 ở 25 °C |
|
B.4.2 Cách tiến hành
Chuẩn bị môi trường BHI theo hướng dẫn của nhà sản xuất;
Hòa tan các thành phần trên;
Chia ra ống nghiệm, 10 ml/ống (5.12);
Vô trùng môi môi trường ở 121 °C trong 20 min bằng nồi hấp (5.3);
Đặt ít nhất một ống môi trường canh thang Glycerol vào trong tủ ấm (5.1) ủ ở 37 °C với điều kiện hiếu khí để kiểm tra vô trùng. Sau từ 18 h đến 24 h, ống môi trường không đục, không có váng là đảm bảo vô trùng sẽ được bảo quản và sử dụng.
Bảo quản các ống môi trường trong tủ lạnh (5.20) ở nhiệt độ 4 °C.
B.5 Môi trường bảo quản và vận chuyển mẫu (Môi trường Cary Blair)
Thành phần:
| Dinatri hydro phosphat (Na2HPO4) | 1,1 g |
| Natri thioglycollat (C2H3NaO2S) | 1,5 g |
| Natri clorua (NaCl) | 5,0 g |
| Canxi clorua (CaCl2) | 0,1 g |
| Nước cất | 1000 ml |
| Chỉnh pH = 8,4 ± 0,2 ở 25 °C |
|
Có thể sử dụng môi trường thương mại đã pha sẵn hoặc môi trường tự pha chế, theo hướng dẫn của nhà sản xuất.
VÍ DỤ: Dùng môi trường Cary Blair chế sẵn của hãng Aptaca (Cat. No. 309/SG); hoặc môi trường Cary Blair tự pha chế của hãng Himedia (Cat No. M202) hoặc của hãng Alpha Biosciences (Cat No. CO3-125) 6)
Vô trùng môi trường ở nhiệt độ 100 °C trong 15 min bằng nồi hấp (5.3).
Lắc đều và chia ra ống đựng mẫu khoảng 7 ml/ống có dung tích 9 ml có nắp vặn chặt.
Đặt ít nhất một ống môi trường vào trong tủ ấm (5.1) ủ ở 37 °C với điều kiện hiếu khí để kiểm tra vô trùng. Sau từ 18 h đến 24 h, ống môi trường không đục, không có váng là đảm bảo vô trùng sẽ được bảo quản và sử dụng.
Bảo quản các ống môi trường trong tủ lạnh (5.20) ở nhiệt độ 4 °C.
Phụ lục C
(Quy định)
Xác định các đặc tính sinh hóa của vi khuẩn B. mallei
C.1 Phản ứng kali hydroxit
C.1.1 Dung dịch kali hydroxit 3 %
Thành phần
| Kali hydroxit (KOH) | 3 g |
| Nước cất | 100 ml |
Cách pha: Hòa 3 g kali hydroxit vào nước cất, lắc đều cho tan. Bảo quản ở nhiệt độ thường.
C.1.2 Cách tiến hành
Nhỏ 1 giọt (tương đương 30 μl) dung dịch kali hydroxit vào phiến kính (5.15)
Dùng que cấy (5.14) lấy 1 khuẩn lạc hoặc dùng pipet (5.11) hút 30 μl canh khuẩn lên giọt dung dịch kali hydroxit;
Trộn đều vi khuẩn và dung dịch kali hydroxit;
Đọc kết quả như sau:
- Phản ứng dương tính: Dung dịch nhớt, nhấc que trộn lên thấy nhày, nhớt;
- Phản ứng âm tính: Dung dịch đồng nhất, không nhày, không nhớt.
C.2 Phản ứng khử nitrat
C.2.1 Chuẩn bị
Thuốc thử:
- Dung dịch NaNO3 (pha dung dịch NaNO3 0,01 M trong đệm phosphat 0,022 M, pH 7)
- Axít HCl đặc pha loãng với nước theo tỷ lệ 1 : 1 (phần thể tích)
- Dung dịch sulphanilamid 0,2 %
- Dung dịch N-(1-naphthyl) etylendiamin dihydroclorua 0,1%
- Nước cất, vô trùng.
Dụng cụ:
- Ống nghiệm, vô trùng, có nắp vặn, kích thước 16 mm x 125 mm.
C.2.2 Cách tiến hành
- Cho vài giọt nước cất vào 1 ống nghiệm và cấy vào 1 vòng que cấy vi khuẩn B. mallei;
- Dùng một ống nghiệm khác có nước cất, không cấy vi khuẩn để làm đối chứng âm;
- Cho 2 ml dung dịch NaNO3;
- Lắc rồi ủ trong nồi cách thủy ở 37 °C trong 2 h;
- Cho tiếp vào ống nghiệm 1 giọt axit HCl, 2 giọt dung dịch sulphanilamid, 2 giọt dung dịch N-(1-naphthyl) etylendiamin dihydroclorua.
C.2.3 Đọc kết quả
- Phản ứng dương tính: Dung dịch trong ống có màu đỏ;
- Phản ứng âm tính: Dung dịch trong có màu giống đối chứng âm và có màu hồng.
C.3 Phản ứng phân hủy arginin
C.3.1 Môi trường arginin
Thành phần:
| Pepton | 4 g |
| L-arginin | 0,5 g |
| Glucose | 0,1 g |
| Chỉ thị màu bromocresol purple | 0,1 ml |
| Nước | 100 ml |
| Chỉnh pH đến 6,0 |
|
Dung dịch chỉ thị màu Bromocresol purple
| Bromocresol purple | 1,5 g |
| Cồn 90 % | 100 ml |
C.3.2 Cách tiến hành
Lấy khuẩn lạc nghi ngờ cho vào môi trường có chứa arginin và chỉ thị màu, nuôi cấy trong điều kiện hiếu khí ở tủ ấm (5.1), kiểm tra sau 24 h đến 72 h.
C.3.3 Đọc kết quả
- Dương tính: Môi trường chuyển màu tím;
- Âm tính: Môi trường có màu vàng (không chuyển màu).
Nếu sử dụng môi trường thương mại thì pha chế và đọc kết quả theo hướng dẫn của nhà sản xuất.
C.4 Kiểm tra khả năng sinh idol
C.4.1 Môi trường và thuốc thử
Chuẩn bị môi trường nước pepton: theo hướng dẫn của nhà sản xuất.
Thuốc thử Kovac’s, thành phần như sau:
| Paradimetyl aminobenzaldehyt | 5 g |
| Cồn amyl (2-Metylbutan-2-ol) | 75 ml |
| Axit clohydric đặc | 25 ml |
Cách pha:
Trộn dung dịch paradimetyl aminobenzaldehyt vào cồn amyl cho tan hết và để trong tủ lạnh 4 °C. Thêm từ từ 5 ml đến 10 ml axit dohydric đặc, trộn đều rồi để tủ lạnh, sau đó tiếp tục bổ sung axit clohydric.
Bảo quản thuốc thử trong lọ tối màu, ở 4 °C.
CHÚ THÍCH: Có thể sử dụng thuốc thử Kovac’s thương mại và làm theo hướng dẫn của nhà sản xuất.
C.4.2 Cách tiến hành
Dùng que cấy (5.14) lấy canh khuẩn hoặc khuẩn lạc của vi khuẩn nghi ngờ (xem 7.2.2) cấy vào môi trường nước pepton (xem C.4.1). Nuôi trong tủ ấm (5.1). Sau 48 h đến 72 h nuôi cấy, nhỏ từ 0,2 ml đến 0,3 ml dung dịch thuốc thử Kovac’s (xem C.4.1) vào môi trường, lắc nhẹ.
Đọc kết quả:
- Phản ứng dương tính (sinh indol): Xuất hiện vòng màu đỏ phía trên môi trường.
- Phản ứng âm tính (không sinh indol): Không xuất hiện vòng màu đỏ.
C.5 Kiểm tra khả năng lên men đường
C.5.1 Môi trường nước pepton - đường
Thành phần:
- Nước pepton.
- Dung dịch chỉ thị màu bromocrezol: Cho 0,2 g bromocrezol vào 100 ml etanol 90 % (thể tích) và lắc cho tan hết.
- Dung dịch đường: Glucose, sucrose, lactose, mannitol.
Pha glucose (hoặc sucrose, lactose, mannitol) thành dung dịch 10 % (thể tích) trong nước, hấp tiệt trùng môi trường bằng nồi hấp (5.3) ở 110 °C trong 15 min đến 20 min hoặc hấp cách quãng 3 lần ở 100 °C trong 30 min hoặc lọc qua màng lọc có kích thước lỗ lọc 0,45 μm.
Cách pha:
Cho 1 ml chỉ thị màu bromocrezol vào 100 ml môi trường nước pepton, chia ra các ống (4 ml mỗi ống). Vô trùng môi trường ở 121 °C trong 20 min bằng nồi hấp (5.3). Chỉnh pH môi trường ở 6,8 ± 0,2.
Thêm 0,4 ml dung dịch glucose 10 % (thể tích) hoặc lactose 10 % (thể tích) vào ống chứa 4 ml môi trường pepton đã có chất chỉ thị.
C.5.2 Cách tiến hành
Dùng que cấy (5.14) lấy canh khuẩn hoặc khuẩn lạc của vi khuẩn nghi ngờ (xem 7.2.2) cấy vào ống môi trường nước pepton có đường glucose (hoặc lactose) (xem C.5.1).
Nuôi trong tủ ấm (5.1), đọc kết quả sau 48 h đến 72 h.
- Phản ứng dương tính: Môi trường chuyển màu vàng;
- Phản ứng âm tính: Môi trường không thay đổi màu.
C.6 Kiểm tra đặc tính sinh H2S
C.6.1 Môi trường
Chuẩn bị môi trường TSI hay Kligler (theo hướng dẫn của nhà sản xuất).
Thạch nghiêng chế từ Kligler hoặc TSI. Thạch màu đỏ và có 2 phần: phần thạch đứng bên dưới để kiểm tra khả năng lên men đường glucose, sinh hơi, sinh H2S, phần thạch nghiêng để kiểm tra khả năng lên men đường lactose.
C.6.2 Cách tiến hành
Lấy khuẩn lạc nghi ngờ cấy thẳng (chính giữa phần thạch đứng) xuống đáy ống nghiệm, rút dần que lên và tiếp tục cấy trên bề mặt nghiêng, nuôi cấy trong điều kiện hiếu khí ở tủ ấm (xem 5.1), kiểm tra sau 24 h đến 72 h.
C.6.3 Đọc kết quả
- Dương tính: Đáy ống nghiệm có màu đen;
- Âm tính: Đáy ống nghiệm không có màu đen.
C.7 Kiểm tra khả năng di động
Kiểm tra đặc tính di động của vi khuẩn có thể dùng phương pháp giọt treo dưới kính hiển vi (5.2) hoặc cấy vi khuẩn vào môi trường thạch bán lỏng (semi-solid).
Phương pháp giọt treo dưới kính hiển vi:
Dùng phiến kính đặc biệt có phần lõm hình tròn ở giữa.
Cho một giọt canh khuẩn lên giữa kính phủ vật. Thận trọng xoay ngược lá kinh cho giọt canh khuẩn quay xuống phía dưới rồi đặt lên phần lõm của phiến kính.
Chú ý không giọt canh khuẩn lan rộng hay chạm vào đáy của phần lõm.
Đặt tiêu bản lên kính hiển vi (5.2) và quan sát tiêu bản ở vật kính độ phóng đại 10 X hoặc 40 X.
Trên thị trường hiện nay đã xuất hiện một dụng cụ có tên gọi là vòng O (O-ring) dùng để thực hiện giọt treo mà không cần lam kính lõm. Đây là một miếng đệm hình tròn, có kích thước vòng trong 12 mm, cao 3 mm có thể sử dụng nhiều lần. Khi thực hiện, đặt vòng O lên giữa lam kính thường, đưa giọt canh khuẩn vào một mặt của kính phủ vật, xoay ngược kính phủ vật và úp lên vòng O.
Kiểm tra khả năng di động của vi khuẩn bằng môi trường thạch lỏng:
Chuẩn bị môi trường: Môi trường thạch lỏng (từ 0,2 % đến 0,5 % thạch) đựng trong ống nghiệm.
Cách tiến hành: Dùng que cấy nhọn vô trùng lấy vi khuẩn rồi cấy trích sâu vào ống nghiệm có chứa môi trường thạch lỏng. Đặt ống nghiệm thẳng, nuôi cấy trong điều kiện hiếu khí ở tủ ấm (5.1), sau 24 h đến 72 h đọc kết quả.
- Khả năng di động dương tính: Vi khuẩn mọc lan ra xung quanh đường cấy trích sâu.
- Khả năng di động âm tính: Vi khuẩn chỉ mọc theo đường cấy trích sâu.
C.8 Phản ứng catalase
Nhỏ một giọt dung dịch H2O2 3 % lên phiến kính sạch.
Lấy khuẩn lạc nghi ngờ cho vào giọt dung dịch H2O2 3 %.
Đọc kết quả sau 5 s như sau:
- Dương tính: Có hiện tượng sủi bọt;
- Âm tính: Không có hiện tượng sủi bọt.
C.9 Phản ứng oxidase
Tiến hành trên giấy có tẩm dung dịch 1 % Tetrammethyl-P. phenylene diamin hydrochlorid.
Dùng que cấy lấy khuẩn lạc nghi ngờ phết lên mặt giấy đã thấm thuốc thử.
Đọc kết quả sau 30 s như sau:
- Dương tính: Tại chỗ phết khuẩn lạc có xuất hiện màu tím;
- Âm tính: Không xuất hiện màu tím.
Phụ lục D
(Quy định)
Xác định vi khuẩn B. mallei bằng phương pháp PCR
D.1 Nguyên liệu cho phương pháp PCR
D.1.1 Taq PCR Master Mix Kit
D.1.2 Cặp mồi (primers): xem Bảng 2
D.1.3 Nước tinh khiết không có nuclease
D.1.4 Dung dịch đệm điện di: Có thể dùng dung dịch đệm TAE hoặc TBE
D.1.5 Chất nhuộm màu ADN
VÍ DỤ: Chất nhuộm màu SYBR safe ADN gel stain của hãng Invitrogen; hoặc chất nhuộm màu Gel Red của hãng Biotium 7).
CẢNH BÁO: Không sử dụng chất nhuộm màu ethidi bromua vì có thể gây ung thư.
D.1.6 Đệm tải mẫu (Loading dye)
D.1.7 ADN chuẩn (Ladder, marker), thang 100 bp
D.1.8 Dung dịch đệm TE.
D.2 Chuẩn bị mẫu
Mẫu kiểm tra là bệnh phẩm hoặc canh khuẩn, khuẩn lạc nghi là vi khuẩn B. mallei (xem 7.3.3.1).
Bất hoạt mẫu vi khuẩn từ canh khuẩn hoặc khuẩn lạc: Dùng pipet (5.11) hút 200 μl canh khuẩn nghi ngờ là vi khuẩn B. mallei (xem 7.2.2) vào ống ly tâm 1,5 ml (5.19) hoặc lấy từ 2 khuẩn lạc đến 3 khuẩn lạc nghi ngờ là vi khuẩn B. mallei (xem 7.2.2), hòa vào 200 μl nước vô trùng không chứa nuclease. Đun sôi cách thủy ống ly tâm đã có vi khuẩn trong 60 min hoặc dùng bể điều nhiệt ủ mẫu ở 100 °C trong 60 min.
Mẫu đối chứng dương: Là ADN của chủng vi khuẩn đã được xác định là B. mallei hoặc sử dụng các chủng B. mallei chuẩn.
Tách chiết ADN
Mẫu bệnh phẩm hoặc vi khuẩn sau khi bất hoạt được tách chiết ADN bằng các kít thương mại. Các bước tiến hành theo hướng dẫn của nhà sản xuất.
VÍ DỤ: Kít tách chiết ADN của hãng Qiagen (DNeasy Blood & Tissue Kit, Catalog number: 69504); Kít tách chiết ADN của hãng Invitrogen (PureLink™ Genomic DNA Mini Kit, Catalog number: K182002) 8).
Đối với mẫu là vi khuẩn đã được bất hoạt bằng nhiệt ở 100 °C trong 60 min sẽ được lạnh nhanh rồi ly tâm bằng máy ly tâm (5.4) với gia tốc 12 000 g trong 4 min. Thu hoạch phần trong phía trên để thực hiện phản ứng PCR.
D.3 Chuẩn bị mồi
Mồi được chuẩn bị như sau:
- Chuẩn bị mồi gốc: Mồi gốc ở trạng thái đông khô phải được ly tâm nhanh bằng máy ly tâm (5.4) ở gia tốc 6 000 g trong 30 s để mồi lắng xuống đáy ống trước khi mở và hoàn nguyên. Lần đầu tiên nên dùng dung dịch đệm TE (xem D.1.8) để hoàn nguyên mồi ở nồng độ 100 μM/μl làm mồi gốc;
- Chuẩn bị mồi sử dụng ở nồng độ 20 μM/μl: Pha loãng mồi gốc bằng nước tinh khiết không có nuclease (xem D.1.3).
VÍ DỤ: lấy 20 μl mồi gốc có nồng độ 100 μl và thêm 80 μl nước sẽ được mồi sử dụng có nồng độ 20 μM / μl.
D.4 Cách tiến hành
Sử dụng cặp mồi đã được chuẩn bị (xem D.3). Hỗn hợp phản ứng được chuẩn bị trong ống 0,2 ml.
Sử dụng kít nhân gen theo hướng dẫn của nhà sản xuất.
VÍ DỤ: dùng kít nhân gen của Thermo Scientific Dream Taq PCR Mastermix (2X) (Cat. No. K1071) 8), thành phần cho một phản ứng được nêu trong Bảng D.1.
Bảng D.1 - Thành phần của phản ứng PCR
| Thành phần | Thể tích (μl) |
| Thermo Scientific Dream Taq PCR Mastermix (2 X) | 12,5 |
| Nước không có nuclease | 6,5 |
| Mồi xuôi 20 μM | 0,5 |
| Mồi ngược 20 μM | 0,5 |
| Tổng thể tích | 20,0 |
Chuyển 20 μl hỗn hợp nhân gen vào mỗi ống phản ứng.
- Mẫu đối chứng dương: Cho 5 μl mẫu ADN của vi khuẩn B. mallei vào ống phản ứng.
- Mẫu đối chứng âm: Cho 5 μl nước tinh khiết không có nuclease vào ống phản ứng.
- Mẫu bệnh phẩm: Cho 5 μl mẫu ADN cần kiểm tra vào ống phản ứng.
LƯU Ý: Phản ứng PCR phải bao gồm: mẫu thử, mẫu đối chứng dương, mẫu đối chứng âm. Mẫu và nguyên vật liệu cho phản ứng PCR cần đặt trong khay đá lạnh trong suốt quá trình chuẩn bị hỗn hợp phản ứng.
Tiến hành phản ứng bằng máy PCR (5.6) với chu trình nhiệt như nêu trong bảng D.2.
Bảng D.2 - Chu trình nhiệt xác định vi khuẩn B. mallei
| Nhiệt độ | Thời gian | Số chu kỳ |
| 94 °C | 2 min | 1 vòng |
| 94 °C | 30 s | 35 vòng |
| 54 °C | 30 s | |
| 72 °C | 30 s | |
| 72 °C | 10 min | 1 vòng |
| CHÚ THÍCH: Chu trình nhiệt và thời gian phản ứng có thể thay đổi tùy theo bộ kít nhân gen. Khi sử dụng các bộ kít khác nhau cần thực hiện theo hướng dẫn của nhà sản xuất. | ||
D.5 Chạy điện di
Sản phẩm PCR được chạy điện di bằng bộ điện di (5.5) trên thạch agarose 1,5 % đến 2 % trong dung dịch đệm TAE hoặc TBE có bổ sung chất nhuộm màu (xem D.1.5). Cách pha chế thạch agarose và bổ sung chất nhuộm màu, sử dụng theo hướng dẫn của nhà sản xuất.
Cho 2 μl dung dịch loading dye (xem D.1.6) vào 10 μl sản phẩm PCR, trộn đều cho vào từng giếng trên bản thạch. Cho 10 μl thang chuẩn (marker) (xem D.1.7) vào một giếng.
Bản thạch được chạy điện di trong môi trường dung dịch đệm TAE hoặc TBE (tùy thuộc vào loại dung dịch đệm sử dụng khi pha thạch), trong thời gian từ 20 min đến 30 min, ở 100 V.
D.6 Đọc kết quả
Phản ứng PCR có nghĩa khi: Mẫu đối chứng dương có một vạch duy nhất đúng kích cỡ của sản phẩm (989 bp) và mẫu đối chứng âm không xuất hiện vạch.
- Mẫu kiểm tra dương tính khi sản phẩm PCR có vạch giống mẫu đối chứng dương (sản phẩm có kích cỡ 989 bp);
- Mẫu kiểm tra âm tính khi sản phẩm PCR không có vạch, giống mẫu đối chứng âm.
Phụ lục E
(Quy định)
Xác định vi khuẩn B. mallei bằng phương pháp Realtime PCR
E.1 Nguyên liệu cho phương pháp Realtime PCR
E.1.1 Realtime Master Mix kit;
VÍ DỤ: QuantiTect Probe PCR kit (Cat. No. 204343), Platinum™ Quantitative PCR SuperMix-UDG (Cat No. 11730025) 9).
E.1.2 Cặp mồi (primers) và mẫu dò: (xem Bảng 3);
E.1.3 Nước tinh khiết không có nuclease;
E.1.4 Dung dịch đệm TE
E.2 Chuẩn bị mẫu
Mẫu kiểm tra: Là bệnh phẩm hoặc canh khuẩn, khuẩn lạc nghi là vi khuẩn B. mallei (xem 7.3.3.1).
Bất hoạt mẫu vi khuẩn từ canh khuẩn hoặc khuẩn lạc: Dùng pipet (5.11) hút 200 μl canh khuẩn nghi ngờ là vi khuẩn B. mallei (xem 7.2.2) vào ống ly tâm 1,5 ml (5.19) hoặc lấy từ 2 khuẩn lạc đến 3 khuẩn lạc nghi ngờ là vi khuẩn B. mallei (xem 7.2.2), hòa vào 200 μl nước vô trùng không chứa nuclease (nuclease free water). Đun sôi cách thủy ống ly tâm đã có vi khuẩn trong 60 min hoặc dùng bể điều nhiệt ủ mẫu ở 100 °C trong 60 min.
Mẫu đối chứng dương: Là ADN của chủng vi khuẩn đã được xác định là B. mallei hoặc sử dụng các chủng B. mallei chuẩn.
Tách chiết ADN
Mẫu bệnh phẩm hoặc vi khuẩn sau khi bất hoạt được tách chiết ADN bằng các kít thương mại. Các bước tiến hành theo hướng dẫn của nhà sản xuất.
VÍ DỤ: Kít tách chiết ADN của hãng Qiagen (DNeasy Blood & Tissue Kit, Catalog number: 69504); Kít tách chiết ADN của hãng Invitrogen (PureLink™ Genomic DNA Mini Kit, Catalog number: K182002) 9).
Đối với mẫu kiểm tra là vi khuẩn đã được bất hoạt bằng nhiệt ở 100 °C trong 60 min sẽ được làm lạnh nhanh rồi ly tâm (4.5) với gia tốc 12 000 g trong 4 min. Thu hoạch phần trong phía trên để thực hiện phản ứng Realtime PCR.
E.3 Chuẩn bị mồi và mẫu dò
- Chuẩn bị mồi gốc và mẫu dò gốc: Mồi và mẫu dò ở trạng thái đông khô phải được ly tâm nhanh (4.5) ở gia tốc 6 000 vòng trong 30 s để mồi lắng xuống đáy ống trước khi mở và hoàn nguyên. Lần đầu tiên nên dùng dung dịch đệm TE (xem E.1.4) để hoàn nguyên mồi và mẫu dò ở nồng độ 100 μM làm mồi gốc và mẫu dò gốc.
- Chuẩn bị mồi, mẫu dò sử dụng ở nồng độ 20 μM: Pha loãng mồi gốc bằng nước tinh khiết không có nuclease (E.1.3).
VÍ DỤ: lấy 20 μl mồi gốc hoặc mẫu dò gốc có nồng độ 100 μl và thêm 80 μl nước sẽ được mồi sử dụng có nồng độ 20 μM/μl.
E.4 Cách tiến hành
Sử dụng cặp mồi và mẫu dò đã được chuẩn bị (xem E.3).
Hỗn hợp phản ứng được chuẩn bị trong ống 0,2 ml.
Phản ứng Realtime PCR sử dụng kít nhân gen theo hướng dẫn của nhà sản xuất.
VÍ DỤ: Sử dụng kit nhân gen QuantiTect Probe PCR kit, code: 204343 10).
Bảng E.1 - Thành phần của phản ứng Realtime PCR
| Thành phần | Thể tích (μl) |
| QuantiTect Probe PCR kit | 12,5 |
| Nước không có nuclease | 6,0 |
| Probe 20 μM | 0.5 |
| Mồi xuôi 20 μM | 0,5 |
| Mồi ngược 20 μM | 0,5 |
| Tổng thể tích | 20,0 |
Chuyển 20 μl hỗn hợp nhân gen vào mỗi ống phản ứng.
- Mẫu kiểm chứng dương: Cho 5 μl mẫu ADN có giá trị Ct đã biết trước vào ống phản ứng.
- Mẫu kiểm chứng âm: Cho 5 μl nước tinh khiết không có nuclease vào ống phản ứng.
- Mẫu bệnh phẩm: Cho 5 μl mẫu ADN vào ống phản ứng.
LƯU Ý: Phản ứng Realtime PCR phải bao gồm: mẫu thử, mẫu đối chứng dương, mẫu đối chứng âm. Mẫu và nguyên vật liệu cho phản ứng Realtime PCR cần đặt trong khay đá lạnh trong suốt quá trình chuẩn bị hỗn hợp phản ứng.
Tiến hành phản ứng bằng máy Realtime PCR (5.7) theo đặt chu trình nhiệt nêu trong Bảng E.2.
Bảng E.2 - Chu trình nhiệt phản ứng Realtime PCR
| Nhiệt độ | Thời gian | Số chu kỳ |
| 50 °C | 2 min | 1 vòng |
| 95 °C | 15 min | 1 vòng |
| 94 °C | 15 s | 45 vòng |
| 60 °C (*) | 1 min | |
| (*) Thời điểm ghi nhận tín hiệu huỳnh quang. CHÚ THÍCH: Chu trình nhiệt và thời gian phản ứng có thể thay đổi tùy theo bộ kít nhân gen. Khi sử dụng các bộ kít khác nhau cần thực hiện theo hướng dẫn của nhà sản xuất. | ||
E.5 Đọc kết quả
Đọc kết quả phản ứng bằng máy Reatime PCR dựa trên giá trị Ct (thời điểm máy đọc Realtime PCR ghi nhận tín hiệu huỳnh quang phát ra từ ống phản ứng bắt đầu vượt qua cường độ huỳnh quang nền).
Điều kiện phản ứng được công nhận: Mẫu kiểm chứng dương tính có giá trị Ct biết trước (± 2 giá trị Ct), mẫu kiểm chứng âm tính không có Ct;
- Mẫu kiểm tra dương tính khi giá trị Ct ≤ 40;
- Mẫu kiểm tra âm tính khi không có giá trị Ct;
- Mẫu kiểm tra nghi ngờ khi có giá trị 40 < Ct ≤ 45.
Những mẫu nghi ngờ cần được xét nghiệm lại theo quy trình hoặc bằng phương pháp khác để khẳng định.
Phụ lục F
(Quy định)
Phản ứng Mallein
F.1 Chuẩn bị kháng nguyên
- Kháng nguyên là canh khuẩn B. mallei được nuôi trong môi trường canh thang glycerol (xem B.4);
- Ly tâm, thu nước trong phía trên để tiến hành phản ứng Mallein.
CHÚ Ý: Có thể dùng kháng nguyên PPD Mallein thương mại cho phản ứng Mallein
F.2 Tiến hành phản ứng Mallein
Phản ứng có thể làm theo 2 phương pháp: nhỏ mắt, tiêm dưới da.
Phương pháp nhỏ mắt:
- Nhỏ 2 giọt đến 3 giọt (tương đương 0,2 ml) kháng nguyên mallein vào trong kết mạc một bên mắt của gia súc, mắt bên kia không nhỏ để làm đối chứng âm.
- Đọc kết quả lần 1 sau 8 h đến 12 h sau khi nhỏ kháng nguyên;
- Đọc kết quả lần 2 sau 16 h đến 24 h sau khi nhỏ kháng nguyên.
Phương pháp tiêm dưới da:
- Gia súc cần được theo dõi nhiệt độ trước 2 ngày tiêm kháng nguyên. Thân nhiệt của gia súc không vượt quá 38,5 °C.
- Tiêm 1 ml kháng nguyên mallein vào dưới da vùng cổ hoặc da vùng yếm của gia súc.
- Sau 6 h đến 8 h tiêm kháng nguyên, theo dõi thân nhiệt gia súc và quan sát biến đổi nơi tiêm, và theo dõi đến 72 h sau tiêm.
F.3 Đọc kết quả
Với phương pháp nhỏ mắt:
- Phản ứng dương tính: Kết mạc có mủ, sưng hoặc hơi sưng, đầu khóe mắt có mủ chảy ra thành hình sợi nhỏ.
- Phản ứng âm tính: Kết mạc mắt không thay đổi hoặc chỉ hơi đỏ.
- Phản ứng nghi ngờ: Kết mạc mắt đỏ, sưng, chảy nước mắt, ở đầu khóe mắt chỉ có ít mủ. Trong trường hợp này cần làm lại phản ứng sau 3 tuần và nên kết hợp với phản ứng huyết thanh học.
Với phương pháp tiêm dưới da:
- Phản ứng dương tính: Sau 15 h tiêm kháng nguyên, thân nhiệt gia súc tăng (trên 39,5 °C), chỗ tiêm sưng, nóng và có biểu hiện đau. Sau 24 h đến 36 h tiêm, chỗ tiêm tiếp tục sưng to, đo độ sưng da từ 10 mm đến 20 mm và giữ nguyên trong 2 ngày đến 3 ngày. Gia súc mệt mỏi, không ăn, mạch đập nhanh.
- Phản ứng âm tính: Sau 15 h tiêm kháng nguyên, thân nhiệt gia súc không quá 39 °C.
- Phản ứng nghi ngờ: Sau 15 h tiêm kháng nguyên, thân nhiệt tăng đến trên 39 °C nhưng không có phản ứng cục bộ.
Phụ lục G
(Quy định)
Phản ứng kết hợp bổ thể (CFT)
G.1 Chuẩn bị
G.1.1 Chuẩn bị kháng nguyên
- Vi khuẩn B. mallei (lưu giữ ở nhiệt độ âm 80 °C) được cấy vào thạch máu cừu, nuôi ở tủ ấm 37 °C trong 24 đến 72 h.
- Lấy 1 vòng que cấy khuẩn lạc cho vào môi trường BHI 3 % glycerol), nuôi ở tủ ấm 37 °C trong 48 h.
- Lấy 1 ml canh trùng trên cho vào 100 ml môi trường BHI 3 % glycerol)/nuôi ở tủ ấm 37 °C trong 48 h có lắc nhẹ.
- Vô hoạt canh trùng bằng cách đun sôi cách thủy canh trùng ở 100 °C trong 1 h.
- Ly tâm canh trùng đã vô hoạt ở gia tốc 2500 g trong 10 min, thu dịch nổi phía trên (dịch thu được là kháng nguyên).
- Chia nhỏ kháng nguyên vào các ống, lọ vô trùng, tối màu.
- Bảo quản kháng nguyên ở nhiệt độ 4 °C.
G.1.2 Chuẩn bị dung dịch VBS
Pha dung dịch VBS 5X, chuẩn bị 3 loại dung dịch sau:
Dung dịch 1:
| Natri clorua | 21,25 g |
| Natri barbiton (C8H11N2NaO3) | 0,94 g |
| Nước cất | 350 ml |
Dung dịch 2:
| Barbiton (C8H11N2O3) | 1,44 g |
| Nước cất nóng | 125 ml |
Dung dịch 3:
| MgCl2 | 20,33 g |
| CaCl2 | 4,41 g |
| Nước cất | 100 ml |
Trộn dung dịch 1 vào dung dịch 2, để nguội ở nhiệt độ phòng;
Thêm 1,25 ml dung dịch 3;
Trộn đều và điều chỉnh pH = 7,4 ± 0,1 (sử dụng HCl để điều chỉnh);
Sử dụng dung dịch VBS 1 X bằng cách pha loãng dung dịch VBS 5 X với nước theo tỷ lệ 1 : 4 (phần thể tích).
G.1.3 Chuẩn độ kháng nguyên, bổ thể
CHÚ Ý: Sử dụng kháng nguyên, bổ thể thương mại thì tiến hành theo hướng dẫn của nhà sản xuất.
- Cho 25 μl dung dịch VBS vào tất cả các giếng của đĩa chữ U 96 giếng;
- Cho 25 μl kháng nguyên vào giếng đầu tiên. Tiến hành pha loãng kháng nguyên theo cơ số 2 bằng thao tác pipet khoảng 10 lần (tránh tạo bọt): hút 25 μl ở giếng đầu tiên sang giếng thứ 2, trộn đều, hút 25 μl ở giếng thứ 2 sang giếng thứ 3, trộn đều…, đến giếng cuối cùng thì hút bỏ 25 μl;
- Cho 25 μl bổ thể vào tất cả các các giếng;
- Cho 25 μl dung dịch hồng cầu cừu 3 % vào tất cả các giếng;
- Đọc kết quả sau 20 min.
Phản ứng dương tính: Xuất hiện hạt ngưng kết lấm chấm;
Phản ứng âm tính: Hồng cầu lắng xuống đáy tạo thành chấm tròn;
Đơn vị ngưng kết (HAU) được tính ở độ pha loãng kháng nguyên cao nhất còn xuất hiện ngưng kết hoàn toàn. Sử dụng 4 đơn vị HAU để làm phản ứng CFT.
VÍ DỤ: Đơn vị ngưng kết là 1/256 (tức là 8 log2) thì 4 HAU sẽ là 4 x 1/256 = 1/64. Lúc này sẽ pha kháng nguyên trong VBS theo tỷ lệ 1 : 63 (phần thể tích).
G.1.4 Chuẩn bị mẫu huyết thanh kiểm tra
- Mẫu huyết thanh được pha loãng 1/5 trong dung dịch VBS có chứa 0,1 % gelatin;
- Bất hoạt huyết thanh được pha loãng trên ở nhiệt độ 56 °C đến 60 °C trong 30 min (trường hợp với mẫu huyết thanh ngựa thì bất hoạt ở 63 °C.
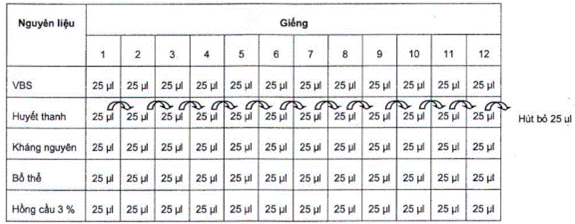
G.2 Cách tiến hành
- Cho 25 μl dung dịch VBS vào tất cả các giếng của đĩa chữ U 96 giếng;
- Cho 25 μl huyết thanh vào các giếng theo sơ đồ bố trí thí nghiệm;
- Pha loãng mẫu huyết thanh theo cơ số 2 bằng thao tác pipet khoảng 10 lần (tránh tạo bọt): hút 25 μl ở giếng đầu tiên sang giếng thứ 2, trộn đều, hút 25 μl ở giếng thứ 2 sang giếng thứ 3, trộn đều…, đến giếng cuối cùng thì hút bỏ 25 μl;
- Cho 25 μl kháng nguyên vào tất cả các các giếng (kháng nguyên được sử dụng ở 4 HAU);
- Cho 25 μl bổ thể vào tất cả các các giếng;
- Ủ đĩa thí nghiệm ở 37 °C trong 1 h (hoặc để 4 °C qua đêm);
- Cho 25 μl dung dịch hồng cầu cừu 3 % vào tất cả các giếng;
- Ủ đĩa thí nghiệm ở 37 °C trong 45 min;
- Ly tâm đĩa thí nghiệm với gia tốc 600 g trong 5 min, đọc kết quả.
LƯU Ý: Phản ứng thực hiện có các đối chứng sau
- Đối chứng dương: gồm dung dịch VBS, huyết thanh dương tính với kháng thể B. mallei, kháng nguyên, bổ thể, hồng cầu;
- Đối chứng âm gồm dung dịch VBS, huyết thanh âm tính với kháng thể B. mallei, kháng nguyên, bổ thể, hồng cầu;
- Đối chứng huyết thanh: gồm dung dịch VBS, huyết thanh đã bất hoạt, bổ thể, hồng cầu;
- Đối chứng kháng nguyên: gồm dung dịch VBS, kháng nguyên, bổ thể, hồng cầu;
- Đối chứng hồng cầu: gồm dung dịch VBS, hồng cầu;
- Đối chứng bổ thể: gồm dung dịch VBS, kháng nguyên và bổ thể theo 4 đơn vị HAU, hồng cầu.
Bảng G.1 - Sơ đồ các bước tiến hành phản ứng
G.3 Đọc kết quả
Phản ứng có nghĩa khi:
- Các giếng đối chứng dương: Không có dung huyết (hồng cầu ngưng kết);
- Các giếng đối chứng âm: Có dung huyết (hồng cầu bị tan);
- Các giếng đối chứng huyết thanh: Không có dung huyết (hồng cầu ngưng kết);
- Đối chứng kháng nguyên: Có dung huyết (hồng cầu bị tan);
- Đối chứng hồng cầu: Không có dung huyết (hồng cầu ngưng kết);
- Đối chứng bổ thể: Có dung huyết (hồng cầu bị tan).
Đánh giá mẫu kiểm tra:
- Mẫu huyết thanh dương tính: Mẫu huyết thanh pha loãng ở tất cả các giếng đều không dung huyết (hồng cầu ngưng kết);
- Mẫu huyết thanh âm tính: Mẫu huyết thanh pha loãng ở tất cả các giếng đều dung huyết;
- Mẫu huyết thanh nghi ngờ: Mẫu huyết thanh pha loãng ở tất cả các giếng có dung huyết từ 25 % đến 75 %.
CHÚ THÍCH 1: Phản ứng dương tính giả có thể xảy ra khi gia súc đang trong giai đoạn kiểm tra phản ứng Mallein.
CHÚ THÍCH 2: Giữa B. mallei và B. pseudomallei có khả năng phản ứng chéo và phản ứng huyết thanh học không thể phân biệt được.
Phụ lục H
(Quy định)
Phản ứng ngưng kết hoa hồng
H.1 Chuẩn bị
H.1.1 Kháng nguyên B. mallei
H.1.2 Huyết thanh dương tính với kháng thể B. mallei
H.1.3 Huyết thanh âm tính với kháng thể B. mallei
H.1.4 Mẫu huyết thanh cần kiểm tra, đã được diệt bổ thể ở nhiệt độ 56 °C đến 60 °C trong 30 min (trường hợp với mẫu huyết thanh ngựa thì bất hoạt ở 63 °C)
H.1.5 Phiến kính, sạch
H.1.6 Que trộn mẫu, sạch
H.1.7 Đồng hồ hẹn giờ
H.1.8 Pipet và đầu tip tương ứng, loại 100 μl
H.2 Tiến hành phản ứng
- Nguyên liệu phản ứng và mẫu huyết thanh để ở nhiệt độ phòng (22 °C ± 4 °C) khoảng 1h trước khi làm phản ứng;
- Lắc đều lọ kháng nguyên một cách nhẹ nhàng để kháng nguyên chắc chắn được đồng nhất;
- Nhỏ 30 μl mẫu huyết thanh lên trên phiến kính;
- Nhỏ 30 μl kháng nguyên lên huyết thanh;
- Trộn đều mẫu huyết thanh với kháng nguyên bằng que trộn;
- Lặp lại các bước trên với huyết thanh đối chứng âm, dương;
- Nhẹ nhàng lắc tròn phiến kính trong 2 min (có thể sử dụng máy lắc);
H.3 Đánh giá kết quả
Phản ứng có ý nghĩa khi đối chứng dương có xuất hiện ngưng kết là các chấm màu hồng và đối chứng âm không xuất hiện ngưng kết.
Mẫu huyết thanh dương tính: có xuất hiện ngưng kết là các chấm màu hồng;
Mẫu huyết thanh âm tính: không xuất hiện ngưng kết.
Thư mục tài liệu tham khảo
[1] OIE, 2018. Mannual of Diagnostic Test and Vaccines for Terrestrial Animals. Chapter 3.5.11. - Glanders and Melioidosis, p. 1350 - 1362.
[2] Ronald M. Atlas, James W. Snyder, 2010. Hand book of microbiology media, Fourth edition. Part: Glycerol medium, p.752.
[3] Mandy Carolina Elschner, Karine Laroucau,Harisankar Shingha, Bhupendra Nath Tripathi, 2019. Evaluation of the compartive accuracy of the complement fixation test, Western blot and five enzyme-linked immunosorbent assays for serodiagnosis of glanders. https://doi.org/10.1371/journal.pone.0214936.
[4] Scholz H.C., Joseph M., Tomaso H., AI dahouk S., Witte A., Kinne J., Hagen R.M., Wernery R., Wernery U. & Neubauer H., 2006. Detection of the reemerging agent Burkholderia mallei in a recent outbreak of glanders in the United Arab Emirates by a newly developed fliP-based polymerase chain reaction assay. Diagnostic. Microbiology Infectious Disease, 54, p. 241 - 247.
[5] Tomaso H., Scholz H.C., AI dahouk S., Eickhoff M., Treu T.M., Wernery R., Wernery U. & Neubauer H., 2006. Development of a 5’-nuclease real-time PCR assay targeting fliP for the rapid identification of Burkholderia mallei in clinical samples. Clinical Chemistry, 52, p. 307 - 310.
[6] Nguyễn Vĩnh Phước, 1978. Giáo trình bệnh truyền nhiễm gia súc. Chương IV: Bệnh truyền nhiễm của loài một móng (ngựa, lừa, la) - Bệnh tỵ thư, trang 246 - 258.
[7] Nguyễn Bá Hiên, Huỳnh Thị Mỹ Lệ, Lê Văn Lãnh, Đỗ Ngọc Thúy, 2012. Giáo trình bệnh truyền nhiễm thú y. Chương 6: Bệnh truyền nhiễm của một số loài vật nuôi khác - Phần 77: Bệnh tỵ thư, trang 646 - 649.
[8] Phạm Sỹ Lăng, Phan Đình Lân, Đặng Đình Hanh, 2008. Bệnh của ngựa ở Việt Nam và biện pháp phòng trị. Nhà xuất bản Nông nghiệp, trang 18-21.
1) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của các nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
2) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của các nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
3) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của các nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
4) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của các nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
5) Có thể dùng môi trường BHI (Brain Heart infusion) của hãng Merck (Cat. No. 110493). Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của các nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
6) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của các nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
7) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của các nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
8) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của các nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
9) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của các nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
10) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 8400-54:2022 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 8400-54:2022 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 8400-54:2022 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 8400-54:2022 DOC (Bản Word)