- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 9858-1:2013 quản lý rủi ro thiết bị y tế sử dụng mô động vật
| Số hiệu: | TCVN 9858-1:2013 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Y tế-Sức khỏe |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
2013 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 9858-1:2013
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 9858-1:2013
TIÊU CHUẨN QUỐC GIA
TCVN 9858-1:2013
ISO 22442-1:2007
THIẾT BỊ Y TẾ SỬ DỤNG MÔ ĐỘNG VẬT VÀ CÁC DẪN XUẤT - PHẦN 1: ÁP DỤNG QUẢN LÝ RỦI RO
Medical devices utilizing animal tissues and their derivatives - Part 1: Application of risk management
Lời nói đầu
TCVN 9858-1:2013 hoàn toàn tương đương với ISO 22442-1:2007;
TCVN 9858-1:2013 do Viện Trang thiết bị và Công trình y tế biên soạn, Bộ Y tế đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Bộ tiêu chuẩn TCVN 9858 (ISO 22442) Thiết bị y tế sử dụng mô động vật và các dẫn xuất, gồm các tiêu chuẩn sau:
- TCVN 9858-1:2013 (ISO 22442-1:2007) Phần 1: Áp dụng quản lý rủi ro.
- TCVN 9858-2:2013 (ISO 22442-2:2007) Phần 2: Kiểm soát việc lập nguồn, thu thập và xử lý.
- TCVN 9858-3:2013 (ISO 22442-3:2007) Phần 3: Đánh giá xác nhận việc loại trừ và/hoặc bất hoạt virus và các tác nhân gây bệnh xốp não lây truyền (TSE).
Bộ tiêu chuẩn ISO 22442 Medical devices utilizing animal tissues and their derivatives, còn các phần sau:
- ISO 22442-4: Medical devices utilizing animal tissues and their derivatives - Part 4: Principles for elimination and/or inactivation of transmissible spongiform encephalopathy (TSE) agents and validation asays for those processes.
Lời giới thiệu
Một số thiết bị y tế có sử dụng các vật liệu có nguồn gốc động vật.
Mô động vật và các dẫn xuất của chúng được sử dụng trong thiết kế và sản xuất các thiết bị y tế sẽ có nhiều ưu điểm hơn so với vật liệu không phải từ động vật. Phạm vi và số lượng các vật liệu có nguồn gốc động vật trong các thiết bị y tế rất đa dạng. Các vật liệu này có thể cấu thành một phần chủ yếu của thiết bị (ví dụ van tim bò/lợn, chất thay thế xương sử dụng trong nha khoa hoặc chỉnh hình, các dụng cụ cầm máu), có thể dùng làm lớp phủ ngoài sản phẩm hoặc trong ngâm tẩm (ví dụ collagen, gelatin, heparin) hoặc có thể được sử dụng trong quá trình sản xuất thiết bị (ví dụ các dẫn xuất của mỡ động vật như oleate và stearate, huyết thanh thai bê, men, môi trường nuôi cấy).
TCVN 8023 (ISO 14971) là tiêu chuẩn chung quy định quá trình cho nhà sản xuất nhận biết việc xác định các nguy hiểm và các tình huống nguy hiểm liên quan đến các thiết bị y tế, bao gồm các thiết bị y tế in vitro, nhằm ước lượng và đánh giá những rủi ro phối hợp với các nguy hiểm đó, nhằm kiểm soát các rủi ro và theo dõi tính hiệu quả của việc kiểm soát trong suốt chu trình sống. Tiêu chuẩn này cung cấp thêm các yêu cầu và hướng dẫn cho việc đánh giá các thiết bị y tế được sản xuất sử dụng mô động vật hoặc các dẫn xuất không còn sống hoặc đã được làm cho không còn sống.
Tiêu chuẩn này bao hàm cả các thiết bị y tế gồm các thiết bị y tế cấy ghép chủ động như bơm truyền dịch có thể cấy ghép được.
Tiêu chuẩn này không áp dụng cho các thiết bị chẩn đoán in vitro.
Tiêu chuẩn này chỉ có thể dùng kết hợp với TCVN 8023 (ISO 14971) và không phải là tiêu chuẩn độc lập.
CHÚ THÍCH Để cho thấy sự phù hợp theo tiêu chuẩn này, cần hoàn thành các yêu cầu đã được quy định. Các hướng dẫn nêu trong các phần chú thích và Thư mục tài liệu tham khảo không phải là bắt buộc và không cung cấp để làm danh sách kiểm tra cho chuyên gia đánh giá.
THIẾT BỊ Y TẾ SỬ DỤNG MÔ ĐỘNG VẬT VÀ CÁC DẪN XUẤT - PHẦN 1: ÁP DỤNG QUẢN LÝ RỦI RO
Medical devices utilizing animal tissues and their derivatives - Part 1: Application of risk management
1 Phạm vi áp dụng
Tiêu chuẩn này áp dụng cho các thiết bị y tế không phải các thiết bị chẩn đoán y tế in vitro được sản xuất có sử dụng nguyên liệu có nguồn gốc động vật không còn sống hoặc đã được làm cho không còn sống. Cùng với TCVN 8023 (ISO 14971), tiêu chuẩn này quy định phương pháp nhận dạng các nguy cơ và các tình huống nguy hiểm liên quan đến các thiết bị như vậy, nhằm ước lượng và đánh giá các rủi ro gây ra, kiểm soát các nguy cơ đó và theo dõi tính hiệu quả của quá trình kiểm soát đó. Ngoài ra, tiêu chuẩn này nêu quá trình ra quy trình chấp nhận rủi ro tồn dư, có xem xét sự cân bằng của rủi ro tồn dư, như định nghĩa trong TCVN 8023 (ISO 14971) và các lợi ích mong đợi về y tế khi so sánh với các phương án sẵn có. Tiêu chuẩn này cung cấp các yêu cầu và hướng dẫn về quản lý rủi ro liên quan đến các nguy hiểm điển hình của các thiết bị y tế được sản xuất bằng cách sử dụng mô động vật hoặc các dẫn xuất như:
a) sự lây nhiễm do vi khuẩn, nấm mốc, hoặc nấm men;
b) sự lây nhiễm do virus;
c) sự lây nhiễm do các yếu tố gây bệnh xốp não lây truyền (TSE);
d) vật liệu gây nên các phản ứng sốt, miễn dịch, hoặc độc tính.
Các nguyên tắc tương tự có thể áp dụng đối với các ký sinh trùng và các nguyên nhân gây bệnh chưa được phân loại khác.
Tiêu chuẩn này không quy định các mức chấp thuận vì chúng được xác định bởi nhiều yếu tố - trừ một số dẫn xuất đặc biệt nêu trong Phụ lục C. Phụ lục C quy định các mức chấp thuận rủi ro TSE đối với các dẫn xuất từ mỡ, than xương động vật, sữa và các dẫn xuất từ sữa, các dẫn xuất từ len và các axit amin.
Tiêu chuẩn này không quy định hệ thống quản lý chất lượng cho việc kiểm soát tất cả các giai đoạn sản xuất của các thiết bị y tế.
Tiêu chuẩn này không bao gồm việc sử dụng mô người trong các thiết bị y tế.
CHÚ THÍCH 1 Tiêu chuẩn này không đưa ra một hệ thống quản lý chất lượng đầy đủ trong sản xuất. Tuy nhiên, chú ý đến các bộ tiêu chuẩn về các hệ thống quản lý chất lượng (xem TCVN ISO 13485 (ISO 13485)) có kiểm soát tất cả các giai đoạn sản xuất hoặc tái chế các thiết bị y tế.
CHÚ THÍCH 2 Xem Phụ lục A về hướng dẫn áp dụng tiêu chuẩn này.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 7391-1 (ISO 10993-1), Đánh giá sinh học trang thiết bị y tế - Phần 1: Đánh giá và thử nghiệm.
TCVN 8023:2009 (ISO 14971: 2007), Thiết bị y tế - Áp dụng quản lý rủi ro đối với các thiết bị y tế.
TCVN 9858-2:2013 (ISO 22442-2:2007), Thiết bị y tế sử dụng mô động vật và các dẫn xuất - Phần 2: Kiểm soát việc lập nguồn, thu thập và xử lý.
TCVN 9858-3:2013 (ISO 22442-3:2007), Thiết bị y tế sử dụng mô động vật và các dẫn xuất - Phần 3: Đánh giá xác nhận việc loại trừ và/hoặc bất hoạt virus và các yếu tố gây bệnh xốp não lây truyền (TSE).
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này, áp dụng các thuật ngữ và định nghĩa nêu trong TCVN 8023 (ISO 14971) và các thuật ngữ, định nghĩa sau:
3.1
Động vật (animal)
Bất kỳ loài có xương sống hoặc không xương sống nào [bao gồm động vật lưỡng cư, chân đốt (ví dụ giáp xác), chim, san hô, cá, bò sát, nhuyễn thể và động vật có vú] trừ con người (Homo sapiens)
3.2
Tế bào (cell)
Đơn vị cấu trúc nhỏ nhất của bất kỳ dạng sống nào có thể tồn tại độc lập và thay thế các chất của mình trong môi trường thích hợp
3.3
Dẫn xuất (derivative)
Chất thu được từ vật liệu động vật của một quá trình sản xuất
VÍ DỤ axit hyaluronic, collagen, gelatine, kháng thể đơn dòng, chitosan, albumin.
3.4
Loại bỏ (elimination)
Quá trình qua đó các tác nhân lây truyền bị giảm bớt
CHÚ THÍCH 1 Tính hiệu quả của quá trình để loại bỏ virus và các yếu tố gây bệnh TSE nên được trình bày bằng toán học dưới dạng hệ số rút gọn (xem C.2 và Phụ lục F của TCVN 9858-3:2013 (ISO 22442-3:2007)).
CHÚ THÍCH 2 Việc loại bỏ là nhằm ngăn ngừa phản ứng nhiễm khuẩn hoặc sinh bệnh do các tác nhân truyền bệnh
3.5
Bất hoạt (inactivation)
Quá trình qua đó khả năng gây nhiễm trùng hoặc phản ứng gây bệnh của nhân tố lây bệnh được làm giảm đi
CHÚ THÍCH 1 Tính hiệu quả của quá trình bất hoạt virus và các nhân tố gây bệnh TSE nên được trình bày bằng toán học dưới dạng hệ số rút gọn (xem Phụ lục F của TCVN 9858-3:2013 (ISO 22442-3:2007)).
CHÚ THÍCH 2 Việc bất hoạt là nhằm ngăn ngừa nhiễm khuẩn và nhân lên của các nhân tố lây bệnh.
3.6
Thiết bị y tế (medical device)
Bất kỳ một công cụ, dụng cụ thí nghiệm, đồ dùng, máy móc, thiết bị, mô cấy, chất thử hoặc dưỡng đo in vitro, phần mềm, nguyên liệu hoặc các vật phẩm tương tự hoặc có liên quan, được nhà sản xuất dự kiến sử dụng đối với con người, một cách đơn lẻ hoặc kết hợp với nhau với một hoặc nhiều mục đích cụ thể là:
- chẩn đoán, phòng ngừa, giám sát, điều trị hoặc giảm nhẹ bệnh tật,
- chẩn đoán, giám sát, điều trị, giảm nhẹ hoặc phục hồi thương tật,
- nghiên cứu, thay thế, sửa đổi, hoặc hỗ trợ giải phẫu hoặc một quá trình sinh lý,
- hỗ trợ hoặc duy trì sự sống,
- kiểm soát sự thụ thai,
- tẩy rửa thiết bị y tế,
- cung cấp thông tin cho mục đích y tế bằng xét nghiệm in vitro các mẫu lấy từ cơ thể người,
và những thiết bị tuy không hoạt động theo đúng công dụng ban đầu của nó trong hoặc trên cơ thể người bằng các phương tiện dược lý, miễn dịch hoặc chuyển hóa nhưng các chức năng của chúng có thể được hỗ trợ bằng chính những phương tiện trên.
CHÚ THÍCH 1 Định nghĩa này được xây dựng bởi Tổ chức hài hòa các thủ tục toàn cầu (GHTF)[39].
CHÚ THÍCH 2 TCVN 9858 (ISO 22442) không áp dụng cho các thiết bị chẩn đoán in vitro
3.7
Không sống (non-viable)
Không có khả năng chuyển hóa hoặc nhân lên.
3.8
Thỏa thuận kỹ thuật (technical agreement)
Hợp đồng liên kết giữa hai hoặc nhiều bên có trách nhiệm đối với các yêu cầu kỹ thuật
3.9
Mô (tissue)
Tổ chức của các tế bào và/hoặc các thành phần của ngoại bào
3.10
Tác nhân lây truyền (transmissible agents)
Vi khuẩn, nấm mốc, nấm men, ký sinh trùng, virus, các tác nhân lây truyền TSE và tác nhân lây truyền chưa phân loại
4 Quá trình quản lý rủi ro
4.1 Quy định chung
Nhà sản xuất phải giải thích việc sử dụng vật liệu động vật (gồm việc lựa chọn loài và mô động vật) dựa trên khả năng chấp nhận rủi ro tồn dư, có xem xét sự cân đối giữa rủi ro tồn dư và lợi ích được mong đợi về y học, so với các biện pháp sẵn có khác.
Áp dụng các yêu cầu của TCVN 8023 (ISO 14971) và Điều 4.2 đến 4.5. Việc tuân thủ với các yêu cầu này phải được xác nhận qua kiểm tra hồ sơ quản lý rủi ro.
CHÚ THÍCH Bàn luận sâu về các lợi ích y học và phân tích rủi ro/lợi ích có thể xem ở TCVN 8023:2009 (ISO 14971:2007), Điều D.6.
4.2 Phân tích rủi ro
4.2.1 Nhận dạng các tính chất định tính và định lượng liên quan đến an toàn của thiết bị y tế
4.2.1.1 Thiết bị có tiếp xúc với bệnh nhân hoặc người nào khác không?
Số lượng vật liệu, diện tích bề mặt tiếp xúc và các kiểu vật liệu có tiếp xúc với mô hoặc dịch cơ thể cũng như loại mô hoặc dịch cơ thể tiếp xúc với nó phải được đề cập tới trong phần phân tích rủi ro. Đối với bệnh TSE, có thể xem hướng dẫn ở Điều D.3.7.
CHÚ THÍCH 1 Các thiết bị y tế như giầy chỉnh hình hay các bộ phận như dây da chỉ tiếp xúc với da lành có rủi ro nhiễm khuẩn thấp.
CHÚ THÍCH 2 Số lượng vật liệu tiếp xúc là một trong các yếu tố tạo ra các ảnh hưởng sinh học. Xem TCVN 7391 (ISO 10993) đối với phần đánh giá các ảnh hưởng như vậy.
CHÚ THÍCH 3 Cấu trúc mô động vật được xử lý có thể ảnh hưởng đến tính bất hoạt và/hoặc việc loại bỏ các nhân tố lây bệnh, và khả năng lưu giữ tế bào sống có thể bị ảnh hưởng bởi cấu trúc của mô động vật và các dẫn xuất được xử lý.
4.2.1.2 Các vật liệu hoặc bộ phận nào được tích hợp vào thiết bị y tế hoặc được sử dụng với, hoặc tiếp xúc với thiết bị y tế?
Phải đề cập đến các yếu tố sau nếu có thể:
a) nếu các vật liệu động vật sống được sử dụng trong việc sản xuất thiết bị y tế, xác nhận rằng thiết bị y tế thành phẩm không chứa vật liệu động vật còn sống;
b) mục đích sử dụng của các mô hoặc dẫn xuất;
c) nguồn gốc địa lý, loài, tuổi và việc chăn nuôi (bao gồm việc sử dụng protein từ động vật) động vật;
d) kiểm soát về thú y, các điều kiện trong đó các vật liệu động vật được thu hồi, rủi ro lây chéo;
e) loại và nguồn gốc giải phẫu của mô;
f) quá trình sản xuất, đặc biệt nếu sử dụng các vật liệu gom từ nhiều động vật;
g) tình trạng vật liệu được sử dụng trong thiết bị y tế (ví dụ mô lành, dẫn xuất có độ tinh khiết cao);
h) phương pháp sử dụng hoặc tích hợp vào thiết bị y tế.
CHÚ THÍCH Trong trường hợp các thiết bị y tế sử dụng một vài thành phần (ví dụ từ các loài, nguồn gốc, hoặc mô khác nhau) hoặc một vài loại thành phần tương tự được sản xuất bằng các phương pháp khác nhau, từng thành phần đơn lẻ cần được phân tích riêng.
4.2.1.3 Dụng cụ được cung cấp vô khuẩn hoặc sẽ được dự kiến khử khuẩn hay các biện pháp kiểm soát về vi sinh khác có thể áp dụng được không?
Vì bản chất sinh học của các mô và dẫn xuất động vật nên phải đánh giá các thay đổi về vi sinh vật tạp nhiễm của vi khuẩn, nấm mốc và nấm men của vật liệu động vật.
CHÚ THÍCH Xem TCVN 8581-1 (ISO11737-1) và ISO 14160.
4.2.1.4 Có thải ra các chất không mong muốn nào không?
Khả năng tồn tại của các chất tồn dư độc hại liên quan đến quá trình sản xuất hoặc các sản phẩm phụ thoái hóa phải được đề cập đến, có xem xét các đặc trưng lý học (ví dụ độ xếp, tính không đồng nhất) và thành phần hóa học của các mô hoặc dẫn xuất động vật.
CHÚ THÍCH Xem TCVN 7391-1 (ISO 10993-1), ISO 10993-9, TCVN 7391-17 (ISO 10993-17), TCVN 7391-18 (ISO 10993-18) và ISO 10993-19.
4.2.2 Nhận dạng các nguy hiểm và các tình huống nguy hiểm
Sự nguy hiểm liên quan đến các mô hoặc dẫn xuất động vật phải được xác định và nêu bằng văn bản. Phải chú ý đặc biệt đến các rủi ro có thể gây ra do mô hoặc dẫn xuất động vật về các khía cạnh sau:
- Khả năng nhiễm các tác nhân lây truyền bệnh và độ nhạy cảm của chúng đối với việc loại bỏ và/hoặc bất hoạt trong khi xử lý;
- Khả năng các chất ô nhiễm trên thành phẩm có thể gây ra các phản ứng sốt, miễn dịch, hay độc tính không mong muốn;
- Khả năng thành phẩm gây nên các phản ứng sốt, miễn dịch, hay độc tính không mong muốn.
4.3 Đánh giá rủi ro
Theo TCVN 8023 (ISO 14971), tất cả các rủi ro đã xác định phải được đánh giá. An toàn sinh học phải được đánh giá theo TCVN 7391-1 (ISO 10993-1). Việc đánh giá rủi ro đối với các yếu tố lây truyền bệnh phải được tiến hành bằng cách đánh giá riêng rẽ các rủi ro liên quan đến các loại yếu tố lây truyền bệnh khác nhau. Phụ lục B xác định các loại rủi ro chính cần được xem xét. Đối với rủi ro bệnh TSE, tuân thủ theo các yêu cầu quy định trong Phụ lục C đối với các vật liệu động vật nhất định có thể chỉ ra khả năng chấp nhận rủi ro.
CHÚ THÍCH Phụ lục C kết hợp các yếu tố đánh giá rủi ro và kiểm soát rủi ro.
4.4 Kiểm soát rủi ro
4.4.1 Quy định chung
Các lựa chọn về kiểm soát rủi ro phải được nêu thành văn bản và giải thích.
Biểu đồ tiến trình trong Phụ lục B nêu tổng quan về quy trình quản lý rủi ro. Nếu xác định được thêm các rủi ro khi sử dụng tiêu chuẩn này, nhà sản xuất thiết bị y tế có thể lựa chọn tuân theo bất kỳ tiêu chuẩn phù hợp nào khác hoặc bất kỳ lộ trình nào khác. Quyết định đưa ra cần được giải thích và lập văn bản.
4.4.2 Kiểm soát rủi ro đối với virus và các yếu tố gây bệnh TSE
Việc kiểm soát rủi ro phải được thực hiện bằng cách xử lý riêng rẽ các rủi ro liên quan đến các loại virus và các yếu tố gây bệnh TSE khác nhau. Sau khi xác định các tính chất của sản phẩm, nhà sản xuất thiết bị y tế phải tuân thủ với các yêu cầu liên quan của cả TCVN 9858-2 (ISO 22442-2) và TCVN 9858-3 (ISO 22442-3), trừ khi loài động vật là loại mà nhà sản xuất không thể đáp ứng một cách đầy đủ các yêu cầu của TCVN 9858-2 (ISO 22442-2) hoặc quy trình làm bất hoạt theo TCVN 9858-3 (ISO 22442-3) có thể gây ra thoái hóa không thể chấp nhận được.
Các dẫn xuất từ mỡ động vật, than xương động vật, và các axit amin có thể chấp nhận được đối với rủi ro bệnh TSE như trong Phụ lục C, do việc xử lý chúng chứ không phải do nguồn gốc của chúng - cũng phải được coi là có rủi ro có thể chấp nhận được đối với virus.
Về rủi ro bệnh TSE, các biện pháp kiểm soát rủi ro quy định trong Phụ lục C đối với các vật liệu động vật nhất định phải được áp dụng nếu thích hợp. Nếu nhà sản xuất coi bất kỳ yêu cầu nào là không thích hợp, phải đưa ra lý do và giải thích bằng văn bản.
Với các thiết bị y tế khi quá trình bất hoạt gây ra thoái hóa không thể chấp nhận được, nhà sản xuất có thể dựa vào TCVN 9858-2 (ISO 22442-2) để đáp ứng các yêu cầu của tiêu chuẩn này.
Nếu loài động vật làm cho nhà sản xuất không thể đáp ứng đầy đủ các yêu cầu của TCVN 9858-2 (ISO 22442-2), nhà sản xuất phải chứng minh rằng mức độ bất hoạt các yếu tố lây truyền bệnh trong quá trình sản xuất được phê chuẩn, như yêu cầu trong TCVN 9858-3 (ISO 22442-3), là đủ để đạt được mức độ rủi ro chấp nhận được.
CHÚ THÍCH Các tiêu chuẩn và nguyên tắc liên quan đến việc quản lý các rủi ro bệnh TSE được mô tả trong Phụ lục D. Phụ lục D có các thông tin về các biện pháp kiểm soát rủi ro thích hợp.
4.4.3 Kiểm soát rủi ro đối với các mối nguy hiểm khác
Việc kiểm soát rủi ro liên quan đến vi khuẩn, nấm mốc, nấm men, cũng như các phản ứng gây sốt, miễn dịch và độc tính không mong muốn phải được tiến hành theo các tiêu chuẩn sẵn có.
Các dẫn xuất từ mỡ động vật, than xương động vật và các axit amin có thể chấp nhận được đối với rủi ro bệnh TSE như đã bàn luận trong Phụ lục C, do việc xử lý của chúng chứ không phải do nguồn gốc của chúng, cũng phải được coi là có rủi ro có thể chấp nhận được đối với vi khuẩn, nấm mốc và nấm men, tùy theo việc duy trì điều kiện bảo quản phù hợp.
Nhà sản xuất phải tiến hành các nghiên cứu chu kỳ về vi sinh để xác định và định lượng vi sinh vật tạp nhiễm ban đầu của lô vật liệu động vật đầu vào cho sản xuất thiết bị y tế.
CHÚ THÍCH Các bộ tiêu chuẩn có thể liên quan gồm:
a) TCVN 7392 (ISO 11135), TCVN 7393 (ISO 11137), TCVN 8581-1 (ISO 11737-1), TCVN 8026 (ISO 13408), ISO 14160, TCVN 8582 (ISO 14937), ISO 17664 và ISO 17665-1, có thể phù hợp đối với vi khuẩn, nấm mốc, nấm men (xem Thư mục tài liệu tham khảo);
b) Tất cả các phần liên quan của TCVN 7391 (ISO 10993), có thể được sử dụng để quản lý các rủi ro liên quan đến các phản ứng sốt, miễn dịch, hoặc độc tính không mong muốn (xem Thư mục tài liệu tham khảo).
Việc sử dụng các bộ tiêu chuẩn này được minh họa trong Phụ lục B.
4.4.4 Đánh giá rủi ro tồn dư
4.4.4.1 Quy định chung
Việc đánh giá rủi ro tồn dư phải được tiến hành cho từng rủi ro.
4.4.4.2 Rủi ro bệnh TSE
Rủi ro bệnh TSE có thể được đánh giá là có thể chấp nhận được nếu cả hai tiêu chuẩn sau đều được đáp ứng, có xem xét sự sẵn có của các nguyên liệu thay thế:
a) có thể việc đánh giá rủi ro tồn dư chỉ ra rằng rủi ro bệnh TSE đã được kiểm soát ở một mức độ chấp nhận được;
b) lợi ích về y tế từ việc sử dụng thiết bị dự kiến được coi là lớn hơn rủi ro tồn dư ước tính.
CHÚ THÍCH Hướng dẫn về việc quản lý rủi ro có thể áp dụng cho các nhân tố gây bệnh TSE được nêu trong Phụ lục D. Mức độ chấp nhận được có thể dựa trên việc tuân thủ theo các yêu cầu cụ thể đối với một số vật liệu động vật nêu trong Phụ lục C hoặc các yêu cầu liên quan đến lập nguồn, thu thập và xử lý các nguyên liệu từ bò được nêu trong Phụ lục A trong TCVN 9858-2:2013 (ISO 22442-2:2007).
Về rủi ro tồn dư của bệnh TSE, các xem xét cụ thể được nêu trong Phụ lục C. Một số dẫn xuất như dẫn xuất từ mỡ, than xương động vật, dẫn xuất từ sữa, dẫn xuất từ len và các axit amin được sản xuất theo các điều kiện nêu trong Phụ lục C được coi là biểu thị rủi ro TSE chấp nhận được.
Nếu rủi ro bệnh TSE chưa được kiểm soát ở một mức được trình bày coi là mức rủi ro chấp nhận được đối với những người sử dụng hoặc những người nhận, rủi ro chung chỉ có thể được đánh giá là chấp nhận được nếu cân bằng lợi ích đặc biệt và các xem xét về tính khả thi.
4.5 Đánh giá khả năng chấp nhận rủi ro tồn dư chung
4.5.1 Quy định chung
Việc đánh giá khả năng chấp nhận rủi ro tồn dư chung phải xem xét sự cân đối giữa rủi ro tồn dư sau khi tiến hành tất cả các biện pháp kiểm soát rủi ro và các lợi ích về y tế được mong đợi, khi so sánh với các biện pháp thay thế sẵn có. Nếu có rủi ro tồn dư đối với việc nhiễm các nhân tố lây truyền bệnh, việc đánh giá cần phải xem xét một cách cụ thể các rủi ro và các lợi ích của:
- việc sử dụng các nguyên liệu thay thế không có rủi ro nhiễm các nhân tố lây truyền bệnh đó, như các vật liệu tổng hợp, các nguyên liệu từ các loài động vật khác, hoặc các vật liệu có nguồn gốc từ người và
- việc áp dụng thay thế sản phẩm toàn bộ cho cùng mục đích có dự kiến.
Nếu rủi ro chưa được kiểm soát ở mức độ có thể chấp nhận được cho những người sử dụng hoặc những người nhận, rủi ro chung chỉ có thể được coi là chấp nhận được khi cân bằng các lợi ích đặc biệt và các xem xét về tính khả thi.
4.5.2 Lập văn bản
Cơ sở cho rằng rủi ro là có thể chấp nhận được phải được lập thành văn bản trong hồ sơ quản lý rủi ro.
4.6 Hệ thống thông tin về sản xuất và sau sản xuất
Nhà sản xuất phải bảo đảm rằng hệ thống sẽ xác định được các thay đổi trong tình trạng bệnh lây truyền từ động vật sang người của nguồn vật liệu động vật được lựa chọn.
Phụ lục A
(tham khảo)
Hướng dẫn áp dụng tiêu chuẩn này
A.1 Quy định chung
Khi văn bản có nêu “quy trình quản lý rủi ro”, người đọc nên kiểm soát rủi ro hoặc lý giải trong báo cáo quản lý rủi ro vì sao không làm như vậy.
A.2 Áp dụng cho các vật liệu có nguồn gốc động vật
Tiêu chuẩn này có thể áp dụng được cho các vật liệu như:
- van tim lợn, xương bò, dây chằng gia súc, và màng ngoài tim bò;
- các dẫn xuất của mô động vật, như chondroitine sulfate lấy từ cá mập, collagen dẫn xuất từ da tươi và của máu hoặc huyết thanh động vật;
- các nguyên liệu được sản xuất in vivo từ các động vật liên quan, ví dụ kháng thể được dùng trong quá trình sản xuất;
- các nguyên liệu đầu vào như albumin huyết thanh bò, enzyme, môi trường nuôi cấy bao gồm các môi trường dùng để chuẩn bị cho hoạt động của các ngân hàng tế bào, ngân hàng tế bào chính hay hạt giống chính cho các sản phẩm như axit hyaluronic.
A.3 Áp dụng cho các vật liệu được cung cấp bởi bên thứ ba
Tiêu chuẩn này có thể được áp dụng khi nguyên liệu được các nhà sản xuất thiết bị y tế sử dụng được lấy từ các nguồn động vật của bên thứ ba hoặc các nhà thầu phụ. Một ví dụ là gelatine dẫn xuất từ da hoặc xương động vật. Trong khi xem xét các rủi ro liên quan đến việc sử dụng các sản phẩm này, nhà sản xuất thiết bị y tế cần tìm bằng chứng từ các nhà cung cấp về vấn đề liệu các yêu cầu liên quan của TCVN 9858 (ISO 22442) được áp dụng trong đánh giá sự phù hợp của nguyên liệu hay về vấn đề liệu có biện pháp thay thế nào được áp dụng không. Thông tin thu được cần được đưa vào báo cáo quản lý rủi ro liên quan đến thiết bị y tế, nếu phù hợp, nhưng có thể cần phải bổ sung thông tin do bên thứ ba hay nhà thầu phụ cung cấp.
Phụ lục B
(tham khảo)
Sơ đồ quá trình quản lý rủi ro đối với các thiết bị y tế sử dụng vật liệu động vật
Xem Hình B.1
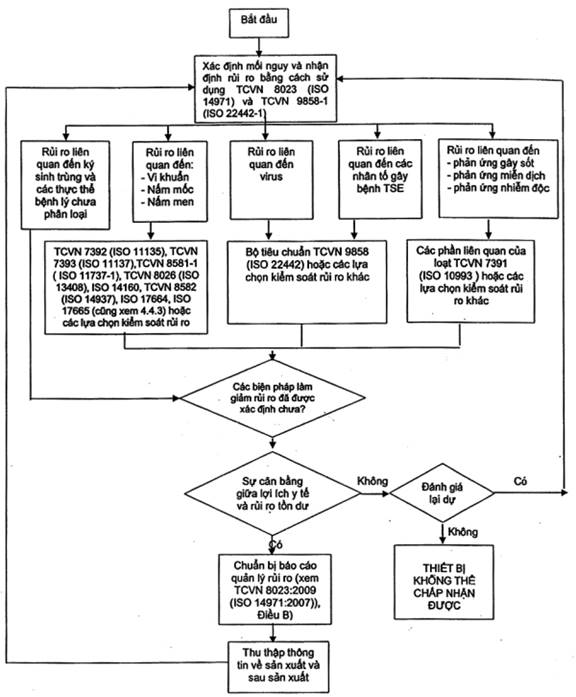
Hình B.1 - Sơ đồ quá trình quản lý rủi ro
Biểu đồ này minh họa phần quá trình quản lý rủi ro theo TCVN 8023 (ISO 14971) và tiêu chuẩn này. Quá trình quản lý rủi ro cần giải quyết tất cả các rủi ro liên quan nêu trong biểu đồ này.
Phụ lục C
(quy định)
Yêu cầu đặc biệt đối với một số vật liệu động vật bằng việc xem xét quản lý rủi ro đối với các nhân tố gây bệnh TSE
C.1 Quy định chung
Các yêu cầu nêu trong phụ lục này không bãi bỏ được nhu cầu tiến hành đánh giá rủi ro bị bệnh TSE, bao gồm các yêu cầu trong Điều 4, như một phần trong quá trình đánh giá và quản lý rủi ro được mô tả trong TCVN 8023 (ISO 14971).
Việc quản lý rủi ro có thể được giải quyết thông qua xử lý, tạo nguồn hoặc phối hợp cả hai. Các dẫn xuất từ mô, than xương động vật và các axit amin có thể chấp nhận được đối với rủi ro bệnh TSE do việc xử lý chứ không phải do nguồn gốc của chúng.
Phụ lục A của TCVN 9858-2:2013 (ISO 22442-2:2007) có nêu các yêu cầu bổ sung liên quan đến việc áp dụng tiêu chuẩn này cho các nguyên liệu có nguồn gốc từ bò.
Để chứng minh sự tuân thủ với các yêu cầu của tiêu chuẩn này, cần thực thi một thỏa thuận kỹ thuật giữa nhà sản xuất thiết bị y tế và nhà cung cấp nguyên liệu/dẫn xuất có nguồn gốc động vật (xem TCVN 9858-2:2013 (ISO 22442-2:2007), Điều 6).
C.2 Collagen
Collagen là thành phần protein dạng sợi trong các mô liên kết của động vật có vú.
Đối với collagen, phải cung cấp văn bản để chứng minh sự tuân thủ với tiêu chuẩn này, xem xét các yêu cầu liên quan trong phụ lục này.
Khi hoàn thành việc quản lý rủi ro theo yêu cầu của tiêu chuẩn này, cần xem xét các yếu tố sau:
- Đối với collagen sản xuất từ xương, xương phải được lấy từ các quốc gia ít bị phơi nhiễm với BSE. Việc lấy xương từ các quốc gia phơi nhiễm hạn chế với BSE phải được giải trình bằng cách tham khảo các biện pháp kiểm soát rủi ro có thể áp dụng được (xem Phụ lục A của TCVN 9858-2:2013 (ISO 22442-2:2007)). Không được lấy xương từ các quốc gia có tỷ lệ nhiễm BSE cao, trừ khi lấy từ bầy đàn gia súc có rủi ro thấp như đã quy định trong TCVN 9858-2 (ISO 22442-2).
- Đối với collagen sản xuất từ xương, các điều kiện sản xuất được quy định đối với gelatin có thể áp dụng được (xem dưới đây).
- Collagen sản xuất từ da tươi và da thường không có rủi ro bị bệnh TSE đáng kể miễn là trong khi thu mua tránh được rủi ro lây chéo từ các nguyên liệu có thể bị nhiễm khác, ví dụ như các mô thần kinh trung ương. Để chứng minh sự tuân thủ với các yêu cầu của tiêu chuẩn này, cần phối hợp các biện pháp nhằm ngăn ngừa lây chéo (xem TCVN 9858-2 (ISO 22442-2) và lập văn bản về các biện pháp được thông qua trong thỏa thuận kỹ thuật giữa nhà cung cấp collagen và nhà sản xuất thiết bị y tế nhằm ngăn ngừa lây nhiễm chéo.
Collagen phải được lấy từ các động vật được tuyên bố là khỏe mạnh phù hợp cho việc sử dụng trên người (xem TCVN 9858-2 (ISO 22442-2).
CHÚ THÍCH 1 “Ít phơi nhiễm với BSE” nên được giải thích theo GBR I1 hoặc các quốc gia trong Danh sách APHIS2 hoặc từ các bầy đàn có rủi ro thấp như quy định trong TCVN 9858-2 (ISO 22442-2).
CHÚ THÍCH 2 “Phơi nhiễm hạn chế với BSE” nên được giải thích theo GBR II hay GBR III.
C.3 Gelatine dẫn xuất từ da tươi và xương
C.3.1 Yêu cầu chung
Gelatine là protein hòa tan, tự nhiên, dạng gel hoặc không gel, thu được từ thủy phân một phần collagen sản xuất từ xương, da tươi, da, dây chằng và gân động vật.
Đối với gelatine, phải cung cấp văn bản để chứng minh sự tuân thủ với tiêu chuẩn này, có xem xét các yêu cầu liên quan được nêu trong phụ lục này.
Gelatine phải được lấy từ các động vật được tuyên bố là khoẻ mạnh phù hợp cho việc sử dụng trên người.
Khi hoàn thành việc đánh giá và kiểm soát rủi ro theo yêu cầu của tiêu chuẩn này, xem xét các Điều C.3.2 đến C.3.4.
C.3.2 Nguyên liệu đầu vào là da
Dựa vào các kiến thức hiện tại, da dùng để sản xuất gelatine là nguyên liệu an toàn hơn so với xương.
Gelatine sản xuất từ da thường không có rủi ro TSE đáng kể miễn là trong quá trình thu mua tránh được sự lây chéo với các nguyên liệu có thể bị nhiễm khác như các mô thần kinh trung ương. Để chứng minh sự tuân thủ với các yêu cầu của tiêu chuẩn này, cần kết hợp với các biện pháp ngăn ngừa lây nhiễm chéo (xem TCVN 9858-2 (ISO 22442-2) và lập văn bản các biện pháp đã được thông qua nhằm ngăn ngừa lây chéo trong thỏa thuận kỹ thuật giữa nhà cung cấp gelatine và nhà sản xuất thiết bị y tế.
C.3.3 Nguyên liệu đầu vào là xương
Khi xương được sử dụng để sản xuất gelatine, chất lượng của nguyên liệu đầu vào là thông số chủ yếu đảm bảo độ an toàn của thành phẩm. Do đó, các yêu cầu sau phải được áp dụng:
- Tùy theo quy định của quốc gia, xương phải được lấy từ các quốc gia phơi nhiễm ít nhất hoặc phơi nhiễm hạn chế với BSE. Không được nhập xương từ các nước có nhiễm BSE cao, trừ khi từ bầy đàn có rủi ro thấp như quy định trong TCVN 9858-2 (ISO 22442-2).
Xương sọ và tủy sống phải được loại bỏ khỏi xương đã thu thập (nguyên liệu thô/đầu vào) từ gia súc có độ tuổi nhất định được quy định theo luật pháp của quốc gia.
Ngoài ra, phải loại bỏ xương sống khỏi các nguyên liệu thô/nguyên liệu đầu vào từ gia súc mọi lứa tuổi từ các quốc gia có phơi nhiễm hạn chế với BSE.
C.3.4 Phương pháp sản xuất
Không cần có yêu cầu gì đặc biệt về điều kiện xử lý đối với gelatine sản xuất từ da miễn là có các biện pháp kiểm soát tại chỗ nhằm tránh lây nhiễm chéo trong quá trình thu thập da và trong quá trình sản xuất (xem C.3.2)
Khi xương được sử dụng làm nguyên liệu đầu vào, sử dụng một trong các phương pháp sản xuất sau đây:
- Mặc dù quá trình dẫn xuất kiềm (trước các bước thành phẩm) cho thấy khả năng bất hoạt/loại bỏ hơi cao hơn so với quá trình axit, cả hai phương pháp sản xuất axit và kiềm tạo ra gelatine thành phẩm đều có khả năng loại bỏ/bất hoạt chung tương tự như nhau đối với việc nhiễm TSE trong các thử nghiệm thẩm định gelatine. Các nghiên cứu đó đã cho thấy rằng việc xử lý kiềm bổ sung (pH = 13 trong 1h) đối với xương/chất xương làm tăng thêm khả năng bất hoạt/loại bỏ TSE của quy trình sản xuất axit.
- Đối với quy trình sản xuất kiềm điển hình, xương được nghiền thật nhỏ, khử mỡ bằng nước nóng và được khử khoáng bằng axit hydrocloric pha loãng (tối thiểu 4 % và pH < 1,5) trong vòng ít nhất hai ngày để tạo ra ossein. Sau đó xử lý bằng kiềm với dung dịch nước vôi bão hòa (ít nhất pH = 12,5) trong vòng ít nhất 20 ngày. Gelatine được tách, rửa, lọc và cô đặc. Áp dụng bước xử lý nhiệt nhanh ở 138°C - 140°C trong 4s. Xương bò cũng có thể được xử lý bằng quy trình axit. Khi đó thay thế bước ngâm vào nước vôi bằng xử lý trước bằng axit trong đó ossein được ngâm qua đêm ở pH < 4. Trong quá trình nhiệt/áp suất, xương khô đã nghiền và khử mỡ được hấp bằng hơi bão hòa ở áp suất cao hơn 3 bar và nhiệt độ ít nhất 133 °C trong ít nhất 20 min, sau đó chiết tách protein bằng nước nóng. Các bước thành phẩm cho cả hai quy trình nhiệt/áp suất và tương tự như quy trình kiềm.
C.4 Các dẫn xuất từ máu bò
C.4.1 Yêu cầu chung
Huyết thanh thai bò thường được sử dụng trong nuôi cấy tế bào. Huyết thanh thai bò nên được lấy từ thai thu thập tại các lò mổ từ các con mẹ khỏe mạnh thích hợp dùng cho người và tử cung cần được lấy bỏ hoàn toàn. Máu thai phải được thu thập tại khu vực chuyên biệt, bằng cách chọc tim rồi cho vào hệ thống thu gom kín, vô khuẩn.
Huyết thanh bê mới đẻ được lấy từ bê có tuổi đời dưới 20 ngày; huyết thanh bê lấy từ bê có tuổi đời dưới 12 tháng. Trong trường hợp huyết thanh bò, vì nó có thể được lấy từ các con vật dưới 36 tháng tuổi, tình trạng BSE của đàn bò cho phải được xác định và lập hồ sơ rõ ràng. Trong mọi trường hợp, huyết thanh phải được thu gom theo các phương thức được quy định bằng nhân viên được huấn luyện về các quy trình đó và cần thận trọng để tránh lây nhiễm chéo với các mô có rủi ro cao hơn.
Đối với dẫn xuất từ máu bò, hồ sơ phải chứng minh sự tuân thủ tiêu chuẩn này, có xem xét các yêu cầu liên quan đã nêu trong phụ lục này. Khi hoàn thành việc quản lý rủi ro theo yêu cầu của tiêu chuẩn này, cần xem xét các Điều C.4.2 đến C.4.4.
C.4.2 Khả năng truy nguyên
Cần phải bảo đảm khả năng truy nguyên được nhà giết mổ đối với từng lô huyết thanh hay huyết tương. Các nhà giết mổ phải có sẵn danh sách các trang trại từ đó động vật được cung cấp. Nếu huyết thanh được sản xuất từ động vật sống, phải có sẵn các ghi chép cho từng lô huyết thanh để bảo đảm khả năng truy nguyên trang trại và từng con vật một. Khi không có khả năng truy nguyên từng con vật cá thể, phải giải trình trong hồ sơ quản lý rủi ro.
C.4.3 Nguồn gốc địa lý
Máu bò phải được lấy từ các quốc gia có sự phơi nhiễm tối thiểu với BSE trừ khi có giải trình và ủy quyền khác.
C.4.4 Các phương pháp làm choáng
Nếu máu được lấy từ các động vật giết mổ, phương pháp giết mổ rất quan trọng trong việc bảo đảm độ an toàn của nguyên liệu. Người ta đã chứng minh rằng làm choáng bằng súng gây choáng có hoặc không có hủy não, cũng như bằng súng nén khí, đặc biệt có bơm khí, có thể phá hủy não bộ và làm phát tán mô não vào dòng máu. Có bằng chứng rằng làm choáng kiểu không xâm thâm nhập có thể gây tắc mạch của hệ thần kinh trung ương. Phải mô tả phương pháp làm choáng trong quá trình thu gom máu bò trừ khi nguyên liệu được lấy từ một quốc gia có rủi ro theo vùng địa lý của BSE không đáng kể (xem A.3.1 của TCVN 9858-2:2013 (ISO 22442-2:2007).
Nếu máu có nguồn gốc từ các quốc gia có phơi nhiễm hạn chế với BSE, phải sử dụng súng làm choáng không thâm nhập hoặc làm mê bằng điện để giết mổ các động vật trên 12 tháng tuổi. Phải giải trình việc sử dụng phương pháp làm choáng không thâm nhập trên cơ sở đánh giá rủi ro phát tán nhu mô não vào trong máu.
CHÚ THÍCH Thông tin thêm về các kỹ thuật làm choáng có thể tìm trong Quan điểm của SSC về các phương pháp làm choáng và rủi ro bệnh BSE (rủi ro phát tán mô não vào trong máu và cơ thể khi áp dụng các phương pháp làm choáng nhất định) được thông qua tại kỳ họp ngày 10-11/1/2002
(http://www.europa.eu.int/comm/food/fs/sc/ssc/out245_en.pdf) và Báo cáo của Nhóm công tác EFSA về rủi ro BSE từ việc phát tán mô não vào dòng máu và cơ thể. Câu hỏi No. EFSA-Q-2003-122 thông qua ngày 21/10/2004 (http://www.efsa.europa.eu/en/science/biohaz/biohaz_opinions/731.html).
C.5 Các dẫn xuất từ mỡ
Mỡ là chất béo lấy từ các mô bao gồm khu vực dưới da, bụng, giữa các cơ, và xương.
Các dẫn xuất từ mỡ, như glycerol và các axit béo, được sản xuất từ mỡ theo các quá trình nghiêm ngặt, được coi là không thể bị nhiễm khuẩn. Vì lý do này, các nguyên liệu như vậy được sản xuất trong các điều kiện nghiêm ngặt như nêu dưới đây phải được coi là có rủi ro TSE có thể chấp nhận được, bất kể nguồn gốc địa lý và bản chất của các loại mô từ đó các dẫn xuất của mỡ được tạo ra. Các ví dụ về các quy trình nghiêm ngặt là:
a) Este hóa chuyển dạng hoặc thủy phân không nhỏ hơn 200 °C không dưới 20 min dưới áp lực (sản xuất glycerol, axit béo và este của axit béo);
b) Xà phòng hóa bằng dung dịch hydroxit natri ở nồng độ 12 mol/l (sản xuất glycerol và xà phòng);
1) Quy trình theo mẻ: không nhỏ hơn 95 °C với không ít hơn 3 h;
2) Quy trình liên tục: không nhỏ hơn 140 °C dưới áp suất trong thời gian không dưới 8 min hoặc tương đương;
c) Chưng cất ở 200 °C.
C.6 Than xương động vật
Than xương động vật được chế biến bằng cacbon hóa mô động vật chẳng hạn như xương, tại nhiệt độ > 800 °C.
Bất kể nguồn gốc địa lý và bản chất của mô, than xương động vật được sản xuất theo các điều kiện như vậy phải được coi là có rủi ro TSE có thể chấp nhận được.
C.7 Sữa và các dẫn xuất từ sữa
Một số nguyên liệu nhất định, bao gồm lactose, được dẫn xuất từ nước sữa, chất lỏng còn lại từ việc sản xuất phomat sau khi đông vón. Đông vón có thể liên quan đến việc sử dụng enzym đông sữa từ bê, một chất dẫn xuất từ dạ múi khế, hoặc enzym đông sữa dẫn xuất từ các động vật nhai lại khác. Việc đánh giá rủi ro đối với lactose và các dẫn xuất nước sữa khác làm từ enzym đông sữa bê được tiến hành3 và kết luận rằng rủi ro của TSE là không đáng kể nếu enzyme đông sữa từ bê được sản xuất phù hợp với quá trình được mô tả trong báo cáo đánh giá rủi ro của CPMP[42].
Tùy thuộc vào luật pháp quốc gia, các dẫn xuất từ sữa được sản xuất theo các điều kiện dưới đây được coi là có rủi ro TSE có thể chấp nhận được:
- sữa được lấy từ động vật khỏe mạnh trong cùng điều kiện như đối với sữa được lấy để dùng cho người;
- không có nguyên liệu từ động vật nhai lại nào khác, trừ enzym đông sữa từ bê, được sử dụng để chế biến các dẫn xuất như vậy (ví dụ men tụy tiêu hóa casein).
C.8 Len và các dẫn xuất
Len và các dẫn xuất của nó như lanotin và cồn làm từ len, phải được xem xét tuân thủ theo tiêu chuẩn này, với điều kiện len được lấy từ các động vật sống khỏe mạnh.
Các dẫn xuất từ len được sản xuất từ len có nguồn gốc từ động vật được giết mổ được tuyên bố là “phù hợp để dùng cho người” được coi là có rủi ro TSE có thể chấp nhận được nếu quá trình sản xuất liên quan đến pH, nhiệt độ và thời gian xử lý đáp ứng ít nhất một trong số các điều kiện xử lý quy định nêu sau đây:
- xử lý tại pH ≥ 13 (lúc đầu; tương ứng với nồng độ hydroxit natri ≥ 0,1 mol/l) tại ≥ 60 °C trong ít nhất 1h; việc này thường xảy ra trong giai đoạn trào ngược của quá trình xử lý kiềm hữu cơ;
- chưng cất phân tử ≥ 220 °C trong điều kiện giảm áp.
C.9 Axit amin
Axit amin có thể thu được bằng cách thủy phân các vật liệu động vật có nguồn gốc khác nhau.
Các axit amin được sản xuất trong các điều kiện chế biến sau đây được coi là có rủi ro TSE có thể chấp nhận được:
- các axit amin được sản xuất từ da tươi và da theo quy trình có làm cho nguyên liệu tiếp xúc với pH từ 1 đến 2, tiếp sau đó là pH > 11, sau đó là xử lý nhiệt ở 140 °C trong 30 min ở 3 bar,
- các axit amin hoặc peptit thu được phải được lọc sau khi sản xuất;
- phải tiến hành phân tích bằng một phương pháp nhạy và đã được phê chuẩn để kiểm soát các đại phân tử nguyên vẹn tồn dư với một mức giới hạn cho phép.
Phụ lục D
(tham khảo)
Thông tin liên quan đến quản lý rủi ro TSE
D.1 Quy định chung
Các bệnh xốp não lây truyền (TSE) xảy ra một cách tự nhiên bao gồm bệnh thần kinh cừu (ở cừu và dê), bệnh gầy mòn mạn tính (hươu la và nai), bệnh xốp não ở bò (BSE) ở gia súc cũng như bệnh run và Creutzfeldt-Jakob (CJD) ở người. Khó tìm được các tác nhân gây nên các bệnh này in vivo. Sau giai đoạn tiềm tàng có thể tới nhiều năm, tác nhân gây nên bệnh và cuối cùng dẫn đến tử vong. Chưa có phương pháp điều trị nào được biết tới.
Thông tin hiện tại về đặc điểm của các yếu tố nguyên nhân rất hạn chế. Các yếu tố này cực kỳ đề kháng lại hầu hết các phương pháp lý, hóa học dùng để bất hoạt các virus thông thường. Chúng không tạo nên đáp ứng miễn dịch có thể phát hiện được. Có các rào cản tự nhiên hạn chế sự lây lan yếu tố gây bệnh giữa các loài, nhưng chúng có thể lây chéo trong các điều kiện phù hợp. Điều này thường tùy thuộc vào chủng, liều, đường phơi nhiễm và rào cản về loài. Các nghiên cứu trên động vật thí nghiệm đã cho thấy rằng tiêm trong não là đường lây truyền hữu hiệu nhất.
D.2 Các rủi ro đối với người
Có bằng chứng đáng kể rằng dạng biến thể của bệnh CJD ở người (vCJD) bắt nguồn từ BSE và để thận trọng thì nên chấp nhận rằng tác nhân gây BSE có thể truyền sang người. Do đó tiêu chuẩn này có một số yêu cầu để bảo đảm rằng các rủi ro được kiểm soát nếu các nguyên liệu sinh học từ các loài dễ bị TSE được sử dụng để sản xuất các thiết bị y tế. Phụ lục này nêu các hướng dẫn cần tuân thủ để giảm thiểu rủi ro lây nhiễm. Nó quy định nơi mà các yêu cầu trong tiêu chuẩn này có thể áp dụng được và nơi nào các thông tin từ các nguồn khác là có liên quan. Tất cả các thiết bị nên được xem xét trên cơ sở từng trường hợp một.
D.3. Quản lý rủi ro đối với các tác nhân TSE
D.3.1 Nguyên tắc
Độ an toàn của một thiết bị y tế, xét theo khía cạnh về tiềm năng làm lây truyền một tác nhân TSE, phụ thuộc vào một số yếu tố, 8 yếu tố quan trọng nhất dưới đây nên được phân tích, đánh giá và quản lý:
- Loài động vật được sử dụng (xem D.3.2);
- Nguồn gốc địa lý (xem D.3.3);
- Tình trạng của mô lúc đầu (xem D.3.4);
- Việc kiểm soát giết mổ và xử lý nhằm ngăn ngừa lây nhiễm chéo (xem D.3.5);
- Phương pháp dùng để bất hoạt hoặc loại bỏ các tác nhân TSE (xem D.3.6);
- Số lượng nguyên liệu động vật đầu vào cần để sản xuất một đơn vị thiết bị y tế (xem D.3.7.1);
- Số lượng vật liệu có nguồn gốc động vật dẫn đến tiếp xúc với bệnh nhân và người sử dụng (xem D.3.7.2);
- Đường dùng (xem D.3.7.3).
Khi nhà sản xuất có sự lựa chọn, ưu tiên sử dụng các nguyên liệu từ các loài động vật có liên quan không bị TSE hoặc có nguồn gốc không phải động vật.
D.3.2 Các loại động vật được sử dụng (xem TCVN 9858-2 (ISO 22442-2))
Rủi ro TSE có liên quan đến loài, chủng động vật và bản chất của mô đầu vào.
Vì sự tích lũy nhiễm bệnh TSE xảy ra sau giai đoạn ủ bệnh trong nhiều năm, bắt nguồn từ động vật non, khỏe mạnh được coi là một yếu tố để làm giảm rủi ro. Việc sử dụng động vật già hơn có thể làm tăng rủi ro. Sử dụng động vật dưới 6 tháng tuổi có thể làm giảm mức rủi ro. Việc sử dụng động vật chết, giết mổ khẩn cấp và nghi bị TSE có thể làm tăng rủi ro và nên loại bỏ đi. Rủi ro dạng này được giải quyết bằng cách chứng minh sự tuân thủ các yêu cầu có trong TCVN 9858-2:2013 (ISO 22442-2:2007), Phụ lục A.
D.3.3 Nguồn gốc địa lý (xem TCVN 9858-2 (ISO 22442-2))
Các yếu tố nhất định có ảnh hưởng đến rủi ro nhiễm BSE theo vùng địa lý liên quan đến việc sử dụng mô hoặc các dẫn xuất thô từ các quốc gia riêng biệt. Chúng sẽ được áp dụng cụ thể cho BSE nhưng cũng có thể được sử dụng để xác định rủi ro TSE từ các loài khác.
CHÚ THÍCH Nhà sản xuất cần xem xét các đánh giá đã được công bố liên quan đến rủi ro BSE kết nối đến các Quốc gia cụ thể. Ví dụ, Liên minh Châu Âu EU đã xuất bản các tài liệu về Rủi ro BSE Theo Vùng địa lý (GBR) cho một số Quốc gia (có sẵn trên trang web của Ủy ban Điều hành Khoa học của Ủy ban Liên Minh Châu Âu: http://europa.eu.in/comm/food/fs/sc/ssc/outcome_en.htmh. Bộ Nông nghiệp Mỹ đã xuất bản các Quốc gia có nguồn động vật được phép và không được phép (xuất bản bởi Dịch vụ Kiểm tra Sức khỏe Cây trồng và Động vật xem Chú thích 2, Phụ lục C):
http://www.efsa.eu.int/science/tse_assessments/gbr_assessments/catindex_en.html). Bộ Y tế, Lao động và Phúc lợi Nhật Bản cũng đã xuất bản danh sách các nước có động vật nguồn được phép và không được phép (xem Tài liệu tham khảo số [45]). Bộ luật Mặt đất OIE liên quan đến BSE được đăng tại http://www.oie.int/eng/normes/mcode/en_chapitre_2.3.13.htm.
D.3.4 Bản chất của mô đầu vào
Nhà sản xuất cần xem xét sự phân loại các rủi ro liên quan đến các loại mô đầu vào khác nhau. Nguồn gốc mô động vật cần phải qua kiểm soát và kiểm tra riêng do chuyên viên thú y tiến hành và xác động vật cần được xác nhận là khỏe mạnh phù hợp dùng cho người, theo quy định và thực hành tại địa phương. Nhà sản xuất không được lấy các mô động vật đã được phân loại là có rủi ro nhiễm TSE cao. Trường hợp chỉ có ngoại lệ là khi không có mô đầu vào thay thế và khi có lợi ích về y tế đáng kể cho bệnh nhân.
Việc phân loại các rủi ro liên quan đến các loại vật liệu động vật đầu vào khác nhau đã được thiết lập và thẩm định bởi Tổ chức Y tế Thế giới [41]. Các Bảng D.1 đến D.3 được dựa trên phân loại của WHO về mô năm 2006. Việc đánh giá rủi ro cần được kiểm nghiệm dưới ánh sáng của các thông tin gần nhất khi có thể, và cần xem xét mức độ không chắc chắn trong bộ dữ liệu sẵn có.
Trong các Bảng D.1, D.2 và D.3, có sử dụng các ký hiệu nhập dữ liệu sau đây:
+ có nhiễm PrPTSE 4;
- không nhiễm PrPTSE;
NT không thử;
NA không có thể áp dụng được;
? gây tranh cãi hoặc kết quả không chắc chắn;
() số liệu ban đầu hoặc còn hạn chế.
Việc bố trí một mô nào đó trong một hạng mục có thể đặc hiệu theo từng bệnh và có thể sửa đổi khi có thêm số liệu mới từ các thử nghiệm cơ độ nhạy ngày càng tăng. Trên thực tế, có thể hiểu được rằng việc phát hiện nhiễm bệnh bằng chuột chuyển gen có biểu hiện quá mức các gen mã hóa các protein prion khác nhau, hoặc việc phát hiện PrPTSE bằng các phương pháp khuếch đại mới được triển khai, có thể nhạy hơn các nghiên cứu lây truyền trên các động vật thí nghiệm hoang dã, và như vậy có thể không tương quan với sự truyền bệnh trong tự nhiên.
Điều quan trọng cần hiểu là việc phân loại nhiễm bệnh không giống như việc phân loại rủi ro, vì phân loại rủi ro cần phải xem xét không chỉ mức nhiễm bệnh của mô, mà còn số lượng mô mà một người hay xúc vật bị phơi nhiễm, và con đường lây nhiễm. Ví dụ, cho dù mức nhiễm bệnh ở mô (nồng độ nhiễm khuẩn tại mô được phản ánh bởi chuẩn độ) là yếu tố quan trọng nhất trong ước lượng rủi ro truyền bệnh do ô nhiễm chéo dụng cụ trong các quá trình phẫu thuật (ví dụ phẫu thuật thần kinh so với phẫu thuật chung), chỉ có một yếu tố quyết định rủi ro lây truyền bởi truyền máu trong đó một lượng lớn vật liệu có độ nhiễm thấp được đưa thẳng vào hệ tuần hoàn, hoặc rủi ro truyền bệnh qua thực phẩm, mới bao gồm cả lây qua đường miệng tương đối không hiệu quả, bất kể độ nhiễm bệnh cao hay thấp.
Bảng D.1 - Loại A: Các mô có độ nhiễm cao
| Các mô thần kinh trung ương đạt tới chuẩn độ nhiễm bệnh ở các giai đoạn muộn của TSE và các mô nhất định có liên quan về mặt giải phẫu với hệ thần kinh trung ương | ||||||||
| Mô | Các bệnh TSE ở người | Gia súc | Cừu và dê | |||||
| vCJD | Các TSE khác | BSE | Bệnh thần kinh cừu, dê | |||||
| Độ nhiễma | PrPTSE | Độ nhiễma | PrPTSE | Độ nhiễma | PrPTSE | Độ nhiễma | PrPTSE | |
| Não | + | + | + | + | + | + | + | + |
| Tủy sống | + | + | + | + | + | + | + | + |
| Võng mạc | NT | + | + | + | + | NT | NT | + |
| Thần kinh thị giác | NT | + | NT | + | + | NT | NT | + |
| Hạch đốt sống | + | + | NT | + | + | NT | NT | + |
| Hạch tam thoa | + | + | NT | + | + | NT | NT | + |
| Tuyến yênc | NT | + | + | + | - | NT | + | NT |
| Màng cứngc | NT | - | + | - | NT | NT | NT | NT |
| a Thử độ nhiễm trên mô người được tiến hành hoặc trên động vật linh trưởng hoặc trên chuột (hoặc cả hai); thử nghiệm sinh học các mô gia súc được tiến hành hoặc trên gia súc hoặc trên chuột (hoặc cả hai); và hầu hết các thử nghiệm sinh học trên mô cừu và/hoặc dê được tiến hành chỉ trên chuột. Đối với cừu và dê, không phải tất cả kết quả đều thống nhất cho cả hai loài. b Trong các mô hình thực nghiệm của TSE, thần kinh thị giác là đường xâm nhập thần kinh và có chứa nồng độ nhiễm cao. c Chưa có số liệu thực nghiệm nào về độ nhiễm của tuyến yên hay màng cứng của người được báo cáo, tuy nhiên các mảnh vá màng cứng từ xác đồng chủng và hocmon tăng trưởng từ tuyến yên của xác đã truyền bệnh cho hàng trăm người và do đó phải được đưa vào danh mục các mô có rủi ro cao. | ||||||||
Bảng D.2 - Loại B: Các mô có độ nhiễm thấp
| Các mô ngoại vi được thử dương tính và/hoặc có PrPTSE trong ít nhất một dạng của TSE | ||||||||
| Mô | Các bệnh TSE ở người | Gia súc | Cừu và dê | |||||
| vCJD | Các TSE khác | BSE | Bệnh thần kinh cừu, dê scrapie | |||||
| Độ nhiễm | PrPTSE | Độ nhiễm | PrPTSE | Độ nhiễm | PrPTSE | Độ nhiễm | PrPTSE | |
| Hệ thần kinh ngoại biên |
|
|
|
|
|
|
|
|
| Thần kinh ngoại biên | + | + | (-) | + | + | + | + | + |
| Đám rối ruột a | NT | + | NT | (-) | NT | + | NT | + |
| Mô lưới bạch huyết |
|
|
|
|
|
|
|
|
| Lách | + | + | + | + | - | - | + | + |
| Hạch lympho | + | + | + | - | - | - | + | + |
| Amidan | + | + | NT | - | + | - | + | + |
| Màng nháy | NA | NA | NA | NA | + | - | NT |
|
| Tuyến ức | NT | + | NT | - | - | NT | + | NT |
| Ống tiêu hóa |
|
|
|
|
|
|
|
|
| Thực quản | NT | - | NT | - | - | NT | NT | + |
| Dạ tổ ong b (động vật nhai lại) | NA | NA | NA | NA | - | NT | NT | + |
| Dạ dày/dạ múi khế c | NT | - | NT | NT | - | NT | NT | + |
| Tá tràng | NT | - | NT | NT | - | NT | NT | + |
| Hỗng tràng c | NT | + | NT | - | - | NT | NT | + |
| Hồi tràng c,d | NT | + | NT | - | + | + | + | + |
| Ruột thừa | - | + | NT | - | NA | NA | NA | NA |
| Đại tràng e | + | + | NT | - | - | NT | + | + |
| Mô sinh sản |
|
|
|
|
|
|
|
|
| Rau thai | NT | - | (+) | - | - | NT | + | + |
| Các mô khác |
|
|
|
|
|
|
|
|
| Phổi | NT | - | + | - | - | NT | - | - |
| Gan | NT | - | + | - | - | NT | + | NT |
| Thận | NT | - | + | - | - | - | - | - |
| Thượng thận | NT | + | - | - | NT | NT | + | NT |
| Tụy | NT | - | NT | - | - | NT | + | NT |
| Tủy xương | - | - | (-) | - | (+) | NT | + | NT |
| Cơ xương f | NT | + | (-) | + | (+) | NT | - | + |
| Lưỡi g | NT | - | NT | - | - | NT | NT | + |
| Mạch máu | NT | + | NT | + | - | NT | NT | + |
| Niêm mạc mũi h | NT | NT | NT | + | - | NT | + | + |
| Tuyến nước bọt | NT | - | NT | NT | - | NT | + | NT |
| Giác mạc | NT | - | + | - | NT | NT | NT | NT |
| Dịch cơ thể |
|
|
|
|
|
|
|
|
| Dịch não tủy | - | - | + | - | - | NT | + | NT |
| Máu j | + | ? | - | ? | - | ? | + | ? |
| a Trên gia súc, PrPTSE giới hạn ở đám rối ruột ở đầu xa hồi tràng. b Dạ tổ ong của loài nhai lại (dạ tổ ong, dạ cỏ, xách) được sử dụng rộng rãi như dạ dày chính danh (dạ múi khế). Dạ múi khế của gia súc (và đôi khi cả cừu) cũng là nguồn lấy enzym đông sữa c Trong vCJD, cho đến nay sự lây truyền cho chuột chỉ giới hạn ở mô trực tràng, và PrPTSE chỉ được phát hiện ở mô thần kinh và lympho liên quan với ruột (niêm mạc, cơ và thanh dịch đều âm tính). Trên dê, PrPTSE cũng chỉ giới hạn ở các mô thần kinh và lympho liên quan đến ruột [Andreoletti, số liệu chưa công bố). d Ở gia súc và cừu, chỉ có đầu xa hồi tràng được thử nghiệm sinh học tìm nhiễm. e Báo cáo duy nhất về lây truyền nhiễm CJD từ rau thai người chưa bao giờ được xác nhận và được coi là có thể cải thiện được. f Các chất đồng nhất của cơ không truyền bệnh cho linh trưởng từ người nhiễm sCJD, hoặc cho gia súc từ các gia súc nhiễm BSE. Tuy nhiên, tiêm trong não của chất đồng nhất của gân (gồm các thành phần thần kinh và bạch huyết; từ một con bò duy nhất bị BSE đã truyền bệnh cho chuột chuyển gen biểu hiện quá mức PrP với một tỷ lệ chỉ đủ biểu hiện mức độ nhiễm thoáng qua. Cũng như vậy, các nghiên cứu được công bố và chưa công bố gần đây đã báo các sự có mặt của PrPTSE trong cơ xương trên các mô hình thực nghiệm trên loài gặm nhắm của bệnh scrapie và vCJD trên các nhiễm khuẩn tự nhiên và thực nghiệm của cừu và dê, trên cừu gây nhiễm BSE qua đường miệng [Andreoletti, số liệu chưa công bố], và trên người bị sCJD, iCJD và vCJD. Hiện đang có các thử nghiệm sinh học để xác định liệu PrPTSE có liên quan với khả năng lây truyền trên các nhiễm khuẩn tự nhiên và thực nghiệm này. g Trên gia súc, thử nghiệm sinh học tìm nhiễm âm tính, nhưng sự có mặt của PrPTSE ở amidan khẩu cái làm tăng mối lo ngại về khả năng nhiễm bệnh ở mô amidan lưỡi ở đáy lưỡi có thể không bị cắt bỏ lúc giết mổ. h Trong sCJD, PrPTSE bị giới hạn ở niêm mạc khứu giác. i Vì chỉ có một hoặc hai trường hợp của CJD là có thể do ghép giác mạc trong số hàng trăm ngàn người nhận, giác mạc được xếp vào loại mô có rủi ro thấp hơn; các mô khác ở tiền phòng (thủy tinh thể, thủy dịch, mống mắt, kết mạc) đã được thử cho kết quả âm tính với cả vCJD và các bệnh TSE ở người khác, và không có bằng chứng dịch tễ học cho thấy chúng có liên quan đến lây truyền do thầy thuốc. j Rất nhiều dữ liệu từ các nghiên cứu về nhiễm vào máu trên các mô hình TSE trên động vật thực nghiệm đã được mở rộng trong những nghiên cứu gần đây cho thấy có nhiễm bệnh trong máu của cừu bị bệnh scrapie tự nhiên, và (từ các quan sát dịch tễ học) ba trường hợp lây truyền vCJD liên quan đến máu ở người. Máu không được coi là làm truyền bệnh từ các bệnh nhân bị bất kỳ dạng nào khác của TSE, hoặc từ gia súc bị BSE (bao gồm máu thai bê). Tuy nhiên, một số phòng thí nghiệm có sử dụng các phương pháp mới, nhạy hơn để tìm PrPTSE đã thừa nhận thành công trong các nghiên cứu về huyết tương và/hoặc lớp bufly trên nhiều loại TSE ở động vật và người. Do các phép thử đều trong giai đoạn phát triển ban đầu (và chưa bao gồm các kết quả phép thử mù trên các bệnh phẩm của người hoặc động vật bị nhiễm tự nhiên), Ban Cố vấn cảm thấy còn quá sớm để đánh giá độ tin cậy của các phép thử với đủ độ tin cậy cho phép hoặc để kết luận là âm tính hoặc là dương tính. | ||||||||
Bảng D.3 - Loại C: Các mô không bị nhiễm bệnh hoặc PrPTSE
| Mô | Các bệnh TSE ở người | Gia súc | Cừu và dê | |||||
| vCJD | Các TSE khác | BSE | Bệnh thần kinh cừu, dê scrapie | |||||
| Độ nhiễm | PrPTSE | Độ nhiễm | PrPTSE | Độ nhiễm | PrPTSE | Độ nhiễm | PrPTSE | |
| Các mô sinh sản |
|
|
|
|
|
|
|
|
| Tinh hoàn | NT | - | (-) | - | - | NT | - | NT |
| Tuyến tiền liệt/mào tinh/túi tinh | NT | - | (-) | - | - | NT | - | NT |
| Tinh dịch | NT | - | (-) | - | - | NT | NT | NT |
| Buồng trứng | NT | - | NT | - | - | NT | - | NT |
| Tử cung (không thai) | NT | - | NT | - | - | NT | - | NT |
| Dịch rau thai | NT | NT | (-) | NT | - | NT | NT | NT |
| Bào thai a | NT | NT | NT | NT | - | NT | - | - |
| Phôi a | NT | NT | NT | NT | - | NT | ? | NT |
| Mô cơ xương |
|
|
|
|
|
|
|
|
| Xương | NT | NT | NT | NT | - | NT | NT | NT |
| Tim/màng tim | NT | - | - | - | - | NT | - | NT |
| Dây chằng | NT | NT | NT | NT | - | NT | NT | NT |
| Các mô khác |
|
|
|
|
|
|
|
|
| Mô nướu | NT | - | - | - | NT | NT | NT | NT |
| Tủy răng | NT | - | NT | - | NT | NT | NT | NT |
| Khí quản | NT | - | NT | - | - | NT | NT | NT |
| Da | NT | - | NT | - | - | NT | - | NT |
| Mô mỡ | NT | - | (-) | - | - | NT | NT | NT |
| Tuyến giáp | NT | - | (-) | - | NT | NT | - | NT |
| Tuyến vú/vú | NT | NT | NT | NT | - | NT | - | NT |
| Dịch cơ thể, chất bài tiết và thải tiết |
|
|
|
|
|
|
|
|
| Sữa b | NT | NT | (-) | NT | - | - | - | NT |
| Sữa non c | NT | NT | (-) | NT | (-) | - | - | NT |
| Máu dây rốn c | NT | NT | (-) | NT | - | NT | NT | NT |
| Nước bọt | NT | - | - | NT | NT | NT | - | NT |
| Mồ hôi | NT | NT | - | NT | NT | NT | NT | NT |
| Nước mắt | NT | NT | - | NT | NT | NT | NT | NT |
| Nhầy mũi | NT | - | - | NT | NT | NT | NT | NT |
| Mật | NT | NT | NT | NT | NT | NT | NT | NT |
| Nước tiểuc,d | NT | NT | - | - | - | NT | NT | NT |
| Phân | NT | NT | - | NT | - | NT | - | NT |
| a Phôi từ súc vật nhiễm BSE không truyền bệnh cho chuột, nhưng chưa có nghiên cứu về nhiễm bệnh ở mô thai bê ngoài máu (xét nghiệm sinh học âm tính trên chuột). Bê sinh từ mẹ nhận phôi từ súc vật nhiễm BSE vẫn sống sót trong thời gian theo dõi tới 7 năm, và xét nghiệm não của cả con mẹ bị nhiễm và con cái của nó cho thấy không có bệnh xốp não hay PrPTSE. b Bằng chứng về việc không nhiễm bệnh trong sữa bao gồm các quan sát dịch tễ theo không gian và thời gian không thấy có truyền bệnh từ mẹ, các quan sát về lâm sàng trên 100 con bê được nuôi dưỡng bởi các con bò không bị BSE, và các quan sát thực nghiệm rằng sữa từ bò bị nhiễm không truyền bệnh khi được đưa vào theo đường não hoặc đường miệng cho chuột. Cũng như vậy, PrPTSE thấy có trong sữa của gia súc ủ bệnh BSE sau khi cho thử thách qua đường uống. c Các báo cáo trước đây về lây truyền CJD từ máu dây rốn người, sữa non, và nước tiểu chưa bao giờ được xác nhận và được coi là không có thực. Gần đây xét nghiệm - trên chuột chuyển gen biểu hiện quá mức PrP - sữa non từ bò bị BSE cho kết quả âm tính, và PrPTSE không được phát hiện trong sữa non của gia súc ủ bệnh BSE sau khi cho thử thách qua đường uống. d Chuỗi ngắn của IgG hoạt động giống PrPTSE trong thử nghiệm Western blot đã được phát hiện trong nước tiểu của lác đác vài bệnh nhân CJD có tính gia đình và biến đổi. | ||||||||
D.3.5 Kiểm soát việc giết mổ và chế biến (xem TCVN 9858-2 (ISO 22442-2)
Nhà sản xuất cần bảo đảm rằng tất cả các biện pháp cần thiết đã được tiến hành để giảm thiểu rủi ro lây nhiễm lúc giết mổ và chế biến.
D.3.6 Các phương pháp dùng để bất hoạt hoặc loại bỏ các tác nhân TSE (xem TCVN 9858-3 (ISO 22442-3))
Đối với các thiết bị không chịu được quá trình bất hoạt/loại bỏ mà không bị hư hỏng không chấp nhận được, nhà sản xuất nên chủ yếu dựa vào việc kiểm soát nguồn gốc (xem TCVN 9858-2 (ISO 22442-2)).
Đối với các thiết bị khác, nếu nhà sản xuất cho rằng quá trình sản xuất có khả năng loại bỏ hoặc bất hoạt các tác nhân TSE, chi tiết cụ thể cần được chứng minh bằng văn bản phù hợp. Thông tin liên quan từ điểm tổng quan khoa học có thể được sử dụng để hỗ trợ các yếu tố bất hoạt/loại bỏ, trong đó các quá trình cụ thể nêu trong tài liệu có liên quan đến các quá trình được sử dụng cho thiết bị.
Nếu điểm tổng quan tài liệu không chứng minh được quan điểm, nhà sản xuất nên tiến hành nghiên cứu cụ thể về việc bất hoạt và/hoặc loại bỏ và các yếu tố sau cần được giải quyết trong nghiên cứu:
- rủi ro được xác định đối với mô;
- xác định các tác nhân TSE mẫu liên quan;
- lý do lựa chọn việc kết hợp các tác nhân TSE mẫu;
- xác định giai đoạn lựa chọn để loại bỏ và/hoặc bất hoạt các tác nhân TSE;
- tính các hệ số rút gọn.
Báo cáo tổng kết cần xác định được các thông số và giới hạn trong sản xuất đóng vai trò quan trọng trong tính hiệu quả của quá trình bất hoạt hoặc loại bỏ.
Thủ tục văn bản phù hợp cần được áp dụng nhằm bảo đảm các thông số xử lý đã được phê chuẩn sẽ được áp dụng trong quá trình sản xuất thường quy.
D.3.7 Phơi nhiễm với rủi ro TSE
D.3.7.1 Số lượng vật liệu động vật đầu vào cần để sản xuất một đơn vị vật tư y tế
Nhà sản xuất cần đánh giá số lượng mô thô hay các dẫn xuất có nguồn gốc động vật cần thiết để sản xuất một đơn vị vật tư y tế. Nhà sản xuất cần đánh giá xem liệu quá trình sản xuất có khả năng làm tập trung các nhân tố TSE có trong các mô động vật đầu vào hoặc các dẫn xuất.
D.3.7.2 Số lượng nguyên liệu nguồn gốc động vật có tiếp xúc với bệnh nhân và người sử dụng
Nhà sản xuất cần xem xét số lượng tối đa vật liệu động vật có thể tiếp xúc với các bệnh nhân và những người sử dụng (gồm cả hấp thụ và/hoặc thoái hóa), số lượng thiết bị y tế có thể sử dụng trong một quy trình nào đó và số lượng trị liệu cũng cần phải được xem xét.
D.3.7.3 Đường dùng
Cần xem xét đường dùng được khuyến cáo trong thông tin về sản phẩm. Xếp theo thứ tự từ rủi ro cao nhất đến rủi ro thấp nhất, danh sách được nêu là:
a) các sản phẩm có tiếp xúc với hệ thần kinh trung ương (bao gồm đường trong mắt);
b) các sản phẩm có tiếp xúc với hệ tuần hoàn trung tâm hoặc dùng ngoài đường tiêu hóa hoặc các thiết bị xâm lấn hoặc các thiết bị dùng trên vết thương hở, bao gồm các chế phẩm điều trị loét;
c) các sản phẩm cần dùng trên màng niêm mạc lành như kết mạc, niêm mạc mũi, phế quản, trực tràng, âm đạo, bàng quang; các sản phẩm cần thiết để lưu trong miệng (má, dưới lưỡi) hoặc để nuốt vào;
d) các sản phẩm được áp dụng trên da không bị tổn thương.
D.3.7.4 Ước lượng rủi ro phơi nhiễm
Cần ước lượng mức độ phơi nhiễm với rủi ro TSE và ảnh hưởng của nó đối với rủi ro TSE chung.
Thư mục tài liệu tham khảo
[1] TCVN 7391-2 (ISO 10993-2), Đánh giá sinh học trang thiết bị y tế - Phần 2: Yêu cầu sử dụng động vật.
[2] TCVN 7391-3 (ISO 10993-3), Đánh giá sinh học trang thiết bị y tế - Phần 3: Phép thử độc tính di truyền, khả năng gây ung thư và độc tính sinh sản.
[3] TCVN 7391-4 (ISO 10993-4), Đánh giá sinh học trang thiết bị y tế - Phần 4: Chọn phép thử tương tác với máu.
[4] TCVN 7391-5 (ISO 10993-5), Đánh giá sinh học trang thiết bị y tế - Phần 5: Phép thử độc tính tế bào in vitro.
[5] TCVN 7391-6 (ISO 10993-6), Đánh giá sinh học trang thiết bị y tế - Phần 6: Phép thử hiệu ứng tại chỗ sau cấy ghép.
[6] TCVN 7391-7 (ISO 10993-7), Đánh giá sinh học trang thiết bị y tế - Phần 7: Dư lượng tiệt trùng bằng etylen oxit.
[7] ISO 10993-9 Biological evaluation of medical devices - Part 9: Framework for identification and quantification of potential degradation products (Đánh giá sinh học trang thiết bị y tế - Phần 9: Cơ cấu xác định và định lượng các sản phẩm hư hỏng tiềm tàng).
[8] TCVN 7391-10 (ISO 10993-10), Đánh giá sinh học trang thiết bị y tế - Phần 10: Phép thử kích thích và quá mẫn muộn.
[9] TCVN 7391-11 (ISO 10993-11), Đánh giá sinh học trang thiết bị y tế- Phần 11: Phép thử độc tính toàn thân.
[10] TCVN 7391-12 (ISO 10993-12), Đánh giá sinh học trang thiết bị y tế - Phần 12: Chuẩn bị mẫu và các vật liệu chuẩn.
[11] ISO 10993-13 Biological evaluation of medical devices - Part 13: Identification and quantification of degradation products from polymeric medical devices (Đánh giá sinh học trang thiết bị y tế - Phần 13: Xác định và định lượng sản phẩm thoái hóa từ các thiết bị y tế bằng polyme).
[12] TCVN 7391-14 (ISO 10993-14), Đánh giá sinh học trang thiết bị y tế - Phần 14: Nhận dạng và định lượng sản phẩm phân hủy từ gốm sứ.
[13] TCVN 7391-15 (ISO 10993-15), Đánh giá sinh học trang thiết bị y tế - Phần 15: Nhận dạng và định lượng sản phẩm phân hủy từ kim loại và hợp kim.
[14] TCVN 7391-16 (ISO 10993-16), Đánh giá sinh học trang thiết bị y tế - Phần 16: Thiết kế nghiên cứu độc lực cho sản phẩm phân hủy và ngâm chiết.
[15] TCVN 7391-17 (ISO 10993-17), Đánh giá sinh học trang thiết bị y tế- Phần 17: Thiết lập giới hạn cho phép của chất ngâm chiết.
[16] TCVN 7391-18 (ISO 10993-18), Đánh giá sinh học trang thiết bị y tế - Phần 18: Đặc trưng hóa học của vật liệu.
[17] ISO/TS 10993-19, Biological evaluation of medical devices - Part 19: Physico chemical, morphological and topographical characterization (Đánh giá sinh học trang thiết bị y tế - Phần 19: Đặc tính lý-hóa, hình thái và định vị của vật liệu).
[18] ISO/TS 10993-20, Biological evaluation of medical devices - Part 20: Principles and methods for immunotoxicology testing of medical devices (Đánh giá sinh học trang thiết bị y tế - Phần 20: Các nguyên lý và phương pháp thử nghiệm độc miễn dịch đối với thiết bị y tế).
[19] TCVN 7392 (ISO 11135), Trang thiết bị y tế - Xác nhận và kiểm soát thường quy tiệt trùng bằng ethylen oxit.
[20] TCVN 7393 (ISO 11137) (tất cả các phần), Tiệt trùng các sản phẩm chăm sóc sức khỏe - Yêu cầu xác nhận và kiểm soát thường quy - Tiệt trùng bằng bức xạ.
[21] ISO 11737-1, Sterilization of medical devices - Microbiological methods - Part 1: Estimation of population of microorganisms on products (Tiệt khuẩn thiết bị y tế- Phương pháp vi sinh vật - Phần 1: Xác định quần thể vi sinh vật trên sản phẩm).
[22] TCVN 8026-1 (ISO 13408-1), Quá trình vô khuẩn sản phẩm chăm sóc sức khỏe - Phần 1: Yêu cầu chung.
[23] TCVN 8026-2 (ISO 13408-2), Quá trình vô khuẩn sản phẩm chăm sóc sức khỏe - Phần 2: Sự lọc.
[24] TCVN 8026-3 (ISO 13408-3), Quá trình vô khuẩn sản phẩm chăm sóc sức khỏe - Phần 3: Sự đông khô.
[25] TCVN 8026-4 (ISO 13408-4) Quá trình vô khuẩn sản phẩm chăm sóc sức khỏe - Phần 4: Công nghệ làm sạch tại chỗ.
[26] TCVN 8026-5 (ISO 13408-5) Quá trình vô khuẩn sản phẩm chăm sóc sức khỏe - Phần 5: Tiệt khuẩn tại chỗ.
[27] TCVN 8026-6 (ISO 13408-6) Quá trình vô khuẩn sản phẩm chăm sóc sức khỏe - Phần 6: Hệ thống phân tách.
[28] TCVN ISO 13485 (ISO 13485), Thiết bị y tế - Hệ thống quản lý chất lượng - Yêu cầu đối với các mục đích chế định.
[29] ISO 14160 Sterilization of health care products - Liquid chemical sterilizing agents for single-use medical devices utilizing animal tissues and their derivatives - Requirements for characterization, development, validation and routine control of a sterilization process for medical devices (Tiệt khuẩn sản phẩm chăm sóc sức khỏe - Chất tiệt khuẩn hóa học dạng lỏng dùng cho thiết bị y tế sử dụng một lần có dùng mô động vật và các dẫn xuất của chúng - Yêu cầu về triển khai, xây dựng, đánh giá xác nhận và kiểm soát thường quy quá trình tiệt khuẩn thiết bị y tế).
[30] TCVN 8582 (ISO 14937) Tiệt khuẩn sản phẩm chăm sóc sức khỏe - Yêu cầu chung đối với đặc tính của các tác nhân tiệt khuẩn. Việc triển khai, đánh giá xác nhận và kiểm soát thường quy quá trình tiệt khuẩn thiết bị y tế.
[31] ISO 17664, specifies the information to be provided by the medical device manufacturer on the processing of medical devices claimed to be (Tiệt khuẩn các thiết bị y tế - Thông tin nhà sản xuất cung cấp đối với xử lý các thiết bị y tế có thể tiệt khuẩn lại).
[32] ISO 17665-1, Sterilization of health care products - Moist heat - Part 1: Requirements for the development, validation and routine control of a sterilization process for medical devices (Tiệt khuẩn sản phẩm chăm sóc sức khỏe - Ẩm nhiệt độ cao - Phần 1: Yêu cầu đối với việc triển khai, đánh giá xác nhận và kiểm soát thường quy quá trình tiệt khuẩn thiết bị y tế).
[33] European Pharmacopoeia, 2.6.8 Pyrogents (Dược thư Châu Âu, 2.6.8. Chất gây sốt).
[34] European Pharmacopoeia, 2.6.4 Bact erial endotoxins (Dược thư Châu Âu, 2.6.14. Nội độc tố vi khuẩn).
[35] European Pharmacopoeia, 5.2.8 Minimizing the risk ò transmitting animal sponggiform ecephalopathy agents via human and medicinal products (Dược thư Châu Âu, 5.2.8. Giảm thiểu rủi ro truyền bệnh xốp não động vật qua các sản phẩm y tế dùng cho người và thú y).
[36] US Pharmacopoeia <85> Bacterial Endotoxins Test (Dược thư Mỹ <85> Xét nghiệm nội độc tố vi khuẩn).
[37] US Pharmacopoeia <151> Pyrogen Test (Dược thư Mỹ <151> Xét nghiệm chất gây sốt).
[38] Suplement 1, Japanese Pharmacopoeia XIV, 17. Basic Requirements for Viral Safety of Biotechnological/Biological Products, listed in Japanese pharamacopoeia, pp 1618-1631, 2003 (Phụ chương 1, Dược thư Nhật Bản XIV, 17. Các yêu cầu cơ bản đối với độ an toàn với virus của các sản phẩm sinh học/công nghệ sinh học, liệt kê trong Dược thư Nhật Bản, tr. 1618-1631, 2003).
[39] Global Harmonization Task Force (GHTF) - study Group 1 (SG1), Document No. N029R13, Stage PD dated December 2003 (http://www.ghtf.org) (Tổ chức Hài hòa các thủ tục trên Toàn cầu (GHTF) - Nhóm nghiên cứu 1 (SG1) Văn bản số N029R13, Giai đoạn PD tháng 12/2003)
[40] WHO Guidelines on Transmissible Spongiform Encephalopathies in relation to Biological and Pharmaceutical Products, 2003) (www.who.int/bloodproducts/publications/en/WHO_TSE_2003.pdf) (Hướng dẫn của WHO về các bệnh xốp não lây truyền liên quan đến các sản phẩm sinh học và dược phẩm, 2003).
[41] WHO Guidelines on Tissue Infectivity Distribution in Transmissible Spongiform Encephalopathies 2006 (http://www.who.int/bloodproducts/cs/TSEPUBLISHEDREPORT.pdf) (Hướng dẫn của WHO về Phân bố các mô bị nhiễm trong các bệnh xốp não lây truyền năm 2006).
[42] EMEA/410/01 Rev.2 - October 2003, Note for guidence on minimising the risk of transmitting animal spongiform encephalopathy agents via human and veterinary medicinal products adopted by the Committee for Proprietery Medicinal Product (CPMP) and by the Committee for Veterinary Medicinal Products (CVMP) - Official Journal of the European Union 28.1.2004 (EMEA/410/01 Rev.2 - 10/2003, Chú ý đối với hướng dẫn giảm thiểu rủi ro truyền các yếu tố gây bệnh xốp não động vật qua các sản phẩm y tế dùng cho người và thú y, được thông qua bởi Ủy ban Các sản phẩm Y tế Độc quyền (CPMP) và bởi Ủy ban Các sản phẩm Y tế Thú y (CVMP) - Tạp chí chính thức của Liên minh Châu Âu 28/1/2004).
[43] EMEA/CPMP/571/02 - February 2002, Public statement on Lactose prepared using calf rennet of the European Agency for the Evaluation of Medicine Products (EMEA/CPMP/571/02 - 2/2002, Công bố về Lactose pha chế có sử dụng enzym đông sữa của Cục Đánh giá Các sản phẩm Y tế Châu Âu).
[44] Terrestrial Animal Health Code from OIE - Office International des Epizooties/World Organisation for Animal Health (Luật Sức khỏe Động vật trên cạn của OIE - Tổ chức Sức khỏe Động vật Thế giới) (http://www.oie.int/).
[45] Notification No. 177 of Ministry of Health, Labour and Welfare on the standard for biological ingredients, 31 March 2005 on Standards for Raw Materials Originating from Living Organisms (http://www.nihs.ao.jp/cgtp/cgtp/guidline/03052001.pdf) (in Japanese) (Thông báo số 177 của Bộ Y tế, Lao động và Phúc lợi về tiêu chuẩn các thành phần sinh học, 31/3/2005 trong Các tiêu chuẩn cho Nguyên liệu Thô Bắt nguồn từ Sinh vật Sống) (bằng tiếng Nhật).
[46] MEDDEV 2.11/1, rev 1, 2/2004, Guidelines relating to medical Devices Directives, Application of Council Directive 93/42/EEC taking into account the Commission Directive 2003/32/EC for medical devices utilising tissue or derivatives originating from animals for which a TSE risk is suspected, a guide for manufacturers and notified bodies (http://www.meddev.net/) (Hướng dẫn liên quan đến Chỉ thị về Các thiết bị Y tế, Áp dụng Chỉ thị của Hội đồng 93/42/EEC có xem xét Chỉ thị Ủy ban 2003/32/EC đối với các thiết bị y tế dùng mô hoặc dẫn xuất có nguồn gốc động vật nghi ngờ có TSE, hướng dẫn cho nhà sản xuất và các cơ quan được thông báo).
[47] Assessment of Risk of Bovine Spongiform Encephalopathy in Pharmaceutical Products, Part 1, Pharmaceutical Research and Manufacturersof America (PhRMA) BSE Committee, BioPharm, 11, Nuber 1, pp 20-31, 56, January, 1998 (Đánh giá Rủi ro Bệnh xốp não Bò trong Các sản phẩm Dược, Phần 1, Ủy ban BSE trong Nghiên cứu và Sản xuất Dược phẩm Mỹ (PhRMA), BioPharm., 11, Số 1, tr. 20-31, 56, 1/1998).
[48] Assessment of Risk of Bovine Spongiform Encephalopathy in Pharmaceutical Products, Part 2, Example Risk Assessment for a Hypothetical Product, Pharmaceutical Research and manufacturers of America (PhRMA) BSE Committee, BioPharm, 11, Number 3, pp 18-30, March, 1998 (Đánh giá Rủi ro Bệnh xốp não Bò trong Các sản phẩm Dược, Phần 2, Đánh giá Rủi ro Ví dụ trên Sản phẩm Giả định, Ủy ban BSE trong Nghiên cứu và Sản xuất Dược phẩm Mỹ (PhRMA), BioPharm., 11, số 3, tr. 18-30, 3/1998).
Mục lục
Lời giới thiệu
1 Phạm vi áp dụng
2 Tài liệu viện dẫn
3 Thuật ngữ và định nghĩa
4 Quy trình quản lý rủi ro
Phụ lục A - (tham khảo) Hướng dẫn áp dụng tiêu chuẩn này
Phụ lục B - (tham khảo) Biểu diễn đồ thị phần quy trình quản lý rủi ro đối với các thiết bị y tế sử dụng vật liệu động vật
Phụ lục C - (quy định) Các yêu cầu đặc biệt đối với một số vật liệu động vật có xem xét quản lý rủi ro đối với các tác nhân gây bệnh TSE
Phụ lục D - (tham khảo) Thông tin liên quan đến quản lý rủi ro TSE
Thư mục tài liệu tham khảo
1 Liên minh Châu Âu EU đã xuất bản các tài liệu về Các rủi ro BSE theo vùng địa lý cho một số quốc gia, có thể xem trên trang web của Ủy ban Điều hành Khoa học của Ủy ban Liên minh Châu Âu: http://europa.eu.int/comm/food/fs/sc/ssc/outcome_en.html.
Danh sách được EFSA cho phép có thể tìm thấy trong địa chỉ sau: http://www.efsa.eu.int/science/tse_assessments/gbr_assessments/catindex_en.html.
2 Danh sách cho phép được ban hành bởi Dịch vụ Kiểm tra Sức khỏe Cây trồng và Động vật có thể xem tại http://www.aphis.usda.gov/vs/ncie/country-html#BSE.
3 Ủy ban cho Sản phẩm Y tế Độc quyền và Nhóm Công tác Công nghệ sinh học đã tiến hành việc đánh giá quản lý và rủi ro đối với lactose chế biến từ enzyme đông sữa từ bê. Việc đánh giá rủi ro bao gồm nguồn gốc của động vật, cách cắt dạ múi khế, và sự sẵn có của các phương pháp bảo hiểm chất lượng. Chất lượng của các sản phẩm thay thế sữa dùng chăn nuôi động vật để lấy dạ múi khế được coi là đặc biệt quan trọng.
4 PrPTSE = prion protein - cùng dạng protein gây nhiễm TSE.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 9858-1:2013 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 9858-1:2013 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 9858-1:2013 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 9858-1:2013 DOC (Bản Word)