- Tổng quan
- Nội dung
- VB gốc
- Tiếng Anh
- Hiệu lực
- VB liên quan
- Lược đồ
-
Nội dung hợp nhất
Tính năng này chỉ có tại LuatVietnam.vn. Nội dung hợp nhất tổng hợp lại tất cả các quy định còn hiệu lực của văn bản gốc và các văn bản sửa đổi, bổ sung, đính chính... trên một trang. Việc hợp nhất văn bản gốc và những văn bản, Thông tư, Nghị định hướng dẫn khác không làm thay đổi thứ tự điều khoản, nội dung.
Khách hàng chỉ cần xem Nội dung hợp nhất là có thể nắm bắt toàn bộ quy định hiện hành đang áp dụng, cho dù văn bản gốc đã qua nhiều lần chỉnh sửa, bổ sung.
- Tải về
Quyết định 3129/QĐ-BYT Tài liệu Hướng dẫn chẩn đoán và điều trị ung thư biểu mô tế bào gan
| Cơ quan ban hành: | Bộ Y tế |
Số công báo:
Số công báo là mã số ấn phẩm được đăng chính thức trên ấn phẩm thông tin của Nhà nước. Mã số này do Chính phủ thống nhất quản lý.
|
Đang cập nhật |
| Số hiệu: | 3129/QĐ-BYT | Ngày đăng công báo: | Đang cập nhật |
| Loại văn bản: | Quyết định | Người ký: | Nguyễn Trường Sơn |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
17/07/2020 |
Ngày hết hiệu lực:
Ngày hết hiệu lực là ngày, tháng, năm văn bản chính thức không còn hiệu lực (áp dụng).
|
Đang cập nhật |
|
Áp dụng:
Ngày áp dụng là ngày, tháng, năm văn bản chính thức có hiệu lực (áp dụng).
|
Đã biết
|
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
| Lĩnh vực: | Y tế-Sức khỏe |
TÓM TẮT QUYẾT ĐỊNH 3129/QĐ-BYT
Theo đó, các phương pháp điều trị đối với tổn thương ung thư biểu mô tế bào gan bao gồm: Phẫu thuật cắt bỏ phần gan có mang khối u; Phẫu thuật ghép gan; Phá hủy khối u tại chỗ; Cắt nguồn máu nuôi khối u phối hợp với diệt tế bào ung thư bằng hóa chất; Truyền hoá chất qua động mạch gan; Xạ trị; Điều trị toàn thân;..
Cụ thể, phẫu thuật cắt gan nên được thực hiện đối với các trường hợp: Phần gan có khối u dự kiến cắt bỏ được; Thể tích gan dự kiến còn lại phù hợp với bệnh nhân, nên đo thể tích gan để góp phần ra chỉ định cắt gan đối với các trường hợp dự kiến cắt ≥ 50% thể tích gan; Không có di căn xa;…
Bên cạnh đó, Bộ Y tế quy định cần theo dõi định kỳ cho đến khi bệnh nhân không thể tiếp tục được theo dõi nữa; Bệnh nhân vừa được điều trị sẽ được hẹn tái khám sau 01 tháng để đánh giá kết quả điều trị; Nếu bệnh tiến triển và còn khả năng điều trị thì chỉ định phương pháp điều trị và cho lịch hẹn; Nếu kết quả điều trị là ổn thì hẹn tái khám sau 02 tháng.
Ngoài ra, để phòng bệnh cần tiêm vaccine phòng bệnh viêm gan siêu vi B cho những người chưa nhiễm, đặc biệt là cho trẻ sơ sinh; Chủ động tầm soát định kỳ ung thư biểu mô tế bào gan trên những người có nhiễm HBV, HCV, xơ gan; Tuyên truyền hạn chế sử dụng các đồ uống có cồn;…
Quyết định này có hiệu lực kể từ ngày ký.
Xem chi tiết Quyết định 3129/QĐ-BYT có hiệu lực kể từ ngày 17/07/2020
Tải Quyết định 3129/QĐ-BYT
| BỘ Y TẾ Số: 3129/QĐ-BYT | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM Hà Nội, ngày 17 tháng 7 năm 2020 |
QUYẾT ĐỊNH
Về việc ban hành tài liệu chuyên môn
“Hướng dẫn chẩn đoán và điều trị ung thư biểu mô tế bào gan”
___________
BỘ TRƯỞNG BỘ Y TẾ
Căn cứ Luật Khám bệnh, chữa bệnh năm 2009;
Căn cứ Nghị định số 75/2017/NĐ-CP ngày 20 tháng 6 năm 2017 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Theo đề nghị của Cục trưởng Cục Quản lý khám, chữa bệnh,
QUYẾT ĐỊNH:
Điều 1. Ban hành kèm theo Quyết định này tài liệu chuyên môn “Hướng dẫn chẩn đoán và điều trị ung thư biểu mô tế bào gan”.
Điều 2. Tài liệu chuyên môn “Hướng dẫn chẩn đoán và điều trị ung thư biểu mô tế bào gan” được áp dụng tại các cơ sở khám bệnh, chữa bệnh trong cả nước.
Điều 3. Quyết định này có hiệu lực kể từ ngày ký, ban hành.
Điều 4. Các ông, bà: Chánh Văn phòng Bộ, Chánh thanh tra Bộ, Tổng Cục trưởng, Cục trưởng và Vụ trưởng các Tổng cục, Cục, Vụ thuộc Bộ Y tế, Giám đốc Sở Y tế các tỉnh, thành phố trực thuộc trung ương, Giám đốc các Bệnh viện trực thuộc Bộ Y tế, Thủ trưởng Y tế các ngành chịu trách nhiệm thi hành Quyết định này./.
| Nơi nhận: - Như Điều 4; - Quyền Bộ trưởng (để báo cáo); - Các Thứ trưởng; - Cổng thông tin điện tử Bộ Y tế; Website Cục KCB; - Lưu: VT, KCB. | KT. BỘ TRƯỞNG THỨ TRƯỞNG
Nguyễn Trường Sơn |

HƯỚNG DẪN CHẨN ĐOÁN VÀ ĐIỀU TRỊ UNG THƯ BIỂU MÔ TẾ BÀO GAN
(Ban hành kèm theo Quyết định số 3129/QĐ-BYT ngày 17 tháng 07 năm 2020)
Hà Nội, 2020
CHỈ ĐẠO BIÊN SOẠN
PGS.TS. Nguyễn Trường Sơn, Thứ trưởng Bộ Y tế
CHỦ BIÊN
PGS.TS. Lương Ngọc Khuê, Cục trưởng Cục Quản lý Khám, chữa bệnh, Bộ Y tế
ĐỒNG CHỦ BIÊN
GS.TS. Mai Trọng Khoa, Nguyên Phó Giám đốc Bệnh viện Bạch Mai
THAM GIA BIÊN SOẠN
GS.TS. Mai Trọng Khoa, Nguyên Phó Giám đốc Bệnh viện Bạch Mai
PGS.TS. Lương Ngọc Khuê, Cục trưởng Cục Quản lý Khám, chữa bệnh, Bộ Y tế
BSCKII. Nguyễn Đình Song Huy, Phó Giám đốc Trung tâm Ung bướu, Bệnh viện Chợ Rẫy
GS.TS. Mai Hồng Bàng, Giám đốc Bệnh viện Trung ương Quân đội 108
GS.TS. Nguyễn Cường Thịnh, Chủ nhiệm Bộ môn Ngoại tiêu hóa, Viện Nghiên cứu khoa học Y Dược lâm sàng, Bệnh viện trung ương Quân đội 108
PGS.TS. Đỗ Đức Cường, Chủ nhiệm khoa Chẩn đoán hình ảnh - Bệnh viện Trung ương Quân đội 108
PGS.TS. Lê Hữu Song, Phó Giám đốc Bệnh viện Trung ương Quân đội 108
PGS.TS. Nguyễn Tiến Thịnh, Chủ nhiệm Khoa Nội tiêu hóa, Bệnh viện Trung ương Quân đội 108
PGS.TS. Trần Đình Hà, Nguyên Giám đốc Trung tâm Y học hạt nhân và Ung bướu, Bệnh viện Bạch Mai
PGS.TS. Phạm Cẩm Phương, Giám đốc Trung tâm Y học hạt nhân và Ung bướu, Bệnh viện Bạch Mai
TS. Lê Thanh Dũng, Phó Trưởng khoa Chẩn đoán hình ảnh, Bệnh viện Việt Đức PGS.TS. Nguyễn Quang Nghĩa, Giám đốc Trung tâm ghép tạng, Bệnh viện Việt Đức
GS.TS. Phạm Như Hiệp, Giám đốc Bệnh viện Trung ương Huế
PGS.TS. Bùi Văn Giang, Giám đốc Trung tâm Chẩn đoán hình ảnh, Bệnh viện K
PGS.TS. Tạ Văn Tờ, Giám đốc Trung tâm Giải phẫu bệnh và Sinh học phân tử, Bệnh viện K
TS. Nguyễn Tiến Quang, Phó Giám đốc Bệnh viện K
TS. Đỗ Anh Tú, Phụ trách cơ sở Tam Hiệp, Bệnh viện K
TS. Phạm Thế Anh, Trưởng khoa Gan mật, Bệnh viện K
ThS. Nguyễn Trọng Khoa, Phó Cục trưởng Cục Quản lý Khám, chữa bệnh
TỔ THƯ KÝ
TS. Đỗ Anh Tú, Phụ trách cơ sở Tam Hiệp, Bệnh viện K
ThS.BS. Trương Lê Vân Ngọc, Chuyên viên Cục Quản lý Khám, chữa bện
MỤC LỤC
BẢNG DANH MỤC CÁC CHỮ VIẾT TẮT....................................................................... 3
1. ĐẠI CƯƠNG............................................................................................................ 6
2. DỊCH TỄ HỌC UTBMTBG VÀ CÁC YẾU TỐ NGUY CƠ.............................................. 6
2.1. Dịch tễ học........................................................................................................... 6
2.2. Các yếu tố nguy cơ chính....................................................................................... 6
2.3. Phòng ngừa UTBMTBG.......................................................................................... 7
3. TẦM SOÁT UTBMTBG.............................................................................................. 7
3.1. Đối tượng tầm soát................................................................................................. 7
3.2. Phương tiện và tần suất tầm soát............................................................................ 7
4.1. Khám lâm sàng và các xét nghiệm cận lâm sàng cần làm......................................... 7
4.2. Hình ảnh học.......................................................................................................... 8
4.3. Chỉ dấu sinh học................................................................................................... 10
4.4. Sinh thiết gan....................................................................................................... 11
4.5. Chẩn đoán xác định UTBMTBG............................................................................. 11
4.6. Chẩn đoán phân biệt............................................................................................. 14
4.7. Phân chia giai đoạn bệnh...................................................................................... 14
5. ĐIỀU TRỊ UTBMTBG............................................................................................... 14
5.1. Nguyên tắc điều trị UTBMTBG............................................................................... 14
5.2. Các phương pháp điều trị đối với tổn thương UTBMTBG........................................ 14
5.3. Phối hợp các phương pháp điều trị........................................................................ 20
5.4. Điều trị giảm nhẹ.................................................................................................. 20
5.5. Điều trị hỗ trợ....................................................................................................... 20
6. THEO DÕI VÀ TÁI KHÁM........................................................................................ 21
7. PHÒNG BỆNH........................................................................................................ 21
TÀI LIỆU THAM KHẢO................................................................................................ 32
BẢNG DANH MỤC CÁC CHỮ VIẾT TẮT
| AASLD | American Association for Study of the Liver Diseases Hội Nghiên cứu bệnh gan Hoa Kỳ |
| AFP | Alpha-fetoprotein |
| AFP-L3 | Lens culinaris agglutinin-reactive fraction of AFP |
| AJCC | American Joint Committee on Cancer Hiệp hội Ung thư Mỹ |
| ALT | Alanine transaminase |
| APASL | Asian Pacific Association for the Study of the Liver Hiệp hội Nghiên cứu Bệnh gan châu Á Thái Bình Dương |
| AST | Aspartate transaminase |
| BCLC | Barcelona Clinic Liver Cancer |
| CA 12-5 | Carbohydrate antigen (carcinoma antigen) 12-5 |
| CA 19-9 | Carbohydrate antigen (carcinoma antigen) 19-9 |
| CĐHA | Chẩn đoán hình ảnh |
| CEA | Carcinoembryonic antigen |
| CEUS | Contrast-enhanced ultrasound Siêu âm có chất tương phản |
| CT | Computerized Tomography Chụp cắt lớp vi tính |
| cTACE | conventional TACE Nút mạch hóa chất thường quy |
| DCP | Des-gamma-carboxyprothrombin |
| DEB-TACE | Drug-eluting bead TACE Nút mạch sử dụng hạt nhúng hóa chất |
| ESMO | European Society of Medical Oncology Hội Ung thư Nội khoa châu Âu |
| FGFR | Fibroblast growth factor receptor Thụ thể yếu tố tăng truởng nguyên bào sợi |
| Gd-EOB-DTPA | Gadolinium ethoxybenzyl diethylenetriamine pentaacetic acid |
| HAIC | Hepatic arterial infusion chemotherapy Truyền hóa chất qua động mạch gan |
| HBV | Hepatitis B virus Vi rút viêm gan siêu vi B |
| HCC | Hepatocellular Carcinoma |
|
| Ung thư biểu mô tế bào gan |
| HCV | Hepatitis C virus Vi rút viêm gan siêu vi C |
| ICG | Indocyanin green |
| IMRT | Intensity-modulated radiation therapy Xạ trị điều biến liều |
| LI-RADS | The Liver Imaging Reporting And Data System Hệ thống Dữ liệu và Báo cáo hình ảnh Gan |
| MDCT | Multidetector Computerized Tomography Chụp cắt lớp vi tính đa dãy đầu thu |
| mRECIST | Modified Response Evaluation Criteria in Solid Tumors Tiêu chuẩn đánh giá đáp ứng khối u đặc cải tiến |
| MRI | Magnetic resonance imaging Chụp cộng hưởng từ |
| MWA | Microwave Ablation Hủy u bằng vi sóng |
| NAFLD | Non-alcoholic Fatty Liver Disease Bệnh gan nhiễm mỡ không do rượu |
| NASH | Non-alcoholic Steatohepatitis Bệnh viêm gan thoái hóa mỡ không do rượu |
| UTBMTBG | Ung thư biểu mô tế bào gan |
| PEI | Percutaneous Ethanol Injection Hủy u bằng cách tiêm cồn qua da |
| PET/CT | Positron emission tomography/computerized tomography |
| PIVKA-II | Prothrombin induced by vitamin K absence-II |
| PS | Performance Status Tình trạng hoạt động cơ thể |
| PSA | Prostate-specific antigen |
| RFA | Radiofrequency ablation |
| RFA | Đốt sóng cao tần |
| SBRT | Stereotactic Body Radiation Therapy Xạ trị định vị thân |
| SIRT | Selective Internal Radiation Therapy Xạ trị trong chọn lọc |
| SPECT | Single-photon emission computed tomography |
| SRS | Xạ phẫu định vị thân |
| SVR | Sustained virologic response Đáp ứng vi rút bền vững |
| TACE | Transarterial Chemoembolization Nút mạch xạ trị |
| TNM | Tumor Node Metastasis |
| VEGFR | Vascular endothelial growth factor receptor Thụ thể yếu tố tăng truởng nội mô mạch máu |
| WHO | World Health Organization Tổ chức Y tế tế giới |
HƯỚNG DẪN CHẨN ĐOÁN VÀ ĐIỀU TRỊ UNG THƯ BIỂU MÔ TẾ BÀO GAN
(Ban hành kèm theo Quyết định số 3129/QĐ-BYT ngày 17 tháng 07 năm 2020)
1. ĐẠI CƯƠNG
Ung thư biểu mô tế bào gan (UTBMTBG) là loại tổn thương thường gặp nhất trong các loại ung thư tại gan, nằm trong sáu loại ung thư phổ biến nhất trên thế giới và nằm trong ba loại ung thư phổ biến nhất tại Việt Nam. UTBMTBG đứng đầu trong các nguyên nhân tử vong liên quan đến ung thư tại Việt Nam.
2. DỊCH TỄ HỌC UTBMTBG VÀ CÁC YẾU TỐ NGUY CƠ
2.1. Dịch tễ học
UTBMTBG là loại ung thư thường gặp nhất và là nguyên nhân hàng đầu gây tử vong liên quan đến ung thư tại Việt Nam theo ước tính của Tổ chức Ghi nhận Ung thư toàn cầu (GLOBOCAN) năm 2018. Tại Việt Nam chưa có số liệu quốc gia được công bố chính thức về xuất độ UTBMTBG. Một nghiên cứu ghi nhận số liệu UTBMTBG tại miền Trung và miền Nam Việt Nam là 24091 trường hợp trong thời gian 2010 đến 2016, trong đó 62,3% có nhiễm virus viêm gan B (HBV) mạn và 26% có nhiễm virus viêm gan C (HCV) mạn. Việt Nam là nước có xuất độ nhiễm HBV cao, ước tính có khoảng 12,3% nam giới và 8,8% nữ giới có nhiễm HBV mạn. Tuy việc chủng ngừa HBV cho trẻ em tại Việt Nam đã làm giảm phần nào xuất độ viêm gan virus B mạn, nhưng vẫn đang có tình trạng bùng phát ung thư biểu mô tế bào gan liên quan đến nhiễm HBV tại Việt Nam.
2.2. Các yếu tố nguy cơ chính
- HBV: theo số liệu của Tổ chức Y tế Thế giới (WHO) năm 2016, dựa trên một số nghiên cứu từ 2003 đến 2014, tỉ lệ nhiễm HBV ở người lớn tại Việt Nam khoảng 8,2-19%. Nhiều nghiên cứu phân tích gộp (meta-analysis) đã chứng tỏ nguy cơ UTBMTBG ở những người nhiễm HBV cao hơn 15-20 lần so với những người không nhiễm. Nguy cơ bị UTBMTBG trong cuộc đời của người nhiễm HBV mạn là khoảng 10-25%. Có nhiều yếu tố làm tăng nguy cơ UTBMTBG ở người nhiễm HBV mạn, bao gồm các yếu tố về hình thái (nam giới, tuổi lớn, tiền sử gia đình có người bị UTBMTBG), về virus (mức độ nhân bản HBV cao, kiểu hình HBV, thời gian nhiễm HBV, đồng nhiễm với HCV, HIV, HDV), về lâm sàng (có xơ gan) và về môi trường và lối sống (phơi nhiễm với Aflatoxin, nghiện rượu nặng, hút thuốc lá).
- HCV: theo số liệu của Tổ chức Y tế Thế giới (WHO) năm 2016, dựa trên một số nghiên cứu từ 2003 đến 2014, tỉ lệ nhiễm HCV ở người lớn tại Việt Nam khoảng 1-3,3%. Một phân tích gộp trên một số nghiên cứu bệnh-chứng (case-control studies) cho thấy người có kháng thể kháng HCV có nguy cơ bị UTBMTBG gấp 17 lần so với người không có kháng thể kháng HCV.
- Đồng nhiễm HBV và HCV: làm tăng nguy cơ bị UTBMTBG. Trong một nghiên cứu 24091 trường hợp UTBMTBG tại miền Trung và miền Nam Việt Nam trong thời gian 2010 đến 2016, tỉ lệ đồng nhiễm HBV và HCV là 2,7%.
- Sử dụng đồ uống có cồn: một phân tích gộp trên 19 nghiên cứu tiến cứu ghi nhận nguy cơ UTBMTBG tăng 16% ở những người sử dụng từ 3 đơn vị đồ uống có cồn trở lên mỗi ngày và tăng 22% ở những người sử dụng từ 6 đơn vị đồ uống có cồn trở lên mỗi ngày, và nguy cơ này cũng tăng ngay cả khi chỉ sử dụng lượng cồn thấp nhất mỗi ngày (25g mỗi ngày, tương ứng với 2 đơn vị đồ uống có cồn mỗi ngày). Ở Việt Nam, chưa có số liệu chính thức về mối liên quan giữa UTBMTBG và việc sử dụng đồ uống có cồn. Theo một nghiên cứu trên 1617 bệnh nhân UTBMTBG tại miền Trung và miền Nam Việt Nam, có 68,6% bệnh nhân đã và đang sử dụng đồ uống có cồn với nhiều mức độ khác nhau.
2.3. Phòng ngừa UTBMTBG
- Nên sử dụng vaccin chủng ngừa HBV cho trẻ em, nhất là trẻ sơ sinh để ngăn ngừa việc nhiễm HBV. Nên điều trị lâu dài và hiệu quả cho các bệnh nhân nhiễm HBV mạn và có bệnh lý gan đang hoạt động.
- Nên điều trị viêm gan virus C cho đến khi bệnh nhân đạt được đáp ứng virus bền vững (sustained virologic response - SVR). Nguy cơ UTBMTBG sẽ giảm đáng kể nếu các bệnh nhân viêm gan virus C mạn đạt được SVR. Tuy nhiên, ngay cả khi đạt được SVR, các bệnh nhân lớn tuổi, số lượng tiểu cầu thấp, và/hoặc có xơ gan vẫn có nguy cơ UTBMTBG cao và cần được tầm soát.
- Nên điều trị các bệnh lý chuyển hóa như bệnh gan nhiễm mỡ không do rượu (Non-alcoholic Fatty Liver Disease - NAFLD), bệnh viêm gan thoái hóa mỡ không do rượu (Non-alcoholic Steatohepatitis - NASH) vì các bệnh lý này làm tăng nguy cơ UTBMTBG, nhất là khi đã có xơ gan. Các hội chứng chuyển hóa, đặc biệt là tiểu đường và béo phì, làm tăng nguy cơ UTBMTBG trên các bệnh nhân bị NASH.
3. TẦM SOÁT UTBMTBG
3.1. Đối tượng tầm soát
- Nhóm nguy cơ cao: các trường hợp nhiễm HBV mạn và HCV mạn chưa điều trị, đang điều trị và đã ngưng điều trị bằng thuốc kháng virus, và các trường hợp xơ gan không liên quan đến nhiễm virus viêm gan.
- Nhóm nguy cơ rất cao: các trường hợp xơ gan có liên quan đến viêm gan do virus (HBV, HCV).
3.2. Phương tiện và tần suất tầm soát
- Tầm soát bằng siêu âm bụng và xét nghiệm phối hợp các chỉ dấu sinh học AFP, AFP-L3, PIVKA II.
- Tầm soát mỗi 6 tháng đối với nhóm nguy cơ cao và mỗi 3 tháng đối với nhóm nguy cơ rất cao. Nếu phát hiện có tổn thương nghi ngờ UTBMTBG và/hoặc giá trị các chỉ dấu sinh học tăng thì nên chụp CT scan bụng có cản quang hoặc MRI bụng có tương phản từ.
4. CHẨN ĐOÁN UTBMTBG
4.1. Khám lâm sàng và các xét nghiệm cận lâm sàng cần làm
- Cần tìm hiểu các yếu tố nguy cơ của bệnh nhân:
+ Bệnh nhân đã từng bị nhiễm hay đã hoặc đang điều trị nhiễm HBV và/hoặc HCV.
+ Gia đình bệnh nhân (cha mẹ, vợ chồng, anh chị em ruột) có người đã từng bị nhiễm hay đã hoặc đang điều trị nhiễm HBV và/hoặc HCV, hoặc đã được chẩn đoán bị UTBMTBG.
+ Đã từng được truyền máu hay từng sử dụng kim tiêm chung với người khác.
+ Tình trạng sử dụng thức uống có cồn (số lượng, tần suất, thời gian, ...).
+ Đã từng tiếp xúc với các loại độc tố hay hóa chất (loại, thời gian tiếp xúc.).
+ Lý do đến khám bệnh (đau bụng, vàng da, bụng to, . hay chỉ là kiểm tra sức khỏe).
+ Các bệnh lý khác đi kèm (nếu có).
- Khám lâm sàng:
+ Phần lớn các trường hợp UTBMTBG chỉ có đau bụng mơ hồ hoặc được phát hiện tình cờ.
+ Đánh giá toàn trạng, dấu hiệu sinh tồn, tình trạng vàng da niêm mạc.
+ Khám tổng thể, khám bụng, chú ý có sờ thấy gan to hay không.
- Các xét nghiệm cận lâm sàng cần làm:
+ Công thức máu, chức năng đông máu toàn bộ, đường huyết.
+ Chức năng gan thận: ALT, AST, Bilirubin, Albumin, Ure, Creatinin máu.
+ Các xét nghiệm miễn dịch về virus viêm gan B, C: HBsAg, AntiHCV
+ Chỉ dấu sinh học của UTBMTBG: AFP, AFP-L3, PIVKA II (DCP).
+ Các chỉ dấu ung thư khác (nếu cần): CEA, CA 19.9, PSA, CA 12.5, .
+ X quang phổi thẳng.
+ Siêu âm Doppler mạch máu gan.
+ CT scan bụng có cản quang (và MRI bụng có tương phản từ nếu cần).
4.2. Hình ảnh học
4.2.1. Siêu âm
a. Siêu âm 2D và siêu âm Doppler mạch máu gan
Siêu âm 2D và siêu âm Doppler thuận tiện và có chi phí thấp nên là các phương tiện đầu tiên được áp dụng để tầm soát và theo dõi điều trị UTBMTBG, nhưng không dùng để chẩn đoán UTBMTBG. Siêu âm đánh giá hình dạng, vị trí, số lượng, kích thước khối u gan, tình trạng bệnh lý gan nền, tình trạng dịch ổ bụng và các tổn thương đi kèm trong ổ bụng. Siêu âm Doppler mạch máu gan cho phép đánh giá tình trạng cấp máu của khối u, tình trạng khối u xâm lấn và di căn vào các mạch máu lân cận, đặc biệt là tĩnh mạch cửa và tĩnh mạch chủ dưới.
Hệ thống Dữ liệu và Báo cáo hình ảnh Gan (The Liver Imaging Reporting And Data System - LI-RADS) khuyến cáo sử dụng siêu âm không tiêm chất tương phản để tầm soát và theo dõi UTBMTBG ở các bệnh nhân xơ gan và yếu tố nguy cơ cao khác.
b. Siêu âm có chất tương phản (contrast-enhanced ultrasound - CEUS)
Những thay đổi chính trong quá trình sinh UTBMTBG bao gồm sự hình thành mạch, thay đổi tế bào gan, giảm số lượng và chức năng của tế bào Kupffer, trong đó sự thay đổi huyết động của các nốt, bao gồm tăng lưu lượng động mạch và giảm lưu lượng tĩnh mạch cửa, là thay đổi quan trọng nhất để chẩn đoán UTBMTBG. Mật độ tế bào Kupffer giảm cùng với sự giảm biệt hóa của nốt xơ gan. Các vi bóng khí trong CEUS được thực bào bởi các tế bào Kupffer, nên hình ảnh tế bào Kupffer có thể quan sát được, các khối u ác tính có thể được phân biệt với vùng gan quanh u do chúng chứa ít hoặc không chứa tế bào Kupffer.
Hình ảnh điển hình của UTBMTBG trên CEUS là ngấm thuốc mạnh thì động mạch (arterial phase hyperenhancement - APHE) và thải thuốc nhẹ sau 60 giây. CEUS có độ nhạy cao để phát hiện tình trạng giảm quang thì động mạch và thể hiện tốt hơn dấu hiệu “thải thuốc” nhanh (diễn ra sớm, tại thời điểm 55-60 giây) đối với bệnh ác tính không phải UTBMTBG và “thải thuốc” rất muộn (sau 60 giây) đối với UTBMTBG. CEUS không có bức xạ ion hóa và các chất tương phản của CEUS không gây độc cho thận.
CEUS có phân độ theo LI-RADS (Phụ lục 1) được Hiệp hội Nghiên cứu Bệnh gan châu Á Thái Bình Dương (APASL) và Hội Ung thư Nội khoa châu Âu (ESMO) khuyến cáo dùng trong chẩn đoán UTBMTBG nhưng chưa được đồng thuận đưa vào các hướng dẫn chẩn đoán UTBMTBG khác trên thế giới do khó phân biệt được ung thư đường mật trong gan với UTBMTBG trong một số trường hợp. Bên cạnh đó, vẫn phải chỉ định CT và/hoặc MRI động để xác định giai đoạn bệnh trước khi điều trị.
4.2.2. Chụp cắt lớp vi tính (CT) và cộng huởng từ (MRI)
Hình ảnh học đóng vai trò quan trọng trong chẩn đoán và trong việc đưa ra quyết định điều trị UTBMTBG nhờ vào việc mô tả đầy đủ hình thái gan và nêu lên được động học tưới máu gan. Tổn thương UTBMTBG có sự thay đổi điển hình là tăng nguồn cấp máu từ động mạch và giảm nguồn cấp máu từ tĩnh mạch cửa.
Để chẩn đoán UTBMTBG, cần có CT đa dãy đầu dò chụp đủ 4 thì và/hoặc MRI động có thì động mạch trễ, thì tĩnh mạch cửa và thì muộn (khoảng 3-5 phút sau khi tiêm chất tương phản từ). CT động và MRI động cho phép đánh giá mức độ phân bố mạch máu tại khối u, với hình ảnh điển hình của UTBMTBG là ngấm thuốc mạnh ở thì động mạch và thải thuốc ở thì tĩnh mạch cửa và/hoặc ở thì muộn.
MRI có thể phát hiện những khối u có kích thước nhỏ, nhất là các khối u < 2cm, dựa vào sự khảo sát trên nhiều chuỗi xung, đặc biệt là MRI động và chuỗi xung khuếch tán rất nhạy trong chẩn đoán. MRI cho phép chẩn đoán phân biệt rất tốt giữa UTBMTBG với các tổn thương khu trú khác trong gan nhu u máu, u tuyến (adenoma), tăng sinh dạng nốt khu trú (focal nodular hyperplasia-FNH), di căn gan hoặc nốt tân tạo trong xơ gan. Trong hầu hết các nghiên cứu về giá trị trong chẩn đoán UTBMTBG, MRI đều có độ nhạy cao hơn CT với độ chuyên biệt từ 85% đến 100%, đặc biệt đối với các tổn thương nhỏ. Các nghiên cứu gần đây khuyến cáo chụp MRI với chất tương phản từ gan-mật gadoxetate disodium (Gd-EOB-DTPA- gadolinium ethoxybenzyl diethylenetriamine pentaacetic acid) có độ nhạy cao hơn CT động và MRI sử dụng các chất tương phản từ khác.
Hình ảnh điển hình của UTBMTBG trên CT/MRI là giảm đậm độ ở thì chưa tiêm thuốc, ngấm thuốc mạnh ở thì động mạch (arterial phase hyperenhancement - APHE) và thải thuốc (wash-out) ở thì tĩnh mạch cửa hay thì muộn.
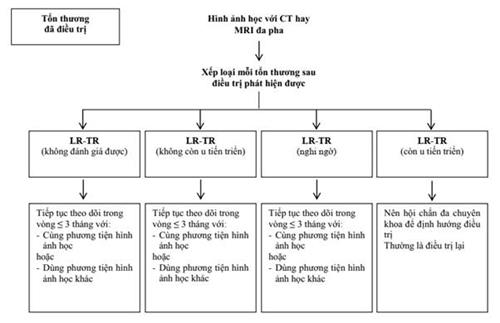
Ngoài giá trị chẩn đoán, CT/MRI còn được sử dụng để theo dõi và đánh giá sau điều trị UTBMTBG. Có thể sử dụng phân độ theo LI-RADS (Phụ lục 2 và 3) để hướng dẫn chẩn đoán và đánh giá kết quả điều trị.
Các tổn thương nghi ngờ là UTBMTBG nếu có ngấm lipiodol tại tổn thương sau khi làm Nút mạch hóa chất (TACE) thì được chẩn đoán là UTBMTBG.
4.2.3. PET và PET/CT
Chỉ có khoảng 40% các trường hợp UTBMTBG có hấp thu Fluorodeoxyglucose F- 18 (18F) khi chụp PET và PET/CT, và hầu hết các trường hợp UTBMTBG biệt hóa cao đều cho kết quả âm tính khi chụp PET và PET/CT. Tuy nhiên, PET và PET/CT rất có giá trị để phát hiện các tổn thương di căn ngoài gan của UTBMTBG, nhất là trong các trường hợp không thấy tổn thương UTBMTBG mới hay tiến triển tại gan sau khi điều trị. Ngoài ra có thể chụp PET/CT với 11C-Choline để phát hiện tổn thương tại gan, ngoài gan tốt hơn 18F.
4.2.4. Các xét nghiệm khác
- Xạ hình xương bằng máy SPECT, SPECT/CT với 99mTc-MDP để đánh giá tổn thương di căn xương, chẩn đoán giai đoạn bệnh trước điều trị, theo dõi đáp ứng điều trị, đánh giá tái phát và di căn.
- Xạ hình thận chức năng bằng máy SPECT, SPECT/CT với 99mTc-DTPA để đánh giá chức năng thận trước điều trị và sau điều trị.
- Xạ hình - SPECT gan với 99mTc-Sulfure Colloid: hình ảnh khối choán chỗ trong gan, áp dụng trong một số trường hợp.
- Xạ hình gan mật trong một số trường hợp
4.3. Chỉ dấu sinh học
4.3.1. Alpha-fetoprotein (AFP)
Vai trò của AFP trong chẩn đoán UTBMTBG chưa rõ ràng. AFP có thể tăng trong các trường hợp viêm gan hoạt động và xơ gan, và có thể giảm đi khi điều trị các tình trạng viêm gan bằng các thuốc điều trị HBV và HCV. Ngưỡng giá trị bình thường của AFP thường là 20 ng/ml, ngưỡng giá trị chẩn đoán của AFP là 400 ng/ml. AFP có thể được sử dụng phối hợp với siêu âm để tầm soát UTBMTBG trên các đối tượng nguy cơ.
4.3.2. Lens culinaris agglutinin-reactive fraction of AFP (AFP-L3)
AFP-L3 có thể được dùng để phân biệt sự gia tăng AFP trong các trường hợp UTBMTBG với các trường hợp u lành tính ở gan. Ngưỡng giá trị bình thường của AFP-L3 là 5%.
4.3.3. Prothrombin induced by vitamin K absence-II (PIVKA II) hay còn gọi là Des-gamma-carboxyprothrombin (DCP)
PIVKA II là một prothombin bất thường, tăng trong huyết thanh của các trường hợp UTBMTBG. Ngưỡng giá trị bình thường của PIVKA II là 40 mAU/ml.
4.3.4. Một số chỉ dấu sinh học khác trong huyết thanh
Các chỉ dấu sinh học khác như Glypican-3 (GPC3), Golgi protein 73 (GP73), Osteopontin, circulating cell free DNA, và các microRNA chưa có vai trò rõ ràng về chuyên môn lẫn hiệu quả về kinh tế.
4.3.5. Kết hợp các chỉ dấu sinh học trong huyết thanh
Sự kết hợp các chỉ dấu sinh học AFP, AFP-L3 và PIVKA II trong huyết thanh có thể cải thiện độ nhạy trong tầm soát và chẩn đoán UTBMTBG mà không làm giảm đi độ chuyên biệt, do đó nên sử dụng việc kết hợp này trong thực tế lâm sàng.
4.4. Sinh thiết gan
Trong những trường hợp tổn thương ở gan không đáp ứng được các tiêu chuẩn chẩn đoán dưới đây thì sinh thiết gan cho phép xác định chẩn đoán UTBMTBG và phân biệt với các tổn thương ác tính nguyên phát khác tại gan như ung thư đường mật, ung thư gan-mật kết hợp, cũng như các tổn thương ác tính thứ phát tại gan các u thần kinh nội tiết và các tổn thương di căn tại gan. Các nguy cơ như chảy máu hay gieo rắc tế bào ung thư đều có tỉ lệ rất thấp, có thể xử trí được và không ảnh hưởng đến quyết định làm sinh thiết gan khi cần thiết.
Kết quả sinh thiết gan cần được đối chiếu với các dữ liệu về hình ảnh học và chỉ dấu sinh học để quyết định nên sinh thiết lại hay nên theo dõi tiếp. Nếu quyết định theo dõi tiếp thì nên đánh giá lại tổn thương bằng hình ảnh học và chỉ dấu sinh học sau 02 tháng.
4.5. Chẩn đoán xác định UTBMTBG
Khi tổn thương ở gan có một trong ba tiêu chuẩn sau:
- Hình ảnh điển hình* của UTBMTBG trên CT scan bụng có cản quang hoặc MRI bụng có tương phản từ + AFP ≥ 400 ng/ml.
- Hình ảnh điển hình* của UTBMTBG trên CT scan bụng có cản quang hoặc MRI bụng có tương phản từ + AFP tăng cao hơn bình thường (nhưng chưa đến 400 ng/ml) + có nhiễm HBV và/hoặc HCV. Có thể làm sinh thiết gan để chẩn đoán xác định nếu bác sĩ lâm sàng thấy cần thiết.
Các trường hợp không đủ các tiêu chuẩn nói trên đều phải làm sinh thiết khối u gan (có thể phải làm nhiều lần) để chẩn đoán xác định. Nếu sinh thiết lại vẫn âm tính thì có thể theo dõi và làm lại các xét nghiệm hình ảnh học và chỉ dấu sinh học mỗi 2 tháng.
- Có bằng chứng giải phẫu bệnh lý là UTBMTBG.
* Hình ảnh điển hình trên CT scan bụng có cản quang hoặc MRI bụng có tương phản từ: (các) khối u bắt thuốc trên thì động mạch gan và thải thuốc (wash-out) trên thì tĩnh mạch cửa hay thì chậm. Nên chụp MRI với chất tương phản từ gan - mật gadoxetate disodium (Gd-EOB-DTPA - gadolinium ethoxybenzyl diethylenetriamine pentaacetic acid) để tăng khả năng chẩn đoán ung thư biểu mô tế bào gan.
Sơ đồ chẩn đoán UTBMTBG
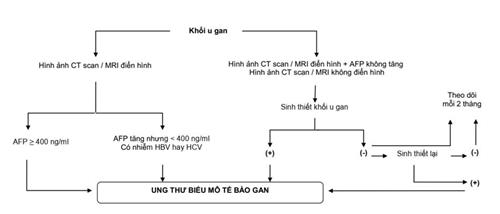
4.6. Chẩn đoán phân biệt
- U máu ở gan (hemangioma): khối u bắt thuốc tăng dần từ thì động mạch gan đến thì chậm trên CT scan hoặc MRI, chỉ dấu sinh học của UTBMTBG bình thường, có thể có hoặc không nhiễm HBV và/hoặc HCV.
- Các u lành ở gan nhu u tuyến (adenoma), tăng sinh dạng nốt (focal nodular hyperplasia - FNH), áp xe gan, nốt vôi hóa ở gan, ...: hình ảnh không điển hình trên CT scan hoặc MRI, chỉ dấu sinh học của UTBMTBG bình thường, có thể có hoặc không nhiễm HBV và/hoặc HCV, có thể xác định nhờ MRI bụng có tương phản từ đặc hiệu hoặc sinh thiết gan.
- Ung thư đường mật trong gan: khối u bắt thuốc không đồng đều, không có hiện tượng thải thuốc, chỉ dấu ung thư CEA, CA 19.9 có thể tăng cao. Chẩn đoán xác định nhờ sinh thiết gan.
- Di căn gan của các ung thư khác (ung thư dạ dày, ung thư đại trực tràng, ung thư phổi, ung thư vú, .): hình ảnh bắt thuốc dạng viền trên CT scan hoặc MRI, các chỉ dấu ung thư tương ứng tăng cao, có tổn thương nguyên phát, ...
4.7. Phân chia giai đoạn bệnh
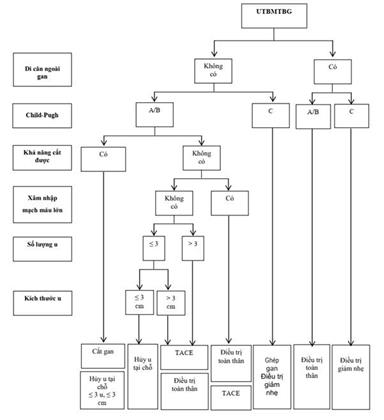
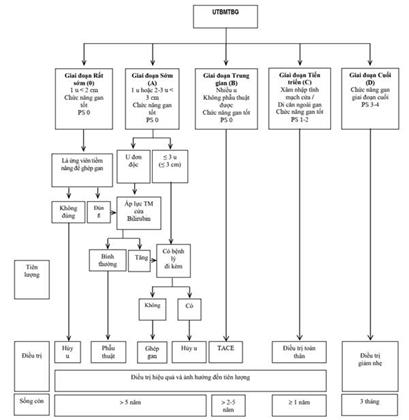
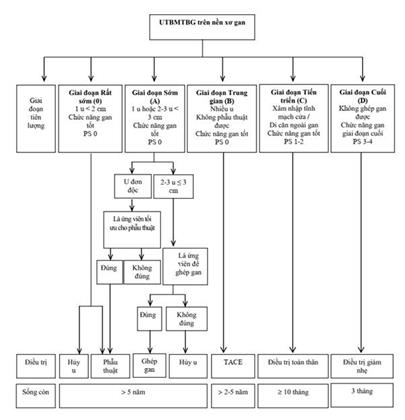
Các Hướng dẫn điều trị của Nhóm Ung thư gan Barcelona (BCLC), Hội Nghiên cứu bệnh gan châu Âu (EASL), Hội Ung thư Nội khoa châu Âu (ESMO) và Hội Nghiên cứu bệnh gan Hoa Kỳ (AASLD) phân chia UTBMTBG thành 5 giai đoạn bệnh: 0 (rất sớm), A (sớm), B (trung gian), C (tiến triển), D (cuối), để đề ra cách điều trị phù hợp. Trong khi đó, Hiệp hội nghiên cứu bệnh gan châu Á Thái Bình Dương (APASL) không phân chia giai đoạn bệnh, mà dựa trên 6 yếu tố: di căn ngoài gan, chức năng gan (đánh giá bằng hệ thống Child-Pugh), khả năng cắt gan được, xâm nhập mạch máu lớn, số lượng u, kích thước u, để chọn lựa các điều trị phù hợp.
Tại Việt Nam, trên thực tế lâm sàng, thường chỉ xác định tình trạng bệnh còn khả năng điều trị hay không, do đó có thể dựa trên các yếu tố nhu của APASL để chọn lựa cách điều trị phù hợp.
Các nghiên cứu khoa học thì có thể dựa trên phân chia giai đoạn bệnh của BCLC, EASL, ESMO hay AASLD (Phụ lục 5) để chọn ra nhóm bệnh nhân phù hợp cho nghiên cứu.
5. ĐIỀU TRỊ UTBMTBG
5.1. Nguyên tắc điều trị UTBMTBG
- Điều trị (các) khối UTBMTBG ở giai đoạn còn khả năng điều trị.
- Điều trị bệnh lý nền tảng hay yếu tố nguy cơ (viêm gan siêu vi B hoặc C, xơ gan...).
- Điều trị nội khoa kết hợp chăm sóc giảm nhẹ ở giai đoạn muộn.
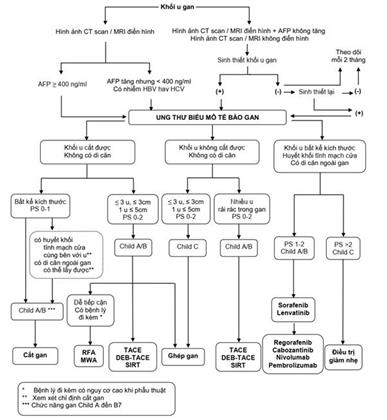
5.2. Các phương pháp điều trị đối với tổn thương UTBMTBG
5.2.1. Phẫu thuật cắt bỏ phần gan có mang khối u (phẫu thuật cắt gan)
Phẫu thuật cắt gan được coi là điều trị triệt để đối với UTBMTBG và an toàn ngay cả đối với các bệnh nhân có xơ gan. Tuy nhiên, chưa có đồng thuận trên thế giới về tình trạng u và mức độ bảo tồn chức năng gan để đạt được hiệu quả sống còn phù hợp khi chỉ định cắt gan. EASL, ESMO và AASLD chỉ đề xuất phẫu thuật cắt gan cho các trường hợp chỉ có một khối u đơn độc, chức năng gan là Child-Pugh A và không có tăng áp lực tĩnh mạch cửa. Trong khi đó, APASL lại đề xuất phẫu thuật cắt gan cho các trường hợp có thể có nhiều u, chức năng gan Child-Pugh A và B, và có thể cả khi có xâm nhập mạch máu đại thể (nhu có huyết khối tĩnh mạch cửa) hay di căn ngoài gan mà có thể lấy bỏ được khi phẫu thuật cắt gan.
Tại Việt Nam, phẫu thuật cắt gan nên được thực hiện đối với các trường hợp:
- Phần gan có khối u dự kiến cắt bỏ được (theo giải phẫu hay không theo giải phẫu).
- Thể tích gan dự kiến còn lại phù hợp với bệnh nhân. Nên đo thể tích gan để góp phần ra chỉ định cắt gan đối với các trường hợp dự kiến cắt ≥ 50% thể tích gan.
- Chức năng gan là Child-Pugh A đến B7 (Phụ lục 4). Có thể đánh giá chức năng gan dựa trên xét nghiệm thanh lọc Indocyanin green (ICG test) để quyết định mức độ cắt gan.
- Điểm hoạt động cơ thể (Performance Status - PS) 0-2, không có di căn xa.
Nên xem xét phẫu thuật cắt gan cho các trường hợp có huyết khối tĩnh mạch cửa cùng bên với phần gan định cắt, cũng nhu các trường hợp có tổn thương di căn ngoài gan (hạch cuống gan, tuyến thượng thận, di căn tại mạc nối lớn, ...) có thể lấy bỏ được khi phẫu thuật cắt gan.
5.2.2. Phẫu thuật ghép gan
Phẫu thuật ghép gan là biện pháp duy nhất có thể giúp bệnh nhân điều trị cả UTBMTBG lẫn bệnh gan nền. Chỉ định ghép gan cho bệnh nhân UTBMTBG tùy thuộc vào nhiều yếu tố, trong đó có cân nhắc tới hiệu quả của phẫu thuật cắt gan và các phương pháp điều trị tại chỗ - tại vùng, cũng nhu mức độ ưu tiên so với nhu cầu ghép gan của các bệnh nhân không phải là UTBMTBG.
Các hướng dẫn điều trị trên thế giới đều khuyến cáo xem Tiêu chuẩn Milan (chỉ có 01 u với kích thước khối u không quá 5cm, hay không quá 03 u với kích thước mỗi u không quá 3cm) là tiêu chuẩn vàng để ghép gan cho UTBMTBG, và ghép gan là lựa chọn hàng đầu cho các trường hợp UTBMTBG nằm trong Tiêu chuẩn Milan nhưng không phù hợp để phẫu thuật cắt gan, đặc biệt là khi có xơ gan mất bù. Các cơ sở y tế có thể cân nhắc vận dụng các tiêu chuẩn mở rộng hơn khi chỉ định ghép gan nhưng cần có hội chẩn cụ thể.
Có thể cân nhắc các biện pháp điều trị bắc cầu để làm giảm giai đoạn UTBMTBG trước khi xem xét ghép gan.
5.2.3. Phá hủy khối u tại chỗ (đốt u)
Phá hủy khối u tại chỗ (đốt u) có thể thực hiện bằng sóng cao tần (Radiofrequency Ablation-RFA), bằng vi sóng (Microwave Ablation-MWA), bằng cách tiêm cồn vào khối u (Percutaneous Ethanol Injection-PEI) hay bằng đốt lạnh (cryoablation) trên bệnh nhân có PS 0-2, chức năng gan là Child Pugh A,B, không có di căn xa.
Phá hủy khối u tại chỗ (đốt u) nên thực hiện cho các trường hợp UTBMTBG có số lượng u ≤ 3 với kích thước u ≤ 3cm, hoặc có 1 u với kích thước u ≤ 5cm, nhất là khi các trường hợp này không phù hợp để phẫu thuật cắt gan (do vị trí u, do tình trạng bệnh nhân). Phá hủy khối u tại chỗ (đốt u) cũng được coi là biện pháp thay thế cho phẫu thuật cắt gan trong trường hợp u có kích thước nhỏ ≤ 3cm.
Phá hủy khối u tại chỗ (đốt u) nên thực hiện cho các khối u dễ tiếp cận dưới hướng dẫn của hình ảnh học (siêu âm, CT scan, MRI). Những trường hợp chỉ định phá hủy khối u kích thước > 5cm cần được hội chẩn.
Tiêm cồn vào khối u chỉ nên thực hiện khi các biện pháp phá hủy khối u (đốt u) khác không thực hiện được vì lý do kỹ thuật, và nếu sử dụng thì chủ yếu là cho u ≤ 2cm.
Đối với (các) khối u chưa loại trừ được là UTBMTBG, có thể phối hợp sinh thiết và phá hủy u tại chỗ trong cùng một lần nằm viện.
5.2.4. Cắt nguồn máu nuôi khối u phối hợp với diệt tế bào ung thư bằng hóa chất
Có các hình thức như:
- Nút mạch hóa chất thường quy (conventional TransArterial Chemo-Embolization - cTACE)
- Nút mạch sử dụng hạt nhúng hóa chất (Drug-eluting bead TACE - DEB-TACE)
TACE được chỉ định cho các trường hợp UTBMTBG mà khối u không cắt được, hoặc có nhiều u ở cả hai thùy, chưa có xâm nhập mạch máu và chưa có di căn ngoài gan, trên bệnh nhân có PS 0-2, chức năng gan là Child Pugh A,B. TACE nên được thực hiện chọn lọc hay siêu chọn lọc để tăng hiệu quả, giảm biến chứng và giảm ảnh huởng đến phần gan lành quanh u.
TACE chọn lọc cũng được chỉ định cho các trường hợp u nhỏ nhưng không thể thực hiện đốt u được do vị trí khó hay do có các bệnh lý đi kèm làm tăng nguy cơ biến chứng.
Trong một số trường hợp có u đã vỡ hoặc có nguy cơ vỡ mà tình trạng chức năng gan hoặc tình trạng cơ thể không cho phép làm TACE thì có thể làm nút mạch đơn thuần (TransArterial Embolization - TAE) để điều trị tạm thời.
Đánh giá hiệu quả của TACE cần dựa vào hình ảnh học và sự thay đổi của các chỉ dấu sinh học cũng nhu của chức năng gan sau TACE. Tại Việt Nam, có thể thực hiện TACE nhiều lần nếu (các) khối u còn tiến triển hoặc xuất hiện u mới và tình trạng chức năng gan và tình trạng cơ thể cho phép. Cần hội chẩn để đánh giá TACE thất bại hay không trước khi quyết định ngung làm TACE tiếp tục để chuyển sang hóa trị toàn thân.
5.2.5. Xạ trị trong chọn lọc (Selective Internal Radiation Therapy - SIRT)
Sử dụng hạt vi cầu phóng xạ Ytrium-90 (90Y) bơm vào động mạch nuôi khối u gan. Các hạt vi cầu này sẽ đi vào các nhánh động mạch nhỏ khắp trong khối u gây tắc mạch. Khối u sẽ bị tiêu diệt theo hai cơ chế: giảm nuôi duỡng u và bức xạ bêta năng lượng 0,93MeV được phát ra từ đồng vị phóng xạ 90Y gắn trên các hạt vi cầu sẽ tiêu diệt các tế bào ung thư và làm giảm thể tích hoặc tiêu hoàn toàn khối u gan mà rất ít ảnh huởng đến tổ chức lành xung quanh.
- Chỉ định:
+ UTBMTBG không còn khả năng phẫu thuật, hoặc có chống chỉ định phẫu thuật hay bệnh nhân từ chối phẫu thuật.
+ Tổng trạng còn tốt ECOG ≤ 1, chức năng gan còn bù (Child-Pugh A, B)
+ Shunt lưu thông hoạt tính phóng xạ lên phổi < 20% trên xạ hình Tc-99m MAA
+ Chưa từng xạ trị trước đó vào gan
- Chống chỉ định:
+ Có luồng thông động mạch gan-phổi (shunt gan-phổi) lớn (> 20%)
+ Xơ gan mất bù, bệnh não gan
+ Thể trạng quá yếu, dự kiến thời gian sống thêm dưới 3 tháng.
5.2.6. Truyền hoá chất qua động mạch gan (Hepatic Arterial Infusion Chemotherapy - HAIC)
Phương pháp sử dụng buồng truyền và dây dẫn đặt chọn lọc vào động mạch gan sau khi đã nút tắc các nhánh mạch của động mạch gan cấp máu cho các tạng khác. Phương pháp này giúp đưa hóa chất khu trú tại gan nên giảm các tác dụng phụ hơn so với hóa trị toàn thân. Hóa chất thường dùng là tổ hợp liều thấp của Cisplatin với 5-Fluorouracil (phác đồ FP liều thấp). Chỉ định chủ yếu cho các trường hợp UTBMTBG giai đoạn tiến xa có xâm lấn tĩnh mạch cửa. Các biến chứng của phương pháp này bao gồm: viêm tắc mạch, loét dạ dày ruột do rò thuốc và nhiễm khuẩn hoặc tắc dây truyền.
5.2.7. Xạ trị
- Xạ trị chiếu ngoài
+ Chỉ định: xạ trị chiếu ngoài bằng máy gia tốc có thể dùng đối với những trường hợp không phẫu thuật được. Lựa chọn trường chiếu xạ phụ thuộc vào vị trí, kích thước khối u. Liều xạ trị tùy thuộc vào thể tích trường chiếu, dao động từ 5070Gy, phân liều 2Gy/ngày.
+ Chỉ định xạ trị toàn gan trong những trường hợp điều trị giảm nhẹ triệu chứng, liều xạ 21Gy, phân liều 3Gy/ngày.
+ Ngoài ra, có thể chỉ định xạ trị cho những trường hợp UTBMTBG di căn xương, di căn não, di căn phổi, di căn hạch. Thể tích và liều xạ phụ thuộc vào vị trí và kích thước tổn thương.
+ Mô phỏng bằng CT, MRI hoặc PET/CT, PET/MRI.
+ Kỹ thuật: có thể dùng các kỹ thuật thường quy 3D, hoặc các kỹ thuật xạ trị tiên tiến giúp tăng hiệu quả, độ chính xác và giảm thiểu tác dụng phụ nhu xạ trị điều biến liều (Intensity Modulated Radiation Therapy - IMRT), xạ trị điều biến thể tích (Volumetric Modulated Arc Therapy - VMAT).
- Xạ phẫu
+ Xạ phẫu có thể bằng dao gamma cổ điển, dao gamma quay (Rotating Gamma Knife), CyberKnife, ...
+ Nguyên lý: bức xạ hội tụ với liều rất cao tại tiêu điểm khối u gây hoại tử hoặc bất hoạt tế bào u, đồng thời liều xạ tại các mô lành ở mức tối thiểu, rất ít gây tác dụng phụ cho cơ quan lành xung quanh.
+ Chỉ định cho các trường hợp di căn một vài ổ tại não.
- Xạ phẫu định vị thân (Stereotatic Body Radiation Therapy - SBRT)
+ Xạ phẫu định vị thân là phương pháp đang có nhiều bằng chứng đánh giá tác dụng tích cực, có thể dùng cho các khối u nguyên phát tại gan, không còn khả năng cắt bỏ hay các phương pháp phá huỷ u tại chỗ, và các khối u di căn ở gan.
- Cấy hạt phóng xạ
+ Cấy hạt phóng xạ vào khối u hoặc diện u trong các trường hợp không phẫu thuật triệt căn hoặc không thể phẫu thuật do có bệnh lý kèm theo hay bệnh nhân từ chối phẫu thuật.
+ Các biện pháp xạ trị khác bằng tia hạt (Particle Beam Radiation Therapy) nhu tia proton hay ion carbon cho các kết quả bước đầu khá khích lệ nhưng vẫn còn cần các nghiên cứu tiếp theo để xác định hiệu quả đối với UTBMTBG.
5.2.8. Điều trị toàn thân
Các trường hợp UTBMTBG tiến triển, không còn chỉ định phẫu thuật, nút mạch, đốt u thì có thể xem xét dùng điều trị toàn thân.
a. Điều trị đích và điều trị miễn dịch
- Sorafenib là thuốc ức chế đa kinase đường uống, ức chế khoảng 40 kinase, bao gồm cả VEGFR-2 (vascular endothelial growth factor receptor 2) và BRAF (B-Raf proto-oncogene, serine/threonine kinase). Sorafenib được coi là điều trị bước một chuẩn cho các trường hợp UTBMTBG không còn đáp ứng hoặc không phù hợp với các biện pháp điều trị can thiệp tại chỗ tại vùng nhu nút mạch hóa chất, hoặc đã có xâm nhập mạch máu đại thể hay di căn ngoài gan, với điều kiện chức năng gan còn tốt (Child-Pugh A hay B7). Các tác dụng của sorafenib có thể gặp nhu: phản ứng da bàn tay-bàn chân, tiêu chảy, tăng huyết áp,. .Các tác dụng phụ này thường xảy ra sớm và có thể dự phòng và kiểm soát được với các biện pháp dùng thuốc và không dùng thuốc. Liều dùng sorafenib là 400mg, uống 2 lần/ngày cho tới khi bệnh tiến triển. Có thể điều chỉnh liều sorafenib cho phù hợp theo mức độ của độc tính. Nên duy trì việc sử dụng sorafenib cho bệnh nhân ít nhất cho tới khi bệnh tiến triển trên hình ảnh học, hoặc trên lâm sàng, khi đó nên hội chẩn để xem xét chuyển sang điều trị bước hai.
- Lenvatinib là thuốc ức chế đa kinase đường uống, ức chế VEGFR 1-3, FGFR 1-4 (fibroblast growth factor receptor 1-4) và một số kinase khác. Lenvatinib cho kết quả về thời gian sống còn không kém hơn sorafenib và có thời gian sống không bệnh tiến triển, thời gian cho đến khi bệnh tiến triển và tỷ lệ đáp ứng chung ưu thế hơn sorafenib trong các nghiên cứu trên các bệnh nhân UTBMTBG tiến triển, không còn đáp ứng đối với các biện pháp điều trị tại chỗ, tại vùng hoặc đã có di căn ngoài gan, nhưng chưa có huyết khối nhánh chính tĩnh mạch cửa. Lenvatinib được sử dụng điều trị bước một cho các bệnh nhân thuộc nhóm trên. Liều dùng lenvatinib là 12mg/ngày ở bệnh nhân trên 60kg hoặc 8mg/ngày ở bệnh nhân dưới 60kg, uống hàng ngày. Các tác dụng phụ của lenvatinib cũng tương tự sorafenib.
- Regorafenib, một thuốc ức chế đa kinase đường uống, tác động vào các quá trình sinh mạch máu, tăng sinh tế bào u và vi môi trường u với các đích ức chế nhu VEGFR 1-3, KIT, RET, RAF-1, BRAF, PDGFR, FGFR, CSF1R giúp cải thiện tỉ lệ sống còn ở các bệnh nhân UTBMTBG đã điều trị bằng sorafenib, dung nạp được sorafenib, nhưng bệnh vẫn tiến triển. Các tác dụng phụ của regorafenib cũng tương tự sorafenib. Do đó, regorafenib được chấp thuận nhu là điều trị bước hai cho UTBMTBG khi đã thất bại với sorafenib. Regorafenib là thuốc có nghiên cứu đánh giá hiệu quả của chuỗi phối hợp sau tiến triển với sorafenib, cho thấy thời gian sống còn là 26 tháng tính từ thời điểm bắt đầu bước 1. Liều dùng regorafenib: 160mg/ngày, uống ngày 1-21, chu kỳ 28 ngày.
- Pembrolizumab là các thuốc ức chế chốt kiểm soát miễn dịch (immune checkpoints inhibitors) cho thấy có thể cải thiện tỉ lệ sống còn ở các bệnh nhân UTBMTBG đã điều trị bằng sorafenib hoặc lenvatinib, và đã được chấp thuận điều trị bước hai cho UTBMTBG khi đã thất bại với sorafenib hoặc lenvatinib. Các tác dụng phụ chủ yếu là mệt mỏi, ngứa và phát ban. Liều dung pembrolizumab: 200mg, truyền tĩnh mạch chu kỳ 3 tuần
- Một số nghiên cứu cho thấy việc kết hợp bevacizumab với atezolizumab cho hiệu quả trong việc cải thiện thời gian sống thêm không bệnh ở các bệnh nhân UTBMTBG giai đoạn muộn hoặc tái phát. Liều dùng:
Atezolizumab : 1200mg truyền tĩnh mạch ngày 1
Bevacizumab : 15mg/kg truyền tĩnh mạch ngày 1, chu kỳ 21 ngày
- Ramucirumab là kháng thể kháng VEGFR có hiệu quả điều trị ung thư gan có AFP ≥ 400 ng/ml.
- Cabozantinib là một thuốc ức chế MET, VEGFR2, AXL và RET, cũng giúp cải thiện tỉ lệ sống còn ở các bệnh nhân UTBMTBG đã điều trị bằng sorafenib.
b. Hóa trị toàn thân: một số phác đồ hóa chất có thể áp dụng trong UTBMTBG nhưng hiệu quả rất hạn chế.
- Phác đồ PIAF : chu kỳ 3 tuần
| Doxorubicin Cisplatin 5-FU Interferon α-2a - Phác đồ GEMOX Gemcitabine Oxaliplatin - Phác đồ FOLFOX 4 Folinic acid Oxaliplatin 5-FU 5-FU | : 40mg/m2, truyền tĩnh mạch ngày 1 : 20mg/m2, truyền tĩnh mạch ngày 1, 2, 3, 4 : 400mg/m2, truyền tĩnh mạch ngày 1, 2, 3, 4 : tiêm dưới da 5 MIU/m2, ngày 1, 2, 3, 4 : chu kỳ 2 tuần : 1.000mg/m2, truyền tĩnh mạch ngày 1 : 100mg/m2, truyền tĩnh mạch ngày 2 : chu kỳ 2 tuần : 200mg/m2, truyền tĩnh mạch ngày 1 : 85mg/m2, truyền tĩnh mạch ngày 1 : 400mg/m2, tiêm/truyền tĩnh mạch bolus ngày 1 : 1.200mg/m2, truyền tĩnh mạch ngày 1, 2 |
5.3. Phối hợp các phương pháp điều trị
Có thể phối hợp các phương pháp nói trên cho từng trường hợp cụ thể.
5.4. Điều trị giảm nhẹ
Được thực hiện khi
- Tổng thể tích các khối u vượt quá 50% thể tích gan.
- Đã có huyết khối tĩnh mạch cửa, tĩnh mạch gan, tĩnh mạch chủ dưới, ...
- Đã có di căn ngoài gan.
- PS > 2, Child Pugh C.
Ở các bệnh nhân có xơ gan, có thể dùng Acetaminophen (Paracetamol) để giảm đau nếu đau nhẹ, và dùng các thuốc giảm đau gây nghiện (opioids) nếu đau từ vừa đến nhiều (lưu ý trách tác dụng phụ là táo bón). Có thể xạ trị để giảm đau do di căn xương hay để ngăn ngừa gãy xương bệnh lý.
Cần lưu ý đến vấn đề dinh dưỡng và hỗ trợ tâm lý cho các bệnh nhân UTBMTBG giai đoạn muộn.
5.5. Điều trị hỗ trợ
- Điều trị bệnh lý gan nền tảng và nâng đỡ chức năng gan.
- Dùng thuốc kháng virus khi có chỉ định.
- Hỗ trợ dinh dưỡng để nâng tổng trạng.
- Điều trị các bệnh lý đi kèm.
6. THEO DÕI VÀ TÁI KHÁM
- Theo dõi định kỳ cho đến khi bệnh nhân không thể tiếp tục được theo dõi nữa (tử vong, mất liên lạc,..
- Tùy phương pháp, hiệu quả điều trị, thời gian bệnh ổn định hay tiến triển mà hẹn tái khám mỗi tháng, mỗi hai tháng, hay mỗi ba tháng, cụ thể:
+ Bệnh nhân vừa được điều trị sẽ được hẹn tái khám sau 01 tháng để đánh giá kết quả điều trị. Nếu bệnh tiến triển và còn khả năng điều trị thì chỉ định phương pháp điều trị và cho lịch hẹn. Nếu kết quả điều trị là ổn thì hẹn tái khám sau 02 tháng.
+ Nếu tại lần tái khám sau 02 tháng mà bệnh tiến triển lại và còn khả năng điều trị thì chỉ định phương pháp điều trị và cho lịch hẹn. Nếu bệnh vẫn ổn thì hẹn tái khám sau mỗi 03 tháng.
- Mỗi lần tái khám, bệnh nhân sẽ được đánh giá về lâm sàng và làm đầy đủ các xét nghiệm cận lâm sàng và hình ảnh học như đã nêu trong phần Chẩn đoán. Cần thiết làm các chỉ dấu sinh học AFP, AFP-L3, PIVKA II (DCP) để đánh giá kết quả điều trị, theo dõi diễn tiến bệnh và phát hiện tái phát UTBMTBG.
- Nếu đã xác định bệnh nhân có nhiễm virus viêm gan B hay C thì nên làm đầy đủ các xét nghiệm để chỉ định điều trị (nếu cần) và đánh giá hiệu quả điều trị các virus này, cụ thể là: HBsAg, HbsAb, HbcAb, HBeAg, HBeAb, định lượng HBV-DNA, AntiHCV, định lượng HCV-RNA.
7. PHÒNG BỆNH
- Tiêm vaccine phòng bệnh viêm gan siêu vi B cho những người chưa nhiễm, đặc biệt là cho trẻ sơ sinh.
- Chủ động tầm soát định kỳ UTBMTBG trên những người có nhiễm HBV, HCV, xơ gan.
- Tuyên truyền giáo dục tránh lây nhiễm HBV, HCV qua đường tình dục và từ mẹ sang con, kiểm soát chặt chẽ việc truyền các chế phẩm máu.
- Tuyên truyền hạn chế sử dụng các đồ uống có cồn.
Sơ đồ hướng dẫn chẩn đoán và điều trị ung thư biểu mô tế bào gan
Phụ lục 1: Phân độ LIRADS trên siêu âm và siêu âm có chất cản âm (CEUS)
Siêu âm: LI-RADS phân thành 3 nhóm:
* US-1: không thấy hoặc tổn thưong/giả tổn thương lành tính hiển nhiên (nang đơn giản, vùng gan lành quanh túi mật, u máu (hemangioma) biết trước.
* US-2: tổn thương/giả tổn thương < 10 mm, không chắc là lành tính.
* US-3: tổn thương/giả tổn thương ≥10 mm, không chắc là lành tính hoặc có huyết khối mới trong tĩnh mạch
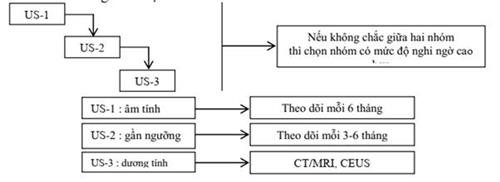
Lược đồ của LI-RADS về CEUS:
Khối u thấy được trên siêu âm không có chất tương phản, chưa được điều trị và không có bằng chứng giải phẫu bệnh trên bệnh nhân có nguy cơ cao bị UTBMTBG:

Ngoài các trường hợp trên, có thể áp dụng bảng dưới đây:

Bảng chẩn đoán bằng CEUS
| Ngấm thuốc mạnh thì động mạch | Không ngấm thuốc mạnh thì động mạch | Ngấm thuốc mạnh thì động mạch (không viềna, không mất liên tục ngoại vib) | ||
| Kích thước u (mm) | < 20 | ≥ 20 | < 10 | ≥ 10 |
| Không thải thuốc | CEUS LR-3 | CEUS LR-3 | CEUS LR-3 | CEUS LR-4 |
| Thải thuốc chậm và ít | CEUS LR-3 | CEUS LR-4 | CEUS LR-4 | CEUS LR-5 |

Phụ lục 2: Phân độ LIRADS trên CT scan và MRI scan
Khuyến cáo của LI-RADS về CT/MRI:
- Áp dụng cho các bệnh nhân có nguy cơ cao bị UTBMTBG:
√ Xơ gan, hoặc
√ Nhiễm HBV mạn, hoặc
√ Đã hay đang bị UTBMTBG.
- Áp dụng cho các khảo sát nhiều thì có sử dụng chất tương phản ngoại bào hoặc chất tương phản gan-mật.
- Không áp dụng cho các bệnh nhân:
√ Không có các nguy cơ trên
√ Dưới 18 tuổi
√ Xơ gan do xơ hóa gan bẩm sinh
√ Xơ gan do các bệnh lý mạch máu như bệnh giãn mạch máu xuất huyết di truyền (hereditary hemorrhagic telangiectasia), hội chứng Budd-Chiari, tắc tĩnh mạch cửa mạn, bệnh tim ứ máu, hay tăng sản tái tạo dạng nốt lan tỏa.
- Không sử dụng phân độ LI-RADS cho các trường hợp:
√ Tổn thương có bằng chứng giải phẫu bệnh là ác tính, hoặc
√ Tổn thương có bằng chứng giải phẫu bệnh là lành tính và không xuất phát từ tế bào gan, như u máu
Các tổn thương chưa được điều trị và không có bằng chứng giải phẫu bệnh trên bệnh nhân có nguy cơ cao bị UTBMTBG

Trường hợp khác, sử dụng bảng chẩn đoán CT/MRI sau đây:
| Ngấm thuốc mạnh thì động mạch | Không ngấm thuốc mạnh thì động mạch | Ngấm thuốc mạnh thì động mạch (không viền) | ||||
| Kích thước u (mm) | < 20 | ≥ 20 | < 10 | 10-19 | ≥ 20 | |
| Các tiêu chuẩn chính: Thải thuốc (không phải ở ngoại vi) “Vỏ” ngấm thuốc Phát triển nhanh | Tổng |
|
|
|
|
|
| 0 | LR-3 | LR-3 | LR-3 | LR-3 | LR-4 | |
| 1 | LR-3 | LR-4 | LR-4 | LR-4 / LR- 5* | LR-5 | |
| ≥ 2 | LR-3 | LR-4 | LR-4 | LR-5 | LR-5 | |

Phụ lục 3: Sử dụng LIRADS để hướng dẫn chẩn đoán và đánh giá kết quả điều trị trên CT scan và MRI scan
Phụ lục 4: Hệ thống điểm Child-Pugh đánh giá chức năng gan
| Thông số | 1 điểm | 2 điểm | 3 điểm |
| Bilirubin huyết thanh (Limol/I.) Bilirubin huyết thanh (mg%) | < 34 < 2 | 34-50 2 - 3 | > 50 > 3 |
| Albumin huyết thanh (g/L) | > 35 | 28 - 35 | < 28 |
| INR | < 1.70 | 1.71 - 2.2 | > 2.2 |
| Báng bụng | không | Kiểm soát được bằng thuốc | khó kiểm soát |
| Bệnh lý não gan | không | Kiểm soát được bằng thuốc | khó kiểm soát |
INR: International Normalised Ratio
| Tổng số điểm | Phân loại Child-Pugh |
| 5 - 6 | A |
| 7 - 9 | B |
| 10 - 15 | C |
Phụ lục 5: Hướng dẫn Điều trị của APASL 2017
Hướng dẫn Điều trị của BCLC 2018
Hướng dẫn Điều trị của EASL 2018
Hướng dẫn Điều trị của AASLD 2018
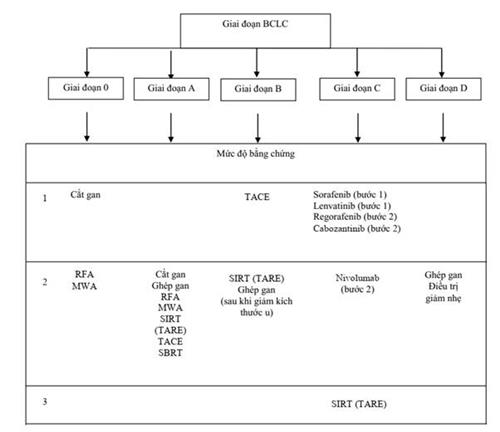
Hướng dẫn Điều trị của ESMO 2018
| Giai đoạn BCLCa | Điều trị chuẩn | Những hạn chế về chỉ định do sự phát triển của u và chức năng gan | Điều trị thay thế (chưa được EMAb phê duyệt) | Biện pháp điều trị thay thế | |
| 0-A | 1 u bất kể kích thước hoặc ≤ 3 u kích thước ≤ 3cm Chức năng gan tốt ECOG PS 0 | Cắt gan [III,A]
Ghép gan [III,A]
Đốt u [III,A]
TACE [I,A] | Phần gan còn lại đủ về kích thước và chức năng U ≤ 5cm, ≤ 3 u U ≤ 3cm, không nằm gần mạch máu hay đường mật Chống chỉ định phẫu thuật và đốt u. Bắc cầu để ghép gan |
| Xạ trị lập thể định vị thân (SBRT) [III,C] Xạ trị áp sát liều cao [III,C] SIRT [III,C] |
| B | Nhiều u Chức năng gan tốt ECOG PS 0 | TACE [I,A] | U 5-10cm, các khối u có thể tiếp cận siêu chọn lọc |
| Ghép gan [III,A] Cắt gan [III,A] Điều trị toàn thân (sau khi TACE thất bại / kháng trị) [I,A] SIRT (sau khi TACE thất bại / kháng trị) [III,C] |
| C | Xâm nhập tĩnh mạch cửa Di căn ngoài gan Chức năng gan tốt ECOG PS 1-2 | Sorafenib (bước 1) [I,A]
Regorafenib (bước 2) [I,A]
| Child-Pugh A
Child-Pugh A, dung nạp với Sorafenib | Lenvatinib (bước 1) [I,A] Cabozantinib (bước 2) [I,A] Ramucirumab (AFP cao, bước 2) [I,A] | Nivolumab (bước 2) [III,B] Pembrolizumab (bước 2) [III,B] SIRT (gan hạn chế, chức năng gan tốt, không có điều trị toàn thân nào khả thi) [III,C] |
| D | Chức năng gan giai đoạn cuối ECOG PS 3-4 | Điều trị giảm nhẹ |
|
|
|
a. BCLC: Barcelona Clinic Liver Cancer
b. EMA: European Medicines Agency
TÀI LIỆU THAM KHẢO
1. Nguyễn Bá Đức, Trần Văn Thuấn, Nguyễn Tuyết Mai (2010). Điều trị nội khoa bệnh ung thư. Nhà xuất bản Y học.
2. Nguyễn Chấn Hùng (2004). Ung bướu học nội khoa. Nhà xuất bản Y học.
3. Lương Ngọc Khuê, Mai Trọng Khoa (2020). Hướng dẫn Chẩn đoán và Điều trị một số bệnh Ung bướu. Nhà xuất bản Y học.
4. Mai Trọng Khoa (2014). Hướng dẫn chẩn đoán và điều trị một số bệnh ung bướu. Nhà xuất bản Y học.
5. Bùi Diệu và cs (2016). Hướng dẫn chẩn đoán và điều trị các bệnh ung thư thường gặp. Nhà xuất bản Y học.
6. Nguyễn Văn Hiếu (2010). Điều trị phẫu thuật bệnh ung thư. Nhà xuất bản Y học.
7. Trần Văn Thuấn, Lê Văn Quảng, Nguyễn Tiến Quang (2019). Hướng dẫn chẩn đoán điều trị bệnh ung thư thường gặp. Nhà xuất bản Y học.
8. Bộ Y tế (2012). Quyết định số 5250 QĐ-BYT. “Hướng dẫn chẩn đoán và điều trị ung thư tế bào gan nguyên phát”.
9. Trịnh Hồng Sơn (2017). Ung thư và một số vấn đề liên quan. Nhà xuất bản Giáo dục Việt Nam.
10. Mai Trọng Khoa (2016). Kháng thể đơn dòng và phân tử nhỏ trong điều trị ung thư. Nhà xuất bản Y học.
11. Mai Trọng Khoa và cộng sự (2012). Y học hạt nhân (Sách dùng cho sau đại học). Nhà xuất bản Y học.
12. Hướng dẫn Chẩn đoán và Điều trị bệnh Viêm gan vi rút B - Quyết định 3310/QĐ-BYT (2019)
13. Chien Peter Chen, Kim Huang, and Mack Roach III (2010). Hepatobiliary Cancer”, Handbook of Evidence-Based Radiation Oncology, 2nd Edition, Chapter 21.
14. Chen YY, Yen HH, Choi KC, Wu SS (2012). Thalidomide-based multidisciplinary treatment for patients with advanced hepatocellular carcinoma: A retrospective analysis. World J Gastroenterol 2012 Feb 7: 18(5):466-471.
15. David L. Bartlett, Adrian M. Di Bisceglie, Laura A. Dawson (2008). “Cancer of the Liver”, Cancer principles & Practice of Oncology, 8th Edition, P1130-1151, Lippincott William & Wilkins.
16. EASL-EORTC Clinical Practice Guidelines (2012): Management of Hepatocellular Carcinoma. J Hep V.56 No4 April 2012; 908-943.
17. ESMO. Hepatocellular Carcinoma (2018). ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up.
18. Llovet JM, et al. (the SHARP investigator group) (2008). Sorafenib in Advanced Hepatocellular Carcinoma. J Natl Cancer Inst 2008; 100: 698-711
19. Makưuchi M, Kokudo N (2006). World J Gastroenterol 2006; 12: 828-9.
20. National Comprehensive Cancer Network (2020). Hepatobiliary Cancers, version 1.2020. NCCN Clinical Practice Guideline in Oncology.
21. National Comprehensive Cancer Network (2020) Hepatocellular Carcinoma, version 01.2020. NCCN Clinical Practice Guideline in Oncology.
22. World Health Organization. Global Health Observatory. Geneva: World Health Organization; 2018. who.int/gho/database/ en/. Accessed June 21, 2018 - GLOBOCAN 2018
23. Masao Omata, Ann-Lii Cheng, Norihiro Kokudo, Masatoshi Kudo, Jeong Min Lee, Jidong Jia, Ryosuke Tateishi, Kwang-Hyub Han, Yoghesh K. Chawla, Shuichiro Shiina, Wasim Jafri, Diana Alcantara Payawal, Takamasa Ohki, Sadahisa Ogasawara, Pei-Jer Chen, Cosmas Rinaldi A. Lesmana, Laurentius A. Lesmana, Rino A. Gani, Shuntaro Obi, A. Kadir Dokmeci, Shiv Kumar Sarin - Asia-Pacific clinical practice guidelines on the management of hepatocellular carcinoma : a 2017 update - Hepatol Int (2017) 11: 317-370
24. Alejandro Forner, María Reig, Jordi Bruix - Hepatocellular Carcinoma - www thelancet.com http://dx.doi.org/10.1016/S0140-6736(18)30010-2 January 4, 2018
25. Peter R. Galle, Alejandro Forner, Josep M. Llovet, Vincenzo Mazzaferro, Fabio Piscaglia, Jean-Luc Raoul, Peter Schirmacher, Valérie Vilgrain - EASL Clinical Practice Guidelines : Management of Hepatocellular Carcinoma - J Hep 2018 vol. 69: 182-236
26. Jorge A. Marrero, Laura M. Kulik, Claude B. Sirlin, Andrew X. Zhu, Richard S. Finn, Michael M. Abecassis, Lewis R. Roberts, Julie K. Heimbach - Diagnosis, Staging, and Management of Hepatocellular Carcinoma: 2018 Practice Guidance by the American Association for the Study of Liver Diseases - Hepatology 2018 vol 68, No.2
27. Arndt Vogel, Andrés Cervantes, Ian Chau, Bruno Daniele, Josep M. Llovet, Tim Meyer, Jean-Charles Nault, Ulf Neumann, Jens Ricke, Bruno Sangro, Peter Schirmacher, Chris Verslype, Christoph J. Zech, Dirk Arnold, Erika Martinelli - Hepatocellular carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up - Annals of Oncology 2018 29 (Supplement 4): iv238- iv255
28. Andrew Bang, Laura A. Dawson - Radiotherapy for HCC: Ready for prime time? - JHEP Reports 2019 vol 1: 131-137
29. Peter R. Galle, Friedrich Foerster, Masatoshi Kudo, Stephen L. Chan, Josep M. Llovet, Shukui Qin, William R. Schelman, Sudhakar Chintharlapalli, Paolo B. Abada, Morris Sherman, Andrew X. Zhu - Biology and significance of alphafetoprotein in hepatocellular carcinoma - Liver International 2019:39: 2214-2229
30. Su Jong Yu, Yoon Jun Kim - Effective treatment strategies other than Sorafenib for the patients with advanced hepatocellular carcinoma invading portal vein - World J Hepatol 2015 June 18;7(11): 1553-1561
31. Richard S. Finn, Philippe Merle, Alessandro Granito, Yi-Hsiang Huang, Gyorgy Bodoky, Marc Pracht, Osamu Yokosuka, Olivier Rosmorduc, René Gerolami, Chiara Caparello, Roniel Cabrera, Charissa Chang, Weijing Sun, Marie-Aude LeBerre, Annette Baumhauer, Gerold Meinhardt, Jordi Bruix - Outcomes of sequential treatment with sorafenib followed by regorafenib for HCC: Additional analyses from the phase III RESORCE trial - J Hepatol. 2018 Aug;69(2): 353-358
32. Alejandro Forner, Marine Gilabert, Jordi Bruix, Jean-Luc Raoul - Treatment of Intermediate stage Hepatocellular Carcinoma - Nat. Rev. Clin. Oncol. 2014 vol. 11: 525-535
33. Masatoshi Kudo, Osamu Matsui, Namiki Izumi, Hiroko Iijima, Masumi Kadoya, Yasuharu Imai - Surveillance and Diagnostic Algorithm for Hepatocellular Carcinoma proposed by the Liver Cancer Study Group of Japan - Oncology 2014; 87 Suppl 1:7-21.
34. Norihiro Kokudo, Nobuyuki Takemura, Kiyoshi Hasegawa, Tadatoshi Takayama, Shoji Kubo, Mitsuo Shimada, Hiroaki Nagano, Etsuro Hatano, Namiki Izumi, Shuichi Kaneko, Masatoshi Kudo, Hiroko Iijima, Takuya Genda, Ryosuke Tateishi, Takuji Torimura, Hiroshi Igaki, Satoshi Kobayashi, Hideyuki Sakurai, Takamichi Murakami, Takeyuki Watadani, Yutaka Matsuyama - Clinical practice guidelines for hepatocellular carcinoma: The Japan Society of Hepatology 2017 (4th JSH-HCC guidelines) 2019 update - Hepatol Res. 2019 Oct;49(10): 1109-1113
35. Xian-Qiang Wang, Zhe Liu, Wen-Ping Lv, Ying Luo, Guang-Yun Yang, Chong-Hui Li, Xiang-Fei Meng, Yang Liu, Ke-Sen Xu, Jia-Hong Dong - Safety validation of decision trees for Hepatocellular Carcinoma - World J Gastroenterol 2015; 21(31): 9394-9402
36. Thomas Yau, Vikki Y.F. Tang, Tzy-Jyun Yao, Sheung-Tat Fan, Chung-Mau Lo, Ronnie T.P. Poon - HongKong Liver Cancer Group Classification of Hepatocellular Carcinoma - Gastroenterology 2014; 146: 1691-1700
37. Don C. Rockey, Stephen H. Caldwell, Zachary D. Goodman, Rendon C. Nelson, and Alastair D. Smith - Liver Biopsy - Hepatology 2009 vol 49 (3): 1017-1044
38. World Health Organization, Western Pacific region - Viral hepatitis situation and response in Vietnam - 2018
39. Song-Huy Nguyen-Dinh, Albert Do, Trang Ngoc Doan Pham, Doan Y Dao, Trinh Nhu Nguy, Moon S Chen Jr - High burden of hepatocellular carcinoma and viral hepatitis in Southern and Central Vietnam: Experience of a large tertiary referral center, 2010 to 2016 - World J Hepatol. 2018 10(1): 116-123
40. World Health Organization - Surveillance of viral hepatitis at sentinels hospitals in Vietnam - 2019 (unpublished data)
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Quyết định 3129/QĐ-BYT PDF (Bản có dấu đỏ)
Quyết định 3129/QĐ-BYT PDF (Bản có dấu đỏ) Quyết định 3129/QĐ-BYT DOC (Bản Word)
Quyết định 3129/QĐ-BYT DOC (Bản Word)