- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 6686-2:2007 ISO 13366-2:2006 Sữa - Định lượng tế bào xôma
| Số hiệu: | TCVN 6686-2:2007 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Khoa học-Công nghệ , Thực phẩm-Dược phẩm |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
2007 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 6686-2:2007
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 6686-2:2007
TIÊU CHUẨN QUỐC GIA
TCVN 6686-2:2007
ISO 13366-2:2006
SỮA – ĐỊNH LƯỢNG TẾ BÀO XÔMA – PHẦN 2: HƯỚNG DẪN VẬN HÀNH MÁY ĐẾM HUỲNH QUANG ĐIỆN TỬ
Milk – Enumeration of somatic cells –Part 2: Guindance on the operation of fluoro-opto-electronic counters
Lời nói đầu
TCVN 6686-2:2007 thay thế TCVN 6686-2:2000;
TCVN 6686-2:2007 hoàn toàn tương đương với ISO 13366-2:2006;
TCVN 6686-2:2007 do Ban kỹ thuật tiêu chuẩn TCVN/TC/F 12 Sữa và sản phẩm sữa biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
TCVN 6686 (ISO 13366) Sữa – Định lượng tế bào xôma bao gồm các phần sau:
- TCVN 6686 – 1: 2000 (ISO 13366-1: 1997) Phương pháp dùng kính hiển vi (Phương pháp chuẩn);
- TCVN 6686 – 2: 2007 (ISO 13366-2:2006) Hướng dẫn vận hành máy đếm huỳnh quang điện tử.
SỮA – ĐỊNH LƯỢNG TẾ BÀO XÔMA – PHẦN 2: HƯỚNG DẪN VẬN HÀNH MÁY ĐẾM HUỲNH QUANG ĐIỆN TỬ
Milk – Enumeration of somatic cells –Part 2: Guindance on the operation of fluoro-opto-electronic counters
1. Phạm vi áp dụng
Tiêu chuẩn này đưa ra hướng dẫn về điều kiện vận hành máy đếm tế bào xôma trong sữa nguyên liệu và sữa được bảo quản bằng hóa chất, sử dụng máy đếm tế bào xôma huỳnh quang điện tử, trong đó sử dụng kỹ thuật đĩa quay hoặc đo mật độ lưu lượng tế bào trong vùng đếm.
Hướng dẫn này có thể áp dụng để đếm tế bào xôma trong sữa bò nguyên liệu. Hướng dẫn này cũng có thể áp dụng cho sữa nguyên liệu được lấy từ các loại động vật khác như dê, cừu và trâu, nếu đáp ứng được các qui định.
2. Tài liệu viện dẫn
Các tài liệu viện dẫn sau là rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm ban hành thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm ban hành thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi.
TCVN 6686-1 (ISO 13366-1) Sữa – Định lượng tế bào xôma – Phần 1: Phương pháp dùng kính hiển vi (Phương pháp chuẩn).
ISO 8196-1, Milk – Definition and evaluation of the overall accuracy of indirect methods of milk analysis – Part 1: Analytical attributes of indirect methods (Sữa – Định nghĩa và đánh giá độ chính xác tổng thể của các phương pháp phân tích gián tiếp – Phần 1: Thuộc tính phân tích của các phương pháp gián tiếp)
ISO 8196-2, Milk – Definition and evaluation of the overall accuracy of indirect methods of milk analysis – Part 2: Calibration and quality control in the dairy laboratory (Sữa – Định nghĩa và đánh giá độ chính xác tổng thể của các phương pháp phân tích gián tiếp – Phần 2: Hiệu chuẩn và kiểm tra chất lượng trong phòng thử nghiệm sữa).
ISO Guide 34, General requirements for the competence of reference material producers (ISO Hướng dẫn 34, Yêu cầu chung về năng lực của các nhà sản xuất mẫu chuẩn).
ISO Guide 34-1, Proficiency testing by interlaboratory comparisions – Part 1: Development and operation of proficiency testing schemes (ISO Hướng dẫn 43-1, Phần 1: Xây dựng và thực hiện kế hoạch thử nghiệm thành thạo).
3. Thuật ngữ và định nghĩa
Trong tiêu chuẩn này áp dụng các thuật ngữ và định nghĩa nêu trong ISO 8196-1, ISO 8196-2 và các thuật ngữ, định nghĩa sau đây:
3.1. Phương pháp chuẩn (Reference method)
Phương pháp được mô tả trong TCVN 6686-1 (ISO 13366-1) về đếm tế bào xôma.
3.2. Tế bào xôma (Somatic cells)
Các tế bào cho thấy có cường độ huỳnh quang mạnh hơn do việc nhuộm ADN trong nhân tế bào.
CHÚ THÍCH: Số lượng tế bào xôma được biểu thị bằng số tế bào trong một mililit.
4. Nguyên tắc
Các máy đếm huỳnh quang điện tử có các chức năng hấp thu thuốc thử và mẫu thử, vùng trộn và vùng đếm. Trong vùng trộn, mẫu thử được trộn với dung dịch đệm và dung dịch thuốc nhuộm. Một phần của hỗn hợp tạo thành được chuyển sang vùng đếm và đặt vào tấm tiêu điểm. Mỗi một hạt đã nhuộm màu được quan sát bằng kính hiển vi huỳnh quang tạo ra xung điện, được lọc, khuếch đại và ghi lại. Sự phân bố chiều cao xung tạo ra được xử lý điện tử, nhờ đó mà phân biệt được sự khác nhau giữa các tín hiệu ồn và các xung tạo ra do các tế bào xôma đã nhuộm. Mức độ phân biệt có thể ổn định hoặc không ổn định.
Trong vùng trộn mẫu, các thể tích mẫu thử và dung dịch đệm/dung dịch nhuộm màu được lấy theo liều lượng được kiểm soát chặt. Việc trộn có thể được thực hiện trong cốc, khoang trộn, ly tâm, ống mẫu hoặc ống dẫn vào cuvet dòng chảy.
Trong vùng đếm, có thể sử dụng cách đếm đĩa hoặc đếm lưu lượng. Trong trường hợp đếm đĩa, một lớp màng mỏng hỗn hợp được đưa qua ống phun vào đỉnh đĩa quay theo phương thẳng đứng. Đối với kính hiển vi huỳnh quang thì bề mặt quay này hoạt động giống như tấm tiêu điểm chuyển động. Khi sử dụng cách đo lưu lượng tế bào, thì phần hỗn hợp được đặt vào dòng dịch lỏng bao quanh trong cuvet với tốt độ cao. Do gia tốc quay mà hỗn hợp tạo thành một sợi dây mà trong đó các tế bào xôma hội tụ và xếp thành hàng thẳng. Sợi này sau đó được đi qua vật kính hiển vi huỳnh quang.
Trong một số thiết bị, trong vùng đếm có hai kênh. Về mặt đảm bảo chất lượng phân tích, thì tình huống như thế cần được coi là tương đương với hai bộ phận riêng rẽ, nên khi đánh giá cần thực hiện riêng biệt cho từng kênh.
5. Các yếu tố ảnh hưởng đến kết quả phép đo
5.1. Chai đựng mẫu
Chai đựng mẫu phải phù hợp với mục đích sử dụng, nghĩa là vận chuyển các mẫu thử từ điểm lấy mẫu đến phòng thử nghiệm mà không làm thất thoát hoặc hư hỏng.
Chú ý sao cho chia đựng mẫu phải kín và có thể tích trống thích hợp phía trên chai. Thể tích trống quá lớn có thể tạo cream; thể tích trống quá nhỏ có thể gây khó khăn khi trộn.
5.2. Lấy mẫu
5.2.1. Khái quát
Dụng cụ lấy mẫu (nghĩa là chai đựng mẫu, cốc có mỏ và dụng cụ lấy mẫu) phải khô và sạch. Khi sử dụng dụng cụ lấy mẫu tự động, thì chúng phải được đánh giá thích hợp.
Tốt nhất là sau khi lấy mẫu, mẫu thử được làm lạnh ngay đến nhiệt độ từ 0 °C đến 6 °C và giữ ở nhiệt độ này cho đến khi bắt đầu đếm (xem 5.4) hơn là bảo quản. Tránh làm kết đông. Nếu cần thiết phải bảo quản, thì các phương pháp thích hợp để bảo quản mẫu thử bằng hóa chất được mô tả trong 5.3.
5.2.2. Mẫu sữa gộp chung
Trộn kỹ mẫu sữa nguyên liệu gộp chung. Khi khuấy trộn không đủ thì các tế bào xôma sẽ tập trung ở các lớp phía trên và các lớp phía dưới.
5.2.3. Mẫu sữa từ các động vật riêng lẻ
Việc giải phóng các tế bào xôma trong quá trình lấy sữa là không đều. Để có kết quả đếm đại diện cho toàn bộ quá trình lấy sữa, thì điều cơ bản là phải thu được mẫu đại diện. Để chẩn đoán, thì có thể chỉ cần đến mẫu của một công đoạn lấy sữa.
5.3. Bảo quản
Nếu cần phải bảo quản mẫu thử bằng hóa chất, thì bảo quản (5.2.1) càng sớm càng tốt, nhưng phải trong vòng 24 h sau khi lấy mẫu. Trong mọi trường hợp, mẫu thử phải được giữ lạnh (0 °C đến 6 °C) cho đến khi được bổ sung chất bảo quản.
Các chất bảo quản thích hợp như sau:
a) Axit boric: nồng độ cuối cùng có trong mẫu không được vượt quá 0,6 g/100 ml. Các mẫu được bảo quản như thế có thể bảo quản tiếp 24 h ở 6 °C đến 12 °C.
b) Natri azit: nồng độ cuối cùng có trong mẫu không được vượt quá 0,024 g/100 ml. Các mẫu được bảo quản như thế có thể bảo quản tiếp 72 h ở 2 °C đến 10 °C.
c) Bronopol (2-bromo-2-nitro-1,3-propandiol): nồng độ cuối cùng có trong mẫu không được vượt qúa 0,05 g/100 ml. Các mẫu được bảo quản như thế có thể bảo quản tiếp 6 ngày ở 2 °C đến 12 °C.
d) Kali dicromat: nồng độ cuối cùng có trong mẫu không được vượt quá 0,2 g/100 ml. Các mẫu được bảo quản như thế có thể bảo quản tiếp 6 ngày ở 2 °C đến 12 °C.
Các vết màu đi kèm cho thấy thích hợp là:
- Parent Blue V, có nồng độ cuối cùng trong mẫu thử đến 0,15 mg/100 ml,
- Yellow Orange S (E110), có nồng độ cuối cùng trong mẫu thử đến 1 mg/100 ml và
- Hỗn hợp của Patent Blue V và Eosin B, có nồng độ cuối cùng trong mẫu thử đến 0,03 mg/100 ml và 0,45 mg/100 ml, tương ứng.
Có thể sử dụng các chất bảo quản và các vết màu khác với điều kiện là tính hiệu lực và các điều kiện sử dụng đã được đánh giá đầy đủ.
Trong mọi trường hợp, trước khi sử dụng cần đánh giá đúng sự có mặt chất gây nhiễu thiết bị đếm.
Trong các trường hợp khi các máy đếm tế bào huỳnh quang điện tử được kết hợp với máy phân tích sữa để đo các thành phần mẫu thử khác, thì chú ý rằng các chất bảo quản và các vết màu không ảnh hưởng đến kết quả đếm.
5.4. Bảo quản và vận chuyển mẫu
Các mẫu thử chưa bảo quản cần được giữ ở 0 °C đến 6 °C và phải được đếm trong 96 h sau khi lấy mẫu. Không làm kết đông mẫu thử. Bảo quản ở nhiệt độ cao hơn và/hoặc lâu hơn khoảng thời gian đã định có thể cho các số đếm không đại diện. Việc đo các mẫu sau khi cấp đông và rã đông có thể làm cho số đếm thấp đi (10 % đến 20 %). Thời gian các mẫu để ở trạng thái đóng băng và kiểu rã đông có thể ảnh hưởng đến kết quả đếm.
5.5. Chất gây nhiễu
Tránh sử dụng các chất gây nhiễu trong khi đếm. Các chất được biết là gây nhiễu thiết bị đếm là:
a) Các chất bảo quản và các vết màu ở nồng độ cao hơn qui định trong 5.3 và
b) Xanh metylen ở nồng độ cao, ví dụ: > 0,06 mg/100 ml.
5.6. Chất lượng mẫu phân tích
Việc phá vỡ các tế bào xôma (phân giải) sẽ làm tăng các mảnh tế bào nhỏ hơn. Mật độ thấp hơn của huỳnh quang sau khi nhuộm các hạt này gây nên thay đổi phân bố chiều cao xung sang bên trái. Điều này cản trở việc phân biệt các xung tiếng ồn và dẫn đến số đếm thấp đi.
CHÚ THÍCH: Trong một số kiểu loại thiết bị, có sẵn các điểm đặc trưng để đánh giá vị trí và hình dạng phân bố chiều cao xung. Xem các hướng dẫn có liên quan và chỉ dẫn của nhà sản xuất.
Sau khi xử lý các mẫu có vấn đề, cần kiểm tra và làm sạch đường dòng chảy. Cần kiểm tra chức năng của thiết bị trước khi sử dụng tiếp. Các mẫu thử có vấn đề có thể là:
a) các mẫu sữa lấy từ vú động vật bị nhiễm bệnh nặng, nghĩa là có vón cục,
b) các mẫu sữa có tạp chất bẩn,
c) các mẫu sữa có số lượng hồng cầu cao,
d) sữa non,
e) sữa ở cuối thời kì tiết sữa và
f) sữa bị chua.
Tránh phân tích các mẫu có vấn đề, nếu có thể.
5.7. Hóa chất được sử dụng
Tất cả các thuốc thử được sử dụng phải là loại phân tích và có chất lượng dùng cho phân tích vi sinh. Nước được sử dụng phải là nước đã loại khoáng (độ dẫn điện < 10 µS/cm) hoặc nước có độ tinh khiết tương đương. Chuẩn bị các dung dịch làm việc, thời gian bảo quản tối đa và các yêu cầu về bảo quản theo hướng dẫn của nhà sản xuất.
Các điều kiện liên quan đến sử dụng và thải bỏ các hóa chất đã sử dụng và nước thải phải tuân thủ quy định.
5.8. Điều kiện thiết bị
5.8.1. Các điểm chung cần lưu ý là:
a) chức năng của máy trộn và máy khuấy,
b) khả năng nhiễu tại điểm lấy mẫu và trong hệ thống dòng chảy do sự cản trở của tạp chất, các mảng hoặc khối tắc nghẽn trong máy trộn và trong bộ phận ủ ấm và
c) điều kiện và chức năng nguồn ánh sáng và bộ phận nhân bản, kết quả thu được và chất lượng tín hiệu.
5.8.2. Với máy đếm đĩa tế bào, các điểm cụ thể cần chú ý là:
a) vị trí màng trên đĩa quay,
b) độ sạch của tấm tiêu điểm và chức năng của miếng xốp làm sạch; thay miếng xốp đúng lúc là cần thiết và
c) xả hết bình thu nhận dịch đã tráng rửa đúng cách.
5.8.3. Điểm chú ý cụ thể đối với các máy đếm dòng tế bào là sự khác nhau về đặc điểm của sợi mẫu trong cuvet dòng và dòng chất lỏng bao quanh. Một số nhà sản xuất thiết bị đưa ra chương trình đặc biệt để kiểm tra điều này, do đó phải chỉ rõ các giải pháp hợp lý trong trường hợp sai lệch.
5.9. Hệ số làm việc
Hệ số làm việc là số lượng mà qua đó số lượng tế bào xôma thực tế đếm được bằng thiết bị được nhân lên để đạt được số đếm tế bào xôma của mẫu thử. Về lý thuyết, các đặc trưng về độ chụm và độ đúng cần thu được từ hệ số làm việc thấp hơn.
5.10. Thể tích thử nghiệm
Tỷ lệ đúng giữa thể tích dung dịch đệm/dung dịch thuốc nhuộm và thể tích mẫu thử là yếu tố cần thiết cho việc đếm đúng.
6. Hiệu chuẩn
6.1. Chất chuẩn
6.1.1. Khái quát
Các chất chuẩn cần được tạo ra trong các điều kiện được kiểm soát nghiêm ngặt; nghĩa là thực hiện với hệ thống đảm bảo chất lượng và thực hiện các yêu cầu được liệt kê trong ISO Guide 34.
Các chất chuẩn có thể là:
a) các chất chuẩn đã được chứng nhận (CRMs) do tổ chức chính thức được công nhận cung cấp,
b) các chất chuẩn thứ cấp (SRMs) do nhà cung cấp bên ngoài cung cấp, hoặc
c) các chất chuẩn nội bộ (IRMs) do phòng thử nghiệm tự tạo, do đó việc truy nguyên được tuân theo CRMs, SRMs hoặc theo các nghiên cứu thành thạo liên phòng thử nghiệm,
CHÚ THÍCH: Các CRMs để đếm tế bào xôma là không có sẵn. Các ví dụ của các nhà sản xuất thích hợp về chuẩn bị IRMs được liệt kê dưới đây. Các IRMs có thành phần càng giống với thành phần của sữa tự nhiên càng tốt.
6.1.2 Chuẩn bị các mẫu hiệu chuẩn
6.1.2.1 Chuẩn bị bằng cách thêm huyền phù bạch cầu bò
a) Trộn 1000 ml sữa tiệt trùng hoặc sữa xử lí bằng UHT có số đếm tế bào xôma thấp với 1 ml polypropylen 2000 và 0,4 g bronopol.
b) Thêm một lượng cần thiết huyền phù bạch cầu thích hợp vào các phần khác nhau của hỗn hợp để thu được một phạm vi đếm thích hợp.
6.1.2.2. Chuẩn bị bằng vi lọc
a) Thu lấy sữa tươi và thêm bronopol đến phần khối lượng cuối cùng là 0,02 %.
b) Tách chất béo của sữa trong bộ tách cream đến khi thu được chất béo nhỏ hơn 0,1 % phần khối lượng.
c) Cô đặc sữa đã tách chất béo 20 lần bằng cách sử dụng vi lọc trên màng có cỡ lỗ 0,8 µm, tạo ra một phần có hàm lượng tế bào cao (HCM) và một phần có hàm lượng tế bào thấp (LCM).
d) Trộn cream, HCM và LCM theo các lượng cần thiết để thu được 5 phần đến 8 phần sữa với chất béo chiếm 3,5 % phần khối lượng và có các mức khác nhau của số đếm tế bào bao trùm phạm vi đếm quan tâm.
6.1.2.3. Chuẩn bị bằng ly tâm
a) Thu lấy sữa tươi và bronopol đến phần khối lượng cuối cùng là 0,02 %.
b) Lọc dung dịch sữa thu được qua bộ lọc bằng kim loại có cỡ lỗ 0,5 mm.
c) Tách chất béo sữa đã lọc bằng cách cho ly tâm ở gia tốc quay 40 g trong 10 min để thu được cream, sữa gầy và một viên nhỏ.
d) Trộn sữa gầy và viên nhỏ theo các lượng cần thiết để thu được 5 phần đến 8 phần sữa có các mức khác nhau về số đếm tế bào bao trùm phạm vi đếm cần quan tâm.
e) Bổ sung cream sao cho thu được các phần có chất béo là 3,3 % ± 0,3 % phần khối lượng, nếu cần.
f) Tách các phần thu được thành các mẫu riêng lẻ và gia nhiệt ở 120 °C và áp suất 105 Pa trong 3 min.
6.1.3. Chỉ định các giá trị đối chứng
Các giá trị đối chứng cần được xác định bằng phân tích kép sử dụng phương pháp chuẩn qui định trong TCVN 6686-1 (ISO 13366-1), tốt nhất là thực hiện trong hai phòng thử nghiệm khác nhau.
Việc đếm kép đồng thời với các mẫu hiện chuẩn bằng phương pháp đo bằng máy, được hiệu chuẩn chính xác bằng bộ mẫu hiệu chuẩn trước vẫn còn hiệu lực, có thể đóng vai trò hỗ trợ có giá trị trong việc ngăn chặn các dao động trong các mức đếm qua thời gian.
Sự tương hợp hoàn toàn cần có được thường xuyên; đó là chênh lệch tối đa giữa các kết quả của phương pháp chuẩn và số đếm thu được bằng máy đối với các mẫu hiệu chuẩn riêng lẻ nhỏ hơn 10 %. Khi đó, các giá trị thu được bằng phương pháp chuẩn và các số đếm được bằng máy có thể kết hợp, do đó kết quả của phương pháp chuẩn cần phải tính đến cả hệ số trọng lượng ít nhất 0,5 trong giá trị đối chứng đã chỉ định.
Trong trường hợp kết quả đếm mẫu thử được sử dụng để kiểm tra các giới hạn chính thức, thì việc phê chuẩn từ cơ quan có thẩm quyền cần hướng tới qui trình chỉ định các giá trị đối chứng.
6.1.4. Điều kiện bảo quản và thời gian lưu giữ
Điều kiện bảo quản và thời gian lưu giữ chất chuẩn đã chuẩn bị phải được đánh giá đúng. Thời hạn một tháng được coi là tối thiểu.
Khi được bảo quản bằng hóa chất, việc chỉ định cần tìm ra chủng loại và nồng độ chất bảo quản dùng cho các mẫu thử (xem 5.3).
6.2. Qui trình hiệu chuẩn
6.2.1. Hiệu chuẩn
Trước khi hiệu chuẩn, cần chắc chắn rằng thiết bị được vận hành đúng và đáp ứng đầy đủ các yêu cầu liên quan đến kiểm tra mẫu trắng (9.1), ảnh hưởng của việc mang sang (9.2), tỷ lệ thể tích (9.3) và độ lặp lại (9.6).
Tính chất hồi qui tuyến tính có thể được áp dụng cho các mục đích hiệu chuẩn.
Áp dụng qui trình hiệu chuẩn theo ISO 8196-2, sử dụng ít nhất năm mẫu hiệu chuẩn bao trùm phạm vi các số đếm tế bào xôma có liên quan.
Các giá trị biểu thị về các phạm vi đếm tế bào xôma có liên quan của các mẫu hiệu chuẩn được đưa ra trong bảng 1.
Bảng 1 – Các giá trị biểu thị về các phạm vi hiệu chuẩn có liên quan
| Loại sữa | Phạm vi Tế bào/ml |
| Sữa bò (của cả đàn) | Từ 100000 đến 1000000 |
| Sữa bò (của từng con vật) | Từ 100000 đến 2000000 |
| Sữa dê | Từ 200000 đến 2000000 |
| Sữa cừu | Từ 100000 đến 2000000 |
| Sữa trâu | Từ 100000 đến 2000000 |
Việc hiệu chuẩn cần được kiểm tra ít nhất một tháng một lần.
6.2.2. Kiểm tra độ tuyến tính
Mối liên quan giữa các số đọc của thiết bị và các giá trị đối chứng cần phải tuyến tính trong phạm vi đo có liên quan của số đếm tế bào xôma. Sai lệch khỏi tuyến tính có thể xuất phát từ các tín hiệu không đặc thù và tác động ngẫu nhiên.
Trước hết là kiểm tra độ tuyến tính theo bề ngoài bằng cách sử dụng các con số thích hợp sao cho thu được một bức tranh rõ nét về hình đạng của mối quan hệ. Khi có bằng chứng về sự trệch khỏi tuyến tính, thì sử dụng thông số định lượng như phép kiểm tra để nhận dạng mà không quan tâm đến chiều hướng quan sát được có thể chấp nhận được hay không.
Để thực hiện điều đó, có thể sử dụng sữa có số đếm tế bào cao đã được pha loãng hàng loạt với sữa có số đếm thấp, tạo thành một dãy ít nhất năm mẫu bao trùm dải nồng độ.
Đo sữa có số đếm cao và sữa có số đếm thấp theo điều 8 ít nhất là bốn lần giống nhau và tính kết quả trung bình cho từng mẫu. Tính các giá trị đối với mẫu trung gian từ tỷ lệ hỗn hợp trên mẫu đã dùng đưa đến giá trị mong đợi đối với mỗi mẫu. sau đó, đo tất cả các mẫu theo điều 8 ít nhất là bốn lần giống nhau và tính kết quả trung bình cho từng mẫu, tương đương với giá trị đo được đối với một mẫu.
Sử dụng hồi qui tuyến tính với các giá trị dự đoán trên mẫu trên trục x và các giá trị đo được trên mẫu trên trục y. Tính ei = yi – (bxi + a) từ đường hồi qui. Dựng đồ thị các giá trị ei (trục y) và các giá trị dự đoán (trục x). Việc kiểm tra bằng mắt thường các điểm thường sẽ cho đủ thông tin về độ tuyến tính của tín hiệu. Mọi điểm nằm ngoài sẽ dẫn đến loại bỏ kết quả và tính toán lại trước khi thử nghiệm tiếp.
Khi được quan sát, độ cong có thể được biểu thị bằng tỷ số, rc, sử dụng công thức sau đây:
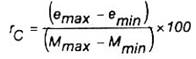
Trong đó
emax là giá trị số dư tối đa từ đường hồi qui;
emin là giá trị số dư tối thiểu từ đường hồi qui;
Mmax là giá trị trên đo được đối với loạt mẫu liên quan;
Mmin là giá trị dưới đo được đối với loạt mẫu liên quan.
Tỷ lệ rc, phải nhỏ hơn 2 %. Nếu giá trị này bị loại bỏ, thì có thể thu được hiệu suất tốt hơn bằng cách thực hiện các phép hiệu chuẩn riêng rẽ đối với các phạm vi đếm riêng biệt.
CHÚ THÍCH: Nhìn chung, có thể kết hợp việc kiểm tra tuyến tính qui định với việc hiệu chuẩn.
7. Lấy mẫu
Mẫu được gửi đến phòng thử nghiệm phải là mẫu đại diện. Mẫu không bị hư hỏng hoặc thay đổi chất lượng trong quá trình vận chuyển hoặc bảo quản. Các điểm cụ thể được liệt kê trong 5.2 đến 5.6.
Việc lấy mẫu không qui định trong tiêu chuẩn này. Nên lấy mẫu theo TCVN 6400 (ISO 707).
8. Cách tiến hành
Trước khi phân tích, mẫu thử (5.2.2 hoặc 5.2.3) cần được làm nóng từ từ đến 40 °C ± 3 °C và cần được trộn bằng cách đảo chiều hộp chứa mẫu. Mẫu thử có thể được giữ ở nhiệt độ phòng cho đến khi thử nghiệm, với điều kiện là các mẫu đó được thử nghiệm trong vòng 30 min khi đã đạt tới 40 °C ± 3 °C. Mẫu cần được trộn kỹ lại ngay trước khi thử nghiệm.
Đo mẫu thử theo hướng dẫn của nhà sản xuất thiết bị.
CHÚ THÍCH: Đối với một vài loại thiết bị, việc kéo dài thời gian đếm là tùy ý, trùng khớp với việc làm giảm hệ số làm việc (xem 5.9). Điều này có thể tăng độ lặp lại và độ chính xác của phép đo.
9. Kiểm tra hiệu suất trong vận hành thông thường
9.1. Kiểm tra mẫu trắng
Kiểm tra mẫu trắng có nghĩa là kiểm tra sự nhiễm bẩn của đường ống trong toàn bộ thiết bị. Trước khi bắt đầu, cần kiểm tra mẫu trắng ít nhất năm lần.
Giá trị trung bình không được vượt quá 3000 tế bào/ml và tất cả các kết quả riêng lẻ cần phải nhỏ hơn 8000 tế bào/ml.
Trong phép thử thông thường, tối đa là sau 100 mẫu hoặc cứ sau 2 h cần tiến hành kiểm tra mẫu trắng.
9.2. Ảnh hưởng của việc mang sang
Phần mẫu thử được lấy từ một mẫu thử có thể ảnh hưởng đến kết quả của mẫu tiếp sau đó. Ảnh hưởng của việc mang sang đó cần được kiểm tra ít nhất mỗi tháng một lần bằng cách đo ít nhất năm dãy mẫu thử có số đếm tế bào xôma ít nhất 750000/mililit, tiếp theo là hai mẫu trắng. Tính giá trị mang sang, CO bằng phần trăm, theo công thức sau đây:
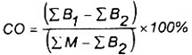
Trong đó
B1 là số đọc được của mẫu trắng thứ nhất;
B2 là số đọc được của mẫu trắng thứ hai;
M là số đọc được của mẫu thử.
Ảnh hưởng của việc mang sang phải nhỏ hơn 2 %.
Nhìn chung, giá trị ảnh hưởng của việc mang sang tính được có thể được bù tự động khi thử nghiệm các mẫu thông thường.
CHÚ THÍCH: Trong một vài loại thiết bị, ảnh hưởng của việc mang sang có thể xuất hiện giữa các mẫu không liên tiếp, ví dụ khi sử dụng bánh xe có các cốc ủ ấm.
9.3. Tỷ lệ giữa thể tích thuốc thử và thể tích mẫu thử
Để đếm đúng, cần có một tỷ lệ thích hợp giữa các thể tích dung dịch đệm/thuốc nhuộm và mẫu sữa thử nghiệm. Điều này cần được kiểm tra thường xuyên đối với máy đếm tế bào đĩa quay. Đối với phép thử này, có thể sử dụng các chai hoặc các ống đã biết trước khối lượng chứa các thể tích dung dịch đệm/thuốc nhuộm và mẫu thử.
Sau khi cân, tỷ lệ này có thể tính được. Tỷ lệ này cần thống nhất với giá trị qui định trong khoảng ± 5 %.
9.4. Kiểm tra thí điểm
9.4.1. Khái quát
Phép đo các mẫu thí điểm với các giá trị sữa thí điểm ấn định là để kiểm tra sự ổn định của thiết bị trong thời gian ngắn. Sử dụng mẫu sữa thí điểm với các số đếm tế bào xôma trung bình và cao (> 2 x trung bình) trong phạm vi đếm có liên quan.
9.4.2. Sữa thí điểm
Để thu được sữa thí điểm thích hợp, thì có thể áp dụng qui trình chuẩn bị chất chuẩn (xem 6.1). Một qui trình thay thế là lựa chọn các mẫu thử thích hợp từ các mẻ được phân tích thường lệ và chuẩn bị tiếp theo của các loại sữa đã gộp lại có bổ sung chất bảo quản thích hợp (xem 5.3). Bảo quản các mẫu này ở nhiệt độ từ 0 °C đến 6 °C cho đến khi sử dụng. Tránh làm đông lạnh các mẫu sữa thí điểm. Cũng cần phải ghi lại thời gian sử dụng các mẫu chưa bảo quản thường được giới hạn từ một đến hai ngày sau khi chuẩn bị.
9.4.3. Chỉ định các giá trị sữa thí điểm
Phân tích ít nhất 10 mẫu thí điểm hai lần giống nhau trên thiết bị đã hiệu chuẩn. Tính giới hạn lặp lại r từ các kết quả thu được theo ISO 8196-2. Với điều kiện là giá trị tính được thấp hơn giá trị độ lặp lại mục tiêu trong 11.1, tính giá trị trung bình của các kết quả thu được và chỉ định giá trị này là giá trị thí điểm.
9.4.4. Sử dụng các mẫu sữa thí điểm
Cần kiểm tra thí điểm ngay trước ngày làm việc và tiếp theo ít nhất một giờ ba lần trong khi phân tích các mẫu thường lệ. Các mẫu sữa thí điểm phải đại diện cho sữa cần phân tích và cần tuân theo cùng một qui trình xử lý sơ bộ mẫu và phân tích như đối với các mẫu thử nghiệm.
Đối với việc kiểm soát sự ổn định thiết bị, có thể sử dụng đồ thị kiểm soát theo ISO 8196-2. Do đó, giá trị chỉ định đối với sữa thí điểm được coi như giá trị chuẩn. Cần có hành động thích hợp nếu một hoặc nhiều giá trị thu được nằm ngoài các giới hạn đối với kết quả riêng lẻ hoặc giá trị trung bình.
9.5. Giám sát thêm thiết bị
Một số nhà sản xuất thiết bị cung cấp các mẫu hạt nhân tạo để hỗ trợ trong việc giám sát thiết bị hàng ngày.
9.6. Độ lặp lại
Trước mỗi ngày làm việc cần kiểm tra độ lặp lại theo hướng dẫn của nhà sản xuất. Có thể sử dụng các mẫu sữa thí điểm.
Khi kiểm tra thường lệ các lượng lớn mẫu thử bằng thiết bị có công suất cao, thì khi bắt đầu nên thực hiện 10 phép xác định lặp lại hai lần trong mẫu thí điểm. Vả lại, nên kiểm tra 20 mẫu thử riêng lẻ khác nhau hai lần giống hệt nhau trong các mẻ chạy liên tiếp tại các khoảng đều đặn, ví dụ: mỗi tuần một lần.
Độ lệch chuẩn tương đối lặp lại cần được tính theo ISO 8196-2. Cần có hành động thích hợp nếu giá trị thu được lớn hơn giá trị qui định trong 11.1.
9.7. Độ tái lập trong phòng thử nghiệm
Đối với các thiết bị cần cùng một hệ thống hiệu chuẩn, điển hình là trong một phòng thử nghiệm có một vài thiết bị, thì độ tái lập (11.2) trong phòng thử nghiệm cần được kiểm tra.
Thuật ngữ “độ tái lập trong phòng thử nghiệm” liên quan đến phép phân tích được thực hiện trong cùng một phòng thử nghiệm, sử dụng cùng phương pháp thực hiện trên vật liệu thử giống hệt nhau, do các người khác nhau phân tích, sử dụng các thiết bị khác nhau tại các thời điểm khác nhau (trong vài giờ).
Có thể dùng các kết quả sữa thí điểm riêng lẻ có sẵn từ việc kiểm tra độ lặp lại (xem 9.6) để kiểm tra độ tái lập trong phòng thử nghiệm. Cần có hành động thích hợp nếu giá trị thu được lớn hơn giá trị qui định trong 11.2.
9.8. So sánh bên ngoài
Sự tham gia trong các nghiên cứu liên phòng thử nghiệm theo ISO Guide 43-1 ít nhất hai lần trong một năm như là một phần của hệ thống đảm bảo chất lượng đối với việc đếm tế bào xôma bằng huỳnh quang điện tử. Số lượng các đơn vị tham gia cần nhỏ hơn 10. Phạm vi đếm liên quan cần bao trùm ít nhất 10 mẫu, được cung cấp cho phép phân tích lặp lại hai lần, hai mẫu được lấy từ mỗi chai mẫu.
10. Nhận xét cụ thể về sử dụng sữa từ các loài khác nhau
10.1. Khái quát
Nên kiểm tra việc không bị ảnh hưởng đáng kể của chất béo và protein, ví dụ: bằng cách cho thêm cream và phần còn lại sau khi siêu lọc.
Nếu quan sát thấy có ảnh hưởng đáng kể, thì chỉnh thiết bị và/hoặc qui trình đếm theo hướng dẫn của nhà sản xuất thiết bị.
Có thể cần phải điều chỉnh như sau:
a) pha loãng sơ bộ mẫu thử;
b) sử dụng thuốc nhuộm màu đậm đặc hơn;
c) điều chỉnh lượng dung dịch đệm/dung dịch thuốc nhuộm;
d) thay đổi nhiệt độ mẫu thử;
e) kéo dài thời gian đi qua cuvet dòng;
f) điều chỉnh việc xử lý chính xác phân bố chiều cao xung thu được.
10.2. Sữa bò
Đối với các giống bò cho sữa có hàm lượng chất béo và protein cao, thì kiểm tra khả năng gây cản trở cho việc đếm tế bào xôma.
10.3. Sữa dê
Lượng tế bào xôma trong sữa dê nhỏ hơn nhiều so với sữa bò. Tế bào bổ sung, như các hạt dạng tế bào chất có thể tạo thêm tạp. Điều này cần chú ý đặc biệt để phân biệt đúng. Tuy nhiên, tùy thuộc vào thiết bị và nếu hàm lượng chất rắn tổng số không quá cao, thì sữa dê có thể được phân tích sử dụng máy đếm huỳnh quang điện tử dùng đường hiệu chuẩn của sữa bò, với điều kiện là phạm vi số đếm tế bào xôma có liên quan đã bao trùm trong dây hiệu chuẩn [4].
Số đếm tế bào xôma trong sữa dê và sự biến thiên của chúng, ví dụ, giai đoạn lấy sữa, nhìn chung cao hơn so với sữa bò và ít bị ảnh hưởng bởi tình trạng sức khỏe của động vật cho sữa.
10.4. Sữa cừu
Trong quá trình xử lý số đếm bằng huỳnh quang điện tử, các tế bào xôma trong sữa cừu có biểu hiện bên ngoài giống với sữa bò. Tùy thuộc vào loại thiết bị và nếu hàm lượng chất rắn tổng số không quá cao, thì có thể phân tích sữa cừu trên các máy đếm bằng huỳnh quang điện tử sử dụng đường hiệu chuẩn của sữa bò, với điều kiện là phạm vi số đếm tế bào xôma có liên quan đã bao trùm trong dãy hiệu chuẩn [4].
Số đếm tế bào xôma trong sữa cừu có thể ở mức tương tự như trong sữa bò nhưng cũng có thể cao hơn.
10.5. Sữa trâu
Trong quá trình xử lý số đếm bằng huỳnh quang điện tử, các tế bào xôma trong sữa trâu có biểu hiện bên ngoài giống với sữa bò. Hàm lượng chất béo và protein có thể cao hơn đáng kể, cần kiểm tra về khả năng gây nhiễu và việc điều chỉnh cần thiết.
11. Độ chụm
CHÚ THÍCH: Các giá trị đã nêu về độ chụm được liệt kê dưới đây từ nghiên cứu trên sữa bò. Các giá trị về sữa được lấy từ các loài khác có thể kém thích hợp.
11.1. Độ lặp lại
Chênh lệch tuyệt đối giữa các kết quả thu được của hai lần thử nghiệm độc lập riêng rẽ (r), thu được khi sử dụng cùng một phương pháp, phân tích trên cùng nguyên liệu, do cùng một người tiến hành trong cùng một phòng thử nghiệm, dùng cùng thiết bị, trong một khoảng thời gian ngắn, không quá 5 % các trường hợp lớn hơn các giá trị được nêu trong bảng 2.
Bảng 2 – Giá trị độ lặp lại
| Mức số đếm tế bào tế bào/ml | sr % | r tế bào/ml |
| 150000 | 6 | 25000 |
| 300000 | 5 | 42000 |
| 450000 | 4 | 50000 |
| 750000 | 3 | 63000 |
| 1500000 | 3 | 126000 |
11.2. Độ tái lập trong phòng thử nghiệm
Chênh lệch tuyệt đối giữa các kết quả của hai lần thử nghiệm độc lập riêng rẽ (Rintra), thu được sử dụng cùng một phương pháp, phân tích trên nguyên liệu giống hệt nhau, do các người khác nhau phân tích, tiến hành trong cùng phòng thí nghiệm, dùng các thiết bị khác nhau, ở các thời điểm khác nhau (trong vòng vài giờ), không quá 5 % các trường hợp lớn hơn các giá trị nêu trong bảng 3.
Bảng 3 – Giá trị độ tái lập trong phòng thử nghiệm
| Mức số đếm tế bào tế bào/ml | sR intra % | Rintra tế bào/ml |
| 150000 | 7 | 29000 |
| 300000 | 6 | 50000 |
| 450000 | 5 | 63000 |
| 750000 | 4 | 84000 |
| 1500000 | 4 | 168000 |
11.3. Độ tái lập
Chênh lệch tuyệt đối giữa hai kết quả thu được của hai lần thử nghiệm độc lập riêng rẽ (R), thu được khi sử dụng cùng một phương pháp, phân tích trên nguyên liệu thử giống hệt nhau, do các người khác nhau thực hiện trong các phòng thử nghiệm khác nhau, trong một khoảng thời gian ngắn, không quá 5 % các trường hợp lớn hơn các giá trị được nêu trong bảng 4.
Bảng 4 – Giá trị độ lặp lại
| Mức số đếm tế bào tế bào/ml | sR % | R tế bào/ml |
| 150000 | 9 | 38000 |
| 300000 | 8 | 67000 |
| 450000 | 7 | 88000 |
| 750000 | 6 | 126000 |
| 1500000 | 6 | 252000 |
12. Báo cáo thử nghiệm
Báo cáo thử nghiệm phải ghi rõ:
a) mọi thông tin cần thiết để nhận biết đầy đủ về mẫu thử;
b) phương pháp lấy mẫu đã sử dụng, nếu biết;
c) ngày lấy mẫu;
d) kiểu loại mẫu;
e) phương pháp thử đã dùng;
f) mọi chi tiết thao tác sai lệch so với qui định trong tiêu chuẩn này mà có thể ảnh hưởng tới kết quả;
g) kết quả thu được tính theo đơn vị hàng nghìn tế bào trên mililit hoặc nếu đáp ứng yêu cầu về độ lặp lại thì ghi kết quả cuối cùng thu được.
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] TCVN 6400 (ISO 707) Sữa và sản phẩm sữa – Hướng dẫn lấy mẫu.
[2] TCVN 6910-1 (ISO 5725-1), Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo. Phần 1: Nguyên tắc và định nghĩa chung.
[3] TCVN 6910-2 (ISO 5725-2). Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo. Phần 2: Phương pháp cơ bản xác định độ lặp lại và độ tái lập của phương pháp đo tiêu chuẩn.
[4] Programme FAIR 1 CT 95-0881:2002, Strategies de contrôle en fermes des comptage de cellules somatiques du lait de brebis et de chervre.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 6686-2:2007 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 6686-2:2007 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 6686-2:2007 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 6686-2:2007 DOC (Bản Word)