- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn quốc gia TCVN 14175:2024 Thuốc bảo vệ thực vật - Phương pháp định lượng Bacillus amyloliquefaciens - Kỹ thuật đếm khuẩn lạc
| Số hiệu: | TCVN 14175:2024 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Công nghiệp , Nông nghiệp-Lâm nghiệp |
| Trích yếu: | Thuốc bảo vệ thực vật - Phương pháp định lượng Bacillus amyloliquefaciens - Kỹ thuật đếm khuẩn lạc | ||
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
11/10/2024 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 14175:2024
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 14175:2024
TIÊU CHUẨN QUỐC GIA
TCVN 14175:2024
THUỐC BẢO VỆ THỰC VẬT - PHƯƠNG PHÁP ĐỊNH LƯỢNG BACILLUS AMYLOLIQUEFACIENS - KỸ THUẬT ĐẾM KHUẨN LẠC
Pesticides - Enumeration of Bacillus amyloliquefaciens - The plate count method
Lời nói đầu
TCVN 14175:2024 do Trường Đại học Khoa học Tự nhiên biên soạn, Bộ Nông nghiệp và Phát triển Nông thôn đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng Quốc gia thẩm định, Bộ Khoa học và Công nghệ công bố.
THUỐC BẢO VỆ THỰC VẬT - PHƯƠNG PHÁP ĐỊNH LƯỢNG BACILLUS AMYLOLIQUEFACIENS - KỸ THUẬT ĐẾM KHUẨN LẠC
Pesticides - Enumeration of Bacillus amyloliquefaciens - The plate count method
1 Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp định lượng B. amyloliquefaciens (bao gồm loài đồng danh Bacillus velezensis) trong thuốc bảo vệ thực vật hoặc nguyên liệu sản xuất thuốc bảo vệ thực vật bằng kỹ thuật đếm khuẩn lạc.
Tiêu chuẩn này sử dụng quy trình real-time PCR cho phép thử khẳng định B. amyloliquefaciens và loài đồng danh.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau là rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 6166, Phân bón vi sinh vật cố định nitơ.
TCVN 6404 (ISO 7218), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi. Yêu cầu chung và hướng dẫn kiểm tra vi sinh vật.
TCVN 7682 (ISO 20838), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi. Phản ứng chuỗi Polymeraza (PCR) để phát hiện sinh vật gây bệnh từ thực phẩm. Yêu cầu về khuếch đại và phát hiện đối với các phương pháp định tính.
TCVN 7700-2 (ISO 11290-2), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi. Phương pháp phát hiện và định lượng Listeria monocytogenes. Phần 2: Phương pháp định lượng.
TCVN 8128 (ISO 11133), Vi sinh vật trong thực phẩm, thức ăn chăn nuôi và nước. Chuẩn bị, sản xuất, bảo quản và thử hiệu năng của môi trường nuôi cấy.
TCVN 11133 (ISO 22119), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phản ứng chuỗi polymerase real-time (PCR real-time) để phát hiện vi sinh vật gây bệnh từ thực phẩm - Định nghĩa và yêu cầu chung.
TCVN 11134 (ISO 22174), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi. Phản ứng chuỗi polymerase (PCR) để phát hiện vi sinh vật gây bệnh từ thực phẩm. Định nghĩa và yêu cầu chung.
TCVN 11925 (ISO 20837), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi. Phản ứng chuỗi Polymerase (PCR) để phát hiện vi sinh vật gây bệnh từ thực phẩm. Yêu cầu về chuẩn bị mẫu để phát hiện định tính.
TCVN 12017, Thuốc bảo vệ thực vật - Lấy mẫu.
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này áp dụng các thuật ngữ, định nghĩa sau:
3.1
Môi trường nuôi cấy sinh màu Bacillus (Bacillus chromogenic medium - BM)
Là môi trường nuôi cấy vi khuẩn thuộc nhóm Bacillus, giúp nhận dạng nhanh các loài Bacillus dựa trên màu sắc và hình dạng các đơn vị hình thành khuẩn lạc (colony-forming unit - CFU).
3.2
Khuẩn lạc B. amyloliquefaciens giả định (Putative B. amyloliquefaciens Colony - PBC)
Là khuẩn lạc mang các đặc điểm phù hợp với các mô tả về khuẩn lạc của B. amyloliquefaciens trên môi trường BM, khi tiến hành thử nghiệm theo tiêu chuẩn này và chưa qua phép thử khẳng định.
3.3
Phép thử khẳng định B. amyloliquefaciens (B. amyloliquefaciens confirmation)
Là phương pháp kiểm tra định tính các khuẩn lạc B. amyloliquefaciens giả định (3.2) là đúng hay sai, khi tiến hành thử nghiệm theo tiêu chuẩn này.
3.4
Bacillus amyloliquefaciens (Bacillus amyloliquefaciens)
Là vi sinh vật tạo thành khuẩn lạc B. amyloliquefaciens giả định trên môi trường BM và được khẳng định đúng với phép thử khẳng định B. amyloliquefaciens, khi tiến hành thử nghiệm theo tiêu chuẩn này.
3.5
Định lượng B. amyloliquefaciens (B. amyloliquefaciens enumeration)
Là xác định số lượng đơn vị hình thành khuẩn lạc B. amyloliquefaciens (3.4) có trong một khối lượng hoặc thể tích cụ thể của thuốc bảo vệ thực vật, nguyên liệu sản xuất thuốc bảo vệ thực vật, khi tiến hành các thử nghiệm theo tiêu chuẩn này.
3.6
Real-time PCR
Là phản ứng tổng hợp chuỗi polymerase thời gian thực cho phép theo dõi sự gia tăng và định lượng DNA mục tiêu trong mẫu thử trong suốt thời gian thực tế diễn ra phản ứng nhờ vào công nghệ phát huỳnh quang.
3.7
Giá trị chu kỳ ngưỡng (Threshold cycle value - Ct)
Là giá trị chu kỳ mà tại đó tín hiệu huỳnh quang được tạo ra vượt qua ngưỡng huỳnh quang nền, trong quy trình real-time PCR (phản ứng tổng hợp chuỗi polymerase thời gian thực).
3.8
Đường cong nóng chảy và giá trị Tm (Melting curve analysis and Tm value)
Đường cong nóng chảy là đồ thị biểu diễn sự thay đổi của nhiệt độ trong các bước của quy trình real-time PCR. Đỉnh cao nhất của đường cong nóng chảy thể hiện giá trị Tm, đại diện cho mẫu nghiên cứu.
Giá trị Tm là điểm nhiệt độ mà tại đó 50 % sợi đôi ADN phân tách nhau và tạo thành sợi đơn.
4 Nguyên tắc
Định lượng B. amyloliquefaciens trong thuốc bảo vệ thực vật, nguyên liệu sản xuất thuốc bảo vệ thực vật bằng phương pháp đếm PBC (3.2) trên đĩa thạch BM và xác định số lượng PBC (3.2) là đúng B. amyloliquefaciens (3.4) bằng phương pháp real-time PCR.
Phép phân tích nhìn chung bao gồm:
a. Đếm số lượng khuẩn lạc B. amyloliquefaciens giả định PBC (3.2), trên đĩa thạch BM;
b. Thực hiện phép thử khẳng định khuẩn lạc B. amyloliquefaciens (3.3);
c. Khẳng định số lượng khuẩn lạc đúng B. amyloliquefaciens (3.4) dựa theo giá trị Ct;
d. Từ số lượng khuẩn lạc đã khẳng định, áp dụng công thức tính để định lượng B. amyloliquefaciens (3.5).
5 Thiết bị, dụng cụ
Cơ sở thử nghiệm cần sử dụng trang thiết bị và dụng cụ của phòng thử nghiệm vi sinh theo TCVN 6404 (ISO 7218).
Thiết bị và dụng cụ để thực hiện quy trình real-time PCR cần được trang bị theo TCVN 11133 (ISO 22119).
5.1 Thiết bị
Trang thiết bị của phòng thử nghiệm và các thiết bị, dụng cụ nêu trong TCVN 6404 (ISO 7218), TCVN 11133 (ISO 22119) và TCVN 11134 (ISO 22174) cần sử dụng các thiết bị, dụng cụ như sau:
5.1.1 Tủ cấy vô trùng, tủ cấy vi sinh, luồng không khí thổi theo chiều dọc.
5.1.2 Nồi hấp áp lực, có nhiệt độ hơi nước bão hòa trong buồng có khả năng duy trì nhiệt độ ở 121 °C ± 3 °C tương ứng áp suất tối thiểu 101,3 kPa.
5.1.3 Cân kỹ thuật, có độ chính xác đến ± 0,01 g.
5.1.4 Tủ ấm, thông gió đối lưu, có thể duy trì ở nhiệt độ từ 25 °C đến 40 °C, độ chính xác đến ± 1 °C.
5.1.5 Tủ lạnh, với ngăn đông duy trì nhiệt độ ổn định ở âm 20 °C ± 1 °C và ngăn lạnh duy trì nhiệt độ ổn định ở 4 °C ± 1 °C.
5.1.6 Bể ổn nhiệt, có khả năng điều chỉnh tự động về nhiệt độ trong khoảng từ 5 °C đến 99 °C, độ chính xác đến ± 1 °C.
5.1.7 Máy trộn mẫu (máy vortex), có khả năng khuấy trộn mẫu đồng đều.
5.1.8 Máy quang phổ, định lượng ADN/ARN có phạm vi bước sóng từ 200 nm đến 850 nm, độ chính xác bước sóng ± 1 nm.
5.1.9 Máy đo pH, có độ chính xác đến ± 0,01 đơn vị pH ở nhiệt độ phòng.
5.1.10 Máy chu trình nhiệt (máy real-time PCR), phần nhiệt với khả năng luân nhiệt ở nhiệt độ khác nhau trong phạm vi từ 4 °C đến 115 °C một cách chính xác và quá trình luân nhiệt này được lặp đi lặp lại từ 30 đến 45 chu kỳ. Phần quang dùng để ghi nhận (detector) nhiều tín hiệu quang phát ra cùng lúc (theo mục 7.2.1 TCVN 11133).
5.1.11 Máy ly tâm, có thể ly tâm với gia tốc 6 000 g và 20 000 g.
5.2 Dụng cụ
5.2.1 Ống ly tâm, 1,5 mL.
5.2.2 Bộ Pipet, cho các kích cỡ từ 1 μL đến 10 μL, 20 μL đến 200 μL, 100 μL đến 1000 μL.
5.2.3 Đầu côn, 1 mL; 200 μL; 20 μL; 10 μL.
5.2.4 Ống real-time PCR, thể tích từ 100 μL đến 200 μL.
5.2.5 Bình thủy tinh có nút vặn, thể tích phù hợp (100 mL, 250 mL, 500 mL, 1000 mL).
5.2.6 Bình định mức: 500 mL, 1000 mL.
5.2.7 Que cấy vi sinh, bằng thủy tinh hoặc bằng chất dẻo hoặc bằng thép.
5.2.8 Ống falcon có nắp vặn, vô trùng và có dung tích 50 mL.
5.2.9 Đĩa Petri, đường kính từ 90 mm đến 200 mm.
5.2.10 Đèn cồn
5.2.11 Khay đá, giữ lạnh mẫu.
6 Môi trường, thuốc thử và vật liệu thử
6.1 Yêu cầu chung
Sử dụng môi trường BM hoàn chỉnh (3.1), tuân thủ chính xác hướng dẫn của nhà sản xuất [1], [5]. Chuẩn bị môi trường trong phòng thử nghiệm theo Điều 4.3 TCVN 8128 (ISO 11133).
Yêu cầu chung cho nước, thuốc thử và vật liệu thử cho quy trình real-time PCR theo TCVN 11133 (ISO 22119).
6.2 Dung dịch pha loãng
Chuẩn bị dung dịch pha loãng Natri clorua (NaCl) 0,85 % theo mục 6.2.1.2 của TCVN 6166.
6.3 Cặp mồi real-time PCR
Cặp mồi được thiết kế và kiểm tra tính đặc hiệu theo Điều 7.5 TCVN 7682 (ISO 20838).
Cặp mồi đặc hiệu khuếch đại đoạn ADN dài 67 bp, sử dụng cho phép thử khẳng định B. amyloliquefaciens (3.3) bằng quy trình real-time PCR, với trình tự mồi (5' - 3') như sau:
qPCR.Ba.F: AGGAGCCGCACATGAATAAAGC
qPCR.Ba.R: TGGTGGAGGTCGCTCATACTTC
6.4 Vật liệu ADN
Vật liệu ADN sử dụng trong phép thử khẳng định B. amyloliquefaciens (3.3) bao gồm một ADN đối chứng dương (Positive control - PC), một ADN đối chứng âm (Negative control - NC) và ADN từ khuẩn lạc B. amyloliquefaciens giả định (Testing colony - TC).
6.4.1 Đối chứng dương
Chủng chuẩn B. amyloliquefaciens hoặc loài đồng danh (synonym) B. velezensis tiếp nhận từ bộ sưu tập chủng của Liên đoàn thế giới các Bảo tàng giống vi sinh vật (WFCC) hoặc Tổ chức Bảo tàng giống vi sinh vật châu Âu (ECCO) theo TCVN 8128 (ISO 11133).
CHÚ THÍCH: Chủng chuẩn B. amyloliquefaciens được ghi nhận trên Trung tâm Thông tin Công nghệ Sinh học Quốc gia Mỹ (NCBI) bao gồm ATCC:23350, BCCM/LMG:12234, BCCM/LMG:22478, BCCM/LMG:9814, BCRC:11601, BCRC:17467, CCUG:28519, CCUG:50740, CECT:5686, CFBP:4246, CIP:103265, DSM:7, HAMBI:1824, IFO:15535, KCTC:13102, KCTC:13012, NBRC:15535, NCAIM B.01704, NCIMB:12077, NRRL:B-14393, NRRL:B-41580.
6.4.2 Đối chứng âm
Chủng chuẩn không phải là B. amyloliquefaciens và loài đồng danh (synonym) B. velezensis [2 - 4, 6 - 8], tiếp nhận từ bộ sưu tập chủng của Liên đoàn thế giới các Bảo tàng giống vi sinh vật (WFCC) hoặc Tổ chức Bảo tàng giống vi sinh vật châu Âu (ECCO) theo TCVN 8128 (ISO 11133).
6.4.3 Tách chiết ADN từ khuẩn lạc
Phương pháp này áp dụng cho tách chiết ADN vi khuẩn từ khuẩn lạc với đối chứng dương (6.4.1), đối chứng âm (6.4.2) và các khuẩn lạc B. amyloliquefaciens giả định. Để ngăn ngừa nhiễm chéo, không thực hiện tách chiết ADN của đối chứng dương (6.4.1), đối chứng âm (6.4.2) và PBC (3.2) cùng thời điểm.
Các khuẩn lạc, mọc riêng rẽ trên đĩa nuôi cấy, được lấy bằng que cấy (5.2.7), hoà tan khuẩn lạc trong 100 μL dung dịch pha loãng (6.2). Dùng máy trộn mẫu (5.1.7) trộn đều, mạnh, tạo huyền phù tế bào vi khuẩn. Sau đó thực hiện tiếp quy trình tách chiết ADN vi khuẩn bằng phương pháp sốc nhiệt theo Phụ lục B TCVN 11925 (ISO 20837).
Định lượng ADN bằng máy quang phổ (5.1.8) và kiểm tra độ tinh sạch theo mục 6.2.1.2 TCVN 11925 (ISO 20837). Nồng độ ADN thu được nên tối thiểu là 50 ng trong 1 μL dịch ADN.
ADN sau tách chiết cần được bảo quản trong ngăn lạnh tủ lạnh (5.1.5) trong vòng 24 h nếu sử dụng ngay cho phép thử khẳng định B. amyloquefaciens, hoặc nếu chưa tiến hành phản ứng ngay thì cần lưu trữ trong ngăn đông tủ lạnh (5.1.5).
6.5 Thuốc thử để ngăn ngừa lây nhiễm chéo
Ngăn ngừa nhiễm chéo theo mục 5.9.4 TCVN 7682:2007 (ISO 20838:2006).
6.6 Kít real-time PCR
Sử dụng thuốc thử thương mại cho quy trình real-time PCR với thuốc nhuộm SYBR Green (SYBR Green Master Mix). Việc pha chế, bảo quản và sử dụng thuốc thử phải tuân thủ theo hướng dẫn của nhà sản xuất.
7 Lấy mẫu và chuẩn bị mẫu thử
7.1 Lấy mẫu
Thuốc bảo vệ thực vật được lấy mẫu theo quy định (TCVN 12017) về cách lấy mẫu, số lượng mẫu và bảo quản mẫu trước khi đưa đến phòng thử nghiệm.
Mẫu sau khi được tiếp nhận ở phòng thử nghiệm được bảo quản theo khuyến cáo của nhà sản xuất nhằm đảm bảo sức sống của các tế bào vi khuẩn trong thuốc bảo vệ thực vật.
7.2 Chuẩn bị mẫu thử
Đối với mẫu dạng lỏng, lắc đều và dùng pipet (5.2.2) hút 10 mL, chính xác đến 10 μL vào bình thủy tinh có nắp vặn vô trùng thể tích 250 mL (5.2.5). Đối với mẫu dạng rắn, cân 10 gram vào bình thủy tinh có nắp vặn vô trùng thể tích 250 mL (5.2.5) bằng cân kỹ thuật (5.1.3). Bổ sung 90 mL dung dịch pha loãng NaCl 0,85 % (6.2) vô trùng để thu được độ pha loãng 10-1. Trộn đều mẫu bằng máy trộn mẫu (5.1.7) trong 5 min đến 10 min (nếu mẫu chưa đồng nhất, tiếp tục ủ mẫu khoảng 5 min đến 10 min rồi tiếp tục trộn). Mẫu sau đó được đun nóng ở 80 °C trong bể ổn nhiệt (5.1.6) trong 10 min để diệt các tế bào sinh dưỡng của vi sinh vật khác.
CHÚ THÍCH: (1) Đối với một số mẫu có chất mang là tinh bột hoặc dạng lỏng không chứa bào tử thì bỏ qua bước đun nóng ở 80 °C. (2) Nếu mẫu có chứa thành phần là vô cơ thì mẫu ban đầu nên được pha loãng theo khuyến cáo của nhà sản xuất hoặc pha loãng trực tiếp thành 10-2 để tránh vi sinh vật bị ảnh hưởng sức sống. Mẫu pha loãng 10-1 được tiếp tục sử dụng để pha loãng ở các nồng độ thấp hơn. Mẫu tiếp tục được pha loãng từ 10-2 đến 10-8 trong dung dịch pha loãng NaCl 0,85 % với thể tích của mỗi nồng độ pha loãng là 10 mL đựng trong ống falcon vô trùng (5.2.8) hoặc bình thủy tinh thể tích phù hợp (5.2.5). Các mẫu pha loãng sẽ được sử dụng ngay để thực hiện ở Điều 8.1.
8 Cách tiến hành
8.1 Cấy trải mẫu trên đĩa thạch
Sử dụng 100 μL (0,1 mL) dịch đồng nhất của các mẫu pha loãng và cấy trải trên đĩa Petri (5.2.9) rồi chuyển các đĩa này vào tủ ấm (5.1.4) ở 37 °C ± 1 °C. Kiểm tra các đĩa nuôi cấy sau 12 h đến 24 h, giữ lại các đĩa nuôi cấy có chứa ít hơn 200 khuẩn lạc trong tủ lạnh (5.1.5) để thực hiện việc nhận diện, đếm khuẩn lạc B. amyloliquefaciens giả định (PBC) và thực hiện phép thử khẳng định B. amyloliquefaciens.
CHÚ THÍCH: Do khuẩn lạc của một số chủng B. amyloliquefaciens có kích thước lớn (15 mm), với mẫu thuốc bảo vệ thực vật thử nghiệm có đăng ký số lượng vi khuẩn 1 × 106 CFU/g (dạng rắn) hoặc CFU/mL (dạng lỏng), nên cấy trải mẫu thử ở nồng độ pha loãng 10-4 và 10-5, để đảm bảo các khuẩn lạc hình thành tách rời nhau. Tương tự, với mẫu thuốc bảo vệ thực vật thử nghiệm có đăng ký số lượng vi khuẩn 1 × 108 CFU/g (dạng rắn) hoặc CFU/mL (dạng lỏng), nên cấy trải mẫu thử ở nồng độ pha loãng 10-8 và 10-7.
8.2 Nhận diện khuẩn lạc
Khuẩn lạc B. amyloliquefaciens trên môi trường BM có hình dạng không đồng đều, màu trắng, hồng hoặc xám, kích thước khoảng 6 mm đến 150 mm. Bề mặt khuẩn lạc khô, sần sùi, có thể có nhân tròn màu trắng hoặc xanh nhạt nằm giữa khuẩn lạc hoặc lệch về một bên. Trên bề mặt khuẩn lạc có thể có các đường gờ màu trắng nổi rõ, phân nhánh từ một điểm và toả ra mép khuẩn lạc hoặc toả nhánh dạng san hô. Mép khuẩn lạc không đều hoặc nhăn, có thể có viền ngoài màu trắng. Khuẩn lạc B. amyloliquefaciens có thể mọc lan, mép phía ngoài có thể tạo thành quầng sáng màu trắng, hồng hoặc xám (Hình thái khuẩn lạc tham khảo Phụ lục A).
8.3 Đếm khuẩn lạc B. amyloliquefaciens giả định
Đĩa nuôi cấy được giữ lại (8.1) đạt yêu cầu cho việc định lượng B. amyloliquefaciens là đĩa có chứa các PBC (3.2) tách rời nhau.
Trong đĩa nuôi cấy có thể xuất hiện các khuẩn lạc mọc lan không mang các đặc điểm như mô tả cho B. amyloliquefaciens (8.2). Nếu số khuẩn lạc mọc lan ít hơn một phần tư đĩa, thì đếm PBC trên phần đĩa không bị ảnh hưởng và tính bằng cách ngoại suy số đếm lý thuyết của các PBC cho toàn bộ đĩa. Nếu số khuẩn lạc mọc lan nhiều hơn một phần tư đĩa, thì không đếm PBC trên đĩa này.
Thực hiện đếm tất cả PBC trong các đĩa nuôi cấy giữ lại (8.1), ở 2 độ pha loãng liên tiếp, mỗi độ pha loãng đếm trên 2 đĩa. Ưu tiên đếm từ đĩa có độ pha loãng thấp nhất và có tối thiểu 4 PBC.
8.4 Phép thử khẳng định B. amyloliquefaciens
Phép thử khẳng định B. amyloliquefaciens (3.3) nhằm định tính các PBC được thực hiện bằng phương pháp real-time PCR. Trên mỗi đĩa đã đếm PBC, chọn 5 khuẩn lạc điển hình, nếu trên một đĩa có ít hơn 5 khuẩn lạc thì lấy tất cả để tách chiết ADN (6.4.3) làm vật liệu (khuôn mẫu ADN) cho phép thử khẳng định.
8.4.1 Quy trình real-time PCR
Kỹ thuật real-time PCR sử dụng cặp mồi qPCR.Ba.F/ qPCR. Ba.R có trình tự tại Điều 6.3, sử dụng kít real-time PCR (6.6). Mỗi quy trình real-time PCR, ngoài mẫu TC, cần tiến hành song song 1 mẫu PC (6.4.1), 1 mẫu NC (6.4.2), và 1 mẫu nước không chứa ADN/ARN (Bảng 1).
Bảng 1 - Hỗn hợp thuốc thử cho một mẫu tham gia quy trình real-time PCR
| STT | Thành phần | Nồng độ cuối |
| 1 | Nước* |
|
| 2 | qPCR.Ba.F | 0,1 μM/μL |
| 3 | qPCR.Ba.R | 0,1 μM/μL |
| 4 | Kít real-time PCR | 1x |
| 5 | ADN | 2,5 ng/μL |
| * CHÚ THÍCH: Nước được thêm vào cho đủ tổng thể tích phản ứng. | ||
CHÚ THÍCH: Mẫu và nguyên liệu cho phản ứng real-time PCR cần đặt trong khay đá lạnh trong suốt quá trình chuẩn bị hỗn hợp phản ứng.
Đặt các ống real-time PCR đã hoàn thành bổ sung hỗn hợp thuốc thử vào máy chu trình nhiệt (5.1.10) và tiến hành cài đặt chu trình nhiệt 3 bước, với 40 chu kỳ, theo hướng dẫn của nhà sản xuất thuốc thử SYBR Green Master Mix. Nhiệt độ gắn mồi của cặp mồi đặc hiệu trong phép thử này là 62 °C. Thực hiện các bước cài đặt theo thông số nêu trong Bảng 2.
Bảng 2 - Chu trình nhiệt cho quy trình real-time PCR có phân tích đường cong nóng chảy
| Bước | Giai đoạn | Nhiệt độ (°C) | Thời gian | Số chu kỳ |
| 1 | Biến tính ban đầu | 95 | 10 min | 1 |
| 2 | Biến tính | 95 | 15 s | 40 |
| Gắn mồi | 62 | 30 s | ||
| Tổng hợp chuỗi | 72 | 20 s | ||
| 3 | Phân tích đường cong nóng chảy | 95 | 10 s | 1 |
| 65 | 20 s | |||
| 95 | 1 s |
8.4.2 Phân tích kết quả
Quy trình real-time PCR cho phép thử khẳng định B. amyloliquefaciens đạt yêu cầu khi mẫu PC (6.4.1) cho giá trị Ct ≤ 25, mẫu NC (6.4.2) và mẫu nước cho giá trị Ct > 29 hoặc không có giá trị Ct.
Với mẫu TC có giá trị Ct ≤ 25, khuẩn lạc của mẫu thử được khẳng định là B. amyloliquefaciens (3.4).
Với mẫu TC có giá trị Ct > 29 hoặc không có giá trị Ct, khuẩn lạc của mẫu thử được khẳng định là không phải B. amyloliquefaciens.
Với mẫu thử có giá trị 25 < Ct ≤ 29, mẫu thử cần được kiểm tra lại nồng độ ADN, và cần thực hiện lại quy trình real-time PCR với chu trình nhiệt có phân tích đường cong nóng chảy theo hướng dẫn của nhà sản xuất thuốc thử SYBR Green Master Mix.
Phân tích kết quả quy trình real-time PCR với chu trình nhiệt có phân tích đường cong nóng chảy, nếu giá trị Ct ≤ 29, và thể hiện một đỉnh nóng chảy với Tm đạt từ 74 °C đến 78 °C, khác biệt ± 1 °C so với mẫu đối chứng dương, thì mẫu thử được xác định dương tính, và khuẩn lạc của mẫu thử được khẳng định là B. amyloliquefaciens (3.4) (Tham khảo Phụ lục B).
CHÚ THÍCH: Giá trị Tm phụ thuộc vào máy chu trình nhiệt (mục 7.2.1 TCVN 11133) và thuốc thử SYBR Green Master Mix (6.6). Tuy nhiên các mẫu thử được khẳng định là B. amyloliquefaciens khi giá trị Ct ≤ 29 và giá trị Tm của mẫu TC có thể khác biệt ±1 °C so với giá trị Tm của mẫu PC, trong cùng một quy trình real-time PCR.
8.5 Tính và biểu thị kết quả định lượng B. amyloliquefaciens
Phương pháp định lượng B. amyloliquefaciens được thực hiện theo TCVN 7700-2 (ISO 11290-2) và được tính theo Công thức (1):
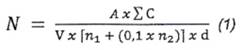
Trong đó
| N | số lượng CFU B. amyloliquefaciens trong một đơn vị mẫu, ở dạng lỏng được tính bằng CFU trên mililit (CFU/mL), hoặc dạng khô được tính bằng CFU trên gam (CFU/g); |
| A | tính bằng phần trăm (%) số mẫu thử được khẳng định là B. amyloliquefaciens (8.4.2) trên tổng số PBC tham gia phép thử (8.4). (Ví dụ trong 5 PBC tham gia phép thử khẳng định B. amyloliquefaciens (8.4), có 4 mẫu thử được khẳng định là B. amyloliquefaciens (8.4.2) thì A được tính là (4/5) × 100 % = 80 %.) |
| Σ C | tổng các PBC đếm được trên tất cả các đĩa được giữ lại từ hai độ pha loãng liên tiếp, chỉ tính các đĩa có chứa tối thiểu 4 khuẩn lạc; |
| V | thể tích dịch cấy trên mỗi đĩa, tính bằng mililit (mL); |
| n1, n2 | số đĩa có PBC được đếm ở hai độ pha loãng liên tiếp; |
| d | hệ số pha loãng tương ứng với độ pha loãng thứ nhất được giữ lại [d = 1 khi mẫu thử ở dạng lỏng, không pha loãng]; |
Kết quả định lượng B. amyloliquefaciens được làm tròn đến hai chữ số sau dấu phẩy.
9 Báo cáo thử nghiệm
Báo cáo thử nghiệm bao gồm ít nhất các thông tin sau:
a) mọi thông tin cần thiết để nhận biết đầy đủ về mẫu thử;
b) phương pháp lấy mẫu đã sử dụng, nếu biết;
c) phương pháp thử nghiệm đã dùng, viện dẫn tiêu chuẩn này;
d) các thao tác không quy định trong tiêu chuẩn này, cùng với các chi tiết bất thường nào khác có thể ảnh hưởng đến kết quả;
e) các kết quả thử nghiệm thu được.
Phụ lục A: Nhận diện khuẩn lạc B. amyloliquefaciens
(Tham khảo)
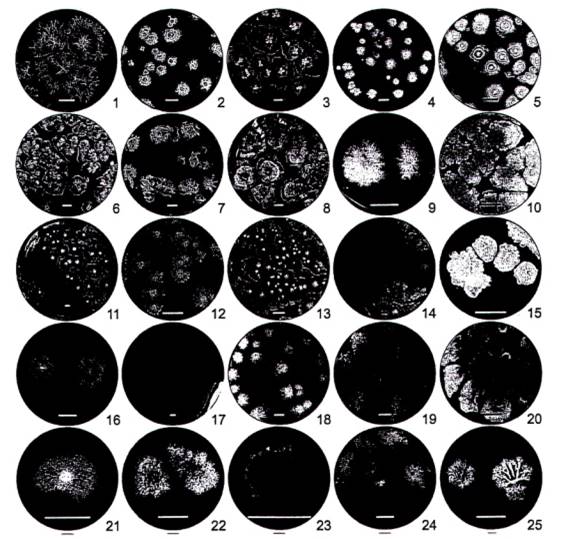
Hình A.1. Hình thái khuẩn lạc của một số chủng thuộc loài B. amyloliquefaciens
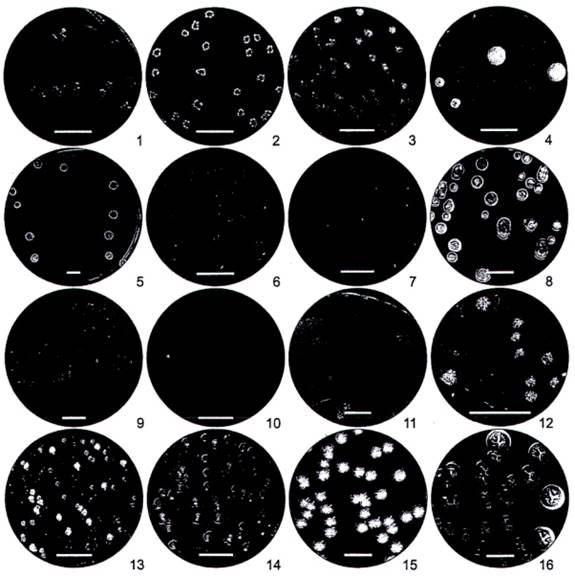
Hình A.2. Hình thái khuẩn lạc của một số chủng Bacillus gần gũi với B. amyloliquefaciens
1 - 8 B. pumilus; 9 - 11 B. licheniformis; 12 B. claussi; 13 - 14 B. subtilis; 15 - 16 B. megaterium.

Hình A.3. Nhận diện khuẩn lạc của B. amyloliquefaciens trong hỗn hợp các chủng Bacillus gần gũi với B. amyloliquefaciens
Phụ lục B: Phân tích kết quả phát hiện B. amyloliquefaciens dựa trên phương pháp real-time PCR
(Tham khảo)
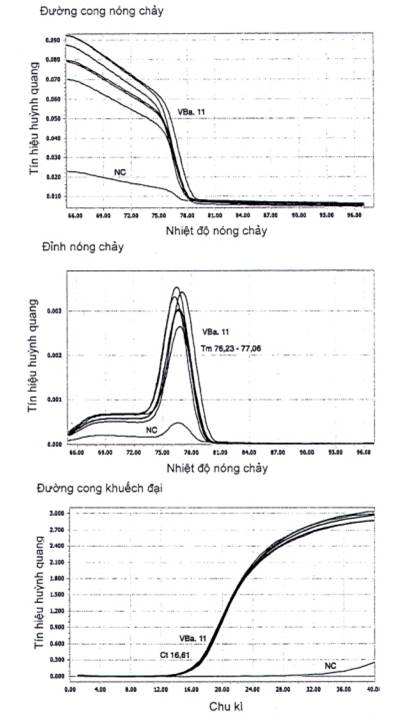
Hình B.1. Kết quả real-time PCR của B. amyloliquefaciens
Thư mục tài liệu tham khảo
[1] Alippi, A.M., (2019). Data associated with the characterization and presumptive identification of Bacillus and related species isolated from honey samples by using HiCrome Bacillus agar. Data in brief, 25, p.104206.
[2] Borriss, R., Chen, X.H., Rueckert, C., Blom, J., Becker, A., Baumgarth, B., Fan, B., Pukall, R. , Schumann, P., Spröer, C. and Junge, H., (2011). Relationship of Bacillus amyloliquefaciens clades associated with strains DSM 7T and FZB42T: a proposal for Bacillus amyloliquefaciens subsp. amyloliquefaciens subsp. nov. and Bacillus amyloliquefaciens subsp. plantarum subsp. nov. based on complete genome sequence comparisons. International journal of systematic and evolutionary microbiology, 61(8), pp.1786-1801.
[3] Dunlap, C. A. (2019). Taxonomy of registered Bacillus spp. strains used as plant pathogen antagonists. Biological control, 134, 82-86.
[4] Fan, B., Blom, J., Klenk, H.P. and Borriss, R., (2017). Bacillus amyloliquefaciens, Bacillus velezensis, and Bacillus siamensis form an “operational group B. amyloliquefaciens” within the B. subtilis species complex. Frontiers in microbiology, 8, p.22.
[5] Kabir, M. S., Hsieh, Y. H., Simpson, S., Kerdahi, K., & Sulaiman, I. M., (2017). Evaluation of two standard and two chromogenic selective media for optimal growth and enumeration of isolates of 16 unique Bacillus species. Journal of food protection, 80(6), 952-962.
[6] Ngalimat, M.S., Yahaya, R.S.R., Baharudin, M.M.A.A., Yaminudin, S.M., Karim, M., Ahmad, S. A. and Sabri, S., (2021). A review on the biotechnological applications of the operational group Bacillus amyloliquefaciens. Microorganisms, 9(3), p.614.
[7] Qiao J.Q., Wu, H.J., Huo, R., Gao, X.W. and Borriss, R., (2014). Stimulation of plant growth and biocontrol by Bacillus amyloliquefaciens subsp. plantarum FZB42 engineered for improved action. Chemical and Biological Technologies in Agriculture, 1, pp.1-14.
[8] Rϋckert, C., Blom, J., Chen, X., Reva, O. and Borriss, R., (2011). Genome sequence of B. amyloliquefaciens type strain DSM7T reveals differences to plant-associated B. amyloliquefaciens FZB42T. Journal of biotechnology, 155(1), pp.78-85.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 14175:2024 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 14175:2024 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 14175:2024 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 14175:2024 DOC (Bản Word)