- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 7700-2:2007 Vi sinh vật trong thực phẩm - Phương pháp định lượng listeria monocytogenes
| Số hiệu: | TCVN 7700-2:2007 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
26/10/2007 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 7700-2:2007
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 7700-2:2007
TIÊU CHUẨN QUỐC GIA
TCVN 7700-2:2007
ISO 11290-2:1998
WITH AMENDMENT 1:2004
VI SINH VẬT TRONG THỰC PHẨM VÀ THỨC ĂN CHĂN NUÔI - PHƯƠNG PHÁP PHÁT HIỆN VÀ ĐỊNH LƯỢNG LISTERIA MONOCYTOGENES - PHẦN 2: PHƯƠNG PHÁP ĐỊNH LƯỢNG
Microbiology of food and animal feeding stuffs - Horizontal method for the detection and enumeration of Listeria monocytogenes - Part 2: Enumeration method
Lời nói đầu
TCVN 7700-2:2007 hoàn toàn tương đương với ISO 11290-2:1996, sửa đổi 1:2004;
TCVN 7700-2:2007 do Ban kỹ thuật tiêu chuẩn TCVN/TC/F13 Phương pháp phân tích và lấy mẫu biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
TCVN 7700:2007 Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp phát hiện và định lượng Listeria monocytogens, bao gồm:
- Phần 1: Phương pháp phát hiện;
- Phần 2: Phương pháp định lượng.
Lời giới thiệu
Do tính đa dạng của thực phẩm và thức ăn chăn nuôi nên phương pháp này có thể không thích hợp đến từng chi tiết cho từng sản phẩm cụ thể. Trong trường hợp này, có thể sử dụng các phương pháp khác đặc trưng cho từng sản phẩm, nếu hoàn toàn chỉ vì lý do kỹ thuật. Tuy nhiên, cần cố gắng áp dụng phương pháp này khi có thể.
Khi tiêu chuẩn này được soát xét thì cần phải tính đến mọi thông tin liên quan đến phạm vi mà phương pháp đếm đĩa này phải tuân theo và các nguyên nhân gây sai lệch so với phương pháp trong trường hợp các sản phẩm cụ thể.
Việc hài hoà các phương pháp thử có thể không thực hiện được ngay và đối với một vài nhóm sản phẩm có thể tồn tại các tiêu chuẩn quốc tế và/hoặc tiêu chuẩn quốc gia mà không phù hợp với tiêu chuẩn này. Trong trường hợp có sẵn tiêu chuẩn cho sản phẩm cần thử nghiệm thì phải tuân theo tiêu chuẩn đó. Thông thường khi các tiêu chuẩn như vậy được soát xét, thì chúng phải được sửa đổi để phù hợp với tiêu chuẩn này, sao cho cuối cùng chỉ còn các sai lệch với phương pháp đếm đĩa này là các lý do kỹ thuật được thừa nhận.
VI SINH VẬT TRONG THỰC PHẨM VÀ THỨC ĂN CHĂN NUÔI - PHƯƠNG PHÁP PHÁT HIỆN VÀ ĐỊNH LƯỢNG LISTERIA MONOCYTOGENES - PHẦN 2: PHƯƠNG PHÁP ĐỊNH LƯỢNG
Microbiology of food and animal feeding stuffs - Horizontal method for the detection and enumeration of Listeria monocytogenes - Part 2: Enumeration method
CẢNH BÁO - Để đảm bảo an toàn cho nhân viên phòng thử nghiệm, cần chú ý rằng các phép thử phát hiện Listeria monocytogenes phải được thực hiện trong các phòng thử nghiệm được trang bị đúng, dưới sự kiểm soát của các nhà vi sinh vật học có kinh nghiệm và hết sức thận trọng với công việc thải tất cả các nguyên vật liệu đã nuôi ấm. Đặc biệt, phụ nữ mang thai không được tiếp xúc trực tiếp với dịch cấy L. monocytogenes.
1. Phạm vi áp dụng
Tiêu chuẩn này qui định phương pháp định lượng Listeria monocytogenes.
CHÚ THÍCH Phương pháp này dùng để định lượng các loài Listeria khác mà chúng có thể được dùng làm chỉ thị về chất lượng vệ sinh của sản phẩm thực phẩm và thức ăn chăn nuôi.
Tiêu chuẩn này có thể áp dụng cho các sản phẩm thực phẩm hoặc thức ăn chăn nuôi như đã nêu trong lời giới thiệu.
Nhìn chung (xem chú thích trong 9.2.1), giới hạn dưới của việc định lượng của phương pháp này là 10 L. monocytogenes trong một mililit mẫu ở dạng lỏng hoặc 100 L. monocytogenes trong một gam sản phẩm ở dạng khác.
2. Tài liệu viện dẫn
Các tài liệu viện dẫn sau là rất cần thiết cho việc áp dụng tiêu chuẩn. Đối với các tài liệu viện dẫn ghi năm ban hành thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm ban hành thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi.
TCVN 6507-1 (ISO 6887-1),[1]) Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử, dung dịch huyền phù ban đầu và các dung dịch pha loãng thập phân để kiểm tra vi sinh vật - Phần 1: Các nguyên tắc chung để chuẩn bị huyền phù ban đầu và các dung dịch pha loãng thập phân.
TCVN 6404 (ISO 7218), Vi sinh vật trong thực phẩm và trong thức ăn chăn nuôi - Nguyên tắc chung về kiểm tra vi sinh vật.
TCVN 7100-1 (ISO 11290-1), Vi sinh vật trong thực phẩm và trong thức ăn chăn nuôi - Phương pháp phát hiện và định lượng Listeria monocytogenes - Phần 1: Phương pháp phát hiện.
3. Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng các thuật ngữ và định nghĩa sau đây:
3.1.
Listeria monocytogenes (Listeria monocytogenes)
Các vi sinh vật tạo thành các khuẩn lạc điển hình trên môi trường đặc chọn lọc và cho thấy rõ các đặc điểm hình thái, sinh lý và sinh hoá như đã mô tả, khi tiến hành thử theo tiêu chuẩn này.
3.2.
Định lượng Listeria monocytogenes (Enumeration of Listeria monocytogenes)
Xác định số lượng đơn vị hình thành khuẩn lạc (CFU) Listeria monocytogenes (xem 3.1) có trong mộl lượng xác định của sản phẩm, khi tiến hành thử theo tiêu chuẩn này.
4. Nguyên tắc
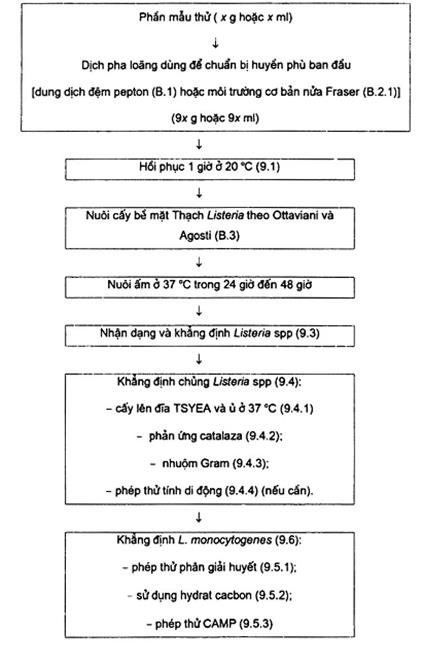
Trong giới hạn của tiêu chuẩn này thì việc phát hiện định lượng L. monocytogenes cần đến ít nhất sáu giai đoạn liên tiếp (Xem sơ đồ trong phụ lục A).
4.1. Chuẩn bị huyền phù ban đầu trong mỗi dịch pha loãng qui định.
4.2. Hồi phục trong 1 giờ ở 20 °C.
4.3. Cấy lên bề mặt đĩa một lượng xác định của mẫu thử dạng lỏng hoặc của huyền phù ban đầu nếu sản phẩm dạng khác, trên môi trường nuôi cấy chọn lọc đặc đựng trong hai đĩa Petri.
Chuẩn bị các đĩa khác, sử dụng các dung dịch pha loãng thập phân từ mẫu thử hoặc từ huyền phù ban đầu, trong cùng điều kiện.
4.4. Ủ các đĩa này ở 37 °C và kiểm tra sau 24 giờ hoặc 48 giờ.
4.5. Khẳng định các khuẩn lạc Listeria monocytogenes giả định bằng các phép thử qui định.
4.6. Từ số lượng khuẩn lạc đã khẳng định, tính số lượng Listeria monocytogenes có trong một gam hoặc một mililit mẫu thử.
5. Môi trường nuôi cấy và thuốc thử
Về thực hành trong phòng thử nghiệm hiện hành, xem TCVN 6404 (ISO 7218).
CHÚ THÍCH Do trong tiêu chuẩn sử dụng một lượng lớn môi trường nuôi cấy và thuốc thử, để cho nội dung tiêu chuẩn được gọn nên thành phần và cách chuẩn bị môi trường nuôi cấy và thuốc thử được đưa riêng vào trong phụ lục B.
6. Thiết bị và dụng cụ thủy tinh
Sử dụng các thiết bị, dụng cụ của phòng thử nghiệm vi sinh thông thường [xem TCVN 6404 (ISO 7218)] và cụ thể như sau:
6.1. Thiết bị để khử trùng khô (tủ sấy) hoặc thiết bị để khử trùng ướt (nồi hấp áp lực)
Xem TCVN 6404 (ISO 7218).
6.2. Tủ sấy hoặc tủ ấm, có thể duy trì nhiệt độ từ 25 °C ± 1 °C đến 50 °C ± 1 °C.
6.3. Tủ ấm, có thể duy trì môi trường, các đĩa và các ống nghiệm trong dải nhiệt độ sau:
a) ở 20 °C ± 1°C (tùy chọn);
b) ở 25 °C + 1°C (tùy chọn);
c) 37°C ± 1°C.
6.4. Nồi cách thuỷ, có thể duy trì nhiệt độ ở 44 °C đến 47 °C.
6.5. Que cấy vòng hoặc que cấy, bằng hợp chất platin/iridin hoặc niken/crom, hoặc pipet Pasteur hoặc que cấy vòng sử dụng một lần.
6.6. Que dàn mẫu vô trùng bằng thủy tinh hoặc bằng chất dẻo.
6.7. Máy đo pH, có thể đọc chính xác đến 0.01 đơn vị pH ở nhiệt độ 25 °C và có thể đo chính xác đến 0.1 đơn vị pH.
6.8. Ống nghiệm hoặc bình cầu, có dung tích thích hợp, để khử trùng và bảo quản môi trường nuôi cấy và nuôi ấm môi trường lỏng.
6.9. Pipet chia độ xả hết, dung tích danh định 1 ml và 10 ml, được chia vạch tương ứng là 0,1 ml và 0,5 ml.
6.10. Đĩa Petri, đường kính 90 mm và 140 mm.
6.11. Bình, thích hợp cho việc ủ trong môi trường vi hiếu khí (tuỳ chọn).
6.12. Hỗn hợp khí (tuỳ chọn), có thành phần qui định dùng để ủ vi hiếu khí:
hàm lượng CO2 từ 5 % đến 12%, O2 từ 5 % đến 15 % và N2 đến 100 %
6.3. Thiết bị dùng cho phép thử rọi Henry (tuỳ chọn)
Xem phụ lục B.
6.14. Kính hiển vi, tốt nhất là loại phản pha, có thêm lam kính và lamen (coverslip).
7. Lấy mẫu
Việc lấy mẫu không qui định trong tiêu chuẩn này. Nếu không có tiêu chuẩn riêng về lấy mẫu sản phẩm có liên quan thì các bên tự thoả thuận về vấn đề này.
Điều quan trọng là mẫu gửi đến phòng thử nghiệm phải đúng là mẫu đại diện và không bị hư hỏng hoặc bị biến đổi trong suốt quá trình vận chuyển và bảo quản [xem TCVN 6404 (ISO 7218)].
8. Chuẩn bị mẫu thử
Chuẩn bị mẫu thử theo tiêu chuẩn riêng cho sản phẩm có liên quan. Nếu không có tiêu chuẩn riêng đó thì các bên tự thoả thuận về vấn đề này.
9. Cách tiến hành
9.1. Phần mẫu thử và huyền phù ban đầu
Xem TCVN 6507-1 (ISO 6887-1) và tiêu chuẩn cụ thể thích hợp của sản phẩm có liên quan. Để chuẩn bị huyền phù ban đầu, sử dụng dung dịch pepton đệm (B.1) hoặc môi trường cơ bản của canh thang nửa Fraser (B.2) làm dịch pha loãng.
Có thể sử dụng môi trường cơ bản của canh thang nửa Fraser không bổ sung các chất chọn lọc làm dịch pha loãng cho mẫu thực phẩm hoặc thức ăn chăn nuôi khi tiến hành trên cùng một mẫu thử đồng thời cho cả phương pháp phát hiện [TCVN 7700 (ISO 11290-1)] và phương pháp định lượng. Qui trình này là để tránh phải chuẩn bị hai dung dịch huyền phù ban đầu; các chất chọn lọc được bổ sung vào huyền phù ngay khi sử dụng phần mẫu thử để định lượng. Việc sử dụng qui trình này phải được ghi vào báo cáo kết quả thử nghiệm.
Để yên huyền phù ban đầu 1 giờ ± 5 phút ở 20 °C ± 2 °C [sử dụng tủ ấm 6.3 a), nếu cần], để phục hồi lại các vi sinh vật bị ức chế.
Nếu sử dụng một dãy pha loãng thì cần chuẩn bị sau khi đã phục hồi.
9.2. Cấy và nuôi ấm
9.2.1. Dùng pipet vô trùng (6.9) chuyển 0,1 ml huyền phù ban đầu (9.1) cho vào hai đĩa Thạch Listeria theo ottaviani và Agosti (B.3), đã được làm khô trong tủ ấm (6.2) nếu cần.
Lặp lại qui trình này sử dụng các dung dịch pha loãng thập phân tiếp theo, nếu cần.
CHÚ THÍCH Đối với một số sản phẩm nhất định, khi cần ước tính một lượng nhỏ Listeria monocytogenes, thì giới hạn định lượng có thể giảm đi 10 lần bằng việc kiểm tra 1,0 ml huyền phù ban đầu. Cho 1 ml dịch cấy lên bề mặt môi trường thạch của đĩa Petri to (140 mm) hoặc trên khắp bề mặt môi trường thạch của ba đĩa Petri nhỏ (90 mm) sử dụng que dàn mẫu vô trùng (6.6). Trong cả hai trường hợp, chuẩn bị kép bằng cách sử dụng hai đĩa to hoặc sáu đĩa nhỏ.
9.2.2. Dàn cẩn thận dịch cấy lên bề mặt thạch càng nhanh càng tốt mà không chạm que dàn vào mép đĩa. Sử dụng mỗi que dàn mẫu vô trùng cho mỗi đĩa[2]). Để yên các đĩa đã đậy nắp khoảng 15 phút ở nhiệt độ môi trường để dịch cấy hấp thụ vào thạch.
9.2.3. Lật ngược các đĩa thạch đã chuẩn bị trong 9.2.2 và đặt chúng vào tủ ấm [6.3 c)] ở 37 °C.
9.3. Định lượng các khuẩn lạc đặc trưng
9.3.1. Sau khi ủ 24 giờ, và ủ tiếp 18 giờ đến 24 giờ nếu mọc yếu hoặc nếu không quan sát thấy khuẩn lạc nào sau khi ủ 24 giờ, kiểm tra các đĩa này (9.2.3) về sự có mặt của các khuẩn lạc giả định là Listeria spp. (xem 9.3.3).
9.3.2. Các khuẩn lạc màu xanh được bao quanh bởi quầng sáng đục (các khuẩn lạc điển hình) được coi là L. monocytogenes. Nếu mọc rất thưa, hoặc nếu không quan sát thấy khuẩn lạc nào, hoặc nếu sau khi ủ 24 giờ ± 3 giờ mà không có mặt khuẩn lạc điển hình nào, thì ủ lại các đĩa thêm 24 giờ ± 3 giờ.
CHÚ THÍCH 1 Một số chủng L. monocytogenes cho thấy quầng sáng rất yếu (thậm chí không có quầng sáng) trong các trường hợp bị ức chế, cụ thể là ức chế bởi axit.
CHÚ THÍCH 2 Một số chủng L. monocytogenes được đặc trưng bởi hoạt tính PIPCL (phospholipaza inositol phosphatidyl C) chậm. Các vi khuẩn như thế được phát hiện khi thời gian ủ tăng lên, ví dụ: 4 ngày. Một số các chủng như thế có thể là loại gây bệnh (xem [1]).
9.3.3. Đếm tất cả các khuẩn lạc nghi ngờ là Listeria spp. (9.3.2) trên từng đĩa chứa ít hơn 150 khuẩn lạc đặc trưng hoặc không đặc trưng.
9.4. Khẳng định Listeria spp
9.4.1. Chọn lọc các khuẩn lạc để khẳng định
9.4.1.1. Sau khi ủ ấm (9.3.1), giữ lại các đĩa chứa ít hơn 150 khuẩn lạc Listeria spp giả định ở tất cả các độ pha loãng và ở hai độ pha loãng liên tiếp, nếu có thể.
Trên mỗi đĩa được giữ lại, chọn năm khuẩn lạc. Nếu trên một đĩa có ít hơn năm khuẩn lạc thì lấy tất cả để khẳng định.
9.4.1.2. Ria cấy các khuẩn lạc đã chọn lên bề mặt đĩa thạch TSYEA (B.4) sao cho các khuẩn lạc mọc tách biệt rõ.
Đặt các đĩa này trong tủ ấm [6.3 c)] ở 37 °C trong 18 giờ đến 24 giờ, hoặc cho đến khi có các khuẩn lạc mọc đủ.
Các khuẩn lạc điển hinh có đường kính từ 1 mm đến 2 mm, lồi, không màu và toàn bộ mép mờ đục. Nếu các khuẩn lạc không tách biệt rõ thì lấy một khuẩn lạc Listeria spp, điển hình cho vào một đĩa TSYEA khác. Tiến hành các phép thử sau đây trên các khuẩn lạc của dịch cấy thuần khiết trên TSYEA.
CHÚ THÍCH Có thể thực hiện phép thử rọi Henry (xem phụ lục C và chú thích trong B.4.2). nếu cán. Màu của khuẩn lạc sau đó hơi xanh có bề mặt nổi hạt.
9.4.2. Phản ứng catalaza
Lấy một khuẩn lạc tách biệt thu được trong 9.4.1.2 và hoà vào một giọt dung dịch hydro peroxit (B.10) trên phiến kính. Sự hình thành ngay bọt khí chứng tỏ phản ứng dương tính [xem TCVN 6404 (ISO 7218)].
9.4.3. Nhuộm gram
Tiến hành nhuộm Gram các khuẩn lạc đã tách trong 9.4.1.2 [xem TCVN 6404 (ISO 7218)]. Listeria spp. cho Gram dương, dạng que ngắn và mảnh (đường kính khoảng 0,4 mm đến 0,5 mm và dài từ 1 mm đến 2 mm).
9.4.4. Thử tính di động (nếu cần)[3]
Lấy một khuẩn lạc tách biệt tốt thu được trong 9.4.1.2, hoà vào ống nghiệm đựng TSYEB (B.5).
Ủ trong tủ ấm [6.3 b)] để 8 giờ đến 24 giờ ở 25 °C cho đến khi quan sát thấy môi trường mờ đục.
Dùng que cấy (6.5) lấy một giọt dịch cấy ở trên cho lên phiến kính thuỷ tinh sạch. Đậy lamen lên đỉnh và kiểm tra bằng kính hiển vi (6.14). Listeria spp có dạng hình que ngắn, mảnh chuyển động hỗn loạn.
Các chủng vi khuẩn mọc ở nhiệt độ trên 25 °C có thể không cho thấy chuyển động này. Phải luôn luôn so sánh với một chủng vi khuẩn đã biết trước. Các dạng trực cầu khuẩn lớn, hoặc các trực khuẩn chuyển động nhanh, dạng bơi thì không phải là Listeria spp.
Một phép thử khác về tính di động, dùng kim cấy (6.5) lấy dịch cấy từ khuẩn lạc điển hình trên thạch TSYEA (9.4.1.2) cấy đâm sâu vào môi truờng thạch di động (B.8). Ủ 48 giờ trong tủ ấm [6.3 b)] để ở 25 °C.
Kiểm tra kiểu mọc xung quanh vết cấy. Listeria spp. là loại di động, cho kiểu mọc điển hình giống như cái ô. Nếu mọc chưa đủ, thì nuôi ấm thêm 5 ngày và kiểm tra lại vết cấy.
9.5. Khẳng định L. monocytognes
9.5.1. Phép thử đặc tính phân giải huyết
9.5.1.1. Nếu các đặc tính hình thái, sinh lý học và phản ứng catalaza cho thấy có khả năng có Listeria spp., thì cấy lên các đĩa thạch huyết (B.6) để xác định phản ứng phân giải huyết cừu.
Làm khô bề mặt thạch trước khi sử dụng. Lấy một khuẩn lạc điển hình tách biệt tốt trong 9.4.1.2 và dùng que cấy (6.5) chấm vào mỗi ô một khuẩn lạc. Đồng thời chấm các chủng kiểm tra dương tính (L. monocytogenes) và âm tính (L.innocua).
Sau khi ủ ở 37 °C trong 24 giờ ± 2 giờ, kiểm tra các chủng từ mẫu thử và chuẩn so sánh. L. monocytogenes tạo ra các vùng sáng, trong và hẹp (phân giải huyết b)[4]); L. innocua có thể tạo ra vùng không trong xung quanh vết chấm. L. seeligeri tạo ra vùng phân giải huyết b yếu. L. ivanovii thường tạo ra các vùng vạch trong, rộng trong vùng phân giải huyết b. Đặt các đĩa vào vùng rọi sáng để so sánh các chủng xét nghiệm với chủng chuẩn.
9.5.1.2. Phản ứng phân giải huyết cũng có thể được thực hiện bằng phép thử CAMP (9.5.3) hoặc bằng cách sử dụng các tế bào huyết cầu trong huyền phù như sau đây. Hoà một khuẩn lạc vào 150 ml TSYEB (B.5); ủ 2 giờ ở 37 °C. Thêm 150 ml huyền phù huyết cừu (B.12). Ủ 15 phút đến 60 phút ở 37 °C, rồi để khoảng 2 giờ trong tủ lạnh ở 3 °C ± 2 °C. Kiểm tra sự có mặt hay không có mặt của phần giải huyết b. Nếu không xác định được phản ứng thì để tiếp đến 24 giờ ở 3 °C ± 2 °C.
9.5.2. Sử dụng hydrat cacbon
Sử dụng que cấy vòng (6.5) lấy dịch cấy thu được từ TSYEB (9.4.4) cấy vào từng ống canh thang hydrat cacbon (B.7). Nuôi ấm ở 37 °C đến 5 ngày. Các phản ứng dương tính (sinh axit) có màu tím đến vàng và phần lớn xảy ra trong vòng từ 24 giờ đến 48 giờ.
9.5.3. Phép thử CAMP
Ria cấy các chủng Staphylococcus aureus và Rhodococcus equi (B.9.4) thành những vạch đơn ngang đĩa thạch huyết cừu (B.6 hoặc B.9.3) sao cho hai vệt cấy này song song và cân đối nhau trên đĩa (xem hình 1). Vết cấy cần phải mảnh và đều. Điều này được thực hiện bằng cách giữ vòng cấy hoặc que cấy (6.5) vuông góc với mặt thạch.
Ria cấy chủng xét nghiệm đã chuẩn bị trong 9.4.1.2 theo cách tương tự, vuông góc với các vệt cấy trên sao cho chủng xét nghiệm và các chủng cho phản ứng không chạm nhau nhưng phải rất gần nhau, cách nhau từ 1 mm đến 2 mm. Một vài chủng xét nghiệm có thể được ria cấy trên cùng một đĩa thạch.
Đồng thời, ria cấy các chủng đối chứng L. monocytogenes, L. innocua và L. ivanivii. Nếu dùng thạch huyết cừu (B.6), thi nuôi ấm các đĩa ở 37 °C từ 18 giờ đến 24 giờ. Nếu dùng đĩa lớp kép (B.9.3) thì nuôi ấm các đĩa từ 12 giờ đến 18 giờ ở 37 °C.
Vùng phân giải huyết b ở điểm giao nhau của chủng xét nghiệm với mỗi chủng S.aureus và R.equi tăng lên thì được coi là phản ứng dương tính.
Phản ứng dương tính với R.equi cho thấy một quầng phân giải huyết rộng (5 mm đến 10 mm) "hình đầu mũi tên". Phản ứng được coi là âm tính nếu một quầng phân giải huyết nhỏ trải ra chỉ khoảng 1 mm ở điểm giao nhau của chủng xét nghiệm và vùng khuếch tán của chủng R.equi.
Phản ứng dương tính với S.aureus cho thấy như một vùng tròn nhỏ từ quầng phân giải huyết lan rộng hơn chỉ khoảng 3 mm đến 4 mm so với chủng xét nghiệm và nằm trong vùng phân giải huyết b yếu do sự phát triển của chủng S.aureus. Các vùng phân giải huyết b rộng không xuất hiện xung quanh vệt cấy của chủng S.aureus và L. monocytogenes.
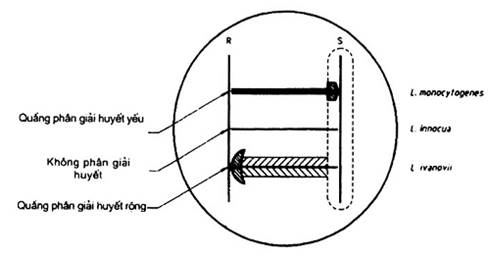
CHÚ THÍCH
1. Cấy các đĩa thạch huyết lớp mỏng (B.6 hoặc B.9.3) như trên biểu đồ. Các vạch thẳng đứng biểu thị các vật cấy của các chủng S.aureus (S) và R.equi (R). Các đường ngang biểu thị các vệt cấy của chủng xét nghiệm. Các vùng gạch chéo cho thấy các vị trí quầng phân giải huyết tăng lên.
2. Các vùng đánh dấu lấm chấm biểu thị vùng chịu ảnh hưởng của S.aureus.
Hình 1 - Cấy và diễn giải các đĩa thử CAMP
9.6. Diễn giải các đặc điểm hình thái, sinh lý và sinh hoá
Tất cả các chủng Listeria spp. đều là các trực khuẩn nhỏ, Gram dương di động (xem 9.4.4). Nếu qua phép rọi Henry, thì quan sát thấy chúng có màu xanh nhạt với bề mặt nổi hạt. Chúng thường dương tính với catalaza.
L. monocytogenes được phân biệt với các loài khác bằng các đặc trưng trong bảng 1.
9.7. Khẳng định cuối cùng
Các chủng được coi là L. monocytogenes (9.6) có thể đưọc gửi tới phòng thử nghiệm chuẩn Listeria đã được công nhận để khẳng định về huyết thanh học hoặc kiểu loại tiềm tan, nếu có thể hoặc sử dụng phương pháp định danh bằng sinh học phân tử tin cậy khác. Việc gửi đến phòng thử nghiệm phải kèm theo tất cả các thông tin có liên quan đến các chủng này.
Bảng 1 - Các phản ứng nhận dạng Listeria spp.
| Các loài | Phân giải huyết | Sinh axit | Thử CAMP | ||
| Ramnoza | Xyloza | S.aureus | R.equi | ||
| L.monocytogenes L. innocua L. ivanovii L. seeligeri L. welshimeri L. grayi | + - + (+) - - | + v - - v - | - - + + + - | + - - (+) - - | - - + - - - |
| v = phản ứng có thể thay đổi; (+) = phản ứng yếu; + => 90% phản ứng dương tính; - = không phản ứng | |||||
| CHÚ THÍCH Hiếm khi gặp các chủng L. monocytogenes không cho thấy phân giải huyết b hoặc phản ứng CAMP dương tính dưới các điều kiện quy định trong tiêu chuẩn này. | |||||
10. Biểu thị kết quả [xem TCVN 6404 (ISO 7218)]
10.1. Đếm khuẩn lạc L. monocytogenes
Tính số lượng a của các khuẩn lạc L. monocytogenes có mặt trong mỗi đĩa, theo công thức sau đây:
![]()
trong đó
b là số lượng khuẩn lạc phù hợp với các chuẩn cứ nhận dạng (9.6);
A là số khuẩn lạc trên đĩa được chọn để khẳng định (9.4.1.1);
C là tổng số khuẩn lạc đặc trưng đếm được trên đĩa (9.3.3);
Làm tròn kết quả đến số nguyên.
10.2. Phương pháp tính
10.2.1. Trường hợp các đĩa chứa ít hơn 150 khuẩn lạc L. monocytogenes, một trong số các đĩa chứa ít nhất 15 khuẩn lạc L. monocytogenes
Tính số lượng N của L. monocytogenes có mặt trong 1 ml hoặc 1 g sản phẩm, theo công thức sau đây:
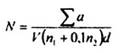
trong đó
Sa là tổng các khuẩn lạc L. monocytogenes tính được sau khi khẳng định, trên tất cả các đĩa được giữ lại từ hai độ pha loãng liên tiếp và trong đó ít nhất một dĩa có chứa ít nhất 15 khuẩn lạc.
V là thể tích dịch cấy trên mỗi đĩa, tính bằng mililit;
n1 là số đĩa được giữ lại ở độ pha loãng thứ nhất;
n2 là số đĩa được giữ tại ở độ pha loãng thứ hai;
d là hệ số pha loãng tương ứng với độ pha loãng thứ nhất được giữ lại.
Làm tròn số các kết quả thu được đến hai chữ số có nghĩa [xem TCVN 6404 (ISO 7218)].
Lấy kết quả số L. monocytogenes trong một mililit (sản phẩm dạng lỏng) hoặc gam (sản phẩm dạng khác) là số thích hợp giữa 1,0 và 9,9 nhân với lũy thừa tương ứng của 10.
CHÚ THÍCH Ví dụ, xem TCVN 6404 (ISO 7218).
10.2.2. Ước tính số lượng nhỏ các khuẩn lạc
10.2.2.1. Nếu hai đĩa huyền phù ban đầu của mẫu thử, chứa ít hơn 15 khuẩn lạc L. monocytogenes, thì tính số lượng các khuẩn lạc đã khẳng định trên mỗi đĩa, sử dụng công thức trong 10.1. Tính giá trị trung bình y của các khuẩn lạc đếm được trên hai đĩa.
Biểu thị kết quả như sau:
- số lượng ước tính L. monocytogenes có trong một gam hoặc một mililit
trong đó
d là hệ số pha loãng của huyền phù ban đầu;
V là thể tích dịch cấy đã cấy trên mỗi đĩa, tính bằng mililit;
10.2.2.2 Nếu hai đĩa huyền phù ban đầu của mẫu thử không chứa khuẩn lạc nào, thì biểu thị kết quả như sau:
- ít hơn L. monocytogenes trong mililit hoăc trong gam sản phẩm.
trong đó
d là hệ số pha loãng của huyền phù ban đầu;
V là thể tích dịch cấy đã cấy lên mỗi đĩa, tính bằng mililit;
11. Độ chụm
Xem TCVN 6404 (ISO 7218).
12. Kiểm soát chất lượng môi trường cấy
Do chưa có tiêu chuẩn chung nào qui định về vấn đề này, nên thực hiện việc kiểm tra khả năng của môi trường nuôi cấy L. monocytogenes chọn lọc như sau: Cho dịch pha loãng của dịch cấy đối chứng của các chủng L. monocytogenes vừa tách xong và các chủng kiểm chứng âm tính (ví dụ: lactobacilli, Streptococcus) vào bình cầu kiểm chứng đựng môi trường tăng sinh chọn lọc ban đầu (xem 9.2). Cho vào mỗi bình cầu từ 10 tế bào đến 100 tế bào L. monocytogenes hoặc các chủng kiểm chứng âm tính.
Thục hiện với các bình kiểm chứng giống như đối với các chủng xét nghiệm để chứng minh rằng đã thu hồi lại đưạc chủng kiểm chứng dương tính.
13. Báo cáo thử nghiệm
Báo cáo thử nghiệm phải ghi rõ phương pháp đã sử dụng, nhiệt độ ủ và kết quả thu được. Báo cáo kết quả thử nghiệm cũng cần phải đề cập đến tất cả các chi tiết thao tác không qui định trong tiêu chuẩn này. hoặc được xem là tùy ý, cùng với mọi tình huống bất thường có thể ảnh hưởng đến kết quả.
Báo cáo thử nghiệm cũng bao gồm các thông tin cần thiết về việc nhận biết đầy đủ mẫu thử.
PHỤ LỤC A
(qui định)
Sơ đồ qui trình
PHỤ LỤC B
(qui định)
Thành phần và cách chuẩn bị môi trường và thuốc thử
B.1. Dung dịch đệm pepton
B.1.1. Thành phần
| Dịch thuỷ phân mô động vật bằng enzym | 10,0 g |
| Natri clorua (NaCI) | 5,0 g |
| Dinatri hydro phosphat ngậm mười hai phân tử nước (Na2HPO412H2O) | 9,0 g |
| Kali dihydro phosphat (KH2PO4) | 1,5 g |
| Nước | 1 000 ml |
B.1.2. Chuẩn bị
Hoà tan các thành phần trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH [sử dụng máy đo pH (6.7)], sao cho sau khi khử trùng là 7,0 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường vào các bình cầu (6.8) có dung tích thích hợp để thu được các lượng cần thiết cho phép thử (xem 9.1).
Khử trùng 15 phút trong nồi hấp áp lực (6.1) ở nhiệt độ 121 °C.
B.2. Môi trường cơ bản đối với canh thang nửa Fraser có sắt (III) amoni xitrat [xem TCVN 7700-1 (ISO 11290-1)]
B.2.1. Môi trường cơ bản đối vái canh thang nửa Fraser
| Dịch thuỷ phân mô động vật bằng enzym | 5,0 g |
| Dịch thuỷ phân casein bằng enzym | 5,0 g |
| Cao thịt | 5,0 g |
| Cao men | 5,0 g |
| Natri clorua (NaCI) | 20,0 g |
| Dinatri hydro phosphat ngậm hai phân tử nước (Na2HPO42H2O) | 12,0 g |
| Kali dihydro phosphat (KH2PO4) | 1,35 g |
| Aesculin | 1,0 g |
| Nước | 1 000 ml |
B.2.1.2. Chuẩn bị
Hoà tan các thành phần hoặc môi trường cơ bản hoàn chỉnh khô trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH, sao cho sau khi khử trùng là 7.2 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường vào các bình cầu (6.8) có dung tích thích hợp để thu được các lượng cần thiết cho phép thử (xem 9.1).
Khử trùng 15 phút trong nồi hấp áp lực (6.1) ở nhiệt độ 121 °C.
B.2.2. Dung dịch sắt (III) amoni xitrat
B.2.2.1. Thành phần
| Sắt (III) amoni xitrat | 5,0 g |
| Nước | 100 ml |
B.2.2.2. Chuẩn bị
Hoà tan sắt (III) amoni xitrat trong nước.
Khử trùng bằng cách lọc.
B.2.3. Chuẩn bị môi trường
Ngay trước khi sử dụng, cho 1,0 ml sắt (III) amoni xitrat (B.2.2) vào mỗi phần 100 ml môi trường cơ bản đối với canh thang nửa Fraser (B.2.1).
B.3. Thạch Listeria theo Ottaviani và Agosti (ALOA[5]))
B.3.1 Môi trường cơ bản
B.3.1.1 Thành phần
| Dịch thuỷ phân mô động vật bằng enzym | 18 g |
| Dịch thuỷ phân casein bằng enzym | 6g |
| Cao men | 10 g |
| Natri pyruvat | 2g |
| Glucoza | 2g |
| Magie glyxerolphosphat | 1 g |
| Magie sulfat (khan) | 0,5 g |
| Natri clorua (NaCI) | 5g |
| Liti clorua | 10 g |
| Dinatri hydro phosphat (khan) | 2,5 g |
| 5-bromo-4-cloro-3-indolyt-b-D-glucopyranosit | 0,05 g |
| Thạch | 12 g đến 18 g a |
| Nước | 930 ml b |
| a Tùy thuộc vào sức đông của thạch b 925 ml nếu sử dụng dung dịch amphoterixin B (xem B.3.5.2). | |
B.3.1.2. Chuẩn bị
Hoà tan các thành phần hoặc môi trường cơ bản hoàn chỉnh khô trong nuớc bằng cách đun sôi. Khử trùng 15 phút trong nồi hấp áp lực (6.1) ở nhiệt độ 121 °C.
Chỉnh pH, sao cho sau khi khử trùng là 7,2 ± 0,2 ở 25 °C, nếu cần.
B.3.2. Dung dịch axit nalidixic
| Muối natri của axit nalidixic | 0,02 g |
| Natri hydroxit (0,05 mol/l) | 5 ml |
Hòa tan muối natri của axit nalidixic trong 5 ml natri hydroxit và lọc để khử trùng.
B.3.3. Dung dịch xeftazidim
| Xeftazidim | 0,02 g |
| Nước | 5 ml |
Hòa tan xeftazidim trong 5 ml nước và lọc qua màng 0,45 mm để khử trùng.
B.3.4. Dung dịch polymyxin B
| Polymyxin B sulfat | 76 700 IU |
| Nước | 5 ml |
Hòa tan polymyxin B trong 5 ml nước và lọc qua màng 0,45 mm để khử trùng.
B.3.5. Kháng sinh bổ sung
B.3.5.1. Dung dịch xycloheximit
| Xycloheximit | 0,05 g |
| Etanol | 2,5 ml |
| Nước | 2,5 ml |
Hòa tan xycloheximit trong 2,5 ml etanol và sau đó thêm 2,5 ml nước. Lọc qua màng 0,45 mm để khử trùng.
B.3.5.2 Dung dịch amphoterixin B (làm dung dịch thay thế cho xycloheximit)
| Amphoterixin B | 0,01 g |
| HCI (1 mol/l) | 2,5 ml |
| Dimetylformamit (DMF) | 7,5 ml |
Hòa tan amphoterixin trong dung dịch HCI/DMF. Lọc qua màng 0,45 mm để khử trùng.
CẢNH BÁO - Dung dịch HCI/DMF rất độc, cần thận trọng khi sử dụng.
B.3.6. Dung dịch bổ sung
Hòa tan 2 g L-a-phosphatidylinositol (Sigma P 6636 [6])) trong 50 ml nước lạnh.
Khuấy khoảng 30 phút cho đến khi thu được dung dịch đồng nhất.
Khử trùng 15 phút trong nồi hấp áp lực ở nhiệt độ 121 °C và làm nguội đến khoảng nhiệt độ từ 48 °C đến 50 °C.
B.3.7. Môi trường hoàn chỉnh
B.3.7.1. Thành phần
| Môi trường cơ bản (B.3.1) | 930 mla |
| Dung dịch axit nalidixic (B.3.2) | 5 ml |
| Dung dịch xeftazidim (B.3.3) | 5 ml |
| Dung dịch polymyxin B (B.3.4) | 5 ml |
| Dung dịch xycloheximit (B.3.5.1) hoặc dung dịch amphoterixin B (B.3.5.2) | 10 ml |
| Dung dịch bổ sung (B.3.6) | 50 ml |
| a 925 ml nếu sử dụng dung dịch amphoterixin B. | |
B.3.7.2. Chuẩn bị
Cho các dung dịch trên vào môi trường cơ bản tan chảy đến 50 °C, trộn kỹ sau mỗi lần thêm.
pH của môi trường hoàn chỉnh phải là 7,2 ± 0,2 ở 25 °C.
Môi trường hoàn chỉnh phải mờ đục đồng đều.
B.3.7.3 Chuẩn bị các đĩa thạch
Cho vào mỗi đĩa Petri từ 15 ml đến 20 ml môi trường hoàn chỉnh vừa mới chuẩn bị, rồi để cho đông đặc
B.4. Môi trường nuôi cấy đặc: Thạch từ dịch chiết nấm men trypton dậu tương (TSYEA)
B.4.1 Thành phần
| Dịch thuỷ phân casein bằng enzym | 17,0 g |
| Dịch thuỷ phân đậu tương bằng enzym | 3,0 g |
| Natri clorua (NaCI) | 5,0 g |
| Dikali hydro phosphat (K2HPO4) | 2,5 g |
| D-Glucoza | 2,5 g |
| Cao men | 6 g |
| Thạch | 9 g đến 18 g 1) |
| Nước | 1 000 ml |
| 1) Tùy thuộc vào sức đông của thạch. | |
Hoà tan các thành phần hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun sôi.
Chỉnh pH, sao cho sau khi khử trùng là 7,3 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường này vào các ống nghiệm có dung tích thích hợp để có được các lượng cần thiết cho phép thử.
Khử trùng 15 phút trong nối hấp áp lực (6.1) ở nhiệt độ 121 °C.
Để yên trong tư thế nghiêng.
Để chuẩn bị các đĩa thạch, phân phối vào các đĩa Petri vô trùng với các lượng môi trường thích hợp cho phép thử. Để yên cho đông đặc.
CHÚ THÍCH Nếu thực hiện phép thử rọi Henry, thì lớp môi trường phải mỏng (khoảng 12 ml cho một đĩa có đường kính 90 mm).
B.5. Môi trường nuôi cấy lỏng: Canh thang từ dịch chiết nấm men trypton đậu tương (TSYEB)
B.5.1. Thành phần
| Dịch thuỷ phân casein bằng enzym | 17,0 g |
| Dịch thuỷ phân đậu tương bằng enzym | 3,0 g |
| Natri clorua (NaCI) | 5,0 g |
| Dikali hydro phosphat (K2HPO4) | 2,5 g |
| D-Glucoza | 2,5 g |
| Cao men | 6g |
| Nước | 1 000 ml |
B.5.2. Chuẩn bị
Hoà tan các thành phần hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun sôi, nếu cần.
Chỉnh pH, sao cho sau khi khử trùng là 7,3 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường này vào các ống nghiệm hoặc bình có dung tích thích hợp để có được các lượng cần thiết cho phép thử.
Khử trùng 15 phút trong nồi hấp áp lực (6.1) ở nhiệt độ 121 °C.
B.6. Thạch huyết cừu
B.6.1. Môi trường cơ bản
B.6.1.1. Thành phần
| Dịch thuỷ phân mô động vật bằng enzym | 15 g |
| Dịch thuỷ phân gan bằng enzym | 2,5 g |
| Cao men | 5g |
| Natri clorua (NaCI) | 5g |
| Thạch | 9 g đến 18 g 1) |
| Nước | 1 000 ml |
| 1) Tùy thuộc vào sức đông của thạch. | |
B.6.1.2. Chuẩn bị
Hoà tan các thành phần hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun sôi.
Chỉnh pH, sao cho sau khi khử trùng là 7,2 ± 0,2 ở 25 °c, nếu cần.
Phân phối môi trường này vào các bình có dung tích thích hợp để có được các lượng cần thiết cho phép thử.
Khử trùng 15 phút trong nỗi hấp áp lực (6.1) ở nhiệt độ 121 °C.
B.6.2. Môi trường hoàn chỉnh
B.6.2.1. Thành phần
| Môi trường cơ bản (B.6.1) | 100 ml |
| Huyết cừu đã khử fibrin | 5 ml đến 7 ml |
B.6.2.2 Chuẩn bị
Cho huyết cừu vào môi trường cơ bản đã làm nguội đến 47 °C. Trộn đều.
Phân phối môi trường này vào các đĩa Petri vô trùng với các lượng thích hợp cho phép thử. Để yên cho đông đặc.
B.7. Canh thang sử dụng cacbohydrat (ramnoza và xyloza)
B.7.1. Môi trường cơ bản
B.7.1.1. Thành phần
| Dịch thủy phân mô động vật bằng enzym | 10 g |
| Cao thịt | 1 g |
| Natri clorua (NaCI) | 5 g |
| Bromocresol tía | 0,02 g |
| Nước | 1 000 ml |
B.7.1.2 Chuẩn bị
Hoà tan các thành phần trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH, sao cho sau khi khử trùng là 6,8 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường này vào các ống nghiệm có dung tích thích hợp để có được các lượng cần thiết cho phép thử.
Khử trùng 15 phút trong nồi hấp áp lực ở nhiệt độ 121 °C.
B.7.2 Dung dịch hydrat cacbon
B.7.2.1 Thành phần
| Hydrat cacbon 1) | 5g |
| Nước | 100 ml |
| 1) L-Ramnosa hoặc D-xylosa |
|
B.7.2.2. Chuẩn bị
Hòa tan riêng rẽ từng hydrat cacbon vào 100 ml nước.
Lọc để khử trùng.
B.7.3. Môi trường hoàn chỉnh
Đối với từng loại hydrat cacbon, thêm xml dung dịch B.7.2 vào 9x ml môi trường cơ bản (B.7.1).
B.8. Môi trường thạch di động
B.8.1. Thành phần
| Dịch thuỷ phân casein bằng enzym | 20,0 g |
| Dịch thuỷ phân mô động vật bằng enzym | 6,1 g |
| Thạch | 3,5 g |
| Nước | 1 000 ml |
B.8.2 Chuẩn bị
Hoà tan các thành phần trong nước bằng cách đun sôi.
Chỉnh pH, sao cho sau khi khử trùng là 7,3 ± 0,2 ở 25 °C, nếu cần.
Phân phối môi trường này với các lượng 5 ml vào các ống nghiệm.
Khử trùng 15 phút trong nồi hấp áp lực ở nhiệt độ 121 °C.
B.9. Môi trường CAMP (Christie, Atkins, Munch-Paterson) và chủng xét nghiệm
Đối với phép thử này có thể sử dụng các đĩa thạch huyết cừu (B.6), nhưng tốt nhất là sử dụng các đĩa thạch hai lớp có lớp môi trường huyết cừu rất mỏng (xem B.9.3).
B.9.1. Môi trường cơ bản
Xem B.6.1.
B.9.2. Môi trưởng huyết cừu
Xem B.6.2.
B.9.3. Môi trường hoàn chỉnh
Phân phối môi trường cơ bản (B.9.1) vào các đĩa Petri vô trùng, với các lượng khoảng 12 ml cho mỗi đĩa Petri đường kính 90 mm, để yên cho đông đặc. Rót đều một lớp rất mỏng môi trường huyết cừu (B.9.2) với các lượng không lớn hơn 3 ml trên một đĩa. Để yên cho đông đặc.
Nếu cho môi trường huyết cừu vào các đĩa môi trường cơ bản đã chuẩn bị trước, thì có thể phải làm ấm các đĩa này 20 phút bằng cách đặt chúng vào tủ ấm để ở 37 °C trước khi rót lớp môi trường huyết cừu.
B.9.4 Các chủng phản ứng CAMP
Chủng phân giải huyết b của S.aureus (ví dụ: NCTC 1803 hoặc ATCC 25923), chủng R.equi (ví dụ: NCTC 1621 hoặc ATCC 6939) và chủng L. monocytogenes (ví dụ: NCTC 11994) cần phải qua phép thử CAMP. Không phải tất cả các chủng S. aureus và chủng L. monocytogenes đều thích hợp đối với phép thử CAMP.
Bảo quản các chất cấy gốc của S. aureus, R. equi, L. monocytogenes, L. innocua và L. ivanivii bằng cách nuôi cấy lên môi trường TSVEA (B.4) đổ nghiêng, nuôi ấm ở 37°C từ 24 giờ đến 28 giờ, hoặc cho đến khi thấy mọc và bảo quản trong tủ lạnh +3 °C ± 2 °C. Cấy truyền ít nhất một lần trong một tháng và khẳng định độ thuần khiết của chúng bằng cách ria cấy lên các đĩa thạch TSYEA (B.4).
B.10. Dung dịch hydro peroxit
Sử dụng dung dịch 3 % (m/m).
B.11. Dung dịch muối đệm phosphat (PBS) (tùy chọn)
B.11.1. Thành phần
| Dinatri hydro phosphat ngậm hai phân tử nước (Na2HPO4.2H2O) | 8,98 g |
| Natri dihydro phosphat (NaH2PO4) | 2,71 g |
| Natri clorua (NaCI) | 8,5 g |
| Nước | 1 000 ml |
B.11.2. Chuẩn bị
Hoà tan các thành phần trong nước.
Chỉnh pH, sao cho sau khi khử trùng là 7.2 ± 0,2 ở 25 °C, nếu cần.
Khử trùng 15 phút trong nồi hấp áp lực ở nhiệt độ 121 °C.
B.12. Huyền phù huyết cầu cừu (tùy chọn)
Giữ tế bào huyết cừu ở +3 °C ± 2 °C truớc khi sử dụng.
Trước khi sử dụng phải kiểm tra dấu hiệu phân giải huyết (bị đỏ) trong lớp huyết thanh phía trên.
Nếu không phân giải huyết, thì lấy 2 ml lớp tế bào đỏ phía dưới cho vào 98 ml dung dịch đệm PBS (B.11).
Nếu thấy xuất hiện phân giải huyết, thì hòa khoảng 4 ml lớp tế bào đỏ trong 10 ml dung dịch đệm PBS và trộn nhẹ, rồi ly tâm. Nếu thấy có lớp nổi phía trên màu đỏ chứng tỏ có sự phân giải huyết, thì không sử dụng nữa và loại bỏ huyền phù gốc này. Nếu không thì gạn lớp nổi phía trên và cho 2 ml huyền phù tế bào này vào 98 ml dung dịch đệm PBS.
Bảo quản huyền phù này đến 5 ngày ở +3 °C ± 2 °C. Nếu thấy xuất hiện phân giải huyết thì loại bỏ.
PHỤ LỤC C
(tham khảo)
Phép thử rọi Henry
Kiểm tra các đĩa, sử dụng nguồn ánh sáng trắng, đủ để rọi tốt các đĩa, rọi vào đáy đĩa một góc 45° (xem hình C.1). Khi được kiểm tra dưới ánh sáng truyền trệch góc này (rọi Henry) trực tiếp trên đĩa, thì các khuẩn lạc Listeria spp cho thấy có màu xanh nhạt và bề mặt nổi hạt.
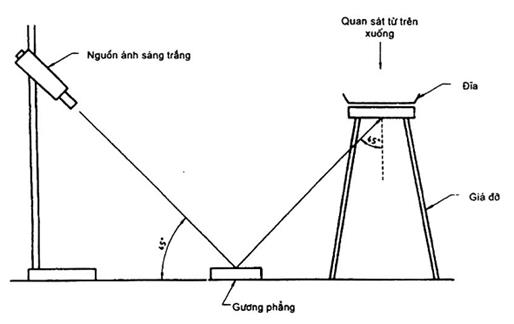
Hình C.1 - Kiểm tra các đĩa về khuẩn lạc nghi ngờ
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] LECLERCQ. A. Colonial atypical morphology and low recoveries of Listeria monocytogenes strains on Oxford, PALCAM, Rapid’L.mono and ALOA solid media. J. Microbiol. Methods 57, 2004, pp.251-258.
[1] Tại thời điểm ban hành ISO này, ISO 6887:1993 đang được soát xét và đến nay đã được ban hành.
[2] Đối với một mẫu đã cho có thể sử dụng cùng một bộ dàn mẫu, bằng cách bắt đầu với độ pha loãng cao hơn.
[3] Việc Kiểm tra này là không cần thiết nếu người phân tích thường xuyên phân tích phát hiện L.monocytogens.
[4] Vùng phân giải huyết b có thể nhìn thấy rõ hơn bằng cách chuyển bất kỳ một khuẩn lạc mọc trên bề mặt đĩa thạch xung quanh dịch cấy đánh dấu.
[5] ALOA là một ví dụ về môi trường thích hợp có bán sẵn. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và tổ chức ISO không ấn định phải sử dụng sản phẩm này. Có thể sử dụng các môi trường khác nếu chúng cho các kết quả tương đương.
[6] P6636 là tên thương mại của sản phẩm do hãng Sigma cung cấp. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và tổ chức ISO không ấn định phải sử dụng sản phẩm này. Có thể sử dụng sản phẩm khác nếu chúng cho các kết quả tương đương.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 7700-2:2007 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 7700-2:2007 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 7700-2:2007 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 7700-2:2007 DOC (Bản Word)