- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 8128:2015 ISO 11133:2014 Vi sinh vật trong thực phẩm, thức ăn chăn nuôi và nước-Chuẩn bị, sản xuất, bảo quản và thử hiệu năng của môi trường nuôi cấy
| Số hiệu: | TCVN 8128:2015 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Thực phẩm-Dược phẩm , Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
2015 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 8128:2015
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 8128:2015
TIÊU CHUẨN QUỐC GIA
TCVN 8128:2015
ISO 11133:2014
VI SINH VẬT TRONG THỰC PHẨM, THỨC ĂN CHĂN NUÔI VÀ NƯỚC - CHUẨN BỊ, SẢN XUẤT, BẢO QUẢN VÀ THỬ HIỆU NĂNG CỦA MÔI TRƯỜNG NUÔI CẤY
Microbiology of food, animal feed and water - Preparation, production, storage and performance testing of culture media
Lời nói đầu
TCVN 8128:2015 thay thế TCVN 8128-1:2009 và TCVN 8128-2:2009;
TCVN 8128:2015 hoàn toàn tương đương với ISO 11133:2014;
TCVN 8128:2015 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC/F13 Phương pháp phân tích và lấy mẫu biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Lời giới thiệu
Tại tất cả các phòng thử nghiệm thực hiện kiểm tra vi sinh, các mục tiêu chính là để duy trì, hồi sinh, phát triển, phát hiện và/hoặc định lượng các giống vi sinh vật. Môi trường nuôi cấy được sử dụng trong tất cả các kỹ thuật nuôi cấy vi sinh vật truyền thống và cũng dùng cho nhiều kỹ thuật thay thế khác. Nhiều công thức môi trường nuôi cấy có bán sẵn trên thị trường và được dùng cho các mục đích tăng trưởng đặc biệt, được mô tả trong các tài liệu.
Nhiều phép thử và nhiều quy trình phụ thuộc vào môi trường nuôi cấy có thể cho các kết quả hợp lý và tái lập. Các yêu cầu về môi trường nuôi cấy có thể đặc thù đối với mẫu và các sinh vật cần phát hiện. Do đó, môi trường nuôi cấy đáp ứng các tiêu chí quy định là điều kiện tiên quyết đối với mọi công việc về vi sinh. Thử nghiệm thích đáng phải được thực hiện để chứng minh:
a) sự chấp nhận của từng mẻ môi trường:
b) môi trường là “phù hợp cho mục đích”; và
c) môi trường có thể cho các kết quả phù hợp.
Ba tiêu chí trên là một phần thiết yếu của các quy trình kiểm soát chất lượng nội bộ, với các tài liệu thích hợp, sẽ cho phép giám sát hiệu quả môi trường nuôi cấy và góp phần vào việc cung cấp dữ liệu chính xác và đáng tin cậy. Đối với phép phân tích vi sinh vật đáng tin cậy thì điều cơ bản là sử dụng môi trường nuôi cấy có chất lượng đã được chứng minh. Đối với tất cả các môi trường quy định trong các phương pháp chuẩn, cần xác định các tiêu chí chấp nhận yêu cầu tối thiểu để đảm bảo độ tin cậy của môi trường. Khuyến cáo rằng trong phép xác định các đặc tính hiệu suất của môi trường nuôi cấy cần thực hiện các phép thử theo tiêu chuẩn này.
Việc thiết lập các tiêu chí hiệu suất tối thiểu được chấp nhận rộng rãi đối với môi trường nuôi cấy có thể dẫn đến sản phẩm có chất lượng phù hợp hơn và do đó làm giảm mức độ thử nghiệm cần thiết trong phòng thử nghiệm.
Ngoài ra, các tiêu chí chấp nhận bằng phương pháp quy định trong tiêu chuẩn này có thể được tất cả các phòng thử nghiệm vi sinh sử dụng để đánh giá tính hiệu quả, chọn lọc và/hoặc đặc tính chọn lọc của môi trường nuôi cấy.
Phân tích vi sinh vật trong thực phẩm, thức ăn chăn nuôi và nước, các yêu cầu của tiêu chuẩn này phải được ưu tiên trong việc đánh giá chất lượng của môi trường nuôi cấy.
VI SINH VẬT TRONG THỰC PHẨM, THỨC ĂN CHĂN NUÔI VÀ NƯỚC - CHUẨN BỊ, SẢN XUẤT, BẢO QUẢN VÀ THỬ HIỆU NĂNG CỦA MÔI TRƯỜNG NUÔI CẤY
Microbiology of food, animal feed and water - Preparation, production, storage and performance testing of culture media
1 Phạm vi áp dụng
Tiêu chuẩn này đưa ra các định nghĩa liên quan đến việc đảm bảo chất lượng của môi trường nuôi cấy và quy định các yêu cầu đối với việc chuẩn bị các môi trường nuôi cấy dùng để phân tích vi sinh vật trong thực phẩm, thức ăn chăn nuôi và các mẫu từ các môi trường sản xuất thực phẩm hoặc thức ăn chăn nuôi cũng như tất cả các loại nước sinh hoạt hoặc được sử dụng trong chế biến thực phẩm.
Các yêu cầu này có thể áp dụng để chuẩn bị tất cả các loại môi trường nuôi cấy sử dụng trong các phòng thử nghiệm thực hiện phân tích vi sinh vật.
Tiêu chuẩn này cũng đưa ra các tiêu chí và quy định các phương pháp để thử hiệu năng của môi trường nuôi cấy. Tiêu chuẩn này áp dụng cho các nhà sản xuất như:
- Các tổ chức thương mại sản xuất và/hoặc phân phối môi trường pha chế sẵn để sử dụng, môi trường hoàn chỉnh khô hoặc môi trường bán hoàn chỉnh;
- Các tổ chức phi thương mại cung cấp môi trường cho các bên thứ ba;
- Các phòng thử nghiệm vi sinh tự chuẩn bị môi trường nuôi cấy để sử dụng.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 6404 (ISO 7218), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Yêu cầu chung và hướng dẫn kiểm tra vi sinh vật.
TCVN 6507-1 (ISO 6887-1), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử, huyền phù ban đầu và các dung dịch pha loãng thập phân đã kiểm tra vi sinh vật - Phần 1: Các nguyên tắc chung để chuẩn bị huyền phù ban đầu và các dung dịch pha loãng thập phân.
TCVN 6507-2 (ISO 6887-2), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử, huyền phù ban đầu và các dung dịch pha loãng thập phân để kiểm tra vi sinh vật - Phần 2: Các nguyên tắc cụ thể để chuẩn bị các mẫu thịt và sản phẩm thịt.
TCVN 6507-3 (ISO 6887-3), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử, huyền phù ban đầu và các dung dịch pha loãng thập phân để kiểm tra vi sinh vật - Phần 3: Các nguyên tắc cụ thể để chuẩn bị các mẫu thủy sản và sản phẩm thủy sản.
TCVN 6507-4 (ISO 6887-4), Vi sinh vật trong thực phẩm về thức ăn chăn nuôi - Chuẩn bị mẫu thử, huyền phù ban đầu và các dung dịch pha loãng thập phân để kiểm tra vi sinh vật - Phần 4: Các nguyên tắc cụ thể để chuẩn bị các sản phẩm khác với sữa và sản phẩm sữa, thịt và sản phẩm thịt thủy sản và sản phẩm thủy sản.
TCVN 6507-5 (ISO 6887-5), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử, huyền phù ban đầu và dung dịch pha loãng thập phân để kiểm tra vi sinh vật - Phần 5: Các nguyên tắc cụ thể để chuẩn bị mẫu sữa và sản phẩm sữa.
TCVN 6507-6 (ISO 6887-6), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử, huyền phù ban đầu và dịch pha loãng thập phân để kiểm tra vi sinh vật - Phần 6: Các nguyên tắc cụ thể để chuẩn bị mẫu được lấy từ giai đoạn sản xuất ban đầu.
TCVN 9716 (ISO 8199), Chất lượng nước - Hướng dẫn chung về đếm vi sinh vật bằng nuôi cấy.
ISO 7704, Water quality - Evaluation of membrane filters used for microbiological analyses (Chất lượng nước - Đánh giá bộ lọc màng được sử dụng trong phân tích vi sinh).
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng các thuật ngữ và định nghĩa sau đây:
CHÚ THÍCH 1: Điều này cung cấp các định nghĩa chung liên quan đến đảm bảo chất lượng của môi trường nuôi cấy và cung cấp các thuật ngữ liên quan đến thực hiện thử nghiệm, môi trường nuôi cấy và vi sinh vật thử nghiệm.
CHÚ THÍCH 2: Các Bảng E.2 và F.2 đưa ra các giải thích về các thuật ngữ viết tắt tên gọi môi trường.
3.1 Thuật ngữ chung và định nghĩa
3.1.1
Kiểm soát chất lượng (quality control)
Một phần của quản lý chất lượng tập trung vào thực hiện các yêu cầu chất lượng.
CHÚ THÍCH 1: Xem Tài liệu tham khảo [1].
3.1.2
Mẻ môi trường nuôi cấy (batch of culture medium)
Lô môi trường nuôi cấy (lot of culture medium)
Đơn vị môi trường đồng nhất và hoàn toàn có thể truy xuất liên quan đến một lượng xác định của nguyên liệu, bán thành phẩm hoặc thành phẩm, đồng nhất về kiểu loại và chất lượng và được sản xuất trong một giai đoạn xác định, có cùng số mẻ (hoặc số lô) sản xuất.
3.1.3
Cơ chất tạo màu (chromogenic substrate)
Cơ chất phát huỳnh quang (fluorogenic substrate)
Cơ chất có chứa một nhóm chất màu/nhóm chất huỳnh quang và cơ chất để nuôi cấy được bởi vi khuẩn hoặc nấm.
CHÚ THÍCH 1: Sau khi tách cơ chất tạo màu/cơ chất phát huỳnh quang, chất màu/huỳnh quang được giải phóng và sản phẩm cuối cùng có màu/huỳnh quang có thể nhìn thấy được/có thể được phát hiện bằng cách sử dụng đèn cực tím (UV).
3.2 Thuật ngữ thử hiệu năng
3.2.1
Hiệu năng môi trường nuôi cấy (performance of culture media)
Sự đáp ứng của môi trường nuôi cấy đối với các vi sinh vật thử nghiệm trong các điều kiện xác định.
3.2.2
Vi sinh vật đích (target microorganism)
Vi sinh vật hoặc nhóm vi sinh vật cần được phát hiện hoặc định lượng.
3.2.3
Vi sinh vật không phải đích (non-target microorganism)
Vi sinh vật bị ức chế bởi môi trường và/hoặc điều kiện ủ hoặc không hiển thị các đặc trưng mong muốn của các vi sinh vật đích.
3.2.4
Hiệu suất của môi trường nuôi cấy (productivity of culture medium)
Mức thu hồi vi sinh vật đích từ môi trường nuôi cấy trong các điều kiện xác định.
3.2.5
Tính chọn lọc của môi trường nuôi cấy (selectivity of culture medium)
Mức độ ức chế các vi sinh vật không phải đích trên hoặc trong một môi trường nuôi cấy chọn lọc trong các điều kiện quy định.
3.2.6
Tính đặc thù của môi trường nuôi cấy (electivity of culture medium)
Tính đặc hiệu của môi trường nuôi cấy (speciticity of culture medium)
Trong các điều kiện xác định, các vi sinh vật không phải đích không hiển thị các đặc tính tương tự như vi sinh vật đích.
3.3 Thuật ngữ về môi trường nuôi cấy
3.3.1
Môi trường nuôi cấy (culture medium)
Sự tạo thành của các chất ở dạng lỏng, bán đặc hoặc dạng đặc, có chứa các thành phần tự nhiên và hoặc tổng hợp để giúp cho việc nhân lên (có hoặc không có sự ức chế một số vi sinh vật nhất định), nhận biết hoặc duy trì sự sống của các vi sinh vật.
CHÚ THÍCH: Khi được sử dụng cùng với các cụm từ khác thì thuật ngữ này thường gọi tắt là “môi trường” (ví dụ: môi trường tăng sinh).
3.3.2 Môi trường nuôi cấy phân loại theo thành phần
3.3.2.1
Môi trường xác định về hóa học (chemically defined medium)
Môi trường nuôi cấy chỉ bao gồm các thành phần hóa học xác định đã biết về cấu trúc phân tử và độ tinh khiết.
3.3.2.2
Môi trường không xác định hoặc môi trường không xác định một phần về hóa học (chemically undefined or partially undefined medium)
Môi trường nuôi cấy bao gồm toàn bộ hoặc một phần của nguyên liệu tự nhiên, đã chế biến hoặc cách khác, có thành phần hóa học chưa được xác định hoàn toàn.
CHÚ THÍCH 1: Các tên gọi đối với các thành phần không xác định về mặt hóa học được sử dụng trong môi trường nuôi cấy được quy định trong Phụ lục A.
3.3.2.3
Môi trường nuôi cấy sinh màu (chromogenic culture medium)
Môi trường nuôi cấy phát huỳnh quang (fluorogenic culture medium)
Môi trường nuôi cấy có chứa một hoặc nhiều cơ chất tạo màu/cơ chất phát huỳnh quang.
CHÚ THÍCH 1: Môi trường nuôi cấy sinh màu tạo thuận tiện cho việc nhận biết các vi khuẩn hoặc nấm bởi màu sắc xác định hoặc các đặc điểm hình thái (môi trường nuôi cấy phát triển điển hình). Môi trường nuôi cấy phát huỳnh quang yêu cầu quan sát dưới đèn UV. Các sản phẩm phản ứng sinh hóa cần thiết cho việc đánh giá môi trường nuôi cấy sinh màu/phát huỳnh quang, thường là kết quả hoạt động enzym của các sinh vật nhất định, phụ thuộc rất nhiều vào việc duy trì chính xác các điều kiện cụ thể (ví dụ như nhiệt độ, độ pH, nồng độ cơ chất).
3.3.2 Môi trường nuôi cấy được phân loại theo trạng thái vật lý
3.3.3.1
Môi trường lỏng (liquid medium)
Môi trường nuôi cấy bao gồm dung dịch hòa tan của một hoặc nhiều thành phần như nước pepton và canh thang dinh dưỡng.
CHÚ THÍCH 1: Trong một số trường hợp, các hạt rắn được cho vào môi trường nuôi cấy lỏng, như nước thịt.
CHÚ THÍCH 2: Môi trường dạng lỏng đựng trong các ống, bình hoặc chai thường được gọi là “canh thang”.
3.3.3.2
Môi trường đặc (solid medium)
Môi trường bán đặc (semi-solid medium)
Môi trường lỏng chứa các chất làm đông đặc (ví dụ: thạch, gelatin) ở các nồng độ khác nhau.
CHÚ THÍCH 1: Do môi trường agar-agar đông đặc được sử dụng rộng rãi, nên thuật ngữ rút ngắn “agar” (“thạch”) thường được sử dụng đồng nghĩa với môi trường đặc và liên quan đến “thạch đếm đĩa”.
CHÚ THÍCH 2: Môi trường đặc được rót vào các đĩa Petri thường được gọi là “thạch đếm đĩa”. Môi trường đặc được rót vào các ống hoặc chai nhỏ được giữ theo vị trí nghiêng để cho môi trường đông đặc lại được gọi là “thạch nghiêng” hoặc “dốc”. Nếu môi trường được phân phối vào đáy vật chứa, tạo thành “thạch đứng”.
3.3.3 Môi trường nuôi cấy được phân loại theo mục đích sử dụng
3.3.4.1
Môi trường vận chuyển (transport medium)
Môi trường được thiết kế để bảo tồn và duy trì khả năng sống của vi sinh vật trong khi vẫn giảm thiểu thời gian tính từ lúc thu thập mẫu đến khi xử lý mẫu trong phòng thử nghiệm.
VÍ DỤ: Môi trường vận chuyển Stuart hoặc Amies.
3.3.4.2
Môi trường bảo quản (preservation medium)
Môi trường được thiết kế để bảo tồn và duy trì sự tồn tại của các vi sinh vật trong một thời gian dài, nhằm bảo vệ các vi sinh vật chống lại những ảnh hưởng bất lợi có thể xảy ra trong thời gian bảo quản dài và cho phép phục hồi sau giai đoạn bảo quản.
VÍ DỤ: Môi trường trứng Dorset, thạch dinh dưỡng nghiêng.
3.3.4.3
Môi trường pha loãng (diluent medium)
Môi trường huyền phù (suspension medium)
Môi trường được thiết kế để tách các vi sinh vật từ sản phẩm thử nghiệm dạng đặc thành dạng lỏng và/hoặc làm giảm nồng độ bằng cách pha loãng mà không làm tăng hoặc làm ức chế vi sinh vật trong thời gian tiếp xúc.
VÍ DỤ: Dung dịch muối pepton.
3.3.4.4
Môi trường phục hồi (resuscitation medium)
Môi trường tạo điều kiện cho các vi sinh vật bị ức chế và bị hư hỏng có thể phục hồi và phát triển bình thường mà không cần thiết phải nhân lên.
VÍ DỤ: Nước đệm pepton.
CHÚ THÍCH 1: Môi trường phục hồi cũng có thể được sử dụng làm môi trường tăng sinh sơ bộ, ví dụ: nước đệm pepton.
3.3.4.5
Môi trường tăng sinh sơ bộ (pre-enrichment medium)
Môi trường tăng sinh (enrichment medium)
Môi trường dạng lỏng, có thành phần tạo điều kiện thuận lợi cho việc nhân lên các vi sinh vật.
VÍ DỤ: Canh thang trypton đậu tương.
3.3.4.5.1
Môi trường tăng sinh chọn lọc (selective enrichment medium)
Môi trường tăng sinh cho phép một số vi sinh vật nhân lên trong khi lại ức chế một phần hoặc hoàn toàn sự tăng trưởng của các vi sinh vật khác.
VÍ DỤ: Môi trường Rappaport-Vassiliadis pepton đậu tương (RVS).
3.3.4.5.2
Môi trường tăng sinh không chọn lọc (non-selective enrichment medium)
Môi trường tăng sinh cho phép nhiều loại vi sinh vật phát triển.
VÍ DỤ: Canh thang tim não.
3.3.4.6
Môi trường phân lập (isolation medium)
Môi trường đặc hoặc bán đặc cho phép các vi sinh vật phát triển.
3.3.4.6.1
Môi trường phân lập chọn lọc (selective isolation medium)
Môi trường phân lập cho phép phát triển các vi sinh vật đích cụ thể, trong khi lại ức chế hoàn toàn hoặc một phần các vi sinh vật khác.
VÍ DỤ: Thạch deoxycholat cefoperazon than cải biến (Thạch mCCD).
3.3.4.6.2
Môi trường phân lập không chọn lọc (non-selective isolation medium)
Môi trường phân lập không ức chế chọn lọc các vi sinh vật.
VÍ DỤ: Thạch dinh dưỡng.
3.3.4.6.3
Môi trường nuôi cấy chọn lọc sinh màu (chromogenic selective culture medium)
Môi trường nuôi cấy chọn lọc phát huỳnh quang (fluorogenic selective culture medium)
Môi trường nuôi cấy sinh màu/phát huỳnh quang cũng chứa các chất chọn lọc để ức chế hoàn toàn hoặc một phần đi kèm với hệ vi sinh vật có trong mẫu thử, do đó hỗ trợ cho việc phát hiện chính xác các vi sinh vật đích.
VÍ DỤ: Thạch TBX, môi trường MUG/EC.
3.3.4.7
Môi trường phân biệt (differential medium)
Môi trường đặc trưng (characterization medium)
Môi trường cho phép thử nghiệm một hoặc nhiều đặc tính sinh lý/sinh hóa của các vi sinh vật để nhận biết chúng.
VÍ DỤ: Thạch TBX, thạch Lactose với tergitol 7 và TTC.
CHÚ THÍCH 1: Các môi trường phân biệt có thể được sử dụng như môi trường phân lập được gọi là môi trường phân lập/phân biệt, ví dụ như thạch deoxychotat lysin xytose (XLD), thạch TTC lactose.
3.3.4.8
Môi trường nhận biết (identification medium)
Môi trường được thiết kế để tạo ra phản ứng nhận biết cụ thể mà thường không yêu cầu thêm bất kỳ phép thử khẳng định nào.
VÍ DỤ: Thạch mật azid aesculin.
3.3.4.9
Môi trường định lượng (enumeration medium)
Môi trường nuôi cấy chọn lọc hoặc không chọn lọc, cho phép định lượng các vi sinh vật.
VÍ DỤ: Thạch Baird-Parker, chất chiết nấm men.
CHÚ THÍCH 1: Môi trường định lượng có thể bao gồm các thuộc tính của môi trường tăng sinh và/hoặc phục hồi.
3.3.4.10
Môi trường khẳng định (confirmation medium)
Môi trường góp phần vào việc nhận biết hoặc xác định đặc trưng của vi sinh vật sau khi phục hồi sơ bộ và/hoặc tăng sinh và/hoặc phân lập.
VÍ DỤ: Thạch sắt Kligter.
3.3.4.11
Môi trường có chứa các chất trung hòa (medium containing neutralisers)
Môi trường vận chuyển, môi trường pha loãng hoặc môi trường nuôi cấy có chứa các chất trung hòa để làm bất hoạt chất tẩy rửa/ chất khử trùng hoặc các chất diệt sinh vật khác.
3.3.4.12
Môi trường sử dụng cho nhiều mục đích (medium having multiple uses)
Môi trường được phân vào một số mục khác nhau.
VÍ DỤ: Thạch máu là môi trường phục hồi theo 3.3.4 4, môi trường phân lập theo 3.4.4.6 và môi trường phân biệt theo 3.3.4.7 sử dụng để phát hiện tan máu. Nước đệm pepton là chất pha loãng theo 3.3.4.3 và môi trường tăng sinh sơ bộ theo 3.3 4.5.
3.3.4.13
Môi trường đối chứng (reference medium)
Môi trường, thường là không chọn lọc, để đánh giá so sánh về hiệu suất độc lập của môi trường cần thử nghiệm và được chứng minh là phù hợp cho việc sử dụng để kiểm soát.
VÍ DỤ: Thạch trypton đậu tương (TSA).
3.3.5 Môi trường nuôi cấy được phân loại theo phương pháp chuẩn bị
3.3.5.1
Môi trường để sử dụng ngay (ready-to-use medium)
Môi trường lỏng, đặc hoặc bán đặc được cung cấp trong các đĩa, chai lọ, ống nghiệm hoặc vật chứa khác, ở dạng để sử dụng ngay hoặc để sử dụng sau khi làm tan chảy hoặc để sử dụng ngay sau khi làm tan chảy và bổ sung.
3.3.5.1.1
Môi trường nuôi cấy hoàn chỉnh (finished culture medium)
Môi trường ở sẵn sàng để nuôi cấy.
3.3.5.1.2
Môi trường sử dụng ngay sau khi làm tan chảy lại (ready-to-use medium after remelting)
Môi trường cần làm tan chảy lại, ví dụ để sử dụng trong kỹ thuật đổ đĩa hoặc để rót vào các đĩa Petri.
3.3.5.1.3
Môi trường sử dụng ngay sau khi làm tan chảy lại và bổ sung (ready-to-use medium after remelting and supplementing)
Môi trường cần làm tan chảy lại, bổ sung và phân phối trước khi sử dụng (trước đó môi trường chưa sẵn sàng để sử dụng).
VÍ DỤ: Thạch sulfit xycloserin tryptose (TSC), thạch Baird-Parter hoặc thạch Fibrinogen huyết tương thỏ (RPF).
3.3.5.2
Môi trường được chuẩn bị từ các chế phẩm khô bán sẵn (medium prepared from commercially dehydrated formulations)
Môi trường ở dạng khô yêu cầu bù nước và xử lý trước khi sử dụng, ở một trong hai dạng sau:
- môi trường hoàn chỉnh;
- môi trường không hoàn chỉnh cần bổ sung trước khi sử dụng.
VÍ DỤ: Dạng bột, dạng hạt, sản phẩm đông khô.
3.3.5.3
Môi trường được chuẩn bị từ các thành phần riêng lẻ (medium prepared from individual component)
Môi trường được sản xuất bởi một phòng thử nghiệm vi sinh hoàn toàn từ các thành phần riêng lẻ.
3.4 Thuật ngữ về vi sinh vật thử nghiệm
3.4.1
Sinh vật thử nghiệm (test organism)
Vi sinh vật thường được sử dụng để thử hiệu năng của môi trường nuôi cấy.
CHÚ THÍCH 1: Sinh vật thử nghiệm được xác định tiếp theo nguồn của chúng (xem 3.4.2 đến 3.4.7).
3.4.2
Chủng đối chứng (reference strain)
Vi sinh vật thu được trực tiếp từ một bộ sưu tập chủng đối chứng, từ bộ sưu tập chủng của Liên đoàn thế giới các Bảo tàng giống vi sinh vật (WFCC) hoặc Tổ chức Bảo tàng giống vi sinh vật châu Âu (ECCO) và được xác định ít nhất đến mức chi và loài, được phân loại và mô tả theo đặc điểm của chúng và tốt nhất là có nguồn gốc từ thực phẩm, thức ăn chăn nuôi hoặc môi trường sản xuất thực phẩm hoặc thức ăn chăn nuôi hoặc nước.
3.4.3
Gốc đối chứng (reference stock)
Các giống riêng biệt giống hệt nhau thu được bằng cấy chuyền riêng rẽ từ chủng đối chứng trong phòng thử nghiệm hoặc có được từ một nhà cung cấp.
3.4.4
Giống gốc (stock culture)
Cấy chuyền từ gốc đối chứng.
3.4.5
Giống làm việc (working culture)
Cấy chuyền từ gốc đối chứng hoặc giống gốc hoặc chất đối chứng, đã được chứng nhận hoặc không.
3.4.6
Chất chuẩn (reference material)
RM
Vật liệu có chứa một lượng vi sinh vật có thể sống lại, đồng nhất và ổn định đối với số lượng vi sinh vật sống, đã được thiết lập là để phù hợp với mục đích sử dụng trong quá trình định lượng.
CHÚ THÍCH 1: Xem Tài liệu tham khảo [3].
3.4.7
Chất chuẩn đã được chứng nhận (certified reference material)
CRM
Chất chuẩn được định rõ đặc điểm bằng quy trình có hiệu lực về đo lường để định lượng các vi sinh vật sống, đi kèm giấy chứng nhận ghi rõ số lượng quy định của các vi sinh vật sống, với độ không đảm bảo đo và liên kết chuẩn đo lường.
CHÚ THÍCH 1: Xem Tài liệu tham khảo [3].
4 Quản lý đảm bảo chất lượng
4.1 Hệ thống tài liệu
4.1.1 Tài liệu từ nhà sản xuất hoặc người sản xuất
Nhà sản xuất (các tổ chức thương mại hoặc phi thương mại cung cấp môi trường cho bên thứ ba) cần có sẵn các tài liệu sau đây:
- tên môi trường, các thành phần riêng lẻ và các thành phần bổ sung bất kỳ, nếu có và các mã số sản phẩm;
- bảng dữ liệu kỹ thuật, ví dụ: công thức, mục đích sử dụng, lượng đổ đầy, nếu có;
- dữ liệu an toàn và/hoặc mối nguy khi cần.
- số mẻ;
- pH đích của môi trường hoàn chỉnh;
- thông tin bảo quản và hạn sử dụng;
- hạn sử dụng dự định;
- giấy chứng nhận kiểm soát chất lượng, các vi sinh vật thử nghiệm được sử dụng và các kết quả phép thử hiệu năng theo các tiêu chí chấp nhận.
4.1.2 Chấp nhận giao sản phẩm
Đối với mỗi mẻ sản phẩm (thành phần hoặc môi trường nuôi cấy), kiểm tra như sau:
- nhận biết sản phẩm;
- tính nguyên vẹn của bao gói;
- hạn dùng của sản phẩm;
- tài liệu được cung cấp.
- số lượng đơn vị nhận được
Ghi lại ngày nhận sản phẩm.
4.2 Bảo quản
4.2.1 Yêu cầu chung
Trong mọi trường hợp, phải tuân thủ các hướng dẫn của nhà sản xuất.
4.2.2 Quản lý chất lượng và kiểm soát sản phẩm môi trường khô và các thành phần bổ sung
Môi trường dạng bột khô hoặc dạng hạt đựng trong vật chứa có nắp đậy kín. Các chất bổ sung chọn lọc khác nhau hoặc các chất chẩn đoán được cung cấp ở trạng thái lỏng, bột hoặc đông khô. Việc đặt mua môi trường cần lập kế hoạch quay vòng định kỳ trong kho (nghĩa là vào trước-ra trước). Khi mở vật chứa mới cần:
- kiểm tra niêm phong;
- ghi ngày mở lần đầu tiên;
- nhìn để đánh giá lượng chứa trong hộp đã mở.
Sau khi mở hộp chứa mới, chất lượng của môi trường có thể phụ thuộc vào điều kiện bảo quản. Chất lượng môi trường khô bị giảm khi thấy có sự thay đổi đặc tính chảy của bột, tính đồng nhất, vón cục, đổi màu v.v... Môi trường khô đã hút ẩm hoặc thấy thay đổi nhiều về hình thức bên ngoài thì phải loại bỏ.
Khi mở chai đựng môi trường khô, ghi lại ngày tháng và nêu rõ thời gian bảo quản tối đa.
4.3 Chuẩn bị môi trường trong phòng thử nghiệm
4.3.1 Yêu cầu chung
Chuẩn bị chính xác môi trường nuôi cấy là một trong các bước cơ bản để đảm bảo tính toàn diện trong kiểm tra vi sinh vật và được chú ý đặc biệt.
Chú ý về thực hành tốt phòng thử nghiệm và các hướng dẫn của nhà sản xuất liên quan đến xử lý môi trường khô và các thành phần khác, đặc biệt các thành phần có chứa các vật liệu độc hại, nghĩa là muối mật, natri azid, chất kháng sinh hoặc các chất chọn lọc khác.
Khi môi trường được chuẩn bị từ các chế phẩm khô có bán sẵn, thì tuân thủ chính xác các hướng dẫn của nhà sản xuất. Ghi lại tất cả các dữ liệu liên quan, như khối lượng/thể tích, mã sản phẩm, số hiệu lô hàng, pH, ngày chuẩn bị, điều kiện khử trùng, người thực hiện.
Đối với môi trường được chuẩn bị từ các thành phần riêng lẻ, thực hiện chính xác theo công thức. Ghi lại tất cả mọi chi tiết và nhận biết đầy đủ (nghĩa là mã sản phẩm, số hiệu lô hàng và hạn sử dụng, nếu có sẵn) của tất cả các thành phần được sử dụng.
Phụ lục D nêu ví dụ về thông tin này.
4.3.2 Chất lượng của các thành phần môi trường cơ bản
Công thức của các thành phần môi trường cơ bản được quy định trong các tiêu chuẩn cụ thể (xem Thư mục tài liệu tham khảo). Khi sẵn có, nêu rõ khối lượng phân tử và số CAS1) của hóa chất trong công thức.
Trong một số trường hợp, thành phần cụ thể (ví dụ nêu dưới đây) được quy định trong công thức cần được điều chỉnh để có được môi trường ổn định và phù hợp.
- pepton và nước thịt hoặc chất chiết nấm men có thể thay đổi các đặc tính dinh dưỡng của chúng;
- thạch có thể thay đổi sức đông;
- các chất đệm;
- muối mật, chất chiết mật và deoxycolat, chất màu kháng khuẩn, phụ thuộc vào các đặc tính chọn lọc của chúng;
- chất chỉ thị màu;
- các chất kháng sinh, phụ thuộc vào hoạt tính và tương tác với các thành phần khác.
CHÚ THÍCH: Ở quy mô công nghiệp, các nhà sản xuất thường đưa ra công thức đã được tối ưu hóa để đáp ứng các tiêu chí thực hiện. Thông thường trước tiên là chọn các thành phần, sau đó điều chỉnh nồng độ giữa các sản phẩm để thu được cùng hiệu năng và giảm thiểu biến động giữa các mẻ.
4.3.3 Nước
Để chuẩn bị môi trường nuôi cấy, chỉ sử dụng nước tinh khiết như nước cất, đã khử khoáng, đã loại ion hoặc được sản xuất bằng thẩm thấu ngược hoặc nước có chất lượng tương đương không chứa các chất gây ức chế hoặc ảnh hưởng đến sự phát triển của vi sinh vật trong các điều kiện thử nghiệm, ví dụ: các vết clo, vết amoniac và các vết ion kim loại.
Nước tinh khiết phải được bảo quản trong vật chứa có nắp đậy kín làm bằng vật liệu trơ (thủy tinh trung tính, polyetylen v.v...) không chứa các chất gây ức chế. Tuy nhiên, sử dụng nước mới được chung cất.
Số lượng vi khuẩn không được vượt quá 103 đơn vị hình thành khuẩn lạc (cfu)/ml và tốt nhất là dưới 102 cfu/ml. Sự nhiễm khuẩn cần được kiểm soát định kỳ theo ISO 6222 [4], ủ ấm ở 22 °C ± 1 °C trong 68 h ± 4 h hoặc sử dụng phương pháp tương đương.
CHÚ THÍCH: Nước đã loại ion (đã khử khoáng) có thể chứa lượng vi sinh vật rất cao, do đó, chỉ sử dụng loại nước này khi kiểm tra hàm lượng vi sinh vật. Tham khảo tư vấn của nhà sản xuất để tìm biện pháp tốt nhất nhằm giảm thiểu nhiễm khuẩn. Nước đã khử khoáng bị nhiễm bẩn cao, thậm chí đã khử trùng bằng cách lọc, thì vẫn có thể còn chứa các chất mà có thể gây ức chế sự phát triển của các vi sinh vật nhất định.
Độ dẫn điện của nước được sử dụng trong phòng thử nghiệm không được lớn hơn 25 μS.cm-1 (tương đương với điện trở ≥ 0,04 MΩ.cm) và tốt nhất là dưới 5 μS.cm-1 [nước đạt chất lượng loại 3 quy định trong TCVN 4851 (ISO 3696) [5]] ở 25 °C, trừ khi có quy định khác. Độ dẫn điện của nước cần được kiểm tra trước khi sử dụng.
4.3.4 Cân và hoàn nước
Tuân thủ các cảnh báo về an toàn, cân cẩn thận một lượng cần thiết của môi trường khô hoặc các thành phần riêng lẻ và khuấy trộn với một lượng nước cần thiết để tránh vón cục. Dùng cân chính xác có sai số tối đa cho phép nhỏ hơn hoặc bằng 1 % như trong TCVN 6404 (ISO 7218) và TCVN 9716 (ISO 8199). Các thành phần phải được cho vào một lượng nước quy định, trừ khi có quy định khác.
4.3.5 Hòa tan và phân tán
Môi trường khô cần được phân tán nhanh bằng cách khuấy ngay và khuấy liên tục sau đó đun nóng để hòa tan, nếu cần. Môi trường chứa thạch cần được ngâm trong nước vài phút trước khi làm nóng, khuấy để hòa tan và sau đó phân phối vào vật chứa, nếu cần, trước khi hấp áp lực. Tránh để môi trường bị quá nhiệt.
4.3.6 Đo và chỉnh pH
Dùng máy đo pH để đo độ pH và chỉnh trước khi khử trùng, nếu cần, sao cho sau khi khử trùng và làm nguội đến 25 °C, môi trường có pH đạt yêu cầu ± 0,2 đơn vị pH, trừ khi có quy định khác. Thông thường sử dụng dung dịch natri hydroxit khoảng 40 g/l [c(NaOH) = 1 mol/l] hoặc axit clohydric loãng khoảng 36,5 g/l [c(HCI) = 1 mol/l] để điều chỉnh pH. Việc điều chỉnh này được thực hiện sau khi khử trùng, sử dụng dung dịch đã khử trùng. Việc chỉnh pH được nêu trong TCVN 6404 (ISO 7218) và TCVN 9716 (ISO 8199).
CHÚ THÍCH: Môi trường có bán sẵn thường cho thấy thay đổi pH trước và sau khi hấp áp lực khác nhau đáng kể. Tuy nhiên, nếu sử dụng nước cất hoặc nước đã khử khoáng, thì việc chỉnh pH trước khi hấp áp lực là không cần thiết.
4.3.7 Phân phối
Phân phối môi trường vào các vật chứa thích hợp, đảm bảo có khoảng trống phía trên để tránh quá sôi trong quá trình làm nguội sau khi xử lý nhiệt bằng hấp áp lực hoặc làm tan chảy lại hoặc làm tràn sau khi thêm các thành phần khác.
CHÚ THÍCH: Khoảng trống này có thể không cần thiết nếu áp lực trong nồi hấp được duy trì trong suốt quá trình làm nguội.
4.3.8 Khử trùng
4.3.8.1 Yêu cầu chung
Khử trùng môi trường nuôi cấy đã chuẩn bị trong ngày sử dụng.
Khử trùng môi trường nuôi cấy và thuốc thử bằng khử trùng ướt bằng nhiệt (4.3.7.2) hoặc bằng cách lọc (4.3.7.3).
Một số môi trường nhất định không cần hấp áp lực nhưng có thể được sử dụng sau khi đun sôi. Ví dụ: môi trường Enterobacteriaceae chứa xanh briliant thường đặc biệt nhạy với nhiệt và ánh sáng và cần được làm nguội nhanh sau khi đun sôi và bảo vệ tránh ánh sáng mạnh. Cũng tương tự, một số thuốc thử có thể được sử dụng mà không cần phải khử trùng. Trong mọi trường hợp, xem tiêu chuẩn thích hợp cụ thể hoặc hướng dẫn của nhà sản xuất.
4.3.8.2 Khử trùng bằng nhiệt ẩm
Việc khử trùng bằng nhiệt ẩm được thực hiện trong nồi hấp áp lực hoặc máy chuẩn bị môi trường.
Đối với các vật chứa môi trường với thể tích lớn hơn 1 000 ml, chấp nhận chu kỳ khử trùng của nồi hấp áp lực để đảm bảo xử lý nhiệt đầy đủ. Trong mọi trường hợp, tuân thủ các hướng dẫn nêu trong tiêu chuẩn cụ thể hoặc theo hướng dẫn của nhà sản xuất.
CHÚ THÍCH: Việc quá nhiệt cục bộ có thể xuất hiện khi hấp áp lực môi trường với thể tích lớn (> 1 000 ml).
Sau khi gia nhiệt cần làm nguội môi trường tránh để trào. Điều này đặc biệt quan trọng đối với môi trường có thể tích lớn và đối với các môi trường có các thành phần nhạy cảm với nhiệt, ví dụ: môi trường chứa lục sáng.
Thông tin bổ sung về khử trùng bằng nhiệt ẩm được nêu trong TCVN 6404 (ISO 7218) [11].
Việc khử trùng bằng nhiệt cần được đánh giá sử dụng các giá trị F0, có tính đến việc xử lý nhiệt trong suốt quá trình gia nhiệt và làm nguội. Việc xử lý nhiệt cần được xác định cho từng mẻ cụ thể, để đảm bảo xử lý thích hợp các vật chứa ở bất kỳ vị trí nào trong nồi hấp áp lực.
4.3.8.3 Khử trùng bằng cách lọc
Khử trùng bằng cách lọc có thể được thực hiện trong các điều kiện chân không hoặc giảm áp suất. Sử dụng thiết bị và các màng lọc vô trùng có cỡ lỗ 0,2 μm. Khử trùng các bộ phận khác nhau của thiết bị lọc theo TCVN 6404 (ISO 7218) hoặc TCVN 9716 (ISO 8199) hoặc sử dụng dụng cụ đã khử trùng trước.
Một số màng lọc có thể giữ lại các protein hoặc các chất khác (như kháng sinh). Để thu được nồng độ đúng, người sử dụng cần chọn kiểu màng lọc thích hợp, ví dụ: màng liên kết protein thấp và bộ lọc đã được làm ướt sơ bộ.
4.3.8.4 Chuẩn bị các chất bổ sung
CẢNH BÁO - Các chất bổ sung có chứa các chất độc, đặc biệt là các chất kháng sinh, cần được xử lý cẩn thận để tránh phân tán vào bột có thể gây dị ứng hoặc các phản ứng cho nhân viên phòng thử nghiệm. Thực hiện các biện pháp phòng ngừa thích hợp và tuân thủ các hướng dẫn của nhà sản xuất khi pha chế các dung dịch.
Không sử dụng các chất bổ sung được pha chế đã hết hạn sử dụng, đối với các dung dịch làm việc của các chất kháng sinh chỉ sử dụng trong ngày chuẩn bị. Trong những tình huống nhất định, các dung dịch kháng sinh có thể được bảo quản đông lạnh với các lượng thích hợp nhưng không cấp đông lại sau khi rã đông. Khả năng giảm hoạt tính do đông lạnh cần được nhà sản xuất thiết lập hoặc được người sử dụng kiểm tra.
4.4 Bảo quản và hạn sử dụng môi trường đã chuẩn bị
4.4.1 Môi trường sử dụng ngay có bán sẵn trên thị trường
Tuân thủ các hướng dẫn của nhà sản xuất về các điều kiện bảo quản, hạn sử dụng và cách sử dụng.
4.4.2 Môi trường được chuẩn bị trong phòng thử nghiệm
4.4.2.1 Yêu cầu chung
Nhận biết tất cả các môi trường để đảm bảo truy xuất được nguồn gốc.
Các môi trường có thời hạn sử dụng là khác nhau. Trong các tiêu chuẩn riêng sẽ quy định các điều kiện cụ thể và thời hạn sử dụng của từng loại môi trường nhưng phòng thử nghiệm phải thẩm định các đều kiện đó. Phòng thử nghiệm phải quy định tần suất kiểm tra xác nhận.
Bảo quản môi trường ở các điều kiện không làm thay đổi thành phần môi trường, tránh ánh sáng và tránh bị khô. Bảo quản ở 5 °C ± 3 °C, nếu không sử dụng ngay hoặc theo quy định khác trong tiêu chuẩn cụ thể.
Nếu được bảo quản lạnh, thì không nên bảo quản quá 2 tuần đến 4 tuần đối với đĩa và đối với các ống hoặc lọ nhỏ thì không quá 3 tháng đến 6 tháng, trừ khi có quy định trong các tiêu chuẩn cụ thể hoặc các kết quả kiểm tra xác nhận thời hạn sử dụng của phòng thử nghiệm cho thấy lâu hơn. Thông tin bổ sung về thời hạn bảo quản tối đa đối với môi trường pha chế sẵn được nêu trong TCVN 9716 (ISO 8199), Tài liệu tham khảo [17] và [21].
Khuyến cáo, môi trường được bổ sung các thành phần không ổn định thì cần được sử dụng trong ngày, trừ khi có quy định trong các tiêu chuẩn cụ thể hoặc các kết quả kiểm tra xác nhận thời hạn sử dụng của phòng thử nghiệm cho thấy lâu hơn (4.4.2.2). Môi trường đặc có chứa các chất không ổn định và/hoặc các chất hoạt hóa để tan chảy lại không nên bảo quản với lượng lớn.
Trước khi sử dụng hoặc trước khi làm nóng tiếp, nên cân bằng nhiệt độ môi trường nuôi cấy đến nhiệt độ môi trường xung quanh.
4.4.2.2 Đánh giá hạn sử dụng
Hạn sử dụng đối với môi trường nuôi cấy đã được bảo quản phải được thiết lập bằng cách kiểm tra môi trường sau khoảng thời gian bảo quản xác định về các đặc tính vật lý, hóa học và vi sinh vật theo quy định trong tiêu chuẩn này. Phòng thử nghiệm phải quy định tần xuất kiểm tra xác nhận.
Kiểm tra sự thay đổi bất kỳ về màu sắc, dấu hiệu bay hơi/mất nước, thay đổi pH hoặc hiệu suất hoặc tính chọn lọc và tính đặc hiệu khi có thể. Hạn sử dụng phải dựa vào thời gian bảo quản mà môi trường vẫn giữ được các tính năng quy định.
CHÚ THÍCH: Việc kiểm tra này cũng thích hợp khi thử kiểm tra các môi trường bán sẵn.
4.4.2.3 Bảo quản môi trường trong đĩa Petri
Sử dụng ngay môi trường đông đặc hoặc bảo quản trong các điều kiện không làm thành phần của môi trường bị biến đổi và mất nước, nghĩa là để ở nơi tối và/hoặc trong tủ lạnh ở 5 °C ± 3 °C. Dán nhãn trên đáy hoặc mặt bên của đĩa điền ngày tháng chuẩn bị và/hoặc hạn sử dụng và cách nhận biết. Cách khác, có thể sử dụng các hệ thống mã hóa đáp ứng được các yêu cầu này.
Hạn sử dụng của các đĩa thạch sẽ tăng lên nếu được bảo quản trong các túi bằng chất dẻo hoặc cellophan hàn kín. Để giảm thiểu ngưng tụ nước, thì cần làm mát các đĩa trước khi cho vào túi. Không làm khô bề mặt các đĩa thạch trước khi bảo quản lạnh.
4.5 Chuẩn bị để sử dụng
4.5.1 Làm tan chảy môi trường thạch nuôi cấy
Làm tan chảy môi trường nuôi cấy bằng cách đặt trong nồi cách thủy hoặc bằng cách khác cho kết quả tương tự [ví dụ: dòng hơi qua hấp áp lực như quy định trong TCVN 6404 (ISO 7218) hoặc TCVN 9716 (ISO 8199)]. Môi trường trước đó đã được hấp áp lực cần được làm nóng lại trong một thời gian tối thiểu để duy trì chất lượng môi trường. Tránh quá nhiệt và khi đã tan chảy thì lấy môi trường ra. Để ở nhiệt độ phòng trong khoảng thời gian ngắn, ví dụ: 2 min, trước khi đặt vào nồi cách thủy để làm nguội, không làm thủy tinh bị vỡ. Cần nới lỏng nắp đậy trước khi gia nhiệt và vặn chặt trước khi đưa ra khỏi nguồn nhiệt.
Làm nguội môi trường tan chảy duy trì từ 47 °C đến 50 °C trong nồi cách thủy kiểm soát được nhiệt độ. Thời gian thực tế cần thiết để đạt được 47 °C đến 50 °C phụ thuộc vào loại môi trường, thể tích và số lượng đơn vị để trong nồi cách thủy. Môi trường đã tan chảy thì sử dụng càng sớm càng tốt, nhưng không nên để quá 4 h. Trường hợp môi trường đặc biệt nhạy cảm, thì thời gian giữ môi trường tan chảy phải ngắn hơn, theo quy định trong tiêu chuẩn cụ thể liên quan. Môi trường tan chảy chưa sử dụng không được làm đông đặc lại để sử dụng cho lần sau.
Thiết lập và ghi thành văn bản chế độ điều chỉnh thạch bằng cách cài đặt nhiệt kế trong môi trường thạch trong hộp chứa riêng tương tự như được sử dụng cho môi trường thử nghiệm. Điều này phụ thuộc vào số lượng và kích thước vật chứa đặt vào nồi cách thủy.
CHÚ THÍCH: Môi trường được sử dụng trong phương pháp đổ đĩa, được bổ sung vào mẫu cần được chỉnh đến 44 °C đến 47 °C, hoặc theo quy định trong tiêu chuẩn liên quan. Sử dụng nồi cách thủy cài đặt ở 44 °C đến 47 °C. Thông tin bổ sung về sử dụng và kiểm tra nồi cách thủy được nêu trong TCVN 6404 (ISO 7218).
4.5.2 Loại khí môi trường nuôi cấy
Để có hàm lượng chính xác không khí/oxy, nếu cần, ngay trước khi sử dụng, làm nóng môi trường trong nồi cách thủy đun sôi hoặc dưới dòng hơi nước 15 min, nới lỏng nắp; sau khi làm nóng, vặn chặt nắp và làm nguội nhanh đến nhiệt độ làm việc.
4.5.3 Thêm chất bổ sung
Các thành phần không bền nhiệt cần được bổ sung vào môi trường sau khi đã làm nguội đến dưới 50 °C. Nếu môi trường chứa thạch, để cho chất bổ sung vô trùng cân bằng đến nhiệt độ phòng trước khi bổ sung vào môi trường thạch. Việc thêm các chất bổ sung lạnh dạng lỏng có thể làm cho thạch đông lại hoặc tạo thành các lớp vảy trong suốt làm cho phân bố không đúng. Cần thực hiện theo đúng hướng dẫn của nhà sản xuất. Nhẹ nhàng trộn kỹ tất cả các thành phần vào môi trường và phân phối vào các hộp chứa cuối cùng càng nhanh càng tốt.
4.5.4 Chuẩn bị môi trường đặc trong các đĩa Petri
Rót môi trường thạch nuôi cấy đã tan chảy vào các đĩa Petri sao cho thu được một lớp dày ít nhất là 3 mm (đối với các đĩa có đường kính 90 mm, 18 ml đến 20 ml thạch thường là đủ) hoặc theo quy định trong tiêu chuẩn liên quan. Nếu các đĩa được bảo quản hoặc nếu ủ ẩm quá 72 h, hoặc nhiệt độ ủ trên 40 °C, thì cần đến một lượng môi trường nuôi cấy lớn hơn. Để thạch nguội và đông đặc lại bằng cách đặt các đĩa cùng với nắp trên mặt phẳng nằm ngang, ở nơi mát.
Các đĩa môi trường nuôi cấy đã chuẩn bị sẵn để sử dụng ngay cần được bảo quản và sử dụng theo hướng dẫn của nhà sản xuất.
4.5.5 Chuẩn bị môi trường đổ đĩa để nuôi cấy
Để nuôi cấy bề mặt môi trường đặc, thì cần làm khô nhanh các đĩa ngay trước khi sử dụng, cho đến khi không còn các giọt nước trên bề mặt môi trường. Không làm quá khô bề mặt thạch.
Để làm khô các đĩa, các điểm sau đây rất quan trọng;
- Độ ẩm của môi trường nuôi cấy là quan trọng vì việc phát triển tối ưu vi khuẩn phụ thuộc vào các điều kiện ẩm trong và trên môi trường. Ví dụ việc thất thoát quá nhiều nước có thể dẫn đến tăng nồng độ các chất gây ức chế trong môi trường nuôi cấy chọn lọc và giảm hoạt độ nước trên bề mặt môi trường.
- Khi vi khuẩn được nuôi cấy không lan nhanh và các đĩa khô do thời tiết thì không cần phải làm khô. Trong trường hợp này, có thể bỏ qua quy trình sấy vì chỉ làm tăng khả năng nhiễm bẩn và thất thoát nước không cần thiết.
- Chọn nhiệt độ và thời gian làm khô sao cho môi trường càng ít bị nhiễm bẩn càng tốt và việc gia nhiệt không ảnh hưởng đến chất lượng môi trường nuôi cấy. Thời gian làm khô phụ thuộc vào mức độ ngưng tụ nước trong đĩa Petri, nhưng phải càng ngắn càng tốt.
- Để tránh nhiễm bẩn và nếu các đĩa không làm khô trong tủ sấy thì các đĩa phải được làm khô bằng cách úp ngược đĩa với bề mặt môi trường nuôi cấy lật úp.
Trong thực tế, các đĩa có thể được làm khô bằng cách đặt đĩa với bề mặt thạch lật úp và mở nắp một nửa và để trong tủ ở nhiệt độ từ 25 °C đến 50 °C. Làm khô các đĩa cho đến khi hết hẳn các giọt nước trên bề mặt nắp. Không làm khô thêm. Các đĩa thạch cũng có thể được làm khô với bề mặt thạch hướng lên trên để trong tủ cấy (ở nhiệt độ phòng) từ 30 min đến 60 min hoặc đậy nắp để qua đêm ở nhiệt độ phòng.
4.6 Ủ ấm môi trường đặc trong các đĩa Petri
Trong quá trình ủ ấm, môi trường thạch sẽ mất nước. Trong một số trường hợp, điều này có thể ảnh hưởng đến sự phát triển của các vi sinh vật. Các yếu tố ảnh hưởng đến sự mất nước là thành phần môi trường, lượng môi trường trong đĩa, kiểu tủ ấm có quạt hoặc kiểu khác, độ ẩm của không khí trong tủ ấm, vị trí và số lượng đĩa trong tủ ấm và nhiệt độ ủ. Có thể giảm thiểu việc mất nước bằng cách chồng sáu đĩa đặt vào túi chất dẻo mở miệng phía trên (để tránh ngưng tụ nhiều nước). Cách khác, có thể làm tăng độ ẩm của không khí trong tủ ấm bằng cách đặt hộp đựng nước ở phía dưới. Thường xuyên thay nước để tránh nhiễm nấm mốc.
4.7 Thải bỏ môi trường
Thải bỏ môi trường bị nhiễm bẩn và không sử dụng theo cách an toàn và đáp ứng được các quy định hiện hành.
5 Vi sinh vật thử nghiệm để thử hiệu năng
5.1 Yêu cầu chung
Các tiêu chuẩn mới hoặc đã được soát xét phải quy định rõ phép thử hiệu năng của môi trường nuôi cấy, bao gồm quy định về các chủng kiểm chứng và các tiêu chí chấp nhận, theo Phụ lục J.
5.2 Chọn vi sinh vật thử nghiệm
Bộ vi sinh vật thử nghiệm cần có các vi sinh vật có các đặc tính ổn định đại diện cho các loài và có thể tin cậy đối với việc thể hiện hiệu năng tối ưu của môi trường được phòng thử nghiệm chuẩn bị cụ thể. Các vi sinh vật thử nghiệm gồm các chủng có sẵn trong các bộ sưu tập giống đối chứng, nhưng cũng có thể bao gồm các chủng đặc trưng do phòng thử nghiệm phân lập. Các đặc trưng nuôi cấy liên quan của chủng gốc đối chứng cần được kiểm tra và được phòng thử nghiệm ghi lại hoặc chọn chủng mới nếu xuất hiện các đặc trưng không điển hình. Tốt nhất là sử dụng các chủng có nguồn gốc từ thực phẩm hoặc từ nước cho dù không phải tất cả các bộ sưu tập các chủng nuôi cấy đều cung cấp các dữ liệu đó về nguồn gốc xuất xứ của chúng.
Các đặc trưng về giống của gốc đối chứng liên quan phải được phòng thử nghiệm kiểm tra và ghi lại. Nếu có sự biến đổi về chủng, thì nghiên cứu các khả năng ảnh hưởng của môi trường nuôi cấy bằng cách thu thập cùng một môi trường từ các nhà sản xuất khác nhau và thu lấy các giống đối chứng bổ sung từ bộ sưu tập giống.
LƯU Ý: Người sử dụng cần phản hồi thông tin liên quan đến các biến đổi về chủng và hiệu năng.
Các vi sinh vật thử nghiệm đối với mỗi môi trường có thể bao gồm:
- các chủng dương tính mạnh với các đặc trưng điển hình của vi sinh vật đích;
- các chủng dương tính yếu;
- các chủng âm tính không cho thấy các đặc tính mong đợi của vi sinh vật đích (các đặc trưng âm tính);
- các chủng bị ức chế một phần hoặc hoàn toàn.
Phụ lục E đưa ra các vi sinh vật thử nghiệm được sử dụng trong các tiêu chuẩn vi sinh vật trong thực phẩm và Phụ lục F đưa ra các vi sinh vật thử nghiệm được sử dụng trong các tiêu chuẩn vi sinh vật trong nước.
CHÚ THÍCH: Một vài hạn chế của quốc gia và một vài hướng dẫn yêu cầu sử dụng các typ huyết thanh khác với các typ huyết thanh quy định trong các Bảng này. Nêu rõ các yêu cầu của quốc gia liên quan đến việc chọn các typ huyết thanh Salmonella.
5.3 Bảo quản và duy trì các vi sinh vật thử nghiệm
5.3.1 Yêu cầu chung
Hiện nay có sẵn một vài phương pháp bảo quản và duy trì thành công tất cả các vi sinh vật liên quan đến vi sinh vật trong thực phẩm và trong nước, ví dụ: đông khô, bảo quản các hạt ở □ 70 °C, hoặc sử dụng nitơ lỏng. Một phương pháp có thể không thích hợp cho tất cả các chủng. Các phương pháp bổ sung để bảo quản các vi sinh vật nêu trong [14], [15], [36], [37] và [38].
Số lượng vi sinh vật thử nghiệm được cấy chuyền cần được lập thành văn bản để ngăn ngừa cấy chuyền quá nhiều làm tăng nguy cơ biến đổi kiểu hình. Một lần cấy chuyền được xác định là chuyển từ giống vi sinh vật sống sang môi trường mới với sự phát triển của các vi sinh vật. Mọi kiểu cấy chuyền được coi là dạng cấy chuyển/chuyển sang. Thông tin bổ sung có trong [27], [28], [35], [38].
Xem sơ đồ trong B.1, B.2 và Phụ lục B về thông tin bổ sung để duy trì và chuẩn bị.
5.3.2 Vi sinh vật thử nghiệm từ các nguồn thương mại
Nếu các vi sinh vật thử nghiệm thu được từ các bộ sưu tập chuẩn hoặc các nhà cung cấp được cấp chứng chỉ ISO 9001 [2] hoặc chứng nhận thích hợp khác và được giữ trong các hộp đựng gốc, thì phải sử dụng và nuôi cấy theo hướng dẫn của nhà sản xuất.
Phòng thử nghiệm cần chắc chắn rằng chủng được cung cấp là chủng đối chứng hoặc gốc đối chứng và bao nhiêu lần cấy chuyền đã được thực hiện trước khi nhận và tài liệu về thông tin liên quan.
Phòng thử nghiệm cần kiểm tra sự có mặt các đặc tính mong đợi.
5.3.3 Chủng gốc đối chứng được chuẩn bị trong phòng thử nghiệm
Các giống gốc của các chủng đối chứng (xem Hình B.1) dùng cho các mục đích thử hiệu năng phải được duy trì và xử lý theo cách sao cho giảm thiểu khả năng nhiễm chéo, biến đổi hoặc thay đổi các tính chất điển hình. Các gốc đối chứng cần được bảo quản với các lượng nhỏ, thường được duy trì ở nhiệt độ đông lạnh sâu (ví dụ, dưới - 70 °C) hoặc đông khô. Ở nhiệt độ cao hơn thì thời gian sống có thể giảm và có sự biến đổi về di truyền.
Các đặc trưng phát triển của chúng cần được lập thành văn bản đầy đủ cho từng môi trường mà trên/trong đó các chủng này được sử dụng làm sinh vật thử nghiệm.
Các gốc đối chứng không được dùng để chuẩn bị các chủng đối chứng.
5.3.4 Giống gốc
Cấy giống gốc thường được chuẩn bị từ gốc đối chứng đông sâu hoặc đông khô (xem Hình B.2). Các lượng nhỏ phải được xử lý theo cách sao cho tránh được nhiễm bẩn chéo gốc đối chứng và/hoặc suy giảm chất lượng của chúng. Các giống gốc cần được chuẩn bị bằng cách hòa lại một lượng gốc đối chứng trong hoặc trên môi trường phát triển không chọn lọc và ủ để tạo ra giống pha tĩnh.
Xem 5.3.3 về các yêu cầu bảo quản và hồ sơ lưu trữ.
Đối với các hệ thống bảo quản có bán sẵn, cần tuân thủ nghiêm ngặt các hướng dẫn của nhà sản xuất.
Các giống gốc không được dùng để chuẩn bị các chủng đối chứng hoặc gốc đối chứng.
5.3.5 Giống làm việc
Các giống làm việc phải được chuẩn bị từ giống gốc hoặc gốc đối chứng và được sử dụng để chuẩn bị giống thử nghiệm.
Các giống làm việc không được dùng để chuẩn bị các chủng đối chứng, gốc đối chứng hoặc giống gốc hoặc tạo ra giống làm việc tiếp theo.
5.4 Vi sinh vật để thử hiệu năng
5.4.1 Yêu cầu chung
Các vi sinh vật thích hợp để thử hiệu năng thông thường được nêu trong các Phụ lục E và F.
Các thể tích dịch cấy và số lượng vi sinh vật được sử dụng, xem 5.4.2.4 và 5.4.2.5.
Hướng dẫn dưới đây là một ví dụ về quy trình thích hợp để tạo ra dịch cấy tiêu chuẩn để kiểm soát chất lượng môi trường. Các quy trình này được áp dụng trong trường hợp chung nhưng một số sinh vật có thể yêu cầu các điều kiện chuẩn bị đặc biệt, ví dụ: các sinh vật kị khí, ưa mặn, ưa thẩm thấu và các vi sinh vật có yêu cầu phát triển hoặc dinh dưỡng đặc biệt.
5.4.2 Chuẩn bị
5.4.2.1 Chuẩn bị giống gốc
Khi yêu cầu cấy gốc đối chứng vào môi trường đặc, ví dụ thạch trypton đậu tương (TSA) hoặc TSA máu, cấy sao cho thu được các khuẩn lạc mọc đơn lẻ. Ủ trong các điều kiện thích hợp, ví dụ: các vi khuẩn hiếu khí ở 37 °C trong khoảng từ 18 h đến 24 h.
Kiểm tra giống gốc trên môi trường đặc về độ thuần khiết và sử dụng trong khoảng thời gian quy định (ví dụ: 14 ngày ở nhiệt độ thích hợp để tránh làm thay đổi đáng kể vi sinh vật).
5.4.2.2 Chuẩn bị giống làm việc
Các giống làm việc phải được chuẩn bị từ gốc đối chứng (hoặc khi cần thì từ giống gốc) như giống pha tĩnh thuần khiết trong môi trường canh thang không chọn lọc. Đối với nhiều vi khuẩn hiếu khí thường thu được bằng cách ủ ấm 18 h đến 24 h.
Giống làm việc có thể được chuẩn bị từ chất chuẩn thương mại RM hoặc CRM hoặc được chuẩn bị trong phòng thử nghiệm. Nồng độ của huyền phù được chuẩn bị phải ổn định và đồng nhất trong suốt quá trình sử dụng [7], [10], [11], [21], [29] và [30].
Có thể sử dụng các kỹ thuật khác nhau, nhưng phải đảm bảo độ thuần của dịch cấy, cũng như sự chuẩn hóa để cho phép sử dụng về sau.
Tùy thuộc vào kích thước khuẩn lạc, lấy một đến hai khuẩn lạc từ môi trường giống gốc bằng vòng cấy. Nên sử dụng vòng cấy 1 μl để tránh lấy quá nhiều dịch cấy.
Chuyển dịch cấy lên môi trường lỏng không chọn lọc, ví dụ: canh thang trypton đậu tương (TSB) và trộn kỹ trên máy trộn vortex.
Ủ ấm trong các điều kiện và thời gian thích hợp (ví dụ: đối với phần lớn các vi khuẩn hiếu khí thường ủ ở 37 °C trong 18 h đến 24 h).
Sử dụng giống làm việc này trong khoảng thời gian quy định (ví dụ: tối đa ba ngày ở nhiệt độ thích hợp để tránh làm thay đổi đáng kể vi sinh vật).
Chuẩn bị và bảo quản các bào tử nấm và vi khuẩn dùng làm giống làm việc, xem [10], [11], [24], [25] và [30].
5.4.2.3 Chuẩn bị các huyền phù (dịch cấy) để thử nghiệm
Chuẩn bị các dãy dung dịch pha loãng trong các dịch pha loãng thích hợp (ví dụ: dung dịch Ringer nồng độ ¼, dung dịch muối pepton) và sử dụng bước pha loãng thích hợp nhất đối với số lượng vi sinh vật mong muốn (cfu) trong một thể tích quy định.
Dung dịch pha loãng thích hợp được sử dụng làm dịch cấy thử nghiệm cần được xác định từ các phép thử trước đó trong các điều kiện chuẩn hóa nghiêm ngặt đối với tất cả các bước.
Sử dụng các huyền phù (dịch cấy) trong thời gian quy định (ví dụ: đến 2 h ở nhiệt độ phòng hoặc trong 24 h nếu được bảo quản ở 5 °C ± 3 °C hoặc thời gian bảo quản lâu hơn nếu đã được đánh giá hiệu lực [10], [21]).
Có thể sử dụng dịch cấy đông lạnh nếu cho thấy vi sinh vật có thể sống trong thời gian được chọn.
5.4.2.4 Thể tích dịch cấy
Thể tích dịch cấy được sử dụng cho phép thử hiệu năng định lượng phải phản ánh được các dịch cấy sử dụng trong các điều kiện thử nghiệm đối với môi trường liên quan.
Đối với dịch pha loãng và môi trường lỏng được sử dụng cho phép thử định lượng, thì thể tích dịch cấy phải có cùng tỷ lệ với thể tích dịch cấy được sử dụng trong tiêu chuẩn liên quan, thường là 10 % môi trường cần thử.
5.4.2.5 Mức dịch cấy
5.4.2.5.1 Mức dịch cấy để thử hiệu suất
5.4.2.5.1.1 Phép thử định lượng
Đối với phép thử định lượng, thì mức ở khoảng 102 cfu là cần thiết để đạt được độ chụm đầy đủ (xem Bảng 1). Phép thử này có thể cần sử dụng nhiều hơn một đĩa kép.
Cần sử dụng dải thực tế từ 80 cfu đến 120 cfu trên đĩa với số đếm tối thiểu 50 cfu trên đĩa. Đối với các bộ lọc, số đếm cfu tương tự cần đến việc sử dụng một hoặc nhiều màng lọc. Bảng 1 cho thấy mức tin cậy 95 % liên quan đến số đếm khuẩn lạc.
Đối với các phép thử định lượng của dịch pha loãng và môi trường vận chuyển lỏng, thì mức dịch cấy ở khoảng 103 đến 104 cfu là cần thiết để đạt được dịch cấy ở khoảng 100 cfu trong thể tích được dàn trên đĩa.
Bảng 1 - Mức tin cậy 95 % đối với số lượng khuẩn lạc giả định thống nhất với phân bố Poisson[21], [26]
| Số lượng khuẩn lạc đếm được | Giới hạn độ chụm | Giới hạn tin cậy xấp xỉ 95 % |
| 500 | ± 9 | 455 đến 545 |
| 400 | ± 10 | 360 đến 440 |
| 320 | ± 11 | 284 đến 356 |
| 200 | ± 14 | 172 đến 228 |
| 100 | ± 20 | 80 đến 120 |
| 80 | ± 22 | 62 đến 98 |
| 50 | ± 28 | 36 đến 64 |
| 30 | ± 37 | 19 đến 41 |
| 20 | ± 47 | 11 đến 29 |
| 16 | ± 50 | 8 đến 24 |
| 10 | ± 60 | 4 đến 16 |
| 6 | ± 83 | 1 đến 11 |
5.4.2.5.1.2 Phép thử định tính
Thể tích được sử dụng cho phép thử cần chứa:
- 103 cfu đến 104 cfu cho các phép thử định tính môi trường đổ đĩa;
- ≤ 100 cfu cho các phép thử hiệu suất của các môi trường tăng sinh và tăng sinh sơ bộ;
- 104 cfu đến 106 cfu cho các phép thử định tính môi trường vận chuyển đặc.
5.4.2.5.2 Mức vi sinh vật trong dịch cấy đối với phép thử tính chọn lọc
Đối với các phép thử tính chọn lọc của môi trường nuôi cấy, nuôi cấy huyền phù vi sinh vật không phải đích có chứa từ 104 cfu đến 106 cfu lên đĩa thạch hoặc vào ống đựng môi trường.
5.4.2.5.3 Mức vi sinh vật trong dịch cấy đối với phép thử tính đặc hiệu
Đối với các phép thử định tính của môi trường đổ đĩa, về tính đặc hiệu cần đến 103 cfu đến 104 cfu.
5.4.2.6 Ủ
Ủ môi trường đã cấy theo các điều kiện quy định trong các tiêu chuẩn liên quan. Phụ lục E nêu các điều kiện ủ được sử dụng trong các tiêu chuẩn quy định đối với vi sinh vật trong thực phẩm và Phụ lục F nêu các điều kiện ủ được sử dụng trong các tiêu chuẩn quy định đối với vi sinh vật trong nước.
Tránh thất thoát nước trong môi trường thạch trong quá trình ủ, xem 4.6.
Cần sử dụng thời gian ủ ngắn nhất trong tiêu chuẩn được dùng đối với vi sinh vật đích, trong khi thời gian ủ cho phép lâu nhất cần được sử dụng khi xác định tính chọn lọc [10].
6 Kiểm soát chất lượng và thử hiệu năng của môi trường nuôi cấy
6.1 Yêu cầu chung
Các điều sau đây mô tả các yêu cầu đối với tất cả các môi trường nuôi cấy. Các yêu cầu này có thể áp dụng cho mọi cỡ mẻ môi trường nuôi cấy.
Thực tế, các mẫu có thể chứa các vi sinh vật bị ức chế. Tính phù hợp của môi trường liên quan đến độ phục hồi của các tế bào bị ức chế cần được tính đến [21], [31], [32], [33].
Chất lượng của môi trường nuôi cấy phụ thuộc vào chất lượng của các thành phần cơ bản, công thức đúng, chất lượng của quy trình chuẩn bị, việc loại trừ nhiễm khuẩn và các điều kiện bao gói và bảo quản.
Kiểm soát chất lượng môi trường nuôi cấy phải phù hợp với việc sử dụng của môi trường (ví dụ: định tính hoặc định lượng). Trước khi sử dụng, hiệu năng của từng mẻ môi trường nuôi cấy phải được thử nghiệm phân loại môi trường trong 6.4. Nếu không thể thực hiện phép thử trước khi sử dụng do tính không ổn định của môi trường hoặc bổ sung, thì phải thực hiện phép thử hiệu năng song song với việc thử nghiệm mẫu.
6.2 Kiểm soát chất lượng lý - hóa
Môi trường nuôi cấy hoàn chỉnh phải phù hợp về các tính chất lý-hóa như quy định trong tiêu chuẩn tương ứng. Ngoài ra, việc đánh giá chất lượng bằng kiểm tra cảm quan phải đảm bảo từng môi trường nuôi cấy đều đáp ứng được các yêu cầu quy định, ví dụ:
- lượng phân phối và/hoặc độ dày;
- bề ngoài, màu sắc và tính đồng nhất;
- độ đông đặc;
- độ ẩm;
Ngoài ra, phải xác định trị số pH.
Các thành phần riêng lẻ và mọi thành phần bổ sung chọn lọc hoặc thành phần dinh dưỡng phải được đánh giá chất lượng bằng các quy trình thích hợp.
6.3 Kiểm soát chất lượng vi sinh vật
6.3.1 Yêu cầu chung
Việc thực hiện các phép thử hiệu năng về vi sinh phải được tiến hành trên mẫu đại diện của mẻ sản phẩm cuối cùng [6], [8], [9], [21].
6.3.2 Môi trường đối chứng
Để có được độ tin cậy của các kết quả phép thử hiệu năng, thì phải sử dụng môi trường đối chứng có chất lượng phù hợp cao.
Các ví dụ cần được người sử dụng xem xét như sau:
- sử dụng RM định lượng (xem 3.4.6) có chứa một lượng xác định các vi sinh vật khi đánh giá môi trường đối chứng;
- sử dụng quá trình sản xuất xác định kể cả việc làm tan chảy, nếu có thể;
- sử dụng cùng một cơ sở sản xuất/nguồn gốc môi trường/các thành phần;
- sử dụng một lượng lớn vi sinh vật khi thử kiểm tra (để bao trùm dải vi sinh vật cần tìm);
- chọn “môi trường đối chứng” cho mục đích đánh giá;
- các quy trình thích hợp để đảm bảo chất lượng khi sử dụng môi trường đối chứng.
Có thể không cần thiết phải bao gồm tất cả các nội dung trên khi đánh giá sự phù hợp của môi trường đối chứng. Phòng thử nghiệm phải tự chọn quy trình phù hợp cho mình.
Các vi sinh vật thử nghiệm phù hợp, phương pháp kiểm soát và các tiêu chí chấp nhận đối với môi trường đối chứng thạch trypton đậu tương (TSA) được nêu trong các Phụ lục E và F. Có thể sử dụng các môi trường đối chứng không chọn lọc khác nếu đáp ứng được các tiêu chí trên.
6.3.3 Kiểm tra mức độ nhiễm vi khuẩn (kiểm tra độ vô trùng)
Cần phải kiểm tra mức độ nhiễm vi khuẩn (độ vô trùng) của một lượng môi trường nuôi cấy thích hợp, tùy thuộc vào cỡ của mẻ bằng cách ủ ấm ở các điều kiện thích hợp.
Các mẫu thử nghiệm phải ít nhất là một đĩa hoặc một ống cho các mẻ nhỏ (< 100 đơn vị). Đối với các mẻ lớn hơn, người sản xuất phải lấy theo quy định, ví dụ: dựa vào các thành phần môi trường, thông số quá trình, các giới hạn và kiểu bao gói, sử dụng các giới hạn chất lượng được chấp nhận. Thông tin bổ sung được nêu trong TCVN 7790-1 (ISO 2859-1) [6] ngoài các tiêu chuẩn quốc gia khác và các nguồn khác [9], [21].
Các tiêu chí chấp nhận phải được thiết lập và điều chỉnh đối với từng môi trường.
6.4 Yêu cầu chung đối với phép thử hiệu năng vi sinh vật
6.4.1 Yêu cầu chung
Để đánh giá mẻ môi trường nuôi cấy hoàn chỉnh, thành phần dinh dưỡng hoặc các chất bổ sung, sự phát triển phải được đánh giá thích hợp bằng các phương pháp định tính hoặc định lượng nêu trong tiêu chuẩn này.
Sử dụng thiết bị thích hợp và thực hiện kỹ thuật nuôi cấy nêu trong các tiêu chuẩn liên quan, nuôi cấy các môi trường nuôi cấy lỏng hoặc bán đặc với một lượng thích hợp (5.4.2.4) giống làm việc của mỗi vi sinh vật thử nghiệm xác định, xem Phụ lục E và Phụ lục F.
Các ví dụ về phương pháp thử định tính và định lượng đối với môi trường nuôi cấy đặc và lỏng được nêu trong tiêu chuẩn này. Có thể chọn phương pháp bất kỳ khác và không phải sử dụng tất cả các phương pháp.
Khi môi trường nuôi cấy được sử dụng để đếm vi sinh vật, phải thực hiện các phương pháp thử định lượng.
Khi cần đánh giá môi trường nuôi cấy mới hoặc nhà sản xuất mới, nên thực hiện các phương pháp thử định lượng để cung cấp thông tin bổ sung về sự thay đổi.
Trong môi trường lỏng, các tương tác dẫn đến sự phát triển các vi sinh vật rất phức tạp, do đó, các phương pháp thử hiệu năng cũng phức tạp hơn
Đối với phép thử nghiệm các hỗn hợp môi trường đặc bằng các bộ lọc màng, sử dụng ISO 7704.
Thông thường các kỹ thuật vi sinh là giả định và do đó, các phương pháp không đưa ra chi tiết cụ thể.
Các vi sinh vật thử nghiệm thích hợp, các phương pháp kiểm soát và các tiêu chí chấp nhận được liệt kê trong Phụ lục E và Phụ lục F.
Tần suất thử nghiệm phải do người sử dụng điều chỉnh, có tính đến phạm vi chuẩn bị trong phòng thử nghiệm của người sử dụng cuối cùng và mức đảm bảo chất lượng tại đó.
6.4.2 Môi trường sử dụng ngay
Các nhà sản xuất môi trường sử dụng ngay có bán sẵn trên thị trường, đặc biệt nếu đã được chứng nhận phù hợp với TCVN ISO 9001, phải có sẵn chương trình chất lượng và có thể kèm theo chứng chỉ về chất lượng của môi trường mà họ cung cấp. Trong các điều kiện này, người sử dụng có thể không cần phải thử nghiệm thêm về môi trường đó nhưng cần đảm bảo rằng các điều kiện bảo quản được duy trì theo hướng dẫn của nhà sản xuất.
Đối với môi trường hoàn chỉnh sử dụng ngay có chất bổ sung, chất lượng đã được nhà sản xuất kiểm soát phù hợp với tiêu chuẩn quy định, thì ít nhất nên có phép thử định tính.
Người sử dụng phải chắc chắn rằng nhà sản xuất các môi trường để sử dụng ngay có bán sẵn trên thị trường đều có chương trình chất lượng đối với các sản phẩm này và các chứng chỉ kiểm soát chất lượng đáp ứng các yêu cầu của tiêu chuẩn này, thỏa mãn các kết quả dự kiến và kết quả thu được. Phòng thử nghiệm sử dụng cũng phải kiểm tra các tài liệu bằng chứng để đảm bảo rằng các tiêu chí chấp nhận của nhà sản xuất về phép thử hiệu năng đáp ứng các yêu cầu nội bộ của phòng thử nghiệm.
Phải định kỳ kiểm tra để chứng minh chất lượng của môi trường được duy trì trong quá trình vận chuyển.
Cũng cần phải kiểm tra sau bảo quản và xử lý tiếp trong phòng thử nghiệm, ví dụ: sự tan chảy của môi trường. Điều chỉnh tần xuất kiểm tra.
Đối với môi trường không hoàn chỉnh cần được phòng thử nghiệm thêm các chất bổ sung (xem 3.3.5.1), thì kiểm tra việc bổ sung bằng các hồ sơ hoặc thực hiện các phép thử định tính để đảm bảo rằng chất bổ sung được thêm đúng.
6.4.3 Môi trường được chuẩn bị từ các công thức thành phần khô bán sẵn trên thị trường
Đối với môi trường để đếm vi sinh vật, thì phải thực hiện phép thử định lượng. Đối với các môi trường khác thì chỉ cần phép thử định tính là đủ. Các phép thử định lượng cho độ đảm bảo chất lượng môi trường cao hơn.
Đối với các môi trường không quy định trong Phụ lục E và Phụ lục F thì việc kiểm soát chất lượng cần quy định theo hướng dẫn của nhà sản xuất.
Đối với các môi trường không chứa các chất chỉ thị hoặc các chất chọn lọc, thì sử dụng một số lượng hạn chế chủng thử nghiệm. Đối với các môi trường có chứa các chất chỉ thị hoặc chất chọn lọc, thì sử dụng các chủng chỉ thị hoặc chọn lọc. Đối với môi trường phức hợp, nghĩa là có chất bổ sung thì mỗi mẻ cần được kiểm tra với các chủng có các đặc trưng được liệt kê trong 5.2.
6.4.4 Môi trường được chuẩn bị từ các thành phần cơ bản riêng rẽ
Ngoài các yêu cầu nêu trong 6.4.3, thì cần tiến hành phép thử định lượng để kiểm tra chiều hướng chất lượng của vật liệu cơ bản, hiệu suất của môi trường và các quy trình chuẩn bị sản xuất trong phòng thử nghiệm.
6.5 Đánh giá hiệu năng và diễn giải các kết quả
Mẻ môi trường nuôi cấy cho thấy đáp ứng nếu tất cả các vi sinh vật thử nghiệm được sử dụng thực hiện theo các quy định kỹ thuật. Môi trường được chấp nhận nếu cả tiêu chí chung lẫn các tiêu chí chất lượng được đáp ứng.
Nếu không đáp ứng yêu cầu về hiệu năng, xem Phụ lục H.
6.6 Môi trường khẳng định và thuốc thử
6.6.1 Môi trường khẳng định
Hiệu năng của môi trường nuôi cấy được sử dụng cho các phép thử khẳng định phải được xác nhận trước khi sử dụng. Các vi sinh vật thử nghiệm âm tính và dương tính thích hợp phải được sử dụng để xác nhận theo cách tương tự trong các tiêu chuẩn cụ thể [9], [16].
6.6.2 Thuốc thử khẳng định
Hiệu năng của các dung dịch nhuộm Gram, các thuốc thử như Kovac, VP, nitrit, oxydase, catalase và các thuốc thử khác được sử dụng để chứng minh các đặc tính sinh hóa phải được kiểm tra xác nhận hiệu năng trước khi sử dụng. Các chủng âm tính, dương tính phải được sử dụng để đánh giá xác nhận và hạn sử dụng phải được thiết lập. Cần sử dụng các thuốc thử thuộc loại tinh khiết phân tích cho các phép thử khẳng định. Nếu sử dụng các loại thuốc thử thương mại, thì tuân thủ các hướng dẫn của nhà sản xuất về bảo quản và sử dụng [18], [19].
7 Phương pháp thử hiệu năng của môi trường nuôi cấy đặc
7.1 Yêu cầu chung
Điều này mô tả phép thử hiệu năng định tính và định lượng đối với môi trường nuôi cấy đặc được quy định trong các tiêu chuẩn cụ thể áp dụng cho thực phẩm và nước. Đây là các phương pháp chung đối với hầu hết các môi trường nuôi cấy. Các phương pháp này có thể không thích hợp cho phép thử một số kiểu môi trường về độ thu hồi nấm mốc. Sơ đồ tóm tắt của phương pháp có trong Phụ lục C.
7.2 Phương pháp thử định lượng
7.2.1 Phương pháp thử định lượng - Các định nghĩa
7.2.1.1 Hiệu suất
Hiệu suất phải đạt được giới hạn xác định tối thiểu (xem tiêu chuẩn cụ thể liên quan hoặc các Phụ lục E và Phụ lục F).
Xem Phụ lục G về sử dụng sơ đồ kiểm soát để thử hiệu năng của môi trường nuôi cấy đặc bằng quy trình quy định dưới đây.
Đối với các phương pháp định lượng, hệ số hiệu suất PR[21] được xác định theo Công thức (1):
![]() (1)
(1)
Trong đó
Ns là số đếm khuẩn lạc tổng số thu được trên hoặc trong môi trường nuôi cấy cần thử, nghĩa là số đếm khuẩn lạc trên các đĩa;
N0 là số đếm khuẩn lạc tổng số thu được trên môi trường nuôi cấy đối chứng thu được từ một hoặc nhiều đĩa và phải ≥ 100 cfu, xem 5.4.2.5.1.
Diễn giải các kết quả, xem 7.2.2.1.2.
7.2.1.2 Tính chọn lọc
Môi trường nuôi cấy chọn lọc và môi trường đối chứng không chọn lọc được cấy cùng các vi sinh vật không phải đích ở các độ pha loãng khác nhau.
Hệ số chọn lọc, SF[22], được tính bằng Công thức (2):
SF = D0 - Ds (2)
Trong đó
D0 là độ pha loãng cao nhất có vi sinh vật phát triển trên môi trường đối chứng không chọn lọc;
Ds là độ pha loãng cao nhất có vi sinh vật phát triển tốt trên môi trường thử nghiệm chọn lọc;
SF, D0 và Ds được biểu thị bằng đơn vị log10.
CHÚ THÍCH: Ví dụ, nếu D010-4 = Iog104,0 và Ds10-3 = log103,0 thì hệ số chọn lọc SF = 1,0.
Diễn giải kết quả, xem 7.2.2.1.2.
7.2.2 Phương pháp thử định lượng đối với môi trường nuôi cấy đặc
7.2.2.1 Yêu cầu chung
Quy trình này cần sử dụng huyền phù vi khuẩn đã được định lượng (có thể là huyền phù mẫu thử/vật liệu chuẩn định lượng được) có nồng độ thích hợp với chủng đích. Độ thu hồi của mẻ môi trường nuôi cấy mới được so sánh với độ thu hồi của môi trường nuôi cấy không chọn lọc (môi trường đối chứng) hoặc trong các trường hợp đặc biệt, được so sánh với mẻ đã được chấp nhận trước đó của thành phần môi trường tương tự.
7.2.2.1.1 Cách tiến hành
a) Sử dụng các giống làm việc và dịch cấy có nồng độ thích hợp biết trước của chủng đích và chủng cấy không phải đích trong 5.3.2 hoặc RM thích hợp.
b) Cần sử dụng một hoặc nhiều đĩa cho mỗi vi sinh vật. Số đếm được sử dụng phụ thuộc vào cỡ của mẻ, độ tin cậy trong quy trình sản xuất đảm bảo chất lượng độ tin cậy và mức vi sinh vật trong huyền phù mẫu thử.
c) Đảm bảo rằng bề mặt các đĩa là khô hoàn toàn, xem 4.5.5.
d) Nuôi cấy bằng cách dàn dịch cấy trên môi trường hoặc bằng phương pháp lọc màng để cho các số đếm nằm trong các giới hạn khuyến cáo nêu trong 5.4.2.5.1 đối với phép thử định lượng.
Phương pháp nhỏ giọt bề mặt Miles-Misra cải biến, các hệ thống nhỏ giọt khác hoặc đổ đĩa xoắn cũng có thể được sử dụng để có được các khuẩn lạc có thể đếm được trên đĩa.
- Đối với các môi trường nuôi cấy thường được sử dụng để định lượng theo cách này thì phải sử dụng phương pháp đổ đĩa.
- Nuôi cấy môi trường đối chứng hoặc các đĩa từ các mẻ được chấp nhận trước đó theo cách tương tự.
- Ủ ấm các đĩa với các điều kiện quy định trong các tiêu chuẩn cụ thể.
- Đếm các khuẩn lạc có mặt trên mỗi đĩa. Đánh giá kích thước và hình thái của các khuẩn lạc trên hoặc trong môi trường thử nghiệm bằng cách so sánh với độ thu hồi trên môi trường nuôi cấy không chọn lọc (môi trường đối chứng) hoặc mẻ đã được chấp nhận trước đó của thành phần môi trường tương tự.
7.2.2.1.2 Tính kết quả và diễn giải kết quả
Đối với phép thử định lượng, khoảng 100 cfu là cần thiết để đảm bảo độ chụm (xem Bảng 1). Có thể cần phải sử dụng nhiều đĩa cho mỗi lần lặp lại.
Các kết quả được chấp nhận có hiệu lực nếu đáp ứng các điều kiện sau đây:
- Mỗi lặp lại phải cho kết quả dương tính (có phát triển vi khuẩn đích);
- Mỗi kết quả báo cáo riêng lẻ bao gồm trong dải phân tích chuẩn (đến 100 khuẩn lạc đối với các phương pháp lọc và đến 150 khuẩn lạc đối với các phương pháp bề mặt).
Diễn giải các kết quả, tính hệ số hiệu suất PR (xem 7.2.1.1) và khi thích hợp, hệ số chọn lọc, SF (xem 7.2.1.2).
a) PR phải ≥ 0,50 để so sánh môi trường chọn lọc với môi trường đối chứng không chọn lọc quy định trong Phụ lục E và Phụ lục F. PR phải ≥ 0,70 để so sánh môi trường không chọn lọc với môi trường đối chứng không chọn lọc hoặc như quy định trong Phụ lục E và Phụ lục F. Điều này có thể áp dụng cho các trường hợp đặc biệt khi so sánh với mẻ trước đó.
b) Nếu PR vượt quá 1,4 thì phải tìm ra nguyên nhân.
c) SF của các vi sinh vật không phải đích ít nhất phải bằng 2.
Đối với các trường hợp đặc biệt, xem các Phụ lục S, F và I. Các tiêu chí này có thể không thích hợp cho các môi trường không được quy định trong các Phụ lục E và F ví dụ như các tiêu chí này quy định trong các tiêu chuẩn cụ thể.
7.2.2.2 Sử dụng hệ số thu hồi từ chất chuẩn
Nguyên tắc này sử dụng các chất chuẩn RM, CRM hoặc các CRM nội bộ để cung cấp huyền phù vi khuẩn có chứa một lượng đơn vị hình thành khuẩn lạc đích đã biết hoặc các chủng không mong muốn. Hệ số thu hồi từ mẻ mới của môi trường nuôi cấy có thể được so sánh với số lượng cfu dự kiến từ RM, CRM hoặc RM nội bộ.
Có thể sử dụng chênh lệch tới hạn để tính giới hạn dung sai (xem TCVN 6910-6 (ISO 5725-6) [34]). Xem Bảng 1.
Đối với việc chuẩn bị và đánh giá các RM nội bộ, xem [21] và [29].
Chất lượng của RM phải được kiểm tra xác nhận trên môi trường đối chứng.
7.3 Thử nghiệm môi trường nuôi cấy sử dụng cho lọc màng
Chất lượng của các bộ lọc màng được sử dụng phải được đánh giá trước đó để chứng minh tính phù hợp của chúng về việc sử dụng, xem ISO 7704.
Để thử hiệu năng của môi trường nuôi cấy sử dụng trong lọc màng, sử dụng giống làm việc và dịch cấy trong 5.4.2. Nuôi cấy môi trường huyền phù, ví dụ: chất lỏng pha loãng, nước vô trùng với mức dịch cấy thích hợp nêu trong 5.4.2.5.
Lọc chất lỏng theo các yêu cầu của tiêu chuẩn cụ thể. Đặt màng lọc lên bề mặt thạch cần thử. Nuôi cấy một lượng đủ các màng/đĩa để thu được khoảng 100 cfu cho thử nghiệm hiệu suất. Lặp lại với màng lọc mới và đặt màng thứ hai lên bề mặt môi trường đối chứng, sử dụng các độ pha loãng nếu cần cho phép thử tính chọn lọc. Nuôi ấm các đĩa theo tiêu chuẩn cụ thể.
Lặp lại quy trình mỗi lần khi thay đổi mẻ màng lọc mới cũng như mẻ môi trường mới.
Nếu cần, đánh giá ảnh hưởng của màng lọc đến kết quả sao cho dàn đều dịch cấy thử nghiệm lên môi trường thử nghiệm và môi trường đối chứng mà không có màng lọc.
7.4 Phương pháp thử định tính
7.4.1 Phương pháp cấy vạch định tính
7.4.1.1 Cách tiến hành
Sử dụng các giống làm việc và dịch cấy trong 5.4.2.
Đối với các phép thử hiệu suất và tính đặc hiệu, sử dụng đĩa môi trường thử nghiệm và cấy vạch từng vi sinh vật thử nghiệm sao cho thu được các khuẩn lạc mọc riêng rẽ.
Đối với các phép thử tính chọn lọc, sử dụng đĩa môi trường thử nghiệm và cấy vạch từng vi sinh vật thử nghiệm thành từng vạch thẳng sử dụng vòng cấy 1 μl lên bề mặt môi trường thử nghiệm. Vài vi sinh vật thử nghiệm có thể được cấy vạch trên cùng một đĩa thành các đường song song không giao nhau, các vạch cần phân biệt rõ để cho phép quan sát hình thái điển hình. Có thể sử dụng các phương pháp cấy vạch đã chuẩn hóa khác.
Ủ ấm các đĩa ở các điều kiện xác định trong các tiêu chuẩn cụ thể.
7.4.1.2 Diễn giải các kết quả
Đánh giá sự phát triển trên các đĩa thạch sau khi ủ như sau:
- 0 tương ứng với không phát triển;
- 1 tương ứng với phát triển yếu;
- 2 tương ứng với phát triển tốt;
Các vi sinh vật đích phải bằng 2 và có vẻ bề ngoài, kích thước và hình thái của khuẩn lạc điển hình.
Đối với các phép thử tính chọn lọc, mức độ ức chế phụ thuộc vào kiểu môi trường. Sự phát triển của các vi sinh vật không phải đích phải bị ức chế toàn phần hoặc một phần.
7.4.2 Xác định tính đặc hiệu
Định nghĩa về tính đặc hiệu được nêu trong 3.2.6. Tính đặc hiệu của môi trường nuôi cấy là chỉ thị về các đặc tính vật lý để phân biệt các vi sinh vật liên quan đến sự có mặt không có mặt và/hoặc cấp độ thể hiện các phản ứng sinh hóa và kích thước khuẩn lạc và hình thái khuẩn lạc. Đối với các yêu cầu của giống làm việc và dịch cấy, xem 5.4.2.
7.4.3 Các phương pháp định tính khác đối với môi trường đặc
Có thể sử dụng các phương pháp định tính khác [9], [21].
8 Phương pháp thử hiệu năng của môi trường nuôi cấy lỏng
8.1 Yêu cầu chung
Điều này mô tả các phương pháp định tính và định lượng để thử hiệu năng của môi trường nuôi cấy lỏng. Sơ đồ tóm tắt cho từng phương pháp được nêu trong Phụ lục C.
8.2 Phương pháp định lượng trong ống nghiệm để thử hiệu năng của môi trường tăng sinh lỏng (phương pháp pha loãng để phân biệt)
8.2.1 Yêu cầu chung
Phương pháp này là phương pháp chung có thể được sử dụng đối với môi trường lỏng chọn lọc hoặc không chọn lọc. Phương pháp này cũng có thể thích hợp để thử hiệu năng của môi trường lỏng dùng để định lượng, ví dụ: trong các phương pháp đếm số có xác suất lớn nhất.
8.2.2 Chuẩn bị dãy pha loãng
- Chọn số ống đại diện, xem 6.3.1.
- Chuẩn bị các dãy pha loãng thích hợp từ giống làm việc của vi sinh vật đích hoặc không phải đích trong các dịch pha loãng quy định trong TCVN 6507-1 (ISO 6887-1) và TCVN 9716 (ISO 8199) sao cho không có mặt các vi sinh vật trong dung dịch pha loãng nhất, ví dụ: từ 10-1 đến 10-10. Thường sử dụng các dãy pha loãng thập phân, nhưng các độ pha loãng 1/5 hoặc 1/2 cũng thích hợp.
- Sử dụng các dãy pha loãng trong khoảng thời gian quy định, xem 5.4.2.3.
- Tại thời điểm sử dụng, chuyển một lượng đã biết, ví dụ: 0,1 ml mỗi dung dịch pha loãng sang bề mặt của đĩa thạch môi trường không chọn lọc và dàn đều.
- Ủ ấm trong các điều kiện thích hợp đối với vi sinh vật liên quan.
- Đếm số khuẩn lạc trên các đĩa thạch ở nồng độ pha loãng thấp nhất có chứa đến 150 khuẩn lạc và số khuẩn lạc có độ pha loãng cao hơn độ pha loãng này và ghi lại kết quả.
8.2.3 Quy trình thử nghiệm môi trường lỏng
- Chọn số lượng ống môi trường cần thử tương ứng với số ống trong dãy pha loãng.
- Sử dụng các dung dịch pha loãng đã chuẩn bị theo 8.2.2 và bắt đầu với dung dịch pha loãng nhất, nuôi cấy một lượng đã biết của huyền phù vi sinh vật thử nghiệm, ví dụ: 0,1 ml vào ống môi trường tương ứng.
- Ủ ấm các ống thử nghiệm trong các điều kiện quy định trong tiêu chuẩn liên quan, xem 5.4.2.6.
- Sau khi ủ ấm, sử dụng vòng cấy riêng rẽ 10 μl cho mỗi ống môi trường đã ủ ấm để cấy chuyền sang môi trường thạch không chọn lọc.
- Ủ ấm các đĩa đã cấy ở các điều kiện thích hợp đối với vi sinh vật.
- Sau khi ủ ấm, kiểm tra từng đĩa về sự phát triển hoặc không phát triển của vi sinh vật.
CHÚ THÍCH: Đối với vi sinh vật đích, thường sử dụng các dung dịch pha loãng từ 10-5 đến 10-8. Đối với các vi sinh vật không phải đích, thường sử dụng các dung dịch pha loãng từ 10-1 đến 10-4.
8.2.4 Tính và diễn giải kết quả
Hiệu suất của môi trường tăng sinh lỏng chọn lọc được đáp ứng nếu có phát triển tốt (ít nhất 10 cfu từ vòng cấy đầy 10 μl) của vi sinh vật đích thu được từ dung dịch pha loãng tạo ra ít hơn 100 cfu (trong 0,1 ml) trên đĩa.
Đối với môi trường lỏng chọn lọc, xác định hệ số chọn lọc SF, từ dung dịch pha loãng nhất của giống làm việc cho thấy phát triển tốt (ít nhất 10 cfu) trên đĩa thạch và dung dịch pha loãng nhất của môi trường lỏng chọn lọc cho thấy không phát triển (hoặc ít hơn 10 cfu) của vi sinh vật không phải đích trên đĩa thạch không chọn lọc. Hệ số SF ít nhất phải bằng 2.
CHÚ THÍCH: Các phương pháp bổ sung cho phép thử định lượng của môi trường lỏng dùng để đánh giá môi trường đang được nghiên cứu hoặc trong các nghiên cứu so sánh được nêu trong Phụ lục I.
8.3 Phương pháp định tính trong ống nghiệm để thử hiệu năng của môi trường lỏng chọn lọc
8.3.1 Yêu cầu chung
Phương pháp này sử dụng vi sinh vật đích, không phải đích hoặc hỗn hợp vi sinh vật đích và không phải đích trong cùng ống nghiệm.
8.3.2 Cách tiến hành
- Chọn một lượng các ống, mỗi ống chứa 10 ml môi trường hoặc các phần 10 ml của mỗi mẻ cần thử nghiệm (xem 3.1.2 và 6.3.1). Tiến hành tiếp theo mô tả sau đây theo các yêu cầu quy định trong các Phụ lục E và Phụ lục F.
- Chuẩn bị dịch cấy: xem 5.4.2.3.
- Nuôi cấy các vi sinh vật đích: Nuôi cấy một ống canh thang thử nghiệm bằng cách cho một lượng dịch cấy chứa ≤ 100 cfu vi sinh vật đích rồi trộn.
- Nuôi cấy các vi sinh vật không phải đích: Nuôi cấy một ống canh thang thử nghiệm của một vi sinh vật bằng cách cho một lượng dịch cấy chứa lượng vi sinh vật cao hơn (> 1000 cfu) rồi trộn.
- Nuôi cấy các vi sinh vật đích và không phải đích trong cùng ống nghiệm khi yêu cầu trong Phụ lục E và Phụ lục F hoặc khi đánh giá môi trường mới hoặc đánh giá nhà sản xuất mới. Nuôi cấy một ống canh thang chứa ≤ 100 tế bào vi sinh vật đích và một lượng lớn hơn các vi sinh vật không phải đích (> 1 000 tế bào cho mỗi ống) trong cùng ống nghiệm và trộn.
- Ủ ấm các ống nghiệm ở các điều kiện quy định trong tiêu chuẩn cụ thể, xem 5.4.2.6.
- Lấy một vòng cấy (10 μl) từ ống nghiệm chứa vi sinh vật đích và cấy vạch lên đĩa môi trường không chọn lọc (ví dụ: TSA).
- Nếu sử dụng hỗn hợp môi trường nuôi cấy vi sinh vật đích và không phải đích thì lấy một vòng cấy (10 μl) và cấy vạch lên đĩa môi trường xác định đối với vi sinh vật đích.
- Lấy một vòng cấy (10 μl) từ giống vi sinh vật không phải đích và cấy vạch lên đĩa môi trường chọn lọc (ví dụ: XLD).
- Ủ ấm các đĩa đã cấy ở các điều kiện quy định trong tiêu chuẩn cụ thể.
Nếu sử dụng thể tích môi trường lớn hơn thì người sử dụng có thể chọn cách để chỉnh tỷ lệ dịch cấy sao cho thu được các kết quả tương đương.
8.3.3 Tính và diễn giải kết quả
Hiệu suất của canh thang thử nghiệm lỏng là đáp ứng nếu có phát triển tốt (ít nhất 10 cfu hoặc đường cấy phát triển tốt) của vi sinh vật đích thu được trên môi trường đặc thù đối với vi sinh vật đó.
Tính chọn lọc của canh thang thử nghiệm được đáp ứng nếu không có sự phát triển (hoặc ít hơn 10 cfu) của vi sinh vật không phải trên môi trường thạch không chọn lọc.
8.4 Phương pháp định tính trong ống nghiệm đơn (độ đục) để thử hiệu năng của môi trường lỏng
8.4.1 Yêu cầu chung
Phương pháp này thích hợp để thử hiệu năng của môi trường nuôi cấy lỏng không chọn lọc và môi trường chọn lọc để thử khẳng định, ví dụ canh thang lactose mật lục sáng (BGBLB) [41]. Phương pháp này chỉ định tính và kết quả chỉ là chỉ thị. Môi trường đục chỉ có thể được thử nghiệm bằng phương pháp này nếu được cấy chuyền sang môi trường đặc cho thấy có phát triển.
Đối với các môi trường trong, đánh giá như sau:
- 0 tương ứng với không đục;
- 1 tương ứng với hơi đục;
- 2 tương ứng với khá đục;
8.4.2 Cách tiến hành
8.4.2.1 Môi trường tăng sinh sơ bộ
- Chọn một số ống, mỗi ống chứa 10 ml môi trường hoặc các phần 10 ml của mỗi mẻ cần thử nghiệm (xem 3.1.2 và 6.3.1).
- Đối với phép thử hiệu năng của môi trường tăng sinh sơ bộ; ví dụ: nước đệm pepton (BPW), nuôi cấy môi trường với một lượng dịch cấy thích hợp (xem tiêu chuẩn cụ thể) có chứa ≤ 100 cfu trực tiếp vào môi trường thử nghiệm.
- Chuẩn bị dịch cấy: xem 5.4.2.3.
- Ủ ấm các ống trong các điều kiện quy định trong tiêu chuẩn cụ thể, xem 5.4.2.6.
- Kiểm tra môi trường về sự phát triển.
8.4.2.2 Môi trường khẳng định
- Đối với phép thử hiệu năng của môi trường khẳng định dạng lỏng, nuôi cấy môi trường thử nghiệm với huyền phù giống làm việc (có chứa > 106 cfu/ml) sử dụng vòng cấy 1 μl.
- Ủ ấm ống nghiệm ở các điều kiện quy định trong tiêu chuẩn cụ thể, xem 5.4.2.6.
- Nếu môi trường chưa nuôi cấy bị đục thì cấy chuyền sang môi trường đặc, ủ ấm các đĩa ở các điều kiện quy định trong các tiêu chuẩn cụ thể và kiểm tra sự phát triển.
8.4.3 Tính và diễn giải kết quả
Thực hiện đánh giá định tính trực quan bằng cách quan sát độ đục (nghĩa là 2) cho thấy phát triển tốt, xem 8.4.1. Đánh giá định tính môi trường mờ đục là chỉ thị có sự phát triển trên môi trường đặc.
CHÚ THÍCH 1: Đôi khi sự phát triển của vi sinh vật có thể quan sát được khi có ngưng kết/lắng ở đáy ống nghiệm hoặc chai. Trong trường hợp này, lắc cẩn thận thì có thể cải thiện việc đánh giá và giải thích kết quả.
CHÚ THÍCH 2: Các đặc tính khác, như sinh khí và đổi màu cũng có thể đánh giá bằng phương pháp này.
9 Phương pháp thử hiệu năng của chất pha loãng và môi trường vận chuyển
9.1 Yêu cầu chung
Các phép thử hiệu năng vi sinh vật phải được thực hiện trên mẫu đại diện cho mẻ sản phẩm cuối cùng, xem 6.3.1.
9.2 Phương pháp thử nghiệm dịch pha loãng
9.2.1 Phương pháp thử định lượng dịch pha loãng
9.2.1.1 Yêu cầu chung
Phương pháp xác định hiệu năng của dịch pha loãng để duy trì sự sống của các vi sinh vật mà không có sự tăng hoặc giảm quá mức vi sinh vật trong suốt quá trình tiếp xúc trước khi đổ thạch lên đĩa hoặc nuôi cấy trong môi trường lỏng.
9.2.1.2 Cách tiến hành
Nuôi cấy phần thử nghiệm (ví dụ 9 ml) dịch pha loãng với 1 ml huyền phù vi sinh vật chứa khoảng 104 cfu/ml và trộn, để chuẩn bị dịch cấy, xem 5.4.2. Lấy ngay 0,1 ml dịch đã cấy và dàn đều trên bề mặt thạch không chọn lọc (môi trường đối chứng) như TSA (t0).
Giữ dịch nuôi cấy ở nhiệt độ phòng trong khoảng thời gian quy định trong phần thích hợp của bộ TCVN 6507 (ISO 6887) hoặc TCVN 9716 (ISO 8199) tính từ thời điểm kết thúc chuẩn bị huyền phù ban đầu đến khi lấy dịch cấy ra cho tiếp xúc với môi trường nuôi cấy (thường là 45 min). Trộn và lấy ra một lượng tương tự (0,1 ml) và cấy đĩa lại trên môi trường đối chứng (t1).
Ủ ấm môi trường đối chứng ở nhiệt độ và thời gian thích hợp, ví dụ: 30 °C/72 h.
9.2.1.3 Đọc và diễn giải kết quả
Sau khi ủ ấm, đếm các khuẩn lạc trên các đĩa t0 và t1.
Số lượng vi sinh vật, t1, sau khi ủ ấm dịch pha loãng đã cấy phải trong phạm vi ± 30 % số đếm ban đầu (t0).
9.3 Phương pháp thử môi trường vận chuyển
9.3.1 Yêu cầu chung
Phương pháp xác định hiệu năng của môi trường vận chuyển để duy trì sự sống của các vi sinh vật trong quá trình vận chuyển mà không làm tăng hoặc giảm mức vi sinh vật đã cấy.
Nếu các hệ thống vận chuyển phù hợp với thiết bị lấy mẫu, thì phải được sử dụng để cấy môi trường vận chuyển. Mặt khác, việc nuôi cấy phải được thực hiện trong các điều kiện tương ứng với các điều kiện thực tế.
Ủ ấm môi trường vận chuyển đã cấy ở nhiệt độ và thời gian thích hợp theo thực tế hoặc nêu quy định trong tiêu chuẩn cụ thể [12], [13].
VÍ DỤ: Các hệ thống vận chuyển để vận chuyển mẫu trong các điều kiện lạnh được thử nghiệm ở nhiệt độ 5 °C ± 3 °C đối với quá trình vận chuyển thông thường, ví dụ: 24 h trước khi lặp lại đổ đĩa.
9.3.2 Phương pháp thử định lượng môi trường vận chuyển lỏng
9.3.2.1 Cách tiến hành
Nuôi cấy phần mẫu thử (ví dụ 10 ml) môi trường vận chuyển lỏng với một lượng vi sinh vật thử nghiệm thích hợp cần sử dụng. Sử dụng mức dịch cấy chứa khoảng 103 đến 104 tế bào cho mỗi ống 10 ml, để chuẩn bị dịch cấy, xem 5.4.2. Lấy ngay 0,1 ml môi trường đã cấy và dàn đều trên bề mặt thạch không chọn lọc (môi trường đối chứng) như TSA (t0).
Để nuôi cấy trong các hệ thống vận chuyển bằng các dụng cụ lấy mẫu, đặt dụng cụ lấy mẫu trong một lượng dung dịch giống làm việc thích hợp (ví dụ 0,1 ml đối với tăm bông) (chứa khoảng 103 đến 104 tế bào) trong khoảng 10 s, sau đó nuôi cấy môi trường vận chuyển bằng dụng cụ lấy mẫu. Lấy ngay 0,1 ml môi trường vận chuyển lỏng đã cấy và dàn đều trên bề mặt thạch không chọn lọc (môi trường đối chứng) như TSA (t0).
Ủ ấm môi trường vận chuyển đã cấy ở nhiệt độ và thời gian thích hợp theo thực tế hoặc nêu trong tiêu chuẩn cụ thể, ví dụ: 25 °C/5 ngày đối với môi trường vận chuyển và 30 °C/3 ngày đối với môi trường đối chứng, sau đó lặp lại việc đổ đĩa trên môi trường đối chứng (t1).
9.3.2.2 Đọc và diễn giải kết quả
Sau khi ủ ấm, đếm các khuẩn lạc trên các đĩa t0 và t1.
Số lượng vi sinh vật, t1, sau khi ủ ấm môi trường vận chuyển phải trong phạm vi ± 30 % số đếm ban đầu (t0).
9.3.3 Phương pháp thử định tính môi trường vận chuyển rắn
9.3.3.1 Cách tiến hành
Nuôi cấy phần mẫu thử (ví dụ 10 ml) môi trường vận chuyển rắn với một lượng vi sinh vật thử nghiệm thích hợp cần sử dụng. Sử dụng mức dịch cấy chứa khoảng 104 đến 106, để chuẩn bị dịch cấy, xem 5.4.2
Để nuôi cấy các hệ thống vận chuyển bằng các dụng cụ lấy mẫu, đặt dụng cụ lấy mẫu trong một lượng dung dịch giống làm việc thích hợp (ví dụ 100 μl đối với tăm bông) (chứa khoảng 104 đến 106 tế bào) trong khoảng 10 s, sau đó nuôi cấy môi trường vận chuyển bằng dụng cụ lấy mẫu.
Ủ ấm môi trường vận chuyển đã nuôi cấy ở nhiệt độ và thời gian thích hợp theo thực tế hoặc nêu trong tiêu chuẩn quy định cụ thể. Cấy chuyền lên môi trường thạch không chọn lọc (môi trường đối chứng), như thạch TSA và ủ ấm theo thực tế hoặc nêu trong tiêu chuẩn cụ thể.
9.3.3.2 Đọc và giải thích kết quả
Sau khi ủ ấm, kiểm tra sự phát triển của khuẩn lạc trên thạch không chọn lọc.
Phải quan sát thấy sự phát triển của các vi sinh vật sau khi ủ ấm.
10 Hệ thống tài liệu về các kết quả thử nghiệm
10.1 Thông tin từ nhà sản xuất
Nhà sản xuất hoặc nhà cung cấp môi trường nuôi cấy phải cung cấp, khi có yêu cầu, về các đặc tính phát triển của vi sinh vật cụ thể và các thông tin chung liên quan đến mẻ môi trường nuôi cấy cụ thể.
10.2 Truy xuất nguồn gốc
Tất cả các số liệu từ phép thử hiệu năng thông thường cần được lập văn bản theo cách thích hợp và được giữ trong khoảng thời gian thích hợp theo hệ thống chất lượng được sử dụng. Cần sử dụng các biểu mẫu kiểm soát đối với tài liệu và biểu mẫu để đánh giá các kết quả thử nghiệm (xem Phụ lục D).
Phụ lục A
(Tham khảo)
Tên gọi các thành phần môi trường nuôi cấy sử dụng trong phân tích vi sinh vật thực phẩm, thức ăn chăn nuôi và nước
A.1 Yêu cầu chung
Các tên gọi sau đây đã được thống nhất để hài hòa tên gọi của các thành phần khác nhau của môi trường nuôi cấy trong các tiêu chuẩn phương pháp phân tích vi sinh vật.
A.2 Pepton
- Sản phẩm thủy phân casein bằng enzym;
CHÚ THÍCH 1: Sản phẩm này bao gồm cả sản phẩm thủy phân casein bằng chất phân hủy tuyến tụy hoặc pepxin, sản phẩm thủy phân casein và trypton bằng trypsin.
- Sản phẩm thủy phân đậu tương hoặc bột đậu tương bằng enzym;
- Sản phẩm thủy phân mô động vật bằng enzym;
CHÚ THÍCH 2: Sản phẩm này bao gồm cả pepton thịt, sản phẩm thủy phân thịt bằng pepxin, sản phẩm thủy phân thịt bằng chất phân hủy tuyến tụy.
- Sản phẩm thủy phân tim bằng enzym;
- Sản phẩm thủy phân gelatin bằng enzym;
- Sản phẩm thủy phân mô động vật và thực vật bằng enzym;
CHÚ THÍCH 3: Sản phẩm này bao gồm cả trypton.
- Sản phẩm thủy phân casein bằng axit.
A.3 Các chất chiết và chất để pha
- Chất chiết thịt và canh thang thịt;
- Chất chiết tim-não và canh thang tim-não;
- Chất chiết nấm men.
A.4 Thạch
Thạch dùng cho vi khuẩn.
A.5 Các loại khác
- Nhũ tương lòng đỏ trứng;
- Sữa bột gầy;
- Huyết, huyết đã tách fibrin hoặc huyết đã dung giải, bột máu, plasma, sợi huyết, haemin từ các động vật xác định;
- Mật bò dùng cho vi khuẩn;
- Các muối mặt.
CHÚ THÍCH: Các loại này bao gồm các muối mật số 3.
Phụ lục B
(Quy định)
Chuẩn bị gốc đối chứng và giống làm việc
B.1 Chuẩn bị gốc đối chứng từ chủng đối chứng
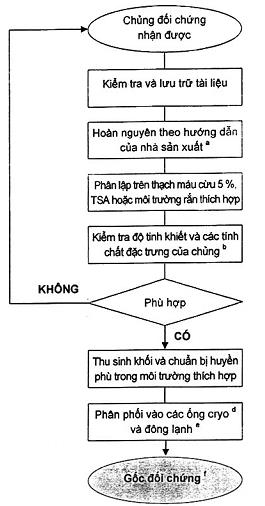
a Nhìn chung, hoàn nguyên trong canh thang dinh dưỡng và cần thời gian để hồi phục.
b Kiểm tra xác nhận hình thái các khuẩn lạc và nhuộm Gram hoặc nhận biết sử dụng phép thử sinh hóa
c Ví dụ môi trường bảo vệ cryo, như TSB được bổ sung từ 10 % glyxerol đến 15 % glyxerol (thể tích).
d Các ống cryo có thể chứa các hạt.
e Làm đông lạnh ở nhiệt độ dưới - 70 °C có thể kéo dài thời gian bảo quản. Nên hạn chế thời gian bảo quản ở nhiệt độ cao hơn [36].
f Có thể sử dụng trực tiếp giống làm việc.
Hình B.1 - Sơ đồ chuẩn bị gốc đối chứng từ chủng đối chứng
B.2 Chuẩn bị giống làm việc từ chủng đối chứng
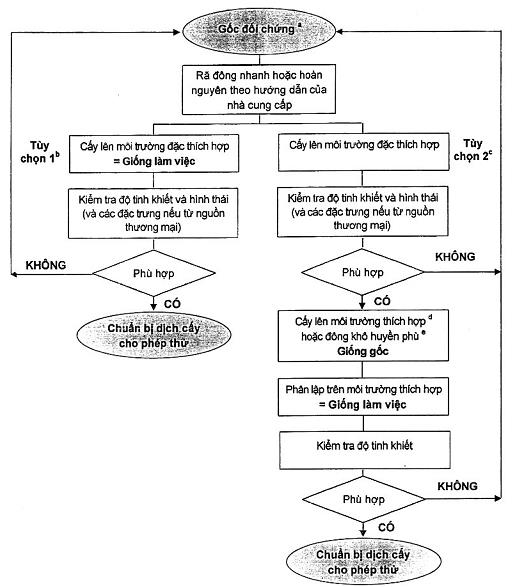
a Kiểm tra các tài liệu, kể cả liên kết đến chủng đối chứng và các đặc tính liên quan, nếu gốc đối chứng thu được từ nguồn khác.
b Quy trình này là thích hợp.
c Quy trình này có thể cần thiết đối với một vài chủng, ví dụ: cho các phép định lượng. Mọi giai đoạn phải được ghi lại.
d Ví dụ: nuôi cấy trên thạch nghiêng TSA hoặc TSA huyết cừu hoặc môi trường thích hợp khác, ủ ấm 24 h và bảo quản ở nhiệt độ thích hợp (18 °C đến 25 °C hoặc 2 °C đến 8 °C tùy thuộc vào vi sinh vật) đến 4 tuần [36].
e Ví dụ môi trường bảo vệ cryo, như TSB được bổ sung từ 10 % glyxerol đến 15 % glyxerol (thể tích). Làm đông lạnh ở nhiệt độ dưới - 70 °C có thể kéo dài thời gian bảo quản. Nên hạn chế thời gian bảo quản ở nhiệt độ cao hơn [36].
Hình B.2 - Sơ đồ chuẩn bị giống làm việc từ gốc đối chứng
Phụ lục C
(Quy định)
Sơ đồ của các phương pháp thử hiệu năng
C.1 Yêu cầu chung
Xem Điều 7.
C.2 Phương pháp định lượng đối với môi trường đặc: hiệu suất và tính chọn lọc
(xem 7.2.2 và Hình C.1).
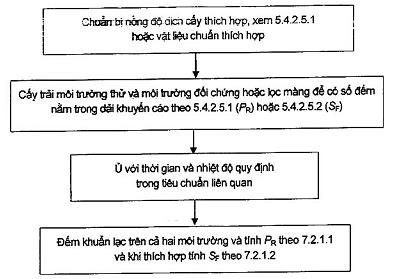
CHÚ DẪN
PR Hệ số hiệu suất.
SF Hệ số chọn lọc.
Hệ số hiệu suất PR có thể được dùng để so sánh:
a) môi trường không chọn lọc với môi trường đối chứng không chọn lọc.
b) môi trường chọn lọc với môi trường đối chứng không chọn lọc.
c) môi trường chọn lọc với môi trường đối chứng chọn lọc.
Để ủ ấm (hộp thứ ba của Hình này), xem 5.4.2.6.
Hình C.1 - Sơ đồ phép thử định lượng môi trường nuôi cấy đặc
C.3 Phương pháp định lượng trong ống nghiệm để thử hiệu năng của môi trường tăng sinh lỏng (xem 8.2 và Hình C.2)
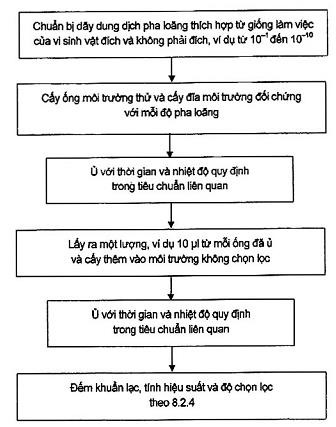
CHÚ THÍCH: Để ủ ấm (hộp thứ năm của hình này), xem 5.4.2.6.
Hình C.2 - Sơ đồ phép thử hiệu năng môi trường tăng sinh lỏng (phương pháp độ pha loãng giảm dần)
C.4 Phương pháp định tính trong ống nghiệm đơn đối với môi trường tăng sinh lỏng chọn lọc (với vi sinh vật đích, không phải đích, hoặc hỗn hợp của vi sinh vật đích và không phải đích trong cùng một ống) (xem 8.3 và Hình C.3)
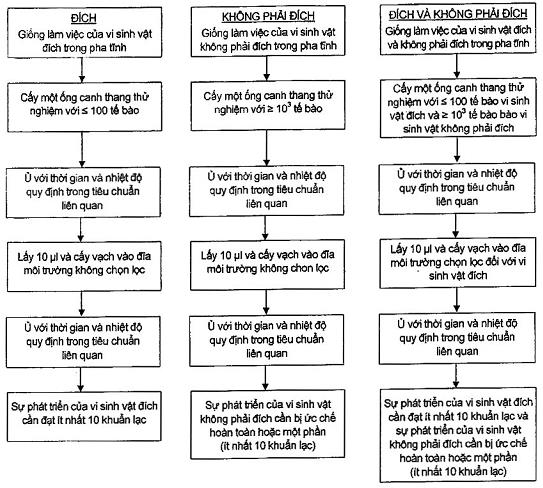
CHÚ THÍCH: Để ủ ấm (hộp thứ năm của mỗi cột trong hình này), xem 5.4.2.6.
Hình C.3 - Sơ đồ của phương pháp định tính trong ống nghiệm đơn đối với môi trường tăng sinh lỏng chọn lọc
C.5 Phương pháp định tính trong ống nghiệm đơn đối với môi trường không chọn lọc và môi trường lỏng chọn lọc: Độ đục (xem 8.4 và Hình C.4)
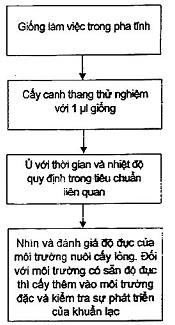
Nhìn chung, cần kiểm tra các đặc tính phát triển vi khuẩn đối với từng môi trường lỏng, ví dụ: sinh khí, đổi màu, nếu có thể.
CHÚ THÍCH: Để ủ ấm (hộp thứ ba của hình này), xem 5.4.2.6.
Hình C.4 - Sơ đồ thử định tính môi trường lỏng trong ống nghiệm đơn (độ đục)
Phụ lục D
(Tham khảo)
Ví dụ về phiếu ghi các kết quả thử nghiệm môi trường nuôi cấy
Bảng D.1 - Ví dụ về phiếu
| Phiếu kiểm soát thử nghiệm chất lượng nội bộ của môi trường nuôi cấy | |||||
| Môi trường nuôi cấy | Lượng được chuẩn bị | Ngày rót | Số mẻ nội bộ | ||
| Môi trường khô (và mã số): | Người cung cấp | Mẻ | Lượng: | Ngày/chữ ký | |
| Chất bổ sung | Người cung cấp | Mẻ | Lượng: | Ngày/chữ ký | |
| Chi tiết quy trình: |
|
|
|
| |
| Kiểm soát chất lượng vật lý | |||||
| Vẻ bên ngoài dự kiến của môi trường nuôi cấy khô | Màu bình thường, không bị chảy | Chất lượng được khẳng định: Có Không: | Các khuyết tật: | Ngày/chữ ký | |
| Giá trị pH dự kiến: | pH đo được: | Chất lượng được khẳng định: Có: Không: | Các khuyết tật: | Ngày/chữ ký | |
| Lượng điền đầy và/hoặc độ dày dự kiến | Quan sát được: | Chất lượng được khẳng định: Có: Không: | Các khuyết tật: | Ngày/chữ ký | |
| Màu sắc dự kiến | Quan sát được: | Chất lượng được khẳng định: Có: Không: | Các khuyết tật: | Ngày/chữ ký | |
| Độ nét/sự có mặt của các vật phát quang dự kiến | Quan sát được: | Chất lượng được khẳng định: Có: Không: | Các khuyết tật: | Ngày/chữ ký | |
| Độ ổn định gel/độ đặc/độ ẩm | Quan sát được: | Chất lượng được khẳng định: Có: Không: | Các khuyết tật: | Ngày/chữ ký | |
| Nhiễm khuẩn | |||||
| Số lượng đĩa hoặc ống được thử nghiệm: Ủ ấm: | Kết quả | Chất lượng được khẳng định: Có: Không: | Số lượng đĩa hoặc ống bị nhiễm: | Ngày/chữ ký | |
| Phát triển vi khuẩn - Hiệu suất | Phương pháp kiểm chứng: Định lượng: Định tính: | ||||
| Chủng Ủ ấm: Môi trường đối chứng: | Tiêu chí: | Kết quả: | Chất lượng được khẳng định: Có: Không: | Ngày/chữ ký | |
| Phát triển vi khuẩn - Tính chọn lọc | Phương pháp kiểm soát: Định lượng: Định tính: | ||||
| Chủng Ủ ấm: Môi trường đối chứng: | Tiêu chí: | Kết quả: | Chất lượng được khẳng định: Có: Không: | Ngày/chữ ký | |
| Phát triển vi khuẩn - Tính đặc hiệu | Phương pháp kiểm chứng: Định lượng: Định tính: | ||||
| Chủng Ủ ấm: Môi trường đối chứng: | Tiêu chí: | Kết quả: | Chất lượng được khẳng định: Có: Không: | Ngày/chữ ký | |
| Đánh giá mẻ môi trường | |||||
| Chi tiết bảo quản: | Biên lai của mẻ hàng: có: không: | Ngày/chữ ký | |||
Phụ lục E
(Quy định)
Các vi sinh vật thử nghiệm và các tiêu chí hiệu năng đối với môi trường nuôi cấy khuẩn lạc được sử dụng cho vi sinh vật trong thực phẩm
Phụ lục này cung cấp thông tin về môi trường nuôi cấy, các điều kiện nuôi cấy, các vi sinh vật thử nghiệm, số bộ sưu tập giống vi sinh vật thử nghiệm và các phản ứng dự kiến khi thực hiện thử nghiệm môi trường nuôi cấy.
Các chủng đặc thù được chọn để thử nghiệm nhằm đảm bảo sự nhất quán giữa các phòng thử nghiệm và để chứng minh sự khác nhau giữa các môi trường (giữa các mẻ, giữa các nhà sản xuất). Các chủng này đã được đánh giá đầy đủ để đảm bảo sự phù hợp và thống nhất về hiệu năng.
Khi có nhiều hơn một chủng được liệt kê cho mỗi lĩnh vực thử hiệu năng (hiệu suất, tính chọn lọc, tính đặc hiệu), thì ít nhất các chủng được sử dụng phải được viết rõ bằng chữ b. Các nhà cung cấp môi trường thương mại hoặc phi thương mại dự kiến sử dụng các chủng bổ sung, ví dụ: các chủng nêu trong Bảng E.1 để đảm bảo thêm về chất lượng của môi trường nuôi cấy mà họ áp dụng.
Bảng E.1 được thiết lập có tính đến các chủng kiểm soát được sử dụng trong Dược điển châu Âu (EP) và các khuyến nghị đối với môi trường nuôi cấy vi sinh vật trong thực phẩm từ Nhóm làm việc của Ủy ban quốc tế về Vi sinh vật thực phẩm và Vệ sinh thực phẩm (ICFMH). Các tiêu chí này phải được đưa vào trong các tiêu chuẩn cụ thể khi được xây dựng và soát xét. Mẻ môi trường nuôi cấy đã được đánh giá xác nhận là mẻ môi trường đáp ứng được hiệu năng, số lượng chủng được quy định trong Bảng E.1 là số lượng từ bảng kê của các bộ định danh chủng phổ biến do Trung tâm Dữ liệu Thế giới về Vi sinh vật (WDCM) cung cấp.[20] Bảng kê này có chứa chi tiết các chủng đối chứng được thể hiện bằng mỗi số WDCM và các chi tiết liên lạc của các bộ sưu tập giống. Tất cả các môi trường trích dẫn được quy định trong các tiêu chuẩn quốc tế (ISO) và tiêu chuẩn quốc gia (TCVN).
Nếu gặp phải sự biến đổi về chủng thì nghiên cứu ảnh hưởng của môi trường nuôi cấy (ví dụ: thu lấy cùng môi trường từ các nhà sản xuất khác nhau), thu lấy giống đối chứng bổ sung từ bộ sưu tập giống gốc. Người sử dụng phải phản hồi về sự biến đổi về chủng cho WG5 Môi trường nuôi cấy của ISO/TC34/SC9.
Các chú thích được sử dụng trong Bảng E.1 như sau:
a Tên gọi đầy đủ của các thuật ngữ môi trường viết tắt nêu trong Bảng E.2.
b Các chủng được sử dụng ít nhất;
c Tham khảo đến bảng kê chủng đối chứng có sẵn trên http://www.wfcc.info về thông tin số lượng chủng của bộ sưu tập giống và các chi tiết liên lạc.
d Chủng được chọn tự do, một trong các chủng được sử dụng ít nhất.
e L: môi trường lỏng; S: môi trường đặc; SS: môi trường bán đặc
f Phát triển/độ đục được phân loại như sau: 0 - không phát triển/không đục; 1 - phát triển yếu/hơi đục và 2 - phát triển/có đục (xem 7.4.2.1, 8.4.1).
g Escherichia coli WDCM 00013 được nêu trong tiêu chuẩn cụ thể.
h Escherichia coli WDCM 00013 là chất sản xuất ra β-d-gluconidase mạnh và WDCM 00202 chất sản xuất ra β-d-gluconidase yếu.
i Một số quy định và hạn chế của quốc gia về sử dụng typ huyết thanh khác. Xem các yêu cầu hiện hành về việc chọn typ huyết thanh Salmonella.
j Trong trường hợp sử dụng phép thử định tính và định lượng đối với môi trường thì chỉ cần các kết quả định lượng (xem Bảng E.1).
k Các chi tiết về kiểm soát chất lượng môi trường MSRV kể cả nồng độ cuối cùng của dịch cấy và các tiêu chí được nêu trong TCVN 4829 (ISO 6579).
l Nếu môi trường dinh dưỡng được sử dụng cho hai hoặc ba ứng dụng khác nhau: ít nhất là thực hiện phép thử phát triển Salmonella (nếu phòng thử nghiệm thực hiện thử vi sinh vật này).
m Nếu môi trường BPW được sử dụng cho hai hoặc ba ứng dụng khác nhau: ít nhất là thực hiện phép thử phát triển Salmonella (nếu phòng thử nghiệm thực hiện thử vi sinh vật này).
n Chọn các chủng theo phương pháp sử dụng trong đó TSA được dùng làm môi trường đối chứng.
Bảng E.1 - Các vi sinh vật thử nghiệm và các tiêu chí hiệu năng của môi trường nuôi cấy thường dùng trong vi sinh vật thực phẩm
| Môi trường chọn lọc để đếm vi sinh vật | |||||||||||
| Môi trường a | Typ | Vi sinh vật | Tiêu chuẩn | Chức năng | Ủ | Chủng đối chứng | Số WDCMc | Môi trường đối chứng | Phương pháp kiểm chứng | Chuẩn cứ | Các phản ứng đặc trưng |
| Thạch Listeria theo Ottaviani và Agosti | S | Listeria monocytognes | TCVN 7700-2 (ISO 11290-2) | Hiệu suất | (44 ± 4) h/ (37 ± 1)°C | Listeria monocytognes 4b Listeria monocytognes 1/2a | 00021 b
00109 | TSA | Định lượng | PR ≥ 0,5 | Khuẩn lạc màu xanh lục lam có quầng đục |
| Tính chọn lọc | Escherichia coli d
Enterococus taecalis d | 00012 hoặc 00013 00009 hoặc 00087 | - | Định tính | Ức chế toàn phần (0) | - | |||||
| Độ đặc hiệu | Listeria innocua | 00017 | - | Định tính | - | Khuẩn lạc màu xanh lục lam có quầng đục | |||||
| Baird -Parker | S | Staphylococci dương tính coagulase | TCVN 4830-1 (ISO 6888-1) | Hiệu suất | (24 ± 2) h đến (48 ± 2) h/ (37 ± 1) °C | Staphylococus aureus | 00034b 00032 | TSA | Định lượng | PR > 0,5 | Khuẩn lạc màu đen hoặc xám có quầng trong (phản ứng làm trong lòng đỏ trứng) |
| Tính chọn lọc | (48 ± 2) h/ (37 ± 1)°C | E. colid | 00012 00013 | - | Định tính | Ức chế toàn phần (0) | - | ||||
| Độ đặc hiệu | (24 ± 2) h đến (48 ± 2) h / (37 ± 1) °C | Staphytococus saprophyticus Staphylococus epidermidis | 00159b
00036 | - | Định tính | - | Khuẩn lạc màu đen hoặc xám không có phản ứng làm trong lòng đỏ trứng | ||||
| BGBLB | L | Coliform | TCVN 4882 (ISO 4831) | Hiệu suất | (24 ± 2) h đến (48 ± 2) h/ (30 ± 1)°C | E. coli Citrobacter freundii | 00012b 00013 00006 | - | Định tính | Đục (2)f và có khí trong ống Durham | Có sinh khí và có đục |
| Độ đặc hiệu | Enterococcus faecalisd | 00009 00087 | - | Định tính | Ức chế từng phần không sinh khí | - | |||||
| CFC | S | Pseudomonas spp. | TCVN 7138 (ISO 13720) | Hiệu suất | (44 ± 4) h/ (25 ± 1) °C | Pseudomonas fuorescens Pseudomonas fragi | 00115b
00116 | TSA | Định lượng | PR ≥ 0,5 | - |
| Tính chọn lọc | E colid | 00012 00013 | - | Định tính | Ức chế toàn phần (0) | - | |||||
| DG18 | S | Nấm men và nấm mốc | TCVN 8275-2 (ISO 21527-2) | Hiệu suất | 5 ngày/ (25 ± 1) °C | Sacchammyces cerevisiae | 00058b | SDA | Định lượng | PR ≥ 0,5 | Khuẩn lạc/chồi đặc trưng theo từng loài |
| Wallemia sebi | 00182b | ||||||||||
| Aspergillus restrictus | 00183 | ||||||||||
| Eurotium rubrum | 00184 | ||||||||||
| Tính chọn lọc | E. coli | 00012 hoặc 00013g | - | Định tính | Không phát triển | - | |||||
| Bacillus subtilis subsp. spizizenii | 00003 | ||||||||||
| DRBC | S | Nấm men và nấm mốc | TCVN 8275-1 (ISO 21527-1) | Hiệu suất | 5 ngày/ (25 ± 1) °C | Saccharomyces cerevisiae | 00058b | SDA | Định lượng | PR ≥ 0,5 | Khuẩn lạc/chồi đặc trưng theo từng loài |
| Aspergillus brasiliensis | 00053b | ||||||||||
| Candida albicans | 00054 | ||||||||||
| Mucor racemosus | 00181 | ||||||||||
| Tính chọn lọc | E. coli | 00012 hoặc 00013 g | - | Định tính | Không phát triển | - | |||||
| Bacillus subtilis subsp. spizizenii | 00003 | ||||||||||
| EC | L | E. coli | TCVN 6846 (ISO 7251) | Hiệu suất | (24 ± 2) h đến (48 ± 2) h/ (44 ± 1)°C | E. coli | 00012b 00013 | - | Định tính | Độ đục (2)f và khí trong ống Durham | Có sinh khí và có đục |
| Tính chọn lọc | Pseudomonas aeruginosa | 00025 | - | Định tính | Không phát triển | - | |||||
| IS (“TS”) | S | Vi khuẩn tạo sulfit | TCVN 7902 (ISO 15213) | Hiệu suất | (24 ± 3) h đến (48 ± 2) h/ (37 ± 1)°C môi trường kị khí | Closstridium perfringens | 00007b 00080 | TSA hoặc môi trường không chọn lọc khác đối với vi khuẩn kị khí | Định lượng | PR ≥ 0,5 | Khuẩn lạc màu đen |
| Tính chọn lọc | E. colid | 00012 00013 | - | Định tính | - | Khuẩn lạc không có màu đen | |||||
| LST | L | Coliform | TCVN 4882 (ISO 4831) | Hiệu suất | (24 ± 2) h đến (48 ± 2) h/ (30 ± 1)°C | E coli
| 00012b 00013 00006 | - | Định tính | Độ đục (2)f và khí trong ống Durham | Có sinh khí và có đục |
| Tính chọn lọc | Enterococcus faecalisd | 00009 00087 | - | Định tính | Không phát triển | - | |||||
| E. coli | TCVN 6846 (ISO 7251) | Hiệu suất | (24 ± 2) h đến (48 ± 2) h/ (37 ± 1)°C | E. coli | 00012b 00013 | - | Định tính | Độ đục (2)f và khí trong ống Durham | Có sinh khí và có đục | ||
| Tính chọn lọc | Enterococcus faecalisd | 00009 00087 | - | Định tính | Không phát triển | - | |||||
| mCCDA | S | Campylobacter | TCVN 7715-2 (ISO 10272-2) | Hiệu suất | (44 ± 4) h / (41.5 ± 1) °C môi trường hiếu khí | Campylobacter jejunid Campylobacter colid | 00156 00004 | Thạch máu | Định lượng | PR ≥ 0,5 | Khuẩn lạc màu xám nhạt, phẳng và ẩm, đôi khi có ánh màu kim loại |
| Tính chọn lọc | E. colid | 00012 hoặc 00013 | - | Định tính | - | - | |||||
| Staphylococcus aureus | 00034 | - | Định tính | - | - | ||||||
| MRS | S | Vi khuẩn sinh axit lactic | TCVN 7906 (ISO 15214) | Hiệu suất | (72 ± 3) h/ (30 ± 1) °C | Lactobacillus sakei | 00015b | Mẻ môi trường MRS đã được đánh giá | Định lượng | PR ≥ 0,7 | Khuẩn lạc đặc trưng theo từng loài |
| Lactococcus lactis | 00016b | ||||||||||
| Pediococcus pentosaceus | 00158 | ||||||||||
| Tính chọn lọc | E. colid
Bacillus cereus | 00012 hoặc 00013 00001 | - | Định tính | Ức chế toàn phần (0) | - | |||||
| MYP | S | Baclllus cereus | TCVN 4902 (ISO 7932) | Hiệu suất | (24 ± 3) h đến (44 ± 4) h/ (30 ± 1) °C | Bacillus cereus | 00001 | TSA | Định lượng | PR ≥ 0,5 | Khuẩn lạc màu hồng có quầng kết tủa |
| Tính chọn lọc | (44 ± 4) h/ (30 ± 1) °C | E. colid | 00012 hoặc 00013 | - | Định tính | Ức chế toàn phần (0) | - | ||||
| Độ đặc hiệu | Bacillus subtilis subsp. spizizenii | 00003 | - | Định tính | - | Khuẩn lạc màu vàng không có quầng kết tủa | |||||
| RPFA | S | Staphylococci dương tính coagulase | TCVN 4830-2 (ISO 6888-2) | Hiệu suất | (24 ± 2) h đến (48 ± 2) h/ (37 ± 1) °C | Staphylococcus aureus | 00034b 00032 | TAS | Định lượng | PR ≥ 0,5 | Khuẩn lạc màu đen hoặc xám có quầng mờ đục |
| Tính chọn lọc | (48 ± 2) h/ (37 ± 1) °C | E.colid | 00012 hoặc 00013 | - | Định tính | Ức chế toàn phần (0) | - | ||||
| Độ đặc hiệu | (24 ± 2) h đến (48 ± 2) h/ (37 ± 1)°C | Staphylococcus saprophyticus Staphytococcus epidermidis | 00159b 00036 | - | Định tính | - | Khuẩn lạc màu đen hoặc xám có quầng mờ đục | ||||
| PPA | S | Pseudomonas spp. | TCVN 8899 (ISO/TS 11059) | Hiệu suất | (48 ± 2) h/ (25 ± 1) °C | Pseudomonas fluorescens Pseudomonas aeruginosa | 00115b 00025 | TSA | Định lượng | PR ≥ 0,5 | - |
| Tính chọn lọc | E. colid | 00012 hoặc 00013 | - | Định tính | Ức chế toàn phần (0) | - | |||||
| TBX | S | E. coli dương tính β-D-glucuronidase | TCVN 7924-1 (ISO 16649-1) và TCVN 7924-2 (ISO 16649-2) | Hiệu suất | (21 ± 3) h/ (44 ± 1) °C | E.colih | 00012d 00013d 00202b | TSA | Định lượng | PR ≥ 0,5 | Khuẩn lạc màu xanh lam |
| Tính chọn lọc | Enterococcus faecalisd | 00009 00087 |
| Định tính | Ức chế toàn phần (0) | - | |||||
| Độ đặc hiệu | Citrobacter freundii Pseudomonas aeruginosa | 00006b
00025 |
| Định tính | - | Khuẩn lạc màu trắng đến xanh lục-xanh be | |||||
| TSC (SC) | S | Clostridium perfingens | TCVN 4991 (ISO 7937) | Hiệu suất | (21 ± 2) h/ (37 ± 1) °C môi trường kị khí | Clostridium perfingens | 00007 00080 | TSA hoặc môi trường không chọn lọc khác đối với vi khuẩn kị khí | Định lượng | PR ≥ 0,5 | Khuẩn lạc màu đen |
| Tính chọn lọc | E. colid | 00012 hoặc 00013 | - | Định tính | Ức chế toàn phần (0) | - | |||||
| Pseudomonas aeruginosa | 00025 |
|
|
|
| ||||||
| VRBG | S | Enterobacteriaceae | TCVN 5518-2 (ISO 21528-2) | Hiệu suất | (24 ± 2) h/ (37 ± 1) °C | E coli Salmonella Typhymuriumd,l Salmonella Enteritidisd,l | 00012b 00013
00030 | TSA | Định lượng | PR ≥ 0,5 | Khuẩn lạc màu hồng đến đỏ, có hoặc không có quầng kết tủa bên ngoài |
| Tính chọn lọc | Enterococcus faecalisd | 00009 00087 | - | Định tính | Ức chế toàn phần (0) | - | |||||
| VRBL | S | Coliform | TCVN 6848 (ISO 4832) | Hiệu suất | (24 ± 2) h/ (30 ± 1) °C | E.coli | 00012b 00013 | TSA | Định lượng | PR ≥ 0,5 | Khuẩn lạc màu đỏ tía, có hoặc không có quầng kết tủa |
| Tính chọn lọc | Enterococcus faecalisd | 00009 00087 | - | Định tính | Ức chế toàn phần (0) | - | |||||
| Độ đặc hiệu | Pseudomonas aeruginosa | 00025 |
| Định tính | - | Khuẩn lạc không màu đến màu be | |||||
| Môi trường không chọn lọc để đếm vi sinh vật | |||||||||||
| Môi trường | Typ | Vi sinh vật | Tiêu chuẩn | Chức năng | Ủ | Chủng đối chứng | Số WDCMc | Môi trường đối chứng | Phương pháp kiểm chứng | Chuẩn cứ | Các phản ứng đặc trưng |
| PCA MPCA | S | Đếm khuẩn lạc | ISO 4833 | Hiệu suất | (72 ± 3) h/ (30 ± 1) °C | Bacillus subtilis subsp. spizizenii E. coli S. aureus | 00003b 00012b 00034 | TSA | Định lượng | PR ≥ 0,7 | - |
| Môi trường tăng sinh chọn lọc | |||||||||||
| Môi trường | Typ | Vi sinh vật | Tiêu chuẩn | Chức năng | Ủ | Chủng đối chứng | Số WDCMc | Môi trường đối chứng | Phương pháp kiểm chứng | Chuẩn cứ | Các phản ứng đặc trưng |
| Bolton | L | Campylobacter | TCVN 7715-1 (ISO 10272-1) | Hiệu suất | (5 ± 1) h/ (37 ± 1) °C sau đó (44 ± 4) h/ (41,5 ± 1) °C môi trường hiếu khí | Campylobacter jejunid Campylobacter coli + E. Colid + Proteus mirabilis | 000156 hoặc 00005 00004 00012 00013 00023 | - | Định tính | >10 khuẩn lạc trên mCCDA | Khuẩn lạc màu xám nhạt, phẳng và ẩm đôi khi có ánh màu kim loại |
| Tính chọn lọc | E. colid Proteus mirabilis | 00012 00013 00023 | - | Định tính | Ức chế toàn phần (0) trên TSA | - | |||||
| EE | L | Enterobacteriaceae | TCVN 5518-1 (ISO 21528-1) | Hiệu suất | (24 ± 2) h/ (37 ± 1) °C | E. coli + Enterococcus faecalisd | 00012b 00009 hoặc 00087 | - | Định tính | >10 khuẩn lạc trên VRBG | Khuẩn lạc màu hồng đến đỏ có hoặc không có quầng kết tủa bên ngoài |
| Salmonella Typhimuriumi Salmonella Enteritidisi + Enterococcus faececalisd | 00031 hoặc 00030 00009 hoặc 00087 | ||||||||||
| Tính chọn lọc | Enterococcus faececalisd | 00009 hoặc 00087 | - | Định tính | Ức chế toàn phần (0) trên TSA | - | |||||
| Fraser | L | Listeria monocytogenes | TCVN 7700-1 (ISO 11290-1) | Hiệu suất | (48 ± 2) h/ (37 ± 1) °C | Listeria monocytogenes 4b | 00021b | - | Định tính | >10 khuẩn lạc trên thạch Listeria theo Ottaviani và Agosti | Khuẩn lạc màu xanh lục lam có quầng màu đục |
| + E. colid | 00012 hoặc 00013 | ||||||||||
| + Enterococcus faecalisd | 00009 hoặc 00087 | ||||||||||
| Listeria monocytogenes 1/2a | 00109 |
| |||||||||
| + E. colid | 00012 hoặc 00013 | ||||||||||
| + Enterococcus faecalisd | 00009 hoặc 00087 | ||||||||||
| Tính chọn lọc | E.colid | 00012 hoặc 00013 | - | Định tính | Ức chế toàn phần (0) trên TSA | - | |||||
| Enterococcus faecalisd | 00009 hoặc 00087 | - | Định tính | < 100 khuẩn lạc trên TSA | - | ||||||
| Giolitti Cantoni | L | Staphylococci dương tính coagulase | TCVN 4830-3 (ISO 6888-3) | Hiệu suất | (24 ± 2) h đến (48 ± 2) h / (37 ± 1) °C | S. aureus + E. colid | 00034b 00012 hoặc 00013 | - | Định tính | >10 khuẩn lạc trên Baird Parker hoặc RPFA | Khuẩn lạc đặc trưng theo từng môi trường (xem TCVN 4830-1 (ISO 6888-1) đối với Baird Parker và TCVN 4830-2 (ISO 6888-2) đối với RPFA) |
| S. aureus + E. Colid | 00032 00012 hoặc 00013 | ||||||||||
| Tính chọn lọc | (48 ± 2) h / (37 ± 1) °C | E. colid | 00012 hoặc 00013 | - | Định tính | Ức chế toàn phần (0) trên TSA | - | ||||
| Half-Fraser | L | Listeria monocytogenes | TCVN 7700-1 (ISO 11290-1) | Hiệu suất | (24 ± 2) h / (30 ± 1) °C | L. monocytogenes 4b | 00021b | - | Định tính | >10 khuẩn lạc trên Agar Listeria theo Ottaviani và Agosti | Khuẩn lạc màu xanh lục lam có quầng màu đục |
| + E. colid | 00012 hoặc 00013 | ||||||||||
| + Enterococcus faecalisd | 00009 hoặc 00087 | ||||||||||
| L. monocytogenes 1/2a | 00109 | ||||||||||
| + E. colid | 00012 hoặc 00013 | ||||||||||
| + Enterococcus faecalisd | 00009 hoặc 00087 | ||||||||||
| Tính chọn lọc | E. coli | 00012 hoặc 00013 | - | Định tính | Ức chế toàn phần (0) trên TSA | - | |||||
| + Enterococcus faecalisd | 00009 hoặc 00087 | - | Định tính | <100 khuẩn lạc trên TSA | - | ||||||
| ITC | L | Yersinia enterocolitica | TCVN 8127 (ISO 10273) | Hiệu suất | (44 ± 4) h / (25 ± 1) °C | Yersinia enterocolitica | 00038b | - | Định tính | >10 khuẩn lạc trên CIN hoặc SSDC | Khuẩn lạc đặc trưng theo từng môi trường [xem TCVN 8127 (ISO 10273)] |
| + E Colid | 00012 hoặc 00013 | ||||||||||
| + Pseudomonas aeruginosa | 00025 | ||||||||||
| Tính chọn lọc | Pseudomonas aeruginosa Proteus mirabilis | 00025 00023 | - | Định tính | Ức chế toàn phần (0) trên TSA | - | |||||
| MKTTn | L | Salmonella | TCVN 4829 (ISO 6579) | Hiệu suất | (24 ± 3) h / (37 ± 1) °C | Salmonella Enteritidisd,i | 00030 | - | Định tính | >10 khuẩn Iạc trên XID hoặc môi trường chọn lọc khác | Khuẩn lạc đặc trưng theo từng môi trường [xem TCVN 4829 (ISO 6579)] |
| Salmonella Typhimuriumd,i | 00031 | ||||||||||
| + E. colid | 00012 hoặc 00013 | ||||||||||
| + Pseudomonas aeruginosa | 00025 | ||||||||||
| Tính chọn lọc | E. colid | 00012 hoặc 00013 | - | Định tính | Ức chế từng phần < 100 khuẩn lạc trên TSA | - | |||||
| Enterococcus faecalisd | 00009 hoặc 00087 | - | Định tính | < 10 khuẩn lạc trên TSA | - | ||||||
| MSRVk | SS | Salmonella | TCVN 4829 (ISO 6579) | Hiệu suất | 2 x (24 ± 3) h / (41,5 ± 1) °C | Salmonella Enteritidisd,i Salmonella Typhimuriumd,i | 00030 00031 | - | Định tính | Giọt mẫu được ủ có vùng bao quanh màu trắng xám, đục sau 24 h đến 48 h vùng có màu đục sẽ trải rộng trên toàn đĩa | Khả năng cao: khuẩn lạc đặc trưng sau khi nuôi cấy lại trên XLD k |
| Tính chọn lọc | E. colid | 00012 hoặc 00013 | - | Định tính | Có thể phát triển ở vị trí giọt mẫu được ủ, không có vùng bị đục | - | |||||
| Enterococcus faecalisd | 00009 hoặc 00087 | - | Định tính | Không phát triển | - | ||||||
| MMG | L | E. coli dương tính β-D-glucuronidase | TCVN 7924-3 (ISO 16649-3) | Hiệu suất | (24 ± 3) h / (37 ± 1) °C | E. coli | 00012b 00013 | - | Định tính | Sinh axit | Khuẩn lạc thay đổi thành màu vàng |
| Tính chọn lọc | Enterococcus faecalisd | 00009 hoặc 00087 | - | Định tịnh | Không phát triển | - | |||||
| PSB | L | Yersinia enterocolitica | TCVN 8127 (ISO 10273) | Hiệu suất | 3 ngày đến 5 ngày (24 ± 3) h/ (25 ± 1) °C | Yersinia enterocolitica | 00038b | - | Định tính | > 10 huẩn lạc trên CIN hoặc SSDC | Khuẩn lạc đặc trưng theo từng môi trường [xem TCVN 8127 (ISO 10273)] |
| + E.Colid | 00012 hoặc 00013 | ||||||||||
| + Pseudomonas aeruginosa | 00025 | ||||||||||
| Yersinia enterocolitica | 00160 | ||||||||||
| + E.Colid | 00012 hoặc 00013 | ||||||||||
| + Pseudomonas aeruginosa | 00025 | ||||||||||
| Tính chọn lọc | Pseudomonas aeruginosa Proteus mirabilis | 00025 00023 | - | Định tính | Ức chế toàn phần (0) trên TSA | - | |||||
| RVS | L | Salmonella | TCVN 4829 (ISO 6579) | Hiệu suất | (24 ± 3) h/ (41,5 ± 1) °C | Salmonella Enreritidisd,i | 00030 | - | Định tính | > 10 khuẩn lạc trên XLD hoặc môi trường chọn lọc khác | Khuẩn lạc đặc trưng theo từng môi trường [xem TCVN 4829 (ISO 6579)] |
| Salmonella Typhimuriumd,i | 00031 | ||||||||||
| + E. colid | 00012 hoặc 00013 | ||||||||||
| + Pseudomonas aeruginosa | 00025 | ||||||||||
| Tính chọn lọc | E. colid | 00012 hoặc 00013 | - | Định tính | Ức chế từng phần < 100 khuẩn lạc trên TSA | - | |||||
| Enterococcus faecalisd | 00009 hoặc 00087 | - | Định tính | > 10 khuẩn lạc trên TSA | - | ||||||
| TSPB | L | Bacillus cereus | TCVN 7903 (ISO 21871) | Hiệu suất | (48 ± 4) h/ (30 ± 1) °C | Bacillus cereus | 00001 | - | Định tính | > 10 khuẩn lạc trên FEMBA hoặc MYP | Khuẩn lạc đặc trưng theo từng môi trường [xem TCVN 7903 (ISO 21871)] |
| Tính chọn lọc | E. colid | 00012 hoặc 00013 | - | Định tính | Ức chế toàn phần (0) trên TSA | - | |||||
| Môi trường lỏng không chọn lọc | |||||||||||
| Môi trườnga | Type | Vi sinh vật | Tiêu chuẩn | Chức năng | Ủ | Chủng đối chứng | Số WDCMc | Môi trường đối chứng | Phương pháp kiểm soát | Chuẩn cứ | Các phản ứng đặc trưng |
| BHI | L | Staphylococci dương tính coagulase | TCVN 4830-1 (ISO 6888-1) TCVN 4830-2 (ISO 6888-2) | Hiệu suất | (24 ± 2) h / (37 ± 1) °C | Staphylococcus aureus | 00034 | - | Định tính | Độ đục (1-2)f | - |
| Brucella | L | Campylobacter | TCVN 7715 (ISO 10272) (tất cả các phần) | Hiệu suất | 2 ngày đến 5 ngày/ (41,5 ± 1) °C môi trường hiếu khí | Campylobacter jejunid | 000156 hoặc 00005 | - | Định tính | Độ đục (1-2)f | - |
| Campylobacter colid | 00004 | ||||||||||
| Pha loãng với mục đích đặc biệt, ví dụ BPW có bromo-cresol- purpre | L | Chất lỏng pha loãng | TCVN 6507 (ISO 6887) (tất cả các phần) | Pha loãng | 45 min - 1 h/ 20 °C đến 25 °C | E colid Staphylococcus aureus | 00012 hoặc 00013 00034b | TSA | Định lượng | ± 30% khuẩn lạc/T0 (± 30 % số đếm) | - |
| Ringer dài một phần tư Dung dịch Pepton Muối pepton Dung dịch đệm phosphat | L | Chất lỏng pha loãng | TCVN 6507 (ISO 6887) (tất cả các phần) | Pha loãng | 45 min - 1 h/ 20 °C đến | E. colid Staphylococcus aureus | 00012 hoặc 00013 00034b | TSA | Định lượng | ± 30% khuẩn lạc/T0 (± 30 % số đếm gốc) | - |
| Thioglycollat | L | Clostridium perfringens | TCVN 4991 (ISO 7937) | Hiệu suất | (21 ± 3) h / (37 ± 1) °C | Clostridium perfringens | 00007 | - | Định tính | Độ đục (1-2)f | - |
| TSYEB | L | Listeria monocytogenes | TCVN 7700-1 (ISO 11290) (tất cả các phần) | Hiệu suất | (21 ± 3) h/ (25 ± 1) °C | Listeria monocytogenes 4b Listeria monocytogenes 1/2a | 00021b 00109 | - | Định tính | Độ đục (1-2)f | - |
| Môi trường phân lập chọn lọc | |||||||||||
| Môi trườnga | Type | Vi sinh vật | Tiêu chuẩn | Chức năng | Ủ | Chủng đối chứng | Số WDCMc | Môi trường đối chứng | Phương pháp kiểm chứng | Chuẩn cứ | Các phản ứng đặc trưng |
| Thạch Listeria theo Ottaviani và Agostii | S | Listeria monocytogenes | TCVN 7700 (ISO 11290) | Hiệu suất | (44 ± 4) h / (37 ± 1) °C | Listeria monocytogenes 4b | 00021b | - | Định tính | Phát triển tốt | Khuẩn lạc xanh lục lam có quầng đục |
| Listeria monocytogenes 1/2a | 00109 | ||||||||||
| Tính chọn lọc | Escherichia colid Enterococus faecalisd | 00012 hoặc 00013 00009 hoặc 00087 | - | Định tính | Ức chế toàn phần (0) | - | |||||
| Độ đặc hiệu | Listeria innocua | 00017 | - | Định tính | Phát triển tốt | Khuẩn lạc xanh lục lam không có quầng đục | |||||
| mCCDAj | S | Campylobacter | TCVN 7715 (ISO 10272) (tất cả các phần) | Hiệu suất | (44 ± 4) h / (41,5 ± 1) °C môi trường hiếu khí | Campylobacter jejunid Campylobacter coli | 000156 00005 00004 | - | Định tính | >10 khuẩn lạc trên mCCDA | Khuẩn lạc màu xám nhạt, phẳng và ẩm đôi khi có ánh màu kim loại |
| Tính chọn lọc | E. colid | 00012 hoặc 00013 | - | Định tính | Ức chế toàn phần hoặc từng phần (0-1) | Khuẩn lạc không đặc trưng | |||||
| Staphylococcus aureus | 00034 | - | Định tính | Ức chế toàn phần (0) | - | ||||||
| CT-SMAC | S | Escherichia coli O157 | TCVN 7686 (ISO 16654) | Hiệu suất | (21 ± 3) h / (37 ± 1) °C | E coli O157:H7 | 00014 (chuỗi không sinh độc tố) | - | Định tính | Phát triển tốt (2) | Khuẩn lạc trong suốt, dạng đĩa màu nâu vàng và đường kính ~ 1 mm |
| Tính chọn lọc | Staphylococcus aureusd | 00032 hoặc 00034 | - | Định tính | Ức chế toàn phần (0) | - | |||||
| E. colid | 00012 hoặc 00013 | - | Định tính | Ức chế từng phần (0) | Một số khuẩn lạc màu hồng phát triển | ||||||
| CIN SSDC | S | Yersinia enterocolitica | TCVN 8127 (ISO 10273) | Hiệu suất | (21 ± 3) h / (30 ± 1) °C | Yersinia enterocolitica | 00038b 00160 | - | Định tính | Phát triển tốt (2) | Khuẩn lạc đặc trưng theo từng môi trường [xem TCVN 8127 (ISO 10273)] |
| Tính chọn lọc | E.colid | 00012 hoặc 00013 | - | Định tính | Ức chế toàn phần hoặc từng phần (0-1) | Khuẩn lạc không đặc trưng | |||||
| Staphylococcus aureusd | 00034 | - | Định tính | Ức chế toàn phần (0) | - | ||||||
| CPC mCPC | S | Vibrio spp. ngoại trừ Vibrio parahaemolyticus/ V. cholerae | TCVN 7905-2 (ISO/TS 21872-2) | Hiệu suất | (24 ± 3) h / (37 ± 1) °C | Vibrio vulnificus | 00187b | - | Định tính | Phát triển tốt (2) | Khuẩn lạc màu vàng được bao quanh do nhuộm màu vàng môi trường |
| Vibrio cholerae non- 01/non-0139 | 00203b | - | Định tính | Phát triển tốt (2) | Khuẩn lạc đỏ tía được bao quanh do nhuộm màu đỏ tía môi trường | ||||||
| Tính chọn lọc | E.colid | 00012 hoặc 00013 hoặc 00090 | - | Định tính | Ức chế toàn phần (0) | - | |||||
| MYPj | S | Bacillus cereus | TCVN 7903 (ISO 21871) | Hiệu suất | (21 ± 3) h đến 48 h/ (30 ± 1) °C | Bacillus cereus | 00001 | - | Định tính | Phát triển tốt (2) | Khuẩn lạc màu hồng có quầng kết tủa |
| Tính chọn lọc | (44 ± 4) h/ (30 ± 1) °C | E. colid | 00012 hoặc 00013 | - | Định tính | Ức chế toàn phần (0) | - | ||||
| Độ đặc hiệu | Bacillus subtilis subsp. spizizenii | 00003 | - | Định tính | - | Khuẩn lạc màu vàng không có quầng kết tủa | |||||
| PEMBA | S | Bacillus cereus | TCVN 7903 (ISO 21871) | Hiệu suất | (21 ± 3) h đến (44 ± 4) h / (37 ± 1) °C | Bacillus cereus | 00001 | - | Định tính | Phát triển tốt (2) | Khuẩn lạc màu ngọc lam có quầng kết tủa |
| Tính chọn lọc | (44 ± 4) h/ (37 ± 1) °C | E. colid | 00012 hoặc 00013 | - | Định tính | Ức chế toàn phần (0) | - | ||||
| Độ đặc hiệu | Bacillus subtilis subsp. spizizenii | 00003 | - | Định tính | - | Khuẩn lạc màu trắng không có quầng kết tủa | |||||
| SDS | S | Vibrio spp. ngoại trừ Vibrio parahaemolyticus/ V.cholerae | TCVN 7905-2 (ISO/TS 21872-2) | Hiệu suất | (24 ± 3) h / (37 ± 1) °C | Vibrio vulnificus | 00187b | - | Định tính | Phát triển tốt (2) | Khuẩn lạc màu xanh lục/đỏ tía có quầng kết tủa |
| Vibrio cholerae non-01/non-0139 | 00203b | - | Định tính | Phát triển tốt (2) | Khuẩn lạc màu vàng có quầng kết tủa | ||||||
| Tính chọn lọc | E.colid | 00012 hoặc 00013 hoặc 00090 | - | Định tính | Ức chế toàn phần (0) | - | |||||
| TBXj | S | E coli dương tính β-D-glucuronidase | TCVN 7924-3 (ISO 16649-3) | Hiệu suất | (21 ± 3) h/ (44 ± 1) °C | E. colih | 00012d 00013d 00202b | - | Định tính | Phát triển tốt (2) | Khuẩn lạc màu xanh lam |
| Tính chọn lọc | Enterococcus faecalisd | 00009 hoặc 00087 | - | Định tính | Phát triển tốt (2) | - | |||||
| Độ đặc hiệu | Citrobacter freundii Pseudomonas aeruginosa | 00006b 00025 | - | Định tính | - | Khuẩn lạc màu trắng đến xanh lục-xanh be | |||||
| VRBGj | S | Enterobacteriaceae | TCVN 5518-1 (ISO 21528-1 | Hiệu suất | (24 ± 2 )h/ (37 ± 1) °C | E. coli Salmonella Typhimuriumi Salmonella Typhimuriumi | 00012b 00013 00031 hoặc 00032 | - | Định tính | Phát triển tốt (2) | Khuẩn lạc màu hồng đến đỏ, có hoặc không có quầng kết tủa bên ngoài |
| Tính chọn lọc | Enterococcus faecalisd | 00009 hoặc 00087 | - | Định tính | Ức chế toàn phần (0) | - | |||||
| XLD | S | Salmonella | TCVN 4829 (ISO 6579) | Hiệu suất | (24 ± 3) h / (37 ± 1) °C | Salmonella Typhimuriumd,i Salmonella Enteritidisd,i | 00031 00030 | - | Định tính |
| Khuẩn lạc có tâm màu đen và viền trong, màu đỏ nhạt do sự thay đổi màu của môi trường |
| Tính chọn lọc | E. colid | 00012 hoặc 00013 | - | Định tính | Phát triển hoặc ức chế từng phần (0-1) | Khuẩn lạc màu vàng | |||||
| Enterococcus faecalisd | 00009 hoặc 00087 | - | Định tính | Ức chế toàn phần (0) | - | ||||||
| Môi trường phân lập không chọn lọc | |||||||||||
| Môi trườnga | Type | Vi sinh vật | Tiêu chuẩn | Chức năng | Ủ | Chủng đối chứng | Số WDCMc | Môi trường đối chứng | Phương pháp kiểm chứng | Chuẩn cứ | Các phản ứng đặc trưng |
| Thạch dinh dưỡng | S | Enterobacteriaceae | TCVN 5518 (ISO 21528 (tất cả các phần) | Hiệu suất | (24 ± 3) h/ (37 ± 1) °C | E. coli | 00012b 00013 | - | Định tính | Phát triển tốt (2) | - |
| Salmonella | TCVN 4829 (ISO 6579) | (24 ± 3) h / (37 ± 1) °C | Salmonella Typhimuriumd,i Salmonella Enteritidisd,i | 00030 00031 | |||||||
| Yersinia enterocolitica | TCVN 8127 (ISO 10273) | (24 ± 2) h / (30 ± 1) °C | Yersinia enterocolitica | 00038h 000160 | |||||||
| TSYEA | S | Listeria monocytogenes | TCVN 7700 (ISO 11290) (tất cả các phần) | Hiệu suất | (21 ± 3) h/ (37 ± 1) °C | Listeria monocytogenes 4b Listeria monocytogenes 1/2a | 00021b
00109 | - | Định tính | Phát triển tốt (2) | - |
| Môi trường dùng cho nhiều mục đích | |||||||||||
| Môi trườnga | Type | Vi sinh vật | Tiêu chuẩn | Chức năng | Ủ | Chủng đối chứng | Số WDCMc | Môi trường đối chứng | Phương pháp kiểm chứng | Chuẩn cứ | Các phản ứng đặc trưng |
| BPWm | L | Pha loãng để đếm tất cả vi sinh vật | TCVN 6507 (ISO 6887) (tất cả các phần) TCVN 6507-5 (ISO 6887-5) | Pha loãng | 45 min đến 1 h/ 20 °C đến 25 °C | E. coli
Staphylococcus aureus | 00012b 00013 00034b | TSA | Định lượng | ± 30 % khuẩn lạc/T0 (± 30 % số đếm gốc) | - |
| BPWm |
| Pha loãng để đếm Listeria monocytogenes | TCVN 7700-2 (ISO 11290-2) | Pha loãng | (1 h ± 5 min) / (20 ± 2) °C | Listeria monocytogenes 4b Listeria monocytogenes 1/2a | 00021b
00109 | TSA | Định lượng | ± 30 % khuẩn lạc/T0 (± 30 % số đếm gốc) | - |
| Tăng sinh sơ bộ để phát hiện Salmonella | TCVN 4829 (ISO 6579) | Hiệu suất | (18 ± 2) h/ (37 ± 1) °C | Salmonella Typhimuriumd,i Salmonella Enteritidisd,i | 00031 00030 | - | Định tính | Độ đục (1-2)f | - | ||
| Tăng sinh sơ bộ để phát hiện Enterobacteri- aceae | TCVN 5518-1 (ISO 21528-1) | Hiệu suất | (18 ± 2) h/ (37 ± 1) °C | E. coli Salmonella Typhimuriumd,i Salmonella Enteritidisd,i | 00012b 00013 00031 hoặc 00032 | - | Định tính | Độ đục (1-2)f | - | ||
| Môi trường đối chứng đối với số đếm vi sinh vật | |||||||||||
| Môi trườnga | Type | Vi sinh vật | Tiêu chuẩn | Chức năng | Ủ | Chủng đối chứng | Số WDCMc | Môi trường đối chứng | Phương pháp kiểm soát | Chuẩn cứ | Các phản ứng đặc trưng |
| Thạch máu | S | Campylobacter | TCVN 7715-2 (ISO 10272-2) | Hiệu suất | (44 ± 4) h/ (41,5 ± 1) °C | Campylobacter jejunid Campylobacter coli | 000156 00005 00004 | Mẻ môi trường thạch máu đã được đánh giá | Định lượng | PR ≥ 0,7 | - |
| TSAn | S | Đếm khuẩn lạc | - | Hiệu suất | Theo qui định trong phương pháp mà TSA được dùng làm môi trường đối chứng | Bacillus cereus Bacillus subtilis supsp. spizizenii E. coli E. coli O157:H7 Listeria monocytogenes 4b Staphylococcus aureus | 00001 00003 00012 00014 (chủng không sinh độc tố) 00021 00034 | Mẻ môi trường TSA đã được đánh giá | Định lượng | PR ≥ 0,7 | Khuẩn lạc đặc trưng theo từng loài |
| SDA | S | Đếm khuẩn lạc | - | Hiệu suất | Theo qui định trong phương pháp mà SDA được dùng làm môi trường đối chứng | Saccharomyces cerevisiae Aspergillus brasiliensis | 00058b | Mẻ môi trường SDA đã được đánh giá | Định lượng | PR ≥ 0,7 | Khuẩn lạc/chồi/mầm đặc trưng theo từng loài |
| a Tên gọi đầy đủ của các môi trường viết tắt nêu trong Bảng E.2. b Các chủng được thử nghiệm ít nhất c Tham khảo bảng kê chủng đối chứng có sẵn trên http://www.wfcc.info về thông tin số lượng chủng của bộ sưu tập giống và các chi tiết liên lạc; d Chủng được chọn tự do, một trong các chủng được sử dụng ít nhất. e L: môi trường lỏng; S: môi trường đặc; SS: môi trường bán đặc f Phát triển/độ đục được phân loại như sau: 0 - không phát triển/không đục; 1 - phát triển yếu/hơi đục và 2 - phát triển/có đục (xem 7.4.2.1,8.4.1). g Escherichia coli WDCM 00013 được nêu trong tiêu chuẩn cụ thể. h Escherichia coli WDCM 00013 là chất sản xuất ra β-d-gluconidase mạnh và WDCM 00202 chất sản xuất ra β-d-gluconidase yếu i Một số quy định và hạn chế của quốc gia về sử dụng typ huyết thanh khác. Xem các yêu cầu hiện hành về việc chọn typ huyết thanh Salmonella. j Trong trường hợp sử dụng phép thử định tính và định lượng đối với môi trường thì chỉ cần các kết quả định lượng (xem Bảng E.1). k Các chi tiết về kiểm soát chất lượng môi trường MSRV kể cả nồng độ cuối cùng của chất cấy và các tiêu chí được nêu trong TCVN 4829 (ISO 6579). l Nếu môi trường dinh dưỡng được sử dụng cho hai hoặc ba ứng dụng khác nhau: ít nhất là thực hiện phép thử phát triển Salmonella (nếu phòng thử nghiệm thực hiện thử vi sinh vật này). m Nếu môi trường BPW được sử dụng cho hai hoặc ba ứng dụng khác nhau: ít nhất là thực hiện phép thử phát triển Salmonella (nếu phòng thử nghiệm thực hiện thử vi sinh vật này). n Chọn các chủng theo phương pháp có sử dụng TSA làm môi trường đối chứng. | |||||||||||
Bảng E.2 - Các thuật ngữ viết tắt về môi trường được sử dụng trong Bảng E.1
| Thuật ngữ môi trường viết tắt | Tên đầy đủ của môi trường | Tiêu chuẩn |
| Baird-Parker | Thạch Baird-Parker | TCVN 4830-1 (ISO 6888-1) |
| BGBLB | Canh thang lactose mật lục sáng | TCVN 4882 (ISO 4831) |
| BHI | Canh thang tim não | TCVN 4830-1 (ISO 6888-1) và TCVN 4830-3 (ISO 6888-3) |
| Bolton | Canh thang Bolton | TCVN 7715-1 (ISO 10272-1) |
| BPW | Nước đệm pepton | TCVN 6507 (ISO 6887) (tất cả các phần), TCVN 4829 (ISO 6579), TCVN 7700-2 (ISO 11290-2), TCVN 5518-1 (ISO 21528-1) |
| Brucella | Canh thang Brucella | TCVN 7715 (ISO 10272) (tất cả các phần) |
| CFC | Thạch xetrimit, fuxidin và xephacloridin | TCVN 7138 (ISO 13720) |
| CIN | Thạch cefsulodin, Irgasan novobiocin | TCVN 8127 (ISO 10273) |
| CPC | Thạch xenlulose polymixin B colistin | TCVN 7905-2 (ISO/TS 21872-2) |
| CT-SMAC | Thạch MacConkey sorbitol telurit xefixim | TCVN 7686 (ISO 16654) |
| DG18 | Thạch Dichloran glycerol | TCVN 8275-2 (ISO 21527-2) |
| DRBC | Thạch Dichloran-rose bengal chloramphenicol | TCVN 8275-1 (ISO 21527-1) |
| EC | Canh thang EC | TCVN 6846 (ISO 7251) |
| EE | Canh thang glucose mật lục sáng, có đệm | TCVN 5518-1 (ISO 21528-1) |
| Fraser | Canh thang Fraser | TCVN 7700-1 (ISO 11290-1) |
| Half-Fraser | Canh thang nửa Fraser | TCVN 8127 (ISO 10273) |
| IS (“TS”) | Thạch sắt sulfit (Thạch tryptose sulfit) | TCVN 7902 (ISO 15213) |
| ITC | Canh thang Irgasan, ticarcillin chlorat | TCVN 8127 (ISO 10273) |
| LST | Canh thang Lauryl sulfat, triptose lauryl | TCVN 4882 (ISO 4831) và TCVN 6846 (ISO 7251) |
| mCCDA | Thạch deoxycholat cefoperazon than cải biến | TCVN 7715 (ISO 10272) (tất cả các phần) |
| mCPC | Thạch colistin B polymyxin xellobiose cải biến | TCVN 7905-2 (ISO/TS 21872-2) |
| MKTTn | Môi trường novobiocin tetrathionate Muller- Kauffmann | TCVN 4829 (ISO 6579) |
| MMG | Môi trường glutamate khoáng cải biến | TCVN 7924-3 (ISO 16649-3) |
| MPCA | Thạch đếm đĩa có sữa gầy/thạch đếm đĩa có sữa | TCVN 4884 (ISO 4833) |
| MRS | Môi trường MRS (de Man, Rogosa và Sharpe) | TCVN 7906 (ISO 15214) |
| MSRV | Môi trường rappaport-Vassiliadis bán đặc cải biến | TCVN 4829 (ISO 6579) |
| MYP | Thạch mannitol lòng đỏ trứng polymyxin | TCVN 4992 (ISO 7932) |
| PCA | Thạch đếm đĩa | TCVN 4884 (ISO 4833) |
| PEMBA | Thạch bromothymol mannitol lòng đỏ trứng pyruvat polymyxin | TCVN 7903 (ISO 21871) |
| PPA | Thạch penicillin và pimaricin | TCVN 8899 (ISO/TS 11059) |
| PSB | Canh thang sorbitol và pepton muối mật | TCVN 8127 (ISO 10273) |
| RPFA | Thạch fibrinogen huyết tương thỏ | TCVN 4830-2 (ISO 6888-2) |
| RVS | Canh thang Rappaport-Vassiliadis pepton đậu tương | TCVN 4829 (ISO 6579) |
| SDA | Thạch Sabouraud dextrose | - |
| SDS | Thạch natri dodecyl sulfat polymyxin sucarose | TCVN 7905-2 (ISO/TS 21872-2) |
| SSDC | Thạch Salmonella Shigella deoxychotate và canxi | TCVN 8127 (ISO 10273) |
| TBX | Thạch trypton mật X-glucuronit | TCVN 7924 (ISO 16649) (tất cả các phần) |
| TCBS | Thạch sucarose, muối mật, xitrat và thiosulfat | TCVN 7905-1 (ISO/TS 21872-1) |
| Thioglycollate | Môi trường thioglycolat lỏng | TCVN 4991 (ISO 7937) |
| TSA | Thạch trypton đậu tương | - |
| TSC/SC | Thạch sulfit xycloserin/thạch sulfit xycloserin không chứa lòng đỏ trứng | TCVN 4991 (ISO 7937) |
| TSPB | Thạch polymyxin trypton đậu tương | TCVN 7903 (ISO 21871) |
| TSYEA | Thạch chất chiết nấm men trypton đậu tương | TCVN 7700 (ISO 11290) (tất cả các phần) |
| TSYEB | Canh thang chất chiết nấm men trypton đậu tương | TCVN 7700 (ISO 11290) (tất cả các phần) |
| VRBG | Thạch glucose mật đỏ tím | TCVN 5518 (ISO 21528) (tất cả các phần) |
| VRBL | Thạch lactose mật đỏ tím | TCVN 6848 (ISO 4832) |
| XLD | Thạch deoxycholate lysin xylose | TCVN 4829 (ISO 6579) |
Phụ lục F
(Quy định)
Các vi sinh vật thử nghiệm và các tiêu chí hiệu năng đối với môi trường nuôi cấy khuẩn lạc được sử dụng cho vi sinh vật trong nước
Các chủng đặc thù được chọn để thử nghiệm để đảm bảo sự nhất quán giữa các phòng thử nghiệm và để chứng minh sự khác nhau giữa các môi trường (giữa các mẻ, giữa các nhà sản xuất). Các chủng nêu trong Bảng F.1 đã được đánh giá đầy đủ để đảm bảo sự phù hợp và thống nhất về hiệu năng.
Khi có nhiều hơn một chủng được liệt kê cho mỗi khía cạnh của phép thử hiệu năng (hiệu suất, tính chọn lọc, tính đặc hiệu) thì ít nhất các chủng được sử dụng phải được viết rõ. Các nhà cung cấp môi trường thương mại hoặc phi thương mại dự kiến sử dụng các chủng bổ sung, ví dụ: các chủng nêu trong Bảng F.1 để đảm bảo thêm về chất lượng của môi trường nuôi cấy mà họ áp dụng.
Các tiêu chí này phải bao gồm trong các tiêu chuẩn cụ thể khi được xây dựng và soát xét. Mẻ môi trường nuôi cấy đã được đánh giá hiệu lực là mẻ môi trường đáp ứng được hiệu năng, số lượng chủng được quy định trong Bảng F.1 là số lượng từ bảng kê của các bộ định danh chủng phổ biến do Trung tâm Dữ liệu Thế giới về Vi sinh vật (WDCM) cung cấp. [20] Bảng kê này có chứa chi tiết các chủng đối chứng được thể hiện bằng mỗi số WDCM và các chi tiết liên lạc của các bộ sưu tập giống. Tất cả các môi trường trích dẫn được quy định trong các tiêu chuẩn quốc tế (ISO) và tiêu chuẩn quốc gia (TCVN).
Nếu gặp phải sự biến đổi về chủng, thì nghiên cứu ảnh hưởng của môi trường nuôi cấy (ví dụ: thu lấy cùng môi trường từ các nhà sản xuất khác nhau), thu lấy giống đối chứng bổ sung từ bộ sưu tập giống gốc. Người sử dụng phải phản hồi về sự biến đổi về chủng cho WG5 Môi trường nuôi cấy của ISO/TC34/SC9.
Các Chú thích được sử dụng trong Bảng F.1 như sau:
a Tên gọi đầy đủ của các thuật ngữ môi trường viết tắt nêu trong Bảng F.2.
b Các chủng được sử dụng ít nhất;
c Tham khảo đến bảng kê chủng đối chứng có sẵn trên http://www.wfcc.info về thông tin số lượng chủng của bộ sưu tập giống và các chi tiết liên lạc.
d Chủng được chọn tự do, một trong các chủng được sử dụng ít nhất.
e L: môi trường lỏng; S: môi trường đặc; SS: môi trường bán đặc
f Các chi tiết về môi trường Legionella, kể cả bảo quản các chủng đối chứng, được nêu trong ISO 11731.
g Các chi tiết về kiểm soát chất lượng và các tiêu chí chất lượng môi trường MUG/EC được nêu trong ISO 9308, Phụ lục E, còn tính chọn lọc không được quy định trong tiêu chuẩn này.
h Các chi tiết về kiểm soát chất lượng và các tiêu chí chất lượng môi trường MUD/EC được nêu trong ISO 7899-1:1998, Phụ lục E.
i Một số quy định và hạn chế của quốc gia về sử dụng typ huyết thanh khác. Xem các yêu cầu hiện hành về việc chọn typ huyết thanh Salmonella.
j Phát triển/độ đục được phân loại như sau: 0 - không phát triển/không đục; 1 - phát triển yếu/hơi đục và 2 - phát triển/có đục (xem 7.4.2.1, 8.4.1).
k Nếu môi trường dinh dưỡng được sử dụng cho hai hoặc ba ứng dụng khác nhau: ít nhất là thực hiện phép thử phát triển Salmonella (nếu phòng thử nghiệm thực hiện thử vi sinh vật này).
l Chọn các chủng theo phương pháp sử dụng trong đó TSA được dùng làm môi trường đối chứng.
Bảng F.1 - Các vi sinh vật thử nghiệm và các tiêu chí hiệu năng của môi trường nuôi cấy thường dùng trong vi sinh vật nước
| Môi trường chọn lọc để đếm vi sinh vật bằng cách so sánh với môi trường đối chứng không chọn lọc | |||||||||||
| Môi trườnga | Type | Vi sinh vật | Tiêu chuẩn | Chức năng | Ủ | Chủng đối chứng | Số WDCMc | Môi trường đối chứng | Phương pháp kiểm chứng | Chuẩn cứ | Các phản ứng đặc trưng |
| Colilert | L | E. coli/vi khuẩn Coliform | TCVN 6187-2 (ISO 9308-2) | Hiệu suất | (20 ± 2) h/ (36 ± 2) °C | E. coli | 00013b 00090 | TSA | Định lượng | PR ≥ 0,5 | Khuẩn lạc màu vàng và có huỳnh quang đối với E. coli |
| Klebsiella pneumoniae | 00206 | TSA | Định lượng | PR ≥ 0,5 | Khuẩn lạc màu vàng không nhạt hơn màu của mẫu kiểm chứng đối với vi khuẩn coliform | ||||||
| Tính chọn lọc | Pseudomonas aeruginosad | 00027 hoặc 00025 | - | Định tính | Ức chế toàn phần (0) | Khuẩn lạc màu vàng nhạt hơn màu của mẫu kiểm chứng | |||||
| GVPCf | S | Legionella | ISO 11731 và 11721-2 | Hiệu suất | 2 ngày đến 5 ngày/ (36 ± 2) °C | Legionella pneumophila | 00107b 00180 | BCYE | Định lượng | PR ≥ 0,5 | Khuẩn lạc màu trắng-xám-xanh tam-đỏ tía có gờ và tròn bóng đặc trưng |
| 5 ngày đến 10 ngày/ (36 ± 2) °C | Legionella anisa | 00106 | |||||||||
| Tính chọn lọc | 3 ngày/ (36 ± 2) °C | Enterococcus faecalisd | 00009 hoặc 00087 | - | Định tính | Ức chế toàn phần (0) | - | ||||
| Pseudomonas aeruginosad | 00026 hoặc 00025 | - | Định tính | Ức chế toàn phần hoặc từng phần (0) | - | ||||||
| E. colid | 00012 hoặc 00013 | ||||||||||
| Lactose TTC | S | E. coli/vi khuẩn Coliform | TCVN 6187-1 (ISO 9308-1) | Hiệu suất | (21 ± 3) h/ (44 ± 1) °C | E. coli Enterococcus aerogenes Citrobacter freundii | 00179b 00012 00175 00006 | TSA | Định lượng | PR ≥ 0,5 | Khuẩn lạc màu vàng trong môi trường có màng |
| Tính chọn lọc |
| Enterococcus faecalisd | 00009 hoặc 00087 | - | Định tính | Ức chế toàn phần (0) | - | ||||
| Độ đặc hiệu |
| Pseudomonas aeruginosad | 00025 hoặc 00026 | - | Định tính | - | Khuẩn lạc màu đỏ, xanh trong môi trường | ||||
| mCP | S | Clostridium perfingens | 98/83/EC | Hiệu suất | (21 ± 3) h/ (44 ± 1) °C môi trường kị khí | Clostridium perfingens | 00007b 00080 00174 | ISA hoặc môi trường không chọn lọc khác đối với vi khuẩn kị khí | Định lượng | PR ≥ 0,5 | Khuẩn lạc màu vàng; dương tính với phép thử phosphatase |
| Tính chọn lọc | Clostridium bifermentans | 00079 | - | Định tính | - | Khuẩn lạc màu xanh lam; âm tính với phép thử phosphatase | |||||
| Độ đặc hiệu | E. coli | 00012 hoặc 00013 | - | Định tính | Ức chế toàn phần (0) | - | |||||
| Pseudomonas CN | S | Pseudomonas aeruginosa | TCVN 8881 (ISO 16266) | Hiệu suất | (44 ± 4) h/ (36 ± 2) °C | Pseudomonas aeruginosa | 00024b 00025 00026 | TSA | Định lượng | PR ≥ 0,5 | Khuẩn lạc màu lục lam có huỳnh quang trong dải UV (360 ± 20 nm) |
| Tính chọn lọc | E. colid
| 00012 hoặc 00013 00009 hoặc 00087 | - | Định tính | Ức chế toàn phần (0) | - | |||||
| Slanetz và Bartley | S | Enterococci đường ruột | TCVN 6189-2 (ISO 7899-2) | Hiệu suất | (44 ± 4) h/ (36 ± 2) °C | Enterococcus faecalisd
Enterococcus faeciumd | 00009b 00087 00176 00177 00178 | TSA | Định lượng | PR ≥ 0,5 | Khuẩn lạc màu đỏ-nâu sẫm-hồng |
| Tính chọn lọc | E. colid
| 00012 hoặc 00013 00032 hoặc 00034 | - | Định tính | - | - | |||||
| Sắt sulfit Trypose sulfit (TS) | S | Vi khuẩn kị khí khử sulfit (clostridia) | TCVN 6191-2 (ISO 6461-2) | Hiệu suất | (44 ± 4) h/ (37 ± 1)°C môi trường yếm khí | Clostridium perfingens | 00007b 00080 | TSA hoặc môi trường thạch máu hoặc môi trường chọn lọc khác đối với vi khuẩn kị khí | Định lượng | PR ≥ 0,5 | Khuẩn lạc màu đen |
| Tính chọn lọc | E colid | 00012 hoặc 00013 | - | Định tính | - | Khuẩn lạc không có màu đen | |||||
| TSC | S | Clostridium perfingens | ISO 14189 | Hiệu suất | (21 ± 3) h/ (44 ± 1) °C môi trường kị khí | Clostridium perfingens | 00007b 00080 00174 | TSA hoặc môi trường thạch máu hoặc môi trường chọn lọc khác đối với vi khuẩn kị khí | Định lượng | PR ≥ 0,5 | Khuẩn lạc màu đen |
| Tính chọn lọc | Bacillus subtilis subsp. spizizenii | 00003 | - | Định tính | Ức chế toàn phần (0) | - | |||||
| Môi trường chọn lọc để đếm vi sinh vật bằng cách so sánh với mẻ đã được chấp nhận trước đó (sử dụng trong trường hợp đặc biệt) | |||||||||||
| Môi trườnga | Type | Vi sinh vật | Tiêu chuẩn | Chức năng | Ủ | Chủng đối chứng | Số WDCMc | Môi trường đối chứng | Phương pháp kiểm chứng | Chuẩn cứ | Các phản ứng đặc trưng |
| Colilert | L | E. coli/vi khuẩn coliform | TCVN 6187-2 (ISO 9308-2) | Hiệu suất | (20 ± 2) h/ (36 ± 2) °C | E. coli | 00013b 00090 | Mẻ Colilert được đánh giá trước đó | Định lượng | PR ≥ 0,7 | Khuẩn lạc màu vàng và có huỳnh quang đối với E. coli |
| Klebsiella pneumoniae | 00206 | Mẻ Colilert được đánh giá trước đó | Định lượng | PR ≥ 0,7 | Khuẩn lạc màu vàng không nhạt hơn màu của mẫu kiểm chứng đối với vi khuẩn coilform | ||||||
| Tính chọn lọc | Pseudomonas aeruginosad | 00027 hoặc 00025 | - | Định tính | Ức chế toàn phần (0) | Khuẩn lạc màu vàng nhạt hơn màu của mẫu kiểm chứng | |||||
| GVPCf | S | Legionella | ISO 11731 và 11721-2 | Hiệu suất | 2 ngày đến 5 ngày/ (36 ± 2)°C | Legionella pneumophila | 00107b 00180 | Mè môi trường GVPC đã được đánh giá | Định lượng | PR ≥ 0,5 | Khuẩn lạc màu trắng- xám-xanh lam-đỏ tía có gờ và tròn bóng đặc trưng |
| 5 ngày đến 10 ngày/ (36 ± 2)°C | Legionella anisa | 00106 | |||||||||
| Tính chọn lọc | 3 ngày/ (36 ± 2) °C | Enterococcus faecalisd | 00009 hoặc 00087 | - | Định tính | Ức chế toàn phần (0) | - | ||||
| Pseudomonas aeruginosad E. colid | 00026 hoặc 00025 00012 hoặc 00013 | - | Định tính | Ức chế toàn phần hoặc từng phần (0-1) | - | ||||||
| Lactose TTC | S | E. coli/vi khuẩn Coliform | TCVN 6187-1 (ISO 9308-1) | Hiệu suất | (21 ± 3) h/ (36 ± 2)°C | E. coli Enterococcus aerogenes Citrobacter freundii | 00179b 00012 00013 00175 00006 | Mẻ môi trường lactose TTC đã được đánh giá | Định lượng | PR ≥ 0,7 | Khuẩn lạc màu vàng trong môi trường có màng |
| Tính chọn lọc | Enterococcus faecalisd Pseudomonas aeruginosad | 00009 hoặc 00087 | - | Định tính | Ức chế toàn phần (0) | - | |||||
| Độ đặc hiệu | 00025 hoặc 00026 | - | Định tính | - | Khuẩn lạc màu đỏ, xanh trong môi trường | ||||||
| mCP | S | Clostridium perfingens | 98/83/EC | Hiệu suất | (21 ± 3) h/ (44 ± 1)°C môi trường kị khí | Clostridium perfingens | 00007b 00080 00174 | Mẻ môi trường mCP đã được đánh giá | Định lượng | PR ≥ 0,7 | Khuẩn lạc màu vàng; dương tính với phép thử phosphatase |
| Độ đặc hiệu | Clostridium bifermentans | 00079 | - | Định tính | - | Khuẩn lạc màu xanh lam; âm tính với phép thử phosphatase | |||||
| Tính chọn lọc |
| E colid | 00012 hoặc 00013 | - | Định tính | Ức chế toàn phần (0) | - | ||||
| Pseudomonas CN | S | Pseudomonas aeruginosa | TCVN 8881 (ISO 16266) | Hiệu suất | (44 ± 4) h/ (36 ± 2)°C | Pseudomonas aeruginosa | 00024b 00025 00026 | Mẻ môi trường pseudo- monas CN đã được đánh giá | Định lượng | PR ≥ 0,7 | Khuẩn lạc màu lục lam có huỳnh quang trong dải UV (360 ± 20 nm) |
| Tính chọn lọc | E. coli Enterococcus faecalisd | 00012 hoặc 00013 00009 hoặc 00087 | - | Định tính | Ức chế toàn phần (0) | - | |||||
| Slanetz và Bartley | S | Enterococci ruột | TCVN 6189-2 (ISO 7899-2) | Hiệu suất | (44 ± 4) h/ (36 ± 2) °C | Enterococcus faecalis
Enterococcus faeciumd | 00009b 00087 00176 00177 00178 | Mẻ môi trường Slarnetz và Bartley đã đánh giá | Định lượng | PR ≥ 0,7 | Khuẩn lạc màu đỏ-nâu sẫm-hồng |
| Tính chọn lọc | E. colid Staphylococcus aureusd | 00012 hoặc 00013 00032 hoặc 00034 | - | Định tính | Ức chế toàn phần (0) | - | |||||
| Sắt sulfit Trypose sulfit (TS) | S | Vi khuẩn kị khí khử sulfit (clostridia) | TCVN 6191-2 (ISO 6461-2) | Hiệu suất | (44 ± 4) h/ (37 ± 1)°C môi trường yếm khí | Clostridium perfingens | 00007b 00080 | Mẻ môi trường sắt sulfil hoặc TS đã được đánh giá | Định lượng | PR ≥ 0,7 | Khuẩn lạc màu đen |
| Tính chọn lọc | E. colid | 00012 hoặc 00013 | - | Định tính | - | Khuẩn lạc không có màu đen | |||||
| TSC | S | Clostridium perfingens | ISO 14189 | Hiệu suất | (21 ± 3) h/ (44 ± 1) °C môi trường kị khí | Clostridium perfingens | 00007b 00080 00174 | Mẻ môi trường TSC đã được đánh giá | Định lượng | PR ≥ 0,7 | Khuẩn lạc màu đen |
| Tính chọn lọc | Bacillus subtilis subsp. spizizenii | 00003 | - | Định tính | Ức chế toàn phần (0) | - | |||||
| Môi trường không chọn lọc đối với số đếm vi sinh vật | |||||||||||
| YEA | S | Flora tổng số | ISO 6222 | Hiệu suất | (44 ± 4) h/ (36 ± 2) °C | E. colid Bacillus subtilis subsp. spizizenii | 00012 hoặc 00013 00003 | Mẻ môi trường YEA đã được đánh giá | Định lượng | PR ≥ 0,7 | - |
| Môi trường tăng sinh chọn lọc | |||||||||||
| Môi trườnga | Type | Vi sinh vật | Tiêu chuẩn | Chức năng | Ủ | Chủng đối chứng | Số WDCMc | Môi trường đối chứng | Phương pháp kiểm chứng | Chuẩn cứ | Các phản ứng đặc trưng |
| Bolton preston | L | Campylobacter | ISO 17995 | Hiệu suất | (44 ± 4) h/ (37 ± 1) °C môi trường hiếu khí | Campylobacter jejunid Campylobacter colid + E. coli + Proteus mirabilis | 000156 00005 00004 00012 hoặc 00013 00023 | - | Định tính | > 10 khuẩn lạc trên mCCDA | Khuẩn lạc nhỏ, phẳng hoặc lồi, bề mặt bóng |
| Tính chọn lọc | E. colid Proteus mirabilis | 00012 hoặc 00013 00023 | - | Định tính | Ức chế toàn phần (0) trên TSA | - | |||||
| MUG/EVg | L | E. coli/vi khuẩn coliform | ISO 9308-3 | Hiệu suất | 48 h/ (44 ± 0,5) °C | E. coli | 00179 | Chi tiết về phương pháp kiểm soát và tiêu chí chất lượng của môi trường MUG/EC nêu trong Phụ lục E của ISO 9308-3:1998. | |||
| MUD/SFh | L | Enterococci ruột | TCVN 6189-1 (ISO 7899-1) | Hiệu suất | (44 ± 4) h/ (44 ± 0,5) °C | Enterucoccus faecalis Enterococcus hirae Enterococcus faecium | 00176 00177 00178 | Chi tiết về phương pháp kiểm soát và tiêu chí chất lượng của môi trường MUD/SF nêu trong Phụ lục E của TCVN 6189-2:2009 (ISO 7899-2:2000) | |||
| Tính chọn lọc | Aerococcus viridans Lactococcus lactis Staphylococcus epidermidis | 00061 00016 00132 | |||||||||
| RVS | L | Salmonella | TCVN 9717 (ISO 19250) | Hiệu suất | (24 ± 3) h/ (41,5 ± 1) °C | Salmonella Enteritidisd,i Salmonella Typhimuriumd,i + E. colid + Pseudomonas aeruginosa |
00031 00012 hoặc 00013 00025 | - | Định tính | > 10 khuẩn lạc trên XLD hoặc môi trường chọn lọc khác | Khuẩn lạc đặc trưng theo từng môi trường (xem tiêu chuẩn) |
| Tính chọn lọc | E. colid | 00012 hoặc 00013 | - | Định tính | Ức chế từng phần ≤ 100 khuẩn lạc trên TSA | - | |||||
| Enterococcus faecalisd | 00009 hoặc 00087 | - | Định tính | < 10 khuẩn lạc trên TSA | - | ||||||
| Môi trường chất lỏng không chọn lọc | |||||||||||
| Môi trườnga | Type | Vi sinh vật | Tiêu chuẩn | Chức năng | Ủ | Chủng đối chứng | Số WDCMc | Môi trường đối chứng | Phương pháp kiểm chứng | Chuẩn cứ | Các phản ứng đặc trưng |
| DRCM | L | Vi khuẩn kị khí khử sulfit (clostridia) | TCVN 6191-1 (ISO 6461-1) | Hiệu suất | (44 ± 4) h/ (36 ± 1) °C môi trường yếm khí | Clostridium perfingens | 00007b 00080 | - | Định tính | Độ đục (1-2)j | Khuẩn lạc màu đen |
| Độ đặc hiệu | E. colid | 00012 hoặc 00013 | - | Định tính | Độ đục (0-1)j | Khuẩn lạc không có màu đen | |||||
| Nước muối | L | Các dịch lỏng pha loãng | TCVN 9716 (ISO 8199) | Dịch pha loãng | 45 min đến 1 h/ (20 đến 25) °C | E.colid Staphylococcus aureus | 00012 hoặc 00013 00034 | TSA | Định lượng | ± 30 % khuẩn lạc/T0 (± 30 % số đếm ban đầu) | - |
| Dịch pha loãng pepton Dung dịch muối pepton Dung dịch Ringer (nồng độ 1/4) Dung dịch đệm phosphat | |||||||||||
| Môi trường phân lập chọn lọc | |||||||||||
| Môi trườnga | Type | Vi sinh vật | Tiêu chuẩn | Chức năng | Ủ | Chủng đối chứng | Số WDCMc | Môi trường đối chứng | Phương pháp kiểm chứng | Chuẩn cứ | Các phản ứng đặc trưng |
| mCCDA | S | Campylobacter | ISO 17995 | Hiệu suất | (44 ± 4) h / (41,5 ± 1) °C môi trường hiếu khí | Campylobacter jejunid Campylobacter colid | 000156 hoặc 00005 00004 | - | Định tính | Phát triển tốt (2) | Khuẩn lạc nhỏ, phẳng hoặc lồi có bề mặt bóng |
| Tính chọn lọc | + E colid | 00012 hoặc 00013 hoặc 00179 hoặc 00090 | - | Định tính | Ức chế toàn phần hoặc từng phần (0-1) | Khuẩn lạc không đặc trưng | |||||
| Staphylococcus aureusd | 00032 hoặc 00034 | - | Định tính | Ức chế toàn phần (0) | - | ||||||
| XLD | S | Salmonella | TCVN 9717 (ISO 19250) | Hiệu suất | (24 ± 3) h/ (36 ± 2) °C | Salmonella typhimuriumd,i Salmonella Enteritidisd,i | 00031 00030 | - | Định tính | Phát triển bình thường (2) | Khuẩn lạc có tâm màu đen và viền trong, màu đỏ nhạt do sự thay đổi màu của môi trường |
| Tính chọn lọc | E. colid | 00012 hoặc 00013 | - | Định tính | Phát triển hoặc ức chế từng phần (0-1) | Khuẩn lạc màu vàng | |||||
| Enterococcus faecalisd | 00009 hoặc 00087 | - | Định tính | Ức chế toàn phần (0) | - | ||||||
| Môi trường dùng cho nhiều mục đích | |||||||||||
| Môi trườnga | Type | Vi sinh vật | Tiêu chuẩn | Chức năng | Ủ | Chủng đối chứng | Số WDCMc | Môi trường đối chứng | Phương pháp kiểm chứng | Chuẩn cứ | Các phản ứng đặc trưng |
| BPWk | L | Pha loãng để đếm tất cả vi sinh vật | TCVN 6507 (ISO 6887) | Pha loãng | 45 min đến 1 h/ 20 °C đến 25 °C | E colid Staphylococcus aureus | 00012 hoặc 00013 00034 | TSA | Định lượng | ± 30% khuẩn lạc/T0 (± 30 % số đếm ban đầu) | - |
| Tăng sinh sơ bộ để phát hiện Salmonella | TCVN 9717 (ISO 19250) | Hiệu suất | (18 ± 2) h/ (36 ± 2) °C | Salmonella typhimuriumd,i Salmonella Enteritidisd | 00031 00030 | - | Định tính | Độ đục (1-2)j | - | ||
| Môi trường đối chứng đối với số đếm vi sinh vật | |||||||||||
| Môi trườnga | Type | Vi sinh vật | Tiêu chuẩn | Chức năng | Ủ | Chủng đối chứng | Số WDCMc | Môi trường đối chứng | Phương pháp kiểm chứng | Chuẩn cứ | Các phản ứng đặc trưng |
| BCYE | S | Đếm khuẩn lạc | ISO 11731 và ISO 111731-2 | Hiệu suất | 2 ngày đến 5 ngày/ (36 ± 2) °C | Legionella pneumophilla | 00107b | Mẻ môi trường BCYE đã được đánh giá | Định lượng | PR ≥ 0,7 | Khuẩn lạc màu trắng-xám-xanh lam-đỏ tía có gờ và tròn bóng đặc trưng |
| TSAl | S | Đếm khuẩn lạc | - | Hiệu suất | Theo qui định trong phương pháp mà TSA được dùng làm môi trường đối chứng | E. colid
Pseudomonas aeruginaso Enterococcus faecalis | 00012 00013 00090 00179 00007
00024 00087 | Mẻ môi trường TSA đã được đánh giá | Định lượng | PR ≥ 0,7 | Khuẩn lạc đặc trưng theo từng loài |
| a Tên gọi đầy đủ của các môi trường viết tắt nêu trong Bảng E.2. b Các chủng được thử nghiệm ít nhất c Tham khảo bảng kê chủng đối chứng có sẵn trên http://www.wfcc.info về thông tin số lượng chủng của bộ sưu tập giống và các chi tiết liên lạc; d Chủng được chọn tự do, một trong các chủng được sử dụng ít nhất. e L: môi trường lỏng; S: môi trường đặc; SS: môi trường bán đặc f Phát triển/độ đục được phân loại như sau: 0 - không phát triển/không đục; 1 - phát triển yếu/hơi đục và 2 - phát triển/có đục (xem 7.4.2.1, 8.4.1). g Escherichia coli WDCM 00013 được nêu trong tiêu chuẩn cụ thể. h Escherichia coli WDCM 00013 sinh β-d-gluconidase mạnh và WDCM 00202 sinh β-d-gluconidase yếu i Một số quy định và hạn chế của quốc gia về sử dụng typ huyết thanh khác. Xem các yêu cầu hiện hành về việc chọn typ huyết thanh Salmonella. j Phát triển/độ đục được xếp loại là: 0 - không phát triển/độ đục; 1 - phát triển yếu/độ đục; 2 - phát triển tốt/độ đục (xem 7.4.1.2; 8.4.1). k Nếu môi trường BPW được sử dụng cho hai hoặc ba ứng dụng khác nhau: ít nhất là thực hiện phép thử phát triển Salmonella (nếu phòng thử nghiệm thực hiện thử vi sinh vật này). l Chọn các chủng theo phương pháp có sử dụng TSA làm môi trường đối chứng. | |||||||||||
Bảng F.2 - Các thuật ngữ viết tắt về môi trường được sử dụng trong Bảng F.1
| Thuật ngữ môi trường viết tắt | Tên đầy đủ của môi trường | Tiêu chuẩn |
| BCYE | Môi trường chất chiết nấm men đệm than | ISO 11731 và ISO 11731-2 |
| Bolton | Canh thang Bolton | ISO 17995 |
| BPW | Nước đệm pepton | TCVN 6507 (ISO 6887), TCVN 9717 (ISO 19250) |
| DRCM | Môi trường phân biệt bổ sung clostridium | TCVN 6191-1 (ISO 6461-1) |
| GVPC | Thạch đệm than chất chiết nấm men bổ sung glycin, vancomycin, polymyxin B, cycloheximid | ISO 11731 và ISO 11731-2 |
| Lactose TTC | Thạch clorua triphenyltetrazolium lactose bổ sung natri heptadecylsulfat | TCVN 6187-1 (ISO 9308-1) |
| mCCDA | Thạch deoxycholat cefoperazon than cải biến | ISO 17995 |
| mCP | Thạch pertringen Clostridium dùng cho phương pháp lọc | 98/83/EC |
| MUD/SF | Môi trường 4-metylumbelliferyl-α-D glucoside /SF | TCVN 6189-1 (ISO 7899-1) |
| MUG/EC | Môi trường 4-metylumbelliferyl-β-D glucuronide /EC | ISO 9308-3 |
| Preston | Canh thang Preston | ISO 17995 |
| Pseudomonas CN | Thạch axit nalidixic xetrimid Pseudomonas | TCVN 8881 (ISO 16266) |
| RVS | Canh thang Rappaport-Vassiliadis pepton đậu tương | TCVN 9717 (ISO 19250) |
| Slanetz và Bartley | Môi trường Slanetz và Bartley | TCVN 6189-2 (ISO 7899-2) |
| Sắt sulfil | Thạch sắt sulfil | TCVN 6191-2 (ISO 6461-2) |
| Tryptose sulfit (TS) | Thạch tryptose sulfit | TCVN 6191-2 (ISO 6461-2) |
| TSA | Thạch trypton đậu tương | - |
| TSC | Thạch sulfit xycloserin tryptose (không chứa lòng đỏ trứng) | ISO 14189 |
| XLD | Thạch deoxycholat lysin xylose | TCVN 9717 (ISO 19250) |
| YEA | Chất chiết nấm men | ISO 6222 |
Phụ lục G
(Quy định)
Sử dụng các biểu đồ kiểm chứng để kiểm soát phép thử định lượng môi trường nuôi cấy đặc
G.1 Yêu cầu chung
Phụ lục này mô tả việc sử dụng biểu đồ kiểm chứng để theo dõi các kết quả, đặc biệt là kết quả biểu thị tỷ lệ hiệu suất, PR, như chi tiết trong 7.2, khi thử nghiệm thạch chọn lọc hoặc không chọn lọc dựa vào thạch đối chứng không chọn lọc hoặc các mẻ thạch chọn lọc tương tự đã được chấp nhận.
Cần chú ý khi sử dụng biểu đồ kiểm chứng để thử nghiệm giữa các mẻ của cùng loại thạch, như bất kỳ sự suy giảm chất lượng nào của các mẻ liên tiếp có thể không được rõ ràng, trừ khi các dung dịch huyền phù thử nghiệm được kiểm chứng cẩn thận để cho số lượng sinh vật thích hợp, hoặc sử dụng RM (xem 3.4.6). Bất kỳ hệ thống kiểm soát chất lượng môi trường nào dựa vào việc kiểm tra giữa các mẻ phải được xác nhận là phù hợp với mục đích trước khi đưa vào sử dụng.
Mỗi nguồn gốc và mẻ thạch thử nghiệm đều cho thấy mức độ khác nhau về hiệu suất và các phòng thử nghiệm riêng rẽ có thể sử dụng các thạch đối chứng khác nhau để so sánh với thạch thử nghiệm. Do đó, các phòng thử nghiệm riêng rẽ phải thiết lập và chứng minh các giới hạn của mình và/hoặc khoảng hệ số hiệu suất có thể được chấp nhận đối với mỗi loại thạch thử nghiệm sử dụng thường xuyên trong khoảng giá trị hệ số hiệu suất quy định trong 7.2.2.1.2. Các biểu đồ kiểm chứng được chuẩn bị từ các dữ liệu đánh giá xác nhận ban đầu, thiết lập các giới hạn chấp nhận sử dụng phân tích thống kê và sau đó các biểu đồ này được sử dụng để theo dõi các mẻ thạch tiếp theo. Thường xuyên đánh giá các giới hạn (ví dụ cứ sau mỗi 30 phép thử) và điều chỉnh khi cần (thông tin bổ sung được đưa ra trong G.2.6).
Các quy trình yêu cầu sử dụng dung dịch huyền phù vi sinh vật có nồng độ đã biết của chủng đích quy định cho môi trường thử nghiệm nêu trong Phụ lục E hoặc Phụ lục F; đây là giá trị đích đối với phép thử. Huyền phù thử nghiệm là RM thương mại (xem 3.4.6) hoặc được phòng thử nghiệm chuẩn bị từ các giống làm việc đã chuẩn hóa kỹ của các chủng đối chứng. Nồng độ vi sinh vật trong huyền phù phòng thử nghiệm (giá trị đích) phải cho thấy ổn định và đồng nhất trong suốt thời gian sử dụng.
Để tối ưu hóa việc kiểm soát, các huyền phù phải chứa xấp xỉ 100 cfu (khoảng 80 cfu tới 120 cfu) trong một thể tích dịch cấy được đưa lên đĩa thạch và thường thực hiện các phép thử ít nhất hai lần lặp lại. Bảng 1 (xem 5.4.2.5.1) cung cấp các giá trị về độ chụm ở các nồng độ dịch cấy khác nhau cho thấy tầm quan trọng của việc duy trì dịch cấy tối ưu này.
Các đĩa thạch phải được cấy bằng các kỹ thuật dàn bề mặt, đổ đĩa hoặc lọc màng, thích hợp với phương pháp chuẩn đối chứng mà thạch được sử dụng và được ủ trong các điều kiện quy định tại các tiêu chuẩn cụ thể đó.
Các khuẩn lạc có mặt trên hoặc trong mỗi đĩa phải được đếm phù hợp với các phương pháp chuẩn đối chứng và các hệ số hiệu suất tính được trong 7.2.1.1.
G.2 Sử dụng biểu đồ kiểm chứng
G.2.1 Yêu cầu chung
Để thiết lập một biểu đồ kiểm chứng mới, cần thực hiện ít nhất 10 phép thử trên các mẻ khác nhau của cùng loại thạch thử nghiệm, tốt nhất là thực hiện lặp lại hai lần và vào những ngày khác nhau do các người khác nhau thực hiện (các điều kiện tái lập nội phòng thử nghiệm). Sử dụng 20 phép thử (như trong G.2.2) sẽ cho giới hạn đáng tin cậy hơn so với biểu đồ được chuẩn bị từ 10 phép thử ban đầu (số lượng tối thiểu) phải được tính lại khi có sẵn 20 kết quả. Phải duy trì các biểu đồ riêng rẽ theo một dãy ít nhất 30 phép thử được giữ lại cho mỗi đánh giá chất lượng môi trường (xem G.2.6).
G.2.2 Dựng biểu đồ kiểm chứng
Quy trình này dựa trên dịch cấy chuẩn có chứa (100 ± 20) cfu trong 0,1 ml dịch cấy được sử dụng đối với phép thử sử dụng kỹ thuật dàn đĩa quy trình này. Cũng thích hợp khi sử dụng các thể tích khác của dịch cấy đối với các kỹ thuật khác như đổ đĩa hoặc lọc màng, với điều kiện là dịch cấy có chứa số lượng khuẩn lạc nằm trong dải chấp nhận (100 ± 20) cfu.
Trung bình của hai dãy số đếm lặp lại trên phép thử thứ i là xi cfu/0,1 ml đối với môi trường thử nghiệm và yi cfu/0,1 ml đối với môi trường đối chứng. Khi đó, hệ số hiệu suất của phép thử thứ i là xi / yi = ri. Đối với các dãy phép thử từ i = 1, 2, ...n, trong đó n là số tối thiểu 10 và tốt nhất là 20, sử dụng Công thức (G.1) để tính giá trị trung bình, ![]() của PR:
của PR:
![]() (G.1)
(G.1)
Sử dụng Công thức (G.2) để xác định các giá trị trung bình, ![]() của PR:
của PR:
![]() (G.2)
(G.2)
Trong đó:
i là số phép thử;
n là tổng số các phép thử;
ri là giá trị PR thứ i.
Xác định các độ lệch chuẩn (s) như sau:
![]() (G.3)
(G.3)
CHÚ THÍCH: Hằng số 0,8865 (hoặc nghịch đảo của 1,128) là chuẩn được ASTM khuyến cáo để xác định độ lệch chuẩn từ dải trung bình các giá trị thử nghiệm lặp lại hai lần.
Tính các giá trị giới hạn 95 % (± 2s) và 99 % (± 3s) của sự phân bố các kết quả.
Trên trục Y của biểu đồ kiểm chứng, đánh dấu các vị trí của giá trị trung bình tổng thể PR, ![]() , từng giá trị của hai giá trị trên (+2s và +3s) và hai giá trị dưới (-2s và -3s), sau đó vẽ các đường song song với trục X. Dựng các giá trị PR thứ 1, 2, … n trên trục X (xem ví dụ).
, từng giá trị của hai giá trị trên (+2s và +3s) và hai giá trị dưới (-2s và -3s), sau đó vẽ các đường song song với trục X. Dựng các giá trị PR thứ 1, 2, … n trên trục X (xem ví dụ).
Mỗi khi chuẩn bị mẻ môi trường mới, cần thử nghiệm sử dụng huyền phù dịch cấy chuẩn và PR tính được từ tỷ số của số cfu đếm được sau khi ủ ấm trên môi trường thử nghiệm và môi trường đối chứng như trên. Giá trị này được vẽ trên biểu đồ kiểm chứng và được kiểm tra lại dựa vào các giới hạn thu được.
G.2.3 Ví dụ về dựng biểu đồ kiểm chứng sử dụng 20 kết quả
Bảng G.1 cho các kết quả từ 20 lần kiểm tra hệ số hiệu suất liên tiếp trên các mẻ của chủng loại thạch thử nghiệm không chọn lọc sử dụng dịch cấy chuẩn 110 cfu/0,1 ml đếm được trên môi trường đối chứng không chọn lọc (số đếm chính xác trên môi trường đối chứng sẽ khác so với số đếm được trong thực tế, nhưng số liệu được dùng để đưa ra nguyên tắc của biểu đồ kiểm chứng là chỉ từ các hệ số hiệu suất tính được).
Bảng G.1 - Báo cáo kiểm tra hệ số hiệu suất của 20 lần liên tiếp trên thạch không chọn lọc dùng để xây dựng biểu đồ kiểm chứng (cho các số đếm thực chỉ trên môi trường thạch thử nghiệm, các số đếm trên môi trường đối chứng yi là 110 cfu)
|
| Kết quả số phép thử nghiệm (i) | |||||||||
| i = | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Cfu (thạch thử nghiệm - xi) | 95 | 102 | 94 | 97 | 105 | 68 | 98 | 105 | 103 | 116 |
| ri | 0,86 | 0,93 | 0,85 | 0,88 | 0,95 | 0,62 | 0,89 | 0,95 | 0,95 | 1,05 |
|
| - | 0,07 | 0,08 | 0,03 | 0,07 | - | 0,06 | 0,06 | 0,01 | 0,11 |
|
|
|
|
|
|
|
|
|
|
|
|
| i = | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| Cfu (thạch thử nghiệm - xi) | 95 | 90 | 89 | 116 | 114 | 110 | 114 | 98 | 88 | 102 |
| ri | 0,86 | 0,82 | 0,81 | 1,05 | 1,04 | 1,00 | 1,04 | 0,89 | 0,80 | 0,93 |
|
| 0,19 | 0,04 | 0,01 | 0,24 | 0,01 | 0,04 | 0,04 | 0,15 | 0,09 | 0,13 |
Cần lưu ý rằng kết quả dưới của phép thử số 6 trong ví dụ này của thạch không chọn lọc thấp hơn khoảng cho phép đối với giá trị chấp nhận PR từ 0,70 đến 1,40 của thạch không chọn lọc (xem 7.2.2.1.2) và tất cả các kết quả như thế được coi là ngoại lệ trong việc thu lấy độ lệch chuẩn và giá trị trung bình đối với biểu đồ kiểm chứng.
Các lý do kết quả thử nghiệm PR nằm ngoài dải cho phép cần được nghiên cứu vì chúng thường liên quan đến việc thực hiện không tốt quy trình thử nghiệm chứ không phải do chất lượng môi trường kém và thường tìm được khi dịch cấy được sử dụng nằm ngoài khoảng độ chụm quy định từ 80 cfu đến 120 cfu.
Giá trị PR trung bình bằng với:
![]() (G.4)
(G.4)
(thể hiện bằng đường kẻ đậm trên Hình G.1)
Khoảng các giá trị (R = |ri - ri-1|) được xác định là chênh lệch tuyệt đối của các giá trị liên tiếp, ngoại trừ giá trị bị loại (ví dụ: phép thử số 6 trong Bảng G.1 ở trên), nghĩa là:
0,93 - 0,86 = 0,07; 0,93 - 0,85 = 0,08; 0,88 - 0,85 = 0,03 v.v...
Giá trị trung bình bằng:
![]() (0,07 + 0,08 + 0,03 + ... + 0,09 + 0,13)/18 = 1,43/18 = 0,08 (G.5)
(0,07 + 0,08 + 0,03 + ... + 0,09 + 0,13)/18 = 1,43/18 = 0,08 (G.5)
Do đó, độ lệch chuẩn, s = 0,8865 x 0,08 = 0,071
Các giới hạn tin cậy 95 % (thể hiện bằng đường kẻ chấm nhạt trong Hình G.1) là:
0,92 ± 2 x 0,071 = 0,92 ± 0,14 = 0,78 đến 1,06 (G.6)
Các giới hạn tin cậy 99 % (thể hiện bằng đường kẻ chấm đậm trong Hình G.1) là:
0,92 ± 3 x 0,071 = 0,92 ± 0,21 = 0,78 đến 1,13 (G.7)
CHÚ DẪN:
Y hệ số hiệu suất, PR
X số phép thử
Hình G.1 - Biểu đồ kiểm chứng được xây dựng từ các hệ số hiệu suất thu được từ 20 lần kiểm tra đầu tiên nêu trong Bảng G.1 (đã loại trừ kết quả ngoại lệ số 6)
G.2.4 Đánh giá hiệu năng và giải thích kết quả
Mẻ môi trường nuôi cấy sẽ được chấp nhận nếu các tiêu chí chất lượng vi sinh lẫn tiêu chí chung (xem 6.2) đầu đáp ứng.
Mẻ môi trường mới bị loại bỏ nếu các kết quả sau đây xuất phát từ các phép thử định lượng nói trên không kiểm soát được như sau:
- vi phạm giới hạn ± 3s;
- hai trong ba quan sát trong hàng ngang vượt quá giới hạn cảnh báo ± 2s;
- sáu quan sát trong hàng ngang là tăng đều hoặc giảm đều;
- chín quan sát trong hàng ngang trên cùng một bên của giá trị trung bình.
CHÚ THÍCH: Tiêu chí của bốn quan sát trong hàng ngang vượt quá mức ± 1s cũng cho thấy có vấn đề.
G.2.5 Các cách tiếp cận khác để thử hiệu năng của môi trường
Quy trình sử dụng biểu đồ kiểm chứng để thử hiệu năng của môi trường nêu trên thu được để dựng đồ thị các giá trị PR mà không cần chuyển log10 của số đếm khuẩn lạc.
Những phương pháp thay được chấp nhận dựa trên đồ thị trực tiếp các số đếm khuẩn lạc hoặc số đếm khuẩn lạc chuyển về log10, nếu cho thấy thích hợp. Các phương pháp kiểm tra xem sự phân bố dữ liệu số đếm khuẩn lạc có phù hợp với phân bố chuẩn hay không khi không chuyền về log10 sử dụng phép thử Kolmogorov-Smimov hoặc phép thử khi-bình phương, các ví dụ được đưa ra trong NEN 6603. [39]
Tuy nhiên, cần lưu ý rằng nếu các số đếm không bao gồm hệ số pha loãng, khi đó không chắc biến đổi về log10 sẽ là thích hợp. Việc chuyển đổi trực tiếp số đếm (ví dụ 100 cfu/đĩa) cần giả định phân bố Poisson để chuyển đổi số đếm x là ![]() . Ngoài ra, trong tình huống bất kỳ khi số đếm khuẩn lạc được dựng đồ thị trực tiếp thì cần đảm bảo rằng mức dịch cấy thử nghiệm là không đổi giữa các phép thử, nếu không kết quả thu được sẽ bị sai.
. Ngoài ra, trong tình huống bất kỳ khi số đếm khuẩn lạc được dựng đồ thị trực tiếp thì cần đảm bảo rằng mức dịch cấy thử nghiệm là không đổi giữa các phép thử, nếu không kết quả thu được sẽ bị sai.
G.2.6 Xem xét định kỳ các biểu đồ kiểm chứng
Các biểu đồ kiểm chứng đầu tiên và tiếp theo đối với một môi trường thử nghiệm phải được xem xét định kỳ để đảm bảo rằng các giới hạn thiết lập vẫn còn chấp nhận được. Biểu đồ đầu tiên chứa tối thiểu là 20 điểm dữ liệu được xem xét để thiết lập giới hạn ban đầu và sau đó các biểu đồ tiếp theo có thể được xem xét tại các tần suất dự kiến cho mỗi 30 điểm dữ liệu bằng các quy trình dưới đây.
Một khi biểu đồ kiểm chứng được hoàn tất, tính lại giá trị trung bình và độ lệch chuẩn s, bỏ qua mọi kết quả nằm ngoài dải chấp nhận hoặc giới hạn thiết lập. Trường hợp sử dụng việc chuyển đổi về log10, thì thực hiện tất cả các phép tính sử dụng kết quả chuyển đổi log10.
So sánh độ lệch chuẩn của biểu đồ hiện hành với độ lệch chuẩn của tất cả các kết quả trước đó, stot, và kiểm tra biến thiên sử dụng các tiêu chí sau đây:
![]() (G.8)
(G.8)
Trong đó: F(0975; n - 1, ntot - 1) là giá trị của thử nghiệm F ở xác suất α = 0,025 tại quan sát thứ n của s và quan sát ntot của stot.
Biến thiên đã tăng đáng kể khi s không đáp ứng được tiêu chí này và cần tìm nguyên nhân.
Trường hợp độ lệch chuẩn của biểu đồ kiểm chứng đáp ứng được các tiêu chí, thì kết hợp với biểu đồ kiểm chứng tiếp theo [xem công thức (G.9) là ví dụ để tính toán].
Đồng thời so sánh giá trị trung bình, ![]() của biểu đồ hiện hành với trung bình của tất cả các quan sát trước đó,
của biểu đồ hiện hành với trung bình của tất cả các quan sát trước đó, ![]() và thử nghiệm sử dụng tiêu chí sau:
và thử nghiệm sử dụng tiêu chí sau:
![]() (G.9)
(G.9)
Trong đó:
![]() là giá trị trung bình của biểu đồ kiểm chứng hiện hành;
là giá trị trung bình của biểu đồ kiểm chứng hiện hành;
![]() là giá trị trung bình của tất cả các biểu đồ kiểm chứng trước đó;
là giá trị trung bình của tất cả các biểu đồ kiểm chứng trước đó;
s là độ lệch chuẩn của biểu đồ kiểm chứng;
stot là độ lệch chuẩn của tất cả các biểu đồ kiểm chứng trước đó;
n là tổng số quan sát của biểu đồ kiểm chứng hiện hành;
ntot là tổng số quan sát của tất cả các biểu đồ kiểm chứng trước đó.
Nếu trung bình của biểu đồ kiểm chứng hiện hành đáp ứng các tiêu chí thì kết hợp dữ liệu với các quan sát trước đối với cho biểu đồ kiểm chứng tiếp theo.
Bắt đầu điều tra về nguyên nhân có thể xảy ra nếu các tiêu chí không được đáp ứng. Nếu không tìm ra nguyên nhân, thì bắt đầu dựng biểu đồ kiểm chứng mới và thiết lập các giới hạn mới dựa trên những quan sát trước đây bằng cách tính toán lại các giới hạn từ giá trị trung bình và độ lệch chuẩn của tất cả các quan sát.
VÍ DỤ: Ví dụ về tính toán:
Các ví dụ về dữ liệu nêu trong Bảng G2, dựa vào ba biểu đồ kiểm chứng, mỗi biểu đồ có 30 quan sát xtot, stot và ![]() liên quan đến số liệu tổng hợp từ biểu đồ 1 và biểu đồ 2.
liên quan đến số liệu tổng hợp từ biểu đồ 1 và biểu đồ 2.
Một trong những quan sát trong biểu đồ thứ hai (số 22 được đánh dấu bằng chữ in nghiêng) vượt quá giới hạn chấp nhận được phòng thử nghiệm thiết lập từ dữ liệu của mình và quan sát này là do đó không được sử dụng trong việc tính toán.
Bảng G.2 - Dữ liệu đối với 3 biểu đồ kiểm chứng để đánh giá dựa vào các giới hạn đã thiết lập bởi phòng thử nghiệm (từ NEN 6603[39])
| Phép đo | Kết quả thử nghiệm | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
| Biểu đồ 1 | 100 | 77 | 108 | 75 | 83 | 92 | 70 | 81 | 90 | 88 |
| Biểu đồ 2 | 74 | 81 | 60 | 66 | 109 | 83 | 73 | 82 | 74 | 89 |
| Biểu đồ 3 | 89 | 75 | 67 | 63 | 90 | 77 | 90 | 75 | 53 | 91 |
|
|
|
|
|
|
|
|
|
|
|
|
| Phép đo | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| Biểu đồ 1 | 78 | 82 | 90 | 95 | 75 | 86 | 100 | 98 | 75 | 92 |
| Biểu đồ 2 | 80 | 83 | 95 | 71 | 98 | 74 | 76 | 92 | 84 | 88 |
| Biểu đồ 3 | 99 | 74 | 88 | 68 | 100 | 81 | 97 | 89 | 80 | 71 |
|
|
|
|
|
|
|
|
|
|
|
|
| Phép đo | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| Biểu đồ 1 | 74 | 80 | 98 | 79 | 82 | 91 | 78 | 90 | 65 | 60 |
| Biểu đồ 2 | 67 | 130 | 97 | 98 | 64 | 85 | 101 | 73 | 67 | 82 |
| Biểu đồ 3 | 63 | 84 | 82 | 84 | 99 | 79 | 86 | 70 | 72 | 98 |
|
|
|
|
|
|
|
|
|
|
|
|
| Tính các số liệu biểu đồ riêng rẽ | ||||||||||
|
|
| s | s2 |
|
| xtot | stot |
| Từ các số liệu tổng hợp của biểu đồ 1 và biểu đồ 2 | |
| Biểu đồ 1 | 84,4 | 11,1 | 122,7 |
|
| 83,0 | 11,7 | 136,1 | ||
| Biểu đồ 2 | 81,6 | 12,3 | 150,8 |
|
| - | - | - | ||
| Biểu đồ 3 | 81,1 | 12,1 | 147,5 |
|
| - | - | - | ||
Kiểm tra về biến thiên trong độ lệch chuẩn bằng cách so sánh độ lệch chuẩn, s, của biểu đồ cuối cùng (biểu đồ 3) với độ lệch chuẩn của hai biểu đồ đầu tiên (stot) như quy định trên đây để cho kết quả sau:
![]() (G.10)
(G.10)
Giá trị tới hạn là F(0,975; 29,58) = 1,83. Giá trị quan sát được này là nhỏ hơn giá trị tới hạn cho nên không có sự chênh lệch đáng kể giữa độ lệch chuẩn từ Biểu đồ 3 với hai biểu đồ trước đó (Biểu đồ 1 và Biểu đồ 2).
Sau đó kiểm tra nếu giá trị trung bình đã thay đổi như mô tả ở trên đối với các dữ liệu cho các kết quả như sau:
Dữ liệu đối với Biểu đồ 3 cho |81,1 - 83,0| = 1,9 và giá trị tới hạn cho:
![]() (G.11)
(G.11)
Giá trị tính được đối với Biểu đồ 3 là nhỏ hơn giá trị tới hạn do đó không có sự chênh lệch đáng kể giữa trung bình của Biểu đồ 3 với các biểu đồ trước đó (Biểu đồ 1 và Biểu đồ 2).
Khi thử nghiệm về biến thiên có hiệu lực, thì các dữ liệu từ Biểu đồ 3 được kết hợp với dữ liệu của các biểu đồ trước đó để tính các giới hạn mới. Như vậy, các biểu đồ mới được thực hiện trên cơ sở của giá trị trung bình 82,4 và độ lệch chuẩn 11,80.
Phụ lục H
(Tham khảo)
Đảm bảo chất lượng của môi trường nuôi cấy - Xử lý sự cố
Bảng H.1
| Bất thường | Lý do có thể |
| Môi trường thạch không đông đặc | Quá nhiệt trong quá trình chuẩn bị môi trường Độ pH thấp gây ra thủy phân axit Sử dụng khối lượng thạch không đúng Agar không hòa trộn kỹ Trộn các thành phần không kỹ |
| Độ pH không đúng | Quá nhiệt trong quá trình chuẩn bị môi trường Chất lượng nước kém Nhiễm bẩn hóa chất từ bên ngoài pH được đo tại nhiệt độ không chính xác Máy đo pH được hiệu chuẩn không đúng Chất lượng môi trường khô không tốt |
| Màu sắc khác thường | Quá nhiệt trong quá trình chuẩn bị môi trường Chất lượng nước kém Chất lượng môi trường khô không tốt Thiếu một hay nhiều thành phần Các thành phần được sử dụng không chính xác Độ pH không chính xác Nhiễm bẩn từ bên ngoài |
| Hình thành kết tủa | Quá nhiệt trong quá trình chuẩn bị môi trường Chất lượng nước kém Chất lượng môi trường khô không tốt Kiểm soát pH kém Nếu môi trường được chuẩn bị từ các thành phần riêng lẻ, thì có thể có tạp chất trong nguyên liệu |
| Môi trường bị ức chế/Hiệu suất thấp | Quá nhiệt trong quá trình chuẩn bị môi trường Chất lượng môi trường khô không tốt Chất lượng nước kém Công thức được sử dụng không đúng, ví dụ: các thành phần được cân không chính xác, chất bổ sung có nồng độ không đúng Có dư lượng chất độc hại trong bình chuẩn bị hoặc trong nước Chuẩn bị các vi sinh vật kiểm soát sinh vật không đúng cách |
| Tính chọn lọc/tính đặc hiệu kém | Quá nhiệt trong quá trình chuẩn bị môi trường Chất lượng môi trường khô không tốt Sử dụng công thức không đúng Chất bổ sung được thêm vào không đúng cách, ví dụ: cho vào khi môi trường quá nóng hoặc với nồng độ không đúng Chất bổ sung bị nhiễm bẩn Chuẩn bị các vi sinh vật kiểm soát sinh vật không đúng cách |
| Nhiễm bẩn | Khử trùng không đúng cách Kỹ thuật vô trùng kém Chất bổ sung bị nhiễm bẩn |
Phụ lục I
(Tham khảo)
Phép thử định lượng môi trường nuôi cấy lỏng
I.1 Yêu cầu chung
Phụ lục này đưa ra các phương pháp thử định lượng môi trường lỏng, có thể cung cấp thêm thông tin so với các phương pháp thông thường quy định trong Điều 8. Các phương pháp này chủ yếu được áp dụng để đánh giá môi trường đang được nghiên cứu và so sánh.
Chất lượng của môi trường lỏng với khía cạnh tối ưu hóa đặc tính phát triển được thể hiện rõ nhất trong giai đoạn đầu. Nhìn vào độ dài của pha trễ và tăng trưởng trong pha đầu cung cấp thông tin nhạy cảm nhất về hiệu suất và tính chọn lọc của các vi sinh vật đích và không phải đích tương ứng trong canh thang thử nghiệm và canh thang đối chứng. Do đó, nếu chỉ có khác biệt nhỏ về chất lượng, thì cấy vạch từ môi trường lỏng vào các đĩa sau thời gian ủ ngắn hơn, ví dụ: 6 h hoặc 12 h.
I.2 Phương pháp thử định lượng môi trường nuôi cấy lỏng không chọn lọc sử dụng các vi sinh vật đích
I.2.1 Cách tiến hành
- Chọn một lượng các ống, mỗi ống chứa ít nhất 10 ml môi trường hoặc các phần 10 ml từ mỗi mẻ cần thử nghiệm (xem 3.1.2).
- Sử dụng giống làm việc nêu trong 5.4.2.2.
- Nuôi cấy các vi sinh vật đích: Cấy canh thang thử nghiệm và môi trường đối chứng đặc cho mỗi vi sinh vật thử nghiệm ≤ 100 tế bào.
- Ủ các môi trường đã cấy theo các điều kiện quy định trong các tiêu chuẩn cụ thể.
- Chuẩn bị đủ các độ pha loãng từ môi trường đã ủ ấm để thu được số đếm khuẩn lạc (xem 5.4.2.5).
- Dàn đều thể tích đã đong, ví dụ 10 μl, trên một đĩa thạch không có chất ức chế như trong 7.2.2.1.1.
I.2.2 Đếm và diễn giải kết quả
Sau khi ủ, đếm số khuẩn lạc trên các đĩa (xem 7.2.2.1.1 và 7.2.2.1.2). Việc diễn giải các kết quả sẽ phụ thuộc vào mục tiêu của phép thử, ví dụ: so với mẻ trước đó, môi trường đối chứng hoặc RM.
Vi sinh vật đích cần đạt được 106 cfu/ml đến 108 cfu/ml.
I.2.3 Sơ đồ phương pháp định lượng đối với môi trường nuôi cấy lỏng không chọn lọc sử dụng vi sinh vật đích
Hình 1.1 là sơ đồ phương pháp định lượng đối với môi trường nuôi cấy lỏng không chọn lọc sử dụng các vi sinh vật đích.
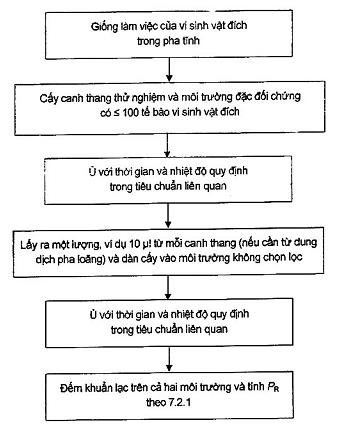
Hình I.1 - Sơ đồ phép thử hiệu năng của môi trường nuôi cấy lỏng không chọn lọc sử dụng các vi sinh vật đích (xem I.2.1 và I.2.2)
I.3 Phương pháp thử định lượng môi trường nuôi cấy lỏng chọn lọc sử dụng vi sinh vật đích và không phải đích
I.3.1 Cách tiến hành
- Chọn một lượng các ống, mỗi ống chứa ít nhất 10 ml môi trường hoặc các phần 10 ml từ mỗi mẻ cần thử nghiệm (xem 3.2.2).
- Sử dụng giống làm việc nêu trong 5.4.2.
- Nuôi cấy các vi sinh vật đích: cấy canh thang thử nghiệm, canh thang đối chứng và môi trường đối chứng đặc cho mỗi vi sinh vật thử nghiệm ≤ 100 tế bào. Môi trường đối chứng đặc được dùng để đếm cfu trong dịch cấy.
- Nuôi cấy các vi sinh vật không phải đích: Cấy canh thang thử nghiệm, canh thang đối chứng và môi trường đối chứng đặc cho mỗi vi sinh vật thử nghiệm ≥ 1 000 tế bào.
- Nuôi cấy hỗn hợp của các vi sinh vật đích và các vi sinh vật không phải đích: Để thử nghiệm các giống hỗn hợp trong canh thang thử nghiệm nuôi cấy môi trường chọn lọc, môi trường đối chứng và môi trường đối chứng đặc có ≤ 100 tế bào vi sinh vật đích và ≥ 1 000 tế bào của vi sinh vật không phải đích trong cùng một ống/trên cùng một đĩa thạch. Để thử nghiệm các giống hỗn hợp, dãn đều khi có thể trên các đĩa thạch không chọn lọc thạch cho phép phân biệt các vi sinh vật trong giống hỗn hợp (ví dụ: đĩa đếm thạch có MUG để đếm Escherichia coli và Salmonella spp.). Khi không thể phân biệt được giống cấy hỗn hợp trên môi trường thạch không chọn lọc, thì cần sử dụng môi trường thạch chọn lọc đã được thử hiệu năng.
- Ủ các môi trường đã cấy theo các điều kiện quy định trong các tiêu chuẩn cụ thể.
Lấy một lượng đã biết hoặc nếu cần, lấy một lượng sau khi pha loãng từ mỗi canh thang và dàn đều lên đĩa thạch không có chất ức chế đối với các ống chỉ chứa các vi sinh vật đích hoặc chỉ chứa các vi sinh vật không phải đích nêu trong 8.2.2. Đối với các ổng chứa cả vi sinh vật đích lẫn vi sinh vật không phải đích, dàn đều trên mỗi đĩa chứa cùng môi trường chọn lọc như đã sử dụng ở trên.
Phương pháp nhỏ giọt bề mặt Miles-Misra, các hệ thống nhỏ giọt khác hoặc đĩa xoắn cũng có thể được sử dụng để thu được số đếm khuẩn lạc trên các đĩa.
I.3.2 Đọc, tính và diễn giải kết quả
Đếm các khuẩn lạc của vi sinh vật đích và không phải đích trên từng đĩa và tính toán độ thu hồi so với canh thang đối chứng, có tính đến độ pha loãng được dùng để đếm (nếu cần). Trong trường hợp các giống cấy hỗn hợp, cần phân biệt các loại khác nhau.
Việc tính toán và diễn giải kết quả phụ thuộc vào mục đích của phép thử. Việc diễn giải các kết quả phụ thuộc vào mục đích của phép thử, ví dụ: so sánh với mẻ trước đó, môi trường đối chứng hoặc RM.
Vi sinh vật đích cần đạt được 106 cfu/ml đến 108 cfu/ml và cần có mặt vi sinh vật ư thế trong môi trường chọn lọc.
Đối với các giống cấy hỗn hợp, độ thu hồi vi sinh vật đích không được thấp hơn so với độ thu hồi của giống thuần của sinh vật đích.
I.3.3 Sơ đồ phương pháp định lượng đối với môi trường nuôi cấy lỏng có chọn lọc bằng cách sử dụng vi sinh vật đích và vi sinh vật không phải đích
Hình I.2 là sơ đồ phương pháp định lượng đối với môi trường nuôi cấy lỏng chọn lọc sử dụng vi sinh vật đích và vi sinh vật không phải đích.
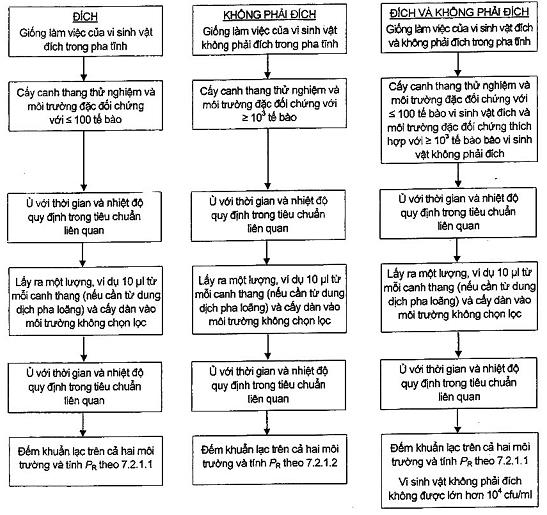
Hình I.2 - Sơ đồ phương pháp định lượng đối với môi trường nuôi cấy lỏng chọn lọc sử dụng vi sinh vật đích và vi sinh vật không phải đích (xem I.3.1 và I.3.2)
Phụ lục J
(Quy định)
Xác định các phép thử hiệu năng vi sinh vật đối với môi trường nuôi cấy chuẩn hóa
J.1 Khái quát
Phụ lục này đưa ra các hướng dẫn cho các nhà lãnh đạo nhóm công tác tiêu chuẩn hóa để họ xác định các tiêu chí hiệu năng vi sinh, các phương pháp và các chủng kiểm chứng, khi xây dựng hoặc soát xét các tiêu chuẩn về phân tích vi sinh vật (vi sinh vật trong thực phẩm hoặc vi sinh vật trong nước).
J.2 Yêu cầu chung
Các yêu cầu về hiệu năng vi sinh vật (tiêu chí hiệu năng, phương pháp kiểm chứng và các mục đích) có thể áp dụng cho các môi trường nuôi cấy chuẩn hóa phải bao gồm trong mỗi tiêu chuẩn phân tích vi sinh.
Các yêu cầu về hiệu năng có thể là:
- được sử dụng và được cải biến nếu cần, theo tiêu chuẩn này đối với các môi trường nuôi cấy có quy định trong tiêu chuẩn;
- hoặc tạo ra môi trường nuôi cấy mới bất kỳ, phù hợp với các nguyên tắc quy định trong phụ lục này.
CHÚ THÍCH: Việc xác định các yêu cầu hiệu năng của vi sinh vật này không đề cập đến thuốc thử hoặc môi trường để khẳng định.
J.3 Tiêu chí hiệu năng, phương pháp và các mục đích
Các tiêu chí được đánh giá (hiệu suất, tính chọn lọc, tính đặc hiệu), các phương pháp thử được sử dụng (phương pháp định lượng và định tính) và các mục đích cần đáp ứng phải được xác định theo các đặc trưng của từng môi trường nuôi cấy, như trong Bảng J.1 dưới đây:
- dạng môi trường (canh thang, thạch);
- thành phần môi trường (môi trường chọn lọc, môi trường không chọn lọc);
- chức năng của môi trường trong phương pháp chuẩn hóa (tăng sinh, pha loãng, phát hiện, định lượng).
Bảng J.1 - Tiêu chí, phương pháp thử và mục đích
| Môi trường | Tiêu chí và phương pháp thử |
| Canh thang định lượng chọn lọc | Hiệu suất (phương pháp: định lượng)e Tính chọn lọc (định tính)f |
| Thạch định lượng chọn lọc | Hiệu suất (phương pháp: định lượng)b Tính chọn lọc (định tính)g Tính đặc hiệu (định tính)i |
| Canh thang tăng sinh chọn lọc | Hiệu suất (phương pháp: định lượng)c Tính chọn lọc (định tính)h |
| Thạch phát hiện chọn lọc | Hiệu suất (phương pháp: định tính)d Tính chọn lọc (định tính)g Tính đặc hiệu (định tính)i |
| Thạch định lượng không chọn lọc | Hiệu suất (phương pháp: định lượng)b |
| Canh thang tăng sinh không chọn lọc | Hiệu suất (phương pháp: định tính)a |
| Canh thang pha loãng không chọn lọc | Hiệu suất (phương pháp: định lượng)e |
| Thạch phát hiện không chọn lọc | Hiệu suất (phương pháp: định tính)d |
| 1. Hiệu suất: mục đích của tiêu chí hiệu năng này là để kiểm tra xác nhận sự phát triển của các chủng đích (và hình thái khuẩn lạc) trên đĩa thạch. a Hiệu suất định tính (môi trường lỏng): xem 8.4. Mục đích: kết quả phải là 2 (tăng trưởng khả quan) đối với một dịch cấy ≤ 100 cfu các vi sinh vật đích (8.4.1). b Hiệu suất định lượng (môi trường thạch): xem 7.2.1.1. - Mục đích: PR phải ≥ 0,50 để so sánh môi trường chọn lọc với môi trường đối chứng không chọn lọc quy định trong các Phụ lục F và E. Các PR phải ≥ 0,70 để so sánh môi trường không chọn lọc với môi trường đối chứng không chọn lọc hoặc theo quy định trong tiêu chuẩn hoặc các Phụ lục F và E. Điều này cũng áp dụng cho các trường hợp đặc biệt, nếu thực hiện so sánh với mẻ trước đó. Các khuẩn lạc vi sinh vật đích phải có vẻ bên ngoài đặc trưng. c Định tính (môi trường lỏng): xem 8.3. Mục đích: Ít nhất 10 khuẩn lạc của vi sinh vật đích quan sát thấy trên môi trường phân lập chọn lọc được sử dụng để phát hiện sau khi cấy ≤ 100 cfu. d Hiệu suất định tính (môi trường thạch): xem 7.4. Mục đích: kết quả phải là 2 (tăng trưởng khả quan) các vi sinh vật đích. Các khuẩn lạc vi sinh vật đích phải có vẻ bên ngoài đặc trưng. e Hiệu suất định lượng (môi trường lỏng): xem 8.2. Mục đích: Đối vối các chất pha loãng, số lượng vi sinh vật sau thời gian tiếp xúc, phải nằm trong khoảng ± 30 % số lượng ban đầu. 2. Tính chọn lọc: mục đích của tiêu chí hiệu năng này là để xác minh rằng các chủng gây nhiễu (không phải đích) bị ức chế một phần hoặc hoàn toàn bởi môi trường chọn lọc. f Tính chọn lọc định tính (môi trường lỏng): xem 8.3. Mục đích: các vi sinh vật thử nghiệm (không mong muốn) bị ức chế hoàn toàn. g Tính chọn lọc định tính (môi trường thạch): xem 7.4. Mục tiêu: Các vi sinh vật thử nghiệm (không mong muốn) bị ức chế một phần hoặc hoàn toàn. h Tính chọn lọc định tính (môi trường lỏng): xem 8.3. Mục tiêu: Không phát triển (hoặc <10 cfu) các vi sinh vật (không mong muốn) trên môi trường thạch không chọn lọc được sử dụng để phát hiện. 3. Tính đặc hiệu: Mục đích của tiêu chí hiệu năng này là để xác minh rằng các chủng gây nhiễu (không phải đích) không bị ức chế không tạo ra các khuẩn lạc đặc trưng. ii Tính đặc hiệu định tính (môi trường thạch): xem 7.4. Mục đích: các khuẩn lạc của các chủng không phải đích thử nghiệm không được có vẻ bên ngoài của các vi sinh vật đích trong các phương pháp đã chuẩn hóa. Các tiêu chí này phải được kiểm tra xác nhận với thời gian và nhiệt độ ủ đã chuẩn hóa. | |
J.4 Chọn các chủng kiểm chứng hiệu năng
J.4.1 Yêu cầu chung
Mục đích của các tiêu chí hiệu năng khác nhau và phạm vi của phương pháp tiêu chuẩn hóa phải xác định việc chọn các chủng kiểm chứng, nghĩa là:
- Các chủng đích (hiệu suất) được phát hiện hoặc được định lượng trong phương pháp, và
- Các chủng không phải đích (tính chọn lọc, tính đặc hiệu) thuộc hệ thực vật gây nhiễu thường gặp trong các nền mẫu được phân tích.
Các chủng kiểm chứng được mô tả trong Phụ lục E và Phụ lục F, đã được thử nghiệm trên môi trường xác định, phải được sử dụng, nếu có thể.
Nếu chứng minh được (tính không ổn định di truyền, không đủ khả năng tái sinh của các chủng QC đã xác định trước đó v.v...), thì chủ trì dự án có thể đề xuất thay đổi các chủng yêu cầu, theo các hướng dẫn trong điều này.
J.4.2 Đánh giá sự phù hợp của các chủng kiểm chứng mới
Trước khi giới thiệu một chủng mới, thì sự phù hợp để sử dụng trong phép thử hiệu năng phải được đánh giá xác nhận và lập thành văn bản. Điều này đòi hỏi việc chứng minh khả năng lặp lại của phép kiểm soát hiệu năng ít nhất hai (tốt nhất là ba) phòng thử nghiệm độc lập, sử dụng hai hoặc ba lô hàng khác nhau của các công thức đã tiêu chuẩn hóa hoặc từ các nhà sản xuất thương mại khác nhau trong từng phòng thử nghiệm.
J.4.3 Môi trường mới
Đối với môi trường mới bất kỳ, các chủng kiểm chứng phải:
- được chọn ưu tiên từ các chủng được mô tả trong Phụ lục E hoặc Phụ lục F;
- được đánh giá trước đó và được chứng minh là phù hợp (xem J.4.2);
- hoặc mới được giới thiệu trong các điều kiện sau đây:
- tốt nhất là chúng có nguồn gốc từ thực phẩm hoặc từ các mẫu nước;
- chúng phải sẵn có trong ít nhất hai bộ sưu tập chủng quốc tế, với mức giá chấp nhận được;
- đã được đánh giá trước đó và được chứng minh là phù hợp (xem J.4.2).
J.4.4 Số lượng các chủng cho mỗi tiêu chí
Chú thích a của Bảng: hiệu suất định tính (môi trường lỏng): xem 8.4.
Hai chủng đích: chủng typ A và chủng typ B
Typ A: chủng được thử nghiệm trong kiểm soát chất lượng hiệu năng của nhà sản xuất môi trường và người sử dụng cuối cùng.
Typ B: chủng chỉ yêu cầu nhà sản xuất môi trường thử nghiệm.
Chú thích b của Bảng: hiệu suất định lượng (môi trường thạch): xem 7.2.1.1.
Hai chủng đích: chủng A và chủng B
Chú thích c của Bảng: hiệu suất định tính (môi trường lỏng): xem 8.3.
Hai chủng đích: chủng A và chủng B mỗi chủng liên quan đến hai chủng không phải đích.
Chú thích d của Bảng: hiệu suất định tính (môi trường thạch): xem 7.4.
Hai chủng đích: chủng A và chủng B.
Chú thích e của Bảng: hiệu suất định lượng (môi trường lỏng): xem 8.2
Hai chủng đích: chủng A và chủng B.
Chú thích f của Bảng: tính chọn lọc định tính (môi trường lỏng): xem 8.3
Hai chủng không phải đích: chủng A và chủng B
Chú thích g của Bảng: tính chọn lọc định tính (môi trường thạch): xem 7.4
Hai chủng không phải đích: chủng A và chủng B
Chú thích h của Bảng: tính chọn lọc định tính (môi trường lỏng): 8.3
Hai chủng không phải đích: chủng A và chủng B
Chú thích i của Bảng: tính chọn lọc định tính (môi trường thạch): 7.4
Một chủng không phải đích: chủng A
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] TCVN ISO 9000, Hệ thống quản lý chất lượng - Cơ sở và từ vựng
[2] TCVN ISO 9001, Hệ thống quản lý chất lượng - Các yêu cầu
[3] TCVN 8890:2011 (ISO Guide 30:1992 with A.mendment 1:2008), Thuật ngữ và định nghĩa sử dụng cho mẫu chuẩn
[4] ISO 6222, Water quality - Enumeration of culturable micro-organisms - Colony count by inoculation in a nutrient agar culture medium
[5] TCVN 4851 (ISO 3696), Nước dùng để phân tích trong phòng thí nghiệm - Yêu cầu kỹ thuật và phương pháp thử
[6] TCVN 7790-1 (ISO 2859-1), Quy trình lấy mẫu để kiểm tra định tính - Phần 1: Chương trình lấy mẫu được xác định theo giới hạn chất lượng chấp nhận (AQL) để kiểm tra từng lô
[7] TCVN 9331 (ISO/TS 22117), Vi sinh vật thực phẩm và thức ăn chăn nuôi - Hướng dẫn và các yêu cầu cụ thể về thử nghiệm thành thạo thông qua so sánh liên phòng thử nghiệm
[8] Nordic Committee on Food Analysis (NMKL) Procedure no 10, 2002, Control of microbiological media
[9] AUSTRALIAN SOCIETY FOR MICROBIOLOGY Guidelines for assuring quality of food and water microbiological culture media. Second Edition, 2014
[10] EUROPEAN PHARMACOPOEIA 2010 7th ed, Council of Europe, France. Chapters 2.6.12 and 2.6.13
[11] UNITED STATES PHARMACOPOEIA 2011, 35th ed, The United States Pharmacopoeial Convention, USA. Chapter 1117.Microbiological Best Laboratory Practice
[12] DIN 58942-4:2003, Medical Microbiology - Culture media - Transport systems for specimen containing bacteria
[13] DIN 58942-4, Suppl. 1:2003, Medical Microbiology - Culture media - Systems, media and conditions for the transport of selected pathogens in clinical specimens
[14] DIN 58959-6, Suppl. 1:1997, Quality management in medical microbiology - Requirements for control strains - Examples for production and preservation of bacteria used as stock cultures and working cultures
[15] DIN 58959-6, Suppl. 2:1997, Quality management in medical microbiology - Requirements for control strains - Examples for production and preservation of fungi used as stock cultures and working cultures
[16] DIN 58959-9, Suppl. 1:1997, Quality management in medical microbiology - Requirements for the use of control strains for testing culture media - Control strains for commonly used culture media
[17] DIN 58959-9, Suppl. 2:1997, Quality management in medical microbiology - Requirements for the use of control strains for testing culture media - Maximum storage times for ready-to-use culture media
[18] DIN 58959-10:1997, Quality management in medical microbiology - Requirements for the use of control strains for testing reagents, dyes and biological materials
[19] DIN 58959-10, Suppl. 1:1997, Quality management in medical microbiology - Requirements for the use of control strains for testing reagents, dyes and biological materials - Control strains for commonly used materials
[20] WORLD DATA CENTRE FOR MICROORGANISMS Reference Strain Catalogue pertaining to organisms for performance testing of culture media. Available (viewed 2013-10-14) at http://www.wfcc.info
[21] J.E.L. Corry, G.D.W. Curtis, R.M. Baird eds. Handbook of Culture Media for Food and Water Microbiology. Royal Society of Chemistry, UK, Third Edition, 2012
[22] G.D.W. Curtis, R.M. Baird, N.P. Skovgaard, J.E.L. Corry Int. J. Food Microbiol. 1998, 45 p. 65 [A statement from the IUMS-ICFMH working party on culture media II]
[23] C. Bell, P. Neaves, A.P. Williams Food Microbiology and Laboratory Practice. Blackwell Science, Oxford, 2005
[24] J.H. Hagemann Single, chemically defined sporulation medium for Bacillus subtilis. J. Bacteriol. 1984, 160 pp. 438-441
[25] V.K. Sharma, P.N. Hobson A sporulation medium for strict anaerobes. Lett. Appl. Microbiol. 1985, 1 pp. 31-32
[26] B. Jarvis Statistical aspects of the microbiological examination of foods. Academic Press, London, Second Edition, 2008
[27] A.M. Cundell, S. Chatellier, P. Schumann, R. Lilischkis Equivalence of quality control strains of microorganisms used in the compendial microbiological tests: are national culture collection strains identical? PDA J. Pharm. Sci. Technol. 2010, 64 pp. 137-155
[28] L.J. Cross, J.E. Russell, M. Desai Examining the genetic variation of reference microbial cultures used within food and environmental laboratories using fluorescent amplified fragment length polymorphism analysis. FEMS Microbiol. Lett. 2011, 321 (2) pp. 100-106
[29] J.F. Schijven, A.H. Havelaar, M. Bahar A simple and widely applicable method for preparing homogeneous and stable quality control samples in water microbiology. Appl. Environ. Microbiol. 1994, 60 (11) pp. 4160-4162
[30] R. Araujo, A.G. Rodrigues, C. Pina-Vaz A fast practicable and reproducible procedure for standardization of the cell density of an Aspergillus inoculums. J. Med. Microbiol. 2004, 53 pp. 783-786
[31] M. Wesche Stress, sublethal injury, resuscitation, and virulence of bacterial foodborne pathogens. J. Food Prot. 2009, 72 (5) pp. 1121-1138
[32] DB Kell 1998, Viability and activity in readily culturable bacteria: a review and discussion of the practical issues. A v Leeuwenhoek 73 pp. 169-187
[33] N.J. Rowan Viable but non-culturable forms of food and waterbome bacteria: Quo Vadis? Trend Food Sciences. 2004,15 pp. 462-467
[34] TCVN 6910-6 (ISO 5725-6), Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo - Phần 6: Sử dụng các giá trị độ chính xác trong thực tế
[35] G.M. Garrity ed. et al. Bergey’s Manual of Systematic Bacteriology. 2nd ed. Springer, New York, NY, USA, 2001-2012
[36] AMERICAN TYPE CULTURE COLLECTION Bacterial Culture Guide. Manassas, VA, USA, 2012
[37] AMERICAN TYPE CULTURE COLLECTION Preservation and recovery of filamentous fungi. Tech.Bull. No 2 Manassas, VA, USA, 2011
[38] AMERICAN TYPE CULTURE COLLECTION Reference strains - How many passages are too many? Tech. Bull, No 6 Manassas, VA, USA, 2011
[39] NEN 6603, Environmental and Food - Internal quality control by the use of control charts with chemical and microbiological analysis
[40] TCVN 4882 (ISO 4831), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp phát hiện và định lượng coliform - Kỹ thuật đếm số có xác suất lớn nhất
[41] TCVN 6848 (ISO 4832), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp định lượng coliform - Kỹ thuật đếm khuẩn lạc
[42] TCVN 4884 (ISO 4833), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp định lượng vi sinh vật trên đĩa thạch - Kỹ thuật đếm khuẩn lạc ở 30 độ C
[43] TCVN 6191-1 (ISO 6461-1), Chất lượng nước - Phát hiện và đếm số bào tử vi khuẩn kị khí khử sunfit (clostridia) - Phần 1: Phương pháp tăng sinh trong môi trường cấy lỏng
[44] TCVN 6191-2 (ISO 6461-2), Chất lượng nước - Phát hiện và đếm số bào tử vi khuẩn kị khí khử sunfit (clostridia) - Phần 2: Phương pháp màng lọc
[45] TCVN 4829 (ISO 6579), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp phát hiện Salmonella trên đĩa thạch
[46] Sửa đổi 1:2008 TCVN 4829:2005 (ISO 6579:2002, Amd. 1:2007), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp phát hiện Salmonella spp. trên đĩa thạch - Sửa đổi 1: Phụ lục D: Phát hiện Salmonella spp. trong phân động vật và trong mẫu môi trường từ giai đoạn sản xuất ban đầu
[47] TCVN 4830-1 (ISO 6888-1), Vi sinh vật trong thục phẩm và thức ăn chăn nuôi - Phương pháp định lượng staphylococci có phản ứng dương tính coagulase (Staphylococcus aureus và các loài khác) trên đĩa thạch - Phần 1: Kỹ thuật sử dụng môi trường thạch Baird-Parker
[48] TCVN 4830-2 (ISO 6888-2), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp định lượng staphylococci có phản ứng dương tính coagulase (Staphylococcus aureus và các loài khác) trên đĩa thạch - Phần 2: Kỹ thuật sử dụng môi trường thạch fibrinogen huyết tương thỏ
[49] TCVN 4830-3 (ISO 6888-3), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp định lượng Staphylococci có phản ứng dương tính với coagulase (Staphylococcus aureus và các loài khác) trên đĩa thạch - Phần 3: Phát hiện và dùng kỹ thuật đếm số có xác suất lớn nhất (MPN) để đếm số lượng nhỏ
[50] TCVN 6846 (ISO 7251), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp phát hiện và định lượng Escherichia coli giả định - Kỹ thuật đếm số có xác suất lớn nhất
[51] TCVN 6189-1:2009 (ISO 7899-1:1998 with Cor 1:2000), Chất lượng nước - Phát hiện và đếm khuẩn đường ruột - Phần 1: Phương pháp thu nhỏ (số có xác suất lớn nhất) đối với nước mặt và nước thải
[52] TCVN 6189-2:2009 (ISO 7899-2:2000), Chất lượng nước - Phát hiện và đếm khuẩn đường ruột - Phần 2: Phương pháp lọc màng
[53] TCVN 4992 (ISO 7932), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp định lượng Bacillus cereus giả định trên đĩa thạch - Kỹ thuật đếm khuẩn lạc ở 30 độ C
[54] TCVN 4991 (ISO 7937), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi- Phương pháp định lượng Clostridium pertringens trên đĩa thạch - Kỹ thuật đếm khuẩn lạc
[55] TCVN 6187-1 (ISO 9308-1), Chất lượng nước - Phát hiện và đếm Escherichia coli và vi khuẩn coliform - Phần 1: Phương pháp lọc màng
[56] TCVN 6187-2 (ISO 9308-2), Chất lượng nước - Phát hiện và đếm Escherichia coli và vi khuẩn coliform - Phần 2: Phương pháp nhiều ống (số có xác suất cao nhất)
[57] ISO 9308-3:1998, Water quality- Detection and enumeration of Escherichia coli and coliform bacteria - Part 3: Miniaturized method (Most Probable Number) for the detection and enumeration of E. coli in surface and waste water
[58] TCVN 7715-1 (ISO 10272-1), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp phát hiện và định lượng Campylobacter spp. - Phần 1: Phương pháp phát hiện
[59] TCVN 7715-2 (ISO/TS 10272-2), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp phát hiện và định lượng Campylobacter spp. - Phần 2: Kỹ thuật đếm khuẩn lạc
[60] TCVN 7715-3 (ISO/TS 10272-3), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp phát hiện và định lượng Campylobacter spp. - Phần 3: Phương pháp bán định lượng
[61] TCVN 8127 (ISO 10273), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phát hiện Yersinia enterocolitica gây bệnh giả định
[62] TCVN 8899 (ISO/TS 11059), Sữa và sản phẩm sữa - Phương pháp định lượng Pseudomonas spp.
[63] TCVN 7700-1 (ISO 11290-1), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp phát hiện và định lượng Listeria monocytogenes - Phần 1: Phương pháp phát hiện
[64] TCVN 7700-2 (ISO 11290-2), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp phát hiện và định lượng Listeria monocytogenes - Phần 2: Phương pháp định lượng
[65] ISO 11731, Water quality - Enumeration of Legionella
[66] ISO 11731-2, Water quality- Detection and enumeration of Legionella - Part 2: Direct membrane filtration method for waters with low bacterial counts
[67] TCVN 7138 (ISO 13720), Thịt và sản phẩm thịt - Định lượng Pseudomonas spp. giả định
[68] ISO 14139, Water quality - Enumeration of Clostridium perfringens - Method using membrane filtration
[69] TCVN 7902 (ISO 15213), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp định lượng vi khuẩn khử sulfit phát triển trong điều kiện kị khí
[70] TCVN 7906 (ISO 15214), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp định lượng vi khuẩn axit lactic ưa nhiệt trung bình - Kỹ thuật đếm khuẩn lạc ở 30 °C
[71] TCVN 8881 (ISO 16266), Chất lượng nước - Phát hiện và đếm Pseudomonas aeruginosa - Phương pháp màng lọc
[72] TCVN 7924-1 (ISO 16649-1), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp định lượng Escherichia coli dương tính b-glucuronidaza - Phần 1: Kỹ thuật đếm khuẩn lạc ở 44 °C sử dụng màng lọc và 5-bromo-4-clo-3-indolyl b-D-glucuronid
[73] TCVN 7924-2 (ISO 16649-2), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp định lượng Escherichia coli dương tính b-glucuronidaza - Phần 2: Kỹ thuật đếm khuẩn lạc ở 44 °C sử dụng 5-bromo-4-clo-3-indolyl b-D-glucuromid
[74] TCVN 7924-3 (ISO/TS 16649-3), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp định lượng Escherichia coli dương tính b-glucuronidaza - Phần 3: Kỹ thuật tính số có xác suất lớn nhất sử dụng 5-bromo-4-clo-3-indolyl b-D-glucuronid
[75] TCVN 7686 (ISO 16654), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp phát hiện Escherichia coli O157
[76] ISO 17995, Water quality - Detection and enumeration of thermotolerant Campylobacter species
[77] TCVN 9717 (ISO 19250), Chất lượng nước - Phát hiện Salmonella spp.
[78] TCVN 8275-1 (ISO 21527-1), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp định lượng nấm men và nấm mốc - Phần 1: Kỹ thuật đếm khuẩn lạc trong các sản phẩm có hoạt độ nước lớn hơn 0,95
[79] TCVN 8275-2 (ISO 21527-2), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp định lượng nấm men và nấm mốc - Phần 2: Kỹ thuật đếm khuẩn lạc trong các sản phẩm có hoạt độ nước nhỏ hơn hoặc bằng 0,95
[80] TCVN 5518-1 (ISO 21528-1), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp phát hiện và định lượng Enterobacteriaceae - Phần 1: Phát hiện và định lượng bằng kỹ thuật MPN có tiền tăng sinh
[81] TCVN 5518-2 (ISO 21528-2), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp phát hiện và định lượng Enterobacteriaceae - Phần 2: Kỹ thuật đếm khuẩn lạc
[82] TCVN 7903 (ISO 21871), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp xác định số lượng nhỏ Bacillus cereus giả định - Phương pháp phát hiện và kỹ thuật đếm số có xác suất lớn nhất
[83] TCVN 7905-1 (ISO/TS 21872-1), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp phát hiện Vibrio spp. có khả năng gây bệnh đường ruột - Phần 1: Phát hiện Vibrio parahaemolyticus và Vibrio cholerae
[84] TCVN 7905-2 (ISO/TS 21872-2), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp phát hiện Vibrio spp. có khả năng gây bệnh đường ruột - Phần 2: Phát hiện các loài không phải là Vibrio parahaemolyticus và Vibrio cholerae
[85] European Culture Collections’ Organisation (ECCO), available at http://www.ecosite.org
[86] European Council Directive 98/83/EC of 3 November 1998 on the quality of water intended for human consumption. Available (viewed 2013-10-14) at http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:1998:330:0032:0054:EN:PDF
[87] World Federation for Culture Collections (WFCC). Available at htpp://www.wfcc.info
MỤC LỤC
Lời nói đầu
Lời giới thiệu
1 Phạm vi áp dụng
2 Tài liệu viện dẫn
3 Thuật ngữ và định nghĩa
3.1 Thuật ngữ chung và định nghĩa
3.2 Thuật ngữ thử hiệu năng
3.3 Thuật ngữ về môi trường nuôi cấy.
3.4 Thuật ngữ về vi sinh vật thử nghiệm
4 Quản lý đảm bảo chất lượng
4.1 Hệ thống tài liệu
4.2 Bảo quản
4.3 Chuẩn bị môi trường trong phòng thử nghiệm
4.4 Bảo quản và hạn sử dụng môi trường đã chuẩn bị
4.5 Chuẩn bị để sử dụng
4.6 Ủ ấm môi trường đặc trong các đĩa Petri
4.7 Thải bỏ môi trường
5 Vi sinh vật thử nghiệm để thử hiệu năng
5.1 Yêu cầu chung
5.2 Chọn vi sinh vật thử nghiệm
5.3 Bảo quản và duy trì các vi sinh vật thử nghiệm
5.4 Vi sinh vật để thử hiệu năng
6 Kiểm soát chất lượng và thử hiệu năng của môi trường nuôi cấy
6.1 Yêu cầu chung
6.2 Kiểm soát chất lượng lý - hóa
6.3 Kiểm soát chất lượng vi sinh vật
6.4 Yêu cầu chung đối với phép thử hiệu năng vi sinh vật
6.5 Đánh giá hiệu năng và diễn giải các kết quả
6.6 Môi trường khẳng định và thuốc thử
7 Phương pháp thử hiệu năng của môi trường nuôi cấy đặc
7.1 Yêu cầu chung
7.2 Phương pháp thử định lượng
7.3 Thử nghiệm môi trường nuôi cấy sử dụng cho lọc màng
7.4 Phương pháp thử định tính
8 Phương pháp thử hiệu năng của môi trường nuôi cấy lỏng
8.1 Yêu cầu chung
8.2 Phương pháp định lượng trong ống nghiệm để thử hiệu năng của môi trường tăng sinh lỏng (phương pháp pha loãng để phân biệt)
8.3 Phương pháp định tính trong ống nghiệm để thử hiệu năng của môi trường lỏng chọn lọc
8.4 Phương pháp định tính trong ống nghiệm đơn (độ đục) để thử hiệu năng của môi trường lỏng
9 Phương pháp thử hiệu năng của chất pha loãng và môi trường vận chuyển
9.1 Yêu cầu chung
9.2 Phương pháp thử nghiệm dịch pha loãng
9.3 Phương pháp thử môi trường vận chuyển
10 Hệ thống tài liệu về các kết quả thử nghiệm
10.1 Thông tin từ nhà sản xuất
10.2 Truy xuất nguồn gốc
Phụ lục A (tham khảo) Tên gọi các các thành phần môi trường nuôi cấy sử dụng trong phân tích vi sinh vật thực phẩm, thức ăn chăn nuôi và nước
Phụ lục B (quy định) Chuẩn bị gốc đối chứng và giống làm việc
Phụ lục C (quy định) Sơ đồ của các phương pháp thử hiệu năng
Phụ lục D (tham khảo) Ví dụ về phiếu ghi các kết quả thử nghiệm môi trường nuôi cấy
Phụ lục E (quy định) Các vi sinh vật thử nghiệm và các tiêu chí hiệu năng đối với môi trường nuôi cấy khuẩn lạc được sử dụng cho vi sinh vật trong thực phẩm
Phụ lục F (quy định) Các vi sinh vật thử nghiệm và các tiêu chí hiệu năng đối với môi trường nuôi cấy khuẩn lạc được sử dụng cho vi sinh vật trong nước
Phụ lục G (quy định) Sử dụng các biểu đồ kiểm chứng để kiểm soát phép thử định lượng môi trường nuôi cấy đặc
Phụ lục H (tham khảo) Đảm bảo chất lượng của môi trường nuôi cấy - Xử lý sự cố
Phụ lục I (tham khảo) Phép thử định lượng môi trường nuôi cấy lỏng
Phụ lục J (quy định) Xác định các phép thử hiệu năng vi sinh vật đối với môi trường nuôi cấy chuẩn hóa
Thư mục tài liệu tham khảo
1) Số CAS là đơn vị nhận dạng đơn nhất của Tổ chức Chemical Abstracts Service (CAS) đối với các nguyên tố, các hợp chất hóa học, polyme, các trình tự sinh học, các hỗn hợp và các hợp kim.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 8128:2015 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 8128:2015 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 8128:2015 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 8128:2015 DOC (Bản Word)