- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 12194-1:2019 Quy trình giám định tuyến trùng gây bệnh thực vật - Phần 1: Yêu cầu chung
| Số hiệu: | TCVN 12194-1:2019 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
31/12/2019 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 12194-1:2019
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 12194-1:2019
TIÊU CHUẨN QUỐC GIA
TCVN 12194-1:2019
QUY TRÌNH GIÁM ĐỊNH TUYẾN TRÙNG GÂY BỆNH THỰC VẬT
PHẦN 1: YÊU CẦU CHUNG
Procedure for identification of plant parasitic nematodes
Part 1: General requirements
TCVN 12194-1:2019 do cục Bảo vệ thực vật biên soạn, Bộ Nông nghiệp và Phát triển nông thôn đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Bộ TCVN 12194 Quy trình giám định tuyến trùng gây bệnh thực vật gồm các phần sau đây:
- TCVN 12194-1:2019, Phần 1: Yêu cầu chung
- TCVN 12194-2-1:2018, Phần 2-1: Yêu cầu cụ thể đối với tuyến trùng Nacobbus aberrans (Thorne) Thorne & Allen
- TCVN 12194-2-2:2018, Phần 2-2: Yêu cầu cụ thể đối với tuyến trùng Aphelenchoides ritzemabosi (Schwartz) Steiner & Buhrer
- TCVN 12194-2-3:2018, Phần 2-3: Yêu cầu cụ thể đối với tuyến trùng Ditylenchus angustus (Butler) Filipjev
QUY TRÌNH GIÁM ĐỊNH TUYẾN TRÙNG GÂY BỆNH THỰC VẬT
PHẦN 1: YÊU CẦU CHUNG
Procedure for identification of plant parasitic nematodes
Part 1: General requirements
1 Phạm vi áp dụng
Tiêu chuẩn này quy định yêu cầu chung đối với quy trình giám định tuyến trùng gây bệnh thực vật
2 Tài liệu viện dẫn
Tài liệu viện dẫn sau là rất cần thiết cho việc áp dụng tiêu chuẩn. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các phiên bản sửa đổi, bổ sung (nếu có).
TCVN 8597: 2010, Kiểm dịch thực vật - Phương pháp luận về việc lấy mẫu chuyến hàng.
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này, sử dụng các thuật ngữ và định nghĩa sau đây:
3.1
Tuyến trùng ký sinh thực vật (plant parasitic nematodes)
Những loài tuyến trùng chủ yếu sống trong đất và có quan hệ chặt chẽ với thực vật đang phát triển và trong các tàn dư, sản phẩm thực vật sau thu hoạch. Chúng có thể sống và ký sinh ở tất cả các phần của thực vật bao gồm rễ, củ, thân, lá, hoa, quả và hạt của các thực vật đang phát triển theo từng nhóm trùng ký sinh.
3.2
Tuyến trùng nốt sần rễ (root-knot nematodes)
Tuyến trùng ký sinh thực vật thuộc giống Meloidogyne. Tuyến trùng tuổi 2 xâm nhiễm vào trong rễ củ,... của cây ký chủ, tìm vị trí thích hợp và kích thích sự phát triển của các tế bào, tạo thành các tế bào khổng lồ, hình thành các nốt sưng phồng trên rễ, củ,., của cây ký chủ. Con cái phình to hình cầu, quả lê, mầu trắng hoặc trắng kem, nằm trong các nốt sần trên rễ cây ký chủ. Con cái đẻ trứng thành bọc dính kết bên ngoài cơ thể.
3.3
Tuyến trùng bào nang (cyst nematodes)
Tuyến trùng ký sinh thực vật thuộc họ Heteroderidea. Tất cả các giai đoạn sinh trưởng của tuyến trùng bào nang đều gây hại cho cây ký chủ. Con cái màu trắng hoặc màu kem phình to dần, thành hình cầu, quả chanh, quả lê, phá vỡ lớp vỏ rễ nhô phần cơ thể ra bên ngoài. Con cái trưởng thành sau khi thụ tinh, cơ thể chứa đầy trứng và lớp vỏ bên ngoài khô dần, biến màu chuyển thành bào nang khi chết. Trứng nằm trong bào nang được bảo vệ chống lại những điều kiện bất lợi của môi trường trong thời gian dài.
4 Thiết bị, dụng cụ
Sử dụng các thiết bị, dụng cụ thông thường của phòng thí nghiệm và các thiết bị sau:
4.1 Kính lúp soi nổi có độ phóng đại từ 10 lần đến 40 lần.
4.2 Kính hiển vi có thước đo, có độ phóng đại từ 40 lần đến 1 000 lần.
4.3 Máy ly tâm có thể vận hành từ 1 200 vòng/phút đến 3 000 vòng/phút.
4.4 Máy khuấy từ gia nhiệt có thể vận hành từ 50 vòng/phút đến 1 700 vòng/phút.
4.5 Tủ định ôn có thể duy trì ở nhiệt độ từ âm 4 °C đến 50 °C.
4.6 Bình hút ẩm
4.7 Tủ ấm có thể duy trì ở nhiệt độ từ 5 °C đến 70 °C
4.8 Tủ lạnh có thể duy trì ở nhiệt độ 5 °C ± 5 °C
4.9 Bộ rây lọc tuyến trùng có đường kính mắt rây là: 5 μm, 25 μm, 40 μm, 63 μm, 75 μm, 150 μm, 250 μm, 700 μm, 1 000 μm, 1 200 μm, lưới lọc có đường kính mắt lưới 2 mm.
4.10 Dụng cụ thủy tinh: cốc thủy tinh thể tích 1 000 ml, 500 ml, 250 ml, 100 ml; chậu thủy tinh có dung tích 4 lít, chén thủy tinh 4 ml, đũa thủy tinh, đĩa petri, đĩa đồng hồ, pipet.
4.11 Kim gắp tuyến trùng
4.12 Lam
4.13 Lamen
4.14 Khay men
4.15 Kim dầm mẫu
4.16 Giấy lọc các loại
4.17 Túi ni-lông đựng mẫu
4.18 Máy xay mẫu
4.19 Dao mổ (lưỡi dao số 11)
4.20 Kính lúp cầm tay
5 Hóa chất
Chỉ sử dụng các hóa chất loại tinh khiết phân tích, trừ khi có quy định khác.
5.1 Kẽm sunphat (ZnSO4) hoặc Magiê sunphat (MgSO4) hoặc đường Saccaroza (C12H22O11) (d=1,18 (g/ml))
5.2 Formaldehyde (CH2O) 40 %
5.3 Glycerol (C3H8O3)
5.4 Triethanolamine (C6H15NO3)
5.5 Cồn (C2H5OH) 96 %
5.6 Nước cất (H2O): nước cất một lần
5.7 Parafin (CnH2n+2) hoặc sáp ong
5.8 Cao lanh (AI2O3.2SiO2.2H2O)
5.9 Keo dính tiêu bản
5.10 Canxi oxit (CaO)
5.11 A xít Lactic (C3H6O3) 40 %
5.12 Natri hydroxit (NaOH) hoặc Kali hydroxit (KOH)
5.13 Clorua natri (NaCl)
6 Lấy mẫu và bảo quản mẫu
6.1 Lấy mẫu
6.1.1 Đối với hàng hóa xuất, nhập khẩu, quá cảnh hoặc vận chuyển, bảo quản trong nước
Lấy mẫu theo TCVN 8597:2010.
6.1.2 Đối với cây trồng ngoài đồng ruộng
6.1.2.1 Lấy mẫu đất
- Đối với rau, màu, cây trồng ngắn ngày, cây công nghiệp dài ngày và cây ăn quả giai đoạn vườn ươm:
Điều tra ngẫu nhiên hoặc theo 5 điểm chéo góc. Tại mỗi điểm, tiến hành điều tra thu mẫu từ 3 cây đến 5 cây. Lấy mẫu đất tại các điểm điều tra ở độ sâu từ 5 cm đến 20 cm xung quanh vùng rễ cây bị bệnh. Số mẫu lấy quy định như sau:
< 100 m2 lấy từ 4 mẫu đến 5 mẫu
100 m2 đến < 500 m2 lấy từ 10 mẫu đến 12 mẫu
500 m2 đến < 1 000 m2 lấy từ 20 mẫu đến 25 mẫu
1 000 m2 đến < 10 000 m2 lấy từ 26 mẫu đến 40 mẫu
Diện tích > 1 ha lấy từ 45 mẫu đến 50 mẫu, sau đó mẫu ở từng khu vực có thể trộn với nhau dồn lại còn 25 mẫu.
- Đối với cây công nghiệp dài ngày và cây ăn quả:
Mỗi cây lấy mẫu tại 3 điểm trong vùng rễ cây và theo góc của tam giác đều mà gốc cây là trung tâm, chiều sâu lấy mẫu đất theo chiều sâu của rễ. Mẫu đất lấy khối lượng 500 g/mẫu.
Số lượng cây điều tra phụ thuộc vào mật độ cây trồng tại mỗi vùng điều tra, quy định như sau:
< 15 cây: điều tra hết số cây
15 đến 100 cây: điều tra từ 15 cây đến 25 cây (theo điểm chéo góc, mỗi điểm điều tra từ 3 cây đến 5 cây)
101 đến 500 cây: điều tra từ 25 cây đến 50 cây (theo điểm chéo góc, mỗi điểm điều tra từ 5 cây đến 10 cây)
> 500 cây, số lượng mẫu tùy theo mật độ cây trồng tại mỗi vùng điều tra. Nếu số mẫu vượt quá 25 mẫu thì dùng phương pháp trộn để 1ha có số lượng từ 20 mẫu đến 25 mẫu.
6.1.2.2 Lấy mẫu cây
Chọn điểm điều tra tương tự phần thu thập mẫu đất (6.1.2.1).
Bộ phận cây trên mặt đất cắt thành từng đoạn từ 20 cm đến 25 cm, cho vào túi ni-lông (4.17).
Bộ phận cây dưới mặt đất (rễ) cắt thành từng đoạn từ 10 cm đến 20 cm; củ, thân củ, thân ngầm, thu các vết biến mầu, biến dạng, nốt sần cho vào túi ni-lông.
6.2 Bảo quản mẫu
Mẫu giám định và mẫu lưu sau giám định được bảo quản như sau:
Các bộ phận tươi có triệu chứng nghi là bị tuyến trùng gây hại (thân, lá, hoa, hạt, rễ, củ, thân củ, thân ngầm) được để trong các túi ni-lông (4.17) có lỗ thông khí, có đính nhãn và bảo quản trong tủ lạnh (4.8) ở nhiệt độ khoảng 5 °C.
Mẫu đất được bảo quản bằng cách cho vào túi ni-lông có lỗ thông khí, có đính nhãn và để ở những nơi thoáng mát ở nhiệt độ phòng hoặc tốt nhất trong tủ mát nhiệt độ từ 12 °C đến 15 °C.
Dung dịch có tuyến trùng được tách ra từ bộ phận bị hại thường được định hình trong dung dịch bảo quản tuyến trùng (xem 7.2.2.3) để trong các lọ kín có dán nhãn và bảo quản trong tủ lạnh ở nhiệt độ từ 5 °C đến 10 °C.
Tiêu bản lam phải có nhãn ký hiệu mẫu, để trong hộp chuyên dụng đựng tiêu bản lam và được bảo quản ở nhiệt độ phòng.
7 Phát hiện và thu tuyến trùng
7.1 Ký chủ và triệu chứng
7.1.1 Ký chủ
Mỗi loài tuyến trùng ký sinh thực vật đều có phổ ký chủ khác nhau. Việc phát hiện các loài tuyến trùng phải dựa vào danh mục ký chủ của từng loài cụ thể.
7.1.2 Triệu chứng hại
Triệu chứng hại của các loài tuyến trùng khác nhau tùy thuộc vào đặc tính sinh học của từng loài.
7.2 Tách lọc tuyến trùng
7.2.1 Tách lọc tuyến trùng bào nang
7.2.1.1 Tách tuyến trùng bào nang từ các bộ phận của cây
Rửa các bộ phận của cây (rễ, củ, thân củ) dưới vòi nước thu phần nước rửa và lọc qua rây có đường kính mắt rây từ 0,05 mm đến 0,1 mm. Hong khô rây và đưa lên kính lúp soi nổi có độ phóng đại từ 10 lần đến 40 lần (4.1) để quan sát và đếm bào nang.
Cắt rễ, củ đã rửa, ngâm trong đĩa petri (4.10) có chứa nước. Sau 2 giờ đến 4 giờ, đưa đĩa petri lên kính lúp soi nổi có độ phóng đại từ 10 lần đến 40 lần (4.1) để quan sát tuyến trùng bào nang.
7.2.1.2 Tách lọc tuyến trùng bào nang từ đất
7.2.1.2.1 Phương pháp dùng giấy lọc Burh
Khối lượng mẫu đất từ 5 gam đến 10 gam.
Cho đất vào cốc thủy tinh (4.10) chứa 0,5 lít nước, cho thêm vào từ 3 giọt đến 5 giọt dung dịch kiềm bão hoà (NaOH hoặc KOH) (5.12), khuấy đều. Đổ hỗn hợp dịch qua rây (4.9) có đường kính mắt rây 2 mm để lọc đá, rác.
Lấy giấy lọc (4.16) cuốn xung quanh mặt trong của cốc thủy tinh sao cho 2 mép giấy chồng lên nhau 1cm, đổ dịch lọc vào, khuấy đều theo một chiều trong 3 phút sau đó dừng lại cho bào nang bám vào mép trên giấy lọc.
Nhấc nhẹ giấy lọc ra, quan sát trực tiếp bằng kính lúp cầm tay có độ phóng đại 10 lần, để phát hiện những bào nang nổi dính bám vào phần đường thẳng của vòng giấy tiếp giáp giữa giấy lọc với mặt nước. Hoặc rửa giấy lọc vào một cốc nước sạch, đổ nước đó lên rây có đường kính mắt rây từ 0,05 mm đến 0,1 mm, quan sát bằng kính lúp cầm tay (4.20) có độ phóng đại 10 lần.
7.2.1.2.2 Phương pháp dùng dung dịch NaCL
Khối lượng mẫu đất từ 10 gam đến 100 gam.
Pha dung dịch NaCI ở nồng độ 20 % (xem A.3). Cho đất vào dung dịch NaCI trên, khuấy đều cho bào nang nổi lên. Đổ hỗn hợp dịch nói trên qua rây có đường kính mắt rây 2 mm để lọc đá, rác. Đổ hỗn hợp dịch trên qua rây có đường kính mắt rây từ 0,05 mm đến 0,1 mm để giữ lại bào nang. Quan sát bào nang thu được bằng kính lúp cầm tay (4.20) có độ phóng đại 10 lần
7.2.1.2.3 Phương pháp dùng bình lọc Fenwick (xem hình 1)
Khối lượng mẫu đất từ 100 gam đến 200 gam.
Đổ đất vào rây (4.9) có đường kính mắt rây 2 mm, xối nước trực tiếp vào đất để đất tan vào bình cho đến khi lượng nước gần đầy bình, loại bỏ phần cặn trên rây. Mở vòi bình lọc với tốc độ chảy vừa phải sao cho các hạt đất tiếp tục chìm xuống còn bào nang nổi lên trên mặt nước và tràn qua miệng bình theo một máng dẫn xuống rây thu bào nang có đường kính mắt rây từ 0,05 mm đến 0,1 mm ở phía dưới.
Hong khô rây ở nhiệt độ phòng, thu bào nang quan sát và đếm.
7.2.1.3 Bảo quản tuyến trùng bào nang
Bào nang thu được theo các phương pháp trong điều 7.2.1, được hong khô ở nhiệt độ phòng, thu bào nang và đựng trong lọ thủy tinh có nắp đậy kín để sử dụng làm tiêu bản lam.
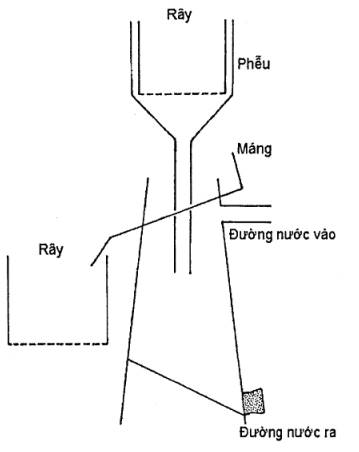
Hình 1 - Bình Fenwick tách bào nang trong đất
7.2.2 Tách lọc tuyến trùng ký sinh thực vật
7.2.2.1 Tách lọc tuyến trùng từ các bộ phận của cây
7.2.2.1.1 Kiểm tra trực tiếp
Các bộ phận của cây (thân, lá, hoa, hạt, củ, thân củ, rễ,...) được rửa sạch. Chọn các bộ phận của cây có vết biến màu, biến dạng, nốt sần cắt nhỏ (khoảng 0,5 mm) đặt vào đĩa petri (4.10). Thêm nước vào đĩa để giữ cho mẫu không bị khô. Đặt đĩa petri có mẫu dưới kính lúp soi nổi (4.1) có độ phóng đại từ 10 lần đến 40 lần. Dùng kim (4.15) dầm nhẹ mẫu và quan sát tìm tuyến trùng.
Nếu phát hiện thấy tuyến trùng hình giun, dùng kim (4.11) gắp tuyến trùng lên lam kính (4.12) có giọt nước nhỏ, đậy nhẹ lamen (4.13) và quan sát dưới kính hiển vi (4.2) có độ phóng đại từ 40 lần đến 1 000 lần.
Nếu phát hiện thấy tuyến trùng cái hình cầu, quả chanh hoặc quả lê, gắp sang chén thủy tinh có chứa dung dịch axít lactic 40 % (5.11) để chuẩn bị làm tiêu bản phần sau con cái.
7.2.2.1.2 Phương pháp lọc tĩnh
Mẫu thực vật (thân, lá, hoa, hạt, củ, thân củ, rễ) được rửa sạch, cắt thành những đoạn thật nhỏ (khoảng 0,5 mm). Đặt mẫu đã cắt lên trên rây (4.9) có đường kính mắt rây 75 pm và thêm nước vừa xâm xấp rây. Sau 24 giờ đến 48 giờ, đổ nước dưới rây vào cốc thủy tinh (4.10). Dùng pipet (4.10) hút lấy dung dịch thu được ở cốc thủy tinh cho vào đĩa đồng hồ (4.10) và kiểm tra dưới kính lúp soi nổi (4.1) có độ phóng đại từ 10 lần đến 40 lần. Nếu phát hiện thấy tuyến trùng, dùng kim (4.11) gắp tuyến trùng lên lam kính (4.12) có giọt nước nhỏ, đậy nhẹ lamen (4.13) và quan sát dưới kính hiển vi (4.2) có độ phóng đại từ 40 lần đến 1 000 lần. Kiểm tra lần lượt cho đến khi hết nước trong cốc thủy tinh.
7.2.2.1.3 Phương pháp ly tâm
Mẫu thực vật (thân, lá, hoa, hạt, củ, thân củ, rễ..) được rửa sạch, cắt thành từng đoạn 0,5 cm, trộn đều và cân lấy từ 5 gam đến 10 gam (tùy theo lượng mẫu có). Thêm 250 ml nước sạch, nghiền nhỏ mẫu bằng máy xay mẫu (4.18). Lọc qua rây (4.9) có đường kính mắt rây 1 200 μm, dùng vòi nước nhỏ rửa sạch từ phía trên xuống cho đến khi phần mẫu nghiền phía trên rây sạch. Thu phần nước phía dưới và thêm nước cho đủ 1 lít, khuấy đều.
Lấy 100 ml dung dịch thu được ở trên cho vào ống li tâm. Thêm 1 thìa cà phê bột cao lanh (5.8) vào ống và khuấy đều bằng máy khuấy. Đặt ống nghiệm vào máy ly tâm (4.3) và ly tâm với vận tốc 1 800 vòng/phút trong 4 phút. Sau đó, bỏ phần dung dịch phía trên, giữ lại phần cặn phía dưới. Thêm dung dịch kẽm sunphat hoặc magiê sunphat hoặc đường saccaroza (5.1) (cao hơn ít nhất 1 cm so với bề mặt của lớp cặn) và khuấy đều trong 1 phút. Tiếp tục ly tâm với vận tốc 1 800 vòng/phút trong 4 phút.
Đổ phần dung dịch phía trên của ống ly tâm qua rây lọc có đường kính mắt rây 5 pm (4.9). Rửa phần trên rây bằng nước sạch và dùng bình xịt nước để rửa, thu tuyến trùng bám dính trên rây vào cốc thủy tinh (4.10) và tiến hành kiểm tra tuyến trùng.
Dùng pipet (4.10) hút lấy dung dịch thu được ở cốc thủy tinh cho vào đĩa đồng hồ (4.10) và kiểm tra dưới kính lúp soi nổi (4.1) có độ phóng đại từ 10 lần đến 40 lần. Nếu phát hiện thấy tuyến trùng, dùng kim (4.11) gắp tuyến trùng lên lam kính (4.12) có giọt nước nhỏ, đậy nhẹ lamen (4.13) và quan sát dưới kính hiển vi (4.2) có độ phóng đại từ 40 lần đến 1 000 lần. Kiểm tra lần lượt cho đến khi hết nước trong cốc thủy tinh.
7.2.2.2 Tách lọc tuyến trùng từ đất
7.2.2.2.1 Phương pháp rây Cobb
Cân 100 gam đất cho vào chậu thủy tinh (4.10), cho thêm từ 2 lít đến 3 lít nước vào chậu thủy tinh và ngâm trong 1 giờ đến 2 giờ cho đất tan. Khuấy đều đất và nước, để lắng trong 10 giây. Sau đó lọc qua rây (4.9) có đường kính mắt rây 1 000 μm, rửa sạch rây và phần cặn trên rây. Dung dịch được thu vào chậu thủy tinh thứ 2. Bỏ phần cặn còn lại trên rây và trong chậu thủy tinh ban đầu. Quá trình này lặp lại từ 2 đến 3 lần nhằm loại bỏ cát, sạn, rác và đá.
Khuấy đều dung dịch đã thu được ở trên và tiếp tục lọc bằng rây có đường kính mắt rây 700 μm, dung dịch được thu vào chậu thủy tinh. Phần cặn trên rây được rửa sạch và cho vào cốc thủy tinh (4.10).
Tiếp tục lọc dung dịch thu được ở chậu thủy tinh qua các rây có đường kính mắt rây 250 μm, 150 μm và 25 μm. Phần cặn trên rây cũng được rửa sạch và cho vào cốc thủy tinh. Riêng với rây 25 μm có thể lọc lại từ 3 đến 4 lần.
Nếu lượng nước thu được trong cốc thủy tinh quá đầy, để lắng trong 2 giờ và đổ bớt nước phía trên. Tiếp đó, chuyển dung dịch trên sang rây lọc tĩnh. Sau 24 giờ đến 48 giờ, đổ nước dưới rây vào cốc thủy tinh. Dùng pipet (4.10) hút lấy dung dịch thu được ở cốc thủy tinh cho vào đĩa đồng hồ (4.10) và kiểm tra dưới kính lúp soi nổi (4.1) có độ phóng đại từ 10 đến 40 lần. Nếu phát hiện thấy tuyến trùng, dùng kim (4.11) gắp tuyến trùng lên lam (4.12) và quan sát dưới kính hiển vi có độ phóng đại từ 40 lần đến 1 000 lần. Kiểm tra lần lượt cho đến khi hết nước trong cốc thủy tinh.
7.2.2.2.2 Phương pháp phễu lọc Baermann cải tiến
Chuẩn bị khay (4.14) và lưới lọc (4.9) có đường kính mắt lưới 2 mm. Đặt lớp giấy lọc lên trên mặt lưới. Cân lượng đất cần kiểm tra (tối thiểu là 100 gam) và rải đều trên mặt giấy. Thao tác đặt giấy và rải đất phải thật nhẹ để tránh rách, thủng giấy lọc. Đổ nước theo mép khay sao cho nước vừa ướt đất. Sau 24 giờ đến 48 giờ, đổ nước dưới rây vào cốc thủy tinh (4.10) và kiểm tra dần bằng đĩa đồng hồ (4.10) dưới kính lúp soi nổi (4.1) có độ phóng đại từ 10 lần đến 40 lần. Nếu phát hiện thấy tuyến trùng, dùng kim (4.11) gắp tuyến trùng lên lam (4.12) và quan sát dưới kính hiển vi (4.2) có độ phóng đại từ 40 lần đến 1 000 lần. Kiểm tra lần lượt cho đến khi hết nước trong cốc thủy tinh.
CHÚ THÍCH: Lưới lọc phải có chân hoặc quai (gác lên thành khay) để khi đặt trong khay, đáy của lưới lọc không chạm sát đáy khay.
7.2.2.2.3 Phương pháp ly tâm
Cân 100 gam đất vào cốc thủy tinh (4.10), thêm 250 ml nước, khuấy đều. Lọc qua rây (4.9) có đường kính mắt rây 1 200 μm, dùng vòi nước rửa kỹ phần trên rây, loại bỏ phần cặn còn lại trên rây. Thu phần nước dưới rây, thêm nước cho đủ 1 lít và khuấy đều.
Lấy 100 ml dung dịch thu được ở trên vào ống li tâm. Thêm 01 thìa cà phê bột cao lanh (5.8) vào ống và khuấy đều bằng máy khuấy. Đặt ống nghiệm vào máy và ly tâm (4.3) với vận tốc 1 800 vòng/phút trong 4 phút.
Bỏ phần dung dịch phía trên, giữ lại phần cặn phía dưới. Thêm dung dịch kẽm sunphat hoặc magiê sunphat hoặc đường saccaroza (5.1) (cao hơn 1cm so với bề mặt của lớp cặn). Khuấy đều trong 1 phút. Tiếp tục ly tâm với vận tốc 1 800 vòng/phút trong 4 phút.
Đổ dung dịch phía trên qua rây lọc có đường kính 5 gm. Rửa phần trên rây bằng nước sạch và dùng bình xịt nước để rửa, thu tuyến trùng bám dính trên rây vào cốc thủy tinh (4.10).
Dùng pipet (4.10) hút lấy dung dịch thu được ở cốc thủy tinh cho vào đĩa đồng hồ (4.10) và kiểm tra dưới kính lúp soi nổi (4.1) có độ phóng đại từ 10 đến 40 lần. Nếu phát hiện thấy tuyến trùng, dùng kim (4.11) gắp tuyến trùng lên lam kính (4.12) và quan sát dưới kính hiển vi (4.2) có độ phóng đại từ 40 lần đến 1 000 lần. Kiểm tra lần lượt cho đến khi hết nước trong cốc thủy tinh.
7.2.2.3 Dung dịch bảo quản tuyến trùng
Tuyến trùng ký sinh thực vật thu được từ một trong các phương pháp tách lọc nêu ở điều 7.2.2 được đưa vào một trong ba loại dung dịch dưới đây để bảo quản tuyến trùng trước khi tiến hành xử lý, làm tiêu bản tuyến trùng.
Bảo quản các dung dịch này trong lọ thủy tinh có nắp đậy kín, ở nhiệt độ phòng và sử dụng không quá 10 ngày.
Để tiêu bản tuyến trùng giữ được hình dáng đặc trưng, trước khi cho vào dung dịch bảo quản nên xử lý nhiệt tuyến trùng bằng nước nóng ở nhiệt độ từ 70 °C đến 80 °C trong 5 phút.
7.2.2.3.1 Dung dịch Formalin 4 % (xem A.1.1)
7.2.2.3.2 Dung dịch Formalin - glycerol (FG) (xem A.1.2)
7.2.2.3.3 Dung dịch TAF (xem A.1.3)
8 Giám định tuyến trùng
8.1 Giám định bằng phương pháp quan sát các đặc điểm hình thái
Giám định tuyến trùng bằng phương pháp quan sát các đặc điểm hình thái dưới kính hiển vi (4.2) (độ phóng đại từ 40 lần đến 1 000 lần) đối với tiêu bản các cá thể tuyến trùng non, tuyến trùng cái và đực trưởng thành.
8.1.1 Làm tiêu bản tuyến trùng giám định
8.1.1.1 Làm tiêu bản phần sau tuyến trùng bào nang và con cái trưởng thành tuyến trùng nốt sần rễ (lỗ sinh dục và lỗ hậu môn)
8.1.1.1.1 Làm tiêu bản phần sau tuyến trùng bào nang
Chuyển tuyến trùng bào nang đã tách lọc ngâm trong nước 24 giờ. Lấy 1 cá thể tuyến trùng bào nang, quan sát dưới kính lúp soi nổi có độ phóng đại từ 10 lần đến 40 lần (4.1) và dùng dao mổ (4.19) cắt lấy phần sau có lỗ sinh dục (xem hình 2) và làm sạch các phần bám dính trên mảnh cắt.
Lấy lam kính (4.12) và làm vòng paraphin hoặc sáp ong (5.7) (đường kính khoảng 1 cm) trên lam kính. Cho 1 giọt glycerol nguyên chất vào giữa vòng paraphin hoặc sáp ong. Dùng kim (4.11) gắp, gắp phần sau có hậu môn đặt vào giữa giọt glycerol, chỉnh cho mảnh cắt nằm úp xuống. Đậy lamen (4.13) và đặt lam kính trên bàn nhiệt cho paraphin hoặc sáp ong tan chảy. Nhấc nhanh lam kính và đặt ra chỗ mát. Gắn keo (5.9) bảo vệ.
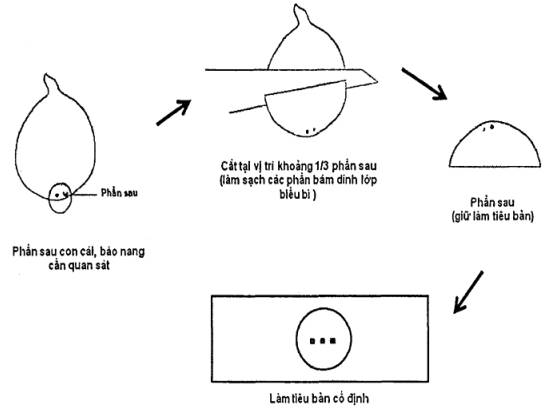
Hình 2 - Cách làm tiêu bản phần sau tuyến trùng bào nang
8.1.1.1.2 Làm tiêu bản phần sau con cái tuyến trùng nốt sần rễ
Chuyển tuyến trùng cái trưởng thành đã tách vào trong dung dịch a xít lactic 40 % (5.11) trong 12 giờ. Lấy 1 cá thể tuyến trùng cái, quan sát dưới kính lúp soi nổi có độ phóng đại từ 10 lần đến 40 lần (4.1) và dùng dao mổ (4.19) cắt phần đầu cho dịch cơ thể thoát ra. Lấy phần thân có hậu môn và lỗ sinh dục (xem hình 3) cắt gọn và làm sạch các phần bám dính trên mảnh cắt.
Lấy lam kính (4.12) và làm vòng paraphin hoặc sáp ong (5.7) (đường kính khoảng 1 cm) trên lam kính. Cho 1 giọt glycerol nguyên chất vào giữa vòng paraphin hoặc sáp ong. Dùng kim (4.11) gắp, gắp phần đầu hoặc mảnh cắt phần sau đặt vào giữa giọt glycerol. Đậy lamen (4.13) và đặt lam kính trên bàn nhiệt cho paraphin hoặc sáp ong (5.7) tan chảy. Nhấc nhanh lam kính và đặt ra chỗ mát. Gắn keo (5.9) bảo vệ.
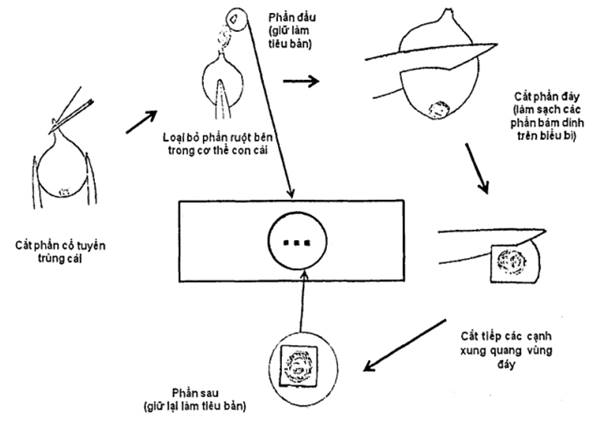
Hình 3 - Cách làm tiêu bản phần sau con cái trưởng thành
8.1.1.2 Làm tiêu bản tuyến trùng ký sinh thực vật (hình giun)
8.1.1.2.1 Dung dịch xử lý tuyến trùng
Dung dịch xử lý
- Dung dịch 1 (xem A.2.1)
- Dung dịch 2 (xem A.2.2)
Bảo quản các dung dịch này trong lọ thủy tinh có nắp đậy kín, ở nhiệt độ phòng và sử dụng không quá 10 ngày.
8.1.1.2.2 Cách tiến hành
Gắp tuyến trùng từ dung dịch bảo quản vào chén thủy tinh (4.10) có chứa 0,5 ml dung dịch xử lý (dung dịch 1). Đặt chén này trong bình hút ẩm (4.6) đậy kín (bình hút ẩm có chứa 1/10 thể tích là cồn 96 % (5.5)). Bình hút ẩm được đặt trong tủ ấm (4.7) ở điều kiện nhiệt độ cố định 40 °C với thời gian tối thiểu là 12 giờ.
Sau 12h, lấy chén thủy tinh ra khỏi bình hút ẩm (có chứa cồn), thêm dung dịch xử lý (dung dịch 2). Đậy nắp 2/3 phần miệng chén để cồn bay hơi từ từ. Chén thủy tinh có chứa tuyến trùng tiếp tục giữ trong tủ ấm ở điều kiện nhiệt độ cố định 40 °C. Sau 2 giờ đến 3 giờ bổ sung thêm dung dịch 2 vào chén thủy tinh cho gần đầy, lặp lại bước này từ 2 lần đến 3 lần. Tới khi chén thủy tinh chỉ còn lại glycerol có chứa tuyến trùng và có thể sử dụng làm tiêu bản cố định được.
Hoặc đặt chén thủy tinh chứa tuyến trùng trong glycerol nguyên chất trong bình hút ẩm có chứa canxi oxit (5.10). Bảo quản lâu dài để làm tiêu bản cố định.
8.1.1.2.3 Làm tiêu bản
Lấy lam kính (4.12) và làm vòng paraphin hoặc sáp ong (5.7) (đường kính khoảng 1 cm) trên lam kính. Cho 1 giọt glycerol nguyên chất vào giữa vòng paraphin hoặc sáp ong. Dùng kim (4.11) gắp, gắp 5 cá thể tuyến trùng (đã xử lý trong dung dịch bảo quản) đặt vào giữa giọt glycerol, chỉnh cho các cá thể tuyến trùng nằm cùng một hướng. Đậy lamen (4.13) và đặt lam kính trên bàn nhiệt cho paraphin hoặc sáp ong (5.7) tan chảy. Nhấc nhanh lam kính và đặt ra chỗ mát. Gắn keo (5.9) bảo vệ.
8.1.2 Các đặc điểm hình thái giám định
Quan sát, đo đếm và so sánh với các đặc điểm hình thái đặc trưng của loài tuyến trùng theo khóa phân loại hiện có.
Các chỉ số và chữ viết tắt sử dụng khi đo đếm và giám định tuyến trùng
n: Tổng số cá thể quan sát, đo đếm.
L: Tổng chiều dài cơ thể
a: Chiều dài cơ thể/chiều rộng lớn nhất (thường là vị trí lỗ sinh dục)
b: Chiều dài cơ thể/chiều dài từ đỉnh đầu cơ thể đến van ruột-thực quản
b’: Chiều dài cơ thể/chiều dài từ đỉnh đầu cơ thể đến hết điều tuyến
c: Chiều dài cơ thể/chiều dài đuôi
c’: Chiều dài đuôi/chiều rộng cơ thể tại hậu môn (con cái) hoặc lỗ huyệt (con đực)
V: Chiều dài cơ thể từ đỉnh đến lỗ sinh dục x 100/chiều dài cơ thể
T: Chiều dài từ lỗ huyệt đến đỉnh của tinh hoàn x 100/chiều dài cơ thể
O: khoảng cách từ gốc kim hút đến lỗ mở tuyến thực quản lưng Chiều dài kim hút (stylet)
Chiều dài gai sinh dục con đực (spicule)
8.2 Giám định bằng phương pháp sinh học phân tử
Tùy từng loài tuyến trùng cụ thể, có thể áp dụng một hoặc một số các kỹ thuật sinh học phân tử sau để định loại tới loài:
- Phản ứng chuỗi trùng hợp (Polymerase chain reaction - PCR).
- Phản ứng tổng hợp chuỗi thời gian thực (Real time - PCR)
- Mã vạch DNA (DNA barcoding).
- Chỉ thị đa hình chiều dài đoạn cắt giới hạn (Restriction fragment length polymorphism - RFLP).
- Trình tự DNA (DNA sequencing).
9 Báo cáo kết quả
Nội dung phiếu kết quả giám định gồm những thông tin cơ bản sau:
- Thông tin về mẫu giám định.
- Tên khoa học của loài Phương pháp giám định
- Tài liệu giám định
- Người giám định/cơ quan giám định
Phiếu kết quả giám định chi tiết có thể tham khảo phụ B.
Phụ lục A
(Quy định)
Dung dịch xử lý mẫu, làm tiêu bản và bảo quản mẫu
A.1 Dung dịch bảo quản tuyến trùng
A.1.1 Dung dịch 1: Formalin 4 %
- Thành phần:
| Formaldehyde 40 % | 10 ml |
| Nước cất | 90 ml |
- Chuẩn bị:
Hòa tan Formaldehyde trong nước.
A.1.2 Dung dịch 2: Formalin - glycerol (FG) 4%
- Thành phần:
| Formaldehyde 40 % | 10 ml |
| Glycerol | 01 ml |
| Nước cất | 89 ml |
- Chuẩn bị:
Hòa tan các thành phần trên trong nước.
A.1.3 Dung dịch 3: TAF
- Thành phần:
| Triethanolamine | 02 ml |
| Formaldehyde 40 % | 07 ml |
| Nước cất | 91 ml |
- Chuẩn bị:
Hòa tan các thành phần trên trong nước.
A.2 Dung dịch xử lý
A.2.1 Dung dịch 1:
+ Thành phần:
| Cồn 96 % | 20 ml |
| Glycerol | 01 ml |
| Nước cất | 79 ml |
+ Chuẩn bị: Hòa tan các thành phần trên trong nước.
A.2.2. Dung dịch 2:
+ Thành phần
| Cồn 96 % | 95 ml |
| Glycerol | 05 ml |
+ Chuẩn bị: Hòa tan glycerol trong cồn.
Bảo quản các dung dịch này trong lọ thủy tinh có nắp đậy kín, ở nhiệt độ phòng và sử dụng không quá 10 ngày.
A.3. Dung dịch NaCI 20 %
+ Thành phần:
| Muối Clorua natri tinh khiết (NaCI) | 20 g |
| Nước cất | 80 ml |
+ Chuẩn bị: Hòa tan các thành phần trên trong nước.
Phụ lục B
(Tham khảo)
Mẫu phiếu kết quả giám định
| Cơ quan Giám định ………………………… | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
|
| ……… ngày... tháng ... năm 20 ….. |
PHIẾU KẾT QUẢ GIÁM ĐỊNH
1. Tên hàng hóa:
2. Nước xuất khẩu:
3. Xuất xứ:
4. Phương tiện vận chuyển: Khối lượng:
5. Địa điểm lấy mẫu:
6. Ngày lấy mẫu:
7. Người lấy mẫu:
8. Tình trạng mẫu:
9. Ký hiệu mẫu:
10. Số mẫu lưu:
11. Người giám định:
12. Phương pháp giám định: Theo TCVN….. về “Quy trình giám định tuyến trùng gây bệnh thực vật - Phần 2-....: Yêu cầu cụ thể đối với…… (nêu tên loài cụ thể)”.
13. Kết quả giám định:
Tên khoa học:
Bộ:
Bộ phụ:
Họ:
Giống:
Loài:
| TRƯỞNG PHÒNG KỸ THUẬT | THỦ TRƯỞNG ĐƠN VỊ |
Thư mục tài liệu tham khảo
[1] Luc M, Sikora RA, Bridge J, (1990). Plant Parasitic Nematodes in Subtropical and Tropical Agriculture. Wallingford, UK: CAB International, 69-108.
[2] CABI, (2017). Crop Protection Compedium
[3] IPPC, (2006), ISPM 27 Diagnostic protocols for regulated pests
[4] TCVN 1-2:2008, Phần 2: Quy định về trình bày và thể hiện nội dung tiêu chuẩn quốc gia.
[5] Southey, J.F. (1986.) Laboratory methods for work with plant and soil nematodes
[6] Tiêu chuẩn kỹ thuật quốc gia TCVN 4731- 1989: Kiểm dịch thực vật - Phương pháp lấy mẫu.
[7] Viện Bảo vệ thực vật (1997). Phương pháp nghiên cứu bảo vệ thực vật. Tập 1: Phương pháp điều tra cơ bản dịch hại nông nghiệp và thiên địch của chúng. NXB Nông nghiệp.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 12194-1:2019 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 12194-1:2019 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 12194-1:2019 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 12194-1:2019 DOC (Bản Word)