- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 10806-3:2015 ISO 7346-3:1996 Chất lượng nước-Xác định độc tính gây chết cấp tính của các chất đối với cá nước ngọt [brachydanio rerio hamilton-buchanan (teleostei, cyprinidae]-Phần 3: Phương pháp dòng chảy
| Số hiệu: | TCVN 10806-3:2015 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Tài nguyên-Môi trường , Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
2015 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 10806-3:2015
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 10806-3:2015
TIÊU CHUẨN QUỐC GIA
TCVN 10806-3:2015
ISO 7346-3:1996
CHẤT LƯỢNG NƯỚC - XÁC ĐỊNH ĐỘC TÍNH GÂY CHẾT CẤP TÍNH CỦA CÁC CHẤT ĐỐI VỚI CÁ NƯỚC NGỌT [BRACHYDANIO RERIO HAMILTON-BUCHANAN (TELEOSTEI, CYPRINIDAE)] - PHẦN 3: PHƯƠNG PHÁP DÒNG CHẢY
Water quality - Determination of the acute lethal toxicity of substances to a freshwater fish [Brachydanio rerio Hamilton-Buchanan (Teleostei, Cyprinidae)] -Part 3: Flow-through method
Lời nói đầu
TCVN 10806-3:2015 hoàn toàn tương đương với ISO 7346-3:1996
TCVN 10806-3:2015 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC 147 Chất lượng nước biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
Bộ tiêu chuẩn TCVN 10806 (ISO 7346), Chất lượng nước - Xác định độc tính gây chết cấp tính của các chất đối với cá nước ngọt [Brachydanio rerio Hamilton-Buchanan (Teleostei Cyprinidae)] gồm các phần sau:
- TCVN 10806-1:2015 (ISO 7346-1:1996), Phần 1: Phương pháp tĩnh;
- TCVN 10806-2:2015 (ISO 7346-2:1996), Phần 2: Phương pháp bán tĩnh;
- TCVN 10806-3:2015 (ISO 7346-3:1996), Phần 3: Phương pháp dòng chảy.
Lời giới thiệu
Bộ tiêu chuẩn 10806 (ISO 7346) đưa ra các phương pháp xác định độc tính gây chết cấp tính của các chất đối với cá ngựa vằn (Brachydanio rerio Hamilton-Buchanan), nhưng phải nhấn mạnh rằng phương pháp sử dụng cá ngựa vằn không loại trừ việc sử dụng cho các loài khác. Các phương pháp nêu ra ở đây có thể sử dụng cho các loài cá nước ngọt, nước mặn hoặc nước lợ khác, với các cải biên thích hợp, ví dụ, chất lượng nước pha loãng và điều kiện nhiệt độ của phép thử.
Trong bộ tiêu chuẩn này, xác định độc tính gây chết cấp tính của các chất có thể thực hiện bằng phương pháp tĩnh, bán tĩnh và dòng chảy. Phép thử tĩnh, được mô tả trong tiêu chuẩn này, trong đó dung dịch không được thay mới, vì thế có ưu điểm là yêu cầu thiết bị, dụng cụ đơn giản, nhưng các chất trong bình thử có thể bị thất thoát trong quá trình thử và chất lượng nước có thể bị giảm. Trong phương pháp dòng chảy, được quy định trong phần TCVN 10806-3 (ISO 7346-3), dung dịch thử được bổ sung liên tục, giải quyết được vấn đề của phương pháp tĩnh nhưng lại yêu cầu sử dụng các thiết bị, dụng cụ phức tạp hơn. Trong phương pháp bán tĩnh, được mô tả trong TCVN 10806-2 (ISO 7346-2), dung dịch thử được thay mới sau mỗi 24 h hoặc 48 h, phương pháp này là sự kết hợp giữa hai phương pháp còn lại.
Phương pháp dòng chảy có thể được sử dụng cho hầu hết các loại chất, bao gồm cả chất không bền trong nước, tuy nhiên nồng độ chất thử được xác định bất cứ khi nào có thể. Phương pháp tĩnh bị giới hạn trong phép thử các chất có nồng độ được duy trì tương đối ổn định trong suốt thời gian thử. Phương pháp bán tĩnh có thể được sử dụng để nghiên cứu chất có nồng độ được duy trì hợp lý trong suốt phép thử bằng cách thay mới dung dịch sau mỗi 24 h hoặc 48 h. Sự chuẩn bị đặc biệt có thể là cần thiết đối với các chất bay hơi nhanh.
Để hỗ trợ cho việc chuẩn bị và duy trì nồng độ chất có thể gây chết tại nồng độ gần với độ hòa tan trong nước của chúng có thể sử dụng một lượng nhỏ dung môi, như đã quy định trong các phương pháp.
CHẤT LỰỢNG NƯỚC - XÁC ĐỊNH ĐỘC TÍNH GÂY CHẾT CẤP TÍNH CỦA CÁC CHẤT ĐỐI VỚI CÁ NƯỚC NGỌT [BRACHYDANIO RERIO HAMILTON-BUCHANAN (TELEOSTEI, CYPRINIDAE)] - PHẦN 3: PHƯƠNG PHÁP DÒNG CHẢY
Water quality - Determination of the acute lethal toxicity of substances to a freshwater fish [Brachydanio rerio Hamilton-Buchanan (Teleostei, Cyprinidae)] -Part 3: Flow-through method
1. Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp dòng chảy để xác định độc tính gây chết cấp tính của các đơn chất bền, không bay hơi và chất tan trong nước trong các điều kiện xác định lên cá nước ngọt [Brachydanio rerio Hamilton-Buchanan (Teteostei, Cyprinidae) - tên thường gọi là cá ngựa vằn] trong nước có chất lượng đã định.
Đối với mỗi chất thử, phương pháp này có thể thích ứng để đánh giá các phạm vi độc tính gây chết cấp tính đối với Brachydanio rerio trong các điều kiện thử.
Kết quả của phương pháp này không đủ căn cứ để xác định các tiêu chuẩn về chất lượng nước cho bảo vệ môi trường.
Phương pháp này cũng có thể áp dụng khi sử dụng một số loài cá nước ngọt khác làm sinh vật thử1).
Phương pháp này cũng có thể áp dụng với cá nước ngọt, cá nước mặn và nước lợ khác bằng những điều chỉnh thích hợp với điều kiện thử, đặc biệt về số lượng và chất lượng của nước pha loãng và nhiệt độ.
2. Nguyên tắc
Trong điều kiện nhất định, xác định nồng độ một chất mà tại nồng độ đó gây chết cho 50% cá thể Brachydanio rerio sau thời gian tiếp xúc 24 h, 48 h, 72 h, 96 h với chất đó trong môi trường nước. Các nồng độ gây chết trung bình tương ứng được chỉ định LC50-24 h, LC50-48 h, LC50-72 h và LC50-96 h.
Phép thử được tiến hành trong hai giai đoạn:
a) Phép thử sơ bộ đưa ra chỉ số gần đúng về nồng độ trung bình gây chết cấp tính và phục vụ cho việc xác định khoảng nồng độ cho phép thử cuối cùng;
b) Chỉ báo cáo các kết quả của phép thử cuối cùng.
Nếu có sẵn bằng chứng cho thấy nồng độ thử còn lại tương đối ổn định (tức là trong khoảng 20% các giá trị danh định) trong quá trình thử, thì hoặc nồng độ được đo hoặc nồng độ danh định được sử dụng để ước lượng giá trị LC50. Nếu phép phân tích này cho thấy nồng độ còn lại có giá trị tương đối ổn định nhưng nhỏ hơn khoảng 80%, hoặc lớn hơn 120% giá trị danh định, thì sử dụng giá trị phân tích này để ước tính giá trị LC50. Nếu không có bằng chứng cho thấy nồng độ thử còn lại để ở mức có thể chấp nhận được thông qua quá trình thử, hoặc được biết (hoặc nghi ngờ) rằng nồng độ của hóa chất thử giảm đáng kể ở mọi giai đoạn trong quá trình thử, thì, dù có số liệu phân tích hóa học hay không, giá trị LC50 cũng không được xác định bằng phương pháp này. Trong trường hợp này, phép thử không cần xác nhận, nhưng chỉ có thể công bố giá trị LC50 của chất có nồng độ là ≤ x mg/l, sử dụng nồng độ danh định để ước tính giá trị, x.
3. Sinh vật thử và thuốc thử
Thuốc thử sử dụng phải được công nhận chất lượng phân tích. Nước sử dụng để chuẩn bị dung dịch phải là nước cất bằng thiết bị thủy tinh hoặc nước đã loại ion với độ tinh khiết tương đương.
3.1. Sinh vật thử nghiệm
Loài thử nghiệm là Brachydanio rerio Hamilton-Buchanan (lớp phụ Teleostei, họ cá chép Cyprinidae), thường gọi là cá ngựa vằn. Mỗi cá thể cá thử nghiệm có chiều dài tổng là 30 mm ± 5 mm, về nguyên tắc, tương ứng với khối lượng là 0,3 g ± 0,1 g. Cá thể thử được chọn từ cùng một quần thể trong một đàn. Đàn cá này phải được nuôi thích nghi với môi trường và, trong mọi trường hợp, phải được nuôi ít nhất 7 ngày trước khi thử trong nước pha loãng, có sục khí liên tục (xem 3.2), trong điều kiện chất lượng nước và chiếu sáng giống với điều kiện trong phép thử. Cá phải được cho ăn bình thường cho đến 24 h trước khi tiến hành phép thử.
Cá thử phải không mắc bệnh hoặc có dị tật nhìn thấy. Cá phải không được chữa trị bệnh trong quá trình thử hoặc trong hai tuần trước khi thử. Cá còn sống sau khi thử phải được thải bỏ theo cách phù hợp.
Điều kiện môi trường để duy trì và nuôi cá ngựa vằn được nêu trong Phụ lục A.
3.2. Nước pha loãng tiêu chuẩn
Nước pha loãng tiêu chuẩn được chuẩn bị mới phải có pH bằng 7,8 ± 0,2, và độ cứng canxi khoảng 250 mg/l tính theo canxi cacbonat, và trước thử nghiệm phải chứa các muối tan trong nước cất hoặc nước đã loại ion với nồng độ sau:
| CaCI2.2H2O MgSO4.7H2O NaHCO3 KCI | 294,0 mg/l; 123,3 mg/I; 63,0 mg/l; 5,5 mg/l. |
Sục khí vào nước pha loãng cho đến khi nồng độ của oxy hòa tan đạt tới ít nhất 90% giá trị bão hòa khí trong dung dịch (AVS) và pH ổn định ở 7,8 ± 0,2. Nếu cần, điều chỉnh pH của dung dịch bằng cách thêm dung dịch natri hydroxit hoặc axít clohydric. Vì thế nước pha loãng đã chuẩn bị không nhận thêm sục khí cưỡng bức trước khi sử dụng trong phép thử.
3.3. Dung dịch gốc của chất thử
Dung dịch gốc là một hỗn hợp xác định của chất thử phải được chuẩn bị bằng cách hòa tan một lượng chất thử đã biết vào một thể tích xác định nước pha loãng, nước đã loại ion hoặc nước cất bằng thiết bị thủy tinh. Dung dịch gốc phải được chuẩn bị ở tần suất thích hợp tới khi ổn định chất thử. Để có thể chuẩn bị dung dịch gốc và hỗ trợ trong việc chuyển vào bình thử, chất ít tan trong nước có thể được hòa tan hoặc phân tán bằng biện pháp thích hợp, kể cả các thiết bị sóng siêu âm và dung môi hữu cơ có độc tính thấp đối với cá. Nếu sử dụng dung môi hữu cơ nào đó thì nồng độ dung môi trong dung dịch thử phải không quá 0,1 ml/l, hoặc thể tích chứa 0,1 g/l, tùy mức nào lớn hơn. Nếu sử dụng dung môi, cần có hai bộ mẫu đối chứng, trong đó một bộ chứa dung môi ở nồng độ cao nhất được sử dụng cho bình thử và một bộ không chứa dung môi hoặc chất thử
3.4. Dung dịch thử
Dung dịch thử được chuẩn bị bằng cách thêm một lượng thích hợp dung dịch gốc của chất thử vào nước pha loãng để có được nồng độ yêu cầu. Khi chuẩn bị dung dịch gốc bằng nước cất hoặc nước khử ion thì không nên thêm quá 100 ml dung dịch gốc vào 10 I nước pha loãng.
4. Thiết bị, dụng cụ
Tất cả vật liệu có thể tiếp xúc với chất lỏng mà cá sẽ được thả vào, hoặc với vật mà cá có khả năng tiếp xúc phải là chất trơ hoặc không hấp thụ chất thử đáng kể.
Thiết bị phòng thí nghiệm thông thường và các thiết bị sau:
4.1. Bình thử, có thể có dạng khác nhau, phù hợp với các đặc tính của vật liệu thử và cần đạt được chuẩn cứ xác nhận [đặc biệt 7.1 b)]. Đối với hóa chất bay hơi có thể cần một hệ thống kín đi kèm. Khi thử hóa chất không bay hơi có thể không mở nắp các bình. Thể tích của bình thử phải đủ để chứa cá theo tỷ lệ không quá 1,5 g cá trong mỗi lít nước trong thời gian thử.
Trước khi sử dụng, bình thử phải được rửa sạch, ví dụ bằng chất tẩy không chứa ion (tiếp theo rửa với axit và dung môi để loại bỏ các chất bám chặt vào thành bình).
4.2. Thiết bị kiểm soát nhiệt độ, để điều tiết nhiệt độ của dung dịch thử và nước trong bể dung dịch gốc ở 23 °C ± 1 °C bằng các phương pháp phù hợp.
4.3. Thiết bị thay thế dung dịch, thiết bị có khả năng đo và khuấy trộn để duy trì nồng độ yêu cầu của chất thử trong các bình thử trong khoảng 20%, và thiết lập quá trình thay mới dung dịch thử trong các bình ở tốc độ đủ để ngăn nồng độ của oxy trong bình không bị giảm xuống dưới 60% ASV.
4.4. Vợt, làm bằng nilon hoặc vật liệu trơ về hóa học khác dùng cho bình đối chứng và các vợt khác cho tất cả các bình thử (4.1).
5. Môi trường thử
Việc chuẩn bị và bảo quản dung dịch, nuôi cá, và tất cả các thao tác và phép thử được thực hiện trong phòng có không khí sạch, không chứa các chất ô nhiễm ở nồng độ có hại trong không khí.
Phải cẩn thận tránh sự xáo trộn không mong muốn vì có thể làm thay đổi hành vi của cá. Thực hiện tất cả phép thử trong điều kiện ánh sáng phòng thí nghiệm thông thường với chu kỳ chiếu sáng hàng ngày từ 12 h đến 16 h.
6. Cách tiến hành
6.1. Điều kiện về cá
Bất kể khi nào có thay đổi về quần thể gốc, phải tiến hành phép thử độc tính sử dụng phương pháp đã định trong tiêu chuẩn này sử dụng hóa chất chuẩn thích hợp [ví dụ kali dicromat (K2Cr2O7)]. Kết quả của phép thử này phải thống nhất hợp lý với kết quả trong phép thử trước trong cùng một phòng thí nghiệm.
Không sử dụng cá thử đã sử dụng trong quá trình thử trước.
Duy trì nhiệt độ của nước trong bề gốc ở 23 °C ± 1 °C (4.2).
6.2 Phép thử giới hạn
Sử dụng quy trình đã mô tả trong tiêu chuẩn này, phép thử giới hạn có thể được tiến hành giới hạn của dịch thể lỏng hòa tan trong nước trong điều kiện của phép thử hoặc ở 100 mg/I, tùy theo mức nào thấp hơn, để cho thấy giá trị LC50-96 h lớn hơn nồng độ này. Nếu không có cá chết trong phép thử giới hạn thì không yêu cầu phép thử tiếp theo.
Tiến hành phép thử giới hạn bằng cách sử dụng 10 con cá, và cùng số lượng trong (các) mẫu đối chứng.
CHÚ THÍCH 1: Lý thuyết nhị thức chỉ ra rằng khi sử dụng 10 con cá, với tỷ lệ chết bằng “không” thì có độ tin cậy 99,9 % giá trị LC50-96 h lớn hơn nồng độ thử giới hạn. Nếu có tỷ lệ chết, phải xem xét tiến hành một nghiên cứu hoàn chỉnh (xem 6.3 và 6.4). Cần ghi lại nếu quan sát thấy ảnh hưởng gần gây chết.
6.3. Phép thử sơ bộ
6.3.1. Nếu có thể, sử dụng phương pháp dòng chảy đối với phép thử sơ bộ, với cùng khoảng nồng độ, số cá trên mỗi khoảng nồng độ dung dịch thử và phương pháp quan sát cá như mô tả trong 6.3.2 để thay thế phương pháp tĩnh sơ bộ.
6.3.2. Thêm ít nhất 2,5 I, tốt nhất là 5 I nước pha loãng tiêu chuẩn (3.2) vào từng bình trong số sáu bình thử (4.1) và sục khí nếu cần để khôi phục nồng độ oxy hòa tan đến ít nhất 90% giá trị bão hòa khí của dung dịch.
Chuẩn bị dung dịch thử bằng cách thêm lượng thích hợp dung dịch gốc của chất thử (3.3) vào năm bình để thu được dãy cấp số mũ về nồng độ, ví dụ 1000 mg/l; 100 mg/l; 10 mg/l; 1 mg/l và 0,1 mg/l. Không thêm gì vào bình thứ sáu là bình đối chứng. Dung dịch được điều chỉnh và duy trì ở nhiệt độ 23 °C ± 1 °C (4.2) và không được sục khí trong quá trình thử này.
Cho ba con cá vào mỗi bình.
Ít nhất hai lần một ngày, ghi lại số cá chết và nồng độ oxy hòa tan trong mỗi bình. Loại bỏ cá chết.
Nếu chưa có đủ số liệu để thiết lập khoảng nồng độ cần cho phép thử cuối cùng thì lặp lại phép thử sơ bộ với khoảng nồng độ khác.
6.4. Phép thử cuối cùng
Chọn ít nhất năm nồng độ tạo thành một dãy cấp số mũ, ví dụ 8 mg/I; 4 mg/l; 2 mg/l; 1 mg/I và 0,5 mg/l, nhưng phải bao gồm cả nồng độ thấp nhất làm chết toàn bộ cá trong phép thử sơ bộ, và nồng độ không gây chết cao nhất trong vòng 96 h. Dãy nồng độ được chọn này phải cung cấp xác suất thu được tỷ lệ chết từ 0% đến 100% trong ít nhất hai nồng độ liên tiếp của dãy cấp số mũ được sử dụng, điều này cần để ước tính LC50 bằng sử dụng phương pháp “tin cậy xác suất “probit””.
Trong một số trường hợp, có thể yêu cầu khoảng nồng độ hẹp hơn để cung cấp các số liệu cần thiết và trong trường hợp khác lại cần khoảng nồng độ rộng hơn.
Lấy một bộ ít nhất sáu bình thử (4.1), và thiết bị kèm theo. Thêm lượng thể tích thích hợp của một trong số các dãy dung dịch thử theo thứ tự vào tất cả các bình trừ một (hoặc hai bình) các dung tích thích hợp của mỗi dung dịch trong dãy dung dịch thử theo thứ tự tương ứng, để đưa ra khoảng nồng độ riêng của mỗi chất thử được chọn. Đổ đầy nước pha loãng vào một trong các bình còn lại (xem Chú thích 2), bình này đóng vai trò làm mẫu đối chứng. Nếu sử dụng dung môi hữu cơ để hòa tan chất thử, phải chuẩn bị mẫu đối chứng thứ hai với nước pha loãng tiêu chuẩn chứa một lượng vừa đủ dung môi hữu cơ để có được nồng độ dung môi cao nhất mà tại nồng độ này dung môi có mặt trong mọi dung dịch thử nghiệm. Khi dung dịch thử (3.4) được điều chỉnh về nhiệt độ 23 °C ± 1 oC (4.2), cho ít nhất bảy con cá vào mỗi bình như sau.
CHÚ THÍCH 2: Nếu sử dụng bình 1 l, hai bình đối chứng chứa nước pha loãng và, khi cần thiết, hai bình chứa dung môi.
Chọn ngẫu nhiên cá trong đàn cá gốc và ngay lập tức thả ngẫu nhiên vào các bình thử, sử dụng vợt có lỗ nhỏ, làm bằng vật liệu trơ mềm (4.4). Loại bỏ bất kỳ con cá nào bị rơi hoặc thao tác không đúng trong quá trình di chuyển. Trong phép thử này, cho tất cả cá vào bình trong khoảng thời gian 30 min.
Đặt thiết bị thay thế dung dịch thử (4.3) tại tốc độ ít nhất là 25 l/ngày, tiến hành thay thế liên tục hoặc thay thế tại các khoảng thời gian ngắn. Tốc độ thay thế có thể giảm tới mức thấp bằng 12 l/ngày, miễn là nồng độ oxy hòa tan của dung dịch chảy ra còn lại lớn hơn 60% ASV.
Dung dịch thử dùng để thay thế phải được điều chỉnh và duy trì ở nhiệt độ gần ở 23 °C trước khi thêm vào bình thử.
Ghi số cá chết trong mỗi bình ít nhất hằng ngày trong quá trình thử. Loại bỏ từng con cá chết khỏi bình càng nhanh càng tốt. Việc quan sát phải thực hiện thường xuyên hơn, ví dụ để chắc chắn thu được khoảng thời gian sống trung bình được tính toán cho mỗi nồng độ. Chú ý không bỏ qua bất cứ hành vi bất thường nào của cá.
Nếu có thể, phải đo nồng độ của chất thử trong dung dịch gốc và trong dung dịch đang thử từ các bình thử ít nhất tại lúc bắt đầu và kết thúc phép thử.
Đo nồng độ oxy hòa tan, pH và nhiệt độ của dung dịch đang thử đi qua từ mỗi bình ít nhất một lần một ngày và tại thời điểm bắt đầu và kết thúc phép thử.
Biểu mẫu gợi ý để ghi số liệu được nêu trong Phụ lục B.
7. Biểu thị kết quả
7.1. Tính hợp lệ
Kết quả được coi là hợp lệ nếu đáp ứng đầy đủ các yêu cầu sau:
a) Nồng độ oxy hòa tan của dung dịch thử trong quá trình thử phải đạt ít nhất 60% ASV;
b) Nồng độ chất thử không được biết (hoặc nghi ngờ) bị thất thoát đáng kể trong quá trình thử (xem Điều 2);
c) Tỷ lệ chết của cá đối chứng không quá 10% hoặc một con trong một bể;
d) Tỷ lệ cá đối chứng có hành vi bất thường không quá 10% hoặc một con trong một bể;
e) Giá trị LC50-24 h của hóa chất chuẩn [ví dụ kali dicromat (K2Cr2O7)] nếu áp dụng, cho bể cá gốc phải thống nhất hợp lý với kết quả trong phép thử trước trong cùng một phòng thí nghiệm.
7.2. Ước tính giá trị LC50
Trong trường hợp ước tính LC50 bằng đồ thị đơn giản được coi là thỏa đáng, thì giá trị này có thể nhận được bằng cách vẽ đồ thị tỷ lệ giữa cá chết (tính theo phần trăm cá thử trong mỗi bình thử) với nồng độ chất thử. Sử dụng các trục có thang chia tuyến tính, đẻ tạo nên tương quan sigma, từ tương quan này có thể được tính giá trị LC50 bằng cách nội suy từ nồng độ dự kiến sẽ gây nên tỷ lệ chết 50% (xem Hình 1).
Sẽ thích hợp hơn nếu vẽ số liệu trên giấy vẽ đồ thị trên các trục với thang chia theo logarit và đơn vị xác suất. Số liệu được vẽ theo cách này sẽ tạo nên tương quan tuyến tính, từ đó có thể nội suy LC50 như trên (xem Hình 2).
Nếu cần ước tính độ dốc, giới hạn tin cậy 95% và LC50, thì khuyến nghị các phân tích thống kê này thường có giá trị trong việc biểu thị kết quả, số liệu có thể được phân tích bằng đồ thị (xem tài liệu tham khảo [2] trong thư mục tài liệu tham khảo).
Nếu có sẵn thiết bị tính toán, có thể áp dụng phân tích “probit” (xem tài liệu tham khảo [1] trong thư mục tài liệu tham khảo).
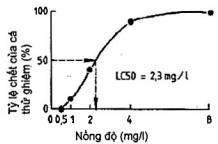
Hình 1- Nội suy giá trị LC50 bằng đồ thị (thang chia tuyến tính)
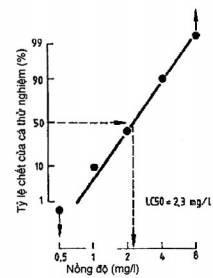
Hình 2 - Nội suy giá trị LC50 bằng đồ thị (thang chia logarit và đơn vị xác suất)
Nếu chưa có đủ số liệu để ước tính LC50 tại 24 h và 48 h và, có thể tại 72 h và 96 h, phải ghi lại nồng độ thấp nhất mà tại đó xuất hiện tỷ lệ cá chết 100% và nồng độ cao nhất cho tỷ lệ cá chết 0% tại 24 h; 48 h; 72 h và 96 h. Nồng độ này chỉ ra giới hạn trong đó có khả năng chứa LC50.
8. Báo cáo thử nghiệm
Báo cáo thử nghiệm phải bao gồm các thông tin sau:
a) Viện dẫn tiêu chuẩn này;
b) Nhận dạng hóa chất và mọi thông tin có sẵn về chất thử (như tính tan, tính bay hơi, hệ số tỷ lệ octanol/nước, tốc độ phân hủy);
c) Phương pháp chuẩn bị nước pha loãng, dung dịch gốc và dung dịch thử bao gồm cả mô tả chi tiết của các thiết bị thay thế dung dịch hoặc các viện dẫn của thiết bị;
d) Tất cả số liệu hóa học, sinh học, vật lý liên quan đến phép thử và không được đưa ra trong tiêu chuẩn này, bao gồm cả các chi tiết về điều kiện thích nghi của cá thử, và khối lượng cá, tính theo gam trên lít;
e) Các số liệu được xem xét khi đánh giá tính hợp lệ của phép thử:
1) Nồng độ của oxy hòa tan,
2) Tỷ lệ chết được quan sát thấy ở cá đối chứng,
3) Tỷ lệ cá đối chứng có hành vi bất bình thường,
4) LC50 của chất chuẩn;
f) Bảng liệt kê nồng độ danh định được thử (với giá trị phân tích hóa học, nơi công bố), và phần trăm tổng số cá chết trong 24 h, 48 h, 72 h và 96 h tính từ lúc bắt đầu phép thử;
g) Các giá trị LC50 và giới hạn tin cậy, nếu có, của chất thử tại 24 h, 48 h, 72 h và 96 h, của chất thử, tài liệu tham khảo cần có cho các phương pháp tính toán, và các phương pháp phân tích hóa học, ở bất cứ nơi nào được áp dụng;
h) Độ dốc của đường cong nồng độ - đáp ứng (và giới hạn tin cậy 95% nếu có);
i) Minh họa bằng đồ thị các mối quan hệ nồng độ - đáp ứng;
j) Mọi phản ứng bất thường của cá trong điều kiện phép thử và mọi tác động bên ngoài quan sát được sinh ra do chất thử;
k) Mọi sai khác so với quy trình được quy định trong tiêu chuẩn này, và nguyên nhân.
Phụ lục A
(Tham khảo)
Thông số môi trường để nuôi và tạo giống cá ngựa vằn
(Brachydanio rerio Hamilton-Buchanan)
A.1. Khái quát
Cá ngựa vằn có nguồn gốc từ bờ biển Coromandel của Ấn Độ nơi có các dòng chảy mạnh. Đây là loại cá thường được nuôi trong bể, vì thế các thông tin về các quy trình chăm sóc và nuôi cá có thể được nêu trong các tài liệu tham khảo về nuôi cá nhiệt đới. Đặc tính sinh học của các loài này đã được tổng kết bởi Laale [5].
Loài cá này hiếm khi dài quá 45 mm. Thân hình trụ với 7 đến 9 sọc dọc xanh đậm trên nền màu bạc. Các sọc này chạy đến vây đuôi và vây bụng. Phần lưng có màu xanh ô liu. Con đực mảnh hơn con cái và có màu ánh vàng. Con cái có màu bạc hơn và bụng phồng to, đặc biệt là trước khi đẻ trứng.
A.2. Thông số môi trường
Loài cá này có khả năng chịu đựng khoảng rộng về nhiệt độ, pH và độ cứng của nước. Axelrod[4] đưa ra khoảng nhiệt độ là 15,5 °C đến 43,3 °C và pH từ 6,6 đến 7,2. Cá có thể sinh sản, nuôi và sống trong nước vòi có độ cứng tổng số cao nhất là 300 mg/l (theo canxi cacbonat) và pH từ 7,7 đến 8,2. Nhiệt độ được duy trì ổn định ở 26 °C ± 1 X và tăng lên 27 °C ± 1 °C để kích thích đẻ trứng.
A.3. Vật liệu và phương pháp
Loài cá này có thể đẻ trứng trong bể thủy tinh có mức chứa khoảng 70 I. Cả mới nở sau đó được chuyển sang bể có mức chứa 200 l.
Vì cá trưởng thành là loài tham ăn trứng, cần có phương pháp để bảo vệ trứng mới đẻ và cá non. Một phương pháp đã được sử dụng thành công bằng cách giam cá trưởng thành trong lồng lưới dưới nước để khi con cái đẻ trứng, trứng sẽ rơi qua lưới xuống đáy bể tránh xa các con trưởng thành.
Lồng lưới có kích thước là 250 mm x 250 mm x 80 mm, được làm từ sợi nhựa, có đường kính mắt lưới 3 mm. Lồng này được kẹp vào miệng bể để phần gờ phía trên của lồng ở trên nước còn lưới nhúng xuống nước khoảng 60 mm. Không sử dụng hệ thống lọc bằng sỏi ở đáy để làm sạch nước vì nó có khả năng làm hại trứng. Bể phải được chiếu sáng 8 h một ngày.
A.4. Điều kiện
Giai đoạn này kéo dài khoảng 2 tuần. Con đực và con cái được cách ly và nuôi ăn thức ăn sống. Bao gồm giun trắng (enchytraeids), Daphnia và tôm biển (Artemia). Mật độ của bể trong suốt quá trình quy định luôn được giữ dưới 30 con cá trong bể có mức chứa 70 l.
Vào cuối của 2 tuần, con đực có màu ánh vàng đậm và con cái có bụng trứng to.
A.5. Giai đoạn đẻ trứng
Có thể thiết lập bể đẻ trứng như sau.
Làm đầy bể rỗng bằng nước vòi sạch có nhiệt độ 27 °C trong 48 h và đặt lồng nhựa vào dưới mép bể, để cá bơi trong một khoảng thể tích 1 I. Cho vào lồng sáu con cái vào buổi sáng và cho ăn bằng tôm biển đã đông khô.
Thêm chín con đực vào lồng vào buổi tối và cho cá ăn một lần nữa bằng tôm biển đã đông khô trước khi tắt đèn.
Quá trình đẻ trứng được kích thích bằng ánh sáng buổi sáng và hoàn thành sau khi bật đèn khoảng 4 h. Trứng, không dính vào nhau, rơi qua lưới, cách biệt với các con trưởng thành.
Khi con cái đẻ trứng xong, chuyển các con trưởng thành ra và để cho trứng nở.
A.6. Phát triển cá con
Trứng nở sau khoảng từ 4 ngày đến 5 ngáy và các cá non bám vào thành bể và giữ bất động từ 24 h đến 48 h. Khi con non tự bơi được, cho chúng ăn thức ăn dành cho cá loại có đăng ký phù hợp với kích thước hạt nhỏ. Khi được 3 tuần, cá non có thể được cho ăn bằng tôm biển mới nở và tốc độ tăng trưởng trở nên nhanh hơn. Sau 1 tháng, có thể chuyển chúng sang bể 200 I và cho ăn bằng hỗn hợp thức ăn đã được đăng ký phù hợp và thức ăn sống. Cá sẽ hoàn thiện cơ quan sinh sản sau 3 tháng và đạt đến chiều dài 3,5 cm. Cần chú ý là các dị tật tự phát ở ấu trùng đang phát triển có thể quan sát được ở những giống nhất định (tài liệu tham khảo [9] trong thư mục tài liệu tham khảo).
Các nghiên cứu khác (xem tài liệu tham khảo [7] trong thư mục tài liệu tham khảo) chỉ ra rằng về các yếu tố trong chế độ ăn có thể dẫn đến dị hình và cá ngựa vằn đặc biệt nhạy cảm với yếu tố này (các loài khác sinh sản và phát triển bình thường khi cho ăn thức ăn cá đã đăng ký phù hợp tương tự).
Phụ lục B
(Tham khảo)
Mẫu gợi ý để ghi số liệu
| Phòng thí nghiệm | Người thực hiện | |||||||
| KÝ hiệu mẫu | Ngày bắt đầu phép thử | |||||||
| Chất | ||||||||
| Độ tinh khiết | ||||||||
| Tạp chất | ||||||||
| Nếu thử một phương thức, nhận dạng các thành phần | ||||||||
| Phương pháp chuẩn bị dung dịch gốc | Nồng độ dung dịch gốc (mg/l) | |||||||
| Nồng độ tối đa của dung môi trong các bình thử (ml/I) | ||||||||
| Phương pháp phân tích hóa học | ||||||||
| Bình đối chứng 1. Chỉ có nước pha loãng | ||||||||
| Thông số xác định | Thời gian bắt đầu phép thử (h) | |||||||
| 0 |
|
|
|
|
|
|
| |
| Nồng độ oxy hòa tan (% ASV1)) pH Nhiệt độ (oC) Số cá chết |
|
|
|
|
|
|
|
|
| 2 Nước pha loãng và |
|
| ||||||
| ml/l | dung môi | |||||||
|
|
| |||||||
| Thông số xác định | Thời gian bắt đầu phép thử (h) | |||||||
| 0 |
|
|
|
|
|
|
| |
| Nồng độ oxy hòa tan (% ASV1)) pH Nhiệt độ (°C) Số cá chết |
|
|
|
|
|
|
|
|
| Ký hiệu bình thử Nồng độ ban đầu (đã đo và đã tính) của chất thử |
|
| ||||||
| mg/l |
| |||||||
|
|
| |||||||
| Thông số xác định | Thời gian bắt đầu phép thử (h) | |||||||
| 0 |
|
|
|
|
|
|
| |
| Nồng độ chất thử [mg/l (trong phân tích)] Nồng độ oxy hòa tan (% ASV1)) pH Nhiệt độ (°C) Số cá chết |
|
|
|
|
|
|
|
|
| 1) Giá trị bão hòa không khí. |
|
|
|
|
|
|
|
|
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] Finney, D.J. Statistical Methods in Biological Asay, Wycombe, Kingdom, Griffin (1978).
[2] Litchfield, J.T. and Wilcoxon, F.A simplified method for evaluating dose-effect experient. J. Pharmacol.Exp.Ther. 96 (1949), pp 99-113.
[3] Stephan, C.E. Method for calculating an LC50. Aquatic Toxycology and Hazard Evaluataion. ASTM (1977), ST, p 634.
[4] Axelrod, H.P. Breeding Quarium Fishes Book 1. T.F.H. Publication, 1967.
[5] Laale, H.W. The biology and use of zebra fish (Brachydanio rerio) in fisheries rearch. A literature review. J. Fish Biol. 10 (2) (1977), pp 121-173.
[6] Mertens, J. Year-round controlled mass reproduction of zebra fish. Aquaculture 2 (1973), pp 245-249.
[7] Newsome, C.S. and Piron, R.D. Aetiology of skeletal deformities in the Zebra Danio fish (Brachydanio rerio Hamilton-Buchanan). J. Fish Biol. 21 (1982), pp 231-237.
[8] NIIMl,A.J and LAHAM, Q.N. Influence of breeding time interval on egg number, mortality and hatching of the zebra fish (Brachydanio rerio). Can. J.Zool. 52 (1974), pp 515-517.
[9] PIRON, R.D. Spontaneous skeletal deformities in the zebra fish (Brachydanio rerio) bred for fish toxicity tests. J. Fish Biol. 13 (1978), pp 79-84.
1) Ngoài Brachydanio rerio, có thể sử dụng các loài cá nước ngọt sau mà không sửa đổi tiêu chuẩn này.
- Lepomismacrochirus (Teleostei, Centrarchidae)
- Oryzias latipes (Teleostei, Poeciliidae)
- Pimephales promelas (Teleostei, Cyprinidae)
- Poecilia reticulata (Teleostei, Poeciliidae)
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 10806-3:2015 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 10806-3:2015 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 10806-3:2015 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 10806-3:2015 DOC (Bản Word)