- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn quốc gia TCVN 13517:2022 Thức ăn chăn nuôi - Phân lập và định lượng enterococcus (E.FAECIUM) SPP.
| Số hiệu: | TCVN 13517:2022 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
30/12/2022 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 13517:2022
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 13517:2022
TIÊU CHUẨN QUỐC GIA
TCVN 13517:2022
THỨC ĂN CHĂN NUÔI - PHÂN LẬP VÀ ĐỊNH LƯỢNG ENTEROCOCCUS (E. FAECIUM) SPP.
Animal feeding stuffs - Isolation and enumeration of Enterococcus (E. faecium) spp.
Lời nói đầu
TCVN 13517:2022 được xây dựng trên cơ sở tham khảo EN 15788:2009;
TCVN 13517:2022 do Viện Chăn nuôi biên soạn, Bộ Nông nghiệp và Phát triển nông thôn đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
THỨC ĂN CHĂN NUÔI - PHÂN LẬP VÀ ĐỊNH LƯỢNG ENTEROCOCCUS (E. FAECIUM) SPP.
Animal feeding stuffs - Isolation and enumeration of Enterococcus (E. faecium) spp.
1 Phạm vi áp dụng
Tiêu chuẩn này đưa ra các nguyên tắc chung để định lượng enterococcus trong các mẫu thức ăn chăn nuôi (phụ gia, premix và các sản phẩm thức ăn chăn nuôi) có chứa (E. faecium) như một thành phần vi sinh vật đơn hoặc trong hỗn hợp của các loại vi sinh vật khác.
Giới hạn phát hiện đối với các mẫu thức ăn chăn nuôi như sau:
a) Các chất phụ gia chứa khoảng 1010 đơn vị hình thành khuẩn lạc (CFU)/g;
b) Các premix chứa 108 CFU/g:
c) Các loại thức ăn chăn nuôi, dạng bột hoặc viên chứa 106 CFU/g và bao gồm cả thức ăn hoàn chỉnh và các chất thay thế sữa.
Tiêu chuẩn này không áp dụng cho các thức ăn khoáng được dùng làm thức ăn bổ sung và có chứa từ 40 % hàm lượng tro thô trở lên.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 6404 (ISO 7218) Vi sinh vật trong thực phẩm và trong thức ăn chăn nuôi - Yêu cầu chung và hướng dẫn kiểm tra vi sinh vật
TCVN 6507-1 (ISO 6887-1) Vi sinh vật trong chuỗi thực phẩm - Chuẩn bị mẫu thử, huyền phù ban đầu và các dung dịch pha loãng thập phân để kiểm tra vi sinh vật - Phần 1: Các nguyên tắc chung để chuẩn bị huyền phù ban đầu và các dung dịch pha loãng thập phân
TCVN 6952 (ISO 6498) Thức ăn chăn nuôi - Chuẩn bị mẫu thử.
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng các thuật ngữ và định nghĩa sau đây:
3.1
Enterococcus faecium (Enterococcus faecium)
Enterococcus faecium là vi khuẩn hình thành các khuẩn lạc phù hợp với mô tả của các loài trên môi trường chọn lọc quy định sau khi ủ 24 h ở nhiệt độ 37 °C trong các điều kiện hiếu khí:
a) hình thái của các khuẩn lạc trên môi trường chọn lọc;
b) hình tròn;
c) lồi đến khum
d) nguyên vẹn
e) màu trắng
f) bề mặt lấp lánh
g) mờ đục
Đường kính của khuẩn lạc từ 1 mm đến 2 mm.
Môi trường xung quanh khuẩn lạc từ nâu sẫm đến màu đen, do thủy phân esculin.
Khi kiểm tra các khuẩn lạc điển hình trên kính hiển vi pha tương phản, cho thấy các tế bào vi khuẩn hình cầu và xếp thành các cặp.
4 Nguyên tắc
Chuẩn bị huyền phù ban đầu của mẫu trong dung dịch đệm pha loãng thích hợp, sử dụng bộ đồng hóa mẫu. Các dung dịch pha loãng của huyền phù ban đầu phải được chuẩn bị ngay trước khi huyền phù lắng xuống. Các đĩa (thạch Azid Esculin Mật) được nuôi cấy với các độ pha loãng được chọn. Các đĩa này được ủ trong điều kiện hiếu khí trong 24 h ± 2 h ở 37 °C ± 1 °C.
Đếm các khuẩn lạc enterococcus (E. faecium) giả định và tính số lượng đơn vị hình thành khuẩn lạc trong 1 g hoặc 1 kg.
CHÚ THÍCH: Để xác nhận số đếm khuẩn lạc, có thể dung bộ kít thử nhận biết để khẳng định các khuẩn lạc đã chọn.
5 Dung dịch pha loãng, môi trường chọn lọc và kit thử đặc trưng kiểu hình
5.1 Dung dịch pha loãng
5.1.1 Dung dịch pha loãng đối với huyền phù ban đầu của các premix, phụ gia và sản phẩm thức ăn chăn nuôi
Dung dịch pha loãng này được dùng để pha loãng các dung dịch thập phân và mẫu pha loãng thập phân ban đầu (10-1) trong các dụng cụ thích hợp (ví dụ: chai hoặc bình)
Muối đệm phosphat (PBS):
Hòa tan 8 g natri clorua, 0,2 g kali clorua, 1,15 g dinatri hydro phosphat, 0,2 g kali dihydro phosphat trong 1 L nước cất, chỉnh để dung dịch có pH là 7,3 ± 0,2. Chia dung dịch này vào các dụng cụ chứa thích hợp (chai hoặc bình), đậy chặt nắp và hấp áp lực ở nhiệt độ 121 °C ± 1 °C trong 10 min.
Trước khi sử dụng, đưa nhiệt độ của dung dịch pha loãng về nhiệt độ phòng.
Đo pH của dung dịch pha loãng để đảm bảo khả năng đệm thích hợp.
5.1.2 Chuẩn bị dãy dung dịch pha loãng thập phân
Dung dịch pha loãng này được dùng để pha loãng huyền phù ban đầu và các dung dịch pha loãng tiếp theo.
Dung dịch muối pepton được chuẩn bị theo TCVN 6507-1 (ISO 6887-1).
Hoặc theo cách sau đây: Cân 1 g casein là pepton của casein thủy phân bởi enzym tuyến tụy (hoặc pepton có chất lượng tương đương) và 8,5 g natri clorua vào bình đựng 1 L nước cất. Hòa tan các thành phần trên trong nước. Khi dung dịch ở nhiệt độ 25 °C ± 1 °C, chỉnh pH đến 7,0 ± 0,2, phân phối 9,0 ml ± 0,1 ml vào các ống nghiệm vặn chặt nắp, tiệt trùng trong nồi hấp áp lực 15 min ở nhiệt độ 121 °C ± 1 °C. Trước khi sử dụng, đưa nhiệt độ của dung dịch pha loãng về nhiệt độ phòng.
5.2 Môi trường chọn lọc
Thạch Esculin Azide Mật được dùng làm môi trường chọn lọc.
Thành phần tính bằng g/L môi trường hoàn chỉnh:
| Pepton 1 (sản phẩm thủy phân casein của enzym tuyến tụy): | 17,0 g |
| Pepton 2 (sản phẩm thủy phân thịt của peptic): | 17,0 g |
| Chất chiết nấm men: | 5,0 g |
| Mật bò (khô): | 10,0 g |
| Natri clorua: | 5,0 g |
| Esculin: | 1,0 g |
| Sắt(lll) amoni xitrat: | 0,5 g |
| Natri azid: | 0,25 g |
| Thạch: | 13,5 g |
pH cuối cùng là 7,1 ± 0,2.
5.3 Đặc trưng kiểu hình và khẳng định
Kiểm tra các khuẩn lạc được chọn bằng kính hiển vi về hình thái giống enterococcus.
CHÚ THÍCH: Có thể sử dụng bộ kit thử kiểu hình về đặc trưng của các khuẩn lạc, nếu cần.
6 Thiết bị, dụng cụ
Sử dụng các thiết bị, dụng cụ của phòng thử nghiệm vi sinh thông thường và cụ thể như sau.
6.1 Thiết bị khử trùng khô (lò sấy) và khử trùng ướt (nồi hấp áp lực)
Theo TCVN 6404 (ISO 7218).
6.2 Tủ ấm, có thể duy trì nhiệt độ ở 37 °C ± 1 °C.
6.3 Nồi cách thủy, có thể duy trì nhiệt độ ở 48 °C ± 1 °C.
6.4 Thiết bị trộn
Sử dụng bộ trộn thích hợp có hai tốc độ (18 000 r/min và 22 000 r/min), kèm theo cốc 1 L được khử trùng 1 h ở 170 °C đến 180 °C.
6.5 Bộ khuấy trộn, ví dụ: vortex hoặc loại tương đương.
6.6 Cân, có thể cân đến hai chữ số sau dấu phẩy.
6.7 Chai có nắp vặn, dung tích 25 ml và 1 000 ml.
6.8 Pipet tự động và các đầu tip vô trùng để phân phối các lượng 100 μl và 1 ml, đầu tip có miệng rộng.
6.9 Que dàn vi khuẩn vô trùng, hình chữ L bằng thủy tinh hoặc kim loại
6.10 Đĩa Petri vô trùng, đường kính 90 mm.
6.11 Tủ cấy vô trùng
6.12 Kính hiển vi, có hình ảnh tương phản (phóng đại 400 lần) và được sử dụng với nhúng dầu
7 Lấy mẫu
Tiêu chuẩn này không quy định việc lấy mẫu. Nên lấy mẫu theo tiêu chuẩn cụ thể liên quan đến sản phẩm, nếu không thì các bên cần thỏa thuận về việc lấy mẫu.
Nên lấy mẫu theo TCVN 11923:2017 (ISO/TS 17728:2015)[1].
Mẫu gửi đến phòng thử nghiệm phải là mẫu đại diện và không bị hư hỏng hoặc biến đổi trong suốt quá trình vận chuyển và bảo quản
CHÚ Ý: Cẩn thận để không làm nhiễm chéo mẫu với enterococci, đặc biệt là khi lấy mẫu chất phụ gia và premix có bổ sung enterococcus.
8 Chuẩn bị mẫu thử
Chuẩn bị mẫu thử theo TCVN 6952 (ISO 6498).
9 Cách tiến hành
9.1 Chuẩn bị đĩa thạch
Chuẩn bị môi trường chọn lọc theo hướng dẫn của nhà sản xuất. Sau khi hấp khử trùng môi trường, làm nguội đến nhiệt độ khoảng 48 °C ± 1 °C. Phân phối môi trường với lượng khoảng 20 ml vào các đĩa Petri (6.10), láng để bề mặt lớp thạch bằng phẳng. Thực hiện việc phân phối môi trường vào đĩa Petri (6.10) trong điều kiện vô trùng.
CẢNH BÁO: Natri azid là thành phần rất nhạy với nhiệt và không được hóa lỏng lại bằng nhiệt.
Khi môi trường đã đông đặc, lật ngược đĩa và xếp chồng bốn đĩa rồi để khô trong không khí ở nhiệt độ phòng hoặc làm khô trong tủ ấm ở 37 °C ± 1 °C trong khoảng 12 h hoặc để qua đêm, hoặc để các đĩa thạch mở hé nắp vào tủ cấy vô trùng trong 30 min và để khô bề mặt thạch.
Sau khi đĩa thạch đã khô, kiểm tra các đĩa về độ vô trùng.
Để tránh mất nước, các đĩa đã khô có thể được bảo quản trong tủ lạnh đến 2 tuần. Đĩa đã bảo quản lạnh phải được đưa về nhiệt độ phòng trước khi sử dụng.
9.2 Chuẩn bị huyền phù ban đầu và các dịch pha loãng thập phân
Cân 20 g ± 0,1 g chất phụ gia hoặc premix thông thường, hoặc 2 g ± 0,01 g mẫu phụ gia dạng hạt nhỏ (trong viên nang) hoặc 50 g ± 0,5 g mẫu thức ăn chăn nuôi. Thêm 180 g ± 0,1 g chất pha loãng (5.1.1) vào phụ gia hoặc premix, 198 g ± 0,1 g vào mẫu phụ gia dạng hạt rất nhỏ hoặc 450 g ± 1 g vào mẫu thức ăn chăn nuôi. Đồng hóa hỗn hợp bằng máy đồng hóa hoặc bộ trộn.
CHÚ THÍCH 1: Nên kiểm tra pH của huyền phù ban đầu và hiệu chính đến dải pH từ 7,3 đến 8,1.
Nên lấy nhiều hơn 25 viên nang để phép phân tích có độ lặp lại tốt với độ lệch chuẩn nhỏ hơn 20 %.
Trộn mẫu phụ gia và premix trong 3 min bằng thiết bị trộn (6.4) và pha loãng ngay.
Khi mới bắt đầu, trộn mẫu thức ăn chăn nuôi ở tốc độ thấp để tránh bắn mẫu, sau đó chuyển sang trộn tốc độ cao trong 1 min. Để yên trong 30 min để các hạt mẫu thấm nước. Tiếp tục trộn trong 2 min ở tốc độ cao và pha loãng ngay, sử dụng pipet miệng rộng.
CHÚ THÍCH 2: Có thể tránh tạo bọt mạnh trong huyền phù ban đầu trong quá trình trộn sử dụng chất chống tạo bọt thích hợp (ví dụ: chất chống tạo bọt silicon hoặc loại tương đương) với lượng phù hợp.
Đối với mẫu viên nang thì sử dụng lượng phụ gia đủ (ví dụ: polyoxyethylensorbitanmonooleat hoặc tương đương) với nhiệt độ phù hợp (ví dụ: 40 °C).
Lượng cân của thể tích đã lấy bằng pipet phải được hiệu chuẩn để có được hệ số hiệu chính trong phép tính số đếm Enterococcus faecium.
CẢNH BÁO - Các huyền phù có chứa các probiotic có xu hướng lắng nhanh sau khi trộn. Cần tránh điều này bằng cách hút nhanh, đúng cách các mẫu đã đồng nhất dùng cho các dịch mẫu pha loãng tiếp theo.
Chuẩn bị một dãy các dung dịch pha loãng (dãy pha loãng) sử dụng pipet vô trùng như bộ phân phối micro đặt tại mức 1 ml. Chuyển 1 ml huyền phù ban đầu vào ống nghiệm có chứa 9 ml dung dịch muối pepton vô trùng (5.1.2) để ở nhiệt độ phòng và lắc để trộn đều. Lặp lại quy trình này ở độ pha loãng 10-2 và tất cả các độ pha loãng tiếp theo cho đến khi thu được số ước tính thích hợp của tế bào. Sau quy trình pha loãng này, ủ ngay các đĩa đã nuôi cấy theo 9.3.
CHÚ THÍCH 3: Nên kiểm tra hàm lượng đồng trong huyền phù ban đầu bằng phép thử sơ bộ. Khi hàm lượng đồng vượt quá 200 mg/kg thì cần sử dụng thuốc thử chelat ví dụ: axit iminodiaxetic với nồng độ thích hợp liên quan đến giá trị pH.
CHÚ THÍCH 4: Đối với các mẫu có số đếm nấm men cao (phụ gia, premix), có thể thu được độ chụm tốt hơn nếu sử dụng các độ pha loãng 1/100 và/hoặc 1/1 000 thay vì độ pha loãng thập phân. Thay đầu tip pipet giữa các lần pha loãng.
9.3 Cấy và ủ các đĩa
Chuyển hỗn dịch từ mỗi nồng độ pha loãng (9.2) đã lựa chọn sang 02 đĩa thạch (9.1), mỗi đĩa 0,1 ml. Dùng que dàn vi khuẩn vô trùng (6.9), láng đều hỗn dịch trên bề mặt môi trường càng nhanh càng tốt.
CẢNH BÁO - Các dung dịch pha loãng được chọn phải đồng nhất trước khi chuyển sang đĩa.
Lật ngược các đĩa và cho vào tủ ấm ở 37 °C ± 1 °C trong 24 h ± 2 h trong điều kiện hiếu khí.
9.4 Đếm khuẩn lạc
Sau khi ủ trong các điều kiện quy định ở trên, đếm tất cả các đĩa có chứa nhiều hơn 30 và ít hơn 250 khuẩn lạc enterococcus (E. faecium) nghi ngờ dương tính giả (môi trường xung quanh các khuẩn lạc có màu nâu sẫm đến màu đen). Nếu có thể, đếm bốn đĩa (hai độ pha loãng liên tiếp). Đối với trường hợp các đĩa đã nuôi không chứa trên 15 khuẩn lạc và ít hơn 150 khuẩn lạc thì lặp lại việc phân tích.
9.5 Đặc trưng kiểu hình và khẳng định
Các vi khuẩn hình thành các khuẩn lạc điển hình trên môi trường đặc hiệu (xem 3) và cho các kiểu hình điển hình của enterococcus (E. faecium) và đếm các khuẩn lạc này.
Các kết quả này là cơ sở để tính số lượng đơn vị hình thành khuẩn lạc (CFU) trên gam mẫu.
10 Biểu thị kết quả
Số lượng đơn vị hình thành khuẩn lạc (CFU) trên gam mẫu được tính theo giá trị trung bình.
Số lượng enterococcus (E. faecium), N, trên gam hoặc trên mililit được tính theo Công thức sau đây:
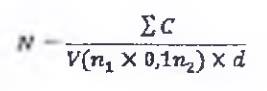
Trong đó:
ΣC là tổng số khuẩn lạc đếm được trên hai đĩa được giữ lại từ hai độ pha loãng liên tiếp, trong đó ít nhất một đĩa chứa 15 khuẩn lạc
V là thể tích dịch cấy được đưa vào mỗi đĩa, tính bằng mililit (ml);
n1 là số lượng đĩa được giữ lại ở độ pha loãng thứ nhất;
n2 là số lượng đĩa được giữ lại ở độ pha loãng thứ hai;
d là độ pha loãng tương ứng với dung dịch pha loãng đầu tiên được chọn.
Làm tròn kết quả thu được đến hai chữ số có nghĩa. Đối với số có ba chữ số, làm tròn chữ số thứ ba đến số gần 0 nhất. Trong trường hợp chữ số thứ ba là 5 thì làm tròn xuống nếu hai chữ số đầu tiên là số chẵn và làm tròn lên nếu hai chữ số đầu tiên là số lẻ
Báo cáo kết quả là số lượng vi sinh vật trên gam sản phẩm, được biểu thị bằng số 1,0 đến 9,9 với số mũ 10.
11 Độ chụm
11.1 Yêu cầu chung
Độ chụm của phương pháp và các môi trường khác nhau đã được xác định trong nghiên cứu liên phòng thử nghiệm.
11.2 Nghiên cứu liên phòng thử nghiệm
Chi tiết nghiên cứu liên phòng thử nghiệm về độ chụm của phương pháp đã được công bố được nêu trong Phụ lục B. Giới hạn lặp lại và giới hạn tái lập đã được xác định sử dụng ba loại mẫu thức ăn chăn nuôi bị nhiễm ở hai mức. Các giá trị thu được từ nghiên cứu liên phòng thử nghiệm này không áp dụng được cho dải nồng độ và nền mẫu khác với các dải nồng độ và nền mẫu đã nêu.
11.3 Độ lặp lại
Chênh lệch tuyệt đối giữa hai kết quả thử nghiệm đơn lẻ (log10) (số lượng enterococcus trên gam hoặc trên mililit) hoặc tỷ số giữa hai kết quả cao với kết quả thấp trên cùng thang đo chuẩn, thu được khi sử dụng cùng phương pháp thực hiện trên các vật liệu thử nghiệm giống hệt nhau, do cùng một người thực hiện, sử dụng cùng một thiết bị, trong khoảng thời gian ngắn không quá 5 % các trường hợp vượt quá giới hạn lặp lại r.
11.4 Độ tái lập
Chênh lệch tuyệt đối giữa hai kết quả thử nghiệm đơn lẻ (log10) (số lượng enterococcus trên gam hoặc trên mililit) hoặc tỷ số giữa hai kết quả cao với kết quả tháp trên cùng thang đo chuẩn, thu được khi sử dụng cùng phương pháp thực hiện trên các vật liệu thử nghiệm giống hệt nhau, do những người khác nhau thực hiện trong các phòng thí nghiệm khác nhau, sử dụng các thiết bị khác nhau, không quá 5 % các trường hợp vượt quá giới hạn tái lập R.
12 Báo cáo thử nghiệm
Báo cáo thử nghiệm phải bao gồm các thông tin sau:
a) tất cả các thông tin cần thiết để nhận biết đầy đủ về mẫu thử;
b) phương pháp lấy mẫu được sử dụng, nếu biết;
c) phương pháp thử nghiệm được sử dụng, viện dẫn tiêu chuẩn này;
d) nhiệt độ ủ;
e) mọi thao tác không quy định trong tiêu chuẩn này hoặc được xem là tùy chọn, cùng với mọi tình huống bất thường có thể ảnh hưởng đến kết quả;
f) kết quả thử nghiệm thu được.
Phụ lục A
(Tham khảo)
Lưu ý về cách tiến hành
Hầu hết các vi sinh vật khác được sử dụng làm phụ gia thức ăn chăn nuôi đều không hình thành khuẩn lạc trong các điều kiện quy định của tiêu chuẩn này.
Một số pediococci và lactobacillli có thể hình thành các khuẩn lạc màu hồng trên thạch Esculin Azid Mật trong các điều kiện quy định trong tiêu chuẩn này. Các khuẩn lạc này dễ dàng phân biệt được và không được đếm.
Phụ lục B
(Tham khảo)
Kết quả nghiên cứu liên phòng thử nghiệm
Một nghiên cứu liên phòng quốc tế gồm 20 cộng tác viên ở 12 quốc gia Châu Âu đã được thực hiện trên các mẫu với hai mức nhiễm. Nghiên cứu này được thực hiện năm 2002 và có sự cộng tác với Phòng thử nghiệm khoa học trung tâm (của Anh). Để nghiên cứu liên phòng thử nghiệm, các mẫu thử thức ăn chăn nuôi đồng nhất có chứa E. faecium đã được chuẩn bị là thành phần duy nhất trong mẫu có mức thấp (4 x 105 CFU/g) và kết hợp với lactobacilli và nấm men với lượng tương đương trong mẫu có chứa mức cao (4 x 107 CFU/g).
Bảng B.1 - Dữ liệu độ chụm thu được trong nghiên cứu liên phòng
|
| BEAA (Thạch Esculin Azide Mật)* | |
| Thấp | Cao | |
| Số lượng mẫu | 2 | 2 |
| Số lượng phòng thử nghiệm còn lại sau khi trừ ngoại lệ | 14 | 12 |
| Giá trị trung bình (log10CFU/g) | 5,52 | 7,57 |
| Độ lệch chuẩn lặp lại | 0,20 | 0,12 |
| Độ lệch chuẩn tương đối lặp lại | 3,60 | 1,49 |
| Giới hạn lặp lại, r | 0,56 | 0,32 |
| Độ lệch chuẩn tái lập | 0,41 | 0,23 |
| Độ lệch chuẩn tương đối lặp lại | 7,37 | 2,91 |
| Giới hạn tái lập, R | 1,14 | 0,63 |
| * Xem Điều 5 về môi trường nuôi cấy. | ||
Thư mục tài liệu tham khảo
[1] TCVN 11923:2017 (ISO/TS 17728:2015) Vi sinh vật trong chuỗi thực phẩm - Kỹ thuật lấy mẫu để phân tích vi sinh vật trong thực phẩm và thức ăn chăn nuôi.
[2] EN 15788:2009 Animal feeding stuffs - Isolation and enumeration of enterococcus(E.faecium)spp
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 13517:2022 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 13517:2022 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 13517:2022 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 13517:2022 DOC (Bản Word)