- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn quốc gia TCVN 8710-5:2023 Bệnh thủy sản - Quy trình chẩn đoán - Phần 5
| Số hiệu: | TCVN 8710-5:2023 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
13/11/2023 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 8710-5:2023
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 8710-5:2023
TIÊU CHUẨN QUỐC GIA
TCVN 8710-5:2023
BỆNH THỦY SẢN - QUY TRÌNH CHẨN ĐOÁN - PHẦN 5: HỘI CHỨNG TAURA Ở TÔM
Aquatic Animal Disease - Diagnostic procedure - Part 5: Taura syndrome in shrimp
Lời nói đầu
TCVN 8710-5:2023 thay thế TCVN 8710-5: 2011
TCVN 8710-5:2023 được xây dựng trên cơ sở tham khảo OIE/WOAH (2021) Manual of Diagnostic Test for Aquatic Animails. Chapter 2.2.7 Infection with Taura syndrome virus.
TCVN 8710-5:2023 do Trung tâm Chẩn đoán thú y Trung ương, Cục Thú y biên soạn, Bộ Nông nghiệp và Phát triển nông thôn đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Bộ tiêu chuẩn TCVN 8710 Bệnh thủy sản - Quy trình chẩn đoán gồm các phần sau đây:
- TCVN 8710-1:2011, Phần 1: Bệnh còi do vi rút ở tôm;
- TCVN 8710-2:2019, Phần 2: Bệnh hoại tử thần kinh ở cá biển;
- TCVN 8710-3:2019, Phần 3: Bệnh đốm trắng ở tôm;
- TCVN 8710-4:2019, Phần 4: Bệnh đầu vàng ở tôm;
- TCVN 8710-5:2023, Phần 5: Hội chứng taura ở tôm;
- TCVN 8710-6:2019, Phần 6: Bệnh do Koi herpesvi rút ở cá chép;
- TCVN 8710-7:2019, Phần 7: Bệnh xuất huyết mùa xuân ở cá chép;
- TCVN 8710-8:2023, Phần 8: Bệnh hoại tử cơ ở tôm (IMNV);
- TCVN 8710-9:2012, Phần 9: Bệnh hoại tử gan tụy ở tôm;
- TCVN 8710-10:2015, Phần 10: Bệnh do Perkinsus marinus ở nhuyễn thể hai mảnh vỏ;
- TCVN 8710-11:2015, Phần 11: Bệnh do Perkinsus olseni ở nhuyễn thể hai mảnh vỏ;
- TCVN 8710-12:2019, Phần 12: Bệnh vi bào tử do Enterocytozoon hepatopenaei ở tôm;
- TCVN 8710-13:2015, Phần 13: Bệnh gan tụy do Parvovi rút ở tôm;
- TCVN 8710-14:2015, Phần 14: Hội chứng lở loét (EUS) ở cá;
- TCVN 8710-15:2015, Phần 15: Bệnh nhiễm trùng do Aeromonas hydrophila ở cá;
- TCVN 8710-16:2016, Phần 16: Bệnh gan thận mủ ở cá da trơn;
- TCVN 8710-17:2016, Phần 17: Bệnh sữa trên tôm hùm;
- TCVN 8710-19:2019, Phần 19: Bệnh hoại tử gan tụy cấp tính ở tôm;
- TCVN 8710-20:2019, Phần 20: Bệnh hoại tử dưới vỏ và cơ quan tạo máu ở tôm;
- TCVN 8710-21:2019, Phần 21: Bệnh do vi khuẩn Streptococcus agalactiae ở cá;
- TCVN 8710-22:2022, Phần 22: Bệnh sán lá 16 móc ở cá;
- TCVN 8710-23:2022, Phần 23: Bệnh hoại tử cơ quan tạo máu do IHNV ở cá hồi;
- TCVN 8710-24:2022, Phần 24: Bệnh do sán lá Dollfustrema sp. ở cá da trơn;
- TCVN 8710-25:2022, Phần 25: Bệnh do ký sinh trùng Bonamia ostreae và Bonamia exitiosa ở hàu;
- TCVN 8710-26:2023, Phần 26: Bệnh hoại tử cơ quan tạo máu do EHNV ở cá;
- TCVN 8710-27:2023, Phần 27: Bệnh do vi rút Tilapia lake (TiLV) ở cá rô phi;
- TCVN 8710-28:2023, Phần 28: Bệnh do RSIV ở cá biển.
BỆNH THỦY SẢN - QUY TRÌNH CHẨN ĐOÁN - PHẦN 5: HỘI CHỨNG TAURA Ở TÔM
Aquatic animal disease - Diagnostic procedure - Part 5: Taura syndrome in shrimp
CẢNH BÁO - Việc áp dụng tiêu chuẩn này có thể liên quan đến các vật liệu, thiết bị và các thao tác gây nguy hiểm. Tiêu chuẩn này không thể đưa ra được hết tất cả các vấn đề an toàn liên quan đến việc sử dụng chúng. Người sử dụng tiêu chuẩn này phải tự thiết lập các thao tác an toàn sức khỏe thích hợp và xác định khả năng áp dụng các giới hạn quy định trước khi sử dụng tiêu chuẩn.
1 Phạm vi áp dụng
Tiêu chuẩn này quy định quy trình chẩn đoán Hội chứng Taura ở tôm (Taura syndrome).
2 Thuật ngữ, định nghĩa và các từ viết tắt
2.1 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng các thuật ngữ và định nghĩa sau:
2.1.1
Hội chứng Taura ở tôm (Taura syndrome)
Hội chứng truyền nhiễm nguy hiểm do tác nhân Taura syndrome virus (TSV) gây ra ở tôm, tôm mắc hội chứng Taura lây lan nhanh, thời gian ủ bệnh cao, có thể gây chết tôm trên diện rộng. Tôm mắc hội chứng Taura, sẽ gặp một số dấu hiệu tương tự những bệnh khác như bơi lờ đờ, tấp mé, ăn yếu, vỏ mềm.
2.1.2
Vi rút gây hội chứng Taura (Taura syndrome virus - TSV)
Là vi rút thuộc Chi Aparavirus, Họ Dicistroviridae, Bộ Picomavirales, TSV có dạng hình cầu 20 mặt, kích thước đường kính khoảng 31- 32 nm. Mật độ nổi 1,338 g/ml, bộ gen chứa sợi đơn thẳng ssRNA chiều thuận dài khoảng 10,2 kb.
Cấu trúc gene của TSV được miêu tả có hai khung đọc mở lớn là ORF1 và ORF2, phân biệt bởi một vùng gồm có 2 gen với 207 nucleotide. ORFs 1 và 2 chiếm 92% gene của TSV, 8% còn lại là của vùng không mã hóa. ORF1 chứa trình tự của các protein phi cấu trúc như helicase (NTP-binding protein), protease và RNA pholymerase phụ thuộc RNA. ORF2 có chứa trình tự cho các protein cấu trúc của TSV, trong đó có 3 protein capsid chính là VP1 tới VP3 (55 ; 40 ; 24 kD) và một chuỗi phụ (58kD). Để phát hiện hội chứng Taura trên tôm người ta thường nghiên cứu trên gen protein capsid hoặc protein áo (coat protein) nằm trong gen protein capsid (vùng gen VP1). Vi rút nhân lên trong tế bào chất của tế bào vật chủ.
2.2 Các từ viết tắt
- ADN (Deoxyribonucleic acid): Axit deoxyribonucleic;
- ARN (Ribonucleic acid): Axit ribonucleic;
- PBS (Phosphate buffered saline): Dung dịch muối đệm phosphat;
- RT-PCR (Reverse Transcription Polymerase Chain Reaction): Phản ứng chuỗi polymerase phiên mã ngược;
- Realtime RT-PCR (Realtime Reverse Transcription Polymerase Chain Reaction): Phản ứng chuỗi polymerase phiên mã ngược theo thời gian thực;
- TAE (Tris-acetate-EDTA): Tris-axetat-axit etylendiamintetraaxetic;
- TBE (Tris-borate-EDTA): Tris-borat-axit etylendiamintetraaxetic;
- TE (Tris-EDTA): Tris-axit etylendiamintetraaxetic.
3 Thuốc thử và vật liệu thử
Chỉ sử dụng thuốc thử loại tinh khiết phân tích, sử dụng nước cất, nước khử khoáng hoặc nước có độ tinh khiết tương đương, trừ các trường hợp có quy định khác.
3.1 Thuốc thử và vật liệu thử dùng chung
3.1.1 Ethanol, từ 70 % đến ethanol tuyệt đối
3.1.2 Dung dịch muối đệm phosphat (PBS), (xem A.2)
3.2 Thuốc thử và vật liệu thử dùng cho phương pháp sinh học phân tử
3.2.1 Mồi và dò (primers/probe) realtime RT-PCR, gồm mồi xuôi, mồi ngược và dò
3.2.2 Mồi (primers) RT-PCR, gồm mồi xuôi và mồi ngược
3.2.3 Kít nhân gen RT - PCR
3.2.4 Kít nhân gen realtime RT - PCR
3.2.5 Kít tách chiết ARN
3.2.6 Nước tinh khiết, không có nuclease
3.2.7 Thạch agarose
3.2.8 Dung dịch đệm TAE hoặc TBE (xem A.1)
3.2.9 Chất nhuộm màu, Ví dụ: Sybr safe
3.2.10 Chất đệm tải mẫu (Loading dye 6X)
3.2.11 Thang chuẩn ADN (Ladder/ Marker)
3.2.12 Dung dịch đệm TE
3.3 Thuốc thử và vật liệu dùng cho kiểm tra bệnh tích vi thể bằng phương pháp nhuộm HE
3.3.1 Formalin 10 %, được chuẩn bị từ dung dịch formaldehyde 38 % và dung dịch muối đệm phosphat (PBS) hoặc nước cất (tỷ lệ thể tích 1 : 9).
3.3.2 Xylen
3.3.3 Thuốc nhuộm Haematoxylin (xem A.2)
3.3.4 Thuốc nhuộm Eosin (xem A.3)
3.3.5 Parafin, có độ nóng chảy từ 56 °C đến 60 °C
3.3.6 Dung dịch Davidson
4 Thiết bị, dụng cụ
Sử dụng thiết bị, dụng cụ thông thường của phòng thử nghiệm sinh học và những thiết bị, dụng cụ sau:
4.1 Thiết bị, dụng cụ dùng chung
4.1.1 Tủ lạnh, có thể duy trì ở nhiệt độ từ 2 °C đến 8 °C
4.1.2 Tủ lạnh âm sâu, có thể duy trì ở nhiệt độ từ - 20 °C tới - 80 °C
4.1.3 Buồng cấy an toàn sinh học cấp 2
4.1.4 Pipet đơn kênh các loại
4.1.5 Ống đong, dung tích 100 mL; 500 mL; 1000 mL
4.1.6 Máy ly tâm, có thể hoạt động với gia tốc 2 000 g đến 4 000 g và gia tốc 12 000 g
4.1.7 Máy nghiền mẫu
4.1.8 Cân phân tích, có thể cân chính xác đến 0,1 mg
4.1.9 Lọ dụng cụ chứa mẫu, kín, có nắp đậy, không rò rỉ, vô trùng
4.1.10 Pank, kéo, vô trùng
4.1.11 Máy ủ nhiệt, từ 0°C đến 100 °C
4.2 Thiết bị, dụng cụ dùng cho phương pháp sinh học phân tử
4.2.1 Máy nhân gen PCR
4.2.2 Máy realtime PCR
4.2.3 Máy tách chiết ARN/ADN
4.2.4 Máy lắc trộn Vortex
4.2.5 Máy đọc sản phẩm PCR
4.2.6 Bộ điện di, gồm bộ nguồn và bể chạy điện di
4.2.7 Khay đựng đá lạnh
4.2.8 Bộ khuôn và lược đổ thạch
4.3 Thiết bị, dụng cụ dùng cho kiểm tra bệnh tích vi thể bằng phương pháp nhuộm HE
4.3.1 Khuôn nhựa, loại chuyên dụng cho làm tiêu bản vi thể
4.3.2 Máy xử lý mẫu mô tự động
4.3.3 Nồi đun parafin, có thể duy trì nhiệt độ từ 56 °C đến 65 °C
4.3.4 Khay sắt, loại chuyên dụng cho làm tiêu bản vi thể
4.3.5 Máy làm lạnh tiêu bản, có thể duy trì nhiệt độ từ âm 10 °C đến 4 °C
4.3.6 Máy cắt tiêu bản, cắt ở độ mỏng từ 3 μm đến 5 μm.
4.3.7 Nồi dãn tiêu bản, có thể duy trì nhiệt độ từ 35 °C đến 65 °C
4.3.8 Kính hiển vi quang học, vật kính 10 X, 20X, 40 X và 100 X
4.3.9 Lamen, vô trùng
4.3.10 Lam kính, vô trùng
4.3.11 Keo dán (Bom Canada)
4.3.12 Bút ghi kính (ghi ký hiệu mẫu)
4.3.13 Máy sấy mẫu sau cắt.
5 Chẩn đoán lâm sàng
5.1 Đặc điểm dịch tễ
Taura syndrome virus (TSV) là tác nhân gây Hội chứng Taura (Taura syndrome-TS) được phát hiện ở Ecuador, các nước Châu Mỹ, Đông Nam Á và Trung Đông gây nhiều thiệt hại cho người nuôi tôm. Các loài đáp ứng các tiêu chí mẫn cảm nhất với TSV là: greasyback shrimp (Metapenaeus ensis), northern brown shrimp (Penaeus aztecus), giant tiger prawn (P. monodon), northern white shrimp (P. setiferus), blue shrimp (P. stylirostris) và whiteleg shrimp (P. vannamei).
Hội chứng Taura đặc biệt gây hại cho hậu ấu trùng P. vannamei ở giai đoạn nuôi từ 14-40 ngày tuổi, cỡ 0,05 g đến < 5 g, TSV cũng có thể lây nhiễm trên tôm thương phẩm.
Tôm bị nhiễm TSV có thời gian ủ bệnh lâu, lan truyền rất nhanh, có thể gây chết từ 40- 95% ở tôm nuôi.
Tôm dễ bị nhiễm TSV hơn khi độ mặn môi trường nước dưới 30 ppt.
TSV có thể lây truyền theo 2 chiều: Theo chiều ngang khi tôm khỏe ăn tôm bệnh, chết hoặc lây truyền trong môi trường nước có chứa chất thải từ tôm bệnh và những con chim ăn tôm chết đã trở thành nguồn lây bệnh từ nơi này tới nơi khác. Theo chiều dọc từ tôm bố mẹ mang mầm bệnh sang tôm giống. Đặc biệt sự lây nhiễm theo chiều dọc rất phổ biến khi những con tôm bị bệnh ở thời kỳ mãn tính, sau vài lần lột xác, những dấu hiệu của TSV biến mất, nhưng trong cơ thể vẫn mang mầm bệnh và sinh sản.
5.2 Triệu chứng và bệnh tích
Tôm nhiễm TSV có ba giai đoạn riêng biệt: cấp tính, chuyển tiếp (phục hồi) và mãn tính:
Giai đoạn cấp tính: các dấu hiệu của tôm thẻ chân trắng P. vannamei bị nhiễm TSV ở giai đoạn cấp tính tôm có màu hơi đỏ nhạt, quạt đuôi và chân bơi có màu đỏ rõ rệt nên bệnh còn có tên gọi là bệnh “đuôi đỏ”. Ngoài ra còn tôm nhiễm TSV cấp tính còn có dấu hiệu khác như vỏ mềm, ruột rỗng và thường chết ở giai đoạn cuối của chu kỳ lột xác. Ở giai đoạn bị bệnh cấp tính tôm P. vannamei có tỷ lệ chết cao từ 40% đến 90%, ngoài ra nhiều chủng tôm P. stylirostris có tính đề kháng với TSV. Tôm sống sót qua giai đoạn cấp tính sẽ chuyển qua một giai đoạn chuyển tiếp rồi chuyển sang giai đoạn mãn tính và có thể sống sót.
Giai đoạn chuyển tiếp (phục hồi): Là giai đoạn xuất hiện trong vài ngày khi bùng phát nhiễm vi rút TSV. Trong giai đoạn chuyển tiếp này, có thể xảy ra nhiều tôm trong ao vẫn trong giai đoạn cấp tính và tỷ lệ chết ngày càng cao, tôm ở các ao bị nhiễm TSV xuất hiện nhiều đốm melanin hình dạng bất thường trên vỏ. Đốm melanin này là kết quả của quá trình tích lũy các tế bào máu để làm lành tổn thương biểu mô do TSV. Những còn tôm này có thể mềm hoặc không mềm vỏ, có thể đỏ hoặc không đỏ, có thể hoạt động và ăn bình thường.
Giai đoạn mãn tính: sau khi lột xác thành công, tôm ở giai đoạn chuyển tiếp chuyển sang giai đoạn nhiễm TSV mãn tính, trong đó tôm nhiễm bệnh không có dấu hiệu bệnh rõ ràng, có thể có nhiều đốm đen như bị bệnh do vi khuẩn trên vỏ. Tôm sống sót có thể sẽ chết trong lần lột xác tiếp theo hoặc sẽ vượt qua nhờ miễn dịch tự nhiên, Tôm có thể hoặc không bị mềm vỏ đỏ thân, hoạt động và ăn bình thường, sau khi lột xác các chấm melanin sẽ biến mất. Tôm thẻ chân trắng bị nhiễm TSV mãn tính có thể kém chống chịu với các thay đổi môi trường (ví dụ: giảm độ mặn đột ngột) so với tôm không bị nhiễm bệnh.
6 Chẩn đoán trong phòng thí nghiệm
6.1 Phương pháp sinh học phân tử
6.1.1 Lấy mẫu
Số lượng tôm trên mỗi mẫu phụ thuộc vào kích cỡ của tôm:
- Tôm giống, ấu trùng và hậu ấu trùng: Lấy nguyên con, từ 100 mg đến 500mg/ mẫu
- Tôm thương phẩm: Lấy nguyên con, từ 5 con/mẫu đến 10 con/mẫu hoặc lấy mang, máu, biểu mô dưới vỏ kitin, chân bơi của 5 con/mẫu đến 10 con/mẫu
- Tôm bố mẹ: Lấy nguyên con, 1 con/mẫu hoặc lấy mang, chân bơi của 1 con/mẫu
Thu mẫu tôm có dấu hiệu bệnh lý, còn sống hoặc mới chết. Mẫu bệnh phẩm phải được lấy vô trùng và để riêng biệt trong lọ dụng cụ chứa mẫu (4.1.9).
6.1.2 Bảo quản mẫu
Bảo quản vận chuyển: Bảo quản mẫu ở nhiệt độ từ 2 °C đến 8 °C không quá 48 h từ khi lấy mẫu đến khi vận chuyển về phòng thí nghiệm hoặc bảo quản trong ethanol 70 % đến ethanol tuyệt đối với tỷ lệ 1:10 (1 phần mẫu:9 phần ethanol).
Bảo quản tại phòng thí nghiệm: Mẫu được được bảo quản ở nhiệt độ từ 2 °C đến 8 °C chuyển đến phòng thí nghiệm chưa phân tích ngay phải được bảo quản ở nhiệt độ âm 20 °C đến âm 80 °C hoặc được bảo quản trong dung dịch (PBS) (3.1.2) theo tỷ lệ 1:10 (1 phần mẫu: 9 phần PBS) ở nhiệt độ âm 20 °C đến âm 80 °C hoặc bảo quản trong ethanol từ 70 % đến ethanol tuyệt đối.
6.1.3 Chuẩn bị mẫu
Dùng panh, kéo (4.1.10) vô trùng để thực hiện các thao tác: tách, cắt lấy mẫu (mang, máu, biểu mô dưới vỏ kitin, chân bơi). Mẫu được chia thành hai phần: một phần cho thực hiện xét nghiệm và một phần lưu trữ.
Lượng mẫu lấy để tách chiết ARN khoảng 30 mg.
Cho 30 mg mẫu vào dung dịch PBS (3.1.2) với tỷ lệ 1:10 (1 thể tích mẫu: 9 thể tích PBS), đồng nhất mẫu bằng máy nghiền mẫu (4.1.7) hoặc bằng cối, chày nghiền mẫu để tạo thành huyễn dịch 10 %. Chuyển huyễn dịch vào 2 ống vô trùng đóng nắp, một ống mẫu để xét nghiệm và một ống lưu mẫu.
CHÚ Ý: Với mẫu đã bảo quản ở nhiệt độ âm 20 °C đến âm 80 °C cần rã đông ngoài nhiệt độ phòng trước khi thực hiện đồng nhất mẫu.
6.1.4 Tách chiết ARN
Sử dụng bộ kít tách chiết (3.2.5) thích hợp và an toàn theo hướng dẫn của nhà sản xuất.
VÍ DỤ: Sử dụng kít tách chiết ARN: InviMAG®Virus DNA/RNA Mini Kit/ KF96, Cat. No: 7441050100 (xem phụ lục B1) hoặc sử dụng kít tách chiết TACO RNA/DNA extraction Kit (GeneReach Cat. No. atc-d/rna, 320 tests (xem phụ lục B2) hoặc PureLinK Viral RNA/DNA mini kit (50) (Cat. No: 12280-050)xem phụ lục B3) 1).
6.1.5 Phương pháp RT - PCR
6.1.5.1 Chuẩn bị mồi
Phương pháp RT - PCR sử dụng cặp mồi đặc hiệu 9992F/9195R hoặc 7171F/7511R (3.2.2) để phát hiện vi rút gây hội chứng Taura ở tôm
Trình tự cặp mồi (xem phụ lục C, Bảng C1).
Mồi được chuẩn bị như sau:
- Mồi ở trạng thái đông khô phải được ly tâm nhanh bang máy ly tâm (4.1.6) trong 30 s để mồi lắng xuống đáy ống trước khi mở và hoàn nguyên. Dùng dung dịch đệm TE (3.2.12) để hoàn nguyên mồi ở nồng độ 100 μM làm gốc.
- Mồi được sử dụng ở nồng độ 20 μM: Pha loãng mồi gốc bằng nước tinh khiết không có nuclease (3.2.6) (20 μl mồi gốc và 80 μl nước tinh khiết không có nuclease).
6.1.5.2 Tiến hành phản ứng RT - PCR
Phản ứng khuếch đại được thực hiện trong máy nhân gen (4.2.1) theo phương pháp RT - PCR khuếch đại đoạn gen đặc hiệu của vi rút gây hội chứng Taura ở tôm sử dụng cặp mồi 9992F/ 9195R hoặc 7171F/7511R (3.2.2) (xem phụ lục C)
6.1.5.3 Điện di
6.1.5.3.1 Chuẩn bị bản thạch
Pha thạch với nồng độ agarose (3.2.7) từ 1,5 % đến 2 % bằng dung dịch đệm TBE 1X hoặc TAE 1X (3.2.8) vào chai thủy tinh 250 ml, lắc đều rồi đun sôi;
Khi nhiệt độ giảm xuống khoảng 40 °C đến 50 °C thì bổ sung 10 μl chất nhuộm màu (3.2.9) vào mỗi 100 ml thạch. Lắc nhẹ tránh tạo bọt để chất nhuộm màu tan đều.
Tiến hành đổ thạch vào khay điện di đã được cài lược; không nên đổ bản thạch dày quá 0,8 cm.
Khi bản thạch đông lại thì tiến hành gỡ lược khỏi bản thạch.
Chuyển bản thạch vào bể điện di (4.2.6), đổ dung dịch đệm (TBE 1X hoặc TAE 1X) (3.2.8) cùng loại với dung dịch pha agarose đã đun vào bể điện di cho tới khi ngập bản thạch.
CHÚ THÍCH: Có thể dùng các sản phẩm có sẵn chất nhuộm ADN để pha chế thạch agarose (VÍ DỤ: Sybr safe DNA gel stain và sử dụng theo quy định của nhà sản xuất)2).
6.1.5.3.2 Chạy điện di
Hút 2 μl chất đệm tải mẫu (Loading dye 6X) (3.2.10) vào 8 μl sản phẩm PCR trộn đều và cho vào các giếng trên bản thạch. Thực hiện điện di trong bộ điện di, chạy kèm theo thang chuẩn ADN (3.2.11) để so sánh kích thước sản phẩm khuếch đại. Hút 10 μl thang chuẩn ADN (3.2.11) vào một giếng trên bản thạch.
Điện di ở hiệu điện thế 100 V trong thời gian 30 min.
6.1.5.4 Đọc kết quả
Sau khi điện di, đọc kết quả trên máy đọc sản phẩm PCR (4.2.5).
Điều kiện của phản ứng được công nhận khi:
- Đối chứng âm không có vạch sáng (không có sản phẩm khuếch đại);
- Đối chứng dương có vạch sáng kích thước 231 bp với cặp mồi 9992F/9995R hoặc 341 bp với cặp mồi 7171F/7511R.
- Thang chuẩn ADN sáng và chia vạch rõ ràng
Với điều kiện phản ứng trên
Mẫu xét nghiệm âm tính khi:
- Tại giếng của mẫu thử không xuất hiện vạch sáng (không có sản phẩm khuếch đại);
Mẫu xét nghiệm dương tính khi:
- Tại giếng của mẫu thử xuất hiện vạch sáng kích thước 231 bp với cặp mồi 9992F/9995R hoặc 341 bp với cặp mồi 7171F/7511R.
6.1.6 Phương pháp realtime RT - PCR
6.1.6.1 Chuẩn bị mồi
Phương pháp realtime RT - PCR sử dụng cặp mồi TSV1004F / TSV1075R và TSV-P1 (3.2.1) để phát hiện vi rút gây hội chứng Taura ở tôm. Trình tự cặp mồi (xem phụ lục D, Bảng D.1).
Mồi ở trạng thái đông khô phải được ly tâm nhanh bằng máy ly tâm (4.1.6) trong 30 s để mồi lắng xuống đáy ống trước khi mở và hoàn nguyên. Dùng dung dịch đệm TE (3.2.12) để hoàn nguyên mồi ở nồng độ 100 μM làm gốc.
Mồi được sử dụng ở nồng độ 15 μM: Pha loãng mồi gốc bằng nước tinh khiết không có nuclease (3.2.6) (15 μl mồi gốc và 85 μl nước tinh khiết không có nuclease).
Đoạn dò TSV-P1 sử dụng nồng độ 5 μM: Pha loãng đoạn dò bằng nước tinh khiết không có nuclease (3.2.6) (5 μl mồi gốc và 95 μl nước tinh khiết không có nuclease).
6.1.6.2 Thực hiện phản ứng realtime RT - PCR
Phản ứng khuếch đại được thực hiện trong máy realtime PCR (4.2.2) theo phương pháp realtime RT-PCR khuếch đại đoạn gen đặc hiệu của vi rút gây hội chứng Taura ở tôm sử dụng cặp mồi TSV1004F / TSV1075R và TSV-P1 (3.2.1) (xem phụ lục D).
6.1.6.3 Đọc kết quả
Điều kiện phản ứng được công nhận khi:
- Mẫu đối chứng âm phải cho kết quả âm tính (không có giá trị Ct);
- Mẫu đối chứng dương phải cho kết quả dương tính và có giá trị Ct so với giá trị Ct của mẫu đã được chuẩn độ trước đó có khoảng giá trị Ct dao động ± 2.
Với điều kiện phản ứng như trên:
- Mẫu có giá trị Ct < 35 được xem là dương tính;
- Mẫu không có giá trị Ct là âm tính;
- Mẫu có giá trị Ct trong khoảng 35 ≤ Ct ≤ 40 được xem là nghi ngờ.
CHÚ Ý: - Những mẫu nghi ngờ, cần được thực hiện lại xét nghiệm hoặc sử dụng phương pháp xét nghiệm tương đương khác để khẳng định kết quả;
- Phản ứng realtime RT-PCR phải bao gồm: mẫu kiểm tra, mẫu đối chứng dương và mẫu đối chứng âm;
- Mẫu và nguyên liệu cho phản ứng realtime RT-PCR cần đặt trong khay đá lạnh trong suốt quá trình chuẩn bị hỗn hợp phản ứng.
6.2 Phương pháp kiểm tra bệnh tích vi thể bằng phương pháp nhuộm HE
6.2.1 Lấy mẫu
Tôm ấu trùng, hậu ấu trùng sử dụng nguyên con. Tôm bố mẹ, tôm thương phẩm lấy nguyên con hoặc bộ phận đầu ngực có chứa khối gan tụy (< 1 cm3). Cố định mẫu trong dung dịch Davidson (3.3.6) ngay sau khi lấy mẫu với tỷ lệ mẫu và dung dịch Davidson là 1: 10.
6.2.2 Bảo quản mẫu
Mẫu cố định trong Davidson (3.3.6) chuyển đến phòng thí nghiệm trong khoảng từ 24 h đến 72 h sau khi lấy mẫu
6.2.3 Chuẩn bị mẫu
Mẫu cố định trong Davidson (3.3.6) khoảng từ 24 h đến 72 h.
Mẫu được chuyển sang ethanol 70%
Lấy bệnh phẩm đã cố định trong ethanol hoặc Davidson cắt miếng nhỏ dày khoảng 1 mm, dài khoảng 1 cm cho vào khuôn nhựa (4.3.1).
6.2.4 Cách tiến hành
Tiến hành xử lý mẫu, cắt tiêu bản và nhuộm tiêu bản tiêu bản Haematoxylin và Eosin theo hướng dẫn (xem phụ lục E).
6.2.5 Đọc kết quả
Soi kính hiển vi từ vật kính có độ phóng đại thấp đến vật kính có độ phóng đại cao. Khi tôm mắc hội chứng TSV, trên các lát cắt mô bệnh học của tầng biểu bì mang, dạ dày, mô liên kết thể hiện các vùng bị hoại tử.
Trong tế bào bị cảm nhiễm, nhân kết đặc hay phân tán, trong tế bào chất xuất hiện các thể vùi hình cầu kích thước từ 1 μm đến 20 μm, bắt màu trung gian giữa màu tím của haematoxylin và màu hồng của eosin.
Ngoài ra một dấu hiệu khác của hội chứng taura ở thời kì cấp tính là các ống tuyến an ten bị phá hủy, xuất hiện nhiều các tế bào bạch cầu có nhân, sự vắng mặt của các tế bào máu trong phần mô bị hoại tử, xuất hiện sắc tố đen trên vỏ ki tin, là sản phẩm cuối cùng của hoạt động miễn dịch của tôm khi bị bệnh.
7 Kết luận
Tôm được xác định mắc hội chứng Taura khi có những đặc điểm dịch tễ, triệu chứng lâm sàng, bệnh tích đặc trưng của bệnh và:
- Có kết quả dương tính với TSV bằng phương pháp RT - PCR hoặc
- Có kết quả dương tính với TSV bằng phương pháp realtime RT- PCR hoặc
- Phát hiện được bệnh tích vi thể đặc trưng bằng phương pháp nhuộm HE.
Phụ lục A
(Quy định)
Thành phần và chuẩn bị thuốc thử
A.1 Dung dịch đệm TAE 1X hoặc TBE 1X
A.1.1 Thành phần
| Dung dịch TAE (hoặc TBE) 10X: | 100 ml |
| Nước khử ion: | 900 ml |
Tổng: 1000 ml dung dịch TAE (TBE) 1X
A.1.2 Chuẩn bị
Lấy 100 ml dung dịch TAE (TBE) 10X hoà chung với 900 ml nước khử ion, khuấy và lắc đều.
Bảo quản ở nhiệt độ phòng.
A.2 Dung dịch muối đệm phosphat (PBS)
A.2.1 Thành phần
| Natri clorua (NaCl) | 8 g |
| Natri hydro photphat dihydrat (Na2HPO4.2H2O) | 2,9 g |
| Kali dihydro photphat (KH2PO4) | 0,2 g |
| Kali clorua (KCl) | 0,2 g |
| Nước cất | 1000 ml |
A.2.2 Chuẩn bị
Hòa tan các thành phần trên vào 1000 ml nước cất, khuấy và lắc đều.
Chỉnh pH về trung tính bằng dung dịch NaOH 1N hoặc dung dịch HCl 1N. Hấp vô trùng ở 121 °C trong 30 min.
A.3 Dung dịch Davidson
| Ethanol 95 %: | 330 ml |
| Formalin (formaldehyd 37 %): | 220 ml |
| Axit axetic đậm đặc: | 115 ml |
| Nước: | 335 ml |
A.4 Thuốc nhuộm hematoxylin (dung dịch hematoxylin - Mayer)
| Hematoxylin dạng tinh thể: | 1 g |
| Natri iodat: | 0,2 g |
| Amoni alum [NH4Al(SO4)2] hoặc kali alum [KAl(SO4)2]: 50 g Axit xitric: | 1 g |
| Cloral hydrat: | 50 g |
| Nước: | 1000 ml |
Hoà tan hematoxylin trong nước, sau đó cho natri iodat và amoni alum hoặc kali alum, hoà tan, tiếp tục cho axit xitric và chloral hydrat rồi lọc qua giấy lọc.
Bảo quản dung dịch đã pha trong chai tối màu.
A.5 Thuốc nhuộm eosin
| Eosin Y: | 1 g |
| Ethanol 70 %: | 1000 ml |
| Axit axetic: | 5 ml |
Thêm từ 2 giọt đến 3 giọt axit axetic vào ethanol 70 %. Hoà tan eosin trong ethanol, sau đó cho thêm axit axetic rồi lọc qua giấy lọc.
Bảo quản dung dịch đã pha trong chai tối màu.
Phụ lục B
(Tham khảo)
Quy trình tách chiết ARN
CẢNH BÁO: Việc tách chiết ADN có sử dụng hóa chất nguy hiểm và có khả năng gây hại nếu thao tác không cẩn thận. Do vậy, nên tránh tiếp xúc trực tiếp với da và hít phải hơi của các hóa chất này. Luôn luôn đeo găng tay, khẩu trang, mặc quần áo bảo hộ khi thực hiện các thao tác này.
B1. Tách chiết ARN bằng bộ kít InviMAG®Virus DNA/RNA Mini Kit/ KF96
B1.1. Chuẩn bị hóa chất
Các hóa chất cần được chuẩn bị và bảo quản theo đúng hướng dẫn của bộ kít InviMAG®Virus DNA/RNA Mini Kit/ KF96, Cat. No: 7441050100, với thể tích vừa đủ cho số lượng mẫu chiết tách, bao gồm:
(1) Dung dịch đệm Lysis Buffer RV
(2) Dung dịch rửa 1 (Wash 1)
(3) Dung dịch rửa 2 (Wash 2)
(4) Hỗn hợp hạt từ tính (Bead Mix)
(5) Dung dịch thu hồi DNA/RNA Elution Buffer (EB)
Nếu chiết tách RNA bằng máy chiết tách tự động Thermo Scientific™ KingFisher™ Flex, cần phải chuẩn bị trước các đĩa chứa dung dịch chiết tách theo hệ thống của máy như sau:
+ Đĩa Washing 1: 800μl dung dịch Wash 1/giếng;
+ Đĩa Washing Wash 2 và Washing Wash 3: 800μl dung dịch Wash 2/giếng;
+ Đĩa Elution Buffer: 100 μl dung dịch EB/giếng.
B1.2. Tiến hành
- Huyễn dịch 10% của mẫu bệnh phẩm được rã đông, trộn đều bằng máy vortex. Ly tâm mẫu trong máy ly tâm lạnh với lực ly tâm 2500 vòng/15 min.
- Hút 200μl dịch trong bên trên sau khi ly tâm vào ống eppendorf 1,5ml vô trùng có chứa sẵn 200 μl dung dịch đệm Lysis. Trộn đều mẫu bằng máy vortex và spin để kéo các phần bám trên nắp ống xuống.
- Chuyển toàn bộ dung dịch trong ống eppendorf vào đĩa chứa mẫu 96 giếng (mỗi giếng tương ứng với một mẫu chiết tách). Dùng giấy dán đĩa chuyên dụng dán kín mặt đĩa.
- Đặt đĩa lên máy lắc, ủ nhiệt (HLC-MHR23). Lắc đĩa 15 min, nhiệt độ 65°C.
- Lấy đĩa ra khỏi máy lắc, để nguội trong 5 min, tháo bỏ giấy dán đĩa. Bổ sung 420 μl dung dịch Bead Mix (gồm có 400 μl Binding solution và 20 μl MAP) vào mỗi giếng.
- Chuyển tất cả các đĩa bao gồm: đĩa Tip Combs, đĩa Elution Buffer, đĩa Washing Wash 3, đĩa Washing Wash 2, đĩa Washing Wash 1 và đĩa chứa mẫu vào từng khay của máy chiết tách tự động theo hướng dẫn của máy.
- Chọn chương trình chiết tách RNA đã được cài đặt trước đó theo hướng dẫn của hãng sản xuất kít InviMAG®Virus DNA/RNA Mini Kit/ KF96.
- Sau 34 min, quá trình chiết tách hoàn tất. Thu hồi RNA của từng giếng vào ống eppendorf 0.5 ml tương ứng đã ghi rõ ký hiệu mẫu.
- Bảo quản mẫu RNA ở 4°C trong vài giờ và âm 20 °C đến âm 80 °C trong thời gian lâu hơn.
B.2. Tách chiết ARN bằng TACO RNA/DNA extraction Kít
B.2.1 Vật liệu: Bộ kít chiết tách TACO RNA/DNA extraction Kít (GeneReach Cat. No. atc-d/rna, 320 tests)
Ethanol tuyệt đối
B.2.2 Chuẩn bị:
- Pha dung dịch đệm rửa A (washing buffer A) với 135 ml ethanol tuyệt đối
- Pha dung dịch đệm rửa B (washing buffer B) với 230 ml ethanol tuyệt đối
- Tiến hành theo sơ đồ
| Thuốc Thử | Lượng (μl) | Thuốc thử | Lượng (μl) |
| H | G | F | E | D | C | B | A |
| Ethanol tuyệt đối | 250 | - | - | ►1 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa A | 750 | Hạt từ | 50 | ►2 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa A | 750 | - | - | ►3 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa B | 750 | - | - | ►4 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa B | 750 | - | - | ►5 |
|
|
|
|
|
|
|
|
| Nước đệm | 100 | - | - | ►6 |
|
|
|
|
|
|
|
|
| Ethanol tuyệt đối | 250 | - | - | ►7 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa A | 750 | Hạt từ | 50 | ►8 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa A | 750 | - | - | ►9 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa B | 750 | - | - | ►10 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa B | 750 | - | - | ►11 |
|
|
|
|
|
|
|
|
| Nước đệm | 100 | - | - | ►12 |
|
|
|
|
|
|
|
|
B.2.3 Chuẩn bị mẫu:
- Cho 250 μL/mẫu dung dịch đệm vào các ống eppendort.
- Cho 100 μL/mẫu vào ống eppendort chứa dung đệm.
- Lắc bằng máy lắc trộn vortex (4.2.4) trong 15 s.
- Ly tâm 10000 vòng trong 1 min.
- Cho 350 μL (mẫu và dung dịch đệm) vào các giếng ở cột 1 hoặc 7.
B.2.4 Đưa mẫu vào máy TACO
- Đặt đĩa vào máy TACO
- Đặt lược vào máy TACO.
- Sử dụng máy TACO theo hướng dẫn sử dụng: Máy TACO tự động chiết tách trong khoảng 50 min.
- Thu 100 μL ARN từ các giếng trong cột 6 hoặc 12 sang các ống eppendort mới.
CHÚ Ý: Mẫu đối chứng âm và mẫu đối chứng dương đều được tách chiết ARN trong cùng thời điểm với mẫu cần phát hiện vi rút gây hội chứng Taura ở tôm
B.3. Tách chiết RNA bằng bộ kít Invitrogen PureLink Viral RNA/DNA Mini Kit
B.3.1. Chuẩn bị hóa chất
Các hóa chất cần được chuẩn bị và bảo quản theo đúng hướng dẫn của bộ kít Invitrogen PureLink Viral RNA/DNA Mini Kit, Cat. No: 12280-050, với thể tích vừa đủ cho số lượng mẫu chiết tách, bao gồm:
- Proteinase K
- Dung dịch đệm Lysis Buffer
- Dung dịch Carrier RNA
- Dung dịch Wash buffer (W5)
- Nước RNase-free (E3)
- Cách pha hỗn hợp dung dịch Carrier và Lysis Buffer
N x 0.21 mL = A mL
A mL x 28 μL/mL = B μL
Trong đó: N là số mẫu cần tách chiết
A là tổng số mL Lysis Buffer cần cho N mẫu;
B là tổng số μL Carrier RNA cần cho N mẫu.
B.3.2. Tiến Hành
1. Cho 25 μL Proteinase K vào ống eppendorf 1,5 ml;
2. Cho 200 μL mẫu vào ống eppendorf chứa Proteinase K;
CHÚ Ý: nếu thể tích mẫu <200 μL thì có thể điều chỉnh thể tích mẫu cho đủ 200 μL bằng dung dịch PBS hoặc 0.9% NaCl.
3. Cho hỗn hợp dung dịch Lysis Buffer và Carrier RNA vào ống chứa mẫu; đóng nắp ống và vortex 15s;
4. Ủ mẫu ở 56 °C trong 15 min;
5. Cho thêm 250 μL ethanol từ 96 % đến ethanol tuyệt đối vào ống mẫu; đóng nắp và vortex 15s;
6. Để ở nhiệt độ phòng 5 min;
CHÚ Ý: mẫu mô sau khi để ở nhiệt độ phòng 5 min thì đem ly tâm 12.000 vòng trong 2 min và lấy dịch nổi bên trên.
7. Chuyển toàn bộ mẫu tách chiết vào cột lọc;
8. Ly tâm cột lọc ở 12.000 vòng trong từ 2 min đến 3 min; chuyển cột lọc sang ống thu mới;
9. Cho 500 μL nước rửa Wash buffer (W5) vào cột lọc; ly tâm 12.000 vòng trong từ 2 min đến 3 min; Chuyển cột lọc sang ống thu mới;
10. Lặp lại bước 9 với 500 μL nước rửa Wash buffer (W5) một lần nữa;
11. Loại bỏ ống thu và chuyển cột lọc sang ống thu mới;
12. Ly tâm khô 12000 vòng trong 1 min cho khô sạch nước rửa W5;
13. Chuyển cột lọc sang ống eppendorf 1,5 μL;
14. Cho 10 μL - 50 μL nước RNase-free (E3) (có sẵn) vào cột lọc;
15. Để ở nhiệt độ phòng 1 min; Ly tâm cột lọc ở 12000 vòng trong từ 1 min đến 2 min.
16. Lấy sản phẩm dưới cột lọc; Bảo quản mẫu RNA ở 4 °C trong vài giờ và âm 20 °C đến âm 80 °C trong thời gian lâu hơn.
Phụ lục C
(Quy định)
Phương pháp RT - PCR phát hiện vi rút gây hội chứng Taura ở tôm
C.1 Trình tự cặp mồi
Bảng C.1 - Trình tự cặp mồi[1]
| Cặp mồi | Trình tự mồi từ đầu 5’ tới 3’ | Sản phẩm (bp) |
| 9992F | 5’-AAG-TAG-ACA-GCC-GCG-CTT-3’ | 231 |
| 9195R | 5’-TCA-ATG-AGA-GCT-TGG-TCC-3’ | |
| 7171F | 5’-CGA-CAG-TTG-GAC-ATC-TAG-TG-3’ | 341 |
| 7511R | 5’-GAG-CTT-CAG-ACT-GCA-ACT-TC-3’ |
C.2 Thực hiện phản ứng RT - PCR
Kỹ thuật RT - PCR bao gồm:
Chuẩn bị dung dịch cho phản ứng sử dụng cặp mồi 9992F/ 9195R hoặc 7171F/7511R đã được chuẩn bị (3.2.2) và kít nhân gen (3.2.3) theo hướng dẫn của nhà sản xuất.
VÍ DỤ: Chuẩn bị MasterMix cho phản ứng RT - PCR theo kít Superscript® III One-Step RT-PCR with Platinum® Taq. Cat: 12574-026 hoặc kít tương đương; và hướng dẫn của nhả sản xuất (3.2.3)3)
Thành phần cho 1 phản ứng (xem bảng C.2).
Bảng C.2 - Thành phần phản ứng RT - PCR với cặp mồi 9992F/ 9195R
| Thành phần | Nồng độ (μM) | Thể tích cho 1 phản ứng (μl) |
| Nước không có ARN/DNA |
| 6 |
| Dung dịch 2x Reaction Mix |
| 12,5 |
| Mồi 9992F | 20 | 0,5 |
| Mồi 9195R | 20 | 0,5 |
| Enzym |
| 0,5 |
| Tổng thể tích dung dịch đệm thực hiện phản ứng | 20 | |
Bảng C.3 - Thành phần phản ứng RT - PCR với cặp mồi 7171F/7511R
| Thành phần | Nồng độ (μM) | Thể tích cho 1 phản ứng (μl) |
| Nước không có ARN/DNA |
| 6 |
| Dung dịch 2x Reaction Mix |
| 12,5 |
| Mồi 7171F | 20 | 0,5 |
| Mồi 7511R | 20 | 0,5 |
| Enzyme |
| 0,5 |
| Tổng thể tích dung dịch đệm thực hiện phản ứng | 20 | |
Chuyển 20 μl hỗn hợp nhân gen vào mỗi ống phản ứng:
Mẫu đối chứng dương: Cho 5 μl mẫu ARN đã được giám định hoặc sử dụng các chủng chuẩn.
Mẫu đối chứng âm: Cho 5 μl nước tinh khiết không có nuclease.
Mẫu thử: Cho 5 μl mẫu kiểm tra vào ống phản ứng.
Tiến hành phản ứng RT - PCR bằng máy nhân gen (4.2.1) đã cài đặt chu trình nhiệt (xem Bảng C.4).
Bảng C.4 - Chu trình nhiệt của phản ứng RT - PCR
| Nhiệt độ (°C) | Thời gian | Số chu kỳ (vòng) |
| 50 | 25 min | 1 |
| 94 | 2 min | 1 |
| 94 | 15 s | 35 |
| 55 | 30 s | |
| 68 | 60 s | |
| 68 | 5 min | 1 |
CHÚ Ý:
+ Phản ứng RT - PCR phải bao gồm: mẫu kiểm tra, mẫu kiểm chứng dương (mẫu chiết tách và mẫu chạy nhân gen) và mẫu kiểm chứng âm (mẫu chiết tách và mẫu chạy nhân gen);
+ Mẫu và nguyên liệu cho phản ứng RT - PCR cần đặt trong khay đá lạnh trong suốt quá trình chuẩn bị hỗn hợp phản ứng;
+ Tùy theo kít sử dụng mà thành phần hỗn hợp phản ứng có thể khác nhau, việc thực hiện chuẩn bị hỗn hợp phản ứng nên tuân thủ theo hướng dẫn của kít được sử dụng.
Phụ lục D
(Quy định)
Phương pháp realtime RT - PCR phát hiện vi rút gây hội chứng Taura ở tôm
D.1 Trình tự cặp mồi và đoạn dò
Bảng D.1 - Trình tự cặp mồi và đoạn dò[1]
| Cặp mồi và đoạn dò | Trình tự mồi từ đầu 5’ tới 3’ |
| TSV1004F | 5’-TTG GGC ACC AAA CGA CAT T-3’ |
| TSV1075R | 5’-GGG AGC TTA AAC TGG ACA CAC TGT- 3’ |
| TSV-P1 | 5’-6FAM CAG CAC TGA CGC ACA ATA TTC GAG CAT C BHQ1-3’ |
D.2 Thực hiện phản ứng realtime RT- PCR
Phương pháp realtime RT - PCR khuếch đại đoạn gen đặc hiệu của TSV, sử dụng cặp mồi đã được chuẩn bị (3.2.1) và kít nhân gen (3.2.4) theo hướng dẫn của nhà sản xuất.
VÍ DỤ: theo kít Superscript III Platinum® one step qRT-PCR System, Cat.No: 11732-0204)
Thành phần cho 1 phản ứng (xem Bảng D.2).
Bảng D. 2 - Thành phần phản ứng realtime RT- PCR
| Thành phần | Nồng độ gốc (μM) | Thể tích phản ứng (μl) |
| Nước không có ARN/DNA |
| 5,5 |
| Dung dịch 2X reaction mix |
| 12,5 |
| Mồi TSV1004F | 15 | 0,5 |
| Mồi TSV1075R | 15 | 0,5 |
| Đoạn dò TSV-P | 5 | 0,5 |
| Enzyme Taq Mix |
| 0,5 |
| Tổng thể tích | 20 | |
Chuyển 20 μl hỗn hợp nhân gen vào mỗi ống phản ứng:
- Mẫu đối chứng dương: Cho 5 μl mẫu ARN được tách chiết từ mẫu dương tính chuẩn với TSV;
- Mẫu đối chứng âm: Cho 5 μl nước tinh khiết không có nuclease;
- Mẫu thử: Cho 5 μl mẫu ARN kiểm tra vào ống phản ứng.
Tiến hành phản ứng realtime RT- PCR bằng máy realtime PCR (4.2.2) đã cài đặt chu trình nhiệt (xem Bảng D.3).
Bảng D. 3 - Chu trình nhiệt của phản ứng realtime RT- PCR
| Nhiệt độ (°C) | Thời gian | Số chu kỳ (vòng) |
| 50 | 15 min | 1 |
| 95 | 2 min | 1 |
| 95 | 15 s | 40 |
| 60 (*) | 30 s |
CHÚ THÍCH BẢNG: (*) Nhiệt độ và thời gian này phù hợp với máy realtime PCR ABI 7500 và bộ kít ở trên
CHÚ Ý:
+ Phản ứng Realtime RT - PCR phải bao gồm: mẫu kiểm tra, mẫu kiểm chứng dương (mẫu chiết tách và mẫu chạy nhân gen) và mẫu kiểm chứng âm (mẫu chiết tách và mẫu chạy nhân gen);
+ Mẫu và nguyên liệu cho phản ứng Realtime RT - PCR cần đặt trong khay đá lạnh trong suốt quá trình chuẩn bị hỗn hợp phản ứng;
+ Tùy theo kít sử dụng mà thành phần hỗn hợp phản ứng có thể khác nhau, việc thực hiện chuẩn bị hỗn hợp phản ứng nên tuân thủ theo hướng dẫn của kít được sử dụng.
Phụ lục E
(Quy định)
Phương pháp kiểm tra bệnh tích vi thể bằng phương pháp nhuộm HE
E.1 Xử lý mẫu
Chuyển khuôn chứa mẫu sang ngâm ethanol 70 % (thể tích) (3.1.1) trong thời gian từ 30 min đến 60 min;
Ngâm sang ethanol 90 % (3.1.1) trong thời gian từ 30 min đến 60 min;
Ngâm sang ethanol tuyệt đối (3.1.1) lần thứ nhất trong thời gian từ 30 min đến 60 min;
Ngâm sang ethanol tuyệt đối (3.1.1) lần thứ hai trong thời gian từ 30 min đến 60 min;
Ngâm sang xylen (3.3.2) lần thứ nhất trong thời gian từ 30 min đến 60 min;
Ngâm sang xylen (3.3.2) lần thứ hai trong thời gian từ 30 min đến 90 min;
Ngâm tẩm parafin (3.3.5) lần thứ nhất trong thời gian từ 30 min đến 90 min;
Ngâm tẩm parafin (3.3.5) lần thứ hai, thời gian 120 min;
CHÚ THÍCH: Tất cả các thao tác trên có thể được thực hiện trong máy xử lý mẫu mô tự động (4.2.2).
Đúc khuôn:
Sau đó, đưa mẫu vào khung đúc parafin: rót parafin nóng chảy từ nồi đun parafin (4.3.3) vào khay sắt (4.3.4) chuyên dụng;
Gắp bệnh phẩm vào rồi đặt khuôn nhựa (4.3.1) lên trên;
Để nguội, tách lấy khối parafin.
E.2 Cắt tiêu bản
Cắt gọt khối parafin cho bằng phẳng, đặt trên mặt máy làm lạnh (4.3.5);
Đặt khối parafin lên máy cắt tiêu bản (4.3.6) sao cho mặt khối parafin song song với mép lưỡi dao, cắt bỏ những lát đầu đến khi lát cắt có đủ các tổ chức;
Cắt lấy tiêu bản, độ dày lát cắt từ 3 μm đến 5 μm;
Chọn lát cắt tiêu bản phẳng và lấy được hết các mô cần lấy, thả vào nồi dãn tiêu bản (4.3.7) có nhiệt độ nước từ 35 °C đến 40 °C;
Dùng lam kính (4.3.10) vớt dán lát cắt, chuyển sang máy sấy mẫu (4.3.13) có nhiệt độ 40 °C trong 2 h đến 3 h.
E.3 Nhuộm tiêu bản Haematoxylin và Eosin
Tẩy parafin trong xylen (3.3.2) 2 lần (2 cốc), mỗi lần để từ 3 min đến 5 min;
Ngâm trong ethanol tuyệt đối (3.1.1) 2 lần (2 cốc), mỗi lần để từ 3 min đến 5 min;
Ngâm trong ethanol 90 % (3.1.1) để từ 3 min đến 5 min;
Ngâm trong ethanol 70 % (3.1.1) để từ 3 min đến 5 min;
Rửa dưới vòi nước chảy từ 3 min đến 5 min;
Ngâm trong thuốc nhuộm haematoxylin (3.3.3) từ 3 min đến 5 min;
Rửa dưới vòi nước chảy từ 3 min đến 5 min;
Ngâm trong thuốc nhuộm từ Eosin (3.3.4) từ 3 min đến 5 min;
Loại bỏ nước còn bám trên phiến kính bằng cách:
Nhúng qua ethanol 70 % (3.1.1) để từ 2 min đến 3 min; sau đó nhúng qua ethanol tuyệt đối (3.1.1) 3 lần (3 cốc), mỗi lần để từ 2 min đến 3 min; chuyển sang ngâm trong xylen (3.3.2) 2 lần (2 cốc), mỗi lần từ 2 min đến 3 min; Lau sạch xung quanh và gắn lamen (4.3.9) bằng keo dán (4.3.11).
Để khô tự nhiên và soi dưới kính hiển vi quang học (4.3.8).
Phụ lục F
(Quy định)
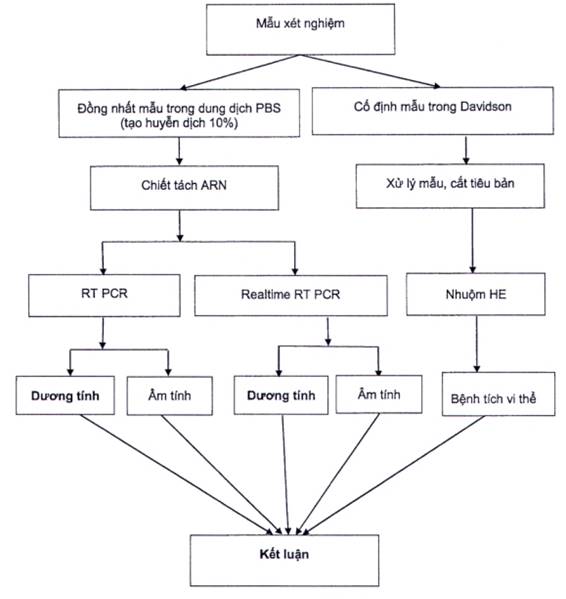
Sơ đồ xét nghiệm vi rút gây hội chứng Taura
Thư mục tài liệu tham khảo
[1] OIE/WOAH, Manual of Diagnostic Tests for Aquatic Animals, 2021, Chapter 2.2.7 Infection with Taura syndrome virus;
[2] Tang K. F. J., Wang J. and Lightner D. V., 2004. Quantitation of Taura syndrome virus by realtime RT-PCR with a TaqMan assay. J. Virol. Methods 115: 109-114;
[3] FAO/NACA. 2001. Asia Diagnostic Guide to Aquatic Animal Diseases. FAO Fish. Pap. No.402/2;
[4] TCVN 8710-5:2011 Bệnh thủy sản - Quy trình chẩn đoán bệnh Taura ở tôm He;
[5] TCVN 8376:2010 Tôm và sản phẩm tôm - Phát hiện virut gây hội chứng taura (TSV) bằng kỹ thuật phản ứng chuỗi trùng hợp-phiên mã ngược (RT-PCR);
1) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
2) Thông tin này đưa ra tạo đều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
3) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
4) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 8710-5:2023 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 8710-5:2023 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 8710-5:2023 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 8710-5:2023 DOC (Bản Word)