- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Việt Nam TCVN 4830-3:2005 Định lượng staphylococci có phản ứng dương tính với coagulase trên đĩa thạch
| Số hiệu: | TCVN 4830-3:2005 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Đang cập nhật | Lĩnh vực: | Khoa học-Công nghệ , Thực phẩm-Dược phẩm |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
2005 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 4830-3:2005
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 4830-3:2005
TIÊU CHUẨN VIỆT NAM
TCVN 4830-3: 2005
ISO 6888-3 : 2003
VI SINH VẬT TRONG THỰC PHẨM VÀ THỨC ĂN CHĂN NUÔI - PHƯƠNG PHÁP ĐỊNH LƯỢNG STAPHYLOCOCCI CÓ PHẢN ỨNG DƯƠNG TÍNH VỚI COAGULASE (STAPHYLOCOCCUS AUREUS VÀ CÁC LOÀI KHÁC; TRÊN ĐĨA THẠCH - PHẦN 3: PHÁT HIỆN VÀ DÙNG KỸ THUẬT ĐẾM SỐ CÓ XÁC SUẤT LỚN NHẤT (MPN) ĐỂ ĐẾM SỐ LƯỢNG NHỎ
Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of coagulase-positive staphylococci (Staphylococcus aureus and other species) - Part 3: Detection and MPN technique for low numbers
Lời giới thiệu
Do tính đa dạng của thực phẩm và thức ăn chăn nuôi nên phương pháp này có thể không thích hợp đến từng chi tiết cho từng sản phẩm cụ thể. Trong trường hợp này, có thể sử dụng các phương pháp khác đặc trưng cho từng sản phẩm, nếu hoàn toàn chỉ vì lý do kỹ thuật. Tuy nhiên, cần cố gắng áp dụng phương pháp này khi có thể.
Khi tiêu chuẩn này được soát xét tiếp thì cần phải tính đến mọi thông tin liên quan đến phạm vi mà phương pháp đếm đĩa này phải tuân theo và các nguyên nhân gây sai lệch so với phương pháp trong trường hợp các sản phẩm cụ thể.
Việc hài hoà các phương pháp thử có thể không thực hiện được ngay và đối với một vài nhóm sản phẩm có thể tồn tại các tiêu chuẩn quốc tế và/hoặc tiêu chuẩn quốc gia mà không phù hợp với tiêu chuẩn này. Trong trường hợp có sẵn tiêu chuẩn quốc tế cho sản phẩm cần thử nghiệm thì phải tuân theo tiêu chuẩn đó. Hy vọng rằng khi các tiêu chuẩn như thế được soát xét, thì chúng phải được sửa đổi để phù hợp với tiêu chuẩn này, sao cho cuối cùng chỉ còn các sai lệch với phương pháp đếm đĩa này là các lý do kỹ thuật được thừa nhận.
VI SINH VẬT TRONG THỰC PHẨM VÀ THỨC ĂN CHĂN NUÔI - PHƯƠNG PHÁP ĐỊNH LƯỢNG STAPHYLOCOCCI CÓ PHẢN ỨNG DƯƠNG TÍNH VỚI COAGULASE (STAPHYLOCOCCUS AUREUS VÀ CÁC LOÀI KHÁC; TRÊN ĐĨA THẠCH - PHẦN 3: PHÁT HIỆN VÀ DÙNG KỸ THUẬT ĐẾM SỐ CÓ XÁC SUẤT LỚN NHẤT (MPN) ĐỂ ĐẾM SỐ LƯỢNG NHỎ
Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of coagulase-positive staphylococci (Staphylococcus aureus and other species) - Part 3: Detection and MPN technique for low numbers
1 Phạm vi áp dụng
Tiêu chuẩn này qui định phương pháp phát hiện và định lượng staphylococci có phản ứng dương tính với coagulase trên đĩa thạch bằng kỹ thuật đếm số có xác suất lớn nhất (MPN). Tiêu chuẩn này có thể áp dụng cho:
- Các sản phẩm dùng cho con người và thức ăn chăn nuôi, và
- Các mẫu môi trường trong khu vực sản xuất và xử lý thực phẩm.
Tiêu chuẩn này được khuyến cáo áp dụng cho các sản phẩm khi ước tính tính staphylococci có mặt trong sản phẩm với số lượng nhỏ, ví dụ như các sản phẩm khô. Staphylococci có phản ứng dương tính với coagulase ban đầu là các Stapylococcus aureus nhưng Stapylococcus intermedius và một số chủng của Stapylococcus hyicus cũng sinh ra coagulase.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau là rất cần thiết cho việc áp dụng tiêu chuẩn. Đối với các tài liệu viện dẫn ghi năm ban hành thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm ban hành thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi.
TCVN 6507 (ISO 6887) (tất cả các phần), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử, huyền phù ban đầu và các dung dịch pha loãng thập phân để kiểm tra vi sinh vật.
TCVN 6263 (ISO 8261), Sữa và các sản phẩm sữa. Chuẩn bị mẫu thử và các dung dịch pha loãng để kiểm tra vi sinh.
TCVN 4830-1 : 2005 (ISO 6888-1 : 1999, with amendment 1: 2003), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp định luợng staphylococci có phản ứng dương tính với coagulase (Staphylococuss aureus và loài khác) trên đĩa thạch. Phần 1: Kỹ thuật sử dụng môi trường thạch Baird-Parker.
TCVN 4830-2 : 2005 (ISO 6888-2 : 1999, with amendment 1 : 2003), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp định lượng staphylococci có phản ứng dương tính với coagulase (Staphylococuss aureus và loài khác) trên đĩa thạch. Phần 2: Kỹ thuật sử dụng môi trường thạch fibrinogen huyết tương thỏ.
TCVN 6404 (ISO 7218), Vi sinh vật trong thực phẩm và trong thức ăn chăn nuôi - Nguyên tắc chung để kiểm tra vi sinh vật.
ISO/TS 11133-1, Microbiology of food and animal feeding stuffs - Guidelines on preparation and production of culture media - Part 1: General guidelines on quality assurance for the preparation of culture media in the laboratory (Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Hướng dẫn chuẩn bị và tạo môi trường cấy - Phần 1. Các hướng dẫn chung về đảm bảo chất lượng cho việc chuẩn bị môi trường cấy trong phòng thử nghiệm).
ISO/TS 11133-2 ; 2003, Microbiology of food and animal feeding stuffs - Guidelines on preparation and production of culture media - Part 2: Practical guidelines on performance testing of culture media (Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Hướng dẫn chuẩn bị và tạo môi trường cấy - Phần 2: Các hướng dẫn thực hành về kiểm tra tính năng của môi trường cấy).
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng các thuật ngữ và định nghĩa sau đây:
3.1
staphylococci có phản ứng dương tính với coagulase (coagulase -positive staphylococci) vi khuẩn hình thành các khuẩn lạc điển hình và/hoặc không điển hình trên bề mặt môi trường cấy chọn lọc và cho các phản ứng dương tính với coagulase hoặc phản ứng huyết tương thỏ đặc trưng trên thạch fibrinogen huyết tương thỏ.
CHÚ THÍCH: Tiêu chuẩn này khẳng định staphylococci có phản ứng dương tính với coagulase được dựa trên phản ứng dương tính với coagulase mạnh, nhưng phải công nhận rằng một số chủng staphylococci có phản ứng dương tính với coagulase nhưng cho các phản ứng dương tính với coagulase yếu. Các chủng này có thể nhầm với các vi khuẩn khác nhưng chúng có thể được phân biệt bằng các thử nghiệm bổ sung như việc tạo ra thermonucleasa (về chi tiết, xem IDF 83).
3.2
Định lượng staphylococci có phản ứng dương tính với coagulase (enumeration of coagulase-positive staphylococci)
Việc xác định số lượng staphylococci có phản ứng dương tính với coagulase tìm thấy trong một gam hoặc một mililit mẫu khi tiến hành thử nghiệm theo phương pháp qui định trong tiêu chuẩn này.
4 Nguyên tắc
4.1 Phương pháp phát hiện
4.1.1 Cấy lên môi trường chọn lọc một lượng mẫu thử qui định, nếu sản phẩm ban đầu ở dạng lỏng, hoặc một lượng huyền phù qui định ban đầu nếu các sản phẩm ở dạng khác .
4.1.2 Ủ các ống trong môi trường kỵ khí ở 37 oC từ 24 h đến 48 h. Sự có mặt của staphylococci giả định có phản ứng dương tính với coagulase được chỉ thị bởi sự khử kali telurit.
CHÚ THÍCH: Trong tiêu chuẩn này, môi trường kỵ khí thu được bằng cách rót thạch hoặc paraffin đậy lên phía trên mỗi ống, nhưng cũng có một cách khác là ủ các ống này trong bình hoặc trong tủ ấm trong các điều kiện kỵ khí.
4.1.3 Cấy lên bề mặt môi trường Baird-Parker đặc chọn lọc các khuẩn lạc lấy từ các ống dương tính giả định (4.1.2) sau 24 h và tất cả các ống còn lại sau 48 h.
4.1.4. Tất cả các ống được cấy ở 37 oC từ 24 h đến 48 h. Sự có mặt của staphylococci giả định có phản ứng dương tính với coagulase được chỉ thị bởi sự khử kali telurit và phản ứng với lòng đỏ trứng.
4.1.5 Các khuẩn lạc điển hình và/hoặc không điển hình được khẳng định bằng phản ứng với coagulase.
4.1.6 Cách khác, có thể cấy lên bề mặt thạch fibrinogen huyết tương thỏ, sau khi ủ ấm thích hợp, sự có mặt của staphylococci có phản ứng dương tính với coagulase được chỉ thị bởi các khuẩn lạc cho thấy có phản ứng với fibrinogen huyết tương thỏ đặc trưng.
4.1.7 Kết quả là "có mặt" hay "không có mặt" staphylococci có phản ứng dương tính với coagulase trong x g hay x ml sản phẩm.
4.2 Phương pháp định lượng
4.2.1 Các dãy dung dịch pha loãng sản phẩm được cấy vào môi trường cấy lỏng chọn lọc.
4.2.2 Các ống được ủ trong điều kiện kỵ khí ở 37 oC từ 24 h đến 48 h. Sự có mặt của staphylococci có phản ứng dương tính với coagulase giả định được chỉ thị bởi sự khử kali telurit.
CHÚ THÍCH: Trong tiêu chuẩn này, môi trường kỵ khí thu được bằng cách rót thạch hoặc paraffin đậy lên phía trên mỗi ống, nhưng cũng có một cách khác là ủ các ống này trong bình hoặc trong tủ ấm trong các điều kiện kỵ khí.
4.2.3 Cấy lên bề mặt môi trường Baird-Parker đặc chọn lọc các khuẩn lạc lấy từ các ống dương tính giả định (4.2.2) sau 24 h và tất cả các ống còn lại sau 48 h.
4.2.4 Ủ các ống này ở 37 oC từ 24 h đến 48 h. Sự có mặt của staphylococci giả định có phản ứng dương tính với coagulase được chỉ thị bởi sự khử kali telurit và phản ứng với lòng đỏ trứng.
4.2.5 Các khuẩn lạc điển hình và/hoặc không điển hình được khẳng định bằng phản ứng với coagulase.
4.2.6 Cách khác, có thể cấy lên bề mặt thạch fibrinogen huyết tương thỏ, sau khi ủ ấm thích hợp, sự có mặt của staphylococci có phản ứng dương tính với coagulase được chỉ thị bởi các khuẩn lạc cho thấy có phản ứng với fibrinogen huyết tương thỏ đặc trưng.
4.2.7 Số có xác suất lớn nhất của staphylococci có phản ứng dương tính với coagulase trong một gam hay trong một mililit sản phẩm tính được bằng cách đối chiếu với các bảng số có xác suất lớn nhất cho các độ pha loãng khẳng định (4 2.5 hoăc 4.2.6)
5 Dịch pha loãng và môi trường cấy
Đối với phòng thử nghiệm, xem TCVN 6404 (ISO 7218).
Các hóa chất được sử dụng để chuẩn bị môi trường cấy và thuốc thử phải có chất lượng tinh khiết phân tích.
5.1 Dịch pha loãng
Xem phần tương ứng của TCVN 6507 (ISO 6887), hoặc TCVN 6263 (ISO 8261), hoặc tiêu chuẩn riêng liên quan đến sản phẩm cần kiểm tra.
5.2 Môi trường Giolitti và Cantoni cải biến
5.2.1 Môi trường cơ bản
5.2.1.1 Thành phần
|
| Môi trường nồng độ kép | Môi trường nồng độ đơn |
| Pepton từ casein | 20,0 g | 10,0 g |
| Cao thịt | 10,0 g | 5,0 g |
| Cao men | 10,0 g | 5,0 g |
| Liti clorua | 10,0 g | 5,0 g |
| Mannitol | 40,0 g | 20,0 g |
| Natri clorua | 10,0 g | 5,0 g |
| Glyxin | 2,4 g | 1,2 g |
| Natri pyruvat | 6,0 g | 3,0 g |
| Polyoxyetylen sorbitan mono-oleat (Tween 80) | 2,0 g | 1,0 g |
| Nước | 1 000 ml | 1 000 ml |
5.2.1.2 Chuẩn bị
Hoà tan các thành phần trong nước, bằng cách đun nóng và khuấy, nếu cần, để thu được dung dịch hoà tan hoàn toàn. Làm nguội đến nhiệt độ phòng và chỉnh pH sao cho sau khi khử trùng pH cuối cùng là 6,9 ± 0,2, nếu cần.
Phân phối môi trường với các lượng thích hợp vào các ống nghiệm có kích thước phù hợp (ví dụ: đối với môi trường nồng độ đơn, dùng ống 16 mm x 160 mm, đối với môi trường nồng độ kép thì dùng ống 20 mm x 200 mm).
Khử trùng 15 phút trong nồi hấp áp lực ở 121 oC.
5.2.2 Dung dịch kali telurit
5.2.2.1 Thành phần
| Kali telurit 2) (K2TeO3) | 1,0 g |
| Nước | 100 ml |
5.2.2.2 Chuẩn bị
Hoà tan kali telurit trong nước bằng cách đun nóng rất nhẹ.
Bột phải dễ tan. Nếu có mặt chất không tan màu trắng trong nước; thì loại bỏ kali telurit.
Lọc qua màng lọc cỡ lỗ 0,22 mm để khử trùng.
Dung dịch có thể bảo quản được tối đa một tháng ở nhiệt độ 3 oC ± 2 oC.
Loại bỏ dung dịch nếu có kết tủa màu trắng.
5.2.3 Môi trường hoàn chỉnh
Ngay trước khi sử dụng, đun nóng môi trường cơ bản (5.2.1) 15 phút ở 100 oC để đuổi hết không khí.
Làm nguội đến nhiệt độ từ 44 oC đến 47 oC và bằng kỹ thuật vô trùng cho thêm vào mỗi ống dung dịch kali telurit (5.2.2): 0,1 ml đối với môi trưòng nồng độ đơn và 0,2 ml đối với môi trường nồng độ kép.
5.2.4 Thử tính năng để đảm bảo chất lượng môi trường cấy
Để xác định tính chọn lọc và năng suất, xem ISO/TS 11133-1. Bảng 1 cho thấy chuẩn cứ thử nghiệm tính năng của môi trường Giolitti và Cantoni cải biến.
Bảng 1 - Chuẩn cứ thử nghiệm tính năng của môi trường Giolitti và Cantoni cải biến
| Chức năng | Chế độ ủ | Các chủng kiểm tra | Môi trường chuẩn | Phương pháp kiểm tra | Chuẩn cứ |
| Năng suất | 37 oC trong 48 h | Staphylococcus aureus ATCC 6538 P hoặc Staphylococcus aureus ATCC 25923 cộng với chủng cạnh tranh (E.coli ATCC 8732 hoặc 25922), hoặc chủng tương tự được đăng ký trong các bộ khác |
| Bán định lượng | > 10 khuẩn lạc, trên môi trường chọn lọc |
| Tính chọn loc | 37 oC trong 48h | Escherichia coli ATCC 25922 hoặc 8739 hoặc chủng tương tự được đăng ký trong các bộ khác | TSA | Bán định lượng | Không mọc trên môi trường không chọn lọc |
5.3 Môi trường thạch (20 g/l)
5.3.1 Thành phần
| Thạch | 15 g đến 20 g3) |
| Nước | 1 000 ml |
5.3.2 Chuẩn bị
Hoà tan thạch trong nước bằng cách đun sôi và khử trùng 15 phút trong nồi hấp áp lực ở 121 oC.
Làm nguội đến nhiệt độ từ 44 oC đến 47 oC trước khi sử dụng. Rót vào các ống nghiệm có dung tích thích hợp. Bảo quản theo TCVN 6404 (ISO 7218).
5.4 Môi trường thạch Baird-Parker
5.4.1 Thành phần và chuẩn bị
Xem 5.3 của TCVN 4830-1 : 2005 (ISO 6888-1 : 1999, with amendment 1: 2003).
5.4.2 Thử tính năng để đảm bảo chất lượng môi trường cấy
Để xác định tính chọn lọc và năng suất, xem ISO/TS 11133-1. Đối với các chuẩn cứ, xem Bảng B.1 của ISO/TS 11133-2.
5.5 Môi trường thạch fibrinogen huyết tương thỏ (xem [6] và [7])
5.5.1 Thành phần và chuẩn bị
Xem 5.3 của TCVN 4830-2 : 2005 (ISO 6888-2: 1999, with amendment 1: 2003).
5.5.2 Thử tính năng để đảm bảo chất lượng môi trường cấy
Để xác định tính chọn lọc và năng suất, xem ISO/TS 11133-1. Đối với các chuẩn cứ, xem Bảng B.1 của ISO/TS 11133-2.
5.6 Môi trường canh thang não - tim (Brain-heart infusion broth)
5.6.1 Thành phần và chuẩn bị
Xem 5.4 của TCVN 4830-1 : 2005 (ISO 6888-1: 1999, with amendment 1 : 2003).
5.6.2 Thử tính năng để đảm bảo chất lượng môi trường cấy
Để xác định tính chọn lọc và năng suất, xem ISO/TS 11133-1. Đối với các chuẩn cứ, xem Bảng B.4 của ISO/TS 11133-2.
5.7 Huyết tương thỏ
Xem 5.5 của TCVN 4830-1 : 2005 (ISO 6888-1: 1999, with amendment 1: 2003).
6 Thiết bị và dụng cụ
CHÚ THÍCH: Có thể dùng dụng cụ thuỷ tinh sử dụng một lần thay thế cho các dụng cụ thủy tinh sử dụng nhiều lần nếu chúng có các đặc tính thích hợp.
Sử dụng các thiết bị, dụng cụ của phòng thử nghiệm vi sinh thông thường [xem TCVN 6404 (ISO 7218)] và cụ thể là:
6.1 Tủ ấm, có thể hoạt động ở 37 oC ± 1 oC.
6.2 Tủ sấy hoặc lò sấy, được thông gió bằng đối lưu, có thể duy trì nhiệt độ từ 37 oC đến 55 oC. Có thể sử dụng tủ quạt gió.
6.3 Đĩa Petri, vô trùng.
6.4 Que cấy vòng, bằng platin-iridi, niken-crôm hoặc chất dẻo, đường kính khoảng 3 mm, hoặc các que cấy vòng 10 ml vô trùng sử dụng một lần và các kim cấy sâu bằng chất liệu tương tự.
6.5 Ống nghiệm, có dung tích thích hợp (ví dụ: 16 mm x 160 mm, 20 mm x 200 mm và 10 mm x 75 mm).
6.6 Pipet chia độ, có dung tích danh định 1 ml, được chia vạch 0,1 ml và có lỗ xả với đường kính hợp lý.
6.7 Nồi cách thủy, có thể hoạt động ở nhiệt độ từ 44 oC đến 47 oC và ở 37 oC.
6.8 Dao, để cắt thạch.
6.9 Bình kỵ khí.
7 Lấy mẫu
Điều quan trọng là phòng thử nghiệm nhận được đúng mẫu đại diện và không bị hư hỏng hoặc biến đổi trong suốt quá trình vận chuyển và bảo quản.
Việc lấy mẫu không qui định trong tiêu chuẩn này. Nếu chưa có tiêu chuẩn riêng về lấy mẫu cho sản phẩm tương ứng, thì các bên có liên quan tự thoả thuận về vấn đề này.
8 Chuẩn bị mẫu thử
Việc chuẩn bị mẫu thử theo các phần thích hợp của TCVN 6507 (ISO 6887), hoặc TCVN 6263 (ISO 8261) hoặc tiêu chuẩn riêng cho sản phẩm tương ứng. Nếu chưa có tiêu chuẩn riêng thì các bên liên quan tự thoả thuận với nhau về vấn đề này.
9 Cách tiến hành
9.1 Phương pháp phát hiện
9.1.1 Phần mẫu thử và huyền phù ban đầu
Xem các phần tương ứng của TCVN 6507 (ISO 6887) tuỳ thuộc vào sản phẩm có liên quan hoặc TCVN 6263 (ISO 8261).
Để chuẩn bị huyền phù ban đầu, cho 1 ml hoặc 1 g sản phẩm vào 9 ml hoặc 9 g môi trường Giolitti và Cantoni cải biến nồng độ đơn (5.2) hoặc 10 ml hoặc 10 g vào 10 ml hoặc 10 g môi trường Giolitti và Cantoni cải biến nồng độ kép. Đối với các thể tích lớn hơn của các phần mẫu thử, thêm x ml hoặc x g vào 9 x ml hoặc 9 x g môi trường Giolitti và Cantoni cải biến nồng độ đơn đã được đuổi khí và đã được bổ sung kali telurit, và có thể tích không khí nhỏ nhất trong bình hoặc trong vật chứa. Rót cẩn thận thạch (5.3) hoặc paraffin phủ lên trên môi trường, được làm nguội đến nhiệt độ từ 44 oC đến 47 oC và cho đông đặc lại để tạo thành lớp hàn kín.
9.1.2 Tăng sinh
Ủ (xem 6.1) dung dịch huyền phù ban đầu (9.1.1) trong 24 h ± 2 h ở 37 oC. Nếu bị đen hoặc có kết tủa đen thì cấy truyền như trong 9.1.3. Nếu không hiện màu đen thì ủ tiếp 24 h ± 2 h và cấy truyền như trong 9.1.3 (kể cả xuất hiện hoặc không xuất hiện màu đen hoặc kết tủa đen).
9.1.3 Cấy truyền từ các ống tăng sinh
Bằng cách vô trùng, tháo bỏ lớp thạch hoặc paraffin phía trên, sử dụng dao vô trùng (6.8) để cắt (xem chú thích trong 4.1.2) thành bốn phần theo chiều dọc. Nếu cần, chèn dao vào sát thành theo đường cong của ống thuỷ tinh để tách lớp phủ này. Lắc mạnh ống để lớp phủ vỡ thành mảnh nhỏ rơi xuống đáy ống và đảm bảo còn nguyên huyền phù dịch cấy.
Dùng que cấy vòng vô trùng (6.4), lấy một vòng đầy từng môi trường chọn lọc dàn lên bề mặt các đĩa thạch Baird Parker (5.4) riêng biệt hoặc các đĩa thạch fibrinogen huyết tương thỏ (5.5) để thu được các khuẩn lạc phân lập.
Lật ngược các đĩa đã chuẩn bị và đặt chúng vào tủ ấm (6.1) để ở 37 oC trong 24 h ± 2 h và 48 h ± 2 h.
9.2 Phương pháp định lượng
9.2.1 Phần mẫu thử và huyền phù ban đầu
Xem các phần thích hợp của TCVN 6507 (ISO 6887) tuỳ thuộc vào sản phẩm có liên quan hoặc TCVN 6263 (ISO 8261).
9.2.2 Cấy
Lấy ba ống môi trường nồng độ kép, đã đuổi khí và đã bổ sung kali telurit (5.2.3). Chuyển vào mỗi ống 10 ml mẫu thử dạng lỏng hoặc 10 ml dung dịch pha loãng ban đầu (tức là 1 g mẫu) của các sản phẩm dạng khác.
Lấy ba ống môi trường nồng độ đơn, đã đuổi khí và bổ sung kali telurit (5.2.3). Chuyển vào mỗi ống 1 ml mẫu thử dạng lỏng hoặc 1 ml dung dịch pha loãng ban đầu (tức là 0,1 g mẫu) của các sản phẩm dạng khác.
Đối với mỗi độ pha loãng tiếp theo (tức là 10-1, 10-2 và 10-3 đối với sản phẩm dạng lỏng hoặc 10-2, 10-3 hoặc 10-4 đối với các sản phẩm dạng khác), tiến hành như mô tả ở trên, sử dụng pipet vô trùng mới cho mỗi độ pha loãng.
Chuẩn bị đủ một số lượng các dung dịch pha loãng để đảm bảo rằng độ pha loãng cuối cùng đủ để cho ba kết quả âm tính.
Trộn cẩn thận chất cấy và môi trường, trong mỗi trường hợp tránh để lẫn không khí vào.
Cẩn thận rót một lớp thạch (5.3), đã được làm nguội đến nhiệt độ từ 44 oC đến 47 oC lên trên môi trường trong mỗi ống đã cấy và để cho đặc lại tạo thành lớp hàn kín.
9.2.3. Ủ
Ủ (xem 6.1) các ống nghiệm đựng môi trường nồng độ kép và môi trường nồng độ đơn (9.2.2) đã cấy, ở 37 oC trong 24 h ± 2 h. Cấy truyền các ống nghiệm cho thấy bị đen hoặc có kết tủa đen như đã chỉ ra trong 9.5.
Ủ tiếp các ống còn lại trong 24 h ± 2 h và cấy truyền tất cả các ống như trong 9.1.3 (kể cả các ống có kết tủa đen hoặc không có kết tủa đen sau 48 h ± 2 h).
9.2.4. Cấy truyền
9.3 Chọn đĩa vả giải thích kết quả
9.3.1 Môi trường thạch Baird-Parker
9.3.1.1 Chọn các khuẩn lạc
Sau khi ủ các đĩa (9.1.3 hoặc 9.2.4) 24 h, đánh dấu vào đáy các đĩa các vị trí của bất kỳ khuẩn lạc điển hình nào có mặt.
CHÚ THÍCH 1: Các khuẩn lạc điển hình có màu đen hoặc màu xám, bóng và lồi (đường kính từ 1 mm đến 1,5 mm sau khi ủ trong 24 h, và có đường kính từ 1,5 mm đến 2,5 mm sau khi ủ 48 h) và được bao quanh bằng một vùng trong rõ rệt, cũng có thể là mờ từng phần. Sau khi ủ trong ít nhất 24 h, có thể xuất hiện một vòng màu trắng đục tiếp giáp với khuẩn lạc .
CHÚ THÍCH 2: Các khuẩn lạc không điển hình cùng kích cỡ như khuẩn lạc điển hình và có thể có một trong các hình thái sau.
a) Các khuẩn lạc đen bóng có hoặc không có rìa trắng hẹp; không có vùng trong hoặc hầu như không nhìn thấy và không có vòng trắng đục hoặc rất khó nhìn thấy.
b) Các khuẩn lạc màu xám không có vùng trong.
Các khuẩn lạc không điển hình được hình thành chủ yếu do các chủng staphylococci có phản ứng dương tính với coagulase nhiễm vào sản phẩm, ví dụ: các sản phẩm sữa, tôm và các bộ phận của vật nuôi. Chúng thường ít khi được hình thành do các chủng staphylococci có phản ứng dương tính với coagulase bị nhiễm trong các sản phẩm khác.
CHÚ THÍCH 3: Các khuẩn lạc khác là tất cả các khuẩn lạc còn lại có khả năng có mặt trên các đĩa mà không cho thấy biểu hiện bên ngoài điển hình hoặc không điển hình như đã mô tả trong Chú thích 1 và Chú thích 2, và được coi là hệ vi khuẩn nền.
Ủ lại (xem 6.1) tất cả các đĩa ở 37 oC thêm 24 h + 2 h và đánh dấu bất kỳ khuẩn lạc điển hình nào mới. Đồng thời cũng đánh dấu bất kỳ khuẩn lạc không điển hình nào có mặt.
9.3.1.2 Khẳng định
Từ bề mặt của mỗi khuẩn lạc đã chọn (9.3.1.1), dùng kim cấy vô trùng lấy một phần và chuyển vào ống hoặc lọ đựng môi trường canh thang não-tim (5.6).
Ủ (xem 6.1) ở 37 oC trong 24 h ± 2 h.
Bằng kỹ thuật vô trùng, lấy 0,1 ml chủng cấy cho vào 0,3 ml huyết tương thỏ (5.7) (trừ khi nhà sản xuất qui định các lượng khác) đựng trong các ống vô trùng có kích thước thích hợp (ví dụ 10 mm x 75 mm)
Nghiêng ống, kiểm tra sự kết dính của huyết tương sau khi ủ từ 4 h đến 6 h, và nếu phép thử là âm tính thì kiểm tra lại sau khi ủ 24 h ± h, hoặc kiểm tra theo thời gian ủ được nhà sản xuất qui định.
Các phép thử coagulase được coi là dương tính nếu các chủng cấy sinh ra tại ít nhất các phản ứng coagulase 3 + theo hướng dẫn đánh dấu (kẻ vạch) trong Hình 1. Các phản ứng từ 1+ đến 2+ được coi là trung gian.
Về kiểm tra âm tính, đối với mỗi mẻ huyết tương, thêm 0,1 ml môi trường canh thang não-tim vô trùng (5.6) vào một lượng huyết tương thỏ (5.7) đã được khuyến cáo và ủ nhưng không cấy. Việc kiểm tra huyết tương không có dấu hiệu nào của sự kết dính thì phép thử là hợp lệ.
Đánh dấu dương tính mỗi ống có ít nhất một khuẩn lạc được khẳng định là dương tính với coagulase.
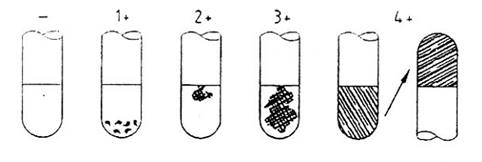
- âm tính: không có bằng chứng hình thành fibrrin.
1 + dương tính: kết dính nhỏ không có tổ chức
2 + dương tính: kết dính nhỏ có tổ chức
3 + dương tính: kết dính nhiều có tổ chức
4 + dương tính: toàn bộ kết dính và không dịch chuyển khi ống bị lật ngược
Hình 1 - Đánh dấu các phản ứng thử nghiệm với coagulase
9.3.2 Môi trường thạch fibrinogen huyết tương thỏ
Sau khi ủ 24 h ± 2 h, và ủ tiếp 24 h nếu cần, staphylococci có phản ứng dương tính với coagulase hình thành các khuẩn lạc nhỏ màu đen hoặc màu xám (hoặc thậm chí màu trắng) được bao quanh bởi vòng sáng kết tủa dấu hiệu cho hoạt tính coagulase. Khi bắt đầu ủ, các khuẩn lạc Proteus, có thể cho thấy vẻ bên ngoài giống với các khuẩn lạc staphylococci có phản úng dương tính với coagulase. Tuy nhiên sau khi ủ 24 h hoặc 48 h chúng có thể phát triển thành khuẩn lạc mọc rộng có màu nâu đậm hoặc nâu nhạt do đó có thể phân biệt được với vi khuẩn staphylococci.
Phép thử là dương tính khi có mặt ít nhất một khuẩn lạc chỉ thị hoạt tính coagulase được thấy
CHÚ THÍCH: Vi thạch fibrinogen huyết tương thỏ được dựa trên phản ứng coagulase, nên không cần thiết phải khẳng định hoạt tính này.
10 Biểu thị kết quả
10.1 Phương pháp phát hiện
Theo giải thích các kết quả, ghi lại sự có mặt hoặc không có mặt staphylococci có phản ứng dương tính với coagulase trong phần mẫu thử, theo khối lượng tính bằng gam hoặc theo thể tích tính bằng mililit của mẫu thử.
10.2 Phương pháp định lượng
10.2.1 Chọn các độ pha loãng
CHÚ THÍCH: Huyền phù ban đầu và mẫu thử, nếu ở dạng lỏng được coi là dung dịch pha loãng.
Đối với mỗi độ pha loãng đã được cấy vào môi trường cấy lỏng chọn lọc (9.1.2 và 9.2.2), ghi lại số lượng ống nghiệm cho thấy có mặt staphylococci có phản ứng dương tính với coagulase đã được khẳng định bằng phép thử thạch Baird-Parker (9.3.1) hoặc sự có mặt các khuẩn lạc với các phản ứng dương tính với coagulase trên môi trường thạch fibrinogen huyết tương thỏ (9.3.2). Chỉ rõ đó là các ống dương tính.
Chọn ba độ pha loãng liên tiếp theo 9.4 của TCVN 6404 : 1998 (ISO 7218 : 1996) và xác định chỉ số có xác suất lớn nhất (MPN) [xem TCVN 6404 (ISO 7218)]
10.2.2 Tính toán
Xem 9.4 của TCVN 6404 : 1998 (ISO 7218 : 1996).
11. Độ chụm
Như đã biết, các sai lệch lớn trong các kết quả có thể xảy ra với kỹ thuật MPN. Các giới hạn tin cậy qui định được dựa hoàn toàn trên sự phân bố ngẫu nhiên các kết quả. Các nguyên nhân gây ra sai lệch khác đôi khi có thể rất quan trọng, nhưng không đề cập trong kỹ thuật MPN. Để tính đến các ảnh hưởng này, sử dụng các phạm trù trong bảng B.2 của TCVN 6404 : 1998 (ISO 7218 : 1996). Chúng tổng kết các tổ hợp ống theo khả năng xuất hiện của chúng.
CHÚ THÍCH: Môt nghiên cứu cộng tác quốc tế (xem [3]) trên các mẫu sữa khô cho thấy, sử dụng kỹ thuật MPN giống như mô tả trong tiêu chuẩn này, thì trong 75 % các trường hợp chênh lệch giữa các kết quả của hai phép thử độc lập nhỏ hơn 1,25 lần so với trung bình cộng của hai kết quả. Chênh lệch lớn nhất quan sát được giữa các kết quả của hai phép thử độc lập là 1.94 lần so với trung bình cộng của hai kết quả.
12 Báo cáo thử nghiệm
Báo cáo thử nghiệm phải chỉ rõ:
a) Mọi thông tin cần thiết để nhận biết đầy đủ về mẫu thử,
b) Phương pháp lấy mẫu đã sử dụng, nếu biết;
c) Phương pháp thử nghiệm đã dùng (phương pháp phát hiện hoặc phương pháp định lượng; môi trường đã sử dụng), viện dẫn tiêu chuẩn này;
d) Mọi chi tiết thao tác không được quy định trong tiêu chuẩn này hoặc những điều được coi là tuỳ ý cũng như các sự cố bất kỳ mà có thể ảnh hưởng đến kết quả;
e) kết quả thu được, chỉ rõ phương pháp biểu thị đã sử dụng.
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] IDF 83 : 1998, Milk and milk-based products - Detection of thermonuclease produced by coagulase - positive staphylococci in milk and milk-based products.
[2] IDF 60 C : 1997, Milk and milk-based products - Detection of coagulase - positive staphylococci - Most probable number technique.
[3] CHOPIN, A. , MALCOLM, S. , JARVIS, G. , ASPERGER, H. , BECKERS, H.J. , BERTONA, A.M. , COMINAZZINI, C. , CARINI, S. , LODI, R. . HAHN, G. , HEESCHEN, W. , JANS, JERVIS, D.l. , LANIER, J.M. , OCONNOR, F., REA, M. , ROSSI, J. , SELIGMANN, R. , TESONE, S. . WAES, G. , MOCQUOT, G. and PIVNICK H Comparision of four media and methods for enumerating Staphylococcus aureus in powdered milk: ICMSF methods studies: XV, J. Food. Prot. , 48, 1985, pp. 21-27.
[4] BAIRD - PARKER, A.C. improvide diagnostic and selective medium for isolating coagulase positive staphylococci, J. Applied Bacteriology, 25 (1), 1962, pp. 12-19.
[5] SMITH, B.A and BAIRD - PARKER, A.C. The use of sulphamezathine for inhibiting Proteus spp. on Baird-Parker's isolation medium for Staphylococcus aureus. J. Applied Bacteriology, 27 (1). 1964, pp. 78 - 82.
[6] BECKERS, H.L et al. Evaluation of pour-plate system with rabbit plasma-bovine fibrinogen agar for the enumeration of Staphylococcus auraus in food. Can. J. Microbioi. , 30, 1984, pp. 470-474.
[7] SAWHEY. D. The toxicity of potassium tellurite to Staphylococcus aureus in rabbit plasma fibrinigen agar, J. Applied Bacteriology, 61, 1996, pp, 149- 155.
2) Chỉ sử dụng kali telurit phù hợp đối với phép thử này (5.3.2.2)
3) Tùy thuộc vào sức đông của thạch
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 4830-3:2005 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 4830-3:2005 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 4830-3:2005 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 4830-3:2005 DOC (Bản Word)