- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn quốc gia TCVN 8710-27:2023 Bệnh thủy sản - Quy trình chẩn đoán - Phần 27
| Số hiệu: | TCVN 8710-27:2023 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
13/11/2023 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 8710-27:2023
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 8710-27:2023
TIÊU CHUẨN QUỐC GIA
TCVN 8710-27:2023
BỆNH THỦY SẢN - QUY TRÌNH CHẨN ĐOÁN - PHẦN 27: BỆNH DO VI RÚT TILAPIA LAKE (TiLV) Ở CÁ RÔ PHI
Aquatic animal disease - Diagnostic procedure - Part 27 :Tilapia lake virus disease
Lời nói đầu
TCVN 8710-27: 2023 được xây dựng trên cơ sở tham khảo OIE/WOAH, 2020, Manual of Diagnostic Tests for Aquatic Animal , Tilapia lake virus (TiLV), Updated February 2018, Tilapia lake virus (TiLV) - Anovel orthomyxo-like virus.
TCVN 8710-27: 2023 do Trung tâm Chẩn đoán thú y Trung ương, Cục Thú y biên soạn, Bộ Nông nghiệp và Phát triển nông thôn đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Bộ tiêu chuẩn TCVN 8710 Bệnh thủy sản - Quy trình chẩn đoán gồm các phần sau đây:
- TCVN 8710-1:2011, Phần 1: Bệnh còi do vi rút ở tôm;
- TCVN 8710-2:2019, Phần 2: Bệnh hoại tử thần kinh ở cá biển;
- TCVN 8710-3:2019, Phần 3: Bệnh đốm trắng ở tôm;
- TCVN 8710-4:2019, Phần 4: Bệnh đầu vàng ở tôm;
- TCVN 8710-5:2023, Phần 5: Hội chứng taura ở tôm;
- TCVN 8710-6:2019, Phần 6: Bệnh do Koi herpesvi rút ở cá chép;
- TCVN 8710-7:2019, Phần 7: Bệnh xuất huyết mùa xuân ở cá chép;
- TCVN 8710-8:2023, Phần 8: Bệnh hoại tử cơ ở tôm (IMNV);
- TCVN 8710-9:2012, Phần 9: Bệnh hoại tử gan tụy ở tôm;
- TCVN 8710-10:2015, Phần 10: Bệnh do Perkinsus marinus ở nhuyễn thể hai mảnh vỏ;
- TCVN 8710-11:2015, Phần 11: Bệnh do Perkinsus olseni ở nhuyễn thể hai mảnh vỏ;
- TCVN 8710-12:2019, Phần 12: Bệnh vi bào tử do Enterocytozoon hepatopenaei ở tôm;
- TCVN 8710-13:2015, Phần 13: Bệnh gan tụy do Parvovi rút ở tôm;
- TCVN 8710 14:2015, Phần 14: Hội chứng lở loét (EUS) ở cá;
- TCVN 8710-15:2015, Phần 15: Bệnh nhiễm trùng do Aeromonas hydrophila ở cá;
- TCVN 8710-16:2016, Phần 16: Bệnh gan thận mủ ở cá da trơn;
- TCVN 8710-17:2016, Phần 17: Bệnh sữa trên tôm hùm;
- TCVN 8710-19:2019, Phần 19: Bệnh hoại tử gan tụy cấp tính ở tôm;
- TCVN 8710-20:2019, Phần 20: Bệnh hoại tử dưới vỏ và cơ quan tạo máu ở tôm;
- TCVN 8710-21:2019, Phần 21: Bệnh do vi khuẩn Streptococcus agalactiae ở cá;
- TCVN 8710-22:2022, Phần 22: Bệnh sán lá 16 móc ở cá;
- TCVN 8710-23:2022, Phần 23: Bệnh hoại tử cơ quan tạo máu do IHNV ở cá hồi;
- TCVN 8710-24:2022, Phần 24: Bệnh do sán lá Dollfustrema sp. ở cá da trơn;
- TCVN 8710-25:2022, Phần 25: Bệnh do ký sinh trùng Bonamia ostreae và Bonamia exitiosa ở hàu;
- TCVN 8710-26:2023, Phần 26: Bệnh hoại tử cơ quan tạo máu do EHNV ở cá;
- TCVN 8710-27:2023, Phần 27: Bệnh do vi rút Tilapia lake (TiLV) ở cá rô phi;
- TCVN 8710-28:2023, Phần 28: Bệnh do RSIV ở cá biển.
BỆNH THỦY SẢN - QUY TRÌNH CHẨN ĐOÁN - PHẦN 27: BỆNH DO VI RÚT TILAPIA LAKE (TiLV) Ở CÁ RÔ PHI
Aquatic animal disease - Diagnostic procedure - Part 27 :Tilapia lake virus disease
CẢNH BÁO - Việc áp dụng tiêu chuẩn này có thể liên quan đến các vật liệu, thiết bị và các thao tác gây nguy hiểm. Tiêu chuẩn này không thể đưa ra được hết tất cả các vấn đề an toàn liên quan đến việc sử dụng chúng. Người sử dụng tiêu chuẩn này phải tự thiết lập các thao tác an toàn sức khỏe thích hợp và xác định khả năng áp dụng các giới hạn quy định trước khi sử dụng tiêu chuẩn.
1 Phạm vi áp dụng
Tiêu chuẩn này quy định quy trình chẩn đoán bệnh do vi rút Tilapia lake (TiLV) ở cá rô phi.
2 Thuật ngữ, định nghĩa và các từ viết tắt
2.1 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng các thuật ngữ và định nghĩa sau:
2.1.1
Bệnh do vi rút Tilapia lake (TiLV) ở cá rô phi
Là bệnh truyền nhiễm nguy hiểm do TiLapia lake virus gây ra ở các loài cá rô phi nuôi và cá rô phi tự nhiên. Cá mắc bệnh có biểu hiện bỏ ăn, màu sắc cơ thể biến đổi (sẫm màu), mắt teo hoặc lồi, lở loét trên da, mang tái nhợt, hậu môn và xoang bụng phình to, vảy dựng, bong tróc và đuôi bị ăn mòn.
2.1.2
Vi rút Tilapia Lake
Là một vi rút mới có nhân ARN sợi đơn âm có kích thước bộ gen là 10.3kb, thuộc họ với Orthomyxovirus và có 10 phân đoạn mã hóa 10 protein, có đường kính từ 55 đến 100nm.
2.2 Các từ viết tắt
| - TiLV | TiLapia lake virus; |
| - ADN (Deoxyribonucleic acid): | Axit deoxyribonucleic; |
| - ARN (Ribonucleic acid): | Axit ribonucleic; |
| - CPE (cytopathic effect): | Bệnh lý tế bào; |
| - FBS (Fetal bovine serum): | Huyết thanh nhau thai bò; |
| - PBS (Phosphate buffered saline): | Dung dịch muối đệm phosphat; |
| - RT-PCR (Reverse Transcription Polymerase Chain Reaction): | |
|
| Phản ứng chuỗi polymerase phiên mã ngược; |
| - TAE (Tris-acetate-EDTA): | Tris-axetat-axit etylendiamintetraaxetic; |
| - TBE (Tris-borate-EDTA): | Tris-borat-axit etylendiamintetraaxetic; |
| - TE (Tris-EDTA); | Tris-axit etylendiamintetraaxetic. |
3 Thuốc thử và vật liệu thử
Chỉ sử dụng thuốc thử loại tinh khiết phân tích, sử dụng nước cất, nước khử khoáng hoặc nước có độ tinh khiết tương đương, trừ các trường hợp có quy định khác.
3.1 Ethanol, từ 70 % đến ethanol tuyệt đối
3.2 Dung dịch muối đệm phosphat (PBS), (xem A.2)
3.3 Cặp mồi (primer) Semi nested RT - PCR, gồm mồi xuôi và mồi ngược
3.4 Cặp mồi (primer) realtime RT - PCR, gồm mồi xuôi và mồi ngược, Dò (Probe)
3.5 Kít tách chiết ARN/ADN
3.6 Kít nhân gen RT - PCR
3.7 Kít nhân gen PCR
3.8 Kít nhân gen realtime RT - PCR
3.9 Thang chuẩn ADN
3.10 Nước tinh khiết, không có nuclease.
3.11 Agarose
3.12 Dung dịch đệm TAE hoặc TBE (xem A.1)
3.13 Chất nhuộm màu, ví dụ: Sybr safe
3.14 Chất đệm tải mẫu (Loading dye 6X)
3.15 Dung dịch đệm TE
4 Thiết bị, dụng cụ
Sử dụng thiết bị, dụng cụ thông thường của phòng thử nghiệm sinh học và những thiết bị, dụng cụ sau:
4.1 Tủ lạnh, có thể duy trì ở nhiệt độ từ 2 °C đến 8 °C
4.2 Tủ lạnh âm sâu, có thể duy trì ở nhiệt độ từ âm 20 °C tới âm 80 °C
4.3 Buồng cấy an toàn sinh học cấp 2
4.4 Pipet đơn kênh các loại
4.5 Ống đong, dung tích 100 mL; 500 mL; 1000 mL
4.6 Máy ly tâm, có thể hoạt động với gia tốc 2 000 g đến 4 000 g và gia tốc 12 000 g
4.7 Máy nghiền mẫu
4.8 Cân phân tích, có thể cân chính xác đến 0,1 mg
4.9 Lọ dụng cụ chứa mẫu, kín, có nắp đậy, không rò rỉ, vô trùng
4.10 Panh, kéo, vô trùng
4.11 Máy ủ nhiệt, từ 0°C đến 100 °C
4.12 Máy nhân gen PCR
4.13 Máy realtime PCR
4.14 Máy lắc trộn Vortex
4.15 Máy đọc sản phẩm PCR
4.16 Khay đựng đá lạnh
4.17 Bộ khuôn và lược đổ thạch
4.18 Bộ điện di, gồm bộ nguồn và bể chạy điện di
5 Chẩn đoán lâm sàng
5.1 Đặc điểm dịch tễ
Loài nhiễm: TiLV gây bệnh ở cá rô nuôi bao gồm: Cá rô phi vằn (Nile tilapia, Oreochromis niloticus), cá rô phi lai tạo (O. niloticus × O. aureus hybrids) và cá rô phi đỏ/cá điêu hồng (Oreochromis sp). Các loài cá rô phi hoang dã như cá rô phi xanh (Oreochromis aureus), cá rô phi Mango (Sarotherodon galilaeus) và một số loài khác cũng mẫn cảm với vi rút này. Tất cả các giai đoạn sống của cá rô phi, trứng đã thụ tinh, ấu trùng túi noãn hoàng, cá bột, cá giống và cá trưởng thành đều dễ bị nhiễm TiLV và cá nhỏ dễ bị nhiễm TiLV hơn cá lớn.
Vi rút lây truyền theo chiều ngang như từ cá bệnh sang cá khỏe trong cùng lồng/ao nuôi, từ nguồn nước, dụng cụ nuôi, dụng cụ cho ăn, dịch nhớt, phân của cá bệnh sang cá khỏe trong ao.
Mầm bệnh có thể tồn tại ở nhớt cá, gan và ruột cá trong vòng hai tuần, vì vậy khi có cá bị nhiễm TiLV thì khả năng lây lan trong quần đàn là rất lớn, đặc biệt với các mô hình nuôi cá rô phi với mật độ cao.
Bệnh do TiLV thường xảy ra ở khoảng nhiệt độ từ 20 °C đến 30 °C và khi có hiện tượng sốc môi trường như nhiệt độ, độ mặn.
Tỷ lệ chết tùy thuộc vào giai đoạn phát triển và giống cá rô phi, tỷ lệ chết dao động 9,2 % đến 90 % đã được ghi nhận ở các nước Ai Cập, Israel, Thái Lan và Ecuador, bệnh do TiLV xuất hiện ở mọi lứa tuổi nhưng chủ yếu tập trung ở cá giống.
5.2 Triệu chứng lâm sàng và dấu hiệu bệnh tích
Cá mắc bệnh có biểu hiện bỏ ăn, màu sắc cơ thể biến đổi như da cá sẫm màu hơn;
Cá bơi lờ đờ, ngừng kéo đàn, hôn mê trước khi chết.
Da cá bị ăn mòn lở loét từ dạng điểm đến mảng; mắt bị teo hoặc lồi ra, có hiện tượng đục thủy tinh thể; vẩy dựng lên, bong tróc, hậu môn phình to và đuôi bị ăn mòn.
Mang và gan cá nhợt nhạt, xuất huyết da, xoang bụng và hậu môn phình to có chứa nhiều dịch, não có hiện tượng xung huyết, xuất huyết. Bụng chướng và có nhiều dịch lỏng bên trong.
6 Chẩn đoán trong phòng thí nghiệm
6.1 Lấy mẫu
- Cá có kích thước < 4 cm: Lấy nguyên con, từ 10 con đến 15 con.
- Cá có kích thước từ 4 cm đến 6 cm: Lấy nguyên con, từ 5 con đến 10 con.
- Cá có kích thước > 6 cm: Lấy nguyên con, từ 3 con đến 5 con hoặc lấy não, gan, thận, lách, tim, mắt, mang của từ 3 đến 5 con.
- Cá bố mẹ: Lấy máu, trứng hoặc sẹ (bằng que thăm trứng hoặc sẹ) của từ 1 đến 3 con..
Thu mẫu cá có dấu hiệu bệnh lý, còn sống hoặc mới chết. Mẫu bệnh phẩm phải được lấy vô trùng và để riêng biệt trong lọ dụng cụ đựng mẫu (4.9).
6.2 Bảo quản mẫu
Bảo quản vận chuyển: Bảo quản mẫu ở nhiệt độ từ 2 °C đến 8 °C không quá 48 h từ khi lẩy mẫu đến khi vận chuyển về phòng thí nghiệm hoặc bảo quản trong ethanol 95 % với tỷ lệ 1:10 (1 phần mẫu : 9 phần ethanol).
Bảo quản tại phòng thí nghiệm: Mẫu được được bảo quản ở nhiệt độ từ 2°C đến 8 °C chuyển đến phòng thí nghiệm chưa phân tích ngay phải được bảo quản ở nhiệt độ âm 20 °C đến âm 80 °C hoặc được bảo quản trong dung dịch PBS (3.2) theo tỷ lệ 1:10 (1 phần mẫu : 9 phần PBS) ở nhiệt độ âm 20 °C đến âm 80 °C hoặc bảo quản trong ethanol từ 95 %.
6.3 Chuẩn bị mẫu
Dùng panh, kéo (4.10) vô trùng để thực hiện các thao tác: tách, cắt lấy mẫu. Mẫu được chia thành hai phần: một phần cho thực hiện xét nghiệm và một phần lưu trữ.
Lượng mẫu lấy để tách chiết ARN khoảng 30 mg.
Cho 30 mg mẫu (não, gan, thận, lách, tim, mắt, mang, máu, trứng, sẹ) vào dung dịch PBS (3.2) với tỷ lệ 1:10 (1 thể tích mẫu : 9 thể tích PBS), đồng nhất mẫu bằng máy nghiền mẫu (4.7) hoặc bằng cối, chày nghiền mẫu để tạo thành huyễn dịch 10 %. Chuyển huyễn dịch vào 2 ống vô trùng đóng nắp. Một ống mẫu để xét nghiệm và một ống lưu mẫu.
CHÚ Ý: Với mẫu đã bảo quản ở nhiệt độ âm 20 °C đến âm 80 °C cần rã đông ngoài nhiệt độ phòng trước khi thực hiện đồng nhất mẫu.
6.4 Tách chiết ARN
Sử dụng bộ kít tách chiết (3.5) thích hợp và an toàn theo hướng dẫn của nhà sản xuất.
VÍ DỤ: Sử dụng kít tách chiết ARN: InviMAG®Virus DNA/RNA Mini Kit/ KF96, Cat. No: 7441050100 (xem phụ lục B1) hoặc sử dụng kit tách chiết TACO RNA/DNA extraction Kit (GeneReach Cat. No. atc-d/rna, 320 tests (xem phụ lục B2) hoặc PureLinK Viral RNA/DNA mini kit (50) (Cat. No: 12280-050)xem phụ lục B3)1)
Mẫu sau khi tách chiết tiến hành theo phương pháp Semi nested RT - PCR hoặc Phương pháp realtime RT - PCR
6.5 Phương pháp Semi nested RT - PCR
6.5.1 Chuẩn bị mồi
Phản ứng khuếch đại được thực hiện trong máy nhân gen PCR (4.12) theo phương pháp Semi nested RT - PCR khuếch đại đoạn gen đặc hiệu của vi rút TiLV sử dụng cặp mồi EXT-1/ ME1 và ME2/ ME1 (3.3) (xem phụ lục C, bảng C1).
- Mồi ở trạng thái đông khô phải được ly tâm nhanh bằng máy ly tâm (4.6) trong 30 s để mồi lắng xuống đáy ống trước khi mở và hoàn nguyên. Dùng dung dịch đệm TE (3.15) để hoàn nguyên mồi ở nồng độ 100 μM làm gốc.
- Mồi được sử dụng ở nồng độ 10 μM: pha loãng mồi gốc bằng nước tinh khiết không có nuclease (3.10) (10 μl mồi gốc và 90 μl nước tinh khiết không có nuclease).
6.5.2 Tiến hành phản ứng Semi Nested RT - PCR
Phương pháp Semi nested RT- PCR bao gồm 2 giai đoạn (hoặc 2 bước): Giai đoạn 1 (bước 1), thực hiện phản ứng RT - PCR sử dụng cặp mồi EXT-1/ ME1; Giai đoạn 2 (bước 2), thực hiện phản ứng Semi nested RT - PCR sử dụng cặp mồi ME2/ ME1 (3.3), (xem phụ lục C)
6.5.3 Điện di
6.5.3.1 Chuẩn bị bản thạch
Pha thạch với nồng độ agarose (3.11) từ 1,5 % đến 2 % bằng dung dịch đệm TBE 1X hoặc TAE 1X (3.12) vào chai thủy tinh 250 ml, lắc đều rồi đun sôi;
Khi nhiệt độ giảm xuống khoảng 40 °C đến 50 °C thì bổ sung 10 μl chất nhuộm màu (3.13) vào mỗi 100 ml thạch. Lắc nhẹ tránh tạo bọt để chất nhuộm màu tan đều.
Tiến hành đổ thạch vào khay điện di đã được cài lược; không nên đổ bản thạch dày quá 0,8 cm.
Khi bản thạch đông lại thì tiến hành gỡ lược khỏi bản thạch.
Chuyển bản thạch vào bể điện di (4.2.7), đổ dung dịch đệm (TBE 1X hoặc TAE 1X) cùng loại với dung dịch pha agarose đã đun vào bể điện di cho tới khi ngập bản thạch.
CHÚ THÍCH: Có thể dùng các sản phẩm có sản chất nhuộm ADN để pha chế thạch agarose (VÍ DỤ: Sybr safe DNA gel stain và sử dụng theo quy định của nhà sản xuất)2).
6.5.3.2 Chạy điện di
Hút 2 μl chất đệm tải mẫu (Loading dye 6X) (3.14) vào 8 μl sản phẩm PCR trộn đều và cho vào các giếng trên bản thạch. Thực hiện điện di trong bộ điện di, chạy kèm theo thang chuẩn ADN (3.9) để so sánh kích thước sản phẩm khuếch đại. Hút 10 μl thang chuẩn ADN (3.9) vào một giếng trên bản thạch.
Điện di ở hiệu điện thế 100 V trong thời gian 30 min.
6.5.3.3 Đọc kết quả
Sau khi điện di, đọc kết quả trên máy đọc sản phẩm PCR (4.15).
Điều kiện của phản ứng được công nhận khi:
- Đối chứng âm không có vạch sáng (không có sản phẩm khuếch đại);
- Đối chứng dương có vạch sáng kích thước 415 bp và 250 bp so với thang chuẩn (Có thể có vạch sản phẩm phụ, không đặc hiệu, kích thước khoảng 800 bp hoặc 300 bp).
- Thang chuẩn ADN sáng và chia vạch rõ ràng
Với điều kiện phản ứng trên:
Mẫu xét nghiệm âm tính khi:
- Tại giếng của mẫu thử không xuất hiện vạch sáng (không có sản phẩm khuếch đại);
Mẫu xét nghiệm dương tính khi:
- Tại giếng của mẫu thử có xuất hiện vạch sáng kích thước 415 bp và 250 bp (Có thể có vạch sản phẩm phụ, không đặc hiệu, kích thước khoảng 800 bp hoặc 300 bp) hoặc chỉ có vạch sáng 250 bp.
6.6 Phương pháp realtime RT - PCR
6.6.1 Chuẩn bị mồi
Phản ứng khuếch đại được thực hiện theo phương pháp realtime RT - PCR khuếch đại đoạn gen đặc hiệu của vi rút TiLV sử dụng cặp mồi TiLV-93F / TiLV-93R và Probe-TiLV93 (3.4). (xem phụ lục D, bảng D1).
Mồi được chuẩn bị như sau:
- Mồi ở trạng thái đông khô phải được ly tâm nhanh bằng máy ly tâm (4.6) trong 30 s để mồi lắng xuống đáy ống trước khi mở và hoàn nguyên. Khi hoàn nguyên, nên dùng dung dịch đệm TE (3.15) để hoàn nguyên mồi ở nồng độ 100 μM làm gốc.
- Mồi được sử dụng ở nồng độ 20 μM: pha loãng mồi gốc bằng nước tinh khiết không có nuclease (3.10) (20 μl mồi gốc và 80 μl nước tinh khiết không có nuclease).
- Đoạn dò Probe - TiLV93 sử dụng ở nồng độ 10 μM: pha loãng đoạn dò bằng nước tinh khiết không có nuclease (3.10) (10 μl mồi gốc và 90 μl nước tinh khiết không có nuclease)
6.6.2 Tiến hành phản ứng realtime RT - PCR
Phương pháp realtime RT - PCR sử dụng cặp mồi TiLV-93F / TiL-V-93R và Probe-TiLV93 đã được chuẩn bị (Theo 6.2.4.2 ) sử dụng kít nhân gen realtime RT - PCR (3.8) theo hướng dẫn của nhà sản xuất. (Xem phụ lục D)
6.6.3 Đọc kết quả
Kết quả của phản ứng realtime RT - PCR được xác định đưa vào chu kỳ ngưỡng (Cycle threshold: Ct).
- Mẫu đối chứng âm phải cho kết quả âm tính
- Mẫu đối chứng dương (có giá trị Ct đã biết trước) phải cho kết quả dương tính và có giá trị Ct ± 2 Ct đã biết trước.
Giải thích kết quả phản ứng realtime RT - PCR phát hiện vi rút TiLV
- Mẫu có giá trị Ct < 35 được xem là dương tính
- Mẫu không có giá trị Ct là âm tính
- Mẫu có giá trị Ct trong khoảng 35 ≤ Ct ≤ 40 được xem là nghi ngờ.
CHÚ Ý:
- Những mẫu nghi ngờ, cần được thực hiện lại xét nghiệm hoặc sử dụng phương pháp xét nghiệm tương đương khác để khẳng định kết quả.
- Phản ứng realtime RT- PCR phải bao gồm: mẫu kiểm tra, mẫu kiểm chứng dương và mẫu kiểm chứng âm;
- Mẫu và nguyên liệu cho phản ứng realtime RT-PCR cần đặt trong khay đá lạnh trong suốt quá trình chuẩn bị hỗn hợp phản ứng.
7 Kết luận
Cá được xác định mắc bệnh do vi rút Tilapia lake (TiLV) ở cá rô phi khi có những đặc điểm dịch tễ, triệu chứng lâm sàng, bệnh tích đặc trưng của bệnh và:
- Có kết quả dương tính bằng phương pháp Semi nested RT- PCR hoặc
- Có kết quả dương tính bằng phương pháp realtime RT- PCR.
Phụ lục A
(Quy định)
Thành phần và chuẩn bị thuốc thử
A.1 Dung dịch đệm TAE 1X hoặc TBE 1X
A.1.1 Thành phần
| Dung dịch TAE (hoặc TBE) 10X: | 100 ml |
| Nước khử ion: | 900 ml |
Tổng: 1000 ml dung dịch TAE (TBE) 1X
A.1.2 Chuẩn bị
Lấy 100 ml dung dịch TAE (TBE) 10X hoà chung với 900 ml nước khử ion, khuấy và lắc đều.
Bảo quản ở nhiệt độ phòng.
A.2 Dung dịch muối đệm phosphat (PBS)
A.2.1 Thành phần
| Natri clorua (NaCI) | 8 g |
| Natri hydro photphat dihydrat (Na2HPO4.2H2O) | 2,9 g |
| Kali dihydro photphat (KH2PO4) | 0,2 g |
| Kali clorua (KCI) | 0,2 g |
| Nước cất | 1000ml |
A.2.2 Chuẩn bị
Hòa tan các thành phần trên vào 1000 ml nước cất, khuấy và lắc đều.
Chỉnh pH về trung tính bằng dung dịch NaOH 1N hoặc dung dịch HCl 1N. Hấp vô trùng ở 121 °C trong 30 min.
Phụ lục B
(Tham khảo)
Quy trình tách chiết ARN
CẢNH BÁO: Việc tách chiết ARN có sử dụng hoá chất nguy hiểm và có khả năng gây hại nếu thao tác không cẩn thận. Do vậy, nên tránh tiếp xúc trực tiếp với da và hít phải hơi của các hoá chất này. Luôn luôn đeo găng tay, khẩu trang, mặc quần áo bảo hộ khi thực hiện các thao tác này.
B1. Tách chiết ARN bằng bộ kít lnvimag®virus DNA/RNA Mini Kit/ KF96
B1.1. Chuẩn bị hóa chất
Các hóa chất cần được chuẩn bị và bảo quản theo đúng hướng dẫn của bộ kít lnviMAG®Virus DNA/RNA Mini Kit/ KF96, Cat. No: 7441050100, với thể tích vừa đủ cho số lượng mẫu chiết tách, bao gồm:
(1) Dung dịch đệm Lysis Buffer RV
(2) Dung dịch rửa 1 (Wash 1)
(3) Dung dịch rửa 2 (Wash 2)
(4) Hỗn hợp hạt từ tính (Bead Mix)
(5) Dung dịch thu hồi DNA/RNA Elution Buffer (EB)
Nếu chiết tách ARN bằng máy chiết tách tự động Thermo Scientific™ KingFisher™ Flex, cần phải chuẩn bị trước các đĩa chứa dung dịch chiết tách theo hệ thống của máy như sau:
+ Đĩa Washing 1: 800μl dung dịch Wash 1/giếng;
+ Đĩa Washing Wash 2 và Washing Wash 3: 800μl dung dịch Wash 2/giếng;
+ Đĩa Elution Buffer: 100μl dung dịch EB/giếng.
B1.2. Tiến hành
- Huyễn dịch 10% của mẫu bệnh phẩm được rã đông, trộn đều bằng máy vortex. Ly tâm mẫu trong máy ly tâm lạnh với lực ly tâm 2500 g/15 min.
- Hút 200μl dịch trong bên trên sau khi ly tâm vào ống eppendorf 1,5ml vô trùng có chứa sẵn 200 μl dung dịch đệm Lysis. Trộn đều mẫu bằng máy vortex và spin để kéo các phần bám trên nắp ống xuống.
- Chuyển toàn bộ dung dịch trong ống eppendort vào đĩa chứa mẫu 96 giếng (mỗi giếng tương ứng với một mẫu chiết tách). Dùng giấy dán đĩa chuyên dụng dán kín mặt đĩa.
- Đặt đĩa lên máy lắc, ủ nhiệt (HLC-MHR23). Lắc dĩa với gia tốc 750 rpm/15 min, nhiệt độ 65 °C.
- Lấy đĩa ra khỏi máy lắc, để nguội trong 5 min, tháo bỏ giấy dán đĩa. Bổ sung 420 μl dung dịch Bead Mix (gồm có 400 μl Binding solution và 20 μl MAP) vào mỗi giếng.
- Chuyển tất cả các đĩa bao gồm: đĩa Tip Combs, đĩa Elution Buffer, đĩa Washing Wash 3, đĩa Washing Wash 2, đĩa Washing Wash 1 và đĩa chứa mẫu vào từng khay của máy chiết tách tự động theo hướng dẫn của máy.
- Chọn chương trình chiết tách ARN đã được cài đặt trước đó theo hướng dẫn của hãng sản xuất kít lnviMAG®Virus DNA/RNA Minii Kit/ KF96.
- Sau 34 min, quá trình chiết tách hoàn tất. Thu hồi ARN của từng giếng vào ống eppendorf 0.5 ml tương ứng đã ghi rõ ký hiệu mẫu.
- Bảo quản mẫu ARN ở 4 °C trong vài giờ và âm 20 °C đến âm 80 °C trong thời gian lâu hơn.
B.2. Tách chiết ARN bằng TACO RNA/DNA extraction Kít
B.2.1 Vật liệu: Bộ kít chiết tách TACO RNA/DNA extraction Kít (GeneReach Cat. No. atc-d/rna, 320 tests)
Ethanol tuyệt đối B.2.2 Chuẩn bị:
- Pha dung dịch đệm rửa A (washing buffer A) với 135 ml ethanol tuyệt đối
- Pha dung dịch đệm rửa B (washing buffer B) với 230 ml ethanol tuyệt đối
- Tiến hành theo sơ đồ
| Thuốc Thử | Lượng (μl) | Thuốc thử | Lượng (μl) |
| H | G | F | E | D | C | B | A |
| Ethanol tuyệt đối | 250 | - | - | ► 1 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa A | 750 | Hạt từ | 50 | ► 2 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa A | 750 | - | - | ► 3 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa B | 750 | - | - | ► 4 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa B | 750 | - | - | ► 5 |
|
|
|
|
|
|
|
|
| Nước đệm | 100 | - | - | ► 6 |
|
|
|
|
|
|
|
|
| Ethanol tuyệt đối | 250 | - | - | ► 7 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa A | 750 | Hạt từ | 50 | ► 8 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa A | 750 | - | - | ► 9 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa B | 750 | - | - | ► 10 |
|
|
|
|
|
|
|
|
| Dung dịch đệm rửa B | 750 | - | - | ► 11 |
|
|
|
|
|
|
|
|
| Nước đệm | 100 | - | - | ► 12 |
|
|
|
|
|
|
|
|
B.2.3 Chuẩn bị mẫu:
- Cho 250 μL/mẫu dung dịch đệm vào các ống eppendort.
- Cho 100 μL/mẫu vào ống eppendort chứa dung đệm.
- Lắc bằng máy lắc trộn votex (4.2.4) trong 15 s.
- Ly tâm 12000 g trong 1 min.
- Cho 350 μL (mẫu và dung dịch đệm) vào các giếng ở cột 1 hoặc 7.
B.2.4 Đưa mẫu vào máy TACO
- Đặt đĩa vào máy TACO
- Đặt lược vào máy TACO.
- Sử dụng máy TACO theo hướng dẫn sử dụng: Máy TACO tự động chiết tách trong khoảng 50 min.
- Thu 100 μL ARN từ các giếng trong cột 6 hoặc 12 sang các ống eppendort mới.
CHÚ Ý: Mẫu đối chứng âm và mẫu đối chứng dương đều được tách chiết ARN trong cùng thời điểm với mẫu cần phát hiện vi rút gây bệnh do vi rút TiLapia Lake trên cá rô phi.
B.3. Tách chiết ARN bằng bộ kít Invitrogen PureLink Viral RNA/DNA Mini Kit
B.3.1.Chuẩn bị hoá chất
Các hóa chất cần được chuẩn bị và bảo quản theo đúng hướng dẫn của bộ kít Invitrogen PureLink Viral RNA/DNA Mini Kit, Cat. No: 12280-050, với thể tích vừa đủ cho số lượng mẫu chiết tách, bao gồm:
- Proteinase K
- Dung dich đệm Lysis Buffer
- Dung dịch Carrier RNA
- Dung dịch Wash buffer (W5)
- Nước RNase-free (E3)
- Cách pha hỗn hợp dung dịch Carrier và Lysis Buffer
N x 0.21 mL = A mL
A mL x 28 μL/mL = B μL
Trong đó: N là số mẫu cần tách chiết
A là tổng số mL Lysis Buffer cần cho N mẫu;
B là tổng số μL Carrier RNA cần cho N mẫu.
B.3.2. Tiến Hành
1. Cho 25 μL Proteinase K vào ống eppendort 1,5 ml;
2. Cho 200 μL mẫu vào ống eppendorf chứa Proteinase K;
CHÚ Ý: nếu thể tích mẫu <200 μL thì có thể điều chỉnh thể tích mẫu cho đủ 200 μL bằng dung dịch PBS hoặc 0.9% NaCI.
3. Cho hỗn hợp dung dịch Lysis Buffer và Carrier RNA vào ống chứa mẫu; đóng nắp ống và vortex 15 s;
4. Ủ mẫu ở 56 °C trong 15 min;
5. Cho thêm 250 μL ethanol 96 % đến tuyệt đối vào ống mẫu; đóng nắp và vortex 15s;
6. Để ở nhiệt độ phòng 5 min;
CHÚ Ý: mẫu mô sau khi để ở nhiệt độ phòng 5 min thì đem ly tâm 12.000 vòng trong 2 min và lấy dịch nổi bên trên.
7. Chuyển toàn bộ mẫu tách chiết vào cột lọc;
8. Ly tâm cột lọc ở 12.000 vòng trong 2 min đến 3 min; chuyển cột lọc sang ống thu mới;
9. Cho 500 μL nước rửa Wash buffer (W5) vào cột lọc; ly tâm 12.000 vòng trong 2 min đến 3 min; Chuyển cột lọc sang ống thu mới;
10. Lặp lại bước 9 với 500 μL nước rửa Wash buffer (W5) một lần nữa;
11. Loại bỏ ống thu và chuyển cột lọc sang ống thu mới;
12. Ly tâm khô 12000 vòng trong 1 min cho khô sạch nước rửa W5;
13. Chuyển cột lọc sang ống eppendorf 1,5 μL;
14. Cho 10 μL đến 50 μL nước RNase-free (E3) (có sẵn) vào cột lọc;
15. Để ở nhiệt độ phòng 1 min; Ly tâm cột lọc ở 12000 vòng trong 1 min đến 2 min.
16. Lấy sản phẩm dưới cột lọc; Bảo quản mẫu ARN ở 4°C trong vài giờ và âm 20 °C đến âm 80 °C trong thời gian lâu hơn.
Phụ lục C
(Quy định)
Phương pháp Semi nested RT - PCR phát hiện TiLV.
C.1 Trình tự cặp mồi
Bảng C.1 - Trình tự cặp mồi[1]
| Tên mồi | Trình tự | Kích thước sản phẩm |
| EXT-1 | 5’- TATGCAGTACTTTCCCTGCC -3' | 415 bp |
| ME1 | 5'- GTTGGGCACAAGGCATCCTA -3’ | |
| ME2 | 5'- TATCACGTGCGTACTCGTTCAGT -3’ | 250 bp |
| ME1 | 5’- GTTGGGCACAAGGCATCCTA -3’ |
C.2 Thực hiện phản ứng Semi nested RT - PCR
Phương pháp Semi nested RT - PCR bao gồm 2 bước:
Bước 1: Phản ứng RT - PCR
Chuẩn bị dung dịch cho phản ứng sử dụng cặp mồi đã được chuẩn bị (3.3) và kít nhân gen (3.6) theo hướng dẫn của nhà sản xuất.
VÍ DỤ: Chuẩn bị MasterMix cho phản ứng RT-PCR theo kít Superscript® III One-Step RTPCR with Platinum® Taq. Cat: 12574-0263) hoặc kít tương đương theo hướng dẫn của nhà sản xuất.
Thành phần cho 1 phản ứng (xem bảng C.2).
Bảng C.2 - Thành phần phản ứng RT - PCR
| Thành phần | Nồng độ (μM) | Thể tích cho 1 phản ứng (μl) |
| Nước không có ARN/DNA |
| 7.5 |
| Dung dịch 2x Reaction Mix |
| 12.5 |
| Mồi EXT-1 | 10 | 1 |
| Mồi ME1 | 10 | 1 |
| EnZym |
| 1 |
| Tổng thể tích dung dịch đệm thực hiện phản ứng | 23 | |
Chuyển 23 μl hỗn hợp nhân gen vào mỗi ống phản ứng:
Mẫu đối chứng dương: Cho 2 μl mẫu ARN đã được giám định hoặc sử dụng các chủng chuẩn.
Mẫu đối chứng âm: Cho 2 μl nước tinh khiết không có nuclease.
Mẫu thử: Cho 2 μl mẫu kiểm tra vào ống phản ứng.
Tiến hành phản ứng RT - PCR bằng máy nhân gen (4.12) đã cài đặt chu trình nhiệt (xem Bảng C.3).
Bảng C.3 - Chu trình nhiệt của phản ứng RT - PCR
| Nhiệt độ (°C) | Thời gian | Số chu kỳ (vòng) |
| 50 | 30 min | 1 |
| 94 | 2 min | |
| 94 | 15 s | 25 |
| 60 | 30 s | |
| 68 | 60s | |
| 68 | 5 min | 1 |
Bước 2: Phản ứng Semi nested RT PCR
Chuẩn bị dung dịch cho phản ứng sử dụng cặp mồi đã được chuẩn bị (3.3) và kít nhân gen (3.7) theo hướng dẫn của nhà sản xuất.
VÍ DỤ: Kít Thermo Scienetific Dream Taq PCR Master Mix (2X), Cat. No: K 10714) theo hướng dẫn của nhà sản xuất (3.7)
Thành phần cho 1 phản ứng (xem bảng C.4).
Bảng C.4- Thành phần phản ứng Semi nested RT - PCR
| Thành phần | Nồng độ (μM) | Thể tích cho 1 phản ứng (μl) |
| Nước không có ARN/DNA |
| 8 |
| Dung dịch Master Mix 2X |
| 10 |
| Mồi ME2 | 10 | 0.5 |
| Mồi ME1 | 10 | 0.5 |
| Tổng thể tích dung dịch đệm thực hiện phản ứng | 19 | |
Chuyển 19 μl hỗn hợp nhân gen vào mỗi ống phản ứng:
Chuyển 1 μl sản phẩm bước 1 sang hỗn hợp mix
Tiến hành phản ứng Semi nested RT - PCR bằng máy nhân gen (4.12) đã cài đặt chu trình nhiệt (xem Bảng C.5).
Bảng C.5 - Chu trình nhiệt của phản ứng Semi nested RT - PCR
| Nhiệt độ (°C) | Thời gian | Số chu kỳ (vòng) |
| 95 | 2 min | 1 |
| 95 | 30 s | 25 |
| 60 | 30 s | |
| 72 | 60s | |
| 72 | 10 min | 1 |
CHÚ Ý:
+ Phản ứng Semi nested RT - PCR phải bao gồm: mẫu kiểm tra, mẫu kiểm chứng dương (mẫu chiết tách và mẫu chạy nhân gen) và mẫu kiểm chứng âm (mẫu chiết tách và mẫu chạy nhân gen);
+ Mẩu và nguyên liệu cho phản ứng Semi nested RT - PCR cần đặt trong khay đá lạnh trong suốt quá trình chuẩn bị hỗn hợp phản ứng;
+ Tùy theo kít sử dụng mà thành phần hỗn hợp phản ứng có thể khác nhau, việc thực hiện chuẩn bị hỗn hợp phản ứng nên tuân thủ theo hướng dẫn của kít được sử dụng.
Phụ lục D
(Quy định)
Phương pháp realtime RT - PCR phát hiện TiLV
D.1 Trình tự cặp mồi
Bảng D1 - Trình tự cặp mồi [5]
| Tên mồi và đoạn dò | Trình tự |
| TiLV-93F | AGCCTGCCACACAGAAG |
| TiLV-93R | CTGCTTGAGTTGTGCTTCT |
| Probe-TiLV93 | FAM-CTCTACCAGCTAGTGCCCCA - Iowa Black |
D.2 Thực hiện phản ứng realtime RT - PCR
Phương pháp realtime RT - PCR sử dụng cặp mồi TiLV-93F / TiLV-93R , dò TiLV 93 đã được chuẩn bị (3.4) sử dụng kít nhân gen realtime RT - PCR (3.2.6) theo hướng dẫn của nhà sản xuất.
VÍ DỤ: kít nhân gen QuantiTect Probe RT-PCR kit Cat.No: 2044435) (200) hoặc Kít nhân gen Invitrogen superscript III qRT-PCR kit Cat. No: 11732-020 (100)
Thành phần cho 1 phản ứng được nêu trong bảng D2:
Bảng D2 - Thành phần phản ứng realtime RT - PCR
| STT | Thành phần | Nồng độ, μM | Thể tích cho 1 phản ứng, μl |
| 1 | Nước không có ARN/ADN |
| 5.5 |
| 2 | Dung dịch SuperMix |
| 12,5 |
| 3 | Mồi THV-93F | 20 | 0,5 |
| 4 | Mồi TiLV-93R | 20 | 0,5 |
| 5 | Đoạn dò-TiLV 93 | 10 | 0,5 |
| 6 | EnZym |
| 0.5 |
| Tổng thể tích dung dịch đệm thực hiện phản ứng | 20 | ||
Chuyển 20 μl hỗn hợp nhân gen vào mỗi ống phản ứng:
- Mẫu kiểm chứng dương: Cho 5 μl mẫu ARN đã được giám định hoặc sử dụng các chủng TiLV chuẩn.
- Mẫu kiểm chứng âm: Cho 5 μl nước tinh khiết không có nuclease.
- Mẫu thử: Cho 5 μl mẫu ARN kiểm tra vào ống phản ứng.
Tiến hành phản ứng trong máy realtime PCR (4.13) đã cài đặt chu trình nhiệt được nêu trong bảng D3:
Bảng D3 - Chu trình nhiệt của phản ứng realtime RT - PCR
| Nhiệt độ, °C | Thời gian | Số chu kỳ (vòng) |
| 50 | 15 min | 01 |
| 95 | 2 min | 01 |
| 95 | 15 s | 40 |
| 60 (*) | 60 s |
CHÚ THÍCH: (*) Nhiệt độ và thời gian này phù hợp với máy Realtime PCR ABI 7500 và bộ kít nêu trên
CHÚ Ý:
+ Phản ứng realtime RT - PCR phải bao gồm: mẫu kiểm tra, mẫu kiểm chứng dương (mẫu chiết tách và mẫu chạy nhân gen) và mẫu kiểm chứng âm (mẫu chiết tách và mẫu chạy nhân gen);
+ Mẫu và nguyên liệu cho phản ứng realtime RT - PCR cần đặt trong khay đá lạnh trong suốt quả trình chuẩn bị hỗn hợp phản ứng;
+ Tùy theo kít sử dụng mà thành phần hỗn hợp phản ứng có thể khác nhau, việc thực hiện chuẩn bị hỗn hợp phản ứng nên tuân thủ theo hướng dẫn của kít được sử dụng.
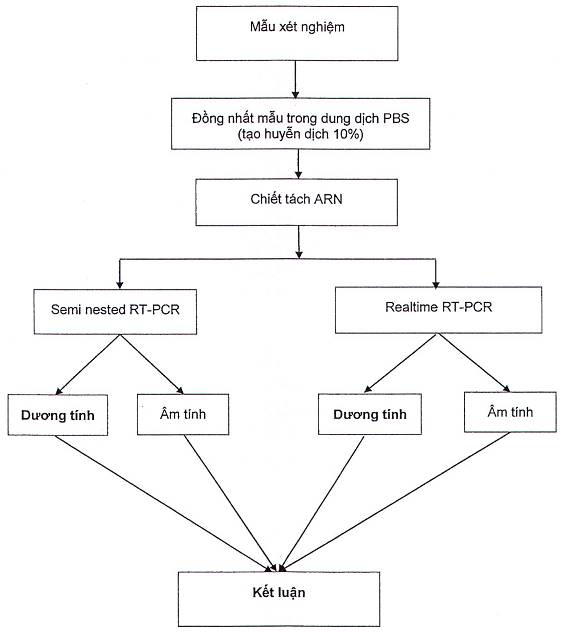
Phụ lục F
(Quy định)
Sơ đồ xét nghiệm TiLV
Thư mục tài liệu tham khảo
[1] H.T. Dong, S. Siriroob, W. Meemetta , W. Santimanawong , W. Gangnonngiw, N. Piraratd , P. Khunraea, T. Rattanarojponga R. Vanichviriyakitb , S. Senapin ,2017 Emergence oftilapia lake virus in Thailand and an alternative semi-nested RT-PCR for detection. Aquaculture. (476), 111-118.
[2] H.T.Dong, , S Siriroob , W Meemetta , W Santimanawong , W Gangnonngiw, N Piraratd , P Khunraea , T Rattanarojponga, R.Vanichviriyakitb, S. Senapin, 2017, A warning and an improved PCR detection method for tilapia lake virus (TiLV) disease in Thai tilapia farms. https://enaca.org/enclosure. php?id=858
[3] OIE/WOAH, 2020, Manual of Diagnostic Tests for Aquatic Animal, Tilapia lake virus (TiLV), Updated February 2018, Tilapia lake virus (TiLV) - Anovel orthomyxo-like virus.
[4] Mona Dverdal Jansen and Chadag Vishnumurthy Mohan, 2017, Tilapia lake virus (TiLV): Literature review. CGIAR Research Program on Fish Agri-Food Systems.Working Paper: FISH- 2017-04. (https://enaca.org/enclosure.php?id=914).
[5] Pitchaporn Waiyamitra, Puntanat Tattiyapong, Kwanrawee Sirikanchana, Skorn Mongkolsuk, Pamela Nicholsone, Win Surachetpong, 2018, A TaqMan RT-qPCR assay for tilapia lake virus (TiLV) detection in tilapia. Aquaculture (497)184-188
[6] TCCS 05:2017/TY-TS Quy trình xét nghiệm phát hiện Tiiapia Lake Virus trên cá rô phi bằng kỹ thuật Semi-nested Reverse Transeriptase PCR (Semi-nested RT PCR) do Cục Thú y ban hành
[7] Puntanat Tattiyapong, Worawan Dachavichitlead, Win Surachetpong, 2017, Experimental infection of Tilapia Lake Virus (TiLV) in Nile tilapia (Oreochromis niloticus) and red tilapia (Oreochromis spp.) Puntanat Tattiyapong et al. Vet Microbiol.
1) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
2) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương
3) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
4) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm của nhà cung cấp này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
5) Thông tin này đưa ra tạo điều kiện thuận tiện cho người sử dụng tiêu chuẩn và không ấn định sử dụng sản phẩm này. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 8710-27:2023 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 8710-27:2023 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 8710-27:2023 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 8710-27:2023 DOC (Bản Word)