- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 12560-2:2018 Phân bón vi sinh vật - Mật độ nấm rễ nội cộng sinh
| Số hiệu: | TCVN 12560-2:2018 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
28/12/2018 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 12560-2:2018
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 12560-2:2018
TIÊU CHUẨN QUỐC GIA
TCVN 12560-2:2018
PHÂN BÓN VI SINH VẬT - XÁC ĐỊNH MẬT ĐỘ NẤM RỄ NỘI CỘNG SINH - PHẦN 2: XÁC ĐỊNH KHẢ NĂNG CỘNG SINH CỦA CÁC CHỦNG NẤM RỄ NỘI CỘNG SINH VỚI CÂY TRỒNG
Biofertilizers - The determination of endomycorrhizae density - Part 2: The assessment of crop infectivity ability of the endomycorrhizae
Lời nói đầu
TCVN 12560-2:2018 do Viện Thổ nhưỡng Nông hóa biên soạn, Bộ Nông nghiệp và Phát triển nông thôn đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
PHÂN BÓN VI SINH VẬT - XÁC ĐỊNH MẬT ĐỘ NẤM RỄ NỘI CỘNG SINH - PHẦN 2: XÁC ĐỊNH KHẢ NĂNG CỘNG SINH CỦA CÁC CHỦNG NẤM RỄ NỘI CỘNG SINH VỚI CÂY TRỒNG
Biofertilizers - The determination of endomycorrhizae density - Part 2: The assessment of crop infectivity ability of the endomycorrhizae
1 Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp xác định khả năng xâm nhiễm của bào tử nấm rễ nội cộng sinh trong phân bón vi sinh vật bằng định lượng các thể xâm nhiễm (IP) có khả năng cộng sinh với cây trồng.
2 Tài liệu viện dẫn
Tài liệu viện dẫn sau là rất cần thiết cho việc áp dụng tiêu chuẩn. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 4851:1989 (ISO 3696:1987), Nước dùng cho phân tích trong phòng thí nghiệm - Yêu cầu kỹ thuật và phương pháp thử.
3 Thuật ngữ, định nghĩa
Tiêu chuẩn này áp dụng các thuật ngữ, định nghĩa được nêu trong TCVN 12560-1:2018 và các thuật ngữ, định nghĩa sau đây.
3.1
Thể xâm nhiễm nấm cộng sinh Mycorrhiza (infective propagueles, viết tắt là IP)
Những bào tử nấm rễ nội cộng sinh có hoạt tính trong phân bón vi sinh vật.
3.2
Điểm xâm nhiễm (infection points)
Điểm trên bề mặt rễ, nơi các thể xâm nhiễm tiếp xúc với rễ cây ký chủ, xâm nhập vào rễ, bắt màu xanh với thuốc nhuộm Trypan blue.
3.3
Tiềm năng xâm nhiễm (infectivity potential)
Khả năng của các bào tử nấm rễ nội cộng sinh có hoạt tính trong phân bón vi sinh vật xâm nhiễm vào hệ thống rễ của cây trồng.
3.4
Cây ký chủ (host crop)
Cây trồng mà nấm rễ nội cộng sinh Mycorrhiza sống cộng sinh và tạo sự xâm nhiễm vào hệ thống rễ.
4 Nguyên tắc
Các thể xâm nhiễm (IP) có khả năng cộng sinh khi tiếp xúc với rễ cây ký chủ, hình thành ra cấu trúc gọi là sợi áp (appressorium), làm cho sợi nấm phông lên, tạo điều kiện cho nấm Mycorrhiza xâm nhập vào rễ thông qua “điểm xâm nhiễm”. Các điểm xâm nhiễm trên bề mặt rễ bắt màu xanh với thuốc nhuộm Trypan blue; Đếm số lượng các điểm xâm nhiễm dưới kính hiển vi nổi hoặc hiển vi thường. Tổng số các thể xâm nhiễm trong mẫu thử chính bằng số lượng điểm xâm nhiễm.
5 Thuốc thử và vật liệu
Sử dụng các loại hóa chất tinh khiết phân tích để pha các loại dung dịch, thuốc thử, chất chuẩn.
5.1 Nước, đáp ứng các yêu cầu của nước loại 3 trong TCVN 4851:1989 (ISO 3969:1987).
5.2 Dung dịch KOH 10 %
Cân 100 g KOH trên cân phân tích (6.1), chính xác đến 0,001 g, cho vào bình định mức dung tích 1 000 mL (6.13), thêm nước (5.1) đến vạch định mức, lắc đều.
5.3 Dung dịch lactoglyxerol
Dùng pipet (6.15), ống đong (6.11) lấy chính xác 33,3 mL axit lactic 98 % (5.11) cho vào cốc dung tích 100 mL (6.12), sau đó bổ sung 33,3 mL glyxerol 99,7 % (5.10) và 33,3 mL nước (5.1), khuấy đều.
5.4 Thuốc nhuộm trypan blue trong lactoglyxerol
Cân 0,05 g trypan blue bằng cân phân tích (6.1), chính xác đến 0,001 g, cho vào cốc dung tích 100 mL (6.12) có chứa 99,9 mL lactoglyxerol (5.3), khuấy đều.
5.5 Dung dịch H2O2 kiềm
Dùng pipet (6.15) lấy 3 mL dung dịch amoniac 25 % (5.9) cho vào cốc dung tích 100 mL (6.12), thêm 30 mL dung dịch H202 10 % (5.6) và 67 mL nước (5.1). Dung dịch được pha ngay trước khi sử dụng.
5.6 Dung dịch H2O2 10 %
Dùng pipet (6.15) lấy 10 mL dung dịch H2O2 30 % (5.12) cho vào cốc dung tích 100 mL (6.12), thêm 20 mL nước (5.1), khuấy đều.
5.7 Dung dịch HCl 1 %
Dùng pipet (6.15) lấy 27,4 mL dung dịch HCI 36,5 % (5.13) cho từ từ vào cốc dung tích 1 000 mL (6.12) có chứa sẵn 500 mL nước (5.1), khuấy đều bằng đũa thủy tinh (6.14), thêm nước (5.1) đến vạch định mức.
CHÚ THÍCH 1: Đổ từ từ axit đặc vào cốc đong bằng cách để axit chảy từ từ dọc theo đũa thủy tinh. Trong quá trình này phải khuấy nhẹ và đều dung dịch để nhiệt hòa tan tỏa ra được phân tán.
5.8 Dung dịch glyxerot 50 %
Dùng ống đong (6.11) lấy 50 mL dung dịch glyxerol 99,7 % (5.10) cho vào cốc dung tích 100 mL (6.12) , thêm 50 mL nước (5.1).
5.9 Dung dịch ammoniac, nồng độ 25 %
5.10 Glyxerol, nồng độ 99,7 %
5.11 Axit lactic, nồng độ 98 %
5.12 H2O2, nồng độ 30 %
5.13 HCI, nồng độ 36,5 %
5.14 Cát sạch, trung tính, được rửa sạch nhiều lần bằng nước sạch.
5.15 Hạt giống cây ký chủ, hạt ngô, giống đã được xác nhận.
6 Thiết bị, dụng cụ
Sử dụng các thiết bị, dụng cụ thông thường trong phòng thí nghiệm và cụ thể như sau:
6.1 Cân phân tích, có độ chính xác đến 0,001 g.
6.2 Kính hiển vi soi nổi hoặc kính hiển vi thường, có trường sáng, độ khuếch đại không ít hơn 70 lần.
6.3 Nồi hấp áp lực, áp suất tối thiểu 101,3 kPa, nhiệt độ 121 °C.
6.4 Tủ sấy, có thể kiểm soát nhiệt độ từ 40 °C đến 260 °C.
6.5 Chậu trồng cây, bằng nhựa trung tính hoặc thép không gỉ hoặc gốm, kích thước R x D = 20 cm x 17 cm.
6.6 Kéo cắt, bằng thép không gỉ.
6.7 Panh, bằng thép không gỉ.
6.8 Đĩa petri hoặc khay, bằng nhựa hoặc thủy tinh trung tính, có lưới chia ô vuông.
6.9 Lam kính, bằng thủy tinh trung tính.
6.10 Lamen, bằng thủy tinh trung tính.
6.11 Ống đong, dung tích 100 mL.
6.12 Cốc, dung tích 100 mL, 500 mL, 1 000 mL.
6.13 Bình định mức, dung tích 100 mL, 1 000 mL.
6.14 Đũa, bằng thủy tinh trung tính.
6.15 Pipet (Micropipet), dung tích 1 mL, 10 mL.
7 Chuẩn bị
7.1 Chuẩn bị dụng cụ, nguyên liệu
Các dụng cụ, cát sạch sử dụng trong chuẩn bị, nuôi cây ký chủ, thu mẫu, nhuộm màu, ... phải được khử trùng bằng 1 trong 2 cách sau:
- giữ ở nhiệt độ 121 °C không ít hơn 30 min trong nồi hấp áp lực (6.3) sau đó sấy khô trong tủ sấy (6.4) hoặc;
- giữ ở nhiệt độ 180 °C không ít hơn 2 h trong tủ sấy (6.4).
7.2 Chuẩn bị mẫu
Trộn đều 500 g mẫu thử với 5 kg cát sạch (5.14), sau đó cho vào chậu (6.5) đã được chuẩn bị sẵn (7.1);
Làm ẩm cát trước khi gieo hạt (độ ẩm từ 50 % đến 60 %). Mỗi chậu gieo 3 hạt ngô (5.15);
Nuôi cây trong 25 ngày khi nhiệt độ môi trường lớn hơn 25 °C hoặc 35 ngày khi nhiệt độ môi trường nhỏ hơn 25 °C; Độ ẩm tương đối từ 70 % đến 74 %; Hai ngày tưới nước một lần;
Thu hoạch toàn bộ rễ cây trong chậu, dùng nước sạch dội nhẹ để rửa sạch cát bám trên bề mặt rễ;
Mỗi mẫu lặp lại ba lần.
8 Cách tiến hành
Cắt rễ thành các đoạn có chiều dài khoảng 1 cm bằng kéo cắt (6.6) và panh (6.7);
Đo tổng chiều dài rể của mỗi mẫu bằng phương pháp đường giao nhau (xem Điều A.1, phụ lục A);
Chọn ngẫu nhiên 100 đoạn rễ;
Nhuộm rễ bằng thuốc nhuộm Trypan blue (5.4) (Xem Điều A.2, phụ lục A);
Làm tiêu bản trên lam kính (6.9) và lamen (6.10), quan sát dưới kính hiển vi (6.2), ghi nhận đoạn rễ có quan sát thấy nấm rễ (xem Điều B2, phụ lục B);
Đếm số điểm xâm nhiễm có trong 100 đoạn rễ.
9 Tính kết quả
Tổng số thể xâm nhiễm trong 1 gram mẫu thử (m), được tính theo công thức:
| | (9.1) |
Trong đó:
m là tổng số thể xâm nhiễm, tính bằng thể xâm nhiễm (IP)
A là số điểm xâm nhiễm có trong 100 đoạn rễ, tính bằng điểm xâm nhiễm
d là tổng chiều dài rễ, tính bằng xentimet (cm)
50 000 là hệ số (bằng 100 đoạn rễ x 1 cm đoạn rễ được cắt x 500 g mẫu)
Nếu độ lặp lại được kiểm tra, thì nêu kết quả cuối cùng thu được.
10 Báo cáo thử nghiệm
Báo cáo thử nghiệm phải bao gồm ít nhất các thông tin sau:
- Mọi thông tin cần thiết để nhận biết đầy đủ về mẫu thử;
- Phương pháp thử đã sử dụng: viện dẫn tiêu chuẩn này;
- Tất cả các thao tác không quy định trong tiêu chuẩn này, cùng với các chi tiết bất thường nào khác có thể ảnh hưởng đến kết quả;
- Các kết quả thử nghiệm thu được.
Phụ lục A
(Quy định)
Phương pháp đo tổng chiều dài rễ của theo điểm giao nhau và nhuộm rễ bằng thuốc nhuộm trypan blue
A.1 Phương pháp đo tổng chiều dài rễ của theo điểm giao nhau
Trải đều các đoạn rễ đã cắt (kích cỡ khoảng 1 cm) vào lưới ô vuông;
Đếm tổng số điểm giao nhau giữa đoạn rễ với các đường kẻ ngang và kẻ dọc của lưới ô vuông (xem Điều B1, phụ lục B);
Chiều dài rễ (D), được tính theo công thức:
| | (cm) |
Trong đó:
D là chiều dài rễ, tính bằng xentimet (cm)
11/14 là hằng số
A là tổng số lượng điểm giao nhau, tính bằng điểm (d)
B là kích thước cạnh ô vuông, tính bằng xentimet (cm)
A.2 Nhuộm rễ bằng thuốc nhuộm Trypan blue
Rửa rễ thật kỹ dưới vòi nước máy;
Cho rễ vào cốc thủy tinh dung tích 500 mL (6.12) có chứa dung dịch KOH 10 % (5.2) trong khoảng thời gian từ 15 min đến 30 min;
Loại bỏ dung dịch KOH 10 %;
Rửa sạch rễ trong cốc bằng nước máy không ít hơn 3 lần sao cho nước sau khi rửa không còn xuất hiện màu nâu;
Nhúng ngập rễ trong dung dịch H2O2 kiềm (5.5) ở nhiệt độ phòng trong 10 min hoặc cho đến khi rễ có màu trắng;
Rửa sạch rễ không ít hơn 3 lần bằng nước máy để loại bỏ hết H2O2 kiềm;
Ngâm rễ bằng dung dịch HCl 1 % (5.7) trong khoảng thời gian từ 3 min đến 4 min;
Loại bỏ dung dịch HCl 1 %;
Nhuộm rễ bằng dung dịch nhuộm trypan blue 0,05 % (5.4) trong 12 h;
Đặt rễ vào trong các đĩa petri (6.8) chứa sẵn dung dịch glyxerol 50 % (5.8) trong 12 h; Các điểm xâm nhiễm bắt màu xanh (xem Điều B2, phụ lục B).
Phụ lục B
(Tham khảo)
Cách tính minh họa để đo tổng chiều dài rễ theo phương pháp đường giao nhau và hình ảnh minh họa điểm xâm nhiễm sau khi nhuộm rễ, soi trên kính hiển vi
B.1 Cách tính minh họa để đo tổng chiều dài rễ theo phương pháp đường giao nhau
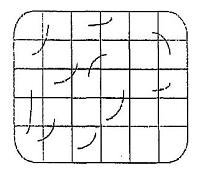
- Tổng số đoạn rễ giao nhau với dường ngang (Horizontal intersects -HI) = 2 + 2 + 2 + 2 = 8 HI
- Tổng số đoạn rễ giao nhau với đường dọc (Vertical intersects - VI) = 2 + 1 + 2 + 0 + 2 = 7 VI
- Tổng đoạn rễ nằm trên các đường giao = HI + VI = 8 + 7 = 15
- Tổng chiều dài đoạn rễ
(cm)
B.2 Hình ảnh minh họa điểm xâm nhiễm sau khi nhuộm rễ, soi trên kính hiển vi
Điểm xâm nhiễm ở mặt ngoài rễ, bắt màu xanh nhạt, ký hiệu là entry point. Lông hút không bắt màu, ký hiệu là rh.
Thư mục tài liệu tham khảo
[1] National Centre of Organic Farming Department of Agriculture and Cooperation, Ministry of Agriculture, Govt of India, CGO-II, Kamla Nehru Nagar Ghaziabad, 201 001, Uttar Pradesh. 1985. Biofertilizers and Organic Fertilizers in Fertilizer (Control) Order, pp. 34 - 38.
[2] Brundrett. Mark et. Al. 1996. Working with Mycorrhiza in Forestry and Agriculture. Canberra, Australia, pp. 141 - 252.
[3] Carter M. R. 1993. Soil sampling and methds of analysis. Canadian society of soil scien. Lewis publishers.
[4] Trần Văn Mão. 2002. Sử dụng côn trùng và vi sinh vật có ích. Tập 2: Sử dụng vi sinh vật có ích. Nhà xuất bản Nông nghiệp, trang 247 - 276.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 12560-2:2018 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 12560-2:2018 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 12560-2:2018 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 12560-2:2018 DOC (Bản Word)