- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Việt Nam TCVN 7596:2007 Xác định aflatoxin B1' và hàm lượng aflatoxin B1, B2, G1 và G2 trong ngũ cốc
| Số hiệu: | TCVN 7596:2007 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Khoa học-Công nghệ , Thực phẩm-Dược phẩm |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
19/06/2007 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 7596:2007
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 7596:2007
TIÊU CHUẨN VIỆT NAM
TCVN 7596 : 2007
THỰC PHẨM – XÁC ĐỊNH AFLATOXIN B1 VÀ HÀM LƯỢNG TỔNG SỐ AFTATOXIN B1, B2, G1 VÀ G2 TRONG NGŨ CỐC, CÁC LOẠI HẠT VÀ CÁC SẢN PHẨM CỦA CHÚNG – PHƯƠNG PHÁP SẮC KÝ LỎNG HIỆU NĂNG CAO
Foodstuffs – Determination of aflatoxin B1, and the total content of aflatoxin B1, B2, G1 and G2 in cereals, nuts and derived products – High-performance liquid chromatographic method
Lời nói đầu
TCVN 7596:2007 hoàn toàn tương đương với ISO 16050:2003;
TCVN 7596:2007 do Ban kỹ thuật tiêu chuẩn TCVN/TC/F13 Phương pháp phân tích và lấy mẫu biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
THỰC PHẨM – XÁC ĐỊNH AFLATOXIN B1 VÀ HÀM LƯỢNG TỔNG SỐ AFTATOXIN B1, B2, G1 VÀ G2 TRONG NGŨ CỐC, CÁC LOẠI HẠT VÀ CÁC SẢN PHẨM CỦA CHÚNG – PHƯƠNG PHÁP SẮC KÝ LỎNG HIỆU NĂNG CAO
Foodstuffs – Determination of aflatoxin B1, and the total content of aflatoxin B1, B2, G1 and G2 in cereals, nuts and derived products – High-performance liquid chromatographic method
CẢNH BÁO – Khi áp dụng tiêu chuẩn này có thể liên quan đến các vật liệu và các thao tác nguy hiểm. Tiêu chuẩn này không đề cập đến tất cả các vấn đề về an toàn có liên quan trong việc sử dụng chúng. Người sử dụng tiêu chuẩn này phải tự thiết lập các thực hành liên quan đến sức khỏe và an toàn thích hợp và xác định khả năng áp dụng các giới hạn qui định trước khi sử dụng tiêu chuẩn.
1. Phạm vi áp dụng
Tiêu chuẩn này qui định phương pháp sắc ký lỏng hiệu năng cao pha đảo có cột ái lực miễn nhiễm làm sạch và dẫn xuất sau cột để xác định aflatoxin trong ngũ cốc, các loại hạt và các sản phẩm của chúng. Giới hạn định lượng của aflatoxin B1 và tổng hàm lượng aflatoxin B1, B2, G1 và G2 là 8 ![]() /kg.
/kg.
Phương pháp đã được kiểm tra xác nhận trên ngô chứa 24,5 ![]() /kg, trên bơ lạc 8,4
/kg, trên bơ lạc 8,4 ![]() /kg, và trên hạt lạc nguyên liệu chứa 16
/kg, và trên hạt lạc nguyên liệu chứa 16 ![]() /kg aflatoxin tổng số. Phương pháp này cũng có thể áp dụng cho các sản phẩm hạt có dầu, quả khô và các sản phẩm của chúng.
/kg aflatoxin tổng số. Phương pháp này cũng có thể áp dụng cho các sản phẩm hạt có dầu, quả khô và các sản phẩm của chúng.
2. Tài liệu viện dẫn
Các tài liệu viện dẫn sau là rất cần thiết cho việc áp dụng tiêu chuẩn. Đối với các tài liệu viện dẫn ghi năm ban hành thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm ban hành thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi.
TCVN 4851-89 (ISO 3696:1987) Nước dùng để phân tích trong phòng thí nghiệm. Yêu cầu kỹ thuật và phương pháp thử.
3. Nguyên tắc
Mẫu thử được chiết bằng hỗn hợp metanol và nước. Mẫu chiết được lọc, pha loãng bằng nước và cho vào cột ái lực chứa các kháng thể đặc hiệu đối với aflatoxin B1, B2, G1 và G2. Các aflatoxin được tách, làm sạch và cô đặc trên cột sau đó được lấy ra khỏi các kháng thể bằng metanol. Các aflatoxin được định lượng bằng sắc ký lỏng hiệu năng cao (HPLC) pha đảo, phát hiện bằng huỳnh quang và dẫn xuất sau cột.
4. Thuốc thử
Chỉ sử dụng thuốc thử tinh khiết phân tích, trừ khi có các qui định khác.
4.1. Nước, theo loại 1 của TCVN 4851-89 (ISO 3696:1987).
4.2. Natri clorua.
4.3. Iôt, tinh thể hoặc pyridinium hydrobromid perbromid (PBPB)1)
4.4. Aflatoxin, dạng tinh thể hoặc viên nang.
CẢNH BÁO: Aflatoxin là chất gây ung thư cho người. Chú ý lời cảnh báo của Tổ chức Quốc tế Nghiên cứu về bệnh ung thư (Tổ chức Y tế Thế giới) (xem [1], [2]).
Phòng phân tích cần tránh ánh sáng mặt trời. Điều này có thể đạt được hiệu quả bằng cách sử dụng tấm hấp thụ tia cực tím (UV) qua cửa sổ kết hợp với ánh sáng dịu (không trực tiếp) hoặc tấm chắn hoặc che kết hợp với ánh sáng nhân tạo (có thể chấp nhận đèn huỳnh quang).
4.5. Axetonitril, loại dùng cho HPLC.
4.6. Metanol, loại dùng cho phân tích.
4.7. Metanol, loại dùng cho HPLC.
4.8. Toluen, loại phân tích.
CẢNH BÁO: Toluen dễ cháy và nguy hiểm. Vì vậy, khi chuẩn bị chất chuẩn phải sử dụng dung môi này cần được thực hiện trong tủ hút. Các thao tác bên ngoài tủ hút như việc đo các chất chuẩn bằng sắc phổ UV, phải được thực hiện với các chất chuẩn trong các vật chứa kín.
4.9. Hỗn hợp toluen/axetonitril
Trộn 98 phần thể tích của toluen (4.8) với 2 phần thể tích của axetonitril (4.5) (xem cảnh báo trong 4.8).
4.10. Dung môi chiết
Trộn 7 phần thể tích metanol (4.6) với 3 phần thể tích nước (4.1).
Các hỗn hợp dung môi chiết khác thích hợp với pha động có thể cũng được sử dụng nếu chứng minh được có hiệu quả hơn hoặc được khuyến cáo bởi nhà sản xuất về cột ái lực miễn nhiễm (IA).
4.11. Pha động
Trộn 3 phần thể tích nước (4.1) với 1 phần thể tích axetonitril (4.5) và 1 phần thể tích metanol (4.7). Khử khí dung dịch trước khi sử dụng.
4.12. Thuốc thử dẫn xuất sau cột
Hòa tan 100 mg iôt (4.3) trong 2 ml metanol (4.6). Thêm 200 ml nước (4.1), khuấy trong 1 giờ, sau đó lọc qua màng lọc 0,45![]() (5.8). Chuẩn bị dung dịch trong tuần sử dụng, bảo quản dung dịch nơi tối hoặc chai thủy tinh màu nâu. Trước khi sử dụng, khuấy dung dịch trong 10 phút.
(5.8). Chuẩn bị dung dịch trong tuần sử dụng, bảo quản dung dịch nơi tối hoặc chai thủy tinh màu nâu. Trước khi sử dụng, khuấy dung dịch trong 10 phút.
Cách khác, hòa tan 50 mg PBPB (4.3) trong 1000 ml nước. Dung dịch này có thể được sử dụng trong vòng 4 ngàyy nếu được bảo quản nơi tối ở nhiệt độ phòng.
4.13. Dung dịch gốc Aflatoxin B1, B2, G1 và G2
CẢNH BÁO: Bảo quản dung dịch chứa aflatoxin tránh ánh sáng (để nơi tối, sử dụng lá nhôm hoặc dụng cụ thủy tinh màu hổ phách).
Hòa tan aflatoxin B1, B2, G1 và G2 riêng biệt trong hỗn hợp toluen/axetonitril (4.9) để có được các dung dịch riêng rẽ chứa 10 ![]() .
.
Để xác định nồng độ chính xác của aflatoxin trong từng dung dịch gốc, thì ghi lại đường hấp thụ ở bước sóng từ 330 nm đến 370 nm trong cuvet thủy tinh thạch anh 1 cm (5.7) sử dụng máy đo quang phổ (5.6) với hỗn hợp toluen/axetonitril (4.9) làm đối chứng. Tính nồng độ của từng loại aflatoxin, pi, tính bằng microgam trên mililít, sử dụng công thức (1):
pi = 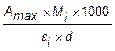 (1)
(1)
trong đó
Amax là độ hấp thụ được xác định ở mức tối đa của đường hấp thụ;
Mi là khối lượng phân tử của từng aflatoxin, tính bằng gam;
![]() là hệ số hấp thụ phân tử của từng loại aflatoxin trong toluen/axetonitril;
là hệ số hấp thụ phân tử của từng loại aflatoxin trong toluen/axetonitril;
CHÚ THÍCH: Giá trị này được xác định trong dung dịch chứa aflatoxin c = 1 mol/l và trong cuvet có chiều dài đường quang d = 1 cm. Hệ số hấp thụ phân tử (![]() ) thường được đưa ra mà không có đơn vị đo, nhưng có thể tính được từ công thức A=
) thường được đưa ra mà không có đơn vị đo, nhưng có thể tính được từ công thức A= ![]() x c x d, đơn vị sau đây có thể thu được để tính l.mol-1 . cm-1.
x c x d, đơn vị sau đây có thể thu được để tính l.mol-1 . cm-1.
d là chiều dài đường quang của cuvét, tính bằng centimet.
Mi và ![]() được đưa ra trong Bảng 1.
được đưa ra trong Bảng 1.
Bảng 1 – Khối lượng phân tử và hệ số hấp thụ phân tử của aflatoxin B1, B2, G1 và G2
| Aflatoxin | Mi |
|
| B1 | 312 | 19 300 |
| B2 | 314 | 20 400 |
| G1 | 328 | 16 600 |
| G2 | 330 | 17 900 |
| CHÚ THÍCH: Hỗn hợp của toluen và axetonitril (98 + 2) được sử dụng làm dung môi. | ||
4.14. Dung dịch gốc của hỗn hợp aflatoxin
Chuẩn bị dung dịch gốc có chứa 500 ng/ml aflatoxin B1, 125 ng/ml aflatoxin B2, 250 ng/ml aflatoxin G1 và 125 ng/ml aflatoxin G2 trong toluen/axetonitril (4.9). Nếu cần bảo quản dung dịch, thì cân bình trước khi bảo quản. Gón kín bình bằng lá nhôm và bảo quản ở nhiệt độ khoảng 4 oC. Ngay trước khi sử dụng, cân lại bình và ghi lại bất kỳ sự thay đổi nào về khối lượng sau khi bảo quản.
CHÚ THÍCH: Thông thường việc phơi nhiễm dưới ánh sáng UV trong suốt quá trình đo độ hấp thụ dẫn đến không quan sát được sự thay đổi phản ứng quang hóa.
4.15. Dung dịch chuẩn của hỗn hợp aflatoxin
Chuyển từng lượng dung dịch gốc aflatoxin đã trộn (4.14) theo qui định trong bảng 2 vào dãy bốn bình định mức 2 ml (5.5). Làm bay hơi dung dịch cho đến khô dưới dòng khí nitơ ở nhiệt độ phòng. Thêm 1 ml metanol (4.6) vào mỗi bình. Hòa tan cặn khô vào đó, pha loãng dung dịch đến vạch bằng nước (4.1) và trộn đều. Chuẩn bị dung dịch mới trong ngày để sử dụng.
Bảng 2 – Chuẩn bị dung dịch chuẩn
| Dung dịch chuẩn | Thể tích được lấy từ dung dịch gốc µl | Nồng độ của aflatoxin | |||
| B1 | B2 | G1 | G2 | ||
| 1 | 60 | 15,0 | 3,75 | 7,50 | 3,75 |
| 2 | 40 | 10,0 | 2,50 | 5,00 | 2,50 |
| 3 | 20 | 5,00 | 1,25 | 2,50 | 1,25 |
| 4 | 10 | 2,50 | 0,625 | 1,25 | 0,625 |
| CHÚ THÍCH: Các giá trị đã cho chỉ là hướng dẫn. Dãy chuẩn bao gồm các nồng độ của các mẫu. | |||||
4.16. Axit sulfuric, c(H2SO4) = 2 mol/l.
5. Thiết bị, dụng cụ
Ngâm dụng cụ thủy tinh phòng thử nghiệm đã tiếp xúc với dung dịch aflatoxin trong axit sulfuric (4.16) trong vài giờ, sau đó tráng kỹ (ví dụ ba lần) bằng nước để loại bỏ hết vết axit. Kiểm tra axit đã hết hay chưa hết bằng đo pH.
CHÚ THÍCH: Việc xử lý này là cần thiết vì nếu sử dụng dụng cụ thủy tinh không rửa bằng axit có thể làm thất thoát aflatoxin. Trong thực tế, việc xử lý này là cần thiết đối với các bình đáy tròn, bình định mức, ống đong, các lọ hoặc ống được dùng cho các dung dịch hiệu chuẩn và các dịch chiết cuối cùng (đặc biệt là các lọ mẫu tự động) và pipet Pasteur nếu chúng được dùng để chuyển dung dịch hiệu chuẩn hoặc dịch chiết.
Sử dụng các thiết bị thí nghiệm thông thường và cụ thể là:
5.1. Cột ái lực miễn nhiễm (IA)
Cột IA chứa các kháng thể hỗ trợ aflatoxin B1, B2, G1 và G2. Cột phải có khả năng liên kết tối thiểu không được nhỏ hơn 100 ng aflatoxin B1. Cột phải có độ thu hồi không nhỏ hơn 80 % đối với aflatoxin B1, B2, G1 và G2 và không nhỏ hơn 60 % đối với aflatoxin G1, khi một dung dịch chuẩn trong 15 ml hỗn hợp metanol/nước [1 phần metanol (4.6) và 3,4 phần nước (4.1) (theo thể tích)] có chứa 5 ng của mỗi aflatoxin được đưa lên cột [A, Cột IA phải được trang bị một nguồn chứa dung môi thích hợp (ví dụ, xy ranh có ống nối).
Nên tiến hành đo độ thu hồi đối với mỗi loại chất nền mà phương pháp này đã được sử dụng.
5.2. Máy trộn, có bình trộn 500 ml và nắp.
Nên sử dụng máy trộn tốc độ cao.
5.3. Giấy lọc gấp nếp, ví dụ đường kính 24 cm.
5.4. Giấy lọc vì sợi thủy tinh2), ví dụ đường kính 11 cm.
5.5. Bình định mức, loại A, dung tích 2 ml.
5.6. Máy đo quang phổ, có thể đo ở bước sóng trong khoảng từ 200 nm đến 400 nm.
5.7. Cuvét thạch anh, có chiều dài đường quang 1 cm và không hấp thụ đáng kể ở bước sóng từ 300 nm đến 370 nm.
5.8. Màng lọc đối với các dung dịch pha lỏng, bằng polytetrafluoroethylen (PTFE), có đường kính 4 mm và cỡ lỗ 0,45 ![]() .
.
5.9. Thiết bị HPLC, bao gồm:
5.9.1. Máy HPLC, có thể tạo ra tốc độ dòng 1 ml/phút.
5.9.2. Bộ bơm mẫu, có vòng bơm nạp 50 ![]() hoặc tương đương.
hoặc tương đương.
5.9.3. Cột tách phân tích pha đảo, ví dụ C18, có thể đảm bảo được đường nền cho các pic aflatoxin với aflatoxin B1, B2, G1 và G2 phân biệt được với các pic khác, có các đặc tính sau đây:
- chiều dài: 250 mm;
- đường kính trong: 4,6 mm;
- cỡ hạt hình cầu; 5![]() .
.
Có thể sử dụng các cột ngắn hơn.
5.9.4. Hệ thống dẫn xuất sau cột, gồm bơm không xung và chi tiết chữ T có thể tích chiết rất thấp, có ống nối bằng polytetrafluoroethylen (PTFE) hoặc thép không gỉ dài từ 3 000 mm đến 5000 mm và đường kính trong 0,5 mm và buồng cột hoặc bộ phản ứng sau cột đối với phản ứng iôt.
5.10. Detector huỳnh quang, có bước sóng kích thích 365 nm và bước sóng phát xạ 435 nm (đối với các thiết bị dùng kính lọc; bước sóng phát xạ > 400 nm), có khả năng phát hiện ít nhất 0,05 ng aflatoxin B1 trên một thể tích bơm (trong trường hợp này là 50 ![]() ).
).
6. Cách tiến hành
6.1. Khái quát
Các dung dịch mẫu và dung dịch chuẩn dùng cho phép xác định HPLC phải chứa cùng một loại dung dịch hoặc hỗn hợp dung môi.
6.2. Chiết
Cân 25 g mẫu thử đã đồng hóa, chính xác đến 0,1 g, cho vào bình trộn (5.2). Thêm 5 g natri clorua (4.2) và 125 ml dung môi chiết (4.10) và đồng hóa bằng máy trộn trong 2 phút ở tốc độ cao. Kiểm tra để đảm bảo thời gian trộn và tốc độ trộn không được ảnh hưởng đến hiệu quả chiết. Lọc hỗn hợp qua giấy lọc gấp nếp (5.3) (V1).
Dùng pipet lấy 15 ml (V2) dịch lọc cho vào bình nón có kích cỡ thích hợp có nắp đậy thủy tinh. Thêm 30 ml nước, đậy nắp bình và trộn. Trước khi bắt đầu cho chạy sắc ký cột ái lực, lọc dịch chiết đã pha loãng qua giấy lọc vi sợi thủy tinh (5.4). Dịch lọc (V3) phải trong. Nếu không trong phải lọc lại. Tiến hành ngay theo 6.3.
Để thu được dung dịch trong có thể cần phải ly tâm.
6.3. Làm sạch
Chuẩn bị cột IA (5.1) và tiến hành quy trình làm sạch theo các hướng dẫn của nhà sản xuất. Dùng pipet lấy 15 ml (V4) của dịch lọc thứ hai (V3) cho vào trong bình chứa dung môi của cột IA. Cho đi qua cột tách, sau đó rửa cột như mô tả trong hướng dẫn của nhà sản xuất và loại bỏ chất rửa giải. Bắt đầu rửa giải các aflatoxin. Thu lấy chất rửa giải metanol hoặc axetonitril (tùy thuộc vào sản phẩm hoặc các hướng dẫn của nhà sản xuất) cho vào bình định mức 2 ml (5.5) (hoặc thể tích khác theo qui định của nhà sản xuất). Pha loãng bằng nước đến vạch (V5). Trộn và tiến hành theo 6.4.
Phương pháp để nạp lên cột IA, rửa và rửa giải hơi khác nhau giữa các hãng sản xuất cột và các hướng dẫn cụ thể đối với các loại cột cần phải tuân thủ một cách chính xác.
CHÚ THÍCH: Nhìn chung các qui trình bao gồm việc chiết mẫu bằng hỗn hợp metanol và nước, lọc hoặc ly tâm, pha loãng mẫu bằng dung dịch đệm phosphat (PBS) hoặc nước, nạp dưới áp suất lên cột đã được rửa trước, rửa cột bằng nước cất và rửa giải aflatoxin bằng metanol hoặc axetonitril (phụ thuộc vào sản phẩm và các hướng dẫn của nhà sản xuất)
Cột sillica gel hoặc cột chiết pha rắn (SPE) truyền thống có thể được sử dụng. Trong trường hợp này cần phải thực hiện chính xác các hướng dẫn của nhà sản xuất. Nếu dung môi được sử dụng để rửa giải aflatoxin không thích hợp với pha động, thì sau đó chất rửa giải phải được làm bay hơi đến khô bằng khí
V6 là thể tích của dịch chiết mẫu (6.7) đã được làm sạch và bơm, tính bằng microlit (V6 = 50 ![]() );
);
mi là khối lượng của từng aflatoxin i có mặt trong thể tích bơm, tương ứng với diện tích pic đã đo hoặc chiều cao pic đọc được ở đường chuẩn, tính bằng nanogam;
m1 là khối lượng của mẫu thử, tính bằng gam, có mặt trong phần dịch lọc thứ hai được lấy dùng cho cột IA (V4) [theo công thức (2)].
Khối lượng của aflatoxin tổng số là tổng cộng khối lượng của bốn loại aflatoxin trên.
8. Độ chụm
8.1. Thử liên phòng thử nghiệm
Các chi tiết của thử liên phòng thử nghiệm về độ chụm của phương pháp đưa ra trong phụ lục A các giá trị được lấy từ thử liên phòng thử nghiệm có thể không áp dụng cho dải nồng độ và các chất nền khác với giá trị đã nêu.
8.2. Độ lặp lại
Chênh lệch tuyệt đối giữa hai kết quả của hai phép thử độc lập đơn lẻ, thu được khi sử dụng cùng phương pháp trên vật liệu thử giống hệt nhau trong cùng một phòng thử nghiệm, do cùng một người thực hiện, sử dụng cùng thiết bị, thực hiện trong một khoảng thời gian ngắn, không quá 5 % các trường hợp vượt quá giới hạn lặp lại r dưới đây.
a) Các giá trị đối với ngô là:
| - aflatoxin B1: |
| r = 2,4 µg/kg |
| - aflatoxin B2: |
| r = 1,0 µg/kg |
| - aflatoxin G1: |
| r = 1,9 µg/kg |
| - aflatoxin G2: |
| r = 0,6 µg/kg |
| - aflatoxin tổng số: |
|
|
b) Các giá trị đối với bơ lạc là:
| - aflatoxin B1: |
| r = 2,2 µg/kg |
| - aflatoxin B2: |
| r = 0,3 µg/kg |
| - aflatoxin G1: |
| r = 1,5 µg/kg |
| - aflatoxin G2: |
| r = 0,5 µg/kg |
| - aflatoxin tổng số: |
|
|
c) Các giá trị đối với lạc là:
| - aflatoxin B1: |
| r = 1,5 µg/kg |
| - aflatoxin B2: |
| r = 0,7 µg/kg |
| - aflatoxin G1: |
| r = 0,8 µg/kg |
| - aflatoxin G2: |
| r = 0,8 µg/kg |
| - aflatoxin tổng số: |
|
|
Dựa trên các kết quả thu được, thì chỉ có thể ước tính được hàm lượng aflatoxin của bơ lạc. Trong trường hợp ngô và lạc, thì có thể xác định được aflatoxin B1 và G1, còn B2 và G2 thì chỉ có thể ước tính hoặc phát hiện tương ứng.
8.3. Độ tái lập
Chênh lệch tuyệt đối giữa hai kết quả của hai phép thử độc lập đơn lẻ, thu được khi sử dụng cùng phương pháp trên vật liệu thử giống hệt nhau, trong các phòng thử nghiệm khác nhau, do những người khác nhau thực hiện, sử dụng các thiết bị khác nhau, không quá 5 % các trường hợp vượt quá giới hạn tái lập R đưa ra dưới đây.
a) Các giá trị đối với ngô là:
| - aflatoxin B1: |
| R = 4,2 µg/kg |
| - aflatoxin B2: |
| R = 1,2 µg/kg |
| - aflatoxin G1: |
| R = 1,9 µg/kg |
| - aflatoxin G2: |
| R = 1,5 µg/kg |
| - aflatoxin tổng số: |
|
|
b) Các giá trị đối với bơ lạc là:
| - aflatoxin B1: |
| R = 4,4 µg/kg |
______________
1) CAS: 39416-48-3 (CAS = Chemical Abstract Service)
2) Ví dụ Whatman 934AH là thích hợp cho mục đích này. Thông tin này đưa ra sự thuận lợi cho người sử dụng tiêu chuẩn này và tổ chức ISO không ấn định phải sử dụng sản phẩm này. Các sản phẩm khác có thể được sử dụng nếu chúng cho các kết quả tương đương.
PHỤ LỤC A
(tham khảo)
Các kết quả thử liên phòng thử nghiệm
Các dữ liệu sau đây thu được trong phép thử liên phòng thử nghiệm tiến hành năm 1999 và do AOAC và IUPAC tổ chức phù hợp với ISO 5725:1986. Các mẫu ngô, lạc và bơ lạc bị nhiễm bẩn tự nhiên và bị làm biến tính với 10 ![]() , 20
, 20 ![]() và 30
và 30 ![]() aflatoxin tổng số, theo tỷ lệ 7:1:3:1 của B1, B2, G1 và G2 tương ứng đã được điều tra đánh giá.
aflatoxin tổng số, theo tỷ lệ 7:1:3:1 của B1, B2, G1 và G2 tương ứng đã được điều tra đánh giá.
Mười phòng thử nghiệm tham gia nghiên cứu và số lượng của mỗi loại mẫu là một.
Trong suốt quá trình thử liên phòng thử nghiệm này, iôt được dùng làm thuốc thử dẫn xuất sau cột.
Bảng A.1 – Dữ liệu độ chụm và độ thu hồi đối với ngô
| Thông số | Aflatoxin | ||||
| B1 | B2 | G1 | G2 | Tổng số | |
| Số lượng phòng thử nghiệm còn lại sau khi trừ ngoại lệ | 9 | 9 | 9 | 10 | 9 |
| Số lượng các kết quả được chấp nhận | 18 | 18 | 18 | 20 | 18 |
| Giá trị trung bình | 14,88 | 1,38 | 7,18 | 1,05 | 24,49 |
| Độ lệch chuẩn lặp lại s1, µg/kg | 0,68 | 0,35 | 0,68 | 0,20 | 1,79 |
| Hệ số biến thiên lặp lại, % | 5,8 | 25 | 9,5 | 19 | 7,3 |
| Giới hạn lặp lại r (r = 2,8 s1 ), µg/kg | 2,4 | 0,98 | 1,90 | 0,56 | 5,0 |
| Độ lệch chuẩn tái lập sR, µg/kg | 1,50 | 0,41 | 0,68 | 0,53 | 2,86 |
| Hệ số biến thiên tái lập, % | 10 | 30 | 9,5 | 51 | 11,7 |
| Giới hạn lặp lại R (R = 2,8 sR ), µg/kg | 4,20 | 1,15 | 1,90 | 1,48 | 8,01 |
| Độ thu hồi, % | 85 | 55 | 96 | 42 | 81 |
Bảng A.2 – Dữ liệu độ chụm và độ thu hồi đối với bơ lạc
| Thông số | Aflatoxin | ||||
| B1 | B2 | G1 | G2 | Tổng số | |
| Số lượng phòng thử nghiệm còn lại sau khi trừ ngoại lệ | 10 | 9 | 10 | 10 | 10 |
| Số lượng các kết quả được chấp nhận | 20 | 18 | 20 | 20 | 20 |
| Giá trị trung bình | 5,26 | 0,58 | 2,34 | 0,24 | 8,42 |
| Độ lệch chuẩn lặp lại s1, µg/kg | 0,78 | 0,12 | 0,55 | 0,19 | 1,45 |
| Hệ số biến thiên lặp lại, % | 14,9 | 21 | 24 | 79 | 17 |
| Giới hạn lặp lại r (r = 2,8 s1 ), µg/kg | 2,2 | 0,34 | 1,54 | 0,53 | 4,06 |
| Độ lệch chuẩn tái lập sR, µg/kg | 1,56 | 0,22 | 0,71 | 0,24 | 2,54 |
| Hệ số biến thiên tái lập, % | 30 | 38 | 31 | 101 | 30 |
| Giới hạn lặp lại R (R = 2,8 sR ), µg/kg | 4,37 | 0,62 | 1,99 | 0,67 | 7,11 |
| Độ thu hồi, % | 90 | 70 | 93 | 29 | 84 |
Bảng A.3 – Dữ liệu độ chụm và độ thu hồi đối với lạc
| Thông số | Aflatoxin | ||||
| B1 | B2 | G1 | G2 | Tổng số | |
| Số lượng phòng thử nghiệm còn lại sau khi trừ ngoại lệ | 9 | 10 | 10 | 10 | 9 |
| Số lượng các kết quả được chấp nhận | 18 | 20 | 20 | 20 | 18 |
| Giá trị trung bình | 9,71 | 1,07 | 4,54 | 0,65 | 16 |
| Độ lệch chuẩn lặp lại s1, µg/kg | 0,53 | 0,25 | 0,28 | 0,27 | 0,83 |
| Hệ số biến thiên lặp lại, % | 5,5 | 23 | 6,2 | 42 | 5,2 |
| Giới hạn lặp lại r (r = 2,8 s1 ), µg/kg | 1,48 | 0,70 | 0,78 | 0,76 | 2,3 |
| Độ lệch chuẩn tái lập sR, µg/kg | 1,62 | 0,41 | 0,66 | 0,56 | 2,58 |
| Hệ số biến thiên tái lập, % | 17 | 38 | 15 | 77 | 16 |
| Giới hạn lặp lại R (R = 2,8 sR ), µg/kg | 4,54 | 1,15 | 1,85 | 1,4 | 7,22 |
| Độ thu hồi, % | 83 | 64 | 91 | 39 | 80 |
Thư mục tài liệu tham khảo
[1] CASTEGNARO M., HUNT D.C., SANSONE E.B., SCHULLER P.L., SIRIWARDANA M.G., TELLING G.M., Van EGMONDH H.P. and WALKER E.A. Laboratory decontamination and destrution of aflatoxin B1, B2, G1 and G2 in laboratory wastes. IARC Scientific Publication No.37, International Agency for Research on Cancer (WHO), Lyon (France), 1980, p. 59.
[2] CASTEGNARO M., BAKER J., FREMY J.M., LAFONTAINE M., MIRAGLIA M., SANSONE E.B. and TELLING G.M. Laboratory decontamination and destrution of carcinogens in laboratory wastes: some mycotoxins, IARC Publication No. 113, international Agency of Research on Cancer (WHO), Lyon (France), 1991, p.63.
[3] Van TRIJP J.M.P and ROSS A.H. Model for caculation fo calibration curves, RIKILT Report 91.02, January 1991.
[4] TRUCKESS M.W. et al. Immunoaffinity of column chromatography coupled with solution fluorometry or liquid chromatography postcolumn derviatization for determination of aflatoxin in com, peanuts and peanut butter. Journal of the Association of Oddcial Analytical Chemists, 74 (1), 1991, pp. 81-88.
[5] ISO 31-0:1992, Quantities and unit – Part 0: General principles.
[6] ISO 5725:1986 Precision of test methods - Determination of repeatability and reproducibility for a standard test method by inter-laboratory test (đã hủy).
[7] TCVN 6910-1:2001 (ISO 5725-1:1994), Độ chính xác (độ đúng và độ chụm của phương pháp đo và kết quả đo. Phần 1 – Nguyên tắc và định nghĩa chung.
[8] TCVN 6910-2-:2001 (ISO 5725-2:1994), Độ chính xác (độ đúng và độ chụm của phương pháp đo và kết quả đo. Phần 2- Phương pháp cơ bản xác định độ lặp lại và độ tái lập của phương pháp đo tiêu chuẩn.
[9] EN 12955: 1999, Foodstuffs – Determination of aflatoxin B1, and sum of aflatoxin B1, B2, G1 and G2 in cereals, shell-fruits and derived products – Hight performance liquid chromatographic method with postcolumn derivatization and immunoaffinity column clean-up.
[10] EN 12955:1999, Foodstuffs- Determination of aflatoxin B1, and sum of aflatoxin B1, B2, G1 and G2 in peanuts, pistachios, figs, and paprika powder – Hight performance liquid chromatographic method with postcolumn derivatization and immunoaffinity column clean-up.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 7596:2007 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 7596:2007 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 7596:2007 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 7596:2007 DOC (Bản Word)