- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 9587:2013 ISO 15914:2004 Thức ăn chăn nuôi-Xác định hàm lượng tinh bột bằng phương pháp enzym
| Số hiệu: | TCVN 9587:2013 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Công nghiệp , Nông nghiệp-Lâm nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
2013 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 9587:2013
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 9587:2013
TIÊU CHUẨN QUỐC GIA
TCVN 9587:2013
ISO 15914:2004
THỨC ĂN CHĂN NUÔI - XÁC ĐỊNH HÀM LƯỢNG TINH BỘT BẰNG PHƯƠNG PHÁP ENZYM
Animal feeding stuffs - Enzymatic determination of total starch content
Lời nói đầu
TCVN 9587:2013 hoàn toàn tương đương với ISO 15914:2004;
TCVN 9587:2013 do Cục Chăn nuôi biên soạn, Bộ Nông nghiệp và Phát triển nông thôn đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
THỨC ĂN CHĂN NUÔI - XÁC ĐỊNH HÀM LƯỢNG TINH BỘT BẰNG PHƯƠNG PHÁP ENZYM
Animal feeding stuffs - Enzymatic determination of total starch content
1. Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp enzym để xác định hàm lượng tinh bột tổng số trong thức ăn chăn nuôi và nguyên liệu thức ăn chăn nuôi.
Phương pháp này có thể áp dụng để xác định độ tinh khiết của tinh bột.
Đối với phương pháp này, quan trọng là nền mẫu không được chứa các thành phần gây triệt tiêu kết quả đo được ở bước sóng 340 nm.
Phương pháp này có thể áp dụng để phân tích hàm lượng tinh bột nằm trong dải từ 40 g/kg đến 1 000 g/kg. Tiêu chuẩn này có thể áp dụng tốt nhất cho hàm lượng tinh bột trong dải từ 200 g/kg đến 1000 g/kg. Đối với hàm lượng tinh bột trong dải từ 40 g/kg đến 200 g/kg thì có thể áp dụng quy trình pha loãng khác đối với dung dịch glucoza chuẩn và mẫu thử.
2. Tài liệu viện dẫn
Các tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 4851:1989 (ISO 3696:1987) Nước dùng để phân tích trong phòng thí nghiệm - Yêu cầu kỹ thuật và phương pháp thử.
TCVN 6952:2001 (ISO 6498:1998) Thức ăn chăn nuôi - Chuẩn bị mẫu thử.
3. Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng các thuật ngữ và định nghĩa sau đây:
3.1. Tinh bột (starch)
Các polyme thực vật tự nhiên gồm có các mạch thẳng dài của 1,4-a-D-glucoza (amyloza) và/hoặc các mạch nhánh a-1,6 của liên kết a-1,4-glucoza (amylopectin).
3.2. Hàm lượng tinh bột (starch content)
Phần khối lượng tinh bột và các sản phẩm của tinh bột có khối lượng phân tử cao, không tan trong etanol 40 % và xác định được bằng phương pháp quy định trong tiêu chuẩn này.
CHÚ THÍCH: Hàm lượng tinh bột được biểu thị bằng gam trên kilogam.
4. Nguyên tắc
Mẫu thử đã nghiền được chiết bằng etanol 40 % để loại bỏ các loại đường hòa tan. Hòa phần mẫu thử chiết được trong dung dịch DMSO (90 % thể tích) ở 100 oC, sau đó thêm axit clohydric đậm đặc ở 60 oC để phân hủy mẫu và hòa tan tinh bột. Tinh bột hòa tan được chuyển thành glucoza bởi enzym amyloglucosidaza. Tiến hành định lượng glucoza bằng phương pháp hexokinaza đã biết (xem [1], [2]).
5. Thuốc thử
Chỉ sử dụng các thuốc thử đạt chất lượng tinh khiết phân tích.
5.1. Nước, phù hợp với loại 3 quy định trong TCVN 4851:1989 (ISO 3696:1987).
5.2. Etanol (C2H5OH), 40 % (thể tích)
Lấy 417 ml etanol (96 % thể tích) và pha loãng bằng nước đến 1 000 ml.
5.3. Axit clohydric, c(HCl) = 12 mol/l.
5.4. Natri hydroxit loãng, c(NaOH) = 4 mol/l.
Hòa tan 40 g NaOH trong khoảng 50 ml nước trong cốc có mỏ. Sau khi nguội, chuyển định lượng sang bình định mức 250 ml và pha loãng bằng nước đến vạch.
CẢNH BÁO - Thao tác này sẽ sinh nhiệt, do đó cần đeo kính an toàn.
5.5. Dung dịch axit axetic, c(CH3COOH) = 2 mol/l.
Cho khoảng 200 ml nước vào bình định mức 500 ml, sau đó thêm 59 ml axit axetic băng. Pha loãng bằng nước đến vạch.
5.6. Dung dịch natri axetat, c(CH3COONa) = 2 mol/l.
Hòa tan 82,0 g natri axetat trong nước đựng trong bình định mức 500 ml và pha loãng bằng nước đến vạch.
5.7. Dung dịch đệm natri axetat, c(CH3COONa/H) = 2 mol/l, pH = 4,8.
Trộn 41 ml dung dịch axit axetic (5.5) với 59 ml dung dịch natri axetat (5.6). Kiểm tra pH bằng máy đo pH và chỉnh để thu được pH quy định bằng dung dịch natri axetat hoặc axit axetic, nếu cần.
Chuẩn bị dung dịch đệm mới trong ngày sử dụng.
5.8. Dung dịch dimethylsulfoxid, (sDMSO) = 90 % (thể tích).
Trộn DMSO tinh khiết với nước theo tỷ lệ thể tích 9:1.
5.9. Các dung dịch làm trong, theo Carrez, được chuẩn bị như sau:
5.9.1. Dung dịch kali hexaxyanoferrat(II), c[K4Fe(CN)6] = 0,25 mol/l.
Hòa tan 106 g kali hexaxyanoferrat(II) ngậm ba phân tử nước [K4Fe(CN)6*3H2O] trong nước đựng trong bình định mức 1 lít. Pha loãng bằng nước đến vạch.
5.9.2. Dung dịch kẽm axetat trong axit axetic 0,5 mol/l, c[Zn(CH3CO2)2*2H2O] và 30 g axit axetic băng trong nước đựng trong bình định mức 1 lít. Pha loãng bằng nước đến vạch.
5.10. Dung dịch iot trong kali iodua
Hòa tan 12,7 g iot (I2) và 24,0 g kali iodua (KI) trong nước đựng trong bình định mức 1 lít. Pha loãng bằng nước đến vạch. Pha loãng dung dịch này 10 lần trước khi sử dụng.
5.11. Dung dịch chuẩn glucoza
5.11.1. Mẫu chứa tinh bột từ 200 g/kg đến 1 000 g/kg
Chuẩn bị ba dung dịch chuẩn glucoza riêng rẽ (c = 0,0194 mol/l). Hòa tan 350 mg glucoza (C6H12O6) khan, được cân chính xác đến miligam, trong nước đựng trong các bình định mức 100 ml riêng rẽ. Pha loãng bằng nước đến vạch.
5.11.2. Mẫu chứa tinh bột từ 40 g/kg đến 200 g/kg
Chuẩn bị ba dung dịch glucoza chuẩn độc lập (c = 0,0039 mol/l). Hòa tan 350 mg ± 1 mg glucoza (C6H12O6) khan, trong nước đựng trong bình định mức 500 ml riêng rẽ. Pha loãng bằng nước đến vạch.
Chuẩn bị các dung dịch glucoza chuẩn mới trong ngày sử dụng.
5.12. Dung dịch amyloglucosidaza, AMG 160 U/ml.
Hòa tan 267 mg amyloglucosidaza (AMG) [EC 3.2.1.3 (Aspergillus niger; Roche Diagnostics, No. 1 202 367,6 U/mg]1) trong hỗn hợp của 9 ml nước và 1 ml dung dịch đệm natri axetat (5.7). Việc bảo quản và sử dụng các enzym, cần tuân thủ các hướng dẫn của nhà cung cấp enzym.
Khi sử dụng loại enzym khác, cần đánh giá hoạt tính của enzym theo chú thích 1. Khối lượng enzym cần tương thích với hoạt độ đánh giá được.
CHÚ THÍCH 1: Các nhà cung cấp enzym khác nhau sử dụng các định nghĩa khác nhau về đơn vị hoạt tính của enzym. Trong tiêu chuẩn này, định nghĩa về hoạt tính đối với AMG được sử dụng là: 1 đơn vị amyloglucosidaza sẽ giải phóng 1 mmol glucoza trong 1 min ở 25 oC và pH = 4,75 từ glycogen.
CHÚ THÍCH 2: 10 ml dung dịch enzym là đủ dùng cho khoảng 75 phép xác định.
5.13. Bộ thử D-glucoza UV, để định lượng enzym glucoza, dùng phương pháp hexokinaza (R-Biopharm, No. 7162512) theo hướng dẫn của nhà sản xuất, các bộ thử chưa sử dụng có thể bảo quản được 1 năm ở 4 oC), như nêu trong 5.13.1 đến 5.13.3.
5.13.1. Dung dịch đệm/cơ chất (Chai 1)
Hòa tan lượng chứa trong Chai 1 bằng 45 ml nước vừa mới được chưng cất. Bảo quản dung dịch này ở nơi mát (4 oC) và tối không quá 4 tuần. Sử dụng một lượng cần thiết của dung dịch này ở nhiệt độ môi trường.
5.13.2. Dung dịch enzym (Chai 2)
Dung dịch này đã chuẩn bị sẵn để sử dụng.
5.13.3. Dung dịch tạo màu
Trộn 22,5 ml dung dịch đệm/co chất (5.13.1) với 95 ml nước và 0,45 ml dung dịch enzym (5.13.2) rồi đồng hóa. Lượng thuốc thử này đủ cho một dãy khoảng 40 lần đo. Nếu cần thực hiện số lần đo nhiều hơn hoặc ít hơn thì trộn các thể tích tương ứng.
Chỉ sử dụng các dung dịch tạo màu mới được chuẩn bị ở nhiệt độ phòng.
6. Thiết bị, dụng cụ
Sử dụng các thiết bị, dụng cụ của phòng thử nghiệm thông thường và cụ thể như sau:
6.1. Cân phân tích, có thể cân chính xác đến 0,1 mg.
6.2. Máy ly tâm, có gia tốc (180 ± 10) g và 3 000 g, thích hợp để dùng cho các ống nghiệm 12 ml có nắp vặn (gia tốc g được ghi ở đáy của ống nghiệm).
6.3. Nồi cách thủy, có thể điều chỉnh đến nhiệt độ (100 ± 2) oC.
6.4. Nồi cách thủy, có thể điều chỉnh đến nhiệt độ (60 ± 1) oC.
6.5. Máy đo pH, đã được hiệu chuẩn, có điện cực thủy tinh phức hợp, có thể đo được pH chính xác đến 0,01 đơn vị pH.
6.6. Pipet microlit, đã được hiệu chuẩn và có thể điều chỉnh được từ 40 ml đến 200 ml, từ 200 ml đến 1 000 ml và từ 1 ml đến 5 ml, và có bộ phận phân phối có thể điều chỉnh được từ 1 ml đến 5 ml.
6.7. Máy đo phổ, có cuvet dòng chảy, có thể đo được ở bước sóng 340 nm.
6.8. Máy lắc quay, tốc độ 50 r/min, dùng cho các ống ly tâm có nắp vặn kín (6.11).
6.9. Bộ phân phối/bộ pha loãng (Ví dụ: Hook & Tucker Compudil D3)).
6.10. Tủ ấm, có lưu thông không khí cưỡng bức.
6.11. Ống ly tâm, kích thước 100 mm x 16 mm, bằng thủy tinh, có nắp vặn được làm kín bằng cao su PTFE.
6.12. Bình đong, dung tích 100 ml, cổ rộng, có khớp nối thủy tinh mài 14/23.
Bình này phải cho phép đo được pH bên trong bình bằng điện cực thủy tinh kết hợp.
6.13. Máy trộn dạng ống, (ví dụ: máy trộn Vortex3)), đối với phương pháp thay thế để phân hủy và hòa tan tinh bột được mô tả trong 8.4.2. Cũng cần đến các dụng cụ sau đây.
6.14. Bể lắc điều nhiệt, có thể điều chỉnh đến nhiệt độ ở (100 ± 2) oC, với dao động 2 cm và tần suất lắc từ 150 đến 200 lần lắc trên phút. Bể lắc cần được trang bị giá đỡ các ống nghiệm thẳng đứng trong nước.
6.15. Ống ly tâm, bằng thủy tinh, dung tích nhỏ nhất là 20 ml, có nắp vặn được làm kín bằng cao su PTFE.
6.16. Bi thủy tinh, đường kính 3 mm.
7. Chuẩn bị mẫu thử
Chuẩn bị mẫu thử theo TCVN 6952 (ISO 6498).
8. Cách tiến hành
8.1. Phần mẫu thử
Tiến hành hai phép xác định song song.
Cân khoảng 200 mg mẫu thử (Điều 7), chính xác đến 0,1 mg, cho vào ống ly tâm (6.11). Cân khoảng 200 mg khác của mẫu đã xử lý (Điều 7), chính xác đến 0,1 mg cho vào ống ly tâm thứ hai.
Lặp lại quy trình đối với mỗi ống ly tâm.
8.2. Tách chiết đường
Cho vào mỗi ống ly tâm 10 ml etanol (5.2). Chiết đường hòa tan bằng cách quay liên tục huyền phù trong 10 min trong máy lắc quay (6.8). Sau đó ly tâm 10 min trong máy ly tâm (6.2) với gia tốc hướng tâm (180 ± 10) g và loại bỏ phần nổi phía trên. Lặp lại quy trình chiết này một lần nữa.
8.3. Mẫu trắng
Từ giai đoạn này của quy trình, đối với mỗi mẻ phân tích phải phân tích một mẫu trắng. Sử dụng một ống ly tâm rỗng đựng mẫu trắng.
8.4. Hòa tan tinh bột
8.4.1. Yêu cầu chung
Hòa tan tinh bột có thể được thực hiện theo 8.4.2 hoặc theo 8.4.3. Khi sử dụng quy trình thay thế (xem 8.4.3) thì phải sử dụng các ống ly tâm lớn hơn đựng thuốc thử bằng thủy tinh có nắp vặn (6.15).
8.4.2. Cách I
Cho 10,0 ml dung dịch DMSO (5.8) vào ống ly tâm bằng bộ phân phối, trong khi vẫn khuấy trộn liên tục trên máy trộn vortex (6.13) và trộn cho đến khi thu được huyền phù không còn vón cục. Đậy nắp ống nghiệm.
CHÚ THÍCH: Cần khuấy trộn mạnh trong khi thêm DMSO để tránh tạo thành microgel và/hoặc cục vón. Microgel và cục vón sẽ dẫn đến kết quả của hàm lượng tinh bột thu được không chính xác.
- do microgel và cục vón làm cho dung dịch mẫu không đồng nhất.
- microgel và cục vón sẽ không được AMG thủy phân hoàn toàn glucoza, nên hàm lượng tinh bột xác định được là không chính xác (phần lớn là quá thấp).
Ngay sau khi đồng hóa xong, đặt ống ly tâm vào máy lắc quay (6.8) và phân hủy tinh bột trong khi quay liên tục 30 min trong tủ ấm (6.10) ở 100 oC. Làm nguội ống ly tâm và dùng pipet (6.6) để thêm 1,7 ml axit clohydric đậm đặc (5.3) và trộn kỹ. Đậy nắp ống và đặt vào bộ lắc quay. Thủy phân mẫu từng phần bằng cách đặt ống vào tủ (6.10) 30 min ở 60 oC trong khi vẫn khuấy liên tục.
Tiến hành tiếp theo 8.4.4.
8.4.3. Cách II
Cho 15 viên bi thủy tinh (6.16) vào phần còn lại trong ống ly tâm bằng thủy tinh (6.15). Dùng bộ phận phối/bộ pha loãng thêm 10,0 ml dung dịch DMSO (5.8) vào ống ly tâm, trong khi vẫn khuấy trộn liên tục trên máy trộn vortex (6.13) và trộn cho đến khi thu được huyền phù không còn vón cục. Vặn nắp ống ly tâm.
CHÚ THÍCH: Cần khuấy trộn mạnh trong khi thêm DMSO để tránh tạo thành microgel và/hoặc cục vón. Microgel và cục vón sẽ dẫn đến kết quả của hàm lượng tinh bột thu được không chính xác.
- do microgel và cục vón làm cho dung dịch mẫu không đồng nhất, và
- microgel và cục vón sẽ không thủy phân hoàn toàn AMG thành glucoza, nên hàm lượng tinh bột xác định được là không chính xác (phần lớn là quá thấp).
Đặt ống nghiệm thẳng đứng vào giá đựng của bể lắc điều nhiệt (6.14) và lắc 30 min trong nước đang sôi. Làm nguội ống nghiệm và dùng pipet có thể điều chỉnh được (6.6) để thêm 1,7 ml axit clohydric đậm đặc (5.3) và trộn kỹ. Đậy nắp ống và đặt ống ly tâm vào nồi cách thủy được điều chỉnh ở nhiệt độ (60 ± 1) oC. Thủy phân mẫu từng phần bằng cách lắc ống nghiệm 30 min trong nồi cách thủy được điều chỉnh ở nhiệt độ (60 ± 1) oC.
Tiến hành tiếp theo 8.4.4.
8.4.4. Chỉnh pH
Làm nguội ống ly tâm và chuyển định lượng lượng chứa sang bình định mức 100 ml (6.12). Thêm 5,0 ml dung dịch natri hydroxit (5.4) và 2,5 ml dung dịch đệm natri axetat (5.7) rồi đồng hóa dung dịch. Dùng máy đo pH (6.5) để đo độ pH của dung dịch. Chỉnh pH đến 4,8 ± 0,1 bằng axit clohydric loãng hoặc dung dịch natri hydroxit loãng, nếu cần. Tráng điện cực pH trong bình định mức và pha loãng dung dịch bằng nước đến vạch.
8.5. Chuyển tinh bột thành glucoza bằng phương pháp enzym
Dùng pipet điều chỉnh được lấy (ngay sau khi đồng hóa kỹ) 5,00 ml (= V1 ở phép tính trong 9.2) dung dịch đồng nhất của tinh bột đã hòa tan và phân hủy một phần (8.4.4) cho vào ống nghiệm thủy tinh sạch và khô (6.11). Dùng pipet (6.6) thêm 0,125 ml enzym AMG (5.12). Đậy nắp ống rồi đồng hóa kỹ. Làm ấm dung dịch trong nồi cách thủy ở 60 oC qua đêm, ít nhất 16 h. Làm bất hoạt AMG bằng cách đặt ống nghiệm trong nước sôi 15 min. Làm nguội ống đến nhiệt độ môi trường rồi dùng pipet thêm 0,125 ml dung dịch kali hexaxyanoferrat(II) (5.9.1) và lắc trong 1 min. Dùng pipet thêm tiếp 0,125 ml dung dịch kẽm axetat (5.9.2) và lắc lại 1 min. Ống nghiệm này chứa 5,375 ml dung dịch (= V2 ở phép tính trong 9.2). Sau đó ly tâm 10 min với gia tốc hướng tâm nhỏ nhất là 3 000 g. Chuyển phần nổi phía trên sang ống nghiệm khô và sạch.
Kiểm tra sự có mặt của tinh bột bằng cách thêm vài mililit nước vào ống ly tâm, đun sôi trong 10 min, làm nguội và thêm 0,2 ml dung dịch iot (5.10). Dung dịch có màu xanh cho thấy vẫn còn tinh bột và do đó quá trình chuyển đổi chưa kết thúc. Cần loại bỏ dung dịch chứa phần mẫu thử và bắt đầu lại phép phân tích mẫu (xem 8.1).
8.6. Xác định hàm lượng glucoza bằng enzym
8.6.1. Mẫu chứa từ 200 g/kg đến 1 000 g/kg tinh bột
Dùng bộ phân phối/bộ pha loãng (6.9) để pha loãng 0,5 ml phần nổi phía trên của các dung dịch tinh bột đã thủy phân (8.5), mẫu trắng (8.3), ba dung dịch chuẩn glucoza (5.11) và mẫu trắng là nước (5.1) tương ứng với 9,5 ml nước (5.1) và đồng hóa.
8.6.2. Mẫu chứa từ 40 g/kg đến 200 g/kg tinh bột
Dùng bộ phân phối/bộ pha loãng (6.9) để pha loãng 0,5 ml phần nổi phía trên của các dung dịch tinh bột đã thủy phân (8.5), mẫu trắng (8.3), ba dung dịch chuẩn glucoza (5.11) và mẫu trắng là nước (5.1) với 1,5 ml nước (5.1) và đồng hóa.
Nếu hàm lượng tinh bột dự kiến thấp (nhỏ hơn 200 g/kg), thì nên tăng độ nhạy của phép xác định bằng cách sử dụng một tỷ lệ pha loãng khác đối với phép chuyển đổi tinh bột thành glucoza bằng enzym. Nên sử dụng cùng tỷ lệ pha loãng đối với dung dịch mẫu trắng. Nên chuẩn bị các dung dịch glucoza chuẩn ở mức nồng độ thấp hơn có thể so sánh được và để pha loãng các dung dịch chuẩn này theo cùng phương thức như đã thực hiện với dung dịch mẫu và mẫu trắng.
Các phép đo màu của các dung dịch mẫu trắng (8.3), mẫu trắng là nước (5.1) và ba dung dịch glucoza chuẩn cần được lặp lại hai lần. Các mẫu chứa tinh bột thủy phân phải được đo một lần.
8.6.3. Dùng pipet (6.6) lấy 0,4 ml dung dịch đã pha loãng cho vào ống ly tâm khô, sạch. Dùng pipet (6.6) bổ sung 2,62 ml dung dịch tạo màu (5.13.3) và trộn kỹ. Đo độ hấp thụ (xem 6.7) của dung dịch ở bước sóng 340 nm dựa vào nước.
9. Tính và biểu thị kết quả
9.1. Đường chuẩn
Tính độ hấp thụ đã hiệu chính đối với từng dung dịch glucoza chuẩn theo công thức sau:
E1gs = (E0gs - E0wb)
Trong đó:
| E1gs | là độ hấp thụ đã hiệu chính của dung dịch glucoza chuẩn; |
| E0gs | là độ hấp thụ của dung dịch glucoza chuẩn; |
| E0wb | là giá trị trung bình độ hấp thụ của mẫu trắng là nước. |
Giá trị độ hấp thụ đã hiệu chính trung bình của mẫu trắng là nước (theo định nghĩa) bằng zero.
Sử dụng phép phân tích hồi quy tuyến tính, để xác định đường chuẩn của giá trị độ hấp thụ hiệu chính theo hàm lượng glucoza (tính bằng gam trên lít) của các dung dịch glucoza chuẩn chưa pha loãng.
Tính giá trị độ hấp thụ đã hiệu chính của từng dung dịch mẫu theo công thức sau:
E1s = (E0s - E0sb)
Trong đó:
| E1s | là độ hấp thụ đã hiệu chính của dung dịch mẫu; |
| E0s | là độ hấp thụ của dung dịch mẫu thử; |
| E0sb | là giá trị trung bình độ hấp thụ của mẫu trắng. |
Từ đường chuẩn (9.1), tính hàm lượng glucoza (rg) của các dung dịch mẫu chưa pha loãng (8.5), tính bằng gam trên lít.
Xem Phụ lục A.
9.2. Hàm lượng tinh bột
Tính hàm lượng tinh bột của mẫu thử theo công thức sau:
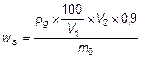
Trong đó:
| ws | là hàm lượng tinh bột của mẫu thử, tính bằng gam trên kilogam (g/kg); |
| rg | là hàm lượng glucoza của dung dịch mẫu, tính được theo 9.1, tính bằng gam trên lít (g/l); |
| V1 | là thể tích của dung dịch tinh bột trong 8.5 được lấy bằng pipet, tính bằng mililit (= 5,00 ml); |
| V2 | là tổng thể tích của tinh bột sau khi chuyển thành glucoza trong 8.5, tính bằng mililit (= 5,375 ml); |
| m0 | là khối lượng phần mẫu thử, tính bằng gam (g). |
Để tính hàm lượng tinh bột theo công thức trên, thì cần sử dụng các độ pha loãng tương ứng đối với cả mẫu trong 8.6.1 lẫn các dung dịch glucoza chuẩn trong 5.11.
10. Độ chụm
10.1. Phép thử liên phòng thử nghiệm
Chi tiết của phép thử liên phòng thử nghiệm về độ chụm của phương pháp được nêu trong Phụ lục B. Các giá trị thu được từ phép thử liên phòng thử nghiệm này có thể không áp dụng được cho các dải nồng độ và chất nền khác với các dải nồng độ và chất nền đã nêu.
10.2. Độ lặp lại
Chênh lệch tuyệt đối giữa hai kết quả thử độc lập, riêng rẽ, thu được khi sử dụng cùng một phương pháp thử trên vật liệu thử giống hệt nhau, thực hiện trong cùng một phòng thử nghiệm, do cùng một người phân tích, sử dụng cùng một thiết bị, trong một khoảng thời gian ngắn, không được quá 5 % các trường hợp vượt quá giới hạn lặp lại sau đây:
- 14 g/kg đối với đậu Hà lan, thức ăn hỗn hợp cho động vật lấy sữa và bột sắn,
- 17 g/kg đối với thức ăn cho lợn con,
- 48 g/kg đối với thức ăn cho gà đẻ (xem Phụ lục B).
10.3. Độ tái lập
Chênh lệch tuyệt đối giữa hai kết quả thử riêng rẽ, thu được khi sử dụng cùng một phương pháp thử trên vật liệu thử giống hệt nhau, thực hiện trong các phòng thử nghiệm khác nhau, do những người phân tích khác nhau, sử dụng các thiết bị khác nhau, không được quá 5 % các trường hợp lớn hơn giới hạn tái lập sau đây:
- 25 g/kg đối với thức ăn cho lợn con,
- 34 g/kg đối với bột sắn,
- 36 g/kg đối với hỗn hợp cho động vật lấy sữa,
- 48 g/kg đối với thức ăn cho gà đẻ,
- 50 g/kg đối với đậu Hà lan (xem Phụ lục B).
11. Báo cáo thử nghiệm
Báo cáo thử nghiệm phải nêu rõ:
- mọi thông tin cần thiết để nhận biết đầy đủ về mẫu thử;
- phương pháp lấy mẫu đã sử dụng, nếu biết;
- phương pháp thử đã sử dụng và viện dẫn tiêu chuẩn này;
- tất cả các chi tiết thao tác không quy định trong tiêu chuẩn này, cùng với các chi tiết bất thường nào khác có thể ảnh hưởng tới kết quả thử;
- kết quả thử nghiệm thu được hoặc nếu đáp ứng yêu cầu về độ lặp lại thì nêu hai kết quả thử thu được.
PHỤ LỤC A
(Tham khảo)
Các lưu ý về cách tiến hành
A.1. Từ số liệu thống kê, có thể biết rằng độ tin cậy của đường chuẩn, tính được bằng cách sử dụng phép phân tích hồi quy tuyến tính, dựa trên mẫu trắng và dung dịch chuẩn, mỗi dung dịch được đo ba lần, tốt hơn đường chuẩn được xây dựng dựa trên mẫu trắng và năm dung dịch chuẩn có nồng độ khác nhau, mỗi dung dịch đo một lần (xem [5]).
A.2. Trong phương pháp này giả định rằng mẫu nền không ảnh hưởng đến độ hấp thụ của mẫu trắng. Điều này cần để kiểm soát tất cả các mẫu nền mới được thử nghiệm bằng phương pháp này. Điều này có thể được thực hiện theo cách sau.
Chuẩn bị một lượng thuốc thử tạo màu theo 5.13.3, không có dung dịch enzym. Dùng pipet lấy 0,4 ml các dung dịch mẫu đã pha loãng (được chuẩn bị theo 8.6.1) để thử nghiệm và cũng lấy tương tự đối với mẫu trắng đã pha loãng vào ống thủy tinh đựng thuốc thử. Dùng pipet lấy 2,6 ml thuốc thử tạo màu không có enzym cho vào các ống này.
Sau 30 min đến 60 min, đo độ hấp thụ của tất cả các dung dịch này ở bước sóng 340 nm. Chênh lệch độ hấp thụ giữa các dung dịch mẫu và các mẫu trắng không được quá 0,002. Đối với một số nền mẫu cụ thể chênh lệch này lớn hơn, thì không sử dụng phương pháp này cho các mẫu nền đó. Các mẫu nền được nghiên cứu trong tiêu chuẩn này, là tinh bột, thức ăn chăn nuôi, ngũ cốc (ngô, lúa mì và quinoa) và bột khoai tây đông khô, tất cả các đáp ứng điều kiện này.
PHỤ LỤC B
(Tham khảo)
Kết quả của phép thử liên phòng thử nghiệm
Phép thử liên phòng thử nghiệm (xem [6]) đã được thực hiện năm 1998 phù hợp với TCVN 6910-2 (ISO 5725-2) (xem [4]). Mười hai phòng thử nghiệm tham gia. Mẫu điều tra là sắn khô, thức ăn cho gà đẻ, đậu Hà Lan, thức ăn lợn con và thức ăn hỗn hợp cho động vật lấy sữa. Các dữ liệu về độ chụm được nêu trong Bảng B.1.
Bảng B.1 - Kết quả thống kê của phép thử nghiệm liên phòng
|
| Mẫu | ||||
| 1 | 2 | 3 | 4 | 5 | |
| Số phòng thử nghiệm tham gia sau khi trừ ngoại lệ | 9 | 10 | 9 | 8 | 10 |
| Số lượng kết quả được chấp nhận | 18 | 20 | 18 | 16 | 20 |
| Hàm lượng tinh bột trung bình, g/kg | 456 | 447 | 233 | 704 | 394 |
| Độ lệch chuẩn lặp lại, sr, g/kg | 5 | 6 | 5 | 5 | 17 |
| Hệ số biến thiên lặp lại, % | 1,1 | 1,3 | 2,1 | 0,7 | 4,3 |
| Giới hạn lặp lại , (r) [2,8 x sr] g/kg | 14 | 17 | 14 | 14 | 48 |
| Độ lệch chuẩn tái lập sR, g/kg | 18 | 9 | 13 | 12 | 17 |
| Hệ số biến thiên tái lập, % | 3,9 | 2,0 | 5,6 | 1,7 | 4,3 |
| Giới hạn tái lập, (R) [2,8 x sR], g/kg | 50 | 25 | 36 | 34 | 48 |
| 1: đậu Hà lan 2: thức ăn cho lợn con 3: thức ăn cho trâu bò 4: sắn khô 5: thức ăn cho gà đẻ. | |||||
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] BRUNT K., SANDERS P. and ROZEMA T. The enzymatic determination of starch in food, feed and raw materials of the starch industry. Starch/Starke, 50, 1998, pp. 413-419
[2] Method of enzymatic bioanalysis and food analysis. Boehringer Mannheim, 1995, pp. 46-49 and 126-129
[3] TCVN 6910-1:2001 (ISO 5725-1:1994) Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo - Phần 1: Nguyên tắc và định nghĩa chung.
[4] TCVN 6910-2:2001 (ISO 5725-2:1994) Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo - Phần 2: Phương pháp cơ bản xác định độ lặp lại và độ tái lập của phương pháp đo tiêu chuẩn.
[5] MILLER J.C. and MILLER J.N. Statistics for analytical chemistry, 2nd edition, 1992, pp. 112-115, Ellis Horwood, New York, London, Toronto, Sydney, Tokyo, Singapore
[6] BRUNT K. Collaborative study concerning the enzymatic determination of starch in food, feed, and raw material for the starch industry. Starch/Starke, 52, 2000, pp. 73-75
1) Roche Diagnostics, No. 1 202 367 là ví dụ về sản phẩm thích hợp có bán sẵn. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn không ấn định phải sử dụng sản phẩm này.
2) R-Biopharm, AG No. 716251 là ví dụ về sản phẩm thích hợp có bán sẵn. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và tiêu chuẩn không ấn định phải sử dụng sản phẩm này.
3) Hook & Tucker Compudil D và Vortex là các ví dụ về sản phẩm thích hợp có bán sẵn. Thông tin này đưa ra tạo thuận lợi cho người sử dụng tiêu chuẩn và tiêu chuẩn này không ấn định phải sử dụng sản phẩm này.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 9587:2013 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 9587:2013 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 9587:2013 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 9587:2013 DOC (Bản Word)