- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 12553:2019 Nhiên liệu dạng khí - Xác định nhiệt trị, hệ số nén
| Số hiệu: | TCVN 12553:2019 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Công nghiệp |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
08/08/2019 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 12553:2019
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 12553:2019
TIÊU CHUẨN QUỐC GIA
TCVN 12553:2019
ASTM D 3588-98
NHIÊN LIỆU DẠNG KHÍ - XÁC ĐỊNH NHIỆT TRỊ, HỆ SỐ NÉN VÀ TỶ KHỐI
Standard Practice for Calculating Heat Value, Compressibility Factor, and Relative Density of Gaseous Fuels
Lời nói đầu
TCVN 12553:2019 được xây dựng trên cơ sở chấp nhận hoàn toàn tương đương với ASTM D 3588-98 (Reapproved 2017) Standard Practice for Calculation Heat Value, Compressibility Factor, and Relative Density of Gaseous Fuels với sự cho phép của ASTM quốc tế, 100 Barr Harbor Drive, West Conshohocken, PA 19428, USA. Tiêu chuẩn ASTM D 3588-98 (Reapproved 2017) thuộc bản quyền của ASTM quốc tế.
TCVN 12553:2019 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC193 Sản phẩm khí biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
NHIÊN LIỆU DẠNG KHÍ - XÁC ĐỊNH NHIỆT TRỊ, HỆ SỐ NÉN VÀ TỶ KHỐI
Standard practice for calculating heat value, compressibility factor, and relative density of gaseous fuels
1 Phạm vi áp dụng
1.1 Tiêu chuẩn này quy định các quy trình tính nhiệt trị, tỷ khối và hệ số nén tại các điều kiện chuẩn [áp suất 14,696 psia và nhiệt độ 15,6 °C (60 °F)] đối với hỗn hợp khí thiên nhiên từ phép phân tích thành phần. Tiêu chuẩn này áp dụng đối với tất cả các loại nhiên liệu dạng khí thông dụng, ví dụ khí thiên nhiên khô, khí trong quá trình chế biến (reformed gas), khí dầu (oil gas) (cả hai loại nhiệt trị cao và thấp), propan-không khí, khí tổng hợp bổ sung hydrocacbon (carbureted water gas), khí lò cốc và khí than chưng, với phương pháp phân tích phù hợp được mô tả trong Điều 6. Các quy trình tính toán đối với các điều kiện chuẩn khác được nêu ra.
1.2 Các giá trị dùng đơn vị SI là các giá trị tiêu chuẩn. Các đơn vị ghi trong ngoặc đơn dùng để tham khảo.
1.3 Tiêu chuẩn này không đề cập đến tất cả các vấn đề liên quan đến an toàn khi sử dụng. Người sử dụng tiêu chuẩn này có trách nhiệm thiết lập các nguyên tắc về an toàn và bảo vệ sức khỏe cũng như khả năng áp dụng phù hợp với các giới hạn quy định trước khi đưa vào sử dụng.
1.4 Tiêu chuẩn này được xây dựng theo các nguyên tắc tiêu chuẩn hóa đã được quốc tế công nhận. Các nguyên tắc đó được lập trong văn bản Quyết định về các nguyên tắc xây dựng tiêu chuẩn quốc tế, các hướng dẫn và khuyến nghị được ban hành bởi Ủy ban về Hàng rào kỹ thuật trong thương mại (TBT) của Tổ chức Thương mại Thế giới.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau đây là cần thiết để áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
TCVN 8360 (ASTM D 2163) Khí dầu mỏ hóa lỏng (LPG) và hỗn hợp propan/propen - Xác định hydrocacbon bằng phương pháp sắc ký khí.
TCVN 9794 (ASTM D 1945) Khí thiên nhiên - Phương pháp phân tích bằng sắc ký khí.
ASTM D 1717 Test method for test for analysis of commerical butane-butene mixtures and isobutylene by gas chromatography (withdrawn 1984) [Phương pháp phân tích các hỗn hợp butan- buten và isobutylen thương phẩm bằng sắc ký khí (đã bị hủy năm 1984)].
ASTM D 1946 Test method for analysis of reformed gas by gas chromatography (Phương pháp phân tích khí trong quá trình chế biến bằng sắc ký khí)
ASTM D 2650 Test method for chemical composition of gases by mass spectrometry (Phương pháp xác định thành phần hóa học của khí bằng phép đo phổ khối lượng).
GPA 2145 Physical constants for the paraffin hydrocarbons and other components in natural gas (Các hằng số vật lý đối với các hydrocacbon parafin và các cấu tử khác trong khí thiên nhiên).
GPA Standard 2166 Methods of obtaining natural gas samples for analysis by gas chromatograph (Phương pháp thu nhận các mẫu khí thiên nhiên để phân tích bằng sắc ký khí).
GPA2172 Calculation of gross heating value, relative density, and compressibility factor for natural gas mixtures from compositional analysis (Tính toán nhiệt trị tổng, tỷ khối, và hệ số nén đối với các hỗn hợp khí thiên nhiên từ phép phân tích thành phần).
GPA 2261 Method of analysis for natural gas and similar gaseous mixtures by gas chromatography (Phương pháp phân tích khí thiên nhiên và các hỗn hợp dạng khí tương tự bằng sắc ký khí).
GPA Technical publication TP-17 Table of physical properties of hydrocarbons for extended analysis of natural gases (Ấn phẩm kỹ thuật TP-17 Bảng các tính chất vật lý của hydrocacbon để phân tích mở rộng khí thiên nhiên).
GPSA Data book, Fig. 23-2 Physical constants (Sổ tay dữ liệu, Hình 23-2 Các hằng số vật lý).
TRC Thermodynamic tables - Hydrocarbons (Bảng nhiệt động học - Các hydrocacbon).
ANSI Z 132.1-1969: Basic conditions of pressure and temperature for the volumetric measurement of natural gas (Các điều kiện chuẩn về áp suất và nhiệt độ đối với phép đo thể tích của khí thiên nhiên).
3 Thuật ngữ và định nghĩa
3.1 Định nghĩa
3.1.1
Đơn vị nhiệt Anh (Bristish thermal unit)
Các bảng quốc tế quy định đơn vị nhiệt Anh (Btu).
3.1.1.1 Giải thích: Mối quan hệ đang xác định là
1 Btu.lb-1 = 2,326 J.g-1 (chính xác)
1 lb = 453,59237 g (chính xác)
theo những mối quan hệ này 1 Btu = 1055,055 852 62 J (chính xác). Đối với hầu hết các mục đích, giá trị (được làm tròn) 1 Btu = 1055,056 J là thích hợp.
3.1.2
Hệ số nén (compressibility factor)
Z
Tỷ số của thể tích thực của khối lượng khí nhất định tại nhiệt độ và áp suất quy định với thể tích của nó được tính từ định luật khí lý tưởng ở cùng các điều kiện.
3.1.3
Nhiệt trị tổng (gross heating value)
Lượng nhiệt được sinh ra từ việc đốt cháy lý tưởng, hoàn toàn khí trong không khí, tại nhiệt độ tiêu chuẩn, trong đó tất cả nước được tạo thành bởi phản ứng ngưng tụ thành lỏng. Các giá trị đối với các khí tinh khiết xuất hiện trong Tiêu chuẩn GPA 2145, được soát xét hàng năm. Dù nhiệt trị tổng thường tính theo thể tích hơn là theo khối lượng hoặc theo mol, vẫn phải quy định áp suất chuẩn.
3.1.4
Nhiệt trị thực (net heating value)
Lượng nhiệt được sinh ra từ việc đốt cháy toàn bộ khí tại nhiệt độ tiêu chuẩn trong đó tất cả nước được tạo thành bởi phản ứng giữ nguyên ở trạng thái hơi. Sự ngưng tụ của nước có sẵn trong khí (nước “spectator”) không tính vào nhiệt trị thực. Dù nhiệt trị thực thường tính theo thể tích hơn là theo khối lượng hoặc theo mol, vẫn phải quy định áp suất chuẩn.
3.1.5
Tỷ khối (relative density)
Tỷ số của khối lượng riêng của nhiên liệu dạng khí, dưới các điều kiện nhiệt độ và áp suất quan sát, với khối lượng riêng của không khí khô (có hàm lượng cacbon dioxit bình thường) tại cùng nhiệt độ và áp suất.
3.1.6
Mét khối tiêu chuẩn của khí [standard cubic metric of gas]
Lượng khí chiếm 1 m3 (hoặc 1 ft3) tại nhiệt độ 15,6 °C (60 °F) dưới áp suất chuẩn nhất định và hoặc được bão hoà với hơi nước (ướt) hoặc không có hơi nước (khô) như đã quy định (xem ANSI Z 132.1). Trong tiêu chuẩn này, các phép tính đã được thực hiện tại áp suất 14.696 psia và nhiệt độ 15,6 °C (60 °F), vì GPA 2145 được Trung tâm nghiên cứu nhiệt động học Hoa kỳ (Thermodynamics Research Center) cập nhật hàng năm, các phép tính này được dựa trên cơ sở GPA 2145, được đưa ra cho áp suất chuẩn này. Các chuyển đổi sang các điều kiện chuẩn khác nên được thực hiện khi kết thúc phép tính để giảm thiểu các sai số do làm tròn.
3.1.7
Nhiệt độ tiêu chuẩn 15,6 °C (60 °F) [standard temperature 15,6 °C (60 °F)]
3.2 Ký hiệu
3.2.1 Thuật ngữ
| 3.2.1.1 | B - | Hệ số virian thứ hai của hỗn hợp khí |
| 3.2.1.2 |
| hệ số tổng để tính hiệu chính khí thực (phương pháp thay thế) |
| 3.2.1.3 | (cor) - | được hiệu chính đối với hàm lượng nước |
| 3.2.1.4 | (dry) - | giá trị trên cơ sở không có nước |
| 3.2.1.5 | d - | khối lượng riêng của khí so với khối lượng riêng của không khí |
| 3.2.1.6 | did -
| tỷ khối lý tưởng hoặc tỷ khối mol, đó là khối lượng mol khí so với khối lượng mol của không khí |
| 3.2.1.7 | Gid - | tỷ lệ khối lượng mol |
| 3.2.1.8 |
| nhiệt trị tổng trên đơn vị khối lượng |
| 3.2.1.9 |
| nhiệt trị tổng trên đơn vị thể tích |
| 3.2.1.10 |
| nhiệt trị tổng trên đơn vị mol |
| 3.2.1.11 |
| nhiệt trị thực trên đơn vị khối lượng |
| 3.2.1.12 |
| nhiệt trị thực trên đơn vị thể tích |
| 3.2.1.13 |
| nhiệt trị thực trên đơn vị mol |
| 3.2.1.14 | a, b, c - trong phương trình 1, các số nguyên được yêu cầu để cân bằng phương trình: C, cacbon; H, hydro; S, lưu huỳnh; O, oxy | |
| 3.2.1.15 | (id) - | trạng thái khí lý tưởng |
| 3.2.1.16 | (l) - | pha lỏng |
| 3.2.1.17 | M - | khối lượng phân tử gam |
| 3.2.1.18 | m - | tốc độ lưu lượng-khối lượng |
| 3.2.1.19 | n - | số các cấu tử |
| 3.2.1.20 | P - | áp suất tính theo đơn vị tuyệt đối (psia) |
| 3.2.1.21 | Qid - | năng lượng lý tưởng trên đơn vị thời gian được giải phóng là nhiệt đốt cháy |
| 3.2.1.22 | R - | hằng số khí, 10,7316 psia.ft3/(lb mol.R) trong tiêu chuẩn này (trên cơ sở R = 8,314 48 J/(mol.K) |
| 3.2.1.23 | (sat) - | biểu thị giá trị bão hoà |
| 3.2.1.24 | T - | nhiệt độ tuyệt đối, °R = °F + 459,67 hoặc K = °C + 273,15 |
| 3.2.1.25 | (T, P) - | giá trị phụ thuộc vào nhiệt độ và áp suất |
| 3.2.1.26 | V - | lưu lượng thể tích khí |
| 3.2.1.27 | x - | phần mol |
| 3.2.1.28 | Z - | độ lặp lại hệ số nén khí của tính chất |
| 3.2.1.29 | l - | độ lặp lại của tính chất |
| 3.2.1.30 | ρ - | khối lượng riêng tính bằng khối lượng trên đơn vị thể tích |
| 3.2.1.31 |
| đặc tính được cộng đối với các cấu tử 1 thông quan n, trong đó n đại diện cho tổng số số các cấu tử trong hỗn hợp |
| 3.2.2 Chỉ số trên |
| |
| 3.2.2.1 | id - | giá trị khí lý tưởng |
| 3.2.2.2 | l - | lỏng |
| 3.2.2.3 | σ - | giá trị tại bão hoà (áp suất hơi) |
| 3.2.2.4 | ‘ - | độ tái lập |
| 3.2.3 Chỉ số dưới |
| |
| 3.2.3.1 | α - | giá trị đối với không khí |
| 3.2.3.2 | a - | số tương đối của các nguyên tử cacbon trong phương trình 1 |
| 3.2.3.3 | b - | số tương đối của các nguyên tử hydro trong phương trình 1 |
| 3.2.3.4 | c - | số tương đối của các nguyên tử lưu huỳnh trong phương trình 1 |
| 3.2.3.5 | j - | đặc tính đối với cấu tử j |
| 3.2.3.6 | ii - | đặc tính khí không lý tưởng đối với cấu tử i |
| 3.2.3.7 | ij - | đặc tính khí không lý tưởng đối với hỗn hợp của i và j |
| 3.2.3.8 | jj - | đặc tính khí không lý tưởng đối với cấu tử j |
| 3.2.3.9 | w - | giá trị đối với nước |
| 3.2.3.10 | 1 - | đặc tính đối với cấu tử 1 |
| 3.2.3.11 | 2 - | đặc tính đối với cấu tử 2 |
4 Tóm tắt phương pháp
Nhiệt trị khí lý tưởng và tỷ khối của khí lý tưởng tại các điều kiện chuẩn (áp suất 14,696 psia và nhiệt độ 15,6 °C (60 °F) được tính từ thành phần phân tử gam và các giá trị khí lý tưởng tương ứng đối với các cấu tử; sau đó các giá trị này được điều chỉnh bằng hệ số nén đã tính.
5 Ý nghĩa và sử dụng
5.1 Nhiệt trị là thước đo độ thích hợp của khí tinh khiết hoặc hỗn hợp khí để sử dụng làm nhiên liệu; nó biểu thị lượng năng lượng có thể nhận được là nhiệt bằng cách đốt cháy một đơn vị khí. Đối với việc sử dụng làm các tác nhân gia nhiệt, giá trị tương đối của các khí từ các nguồn khác nhau và có các thành phần khác nhau có thể được so sánh dễ dàng trên cơ sở các nhiệt trị của chúng. Do vậy, nhiệt trị được sử dụng làm thông số để xác định giá thành của khí trong giao nhận thương mại. Nó cũng là một hệ số cơ bản trong cách tính hiệu suất của các thiết bị chuyển đổi năng lượng như các tuốc bin đốt bằng khí. Các nhiệt trị của khí phụ thuộc không chỉ vào nhiệt độ và áp suất mà còn phụ thuộc vào mức độ bão hòa của hơi nước. Tuy nhiên, một số phương pháp tính nhiệt lượng để đo nhiệt trị được dựa trên cơ sở khí đang được bão hòa với nước tại các điều kiện quy định.
5.2 Tỷ khối (tỷ trọng) của khí được xác định là khối lượng riêng của khí khi được so sánh với khối lượng riêng của không khí trong cùng các điều kiện.
6 Phương pháp phân tích
Xác định các thành phần phân tử gam của khí theo các phương pháp ASTM hoặc GPA bất kỳ thu được thành phần đầy đủ, trừ nước, nhưng bao gồm tất cả các cấu tử có hàm lượng bằng hoặc lớn hơn 0,1 %, theo các cấu tử hoặc các nhóm cấu tử được nêu trong Bảng 1. Ít nhất 98 % mẫu phải được báo cáo là các cấu tử đơn lẻ (đó là, không nhiều hơn tổng số 2 % được báo cáo là các nhóm các cấu tử như là các butan, pentan, hexan, buten và v.v...). Nhóm bất kỳ được sử dụng phải là một trong những nhóm được liệt kê trong Bảng 1 đối với các giá trị trung bình xuất hiện. Nếu thích hợp, các mẫu cần thử nghiệm có thể áp dụng các phương pháp thử sau đây: ASTM D 1717, TCVN 9794 (ASTM D 1945), TCVN 8360 (ASTM D 2163) và ASTM D 2650.
7 Tính toán - Các giá trị khí lý tưởng; nhiệt trị lý tưởng
7.1 Nhìn chung phản ứng cháy lý tưởng đối với nhiên liệu và không khí trong trạng thái khi lý tưởng là:
CaHbSc(id) + (a + b/4 + c)O2(id) = aCO2(id) + (h/2)H2O(id hoặc l) + cSO2(id) (1)
Trong đó id biểu thị trạng thái khí lý tưởng và l biểu thị pha lỏng. Các kết quả nhiệt trị thực lý tưởng khi tất cả nước giữ lại ở trạng thái khí lý tưởng. Các kết quả nhiệt trị tổng lý tưởng khi tất cả nước được tạo thành bởi phản ứng ngưng tụ thành chất lỏng. Đối với nước, phản ứng khử từ H2O(id) thành H2O(l) là ![]() -
- ![]() , entanpy lý tưởng của hơi, lớn hơn entanpy của hơi
, entanpy lý tưởng của hơi, lớn hơn entanpy của hơi ![]() -
- ![]() .
.
7.1.1 Vì các kết quả nhiệt trị tổng từ phản ứng cháy lý tưởng, mối quan hệ khí lý tưởng áp dụng. Nhiệt trị tổng lý tưởng trên đơn vị khối lượng đối với hỗn hợp, ![]() , là
, là

trong đó: xj là phần mol của cấu tử j, Mj là khối lượng phân tử gam của cấu tử j từ Bảng 1, và n là tổng số các cấu tử.
7.1.2 là cấu tử tinh khiết, nhiệt trị tổng lý tưởng trên đơn vị khối lượng đối với cấu tử j (tại nhiệt độ 15,6 °C (60 °F) trong Bảng 1. Các giá trị
là không phụ thuộc vào áp suất, nhưng chúng thay đổi theo nhiệt độ.
7.2 Khối lượng riêng khí lý tưởng
7.2.1 Khối lượng riêng khí lý tưởng, ρid, là:

trong đó, M là khối lượng phân tử gam của hỗn hợp

P là áp suất chuẩn tính bằng đơn vị tuyệt đối (psia), R là hằng số khí, trong tiêu chuẩn này là 10,7316 psia.ft3/(lb mol•°R), dựa trên cơ sở R = 8,31448 J/(mol•K), T là nhiệt độ chuẩn tính bằng đơn vị tuyệt đối (°R = °F + 456,67). Các giá trị của khối lượng riêng khí lý tưởng tại nhiệt độ 15,6 °C (60 °F) và 14.696 psia là trong Tiêu chuẩn GPA 2165.
Bảng 1 - Các tính chất của các cấu tử khí thiên nhiên tại 15,6 °C (60 °F) và 14,696 psia
| Hợp chất | Công thức | Khối lượng phân tử gam | Khối lượng phân tử gam, tỷ lệ, G | Nhiệt trị tổng lý tưởng | Nhiệt trị thực lý tưởng | Hệ số tổng | ||||
|
kJ•mol-1 |
Btu•lbm-1 |
Btu•ft-3 |
kJ•mol-1 |
Btu•lbm-1 |
Btu•ft-3 | |||||
| Hydro | H2 | 2,0159 | 0,06960 | 286,20 | 61022 | 324,2 | 241,79 | 51566 | 273,93 | 0 |
| Heli | He | 4,0026 | 0,13820 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Nước | H2O | 18,0153 | 0,62202 | 44,409 | 1059,8 | 50,312 | 0 | 0 | 0 | 0,0623 |
| Cacbon monoxit | CO | 28,010 | 0,96711 | 282,9 | 4342 | 320,5 | 282,9 | 4342 | 320,5 | 0,0053 |
| Nitơ | N2 | 28,0134 | 0,96723 | 0 | 0 | 0 | 0 | 0 | 0 | 0,0044 |
| Oxy | O2 | 31,9988 | 1,1048 | 0 | 0 | 0 | 0 | 0 | 0 | 0,0073 |
| Hydro sulfua | H2S | 34,08 | 1,1767 | 562,4 | 7094,2 | 637,1 | 517,99 | 6534 | 586,8 | 0,0253 |
| Argon | Ar | 39,948 | 1,3793 | 0 | 0 | 0 | 0 | 0 | 0 | 0,0071 |
| Cacbon dioxit | CO2 | 44,010 | 1,5196 | 0 | 0 | 0 | 0 | 0 | 0 | 0,0197 |
| Không khí | E | 28,9625 | 1,0000 | 0 | 0 | 0 | 0 | 0 | 0 | 0,0050 |
| Metan | CH4 | 16,043 | 0,55392 | 891,63 | 23891 | 1010,0 | 802,71 | 21511 | 909,4 | 0,0116 |
| Etan | C2H6 | 30,070 | 1,0382 | 1562,06 | 22333 | 1769,7 | 1428,83 | 20429 | 1618,7 | 0,0239 |
| Propan | C3H8 | 44,097 | 1,5226 | 2220,99 | 21653 | 2516,1 | 2043,3 | 19922 | 2314,9 | 0,0344 |
| i-Butan | C4H10 | 58,123 | 2,0068 | 2870,45 | 21232 | 3251,9 | 2648,4 | 19590 | 3000,4 | 0,0458 |
| n-Butan | C4H10 | 58,123 | 2,0068 | 2879,63 | 21300 | 3262,3 | 2657,6 | 19658 | 3010,8 | 0,0478 |
| i-Pentan | C5H12 | 72,150 | 2,4912 | 3531,5 | 21043 | 4000,9 | 3265,0 | 19456 | 3699,0 | 0,0581 |
| n-Pentan | C5H12 | 72,150 | 2,4912 | 3535,8 | 21085 | 4008,9 | 3269,3 | 19481 | 3703,9 | 0,0631 |
| n-Hexan | C6H14 | 86,177 | 2,9755 | 4198,1 | 20943 | 4755,9 | 3887,2 | 19393 | 4403,9 | 0,0802 |
| n-Heptan | C7H16 | 100,204 | 3,4598 | 4857,2 | 20839 | 5502,5 | 4501,9 | 19315 | 5100,3 | 0,0944 |
| n-Octan | C8H18 | 114,231 | 3,9441 | 5515,9 | 20759 | 6248,9 | 5116,2 | 19256 | 5796,2 | 0,1137 |
| n-Nonan | C9H20 | 128,258 | 4,4284 | 6175,9 | 20701 | 6996,5 | 5731,8 | 19213 | 6493,6 | 0,1331 |
| n-Decan | C10H22 | 142,285 | 4,9127 | 6834,9 | 20651 | 7742,9 | 6346,4 | 19176 | 7189,9 | 0,1538 |
| Neopentan | C5H12 | 72,015 | 2,4912 | 3517,27 | 20958 | 3985 | 3250,8 | 19371 | 3683 |
|
| 2-Metylpentan | C6H14 | 86,177 | 2,9755 | 4190,43 | 20905 | 4747 | 3879,6 | 19355 | 4395 | 0,080 |
| 3-Metylpentan | C5H14 | 86,177 | 2,9755 | 4193,03 | 20918 | 4750 | 3882,2 | 19367 | 4398 | 0,080 |
| 2,2-Dimetylbutan | C6H14 | 86,177 | 2,9755 | 4180,63 | 20856 | 4736 | 3869,8 | 19306 | 4384 | 0,080 |
| 2,3-Dimetylbutan | C6H14 | 86,177 | 2,9755 | 4188,41 | 20895 | 4745 | 3877,5 | 19344 | 4393 | 0,080 |
| Cyclopropan | C3H6 | 42,081 | 1,4529 | 2092,78 | 21381 | 2371 | 1959,6 | 20020 | 2220 |
|
| Cyclobutan | C4H8 | 56,108 | 1,9373 | 2747,08 | 21049 | 2747 | 2569,4 | 19688 | 2911 |
|
| Cyclopentan | C5H10 | 70,134 | 2,4215 | 3322,04 | 20364 | 3764 | 3100,0 | 19003 | 3512 |
|
| Cyclohexan | C6H12 | 84,161 | 2,9059 | 3955,84 | 20208 | 4482 | 3689,4 | 18847 | 4180 |
|
| Etyn (acetylen) | C2H2 | 26,038 | 0,8990 | 1301,32 | 21487 | 1474 | 1256,9 | 20753 | 1424 | 0,021 |
| Eten (etylen) | C2H4 | 28,054 | 0,9686 | 1412,06 | 21640 | 1600 | 1323,2 | 20278 | 1499 | 0,020 |
| Propen (propylen) | C3H6 | 42,081 | 1,4529 | 2059,35 | 21039 | 2333 | 1926,1 | 19678 | 2182 | 0,033 |
| Benzen | C6H6 | 78,114 | 2,6971 | 3202,74 | 18177 | 3742 | 3169,5 | 17444 | 3591 | 0,069 |
| Các Butan(ave) | C4H10 | 58,123 | 2,0068 | 2875 | 21266 | 3257 | 2653 | 19623 | 3006 | 0,046 |
| Các Pentan(ave) | C5H12 | 72,150 | 2,4912 | 3534 | 21056 | 4003 | 3267 | 19469 | 3702 | 0,062 |
| Các Hexan(ave) | C6H14 | 86,177 | 2,9755 | 4190 | 20904 | 4747 | 3879 | 19353 | 4395 | 0,080 |
| Các Buten(ave) | C4H8 | 56,108 | 1,9372 | 2716 | 20811 | 3077 | 2538 | 19450 | 2876 | 0,046 |
| Các Penten (ave) | C5H10 | 70,134 | 2,4215 | 3375 | 20691 | 3824 | 3153 | 19328 | 3572 | 0,060 |
7.3 Tỷ khối lý tưởng
7.3.1 Tỷ khối lý tưởng did là:
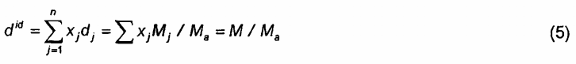
Trong đó: Ma là khối lượng phân tử gam của không khí. Tỷ khối lý tưởng là tỷ lệ khối lượng phân tử gam.
7.4 Nhiệt trị tổng trên đơn vị thể tích
7.4.1 Tích của nhiệt trị tổng trên đơn vị khối lượng với khối lượng riêng khí lý tưởng cho nhiệt trị tổng trên đơn vị thể tích, ![]() :
:

là nhiệt trị tổng cấu tử tinh khiết trên đơn vị thể tích đối với cấu tử i tại nhiệt độ và áp suất quy định [15,6 °C (60 °F) và 14.696 psia trong Bảng 1, các giá trị khí lý tưởng]
7.4.2 Sự chuyển đổi các giá trị trong Bảng 1 sang áp suất khác nhau trên cơ sở các kết quả từ tích tỷ số áp suất:
![]() (P) =
(P) = ![]() (P = 14,696) × P / 14,696 (7)
(P = 14,696) × P / 14,696 (7)
7.5 Các giá trị khí lý tưởng - Hệ số nén
7.5.1 Hệ số nén là:
Z (T,P) = ρid / ρ = (MP / RT)/ ρ (8)
trong đó p là khối lượng riêng khí lý tưởng tính bằng khối lượng trên đơn vị thể tích. Tại các điều kiện gần môi trường xung quanh, phương trình trạng thái virian rút gọn tiêu biểu cho tính chất thể tích của khí thiên nhiên
Z (T,P) = 1 + BP / RT (9)
trong đó B là hệ số virian thứ hai đối với hỗn hợp khí. Hệ số virian thứ hai đối với hỗn hợp là:
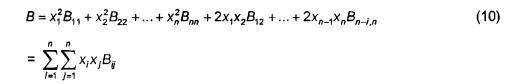
Trong đó Bjj là hệ số virian thứ hai của cấu tử j và Bij là hệ số virian chéo thứ hai của cấu tử i và cấu tử j. Các hệ số virian thứ hai là các hàm số của nhiệt độ. Phương trình 9 có thể được sử dụng với phương trình 10 để tính hệ số nén cho các gốc áp suất khác nhau, nhưng nó không chính xác tại các áp suất lớn hơn hai atmosphe. Xử lý đặc biệt là không yêu cầu đối với H2 và He tại phần mol lên đến 0,01. Các phép tính có thể được thực hiện với Bjj = 0 đối với hydro và heli.
7.5.2 Phương trình 9 và phương trình 10 cho phép tính của Z(T,P) đối với hỗn hợp khí là chặt chẽ mà yêu cầu các phép tính có thể xem xét và thông tin thường không sẵn có. Một cách biểu thị xấp xỉ, thay thế đối với Z(T,P) là thuận lợi hơn đối với các phép tính thủ công là:

trong đó βjj = βjj/RT và ![]() j là hệ số tổng đối với cấu tử j. Các giá trị
j là hệ số tổng đối với cấu tử j. Các giá trị ![]() của tại nhiệt độ 15,6 °C (60 °F) xuất hiện trong Bảng 2. Phương pháp dựa trên phương trình 11 đã được chấp nhận đối với tiêu chuẩn này.
của tại nhiệt độ 15,6 °C (60 °F) xuất hiện trong Bảng 2. Phương pháp dựa trên phương trình 11 đã được chấp nhận đối với tiêu chuẩn này.
7.6 Khối lượng riêng khí thực
7.6.1 Khối lượng riêng khí thực ρ tại nhiệt độ và áp suất cụ thể là:
ρ = ρid/Z (12)
trong đó ρid và Z được đánh giá tại cùng một nhiệt độ và áp suất.
7.7 Tỷ khối thực
7.7.1 Tỷ khối thực d là:
d = ρ/ρα = MZα/MαZ (13)
7.8 Nhiệt trị thực
Nhiệt trị thực không nhận được bằng cách chia nhiệt trị lý tưởng cho hệ số nén. Các nhiệt trị khí thực khác với các nhiệt trị khí lý tưởng bởi nhỏ hơn một phần 104 tại áp suất 14,696 psia, là số thứ tự của độ chính xác của các nhiệt trị.
7.9 Nhiệt trị tổng của khí ướt nước
7.9.1 Nếu khí có chứa nước như một cấu tử nhưng phân tích thành phần ở điều kiện khô, nó cần phải được điều chỉnh các phần mol để phản ánh sự có mặt của nước. Các phần mol được hiệu chính là:
xj(cor) = xj(1 - xw) (14)
Phần mol của nước có thể dải từ 0 đến giá trị bão hòa. Giá trị bão hòa đối với xw là, giả định tuân theo định luật Raoult:
xw(sat) = ![]() (15)
(15)
Trong đó: ![]() là áp suất hơi của nước [0,25636 psia tại nhiệt độ 15,6 °C (60 °F)].
là áp suất hơi của nước [0,25636 psia tại nhiệt độ 15,6 °C (60 °F)].
7.9.2 Về mặt kỹ thuật, nước có nhiệt trị tổng, entanpy lý tưởng của sự ngưng tụ. Nếu chỉ nước được tạo thành trong quá trình đốt cháy ngưng tụ, khi đó nhiệt được giải phóng trong quá trình đốt cháy của khí ướt với không khí khô trở thành:
(khí ướt) = (1 - xw)
![]() (khí khô) (16)
(khí khô) (16)
Đối với khí đã bão hòa nước, xw, tại nhiệt độ 15,6 °C (60 °F) là 0,25636/Pb trong đó Pb là áp suất chuẩn. Phương trình 16 là thích hợp đối với ứng dụng giao nhận thương mại như là vấn đề xác định. Tuy nhiên, phương trình này không mô tả chính xác tác động của nước lên nhiệt trị. Phụ lục A có kiểm tra nghiêm ngặt tác động của nước.
Bảng 2 - Ví dụ các phép tính về các tính chất khí tại nhiệt độ 15,6 °C (60 °F) và áp suất 14,696 psia (Phân tích khí trên cơ sở khô)A
| Hợp chất | xj | ni | βi | γi |
|
| bi | xiαi | xiβi | xiγi | xi | xi | xibi |
| Metan | 0,8302 | 1 | 4 | 0 | 1010,0 | 0,55392 | 0,0116 | 0,8302 | 3,3208 | 0 | 838,5 | 0,4599 | 0,00963 |
| Etan | 0,0745 | 2 | 6 | 0 | 1769,7 | 1,03820 | 0,0239 | 0,1490 | 0,4470 | 0 | 131,8 | 0,0773 | 0,00178 |
| Propan | 0,0439 | 3 | 8 | 0 | 2516,1 | 1,52260 | 0,0344 | 0,1317 | 0,3512 | 0 | 110,5 | 0,0668 | 0,00151 |
| i-Butan | 0,0083 | 4 | 10 | 0 | 3251,9 | 2,00680 | 0,0458 | 0,0332 | 0,0830 | 0 | 27,0 | 0,0167 | 0,00038 |
| n-Butan | 0,0108 | 4 | 10 | 0 | 3262,3 | 2,00680 | 0,0478 | 0,0432 | 0,1080 | 0 | 35,2 | 0,0217 | 0,00052 |
| i-Pentan | 0,0031 | 5 | 12 | 0 | 4000,9 | 2,49120 | 0,0581 | 0,0155 | 0,0372 | 0 | 12,4 | 0,0077 | 0,00018 |
| ˄Psentan | 0,0025 | 5 | 12 | 0 | 4008,9 | 2,49120 | 0,0631 | 0,0125 | 0,03 | 0 | 10,0 | 0,0062 | 0,00016 |
| Hexan | 0,0030 | 6 | 14 | 0 | 4755,9 | 2,97550 | 0,0802 | 0,0180 | 0,0420 | 0 | 14,3 | 0,0089 | 0,00024 |
| Heli | 0,0003 | 0 | 0 | 0 | 0 | 0,13820 | 0 | 0 | 0 | 0 | 0 | 0,0000 | 0,00000 |
| Nitơ | 0,0032 | 0 | 0 | 0 | 0 | 0,96723 | 0,0044 | 0 | 0 | 0 | 0 | 0,0031 | 0,00001 |
| Cacbon dioxit | 0,0202 | 0 | 0 | 0 | 0 | 1,51960 | 0,0197 | 0 | 0 | 0 | 0 | 0,0307 | 0,00040 |
| Tổng | 1,0000 | … | … | … | … | … | … | 1,2333 | 4,4192 | 0 | 1179,7 | 0,6991 | 0,01481 |
| A xw = (0,25636)/14,696 = 0,0174 Gid (khí khô) = 0,6991 Z (khí khô) = 1 - [0,01481] 2(14,696) = 0,9968 Z (không khí khô) = 1 - [0,0050]2(14,696) = 0,9996 G (khí khô, không khí khô) = 0,6991(0,9996)/0,9968 = 0,7011 G (khí khô, không khí bão hoà) = 0,6991 (0,9995)/0,9968 = 0,7010 Hvid (khí khô, không khí khô) = 1179,7 Btu.ft-3 Hvid (khí bão hoà, không khí khô) = 1179,7(0,9826) = 1159,1 Btu.ft-3 l - xw = 0,9826 Gid (khí bão hòa) = 0,6991(0,9826) + 0,0174(0,62202) = 0,6978 Z (khi bão hòa) = 1 - [0,9826(0,01481) + 0,0174(0,0623)]2(14,696) = 0,9964 Z (không khí bão hoà) = 1 - [0,9826(0,0050) + 0,0174(0,0623)]2(14,696) = 0,9995 G (khí bão hòa, không khí khô) = 0,6978(0,9996)/0,9964 = 0,7001 G (khí bão hòa, không khí bão hòa) = 0,6978(0,9995)/0,9964 = 0,7000 {Hvid/Z} (khí khô, không khí khô) = 1179,7/0,9968 = 1183,5 Btu.ft-3 {Hvid/Z} (khí bão hòa, không khí khô) = 1159,1/0,9964 = 1163,3 Btu.ft-3 | |||||||||||||
7.10 Tính năng lượng lý tưởng được giải phóng ra dạng nhiệt
7.10.1 Khi được nhân với lưu lượng khí, nhiệt trị tổng lý tưởng cung cấp năng lượng lý tưởng như là nhiệt trong quá trình đốt cháy, Qid, một đặc tính khí lý tưởng:
(17)
Trong đó m là tốc độ lưu lượng khối lượng. Đối với một khí lý tưởng, tốc độ lưu lượng khối lượng liên quan đến tốc độ lưu lượng thể tích, V id, bởi:
m = (18)
và
Qid = (19)
7.10.2 Tốc độ lưu lượng khí lý tưởng liên quan đến tốc độ lưu lượng khí thực
V id = V/Z (20)
Trong đó V là tốc độ lưu lượng thể tích khí thực và Z(T,P) là hệ số nén khí thực tại cùng T và P. Do vậy, kết hợp phương trình 20 và phương trình 21 có:
Qid = V/Z(T,P) (21)
CHÚ THÍCH 1: Năng lượng lý tưởng được giải phóng trên đơn vị thời gian như là nhiệt trong khi cháy, Qid có thể tính được sử dụng tốc độ lưu lượng khối lượng (phương trình 18), tốc độ lưu lượng khí lý tưởng (phương trình 20), hoặc tốc độ lưu lượng khí thực (phương trình 22), nhưng luôn luôn là một tính chất khí lý tưởng. Thương số của hệ số nén khí Z(T,P) không sinh ra nhiệt trị khí thực mà chỉ cho phép tính Qid sử dụng tốc độ lưu lượng khí thực hơn là tốc độ khí lý tưởng.
8 Độ chụm
8.1 Các tính chất được báo cáo trong tiêu chuẩn này có nguồn gốc từ entanpy thực nghiệm của các phép đo cháy, nói chung, được chính xác đến 1/1000. Các chữ số thêm xuất hiện trong các bảng kèm theo vấn đề liên quan với sai số tròn số và tính nhất quán nội bộ, nhưng chúng không có ý nghĩa. Xem Bảng 3.
Bảng 3 - Ví dụ các phép tính về các tính chất khí tại nhiệt độ 15,6 °C (60 °F) và áp suất 14,696 psia (Phân tích khí trên cơ sở ướt) A
CHÚ THÍCH: Chia Hvid cho Z không cho nhiệt trị khí thực nhưng đúng hơn là nhiệt trị khí lý tưởng trên feet khối thực. Các số bất kỳ được mang trừ 1/1000 là không có ý nghĩa mà chỉ sai số làm tròn. Mặc dù CO2 có một nguyên tử cacbon, α = 0 vì nó không phải là phần của công thức nhiên liệu CαHβSγ
| Hợp chất | xj | ni | βi | γi | | | bi | xjαi | xjβi | xjγi | xi | xj | xjbi |
| Metan | 0,8157 | 1 | 4 | 0 | 1010,0 | 0,55392 | 0,0116 | 0,8157 | 3,2629 | 0 | 823,9 | 0,4518 | 0,00946 |
| Ethan | 0,0732 | 2 | 6 | 0 | 1769,7 | 1,03820 | 0,0239 | 0,1464 | 0,4392 | 0 | 129,5 | 0,0760 | 0,00175 |
| Propan | 0,0431 | 3 | 8 | 0 | 2516,1 | 1,52260 | 0,0344 | 0,1294 | 0,3451 | 0 | 108,5 | 0,0657 | 0,00148 |
| i-Butan | 0,0082 | 4 | 10 | 0 | 3251,9 | 2,00680 | 0,0458 | 0,0326 | 0,0816 | 0 | 26,5 | 0,0164 | 0,00037 |
| n-Butan | 0,0106 | 4 | 10 | 0 | 3262,3 | 2,00680 | 0,0478 | 0,0424 | 0,1061 | 0 | 34,6 | 0,0213 | 0,00051 |
| i-Pentan | 0,0030 | 5 | 12 | 0 | 4000,9 | 2,49120 | 0,0581 | 0,0152 | 0,0366 | 0 | 12,2 | 0,0076 | 0,00018 |
| n-Pentan | 0,0025 | 5 | 12 | 0 | 4008,9 | 2,49120 | 0,0631 | 0,0123 | 0,0295 | 0 | 9,8 | 0,0061 | 0,00015 |
| Hexan | 0,0029 | 6 | 14 | 0 | 4755,9 | 2,97550 | 0,0802 | 0,0177 | 0,0413 | 0 | 14,0 | 0,0088 | 0,00024 |
| Heli | 0,0003 | 0 | 0 | 0 | 0 | 0,13820 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Nitơ | 0,0031 | 0 | 0 | 0 | 0 | 0,96723 | 0,0044 | 0 | 0 | 0 | 0 | 0,0030 | 0 |
| Cacbon dioxit | 0,0198 | 0 | 0 | 0 | 0 | 1,51960 | 0,0197 | 0 | 0 | 0 | 0 | 0,0302 | 0,00039 |
| Water | 0,0174 | 0 | 0 | 0 | 50,3 | 0,62202 | 0,0623 | 0 | 0 | 0 | 0,9 | 0,0108 | 0,00109 |
| Tổng | 1,0000 |
|
|
|
|
|
| 1,2118 | 4,3421 | 0 | 1160,0 | 0,6977 | 0,01564 |
| A Gid (khí bão hòa) = 0,6977 Z (khí bão hòa) = 1 - [0,01564]2(14,696) = 0,9964 Z (không khí khô) = 1 - [0,0050]2(14,696) = 0,9996 G (khí bão hòa, không khí khô) = 0,6977(0,9996)/0,9964 = 0,6999 Hvid (khí bão hòa, không khí khô) = 1160,0 - 0,9 = 1159,1 Btu-fr3 Z(sat air) = 1 -(0,9826(0,050) + 0,0174(0,0623)]2(14,696) = 0,9995 G (khí bão hòa, không khí bão hòa) = 0,6977(0,9995)/0,9S64 = 0,6999 (Hvid /Z)( khí bão hòa, không khi khô) = 1159,1/(0,9964) = 1163,3 Btu-fr3 | |||||||||||||
8.2 Các giá trị của các tính chất trong tiêu chuẩn này là những giá trị xuất hiện trong tiêu chuẩn GPA 2172-97, Hình 23-2 của Sổ tay dữ liệu công trình GPSA, GPA TP-17, và TRC các Bảng nhiệt động học TRC- Hydrocacbon. Tiêu chuẩn GPA 2145 được cập nhật hằng năm và các giá trị trong tiêu chuẩn đó nên được sử dụng trong tất cả các phép tính.
CHÚ THÍCH 2: Ba nguồn sai số phải được xem xét: các sai số về nhiệt trị của các cấu tử, sai số về hệ số nén đã tính và sai số về thành phần. Độ không đảm bảo (hai lần độ lệch chuẩn) của các nhiệt trị khí lý tưởng đối với các cấu tử nên là 0,03 %. Các sai số như vậy ảnh hưởng đến độ chệch và sự thỏa thuận giữa các nhiệt trị đã tính và nhiệt trị đo được, nhưng chúng không ảnh hưởng đến độ chụm. Sai số về hệ số nén đã tính khác với thành phần của khí, nhưng đối khí thiên nhiên, sai số này nên nhỏ hơn 0,03 % và được so sánh không đáng kể với các sai số phát sinh từ độ không đảm bảo về thành phần. Trong tiêu chuẩn này, các sai số về các nhiệt trị của các cấu tử và hệ số nén tính được, Z, được bỏ qua. Độ chụm của phương pháp liên quan đến độ lặp lại và độ tái lập của phép phân tích.
CHÚ THÍCH 3: Điều quan trọng bao gồm tất cả các cấu tử trong mẫu khí xuất hiện với các phần mol lớn hơn hoặc bằng 0,001 trong phép phân tích. Một số phép phân tích hằng ngày không xác định các hợp chất như He và H2S, nhưng các hợp chất này là quan trọng đối với các phép tính.
8.3 Độ lặp lại
8.3.1 Nếu tất cả các cấu tử được phân tích và các kết quả được chuẩn hóa, khi đó độ lặp lại của nhiệt trị , δH là:
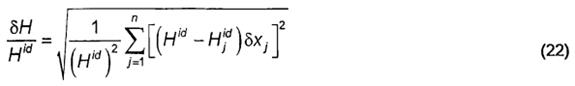
8.3.2 Nếu các kết quả của phép phân tích được thực hiện thành tổng đến 1,0 bằng cách tính phần mol metan là độ chênh lệch giữa 1,0 và tổng của các phần mol của các cấu tử khác, khi đó

Trong đó δxj là độ lặp lại của phương pháp phân tích đối với cấu tử j. Độ chênh lệch giữa các nhiệt trị tính được từ các cặp phân tích liên tiếp được thực hiện bởi cùng một người phân tích sử dụng cùng mẫu khí và cùng thiết bị nên vượt quá 2δH chỉ trong 5 % của các thử nghiệm khi δH được lấy như là một độ lệch chuẩn.
8.4 Độ tái lập
Độ tái lập δH được tính từ phương trình 25 và phương trình 26 sử dụng δx’j, độ tái lập của phương pháp phân tích của hợp chất j. Độ chênh lệch giữa các nhiệt trị tính được từ phép phân tích nhận được trong các phòng thử nghiệm khác nhau được dự kiến vượt quá δH’ đối với chỉ 5 % của phép phân tích.
Phụ lục A
(tham khảo)
Ảnh hưởng của nước đến nhiệt trị
A.1 Giao nhận thương mại khí thiên nhiên sử dụng phương trình giá đơn giản công bố giá của khí là tỷ lệ năng lượng được giải phóng trong quá trình đốt nhân với giá của khí trên đơn vị năng lượng nhân thời gian hoặc khoảng thời gian tính. Tỷ lệ năng lượng được giải phóng trong quá trình đốt là sản phẩm của nhiệt trị của khí và lưu lượng của khí. Lưu lượng của khí yêu cầu sự hiểu biết về hệ số nén và tỷ khối của khí. Tất cả ba tính chất giao nhận thương mại (nhiệt trị, hệ số nén và tỷ khối) có thể được tính toán từ thành phần được nêu trong các bảng đặc tính cấu tử tinh khiết. Các phương trình để tính toán các tính chất của khí thiên nhiên khô đã được biết rõ, nhưng phụ lục này cũng trình bày nội dung ảnh hưởng của nước có trong khí và trong không khí được sử dụng để đốt cháy khí.
A.2 Nhiệt trị của khí thiên nhiên là giá trị tuyệt đối của entanpy của sự cháy trong phản ứng cháy lý tưởng. Do vậy, nhiệt trị là tính chất khí lý tưởng có thể tính được rõ ràng từ các bảng của các giá trị cấu tử tinh khiết và nó không phụ thuộc vào áp suất.
A.3 Tất cả phản ứng cháy lý tưởng với nhiên liệu và không khí trong trạng thái khí lý tưởng và khả năng của nước trong nhiên liệu và không khí là:
CαHβSγ(id) + (α + β/4 + γ)(1 + ε)O2(id) + 0,04383(α + β/4 + γ)(1 + ε)Ar(id) (A1)
+ [0,00162(α + β/4 + γ)(1 + ε) + xc/(1 - xN - xC)]CO2(id)
+ [3,72873(α + β/4 + γ)(1 + ε) + xN/(1 - xN - xC)]N2(id) + ()H2O(id)
= [α + 0,00162(α + β/4 + γ)(1 + ε) + xc/(1 - xN - xc)]CO2(id)
+ ![]() H2O(id) +
H2O(id) + ![]() H2O(1) + γSO2(id)
H2O(1) + γSO2(id)
+ [3,72873 (α + β/4 + γ)(1 + ε) + xN/(1 - xN - xc)]N2(id)
+ 0,04383(α + β/4 + γ)(1 + ε) + xc/(1 - xN - xc)]Ar(id) + (α + β/4 + γ)εO2(id)
Trong đó: α, β và γ là các hệ số tỷ lượng, ε là phần dư không khí, thành phần của không khí được giả định là trong Bảng A.1, là số mol nước có trong khí,
là số mol nước có trong không khí,
là số mol nước có trong hỗn hợp khí sản phẩm,
là số mol của khí ngưng tụ thực, xc là phần mol của CO2 trong khí, và xN là phần mol của N2 trong khí. Nếu không khí được bơm vào khí, giả định rằng ảnh hưởng được tính đối với phần dư ε. Hỗn hợp khí nhiên liệu có giá trị α, β và γ không phải là số nguyên.
A.4 Thông thường để xác định các trạng thái chuẩn giả định đối với nước được tạo thành bởi phản ứng được biểu thị trong phương trình (1) (đối lập với nước “spectator” đi vào phản ứng được thực hiện bởi khí hoặc không khí). Nếu chúng ta giả thiết rằng nước được tạo thành trong phản ứng giữ nguyên ở trạng thái khí lý tưởng, nhiệt trị được coi là “thực”. Nếu chúng ta giả thiết nước được tạo thành trong phản ứng ngưng tụ toàn bộ thành trạng thái lỏng, nhiệt trị được gọi là “tổng”. Nhiệt trị tổng lớn hơn nhiệt trị thực bởi entanpy lý tưởng của sự bay hơi nước.
Nhiệt trị (tổng) - Nhiệt trị (thực) = Hw(id) - Hw(l) (A.2)
trong đó:
H là entanpy
l là trạng thái lỏng, và
w là nước.
Lượng Hw(id) - Hw(l) là entanply lý tưởng của sự bay hơi nước.
A.5 Có thể tính nhiệt trị khí thực hơn là sử dụng trạng thái giả định, nhưng các phép tính là dài dòng, các giá trị bằng số thì khác nhau không đáng kể, và tính đơn giản toán học của phương trình xác định bị mất. Thông thường trong ngành công nghiệp khí để sử dụng nhiệt trị tổng đối với hầu hết các phép tính, do vậy để giữ nguyên phụ lục này, thuật ngữ “nhiệt trị" để cập là giá trị tổng.
A.6 Phương trình 7 trong Điều 7 cung cấp phương thức chuyển đổi nhiệt trị từ áp suất chuẩn này sang áp suất chuẩn khác. Ghi nhận khi sử dụng phương trình 7, nên được tính toán bằng cách sử dụng các giá trị từ Bảng 1 trước khí chuyển đổi áp suất; không nên chuyển đổi các giá trị đơn lẻ trong Bảng 1. Việc chuyển đổi sang nhiệt độ khác là phức tạp hơn. Dữ liệu nhiệt trị tồn tại ở 25 °C dựa trên cơ sở phản ứng:
CαHβSγ(id) + (α + β/4 + γ)O2(id) = αCO2(id) + (β/2)H2O(l) + γSO2(id) (A3)
A.7 Các thực nghiệm sử dụng oxy tinh khiết và được hiệu chính theo các tỷ lệ tỷ lượng. Cần phải hiệu chính các ảnh hưởng nhiệt nhạy tại nhiệt độ khác:
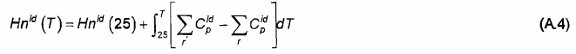
trong đó:
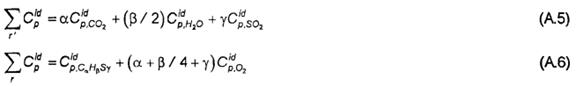
Và là nhiệt dung riêng lý tưởng tại áp suất không đổi, r biểu thị chất phản ứng và r’ biểu thị sản phẩm.
Bảng A.1 - Ví dụ phép tính độ chụm
| Hợp chất | Thành phần xj | Btu•ft3 | Độ lặp lại | Độ tái lập | ||
| δxj | (Btu•ft-3)2 | δx’j | (Btu•ft-3)2 | |||
| Metan | 0,8302 | 169,7 | 0,0010 | 0,029 | 0,0020 | 0,115 |
| Etan | 0,0745 | -590,0 | 0,0002 | 0,014 | 0,0004 | 0,056 |
| Propan | 0,0439 | -1336,4 | 0,0002 | 0,071 | 0,0004 | 0,286 |
| Isobutan | 0,0083 | -2072,2 | 0,0001 | 0,043 | 0,0002 | 0,171 |
| Butan | 0,0108 | -2082,6 | 0,0002 | 0,173 | 0,0004 | 0,694 |
| Isopentan | 0,0031 | -2821,2 | 0,0001 | 0,080 | 0,0002 | 0,318 |
| Pentan | 0,0025 | -2829,2 | 0,0001 | 0,080 | 0,0002 | 0,320 |
| Hexan | 0,0030 | -3576,2 | 0,0001 | 0,128 | 0,0002 | 0,512 |
| Heli | 0,0003 | 1179,7 | 0,0001 | 0,014 | 0,0002 | 0,056 |
| Nitơ | 0,0032 | 1179,7 | 0,0001 | 0,014 | 0,0002 | 0,056 |
| Cacbon dioxit | 0,0202 | 1179,7 | 0,0002 | 0,056 | 0,0004 | 0,223 |
| Tổng | 1,0000 |
|
| 0,702 |
| 2,807 |
Phụ lục B
(tham khảo)
Tính toán đối với nước
B.1 Nếu khí có chứa nước (hoặc phải được giả định là đã bão hòa) nhưng phân tích thành phần là ở trạng thái khô, cần phải điều chỉnh các phần mol để tính thực tế rằng nước được thay thế khí, do vậy làm giảm nhiệt trị. Phần mol của nước trong khí do sự xác định độ ẩm tương đối.
![]()
(trên cơ sở một mol của nhiên liệu CHS) trong đó hg là độ ẩm tương đối của khí, ![]() là áp suất hơi của nước, và nw biểu thị số mol của nước. Đối với khí bão hòa hg là đơn nhất. Sắp xếp lại phương trình B.1 có số mol của nước:
là áp suất hơi của nước, và nw biểu thị số mol của nước. Đối với khí bão hòa hg là đơn nhất. Sắp xếp lại phương trình B.1 có số mol của nước:
nw = xw/(1-xw) (B.2)
khi đó các phần mol hiệu chính trở thành:
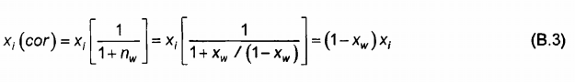
Và nhiệt trị trở thành:

Trong đó nước không được bao gồm trong các cấu tử N của tổng. Nếu phép phân tích thành phần xác định xw và nước được bao gồm trong các cấu tử N của tổng:

B.2 Cần thiết loại bỏ ảnh hưởng của nước vì, mặc dù nước có nhiệt trị, nó chỉ là ảnh hưởng ngưng tụ. Nước được mang bởi khí ướt (khí “spectator”) không ngưng tụ thực sự, và chỉ nước được tạo thành trong phản ứng góp phần vào nhiệt trị.
B.3 Việc xác định nước trong phương thức ở trên là đủ đối với các điều kiện giao nhận thương mại, nhưng khí thử trong các tình huống mô hình thực, vấn đề trở nên phức tạp hơn nhiều. Rõ ràng không phải toàn bộ nước phản ứng có thể ngưng tụ, vì trong trường hợp cả khí và không khí đều khô, một phần nước phản ứng bão hòa các khí sản phẩm và phần còn lại ngưng tụ.
Có thể xác định những ảnh hưởng này bằng phương pháp tổng quát. Để thực hiện, cần phải tính

Trong đó hα là độ ẩm tương đối của không khí. Phương trình B.6 và B.7 là các công thức của phương trình B.1 phản ánh các điều kiện đầu vào. Phương trình B.8 phản ánh phương trình B.1 đối với các sản phẩm khí đã bão hòa (nó phải được bão hòa trước khi bất kỳ nước nào có thể ngưng tụ). Phương trình B.9 là một cân bằng nước: β/2 là các số mol của nước được tạo thành bởi phản ứng, ![]() là các số mol của nước bão hoàn khí sản phẩm, và
là các số mol của nước bão hoàn khí sản phẩm, và là các số mol của nước ngưng tụ. Do vậy, hiệu chính hoàn toàn đối với ảnh hưởng nước lên nhiệt trị là:
![]()
B.4 Phụ thuộc vào các độ ẩm tương đối của khí và không khí, nhiệt trị quan sát được có thể lớn hơn hoặc nhỏ hơn nhiệt trị được tính trong phương trình B.4 và B.5. Độ ẩm của không khí tồn tại đối với từng khí ở trên là lớn hơn độ ẩm được tính bằng phương trình B.4 hoặc B.5. Giá trị tới hạn phụ thuộc vào thành phần khí, độ ẩm của khí và lượng không khí dư. Đối với metan khô, tinh khiết không có không khí dư, hα = 0,79345.
Phụ lục C
(tham khảo)
Các tính chất của khí thực
C.1 Về nguyên tắc, chúng ta có đủ thông tin để chuyển đổi nhiệt trị sang tính chất khí thực (không cần phải thực hiện đối với tỷ khối vì tỷ số khối lượng phân tử gam, Gid, là tính chất mong muốn). Đây là đơn giản hóa vấn đề đánh giá tích phân:
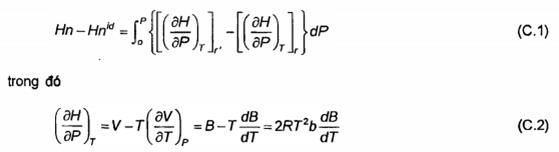
Trong đó V là thể tích phân tử gam. Sự phụ thuộc nhiệt độ của b phải được xác định, nhưng nó dễ thực hiện trong vùng giao nhận thương mại. Các sản phẩm và các chất phản ứng lại tương ứng với phương trình A.3.
C.2 Trong khi có thể thực hiện các phép tính được yêu cầu để chuyển đổi nhiệt trị sang tính chất khí thực, nó không phục vụ mục đích giao nhận thương mại. Như chúng ta đã biết, cân bằng chi phí không thay đổi; các phép tính trong đề cập trước là dài dòng. Hv là hơi khác chút với Hvid vì áp suất chuẩn thấp; tính hợp lý của tất cả các thông tin được yêu cầu sử dụng phương trình C.1 là tách biệt. Nhiệt trị được xác định trong trạng thái giả định. Nó không khả thi, tại các điều kiện chuẩn, để có tất cả nước được tạo thành trong phản ứng hoặc là tất cả khí hoặc tất cả chất lỏng; một số nước được tạo thành là trong từng trạng thái. Do vậy, nếu sự xác định là của trạng thái giả định, sử dụng khí thực giả định hơn là trạng thái khí lý tưởng không cộng thêm nhưng phức tạp.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 12553:2019 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 12553:2019 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 12553:2019 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 12553:2019 DOC (Bản Word)