- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 7723-2:2015 ISO 14403-2:2012 Chất lượng nước-Xác định xyanua tổng số và xyanua tự do sử dụng phương pháp phân tích dòng chảy (FIA và CFA)-Phần 2: Phương pháp phân tích dòng chảy liên tục (CFA)
| Số hiệu: | TCVN 7723-2:2015 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Tài nguyên-Môi trường |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
05/02/2015 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 7723-2:2015
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 7723-2:2015
TIÊU CHUẨN QUỐC GIA
TCVN 7723-2 : 2015
ISO 14403-2 : 2012
CHẤT LƯỢNG NƯỚC - XÁC ĐỊNH XYANUA TỔNG SỐ VÀ XYANUA TỰ DO SỬ DỤNG PHƯƠNG PHÁP PHÂN TÍCH DÒNG CHẢY (FIA VÀ CFA) - PHẦN 2: PHƯƠNG PHÁP PHÂN TÍCH DÒNG CHẢY LIÊN TỤC (CFA)
Water quality - Determination of total cyanide and free cyanide using flow analysis (FIA and CFA) - Part 2: Method using continuous flow analysis (CFA)
Lời nói đầu
TCVN 7723-2:2015 thay thế cho TCVN 7723:2007 (IS0 14403-2:2002).
TCVN 7723-2:2015 hoàn toàn tương đương với ISO 14403-2:2012.
TCVN 7723-2:2015 do Tổng cục Môi trường biên soạn, Bộ Tài nguyên và Môi trường đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Bộ tiêu chuẩn TCVN 7723 (ISO 14403) Chất lượng nước - Xác định xyanua tổng và xyanua tự do sử dụng phương pháp phân tích dòng chảy (FIA và CFA) gồm các tiêu chuẩn sau:
- Phần 1: Phương pháp phân tích dòng bơm vào (FIA);
- Phần 2: Phương pháp phân tích dòng chảy liên tục (CFA).
Lời giới thiệu
Phương pháp sử dụng phân tích theo quy trình hóa ẩm tự động và đặc biệt phù hợp cho quá trình xử lý nhiều chất trong nước có dãy mẫu lớn với tần suất phân tích cao.
Chất phân tích có thể được tiến hành bằng phân tích dòng bơm vào (FIA) hoặc phân tích dòng chảy liên tục (CFA). Cả hai phương pháp chia sẻ tính năng của việc đưa tự động mẫu vào hệ thống dòng chảy (hệ thống phân phối) mà trong đó chất phân tích trong mẫu phản ứng với dung dịch thuốc thử theo cách của chất đó qua hệ thống phân phối. Sự chuẩn bị mẫu có thể được tích hợp trong hệ thống phân phối. Các sản phẩm phản ứng được đo trong detector dòng chảy (ví dụ máy đo quang dòng chảy).
Xem lời dẫn của danh mục các phần tiêu chuẩn.
Phải tiến hành nghiên cứu điều tra xem liệu có những vấn đề đặc biệt nào có yêu cầu kỹ thuật của các điều kiện bổ sung bên lề.
CHẤT LƯỢNG NƯỚC - XÁC ĐỊNH XYANUA TỔNG SỐ VÀ XYANUA TỰ DO SỬ DỤNG PHƯƠNG PHÁP PHÂN TÍCH DÒNG CHẢY (FIA VÀ CFA) - PHẦN 2: PHƯƠNG PHÁP PHÂN TÍCH DÒNG CHẢY LIÊN TỤC (CFA)
Water quality - Determination of total cyanide and free cyanide using flow analysis (FIA and CFA) - Part 2: Method using continuous flow analysis (CFA)
CẢNH BÁO - Người sử dụng tiêu chuẩn này cần thành thạo với các thực hành trong phòng thí nghiệm thông thường. Tiêu chuẩn này không đề cập tới mọi vấn đề an toàn liên quan đến người sử dụng. Trách nhiệm của người sử dụng là phải xác lập thực hành vi an toàn, bảo đảm sức khỏe phù hợp với các quy định của quốc gia.
LƯU Ý - Điều quan trọng là phép thử tiến hành theo tiêu chuẩn này phải được thực hiện bởi các nhân viên đã được đào tạo.
1. Phạm vi áp dụng
Tiêu chuẩn này quy định các phương pháp riêng biệt để xác định xyanua trong các loại nước khác nhau (như nước dưới đất, nước uống, nước mặt, nước đã qua ngâm chiết, và nước thải) với nồng độ xyanua thông thường từ 2 mg/l đến 500 mg/l tính theo ion xyanua trong mẫu không pha loãng. Dải áp dụng có thể thay đổi tùy theo của các điều kiện vận hành, ví dụ, pha loãng mẫu ban đầu hoặc thay đổi chiều dài của cuvet đo dòng chảy.
Phương pháp này mô tả dải nồng độ khối lượng phù hợp từ 10 mg/l đến 100 mg/l.
Có thể phân tích mẫu nước biển bằng cách thay đổi hợp lý về độ nhạy và sự phù hợp/điều chỉnh của thuốc thử cùng các dung dịch hiệu chuẩn theo độ mặn của các mẫu thử.
2. Tài liệu viện dẫn
Các tài liệu viện dẫn sau là cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi (nếu có).
TCVN 4851 (ISO 3696), Nước dùng để phân tích trong phòng thí nghiệm - Yêu cầu kỹ thuật và phương pháp thử.
TCVN 6661-1 (ISO 8466-1), Chất lượng nước - Hiệu chuẩn và đánh giá các phương pháp phân tích về ước lượng các đặc trưng thống kê - Phần 1: Đánh giá thống kê các hàm chuẩn tuyến tính.
TCVN 6661-2 (ISO 8466-2), Chất lượng nước - Hiệu chuẩn và đánh giá các phương pháp phân tích và ước lượng các đặc trưng thống kê - Phần 2: Nguyên tắc hiệu chuẩn đối với các hàm chuẩn bậc hai không tuyến tính.
TCVN 6663-3 (ISO 5667-3), Chất lượng nước - Lấy mẫu - Phần 3: Hướng dẫn bảo quản và xử lý mẫu.
3. Thuật ngữ và định nghĩa
Trong tiêu chuẩn này, áp dụng các thuật ngữ và định nghĩa sau
3.1. Xyanua tự do (free cyanide)
Xyanua dễ giải phóng (easily liberatable xyanide)
Tổng các ion xyanua và xyanua liên kết trong các phức xyanua kim loại yếu, các phức này giải phóng HCN tại pH bằng 3,8.
3.2. Xyanua tổng số (total cyanide)
Xyanua tự do (3.1), cộng với các hợp chất phức kim loại-xyanua mạnh hơn, ngoại trừ xyanua liên kết trong các phức với vàng, platin, coban, ruteni, và rodi từ các phức đó xyanua có thể được thu từng phần.
CHÚ THÍCH 1: Trong phần định nghĩa về xyanua tổng số không bao gồm thioxyanate, xyanua liên kết hữu cơ và xyanua.
CHÚ THÍCH 2: Các phương pháp chưng cất có thể thu được một số xyanua hữu cơ. Sử dụng phương pháp khuếch tán nếu nghi ngờ có các phức xyanua.
4. Cản trở
4.1. Cản trở do các chất oxy hóa
Các tác nhân oxy hóa như clo sẽ phân hủy hầu hết các xyanua. Nếu không thể loại trừ sự có mặt của các chất oxy hóa, cần xử lý mẫu ngay sau quá trình lấy mẫu. Tiến hành kiểm tra bằng cách lấy một vài giọt mẫu với giấy thử hồ tinh bột kali iođua (KI starch paper); nếu xuất hiện màu xanh thì cần phải xử lý. Cho natri thiosulfat, một vài tinh thể một lần, cho đến khi giọt mẫu không tạo ra màu trên giấy chỉ thị. Sau đó cho thêm một phần bằng 0,6 g axit ascobic (6.9) vào từng 1000 ml mẫu thử.
Không cho axit ascobic vào khi không phân tích mẫu trong vòng 24 h.
4.2. Cản trở do sulfua, các hợp chất sulfua, nitrit, và cacbonyl
Sự cản trở bắt đầu xuất hiện khi nồng độ sunfua khoảng 100 mg/l. Sunfua làm ảnh hưởng đến quá trình đo màu, đặc biệt đối với phương pháp khuếch tán khí, và quy trình đo ampe (xem Phụ lục C). Nếu một giọt trên giấy thử chì axetat cho thấy có sunfua thì xử lý bổ sung thêm 25 ml mẫu đã ổn định (pH > 12) theo như yêu cầu đối với mẫu dùng xác định xyanua bằng bột chì cacbonat.
Chì sulfua sẽ kết tủa nếu mẫu có chứa sulfua.
Lặp lại thao tác này cho đến khi giọt dung dịch mẫu được xử lý không làm tối màu giấy thử chì axetat.
Tiến hành lọc dung dịch này qua giấy lọc khô và hứng vào cốc thử khô, rồi lấy mẫu từ phần dung dịch đã lọc được để phân tích. Tránh để dư thừa của chì và thời gian tiếp xúc lâu để giảm thiểu thất thoát do sự tạo phức hoặc xyanua bị giữ trong kết tủa.
Nếu áp dụng phương pháp đo ampe (Phụ lục C), cần cho chì cacbonat một cách hệ thống vào các mẫu trong quá trình phân tích (vài miligam trên 10 ml mẫu), sau đó tiến hành lọc hoặc gạn trước khi cho một lượng mẫu đã lọc vào khay mẫu của máy phân tích dòng chảy liên tục.
Dưới các điều kiện nhất định, các andehyt và xeton có thể hấp thụ xyanua do sự bổ sung chất ưa nhân. Để tránh cản trở này, có thể cho etylenediamin vào mẫu thử.
Dưới các điều kiện chưng cất cho trước, các aldehyd có thể chuyển xyanua thành nitrit. Có thể loại bỏ các andehyt bằng cách cho bạc nitrat vào mẫu. Khi thêm AgNO3 cần chú ý đến tỷ số nồng độ của xyanua tự do và xyanua tổng số. Người sử dụng phải tiến hành đánh giá quy trình này.
Sự cản trở do nitrit sẽ xuất hiện khi nồng độ trên 5 mg/l và có thể tránh được bằng cách cho axit sunfamic (6.10) với dung dịch đệm (pH = 3,8) đối với phương pháp chưng cất và khuếch tán khí (6.21.1).
Sulfit gây cản trở với các nồng độ trên 1 mg/l.
4.3. Cản trở khác
Mẫu có chứa hạt có thể dẫn đến thất thoát thành phần phân tích nếu các hạt làm tắc nghẽn ống dẫn và không chuyển được toàn bộ mẫu vào thiết bị UV. Có thể giảm thiểu hiệu ứng này bằng cách làm đồng nhất mẫu (ví dụ, khuấy) ngay trước khi phân tích để đảm bảo rằng lấy được mẫu đại diện và giảm được cỡ hạt. Các hạt có kích thước > 0,1 mm có thể loại bỏ bằng cách lọc.
Khi áp dụng phương pháp chưng cất lắp nối tiếp trong dãy thiết bị phân tích để tách hydro xyanua, các nồng độ muối cao hơn 10 g/l của các muối có thể gây tắc nghẽn cuộn chưng cất. Trước khi áp dụng phương pháp khuếch tán khí cần tiến hành pha loãng các mẫu để khắc phục vấn đề này.
Thioxyanat có thể gây cản trở nhẹ và dẫn tới độ chệch dương (9.3.2), có thể tăng đáng kể sự cản trở từ xyanua không tinh khiết trong thioxyanat hoặc từ quy trình chưng cất không phù hợp (7.1).
5. Nguyên tắc
5.1. Xác định xyanua tổng số
Phức xyanua được phân ly bằng ánh sáng UV tại pH = 3,8. Sử dụng đèn UV-B (312 nm đến 400 nm) và vòng xoắn phân ly bằng thủy tinh bosilicat, thủy tinh thạch anh hoặc polytetrafloetylen (PTFE). Thiết bị UV phải đảm bảo ánh sáng UV với bước sóng < 290 nm sẽ được lọc ra và do vậy ngăn sự chuyển hóa thioxyanat thành xyanua.
Hydro xyanua tồn tại ở pH = 3,8 và được tách ra bằng cách chưng cất trực tiếp tại 125 °C hoặc được tách ra bằng dòng khí khuếch tán tại 30 °C đến 40 °C đi qua màng kị nước. Áp dụng phương pháp khuếch tán khí, hydro xyanua được hấp thụ vào dung dịch natri hydroxit.
Sau đó hydro xyanua được đo quang bằng phản ứng của xyanua với cloramin-T tạo thành xyanogen clorua. Phản ứng này với axit pyridine-4-cacbonic axit và axit 1,3-dimetylbarbituric cho màu đỏ mà sự hấp thụ là tỷ lệ với nồng độ xyanua.
5.2. Xác định xyanua tự do
Trong quy trình nêu tại 5.1, tắt đèn UV-B khi xác định hàm lượng xyanua tự do. Trong khi chưng cất tại pH = 3,8 để tách hydro xyanua, thêm dung dịch kẽm sulphat vào dòng mẫu để kết tủa sắt xyanua có mặt dưới dạng phức kẽm xyanoferat.
Để xác định, xem 5.1.
Cách khác, có thể xác định xyanua tổng số và xyanua tự do sau khi khuếch tán khí sử dụng detector đo am pe (xem Phụ lục C).
6. Thuốc thử
CẢNH BÁO - KCN, K2[Zn(CN)4] các dung dịch chất thải và có tính độc. Chất thải chứa các chất này cần được loại bỏ theo cách thích hợp.
Chỉ dùng các thuốc thử tinh khiết phân tích.
Có thể sử dụng phần nhỏ hơn của các dung dịch sau đây miễn là các tỷ lệ của các thể tích quy định và các nồng độ khối lượng được giữ nguyên.
6.1. Nước, loại 1 theo TCVN 4851 (ISO 3696).
6.2. Axit clohydric, c(HCl) = 1 mol/l.
6.3. Dung dịch natri hydroxit I, dung dịch chất mang, c(NaOH) = 0,4 mol/l.
6.4. Dung dịch natri hydroxit II, c(NaOH) = 1,0 mol/l.
6.5. Dung dịch natri hydroxit III, c(NaOH) = 0,2 mol/l.
6.6. Dung dịch natri hydroxit IV, dung dịch súc rửa, c(NaOH) = 0,01 mol/l.
6.7. Chất hoạt động bề mặt, polyoxyetylen lauryl ete, HO-(CH2CH2-O)n-C18H37.
Cho từng lượng nhỏ của 30 g polyoxyetylen lauryl ete vào 100 ml nước (6.1) và trộn đều.
Cách khác, có thể dùng dung dịch chất hoạt động bề mặt có sẵn trên thị trường.
6.8. Axit xitric ngậm một phân tử nước, C6H8O7.H2O.
6.9. Axit ascobic, C6H8O6.
6.10. Axit sulfamic, H3SO3N.
6.11. Tetraetylenepentamine, C8H23N5.
6.12. Dung dịch tetraetylenepentamine, (chỉ dùng cho xyanua tự do).
Hòa tan 0,75 g tetraetylenepentamine (6.11) trong 250 ml nước.
Dung dịch này bền trong một tháng nếu được bảo quản ở nhiệt độ phòng.
6.13. Kẽm sunfat ngậm bảy nước, ZnSO4.7H2O.
6.14. Kali hydrophtalat, KHC8H4O4.
6.15. Cloramin-T ngậm ba phân tử nước, C7H7ClNaO2S.3H2O.
6.16. Axit 1,3-Dimetylbarbituric, C6H8N2O3.
6.17. Axit pyridin-4-cacboxylic, C6H5NO2.
6.18. Kali thioxyanat, KSCN.
6.19. Kali hexaxyanoferat(III), K3Fe(CN)6.
6.20. Xyanua tiêu chuẩn.
6.20.1. Kali xyanua, KCN.
6.20.2. Dung dịch gốc kalixyanua, KCN, r CN = 1 000 mg/l (xem Phụ lục B).
Hòa tan 2500 mg ± 1 mg kali xyanua, KCN (6.20.1), vào dung dịch natri hydroxit IV (6.6) trong bình định mức 1000 ml và làm đầy bằng dung dịch natri hydroxit IV (6.6) đến vạch mức.
Dung dịch này bền trong 3 tháng ở nhiệt độ từ 1 °C đến 8 °C.
Cách khác, có thể sử dụng dung dịch kali tetraxyanozincat (6.20.3).
6.20.3. Dung dịch kali tetraxyanozincat, K2Zn(CN)4, r CN = 1000 mg/l ± 2 mg/l, bán sẵn trên thị trường.
Dung dịch này bền trong 3 tháng ở nhiệt độ từ 1 °C đến 8 °C.
6.20.4. Dung dịch xyanua I, r CN = 10 mg/l.
Dùng pipet hút 1 ml dung dịch kali tetraxyanozincat (6.20.3) hoặc 1 ml dung dịch kali xyanua (6.20.2) cho vào bình định mức 100 ml và làm đầy bằng dung dịch natri hydroxit IV (6.6) đến vạch mức.
Dung dịch này bền trong một tuần nếu được bảo quản ở nhiệt độ từ 1 °C đến 8 °C.
6.20.5. Các dung dịch hiệu chuẩn
Chuẩn bị ít nhất năm dung dịch hiệu chuẩn có nồng độ xyanua cách đều trên toàn dải làm việc bằng cách pha loãng dung dịch xyanua I (6.20.4). Ví dụ, nếu phải chuẩn bị sáu dung dịch hiệu chuẩn thì tiến hành như sau:
Dùng pipet hút 10 ml dung dịch xyanua I (6.20.4) cho vào bình định mức 100 ml và làm đầy bằng dung dịch natri hydroxit IV (6.6) đến vạch mức. Dung dịch này chứa 1 mg/l xyanua.
Dùng pipet lần lượt hút 1 ml, 3 ml, 5 ml, 6 ml, 8 ml hoặc 10 ml dung dịch xyanua 1 mg/l vừa pha trước đó và cho vào các bình định mức 100 ml rồi làm đầy bằng natri hydroxit IV (6.6) đến vạch mức.
Các dung dịch này chứa tương ứng 10 mg/l, 30 mg/l, 50 mg/l, 60 mg/l, 80 mg/l và 100 mg/l xyanua [trừ trường hợp có hiệu chỉnh nồng độ khi chuẩn độ dung dịch kali xyanua (6.20.2)], (xem Phụ lục B).
Các dung dịch này bền khoảng hai ngày nếu được bảo quản trong tủ lạnh ở nhiệt độ từ 1 °C đến 5 °C.
6.21. Thuốc thử dùng để xác định xyanua
6.21.1. Dung dịch đệm (pH = 3,8) dùng cho phương pháp chưng cất và khuếch tán khí (R1 ở Hình A.1, A.2 và C.1).
Hòa tan 10 g axit xitric (6.8) trong khoảng 350 ml nước (6.1). Cho vào 50 ml dung dịch natri hydroxit I (6.3) vào và nếu cần thì điều chỉnh đến pH = 3,8 bằng axit clohydric (6.2) hoặc dung dịch natri hydroxyt IV (6.6). Cho vào 12,5 ml axit clohydric (6.2). Pha loãng bằng nước đến 500 ml.
CHÚ THÍCH: Vì cho HCl vào, nên pH của dung dịch này bằng khoảng 3,4. Sau khi trộn với mẫu pH sẽ đạt 3,8.
Dung dịch này bền trong ba tháng nếu được bảo quản trong tủ lạnh từ 1 °C đến 5 °C.
6.21.2. Dung dịch kẽm sunfat, chỉ dùng cho phương pháp chưng cất (R2 ở Hình A.1).
Hòa tan 10 mg kẽm sunfat ngậm bảy nước (6.13) trong 750 ml nước (6.1), lắc rồi pha loãng bằng nước đến 1000 ml.
6.21.3. Dung dịch nhận, chỉ dùng cho phương pháp khuếch tán khí (R3 ở Hình A.2).
Dung dịch natri hydroxyt III (6.5).
6.21.4. Dung dịch đệm để đo quang cuối cùng (R4 tại Hình A.1 và A.2).
6.21.4.1. Đối với phương pháp chưng cất (R4a tại Hình A.1).
Hòa tan 2,3 g natri hydroxyt (NaOH) trong 500 ml nước (6.1). Thêm 20,5 g kali hydrophtalat (6.14) và pha loãng bằng nước đến khoảng 975 ml.
Nếu cần thì dùng axit clohydric (HCl) (6.2) hoặc dung dịch natri hydroxyt II (NaOH) điều chỉnh pH của dung dịch đến 5,2 (6.4).
Thêm 1 ml chất hoạt động bề mặt (6.7) và làm đầy bằng nước đến 1000 ml.
Để có được các kết quả tốt nhất, dung dịch này bền trong một tháng nếu được bảo quản trong chai màu hổ phách để trong tủ lạnh ở 1 °C đến 5°C.
6.21.4.2. Đối với phương pháp khuếch tán khí (R4b tại Hình A.2)
Hòa tan 7,0 g natri hydroxyt (NaOH) trong 250 ml nước. Cho 35,4 g axit sucxinic (6.24) vào và pha loãng bằng nước đến 500 ml.
Dung dịch có pH xấp xỉ bằng 4,3. Khi trộn lẫn với dung dịch natri hydroxyt I (6.21.3; R3 tại Hình A.2) sẽ đạt được pH bằng 5,2.
Để có được các kết quả tốt nhất, dung dịch này bền trong một tháng nếu được bảo quản trong chai màu hổ phách để trong tủ lạnh ở 1 °C đến 5°C.
6.21.5. Dung dịch cloramin-T ngậm ba nước (R5 tại Hình A.1 và A.2).
Hòa tan 2,0 g ± 0,05 g cloramin-T ngậm ba nước (6.15) trong 1000 ml nước.
Dung dịch này bền khoảng một tuần nếu được bảo quản trong tủ lạnh tại nhiệt độ từ 1 °C đến 5° C, để có các kết quả tốt nhất, chuẩn bị dung dịch này hàng ngày.
6.21.6. Thuốc thử màu (R6 tại Hình A.1 và A.2)
Cẩn thận hòa tan trong bình định mức 1 000 ml, 7,0 g natri hydroxyt (NaOH) trong khoảng 500 ml nước (6.1). Cho vào 16,8 g ± 0,1 g axit 1,3-dimetylbarbituric (6.16) và 13,6 g ± 0,1 g axit pyridin-4-cacboxylic (6.17) và pha loãng bằng nước (6.1) tới khoảng 975 ml.
Nếu cần thì điều chỉnh pH đến 5,2 bằng axit clohydric (6.2) hoặc dung dịch natri hydroxyt II (6.4).
Làm đầy đến 1000 ml bằng nước (6.1). Trộn mạnh dung dịch này (ví dụ dùng máy khuấy từ) trong 1 h tại nhiệt độ 30 °C, sau đó lọc qua giấy lọc gấp nếp (ví dụ giấy lọc cứng không tro).
Dung dịch này bền trong 3 tháng nếu được bảo quản trong tủ lạnh tại nhiệt độ từ 2 °C đến 5°C.
CHÚ THÍCH: Nếu bảo quản dung dịch này tại 1 °C thì có thể gây kết tủa.
6.22. Dung dịch thioxyanat, nồng độ xyanua tính toán rCN = 100 mg/l.
Hòa tan 373 mg ± 1 mg kali thioxyanat (6.18) vào dung dịch natri hydroxyt IV (6.6) trong bình định mức 1000 ml, sau đó làm đầy bằng dung dịch natri hydroxyt IV (6.6) đến vạch mức.
Dung dịch này bền trong hai tháng nếu được bảo quản trong tủ lạnh tại nhiệt độ từ 1°C đến 5°C.
Tiến hành kiểm tra xác nhận từng lô để xác định không có các tạp chất CN bằng cách phân tích xác định xyanua tự do.
6.23. Dung dịch kali hexaxyanoferat (III), nồng độ xyanua tính toán rCN = 10 mg/l.
Hòa tan 21,1 mg ± 0,1 mg kali hexaxyanofenat III (6.19) trong dung dịch natri hydroxyt IV (6.6) trong bình định mức 1000 ml, sau đó làm đầy bằng dung dịch natri hydroxyt IV (6.6) đến vạch mức.
Dung dịch này bền trong hai tháng nếu được bảo quản trong tủ lạnh tại nhiệt độ từ 1 °C đến 5 °C.
Tiến hành kiểm tra xác nhận từng lô để xác định không có các tạp chất CN bằng cách phân tích xác định xyanua tự do.
6.24. Axit sucxinic, C4H6O4.
7. Thiết bị, dụng cụ
Sử dụng các thiết bị thông thường trong phòng thí nghiệm và các thiết bị, dụng cụ sau đây.
7.1. Hệ thống phân tích dòng chảy liên tục đối với phương pháp chưng cất.
7.1.1. Quy định chung, Ví dụ hệ thống phù hợp bao gồm các bộ phận nêu tại 7.1.2 đến 7.1.10 (xem Hình A.1). Cũng có thể sử dụng các hệ thống khác nếu đạt được các yêu cầu nêu tại Điều 9.
7.1.2. Bộ phận lấy mẫu tự động hoặc thiết bị khác có khả năng cấp mẫu tái lập.
7.1.3. Bình chứa thuốc thử.
7.1.4. Bơm xung thấp, có các ống dẫn trơ với hóa chất và tốc độ dòng như thể hiện ở Hình A.1 làm ví dụ.
7.15. Đèn UV, có:
- Đèn UV-B (312 nm đến 400 nm);
- Công suất 8 W đến 12 W;
- Cuộn phân ty bằng thủy tinh bosilicat, thủy tinh thạch anh hoặc polytetrafluoroetylen (PTFE).
Các kích thước phù hợp (sử dụng đèn UV có độ phát tia tối đa là 351 nm) đối với cuộn phân ly làm bằng thủy tinh thạch anh hoặc PTFE là: dung tích khoảng 4 ml (ví dụ, 30 hoặc 60 vòng có đường kính 30 mm, bề dầy thành ống lớn nhất là 1 mm và đường kính trong từ 1 mm đến 2 mm).
Đối với đèn có độ phát tia tối đa 312 nm ± 5 nm, cuộn phân ly làm bằng thủy tinh bosilicat hoặc thủy tinh thạch anh hoặc PTFE, các kích thước phù hợp là: dung tích khoảng 13 ml (ví dụ, 45 vòng có đường kính 30 mm).
Tiêu chí chính để chọn đúng được đèn UV và hệ thống phân ly là dựa vào các kết quả của tỷ lệ thu hồi (9.3.2).
Cần đảm bảo không có tia UV có bước sóng thấp hơn 290 nm tới dòng mẫu nhằm tránh sự phân hủy thioxyanat thành xyanua.
7.1.6. Thiết bị chưng cất lắp nối tiếp trong hệ thống (hệ thống CFA), điều chỉnh nhiệt độ 125 °C ± 1 °C với cuộn cất bằng thủy tinh hoặc vật liệu polyme, chiều dài vòng xoắn ví dụ 80 cm, đường kính trong ví dụ 1,5 mm.
7.1.7. Ống phân phối, có khả năng cấp liều các bọt khí, mẫu và thuốc thử, có hệ thống vận chuyển và kết nối thích hợp làm bằng thủy tinh, polyme hay kim loại trơ với hóa chất.
7.1.8. Bể gia nhiệt, dùng cho phản ứng màu, điều chỉnh nhiệt độ 37 °C ± 1 °C với thể tích cuộn phân ly để cho phép giữ mẫu trong khoảng 4 min.
7.1.9. Detector quang, với cuvet dòng chảy, có dải bước sóng 600 nm ± 10 nm.
Dùng cuvét có chiều dài quang thích hợp để đạt được độ hấp thụ tối thiểu (giá trị tuyệt đối) là 0,01 trên 1 cm chiều dài đối với dung dịch xyanua 10 mg/l.
7.1.10. Bộ ghi (ví dụ, bộ ghi bằng đồ thị, bộ tích phân hoặc máy in và máy vẽ). Nói chung, có thể đo được các tín hiệu chiều cao pic.
7.2. Hệ thống phân tích dòng bơm vào đối với phương pháp khuếch tán khí
7.2.1. Quy định chung. Ví dụ hệ thống phù hợp bao gồm các bộ phận nêu từ 7.2.2 đến 7.2.11 (xem Hình A.2). Cũng có thể sử dụng các hệ thống khác nếu đạt được các yêu cầu nêu tại Điều 9.
7.2.2. Bộ phận lấy mẫu tự động, hoặc thiết bị khác có khả năng cấp mẫu tái lặp.
7.2.3. Bình chứa thuốc thử.
7.2.4. Bơm xung thấp, có ống dẫn trơ với hóa chất. Hình A.2 thể hiện ví dụ về các vận tốc dòng.
7.2.5. Đèn UV
Xem 7.1.5.
7.2.6. Cuvet khuếch tán khí, có màng bán thấm kỵ nước làm bằng polypropen hoặc PTFE, ví dụ, có độ dày từ 90 mm đến 200 mm, cỡ lỗ từ 0,1 mm đến 1 mm.
7.2.7. Bể gia nhiệt dùng để ổn định nhiệt độ khuếch tán khí, có thể điều chỉnh nhiệt độ giữa 30 °C đến 40 °C (dung sai cho phép bằng ± 1 °C) với dung tích cuộn phân ly điển hình là 2 ml và đường kính trong bằng, ví dụ, 1 mm.
7.2.8. Ống phân phối, có khả năng cấp liều các bọt khí, mẫu và thuốc thử, có hệ thống vận chuyển và kết nối thích hợp làm bằng thủy tinh, polyme hoặc kim loại trơ với hóa chất.
7.2.9. Bể gia nhiệt dùng cho phản ứng màu, có thể điều chỉnh nhiệt độ 37 °C ± 1 °C với hình dạng xoắn ốc cho phép giữ mẫu trong khoảng 4 min.
7.2.10. Detector quang, với cuvet dòng chảy, có bước sóng 600 nm ± 10 nm. Sử dụng cuvét đo có chiều dài quang thích hợp để đạt được độ hấp thụ tối thiểu (giá trị tuyệt đối) là 0,01 trên 1 cm chiều dài đối với dung dịch xyanua 10 mg/l.
7.2.11. Thiết bị ghi (ví dụ, bộ ghi băng đồ thị, bộ tích phân hoặc máy in vẽ hoặc hệ thống dữ liệu máy tính). Nói chung, đo được các tín hiệu chiều cao pic.
7.3. Các thiết bị bổ sung.
7.3.1. Giấy thử chì axetat, có sẵn trên thị trường.
7.3.2. Bộ màng lọc, với các màng lọc có kích thước lỗ bằng 0,45 mm.
7.3.3. Máy đo pH.
8. Lấy mẫu và chuẩn bị mẫu thử
Ngay sau khi lấy mẫu, điều chỉnh pH của các mẫu nước đến 12 bằng các dung dịch natri hydroxyt I đến IV (6.3 đến 6.6) sao cho lượng kiềm thêm vào là không đáng kể so với thể tích mẫu.
Nếu cần, loại bỏ các hạt cặn có đường kính > 0,1 mm bằng màng lọc hoặc bằng phương pháp gạn trong phòng thử nghiệm.
Thử các chất cản trở và xử lý nếu cần thiết (xem Điều 4).
Ngay sau khi lấy mẫu tiến hành phân tích mẫu theo Điều 9 càng sớm càng tốt, nhưng theo quy định tại TCVN 6663-3 (ISO 5667-3) thì chậm nhất là trong vòng bảy ngày. Bảo quản mẫu ở nơi tối.
9. Cách tiến hành
9.1. Đặt thông số cho hệ thống dòng chảy
Cài đặt thông số và điều chỉnh hệ thống phân tích dòng chảy liên tục theo Bảng 1 hoặc Bảng 2, tùy theo phép xác định được thực hiện.
Bảng 1 - Điều chỉnh hệ thống phân tích dòng chảy liên tục đối với phương pháp chưng cất
| Quy trình | Thành phần hoặc thông số | Cài đặt thông số để xác định | |
| Xyanua tổng số | Xyanua tự do | ||
| Phân hủy bằng UV | Đèn UV (7.1.5) | Mở | Đóng |
| Chưng cất | Dung dịch sau khi phân hủy UV | Nước (6.1) | Dung dịch kẽm sunfat (6.1.2) |
|
| pH | 3,8 | 3,8 |
|
| Nhiệt độ | 125 °C | 125 °C |
| Đo quang cuối cùng | Thuốc thử màu (6.21.6) | - | - |
|
| pH | 5,2 | 5,2 |
|
| Nhiệt độ | 37 °C | 37 °C |
|
| Bước sóng | 590 nm đến 610 nm | 590 nm đến 610 nm |
Bảng 2 - Điều chỉnh hệ thống phân tích dòng chảy đối với phương pháp khuếch tán khí
| Quy trình | Thành phần hoặc thông số | Cài đặt thông số để xác định | |
| Xyanua tổng số | Xyanua tự do | ||
| Phân hủy bằng UV | Đèn UV (7.2.5) | Mở | Đóng |
| Khuếch tán khí | Dung dịch đệm đối với phương pháp chưng cất và khuếch tán khí (6.21.1) |
|
|
|
| pH | 3,8 | 3,8 |
|
| Nhiệt độ | 30 °C đến 40 °C | 30 °C đến 40 °C |
| Đo quang cuối cùng | Thuốc thử màu (6.20.4) | có | có |
|
| pH | 5,2 | 5,2 |
|
| Bước sóng | 590 mm đến 610 nm | 590 mm đến 610 nm |
9.2. Phép đo thuốc thử trắng
Đưa hệ thống phân tích vào vận hành bằng cách bắt đầu bơm nước qua hệ thống.
Đợi đến khi ổn định đường nền và đường “không”
Bơm qua hệ thống dung dịch đệm (pH = 3,8) để chưng cất và khuếch tán khí (6.21.2), dung dịch nhận (6.21.3), dung dịch đệm để đo quang cuối cùng (6.21.4.1 hoặc 6.21.4.2), dung dịch cloramin-T (6.21.5), hoặc thuốc thử màu (6.21.6) và đo độ hấp thụ tăng lên so với nước.
Nếu độ hấp thụ trên centimet chiều dài cuvet thay đổi lớn hơn 0,006 cm-1 thì có thể là nước hoặc dung dịch thuốc thử bị nhiễm bẩn. Tiến hành các biện pháp phù hợp để loại bỏ cản trở này.
CHÚ THÍCH: Nếu detector quang không cho ra các số đọc độ hấp thụ thì có thể xác định độ hấp thụ bằng máy đo phổ hấp thụ bên ngoài.
9.3. Kiểm tra sự phù hợp của hệ thống dòng chảy
9.3.1. Độ hấp thụ tối thiểu
Phân tích một dung dịch hiệu chuẩn xyanua (6.20.5) với nồng độ bằng 50 mg/l.
Dung dịch hiệu chuẩn này (6.20.5) sẽ tạo ra độ hấp thụ bằng ít nhất là 0,027 cm-1.
Xem Chú thích của 9.2.
9.3.2. Tỷ lệ thu hồi
Chuẩn bị các dung dịch tiêu chuẩn hexaxyanoferat (III) và thioxyanat bằng cách lấy 1 ml dung dịch kali hexaxyanoferat (III) (6.23), và 1 ml dung dịch thioxyanat (6.22) cho vào từng bình định mức 100 ml. Dùng dung dịch natri hydroxyt IV (6.6) làm đầy từng bình đến vạch mức.
Các dung dịch đã chuẩn bị này chứa:
Dung dịch A hexaxyanoferat (III): 100 mg/l CN, liên kết hóa học
Dung dịch B thioxyanat: 1 000 mg/l CN, liên kết hóa học
Đo hàm lượng xyanua (CN) từ dung dịch A và B bằng hệ thống phân tích dòng chảy được điều chỉnh về phương pháp xyanua tổng số và xyanua tự do.
Hệ thống được xem là phù hợp để đo xyanua tổng số nếu hàm lượng xyanua xác định được của dung dịch A là ³ 90 % so với hàm lượng xyanua lý thuyết. Nếu hàm lượng xyanua của dung dịch A là quá thấp (< 90 %) chứng tỏ hiệu quả phân hủy của UV không hoàn toàn.
Đối với việc xác định xyanua tự do tỷ lệ thu hồi nêu trên phải là £ 5 %.
Đối với cả hai phép xác định, hàm lượng xyanua xác định được của dung dịch B phải nhỏ hơn 1 % so với hàm lượng xyanua lý thuyết.
9.4. Hiệu chuẩn
Lựa chọn chế độ làm việc của hệ thống phân tích dòng chảy và hiệu chuẩn bằng việc áp dụng tuần tự các dung dịch hiệu chuẩn (6.20.5) và dung dịch trắng.
Trước khi hiệu chuẩn, điều chỉnh điểm “không” của thiết bị theo hướng dẫn của nhà sản xuất và phù hợp với quy định kỹ thuật của tiêu chuẩn này.
Xác định các giá trị đo được từ các dung dịch hiệu chuẩn.
Các điều kiện thử nghiệm đối với hiệu chuẩn và phép đo các mẫu (9.5) phải giống nhau. Độ lớn của tín hiệu đo phải tỷ lệ với nồng độ khối lượng xyanua. Thiết lập đường hồi quy cho các loạt đo thu được.
Hiệu chuẩn hệ thống phân tích dòng chảy theo quy định của TCVN 6661-1 (ISO 8466-1). Nói chung, Công thức (1) là phù hợp (TCVN 6661-1 (ISO 8466-1)). Nếu phép thử độ tuyến tính nêu tại TCVN 6661-1 (ISO 8466-1) cho thấy rằng đường hiệu chuẩn là không tuyến tính, thì tính toán đường hiệu chuẩn theo TCVN 6661-2 (ISO 8466-2).
Giá trị đo được đối với các dung dịch hiệu chuẩn, y, theo các đơn vị liên quan đến thiết bị (ví dụ, các chiều cao pic tính theo centimet hoặc số đếm), bằng;
| y = br + a | (1) |
Trong đó:
b độ dốc của hàm hiệu chuẩn, tính bằng đơn vị của thiết bị hoặc microgam trên lít;
r là nồng độ khối lượng các dung dịch tiêu chuẩn, tính bằng microgam trên lít (mg/l);
a là điểm giao của đường chuẩn cắt trục tung, tính bằng đơn vị của thiết bị.
9.5. Đo mẫu
Phân tích mẫu đã xử lý sơ bộ theo Điều 8, theo đúng quy trình như đối với dung dịch hiệu chuẩn bằng hệ thống phân tích dòng chảy liên tục.
Nếu các nồng độ khối lượng của mẫu vượt quá giá trị của khoảng làm việc hiệu chuẩn thì tiến hành pha loãng các mẫu.
Kiểm tra giá trị của hàm hiệu chuẩn sau từng loạt đo mẫu, nhưng ít nhất là kiểm tra sau khi đo 10 đến 20 mẫu bằng cách dùng một dung dịch hiệu chuẩn cho giới hạn dưới và một dung dịch hiệu chuẩn cho giới hạn trên của khoảng làm việc.
Nếu cần thì xây dựng đường chuẩn mới.
10. Tính toán kết quả
Xác định nồng độ khối lượng của các mẫu dựa vào các giá trị được đo, nhận được như nêu tại 9.4 đối với các dung dịch hiệu chuẩn.
Tính r theo Công thức (2):
|
| (2) |
Giải thích các ký hiệu xem 9.4.
11. Biểu thị kết quả
Báo cáo kết quả đến hai chữ số có nghĩa.
VÍ DỤ 1: r(CN tổng số) 2,9 x 102 mg/l
VÍ DỤ 2: r(CN tự do) 45 mg/l
12. Báo cáo thử
Báo cáo phép thử bao gồm ít nhất các thông tin sau:
a) Phương pháp thử đã sử dụng, và viện dẫn tiêu chuẩn này;
b) Tất cả các thông tin cần thiết để nhận dạng mẫu thử;
c) Cách xử lý mẫu sơ bộ;
d) Nồng độ xyanua (tự do hoặc tổng số) tính bằng microgam trên lít, biểu thị theo Điều 11;
e) Những quan sát/nhận xét đặc biệt được lưu ý trong quá trình xác định;
g) Những sai khác so với tiêu chuẩn này có thể làm ảnh hưởng đến kết quả thử.
Phụ lục A
(Tham khảo)
Các ví dụ về hệ thống dòng chảy
Có thể sử dụng các cấu hình CFA trắc quang khác ngoài cấu hình được thể hiện trên Hình A.1 và A.2 miễn là chúng phù hợp với phương pháp và đạt được các tiêu chí về kiểm soát chất lượng quy định tại Điều 9.
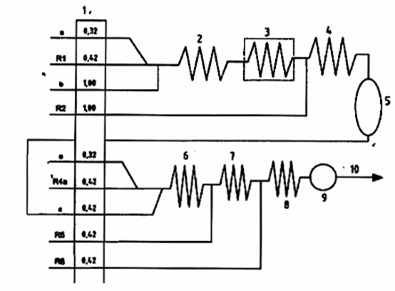
CHÚ DẪN:
| R1 | Dung dịch đệm, pH = 3,8 đối với phương pháp chưng cất (6.21.1); |
| R2 | Dung dịch ZnSO4 (6.21.2) đối với xyanua tự do; nước (6.1) đối với xyanua tổng số; |
| R4a | Dung dịch đệm để đo quang cuối cùng đối với phương pháp chưng cất (6.21.4.1); |
| R5 | Dung dịch cloramin-T (6.21.5); |
| R6 | Thuốc thử màu (6.21.6); |
| 1 | Bơm (tốc độ dòng tính bằng ml/min); |
| 2 | Cuộn phân ly: dài 50 cm, đường kính trong f 1,5 mm; |
| 3 | Bộ phân hủy UV, 351 nm; |
| 4 | Cuộn phân ly: dài 50 cm, đường kính trong f 1,5 mm; |
| 5 | Bộ chưng cất, 125 °C; |
| 6 | Cuộn phân ly: dài 50 cm, đường kính trong f 1,5 mm; |
| 7 | Cuộn phân ly: dài 50 cm, đường kính trong f 1,5 mm; |
| 8 | Bể gia nhiệt: 37 °C, dài 100 cm, đường kính trong f 2 mm; |
| 9 | Detector (ví dụ chiều dài quang 1 cm), bước sóng 590 nm đến 610 nm; |
| 10 | Chất thải. |
| a | Không khí, dòng khí ngắt quãng. |
| b | Mẫu. |
| c | Lấy mẫu lại. |
Hình A.1 - Ví dụ về hệ thống CFA để đo quang xác định xyanua tự do và xyanua tổng số (10 mg/l đến 100 mg/l) với quy trình chưng cất (theo 7.1)
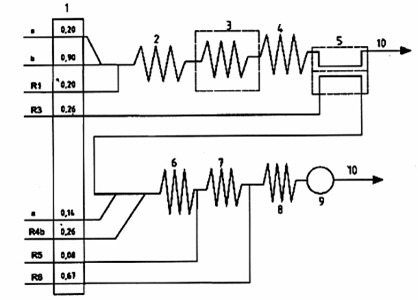
CHÚ DẪN:
| R1 | Dung dịch đệm, pH = 3,8 đối với phương pháp chưng cất (6.21.1); |
| R3 | Dung dịch nhận, chỉ dùng cho phương pháp khuếch tán khí (6.21.3); |
| R4b | Dung dịch đệm để đo quang cuối cùng đối với phương pháp khuếch tán khí (6.21.4.2); |
| R5 | Dung dịch cloramin-T (6.21.5); |
| R6 | Thuốc thử màu (6.21.6); |
| 1 | Bơm (tốc độ dòng tính bằng ml/min); |
| 2 | Cuộn phân ly: dài 50 cm, đường kính trong f 1 mm; |
| 3 | Bộ phân hủy UV, 351 nm;, 420 cm, đường kính trong f 2 mm |
| 4 | Bể gia nhiệt: 30 °C, dài 50 cm, đường kính trong f 2 mm; |
| 5 | Bộ khuếch tán khí; |
| 6 | Cuộn phân ly: dài 50 cm, đường kính trong f 1 mm; |
| 7 | Cuộn phân ly: dài 50 cm, đường kính trong f 1 mm; |
| 8 | Bể gia nhiệt: 37 °C, dài 100 cm, đường kính trong f 1 mm; |
| 9 | Detector (ví dụ chiều dài quang 1 cm), bước sóng 590 nm đến 610 nm; |
| 10 | Chất thải. |
| a | Không khí, dòng khí ngắt quãng. |
| b | Mẫu. |
Hình A.2 - Ví dụ hệ thống CFA để đo quang xác định xyanua tự do và tổng số (10 mg/l đến 100 mg/l) với phương pháp tách khí khuếch tán (theo 7.2)
Phụ lục B
(Tham khảo)
Xác định nồng độ xyanua thực trong dung dịch kali xyanua
B.1. Quy định chung
Nếu sử dụng KCN để chuẩn bị các dung dịch hiệu chuẩn xyanua (6.20.5), tiến hành như sau.
B.2. Các thuốc thử bổ sung
B.2.1. r-dimetylaminobenzyliden rhodanin.
B.2.2. Dung dịch chỉ thị
Hòa tan 0,02 g r-dimetylaminobenzyliden rhodanin (B.2.1) trong 100 ml axeton (C3H6O).
Dung dịch này bền trong một tuần nếu được bảo quản trong tủ lạnh từ 1 °C đến 5 °C.
B.2.3. Dung dịch bạc nitrat, c(AgNO3) = 1 mmol/l.
B.3. Xác định nồng độ xyanua trong dung dịch kali xyanua
Dùng pipet hút 10 ml dung dịch kali xyanua (6.20.2) cho vào cốc thử. Cho vào 0,25 ml dung dịch chỉ thị (B.22). Chuẩn độ bằng dung dịch bạc nitrat (B.2.3) đến khi màu vàng chuyển từ vàng sang vàng-đỏ (ghi thể tích V1). Tính nồng độ xyanua trong dung dịch kali xyanua theo Công thức (B.1):
|
| (B.1) |
Trong đó:
rCN là nồng độ xyanua của dung dịch kali xyanua (6.20.2), tính bằng miligam trên lít (mg/l);
V1 là thể tích của dung dịch bạc nitrat (B.2.3) đã dùng, tính bằng mililit (ml);
c(AgNO3) là nồng độ bạc nitrat của dung dịch bạc nitrat, tính bằng milimol trên lít (mmol/l);
M2CN là khối lượng phân tử của 2CN (= 52 g/mol);
V là thể tích của dung dịch kali xyanua (6.20.2), tính bằng mililít (ml).
Phụ lục C
(Tham khảo)
Ví dụ về xác định xyanua tổng số và xyanua tự do bằng phân tích
dòng chảy liên tục (CFA) với khuếch tán khí và dò ampe
C.1. Nguyên tắc
Có thể sử dụng phương pháp dò ampe thay cho phương pháp đo quang. Theo cách này, sẽ tránh được việc sử dụng các chất độc và nguy hại và cải tiến được độ nhạy của phương pháp riêng biệt để xác định xyanua tự do và xyanua tổng số đến mức thấp hơn, microgam trên lít (ví dụ, giá trị điển hình về giới hạn phát hiện dưới đối với xyanua tổng số là 3 mg/l).
Hình C.1 đưa ra sơ đồ xác định xyanua tự do và tổng số dùng phương pháp khuếch tán khí và dò ampe. Cũng có thể áp dụng khi kết hợp giữa phương pháp chưng cất và dò ampe.
Detetor dòng điện có thể bao gồm:
- Điện cực làm việc: bạc;
- Điện cực so sánh: Ag/AgCl;
- Điện cực phụ: platin;
- Điện thế sử dụng: 0,0 V.
Có thể sử dụng các cấu hình CFA khác miễn là chúng đáp ứng các tiêu chí của phương pháp và đạt được các tiêu chí kiểm soát chất lượng nêu tại Điều 9.
C.2. Thư mục tài liệu tham khảo thêm khi áp dụng phương pháp dò ampe
xem [7] đến [10] và [12].
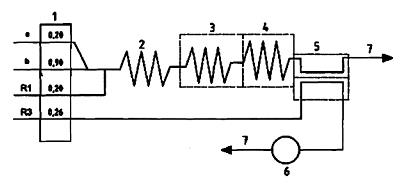
CHÚ DẪN:
| R1 | Dung dịch đệm, pH = 3,8 đối với phương pháp chưng cất và khuếch tán khí (6.21.1); |
| R3 | Dung dịch nhận, chỉ dùng cho phương pháp khuếch tán khí (6.21.3); |
| 1 | Bơm (tốc độ dòng tính bằng ml/min); |
| 2 | Cuộn phân ly dài 50 cm, đường kính trong f 1 mm; |
| 3 | Bộ phân hủy UV, 351 nm, dài 420 cm, đường kính trong f 2 mm; |
| 4 | Bể gia nhiệt: 30 °C, dài 50 cm, đường kính trong f 1 mm; |
| 5 | Bộ khuếch tán khí; |
| 6 | Detector ampe (tính năng kỹ thuật xem C.1); |
| 7 | Chất thải. |
| a | Không khí, dòng khí ngắt quãng. |
| b | Mẫu. |
Hình C.1 - Ví dụ về hệ thống CFA sử dụng dò ampe để xác định xyanua tự do và tổng số (10 mg/l đến 100 mg/l) đối với phương pháp tách khí-khuếch tán (theo C.1)
Phụ lục D
(Tham khảo)
Dữ liệu thực hiện
Chương trình thử liên phòng thí nghiệm đối với các hệ thống phân tích dòng chảy mô tả tại Điều 7 được thực hiện vào mùa xuân năm 2009. Các kết quả được thể hiện tại Bảng D.1 và D.2.
Bảng D.1 - Số liệu thống kê xác định xyanua tự do bằng CFA (Theo TCVN 6910-2 (ISO 5725-2)
| Mẫu | Mẫu nềna | l | n | o % | X mg/l |
mg/l | h % | sR mg/l | CV,R % | sr mg/l | CV,r % |
| 1 | Nước uống | 21 | 92 | 1,1 | 30 | 27,8 | 92,9 | 2,21 | 7,9 | 0,45 | 1,6 |
| 2 | Nước uống | 21 | 93 | 0,0 | 25 | 25,3 | 101,1 | 2,12 | 8,4 | 0,53 | 2,1 |
| 3 | Nước mặt | 21 | 93 | 0,0 | 45 | 43,6 | 96,8 | 2,73 | 6,3 | 0,55 | 1,3 |
| 4 | Nước mặt | 20 | 89 | 4,3 | 30 | 30,8 | 102,6 | 2,32 | 7,5 | 0,45 | 1,5 |
| 5 | Nước thải | 18 | 82 | 11,8 | 60 | 55,0 | 91,6 | 3,43 | 6,2 | 0,82 | 1,5 |
| 6 | Nước thải | 20 | 90 | 3,2 | 25 | 24,0 | 96,1 | 2,60 | 11,7 | 0,61 | 2,5 |
| l là số phòng thí nghiệm sau khi loại giá trị ngoại lai; n là số các kết quả riêng lẻ sau khi loại giá trị ngoại lai; o là phần trăm các giá trị ngoại lai; X là giá trị được ấn định;
h là tỷ lệ thu hồi; sR là độ lệch chuẩn tái lập CV,R là hệ số biến thiên của độ tái lập; sr là độ lệch chuẩn lặp lại; CV,r là hệ số biến thiên của độ lặp lại. | |||||||||||
| a Nguồn gốc các mẫu: Mẫu 1 và 2, đã thêm chuẩn, Thành phố Berlin Mẫu 3 và 4, đã thêm chuẩn, Landwehrkanal, Thành phố Berlin Mẫu 5 và 6, đã thêm chuẩn, Nhà máy xử lý nước thải, Berlin-ruhleben | |||||||||||
Bảng D.2 - Số liệu thống kê xác định xyanua tổng số bằng CFA (Theo TCVN 6910-2 (ISO 5725-2)
| Mẫu | Mẫu nềna | l | n | o % | X mg/l |
mg/l | h % | sR mg/l | CV,R % | sr mg/l | CV,r % |
| 1 | Nước uống | 21 | 93 | 9,7 | 30 | 28,8 | 96,1 | 1,64 | 5,7 | 0,57 | 2,0 |
| 2 | Nước uống | 20 | 91 | 13,3 | 50 | 47,5 | 94,9 | 2,32 | 4,9 | 0,78 | 1,6 |
| 3 | Nước uống | 20 | 91 | 9,9 | 28 | 25,8 | 92,3 | 2,00 | 7,7 | 0,50 | 1,9 |
| 4 | Nước mặt | 18 | 86 | 14,9 | 45 | 45,2 | 100,4 | 1,72 | 3,8 | 0,62 | 1,4 |
| 5 | Nước mặt | 21 | 96 | 7,7 | 55 | 52,9 | 96,2 | 2,65 | 5,0 | 1,05 | 2,0 |
| 6 | Nước mặt | 19 | 88 | 16,2 | 53 | 48,9 | 92,3 | 3,75 | 7,7 | 0,69 | 1,4 |
| 7 | Nước thải | 18 | 84 | 20,0 | 60 | 57,7 | 96,1 | 3,00 | 85,2 | 0,68 | 1,2 |
| 8 | Nước thải | 19 | 88 | 16,2 | 63 | 55,9 | 88,7 | 4,09 | 7,3 | 0,67 | 1,2 |
| 9 | Nước thải | 20 | 93 | 11,4 | 39,9 | 96,7 | 88,7 | 4,14 | 10,4 | 0,75 | 1,9 |
| Xem Bảng D.1 về giải thích các ký hiệu. | |||||||||||
| a Nguồn gốc các mẫu: Mẫu 1, 2 và 3, đã thêm chuẩn, Thành phố Berlin Mẫu 4, 5 và 6, đã thêm chuẩn, Landwehrkanal, Thành phố Berlin Mẫu 7, 8, 9 đã thêm chuẩn, Nhà máy xử lý nước thải, Berlin-ruhleben | |||||||||||
CHÚ THÍCH: Các điều tra nghiên cứu cho thấy rằng thêm chuẩn kali hexaxyanoferat (III) vào một mẫu nền nước thải cụ thể sử dụng trong chương trình thử nghiệm liên phòng để xác định xyanua tổng số đã không thu hồi được hoàn toàn. Thực tế phần thu hồi phụ thuộc vào thời gian trễ giữa quá trình chuẩn bị dung dịch thêm và thời điểm phân tích. Các mẫu dùng cho phép thử xác định xyanua tổng số đã được thêm chuẩn hexaxyanoferat (III). Giả sử rằng một phần thuốc thử được giảm đi theo các thành phần của mẫu nền và vì vậy có thể sinh ra độ chệch âm.
Sự phát hiện này giải thích lượng thu hồi xyanua tổng số thấp hơn trong các mẫu nước thải số 8 và số 9 như một vài thành viên tham gia đã quan sát/theo dõi được tại chương trình thử nghiệm liên phòng. Tuy nhiên hiệu ứng này có khả năng lặp lại cao như thể hiện qua sự không có các giá trị ngoại lai.
Đối với các mục đích thực tế, các nhận xét này được cho là không quan trọng lắm, vì thông thường nước thải không chứa hexaxyanoferat (III) trong các nồng độ có thể đo được. Cũng cho rằng có thể giảm hexaxyanoferat (III) theo các thành phần của nước thải đã kết thúc khi mẫu được lấy.
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] NEN 6655[1], Water en bodem - Fotometrische bepaling van het totale gehalte aan cyanide en het gehalte aan vrij cyanide met behulp van een doorstroomanalysesysteem [Water and soil - Photometric determination of the content of total and free cyanide by continuous flow analysis]
[2] KELADA, N.P. Automated direct measurements of total cyanide species and thiocyanates, and their distribution in waste water and sludge. J. Water Pollut. Contr. Fed. 1989, 61, pp. 350-356.
[3] MEEUSSEN, J.C.L., TEMMINGHOFF, E.J.M., KEIZER, M.G., NOVOZAMSKY, I. Spectrophotometric determination of total cyanide, iron-cyanide complexes and thiocyanate in water by a continuous flow system. Analyst 1989, 114. pp. 959-963.
[4] TAUW INFRA CONSULT Bv. Laboratory study on cyanide determination, Project No 3162052, Deventer, 1992-05.
[5] BERMAN, R., CHRISTMANN, D., RENN, C. Automated determination of weak acid dissociable and total cyanide without thiocyanate interterence. Am. Environ. Lab. 1993, 5, pp. 32-34.
[6] SEKERKA, I., LECHNER, J.F. Determination of cyanide by continuous flow isothermal distillation with amperometric detection. National Water Research Institute of Canada, NWRI Report, pp. 91-108.
[7] PIHLAR, B., KOSTA, L., HRISTOVSKI, B. Amperometric determination of cyanide by use of a flow-through electrode. Talanta 1979, 26, pp. 805-810.
[8] NAGY, A., NAGY, G. Amperometric air gap cell for the measurement of free cyanide. Anal. Chim. Acta 1993, 283, pp. 795-802.
[9] NIKOLIC, S., MILOSAVLJEVIC, E., HENDRIX, J., NELSON, J. Flow injection amperometric determination of cyanide on a modified silver electrode. Analyst 1992, 117, pp. 47-50.
[10] EATON, A.D., CLESCERI, L.S., GREENBERG, A.E. Method 4500-CN- Cyanide. In: Standard methods for the examination of water and wastewater. Washington, DC: American Public Health Association, 1999.
[11] SEBROWSKI, J., ODE, R. Method comparison and evaluation for the analysis of weak acid-dissociable cyanide. Environ. Sci. Technol.1937, 31, pp. 52-57.
[12] ASTM D7511, Standard test method for total cyanide by segmented flow injection analysis, in-line ultraviolet digestion and amperometric detection.
[13] TCVN 6910-2 (ISO 5725-2), Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo - Phần 2: Phương pháp cơ bản xác định độ lặp lại và độ tái lập lại của phương pháp đo tiêu chuẩn.
[1]) Cũng phù hợp để xác định xyanua tự do và xyanua tổng số trong đất và bùn.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 7723-2:2015 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 7723-2:2015 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 7723-2:2015 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 7723-2:2015 DOC (Bản Word)