- Tổng quan
- Nội dung
- Tiêu chuẩn liên quan
- Lược đồ
- Tải về
Tiêu chuẩn Quốc gia TCVN 6001-1:2021 ISO 5815-1:2019 Chất lượng nước - Xác định nhu cầu oxy sinh hoá sau n ngày (BODn) - Phần 1: Phương pháp pha loãng và cấy có bổ sung allylthiourea
| Số hiệu: | TCVN 6001-1:2021 | Loại văn bản: | Tiêu chuẩn Việt Nam |
| Cơ quan ban hành: | Bộ Khoa học và Công nghệ | Lĩnh vực: | Tài nguyên-Môi trường |
|
Ngày ban hành:
Ngày ban hành là ngày, tháng, năm văn bản được thông qua hoặc ký ban hành.
|
30/12/2021 |
Hiệu lực:
|
Đã biết
|
| Người ký: | Đang cập nhật |
Tình trạng hiệu lực:
Cho biết trạng thái hiệu lực của văn bản đang tra cứu: Chưa áp dụng, Còn hiệu lực, Hết hiệu lực, Hết hiệu lực 1 phần; Đã sửa đổi, Đính chính hay Không còn phù hợp,...
|
Đã biết
|
TÓM TẮT TIÊU CHUẨN VIỆT NAM TCVN 6001-1:2021
Nội dung tóm tắt đang được cập nhật, Quý khách vui lòng quay lại sau!
Tải tiêu chuẩn Việt Nam TCVN 6001-1:2021
TIÊU CHUẨN QUỐC GIA
TCVN 6001-1:2021
ISO 5815-1:2019
CHẤT LƯỢNG NƯỚC - XÁC ĐỊNH NHU CẦU OXY SINH HÓA SAU n NGÀY (BODn) - PHẦN 1: PHƯƠNG PHÁP PHA LOÃNG VÀ CẤY CÓ BỔ SUNG ALLYLTHIOUREA
Water quality - Determination of biochemical oxygen demand after n days (BODn) - Part 1: Dilution and seeding method with allylthiourea addition
Lời nói đầu
TCVN 6001-1:2021 thay thế TCVN 6001-1:2008.
TCVN 6001-1:2021 hoàn hoàn tương đương với ISO 5815-1:2019.
TCVN 6001-1:2021 do Ban kỹ thuật tiêu chuẩn TCVN/TC 147 Chất lượng nước biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
Bộ TCVN 6001 (ISO 5815) Chất lượng nước - Xác định nhu cầu oxy sinh hóa sau n ngày (BODn) gồm các tiêu chuẩn sau:
- TCVN 6001-1:2021 (ISO 5815-1:2019) Phần 1: Phương pháp pha loãng và cấy có bổ sung allythiourea;
- TCVN 6001-2:2008 (ISO 5815-2:2003) Phần 2: Phương pháp dùng cho mẫu không pha loãng.
Lời giới thiệu
Thời gian ủ quy định trong tiêu chuẩn này là 5 ngày hoặc 7 ngày. Việc ủ 7 ngày thường tiến hành ở một số nước Bắc Âu. Phụ lục A mô tả thời gian ủ là (2 + 5) ngày.
Tiêu chuẩn này quy định việc xác định nhu cầu oxy sinh hóa (BOD) của nước có BOD dự kiến trong khoảng 1 mg/L đến 6000 mg/L sử dụng phương pháp pha loãng. Giới hạn làm việc thấp hơn dải xác định có thể thu được kết quả từ dữ liệu xác nhận trong phòng thử nghiệm. Đối với các mẫu nước có BOD dự kiến thấp trong dải từ 0,5 mg/L đến 6 mg/L được xác định bằng phương pháp quy định trong TCVN 6001-2 (ISO 5815-2) sử dụng các mẫu không pha loãng.
CHẤT LƯỢNG NƯỚC - XÁC ĐỊNH NHU CẦU OXY SINH HÓA SAU n NGÀY (BODn) - PHẦN 1: PHƯƠNG PHÁP PHA LOÃNG VÀ CẤY CÓ BỔ SUNG ALLYLTHIOUREA
Water quality - Determination of biochemical oxygen demand after n days (BODn) - Part 1: Dilution and seeding method with allylthiourea addition
CẢNH BÁO Người dùng tiêu chuẩn này cần phải thành thạo với thực hành trong phòng thử nghiệm thông thường. Tiêu chuẩn này không đề cập đến mọi vấn đề an toàn liên quan đến người sử dụng. Trách nhiệm của người sử dụng là phải xác lập độ an toàn, đảm bảo sức khỏe và phù hợp với các quy định liên quan.
QUAN TRỌNG Điều quan trọng là phép thử tiến hành theo tiêu chuẩn này cần được thực hiện bởi những nhân viên được đào tạo phù hợp.
1 Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp xác định nhu cầu oxy sinh hóa của nước bằng phương pháp pha loãng và cấy huyền phù của các tác nhân gây ức chế quá trình nitrat hóa sau thời gian ủ 5 ngày hoặc 7 ngày.
Phương pháp này áp dụng được cho các loại nước có nhu cầu oxy sinh hóa từ 1 mg/L đến 6000 mg/L. Phương pháp này đặc biệt áp dụng cho nước thải nhưng cũng phù hợp với phân tích nước tự nhiên. Phương pháp này cũng có thể áp dụng để xác định nhu cầu oxy sinh hóa lớn hơn 6 000 mg/L oxy, nhưng cần đặc biệt cẩn thận khi xem xét tính đại diện của việc lấy mẫu con để chuẩn bị các bước pha loãng. Kết quả thu được là sản phẩm kết hợp của các phản ứng hóa học và sinh hóa khi có mặt vật cất sống. Kết quả này không thể hiện đặc tính chặt chẽ và rõ ràng của một quá trình hóa học đơn lẻ, đã xác định rõ tạo ra. Tuy nhiên, chúng cung cấp một chỉ thị để dựa vào đó có thể ước tính được chất lượng nước.
2 Tài liệu viện dẫn
Các tài liệu viện dẫn sau là rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất (bao gồm cả sửa đổi).
TCVN 4851 (ISO 3696) Nước dùng để phân tích trong phòng thử nghiệm - Yêu cầu kỹ thuật và phương pháp thử;
TCVN 6492 (ISO 10523) Chất lượng nước - Xác định pH
TCVN 6186 (ISO 8467) Chất lượng nước - Xác định chỉ số permanganat.
TCVN 6491 (ISO 6060) Chất lượng nước - Xác định nhu cầu oxy hóa học.
TCVN 6634 (ISO 8245) Chất lượng nước - Xác định tổng cacbon hữu cơ (TOC) và cacbon hữu cơ hòa tan (DOC).
TCVN 6663-3 (ISO 5667-3) Chất lượng nước - Lấy mẫu - Phần 3: Bảo quản và xử lý mẫu nước
TCVN 7324 (ISO 5813) Chất lượng nước - Xác định oxy hòa tan - Phương pháp iod.
TCVN 7325 (ISO 5814) Chất lượng nước - Xác định oxy hòa tan - Phương pháp thử điện hóa.
TCVN 12026 (ISO 17289) Chất lượng nước - xác định oxy hòa tan - Phương pháp cảm biến quang học.
ISO 15705 Water quality - Determiantion of the Chemical oxygen demand index (ST-COD) - Small- scale sealed-tube method (Chất lượng nước - Xác định chỉ số nhu cầu oxy hóa học (ST-COD) - Phương pháp ống đóng kín cỡ nhỏ)
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này áp dụng những thuật ngữ và định nghĩa sau:
3.1
Nhu cầu oxy sinh hóa sau n ngày (biochemical oxygen demand after n days)
BODn
Nồng độ khối lượng của oxy hòa tan bị tiêu thụ do quá trình oxy hóa sinh học của các chất hữu cơ và/hoặc vô cơ trong nước ở các điều kiện xác định, trong đó n là thời gian ủ bằng 5 ngày hoặc 7 ngày.
CHÚ THÍCH 1 Trong tiêu chuẩn này, “sự oxy hóa sinh hóa” được hiểu là “sự oxy hóa sinh học".
CHÚ THÍCH 2 n là 5 hoặc 7
3.2
Nhu cầu oxy hóa học (chemical oxygen demand)
COD
Nhu cầu oxi hóa học (COD): Nồng độ khối lượng của oxi tương đương với lượng dicromat tiêu tốn bởi các chất lơ lửng và hòa tan trong mẫu nước khi mẫu nước được xử lý bằng chất-oxi hóa đó ở điều kiện xác định
[NGUỒN: TCVN 6491:1999 (ISO 6060:1989),Điều 3]
3.3
Tổng các bon hữu cơ (total organic carbon)
TOC
Tổng cacbon liên kết hữu cơ tồn tại trong nước, kể cả dạng tan và không tan, gồm cả cyanat, cacbon nguyên tố và thiocyanat.
[NGUỒN: TCVN 6634:2000 (ISO 8245: 1999), 3.3]
3.4
Chỉ số pemanganat (của nước) (permangannate index (of water))
Nồng độ khối lượng của oxi tương đương với lượng ion pemanganat được sử dụng khi mẫu nước được xử lý bị oxi hóa dưới các điều kiện xác định.
[NGUỒN: ISO 8467:1993, 3.1]
3.5
Nước cấy (seeding water)
Nước có các vi sinh vật thích nghi (hiếu khí) qua đó xảy ra quá trình oxy hóa các thành phần trong nước.
CHÚ THÍCH Nước cấy thường được sử dụng sản xuất nước nuôi cấy pha loãng.
3.6
Nước pha loãng (dilution water)
Nước được bổ sung vào mẫu thử để chuẩn bị cho các dãy pha loãng xác định.
[NGUỒN: ISO 20079:2005,3.7]
3.7
Nước nuôi cấy pha loãng (seeded dilution water)
Nước pha loãng đã được thêm một lượng nước nuôi cấy nhất định.
3.8
Clo tự do (free chlorine)
Clo tồn tại dưới dạng hypocloric axit, hoặc ion hypoclorit hoặc clo nguyên tố hòa tan.
[NGUỒN: ISO 7393-1:1985, 2.1]
3.9
Clo liên kết (combined chlorine)
Phần tổng clo tồn tại dưới dạng các cloramin và cloramin hữu cơ
[NGUỒN: ISO 7393-1:1985, 2.2]
TCVN 6001-1:2021
3.10
Nitrat hóa (nitrification)
Oxy hóa muối amoni bằng vi khuẩn cho sản phẩm trung gian là nitrit và sản phẩm cuối cùng nitrat. [NGUỒN: ISO 11733:2004, 3.9]
4 Nguyên tắc
Chỉ số BODn, được xác định có ức chế sự nitrat hóa, sử dụng phương pháp pha loãng. Một loạt mẻ với các nồng độ pha loãng khác nhau của một mẫu được chuẩn bị và kiểm tra. Nước pha loãng được làm giàu oxy và được nuôi cấy các vi sinh vật hiếu khí tùy ý.
Ủ mẫu ở nhiệt độ (20 ± 1) °C trong một thời gian xác định (n), năm ngày hoặc bảy ngày, ở nơi tối, trong bình được nạp đầy và đậy kín. Xác định nồng độ oxy hòa tan trước và sau khi ủ. Tính khối lượng oxy tiêu tốn trong một lít mẫu.
5 Thuốc thử
Chỉ dùng các thuốc thử tinh khiết phân tích được công nhận
5.1 Nước, nước loại 3 theo phân loại trong TCVN 4581 (ISO 3696).
Nước không được chứa nhiều hơn 0,01 mg/L đồng, không chứa clo hoặc cloramin.
5.2 Nước cấy, có thể tạo ra nước cấy theo một trong các cách sau:
a) Nước thải đô thị, đã gạn hoặc lọc thô;
b) Nước mặt có chứa nước thải đô thị;
c) Nước thải đã xử lý của nhà máy xử lý nước thải được để lắng;
d) Nước lấy ở cuối dòng thải của chính loại nước cần phân tích hoặc nước chứa vi sinh vật thích hợp cho nước cần phân tích.
e) Nguyên liệu nuôi cấy có bán sẵn trên thị trường.
Sử dụng nước cấy có COD khoảng 300 mg/L hoặc TOC khoảng 100 mg/L (xem 5.5). Nếu COD hoặc TOC cao hơn, điều chỉnh cho tương ứng với các nồng độ trên bằng nước pha loãng (5.4) trước khi chuẩn bị nước nuôi cấy pha loãng (5.5) hoặc sử dụng thể tích thay đổi tương ứng của nước cấy để cấy nước pha loãng (5.4).
Nếu mẫu lấy từ một quy trình đã được xử lý khử trùng (khử trùng bằng clo, UV, ozon hoặc loại khác), sử dụng chất cấy, ngay cả khi không có chất khử trùng còn lại.
Đối với vật liệu nuôi cấy có bán trên thị trường, xem xét các khuyến nghị ứng dụng tương ứng.
Vật liệu nuôi cấy được chọn có thể được kiểm tra trước bằng cách tiến hành một mẻ phân tích kiểm soát (9.7) chỉ để chứng minh tính phù hợp cho việc phân tích mẫu.
5.3 Dung dịch muối
5.3.1 Yêu cầu chung
Các dung dịch sau đây bền trong ít nhất sáu tháng khi bảo quản trong bình thủy tinh ở nhiệt độ (5±3) °C trong chỗ tối. Loại bỏ ngay khi dung dịch có dấu hiệu kết tủa hoặc sinh vật phát triển.
5.3.2 Dung dịch đệm photphat
Hòa tan 8,5 g kali dihydrophotphat (KH2PO4), 21,75 g dikali hydrophotphat (K2HPO4), 33,4 g dinatri hydrophotphat ngậm 7 phân tử nước (Na2HPO4.7H2O) và 1,70 g amoni clorua (NH4Cl) trong khoảng 500 mL nước (5.1). Pha loãng bằng nước (5.1) đến 1000 mL và lắc đều. Đo giá trị pH. Nếu giá trị pH nằm ngoài khoảng 7 đến 8, chuẩn bị lại dung dịch mới.
5.3.3 Dung dịch magie sulfat ngậm 7 phân tử nước, p = 22,5 g/L.
Hòa tan 22,5 g magie sulfat ngậm 7 phân tử nước (MgSO4.7H2O) trong nước (5.1). Pha loãng với nước (5.1) đến 1000 mL và lắc đều.
5.3.4 Dung dịch canxi clorua, p = 27,5g/L.
Hòa tan 27,5 g canxi clorua khan (CaCl2) (hoặc một lượng tương đương nếu dùng canxi clorua ngậm 2 phân tử nước (ví dụ sử dụng 36,4 g CaCl2.2H2O) với nước (5.1), pha loãng với nước (5.1) đến 1 000 mL và lắc đều.
5.3.5 Dung dịch sắt (III) clorua ngậm G phân tử nước, p = 0,25 g/L.
Hòa tan 0,25 g sắt (III) clorua ngậm 6 phân tử nước (FeCl3.6H2O) trong nước (5.1). Pha loãng bằng nước (5.1) đến 1000 mL và lắc đều.
5.4 Nước pha loãng
Xác định tổng thể tích nước pha loãng cần thiết cho phép thử thực tế. Đổ khoảng một nửa thể tích nước yêu cầu (5.1) vào bình cấp liệu (6.3) đối với nước pha loãng và thêm 1 mL mỗi dung dịch muối (5.3.2, 5.3.3, 5.3.4 và 5.3.5) cho mỗi lít tổng thể tích. Sau đó đỗ vào tổng thể tích mong muốn bằng nước (5.1) và trộn bằng cách khuấy, sục khí hoặc lắc. Đưa nước pha loãng thu được trong theo cách này đến nhiệt độ (20 ± 2) °C, giữ ở nhiệt độ này và sục khí nhẹ bằng cách khuấy đều. Ví dụ, nếu cần nước cấy thích nghi đặc biệt hoặc vật liệu cấy, quy trình theo Phụ lục C có thể được tuân theo.
VÍ DỤ Nếu cần 20 L nước pha loãng thì chuẩn bị 10 L nước (5.1). Khuấy liên tục, thêm 20 mL của từng dung dịch muối riêng lẻ và làm đầy bằng nước (5.1) đến 20 L.
5.5 Nước nuôi cấy pha loãng
Việc chuẩn bị nước nuôi cấy pha loãng là cần thiết khi các dung dịch thử được chuẩn bị theo 9.3. Nồng độ khối lượng của oxy tiêu thụ trong 5 d (hoặc 7 d) ở (20 ± 1) °C bằng nước nuôi cấy pha loãng có bổ sung dung dịch allylthiourea (ATU) để ức chế quá trình nitrat hóa [giá trị trắng (xem 9.5).] phải từ 0,2 mg/L đến 1,5 mg/L.
Thêm lượng nước cấy vào nước pha loãng càng ít càng tốt.
Lượng nước cấy (5.2) cần thiết để đạt được COD giả định từ 0,6 mg/L đến 3,0 mg/L, tương ứng với mức tiêu thụ oxy mục tiêu trong các giá trị trắng (9.5), được tính toán theo Công thức (1):
Trong đó
Vseeding water là thể tích của nước cấy (5.2) được thêm vào nước pha loãng (5.3) tính bằng lít, L;
CODtaget là COD giả định (0,6 mg/L O2 đến 3 mg/L O2) trong nước nuôi cấy pha loãng (5.5) tính bằng miligam trên lít oxy, mg/L O2;
COD seeding water là COD của nước cấy (5.2) tính bằng miligam trên lít oxy, mg/L O2;
Vdilution water lượng được tính của nước pha loãng để cấy (5.4) tính bằng lít,L.
Đối với các mẻ thử nghiệm cấy trực tiếp hoặc các hệ thống tự động sử dụng phương pháp cấy trực tiếp, xem hướng dẫn trong Phụ lục C.
Thêm nước cấy (5.2) vào nước pha loãng (5.4) và trộn bằng cách khuấy hoặc lắc. Xác định hàm lượng oxy như quy định trong TCVN 7724 (ISO 5813), TCVN 12026 (ISO 17289) hoặc TCVN 7325 (ISO 5814). Sục khí vào nước nuôi cấy pha loãng lên đến hàm lượng oxy tốt nhất là tối thiểu 8 mg/L. Nước phải không được bão hòa với oxy bằng cách sục khí: để yên khoảng 1 h trong bình chứa không có nút đậy trước khi sử dụng. Giữ nước nuôi cấy pha loãng tại (20± 2) °C. Nước nuôi cấy pha loãng đã chuẩn bị sẵn như vậy có thể sử dụng ngay để chuẩn bị các lô phân tích.
Đổ bỏ phần còn lại của nước khử trùng vào cuối ngày làm việc, trừ khi phòng thử nghiệm kinh nghiệm cho thấy thông qua phân tích kiểm soát tuân thủ (9.7) với dung dịch kiểm tra (5. 9), và xác định giá trị mẫu trắng (9.5) mà nước có thể chấp nhận được trong thời gian lâu hơn.
5.6 Dung dịch axit clohydric (HCI) hoặc dung dịch axit sulfuric (H2SO4), ví dụ c (HCl) ≈ 0,50 mol/L hoặc c (H2SO4) ≈ 0,25 mol/L.
5.7 Dung dịch natri hydroxyt (NaOH), ví dụ c(NaOH) = 0,5 mol/L, p ≈ 20 g/L
5.8 Dung dịch natri sunfit (Na2SO3), ví dụ p (Na2SO3) = 50 g/L.
5.9 Axit glucô - glutamic, dung dịch kiểm soát.
Sấy khoảng 200 mg đến 300 mg D-gluco khan (C6H12O6) và 200 mg đến 300 mg axit L-glutamic khan (C5H9NO4) ở nhiệt độ (105 ± 5) °C trong 1 h. Cân mỗi chất (150 ± 1) mg, hòa tan trong nước (5.1) và pha thành 1000 mL và lắc đều. Về lý thuyết nhu cầu oxy của dung dịch này là 307 mg/L oxy cho BOD5 [BOD5 thực nghiệm là (198 ± 40) mg/L oxy và BOD7 (dựa trên hệ số chuyển đổi BOD5/BOD7 = 1,04 lấy từ Bảng D.3 và BOD5 thực nghiệm là (206 ± 40) mg/L oxy).
Chuẩn bị dung dịch này ngay trước khi dùng và đổ bỏ phần còn lại vào cuối ngày làm việc. Một lượng nhỏ dung dịch này có thể giữ đông lạnh. Dung dịch đông lạnh này có thể giữ trong tối đa ba tháng. Dung dịch phải được sử dụng ngay sau khi làm tan đông lạnh.
5.10 Dung dịch allylthiorea (ATU), p =1,0g/L
Hòa tan 200 mg allylthiourea (C4H8N2S) trong nước (5.1), pha loãng bằng nước (5.1) đến 200 mL và lắc đều. Bảo quản dung dịch ở (5±3) °C. Dung dịch này bền ít nhất hai tuần.
CẢNH BÁO Thuốc thử này là độc hại và do đó phải được xử lý an toàn.
Sự ức chế nitrat hóa không đạt được trong mọi trường hợp bằng cách thêm 2 ml dung dịch ATU (p = 1,0 g/L) trên một lít hỗn hợp phân tích. Việc bổ sung một thể tích cao hơn đáng kể so với 2 mL dung dịch ATU này có thể gây ảnh hưởng đến quá trình chuẩn độ theo TCVN 7324 (ISO 5813) (xem 9.6.1).
6 Thiết bị, dụng cụ
Sử dụng các thiết bị, dụng cụ trong phòng thử nghiệm thông thường và các thiết bị, dụng cụ sau:
6.1 Yêu cầu chung
Mọi dụng cụ thủy tinh và chất dẻo cần phải sạch, không hấp thụ các hợp chất độc hoặc chất phân hủy sinh học, luôn được giữ gìn để không bị nhiễm bẩn.
6.2 Bình ủ, bình BOD (loại Karlsruhe), dung tích từ 100 mL đến 300 mL hoặc bình nón có nút hoặc phễu thích hợp, hoặc các bình đóng kín không có bong bóng thích hợp khác. Khi sử dụng hệ thống tự động, điều quan trọng là sử dụng các bình ủ có thể tích chính xác, vì các bình ủ đóng vai trò như các bình pha loãng.
6.3 Bình đựng nước nuôi cấy pha loãng và bình đựng nước không nuôi cấy pha loãng, bình thủy tinh hoặc nhựa/chất dẻo.
Phải áp dụng các biện pháp thích hợp để đảm bảo bình này được bảo quản sạch và không có vi sinh vật phát triển và tránh ánh sáng.
6.4 Tủ ủ, buồng ủ và bình ủ có khả năng duy trì được nhiệt độ (20 ± 1) °C và tối.
6.5 Thiết bị xác định nồng độ oxy hòa tan, phù hợp với TCVN 7324 (ISO 5813) (phương pháp iod) hoặc TCVN 7325 (ISO 5814) (phương pháp đầu đo điện hóa) sử dụng đầu đo oxy hoặc TCVN 12026 (ISO 17289) (phương pháp cảm biến quang học) sử dụng đo oxy quang học.
6.6 Thiết bị làm lạnh và làm mát, vận chuyển và lưu giữ mẫu.
6.7 Bình pha loãng, bình trộn tốt nhất là bằng thủy tinh, ví dụ bình định mức hoặc ống đong chia độ, với thể tích xác định có dung tích đủ cho lô pha loãng và có khả năng trộn đều
6.8 Thiết bị sục khí, chai chứa khí nén hoặc một máy nén khí. Chất lượng không khí sục phải không làm nhiễm bẩn mẫu do sục khí, đặc biệt là làm nhiễm thêm chất hữu cơ, oxy hóa hoặc khử vật liệu, hoặc kim loại. Nếu nghi ngờ bị nhiễm bẩn, thì không khí cần được lọc và rửa.
6.9 Máy đo pH đáp ứng các yêu cầu để xác định pH, như quy định trong TCVN 6492 (ISO 10523).
6.10 Máy khuấy để đảm bảo rằng mẫu là đồng nhất để tách các mẫu hạt và không có không khí lọt vào
6.11 Bộ lọc sợi thủy tinh GF 6.
7 Lấy mẫu và bảo quản mẫu
Bình chứa có nắp đậy làm từ thủy tinh hoặc nhựa là phù hợp để lấy mẫu. Dung tích của bình cần đủ lớn để đảm bảo cho những dãy pha loãng phù hợp. Nạp đầy bình lấy mẫu kín, đậy kín bình và làm mát đến (5±3) °C càng sớm càng tốt. Bảo quản mẫu trong bóng tối để ngăn tảo phát triển và làm mát ở nhiệt độ (5±3) °C cho đến cuối ngày hôm sau ngày lấy mẫu.
Nếu các mẫu không thể được phân tích các mẫu trong ngày hôm sau khi lấy, cần làm đông lạnh các mẫu sau khi lấy mẫu càng sớm càng tốt và bảo quản mẫu ở ≤ - 18 °C trong vòng 1 tháng, hoặc có thể đến 6 tháng nếu BOD> 50 mg/L, trong những bình thích hợp trong bóng tối hoặc trong bình tối màu như quy định trong TCVN 6663-3 (ISO 5667-3). Đảm bảo rằng các bình không gây ra quá nhiều giá trị mẫu trắng (9.5). Vì các bình chứa mẫu đã lấy nạp đầy hoàn toàn khi được vận chuyển, nên việc giảm thể tích mẫu đến thể tích đủ để cho phép sự giãn nở do đóng băng (tránh vỡ bình chứa) cần thực hiện trong phòng thử nghiệm sau khi đồng nhất mẫu.
Rã đông các mẫu thử ở nhiệt độ tối đa là (20 ± 2) °C, nhưng không quá 16 h, vì nếu không, quá trình sự xâm nhập của vi khuẩn có thể làm sai lệch kết quả. Do đó, mẫu thử cần được đông lạnh từng phần, mỗi phần mẫu thử có thể thích không vượt quá 1 L. Không được rã đông các mẫu thử bằng bất kỳ thiết bị gia nhiệt nào, ví dụ lò vi sóng hoặc đĩa gia nhiệt, trong đó (một phần của) mẫu đạt nhiệt độ lớn hơn 22 °C sẽ không được cho phép và dẫn đến kết quả sai. Nhiệt độ của bồn cách thủy không được vượt quá 22 °C. Cần rã đông hoàn toàn mẫu thử trước khu sử dụng, vì quá trình đông lạnh có thể dẫn đến sự tập trung của một số thành phần nhất định tại phần bên trong của mẫu. Không được làm đông lạnh lại mẫu thử đã được rã đông
8 Cản trở
8.1 Yêu cầu chung
Các chất độc đối với vi sinh vật, ví dụ như chất diệt khuẩn, clo tự do, v.v., ức chế oxy hóa sinh hóa và dẫn đến giảm kết quả. Tăng kết quả có thể xảy ra do sự hiện diện của vi sinh nitrat hóa. Sự có mặt của tảo có thể dẫn đến đánh giá quá mức BOD và làm rối loạn phép xác định.
8.2 Sự có mặt clo tự do và/ hoặc clo liên kết
Loại bỏ clo tự do và/hoặc clo liên kết trong mẫu bằng cách thêm thể tích dung dịch natri sulfit thích hợp (5.8). Cẩn thận để tránh thêm phần dư thừa: thực hiện xác định nồng độ clo tự do và clo liên kết như quy định trong ISO 7393-1[3] hoặc ISO 7393-2[4] và tính thể tích của dung dịch natri sulfit theo Công thức (2)
Trong đó
V1 Là thể tích của dung dịch natri sunfit (5.8) tính bằng mililít, mL;
Vp là thể tích mẫu cần xử lý tính bằng mililit, mL;
p2 là lượng clo tự do đo được trong mẫu, tính bằng gam trên lít, g/L;
p3 là nồng độ của dung dịch natri sunfit tính bằng gam trên lít, g/L.
8.3 Sự có mặt của tảo
Trong trường hợp mẫu có chứa tảo, cần xem xét lọc sau khi lấy mẫu ngoài hiện trường hoặc lọc trực tiếp sau khi đưa đến phòng thử nghiệm để tránh việc tạo ra kết quả cao không bình thường. Sử dụng phin lọc sợi thủy tinh (6.11). Lọc có thể làm thay đổi cơ bản kết quả BOD cho nên chỉ tiến hành lọc nếu thật sự thấy cần thiết trong đánh giá chất lượng nước hoặc nếu phân tích từ mẫu yêu cầu không có tảo. Việc lọc cần phải nêu trong báo cáo thử nghiệm (xem Điều 11).
8.4 Sự có mặt của peroxit và các hợp chất peroxit
CHÚ THÍCH: Peroxit và các hợp chất peroxit có thể được tìm thấy trong nước thải của ngành sản xuất chip hoặc tiệm giặt là lớn, v.v...
Các hợp chất peroxit và peroxit làm giảm kết quả phát hiện; do đó peroxit phải được loại bỏ khỏi mẫu cần kiểm tra.
Các phương pháp sau có thể được áp dụng để chỉ định nếu nghi ngờ có peroxit:
- Chứng minh bằng giấy hồ tinh bột iotdua. lốt và giấy lọc chứa tinh bột có màu xanh lam khi có peroxide, nhưng nó cũng phản ứng với clo. Có sẵn dải thử peroxide được bán trên thị trường cho phương pháp này.
- Chứng minh bằng cách sử dụng phép đo hàm lượng oxy (9.6.2). Quá bão hòa nồng độ oxy hòa tan trong mẫu có thể chỉ ra sự có mặt của peroxit và các hợp chất peroxit.
Nếu phát hiện thấy peroxit, có thể áp dụng nhiều phương pháp phá hủy peroxit khác nhau:
- Peroxit có thể được loại bỏ bằng cách lắc hoặc khuấy mạnh mẫu trong một bình hở. Các Sự hiện diện của peroxit phải được kiểm tra bằng cách sử dụng dải thử peroxit hoặc đo nồng độ oxy hòa tan TCVN 6001-1:2021 theo thời gian, nhưng không quá 2 h. Việc phá hủy peroxit được kết thúc khi nồng độ oxy hòa tan không còn giảm trong khoảng thời gian 30 min hoặc các dải thử không còn chỉ ra còn peroxit.
- Một số hợp chất peroxit không thể được loại bỏ bằng các phương pháp này. Các hợp chất peroxit có thể được phân hủy bằng dung dịch natri sulfit (5.8). Sử dụng một phần mẫu để xác định thể tích dung dịch natri sulfit (5.8) cần để phân hủy các hợp chất peroxit. Tránh dùng dư và thử sự tiêu thụ oxy tự phát. Kiểm tra sự phân hủy hoàn toàn có thể được thực hiện với dải thử peroxide. Dựa vào các kết quả này tính lượng dung dịch natri sunfit cần dùng để loại bỏ peroxit và các hợp chất peroxit trong lượng mẫu cần thiết cho phép thử. Thêm một lượng tương đương với phần mẫu được sử dụng để xác định BOD.
Cần lưu ý rằng cách xử lý mẫu này có thể thay đổi mẫu, do đó ghi lại cách xử lý mẫu để loại bỏ peroxit trong báo cáo thử nghiệm.
9 Cách tiến hành
9.1 Yêu cầu chung
Nếu nghi ngờ sự có mặt của các chất độc hại đối với vi sinh vật, thì nên áp dụng việc thử nghiệm tại một số độ pha loãng khác nhau của mẫu theo Phụ lục B.
Số lượng bình cần chuẩn bị phụ thuộc vào kỹ thuật đo oxy hòa tan và số lượng nhắc lại mong muốn. Việc cấy trực tiếp các lô phân tích được mô tả trong Phụ lục C.
9.2 Xử lý sơ bộ
Việc xử lý trước được thực hiện đối với các mẫu chậm nhất là một ngày sau khi lấy mẫu hoặc đối với các mẫu đông lạnh sau khi rã đông mẫu hoàn toàn.
9.2.1 Trung hòa mẫu
Trung hòa mẫu hoặc pha loãng mẫu (ví dụ trong hệ thống tự động) bằng dung dịch axit clohydric (5.6) hoặc natri hydroxyt (5.7) nếu giá trị pH không nằm trong khoảng từ 6 đến 8. Chọn nồng độ của dung dịch axit clohydric (5.6) hoặc natri hydroxit (5.7) để hạn chế thể tích thêm vào không vượt quá 5 % tổng thể tích. Nêu rõ kết tủa tiềm ẩn xảy ra trong báo cáo thử nghiệm.
CHÚ THÍCH Nếu toàn bộ mẫu đáp ứng các yêu cầu pH, thì mọi sự pha loãng cũng đều đáp ứng.
9.2.2 Đồng nhất mẫu
Đối với việc lấy mẫu phụ mẫu tươi hoặc đã rã đông phải được trộn đều trước khi phân bố. Cần đảm bảo sự phân bố của tất cả các thành phần hòa tan và dạng hạt (ví dụ nhẹ nhàng khuấy hoặc lắc mạnh). Nếu mẫu chứa các hạt lớn, làm phức tạp việc hút của từng phần mẫu có chất lượng như nhau, đồng nhất bằng cách nghiền nhỏ các hạt với ví dụ thiết bị phân tán được khuyến nghị.
9.3 Chuẩn bị dung dịch thử
Đưa mẫu về nhiệt độ (20 ±2) °C. Đảm bảo tính đồng nhất của mẫu trong quá trình chuẩn bị các dung dịch pha loãng, ví dụ bằng cách khuấy nhẹ hoặc lắc mạnh bằng tay hoặc bằng máy khuấy không có không khí cho đến khi tất cả các lô phân tích được tạo ra.
Tốt nhất là tiến hành thử nghiệm với hai lần lặp lại cho mỗi độ pha loãng. Tùy thuộc vào mục đích thử nghiệm và các yêu cầu đảm bảo chất lượng đối với các mẫu đã chọn, thử nghiệm chỉ một lần lặp lại cho mỗi độ pha loãng là có thể chấp nhận được. Ghi lại số dung dịch pha loãng (xem 9.4) và số lần lặp lại trên mỗi độ pha loãng được thử nghiệm cho mẫu trong báo cáo thử nghiệm [Điều 11 d)].
Mô tả sau đây của quy trình có tính đến ít nhất hai lần lặp lại cho mỗi độ pha loãng và một số độ pha loãng.
Tính thể tích mẫu và nước nuôi cấy pha loãng cần thiết để chuẩn bị các dung dịch thử cho số lượng dung dịch pha loãng đã chọn và số lượng lặp lại xem xét 9.4 để lựa chọn các dung dịch pha loãng. Nếu phương pháp chuẩn độ iốt (9.6.1) được sử dụng, cần sử dụng một dãy các chai thứ hai có lặp lại để xác định nồng độ oxy hòa tan tại thời điểm bằng không.
Cho từng thể tích đã biết của mẫu (hoặc mẫu đã xử lý trước) vào các bình pha loãng (6.7), thêm 2 mL dung dịch allylthiourea (5.10) trên một lít mẫu đã pha loãng và đổ dung dịch pha loãng cấy (5.5) đến vạch mức. Nếu hệ số pha loãng được sử dụng lớn hơn 100, tiến hành dãy pha loãng thành hai hoặc nhiều bước hơn. Khi áp dụng hệ thống phân tích tự động, thêm một thể tích xác định của mẫu (hoặc mẫu đã xử lý trước) vào bình ủ. Việc bổ sung 2 mL dung dịch allylthiourea (5.10) cho mỗi mẻ lít và nước nuôi cấy pha loãng (5.5) xảy ra hoàn toàn tự động qua hệ thống.
9.4 Tính độ pha loãng
9.4.1 Xác định thực nghiệm các độ pha loãng
Vì độ pha loãng mẫu cho phép đo được giá trị BODn ngay trong chỉ một lần pha là không thể đạt ngay được, nên nhiều độ pha loãng với hệ số pha loãng (là giá trị tương ứng giữa thể tích mẫu và tổng thể tích hỗn hợp đo) tương ứng với giá trị BODn dự kiến (xem Bảng 1 và Phụ lục B) cần được chuẩn bị. Các yếu tố phụ trợ để xác định các hệ số pha loãng và dãy pha loãng được mô tả trong 9.4.2 và 9.4.3. Nếu có sẵn thông tin đầy đủ về mức tiêu thụ oxy của mẫu (ví dụ, thành phần ổn định của mẫu kiểm tra đã biết), chấp nhận kết quả thử nghiệm chỉ một độ pha loãng, nếu kết quả thử nghiệm đối với độ pha loãng này phù hợp với tiêu chí xác nhận giá trị sử dụng (10.3). Nếu nghi ngờ có chất độc hại (ví dụ mùi hóa chất mạnh), sự pha loãng là không thể thiếu và nên chuẩn bị các độ pha loãng trên một khoảng nồng độ rộng hơn.
9.4.2 Xác định độ pha loãng thông qua hệ số R của TOC, chỉ số pemanganat hoặc COD
Xác định tổng cacbon hữu cơ (TOC) (theo TCVN 6634 (ISO 8245), chỉ số pemanganat (theo ISO 8467) hoặc nhu cầu oxy hóa học (COD) (theo TCVN 6491 (ISO 6060) hoặc ISO 15705) trong một phần mẫu đại diện có thể cung cấp các quyết định có giá trị cho dãy pha loãng tương ứng.
Bảng 2 cho thấy khoảng thời gian điển hình cho R, tỷ số BOD với TOC, chỉ số pemanganat hoặc COD, đối với một vài kiểu mẫu.
Bảng 1 - Ví dụ về dãy pha loãng điển hình (3 mức độ pha loãng mỗi dãy) để xác định BOD5
| BODn dự kiến n = 5 d mg/L oxy | Thể tích mẫu có thể mL/L (cho loạt pha loãng mẫu tương ứng) mL/L | Hệ số pha loãnga |
| 1 đến 6 | 250, 500, 750b hoặc 200, 400, 600 | 4 đến 1,33 |
| 4 đến 12 | 200, 400, 600b hoặc 200, 300, 400 | 5 đến 1,67 |
| 10 đến 30 | 200, 400, 600 hoặc 50, 100, 150 | 20 đến 1,67 |
| 20 đến 60 | 100, 200, 300 hoặc 40, 60, 80 | 25 đến 3,33 |
| 40 đến 120 | 40, 80, 120 hoặc 20, 30, 40 | 50 đến 8,33 |
| 100 đến 300 | 30, 40, 50 hoặc 5, 10, 15 | 200 đền 20 |
| 200 đến 600 | 10, 20, 30 hoặc 3, 6, 9 | 333 đến 33,3 |
| 400 đến 1200 | 4, 8, 12 hoặc 1,2, 3 | 1000 đến 83,3 |
| 1000 đến 3000 | 2,4, 6 hoặc 0,5; 1,0; 1,5c | 2000 đến 167 |
| 2000 đến 6000 | 1,2, 3 hoặc 0,3; 0,6; 0,9 | 3333 đến 333 |
| a Thể tích mẫu áp dụng so với tổng thể tích của mẻ phân tích. b Khuyến nghị đối với các mẫu từ quy trình xử lý nước thải có xử lý sinh học tốt. c Đối với điều này, tốt nhất là chuẩn bị các dung dịch pha loãng của ví dụ 1:10. (Dữ liệu bao gồm cả độ pha loãng sơ bộ). | ||
Bảng 2 - Giá trị đặc trưng của tỷ số R
|
| Tổng cacbon hữu cơ BODn/TOC | Chỉ số pecmanganat BODn/chỉ số pecmanganat | Nhu cầu oxy hóa học BODn/COD |
| Nước thải chưa xử lý | 1,2 đến 2,8 | 1,2 đến 1,5 | 0,35 đến 0,65 |
| Nước thải đã qua xử lý sinh học | 0,3 đến 1,0 | 0,5 đến 1,2 | 0,10 đến 0,35 |
Chọn từ kinh nghiệm các giá trị R thích hợp từ Bảng 2 và tính các giá trị BODn dự kiến theo Công thức (3):
BODn (exp ected) = R.y (3)
Trong đó
y là giá trị TOC hoặc chỉ số permanganat hoặc giá trị COD đo được tính bằng miligam trên lít, mg/L;
R là tỷ số tương ứng từ Bảng 2, không thứ nguyên.
Sử dụng các giá trị thấp hơn và cao hơn của tỷ số R từ Bảng 2 tương ứng để tính BODn dự kiến. Dựa trên nồng độ BOD dự kiến được tính này, tìm ra thể tích mẫu có thể có trên một lít mẻ thử nghiệm và các hệ số pha loãng tương ứng từ Bảng 1. Chọn độ pha loãng thứ ba tương ứng với hai độ pha loãng được tính.
VÍ DỤ: Nước thải chưa qua xử lý, R từ 1,2 đến 2,8 và TOC (y) đo được là 100 mg/L.
BODn dự kiến = 1,2 x 100 mg/L = 120 mg/L.
BODn dự kiến, = 2,8 x 100 mg/L = 280 mg/L.
Vì BODn dự kiến từ 120 mg/L đến 280 mg/L, dãy pha loãng với 30 mL/L, 40 mL/L và 50 mL/L là thích hợp.
9.4.3 Tính toán các lần pha loãng qua COD
Đối với các mẫu có COD> 60 mg/L, tốt hơn là sử dụng Công thức (4). Tính độ pha loãng thấp nhất lần F (nghĩa là lần có thể tích mẫu cao nhất) thông qua COD theo Công thức (4):
Trong đó
F là thể tích mẫu của tổng thể tích lô, tính bằng mililit trên lít, mL/l;
COD là giá trị số nhu cầu oxy hóa học tính bằng miligam trên lít, mg/L.
Nửa F để xác định lần pha loãng cao nhất với thể tích mẫu thấp nhất (thể tích mẫu thấp nhất = F/2). Lần pha loãng thứ ba được tính theo giá trị trung bình của cả hai lần pha loãng đã tính.
VÍ DỤ: COD bằng 250 mg/L O2.
Lần pha loãng thấp nhất là 40 mL thể tích mẫu trên một lít tổng thể tích lô. Nếu F = 40 mL/L được chia hai, xác định lần pha loãng cao nhất với thể tích mẫu 20 mL/L. Giá trị trung bình của cả hai thể tích mẫu là thể tích mẫu 30 mL/L và 30 mL/L là lần pha loãng trung bình. Dãy pha loãng được định đến cần gồm các nồng độ này.
9.5 Phép thử trắng
Tiến hành phép thử trắng song song với phép xác định, sử dụng nước nuôi cấy pha loãng (5.5) bao gồm 2 mL dung dịch ATU (5.10) trên một lít lô phân tích.
Nếu BOD của các dung dịch trắng vượt quá 1,5 mg/L O2, các nguyên nhân có thể xảy ra, ví dụ nguồn nhiễm bẩn phải được tìm kiếm.
Nếu các lô phân tích được cấy trực tiếp, sử dụng quy trình được mô tả trong Phụ lục C.
9.6 Xác định oxy hòa tan
9.6.1 Đo oxy hòa tan dùng phương pháp chuẩn độ iốt [theo TCVN 7324 (ISO 5813)]
Đổ đầy dung dịch thử pha loãng (9.3) vào hai dãy bình ủ (6.2) với một hoặc nhiều lần lặp lại cho mỗi mức pha loãng (9.4), và ít nhất 2 bình chứa dung dịch trắng (9.5) để cho dung dịch tràn nhẹ.
Trong quá trình nạp phải chú ý tránh làm thay đổi hàm lượng oxy của dung dịch.
Để cho các bọt khí bám trong thành bình thoát ra hết. Đậy nút bình, cẩn thận để tránh các bọt khí bị tắc lại.
Chia các bình thành hai dãy, mỗi dãy gồm ít nhất hai bình ứng với từng độ pha loãng và ít nhất hai bình là dung dịch trắng (9.5).
Đặt loạt bình thứ nhất chứa dung dịch thử đã pha loãng và dung dịch trắng vào tủ ủ (6.4) và để nơi tối trong n ngày ± 4 h ở (20 ±1) °C.
Tại điểm "không", đo nồng độ oxy hòa tan trong loạt bình thứ hai chứa dung dịch thử. Sử dụng phương pháp quy định trong TCVN 7324 (ISO 5813).
Sau khi ủ xong, xác định nồng độ oxy hòa tan trong từng bình, bằng phương pháp quy định trong TCVN 7324 (ISO 5813).
9.6.2 Đo oxy hòa tan dùng phương pháp đầu đo điện cực [theo TCVN 7325 (ISO 5814) hoặc TCVN 12026 (ISO 17289)]
Đổ đầy vào một hay nhiều bình ủ nhắc lại (6.2) dung dịch thử pha loãng (9.3) và đổ vào hai bình dung dịch trắng (9.5), để cho dung dịch đầy tràn nhẹ. Trong quá trình đổ phải chú ý tránh làm thay đổi hàm lượng oxy của dung dịch.
Để cho các bọt khí bám trong thành bình thoát ra hết.
Đo nồng độ oxy hòa tan trong từng bình tại điểm "không" bằng phương pháp quy định trong TCVN 7325 (ISO 5814) hoặc TCVN 12026 (ISO 17289).
Nếu cần, thêm nước pha loãng để thay thế nước bì tràn và đậy nút bình, cẩn thận để tránh các bọt khí bị tắc lại.
Đặt các bình chứa dung dịch thử đã pha loãng (9.3) và dung dịch trắng (9.5) vào buồng ủ (6.4) và để nơi tối trong n ngày ± 4 h ở (20±1) °C.
Sau khi ủ, xác định nồng độ oxy hòa tan trong mỗi bình, dùng phương pháp quy định trong TCVN 7325 (ISO 5814) hoặc TCVN 12026 (ISO 17289).
9.7 Phép thử kiểm tra
Kiểm tra phương pháp cho từng dãy mẫu bằng cách sử dụng dung dịch kiểm tra axit glucose-glutamic (5.9). Đổ 20 mL/L mỗi dung dịch kiểm tra axit glucose-glutamic (5.9) vào bình pha loãng hoặc bình ủ. Thêm dung dịch ATU (5.10) theo cách pha loãng 2 mL dung dịch ATU (5.10) cho mỗi 1 L mẻ phân tích thu được và đổ đầy bằng nước (5.1).
Vì những lý do thực tế, số lượng phép đo kiểm tra có thể giảm xuống, ví dụ như trong phòng thử nghiệm, nơi nước nuôi cấy pha loãng được lưu trữ trong các bình lớn trong vài ngày, đối chứng có thể được kiểm tra trong dãy đầu tiên và dãy cuối cùng với nước pha loãng này. Cách tiếp cận này có thể chấp nhận được, nếu đủ kinh nghiệm thực tế liên quan đến xu hướng của các kết quả khi thử nghiệm giá trị trắng và dung dịch kiểm tra (5.9) có sẵn và các tiêu chí kiểm tra xác nhận (10.3) được đáp ứng cho mỗi dãy. Thực hiện phép đo theo 9.6.
VÍ DỤ: Chuẩn bị kiểm tra bằng dung dịch đối chứng axit glutamic 20 mL/L (5.9) tại thời điểm bắt đầu và kết thúc mẻ sử dụng bình chiết rót đã chuẩn bị (6.3).
Nếu yêu cầu độ chính xác cao hơn, dãy pha loãng gồm 10 mL/L, 20 mL/L và 30 mL/L dung dịch 5.9.
Các giá trị BOD đạt được phải nằm trong khoảng (198 ±40) mg/L oxy trong xác định BOD5 và trong khoảng (206 ±40) mg/L oxy đối với xác định BOD7.
CHÚ THÍCH: Khoảng kết quả đo với GGA lớn phản ánh mức độ chấp nhận của mẫu và độ biến động của phép phân tích.
Các giới hạn kiểm tra chính xác cho mỗi phòng thử nghiệm có thể thấp hơn (ví dụ (198 ± 20) mg/L) và phải thu được từ việc xây dựng biểu đồ kiểm soát dựa trên tối thiểu 25 phép xác định trong khoảng thời gian ít nhất vài tuần. Giá trị trung bình được tính toán từ các kết quả cho tất cả các độ pha loãng và lặp lại và độ lệch chuẩn sau đó có thể được sử dụng để tính các giới hạn kiểm soát cho việc kiểm tra kiểm soát chất lượng.
Nếu không thể đạt được BODn đã đạt được, kiểm tra xem quy trình đã được thực hiện đúng cách chưa.
10 Tính và thể hiện kết quả
10.1 Kiểm tra sự tiêu thụ oxy trong quá trình thử nghiệm
Các dung dịch thử nghiệm là hợp lệ và có thể được sử dụng để tính toán kết quả thử nghiệm BODn nếu ít nhất là 2,5 mg/L cạn kiệt do tiêu, thụ oxy trong quá trình ủ và ít nhất 1 mg/L oxy hòa tan vẫn còn ở cuối khoảng thời gian 5 ngày hoặc 7 ngày trong dung dịch pha loãng đã thực hiện.
Mức tiêu thụ oxy tối thiểu 2,5 mg/L không áp dụng trong trường hợp sử dụng hệ số pha loãng thấp nhất có thể.
Giới hạn dưới của khoảng làm việc là kết quả từ dữ liệu xác nhận trong phòng thử nghiệm và có thể được tính gấp ba lần độ lệch chuẩn tái lập (3 x sR) của dung dịch thử nghiệm gần giới hạn định lượng (LOQ) với hệ số pha loãng thấp nhất có thể.
10.2 Tính toán nhu cầu oxy sinh hóa sau n ngày (BODn)
Tính nhu cầu oxy sinh hóa (BODn) trong mỗi bình, tính bằng miligam oxy trên lít, theo công thức (5):
trong đó
p1 là nồng độ oxy hòa tan của một dung dịch thử tại điểm “không”, tính bằng miligam trên lít, mg/L;
p2 là nồng độ oxy hòa tan của cùng dung dịch thử sau n ngày, tính bằng miligam trên lít, mg/L;
p3 là nồng độ oxy hòa tan của dung dịch mẫu trắng ở điểm "không", tính bằng miligam trên lít;
p4 là nồng độ oxy hòa tan của dung dịch mẫu trắng sau n ngày, miligam trên lít;
Vsam là thể tích của mẫu dùng để chuẩn bị dung dịch thử, tính bằng mililít;
Vt là tổng thể tích của dung dịch thử đó, tính bằng mililít.
Nếu sử dụng phương pháp theo Phụ lục C (xem Điều 9), áp dụng phép tính với Công thức (C.1) trong Phụ lục C.
Nếu có ít nhất hai độ pha loãng thử nghiệm hợp lệ theo 10.1, thì tính giá trị trung bình của các kết quả thu được đối với các dung dịch này làm kết quả thử nghiệm BOD.
Sử dụng kết quả của một độ pha loãng duy nhất để tính kết quả BOD cuối cùng,
a) chỉ khi độ pha loãng này tuân thủ tất cả các tiêu chí phê duyệt (10.1), hoặc
b) chọn một trong số ít nhất ba độ pha loãng làm kết quả thử nghiệm BOD nếu phép tính sử dụng tất cả các dung dịch thử hợp lệ (10.1) và (10.3) theo Công thức (B.4) cho thấy r ≥ 0,995.
Biểu thị kết quả bằng miligam oxy trên lít. Báo cáo kết quả nhỏ hơn 1,0 mg/L oxy cho mg/L gần nhất. Ví dụ kết quả lớn hơn 10 mg/L oxy có thể được báo cáo với hai chữ số có nghĩa 12 mg/L oxy hoặc 380 mg/L oxy.
10.3 Tiêu chí kiểm tra xác nhận
Các kết quả thu được trong thử nghiệm của từng bộ phân tích là đáng tin cậy và do đó được coi là được chấp thuận, nếu chúng đáp ứng các tiêu chí kiểm tra xác nhận sau:
- mức tiêu thụ oxy của dung dịch trắng (9.5) trong phép thử là 0,2 mg/L đến 1,5 mg/L O2;
- BOD của dung dịch axit glutamic-glucoza (9.7) trong bộ này nằm trong khoảng cho phép (198±40) mg/L đối với BOD5 và (206 ± 40) mg/L đối với BOD7
- ít nhất 2,5 mg/L sẽ bị hết khi tiêu thụ oxy trong quá trình ủ và ít nhất 1 mg/L oxy hòa tan vẫn còn ở cuối khoảng thời gian 5 ngày (hoặc 7 ngày) trong các dung dịch pha loãng được thực hiện cho tính kết quả kiểm tra BODn
Các kết quả không đáp ứng các tiêu chí được chỉ định trước không được coi là hợp lệ.
Nếu sai hỏng là do một số biện pháp kiểm soát chất lượng thì toàn bộ phép thử sẽ bị loại bỏ.
11 Báo cáo thử nghiệm
Báo cáo thử nghiệm gồm các thông tin sau:
a) Phương pháp thử đã áp dụng cùng với viện dẫn tiêu chuẩn này;
b) kỹ thuật đã tiến hành ức chế sự nitrat hóa, nếu dùng;
c) số ngày ủ (n);
d) số lần pha loãng và nhắc lại cho từng độ pha loãng được thử;
e) kết quả BODn, tính bằng miligam trên lít oxy (báo cáo kết quả như trình bày trong 10.2) độ pha loãng đã thử và tính hoặc chọn BODn làm kết quả thử cuối cùng;
f) những kết quả ở dưới khoảng làm việc, lập tài liệu cho giới hạn phát hiện tương ứng;
g) những chi tiết đặc biệt đã từng được ghi nhận trong quá trình thử nghiệm (ví dụ sự kết tủa);
h) những chi tiết về các thao tác mà không quy định trong tiêu chuẩn này, hoặc xem như tùy chọn như lọc (8.3) làm đông lạnh (xem Điều 7), đồng nhất mẫu (xem 9.2.2), phá hủy peroxit (xem 8.4) thời gian ủ thay đổi (BOD2+5) (xem Phụ lục A) và thử nghiệm nhiều lần (xem Phụ lục B).
Phụ lục A
(quy định)
Ảnh hưởng của thời gian và nhiệt độ ủ
Tốc độ oxy hóa cacbon trong giai đoạn đầu thử BOD có thể biểu diễn bằng định luật Phelps [Công thức (A-1)]:
trong đó
L là giá trị BOD cuối cùng ở thời điểm bất kỳ, tính bằng miligam trên lít oxy, mg/L 02;
x là giá trị BOD ờ thời điểm t, tính bằng miligam trên lít oxy, mg/L O2;
t là thời gian, tính bằng ngày, d;
k là hằng số tốc độ, tính bằng bằng đại lượng nghịch đảo của ngày.
Đối với một loại hợp chất hữu cơ và chất cấy vi sinh cho trước, hiệu ứng của nhiệt độ đến hằng số tốc độ k và giá trị L có thể dự đoán được ở mức độ gần đúng đầu tiên. Điều đó rất có ích khi xem xét phép thử BOD ở những vùng khí hậu ấm hoặc khi nghiên cứu những con sông dài chảy qua nhiều vùng khí hậu. Tuy nhiên, khi dùng mối tương quan này phải rất thận trọng.
BOD tiêu chuẩn là kết quả thu được sau 5 ngày hoặc 7 ngày ủ ở (20±1) °C.
Do những lý do thực tế, phép xác định BOD5 có thể được thay thế bằng phép xác định BOD2+ 5. Bằng cách ủ trong 2 ngày ở [0 đến 4) °C sau đó là 5 ngày ở (20 ± 1) °C, kết quả là BOD2+ 5. Kết quả đã được quan sát (Tài liệu tham khảo [1] và Bâng D.2) rằng không có sự khác biệt đáng kể giữa BOD5 và BOD2+ 5 sau khi pha loãng mẫu.
Khi xác định BOD2+ 5, giữ các chai bằng dung dịch thử đã pha loãng (xem 9.3) và dung dịch trắng (9.5) trong bóng tối ở (0 đến 4) °C trong 2 d ± 2 h, sau đó đưa chúng vào tủ ủ (6.4) và để trong bóng tối với nhiệt độ của các dung dịch được cân bằng ở (20 ±1) °C trong 5 d ± 2 h. Sự tăng nhiệt độ của các mẫu diễn ra ở (20 ±1) °C, trong bóng tối và trong khoảng thời gian 2 h yêu cầu ở mức tối đa.
CHÚ THÍCH: Nếu cùng một tủ ủ được sử dụng cho các mẫu ở cả hai nhiệt độ, thì có thể cần sử dụng một tủ ủ với máy thông khí để có thể thay đổi nhiệt độ trong khoảng thời gian cần thiết lên đến 2 h.
Khi các phép xác định BOD5 được thay thế bằng phép xác định BOD2+ 5, phòng thử nghiệm phải xác nhận rằng quy trình xác định BOD2+ 5 cho kết quả tương đương với xác định BOD5.
Kết quả khác với xác định BOD7, trong đó nhiệt độ ủ không đổi trong quá trình xác định toàn bộ thời kỳ ủ. Nếu BOD7 được đo, hệ số chuyển đổi (BOD5/BOD7) cần được sử dụng trong để tính toán BOD5 (xem Phụ lục D)
Phụ lục B
(tham khảo)
Thử nghiệm nhiều lần
Thử nghiệm nhiều lần là phép phân tích một mẫu với hai hoặc nhiều hơn hai lần pha loãng khác nhau. Qui trình này có thể dùng để tăng độ chính xác mong muốn, hoặc do nghi ngờ trong mẫu có mặt các chất độc đối với vi sinh vật.
Mẫu được phân tích như trình bày trong 9.3. Sự tiêu thụ oxy trong quá trình ủ được xác định cho từng bình của các lô pha loãng mẫu và lô nước pha loãng của dung dịch trắng được tính theo Công thức (B.1)
Spij = p1 - p2 (B.1)
Trong đó
p1 là nồng độ oxy hòa tan của một trong các dung dịch thử hoặc dung dịch trắng tại điểm "không", tính bằng miligam trên lít, mg/L;
p2 là nồng độ oxy hòa tan của cùng một dung dịch thử này hoặc dung dịch trắng sau n ngày, tính bằng miligam trên lít, mg/L;
Spij là lượng oxy tiêu thụ của mẫu lặp lại thứ j của dung dịch pha loãng thứ i hoặc dung dịch trắng, tính bằng miligam trên lít, mg/L.
Các phần mẫu của các độ pha loãng là một phần của quá trình đánh giá thêm được tính theo Công thức (B.2):
trong đó
Φi là phần thể tích của mẫu nước trong độ pha loãng thứ i (hàm lượng mẫu) tính bằng mililít trên mililit, mL/mL;
Vsam là thể tích mẫu được sử dụng để chuẩn bị dung dịch thử liên quan, tính bằng mililít, mL;
Vt là tổng thể tích của dung dịch thử này, tính bằng mililit, mL.
Tính hợp lệ của mức tiêu thụ oxy của các lô thử nghiệm được chứng minh với Công thức (5) trong 10.2. Các đánh giá số đặt trước tính hợp lệ của quy tắc trên, có thể được kiểm tra trong thực tế đồ thị đơn giản. Lượng oxy tiêu thụ trong quá trình ủ Spij, đối với mỗi chai có độ pha loãng là được lập đồ thị với thể tích mẫu trong mỗi độ pha loãng Φi.
Mức tiêu thụ oxy của các bình trắng được lập đồ thị theo giá trị thể tích bằng không.
Một ví dụ với bảng đánh giá chuẩn bị về các kết quả thử nghiệm (Bảng B.1) và đồ của những dữ liệu này là được nêu trong Hình B.1. Nếu mối quan hệ giữa lượng tiêu thụ oxy và thể tích mẫu trong đồ thị là tuyến tính, BODn không cho biết các thành phần ức chế vi sinh vật trong mẫu. Nếu đồ thị cho thấy mối quan hệ tuyến tính giữa mức tiêu thụ oxy và khối lượng mẫu chỉ ở mức nồng độ mẫu thấp, chỉ các dung dịch pha loãng mẫu trong khoảng tuyến tính mới được sử dụng để xác định BODn. BODn, được tính như được mô tả trong Điều 10 và là giá trị trung bình của tất cả các phép xác định trong khoảng tuyến tính.
Nếu các giá trị xuất hiện một cách đáng tin cậy đối với mức tiêu thụ oxy hiện có cho nước pha loãng và cho ít nhất hai độ pha loãng, ngoài ra các kết quả đối chiếu có thể được đánh giá thống kê. Hệ số của tương quan (r) được tính toán cho các kết quả này bổ sung cho BODn.
Nếu các điểm nằm dọc theo một đường thẳng, dãy đo có thể được đánh giá mà không bị hạn chế.
Các số ngoại lai sẽ vẫn không được xem xét trong quá trình đánh giá thêm. Tuy nhiên nguyên nhân của phép đo giá trị phân kỳ cần được điều tra. Biến động lớn trong số đọc oxy hòa tan giữa các bình chứa cùng nồng độ mẫu là dấu hiệu của sự nhiễm bẩn hoặc sử dụng mẫu không đồng nhất.
Nếu tính hợp lệ của quy tắc trộn được kiểm tra thành công bằng đồ thị, r, hệ số tương quan, có thể được tính theo Công thức (B.3):
Độ lớn của hệ số tương quan và độ lệch giữa mức tiêu thụ oxy của nước pha loãng như được tìm thấy trong thử nghiệm và được tính trung bình bằng tính toán hồi quy cùng với cung cấp bằng chứng cho tính hợp lệ của quy tắc trộn. Nếu hệ số tương quan lớn hơn 0,995 và đồng thời sự khác biệt giữa mức tiêu thụ oxy được tìm thấy và mức tiêu thụ oxy trung bình bằng phép tính hồi quy không lớn hơn 0,1 mg/L, có thể giả định rằng quy tắc trộn được hoàn thành. Trong tất cả các trường hợp khác, phương pháp kiểm soát đồ thị có thể được sử dụng để quyết định liệu thống kê đánh giá dựa trên kết quả đối chiếu có thể được thực hiện với một bộ dữ liệu hạn chế tương ứng.
VÍ DỤ Như một ví dụ, một bảng (xem Bảng B.1) có thể được tạo trong một chương trình đánh giá.
Bảng B.1 - Bảng đánh giá
| Mẻ | N | Hàm lượng mẫu mL/mL | Hàm lượng mẫu bình phương | Nồng độ oxy lúc đầu mg/L | Nồng độ oxy sau n ngày mg/L | Oxy tiêu thụ mg/L | Oxy tiêu thụ bình phương | Sản phẩm của hàm lượng mẫu và tiêu thụ oxy |
|
|
| Φi | Φi2 | p1 | p2 | p1 - p2 = Spij | Sp2ij | Φi.Spij |
| Nước pha loãng | 1 | 0 | 0 | 8,5 | 7,7 | 0,8 | 0,64 | 0 |
| Nước pha loãng | 2 | 0 | 0 | 8,6 | 7,7 | 0,9 | 0,81 | 0 |
| 1. Pha loãng | 3 | 0,01 | 0,000 1 | 8,5 | 5,8 | 2,7 | 7,29 | 0,027 |
| 1. Pha loãng | 4 | 0,01 | 0,000 1 | 8,6 | 6,0 | 2,6 | 6,76 | 0,026 |
| 2. Pha loãng | 5 | 0,02 | 0,000 4 | 8,5 | 4,0 | 4,5 | 20,25 | 0,09 |
| 2. Pha loãng | 6 | 0,02 | 0,000 4 | 8,6 | 4,1 | 4,5 | 20,25 | 0,09 |
| 3. Pha loãng | 7 | 0,03 | 0,000 9 | 8,6 | 2,2 | 6,4 | 40,96 | 0,192 |
| 3. Pha loãng | 8 | 0,03 | 0,000 9 | 8,5 | 2,2 | 6,3 | 39,69 | 0,189 |
| Tổng | N* |
|
|
|
|
|
|
|
| Kết quả trung gian: | 8 | 0,12 | 0,002 8 |
|
| 28,7 | 136,65 | 0,614 |
| N Số chai. N* số lượng kết quả | ||||||||
Từ Bảng B.1, lượng tiêu thụ oxy của các mẻ (Spij) có thể được chuyển thành hệ thống kết hợp Cartessian (Hình B.1) trên phần thể tích của mẫu (Φi) trong mẻ pha loãng.
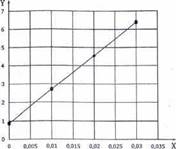
CHÚ DẪN
X pha loãng theo mL/L
Y oxy tiêu thụ theo mg/L O2
Hình B.1 - Kiểm tra đồ thị về tính hợp lệ của quy tắc trộn trong trường hợp đánh giá ví dụ với đồ thị bù trừ
Từ Bảng B.1, tổng đường cuối cùng có thể được đưa vào Công thức (B.3) để tính hệ số tương quan r.
Phụ lục C
(tham khảo)
Cấy trực tiếp các lô phân tích
Trong một số trường hợp, ví dụ khi phân tích được thực hiện với các hệ thống tự động, có thể khuyến nghị thực hiện việc cấy bằng nước cấy (5.2) thích hợp hoặc vật liệu cấy bán sẵn trên thị trường [xem 5.2 e)] trực tiếp trong quá trình chuẩn bị lô phân tích, bao gồm cả lô giá trị mẫu trắng làm phần thử. Điều này có thể cần thiết nếu ví dụ, nước cấy thích nghi đặc biệt hoặc vật liệu cấy là bắt buộc.
Trong trường hợp này, sử dụng nước pha loãng (5.4) thay cho nước nuôi cấy pha loãng (5.5) và sục khí trong bể pha loãng (6.3) lên đến nồng độ oxy tối thiểu là 8,0 mg/L. Sử dụng các bình ủ có thể tích lượng xác định.
Đảm bảo rằng, bằng cách bổ sung trực tiếp nước cấy (5.2) hoặc vật liệu cấy [5.2 e]] vào mỗi lô phân tích, lượng oxy tiêu thụ sau n ngày trong các dung dịch trắng là từ 0,2 mg/L đến 1,5 mg/L oxy và các thông số kỹ thuật của các thử nghiệm kiểm tra (9.7) được tuân thủ.
Tính BOD, với Công thức (C.1) vì nước pha loãng và nước cấy hoặc vật liệu cấy được thêm riêng biệt và cùng thể tích vật liệu cấy được thêm vào mỗi bình.
Trong đó
p1 là nồng độ oxy hòa tan của một trong các dung dịch thử tại điểm 0, tính bằng miligam trên lit, mg/L;
p2 là nồng độ oxy hòa tan của cùng một dung dịch thử nghiệm này sau n ngày, tính bằng miligam trên lít, mg/L;
p3 là nồng độ oxy hòa tan của dung dịch trắng tại điểm 0, tính bằng miligam trên lít, mg/L;
p4 là nồng độ oxy hòa tan của dung dịch trắng sau n ngày, tính bằng miligam trên lít, mg/L;
Vsam là thể tích mẫu được sử dụng để chuẩn bị dung dịch thử liên quan, tính bằng mililít, mL;
Vt là tổng thể tích của dung dịch thử này, tính bằng mililit, mL.
Phụ lục D
(tham khảo)
Dữ liệu tính năng
Độ đúng và độ lệch chuẩn của độ tái lập và độ lặp lại của phân tích BODn đã được tính bởi một so sánh liên phòng thử nghiệm xác định năm 1992. Trong thực hành này ba cặp mẫu đã được 95 phòng thử nghiệm thuộc 11 quốc gia phân tích. Kết quả được trình bày trong Bảng D.1 đến Bảng D.3.
Bảng D.1 - Kết quả so sánh liên phòng thử nghiệm 45:1992
| BODn | Mẫu | Giá trị đã tính được/hiệu số mg/L O2 | Trung vị mg/L O2 | Độ lệch chuẩn tái lập mg/L O2 | Trung bình sai khác mg/L O2 | Độ lệch chuẩn tái lặp của sai khác mg/L O2 | Sổ kết quả | Giá trị ngoại lai | |
| BOD5 | Dung dịch gluco/axit glutamic | A | 199 ˺ | 203 | 22 |
|
|
|
|
|
|
| -19 |
|
| -18 | 11 | 91 | 5 | |
| Dung dịch gluco/axit glutamic | B | 180 ˼ | 184 | 19 |
|
|
|
| |
| Nước thải đã xử lý cơ học | C |
| 58,3 | 7,7 |
|
|
|
| |
|
|
|
|
|
|
|
| 95 | 5 | |
| Nước thải đã xử lý cơ học | D |
| 46,0 | 5,0 |
|
|
|
| |
| Nước thải đã xử lý sinh học | E |
| 18,2 | 4,5 |
|
|
|
| |
|
|
|
|
|
|
|
| 95 | 5 | |
| Nước thải đã xử lý sinh học | F |
| 17,2 | 3,7 |
|
|
|
| |
| BOD2+5 | Dung dịch glueo/axit glutamic | A | 199 ˺ | 201 | 24 |
|
|
|
|
|
|
| -19 |
|
| -17 | 11 | 88 | 2 | |
| Dung dịch gluco/axit glutamic | B | 180 ˼ | 180 | 24 |
|
|
|
| |
| Nước thải đã xử lý cơ học | C |
| 58,0 | 8,9 |
|
|
|
| |
|
|
|
|
|
|
|
| 90 | 4 | |
| Nước thải đã xử lý cơ học | D |
| 45,5 | 6,0 |
|
|
|
| |
| Nước thải đã xử lý sinh học | E |
| 18,1 | 4,9 |
|
|
|
| |
|
|
|
|
|
|
|
| 91 | 3 | |
| Nước thải đã xử lý sinh học | F |
| 17,2 | 4,2 |
|
|
|
| |
| BOD7 | Dung dịch gluco/axit glutamic | A | 213˺ | 210 | 22 |
|
|
|
|
|
|
| -20 |
|
| -19 | 13 | 88 | 3 | |
| Dung dịch gluco/axit glutamic | B | 193 ˼ | 190 | 19 |
|
|
|
| |
| Nước thải đã xử lý cơ học | C |
| 64,4 | 8,6 |
|
|
|
| |
|
|
|
|
|
|
|
| 91 | 6 | |
| Nước thải đã xử lý cơ học | D |
| 51,6 | 6,7 |
|
|
|
| |
| Nước thải đã xử lý sinh học | E |
| 19,3 | 5 0 |
|
|
|
| |
|
|
|
|
|
|
|
| 92 | 4 | |
| Nước thải đã xử lý sinh học | F |
| 17,8 | 4,3 |
|
|
|
| |
Tương quan giữa xác định BOD5 và BOD2+5 được tính cho các kết quả này (Bảng D.2). Trong thực tế không có khác biệt giữa BOD5 và BOD2+5 .
Bảng D.2 - So sánh BOD5 và BOD2+5
| Loại mẫu |
| BOD5 giá trị trung vị mg/L oxy | BOD2+5 giá trị trung vị mg/L oxy | Sai khác có ý nghĩa của BOD5a | Số các phòng thử nghiệm |
| Dung dịch axit | A | 203 | 201 | Không | 91 |
| gluco/glutamic | B | 184 | 180 | Không | 85 |
| Nước thải đã xử lý cơ học | C | 58,3 | 58,0 | Không | 89 |
|
| D | 46,0 | 45,5 | Không | 86 |
| Nước thải đã xử lý sinh học | E | 18,2 | 18,1 | Không | 89 |
|
| F | 17,2 | 17,2 | Không | 87 |
| a Mức ý nghĩa, α = 0,05. | |||||
Có thể lập hệ số chuyển đổi giữa số liệu BOD5 và BOD7 trong cùng một loại nước. Giá trị hệ số chuyển đổi có thể thu được từ các phân tích song song BOD5 và BOD7 với các phép đo cùng một mẫu. Nếu không có hệ số chuyển đổi thì hiệu chỉnh giữa BOD5 và BOD7 có thể tính ra từ các kết quả của so sánh liên phòng thử nghiệm đề cập trên đây. Kết quả so sánh này cho ở Bảng D.3.
Bảng D.3 - So sánh liên phòng - So sánh BOD5 và BOD7
| Mẫu | BOD5 giá trị trung vị mg/L oxy | BOD7 giá trị trung vị mg/L oxy | Sai khác có ý nghĩa a | Số phòng thử nghiệm | BOD7/BOD7 | |
| Dung dịch axit Gluco/glutamic | A | 203 | 210 | Có | 90 | 1,04 |
|
| B | 184 | 190 | Có | 87 | 1,03 |
| Nước thải đã xử lý cơ học | C | 58,3 | 64,4 | Có | 88 | 1,10 |
|
| D | 46,0 | 51,7 | Có | 88 | 1,12 |
| Nước thải đã xử lý sinh học | E | 18,2 | 19,3 | Có | 87 | 1,06 |
|
| F | 17,2 | 17,8 | Có | 89 | 1,03 |
| a Mức ý nghĩa α = 0,05. | ||||||
Độ chính xác của phân tích BODn ngày có thể cải thiện được nếu cần, thông qua thử nghiệm nhiều lần (xem Phụ lục B).
Thư mục tài liệu tham khảo
[1] TYERS R.G., SHAW R.J.1989, Refinements to the BOD Test. Water and enviroment Journal 3 (4):pp.366-374
[2] ISO 6107-2:2006 Water quality - Vocabulary - Part 2 (Chất lượng nước - Từ vựng - Phần 2).
[3] TCVN 6225-1:2012 (ISO 7393-1:1985) Chất lượng nước - Xác định clo tự do và tổng clo - Phần 1: Phương pháp chuẩn độ sử dụng N,N-dietyl-1,4-Phenylenediamine
[4] TCVN 6225-2:2021 (ISO 7393-2:2017), Chất lượng nước - Xác định clo tự do và tổng clo - Phần 2: Phương pháp so màu sử dụng N,N-dietyl-1,4hhenylenediamine, cho mục đích kiểm soát thường xuyên
[5] ISO 20079:2005 Water quality - Determination of the toxic effect of water constituents and waste water on duckweed (Lemma minor) - Duckweed growth inhibition test.
Bạn chưa Đăng nhập thành viên.
Đây là tiện ích dành cho tài khoản thành viên. Vui lòng Đăng nhập để xem chi tiết. Nếu chưa có tài khoản, vui lòng Đăng ký tại đây!
 Tiêu chuẩn Việt Nam TCVN 6001-1:2021 PDF (Bản có dấu đỏ)
Tiêu chuẩn Việt Nam TCVN 6001-1:2021 PDF (Bản có dấu đỏ) Tiêu chuẩn Việt Nam TCVN 6001-1:2021 DOC (Bản Word)
Tiêu chuẩn Việt Nam TCVN 6001-1:2021 DOC (Bản Word)